
SỞ GD & ĐT NGHỆ AN TRƯỜNGTHPTQUỲNHLƯU1
Đề tài: TIẾP CẬN KỲ THI CHUẨN HÓA QUỐC TẾ CHƯƠNG TRÌNH HÓA HỌC THPT - SAT II CHEMISTRY VÀ XÂY DỰNG MỘT SỐ NỘI DUNG DẠY HỌC PHẦN TỐC ĐỘ PHẢN ỨNG, CÂN BẰNG HÓA HỌC THEO SAT II CHEMISTRY



LĨNH VỰC: HÓA HỌC Năm học: 2021– 2022








MỤC LỤC
Nộidung
Trang
PHẦNI:ĐẶTVẤNĐỀ 1
I.LÝDOCHỌNĐỀTÀI 1
II.ĐÓNGGÓPCỦAĐỀTÀI 1
III.TÍNHMỚICỦAĐỀTÀI 2
PHẦNII:NỘIDUNGNGHIÊNCỨU 3
I.CƠSỞLÝLUẬN 3
1.Chươngtrìnhgiáodụcphổthông2018 3
1.1. Đổi mới để phù hợp với hội nhập quốc tế 3
1.2. Những nội dung mới trong chương trình 3
2.Bàikiểmtrađánhgiánănglựcchuẩnhóa(SATvàSATII Chemistry) 5 2.1. Khái niệm và phân loại SAT 5 2.2. SAT II Chemistry 6 a. Nội dung kiểm tra SAT II Chemistry 6 b. Thang đánh giá trong SAT II Chemistry 7 c. Các dạng câu hỏi trong SAT II Chemistry 8 3.MốiquanhệgiữacácchươngtrìnhgiáodụcbộmônHóahọc
4.Mộtsốcôngtrìnhnghiêncứuvềviệcdạyhọctiếpcậncáckỳthi quốctế 16
5.Đánhgiávấnđềthựctiễn 16
5.1. Ưu điểm 16
5.2. Nhược điểm và hạn chế 17
III.NỘIDUNGDẠYHỌCCÁCCHỦĐỀTHEOHƯỚNGTIẾP CẬNSATIICHEMISTRY 17
1. Nguyên tắc xây dựng các chủ đề dạy học tiếp cận SAT II Chemistry 17
2.Xâydựngnộidungdạyhọccácchủđề 18
2.1. Tốc độ phản ứng
Cân bằng hóa học
độ phản ứng
Cân bằng hóa học
III.MỘTSỐĐỀXUẤT
LỜIKẾT
PHỤLỤC
BẢNG CHỮ VIẾT TẮT
Chữ viết đầy đủ
Chữ viết tắt
Trung học phổ thông
Học sinh
Giáo viên
Chương trình giáo dục
Bộ Giáo dục và đào tạo
Đại học Quốc gia
Đại học Bách khoa
Thực nghiệm Đối chứng
PHẦN I: ĐẶT VẤN ĐỀ
I. LÝ DO CHỌN ĐỀ TÀI
Ngày26/12/2018,BộtrưởngBGDĐTđãkýthôngtưsố32/2018/TT-BGDĐT ban hành chương trình giáo dục phổ thông mới. Hóa học là ngành thuộc lĩnh vực khoa học tự nhiên, là môn học có sự kết hợp chặt chẽ giữa lý thuyết và thực nghiệm, là cầu nối các ngành khoa học tự nhiên khác như vật lý, sinh học, y dược và địa chất học. Cùng với Toán học, Vật lý, Sinh học, Tin học và Công nghệ, môn Hóa học góp phần thúc đẩy giáo dục STEM, một trong những xu hướng giáo dục đang được coi trọng ở nhiều quốc gia trên thế giới. Nhiều năm trở lại đây, việc học sinh học xong chương trình phổ thông ở Việt Nam tìm được các học bổng khủng để theo học đại học ở các quốc gia khác, đặc biệt là các trường đại học ở Mỹ, không phải là hiếm. Đầu tiên là học sinh ở các thành phố lớn như Hà Nội, Thành phố Hồ Chí Minh nay lan rộng đến học sinh các tỉnh, thậm chí là học sinh các vùng nông thôn, điều kiện kinh tế và học tập còn khó khăn. Nếu ai có dự định du học Hoa Kỳthì có lẽ đã từng nghe đến kỳthi SAT đóng vai trò đáng kể trong quy trình tuyển sinh đại học ở Mỹ. Trong những năm gần đây, nhiều trường đại học top đầu của Việt Nam cũng đã tuyển sinh bằng chứng chỉ SAT. Giáo viên đượccoilà những người tiên phongnhất trongviệc nắmgiữ tri thức mới và xu hướng mới trong giáo dục. Chúng ta có thể sống ở các vùng miền khác nhau với điều kiện kinh tế khác nhau song chúng ta hoàn toàn có thể nắm giữ những tri thức mới và xu hướng mới như nhau. Trong quá trình tìm hiểu về các chương trình giáo dục, đề thi tốt nghệp của Bộ, đề thi đánh giá năng lực của trường ĐH QG, đề thi đánh giá tư duy của ĐHBK và về kỳ thi SAT II Hóa học, chúng tôi thấy có những nét tương đồng giữa xu hướng giáo dục sắp tới và chương trình giáo dục ở nước ngoài. Chúng tôi mong muốn học sinh được tiếp cận nội dung và hình thức của một kỳ thi quốc tế của một nền giáo dục tiên tiến bậc nhất thế giới, đó là Hoa Kỳ. Khi các em có nhu cầu thi chứng chỉ SAT để du học hoặc xét tuyển vào đại học ở Việt Nam thì các em có thể tiết kiệm được thời gian và chi phí ôn luyện. Đồng thời, nếu xâydựng được tài liệu theo chương trình SAT II Chemistrythì tài liệu nàycũng có thể giúp giáo viên tiếp nhận tốt hơn chương trình giáo dục phổ thông mới nên chúng tôi đã nảysinh ý tưởng xâydựng một số nội dung dạyhọc tiếp cận kỳthi SAT II ở Hoa Kỳ cho học sinh và chọn đề tài: “Tiếp cận kỳ thi chuẩn hóa quốc tế chương trình Hóa học THPT - SAT II Chemistry và xây dựng một số nội dung dạy học phần Tốc độ phản ứng, Cân bằng hóa học theo SAT II Chemistry” làm đề tài sáng kiến kinh nghiệm cho mình.
2. ĐÓNG GÓP VÀ TÍNH MỚI CỦA ĐỀ TÀI
Hoa Kỳ là một nước có nền Khoa học và Giáo dục phát triển. Để đánh giá khách quan năng lực học tập của các học sinh khi tham gia bất kỳ chương trình học nào, tổ chức các trường Đại học Hoa Kỳ đã cho ra đời bài kiểm tra đánh giá năng lực chuẩn hóa (SAT) và hiện việc tổ chức bài kiểm tra này đang được quản lý bởi
Viện Khảo thí Giáo dục Hoa Kỳ (Educational Testing Service - viết tắt EST). SAT trở thành một phần không thể thiếu trong bộ hồ sơ xét tuyển của học sinh vào các trường Đại học ở Hoa Kỳvà một số quốc gia khác trên thế giới. Ở Việt Nam, từ năm 2018 bên cạnh việc tuyển sinh bằng chứng chỉ quốc tế IELTS cho môn tiếng Anh, đã có trường ĐHQG, trường Đại học ngoại thương, trường ĐHBK Hà nội... sử dụng kết quả chứng chỉ quốc tế SAT cho các môn học khácnhư một phương án tuyển sinh độc lập. Do đó, xu hướng dự thi SAT chắc chắn đang và sẽ tăng cao trong vòng vài ba năm tới.
Nội dung chương trình bộ môn Hóa học đang dần thay đổi theo hướng tiếp cận với chương trình của các nước có nền giáo dục tiên tiến trên thế giới, trong đó có Hoa Kỳ. Các bài kiểm tra môn Hóa cũng sẽ chuyển dần từ những bài tập và câu hỏi nặng về tính toán nhưng không thực tế sang các bài tập mang bản chất Hóa học hơn và thực tế hơn. Việc tìm hiểu các bài thi chuẩn hóa môn Hóa học mang tính quốc tế như SAT cũng là một nhu cầu đối với giáo viên nhằm đón đầu xu thế đổi mới giáo dục hiện nay. Nếu đề tài này thực hiện thành công có thể mang lại nhiều ý nghĩa thực tế cho cả giáo viên và học sinh trong việc đổi mới dạy học theo định hướng phát triển năng lực. Vì vậy, vấn đề trong đề tài nàythực sự là vấn đề cần thiết của ngành giáo dục và đào tạo.
Chươngtrình họcvàthi Hóahọc Trunghọcphổthôngở Việt Namnhìn chung có những nét tương đồng với kỳ thi SAT. Nếu giáo viên tìm hiểu và dạy cho học sinh thì có thể tiết kiệm thời gian và tiền bạc cho các em đáng kể. Điều này đặc biệt có ý nghĩa đối với học sinh vùng nông thôn khi điều kiện về cơ sở vật chất, kinh tế vẫn còn khó khăn.
Việc giảng dạy môn Toán và các môn Khoa học tự nhiên bằng tiếng Anh đã đượctriểnkhaitronggiaiđoạn2010 -2020tại Đề ánpháttriểntrườngTHPTchuyên (Số 959 - QĐ TTg ngày 24/06/2010) của Thủ tướng chính phủ. Trong những năm qua, ngành giáo dục trong cả nước nói chung và bộ môn Hóa học ở trường THPT nói riêng đã có khá nhiều công trình nghiên cứu về việc giảng dạy bằng tiếng Anh một số bài học trong chương trình phổ thông hiện hành. Song đề tài xây dựng nội dung dạy học phù hợp với kỳ thi chuẩn hóa quốc tế SAT II Chemistry do Viện khảo thí Giáo dục Hoa kỳ quản lý này là một hướng đi hoàn toàn mới mà chưa có sáng kiến kinh nghiệm nào đề cập đến.
PHẦN II: NỘI DUNG NGHIÊN CỨU
I. CƠ SỞ LÝ LUẬN
1. Chương trình giáo dục phổ thông 2018
1.1. Đổi mới để phù hợp với hội nhập quốc tế
CTGDPT hiện hành được ban hành theo Nghị quyết số 40/2000/QH10 ngày 09/12/2000 của Quốc hội. CTGDPT hiện hành đã là một bước tiến so với chương trình GDPT trước đó. Kết quả giáo dục trong vòng 20 năm qua nói chung và kết quả các kỳ thi quốc tế mà học sinh Việt Nam tham gia nói riêng đã chứng tỏ tác động tích cực của chương trình hiện hành trong việc giáo dục thế hệ trẻ. Tuy nhiên, đất nước và nhân loại đã bước sang một giai đoạn phát triển mới, đặt ra những yêu cầu mới về việc phát triển nguồn nhân lực, phát triển con người. Để đảm bảo phát triển bền vững, nhiều quốc gia đã không ngừng đổi mới giáo dục để nâng cao chất lượng nguồn nhân lực.
Giáo dục Việt Nam hiện nay đang trong từng bước đưa CTGDPT mới 2018 vào thực hiện, trong đó có bộ môn Hóa học ở THPT. Chương trình mới có những điểm giống với chương trình hiện hành như đều có 3 mạch nội dung gồm: Kiến thức cơ sở hóa học chung, Hóa học vô cơ và Hóa học hữu cơ. Tuy nhiên, chương trình mới được biên soạn theo hướng tăng cường bản chất hóa học, tăng cường tính quy luật, xu hướng và giải thích được những quy luật, xu hướng đó. Những điểm mới trong nội dung hứa hẹn sẽ mang lại sự chuyển biến trong cách ra đề thi của những kỳ thi quan trọng. Đề thi THPT Quốc gia trước đây, nay là đề thi Tốt nghiệp THPT vẫn được đánh giá là nặng về tính toán, thuật toán, tình huống trong đề bài mang tính giả định, không có nhiều ý nghĩa trong thực tế, càng ngày càng xa rời bản chất hóa học. Có ý kiến cho rằng, không có quốc gia nào trên thế giới học Hóa như cách học ở Việt Nam. Xu thế bây giờ học sinh không thích học Hóa vì học Hóa khó quá. Theo định hướng của các chuyên gia xây dựng chương trình bộ môn Hóa học mới 2018, đề thi theo CT mới không nặng về tính toán, đề thi sẽ thực tế hơn, mang bản chất hóa học hơn, tiệm cận đề thi của các quốc gia có nền GD phát triển tiên tiến trên thế giới. Vì CTGDPT 2018 chưa được đưa vào thực hiện chính thức nên không biết nội dung học và nội dung thi có thay đổi được như ý tưởng hay không.
1.2. Những nội dung mới trong chương trình
Theo Ban phát triển các chương trình môn học (Bộ GDĐT), chương trình Hóa học cấp THPT giúp học sinh phát triển các năng lực thành phần của năng lực tìm hiểu tự nhiên gắn với chuyên môn về Hóa học như: Năng lực nhận thức kiến thức hóa học, năng lực tìm tòi, khám phá kiến thức hóa học, năng lực vận dụng kiến thức hóa học vào thực tiễn. Từ đó biết ứng xử với tự nhiên một cách đúng đắn, khoa học và có khả năng lựa chọn nghề nghiệp phù hợp với năng lực và sở thích, điều kiện và hoàn cảnh của bản thân.
Theo đó, một số nội dung mới so với chương trình Ban cơ bản hiện nay như:
- Chủ đề 1 (Lớp 10) Cấu tạo nguyên tử: Đưa thêm khái niệm orbital nguyên tử (AO) và sự phân bố electron vào các orbital.
- Chủ đề 3 (Lớp 10) Liên kết hóa học: Viết được công thức Lewis một số chất đơn giản, giảithích được sự hình thành liênkết σvàliênkếtπ dựa vào sự xen phủ orbital. Đưa vào khái niệm liên kết Hidro, liên kết Van der Waals. Sự ảnh hưởng của liên kết Hidro đến trạng thái của vật chất.
- Đưa vào chủ đề 5 (Lớp 10) Năng lượng hóa học: Sự biến thiên enthanpy trong các phản ứng hóa học.
- Tách chương Tốc độ phản ứng và cân bằng hóa học thành 2 chủ đề riêng, phần tốc độ phản ứng học ở lớp 10, phần cân bằng hóa học học ở lớp 11.
- Các nội dung về hóa học nguyên tố: Giảm bớt nghiên cứu một số chất, ví dụ: photpho và hợp chất, silic và hợp chất,…
- Trong phần Đại cương về hóa học Hữu cơ: Đưa thêm nội dung về tách biệt và tinh chế các hợp chất hữu cơ, dựa vào thông số của phổ khối lượng (MS) để xác định phân tử khối của hợp chất hữu cơ.
- Đưa thêm vào nội dung về dẫn xuất halogen của các hidrocacbon, hợp chất xeton.
- Đưa chủ đề Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch vào trong chương trình lớp 12. Một số nội dung được đưa vào chuyên đề tự chọn như:
- Chuyên đề 1 (Lớp 10) Cơ sở hóa học: Viết công thức Lewis của phân tử; Dự đoán dạng hình học phân tử; Sự lai hóa obitan; Phản ứng hạt nhân; Năng lượng hoạt hóa của phản ứng hóa học; Entropy và biến thiên năng lượng tự do Gibbs.
- Chuyên đề 2 (Lớp 10) Hóa học trong việc phòng chống cháy nổ: Sơ lược về phản ứng cháyvà nổ; Điểm chớp cháy, nhiệt độ tự bốc cháyvà nhiệt độ cháy; Hóa học về phản ứng cháy nổ…
- Chuyên đề 3 (Lớp 10) Thực hành hóa học và công nghệ thông tin: Vẽ được cấu trúcphântử;Thựchànhthínghiệmhóahọc ảo; Tínhthamsố cấutrúc và nănglượng.
- Chuyên đề 1 (Lớp 11) Phân bón: Giới thiệu chung về phân bón, phân bón vô cơ, phân bón hữu cơ.
- Chuyên đề 2 (Lớp 11) Trải nghiệm, thực hành hóa học hữu cơ: Tách tinh dầu từ các nguồn thảo mộc thiên nhiên; Chuyển hóa chất béo thành xà phòng; Điều chế glucosamin hidroclorit từ vỏ tôm.
- Chuyên đề 3 (Lớp 11) Dầu mỏ và chế biến dầu mỏ: Trình bày được nguồn gốc của dầu mỏ, chế biến dầu mỏ; Ngành sản xuất dầu mỏ trên thế giới và Việt Nam; Sản xuất dầu mỏ và môi trường; Các nguồn nhiên liệu thay thế dầu mỏ.
- Chuyên đề 1 (Lớp 12) Cơ chế phản ứng trong hóa học hữu cơ: Trình bàyđược khái niệm về cơ chế phản ứng, phân cắt đồng ly, phân cắt dị ly, độ bền của các tiểu phân trung gian; Một số cơ chế phản ứng trong hóa học hữu cơ.
- Chuyên đề 2 (Lớp 12) Trải nghiệm, thực hành hóa học vô cơ: Tìm hiểu quy trình thủ công tái chế kim loại hoặc tìm hiểu một số ngành nghề liên quan đến hóa học tại địa phương; Tìm hiểu công nghiệp silicat; Quy trình xử lý nước sinh hoạt.
- Chuyên đề 3 (Lớp 12) Một số vấn đề cơ bản về phức chất: Một số khái niệm cơ bản về phức chất; Liên kết và cấu tạo của phức chất; Ứng dụng của phức chất.
2.Bàikiểmtrađánhgiánănglựcchuẩnhóaquốc tế(SATvàSATIIChemistry)
Ở Việt Nam, học xong THPT, HS có thể phải tham gia nhiều kỳ thi như Tốt nghiệp THPT, Đánh giá năng lực, Đánh giá tư duy, IELTS, SAT... để có cơ hội vào trường Đại học mà mình mong muốn. Vô hình trung, học sinh nước ta hiện nay tốn khá nhiều tiền bạc, công sức, thời gian để theo đuổi những kỳ thi nói trên. Mỗi kỳ thi lại ra theo hướng khác nhau, không có sự thống nhất, đồng đều. Còn ở Hoa Kỳ, HS phổ thông phải học và tham gia các bài thi SAT của từng môn theo lựa chọn của bản thân phù hợp với ngành nghề trong tương lai, có thể thi nhiều lần và lấy kết quả cao nhất. Kỳ thi SAT đã có lịch sử hình thành và phát triển hơn 100 năm. Đó là kỳ thi luôn đổi mới nhưng ổn định.
2.1. Khái niệm và phân loại SAT Scholatic Assessment Test (SAT) là bài kiểm tra nhằm đánh giá khả năng thành công trong việc học tập tại các trường đại học. SAT thuộc sở hữu của College Board - Tổ chức phi lợi nhuận các trường Đại học Hoa Kỳ, hiện thuộc quyền quản lý của Viện khảo thí Giáo dục Hoa Kỳ (Educational Testing Service - ETS). Học sinh quốc tế không cần phải đến Mỹ để thi SAT bởi vì SAT được tổ chức 7 lần một năm tại 175 quốc gia trên thế giới. Theo mục đích kiểm tra, SAT được chia làm hai bài kiểm tra chính: SAT Resoning (thường gọi là SAT I) và SAT Subject (thường gọi là SAT II). SAT I kiểm tra kỹ năng suy luận ngôn ngữ và toán học mang tính tổng quát. SAT II kiểm tra kiến thức chuyên sâu của môn học cụ thể. SAT II bao gồm 20 bài kiểm tra độc lập thuộc 5 lĩnh vực: Toán học (Toán bậc 1 và Toán bậc 2), Khoa học (Vật lý, Hóa học, Sinh học phân tử, Sinh học sinh thái), Lịch sử (Lịch sử Hoa Kỳ, Lịch sử thế giới), Văn học và Ngôn ngữ (Tiếng Pháp, Tiếng Đức, Tiếng Ý, Tiếng Latinh, Tiếng Do thái hiện đại, Tiếng Tây Ban Nha, Tiếng Nhật Bản, Tiếng Hàn Quốc, Tiếng Trung Quốc).
Nhằm mục đích đánh giá khách quan năng lực và kiến thức các học sinh theo học chương trình khác nhau, các trường Đại học Hoa Kỳ yêu cầu hồ sơ tuyển sinh cần phải có điểm SAT hoặc điểm ACT để bổ trợ cho điểm trung bình (Grade Point Average - GPA). Trong khi ACT được thiết kế để kiểm tra khả năng ghi nhớ kiến thức khi được học ở trường thì SAT đòi hỏi học sinh kỹ năng phân tích, tổng hợp,
suy luận để giải quyết vấn đề. Vì vậy, học sinh muốn vào các trường Đại học đầu bảng bắt buộc phải có chứng chỉ SAT.
2.2. SAT II Chemistry
SAT II Chemistrylà bài thi kiểm tra kiến thức hóa học và kỹnăng giải các bài toán hóa học. Bài thi giúp học sinh thể hiện với hội đồng tuyển sinh các trường Đại học sở thích, năng lực, nguyện vọng của bản thân theo học các ngành Khoa học, Công nghệ, Y dược.
a. Nội dung kiểm tra SAT II Chemistry
Các câu hỏi SAT II Chemistry tập trung vào các chủ đề được giảng dạy hầu hết ở các trường THPT. Nội dung cụ thể từng chủ đề và trọng số từng nội dung được thể hiện trong bảng sau đây: Bảng 1. Nội dung kiểm tra trong SAT II Chemistry
Nội dung Trọng số Chủ đề 1: Cấu trúc của vật chất Cấu trúc nguyên tử: Các thí nghiệm tìm hiểu về cấu tạo nguyên tử; Các số lượng tử và mức năng lượng; Cấu hình electron; Bảng tuần hoàn các nguyên tố hóa học. Cấu trúc phân tử: Cấu trúc Lewis; Hình dạng phân tử; Sự phân cực phân tử. Liên kết: Liên kết ion, liên kết cộng hóa trị, liên kết kim loại; Mối quan hệ giữa liên kết và cấu trúc phân tử; Lực liên kết phân tử như liên kết hidro, lực tương tác lưỡng cực.
25% Chủ đề 2: Trạng thái của vật chất
Chất khí: Thuyết động học phân tử; Các định luật chất khí; Thể tích mol, mật độ, tỷ lượng hóa học. Chất lỏng và chất rắn: Lực liên kết phân tử của chất lỏng và chất rắn; Các loại chất rắn; Sự chuyển pha và giản đồ pha.
Dung dịch: Nồng độ %; nồng độ molan; Tỷ lượng dung dịch; Các yếu tố ảnh hưởng đến độ tan của chất rắn, chất lỏng, chất khí.
Chủ đề 3: Các dạng phản ứng
Axit - Bazo: Thuyết Bronsted-Lowry; Axit, bazo mạnh, yếu; pH; Chuẩn độ; Chỉ thị.
Oxi hóa - khử: Nhận biết phản ứng oxi hóa khử. Sự cháy. Thế điện cực. Bảng tính tan của các chất.
Chủ đề
4: Tỉ lượng hóa học
Khái niệm mol: Công thức mol; Số Avogadro; Công thức phân tử; Công thức đơn giản nhất.
Phương trình hóa học: Cân bằng phươngtrình hóahọc; Các phép tính tỷ lượng hóa học; Hiệu suất phản ứng, chất hết, chất dư.
Chủ đề 5: Cân bằng và tốc độ phản ứng Cân bằng hóa học: Các yếu tố ảnh hưởng đến cân bằng hóa học;
16%
14%
14%
Nguyên lý Le-Chatelier ở trạng thái khí và trạng thái dung dịch; Hằng số cân bằng; Biểu thức hằng số cân bằng.
Tốc độ phản ứng: Các yếu tố ảnh hưởng đến tốc độ phản ứng; Giản đồ năng lượng của phản ứng; Năng lượng hoạt hóa.
Chủ đề 6: Nhiệt hóa học
Định luật bảo toàn năng lượng; Phép đo nhiệt lượng và nhiệt dung riêng; Enthalpi của sự chuyển pha và phản ứng hóa học; Các đường cong chuyển pha, entropy.
Chủ đề 7: Hóa học mô tả Các nguyên tố thường gặp; Danh pháp các hợp chất ion. Sự biến đổi tuần hoàn tính chất vật lý và hóa học của các nguyên tố; Khả năng hoạt động của các nguyên tố và dự đoán sản phẩm của phản ứng hóa học; Các hợp chất hữu cơ đơn giản; Các vấn đề hóa học liên quan đến môi trường.
Chủ đề 8: Phòng thí nghiệm Các thiết bị thí nghiệm, đo lường, các bước tiến hành,quan sát, an toàn phòng thí nghiệm; Tính toán và phân tích số liệu; Dựng đồ thị biểu diễn số liệu, rút ra nhận xét.
(Theo The Official Study Guide for All SAT Subject Tests)
5%
6%
12%
8%
Trong bài kiểm tra SAT II Chemistry, các kỹ năng được kiểm tra thể hiện ở bảng sau đây: Bảng 2. Các kỹ năng trong bài kiểm tra Kỹ năng Trọng số Tái hiện kiến thức: Để làm được nội dung này, học sinh cần: - Nhắc lại được các khái niệm cơ bản và các thông tin đặc trưng. - Sử dụng thành thạo các thuật ngữ hóa học. 20% Kỹ năng hiểu: Học sinh cần làm được các bài tập định tính và định lượng, nội dung câu hỏi có thể liên quan đến tình huống thực tiễn hoặc chỉ là giả định.
Vận dụng: Học sinh phải có kỹ năng phân tích - tổng hợp để kết hợp các kiến thức với các thông tin định tính, định lượng cho sẵn, đưa ra kết luận hoặc giải quyết vấn đề.
(Theo The Official Study Guide for All SAT Subject Tests)
b. Thang đánh giá trong SAT II Chemistry
45%
35%
SAT II Chemistry gồm 85 câu hỏi trắc nghiệm khách quan được chia thành 3 dạng câu hỏi, thời gian làm bài 60 phút, thang điểm đánh giá từ 200 đến 800 điểm. Học sinh được cung cấp Bảng Hệ thống tuần hoàn các nguyên tố hóa học và Đo lường. Các phép tính trong SAT II Chemistry đều đơn giản nên học sinh không được sử dụng máy tính.
c. Các dạng câu hỏi trong SAT II Chemistry
Các câu hỏi trong SAT II Chemistry được chia thành 3 dạng, chia thành 3 phần: phần A, phần B và phần C. Ở mỗi dạng đều có hướng dẫn cách làm bài.
- Phần A(dạng 1): Classification Questions (Đây là dạng câu hỏi phân loại, câu hỏi này đưa ra một số phát biểu, học sinh phải gắn các phát biểu đã cho vào các đáp án tương ứng cho phù hợp).


Với câu hỏi trong ví dụ này, ta hiểu là đề bài cho 5 lựa chọn: (A, B, C, D, E). Chúng ta phải gắn 5 lựa chọn này vào các đáp án 1, 2, 3 cho phù hợp. Đáp án là 1C, 2E và 3A.
- Phần B (dạng 2): Relationship Analysis Questions (Đâylà dạng câu hỏi phân tích mối quan hệ). Cho 2 phát biểu (I và II), học sinh phải xác định được mỗi phát biểu là đúng hay sai (T, F). Nếu phát biểu II là nguyên nhân của phát biểu I thì ta chọn thêm CE*. Đây là dạng câu hỏi lạ, thường gây khó khăn cho cả học sinh Hoa Kỳ và học sinh quốc tế).
Ở trong ví dụ trên, câu 102, ý (I) là: “Kim cương có nhiệt độ nóng chảy cao”. Ý này đúng, nên ta chọn (T), ý (II) là: “Trong tinh thể kim cương, các nguyên tử

cacbonhìnhthànhliên kết ion”.Ýnàylà sai,nêntachọn(F).Theođó, tacũngkhông đánh vào CE* vì ý (II) không phải là nguyên nhân của ý (I).
- Phần C(dạng 3): Five choice completion Questions (Đây là câu hỏi yêu cầu học sinh chọn đáp án đúng trong 5 đáp án đề bài đưa ra).


Trong ví dụ trên, khi pha loãng 50 ml dung dịch HNO3 0,1M thành 500 ml với nước thì nồng độ [H+] là bao nhiêu? Ta dễ dàng tìm được đáp án là (C) 0,01M. 3. Mối quan hệ giữa các chương trình giáo dục bộ môn Hóa học Bảng 3 sau đây so sánh các chương trong chương trình Hóa học phổ thông Quốc gia với các chủ đề trong SAT II Chemistry. Bảng 3. So sánh chương trình hóa học phổ thông và SAT II Chemistry SAT II Chemistry
Chương trình Hóa học phổ thông
Chủ đề 1: Cấu trúc của vật chất Lớp 10, chương 1: Nguyên tử Lớp 10, chương 2: Bảng tuần hoàn các nguyên tố hóa học. Định luật tuần hoàn Lớp 10, chương 3: Liên kết hóa học
Chủ đề 2: Trạng thái của vật chất Các công thức hóa học, mol, thể tích, nồng độ phần trăm, nồng độ mol, độ tan,… nằm chủ yếu trong chương trình hóa học THCS và xuyên suốt chương trình hóa học THPT.
Chủđề3:Cácdạngphảnứng Lớp 10, chương 4: Phản ứng hóa học Lớp 11, chương 1: Sự điện ly
Chủ đề 4: Tỉ lượng hóa học Công thức phân tử, công thức đơn giản nhất, phương trình hóa học và mối liên hệ giữa các chất trongphương trìnhhóahọc nằmtrong chương trình
hóa học THCS và xuyên suốt chương trình hóa học THPT.
Chủđề 5: Cânbằngvàtốcđộ phản ứng Lớp 10, chương 7: Tốc độ phản ứng và cân bằng hóa học
Chủ đề 6: Nhiệt hóa học Lớp 10, chương 4: Phản ứng hóa học Chủ đề 7: Hóa học mô tả Danh pháp, tính chất vật lý, tính chất hóa học của các nguyên tố, hợp chất, ion thường gặp, một số vấn đề Hóa học liên quan đến môi trường và sức khỏe được lồng ghép trong tất cả các bài ở chương trình hóa học phổ thông.
Chủ đề 8: Phòng thí nghiệm Các thiết bị trong phòng thí nghiệm, các thao tác thí nghiệm được lồng ghép trong tất cả các chương trong chương trình hóa học phổ thông. Các phép toán trong SAT II Chemistry rất đơn giản nên học sinh thậm chí không được mang máy tính cá nhân trong thời gian làm bài. Tuy nhiên, SAT II Chemistry lại yêu cầu học sinh hiểu sâu hơn về bản chất Hóa học của các chất trong phản ứng và các quá trình phản ứng. Những kiến thức này còn ít trong chương trình THPT Quốc gia hiện hành mà chủ yếu có trong tài liệu dành cho học sinh chuyên Hóa. Trừ chủ đề 4 và chủ đề 7 trong SAT II Chemistry hoàn toàn tương đồng với chương trình THPT Quốc gia, thì nói chung học sinh ở trường THPT sẽ cần bổ sung một số kiến thức, cụ thể như sau:
- Chủ đề 1: Cấu trúc của vật chất: Các số lượng tử, sự hấp thụ và giải phóng năng lượng của các electron khi chuyển mức năng lượng, lực khuếch tán London.
- Chủ đề 2: Trạng thái của vật chất: Thuyết động học phân tử, các định luật chất khí, mật độ chất khí, lực liên kết giữa các phân tử của chất lỏng và chất rắn, các loại chất rắn, sự chuyển pha, giản đồ pha, các tính chất vật lý phụ thuộc số lượng hạt chất tan trong dung dịch, các yếu tố ảnh hưởng đến độ tan của các chất.
- Chủ đề 3: Các dạng phản ứng: Chuẩn độ dung dịch, dung dịch đệm - Chủ đề 5: Cân bằng và tốc độ phản ứng: Hệ số cân bằng, các biểu thức cân bằng, giản đồ năng lượng của phản ứng, năng lượng hoạt hóa.
- Chủ đề 6: Nhiệt hóa học: Định luật bảo toàn năng lượng, phép đo nhiệt lượng và nhiệt dung riêng, enthanpy của sự chuyển pha và phản ứng hóa học.
- Chủ đề 8: Phòng thí nghiệm: Dựng đồ thị biểu diễn số liệu và rút ra nhận xét.
II. CƠ SỞ THỰC TIỄN
1. Kết quả thi SAT II Chemistry ở Việt Nam
Nền giáo dục đã bước qua phạm trù mỗi quốc gia, tiến đến ranh giới hội nhập, thị trường du học cũng trở nên sôi động và náo nhiệt hơn bao giờ hết. Đứng trước
nhiều sự lựa chọn thì xứ sở Cờ hoa (Mỹ) vẫn luôn được đặt ở vị trí ưu tiên hàng đầu của du học sinh và các bậc phụ huynh. Kết quả thống kê từ tháng 3/2017 đến tháng 3/2019 đã phần nào phản ánh được giá trị cũng như tầm quan trọng của việc du học tại Mỹ đối với du học sinh Việt Nam. Theo đó, trong giai đoạn 2 năm từ năm 2017 đến 2019, số lượng du học sinh Việt Nam đã và đang học tập tại Hoa Kỳ luôn vượt qua con số 30000 du học sinh. Năm2018 được xemlà nămcực thịnh của du học Mỹ với tổng cộng 31613 sinh viên Việt Nam được cấp phép học tập tại quốc gia này. Một số ngành học mà du học sinh Việt Nam đăng ký nhiều nhất là: Khoa học máy tính, công nghệ thông tin, khoa học tự nhiên, khối ngành ydược... SAT II Chemistry được khá nhiều học sinh Việt Nam lựa chọn để phù hợp với ngành nghề yêu thích của mình khi ngành nghề đó thiên nhiều về khoa học và tư duy logic.
Đã có khá nhiều học sinh Việt Nam đạt điểm tuyệt đối 800/800 trong kỳ thi SAT II Chemistry. Nhưng chủ yếu những học sinh này đến từ một số trường có truyền thống và ở các thành phố lớn như Hà nội và Thành phố Hồ Chí Minh, khá hiếmhoi đểthấymột học sinh ở tỉnh lẻ, ở trường không chuyên xuất hiện trong danh sách này.
2. Cơ hội học tập và học bổng với SAT
2.1. Ở các trường Đại học Hoa Kỳ
Hơn 82% giáo viên THPT ở Hoa Kỳ đồng ý đưa kiến thức và kỹ năng trong SAT Subject vào chương trình dạy học ở trường. Gần 90% giáo viên và giảng viên cho rằng, kiến thức và kỹ năng trong SAT Subject rất quan trọng cho việc học tập ở bậc Đại học. Do đó, cùng với GPA, SAT Resoning và SAT Subject tạo ra một bức tranh toàn cảnh về năng lực học sinh, giúp học sinh thể hiện được sở thích và điểm mạnh trong học tập của mình, cũng như giúp hội đồng tuyển sinh các trường Đại học lựa chọn được ứng viên tốt nhất. Sau đây là yêu cầu về hồ sơ tuyển sinh hàng năm của các trường đại học trong TOP 10 ở Hoa Kỳ theo bảng xếp hạng U.S.News 2018.
Chú thích của trường
Chúng tôi khuyến khích nhưng không bắt buộc chứng chỉ 2 môn của SAT Subject. Chứng chỉ này thường hỗ trợ chúng tôi trong quá trình đánh giá. Chúng tôi không ưu tiên đặc biệt đối với những học sinh có chứng chỉ này, tuy nhiên, nếu bạn đăng ký vào ngành khoa học kỹ thuật, bạn nên có kết quả bàithiSATToánI,II,SATVậtlýhoặc SAT Hóa học
Harvard 2 Có Tùy thuộc
Subject Test có ý nghĩa cho việc xét tuyển và sắp xếp khóa học. Học sinh nước ngoài thường có lợi hơn khi gửi chứng chỉ Subject Test, vì vậy nên sử dụng chúng. Việc quyết định thi chứng chỉ này hay không tùy thuộc hoàn toàn vào bạn.
Columbia 3 Có 0
MIT 3 Có 2
Chicago 3 Có 0
Yale 3 Có Tùy thuộc
Stanford 7 Có 2
Các ứng viên phải có 1 chứng chỉ SAT IIToán(LevelIhoặcII)và1chứngchỉ SAT Subject ( Vật lý, Hóa học hoặc Sinh học)
SAT II Toán: Phải trên 740
SAT Subject Test không yêu cầu có nhưng được khuyến khích.
SAT Subject Test là không bắt buộc. Nhưng bởi vì bài thi này làm nổi bật các lĩnh vực thế mạnh của bạn. Chúng tôi hoan nghênh báo cáo những kết quả này của bạn trong bản đăng ký.
Duke 8 Có 2 2 kết quả SAT Subject Tests được khuyến khích cao.
Pennsyvania 8 Có 0
Northwestern 10 Có 3 Kết quả SAT II môn Toán, Vật lý, Hóa học được yêu cầu phải có.
Theo bảng 4, tất cả các trường Đại học hàng đầu ở Hoa Kỳ đều bắt buộc có chứng chỉ SAT Resoning (SAT I), 7/10 trường đại học yêu cầu hoặc khuyến khích thi SAT Subject (SAT II). Tùy thuộc vào thế mạnh cá nhân, học sinh tự lựa chọn môn thi cho phù hợp.
Với kết quả SAT I và SAT II, khả năng nhận vào trường và có học bổng chỉ phụ thuộc duy nhất vào năng lực của học sinh, hoàn toàn không có sự tác động từ những yếu tố khác, không quan trọng học sinh đó là người bản địa hay đến từ quốc gia nào trên thế giới.
2.2. Tại các quốc gia khác
Hầu hết các trường đại học ở Canada yêu cầu kết quả SAT. Các trường đại học ở Anh chấp nhận kết quả SAT Resoning và SAT Subject thay cho chứng chỉ A-
Level. Từ tháng 8/2017, các học sinh Phần Lan hoặc học sinh quốc tế muốn nhập học Đại học tại Phần Lan không cần dự thi đầu vào như những năm trước mà dùng kết quả SAT để thaythế. Đi đầu cho xu hướng nàylà 4 trường Đại học hàng đầu của Phần Lan: Đại học Công nghệ Tampere, Đại học Khoa học và Ứng dụng Savonia, Đại học Aalto, Đại học Khoa học và Ứng dụng Helsinki Metropolia.
Các quốc gia khác có nhiều trường Đại học sử dụng kết quả SAT để xét tuyển cơ hội học tập như Úc, Nhật Bản, Hà Lan, Hàn Quốc, Thổ Nhĩ Kỳ...
2.3. Tại Việt Nam
Theo thông tin tuyển sinh hệ Đại học chính quynăm 2018 của trường Đại học Quốc gia Hà nội công bố ngày18/11/2017, các trường, các khoa của trường Đại học Quốc gia Hà nội mở rộng cách thức xét tuyển đối với các thí sinh sử dụng kết quả SAT. Trường dự định nhận hồ sơ của các thí sinh đạt mức điểm1040 SAT Resoning trở lên. Từ năm 2019- 2020, trường Đại học Ngoại thương cũng đã tuyển sinh bằng các chứng chỉ SAT 1260 điểm, trường Đại học Bách khoa Hà nội xét tuyển thẳng dựa trên chứng chỉ quốc tế SAT từ 1270 điểm... Những trường đại học trên đều là những trường Đại học top đầu của cả nước.
Trong những năm học qua, xu hướng dựa vào kết quả các kỳ thi quốc tế để xét tuyển đại học có thể nói là ngày càng mở rộng hơn. Nhiều ý kiến cho rằng, kết quả học bạ THPT còn có những yếu tố ảnh hưởng nên chưa phản ánh đúng năng lực của học sinh còn các kỳ thi quốc tế có mức độ công bằng, khách quan rất cao, tạo được sự tin tưởng tuyệt đối của toàn xã hội, do đó, tương lai các trường Đại học có thể thay thế học bạ THPT, thậm chí cả kỳ thi TN THPT QG bằng các kết quả SAT I, SAT II là hoàn toàn có thể xảy ra.
Mặc dù, kết quả SAT I, SAT II là khách quan, công bằng. Tuy nhiên, do học sinh Việt Nam chưa được tiếp cận nhiều với nội dung thi, chi phí học tập, chi phí thi cử rất đắt đỏ nên khó có thể sử dụng đại trà cho cả nước. Chủ yếu học sinh học thi các chứng chỉ này, phục vụ cho việc nộp hồ sơ xét tuyển vào các trường đại học trên thế giới kèm theo các gói học bổng hỗ trợ trong suốt quá trình học tập.
3. Dạy học tiếp cận kỳ thi SAT ở Việt Nam
Nhiều trường THPT (chủ yếu các trường ngoài công lập) ở thành phố lớn sử dụng chương trình của đại học Cambridge. Muốn sử dụng chương trình này, các trường phải mất một khoản phíthành viên hàngnămcho trường Đại học Cambridge, chi phí tài liệu đắt đỏ, nhà nước chưa có chính sách hỗ trợ nên gánh nặng kinh tế với học sinh là quá lớn. Nhiều học sinh muốn thamgia nhưng không đủ tiền để theo học. Trong khi đó, tài liệu học tập ôn thi SAT phong phú, đa dạng và dễ tiếp cận hơn vì hầu hết tài liệu đã được online trên mạng. Đó chính là điều kiện quý giá cho học sinh và ngay cả giáo viên có thể tìm hiểu gần hơn với nội dung học và nội dung thi của kỳ thi SAT nói chung và SAT II Chemistry nói riêng. Để tìm hiểu thực trạng dạy học theo hướng tiếp cận kỳ thi SAT II Chemistry trong trường phổ thông, chúng tôi tiến hành điều tra những nội dung sau bằng cách
phát phiếu điều tra.
- Tìm hiểu hứng thú của học sinh với bộ môn hoá học.
- Tìm hiểu nhu cầu học và thi lấy chứng chỉ SAT II Chemistry
- Tìm hiểu hứng thú của giáo viên trong việc tiếp cận kỳthi SAT II Chemistry
- Gặp gỡ trực tiếp giáo viên và học sinh trường THPT X
- Gửi và thu phiếu điều tra cho giáo viên, học sinh
* Tiến hành điều tra học sinh trung học phổ thông theo mẫu:
PHIẾU THĂM DÒ (Sử dụng cho học sinh)
1. Em có thích học môn hóa học không?
+ Có: + Không:
2. Em đã tìm hiểu về kỳ thi SAT và SAT II Chemistry chưa?
+ Chưa + Rồi
3. Em có muốn tiếp cận nội dung học và thi theo SAT II Chemistry không?
+ Có: + Không
* Kết quả được tổng hợp như sau:
- Thích học môn hoá: (231/460)
- Đã tìm hiểu về nội dung thi SAT II Chemistry (5/460 )
- Muốn tiếp cận nội dung học và thi theo SAT II Chemistry (153/460)
Như vậy, học sinh ở trường X là trường ở nông thôn nên chưa có điều kiện tiếp cận và hiểu biết về kỳ thi chuẩn hóa quốc tế SAT. Tuy nhiên nhu cầu tìm hiểu của các em với kỳ thi này khá cao (153 trên tổng 231 em học sinh thích học môn Hóa).
* Tiến hành điều tra giáo viên theo mẫu:
PHIẾU THĂM DÒ
(Sử dụng cho giáo viên)
1. Thầy (Cô) có biết về kỳ thi SAT và SAT II Chemistry không?
+ Đã biết kỹ + Đã biết
+ Đã nghe qua
+ Chưa bao giờ nghe thấy
2. Ý kiến của thầy cô về việc tìm hiểu và tiếp cận kỳ thi SAT II Chemistry?
+ Nên tìm hiểu
+ Không nên tìm hiểu
3. Theo thầy cô việc tìm hiểu kỳ thi SAT Chemistry có ý nghĩa gì ?
+ Đón đầu việc triển khai chương trình GDPT mới
+ Giới thiệu cho học sinh tiếp cận kỳ thi chuẩn hóa quốc tế
+ Xây dựng nguồn tư liệu giảng dạy cho bản thân
+ Lý do khác
* Kết quả ý kiến việc tiếp cận kỳ thi SAT và SAT II Chemistry
- Nên tìm hiểu: 7/7
- Không nên tìm hiểu : 0/7 Bảng 5: Kết quả điều tra hiểu biết về SAT II Chemistry của giáo viên Hiểu Biết Nghequa Chưa biết Kết quả 1/7 2/7 3/7 1/7 Tỉ lệ 14,29% 28,56% 42,86% 14,29% Bảng 6: Lý do tìm hiểu kỳ thi SAT II Chemistry Đón đầu việc dạy học theo CT GDPT mới
Học sinh tiếp cận kỳ thi chuẩn hóa quốc tế
Tạo nguồn tư liệu giảng dạy Lý do khác Tìm hiểu để tăng thêm hiểu biết
Kết quả 7/7 7/7 7/7 3/7 Tỉ lệ 100% 100% 100% 42,86% Như vậy, đa số giáo viên giảng dạy hóa học đều có nhu cầu muốn tìm hiểu và tiếp cận nội dung dạy học và nội dung thi của kỳ thi SAT II Chemistry. Có rất
nhiều lý do khác nhau, nhưng tóm lại lý do chính đó là muốn nâng cao chất lượng của việc dạy học hóa học trong nhà trường THPT.
4. Một số công trình nghiên cứu về việc dạy học tiếp cận các kỳ thi quốc tế
Cho đến nay, việc giảng dạy bộ môn Hóa học ở trường phổ thông bằng tiếng Anh vẫn là nỗi trăn trở của các nhà làm giáo dục và giáo viên Hóa học ở trường THPT tại Việt Nam, có rất nhiều công trình nghiên cứu vấn đề này như :
- Luận văn Thạc sỹKhoa học Giáo dục (Đại học Vinh) của tác giả Nguyễn Thị Trúc Nguyên, người hướng dẫn khoa học PGS.TS Cao Cự Giác, năm 2014: Nghiên cứu giảng dạy Hóa học bằng tiếng Anh ở trường trung học phổ thông. Luận văn này đã xâydựng hệ thống từ vựng, mẫu câu, nội dung, phương pháp liên quan đến bài giảng Hoa học bằng tiếng Anh ; đề xuất cách thức kiểm tra đánh giá kết quả học tập bằng tiếng Anh.
- Bài báo: Dạy học hóa học bằng tiếng Anh theo định hướng tích hợp nội dung và ngôn ngữ CLIL của tác giả Bùi Thị Hoàng Hoa đăng trên tạp chí Khoa học của trường Đại học Sư phạm Thành phố Hồ Chí Minh. Trong bài báo, tác giả đã sử dụng phương pháp CLILđể thực hiện việc giảng dạybằng tiếng Anh các nội dung chương trình môn Hóa và kết quả của việc áp dụng này. Đã có nhiều công trình nghiên cứu việc dạyhọc Hóa học bằng tiếng Anh. Tuy nhiên hiện nay chỉ mới có một vài công trình khoa học nghiên cứu về việc tìm hiểu nội dung của chương trình quốc tế nào đó giảng dạy. Vì vậy việc tiếp cận chương trình thi SAT II Chemistrycủa Hoa Kỳ là một hướng đi rất mới trong giảng dạyHóa học THPT ở tỉnh Nghệ An nói riêng và cả nước nói chung.
5. Đánh giá vấn đề thực tiễn
5.1. Ưu điểm
Bộ giáo dục đã ban hành CTGDPT mới 2018 theo định hướng hội nhập quốc tế. Hàng ngày, chúng ta hay nghe được các thông tin như: Giáo dục Việt Nam đào tạo ‘thầy’ chứ chưa đào tạo ‘thợ’; Học chưa đi đôi với hành; Số lượng bằng sáng chế ở Việt Nam ít; Học Toán – Lý – Hóa để làm gì ? Cách học của học sinh Mỹ khác cách học của học sinh Việt Nam như thế nào ? Chương trình học ở Mỹdễ hơn ở Việt Nam phải không ? ... Là người làm trong ngành GD, việc dạyvà học như thế nào để phát huy thế mạnh, hạn chế những yếu kém của học sinh cũng là nỗi trăn trở của nhiều giáo viên THPT hiện nay. Đặc biệt, giáo dục ở Mỹ là hình mẫu của rất nhiều quốc gia trên thế giới nên việc tìm hiểu về kỳ thi SAT ở Mỹ thực sự rất hấp dẫn không chỉ học sinh mà còn với giáo viên. Ở trường PT địa phương, các thầy cô giáo của bộ môn hóa học được khảo sát đều đã có những hiểu biết nhất định về kỳ thi SAT và SAT II Chemistry. Học sinh được khảo sát đa số có niềm yêu thích với bộ môn Hóa học và việc giảng dạy để thi theo SAT nhận được đồng thuận cao.
5.2. Nhược điểm và hạn chế Mặc dù có nhiều ưu điểm, tuy nhiên thực tiễn còn có rất nhiều nhược điểm và hạn chế như :
- Trong số những GV có chuyên môn vững vàng, thâm niên công tác cao thì rất ít người có thể tự tin tiếp cận tài liệu bằng tiếng Anh. GV trẻ có nền tảng tiếng Anh tốt thì lại cần rèn luyện thêm để lên lớp vững vàng. HS ở vùng nông thôn như trường THPT X có thể tiếp thu kiến thức Khoa học tốt song lại có hạn chế về tiếng Anh.
- Bộ GD và ĐT, Sở GD và ĐT chưabanhành CT chính thức nên dẫn đến mỗi trường dạy một kiểu, không thống nhất và không hỗ trợ rút kinh nghiệm được cho nhau.
- HS chưa được tiếp xúc với CT học và thi SAT II Chemistry do hạn chế về thông tin. Đa số các em thậm chí chưa biết gì về kỳ thi này. Như vậy vai trò của giáo viên chính là người tìm hiểu và truyền lại thông tin cho học sinh, để các em có thêm lựa chọn hấp dẫn sau khi tốt nghiệpTHPT.
Tiểu kết : Mặc dù có nhiều ưu điểm nhưng thực tiễn cũng có rất nhiều điều hạn chế. Ở sáng kiến kinh nghiệm này, đối tượng HS được lựa chọn thực nghiệm là HS ở trường X - trình độ tiếng Anh tương đối tốt, song tiếng Anh chuyên ngành hóa còn hạn chế. Đặc điểm của các môn khoa học, trong đó có Hóa học là kiến thức hầu như sẽ thống nhất giữa các quốc gia, bất kể ngôn ngữ, vì vậy, nếu các em học sinh kết hợp với những kiến thức Hóa đã được học với dự đoán từ chuyên ngành, các em có thể hoàn thành tốt bài thi SAT II Chemistry. Có nhiều nội dung song tác giả chọn 2 nội dung phần Tốc độ phản ứng và Cân bằng hóa học để thực hiện đề tài này.
III. NỘI DUNG DẠY HỌC MỘT SỐ CHỦ ĐỀ THEO HƯỚNG TIẾP CẬN SAT II CHEMISTRY
1. Nguyên tắc xây dựng các chủ đề dạy học tiếp cận SAT II Chemistry
Trong đề tài này, mục đích chính của các chủ đề dạy học Hóa học là tiếp cận SAT II Chemistry, có nghĩa là các nội dung được biên soạn bằng tiếng Anh, tập trung vào lý thuyết Hóa học có mở rộng và chuyên sâu. Hệ thống bài tập cũng được biên soạn theo hệ thống câu hỏi trong SAT II Chemistry, không có dạng bài tập đòi hỏi tính toán phức tạp.
Các bước thực hiện nội dung dạy học như sau:
- Tuyên truyền, phổ biến cho học sinh về Kỳ thi SAT II Chemistry: Nội dung thi và cơ hội tương lai khi có chứng chỉ của kỳ thi này.
- Xây dựng và phát tài liệu song ngữ về các nội dung Tốc độ phản ứng và Cân bằng hóa học cho học sinh tự học, tự nghiên cứu để phát huy tính tự học tự sáng tạo của học sinh. Những vấn đề nếu chưa hiểu sẽ được giáo viên và học sinh thảo luận và giải đáp trên lớp. Qua việc tự học và tìm kiếm thông tin, học sinh nắm được kiến thức và ngôn ngữ Hóa học tiếng Anh chuyên ngành, từ đó các em có thể đọc và hiểu
đề bài. Vì bài thi này là bài thi Trắc nghiệm, nên kỹ năng đọc, hiểu được rèn luyện hơn so với kỹ năng nghe nói, và viết tiếng Anh.
- Đưa cho học sinh hệ thống bài tập luyện tập về các nội dung trên.
- Xây dựng bài kiểm tra theo định hướng bài thi SAT II Chemistry. Các câu hỏi này hoàn toàn bằng tiếng Anh. Kết quả của bài làmđó sẽ được tính toán để đánh giá hiệu quả của đề tài.
2. Xây dựng nội dung dạy học các chủ đề
2.1. Tốc độ phản ứng
Content
These skills are usually tested on the SAT Subject Test in Chemistry. You should be able to…
Explain how each of the following factors affects the rate of chemical reaction: nature of the reactants, surface area exposed, concentrations, temperature, and the presence of a catalyst.
Draw reaction diagrams with and without a catalyst.
Explain the Law of Mass Action
Describe the relationship between reaction mechanism and rates of reaction.
The measurement of reaction rate is based on the rate of appearance of a product or disappearance of a reactant. It is usually expressed in terms of a change in concentration of one of the participants per unit time.
Experiments haveshownthatfor most reactions the concentrations of all participants change most rapidly at the beginning of the reaction; that is, the concentration of the products shows the greatest rate of increase, and the concentration of the reactants the
Nộidung
Những kỹ năng sau thường có trong bài kiểm tra SAT II Hóa học. Học sinh cần phải:
- Giải thích được các yếu tố sau đây ảnh hưởng như thế nào đến tốc độ phản ứng hóa học: Bản chất của chất phản ứng, diện tích bề mặt tiếp xúc, nồng độ, nhiệt độ và chất xúc tác.
- Vẽ được sơ đồ phản ứng khi có và khi không có mặt chất xúc tác.
- Trình bày được định luật tác dụng khối lượng.
- Mô tả được mối quan hệ giữa cơ chế phảnứngvàtốc độ phản ứng hóahọc.
Việc tính tốc độ phản ứng được dựa vào tốc độ tạo thành một sản phẩm hoặc tốc độ mất đi của chất tham gia phản ứng. Nó được biểu diễn bằng sự biến thiên nồng độ của một chất trong phương trình phản ứng trong một đơn vị thời gian.
Các thí nghiệm chỉ ra rằng, nồng độ của các chất trong phản ứng thay đổi nhanh nhất khi bắt đầu xảy ra phản ứng; Có nghĩa là, nồng độ của sản phẩm sẽ tăng nhanh nhất và nồng độ của chất tham gia phản ứng sẽ giảm nhanh nhất
highest rate of decrease, at this point. This means that the rate of a reaction changes with time. Therefore a rate must be identified with a specific time.
Factors affecting reaction rates
Five important factors control the rate of a chemical reaction. There are summarized below.
1. The nature of the reactants.
In chemical reactions, some bonds breaks and others form. Therefore, the rates of chemical reactions should be effectedbythenatureofthebondsinthe reacting substances. For example, reactions between ions in an aqueous solution may take place in a fraction of a second. Thus, the reaction between AgNO3 với NaCl is veryfast. The white AgCl precipitate appears immediately. In reactions where manycovalent bonds must be broken, reaction usually takes place slowly at room temperatures. The decomposition of H2O2 into H2O and O2 happens slowly at room temperatures. In fact, about 17 minutes is required for half the peroxide in a 0.5M solution to decompose.
2. The surface area exposed.
Since most reactions depent on the reactants coming into contact, the surface exposed proportionally affects the rate of the reaction.
3. The concentrations.
The reaction rate is usually proportional to the concentrations of the reactants. The usual dependence of the reaction rate on the concentration of the reactants can simply be explained by theorizing that, if more molecules or
tại thời điểm này. Tức là, tốc độ phản ứng sẽ thay đổi theo thời gian. Do đó, tốc độ phản ứng phải được xác định với khoảng thời gian cụ thể.
Các yếu tố ảnh hưởng đến tốc độ phản ứng Năm yếu tố quan trọng ảnh hưởng đến tốc độ phản ứng, đó là:
1. Bản chất của chất phản ứng
Trong phản ứng hóa học, một số liên kết bị đứt và một số liên kết được hình thành. Do đó, tốc độ phản ứng sẽ bị ảnh hưởng bởi bản chất của các liên kết trong chất phản ứng. Ví dụ, phản ứng giữa các ion trong dung dịch diễn ra trongmộtphầngiây. Nhưphảnứnggiữa AgNO3 với NaCl xảy ra rất nhanh, kết tủa trắng AgCl xuất hiện ngay lập tức. Trong các phản ứng phải bẻ gãy nhiều liên kết cộng hóa trị, phản ứng thường xảy ra chậm hơn ở nhiệt độ thường. Ví dụ, phản ứng phân hủy H2O2 thành H2O và O2 xảy ra chậm ở nhiệt độ thường, thực tế, phải cần khoảng 17 phút để phân hủy hết một nửa lượng peroxide với nồng độ 0,5M.
2. Diện tích bề mặt tiếp xúc Vìhầuhếtcácphảnứngđềuphụthuộc vào sự va chạm của các chất phản ứng với nhau nên diện tích bề mặt tiếp xúc sẽ ảnh hưởng đến tốc độ phản ứng.
3. Nồng độ
Tốc độ phản ứng thường tỉ lệ với nồng độ của các chất tham gia phản ứng. Sự phụ thuộc nàycó thể giải thích một cách đơn giản theo giả thuyết rằng, càng có nhiều phân tử hoặc ion của chất phản ứng thì càng nhiều cơ hội xảy ra phản
ions of the reactant are in the reaction area, then there is a greater chance that more reactions will occur. This idea is further developed in the collision theory discussed below.
4. The temperature.
A tempereature increase of 10oC above room temperature usually causes the reaction rate to double or triple. The basic for this generality is that, as the temperatute increases, the average kinetic energy of the particles involved increases. As a result the particles move faster and have a greater probability of hitting other reactant particles. Because the particleshave more energy, theycan cause an effective collision, resulting in the chemical reaction that forms the product substance.
5. The presence of a catalyst.
It is a substance that increases or decreases the rateof a chemical reaction without itself under going any permanent chemical change. The catalyst provides an alternative pathway by which the reaction can proceed and in which the activation energy is lower. It thus increases the rate at whichthe reaction comes to completion or equilibrium. Generally, the term is used for a subtance that increases reaction rate(apositivecatalyst).Some reactions can be slowed down by negative catalysts.
Activation energy
Often a reaction rate maybe increased
ứng. Giả thuyết này được nêu trong lý thuyết va chạmsẽđược trình bàyở phần sau.
4. Nhiệt độ
Nhiệt độ phòng tăng thêm 10oC thường sẽ làm cho tốc độ phản ứng tăng lên 2 hoặc 3 lần. Cơ sở giải thích cho hiện tượng này là, khi nhiệt độ tăng lên, động năng trung bình của các hạt cũng tăng lên, kết quả là các hạt chuyển động nhanh hơn và có xác suất va chạm với nhau nhiều hơn. Bởi vì các hạt có năng lượng lớn hơn nên có thể gây ra nhiều va chạm hiệu quả hơn, dẫn đến phản ứng hóa học tạo thành sản phẩm.
5. Chất xúc tác
Chất xúc tác là chất làm tăng hoặc giảm tốc độ phản ứng và vẫn giữ nguyên trong quá trình phản ứng. Nó làm cho phản ứng đi theo quá trình có năng lượng hoạt hóa thấp hơn. Do đó nó làm cho phản ứng xảy ra nhanh hơn hoặc cân bằng hóa học nhanh đạt đến trạng thái cân bằng hơn. Thông thường, chất xúc tác được hiểu là chất làm tăng tốc độ phản ứng (chất xúc tác dương). Một số phản ứng xảy ra chậm hơn khi có mặt chất xúc tác, được hiểu là chất xúc tác âm).
Năng lượng hoạt hóa Thông thường, tốc độ phản ứng bị ảnh hưởng bởi năng lượng hoạt hóa, là năng lượng cần thiết để phản ứng có thể xảy ra. Chất xúc tác, như đã trình bày ở phần trước, là chất được đưa vào để làm
or decreased by effecting the activation energy, that is, the energy necessary to cause a reaction to occur. A catalyst, as explained in the preceding section, is a substance that is introduced into a reaction to speed up the reaction by changing the amount of activation energy needed. The effect of catalyst used to speed up a reaction can be shown as follows:
tăng tốc độ phản ứng bằng cách thayđổi năng lượng hoạt hóa. Sự ảnh hưởng đó được biểu diễn qua sơ đồ sau:
Reaction rate law
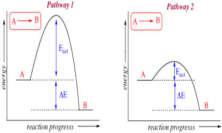
The relationship between the rate of a reaction and the masses (expressed as concentrations) of the reacting substances is summarized in the Law of Mass Action. It states that the rate of a chemical reaction is proportional to the product of the concentrations of the reactants. For a general reaction between A and B, represented by a A + b B → … the rate law expression is r ⁓ [A]a [B]b or, inserting a constant of proportionality that mathematically changes the expression to an equality, we have r = k[A]a[B]b Here k is called the specific rate constant for the reaction at the temperature of the reaction.
Biểu thức tốc độ phản ứng Mối quan hệ giữa tốc độ phản ứng và khối lượng (trong trường hợp này được hiểu là nồng độ) được biểu diễn qua công thức của Định luật tác dụng khối lượng. Tốc độ phản ứng sẽ phụ thuộc vào tích nồng độ của các chất tham gia phản ứng. Với phản ứng tổng quát giữa A và B: a A + b B → … tốc độ phản ứng sẽ tỉ lệ thuận r ⁓ [A]a [B]b khi thêm một hằng số vào biểu thức, ta được: r = k[A]a[B]b
Ở đây, k được gọi là hằng số tốc độ riêng của phản ứng đó tại một nhiệt độ xác định. Tổng các số mũ a, b được gọi là bậc của phản ứng. Ví dụ,
The exponents a and b may be added to give the total reaction order. For example:
H2(g) + I2(g) → 2HI(g) r = k[H2]1[I2]1
The sum of the exponents is 1 + 1 = 2, and therefore we have a second-order reaction.
Reaction Mechanism and Rates of Reaction
The beginning of this chapter stated that the reaction rate is usually proportional to the concentrations of the reactants. This occurs because some reactions do not directly occur between the reactants but may go through intermediate steps to get to the final product. The series of steps by which the reacting particles rearrange themselves to form the products of a chemical reaction is called the reaction mechanism. For example:
Step 1 A + B → I1 (fast)
Step 2 A + I1 → I2 (slow)
Step 3 C + I2 → D (fast)
Net equation 2A + B + C → D
Noticethatthe reactions of steps1and 3 occur relatively fast compared with the reaction of step 2. Now suppose that we increase the concentration of C. This will make the reaction of step 3 go faster, but it will have little effect on the speed of the overall reaction since step 2 is the rate determining step. If, however, the concentration of A is increased, then the overall reaction rate will increase because step 2 will be accelerated. Knowing the reaction
H2(k) + I2(k) → 2HI(k) r = k[H2]1[I2]1
Tổng 1 + 1 = 2, nên ta nói đây là phản ứng bậc 2.
Cơ chế phản ứng và tốc độ phản ứng Phần đầu của chương này đã nói rằng tốc độ phản ứng thường phụ thuộc vào nồng độ của chất tham gia phản ứng. Nhưng một số phản ứng thường không xảy ra trực tiếp giữa các chất phản ứng mà đi qua nhiều giai đoạn mới đi đến sản phẩm cuối cùng. Chuỗi các bước của phản ứng mà các chất phản ứng tự tương tác lại với nhau để tạo thành sản phẩm được gọi là cơ chế phản ứng. Ví dụ:
Bước 1 A + B → I1 (nhanh)
Bước 2 A + I1 → I2 (chậm)
Bước 3 C + I2 → D (nhanh) Phương trình tổng 2A + B + C → D
Bước 1 và bước 3 của phản ứng xảyra tương đối nhanh so với bước 2. Giả sử, ta tăng nồng độ của chất C, lúc này tốc độ phản ứng ở bước 3 tăng lên, nhưng điều này ảnh hưởng rất nhỏ đến tốc độ phản ứng của phương trình tổng khi mà bước 2 mới là bước quyết định chính. Nếu nồng độ của chất A tăng lên thì tốc độ phản ứng của phản ứng tổng sẽ tăng lên vì tốc độ phản ứng của bước 2 tăng lên. Biết cơ chế phản ứng sẽ là cơ sở để nghiên cứu ảnh hưởng của nồng độ các chất tham gia phản ứng đến tốc dộ của phản ứng chung.
mechanism provides the basis for predicting the effect of a concentration change of a reactant on the overall rate of reaction. Anotherwayof determining the effect of concentration changes is actual experimentation.
Practice exercises
1. List thefivefactors that affect therate of a reaction: 1……………… 2……………... 3……………... 4……………... 5……………...
2. Theadditionofa catalyst toa reaction (A) changes the enthalpy (B) changes the entropy (C) changes the nature of the products (D) changes the activation energy
3. An increase in concentration (A) is related to the number of collisions directly (B) is related to the number of collisions inversely (C) has no effect on the number of collisions
4. At the beginning of a reaction, the reaction rate for the reactants is (A) largest, then decreasing (B) largest and remains constant (C) smallest, then increasing (D) smallest and remains constant
5. The reaction rate law applise to the reaction aA + bB → AB gives the expression (A) rate = [A]b[B]a
Phương pháp khác để nghiên cứu ảnh hưởng của sự thay đổi nồng độ là phương pháp thực nghiệm.
Bài tập củng cố
1. Liệt kê 5 yếu tố ảnh hưởng đến tốc độ phản ứng: 1……………… 2……………... 3……………... 4……………... 5……………...
2. Thêm chất xúc tác vào phản ứng sẽ:
(A) thay đổi ∆H (B) thay đổi ∆S (C) thay đổi bản chất của sản phẩm (D) thay đổi năng lượng hoạt hóa
3. Sự tăng nồng độ sẽ:
(A) tăng số va chạm trực tiếp (B) tỉ lệ nghịch đến số vụ va chạm (C)không ảnhhưởngđến sốvụ va chạm
4. Khi bắt đầu phản ứng, tốc độ phản ứng sẽ: (A) lớn nhất, sau đó giảm dần (B) lớn nhất, sau đó không đổi (C) nhỏ nhất, sau đó tăng dần (D) nhỏ nhất sau đó không đổi
5. Biểu thức tính tốc độ phản ứng của phương trình aA + bB → AB tỷ lệ với:
(A) [A]b[B]a (B) [AB]a[A]b
(B) rate = [AB]a[A]b
(C) rate = [B]a[AB]b
(D) rate = [A]a[B]b
2.2. Cân bằng hóa học
(C) [B]a[AB]b
(D) [A]a[B]b
Contents Nộidung
These skills are usually tested on the SAT Subject Test in Chemistry. You should be able to…
Explain the development of an equilibrium condition and how it is expressed as an equilibrium constant, and use it mathematically.
Descible Le Châtelier’s Principle and how changes in temperature, pressure, and concentrations affect an equilibrium.
Solve problems dealing with ionization of water, finding the pH, solubility, products, and the common ion effect.
Explain the relationship of enthanpy and entropy as driving forces in a reaction and how they are combined in the Gibbs equation
In some reactions no products is formed to allow the reaction to go to completion; that is, the reactants and products can still interact in both directions. This can be shown as follows:
A + B C + D
Thedouble arrowindicates that Cand D can react to form A and B react to form C and D.
Những nội dung sau thường được kiểm tra trong bài thi SAT II Chemistry. Bạn cần phải:
- Mô tả được quá trình tạo thành cân bằng hóa học. Biểu thức hằng số cân bằng và sử dụng trong toán học.
- Phát biểu nguyên lý chuyển dịch cân bằng Le Châtelier và các yếu tố làm chuyển dịch cân bằng: nhiệt độ, áp suất và nồng độ.
- Làm các bài tập tính toán liên quan đến sự ion hóa của nước, tìm pH, độ tan, viết sản phẩm và ảnh hưởng của các ion trong dung dịch.
- Trình bày mối quan hệ giữa ∆H và ∆S và ảnh hưởng của chúng đối với phản ứng, kết hợp 2 đại lượng trên tạo nên phương trình Gibbs.
Trong một số phản ứng, phản ứng vẫn chưa kết thúc khi sản phẩm đã được tạo thành. Có nghĩa là, chất tham gia phản ứng và sản phẩm có thể chuyển hóa qua lại với nhau theo 2 chiều thuận, nghịch:
A + B C + D Mũi tên thuận nghịch biểu diễn rằng, A và B phản ứng tạo thành C và D và ngược lại C và D cũng có thể phản ứng tạo thành A và B. Những phản ứng như vậy gọi là phản ứng thuận nghịch.
Reversible reactions and equilibium
The reaction is said to have reached equilibrium when the forward reaction rate is equal to the reverse reaction rate. Notice that this is a dynamic condition, NOT a static one, although on appearance the reaction seems to have stopped. An example of an equilibrium is a crystal of CuSO4 in a saturated solution of CuSO4. Although to the observer the crystal seems to remain unchanged, there is actually an equal exchange of crystal material with the CuSO4 in solution. As some solute comes out of solution, an aqual amount is going into solution.
To express the rate of reaction in numerical terms, we can use the Law of Mass Action, which states: The rate of a chemical reaction is proportional to the product of the concentrations of the reacting substances. The concentrations are expressed in moles of gas per literof volume or moles of solute per liter of solution. Suppose, for example, that 1 mole/literofgasA2 (diatomic molecule) is allowed to react with 1 mole/liter of another diatomic gas, B2, and they form gas AB; let R be the rate for the forward reaction forming AB. The brackted symbols [A2] and [B2] represent the concentrations in moles per liter for these diatomic molecules. Then A2 + B2 → 2AB has the rate expression
R ⁓ [A2]x[B2] where ⁓ is the symbol for “proportional to.”
When [A2] and [B2] are both 1 mole/liter, the reaction rate is a certain
Phản ứng thuận nghịch và cân bằng hóa học
Phản ứng được cho là đạt đến trạng thái cân bằng khi tốc độ phản ứng thuận bằng với tốc độ phản ứng nghịch. Lưu ý rằng, đây là một trạng thái cân bằng động chứ không phải là cân bằng tĩnh mặc dù bề ngoài giống như phản ứng đang dừng lại. Ví dụ, cân bằng giữa tinh thể CuSO4 với dung dịch CuSO4 trong quá trình hòa tan. Mặc dù, bề ngoài có vẻ như tinh thể CuSO4 không thay đổi nhưng thực chất có sự trao đổi giữa phân tử CuSO4 trong tinh thể với CuSO4 trong dung dịch. Nếu có một lượng đi vào tinh thể thì cũng có một lượng tương đương đi vào dung dịch. Đểbiểu thị tốc độ phản ứng dưới dạng số, chúng ta có thể sử dụng định luật tác dụng khối lượng, trong đó nêu rõ: Tốc độ của một phản ứng hóa học tỉ lệ thuậnvớitíchnồngđộ củachấtthamgia phản ứng. Nồng độ có thể được tính bằng mol khí trên một lít thể tích khí hoặc mol chất tan trên một lít thể tích dung dịch. Ví dụ, giả sử 1 mol/l khí A2 (phân tử 2 nguyên tử) phản ứng với 1 mol/l khí B2 (cũng là phân tử 2 nguyên tử) tạo thành phân tử AB. Gọi R là tốc độ của phản ứng thuận tạo AB; ký hiệu [A2] và [B2] là nồng độ của chất A2 và B2 được tính bằng mol/l. Phản ứng A2 + B2 → 2AB có biểu thức tốc độ:
R ⁓ [A2]x[B2]
Với ⁓ có nghĩa là tỷ lệ thuận Khi [A2] = [B2] = 1 mol/l, tốc độ phản ứng bằng hằng số k1 (chỉ phụ thuộc vào nhiệt độ).
constant value (k1) at a fixed temperature.
R=k1 (k1 is called the rate constant)
For any concentrations of A and B, the reaction rate is
R = k1 x [A2] x [B2]
If [A2] is 3 moles/liter and [B2] is 2 moles/liter, the equation becomes
R = k1 x 3 x 2 = 6k1
The reaction rate is six times the value for a 1 mole/liter concentration of each reactant.
At the fixed temperature of the forward reaction,ABmoleculesare also decomposing. If we designate this reverse reaction as R’, then, since 2AB (or AB +AB) →A2 + B2
Two molecules of AB must decompose to form one molecules of A2 and one of B2. Thus the reverse reaction in this equation is proportional to the squareofthe molecular concentrationof AB:
R’ ⁓ [AB] x [AB] or R’ ⁓ [AB]2 and R’ ⁓ k2 x [AB]2 where k2 represents the rate of decomposition of AB at the fixed temperature. Both reactions can be shown is this manner:
A2 + B2 2AB (note double arrow)
When the first reaction begins to produce AB, some AB is avaiable for the reverse reaction. If the initial condition is only the presence of A2 and B2 gases, then the forward reaction will occur rapidly to produce AB. As the
R = k1 (k1 gọi là hằng số tốc độ phản ứng).
Với các nồng độ khác của A và B, tốc độ phản ứng là: R = k1 x [A2] x [B2]
Nếu [A2] = 3 mol/l và [B2] = 2 mol/l. phương trình trở thành: R = k1 x 3 x 2 = 6k1
Tốc độ phản ứng tăng 6 lần so với khi nồng độ mỗi chất là 1 mol/l. Ở nhiệt độ xác định mà phản ứng thuận xảy ra, các phân tử AB cũng bị phân hủy. Nếu chúng ta gọi tốc độ phản ứng nghịch là R ', thì: 2AB (hoặc AB + AB) → A2 + B2 Hai phân tử AB phải phân hủy để tạo thành một phân tử A2 và một phân tử B2. Do đó, tốc độ phản ứng nghịch trong phương trình này tỷ lệ với bình phương nồng độ phân tử của AB: R ’⁓ [AB] x [AB] hoặc R ’⁓ [AB]2 và R ’⁓ k2 x [AB]2 trong đó k2 biểu thị hằng số tốc độ phân hủyAB ở nhiệtđộxác định. Cảhai phản ứng có thể được hiển thị theo cách này: A2 + B2 2AB (lưu ý mũi tên thuận nghịch)
Khi phản ứng đầu tiên bắt đầu tạo ra AB, một số phân tử AB đã sẵn cho phản ứng ngược lại. Nếu điều kiện ban đầu chỉ có mặt của khí A2 vàB2 thì phảnứng thuận xảy ra nhanh chóng tạo ra AB. Khi nồng độ AB tăng, phản ứng nghịch
concentration of AB increases, the reverse reaction will increase. At the same time, the concentrations of A2 and B2 will be decreasing and consequently the forward reaction rate will decrease. Eventually the two rates will be equal, that is, R = R’. At this point, equilibrium has been established, and k1[A2] x [B2] = k2[AB]2 or 1 2
k k = 2 22
AB AB = K
The convention is that k1 (forward reaction) is placed over k2 (reverse reaction) to get this expression. Then k1/k2 can be replaced by Keq which is called the equilibrium constantforthis reaction under the particular conditions.
In another general example: aA + bB cC + dD The reaction rates can be expressed as: R = k1[A]a x [B]b R ’ = k2[C]c x [D]d
Note that the values of k1 and k2 are different, but that each is a constant for theconditions of reaction. At the start of the reaction, [A] and [B] will be at their greatest values, and R will be large; [C], [D], and R ’ will be zero. Gradually R will decrease and R’ will become equal. At this point the reverse reaction is forming the original reactants just as rapidly as thay are being used up by the forward reaction. Therefore, no further change in R, R ’, or any of the concentrations will occur.
If we set R ’ equal to R, we have: k2 x [C]c[D]d = k1 x [A]a x [B]b or
sẽ tăng. Đồng thời, nồng độ của A2 và B2 sẽ giảm và do đó tốc độ phản ứng thuận sẽ giảm. Cuối cùng thì hai tỷlệ sẽ bằng nhau, nghĩa là R = R’. Tại thời điểm này, trạng thái cân bằng đã được thiết lập, và k1 [A2] x [B2] = k2 [AB]2 hoặc là 1 2
k k = 2 22
AB AB = K
Ta quy ước k1 (phản ứng thuận) được đặt phía trên k2 (phản ứng nghịch) trong biểu thức này. Khi đó k1/ k2 có thể được thay thế bằng Keq được gọi là hằng số cânbằngcủaphảnứngnàytại điềukiện xác định.
Xét một ví dụ khác: aA + bB cC + dD
Tốc độ phản ứng có thể được biểu thị bằng: R = k1[A]a x [B]b R’ = k2[C]c x [D]d
Lưu ý rằng các giá trị của k1 và k2 là khác nhau, nhưng mỗi giá trị là một hằng số tại một điều kiện xác định của phản ứng. Khi bắt đầu phản ứng, [A] và [B] sẽ ởgiátrị lớn nhất, và R sẽlớn; [C], [D], và R’sẽ bằng không. Dần dần R sẽ giảm và R’trở nên bằng nhau. Tại thời điểm này, chất được tạo ra do phản ứng thuận bao nhiêu thì sẽ phản ứng theo phản ứng nghịch bấy nhiêu. Do đó, không có sự thay đổi nào về R, R’ và nồng độ các chất tại thời điểm cân bằng sẽ không đổi. Nếu ta cho R’ bằng R thì ta có: k2 x [C]c [D]d = k1 x [A]a x [B]b hoặc là
k k =
1 2
[] c d ab CD AB = K
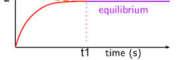
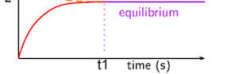
This process of two substances, A and B, reacting to form products C and D and the reverse can be shown graphically to represent what happens as equilibrium is established. The hypothetical equilibrium reaction is describle by the following general equation:
aA + bB cC + dD
At the beginning (time to), the concentrations of C and D are zero and those of A and B are maximum. The graph below shows that over time the rate of the forward reaction decreases as A and B are used up. Meanwhile, the rate of the reverse reaction increase as C and D are formed. When these two reaction rates become equal (at time t1), equilibirum is established. The individualconcentrations ofA, B, Cand D no longer changeif conditions remain the same. To an observer, if appears that all reaction has stopped; infact, however, both reactions are occurring at the same rate.
We see that, for thegiven reaction and the given conditions, Keq is a constant, called the equilibirum constant.

k k =
1 2
[] c d ab CD AB = K
Hai chất Avà Bphản ứng để tạo thành sản phẩm C và D và ngược lại C và D phản ứng tạo thành A và B. Quá trình nàycó thể được biểu diễn bằng đồ thị để biểu diễn những gì xảy ra khi cân bằng được thiết lập. Phản ứng cân bằng giả thuyết có thể phân tích được theo phương trình tổng quát sau: aA + bB cC + dD Tại thời điểm ban đầu (to), nồng độ của C và D bằng 0 và nồng độ của A và B là cực đại. Đồ thị dưới đây cho thấy rằng theo thời gian tốc độ của phản ứng thuận giảm dần. Trong khi đó, tốc độ của phản ứng nghịch tăng khi C và D được tạo thành. Khi hai tốc độ phản ứng này trở nên bằng nhau (tại t1), cân bằng được thiết lập. Nồng độ riêng phần của A,B,CvàDkhôngcònthayđổinếucác điều kiện vẫn giữ nguyên. Đối với một người quan sát, dường như tất cả các phản ứng đã dừng lại, tuy nhiên, cả hai phản ứng đều không dừng lại mà chúng xảy ra với tốc độ như nhau.
Ta thấy rằng, đối với phản ứng đã cho trongmộtđiềukiệnxácđịnh, Keq làmột hằng số, được gọi là hằng số cân bằng.
If Keq is large, this means thatequilibrium occurs almost at once
Nếu Keq lớn,điềunàycó nghĩalà trạng thái cân bằng xảy ra gần như ngay lập
and relatively many product is produced.
The equilibrium constant, Keq has been determined experimentally for manyreactions, andthevalues aregiven in chemiscal handbooks.
Suppose we find Keq for reacting H2 and I2 at 490oC to be equal to 45.9. Then the equilibrium constant for this reaction
H2 (g) + I2 (g) 2HI (g) at 490oC is K = 2 22
HI IH = 45.9
Example 1
Three moles of H2 (g) and 3.00 moles of I2 (g) are introduced into a 1-liter box at a temperature of 490oC. Find the concentration of each substance in the box when equilibrium is established.
Initial conditions: [H2] = 3.00 mol/L [I2] = 3.00 mol/L [HI] = 0 mol/L
The reaction proceeds to equilibrium and K = 2 22
HI IH = 45.9
At equilibrium, then, [H2] = (3.00-x) mol/L (where x is the number of moles of H2 that are in the form of HI at equilibrium)
[I2] = (3.00-x) mol/L (the same x is used since 1 mol of H2 requires 1 mol of I2 to react to form 2 mol of HI) [HI] = 2x mol/L
tức và sản phẩm sinh ra lớn hơn chất thamgiaphảnứng, tacoiđó làphảnứng hoàn toàn.
Hằng số cân bằng, Keq đã được xác định bằng thực nghiệm cho nhiều phản ứng và các giá trị được đưa ra trong sổ tay hóa học.
Giả sử ta có Keq của phản ứng giữa H2 và I2 ở 490oC bằng 45,9. Khi đó hằng số cân bằng cho phản ứng này:
H2(k) + I2(k)2HI (k) ở 490oC
là: K = 2 22
HI IH = 45,9
Ví dụ 1: 3,00 mol H2(k) và 3,00 mol I2(k) được dẫn vào một bình 1 lít ở nhiệt độ 490oC. Tìm nồng độ của mỗi chất trong bình khi cân bằng được thiết lập?
Giải: Điều kiện ban đầu:
[H2] = 3,00 mol/l [I2] = 3,00 mol/l [HI] = 0 mol/l
Phản ứng tiến tới trạng thái cân bằng và K = 2 22
HI IH = 45,9
Ở trạng thái cân bằng:
[H2] = (3,00-x) mol/l (trong đó x là số mol H2 phản ứng tạo thành HI lúc cân bằng)
[I2] = (3,00-x) mol/l (sử dụng cùng một x vì 1 mol H2 cần 1 mol I2 để phản ứng tạo thành 2 mol HI) [HI] = 2x mol/l
Then K = 2 2 (3.00)(3.00) x xx = 45.9
Taking the square root of each side gives
�� �.���� = 6.77 Solving for x: x = 2.32
Note: On the SAT Subject Test in Chemistry, calculators are not permitted. So answers to questions like this would be easily calculated “perfect squares”
Substituting this x value into the concentration expressions at equilibrium we have
[H2] = (3.00 – x) = 0.68 mol/L
[I2] = (3.00 – x) = 0.68 mol/L
[HI] = 2x = 4.64 mol/L
This crucial step in this type of problemis settingupyour concentration expressions from your knowledgeof the equation. Suppose that this problem had been: Example 2 Find the concentration at equilibrium for the same conditions as in the preceding example except that only 2.00 moles of HI are injected into the box.
[H2] = 0 mol/L
[I2] = 0 mol/L
[HI] = 2.00 mol/L
At equilibrium
[HI] = (2.00 – x) mol/L
(For every mole of HI that decomposes, only 0.5 mole of H2 and 0.5 moles of I2 are formed.)
K = 2 2 (3,00)(3,00) x xx = 45,9
Lấy căn bậc hai, ta có: �� �,���� = 6,77 Giải cho x: x = 2,32
Lưu ý: Trong Bài kiểm tra SAT II Chemistry, thí sinh không được phép sử dụng máy tính. Vì vậy, câu trả lời cho những câu hỏi như thế này sẽ dễ dàng nếu được tính toán bằng phương pháp "hìnhvuông hoàn hảo" – phương pháp nhẩm khai căn bậc 2.
Thay giá trị x này vào biểu thức nồng độ ở trạng thái cân bằng, chúng ta có
[H2] = (3,00 - x) = 0,68 mol/l
[I2] = (3,00 - x) = 0,68 mol/l [HI] = 2x = 4,64 mol/l
Bước quan trọng trong giải bài toán này là thiết lập các biểu thức liên quan đến nồng độ dựa vào kiến thức của bạn về tỉ lệ các chất trong phương trình, như ví dụ sau: Ví dụ 2: Tìm nồng độ ở trạng thái cân bằng đối với các điều kiện tương tự như trong ví dụ 1 ngoại trừ chỉ có 2,00 mol HI được bơm vào bình.
[H2] = 0 mol/l
[I2] = 0 mol/l
[HI] = 2,00 mol/l
Ở trạng thái cân bằng
[HI] = (2,00 - x) mol/l (Cứ mỗi mol HI bị phân hủy thì chỉ tạo thành 0,5 mol H2 và 0,5 mol I2).
[HI] = 0.5 x
[I2] = 0.5 x
K = (2-x)2/(x/2)2 = 45.9
Solving for x gives: x = 0.456
Then, substituring into the equilibrium conditions,
[HI] = 2 – x = 1.54 mol/L
[I2] = x/2 = 0.228 mol/L
[H2] = x/2 = 0.228 mol/L
Le Châtelier’s Principle
A general law, Le Châtelier’s Principle, can be used to explain the results of applying any change of condition (stress) on a system in equilibrium. It states that if a stress is placed upon a system in equilibrium, the equilibrium is displaced in the direction that counteracts the effect of a stress. An increase in concentration of a substance and lowers its concentration. A rise in temperature favors the reaction that absorbs heat and so tends to lower the temperature. These ideas are further developed below.
Effects of changing conditions
Effects of changing concentrations
When a system at equilibrium is disturbed by adding or removing one of the substances (thus changing its concentartion), all the concentrations will change until a new equilibrium point is reached with the same value of Keq.
Iftheconcentrationof areactantin the forward action is increased, the equilibrium is displaced to the right,
[HI] = 0,5 x
[I2] = 0,5 x
K = (2-x)2/(x/2)2 = 45,9
Giải hệ x ta được: x = 0,456
Sau đó, thay thế vào các nồng độ lúc cân bằng ta có:
[HI] = 2 - x = 1,54 mol/l
[I2] = x/2 = 0,228 mol/l
[H2] = x/2 = 0,228 mol/l
Nguyên lý Le Châtelier’s
Nguyên lý Le Châtelier’s là nguyên lý chung để giải thích sự chuyển dịch cânbằng hóa học khi có sự thay đổi các yếu tố bên ngoài. Khi thay đổi các yếu tố bên ngoài (như nồng độ, nhiệt độ, áp suất) vào hệ cân bằng thì cân bằng hóa học sẽ chuyển dịch theo hướng làm giảm sự tác động đó. Sự gia tăng nồng độ một chất sẽ làm cân bằng chuyển dịch theo hướng làm giảm nhiệt độ chất đó. Sự gia tăng nhiệt độ sẽ làmcân bằng chuyển dịch theo hướng thu nhiệt, theo đó sẽ làmgiảm nhiệt độ của môi trường. Những ảnh hưởng này sẽ được làm rõ hơn ở phần dưới đây.
Ảnh hưởng của sự thay đổi điều kiện Ảnh hưởng của sự thay đổi nồng độ Khi một hệ ở trạng thái cân bằng bị ảnhhưởngbằngcáchthêmhoặcbớt một trong các chất (do đó thay đổi mật độ của nó), tất cả các nồng độ sẽ thay đổi theo cho đến khi đạt được điểm cân bằng mới với cùng giá trị Keq.
Nếu tăng nồng độ của một chất phản ứng trong phản ứng thuận, thì cân bằng bị dịch chuyển sang phải, có lợi cho phản ứng thuận. Nếu tăng nồng độ của
favoring the forward reaction. If the concentrationofareactantinthereverse reaction is increased, the equilibrium is displaced to the left. Decreases in concentration will produce effects oppositetothose producedbyincreases.
Effect of Temperature on Equilibrium
If the temperature of a given equilibrium reaction will shift to a new equilibrium point. If the temperature of a system in equilibrium is raised, the equilibrium is shifted in the direction that absorbs heat. Note that the shift in equilibrium as a result of temperature change is actually a change in the value of the equilibrium constant. This is different fromthe effect of changing the concentration of a reactant; when concentrations are changed, the equilibrium shifts to a condition that maintains the same equilibrium constant.
Effect of Pressure on Equilibrium
A change in pressure affects only equilibria in which a gas or gases are reactans or products. Le Châtelier’s Law can be used to predict the direction of displacement. If it is assumed that the total space on which the reaction occurs is constant, the presure will depend on the total number of molecules on that space. An increase in the number of molecules will increase pressure; a decrease in the number of molecules will decrease pressure. If the pressure is increased, the reaction that will be favored is the one that will lower the pressure, that is, decrease the number of molecules.
An exampleoftheapplicationofthese
một chất phản ứng trong phản ứng nghịch thì cân bằng bị dịch chuyển sang trái. Khi giảmnồng độ, cân bằng sẽ dịch chuyển ngược chiều so với khi tăng nồng độ. Ảnh hưởng của nhiệt độ đến trạng thái cân bằng
Nếu nhiệt độ của cân bằng hóa học thay đổi thì cân bằng sẽ chuyển dịch sang trạng thái cân bằng mới. Nếu tăng nhiệt độ của một hệ ở trạng thái cân bằng, thì cân bằng chuyển dịch theo hướng hấp thụ nhiệt. Lưu ý rằng sự chuyển dịch cân bằng do thay đổi nhiệt độ thực chất là sự thay đổi giá trị của hằng số cân bằng. Điều này khác với ảnh hưởng của việc thay đổi nồng độ của chất phản ứng; khi nồng độ được thay đổi, cân bằng chuyển dịch nhưng hằng số cân bằng không đổi.
Ảnh hưởng của áp suất đến trạng thái cân bằng
Sự thayđổi áp suất chỉ ảnh hưởng đến sự cân bằng trong đó khí hoặc các chất khí là chất phản ứng hoặc sản phẩm. Định luật Le Châtelier có thể được sử dụng để dự đoán hướng của sự dịch chuyển. Nếu giả định rằng tổng không gian mà phản ứng xảy ra là không đổi, thì giá trị sẽ phụ thuộc vào tổng số phân tử trên không gian đó. Sự gia tăng số lượng phân tử sẽ làm tăng áp suất; giảm số lượng phân tử sẽ làm giảm áp suất. Nếu tăng áp suất, phản ứng thuận lợi là phản ứng làm giảm áp suất, tức là giảm số lượng phân tử.
Một ví dụ về ứng dụng của nguyên tắc này là quy trình Haber tạo ra amoniac.
principleis theHaberprocess of making ammonia. The reaction is
N2 (g) + 3H2 (g) 2NH3(g) + heat (at equilibrium)
If the concentrations of the nitrogen and hyrogen are increased, the forward reaction is increased. At the same time, if the ammonia produced is removed by dissolving it into water, the forward reaction is again favored.
Because the reaction is exthermic, the additionofheat mustbeconsideredwith care. Increasing the temperature causes an increase in molecular motion and collisions, thus allowing the product to formmore readily. At the same time,the equilibrium equation shows that the reserse reaction is favored by the increased temperature, so a compromise temperature of about 500oC is used to get the best yield.
An increase in pressure will cause the forward reaction to be favored since the equation shows that four molecules of reactants are forming two molecules of products. This effecttends to reduce the increase in pressure by the formation of more ammonia.
Equilibria in heterogeneous systems
The examples so far have involved systems made up of only gaseous substances. Expression of the K values of systems changes when other phases are present.
Equilibrium Constant for Systems Involving solids
If the experrimental data for this reaction are studied:
CaCO3(s) CaO(s) + CO2(g)
Phản ứng là:
N2 (k) + 3H2 (k) 2NH3 (k) + nhiệt (ở trạng thái cân bằng)
Nếu tăng nồng độ của nitơ và hyđro thì phản ứng thuận tăng lên. Đồng thời, nếu amoniac sinh ra được loại bỏ bằng cách hòa tan vào nước, thì phản ứng lại theo chiều thuận.
Vì phản ứng là tỏa nhiệt nên việc bổ sung nhiệt phải được xem xét cẩn thận. Tăng nhiệt độ gâyra sự gia tăng chuyển động và va chạm của các phân tử, do đó cho phép sản phẩm dễ hình thành hơn. Phản ứng tăng tốc độ lên khi nhiệt độ tăng. Trong khi đó, khi nhiệt độ tăng thì cân bằng chuyển dịch theo chiều nghịch. Vì vậy nhiệt độ thỏa hiệp khoảng 500oCđượcsửdụngđểđạtđược sản lượng tốt nhất. Việc tăng áp suất sẽ làmcho phản ứng thuận xảy ra vì phương trình cho thấy rằngbốnphântử chấtphảnứngđangtạo thành haiphântử sảnphẩm. Điềunàycó nghĩa là chiều thuận sẽ là chiều làm giảm áp suất của hệ hơn, tức là tạo ra nhiều NH3 hơn.
Cân bằng trong hệ dị thể
Những ví dụ nêu trên chỉ mới áp dụng cho hệ đồng pha khí. Trong hệ dị thể, biểu thức K cân bằng sẽ thay đổi.
Hằng số cân bằng cho hệ có chất rắn
Dữ liệu nghiên cứu của cân bằng này:
CaCO3 (r) CaO (r) + CO2 (k)
it is found that at a given temperature an equilibrium is established in which the concentration of CO2 is constant. It is also true that the concentrations of the solids have no effect on the CO2 concentratrion as long as both solids are present. Therefore, the Keq which would conventionally be written like this:
K = 2 3
[][] CaOCO CaCO can be modified by incorporating the concentrations of the two solids. This can be done since the concentration of solids is fixed. It becomes a new constant K, known as: K = [CO2]
Anyheterogeneousreactioninvolving gases does not include the concentrations of pure solids. As another example, K for the reaction
NH4Cl(s) NH3(g) + HCl(g) is K = [NH3][HCl]
Practice exercises
1. For the reaction A + B C + D, the equilibrium constant can be expressed as:
(A) K = [A][B]/[C][D]
(B) K = [C][B]/[A][D]
(C) K = [C][D]/[A][B]
(D) K = [A][C]/[B][D]
2. The concentrations in an expression of the equilibrium constant are given in
(A) mol/mL (B) g/L
(C) gram-equivalents/L (D) mol/L
thấy rằng ở một nhiệt độ nhất định, khi cân bằng được thiết lập thì nồng độ của CO2 là không đổi. Vì vậy, nồng độ của chất rắn không ảnh hưởng đến nồng độ CO2 miễn là cả hai chất rắn đều có mặt trong hệ. Do đó, Keq thường được viết thế này: K = 2 3
[][] CaOCO CaCO
Ta có thể kết hợp nồng độ không đổi của hai chất rắn lại, biểu thức trở thành một hằng số mới K, được gọi là: K = [CO2]
Bất kỳ phản ứng dị thể nào liên quan đến chất khí đều không bao gồm nồng độ của chất rắn nguyên chất.
Ví dụ, K của cân bằng: NH4Cl(r) NH3 (k) + HCl (k) là K = [NH3] [HCl]
Bài tập củng cố
1. Đối với phản ứng A + B C + D, hằng số cân bằng có thể được biểu thị là là:
(A) K = [A] [B]/[C] [D] (B) K = [C] [B]/[A] [D] (C) K = [C] [D]/[A] [B] (D) K = [A] [C]/[B] [D]
2. Nồng độ trong biểu thức của hằng số cân bằng có đơn vị là:
(A) mol/ml (B) g/l
(C) đương lượng gam /l (D) mol/l
3. A change in whichs of these conditions will change the K of an equilibrium given as a starting point?
(A) Temperature
(B) Pressure
(C) Concentration of reactants
(D) Concentration of products
3. Sự thay đổi nào sau đây của cân bằng hóa học sẽ làm thay đổi giá trị của hằng số cân bằng so với giá trị ban đầu?
(A) Nhiệt độ
(B) Áp suất
(C) Nồng độ của chất phản ứng
(D) Nồng độ của sản phẩm
Vì giới hạn của một sáng kiến kinh nghiệm nên những nội dung còn lại trong chương Cân bằng hóa học là:
- Sự ion hóa của nước, tìm pH, độ tan, viết sản phẩm và ảnh hưởng của các ion trong dung dịch.
- Trình bày mối quan hệ giữa ∆H và ∆S và ảnh hưởng của chúng đối với phản ứng, kết hợp 2 đại lượng trên tạo nên phương trình Gibbs.
xin phép được trình bày ở công trình nghiên cứu khác.
3. Xây dựng bài tập luyện tập Có 3 dạng bài tập trong chương trình thi SAT II Chemistry(đã được trình bày trong Phần II: Cơ sở lý luận; mục c của phần 2.2. Các dạng bài trong SAT II Chemistry). Sau đây, tác giả không trình bày lại nữa mà chỉ nêu các câu hỏi đề bài. (Phần dịch sang tiếng Việt được tác giả trình bày trong phần Phụ lục của đề tài)
3.1. Tốc độ phản ứng
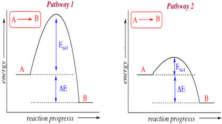
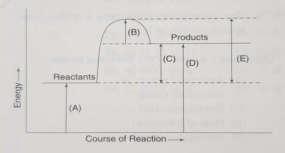
Questions 1-3 refer to the following diagram:
1. Indicates the activation energy of the forward reaction
2. Indicates the activation energy of the reverse reaction
3. Indicates the difference between the activation energies for the reserve and forward reactions and equals the energy change in the reaction
Question 4. In the reaction of Zinc with dilute HCl to form H2, which of the following will increase the reaction rate?
I. Increasing the temperature
II. Increasing the exposed surface of zinc
III. Using a more concentrated solution of HCl (A) I only (B) II only (C) I and III only (D) II and III only (E) I, II, and III
Questions 5-8 refer to the folowing diagram:
5. The activation energy of the forward reaction is shown by
6. The activition energy of the reserve reaction is shown by
7. The heat of the reaction for the forward reaction is shown by
8. The potential energy of the reactants is shown by
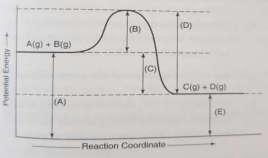
Question 9. How can the addition of a catalyst affect an exothermic reaction?
I. Speed up the reaction.
II. Slow down the reaction.
III. Increase the amount of product formed.
(A) I only (B) II only (C) I and II only (D) II and III only (E) I, II, and III
Question 10. Chose T, F or CE* for two below statements:
(I) A catalyst accelerates a chemiscal reaction (T) (F)
(II) A catalyst lowers the activation energy of the reaction (T) (F) (CE*)
Question 11. Chose the one that is best in each case:
In this graphic representation of a chemical reaction, which arrow depicts the activation energy of the forward reaction?
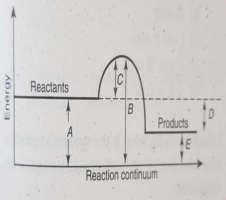
(A) A (B) B (C) C (D) D (E) E
Question 12. Which of the following statements is true?
(A) A catalyst cannot lower the activation energy.
(B) A catalyst can lower the activation energy.
(C) A catalyst affects only the activation energy of the forward reaction.
(D) A catalyst affects only the activation energy of the reserve reaction.
(E) A catalyst is permanently changed after the activation energy is reached.
Question 13. Chose T, F or CE* for two below statements:
(I) The addition of a catalyst will decrease the ∆H for a reaction. (T) (F)
(II)Acatalyst providesanalternatereaction pathwaywitha loweractivationenergy. (T) (F) (CE*)
Question 14. Chose T, F or CE* for two below statements:
(I) Chemical reactions slow down with lower temperature. (T) (F)
(II) The energy barrier for the formation of products decreases with decreasing temperature.
(T) (F) (CE*)
Question 15. Which of the following statements is NOT correct regarding chemical catalysts?
(A) They are not consumed during the chemical reaction.
(B) They can make spontaneous reactions occurs.
(C) They do not have to be the same phase as the reactant molecules.
(D) They shift equilibrated reactions to the product’s side.
(E) Enzymes are biological catalyst.
Question 16. Given the reaction: Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Whythe reaction slower when asinglepiece of Zincisusedthan whenthepowdered Zinc of the same mass is used?
(A) The powdered Zinc is more concentrated (B) The single piece of Zinc is more reactive (C) The powdered Zinc requires less activation energy (D) The powdered Zinc generates more heat energy (E) The powdered Zinc has a greater surface area
Question 17. As the frequency and the number of effective collisions between reacting particies increases, the rate of the reaction
(A) increases (B) decreases (C) remains the same (D) approaches zero (E) none of the above
Question 18. A catalyst is added to a system at equilibrium. The concentration of the reactants will then (A) decrease (B) increase (C) remain the same (D) approach zero (E) none of the above
Question 19. Which is not the factor that affects the rate of a reaction?
(A) Nature of the reactants (B) Surface area exposed (C) Concentrations (D) Temperature (E) Time
Question 20. An increase in concentration
(A) is related to the number of collisions directly (B) is related to the number of collisions inversely (C) has no effect on the number of collisions
(D) increase ∆H
(E) decrease the temperature
Answer key and answer explained
1. (E) This is the energy needed to start the forward reaction.
2. (B) The part indicated by B represents the activition energy for the reserve reaction.
3. (C) The net energy change is the endothermic quantity indicated by C.
4. (E) I, II and III will increase the rate of this reaction. Each of them causes the rate of this reaction to increase.
5. (B) The activation energy of the forward reaction is the energy needed to begin the reaction.
6. (D) For the reserve reaction to occur, activation energy equal to the sum of (B) and (C) is needed. This is shown by (D).
7. (C) The heat of the reaction is the heat liberated between the level of potantial energiesof thereactantsandthat of theproducts. This is quantity(C)onthediagram.
8. (A) The potential energy of the reactants is the total of the original potential energies of the reactants shown by (A).
9. (A) Bydefinition, a catalyst canbeused to speed up a reactionwithout itseft being consumed, so I is correct.
10. (T, T, CE) This is a function of a catalyst - to speed up a reaction without permanently changing itself. Assertion and reason are true.
11. (C) The energy necessary to get the reaction started, which is the activation energy, is shown at C.
12. (B) A catalyst can speed up a reation by lowering the activation energy needed to start the reaction and then keep it going.
13. (F, T) The ∆H for a reaction is unaffected by the addition of a catalyst. So (I) is false. A catalyst increases the rate of a reaction by decreasing the activation energy of reaction. The second statement is true.
14. (T, F) All chemiscal processes slow down at lower temperatures, so (I) is true. At lower temperatures, reactant molecules have less kinetic energy to use to overcome the energy barier for the formation of products, called the activation energy. The only way to lower activation energy is to add a catalyst. The second statement is false.
15. (D) The addition of a catalyst to a system at equilibrium has NO affect. That’s because all a catalyst does increase the rate at which a nonequilibrated system reached equilibrium.
16. (E) The powdered Zinc has a greater surface area than the single piece one, so the correct answer is (E).
17. (A) When the frequency ans the number of effective collisions between reacting particies increases, the rate of the reaction will increase, so the correct answer is (A).
18. (C) The addition of a catalyst to a system at equilibrium has no affect. So the concentrations of the reactants will remain the same.
19. (E) Time is not the factor that affects the rate of a reaction.
20. (A) An increase in concentration is related to the number of collisions directly 3.2. Cân bằng hóa học
Question 1. In this equilibrium reaction: A + B AB + heat (in a closed container), how could the forward reaction rate be increased?
I. By increasing the concentration of AB
II. By increasing the concentration of A III. By removing some of product AB
(A) I only (B) III only (C) I and III only
(D) II and III only (E) I, II, and III
Questions 2. For the following reaction:
N2O4(g) 2 NO2(g) the Keq expression is:
(A) Keq = [N2O4]/[NO2]
(B) Keq = [N2O4]/[NO2]2 (C) Keq = [NO2]/[N2O4] (D) Keq = [NO2]2/[N2O4] (E) Keq = [N2O4]2/[NO2]
Questions 3. What is the Keq for the reaction in question 2 if at equilibrium the concentration of N2O4 is 4 x 10-2 mole/liter and that of NO2 is 2 x 10-2 mole/liter?
(A) 1 x 10-2
(B) 2 x 10-2 (C) 4 x 10-2 (D) 4 x 10-4 (E) 8 x 10-2
Questions 4. Chose T, F or CE* for two below statements:
(I) In a reaction that has both a forward and a reserve reaction, A + BAB, when only A and B are introduced into a reacting vessel, the forward reaction rate is the highest at the beginning and begins to decrease from that point until equilibrium is reached.
(T) (F)
(II) The reserve reaction does not begin until equilibrium is reached. (T) (F) (CE*)
Question 5. Chose T, F or CE* for two below statements:
(I) At equilibrium, the forward reaction and reserve reaction stop.
(T) (F)
(II) At equilibrium, the reactants and products have reached the equilibrium concentrations.
(T) (F) (CE*)
Question 6. For the Haber process: N2 + 3H2 2NH3 + heat (at equilibrium), which of the following statements concerning the reaction rate is/are true?
I. The reaction to the right will increase when pressure is increased.
II. The reaction to the right will decrease when the temperature is increased.
III. The reaction to the right will decrease when NH3 is removed from the chamber.
(A) I only (B) II only (C) I and II only (D) II and III only (E) I, II, and III
Question 7. Chose T, F or CE* for two below statements:
(I) If the forward reaction of an equilibrium is exothermic, adding heat to the system favors the reserve reaction.
(T) (F)
(II) Additional heat causes a stress on the system, and the system moves in the direction that releases the stress.
(T) (F) (CE*)
Question 8. A small value of Keq indicates that equilibrium occurs (A) at a low product concentration (B) at a high product concentration (C) after considerable time (D) with the help of a catalyst (E) with no forward reaction
Question 9. What could be the equilibrium constant for this reaction: aA + bB cC + dD, if A and D are solids?
(A) [C]c[D]d/[A]a[B]b (B)[A]a[B]b/[C]c[D]d (C)[C]c/[B]b (D) [C]c[D]d/ [A]a (E) [A]a[B]b[C]c[D]d
Question 10. If K for the reaction H2 + I2 2HI is equal to 45.9 at 450oC, and 1 mole of H2 and 1 mole of I2 are introduced into a 1-liter box at that temperature, what will be the expression for K at equilibrium?
(A) [x2]2/ [1-x][1-x] (B) [2x]2/ [1-x][1-x] (C) [2x]2/[x][x] (D) [1-x][1-x]/[2x]2 (E) [1-x][1-x]/[x2]2
Question 11. What occurs when a reaction is at equilibrium and more reactant is added to the container?
(A) The equilibrium remains unchanged. (B) The forward reaction rate increases.
(C)Thereversereactionrate increases. (D)Theforwardreactionratedecreases. (E) The reverse reaction rate decreases.
Question 12. Three moles of H2 and 3 moles of I2 are introduced into a liter box at a temperature of 490oC. What will the K expression be for this reaction? (K = 45.9)?
(A) K = [H2][I2]/[HI]
(B) K = [HI]/[H2][I2] (C) K = 2x/(x)(x) (D) K = (2x)2/(3-x)2
(E) K = (3-x)2/(2x)2
Question 13. If the following reaction has achieved equilibrium in a closed system: N2O4 (g)2NO2(g) which of the following is (are) increased by decreasing the size of the containner?
I. The value of K
II. The concentration of N2O4
III. The rate of the reverse reaction
(A) I only (B) III only (C) I and II only (D) II and III only (E) I, II, and III
Questions 14-16 refer to the following:
(A) Ca2+(aq) + CO3 2- (aq)CaCO3 (s)
(B) N2 (g) + 2O2 (g) 2NO2 (g) (C) 4NH3 (g) + 5O2 (g) 4NO (g) + 6H2O (g)
(D) H2 (g) + I2 (g) 2HI (g) (E) Na2O2 (s) + H2O (l) 2NaOH (aq) + H2O2 (aq)
14. Reaction rate can be increased by increasing the surface area of reactants
15. Increasing system pressure by decreasing reaction volume shifts equilibrium to the right
16. Impossible to increase rate of reserve reaction byincreasing the concentration of reactant(s)
Question 17. 2SO3(g)2 SO2(g) + O2 (g)
If the reaction given above is at equilibrium, the result of a sudden increase in the concentration of O2 will reasult in (A) increased concentration of SO2 and decreased concentration of SO3 (B) increased concentration of SO2 and increased concentration of SO3 (C) decreased concentration of SO2 and increased concentration of SO3
(D) decreased concentration of SO2 and decreased concentration of SO3 (E) no change in concentration of any product or reactant
Questions 18-19 refer to the following reaction
2H2S(g) + 3O2(g) 2SO2(g) + 2H2O (g) + heat
18. For the above reaction, the equilibrium concentration of SO2(g) can be increased by (A) adding neon gas
(B) increasing the temperature (C) adding a catalyst (D) increasing the concentration of H2O(g) (E) increasing the concentration of O2(g)
19. Which of the following is inceased by decreasing the volume of the reaction system?
I. Rate of reaction II. Equilibrium concentration of reactants
III. Value of Keq
(A) I only (B) III only (C) I and II only (D) II and III only (E) I, II and III
Question 20. 2NOCl(g) 2NO(g) + Cl2(g)
Which of the following is true of the reaction above as it proceeds in the forward direction?
(A) NO(g) is produced at the same rate that NOCl(g) is consumed.
(B) NO(g) is produced at haft the rate that NOCl(g) is consumed.
(C) NO(g) is produced at twice the rate that NOCl(g) is consumed. (D) Cl2(g) is produced at the same rate that NOCl(g) is consumed.
(E) Cl2(g) is produced at twice the rate that NOCl(g) is consumed.
Answer key and answers explained
1. (D) Increasing the concentration of one or both of the reactants and removing some of the product formed would cause the forward reaction to increase in rate to try to regain the equilibrium condition. II and III are correct.
2. (D) The Keq expression consists of the concentration(s)of the products overthose of the reactants, with the coefficients becoming exponents: Keq = [NO2]2/[N2O4]
3. (A) Keq = [2 x 10-2]2/ [4 x 10-2] = 1 x 10-2
4. (T, F) The statement I is true but II is not true and not the reason.
5. (F, T) The forward and reserve reactions are occurring ats equal rates when equilibrium is reached. The reactions do not stop. The concentrations remain the same at this point.
6. (C) Because this equation is exothermic, higher temperatures will decrease the reaction to the right and increase the reaction to the left, so II is true.
Also, I is true because with an increase of pressure the reaction will try to relieve that pressure by going in the direction that has the least volume: in this reaction, to the right. Statement III is false because removing product in this reaction would increase the forward reaction. Statements I and II are true.
7. (T, T, CE) The assertion is explained by the reason; both are true.
8. (A) For Keq to be small, the numeration, which is made up of the concentratrion(s) of the product(s) at equilibrium, must be smaller than the denominator.
9. (C) Solids are incorporated into the K value and therefore do not appear in the equilibrium constant expression.
10. (B) At the beginning of the reaction:
[H2] = 1 mol/L [I2] = 1 mol/L [HI] = 0
At equilibrium, let x = moles/ liter of H2 and I2 in HI form
[H2] = (1 – x) mol/L [I2] = (1 – x) mol/L [HI] = 2x mol/L
Then, substituting the above values into the equation, you get:
K = [HI]2/ [H2][I2] = [2x]2/[1-x][1-x] = 45.9
11. (B) The equilibrium shifts in the direction that tends to relive the stress and thus regain equilibrium.
12. (D) K= [HI]2/[H2][I2]
Let x = moles of H2 and also of I2 that combine to form HI
Then at equilibrium [H2] = [I2] = 3-x , [HI] = 2x
Then K= (2x)2/(3-x)2
13. (D) In a closed system, decreasing the size of the container will cause the pressure to increase. When pressure is applied to an equilibriuminvolving gases, the reaction that lowers the pressure by decreasing the number of molecules will increaseinrate. In this reaction,therateofthereverse reaction,in which2molecules are decreased to 1, increases, thus reducing pressure while also increasing the concentration of N2O4. Thus, II and III are true.
14. (E) While the surface area of solids and liquids can be increased (throught crushingasolid orsprayingaliquid), thesurface area ofgases cannot.Whichanswer choice has solid and liquid reactants? Choice (E) does, and it’s the correct answer.
15. (B) When the volume of a system is decreased, equilibrium will shift in the direction that produces fewer moles of gas. A and E neither reaction involves a gaseous species, so pressure changes will not affect their equilibrium. Now, look at the other three choises: Which reaction involves fewer moles of gas on the right than on the left? Choise (B) does. So the correct answer is (B).
16. (A) We’re asked about reserve reactions, so read choises (A) to (E) from right to left. Recall that only gaseous and aqueous species can have their concentration increased. Choice (A), which has a single solids reactant for its reserve reaction. That concentration of pure solids cannot be changed, so (A) is correct.
17. (C) Someone increases the concentration of the product O2 in a reaction at equilibrium. This means that the concentration of the other product, SO2, will decrease, and the concentration of the reactant(s) will increase. Choise (C) is correct answer.
18. (E) Catalyst do not affect equilibrium but changing concentrations does influence equilibrium. Increasing the concentration of O2 will produce crowding on the left side and lead to an increase in the concentration of SO2.
19. (A) Decreasing the volume of the system will increase the concentration of reactants. It will increase reactant rate. Reducing the volume will force the equilibrium to shift in the direction that produces fewer moles of gas. This mean the concentration of reactants will decrease because equilibrium will shift to the right. The value of Keq stay the same. So the answer is (A).
20. (A) We can see from the balanced equation that for every mole of NOCl consumed, 1 mole of NO is produced, so choice (A) is correct.
IV. THỰC NGHIỆM SƯ PHẠM
1. Mục đích của thực nghiệm sư phạm
1. Đánh giá hiệu quả của việc xây dựng các nội dung dạy học theo định hướng của kỳ thi SAT II Chemistry.
2. Góp phần đổi mới phương pháp, nâng cao chất lượng dạy học và phù hợp với xu hướng lựa chọn cơ hội học tập sau tốt nghiệp THPT của học sinh hiện nay.
2. Nội dung của thực nghiệm sư phạm
1. Tiến hành giảng dạy nội dung dạy học phần Tốc độ phản ứng và Cân bằng hóa học theo định hướng SAT II Chemistry cho các lớp thực nghiệm.
2. Thực hiện giảng dạy bình thường theo chương trình hiện hành trong sách giáo khoa đối với các lớp đối chứng.
3. Phân tích, xử lý kết quả thực nghiệm để thấyđược hiệu quả của việc dạyhọc theo nội dung bài học đã được xây dựng theo định hướng của kỳ thi SAT II Chemistry.
3. Phương pháp thực nghiệm
3.1. Chọn mẫu thực nghiệm
Đề tài này được thực hiện trong năm học 2020 – 2021. Việc thực nghiệm sư phạm có sự giúp đỡ của đồng nghiệp trong trườngTHPTX.Cụthểnhưsau: Trường Lớpthực nghiệm Lớpđốichứng Năm
THPTX 10A1 10A02 2020–2021
Lớp đối chứng (ĐC) được học theo CT bình thường theo đúng phân phối CT của bộmôntrongtừngnămhọc.Lớpthựcnghiệm(TN)bảnthântôivàđồngnghiệpthựchiện theonộidungcủađềtàinày. LớpTNvàlớpĐCđượcchọncótrìnhđộtươngđươngnhau về cácmặtnhư: Số lượng học sinh,chất lượng học tập nói chung, chất lượng học tập môn Hóa học và môn tiếng Anh nói riêng. Đặc điểm và kết quả học tập kỳ I 2 lớp 10A1(Lớp TN) và lớp 10A02 (lớp ĐC) – Năm học 2020 – 2021 Nội dung Lớp Thực nghiệm Lớp đối chứng Sĩ số 45 45
Học lực
Khá, giỏi 80,00% 77,78% Khá, giỏi môn Hóa 86,67% 88,89% Khá giỏi môn tiếng Anh 68,89% 66,67%
3.2. Phương pháp tổ chức kiểm tra
Sau khi được học các nội dung dạy học được biên soạn theo kỳ thi SAT II Chemistry (có dịch song ngữ để giúp các em làm quen với các từ vựng của chuyên ngành Hóa học ở các nội dung Tốc độ phản ứng và Cân bằng hóa học) ở lớp TN, chúngtôitiếnhànhkiểmtrađểxácđịnhhiệuquảkhảthicủaphươngánthựcnghiệm. Chúng tôi cho học sinh ở cả 2 lớp làm bài tập theo dạng lựa chọn của kỳ thi SAT II Chemistry, bài kiểm tra gồm 10 câu hỏi, không có song ngữ (Đề thi được tác giả đưa trong phần phụ lục). Học sinh làm trong 15 phút.
3.3. Kiểm tra kết quả thực nghiệm và thảo luận
a. Kết quả định tính - Đối với các lớp thực nghiệm được học theo nội dung được biên soạn theo SAT II Chemistry: Đa số học sinh đều tự giác tham gia vào hoạt động học tập, các em tỏ ra rất hứng thú và tham gia hoạt động học tập rất tích cực. Không những vậy, các em còn được rèn luyện các kỹ năng mềm như kỹ năng tự học, kỹ năng kiếm thông tin và tăng cường khả năng ngoại ngữ. Đó là các kỹ năng rất cần thiết khi các em bước sang thế kỷ 21, thế kỷ của sự hội nhập và phát triển. - Đối với lớp đối chứng có trình độ tương đương như lớp thực nghiệm, đa số các em tỏ ra hứng thú khi làm một dạng bài thi của một nền giáo dục tiên tiến thế
giới, các em có tâm lý tìm hiểu, so sánh xem đề thi “họ” với đề thi “ta” như thế nào. Tuynhiên, đó chỉ là tâm lý ban đầu, còn khi thực sự bước vào bài thi, các em trở nên lúng túng vì có quá nhiều từ ngữ tiếng Anh chuyên ngành thực sự các em chưa biết, chưa hiểu, kết quả không cao. Chỉ sau khi được giáo viên dịch sang tiếng Việt, các em mới có thể làm được bài hơn, kết quả cao hơn. Sau đó, các em đều nhận ra rằng, kiến thức “họ” học cũng tương tự như “ta”, nếu ta có thêm tiếng Anh thì thực sự vượt qua bài thi này cũng không quá khó.
- Ở các lớp thực nghiệm, các em trả lời các câu hỏi một cách dễ dàng, nhiều em còn mạnh dạn phát biểu là đề dễ hơn thi đại học ở Việt Nam. Nhiều em tự tin mình có thể chinh phục được SAT II Chemistry với kết quả cao. b. Kết quả định lượng Kết quả định lượng của bài kiểm tra: Điểm xi Số học sinh đạt điểm xi TN 10A1 ĐC 10A02 ĐC 10A02(Sau khi đề được dịch sang tiếng Việt) 0,0 0 0 0 1,0 0 0 0 2,0 0 0 0 3,0 0 2 0 4,0 0 8 0 5,0 1 10 5 6,0
8
15 9,0
8,0
3 10,0 5 1 2
8,02
Từ các kết quả trên ta nhận thấy: Trong bài kiểm tra này:
7,20
Số học sinh đạt điểm khá, giỏi ở lớp TN cao hơn hẳn so với lớp ĐC. + Điểm trung bình của lớp TN cao hơn lớp ĐC. Khi lớp ĐC được làm đề thi đã dịch ra tiếng Việt thì điểm cao hơn hẳn so với khi làm bài thi bằng tiếng Anh. Từ đấy có thể nhận xét rằng lớp ĐC đã nắm được kiến thức cơ bản khi được học bằng chương trình bình thường, nhưng do chưa biết nhiều về từ ngữ tiếng Anh chuyên ngành nên kết quả chưa cao. Lớp thực nghiệm thực hiện bài thi bằng tiếng Anh tốt hơn hẳn lớp đối chứng, kể cả khi lớp đối chứng được làm đề đã dịch ra tiếng Việt. Chứng tỏ lớp thực nghiệm khả năng tiếng Anh chuyên ngành tốt hơn và nắm kiến thức tốt hơn.
PHẦN III. KẾT LUẬN
I. QUÁ TRÌNH NGHIÊN CỨU SÁNG KIẾN KINH NGHIỆM
Đề tài “Tiếp cận kỳ thi chuẩn hóa quốc tế chương trình Hóa học THPTSAT II Chemistry và xây dựng một số nội dung dạy học phần Tốc độ phản ứng, Cân bằng hóa học theo SAT II Chemistry” đã nghiên cứu được các nội dung:
- Tìm hiểu kết quả thi SAT II Chemistry của học sinh Việt Nam; Cơ hôi học tập khi có SAT II Chemistry của học sinh ở các trường đại học trong nước và trên thế giới.
- Xây dựng được nội dung dạy học Tốc độ phản ứng và Cân bằng hóa học theo định hướng SAT II Chemistry, thực hiện giảng dạy theo nội dung đã biên soạn ở trên.
- Xây dựng được hệ thống bài tập ôn luyện cho kỳ thi SAT II Chemistry phần Tốc độ phản ứng và phần Cân bằng hóa học.
- Tiến hành thực nghiệmsư phạmqua các nội dung dạyhọc, từ đấyđã đánh giá được hiệu quả của đề tài. II. Ý NGHĨA CỦA ĐỀ TÀI
- Giúp HS tìm hiểu về kỳ thi có thể giúp cho các em có nhiều lựa chọn hấp dẫn hơn trên con đường học vấn của mình. Từ đó, các em cũng tự nhận ra được những điều thiếu sót để tiếp tục hoàn thiện bản thân hơn.
- Đưa một kỳthi quốc tế đến gần hơn với giáo viên để giáo viên có thể học hỏi thêm về cách dạy, cách học và cách thi. Từ đó thực hiện tốt nhiệm vụ đổi mới giáo dục.
- Đưa một kỳ thi quốc tế đến gần hơn với học sinh, đặc biệt là học sinh nông thôn, điều kiện học tập còn khó khăn.
- Thông qua học tập, học sinh không những nắm chắc kiến thức Hóa học mà khả năng tiếng Anh cũng tăng lên, đặc biệt là tiếng Anh chuyên ngành Hóa.
III. MỘT SỐ ĐỀ XUẤT
- Giáo viên dạy bộ môn hoá học ở các trường trung học phổ thông cần tìm hiểu hơn nữa các xu hướng thi cử hội nhập quốc tế hiện nay. Muốn vậy, bản thân người giáo viên cũng cần phải có ngoại ngữ. Xin được đề xuất cấp trên có kế hoạch bồi dưỡng nâng cao trình độ ngoại ngữ, không những cho các giáo viên dạy ngoại ngữ mà còn các giáo viên bộ môn khác.
- Học sinh cần thay đổi phương pháp học tập để đáp ứng yêu cầu của cách dạy mới tạo hiệu quả giảng dạy và học tập tốt hơn. Đồng thời, tăng cường khả năng ngoại ngữ ở các em học sinh.
- Để giảng dạy theo định hướng của các kỳ thi quốc tế, đề nghị cấp trên tăng cường các cuộc thảo luận chuyên đề, để giáo viên có cơ hội giao lưu, trao đổi kinh nghiệm.
- Tăng cường nghiên cứu và thực nghiệm cho ra nhiều bài học theo những kỳ thi quốc tế hơn nữa.
LỜI KẾT
Hàng năm, sau mỗi đợt tuyển sinh, báo chí lại đưa tin rất nhiều về những tấm gương học sinh học giỏi dành được những học bổng lớn ở các trường Đại học trên thế giới, đặc biệt là Hoa Kỳ. Tuy nhiên đa số những học sinh đó lại là học sinh thành phố. Bản thân chúng tôi nhận thấy học sinh vùng nông thôn rất thông minh, có năng lực, nếu các em có điều kiện tham gia, các em sẽ có nhiều lựa chọn hấp dẫn hơn cho tương lai của mình.
Trong quá trình giảng dạy, chúng tôi có tìm hiểu về kỳ thi SAT II Chemistry của Hoa Kỳ và mạnh dạn xây dựng những nội dung dạy học về Tốc độ phản ứng và Cân bằng hóa học. Năm học 2021 - 2022 tôi hoàn thiện ý tưởng của mình, qua quá trình thực nghiệm sư phạm đã thu được những kết quả thiết thực. Học sinh rất hào hứng làm giáo viên cũng thấy vui và hạnh phúc. Tuy nhiên, bản thân người viết còn có những hạn chế nhất định nên có thể chưa đưa được nhiều dạng bài tập phong phú và đa dạng. Bên cạnh đó, do hướng đi của đề tài là mới, kinh nghiệm giảng dạy của bản thân chưa nhiều nên không tránh khỏi những thiếu sót. Rất mong nhận được sự góp ý của thầy cô và quý đồng nghiệp để tôi có thể hoàn thiện hơn nữa phương pháp dạy học của mình. Chúng tôi viết nên ý tưởng với mong muốn được chia sẻ sáng kiến của bản thân với các đồng nghiệp, mong rằng chúng ta có thể phát huy một cách hiệu quả những cái được, hạn chế được những mặt chưa được của đề tài này nhằm nâng cao hiệu quả dạy học, góp phần vào sự nghiệp trồng người của nước ta hiện nay.
Chúng tôi xin chân thành cảm ơn!
PHỤ LỤC
I. BẢN DỊCH NỘI DUNG BÀI TẬP LUYỆN TẬP
(Kèm đáp án, đáp án được tô đậm)
1. Tốc độ phản ứng
Câu hỏi 1-3 hỏi về sơ đồ sau:

1. Đoạn nào cho biết năng lượng hoạt hóa của phản ứng thuận (E)
2. Đoạn nào cho biết năng lượng hoạt hóa của phản ứng nghịch (B)
3. Đoạn nào cho biết sự chênh lệch giữa năng lượng hoạt hóa của phản ứng nghịch và phản ứng thuận hay chính là sự biến thiên năng lượng trong phản ứng (C) Câu hỏi 4. Trong phản ứng của kẽm (Zn) với dung dịch HCl loãng tạo H2, yếu tố nào làm tăng tốc độ phản ứng?

5. Năng lượng hoạt hóa của phản ứng thuận biểu diễn bằng (B)
6. Năng lượng hoạt hóa của phản ứng nghịch biểu diễn bằng (D)
7. Nhiệt phản ứng của phản ứng thuận (C)
8. Thế năng của các chất phản ứng biểu thị bằng (A)
Câu hỏi 9. Việc thêm chất xúc tác ảnh hưởng như thế nào đến phản ứng tỏa nhiệt?
I. Tăng tốc độ phản ứng
II. Giảm tốc độ phản ứng
III. Tăng lượng sản phẩm của phản ứng.
(A) I (B) II

(D) II và III
(E) Cả I, II và III
Câu hỏi 10. Chọn T, F hay CE* cho hai phát biểu sau:
(C) I và II
(I) Chất xúc tác làm tăng tốc độ phản ứng hóa học (T)
(II) Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng (T) (CE*)
Câu hỏi 11. Chọn một đáp án đúng nhất:
Trong hình biểu diễn phản ứng hóa học này, đoạn nào biểu thị năng lượng hoạt hóa của phản ứng thuận?
(A) A (B) B (C) C (D) D (E) E
Câu hỏi 12. Phát biểu nào sau đây là đúng?
(A) Chất xúc tác không thể làm giảm năng lượng hoạt hóa.
(B) Chất xúc tác có thể làm giảm năng lượng hoạt hóa.
(C) Chất xúc tác chỉ ảnh hưởng đến năng lượng hoạt hóa của phản ứng thuận.
(D) Chất xúc tác chỉ ảnh hưởng đến năng lượng hoạt hóa của phản ứng nghịch.
(E) Chất xúc tác sẽ biến đổi khi hệ đạt đến năng lượng hoạt hóa.
Câu hỏi 13. Chọn T, F hay CE* cho hai phát biểu sau:
(I) Việc thêm chất xúc tác sẽ làm giảm ∆H của phản ứng. (F)
(II) Chất xúc tác làm phản ứng theo con đường có năng lượng hoạt hóa thấp hơn. (T)
Câu hỏi 14. Chọn T, F hay CE* cho hai phát biểu sau:
(I) Phản ứng hóa học chậm lại khi nhiệt độ phản ứng thấp hơn. (T)
(II) Năng lượng hoạt hóa để hình thành sản phẩm giảm khi nhiệt độ giảm. (F) Câu hỏi 15. Phát biểu nào sau đây KHÔNG đúng về chất xúc tác?
(A) Chúng không bị mất đi trong quá trình phản ứng hóa học.
(B) Chúng có thể làm cho phản ứng tự diễn ra.
(C) Chúng không nhất thiết phải cùng pha với chất tham gia phản ứng.
(D) Chúng làm cân bằng chuyển dịch theo chiều tạo ra sản phẩm.
(E) Enzym là những chất xúc tác sinh học. Câu hỏi 16. Cho phản ứng sau: Zn(r) + 2HCl(dd) → ZnCl2(dd) + H2(k) Tại sao phản ứng xảy ra chậm hơn khi sử dụng mẩu Zn nguyên so với khi sử dụng bột Zn với cùng khối lượng như nhau?
(A) Bột Zn có nồng độ lớn hơn
(B) Mẩu Zn kém hoạt động hóa học hơn
(C) Bột Zn cần năng lượng hoạt hóa thấp hơn
(D) Bột Zn tỏa ra nhiều nhiệt hơn
(E) Bột Zn có diện tích tiếp xúc nhiều hơn
Câu hỏi 17. Khi tần số và số lượng va chạm hiệu quả giữa các chất phản ứng tăng lên, tốc độ phản ứng (A) tăng (B) giảm (C) không đổi (D) bằng không (E) không có ý nào ở trên Câu hỏi 18. Một chất xúc tác được thêm vào hệ cân bằng hóa học. Nồng độ của chất tham gia phản ứng sẽ
(A) giảm (B) tăng (C) không đổi (D) bằng không (E) không có ý nào ở trên Câu hỏi 19. Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
(A) Bản chất của chất phản ứng (B) Diện tích bề mặt (C) Nồng độ (D) Nhiệt độ (E) Thời gian Câu hỏi 20. Sự gia tăng nồng độ sẽ làm
(A) tăng số vụ va chạm trực tiếp
(B) tỉ lệ nghịch đến số vụ va chạm trực tiếp
(C) không gây ảnh hưởng đến số vụ va chạm trực tiếp
(D) tăng ∆H
(E) giảm nhiệt độ
2. Cân bằng hóa học
Câu hỏi 1. Trong cân bằng hóa học sau: A + B AB + nhiệt (trong bình kín), làm thế nào để tốc độ phản ứng thuận tăng?
I. Bằng cách tăng nồng độ của AB
II. Bằng cách tăng nồng độ của A
III. Bằng cách loại bỏ một số sản phẩm AB
(A) Ý I đúng (B) Ý III đúng (C) Ý I và III đúng (D) Ý II và III đúng (E) Cả I, II, và III đều đúng Câu hỏi 2. Cho phản ứng N2O4(k) 2 NO2(k)
Biểu thức Keq được biểu diễn là:
(A) Keq = [N2O4]/[NO2]
(B) Keq = [N2O4]/[NO2]2 (C) Keq = [NO2]/[N2O4] (D) Keq = [NO2]2/[N2O4] (E) Keq = [N2O4]2/[NO2] Câu hỏi 3. Biểu thức Keq cho phản ứng ở câu hỏi 2 có giá trị bằng bao nhiêu nếu ở trạng thái cân bằng, nồng độ của N2O4 là 4 x 10-2 M và nồng độ của NO2 là 2 x 10-2M? (A) 1 x 10-2 (B) 2 x 10-2 (C) 4 x 10-2 (D) 4 x 10-4 (E) 8 x 10-2 Câu hỏi 4. Chọn T, F hay CE* cho 2 phát biểu sau đây:
(I) Trong một phản ứng có hai chiều thuận, nghịch: A + B AB, khi chỉ mới có A và B cho vào bình phản ứng thì tốc độ phản ứng thuận lúc đó đạt cực đại và giảm dần cho đến khi hệ đạt đến trạng thái cân bằng. (T)
(II) Phản ứng nghịch sẽ không xảy ra cho đến khi đạt đến trạng thái cân bằng. (F) Câu hỏi 5. Chọn T, F hay CE*cho 2 phát biểu sau:
(I) Khi ở trạng thái cân bằng, phản ứng thuận và phản ứng nghịch đều dừng lại. (F)
(II) Khi ở trạng thái cân bằng, chất tham gia phản ứng và sản phẩm đều đạt đến nồng độ không đổi. (T)
Câu hỏi 6. Cho cân bằng: N2 + 3H2 2NH3 + nhiệt (ở trạng thái cân bằng), phát biểu nào dưới đây là đúng?
I. Cân bằng sẽ chuyển dịch sang phải khi áp suất tăng.
II. Phản ứng sang phải sẽ giảm khi nhiệt độ tăng.
III. Phản ứng sang phải sẽ giảm khi NH3 bị loại bỏ khỏi bình
(A) Ý I đúng (B) Ý II đúng
(D) Ý II và III đúng (E) I, II và III đều đúng Câu hỏi 7. Chọn T, F hay CE* cho 2 phát biểu sau:
(C) Ý I và II đúng
(I) Nếu phản ứng thuận của một cân bằng hóa học là phản ứng tỏa nhiệt thì việc tăng nhiệt độ sẽ làm cân bằng chuyển dịch theo chiều nghịch. (T)
(II) Tăng nhiệt độ sẽ tác động đến hệ cân bằng và làm hệ chuyển dịch theo chiều làm giảm sự tác động đó. (T) (CE*)
Câu hỏi 8. Giá trị Keq nhỏ biểu thị rằng cân bằng hóa học sẽ xảy ra
(A) tạo ra một lượng nhỏ sản phẩm (B) tạo ra một lượng lớn sản phẩm (C) sau một thời gian đáng kể (D) với sự có mặt của chất xúc tác (E) mà không có phản ứng thuận Câu hỏi 9. Đâu là biểu thức biểu diễn hằng số cân bằng của hệ sau: aA + bB cC + dD, nếu A và D là chất rắn? (A) [C]c[D]d/ [A]a[B]b (B) [A]a[B]b/ [C]c[D]d (C) [C]c/ [B]b (D) [C]c[D]d/ [A]a (E) [A]a[B]b[C]c[D]d Câu hỏi 10. Nếu K của cân bằng: H2 + I2 2HI là 45,9 ở 450oC, và 1 mol H2 và 1 mol I2 được cho vào bình kín thể tích 1 lit ở nhiệt độ đó,
Câu hỏi 12. 3 mol H2 và 3 mol I2 được cho thêm vào bình phản ứng dung tích 1 lít ở nhiệt độ 490oC. Hằng số cân bằng của hệ K được tính bằng biểu thức nào? (K = 45.9)
(A) K = [H2][I2]/[HI]
(B) K = [HI]/[H2][I2] (C) K = 2x/(x)(x) (D) K = (2x)2/(3-x)2 (E) K = (3-x)2/(2x)2
Câu hỏi 13. Nếu phản ứng sau đã đạt đến trạng thái cân bằng trong hệ kín: N2O4 (k)2NO2(k) Giá trị nào sau đây sẽ tăng khi giảm thể tích của bình? I. Giá trị của K II. Nồng độ của N2O4 III. Tốc độ của phản ứng nghịch
(A) Chỉ ý I đúng (B) Chỉ ý III đúng (C) Ý I và ý II đúng (D) Ý II và ý III đúng (E) Cả ý I, II và III đều đúng Câu hỏi 14-16 hỏi về các cân bằng hóa học sau:
(A) Ca2+(dd) + CO3 2- (dd)CaCO3 (r)
(B) N2 (k) + 2O2 (k) 2NO2 (k)
(C) 4NH3 (k) + 5O2 (k) 4NO (k) + 6H2O (k)
(D) H2 (k) + I2 (k) 2HI (k)
(E) Na2O2 (r) + H2O (l) 2NaOH (dd) + H2O2 (dd)
14. Phản ứng nào có thể tăng tốc độ bằng cách tăng diện tích bề mặt tiếp xúc của chất tham gia phản ứng. (E)
15. Phản ứng nào khi tăng áp suất của hệ bằng cách giảm thể tích của bình phản ứng thì làm cân bằng chuyển dịch sang phải. (B) 16. Phản ứng nào không tăng tốc độ phản ứng nghịch khi thêm vào hệ chất tham gia phản ứng? (A) Câu hỏi 17. 2SO3(k)2 SO2(k) + O2 (k)
Phản ứng cho ở trên đang ở trạng thái cân bằng, nếu đột ngột tăng nồng độ O2 thì phản
(E) không thay đổi nồng độ của sản phẩm cũng như chất tham gia phản ứng Câu hỏi 18-19 hỏi về cân bằng sau:
2H2S(k) + 3O2(k) 2SO2(k) + 2H2O (k) + heat
18. Trong phản ứng trên, nồng độ cân bằng của SO2(k) bị tăng do:
(A) thêm khí neon (Ne) (B) tăng nhiệt độ (C) thêm chất xúc tác (D) tăng nồng độ của H2O(k) (E) tăng nồng độ của O2(k)
19. Yếu tố nào sau đây sẽ tăng khi giảm thể tích của hệ phản ứng?
I. Tốc độ phản ứng
II. Nồng độ của các chất tham gia phản ứng của phản ứng thuận
III. Giá trị của Keq
(A) Ý I đúng (B) Ý III đúng (C) Ý I và ý II đúng (D) Ý II và ý III đúng (E) Ý I, II và III đều đúng Câu hỏi 20. 2NOCl(k) 2NO(k) + Cl2(k) Điều gì sau đây là đúng đối với phản ứng thuận của cân bằng hóa học trên?
(A) NO(k) tạo ra bằng tốc độ NOCl (k) bị mất.
(B) NO(k) tạo ra bằng một nửa tốc độ NOCl(k) bị mất.
(C) NO(k) tạo ra bằng hai lần tốc độ NOCl(k) bị mất.
(D) Cl2(k) tạo ra bằng tốc độ NOCl(k) bị mất.
(E) Cl2(k) tạo ra bằng hai lần tốc độ NOCl(k) bị mất.
C. changes the nature of the products D. changes the activation energy
Q3. An increase in concentration A. is related to the number of collisions directly B. is related to the number of collisions inversely C. has no effect on the number of collisions.
Q4. A catalyst is added to a system at equilibrium. The concentration of the reactants will then A. decrease B. increase C. remain the same D. approach zero E. none of the above Q5. For the reaction A + B C + D, the equilibrium constant can be expressed as A. K=[A][B] [C][D] B. K= [C][B] [A][D] C. K= [C][D] [A][B] D. K = A.B C.D
Q6. The concentrations in a expression of the equilibrium constant are given in A. mol/mL B. g/L C. mol/L D. g/mL Q7. In the equilibrium expression for the reaction BaSO4(s) Ba2+ (aq) + SO4 2- (aq) K is equal to A. [Ba2+] [SO4 2-] B. 22 4 4
[Ba][SO] BaSO
C. 22 4 4
[Ba][SO] [BaSO]
D. 4 22 4
[BaSO] [Ba][SO]
Q8. A change in which of these conditions will change the K of an equilibrium given as a starting point?
A. temperature B. pressure C. concentration of reactants D. concentration of products
Q9. In the Haper process for making ammonia N2 + 3H2 2NH3 . An increase in pressure factors A. the forward reaction B. the reserve reaction
C. neither reaction
Q10. In the reaction A → products
At t = 0, [A]= 0.1563M. At t = 1.00 minute, [A] = 0.1496M
The average rate of reaction during the first minute aqual A. 0.1563 M/min B. 0.1496 M/min C. 0.0067M/min
