GIÁO TRÌNH HÓA ĐẠI CƯƠNG
vectorstock com/28062440

Ths Nguyễn Thanh Tú
eBook Collection
GIÁO TRÌNH HÓA ĐẠI CƯƠNG NĂM HỌC
2021-2022 TRƯỜNG ĐẠI HỌC TÀI NGUYÊN

VÀ MÔI TRƯỜNG TP.HCM
WORD VERSION | 2023 EDITION
ORDER NOW / CHUYỂN GIAO QUA EMAIL
TAILIEUCHUANTHAMKHAO@GMAIL.COM
TRƯỜNGĐẠIHỌCTÀINGUYÊNVÀMÔITRƯỜNGTP.HCM
HÓAĐẠI
CƯƠNG
CHƯƠNG1:ĐẠICƯƠNGVỀNHIỆTĐỘNGHỌC
VÀĐỘNGHÓAHỌCCỦACÁCQUÁTRÌNHHÓAHỌC
Tài liệu chuẩn tham khảo
Phát triển kênh bởi
Ths Nguyễn Thanh Tú
Đơn vị tài trợ / phát hành / chia sẻ học thuật :
Nguyen Thanh Tu Group
Hỗ trợ trực tuyến
Fb www.facebook.com/DayKemQuyNhon
Mobi/Zalo 0905779594
Nămhọc:2021-2022
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
CHƯƠNG I:ĐẠICƯƠNGVỀNHIỆTĐỘNGHỌCVÀĐỘNG HÓAHỌCCỦACÁCQUÁTRÌNHHÓAHỌC
I.1.MỘTSỐKHÁINIỆMTRONGNHIỆTĐỘNGHỌCVÀĐỘNGHÓAHỌC
I.1.1Nhiệtđộnghọc,nhiệthóahọcvàđộnghóahọc:
Nhiệt động học : là khoa học nghiên cứu các quy luật về sự biến chuyển tương hỗ củacácdạngnănglượngkhácnhau.
Nhiệt hóahọc: làphầnhóahọcnghiêncứuđịnh lượnghiệuứngnhiệt củacácphản ứnghóahọc.
Nhiệtđộnghóahọc: nghiêncứucáckhoahọcvềsựchuyểnbiếntươnghỗgiữahóa năngvàcácdạngnănglượngkháctrongcácphảnứnghóahọc.
Nhiệt độnghóa học nghiên cứu các điều kiện tự diễn biến ( phản ứng hóa học ) và cácđiềukiệnbềnvững(trạngtháicânbằng)củacáchệhóahọc.
I.1.2.Hệhóahọc:
Hệ (nhiệt động ): làtậphợpcácvậtthểxácđịnhtrongkhônggiannàođóvàphần cònlạixungquanhlàmôitrường (môitrườngthườngđượcgiớihạntrongphạmvihẹphơnnhiều:đólàphầnbaoquanh cóthểgâyảnhhưởngtrựctiếplênhệ)
Hệ hóa học: là lượng nhất định của một haynhiều chất ở các điều kiện nhiệt độ , áp suấtvànồngđộxác định.
Ví dụ: Xét hỗn hợp gồm hai chất hóa học chứa trong chén sứ đặt trong lò nung. Hỗn hợphaihóachấtlàmộthệhóahọc,cònthànhchénvàkhônggiantronglòcóthểxemlà môitrường.
Hệ cô lập: làhệkhôngtraođổi chất vàkhôngtraođổi nănglượngdướidạngnhiệtvà côngvớimôitrường.(còngọilàhệđoạnnhiệt)
Hệ kín: làhệkhôngtraođổichấtsongcóthểtraođổinănglượngvớimôitrường.
Hệ hở: làhệkhôngbị ràngbuộcbởi một hạnchếnào, hệcóthểtraođổichất vànăng lượngvớimôitrường
Hệ đồng thể:làhệcócáctínhchấthóahọcvàvậtlýgiốngnhautrongtoànbộthểtích củahệ.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
Hệ dị thể :làhệcóbềmặtphânchiacácphầncủahệthànhnhữngphầncótínhchấthóa
họcvàvậtlý khácnhau.
Vídụ:Dungdịchmuốiăntrongcốcthủytinh
I.1.3.Pha:
là phần đồng thể của hệ dị thể có thành phần, cấu tạo, tính chất nhất định và được
phân chia với các phần khác bằng bề mặt phân chia nào đó.
Vídụ:Hệgồmnướcđávànướclỏnglàmộthệdịthể,gồmhaiphalànướcđá(pharắn) vànướclỏng(phalỏng)
Vậyhệđồngthểlàhệmộtpha,hệdịthểlàhệnhiềupha.
I.1.4.Trạngtháivàcácđạilượngxácđịnhtrạngtháicủahệ:
Trạng thái của hệ: được xác định bằng tập hợp các thông số biễu diễn các tính chấtlýhóacủahệnhưnhiệtđộ,ápsuất,thểtích,nănglượng…
Các thông số nói trên được gọi là thông số trạng thái, chúng liên hệ với nhau bằngcácphươngtrìnhtrạngthái.Cácthongsốtrạngtháiđượcchiathành2loại:dungđộ vàcườngđộ
Thông số dung độ lànhữngthôngsốtỉlệvớilượngchất:thểtích,khốilượng,số mol…
Thông số cường độ lànhữngthôngsốkhôngtỉlệvớilượngchất:nhiệtđộápsuấ, khốilượngriêng…
Trạngtháicủahệsẽbiếnđổi(tứclàchuyểntừtrạngtháinàysangtrạngtháikhác)khi có(ítnhất)mộttrongcácthongsốxácđịnhtrạngtháibiếnđổi
Trạng thái cân bằng là trạng thái tương ứng hệ cân bằng ( khi các thông số trạng thái giốngnhauởmọiđiểmcủahệvakhôngthayđổitheothờigian)
Hàm trạng thái làmộtđạilượngvậtlýquyếtđịnhtrạngtháitồntạicủahệvàcóđộlớn chỉphụthuộcváocácthôngsốtrạngtháicủahệmàkhôngphụthuộcvàocáchchuyểnhệ từtrạngtháiđầuquatrạngtháicuối.
Nhiệtđộ(T),ápsuất(P),thểtích(V),nộinăng(U),entapi(H),entropi(S),thếđẳngáp
G…lànhữnghàmtrạngthái..
Nhiệtvàcôngkhôngphảilàhàmtrạngthái
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Vídụ:ĐốivớihệnmolkhílýtưởnghàmPV=nRTlàhàmtrạngtháivìgiátrịcủanó chỉ phụ thuộc vào giá trị của các thông số P,V,T mà không phụ thộc vào cách biến đổi của hệ ( thuận nghịch, không thuận nghịch…). Thực vậy, ở trạng thái 1 ( tương ứng P1, V1 T1)tacóP1V1 =nRT1,khichuyễnsangtrạngthái2(tươngứngP2,V2 ,T2)tacóP2V2 =nRT2
Quá trình: là sự biến đổi xảy ra trong hệ gắn liền với sự thay đổi (ít nhất) một thôngsốtrạngthái.
Quá trình thuận nghịch: là quá trình có thể diển ra theo chiều thuận cũng như theochiềunghịchvàkhi điễnrat hoe chiềunghịchthì hệcũngnhưmôi trườngsẽtrởvề đúngtrạngtháibanđầumàkhôngcóbiếnđổinhỏnàoxảyra.
Quá trình bất thuận nghịch trongtựnhiênchỉxảyratheomộtchiềuvàkhôngcần tiêu tốn năng lượng. Ví dụ: sự khuếch tán chất khí, nước chảy từ chỗ cao xuống chỗ thấp…
Quá trình đẳng áp là quá trình xảy ra ở điều kiện áp suất không đổi (P=const), quá trình đẳng tích ở điều kiện thể tích không đổi ( V=const), quá trình đẳng nhiệt ở điều kiệnnhiệtđộkhôngđổi(T=const).
I.1.5.Cácđơnvịquốctếvềnănglượng:
+Erg(hệCGS):ergbằngcôngcủalực1đynnhânchokhoảngcáchchuyểndịch1cm.
1erg=1dyn*1cm=10-7J (dynlàlựctruyềnchokhốilượng1gmộtgiatốclà1cm.giây-2)
+Jun(J)(hệSI):junbằngcôngcủa1niutơn(N)nhânchokhoảngcáchchuyểndịch
1mét.
1J=1N*1m=107 erg
1N=105 din (niutơnlàlựccungchovậtthểcókhốilượng1kgmộtgiatốclà1m.giây-2)
+Calo(cal):làđơnvịriêngdùngchohóahọc(đơnvịngoàihệ)
1cal=4,184J=4,184.107 erg
+Electron–von(eV):cũnglàđơnvịngoàihệthườngđượcdùngtronghóahọc.Một eVbằngnănglượngmàN.eđiệntích(N–sốavogađro;e–điệntíchelectron)thuđược khichạyquađiệntrườngcóthếhiệulà1V.
1eV=23062cal
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
I.1.6.Mộtsốdạngnănglượng Năng lượng là thước đo khả năng vận động của vật chất. Nhiệt và công là hai dạng nănglượngquantrọngnhấtđốivớihóahọc.
Nhiệt (Q) là thước đo sự chuyển động nhiệt hỗn loạn của các tiểu phân tạo nên chất hay hệ.
Công (A) là thước đo sự chuyển động có trật tự và có hướng của các tiểu phân theo hướng của trường lực
Quiước:+Hệthunhiệt(nhiệtmàhệhấpthụtừmôitrường)+(Q>0)
+Hệphátnhiệt(nhiệtmàmôitrườnghấpthụtừhệ)–(Q<0)
+Cônghệtácđộnglênmôitrường-(A<0)
+ Côngmôitrườngtácđộnglênhệ+(A>0)
Nộinăng(U) của hệ là năng lượng có sẵn , ẩn dấu bên trong hệ , bao gồm năng lượng
chuyển động tịnh tiến , chuyển động quay của các phân tử , chuyển động quay và chuyển
động dao động của các nguyên tử và nhóm nguyên tử bên trong phân tử và tinh thể, chuyển động của electron trong nguyên tử , năng lượng bên trong hạt nhân. Nóitóm lại nộinănglànănglượngtoànphầncủahệtrừđộngnăngvàthếnăngtoànhệ.
I.2.NGUYÊNLÝICỦANHIỆTĐỘNGLỰCHỌCVÀHIỆUỨNGNHIỆT
I.2.1.NguyênlýIcủanhiệtđộnghọc: Nếu trong quá trình nào đó mà có một dạng năng lượng đã mất đi thì thay cho nó phải có một dạng năng lượng khác xuất hiện với lượng tương đương nghiêm ngặt.
Đâychínhlàđịnhluậtbảotoànnănglượng ( Năng lượng không tự sinh ra hoặc không tự mất đi, chỉ có thể biến đổi từ dạng này sang dạng kháctheo tỉ lệ tươnmg đương nghiêm ngặt)
Các dạng năng lượng chuyển hóa tương hỗ trong các quá trình hóa học chủ yếu là nhiệt,côngvànộinăng.
GiảsửcómộtbìnhhìnhtrụtiếtdiệnSvớimộtpistoncóthểdichuyểnkhôngma sát.Bêntrongbìnhcóchứakhí.Từbênngoài,môitrườngtácđộngvàohệmộtcôngA( nénkhí),đồngthờicungcấpchohệmộtnhiệtlượngQ(đunnóng),kếtquảnhiệtđộchất khítăng(nộinăngchấtkhíUtăng)
*Biểu thức toán học của nguyên lý I:
U=A+Q (*)
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
-Trongtrườnghợpchung, công do hệ thực hiện gồm:
+Cônggiãnnởthểtích: A=-pdV
+Côngcóíchkhác: A’
a/ Quá trình đẳng tích
V1=V2= V=const ⇒ A=-p∆V=0
(*) ⇒ Uv =Qv
⇒ NếuphảnứnghóahọctiếnhànhtrongđiềukiệnV=constthìtoànbộlượngnhiệtdo hệthuvàohaytỏaratrongquátrìnhđẳngtíchdùngđểlàmtăngnộinăngcủahệ.
+Nếuphảnứngthunhiệtthìnộinăngcủahệtăng:
+Nếuphảnứngtỏanhiệtthìnộinăngcủahệgiảm:
b/ Quá trình đẳng áp: (p = const)
A=-p∆V=-p(V2 –V1)
=(U2 –U1)+p(V2-V1)
=(U2 +pV2)–(U1 +pV1)
Đặt H=U+PV:Entanpicủahệ
⇒ Trongđiều kiện p = const, lượngnhiệt thu vào(haytỏa ra) bằngbiến thiên entanpi củahệ:
+Nếuphảnứngthunhiệt,entanpicủahệtăng:
+Nếuphảnứngtỏanhiệt,entanpicủahệgiảm:
H>0
H<0
+ Trongphản ứngchỉ có mặt chất lỏng và chất rắn, ở đósự thayđổi thể tích là không đángkểthì
U H
+Trongphảnứngcóchấtkhíthì:
:biếnthiênsốmolkhí
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
R=1,987cal/mol.độ =8,314J/mol.độ
I.2.2.Phươngtrìnhnhiệthóahọc:
Hiệuứngnhiệtcủaphảnứng:
HóaĐạiCương
Hiệu ứng nhiệt của phản ứng là lượng nhiệt tỏa ra hay hấp thụ của một phản
ứng hóa học. VD :Khiđốtthan,nhiệtlượngtỏara,tráilạinungđávôilàmộtphảnứng thunhiệt.
PhảnứngtỏanhiệtQ<0
PhảnứngthunhiệtQ>0
HiệuứngnhiệtphảnứngđoởđiềukiệnđẳngápbằngbiếnthiênentapicủahệQp = H ,hiệuứngnhiệtphảnứngđoởđiềukiệnđẳngtíchbằngbiếnthiênnộinăngcủahệQv =
U.
2CO(k) + O2 (k) 2CO2 (k) U =-563,50kJ
2CO(k) + O2 (k) 2CO2 (k) H =-563,50kJ
Phươngtrìnhphảnứngcóghithêmnhiệtlượngtỏatahayhấpthụvàtrạngtháicủacác
chấtđượcgọilà phương trình nhiệt hóa học
Vd: C(r) + O2 (k) CO2 (k) H =-395,41kJ
Trongthựctế,cácquátrìnhhóahọcthườngxảyra trongđiềukiệnápsuấtkhôngđổi, vìvậytrongphầnnàychúngtahọcvềhiệuứngnhiệt củamộtsốquátrìnhđẳngáp.
Nhiệttạothành(sinhnhiệt)
Nhiệt tạo thành là hiệu ứng nhiệt của phản ứng tạo thành một mol chất từ các đơn chất ứng với trạng thái bền vững nhất.
Nhiệt tạo thành của đơn chất ở trạng thái bền vững nhất ở điều kiện tiêu chuẩn ( P = 1atm , T0 = 250C = 298,150K ) được quy ước bằng không.
Ví dụ : Nhiệt tạo thành tiêu chuẩn của Asen clorua lỏng bằng –80,2 Kcal nghĩa là có
80,2KcaltỏarakhitạothànhmộtmolAsCl3 lỏngtừAsenđơnchất (rắn)vàphântửkhí
CloởđiềukiệnP=1atmvàT0 =298,150Kmôtảbằngphảnứngsau:
As(r)+3/2Cl2 (k)=AsCl3 (l) 0 298,tt =-80,2kcal
Nhiệt đốt cháy ( thiêu nhiệt): Nhiệt đốt cháy là hiệu ứng nhiệt của phản ứng đốt cháy một mol chất bằng oxy đơn chất để tạo thành khí CO2 , nước lỏng và một số sản phẩm khác.
Vídụ:NhiệtđốtcháycủaEtanởđiềukiệntiêuchuẩnbằng–372,82Kcalnghĩalàcó 372,82 kcal tỏa ra khi đốt cháyhoàn toàn 1 mol C2H6 bằngoxyđơn chất đến tạo thành khí CO2 và H2O lỏng ở P = 1 atm và T0 = 298,150K mô tả bằngphương trình phản ứng
sau:
Tacó:
VD:C2H6(k) + 7/2O2(k)→2CO2(k)+2H2O(l)
(C2H6)=-372,82kcal
VD:H2O(l)=H2(k)+1/2O2(k)
=-372,82kcal
* Nhiệt phân hủy lànhiệtphảnứngphânhủy1molchấtđótạothànhcácđơnchất.
(H2O)=68,3kcal
Định luật Lavoissier – Laplace
VD: 1/2H2(k)+1/2I2(r) =HI(k)
ttH (HI)=+6,2kcal
HI(k)=1/2H2(k)+1/2I2(r)
phH (HI)= -6,2kcal
« Nhiệt tạo thành và nhiệt phân hủy của cùng một chất bằng giá trị và ngược dấu »
Nhiệtchuyểnpha
Nhiệt chuyển pha là hiệu ứng nhiệt của quá trình chuyển chất từ pha này sang pha khác.
Tùythuộcvàoloạichuyểnpha,nhiệtchuyểnphacótênkhácnhau.
Vídụ:NhiệtthănghoacủaIodlàlượngnhiệtcầncungcấpđểmộtmolIodrắnchuyển hoàntoànthànhhơi.
I2 (r) =I2 (k) 0 298,th=14,92kcal/mol
Nhiệt bay hơi của nước là lượng nhiệt cần cung cấp để một mol nước lỏng chuyển hoàntoànthànhhơi.
H2O(l)=H2O(h) 0 298,th =10,52kcal/mol
Nhiệtngưngtụcủanướclàlượngnhiệttỏarakhimộtmolnướchơichuyểnhoàntoàn thànhnướclỏng
H2O(h)=H2O(l) 0 298,th =-10,52kcal/mol
Quátrìnhngưngtụlàquátrìnhnghịchđảocủaquátrìnhbayhơi.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương 7
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Nhiệthoàtan Nhiệt hòa tan là lượng nhiệt tỏa ra hay thu vào khi hòa tan một mol chất vào một lượng nhất định dung môi.
Nhiệthoàtanchịuảnhhưởngrấtlớncủalượngvàbảnchấtdungmôihòatan.
Ghichú:Dựatheođặcđiểmquantrọngnhấtcủanhữngchuyểnbiến hóahọclàcósự thayđổicấutrúcelectroncủacácchấtthìnhữngquátrìnhchuyểnphavàhòatancũngcó thểxemlànhữngquátrìnhhóahọc,vìvậynhiệtchuyểnphavànhiệthòatancũngđược coilàhiệuứngnhiệtcủacácquátrìnhhóahọc.
I.2.3. ĐịnhluậtHessvàcáchệquả:
ĐịnhluậtHess
Hiệu ứng nhiệt của các quá trình hóa học đẳng áp hoặc (và) đẳng tích của hệ cô lập chỉ phụ thuộc vào bản chất của các chất đầu và sản phẩm cuối chứ không phụ thuộc vào số và đặc điểm của các giai đoạn trung gian.
Đâylàđịnhluậtcơbảncủanhiệthóahọcvìnóđãnêurađượcđiềukiệnđểtrạngthái hóanhiệtphảnứng. Ngườitabiết rằng,nhiệt của một quátrình bất kỳnói chungphụ thuộc vàocáchtiến hành quá trình đó. Chỉ có hiệu ứng nhiệt của các quá trình của hệ cô lập diễn ra trong nhữngđiềukiệntuântheođịnhluậtHess(đẳngáp,đẳngtích)mớikhôngphụthuộcvào cáchtiếnhànhquátrình.Vìvậy,đểtínhhiệuứngnhiệtcủaquátrìnhđẳngnhiệtvàđẳng
áp chúng ta chỉ cần quan tâm đến trạng thái đầu và trạng thái cuối của hệ cô lập. Vì có tính chất nêu trên, nên hiệu ứng nhiệt đẳng áp và hiệu ứng nhiệt đẳng tích được gọi là hàm trạng thái.
VD: Có vài cách để chuyển 1 mol Na 0,5 mol H2, 0,5 mol O2, thành 1 mol NaOH và hiệuứngnhiệttổngcộngcủacáchnàocũngbằng =-102,0kcal.
Cách 1:
Na(r) + 1/2O2(k) = 1/2Na2O2(r)
1/2H2 (k) + 1/4O2(k) = 1/2H2O(l)
1/2Na2O2 + 1/2H2O(l) = NaOH(r) + 1/4O2(k)
Tổngcộng:Na(r) + 1/2H2(k) + 1/2O2(k) = NaOH(r)
H1=-60,3kcal
H2=-34,1kcal
H3=-7,6kcal
H=?
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
Cách 2 :
HóaĐạiCương
H2(k) + 1/2O2(k) = H2O(l) H1 =-68,3kcal
Na(r) + H2O(l) = NaOH(r)+1/2H2(k) H2 =-33,7kcal
Tổngcộng:Na(r) + 1/2H2(k) + 1/2O2(k) = NaOH(r) H=?
CHÚÝ:Entanpicủamộtchấtđượctínhđốivới mộtmolchất.Biếnthiênentanpitính
được từ entanpi của các chất ở điều kiện chuẩn được gọi là biến thiên entanpi chuẩn và
đượckíhiệulà
H0 hoặckhichúýcảnhiệtđộnữathìđượckíhiệulà
+Đốivớicáckhí,trạngtháichuẩnlàtrạngtháicủakhílítưởngởápsuất1atm.
+Đốivớicácchấtrắnvàchấtlỏng,trạngtháichuẩnlàtrạngtháicủachấttinhkhiết.
+Nhiệtđộthườngđượclấylà:250C = 2980K.
CáchệquảcủađịnhluậtHess a) Hệquả1
Hiệu ứng nhiệt của phản ứng hóa học bằng tổng nhiệt tạo thành của các sản phẩm phản ứng trừ đi tổng nhiệt tạo thành của các tác chất.
H= Htt(sảnphẩm)-Htt(tácchất)
Ví dụ : Tính hiệu ứng nhiệt của phản ứng sau ở điều kiện tiêu chuẩn , cho biết sinh nhiệtcủacácchấtđầuvàsảnphẩmcủaphảnứng:
Al2O3 (r)+3SO3 (k) =Al2(SO4)3 (r)
Trongđó Al2O3 (r) SO3 (k) Al2(SO4)3 (r)
0 298,tt -400,40 -94,43 -821,0
Apdụngcôngthức được:
b) Hệquả2
Hiệu ứng nhiệt phản ứng bằng tổng nhiệt đốt cháy của tác chất trừ đi tổng nhiệt đốt cháy của chất sản phẩm.
H= Hđc(tácchất)-Hđc(sảnphẩm)
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Vídụ:Tínhhiệuứngnhiệtcủaphảnứngsauởđiềukiệntiêuchuẩn
C2H2 (k)+2H2(k)=C2H6 (k)
Chobiếtnhiệtđốtcháycủacácchấtởđiềukiệntiêuchuẩn:
Chất C2H2 (k) H2(k) C2H6(k)
0
Apdụnghệquả2 : c) Hệquả3
Hiệu ứng nhiệt của phản ứng thuận bằng hiệu ứng nhiệt của phản ứng nghịch với dấu ngược lại.
vídụ: 1/2O2 (k)+H2 (k) =H2O(k) có pư =57,80kcal
H2O(k) =1/2O2 (k)+H2 (k)có pư =-57,80kcal
Ghichú:Giátrị pư làgiátrịchophảnứngcụthể,vìvậykhihệsốtỷlượngthayđổi
thìgiátrị pư thayđổi.
Vídụ:O2 (k)+2H2 (k) =2H2O(k)có pư =115,60kcal
d)Hệquả4:
Hiệu ứng nhiệt của phản ứng hóa học bằng tổng năng lượng liên kết của tác chất trừ đi
tổng năng lượng liên kết của sản phẩm.
H= Elk (tácchất)-Elk (sảnphẩm)
Vídụ:Tínhhiệuứngnhiệtcủaphảnứngsau:
CH2=CH2 + H2 CH3 –CH3
Biếtnănglượngliênkết(Kcal)củaC=C:597,7;C-C:343,4;H-H:216;C-H:418,4.
Apdụnghệquả4:
* ẢNH HƯỞNG CỦA NHIỆT ĐỘĐẾN HIỆU ỨNG NHIỆT
Hiệu ứng nhiệt là một hàm số của nhiệt độ. Mối quan hệ giữa nhiệt độ và hiệu ứng
nhiệtđẳngápđượcbiểudiễnbằngcôngthứcKirhoff:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
(1)
Trongđó các T làhiệuứngnhiệt của phản ứngở cácnhiệt độT1 và T2 Cp làđộ biếnthiênnhiệtdungđẳngápcủaphảnứngvà đượctínhtheocôngthức :
Cp = Cp(sảnphẩm) - Cp(chấtđầu)
Nhiệt dung của một chất là lượng nhiệt cần dùng để nâng nhiệt độ của một lượng xác định chất đó lên một độ.
Nhiệt dung riêng là lượng nhiệt cần dùng để nâng một gam chất đó lên một độ.
Nhiệt dung phân tử là lượng nhiệt cần dùng để nâng một mol chất đó lên một độ.
Nhiệt dung đằng áp là nhiệt dung của quá trình nâng nhiệt trong điều kiện đẳng áp, ký hiệu CP .Nhiệt dung đẳng tích là nhiệt dung của quá trình nâng nhiệt trong điều kiện đẳng tích, Ký hiệu CV
Vídụ:Nhiệtdungriêngđẳngápcủanướctrongkhoảng14,50C–15,50Cbằng 1cal/ g.độ,nhiệtdungphântửđẳngápcủanướctrongkhoảngnhiệtđộnàylà18,015cal/mol. độ.
Trong trường hợp nhiệt dung được coi là không phụ thuộc nhiệt độ thì công thức (1)
đượcviết: Hay: Vídụ:Xácđịnhhiệuứngnhiệtcủaphảnứng: CO(k)+1/2O2 (k)=CO2 (k)
Ơ3980K,biết 0 298,pư =-67,64kcalvànhiệtdungphântửđẳngápcủaCO(k),O2(k) vàCO2(k) tươngứnglà6,97,7,05và8,96cal/mol.độ.
I.3.NGUYÊNLÝIIVÀENTROPI
Mở đầu : Như đã thấy trong phần I.2, nhiệt phản ứng có một vai trò rất quan trọng trong việc khảo sát các quá trình hóa học bởi vì xét về phương diện năng lượng có xu hướng quá trình diễn ra về phía tạo ra hệ bền vững hơn , nghĩa là tạo ra hệ có thế năng
(
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
nhỏ hơn . Tuy nhiên , trong thực tế có rất nhiều phản ứng lại diễn ra về phía thu nhiệt.
Chẳnghạn phảnứng
CuCl2.2H2O(r) = CuCl2 (r) + 2H2O(k)
0 298,tt (kj/mol) -819 -278 -242
S0 298 (j/mol.độ) +191 +211 +189
G0 298,tt (kj/mol) -660 -244 -229
Làphảnứngthunhiệt(0 298,pư =57kJ)nhưngphảnứngnàyvẫnxảyrangayở250C
G0 298,pư = -42kJ ). Như vậy nhiệt phản ứng không phải là điều kiện bắt buộc cho quá trình hóa học xảy ra mặc dù nói chung quá trình hóa học thường tự diễn ra theo chiều hướngcósựtỏanhiệt.
Từ đây, người ta nhận thấycòn có thêm một yếu tố nữa ngoài yếu tố nhiệt góp phần quyếtđịnhchiềutựdiễnbiếncủaquátrìnhhoálý.
I.3.1.Kháiniệmvàtínhchấtcủaentropi:
ĐịnhnghĩacủaEntropi
Entropilàthướcđođộhỗnloạncủatrạngtháicủahệvàđượcbiểuthịbằngcôngthức
sau:
Trongđó:
N là số Avogadro bằng 6,02204.1023( số Avogadro là số nguyên tử có trong một nguyêntửgamhaysốphântửcótrongmộtphântửgam).
R là hằng số khí ( 0,082 lit.atm/mol.độ = 8,3144 j/mol.độ = 1,987 cal/mol.độ). K là hằngsốBolzman1,38066.10-23j/độ.
Wlà xác suất trạng thái củahệ.
Tínhchấtcủaentropi
-EntropiSlàmộtthuộctínhkhếchđộcủahệ,tươngtựnhưnộinăng,tứclànócócộng tính,giátrịcủanóphụthuộcvàolượngchất.
-EntropiSlàmộthàmtrạngtháiđơntrị,liêntụcvàhữuhạncủahệ.Điềunàycónghĩa làbiếnthiênentropicủahệtrongmọiquátrìnhbấtkỳchỉphụthuộcvàtrạngtháiđầuvà cuốicủahệ,khôngphụthuộcvàođườngđi.
-Mỗichấtcógiátrịentropiriêngcủamình,phântửcàngphứctạpthìentropicànglớn.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
- Đối với cùng một chất thì các trạng thái rắn, lỏng, khí, entropi của nó có giá rị khác nhauvàtăngdầnlên.
Vd:SH2O(tt)<SH2O(l)<SH2O(k)
-Entropicủatấtcảcáctinhthểtinhkhiếtmọi chấtở00Kđềubằng0vìchúngchỉ còn mộttrạngtháisắpxếpduynhất
- Nhiệt độ và áp suất có ảnh hưởng đến entropi: nhiệt độ tăng làm entropi tăng nhưng ápsuấttănglạilàmentropigiảm.Điềunàycóthểhiểuđượcdựatrênsựthayđổiđộhỗn loạncủahệtheonhiệtđộvàápsuất.
Trongđiềukiệnđẳngápsựtăngentropitheonhiệtđộtínhtheocôngthức:
TrongđóCP lànhiệtdungđẳngápcủachất.
TrongtrườnghợpcoiCP khôngphụthuộcnhiệtđộthìcóthểviết:
Dùngcôngthứctínhentropicủacácchất.
Ví dụ : Tính entropi của nước
cal/mol.độvàCP =18cal/mol.độ.
Apdụngcôngthức(5.19) có:
I.3.2.Nguyênlýthứhaicủanhiệtđộnghọc
Một hệ đóng biến đổi thuận nghịch vô cùng nhỏ trong đó hệ trao đổi chất với môi trường ở nhiệt độ T một nhiệt lượng Qtn thì sự biến đổi entropi trong quá trình này được xác định bỏi biểu thức: tnQ dS T
Nếusựbiếnđổilà bất thuận nghịch (quátrìnhtựdiễnbiến)thì:
tnQ dS T
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
Vì entropi là hàm trạng thái, nên khi hệ chuyển từ trạng thái 1 sang trạng thái 2 bằng
biếnđổithuậnnghịchhaybấtthuậnnghịchtađềucó:
Nghĩalà Sbtn =Stn
BiểuthứctổngquátcủanguyênlýIInhiệtđộnghọcnhưsau:
;
Dấu=ứngvớiquátrìnhthuậnnghịch,dấu>ứngvớiquátrìnhbấtthuậnnghịch.
Trongthựctếngườitaquansátthấycócácquátrìnhtựdiễnbiếnngượclại.Vídụ:Khi
chomộtgiọtmựcxanhvàomộtcốcnước,màuxanhcủamựcsẽlandầnđếnkhicảcốc nướccó màu đồngnhất. Khôngthể chờđợi cóquátrìnhtự hội tụ trở lạithành giọt mực ban đầu trong cốc nước. Ví dụ 2 : Khi cho hai thanh sắt có nhiệt độ khác nhau tiếp xúc nhauvàcáchlikhỏimôi trườngbênngoài,mọingườiđềubiếtrằngnhiệt độcủacụcsắt nónghơnsẽhạxuốngvànhiệtđộcủacụcsắtlạnhhơnsẽtănglên.Khôngthểcótrường hợp nhiệtđộ của cụcsắt nónghơnsẽ tănglên và nhiệtđộcủacụcsắt lạnhhơnsẽ giảm xuống.
Từ các quan sát thực tế người ta rút ra kết luận : các hệ cô lập tự diễn biến theo chiều tăngđộhỗnloạn vàquyluậtnàyđượcphátbiểunhưsau: Không thể có quá trình tự chyển năng lượng từ vật thể có các tiểu phân chuyển động trật tự hơn sang vật thể có các tiểu phân chuyển động kém trật tự hơn.
I.3.2.Sựbiếnthiênentropicủaphảnứnghóahọc: Entropilàmột hàm trạngtháidođósựbiếnthiên entropicủamột quátrìnhđượctính theocôngthức :
Spư = S(sảnphẩm)- S(chấtphảnứng)
Vídụ:Tính S0 298 tiêuchuẩncủaphảnứngsau
Cgraf + CO2 (k) = 2CO(k) Chobiết S0 298 cal/mol.độ 1,36 51,10 47,30
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Vì entropi của chất khí lớn hơn nhiều entropi của chất rắn và chất lỏng, nên nếu sốmolkhíởvếsảnphẩmlớnhơnnhiềusốmol khíởvếtácchấtthì S>0vàngượclại.
Nếusốmol khí ởhai vếbằngnhauhoặcphànứngkhôngcóchất khí thì S kháckhông khônglớn.
Biếnthiênentropikhichuyểnphacủachấtnguyênchất
Khi chất nguyên chất chuyển pha ở áp suất không đổi thì trong suốt quá trình đangchuyểnphanhiệtđộkhôngđổi.Đâylàquátrìnhđẳngnhiệt–đẳngáp.
S:biếnthiênentropicủaquátrìnhchuyểnpha,J/K.mol
H:entapicủaquátrìnhchuyểnphaJ/mol
T:lànhiệtđộchuyểnpha
Biếnthiênentropicủaquátrìnhgiảnnởđẳngnhiệtkhílýtưởng
Xét n mol khí lý tưởng giản nở từ thể tích V1 đến thể tích V2 ở nhiệt độ không đổi,tacó: Biếnthiênentropicủachấtnguyênchấttheonhiệtđộ:
Khi đun nóng một chất nguyên chất từ T1 đến T2 ở áp suất không đổi và trong khoảngnhiệtđộnàykhôngcósựchuyểnphathì:
Mà dH =CP.dT
Suyra:
Trongkhoảngnhiệtđộhẹp,nếuCP coilàkhôngđổithì:
Tươngtựđốivớiquátrìnhđẳngtích:
1 ln P T SnC T
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
KhiCV =constđốivớinhiệtđộ:
HóaĐạiCương
I.4. CHIỀU, ĐIỀU KIỆN TỰ DIỄN BIẾN VÀ ĐIẾU KIỆN CÂN BẰNG CỦA
CÁCQUÁTRÌNHHÓAHỌC:
I.4.1.Thế đẳngnhiệt-đẳngáp vàchiềucủacácquátrìnhhóahọc
Biểuthức:
TSpư pư
có T cũng là yếu tố làm tăng độ hỗn loạn của hệ nên trong nó có hai thành phần đặc
trưng cho hai xu hướng diễn biến của quá trình của hệ : -TS là yếu tố đặc trưng cho xu hướng làm tăng độ hỗn loạn của hệ . Xu hướng này
đượcbiểuthịtrongđịnhluậtthứhaicủanhiệtđộnghọc.
-là yếu tố đặc trưng cho xu hướng làm tăng độ trật tự của hệ. Xuhướngnàyđược
biểuthịtrongđịnhluậtthứnhấtcủanhiệtđộnghọc.
nên có thể nói công thức phản ảnh hai định luật cơ bản của nhiệt động học nghĩa là phảnảnhhaikhuynhhướngtựdiễnbiếntrongtựnhiên:khuynhhướngtăngđộhỗnloạn củahệvàkhuynhhướnglàmgiảmnănglượngcủahệ(tứclàkhuynhhườnglàmtăngđộ trậttựcủahệ).Ngườitađặtmộtđạilượngbiểuthịchosựtranhchấpnàycủahệđằngáp
đẳngnhiệtvàgọilàsựbiếnthiêncủathếđẳngáp kýhiệu Gtheocôngthứcsau:
G= -TS ()
G=G2 –G1 .Glàthếđẳngáp (còngọilànănglượngtựdoGibbshaylàthếđẳngáp
đẳngnhiệt)
Phương trình ()là phương trình cơ bản của nhiệt động hóa học.
I.4.2.Xácđịnhchiềudiễnbiếnvàđiềukiệncânbằngcủacácquátrìnhhóahọc
Thếđẳngáplàmộthàmtrạngthái.Thựcvậy,triểnkhaicôngthức()được
G=H-TS
∆G= H-T∆S
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
*Nếutấtcảcácchất phảnứngđềuởtrạngtháichuẩn thì nănglượngGibbstạothành củachấtởtrạngtháichuẩnvàđượckíhiệulà G0 hoặc khichúýđếnnhiệtđộ.
* Năng lượng Gibbs tạo tạo thành chuẩn của các đơn chất bằng không
VìH,TvàS đềulàcác hàm trạngtháinênG cũnglàmột hàm trạngthái nên Gcủa quátrìnhtínhđượctheocôngthứcsau:
Gpư= G(sảnphẩm)- G(tácchất)
Ngườitachứngminhrằng Gcủaquátrìnhthuậnnghịchcógiátrịbằngcôngcựcđại (Amax)củaquátrìnhđóvớidấungượclại:
Gpư =-Amax
Vì quá trình tự diễn biến là quá trình sinh công nên có thể rút ra các kết luận quan trọngtừcáccôngthứcvềvaitròcủa Gpư nhưsau: Có thể dùng Gpư làm thước do cho khả năng tự diễn biến của một quá trình của một hệ:
Gpư <0quátrìnhhóahọccókhảnăngtựdiễnbiến.
Gpư>0quátrìnhhóahọckhôngcókhảnăngtựdiễnbiến(hayquátrìnhhóahọc tựxảyratheochiềungượclại)
Gpư =0hệhóahọcnằmởtrạngtháicânbằng.
Ví dụ : Xétphảnứng
Cgr + CO2 (k)=2CO(k)
a) Phản ứng có khả năng diễn ra ở 2980K ở điều kiện tiêu chuẩn (P = 1atm) hay không?
b) Ơnhiệtđộnàothìphảnứngnằmởtrạngtháicânbằngởđiềukiệntiêuchuẩn.
c) Từnhiệtđộnàothìphảnứngcókhảnăngtựdiễnbiếnởđiềukiệntiêuchuẩn.
Giảthiếtrằng pư và Spư hầunhưkhôngphụthuộcnhiệtđộ.
Chobiếtcácgiátrịsau:
Cgf CO2 (k) CO(k)
0 298,tt (kcal/mol) 0 -94,10 -26,42
S0 298 (cal/mol.độ) 1.36 51,10 47,30
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
Sửdụngbiểuthức()trongbiệnluậnđánhgiáchiềuquátrìnhhóahọc
Vì pư ở250Cthườngcógiátrịvàichụcđếnvàitrămkcalcòn Spư ở250Cthường
cógiátrịvàichụccalnêntừphươngtrìnhcơbản()củanhiệtđộnghóahọc
Gpư = pư -TSpư
chúngtathấy: + Ở những nhiệt độ thấp ( từ khoảng vài trăm 0C trở xuống ) thì trong đa số trườnghợp TSpư << pư, nên dấu của Gpư phụ thuộc vào dấu pư vì vậycó thểdựavàoyếutốentanpiđểxétchiềucủaquátrình. Từđâychúngtahiểuđượctạisao ở nhữngnhiệt độ bình thường, đa số các quá trình phát nhiệt (Hpư < 0) lại tự xảyra , cònrấtítquátrìnhthunhiệt(Hpư <0) tựxảyra.
+Ởnhiệtđộcao(>15000C)thìthường|TSpư |>>| pư |,vìthếdấucủa Gpư phụthuộcvàodấucủa Spư vìvậyphảidựavàogiátrịcủaTSpư đểxétchiềuquátrình.
+Ởcác giátrịnhiệtđộkhônglớnlắmvàkhôngnhỏlắmthì Gpư phụthuộcvào
cảhaiđạilượng Spư và pư.
I.5 ĐỘNGHÓAHỌC
I.5.1Tốcđộphảnứng
C v t
Tốc độ phản ứng là sự biến thiên nồng độ của chất phản ứng hoặc của sản phẩm phản
ứng trong một đơn vị thời gian thời gian .
Tốcđộphảnứngtrungbìnhtínhbằngbiểuthức:
dC v dt
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Đốivớicácbiểuthứctrên,ngườita chọndấucộngkhisửdụngnồngđộsảnphẩm(vì nồngđộtăng)vàchọndấutrừkhisửdụngnồngđộchấtphảnứng(vìnồngđộgiảm).
Địnhluậttácdụngkhốilượngcơbảncủađộnghóahọc:
Đối với phản ứng một chiều ở một nhiệt độ xác định và có bậc phản ứng động học xác
định, tốc độ của phản ứng tỷ lệ mỗi lúc với tích nồng độ lúc đó của các chất có ảnh hưởng đến tốc độ ( nồng độ mỗi chất được nâng lên một lũy thừa xác định nào đó)
Chophươngtrìnhtổngquát aA + bB + … cC + dD + …
Địnhluậttácdụngkhốilượngcơbảncủađộnghóahọcbiểudiễnbằngbiểuthứcsau
Trongđó:
klàhằngsốtốcđộphảnứng.
hằngsốtốcđộphảnứngklàmộtđạilượngchỉphụthuộcbảnchất củaphảnứngvànhiệtđộ.
Ý nghĩa của k : k là tốc độ riêng của phản ứng khi nồng độ các chấtcóảnhhưởngđếntốcđộphảnứngbằngđơnvị.
Giátrịcủakcànglớnthìtốcđộphảnứngcàngmạnh
1, 2 làcácsốmũlũythừacủacácnồngđộvàđượcxácđịnhbằngthực nghiệm.Chúngcóthểcócácgiátrịdương,âmvàbằngkhông.Trongtrườnghợp
i =0,nồngđộcủachấtikhôngcóảnhhưởngđếntốcđộphảnứng.
Tốcđộphảnứngtứcthờitínhbằngbiểuthức:
Đốivớiphảnứngtổngquát
aA + bB = cC + dD
cácbiểuthứctốcđộphảnứngtrungbìnhvàtứcthờicódạngnhưsau: 1111 C ABD C CCC v atbtctdt
Chú ý: Khôngthể biết giá trị thôngqua phươngtrình phản ứngvì đối với các phản ứngphứctạptốcđộphảnứngphụthuộcvàogiaiđoạnphảnứngcótốcđộchậmnhất.
Vídụ:Phảnứng
2NO + O2 = 2NO2
xảyratheo3giaiđoạnnốitiếpnhau
a) 2NO= |ON…NO|
b) |ON…NO| +O2 =|ON…O–O…NO|
c) |ON…O–O…NO| =2NO2
thựcnghiệmchobiếtgiaiđoạnacótốcđộchậmnhất.Dođó:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
v=kC2 NO
VậyTốcđộphảnứngphụthuộcvào:
Nồngđộ(hayápsuất)chấtkhí
Nồngđộchấtlỏng
Diệntíchtiếpxúcgiữachấtrắnvớichấtkhívàvớichấtlỏng.
Bậcphản ứng: bậc phản ứng được tính bằng tổng số mũ lũy thừa của các nồng độ
các chất phản ứng trong phương trình vận tốc phản ứng.
dtk[H][Br]
0,5 22
Vídụ:Phảnứng: H2 + I2 = 2HI
cóphươngtrìnhvậntốcphảnứng:
V=-K[H2][I2]
nêncóbậcphảnứngbằng2
Đốivớiphảnứngphứctạp,bậcphảnứngcóthểlẻ.
Vídụ:Phảnứng: H2 + Br2 =2HBr khimớibắtđầuphảnứng,cóphươngtrìnhvậntốc: nêncóbậcphảnứngbằng1,5.
Sựsuybiếncủabậcphảnứng Đối với phản ứng có bậc xác định, nếu phản ứng được tiến hành trong điều kiện một haymộtsốnồngđộnàođólàhằngsốhoặcxấpxỉlàhằngsốthìnhữngnồngđộnàyđược nhậpluônvàohằngsốtốcđộkcủabậcphảnứngvàtrởthànhk’.Trongtrườnghợpnày bậcn củaphản ứngsẽ giảmvàtrởthànhn’.n’bằngtổngnồngđộ cácsố mũ củanhững nồngđộcònlại.Tanóicósựsuybiến(sựgiảm)củabậcphảnứng.
Thí dụ : Phản ứng thủyphân đường sacarozơ ( đường mía) với sự có mặt ion H+ làm xúctác. C12H22O11 + H2O = C6H12O6 + C6H12O6
Sacarozơ glucozơ fructozơ
Thựcnghiệmchobiếtphảnứngnàycóbậc1đốivớisacarozơ
V=k[C12H22O11][H2O][H+]
[] [] dA vkA d
[] [] dA kd A
phảnứngdođónồngđộcủanólàhằngsố.Khiđóbiểuthứctốcđộphảnứngđượcviết:
v=k’[C12H22O11] với k’= k[H2O][H+] const
Vậyphảnứngtrởthànhcóbậc1.Tanóibậc1nàylàbậc1biểukiếnhaybậc1giả.
Biểuthứcđộnghọccủaphảnứng:
+Phảnứngbậc1 A sảnphẩm
Khithay[A]=C,nồngđộbanđầu[A0]=C0 .Lấytíchphânđược:
+ Phản ứng bậc 2
Phảnứngbậchai,vídụdạng: 2A sảnphẩm
cóbiểuthứcđộnghọc:
2 [] 2 [] dA kd A
2 o
kt CC
2 o k CC
111
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
CHƯƠNGII CÂNBẰNGHÓAHỌC
II.1.MỘTSỐKHÁINIỆM
HóaĐạiCương
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
-Trạngtháinàykhôngthayđổitheothờigiannếukhôngcóđiềukiệnbênngoài nàothayđổi.
-Khithayđổicác điềukiệnbênngoàithìtrạngtháinàythayđổi,nhưngkhoicác điềukiệnbanđầuđượctáilậpthìtrạngtháibanđầucũngđượcthiếtlậplại.
1.1. Phản ứng một chiều: làloạiphảnứng,trongđiềukiệnxácđịnh,chỉxảyratheo mộtchiềuxácđịnh,khôngthểxảyratheochiềungượclại.Vídụkhiđunnóng,kali cloratxảyraphảnứng:
2KClO3 2KCl + 3O2
Chođếnnay,chưaaithựchiệnđượcchiềunghịchcủaphảnứngnày. Dochỉxảyratheochiềunênmộtđặcđiểmquantrọngcủaphảnứngmộtchiềulàcóthể tiếnhànhhoàntoànđếntậncùng,tứclàcóhiệusuất100%.
1.2.Phản ứng thuận nghịch: làloạiphảnứng,trongđiềukiệnxácđịnh,cóthểđồng thời xảyratheocảchiềuthuậnvàchiềunghịch.Vídụkhiđunnóngởnhiệtđộxácđịnh hydrovàiodcóthểkếthợpthànhioduahydro:
H2+ I2 2HI
vàcũngtrongnhữngđiềukiệnnhưvậyioduahydrolạibịphânhủythànhhydrovàiod :
2HI I2 + H2
Dotínhchấtthuậnnghịchnênmộtđặcđiểmquantrọngcủaphảnứngthuậnnghịchlà khôngxảyrađếnhoàntoàn.Saumộtthờigiantiếnhành,phảnứngthuậnnghịchđạttới mộttrạngtháitạiđóvậntốchaiphảnứngthuậnvànghịchbằngnhau,nồngđộcácchất khôngthayđổinữa,đólà trạng thái cân bằng hóa học. Cácphảnứngthuậnnghịchđượcbiểudiễnbằngphươngtrìnhvớihaimũitênngược chiềunhau: H2+ I2 2HI
1.3. Trạng thái cân bằng hóa học :làtrạngtháicủahệphảnứnghóahọckhicótốcđộ phảnứngthuậnbằngtôcđộphảnứngnghịchvàtỉlệlượngchấtgiữacácchấtphảnứng vớisảnphẩmphản ứnglàkhôngthayđổiởnhữngđiềukiệnbênngoàinhấtđịnh.
Những đặc trưng của trạng thái cân bằng hóa học:
-Dùđitừphíanàolạiđểđạttrạngtháicânbằng(ởcùngđiềukiệnbênngoàinhư nhau)thìtrạngtháinàycũngchỉlàmộtmàthôi.
II.2
ĐỊNHLUẬTGULBERGVÀHẰNGSỐCÂNBẰNG
ĐịnhluậtGulberg–Waagelàđịnhluậttácdụngkhốilượngchỉápdụngchotrạngthái cânbằngcủacácphảnứngthuậnnghịch. Địnhluậtnàyđượcphátbiểunhưsau: Khi một hệ đồng thể đạt đến trạng thái cân bằng thì tích số nồng độ của các sản phẩm phản ứng với số mũ là các hệ số tỉ lượng tương ứng chia cho tích số nồng độ của các chất phản ứng với số mũ là các hệ số tỷ lượng tương ứng luôn luôn là một hằng số ở một nhiệt dộ nhất định
Với phảnứng
aA + bB cC + dD
ĐịnhluậtGuldberg–Waageviếtdướidạngbiểuthức:
Trongđó[C],[D]lànồngđộtạitrạngtháicânbằngcủacácchấtsảnphẩm C,D. [A],[B]lànồngđộtạitrạngtháicânbằngcủacácchấtđầuA,B. Cácchấtnàyởcùngmộtpha(chấtkhíhaychấttantrongdungdịch)
a,b,c,dlàhệsốtỷlượngtươngứngcủacácchấttrongphảnứngtrên.
Kcb là hằng số cân bằng củaphảnứng.
Hằngsốcânbằnglàmộtđạilượngchỉphụthuộcvàobảnchấtcủaphản
ứngvànhiệtđộ.
Khisửdụngnồngđộphântửgamthìhằngsốcânbằngđượcgọilà hằng số cân bằng nồng độ vàkýhiệuKC .
CC K CC
cd CD C ab AB
TrongđóCA,CB,CCvàCD lànồngđộphântửgamtạitrạngtháicânbằngtươngứng
củaA,B,CvàD.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
Cònkhisửdụngápsuấtthìhằngsốcânbằngtínhđượclà hằng số cân bằng áp suất vàkýhiệulàKP
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
CoicáckhíA,B,CvàDlàkhílýtưởng.CôngthứcliênhệgiữaPvàCcủakhílý
tưởnglà: P=CRT
Trongđó:
TrongđóPA,PB, PC vàPD làápsuấtriêngphầnlúccânbằngtươngứngcủacácchất khíA,B,C,vàDtínhtheoatm.
Chúngtacóthểtínhhằngsốcânbằngnồngđộvàápsuấtcủacácchấtbằng cáccông thức
Vídụ1:Phảnứngtổnghợphydroioduaxảyratrongmộtbìnhkín cóthểtích0,5lít:
H2 (k)+ I2(k) 2HI(k)
Biếthằngsốcânbằngnồngđộởnhiệtđộ356oCbằng64.
a)Hãytínhnồngđộ cácchấtlúccânbằngở356oCnếubanđầu chúngtachovàobình
1molI2 và1molH2
b)Nếusaukhicânbằngđãđượcthiếtlậpchúngtathêmvàobìnhphảnứng1molH2 thìnồngđộcácchấtsẽthayđổinhưthếnào.
Cáchtínhnồngđộcủachấttrongcôngthức
Chấtởthểkhícóthểbiểudiễnbằngnồngđộphântửgam(mol/lit)haybằngápsuất riêngphầncủacácchất(atm).
b)Chấttrongdungdịch thìchỉbiểudiễnbằngnồngđộphântửgam(mol/lit)
c)Chất ởthểrắnvàchấtởthểlỏng:Phảnứngchỉxảyratrênbềmặtphânchiacủa chấtnênnồngđộcủachúngkhôngđổitheothờigian.Nồngđộcủacácchấtởthểrắnvà
ởthểlỏngđượcchuyểnvàohằngsốcânbằngnênkhôngcómặttrongcôngthức
Vídu2:Hãythiếtlậpcáccôngthứctínhhằngsốcânbằngcủacácphảnứng:
Cgrafit +O2 (k) CO2 (k)(*)
2H2 (k) +O2 (k) H2O(l)(**)
BaCl2.aq +Na2SO4.aq BaSO4 (r)+2NaCl.aq(***)
MốiquanhệgiữaKC vàKP .
Xét phảnứngthuậnnghịch:
aA(k)+bB(k) cC(k)+dD(k)(*)
Plàápsuấtcủakhí(atm),Clànồngđộmolcủakhí(mol/lit), Rlàhằngsốkhí(0,082lít.atm/mol.K),Tlànhiệtđộcủakhí(K).
Thaycácgiátrịápsuất củacácchấtkhí vàophươngtrìnhKP ởtrênđược: KP =Kc(RT)n
Trongđó n=(c+d)–(a+b)vớia,b,c,dlàhệsốtỷlượngcủacácchấttrong phươngtrình(*).
Ví du 3 : Tại 3750C Phản ứngthuận nghịch N2(k) + 3H2(K) 2NH3(k) có giá trị hằngsốcânbằngKP =4,3.10-4.TínhKc.
II.3.HỆTHỨCLIÊNHỆGIỮAHẰNGSỐCÂNBẰNGVÀBIẾNTHIÊNTHẾ ĐẲNGNHIỆT-ĐẲNGÁPCỦAPHẢNỨNG
Trongđiềukiệnnhiệtđộvàápsuấtkhôngđổi,biếnthiênthếđẳngápcủaphảnứng: aA(k)+ bB(k) cC(k)+dD(k)
đượctínhbằngcôngthức TrongđóPA,PB,PC,PD làápsuấtriêngphầncủacácchấtA,B,C,Dởđiềukiệnbất kyđangxét. Go T làbiếnthiênthếđẳngápcủaphảnứngthuậnởđiềukiệntiêuchuẩnở
nhiệtđộT.
Khihệđạtđếncânbằng Gpư=0,côngthức trởthành:
Rútratừ côngthức: 0 ln Tp GRTK
Côngthứctrênlàhệthứcliênhệgiữabiếnthiênthếđẳngáptiêuchuẩnvàhằngsốcân bằng ápsuất.
Kếthợp GT 0 = HT 0 -TST 0 đượcbiểuthứcliênhệgiữahằngsốcânbằng,nhiệt phảnứng vàbiếnthiênentropicủaphảnứngởđiềukiệntiêuchuẩn:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Cácbiểuthứcphảnánhmốiliênhệgiữacácđạilượngnhiệtđộng
Tvànồngđộcácchấttrong phảnứng.
Vídụ4:Chophảnứng
2NO2(k) N2O4(k)
có 0 298,tt (kJ/mol) 33,85 9,66
S0 298(J/mol.K) 240,4 304,3
Hãyxemxétởđiềukiệntiêuchuẩnở25oCphảnứngcótựxảyrahaykhông?Nếuxảy rathìhiệusuấtcủaphảnứngsẽlàbaonhiêu?
Hãyxácđịnhchiềucủaphảnứngở250CkhicácápsuấtriêngphầnbanđầucủaNO2 là 0,1atmvàN2O4 là0,9atm.
Chúý: Các biểu thức trên áp dụng được cho phản ứng có các chất nằm trong dung dịch. Trong trường hợp này chúng ta dùng nồng độ mol thay cho áp suất riêng phần và dùng hằng số cân bằng nồng độ (KC) thay cho hằng số cân bằng áp suất (KP).
II.4.SỰCHUYỂNDỊCHCÂNBẰNG:
Khi thay đổi một trong các điều kiện bên ngoài (áp suất, nhiệt độ , nồng độ các chất…) thìtrạngtháicânbằngsẽbịthayđổidotốcđộcủacácphảnứngthuậnvànghịch dướitácdụngcủasựthayđổisẽbiếnđổikhácnhau.Tuynhiênsaumộtthờigianhệcũng sẽđạtđếntrạngtháicânbằngmớivớinhữngđiềukiệnmới.
Sự thay đổi trạng thái cân bằng khi thay đổi điều kiện bên ngoài được gọi là sự chuyển dịch cân bằng
4.1. NguyênlýLeChatelier
Khi tác dụng từ ngoài vào hệ, đang ở trạng thái cân bằng, bằng cách thay đổi một thông số trạng thái nào đó (áp suất, nhiệt độ , nồng độ các chất…) quyết định vị trí cân bằng, thì vị trí cân bằng của hệ sẽ dịch chuyển về phía làm giảm hiệu quả tác dụng đó.
4.2.Ảnhhưởngcủaápsuất
Đối với hệ cân bằng của các chất khí khi tăng áp suất của hệ thì cân bằng sẽ
chuyển dịch về phía làm giảm áp suất,tức là phía tạo ít phân tử khí hơn và ngược lại
Vídụ1:Trạngtháicânbằngcủaphảnứng
I2(k) + H2(k) = 2HI(k)
khôngbịthayđổikhithayđổiápsuấtbênngoàivìtổngsốmolcủacácchấtđầubằng tổngsốmolcủacácchấtsảnphẩmphảnứng.
Vídụ2:Vịtrícânbằngcủaphảnứng
2CO(k) + O2(k) =2CO2(k)
sẽdịchchuyểntheochiềuphảnứngthuậnkhichúngtatăngápsuấtbênngoàivìtổng sốmolcủacácchấtđầulớnhơntổngsốmolcủacácchấtsảnphẩmphảnứng.
4.3.Anhhưởngcủanhiệtđộ
Đối với hệ cân bằng, nếu tăng nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều thu nhiệt. Ngược lại, nếu giảm nhiệt độ cân bằng sẽ chuyển dịch theo chiều phát nhiệt
Vídụ:Phảnứngthuậnnghịch
2NO2(k) N2O4(k) 0 298,pư =-58,04kJ
Khilàmlạnhhệthìvịtrícânbằngcủaphảnứngsẽdịchchuyểntheochiềuphảnứng thuậntạothànhkhíN2O4(khôngmàu),ngượclại,khiđunnónghệthìvịtrícânbằngcủa phảnứngsẽdịchchuyểntheochiềuphảnứngnghịchtạothànhkhíNO2 (màunâu).
4.4.Anhhưởngcủanồngđộcácchất
Đối với hệ cân bằng,nếu tăng (hay giảm) nồng độ của một chất thì cân bằng sẽ chuyển dịch về phía làm giảm ( hay tăng) nồng độ chất đó
Vídụ:Ở250Cphảnứng
2NO2(k) N2O4(k) G0 298,pư =-5,443kJ
Nằmởtrạngtháicânbằngkhiápsuấtriêngphầncủa khíNO2 là0,33atmvàcủakhí N2O4 là1atm.Chobiếtphảnứngsẽxảyratheochiềunàokhităngápsuấtriêngphần củakhíNO2 lên1atm.ChobiếtKP =9,0ở250C.
Giải:Ápdụngcôngthức:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Chương3:Dungdịch
III.1Kháiniệmvềdungdịch
Trong các chương trước, đối tượng nghiên cứu của chúng ta là các chất hóa học nguyên chất. Trong thực tế, không phải bao giờ các chất cũng tồn tại và được sử dụng ở dạng nguyên chất mà thường là ở dạng hỗn hợp với một hay một số chất khác. Sự có mặt của các chất này sẽ làm ảnh hưởng đến tính chất của chất được nghiên cứu, và đôi khi tạo cho nó những tính chất mà ở dạng nguyên chất nó không có được. Chẳng hạn, phản ứng của HCl khí với các chất khác chỉ sử dụng rất ít, trong khi dung dịch HCl (HCl hòa tan trong nước) lại được sử dụng rộng rãi, phần lớn các phản ứng của HCl với các chất khác xảy ra trong dung dịch.
Như vậy, việc nghiên cứu các chất trong trạng thái hỗn hợp với các chất khác có vai trò rất quan trọng.
1.1Hệphântán
Các hệ trong đó có hai hay nhiều chất phân bố đều vào nhau được gọi là hệ phân tán. Trong đó, chất quyết định dạngtồn tại của hệ (rắn, lỏng, haykhí) được gọi là môi trường phân tán,cácchấtcònlạigọilà chất phân tán.Trongtrườnghợpcácchấtởcùngmộtdạng tồntạithìchấtnàocókhốilượnglớnhơnsẽđóngvaitròmôitrườngphântán.
Cáchệphântáncóthểthuộcmộttrongcáckiểusau:
Loạihệphântán Vídụ
Khí-khí Khôngkhí
Khí–lỏng Khôngkhítrongnước
Khí–rắn HiđrotrongPt(hoặcPd…)
Lỏng–lỏng Xăng
Lỏng- khí Nướctrongkhôngkhí
Lỏng–rắn Thủyngântrongvàng
Rắn–lỏng Nướcđường,nướcmuối
Rắn–rắn Kẽmtrongđồng,hợpkim
Rắn–khí Naptalentrongkhôngkhí
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Tính chất của hệ phân tán phụ thuộc rất nhiều vào kích thước của chất phân tán. Trong trường hợp môi trường phân tán là chất lỏng, dựa vào kích thước hạt phân tán người ta phânloạicáchệphântánthành:
Hệ phân tán thô hay thể lơ lửng:
Là hệ mà chất phân tán có kích thước hạt > 10-5cm, có thể nhìn thấyhạt phân tán bằng mắtthườnghaykínhhiểnvi.
-Đượcchialàmhailoại:
Huyền phù: Pha phân tán là chất rắn, môi trường phântánlàchấtlỏng
VD:Phùsaởcácsông.
Nhũ tương: pha phân tán và môi trường phân tán đềulàchấtlỏng.
VD:Cáchạtmỡlơlửngtrongsữa.
Cáchệnàykhôngbềndokíchthướchạtlớnvàtheothờigiansẽtáchlớp
Các hệ phân tán cao hay các hệ keo:
Là hệ mà chất phân tán có kích thước hạt khoảng10-7 đến 10-5cm (vd: gelatin, keo dán, sương mù, khói… Hệ keo cũng không bền vì các hạt keo có thể kết hợp lại thành hạt lớn hơnvàlắngxuống.
Dung dịch phân tử
Là hệ mà kích thước hạt phân tán < 10-7cm , tức cỡ kích thước phân tử. Hệ nàythường đượcgọitắtlàdungdịch.Chấtphântántrongdungdịchtồntạiởdạngphântử,nguyêntử hayion.Hệnàylàhệđồngthể,tồntạibềnvững. (vd: nước đường, nước muối)
1.2Dungdịch: Định nghĩa dung dịch là hệ đồng thể gồm 2 hay nhiều chất mà thành phần của chúng có thể thay đổi trong giới hạn rộng.
Trong thực tế nhiều khi việc phân biệt chất tan và dung môi gặp nhiều khó khăn vì cho đếnnayvẫnchưacótiêuchuẩnrõràngvàtổngquátđểđánhgiáchúng.
Cácchấttrongdungdịchcóthểđóngvaitrò chất tan hayvaitrò dung môi.
Theoquyước:nếudungdịchgồmchấtrắnhaychấtkhíphântántrongchấtlỏngthìchất rắnhaychấtkhílàchấttan,cònchấtlỏnglàdungmôi.Dungdịchgồmhaichấtlỏngphân
tánvàonhauthìchấtnàonhiềuhơnchấtđólàdungmôi.Vídụ:dungdịchH2O–C2H5OH,
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
ởnồngđộrượuthấpthìnướclàdungmôi,alcoletyliclàchấttan,cònởnồngđộrượucao thìalcoletyliclàdungmôi,nướclàchấttan.
Các loại dung dịch: Tùy thuộc vào trạng thái tập hợp các dung dịch có thể là khí, lỏng hayrắn.
Dung dịch gồm hai haynhiều chất khí phân tán vào nhau gọi là dung dịch khí. Ví dụ: khôngkhílàdungdịchkhícủanitơ(chiếm78%thểtích)vàoxi(20%),cáckhítrơ,CO2, hơi nước …(2%)hòa tan tương hỗ vào nhau. Dung dịch khí có áp suất chung bằng tổng ápsuấtriêngphầncủacáckhítạothành.
Dung dịch rắn cóthểđượctạothànhdosựhòatancácchấtrắn,lỏnghaykhívàotrong chấtrắn.Trongquátrìnhtạothànhdungdịchrắn,cáctiểuphânchấttanđãxâmnhậpvào mạngtinhthểcủadungmôitạothànhphatinhthể,trongđótỉlệgiữacácchấtcóthểthay đổimàvẫnđảmbảotínhđồngnhấtcủaphanày.
Vídụ:Cáchợpkimcủavàng–bạc(từ100%bạcđến100%vàng),thépkhônggỉ( 18%crom,9%nikenvà0,1%cacbontrongFe),hợpkimcủahidro–paladi(Khíhidro tantrongkimloạirắnpaladi)…
Dung dịch lỏng đượctạothànhdosựhòatancácchấtrắn,lỏnghaykhívàodungmôi lỏng.Ví dụ: nướcbiển
III.2Dungdịchlỏng
2.1 Quá trình hình thành dung dịch Sựtạothànhdungdịchlàquátrìnhtựdiễnradokếtquảtươngtácgiữacactiểuphân chấttanvàdungmôi.Nhữnglựctươngtácgiữacáctiểuphânchấttanvàdungmôicũng chínhlànhữnglựctươngtácquyếtđịnhtrạngtháitậphợpcủadungdịch.Chúngcóbản chấtvậtlý(nhưlựchúttĩnhđiện,lựcvanderwaals,tươngtáclưỡngcực-ion)vàhóa học(tươngtáccho–nhận,lựcliênkếthidro)
- Gồmcó2quátrình:
Quátrìnhvậtlý:sựphávỡmạngtinhthể,sựkhuếchtánvàodungmôicủachấttan
sự chuyển pha, quá trình thu nhiệt
Quátrìnhhóahọc:sựtạothànhhợpchấtcóthànhphầnthayđổigiữacáctiểuphânchất tan và dung môi sự sonvat hóa, quá trình phát nhiệt (nếu dung môi là nước thì sự sonvat hóa được gọi là sự hidrat hóa. Các hợp chất được tạo thành trong quá trình sonvat hóahayhidrathóađượcgọilàcác sonvat haycác hidrat.)
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
2.2 Quá trình hòa tan và cân bằng hòa tan Khảosátsựhòatanchấtrắnvàodungmôinước:cóthểbaogồm2quátrìnhngượcnhau xảyrađồngthời:
Quátrìnhhòatan:táchcáctiểuphânchấttanrakhỏitinhthểchấttanvàphânbốchúng vàodungmôi. (nếu như không có quá trình ngược lại xảy ra là sự kết tủa thì sự hòa tan sẽ cứ tiếp diễn cho đến khi toàn bộ tinh thể chất A hòa tan hết dù lượng của nó ít hay nhiều)
Quátrìnhkếttủa:kếttủacáctiểuphânchấttantrongdungdịchlênbềmặttinhthểchất tan.
Theo thời gian tốc độ quá trình hòa tan ngàycàng giảm dần, ngược lại tốc độ quá trình kết tủa ngày càng tăng dần. Khi tốc độ của 2 quá trình này bằng nhau thì hệ sẽ đạt được trạngtháicânbằnghòatan TinhthểchấtA A.nH2O(dd)
Cânbằnghòatanlàcânbằngđộng,khiđượcthiếtlậpthìchấttantừđóthựctếkhôngtan thêmđượcnữa.
2.3 Sự thay đổi các tính chất nhiệt động khi tạo thành dung dịch Vìsựtạothànhdungdịchlàquátrìnhtựdiễnra,khiđóđộnglựccủaquátrìnhnàylàsự giảmthếđẳngápcủahệ,nghĩalà:
∆Ght =∑∆Gsp -∑∆Gcđ <0
Khiquátrìnhhòatankếtthúc,nghĩalàhệđạttrạngtháicânbằnghòatanthì:∆Ght =0
Mặt khác, biến thiên thế đẳng áp liên hệ với các yếu tố entanpy và yếu tố entropy theo biểuthứcsau: ∆G=∆H-T∆S
Từ đây có thể thấy rằng quá trình hòa tan cũng có liên quan với biến thiên entanpy và
biếnthiênentropy ∆Ght =∆Hht -T∆Sht
Vìquátrìnhhòatanbaogồm:quátrìnhchuyểnpha(quátrìnhvậtlý)vàquátrìnhsonvat hóa(quátrìnhhóahọc)nên:
∆Hht =∆Hcp +∆Hs
∆Sht =∆Scp +∆Ss
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Nhưvậy,cânbằnghòatanphụthuộcvàodấuvàđộlớncủa∆Hvà∆Scủahaiquátrình: quátrìnhchuyểnphavàquátrìnhsonvathóa.Sựphụthuộcnàykháphứctạp,tùytheomối quanhệgiữa∆Hht và∆Sht.Taxétvàitrườnghợpđiểnhình: a. Quá trình hòa tan chất rắn trong chất lỏng:
- Vì ∆Scp của chất rắn luôn dương và có trị tuyệt đối lớn hơn nhiều so với trị tuyệt đối của∆Ss (∆Ss <0doquátrìnhsonvathóalàmgiảmđộhỗnloạncủahệ)nên ∆Sht,rắn > 0
- Dosựphávỡmạnglướitinhthểvànănglượngkhuếchtáncáctiểuphânratoànbộthể
tích dung dịch đòi hỏi phải cung cấp năng lượng nên các quá trình nàythu nhiệt nghĩa là
∆Hcp,rắn > 0
Quátrìnhsonvathóaluônphátnhiệt,nên ∆Hs < 0
Dođó: +Nếu
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
a. Nồng độ khối lượng:
Nồngđộphầntrăm: lượng chất tan có trong 100g dung dịch. (%)
Trongđó: a:làkhốilượngchấttan
b:làkhốilượngdungmôi
Ví dụ: TínhnồngđộdungdịchHClthuđượckhi cho30gaxitHClnguyênchấtvào70g nước?
Loạinồngđộnàyđượcsửdụngrộngrãitrongsảnxuấtvàthươngmại.
Nồngđộmolan: số mol của chất tan có trong 1kg hay 1000g dung môi.
:quátrìnhhòatanthunhiệt. +Nếu
thì
thì
:quátrìnhhòatanphátnhiệt.
b. Quá trình hòa tan chất khí trong chất lỏng:
- Vì∆Scp <0(dosựgiảmthểtích)vàquátrìnhsonvatlàmgiảmđộhỗnloạncủahệ(∆Ss <0)nên ∆Sht, khí < 0
- Quátrìnhchuyểnchấtkhísangtrạngtháihòatanlàquátrìnhngưngtụ,luônluônphát
nhiệtnên∆Hcp,khí <0.
Quátrìnhsonvathóaluônphátnhiệt,nên ∆Hs < 0.
Dođó: ∆Hht,khí < 0:quátrìnhhòatankhívàolỏngluônluônphátnhiệt.
Tacó: ∆G= ∆H -T∆S, nhưvậykhi nhiệtđộtăng,∆Gsẽdươnghơnnên độtancủakhí giảm.Điềunàyphùhợpvớithựcnghiệm:độtancủachấtkhígiảmkhinhiệtđộtăng.
Tómlại,quátrìnhhòatancácchấttrongchấtlỏngđểtạothànhdungdịchcóthểthuhay phát nhiệt. Lượng nhiệt thu vào hay thoát ra khi hòa tan 1 mol chất tan được gọi là nhiệt hòa tan.
2.4 Nồng độ dung dịch và các phương pháp biểu diễn nồng độ
- Đặctrưngquantrọngnhấtcủamọidungdịchlànồngđộ.
- Nồng độ dung dịch là lượng chất tan có trong một đơn vị khối lượng hay một đơn vị thể tích dung dịch hay dung môi.
- Có nhiều phương pháp biểu diễn nồng độ của dung dịch và có thể chia làm ba nhóm:
nồngđộkhốilượng,nồngđộthểtíchvànồngđộkhôngcóđơnvị.
(m)
Trongđó: n:sốmolchấttan
b:khốilượngdungmôi(g)
Ví dụ: Nếutrong1000gnướccóchứa360gglucozơ(C6H12O2)thìdungdịchcónồngđộ molanlàbaonhiêu?
V n C M
Loạinồngđộnàythườngđượcdùngđểphachếcácdungdịchsửdụngtrongnhữngthí nghiệmhóalýchínhxác.
b. Nồng độ thể tích:
Nồngđộmol(haynồngđộphântửgam): số mol chất tan có trong 1 lít dung dịch.
Trongđó: n:làsốmolchấttan
V:thểtíchdungdịch(lit)
Ví dụ: Hòatanhoàntoàn4gNaOH(rắn)vàonướcthìthuđược1lítdungdịchNaOHcó nồngđộbaonhiêu?
Loạinồngđộnàytiệnlợihơnkhicầntínhtoánthểtíchdungdịchcácchấtphảnứngtheo phương trình hóa học, nhất là khi các dung dịch của chúng có nồng độ phân tử gam bằng nhau.
Nồngđộđươnglượng: số đương lượng chất tan trong 1 lít dung dịch.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
Đượcbiểudiễnbằng: Số đương lượng gam chất tan có trong 1 lít dung dịch.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Ví dụ :
- Xét phản ứng 1: NaOH+HCl →NaCl+H2O
40gamNaOHphảnứngvới36,5gamHCltạosảnphẩm,
nghĩa là: 1mol HCl (36,5 gam) khi phản ứngtươngđươngvới 1 mol nguyên tửH đượcthaythế.
Trongđó: CN:nồngđộđươnglượnggam(N) ;m:khốilượngchấttan(gam)
V:thểtíchcủadungdịch(lít) ;v:thểtíchcủadungdịch(ml)
n’:sốđươnglượnggamchấttan(đlg); N:đươnglượnggamchấttan(g)
Ví dụ :dung dịch H2SO4 1N có chứa 1 đương lượng gam H2SO4 trong 1 lít dung
dịch(1đươnglượnggamH2SO4 tươngứngvới98/2=49gH2SO4)
Đươnglượnggam
Đương lượng gam (N) của một chất là lượng chất đó tính bằng gam khi phản ứng tương đương (kết hợp hay thay thế) 1 mol nguyên tử hidro (1,008g).
Như vậy:Đươnglượnggamcủa1chất phụ thuộc vàophảnứngmànóthamgia.
Đương lượng gam của một đơn chất: bằng khối lượng mol nguyên tử của nó
chia cho hóa trị.
Ví dụ :- Xét phản ứng 1: H2 +½O2 →H2O
16gamoxikếthợpvới2molnguyêntửHidrotạoH2O
Vậy:1đươnglượnggam(N)củaoxi=½.16=8gam
- Xét phản ứng 2: Mg+2HCl →MgCl2 +H2
24gamMgthaythế 2molnguyêntửHidrotạoMgCl2
Vậy:1đươnglượnggam(N)củaMg=½.24=12gam.
Đương lượng gam của một hợp chất tham gia phản ứng trao đổi: bằng
khối lượng mol phân tử của nó chia cho số điện tích dương hay âm mà phân tử chất
đó đã trao đổi.
VậyNNaOH=40g; NHCl=36,5g
- Xét phản ứng 2: 3NaOH+H3PO4 →Na3PO4+3H2O
1molH3PO4khiphảnứngtươngđươngvới3molnguyêntửH.
Vậy:NH3PO4=98/3g;NNaOH=40g
Đương lượng gam của một hợp chất tham gia phản ứng oxi hóa khử:
bằng khối lượng mol phân tử nó chia cho số electron mà phân tử chất đó đã cho hay nhận.
Ví dụ : +2 +7 +3 +2
10FeSO4+2KMnO4 + 8H2SO4→5Fe2(SO4)3 +2MnSO4 +K
1molKMnO4nhận5molelectron(tươngđương5molnguyêntửHidro)
ĐỊNHLUẬTĐƯƠNGLƯỢNG
“Các chất hóa học (đơn chất, hợp chất) phản ứng với nhau theo cùng 1 số đương lượng gam”
VA .CN(A)=VB.CN(B)
Với VA:thểtíchddchấtA,cónồngđộđươnglượngCN(A)
VB:thểtíchddchấtB,cónồngđộđươnglượngCN(B)
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
c. Nồng độ không có đơn vị:
Nồng độ phần mol (Ni): tỉ số giữa số mol của một chất nào đó (ni) trên tổng số mol ( ni) của các chất trong dung dịch.
Tổngsốcácphầnmolluônluônbằng1đơnvị,nghĩalà N =1
Ví dụ: Giảsửcó2chất AvàBtanlẫnvàonhau. GọinA,nB lầnlượt làsốmol củaAvà
B.NồngđộphầnmolcủaAvàBtrongdungdịchđượctínhnhưthếnào?
Nồng độ molan và nồng độ phần mol không phụ thuộc vào nhiệt độ (khác với nồng độ mol.l-1 và nồng độ đương lượng gam.l-1) nên được dùng nhiều trong việc tính toán hóa lí chínhxác.
HệthứcliênhệgiữaC%;CM ;CN vàCm
Với D:Khốilượngriêngdungdịch(g/ml)
CN =aCM (*)
Lưu ý: cách xác định a trong công thức (*)
- Với một axit hay bazơ: a là số ion H+ hay OH‾ của 1 phân tử axit hay 1 phân tử bazơ thực tế tham gia phản ứng trao đổi.
- Với một chất tham gia phản ứng oxi hóa khử: a là số electron mà một phân tử chất khử
cho hay một phân tử chất oxi hóa nhận.
- Với một muối: a là tổng số điện tích dương hay âm của muối.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Ví dụ 1: Ca(OH)2 +2H3PO4 =Ca(H2PO4)2 +2H2O
KhiđómỗiphântửH3PO4 traođổi protonH+,dođóa=
MỗiphântửCa(OH)2 traođổi nhómOH‾,dođóa=
Ví dụ 2: 2KMnO4 +5H2O
ĐốivớiKMnO4 cóa=
ĐốivớiH2O2 cóa=
Ví dụ 3: Fe2(SO4)3 +6NaOH=2Fe(OH)3 +3Na2SO4
ĐốivớiFe2(SO4)3 cóa=
ĐốivớiNaOHcóa=
2.5 Độ tan và các yếu tố ảnh hưởng đến độ tan
a. Độ tan của các chất: - Dungdịchbãohòa:làdungdịchmàchấttankhôngthểtanthêmđượcnữaởđiềukiện (nhiệtđộ,ápsuất,…)xácđịnh.Dungdịchbãohòalàhệcânbằngthực(∆Ght =0).Nồngđộ củadungdịchtươngứngtrạngtháibãohòađượcgọilà nồng độ bão hòa
- Cácdungdịchcónồngđộnhỏhơnnồngđộbãohòađượcgọilànhữngdungdịchchưa bãohòa.((∆Ght <0)
- Cácdungdịchcónồngđộcao hơnnồngđộbãohòaởnhiệtđộvàápsuấtxácđịnhgọi lànhữngdungdịchquábãohòa.Dungdịchquábãohòalàhệcânbằnggiả.(∆Ght >0)
- Nồng độ chất tan trong dung dịch bão hòa ở những điều kiện nhất định gọi là độ tan củachấtđó.Độtancủamộtchấttrongnhữngdungmôikhácnhauhoặccủacácchấttrong cùngdungmôicóthểrấtkhácnhau.
Thựctế, độ tan thườngđượcbiểudiễnbằng số gam chất tan được trong 100g dung môi vàkíhiệulà S.
Ngườitaquyước:
S <0,01g 0,01g 1g 1g 10g >10g
Tính tan khôngtan khótan tan dễtan
b. Các yếu tố ảnh hưởng đến độ tan:
Ảnhhưởngcủabảnchấtchấttanvàdungmôi:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Qui tắc kinh nghiệm: chất tương tự tan trong chất tương tự. Điều này có nghĩa là: nếu dungmôi thuộc loạihợp chất cộnghóa trịkhôngcực haycócực yếusẽ hòatanmạnh các hợp chất không cực hay có cực yếu, hòa tan kém các hợp chất có cực mạnh và hầu như khônghòatancáchợpchấtion.Ngượclại,nếudungmôithuộcloạihợpchấtcócựcmạnh
sẽhòatancáchợpchấtcócựchayionvàíthòatancáchợpchấtkhôngcực.
Ví dụ: thựcnghiệmchothấyrằngphântửlưuhuỳnhkhôngcócựcnênlưuhuỳnhtantốt trongbenzen(dungmôikhôngcực)vàkhôngtantrongnước(dungmôiphâncực).Tráilại phântửmuốiănphâncựcmạnhnênmuốiăntantrongnướcvàkhôngtantrongbezen.
Ảnhhưởngcủaápsuất:
Áp suất ảnh hưởng không đáng kể đến độ tan của chất rắn hay chất lỏng, nhưng có tác
độnglớnđếnđộtancủachấtkhí.
ĐịnhluậtHenry: “Ở nhiệt độ không đổi, độ tan của chất khí tỷ lệ thuận với áp suất riêng
phần của nó”. Độtancủachấtkhítrongchấtlỏngtănglênkhităngápsuất.
S=K.P
Trongđó: S:độtancủachấtkhítrongchấtlỏng(gam/100gamdungmôi)
P:ápsuấtriêngphầncủachấtkhítantrênbềmặtdungdịch
K:hằngsốHenry(đặctrưngchomỗiloạidungdịch)
Chỉ đúng trong trường hợp khí tan không phản ứng với dung môi.
Ảnhhưởngcủanhiệtđộ:
Đa số các chất có độ tan tăng khi tăng nhiệt độ: NH4Cl, NH4NO3,… nhưng cũng có
những chất có độ tan giảm khi tăng nhiệt độ như: NaOH, KOH, Na2SO4, CaO, Ce2(SO4)3,…
Phầnlớnquátrìnhhòatanchấtkhívàotrongchấtlỏnglàquátrìnhphátnhiệt:
A(k) +D(l)
A(dd) ∆Hht <0
Dođókhităngnhiệtđộ,độtancủakhígiảm.(cân bằng chuyển dịch theo chiều nghịch)
Ảnhhưởngcủanhiệtđộđốivớiđộtancủacácchấtkhícóýnghĩaquantrọngvềmặtmôi trường.
III.3Dungdịchcácchấtđiệnli.Cânbằngđiệnlitrongdungdịch
3.1 Khái niệm về sự điện li, chất điện li và dung dịch điện li
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Sựphânlithànhioncủacácchấttantrongdungdịch(haykhinóngchảy)đượcgọilà sự điện li, còn chất phân li thành ion trong dung dịch (hay khi nóng chảy) được gọi là chất điện li.Dungdịchthuđượcgọilà dung dịch điện li. (Thuyết điện li của Arrhenius)
3.2 Cơ chế của sự điện li:
Quátrìnhđiệnlithựcralàmộtquátrìnhtươngtácphứctạpgiữadungmôivàchấttanđể
tạothànhcácion đượcsonvat hóa(hayhydrat hóa,nếudungmôi lànước).Cơchếcủasự
tươngtáctùythuộcbảnchấtcủachấtđiệnli.
Đối với hợp chất ion: Vídụxét NaCl. ỞtrạngtháirắnNaCl cấutạotừnhữngion Na+ vàCl sắpxếptạicácnútmạng.Khihòatanchúngvàomộtdungmôiphâncựcmạnhnhư nước,thìxảyratươngtácgiữacáciontrênbềmặttinhthểvớicácphântửdungmôiphân cực.
điệnli
Na+.xH2O Cl.yH2O
Quá trình tách các ion khỏi mạng lưới tinh thể và hyđrat hóa các ion.
Cựcdươngcủaphântửnướchướngvàoionâm (Cl)củaNaCltrongmạngtinhthể,còn cực âm của nước hướng vào các ion dương (Na+) của NaCl. Nếu năng lượng hút của các phântửnướclớnhơnnănglượngliênkếtcủamạngtinhthể,cácionsẽbịbứtrakhỏimạng tinhthể(trườnghợpNaCllànhưvậy).Sauđócácionbịhidrathóavàkhuếchtánvàodung dịch,tađượcdungdịchđiệnli.
Dođiệnli,dungdịchđồngthời chứacáciondươngvàâm,cáciontráidấuhút nhautạo thànhcácphântử,vìvậyquátrìnhđiệnliluônlà quá trình thuận nghịch.
Quátrìnhhòatanmuốicóthểbiểudiễnbằngphươngtrình:
Na+.xH2O+Cl‾.yH2O
NaCl+(x+y)H2O
Đối với hợp chất cộng hóa trị phân cực: VídụHCl.Quátrìnhđiệnlibaogồmquátrình ion hóa cácphântửphâncựcvà hydrat hóa cácion.CóthểbiểudiễnquátrìnhđiệnliHCl trongnướctheosơđồ:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Đầutiên,nhờtácdụngcủacácphântửdungmôilưỡngcựcmàcácphântửphâncựccủa chất tanbị kéo dài chođếnkhi bị đứtrathànhcácion, đồngthờixảyrasựhydrat hóacác ion.
CóthểbiểudiễnquátrìnhđiệnliHCltrongnướcbằngphươngtrình:
HCl+(x+y+1)H2O H3O+.xH2O+Cl‾.yH2O
Trongthựctế,khiviếtphươngtrìnhđiệnli,đểđơngiản,ngườitakhôngghicácphântử nước:
NaCl
Na+ +Cl‾
HCl+H2O
H3O+ +Cl‾ hayđơngiảnhơnnữa: HCl
H+ +Cl‾
Nhưvậy, quá trình điện li được coi là kết quả tương tác giữa chất tan và dung môi để tạo
thành không phải các ion tự do mà là những ion sonvat hóa. Tươngtácnàykháphứctạp, nhưng có thể nhận thấy một quy luật như sau: Nếu chất điện li phân cực càng mạnh và
phântửdungmôiphâncựccàngmạnhthìsựphânlixảyracàngmạnh.
Nướclàchấtphâncựcmạnhnênnướccótácdụngđiệnliđốivớirấtnhiềuchất.
Đối với các hợp chất vừa có liên kết ion vừa có liên kết cộng hóa trị có cực: Ví dụ
NaHCO3,thìsựphânliđầutiênxảyraởliênkếtion:
NaHCO3
Na+ +HCO
rồisauđómớixảyraởliênkếtcộnghóatrịcócựcmạnh:
HCO
H+ +CO
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
(0≤ ≤1)
Độđiệnliđượcbiểudiễnbằngphầnđơnvịhayphầntrăm.
Ví dụ: Trong1lítdungdịchCH3COOH0,1Mcó0,00136molCH3COOHđãđiệnlinên
Tùytheogiátrịcủa màngườitaphânbiệtchấtđiệnlimạnh,chấtđiệnliyếu.
Chất điện li mạnh: là chất khi hòa tanvàodung dịchhầunhư các phân tửhòa tanđều phân li ra ion (
≈ 1), có thể xem quá trình điện li của chất điện li mạnh là quá trình bất thuận nghịch, không tuân theo các quyluật cân bằng hóa học. Do đó phươngtrình điện li củachấtđiệnlimạnhđượcbiểudiễnbởidấu=haydấu
Ví dụ: HNO3 = H+ + NO3 -
KOH = K+ + OH-
NH4Cl = NH4 + + ClCácaxitmạnh,bazơmạnhvàhầuhếtcácmuốilàcácchấtđiệnlimạnh.
Theo lý thuyết chất điện li mạnh có
đođượcthườngnhỏhơn1 (độ điện li biểu kiến).Chỉkhidungdịchrấtloãngmới
= 1 (độ điện li thực). Nhưng bằng thực nghiệm giátrị
đođược
Đối với hợp chất không phân cực: chúng không phân li thành ion trong dung dịch. Ví dụ:đường,urê,…
3.3 Độ điện li
- Khái niệm
Quátrìnhđiệnli làquátrìnhthuậnnghịch:bêncạnhquátrìnhphânli chất tanthànhion
còn có quá trình các ion trái dấu hút nhau để tạo lại các phân tử ban đầu. Mức độ chuyển hóatrongquátrìnhnàyđượcgọilàđộđiệnli,đượckíhiệulà
Độđiệnli đượcđịnhnghĩalà: Là đại lượng đặc trưng cho mức độ điện ly của một chất, độ điện li là tỷ số giữa số mol chất tan đã điện li (n) trên tổng số mol chất tan đã hòa tan trong dung dịch (no).
= 1 (Đó là do trong dung dịch loãng, khoảng cách giữa các ion lớn, nên có thể bỏ qua sự tương tác tĩnh điện giữa các ion. Trong dung dịch đặc các ion gần nhau, nên có sự tương tác tĩnh điện giữa các ion làm giảm sự chuyển động tự do của các ion và được phản ánh ở giá trị
đo được.)
Chất điện li yếu: là chất điện li mà trong dung dịch không quá loãng (~0,1M) chỉ có một phầnnhỏ sốphântửhòatanbị điệnli thànhion, cònphầnlớntồn tạidướidạngphân tử không điện li. Quá trình điện li của chất điện li yếu là quá trình thuận nghịch và được biểudiễnbởidấu
Các axit hữu cơ, axit vô cơ yếu (HCN, H2CO3…) các bazơ vô cơ yếu (NH4OH), bazơ hữu cơ (amin..), một số muối axit và muối bazơ (NaHCO3, Cu(OH)Cl…) là những chất điệnlyyếu:
CH3COOH ⇌ CH3COO- + H+
NH4OH ⇌ NH4 + + OH-
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
- Những yếu tố ảnh hưởng đế độ điện li
-Độđiệnlyphụthuộcvào:
Bảnchấtchấttan
Bảnchấtdungmôi
Nồngđộvànhiệtđộ
Nồng độ ion cùng tên trong dung dịch, nó là ion
giốngvớiiondochấtđiệnliphânlira.
Đốivớicácaxit,bazơ,độđiệnlicònphụthuộcvào
pHcủamôitrường.
+Dungmôi
Phân tử dungmôi càng phân cực tác dụngion hóa của nó cànglớn.Trongnhữngdung
môithườngdùng,cótácdụngionhóalớnnhấtlànướcvàkémnhấtlàbenzen.
+Chấttan
Sựphânlisẽxảyratrướchếtởliênkếtionrồiđếnliênkếtcócựccókhảnăngchuyển
thànhliênkếtionvàkhôngxảyraởliênkếtcócựcyếuhoặckhôngcócực.
+Nồngđộ
Độđiệnlymộtchấttăngkhinồngđộcủanótrongdungdịchgiảmvàngượclại.
VD:ĐộđiệnlycủaaxitaxeticthayđổitheonồngđộCN nhưsau:
3.4 Cân bằng trong dung dịch chất điện li yếu và hằng số điện li
a. Hằng số điện li Đốivới chất điệnli yếu quátrìnhđiện li củachúngtrongdungdịchthực sựlàquátrình thuậnnghịch,nghĩalàtrongdungdịchcócânbằngđộnggiữacácphântửtrunghòavàion của nó xuất hiện. Chẳng hạn khi hòa tan chất điện li yếu AmBn vào nước chúng ta có cân bằng điện li:
Cânbằngđiệnlinàycũngtuântheođịnhluậttácdụngkhốilượng,nghĩalànóđượcđặc trưngđịnhlượngbằnghằngsốcânbằngKsauđây:
Kđượcgọilàhằngsốđiệnli.
Kcóđầyđủtínhchấtcủamộthằngsốcânbằng: không phụ thuộc nồng độ, chỉ phụ thuộc
bản chất của chất điện li và nhiệt độ.
Chấtđiệnlicàngmạnh,hằngsốđiệnliKcànglớnvàngượclại.
b. Liên hệ giữa độ điện li và hằng số điện li
XétchấtđiệnliyếuABcónồngđộlàC(mol/lit)vàđộđiệnli
cócânbằngđiệnli: AB
A+ + B
Bđ: C 0 0
Pli:
Cb: (1-
C
C
C
)C
C
HằngsốđiệnlicủachấtđiệnliABsẽlà:
C
Ioncùngtêntrongdungdịch
Ví dụ: CH3COOH
CH3COO + H+ mà trong dung dịch đã có sẵn ion
CH3COO thìđộđiệnlicủaCH3COOHsẽgiảmđi.
+Nhiệtđộ
Trongnhiềutrườnghợpvàtrongnhữngkhoảngnhiệtđộnhất định,độđiệnlytănglên khinhiệtđộtăng
<0,05(hay
<5%)thìcóthểxem (1-
)≈1, lúcđó: K=C.
C K
2 hay
(vớiK=const)
ở trên ta thấy: dung dịch càng loãng (nồng độ giảm), độ điện li
càng lớn.ĐóchínhlànộidungcủađịnhluậtphaloãngOztwall.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
4.1 Thuyết axit, bazơ
c. Chuyển dịch cân bằng điện li
GiảsửcómộtchấtđiệnliyếuAB: AB A+ +B
Nếu ta thêm vào dungdịch một chất điện li có ion cùngtên với các ion trongdungdịch
thìcânbằngsẽchuyểndịchsangtrái,độđiệnlicủaABgiảm.
Bài tập áp dụng: Hằng số điện li của CH3COOH là 1,8.10-5. Xét dung dịch CH3COOH 0,1M.
a.TínhnồngđộionH+ trongdungdịch.
b.Nếu thêm vào 1lít dung dịch trên 0,1mol muối CH3COONa thì nồng độ ion H+ sẽ là baonhiêu?Xemthểtíchdungdịchkhôngđổi.
Trongthực tế khái niệm “cân bằng” điện li khôngáp dụng cho các muối, các axit mạnh (HCl, HNO3, H2SO4,…) và các bazơ mạnh (NaOH, KOH, Ba(OH)2,…) vì các chất này điện li hoàn toàn trongdungdịch.Cânbằngtrongdungdịchcủacácchấtđiệnlikhótansẽ đượcxéttrongphần“Tíchsốtan”. d. Sự điện li nhiều nấc: Sự điện li của các đa axit và đa bazơ xảy ra theo nhiều nấc trong đó mỗi nấc
a) ThuyếtArrhenius
AxitlànhữngchấttrongnướcđiệnlychocationH+ vàaniongốcaxit
BazơlànhữngchấtđiệnlychoaniongốchyđroxylOH- vàcationgốcbazơ
Phảnứngtrunghòacủaaxitvớibazơchomuốivànước.
VD: HCl = H+ + Cl-
NaOH = Na+ +OH-
HCl + NaOH = NaCl + H2O
Cácmuốiđiệnlychoaniongốcaxitvàcationgốcbazơ:
VD: Na2SO4 = 2Na+ + SO4 2-
*Hạnchế:
Thuyếtaxit–bazơcủaArrênuytápdụngđúngchotrườnghợpdungmôilànướcnhưng khôngáp dụngđược cho các dungmôi khác. Mặt khác có nhiều phản ứng tạo nên muối giống như phản ứng trung hòa nhưng trong đó không có sự tham gia của ion H+ và ion OH- VD:KhíamoniactácdụngvớikhíHCltạothànhmuốiNH4Cltheophảnứng: NH3(k) + HCl(k) = NH4Cl(r)
KhíHClkhitantrongbenzentuykhôngphânlyraionH+ nhưngvẫnlàmđổimàuchất chỉthị
Những trườnghợp như vậy, thuyết Arrênuyt không giải thích được. Rõ rànglà cần có mộtlýthuyếtchunghơnnữavềaxit–bazơ.
b) ThuyếtprotoncủaBrönsted–Lowry
Năm1923gầnnhưđồngthờivớinhaunhàhóahọcĐanMạchlàBronsted(1879-1947) và nhà hóa học người Anh là Lowry(1874-1936) đã đưa ra một định nghĩa rộnghơn về axitvàbazơ: Axit là chất có thể cho proton và bazơ là chất có thể nhận proton. Bởivậy thuyết axit-bazơ của Bronsted và Lowryđược gọi là thuyết proton. Khi cho proton, axit AbiếnthànhbazơB: A ⇌ B + H+
Nếu một chất điện li theo nhiều nấc thì hằng số điện li tổng cộng bằng tích các hằng số
điệnlinấc:K=K1.K2…Kn III.4Cânbằngtrongdungdịchaxit,bazơ.ĐộpH.
Mỗi axit tương ứng với một bazơ liên hiệp B và mỗi bazơ B tương ứng với một axit liênhợpA.
Axit Bazơliênhợp(hiệp)
CH3COOH - H+ CH3COO-
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
NH4 + -H+ NH3
Bazơ Axitliênhợp
OH- + H+ H2O
HCO3 - + H+ H2CO3
HóaĐạiCương
Protonkhôngtồntạitựdo.Mộtchấtchỉthểhiệntínhaxitkhicómặtmộtbazơđểnhận
proton. Ngược lại, một chất chỉ thể hiện tính bazơ khi có mặt một axit để cho proton.
Thựcchấtcủaphảnứnggiữamộtaxitvớimộtbazơlàsựchuyểnproton.
VD1:CH3COOH + NH3 → CH3COO- + NH4 +
Axit bazơ
⇒ *CH3COOH/CH3COO- làmộtcặpaxit–bazơliênhợp
*NH4 +/NH3 làmộtcặpaxit–bazơliênhợpkhác
VD2: NH4 + + H2O → NH3 + H3O+
CH3COO- + H2O → CH3COOH + OH-
-Trongdungdịchnước,protonkếthợpvớimộtphântửnướctạothànhionoxoniH3O+
H+ + H2O = H3O+
Tùythuộcđiềukiệncụthể,mộtchấtcóthểlàaxithoặcbazơ:
VD: NH4 + + H2O(bazơ) → NH3 + H3O+
CH3COO- + H2O(axit) → CH3COOH + OH-
⇒ Nướcđượcgọilàdungmôilưỡngtính
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
trongđókhôngcómặtproton.Bởi vậy,đồngthời với thuyết proton, thuyết electroncủa Lewisrađời(năm1923).
TheoLewis:
Bazơlàchấtchocặpelectronđểtạothànhliênkếtcộnghóatrị
Axitlàchấtnhậncặpelectron.
Nhưvậytươngtácaxit-bazơlàsựtạothànhliênkếtcộnghóatrịkiểucho –nhận:
VD1: Bazơ axit
VD2: Bazơ axit
⇒ Như vậy ta thấy rằng thuyết electron của Lewis đã đưa thêm vào danh sách axit những hợp chất không chứa proton nhưng có đầy đủ những chỉ tiêu của axit. Tuynhiên nhược điểm chính của thuyết này là không giải quyết được vấn đề độ mạnh của axit và bazơnhưthuyếtArrênuytvàthuyếtBronsted–Lowry.
Như vậy khác với thuyết axit
bazơ của Arrênuyt chỉ áp dụng được cho môi trường nước, thuyết của Bronsted-Loury có thể áp dụng cho bất kỳ môi trường nào và cả khi khôngcómôitrường.
c) ThuyếtelectroncủaLewis:
Thuyết proton của Bronsted – Loury đã được các nhà hóa học coi là hoàn hảo nhất trong lý thuyết axit – bazơ. Tuy nhiên thuyết đó chỉ đúng cho những phản ứng axit –bazơ,trongđótínhchấtaxit–bazơlàthựctếgâynênbởiproton.Cónhữngchấtcũngthể hiệnmạnhtínhaxit,tínhbazơnhưngkhôngphải làaxit,bazơtheothuyết proton vì rằng
d) Độmạnhcủaaxitvàcủabazơ
Độ mạnh tương đối của các cặp axit – bazơ: Theo Bronsted – Loury, độ mạnh của một axit thể hiện khả năng cho proton, còn độ mạnhcủamột bazơthể hiệnkhảnăngnhậnproton.PhảnứngHCl +H2O → H3O+ +Clxảyra hoàn toàn: HCl là axit mạnh hơn H3O+ và H2O là bazơ mạnh hơn Cl-. Nói chung axit càng mạnh bao nhiêu, bazơ liên hợp với nó càng yếu bấy nhiêu và ngược lại.Nhờ vậytacóthểphânloạicácaxit–bazơvớilựcaxitgiảmdầntừtrênxuống,trongkhilực
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
bazơliênhợptăngtươngứng.Mộtaxitởhàngtrêntácdụngđượcvớibazơởhàngdưới
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
[H2O] mol.l-1
Thaysốvào: [H3O+].[OH‾]=K.[H2O]2
Axitliênhợp Bazơliênhợp
LỰC BAZƠ TĂNG
4.2 Cân bằng điện li của nước và tích số ion của nước
Nướclàchấtđiệnlirấtyếutheophươngtrình:
H2O H+ +OH‾ (theothuyếtArrhenius)
2H2O H3O+ +OH‾ (theothuyếtBrönsted–Lowry)
Hằngsốđiệnlicủanước:
Vìnướcđiệnlirấtyếunêncóthểcoi[H2O]=constvà:
[H3O+].[OH‾]=3,24.10-18.(55,56)2 ≈1.10-14
Đặt:
Kn =[H3O+].[OH‾]=[H+].[OH‾]=1.10-14
VìhằngsốcânbằngKchỉphụthuộcvàonhiệtđộ,nênKn làmộthằngsốởnhiệtđộxác
địnhvàđượcgọilà tích số ion của nước.
4.3 Độ pH
Trongnướcnguyênchất[H3O+]=[OH‾]hay[H+]=[OH‾]nênở25oCtacó:
[H3O+]=[OH‾]=
14 10 =10-7 mol.l-1
Vậy môi trường trung tính là môi trường trong đó [H3O+] = [OH‾] hay thường nói môi trườngtrungtínhcó[H3O+]=10-7 mol.l-1 (ở25oC).
Khi hòa tan một axit vào nước thì nồngđộ H3O+ tănglên, đồngthời nồng độ OH‾ giảm xuống(cânbằngđiệnlicủaH2Ochuyểndịchsangtrái)giữchotíchsốioncủanướckhông đổi,dođómôitrườngaxitcó[H3O+]>[OH‾]hay[H3O+]>10-7 mol.l-1 .
Lí luận tương tự cho môi trường bazơ ta có [H3O+] < [OH‾] hay [H3O+] < 10-7 mol.l-1 (25oC).
BiểuthịđộaxithayđộbazơcủadungdịchbằngnồngđộionH3O+ rấtkhôngcólợivìcó lũythừaâmvàthườnglàsốthậpphân.Năm1920Sorensenđưavàokháiniệm chỉ số hiđrô hay độ pH:
pH=-lg[H3O+]
Vậy: - Môitrườngaxit: [H3O+]>10-7 mol.l-1 haypH<7
- Môitrườngtrungtính:[H3O+]=10-7 mol.l-1 haypH=7
- Môitrườngbazơ:[H3O+]<10-7 mol.l-1 haypH>7
Tươngtự,nếuđặt: Nhiềukhingườitasửdụngbiểuthứctíchsốioncủanướcdướidạnglogarit:
pOH=-lg[OH‾]
-lgKn =-lg[H3O+]-lg[OH‾]=-lg10-14
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
Hay:
pH+pOH=14
HóaĐạiCương
BiểuthứcnàychophépchúngtatínhđượcpHkhibiếtpOHhoặcngượclại.
Bài tập áp dụng: a.TínhpHcủadungdịchHNO3 0,1Mở25oC.
b.TínhpHcủadungdịchNaOH0,002Mở25oC.
4.4 Hằng số điện li axit và hằng số điện li bazơ
Độmạnhcủaaxit vàbazơtheothuyết proton đượcđặctrưngbằng hằng số điện li Ka và Kb củachúng.
a) Hằngsốđiệnliaxit
Vìsựđiệnlicủaaxityếulàphảnứngthuậnnghịch,nêncóthểápdụngcácđịnhluậtcủa cânbằnghóahọcchonó.KhimộtaxityếuHAtantrongnướccócânbằngsau:
HA + H2O H3O+ + A‾
Axit 1 Bazơ2 Axit2 Bazơ1
Ởtrạngtháicânbằngtacó: Ka
Ka : hằng số điện li axit,đốivớiaxitxácđịnhnóchỉphụthuộcvàonhiệtđộ.Ka cànglớn
thìaxitHAcàngmạnh.
Ka ≥10-1 :axitmạnh
10-5 ≤Ka <10-1 :axitmạnhtrungbình
Ka <10-5 :axityếu
pKA =-lgKA:đượcgọilà chỉ số axit.
⇒ HằngsốaxitKAcànglớn(tứcchỉsốaxitpKA càngnhỏ)thìlựcaxitcàngmạnh.
VD: Axit CH3COOH ( KA = 1,86.10-5, pKA = 4,73) mạnh hơn axit HCN(KA = 7,2.10-10 ,
pKA =9,14)
Chú ý:[]làkýhiệucủanồngđộởtrạngtháicânbằng -Vớiaxitđachức,sựđiệnlyxảyraquanhiềugiaiđoạn:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
HPO4 2- + H2O ⇌ PO
3- + H
+ K3 =2,20 10-13,pK3 =12,66
b) Hằngsốđiệnlibazơ
Mộtbazơyếukhitantrongnướcxảyraphảnứngsau:
B + H2O BH+ + OH‾
Bazơ1 Axit2 Axit1 Bazơ2
Khicânbằng: Kb
5 6 NH H CK =410
Kb là hằng số điện li bazơ,đốivớibazơxácđịnhnóchỉphụthuộcvàonhiệtđộ.Kb càng
lớnthìbazơBcàngmạnh.
- Chỉ số bazơ: pKB =-lgKB
⇒ Hằng số bazơ KB càng lớn ( tức chỉ số bazơ pKB càng nhỏ ) thì lực bazơ càng mạnh.
VD: H3PO4 + H2O ⇌ H2PO4 - + H3O+ K1 =7,51 10-2,pK1 =1,12
H2PO4 - + H2O ⇌ HPO4 2- + H3O+ K2 =6,23
10-8,pK2 =7,21
VD: Amoniac (KNH3 = 1,79
10-5, pKNH3 = 4,75) là bazơ mạnh hơn Anilin (
10-10,pKB =9,4)
Nhận xét: H2O là một chất lưỡng tính
c) Mối liên hệ giữa Ka và Kb của một cặp axit – bazơ liên hợp
HA+H2O H3O+ +A‾ Ka(HA)
A‾+H2O HA+OH‾ Kb(A )
Ka.Kb
Vậy, Tích của hằng số axit và hằng số bazơ của một cặp axit – bazơ liên hợp bằng tích số ion của nước. Từđó tathấyrằngnếuKa củaaxitcànglớnthì Kb củabazơliênhợpvới axitđócàngnhỏvàngượclại.
Nếuđặt:pKa =-lgKa , pKb =-lgKb
Đốivớimộtcặpaxit–bazơliênhợp,tacó: pKa +pKb =14
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
4.5 Cách tính pH các dung dịch axit, bazơ
Trong phần này chúng ta chỉ nghiên cứu dung dịch axit một nấc, bazơ một nấc (theo thuyếtBrönsted–Lowrymuốicóthểlàaxithoặcbazơ)
4
1. pH của dung dịch axit mạnh một nấc:
Axit một nấc là axit mà một phân tử (hoặc một ion) chỉ có thể nhường một H+ (theo thuyết Brönsted – Lowry) hoặc chỉ có thể phân li ra một ion H+ (theo thuyết Arrhenius), chẳnghạnHCl,CH3COOH,NH
,…
Xét dung dịch HCl có nồng độ Ca (mol/l), trong dung dịch có những phản ứng sau:
HCl+H2O H3O+ +Cl‾
Trongcácdungdịchaxitmạnh[H3O+]khálớn,cânbằngđiệnlicủanướcchuyểndịchvề
bêntrái,dođócóthểbỏqua[H3O+]donướcđiệnlira.
Vìcácaxitmạnhđiệnlihoàntoàntrongdungdịchnên:[H3O+]=Ca (mol.l-1)
pH=-lgCa
2.pH của dung dịch bazơ mạnh một nấc:
Bazơmộtnấclàbazơmàmộtphântử(hoặcmộtion)chỉcóthểnhậnmộtH+ (theothuyết Brönsted – Lowry) hoặc chỉ có thể phân li ra một ion OH‾ (theo thuyết Arrhenius), chẳng
hạnNH3,CH3COO‾,NaOH,…
Xét trường hợp dung dịch một bazơ mạnh NaOH nồng độ Cb mol/l, trong dung dịch có nhữngphảnứngsau: NaOH Na+ +OH‾
VìNaOHphânlihoàntoànnên[OH‾]=Cb (mol.l-1).
pOH=-lgCb
3.pH của dung dịch axit yếu một nấc
pH=14–pOH=14+lgCb
XétdungdịchaxityếuCH3COOHnồngđộCa (mol/l)
CH3COOH+H2O CH3COO‾+H3O+
Bđ: Ca 0 0
Pli: x x x
COOH
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
COOH
CB: Ca –x x x
Ka
KhibiếtKa vàCa sẽtìmđượcx=[H3O+] (với0<x<Ca)
NếuxquánhỏsovớiCa (x 5%Ca)thìcóthểcoiCa –x≈Ca
Khiđó:x=
Bài tập áp dụng:
a.TínhpHcủadungdịchCH3COOH0,1M.BiếtK
=10-4,75 .
=10-4,75 .
a. 2,875 ≈ 2,9 ; b. 8,875
XétdungdịchbazơyếuNH3 nồngđộCb mol/l
+OH‾
Bđ: Cb 0 0
Pli: x x x
b b C K
Kb x C x x b 2 b b b C K x K x với
0<x<
5%Cb thìcóthểcoiCb –x≈Cb
3NH =10-4,77
Bài tập áp dụng: a.TínhpHcủadungdịchNH3 0,01M.BiếtK
3NH =10-4,77
b.TínhpHcủadungdịchNH4Cl0,1M.BiếtK
4.6 Sự thủy phân của muối
1.Kháiniệm
a/Địnhnghĩa
ĐS: a. 10,615 ≈ 10,6; b. 5,115 ≈ 5,1
- Thủy phân muối là phản ứng trao đổi giữa các ion của muối với các ion của nước.
Theo Bronsted – Loury phản ứng thủy phân thực chất là phản ứng chuyển proton như
mọiphảnứngaxit–bazơ.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Nếu kí hiệu muối là MA với M là kim loại hóa trị một thì sự thủyphân được biểu diễn bằngphươngtrìnhphảnứngthuậnnghịchtổngquátnhưsau: MA+H2O MOH+HA
Muốn cho sự thủy phân muối xảy ra được thì ít nhất một trong các sản phẩm của nó
(nghĩalàaxithaybazơtạothành)phảikémđiệnlihaykhótan.Từđâychúngtacóthểthấy sự thủy phân xảy ra đối với hầu hết các muối trừ muối tạo thành từ axit mạnh và bazơ mạnh.
-Sựthủyphânxảyravớicácgốcaxityếuhoặccationgốcbazơyếu
VD1:Muốiaxityếu–bazơmạnh
CH3COONa ⇌ CH3COO- + Na+
CH3COO- + HOH ⇌ CH3COOH + OH-
⇒ dungdịchnatriaxetatcótínhkiềm
VD2:Muốiaxitmạnh–bazơyếu
NH4Cl ⇌ NH4 + + Cl-
NH4 + + HOH ⇌ NH4OH + H+
⇒ ddNH4Clcótínhaxit.
b) Cơchế
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Muốitạothànhbởiaxityếuvàbazơyếu(NH4CN,NH4CH3COO…)
NH4CN+H2O NH4OH+HCN
NH +CN‾+H2O NH4OH+HCN
hay NH +H2O NH4OH+H+ Ka
CN‾+H2O HCN+OH‾ Kb
Trongtrườnghợpnàysựthủyphânxảyrađốivớicảcationvàanion.Trongkếtquảthủy phânsẽthuđượcaxityếuvàbazơyếu(HCNvàNH4OH).
Môi trường dung dịch thu được trong trường hợp này tùy thuộc vào độ mạnh, yếu của axityếuvàbazơyếutạothành:
- Nếuaxitmạnhhơn(Ka >Kb)thìmôitrườngsẽlàaxit,
- Nếubazơmạnhhơn(Kb >Ka)thìmôitrườngsẽlàbazơ,
- Nếuchúngcóđộđiệnlitươngđươngnhau(Ka =Kb)thìmôitrườngsẽlàtrungtính.
Trongvídụtrên(ở25oC):NH4OHcóKb =1,75.10-5 >Ka =8.10-10củaHCNdođódung dịchthuđượccómôitrườngbazơ.
VD: NH4NO2 ⇌ NH4 + + NO2 -
NH4 + + HOH ⇌ NH3 + H3O+
NO2 - + HOH ⇌ HNO2 - + OH-
NH4Cl+H2O NH4OH+HCl
NH
4 +Cl‾+H2O NH4OH+H+ +Cl‾
hay NH
4 +H2O NH4OH+H+
Muốitạothànhbởiaxitmạnhvàbazơyếu(NH4Cl,FeCl3,Al2(SO4)3,…)
Sự thủy phân của những muối tạo thành bởi axit mạnh và bazơ yếu là sự thủy phân
cation,vàdungdịchthuđượccó tính axit
Muối tạo thành bởi axit yếu và bazơ mạnh (CH3COONa, K2CO3, Na3PO4, NaAlO2,…)
CH3COONa+H2O CH3COOH+NaOH
CH3COO‾+Na+ +H2O CH3COOH+OH‾+Na+
hay CH3COO‾+H2O CH3COOH+OH‾
Sựthủyphâncủanhữngmuốitạothànhbởiaxityếuvàbazơmạnhlàsựthủyphân anion, vàdungdịchthuđướccó tính bazơ.
VìKA(NH4 +)=5,6.10-10 >KB(NO2 -)=0,22.10-10 ⇒ Môitrườngaxit
o n n h
3.Độthủyphânvàhằngsốthủyphân
Độthủyphân h làtỷsốgiữasốphântửmuốibịthủyphân(n)trêntổngsốphântửđãhòa tan(no)trongdungdịch:
HằngsốthủyphânK làhằngsốcânbằngápdụngchoquátrìnhthủyphân. Ví dụ: Kt của phảnứngthủyphânmuốiCH3COONacódạng:
Giữa độ thủy phân h và hằng số thủy phân Kt có mối quan hệ định lượng tương tự như giữađộđiệnliαvớihằngsốđiệnliK.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
4.7 Phản ứng trung hòa
HóaĐạiCương
Phản ứng trung hòa là phản ứng trao đổi ion xảyra trong dung dịch điện li giữa axit và bazơ. Phản ứng trung hòa xảy ra trong dung dịch nước là phản ứng nghịch của phản ứng
thủyphânmuốivừakhảosátởtrên.
Phảnứngtrunghòađượcbiểudiễnbằngphươngtrìnhphảnứngthuậnnghịchtổngquát:
HA+MOH MA+H2O
Như vậyphản ứng trung hòa xảyra được nhờ có sự tạo thành chất kém điện li là nước.
Tuynhiênvịtrícânbằngcònphụthuộccảvàomứcđộđiệnlicủaaxitvàbazơ.
- Nếu axit và bazơ đều điện li mạnh: phản ứng trung hòa hầu như xảy ra hoàn toàn và thực chất của phản ứng nàylà phản ứng kết hợp giữa ion H+ và OH‾ trong dung dịch tạo thànhH2O.Dungdịchthuđượclàtrungtính.
- Nếumộttronghaichất,axithaybazơ,làchấtđiệnliyếuhoặccảhaiđềulàchấtđiệnli yếu thì thực tế ít nhiều phản ứng thuận nghịch vẫn xảy ra và các phương trình phản ứng trunghòaion–phântửcódạng:
H+ +MOH M+ +H2O
HA+OH‾ A‾+H2O
HA+MOH M+ +A‾+H2O
Môi trường của dung dịch sau phản ứng là axit, bazơ hay trung tính tùy thuộc vào axit haybazơmạnhhơn,hoặctươngđươngnhau.
III.5Mộtsốcânbằngkhácthườnggặptrongdungdịch
5.1 Cân bằng trong dung dịch chất điện li khó tan
a/ Định nghĩa
Trongdungdịchbãohòacủachấtđiệnliíttantồntạicânbằnggiữaphầnchấtrắnkhông tanvàcácioncủanótrongdungdịch.
Ví dụ: MnXm(tt) nMm+ +mXn-
HằngsốcânbằngKcủaphảnứngnàylà: K=[Mm+]n cb.[Xn-]m cb
Trong trường hợp nàyK đặc trưng cho độ hòa tan của chất điện li ít tan và được gọi là
tích số tan.TakíhiệutíchsốtanbằngT.Tacó:
T m n X M =[Mm+]n cb.[Xn-]m cb
Tích số tan làtíchnồngđộcáciontrongdungdịchbão hòacủachấtđiệnlyíttan vớisốmũthíchhợp.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
b/ Mối liên hệ giữa độ tan (S) và tích số tan
HóaĐạiCương
GọiđộhòatantạimộtnhiệtđộnàođócủachấtđiệnliíttanAgCllà s (mol/l)
MnXm(r) nMm+ +mXn-
Cb: s ns ms
T =[Mm+]n cb.[Xn-]m cb =(ns)n.(ms)m =m m .n n .s m+n
Tíchsốtancànglớn,độhòatanscànglớn(chấtcàngdễtan)vàngượclại.
Khibiếttíchsốtancủamộtchất,taxácđịnhđượcđiềukiệnkếttủahayhòatanchấtđó c/ Điều kiện kết tủa của chất điện li ít tan
o Đểmộtchấtkếttủa,tíchnồngđộcủacácioncủachấttrongdungdịchvớisốmũlàhệ sốtỉlượngtươngứngphảilơnhơntíchsốtan.
↔MnXm kếttủa
o Đểhòatanmộtkếttủa,phảigiảmnồngđộcủacácioncủachấttrongdungdịchsaocho tíchsốnồngđộcủachúngvớisốmũlàhệsốtỉlượngtươngứngphảinhỏhơntíchsốtan.
[Mm+]n.[Xn-]m <T
5.2 Cân bằng tạo phức
↔kếttủaMnXm tanrahaykhôngxuấthiện
Trongdungdịch,cáccationkimloạicóthểkếthợpvớicácanionhayphântửtrunghòa
đểtạothànhcáctậphợpmớilàcác phức chất.
Ví dụ: Ag+ +2NH3 =Ag(NH3)
Pt2+ +2NH3 +2Cl‾=[Pt(NH3)2]Cl2
Trong các phức chất, cation kim loại đóng vai trò ion trung tâm hay chất tạo phức; các anion hay phân tử trung hòa bao quanh ion trung tâm được gọi là phối tử. Tập hợp ion trung tâm và phối tử tạo nên cầu nội của phức chất. Khi cầu nội mang điện tích thì phức chấtcòncóthêm cầu ngoại làcácionmangđiệntíchtráidấuvớicầunộiđểtrunghòađiện tíchcủacầunội.Nếucầunộikhôngmangđiệntíchthìphứcchấtsẽkhôngcócầungoại.
Ví dụ: [Ag(NH3)2]Cl GọiMlàiontrungtâm,Llàphốitử.Giảsửgiữaiontrungtâmvàphốitửtạothànhphức chấtMLn,cânbằngtạophứcđượcbiểudiễnnhưsau: M+nL MLn
Vớihằngsốcânbằng:K= n n L M ML ] ].[ [ ]
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
K được gọi là hằng số tạo thành của phức chất. Khi phức chất càng bền thì cân bằng
chuyển dịch mạnh về phía phải, hằng số cân bằng càng lớn. Do đó hằng số cân bằng còn
gọilàhằngsốbềncủaphứcchấtvàđượckíhiệulàKb.
K làhằngsốcânbằngcủaquátrình: MLn M+nL
Đặc trưng cho quá trình phân li của phức chất, được gọi là hằng số phân li hay hằng số không bền củaphứcchất,kíhiệuKkb
Chương4:Cânbằngoxihóa–khửvàdòngđiện
4.1Phảnứngoxihóa–khử
4.1.1 Các khái niệm
Tấtcảcácphảnứnghóahọccóthểchiathành2loại:
- Cácphảnứng không có sự thay đổi số oxi hóa củacácnguyêntốthamgia
phản
ứng:
NaOH+HCl=NaCl+H2O
- Cácphảnứng có sự thay đổi số oxi hóa củacácnguyêntốthamgiaphản
ứng:
2Mg+O2 =2MgO
Fe+HCl=FeCl2 +H2
phản ứng oxi hóa – khử
Mỗiphảnứngoxihóa-khửphảibaogồm 2 quá trình xảy ra đồng thời:
+ Quá trình cho electron đượcgọilà…………
+ Quá trình nhận electron đượcgọilà…………
+ Chất cho electron đượcgọilà……………hay……………
+ Chất nhận electron đượcgọilà………hay ……………
Mộtcáchtổngquáttacóthểtrìnhbày:
Quátrìnhoxihóa: KhI OxI +ne
Quátrìnhkhử: OxII +ne KhII
Phảnứngoxihóa–khử: KhI +OxII OxI +KhII
OxI/KhI,OxII/KhII gọilànhững cặp oxi hóa – khử củacácchấtIvàII.
Các phản ứng oxi hóa – khử có thể chia thành 2 loại:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
- Cácphảnứngkhôngcómôitrườngthamgia:đólàloạiphảnứngchỉgồm có 2 chất tham gia phản ứng là chất oxi hóa và chất khử. (Phản ứng giữa Zn và CuSO4.)
- Các phản ứng có môi trường tham gia: đó là loại phản ứng mà ngoài 2 chấtoxihóavàkhửcòncóchấtthứbathamgiađểtạomôitrườngchophảnứng (axit,bazơhaytrungtính). Chất thứ ba này được gọi là chất môi trường và thực tế đó là axit, bazơ và nước.
Vd: 2KMnO4 +5KNO2 +3H2SO4 =2MnSO4 +5KNO3 +3H2O
Trongtrườnghợpnàydạngoxihóahaydạngkhửcủacáccặpoxyhóa–khửcóthể baogồmnhiềuchất,vdđốivớiphảnứngvừanêu:
MnO
+8H+ +5e=Mn+2 +4H2O
Dạngoxihóa dạngkhử
NO
+H2O–2e=NO
Dạngkhử dạngoxihóa
+2H+
4.1.2 Sự chuyển hóa hóa năng thành điện năng
Hóa năng của các phản ứng oxi hóa – khử có thể chuyển thành nhiệt năng hay điện năngtùythuộcvàophươngpháptiếnhànhphảnứng.
Xétphảnứngoxihóa–khửsauđâyxảyratrongdungdịchnước: Zn+CuSO4 ZnSO4 +Cu ∆H=-230kJ
Nếuphảnứngnàytiếnhànhtheophươngphápthôngthường:nhúngthanhZnvào dungdịchCuSO4 ,(nghĩalàchochấtkhử vàchấtoxihóatiếpxúctrựctiếpvớinhau)khi
đó hóa năng của phản ứng sẽ chuyển thành nhiệt năng (tỏa ra lượng nhiệt tiêu chuẩn 230kJ).
Trongtrườnghợpnàycác quá trình oxi hóa và quá trình khử sẽxảyraở cùng một nơi và electron sẽ chuyển trực tiếp từchấtkhửZnsangchấtoxihóaCuSO4.
Nếu phản ứng này tiến hành theo cách khác: trong một dụng cụ đặc biệt để cho thanhZnvàdungdịchCuSO4 không tiếp xúc trực tiếp vớinhau,khiđócácquátrìnhoxi hóakẽmvàkhửđồngxảyraở hai nơi khác nhau,vàchocác electron chuyển từZnsang
Cu2+ nhờmột dây dẫn bằng kim loại thìsẽtạođượcmộtdòngelectronliêntục.
Trongtrườnghợpnày hóa năng của phản ứng sẽ chuyển thành điện năng
Dụngcụđặcbiệtnóitrênđượcgọilà nguyên tố Ganvanic hay pin điện hóa học.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
Vậy muốn biến hóa năng thành điện năng ta phải làm thế nào?
4.2Nguyêntốganvanic
4.2.1 Cấu tạo và hoạt động của nguyên tố ganvanic
a.Cấutạo:
HóaĐạiCương
Gồm2điệncựcnốivớinhaubằngsợidâydẫnkimloại,trongđó điện cực là hệ thống
gồm thanh kim loại nhúng trong dung dịch muối của nó.
Khiđó:-tạimỗiđiệncựcsẽxảyraquátrìnhoxihóahoặcquátrìnhkhử; - electron sẽ được chuyển từ chất khử chất oxi hóa theo dây dẫn kim loại.
b.Hoạtđộng:
Xét pin đồng – kẽm (haynguyêntốganvanicđồng–kẽm)(hìnhvẽ)


-Cấutạo:Nguyêntốđượctạothànhtừ2điệncựckẽmvàđồng:
Điệncựckẽmgồm:………………
Điệncựcđồnggồm:………………
Haidungdịchsunfatđượcngănchiabằngmàngxốp(vìsao?)
Haithanhkẽmvàđồngđượcnốivớinhaubằng:…………
- Hình thành lớp điện tích kép: Khi nhúng thanh kim loại vào nước hay dung dịch
muốicủanóở bề mặt tiếp xúc kim loại và dung dịch sẽhìnhthành lớp điện tích kép cân
bằng vàởđâysẽxuấthiệnmột thế hiệu,gọilà thế điện cực.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Giátrịcủathếđiệncựcnàyphụthuộcvàobảnchấtcủakim loạivàdungmôi,nồngđộ ion kim loại trong dung dịch và nhiệt độ. Trong chương này chỉ xét thế điện cực trong dung môi là nước.
-Hoạtđộng:Khinốihaithanhkẽmvàđồnglạivớinhaubằngdâykimloại nguyên tốsẽlàmviệcvàdòngđiệnxuấthiệnlàmlệchkimđiệnkế.
Giảithích:
Ở điện cực kẽm: do kẽm hoạt động mạnh hơn đồng nên thanh Zn chứa nhiều e- hơn thanh Cu, vì vậykhi đóng mạch e- sẽchuyển từ thanh Zn qua dâydẫn kimloạisangthanhCu.
Xảy ra quá trình oxy hóa kẽm (hay quá trình điện cực hoặc điện hóa) được biểu diễnbằngbánphảnứnghayphươngtrìnhđiệnhóa: Zn Zn2+ +2e
Điện cực kẽm, trên đó xảy ra quá trình oxy hóa, được gọi là điện cực âm hay anod.
Ở điện cực đồng: e - được chuyển qua sẽ kết hợp với các ion Cu2+ hydrat hóatrongdungdịchthànhnguyêntửCuvàkếttủatrênthanhCu.
Xảyraquátrìnhkhửđồng:
Cu2+ +2e Cu
Điện cực đồng, trên đó xảy ra quá trình khử, được gọi là điện cực dương hay catod.
Phương trình phản ứng oxi hóa – khử xảy ra trong nguyên tố ganvanic:
Zn+Cu2+ =Zn2+ +Cu
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
Trong pin điện hóa:
Chiềue:………………………
Chiềudòngđiện:………………
HóaĐạiCương
Mộtpinđiệnhóađượckíhiệunhưsau: (-)Vậtliệuđiệncực1│ddđiệncực1║ddđiệncực2│vậtliệuđiện2(+)
Vd: Đốivớipinkẽmđồng: (-)………│………║………│………(+)
4.2.2 Sức điện động của nguyên tố ganvanic
Sức điện động của pin là giá trị (trị tuyệt đối) của hiệu số điện thế lớn nhất giữa hai
điện cực của pin. Kíhiệu: E - Giả sử pin làm việc một cách thuận nghịch (theo nghĩa nhiệt động học) ở áp suất và nhiệtđộkhôngđổi.
Khiđó: A
Mặtkhác: A
=-∆G
=nFE
∆G=-nFE
Trongđó: n: số electron trao đổi giữa chất khử và chất oxi hóa của
phảnứngtrongpin
F: hằng số Faraday, F ≈ 96500 (nếu A
23062(nếuA
tínhbằngcalo)
tính bằng jun) hay F ≈
E:sứcđiệnđộngcủapin(E>0),V -Xétnguyêntốganvanichoạtđộngthuậnnghịchdựatrênphảnứngoxihóa–khửtổng
quát:
Ở
aA+bB cC+dD
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
E = lnK -nFE =-RTlnK ∆G =-nFE
Vậy: ET =E - ln
E :sứcđiệnđộngtiêuchuẩncủanguyêntốganvanic(E =const)
Nếunhiệtđộ T = 298K thì: ET =E - lg
4.2.3 Mối liên hệ giữa sức điện động của nguyên tố ganvanic với biến thiên thế đẳng áp – đẳng nhiệt, hằng số cân bằng của phản ứng oxi hóa – khử.
∆GT =-nFET (ởđiềukiệnbấtkì)
∆G
E
=
=-nFE
(ởđiềukiệntiêuchuẩn)
lnK NếuT=25oCthìEo =
lgK
Bài tập áp dụng: Biếtsứcđiệnđộngtiêuchuẩncủanguyêntốganvanicđồng–kẽmđo được ở 25oC bằng 1,10V. Tính biến thiên entanpi tự do tiêu chuẩn và hằng số cân bằng củaphảnứngoxihóakhửxảyratrongnguyêntốnày?
ĐS: ∆Go = -212,3kJ; K = 1,6.1037
4.3ThếđiệncựcvàphươngtrìnhNernst
4.3.1 Khái niệm về thế điện cực
Mỗihệthốngđiệncựccóđạilượngthếhiệuđặctrưnggọilàthếđiệncực.
Thế điện cực của một điện cực là đại lượng bằng hiệu số điện thế giữa nó so với điện cực hidro tiêu chuẩn và thường được ký hiệu bằng φ hay ε. (những đại lượng thế điện cựcnàychỉlànhữngđạilượngquyướcđặctrưngchothếhiệucủacácđiệncực.)
o T =-nFφo
Thựcra thế điện cực củamộtđiệncựcnàođócũngchínhlà sức điện động của pin gồm điện cực hidro tiêu chuẩn và điện cực khảo sát.
Tacũngcó: ∆GT =-nFφ và ∆G
Với: φ o :thếđiệncựctiêuchuẩn
n:sốelectrontraođổitrongquátrìnhđiệncực
Ví dụ: Điệncựckẽm: ∆GZn =
Điệncựcđồng: ∆GCu =
Xétnguyêntốganvanicđồng–kẽm: (-)Zn│ddZn2+ ║ddCu2+ │Cu(+)
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
Độgiảmthếđẳngápcủanguyêntốganvanicđồng–kẽm:
∆GCu/Zn =
-2FECu/Zn =
ECu/Zn =
Tổngquát: ET =φ+ -φ- và E =φ -φ
HóaĐạiCương
Sức điện động của nguyên tố ganvanic bằng hiệu số các thế điện cực của điện cực
dương và điện cực âm.
4.3.2 Phương trình Nernst
Đốivớiquátrìnhđiệncựcviếttheochiềuoxihóa: Kh Ox+ne
Phươngtrìnhtính thế điện cực bất kỳ: φ=φ o +
ln
Phươngtrìnhnàygọilà phương trình Nernst
Trongđó:
n:sốelectrontraođổicủamỗiiontrongquátrìnhđiệncực
F:sốFaraday
R:hằngsốkhílítưởng
T:nhiệtđộtuyệtđối
COx vàCkh:tíchnồngđộcácchấtthamgiadạngoxihóavàdạngkhử.
Nếuthay:T=298oK;R=8,314J/mol.độvàF=96500culongvàophươngtrìnhtrênthì
tacóphươngNernstchophéptínhthếđiệncựccủađiệncựcbấtkỳở 25oC
thếđiệncựcphụthuộcvào:
φ o:bảnchấtchấtthamgiaquátrìnhđiệncực
T:nhiệtđộ
C:nồngđộcácchấtthamgiađiệncực
NếuCOx =CKh =1đơnvịthìφ=φo
thếđiệncựctiêuchuẩn(φo)là:thếđiệncựccủaquátrìnhđiệncựcđãchokhi nồng
độcácchấtthamgiaquátrìnhđiệncựcbằng1đơnvị.
Thế điện cực tương ứng với quá trình điện cực tổng quát trên còn được gọi là thế oxy
hóa – khử hay thế oxy hóa.
Điệncựchydro:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Quátrìnhđiệncực:H2 2H+ +2e
Phươngtrìnhthếđiệncực:φ =φ + ln
Theoquyước:φ =0nênởT=298oKvàp =1atmcó:
φ =+0,059lgC =-0,059pH
ĐiệncựchidrotiêuchuẩnkhiC =1vàp =1atm φ =φ =0.
Muốn xác định thế điện cực người ta nối điện cực nghiên cứu với điện cực hidro tiêu chuẩn thành nguyên tố ganvanic. Sau đó đo sức điện động của nguyên tố tạo thành rồi suyrathếđiệncựcnghiêncứu.
Ví dụ: 1.Xácđịnhthếđiệncựccủađiệncựckẽm:
Thiếtlậpnguyêntốganvanichydro-kẽm:
(-)Zn│ZnSO4 (1M)║H+ (1M)│H2 (+)
Anod(-):
Catod(+):
Phảnứngoxihóa–khửtổngcộng:
BiếtsứcđiệnđộngcủanguyêntốnàylàE=0,76V
φZn = 2.Xácđịnhthếđiệncựccủađiệncựcđồng:
Thiếtlậpnguyêntốganvanicđồng–hydro:
(-) H2│H+ (1M)║CuSO4 (1M)│Cu(+)
Anod(-):
Catod(+):
Phảnứngoxihóa–khửtổngcộng:
BiếtsứcđiệnđộngcủanguyêntốnàylàE=0,34V
φCu = Ngoàiracòncóđiệncựccalomen,điệncựcbac–clo,…
4.3.3 Thế điện cực và chiều của phản ứng oxi hóa – khử
Xétcặpoxihóa-khửOxI/KhI vàOxII/KhII vớithếđiệncựctươngứngφI vàφII:
KhI OxI +ne φI =φ Kh Ox /
KhII OxII +ne φII =φ II II Kh Ox
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
Phảnứngtổngquát:KhI +OxII OxI +KhII
Có: ∆G=-nFE
Với: E=EII/I = φII -φI
HóaĐạiCương
NếuφII >φI thìE>0khiđó∆G<0,nghĩalàphảnứngxảyratheochiềuthuận.
Hiệusố(φII -φI)cànglớn(∆Gcàngâm)thìphảnứngoxihóa–khửxảyracàngmạnh vàcànghoàntoàn
Khithựchiệnphảnứngởđiềukiệnchuẩntacũngcó: ∆Go =-nFEo
VớiEo =φ
-φ
Tómlại: phản ứng oxy hóa – khử xảy ra theo chiều dạng oxy hóa của cặp oxy hóa –
khử có thế điện cực (φII) lớn hơn sẽ oxy hóa dạng khử của cặp oxy hóa – khử có thế điện cực (φI) nhỏ hơn. (φII > φI)
Ví dụ:
1.Xácđịnhchiềucủaphảnứngsauởđiềukiệntiêuchuẩnvà25oC:
Zn(tt) +Cu2+ Zn2+ +Cu(tt)
φ o(Cu2+/Cu)=0,34V;φo(Zn2+/Zn)=-0,76V
2.Xácđịnhchiềucủaphảnứngsauởđiềukiệntiêuchuẩnvà25oC:
Cu(tt) +Zn2+ Cu2+ +Zn(tt)
3.Xácđịnhchiềucủaphảnứngsau:
Fe2++Ag+ Fe3+ +Ag(tt)
φ o(Fe3+/Fe2+)=0,77V;φo(Ag+/Ag)=0,80V (ở25oC)
a.Hỏichiềucủaphảnứngởđiềukiệnchuẩnvà25oC?
b.MộtdungdịchchứaFe(NO3)3 0,1M,Fe(NO3)2 0,01M;AgNO3 0,01MvàAg kimloạidư.Hỏichiềuphảnứngởđiềukiệnnày?
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
d.TínhhằngsốcânbằngK´ở25oCchophảnứng: Fe3+ +Ag(tt) Fe2++Ag+
4.4Mộtsốứngdụngcủacácquátrìnhđiệnhóa Ngàynay,cácquátrìnhđiệnhóađượcứngdụngphổbiếntrongcáclĩnhvựckhoahọc kỹthuậtkhácnhaunhư:nguồnđiện,điệnphân,…
-Nguồnđiện:có2loại:pinvàacquy +Pin:làloạinguyêntốganvanichoạtđộngchỉcómộtvòng,nghĩalàkhichonóphóng hếtđiệnchúngtakhôngthểkhôiphụclạikhảnăngphóngđiệncủanóđược.
Nhượcđiểm:thờigianhoạtđộngcủapinbịhạnchếdohiệntượng“tựphóngđiện”xảy ratrongpinlàmgiảmthếhiệuvàdunglượng(lượngđiệnnăngdựtrữ).
1. Pin khô (hay pin muối hoặc pin Leclanché) có:
Anod:bằngkẽmđượccuốnthànhốngtrụkiêmchứcnănglàmvỏhộp
Catod:mộtthanhthanchìbaobọcbởimộtlớpMnO2
Chất điện li là hỗn hợp: NH4Cl và ZnCl2 hòa trong hồ tinh bột với gelatin thành bột nhão
Sơđồpin:(-) Zn│NH4Cl,ZnCl2 │MnO2,C (+)
Anod(-):Zn–2e Zn2+
Catod(+):2MnO2 +4e+4H+ Mn2O3 +H2O
Sứcđiệnđộngcủapin1,2đến1,5V.Pindùngmộtlầnkhôngthểsạcdùnglại.
2. Pin oxyt thủy ngân: hoạt động dựa trên sự oxy hóa kẽm bằng thủy ngân oxyt trong môitrườngkiềm.
HgO+Zn+2KOH Hg+K2ZnO2 +H2O
Sứcđiệnđộngcủapinổnđịnh1,35V.
3. Pin nhiên liệu: hoạtđộngdựatrênphảnứngoxyhóa–khửđốtcháynhiênliệu.
Nhiên liệu là các chất khử thông thường: than, khí đốt thiên nhiên và nhân tạo, hydro,…
Chấtoxyhóalàoxyhaykhôngkhí.
c.TínhhằngsốcânbằngKở25oCcủaphảnứngtrên?
Ví dụ: pin oxy – hydro – kiềm: các điện cực là những thanh than hay niken xốp được nhúngtrongdungdịchkiềmlàmchấtđiệnli.Khipinhoạtđộngcócácquátrìnhđiệnhóa sauxảyra:
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
Anod(-):2H2 +4OH‾-4e 4H2O
Catod(+):O2 +2H2O+4e 4OH‾
Phảnứngoxihóatổngcộng:2H2 +O2 2H2O
Sơđồpin:(-)Ni│H2 │KOH(30–40%)│O2│Ni(+)
HóaĐạiCương
Sứcđiệnđộngcủapinlà1,23V + Acquy: là loại nguyên tố ganvanic hoạt động thuận nghịch nhiều vòng, nghĩa là có thể phục hồi khả năng phóng điện của nó để sử dụng lại bằng cách cho dòng điện bên ngoàichạyqua(nạp điện).Phổbiếnlàacquychì
Khiphóngđiện,nguyêntắchoạtđộngcủanógiốngnguyêntắchoạtđộngcủapin.
Trongacquychì, gồm hai điệncựclàhai tấm chì dướidạnglưới,phủbột PbO,nhúng
trong dung dịch H2SO4 nồng độ 25 – 30%. Ở cả hai tấm đều xảy ra phản ứng: PbO +
H2SO4 =PbSO4 +H2OnghĩalàcóhaitấmPbSO4 nhúngtrongdungdịchH2SO4
Khinạpđiệnchoacquysẽxảyracácphảnứngsau:
Anod(-):PbSO4 +2e Pb+SO
Catod(+):PbSO4 –2e+2H2O PbO2 +SO
+4H+
Toànbộquátrìnhxảyratrong acquykhinạpđiệnlà: 2PbSO4 +2H2O=Pb+PbO2 +2H2SO4
Trongacquychì,saukhinạpđiệnđiệncựcâmbiếnthànhchìxốphoạtđộng,cònđiện
cựcdươngbiếnthànhPbO2 khôngtan.
Khiacquychìhoạtđộngsẽxảyrasựphóngđiện:
Anod(-):Pb–2e+SO
PbSO4
Catod(+):PbO2 +2e+4H+ +SO
PbSO4 +2H2O
Toànbộquátrìnhxảyratrong acquykhiphóngđiệnlà:
Pb+PbO2 +2H2SO4 =2PbSO4 +2H2O
Như vậy khi phóng điện, PbSO4 không tan bám vào hai điện cực. Acquy chì có sức
điệnđộngkhoảng2V.
Tómlại:
Phóngđiện
Pb+PbO2 +2H2SO4 2PbSO4 +2H2O
Nạpđiện
Ưuđiểm:dunglượnglớn,bền,hoạtđộngnhiềuvòng.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Nhượcđiểm:nặngnề,chohydrobayrakhinạpđiệnvàkhôngkinnêndễbịaxitchảyra nguyhiểmkhisửdụng.
Ngoàiracòncóacquyniken–cacdimi, 2Ni(OH)3 +Cd 2Ni(OH)2 +Cd(OH)2
Acquykẽm–bạc 2AgO+2Zn+2H2O 2Ag+2Zn(OH)2
-Điệnphân:ứngdụngnhiềutrongcôngnghiệpluyệnkimvàhóahọc + Điều chế kim loại và các chất khác bằng phương pháp điện phân nóng chảy, điện phândungdịchmuối,…
+Mạđiện: dùngphươngpháp điệnphân đểphủ một lớpkim loại(thườnglàkim loại không gỉ) lên những đồ vật bằng kim loại khác. Khi đó vật cần được mạ dùng làm cực âm, kim loại dùng để mạ làm cực dương, còn chất điện phân là dung dịch có muối của kim loại dùng để mạ. Hiện nay việc mạ vàng, mạ bạc và nhất là mạ kền bằng phương phápnàyrấtphổbiến.Đểbảovệsảnphẩmkhỏibịgỉ,tạođộcứngchobềmặtsảnphẩm, trangtrísảnphẩm,… + Đúc điện: Nguyên tắc của đúc điện cũng giống mạ điện. Trước tiên người ta làm khuôn của vật định đúc bằng sáp ong hay bằng một chất dễ nặn nào khác , rồi quét lên khuônmộtlớpthanchì(graphit)mỏngđểchonóthànhdẫnđiện.Khuônnàyđượcdùng làmcựcâm,còncựcdươngthìbằngkimloạimàtamuốnđúcvàdungdịch điệnphânlà muốicủakimloạiđó.Khiđặtmộthiệuđiệnthếvàohaicựcđó,kimloạisẽkếtthànhmột lớp lên khuôn đúc, dày haymỏnglà tuỳthuộc vào thời gian điện phân. Sau đó người ta táchlớpkimloạirakhỏikhuônvàđượcvậtcầnđúc.
Đúc điện là phương pháp đúc chính xác, do đó các khuôn đĩa hát, các bản in thường đượcchếtạobằngphươngphápkhác
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Chương5:Hóakeo
5.1Kháiniệmvềhóakeo
Hóa keo là một bộmôn khoa học nghiên cứu các tính chất hóa lýcủa các hệ dị thể có độ phân tán cao vànhữngquátrìnhxảyratrongcáchệđó.
- Hệdị thể: gồm ít nhất 2 phakhôngtan lẫn vàonhauhoặcít tan vào nhau
và1trong2phađóphảiđượcchianhỏtớikíchthướchạtnhấtđịnh.
- Độphântán(D):làđạilượngnghịchđảocủakíchthướchạt D
Sự thay đổi bề mặt theo độ phân tán d(cm) Sốhạt Diệntíchbềmặt1 hạt(cm2) Diệntíchbềmặtcủatấtcả cáchạt(cm2)
Phân loại hệ phân tán theo D Sốthứ tự d,m D ,m -1
Tênhệ Ghichú
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
thô bụi.Cáchệnàykhôngbềnvững.
- Các phân tử trong hệ keo không phải là một nguyên tử mà chúng là tập hợpcủacácphântử,nguyêntửcủamộtpha,giữa2phađócó bề mặt ngăn cách pha.
- Bềmặtngăncáchpha:làtổngtoànbộbềmặttiếpxúcgiữa2pha. So sánh dung dịch keo và dung dịch thật Dungdịchkeo Dungdịchthật
-Tướngphântánđượcphânbốtrong môitrườngphântán
-Cóbềmặtngăncáchpha
-Khôngtan,íttanvàonhau
5.2Dungdịchkeo
5.2.1 Đặc điểm của dung dịch keo
-Chấttanđượchòatantrongdungmôi.
-Khôngcó.
-Tanhoàntoànvàonhau.
-Cókhảnăngtánxạmạnhánhsáng:ánhsángđiquadungdịchkeolàmxuấthiệnhiện tượngmờ đục.Điềunàychứngtỏ dungdịch keo khôngphải làmột hệ đồngnhất. Đó là hệphântándịthể.
-Dungdịchkeokhuếchtánchậmhơndungdịchthựcrấtnhiều.Điềunàychứngtỏcác tiểuphântrongdungdịchkeocókíchthướclớnhơnkíchthướcphântử.
-Cáctiểuphânkeokhôngđiquamàngtếbàohaymàngbánthấm.
1 <10-7 >107
Hệphântán phântử,ion haydungdịch
Phaphântánlàcácphântử,ion. Dungmôilàmôitrườngphântán. Cáchệnàytuântheocácđịnhluật hóalý,rấtbềnvững.
-Cáctiểuphânkeodichuyểntrongđiệntrường.Điềunàychứngtỏchúngtíchđiện. Nguyên nhân của các hiện tượng trên là do kích thước của các hạt keo: các hạt keocókíchthướctừ10-7 mđến10-5 m,làkíchthướctrunggiangiữakíchthướccủacác tiểu phân trong dung dịch thực (< 10-7 m) và kích thước của các tiểu phân trong các hệ thônhưhuyềnphù,nhũtương(>10-5 m).
5.2.2 Phân loại các dung dịch keo Cáchệkeođượcchiathànhhainhóm:
phântán keo=hệkeo
Tínhchấtcủahệnàytuântheo nhữngquyluậtcủahóakeo, tươngđốibềnvững. 3 >10-4 <104 Hệphântán Hệhuyềnphù,nhũtương,bọt,
- Keo ưa lỏng: là keo hấp phụ các phân tử của môi trường. Các hạt keo ưa lỏngđượcbaobọcbằnglớpvỏsolvat;trongtrườnghợpmôitrườngphân tánlà
nước thì keo gọi là ưa nước. Anbumin, axit silixic, hồ tinh bột … là keo ưa
nước
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
- Keo kị lỏng: làkeohầunhưkhônghấpphụcácphântửmôitrường.Trong
trườnghợpmôitrườngphântánlànướcthìgọilà keo kị nước.Cáckeokimloại, sunfuakimloại,cácmuốilànhữngkeokịnước.Keohidroxitkimloạichiếmvị
trítrunggiangiữahailoạikeotrên.
Tính chất ưa lỏng hay kị lỏng của các hệ keo còn phụ thuộc vào bản chất của môi trường phân tán. Cùng một loại keo, trong môi trường này có tính chất ưa lỏng, nhưng
trongmôitrườngkháclạikịlỏng.
Trongcácloạidungdịchkeothìquantrọngnhấtlàdungdịchkeovớimôitrườngphân tánlànước.Trongchươngnàytachỉxétloạidungdịchkeonày.
5.2.3 Các tính chất của dung dịch keo
a.Tínhchấtđộnghọccủadungdịchkeo
- Chuyển động Brown:

Năm1927,nhàsinhhọcAnhBrownlàngườiđầutiênchúýđếnchuyểnđộnghỗnloạn và liên tục của tiểu phân lơ lững trong chất lỏng. Chuyển động đó được gọi là chuyển độngBrown.
Chuyển động Brown là kết quả của sự va chạm của các tiểu phân trong dungdịch với cácphântửdungmôiđangchuyểnđộngnhiệt.
Các tiểu phân keo cũng bị các tiểu phân môi trường phân tán va chạm nên cũng có chuyểnđộngBrown.Trongmột giây, hướngchuyển độngcủatiểuphân keocóthểthay đổi106 lần.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Khả năngkhuếch tán của dungdịch keo kém hơn của dungdịch thực vì các tiểu phân keo có kích thước lớn, chuyển động khó hơn các phân tử, nên vận tốc khuếch tán nhỏ hơn.
- Áp suất thẩm thấu của một dung dịch: Khingăncáchhaidungdịchcónồngđộkhácnhau(haydungdịchvàdungmôinguyên chất) bởi màngbán thấm thì sẽ có dòngdungmôi chuyển từ phía dungdịch có nồngđộ thấp (hay dung môi nguyên chất) sang phía dung dịch có nồng độ lớn hơn để san bằng nồng độ ở hai phía màng. Hiện tượng đó được gọi là hiện tượng thẩm thấu. Quá trình thẩm thấu dừng lại khi đạt đến một áp suất cân bằng nhất định. Dòng dung môi sẽ “ngừng”lưuchuyểntiếptục,khiđãtạođượcmộtgradianápsuấtcầnthiếtchốnglại.Áp suấtnàycânbằngvớiápsuấtthủytĩnhtươngứng,-gọilà áp suất thẩm thấu π.
◊Ápsuấtthẩmthấucủadungdịchkhôngphụthuộcvàobảnchấtchấttanvàdungmôi màchỉphụthuộcvàosốlượngtiểuphânchấttan.
◊ Áp suất thẩm thấu của dung dịch tỷ lệ thuận với nồng độ chất tan và nhiệt độ tuyệt
đốicủadungdịch:π=CRT
◊Ápsuất thẩmthấu của dungdịchkeonhỏ hơn ápsuấtthẩm thấu củadungdịchthực vànógiảmdầntheothơigian.
Màng bán thấm:làloạimàngchỉchodungmôiđiquachứkhôngchochấttanđiqua.
+Cáctiểuphândungmôikhuếchtánquamàngbánthấmbằngcáchhòatanvàomàng, vìvậytínhchấtbánthấmkhôngphảidokíchthướclỗcủamànggâynênmàdochấtliệu củamàngcókhảnănghòatanchọnlọccácchất.
+ Các màng bán thấm thường dùng là: bong bóng động vật (màng tế bào), colodion, xenlophan,…
- Sự sa lắng:
- Sự khuếch tán:
Sự khuếch tán trong chất lỏng là một quá trình tự diễn biến, dẫn đến sự phân bố đồng đềuchấttantrongtoànbộdungdịch.
Chất tan luôn có xu hướng tự chuyển từ chỗ có nồng độ cao đến chỗ có nồng độ thấp hơn.Dungdịchkeoởvàotrạngtháichuyểnđộngkhôngngừngnêncũngcótínhkhuếch tan.
Hạt keo cókích thướcrất lớnhơnkíchthướcphântửnêncókhối lượngcũnglớnhơn nhiều.Dướitácdụngcủatrọnglực,chúngbịkéoxuốnggâynênhiệntượngsalắng.
Tốcđộsalắngphụthuộckíchthướchạt keo.Vớihạt keocókíchthướcbé,sựsalắng chậm,cókhikéodàicảnămmớihoàntất.
◊Dungdịchkeocũnglàmgiảmápsuấthơibãohòa,làmtăngnhiệtđộsôi,làmhạnhiệt độđôngđặc,songmứcđộthểhiệnyếuhơndungdịchthậtcócùngnồngđộ. Giải thích.
b.Tínhhấpphụcủadungdịchkeo
Trongcáchệdịthểthườngxảyraquátrìnhmộtchấtnàythuhútcáctiểuphâncủakia.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Chấtthuhútthườnglàchấtrắnhoặcchấtlỏng.
Chấtbịthuhútcóthểlàchấtrắn,lỏnghoặckhí.
Nếu giữa chất thu hút và chất bị thu hút có phản ứng xảy ra thì đó là hiện tượng hấp
thụ Ví dụ: H2OhấpthụSO3
Nếuchấtbịthuhútchỉđượcgiữtrênbềmặtchấtthuhút,khôngcóphảnứnghóahọc, đólàhiệntượnghấpphụ. Ví dụ: thanhoạttínhhấpphụkhíclo.
Nguyên nhân của hiện tượng hấp phụ:
Các tiểu phân trên bề mặt một chất sẽ có một phía không bị các tiểu phân khác vây quanh,vì thếcáctiểuphânnàycó nănglượngtự dobềmặt,làmxuất hiệnkhảnăngthu hútcácchấtkhác.
Chấtcódiệntíchtiếpxúccànglớn,khảnănghấpphụcàngcao.
Cáctiểuphânkeocókíchthướcbéhơnrấtnhiềusovớicáchệthônêncóbềmặtphân
cáchlớn,vìthếcókhảnănghấpphụlớn.Tuynhiên,cáchạtkeocótíchđiệnnênsựhấp
phụcủahạtkeolàhấpphụchọnlọchaytraođổitrongdungdịchchấtđiệnli.
+Hấpphụchọnlọc:hạtkeochỉhấpphụcáciontíchđiệntráidấuvớiđiệntíchcủahạt keo.
+Hấpphụtraođổi:quátrìnhhấpphụgâynênsựtraođổiioncùngdấucủahạtkeovới môi trường. Trongquá trình này, nếu có sự trao đổi H+ hayOH‾, pH của môi trường sẽ thayđổi.
Trong thực tế, hiện tượng hấp phụ được ứng dụng để chế tạo các mặt nạ phòng độc, chiếttáccácchấtbằngphươngphápsắcký.
c.Tínhchấtquanghọccủadungdịchkeo
Khi chiếu một chùm tia sáng mạnh qua một cốc đựng dung dịch keo đặt trong buồng
tối, nếu nhìn ngang thì sẽ thấy một hình nón sáng rất rõ trong dung dịch hiện tượng
này gọi là hiệu ứng Tyndall, hiệu ứng tương tự như thế không thấy có trong các dung dịchphântử. Giải thích.

Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
d.Tínhchấtđiệncủadungdịchkeo
Cáchạtriêngbiệtcủahệkeogọilà mixen.
Cáchạtkeocódiệntíchbềmặtlớndođóvềphươngdiệnnhiệtđộnglàkhôngbền.Mặt khác, các tiểu phân keo trong hệ chuyển động hỗn loạn, va chạm liên tục. Nhưng trong thựctếddkeotrongnhữngđiềukiệnxácđịnh cóthểtồntạimộtthời giandàimàkhông dínhlạivớinhauvàlắngxuốngthànhkếttủa.Tạisao?
Nhưvậyphảicómộtlựcngăncảncáchạtkeotậphợpđểsalắng.Nguyênnhâncủalực ngăn cảnđólàđiện tích của các hạt keo.Điệntíchđóđược giảithíchtrên cơsở cấutạo củahạtkeo.
Cấutạocủakeokịnước:
(1) – Nhân: trung hòa điện, do một số lớn nguyên tử hay phân tử kết hợp lại với nhau.
(2) –Lớphấpphụ:donhâncóbềmặttựdotươngđốilớnnêncókhảnănghấpphụ loạiionnàođócủadungdịchvàtrởthànhbềmặtmangđiện.
Nhân ưu tiên hấp phụ một trong các ion đơn có trong thành phần cấu tạo của nhân.Cácionđượchấpphụphânbốquanhnhântạothànhlớphấpphụ.Lớpionhấpphụ nàycònđượcgọilàlớpiontạothế
(3) –Lớpionđối:lớpiontạothếcókhảnănghútmộtsốiontráidấuvớinó.Cácion tráidấunàyphânbốgầnnhântạolớpionđối.
Lớphấpphụvàlớpion đối nằm hoàntoàntrongmột lớpmỏngcùngchuyểnđộngvới nhângọichunglàlớpStern
Nhân,lớphấpphụvàlớpionđốiđượcxemnhưmộtionlớnmangdấucủalớphấpphụ, vàđượcgọilàhạtkeo (4) – Lớp khuếch tán: một số ion đối còn nằm lại trong môi trường phân tán tạo thànhlớpkhuếchtán. Lớpnàybị hạt keohút yếu nênchuyểnđộngtươngđối tựdo,còn gọilàlớplinhđộng.
Hạtkeovàlớpkhuếchtántạothànhmixen.Mixentrunghòađiện.
Dưới tác dụng của điện trường, hạt keo chuyển về một điện cực, còn lớp khuếch tán chuyểnvềđiệncựckia.
Hạtkeođượcgọilàdươngkhilớptạothếtíchđiệndươngvàngượclại.
Ví dụ: XácđịnhcấutạocủakeoAgIđượcđiềuchếtheophảnứng:(vẽhình)
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
a. AgNO3 +KIdư AgI +KNO3
b. AgNO3dư +KI AgI +KNO3
HóaĐạiCương
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Ví dụ 1:
Giải:
a.KhiKIdư sauphảnứngtrongdungdịchcócácion:…………………
Nhânkeolàcácphântử:………
Lớptạothếlàcácion:……… hạtkeomangđiện……
Lớpionđốivàlớpionkhuếchtánlàcácion:……
CấutạocủamixenkeoAgI(……):
b.KhiAgNO3 dư sauphảnứngtrongdungdịchcócácion:…………………
Nhânkeolàcácphântử:………
Lớptạothếlàcácion:……… hạtkeomangđiện……
Lớpionđốivàlớpionkhuếchtánlàcácion:……
CấutạocủamixenkeoAgI(……):
Cấutạocủa keo ưanước: hấpphụnhữngphântử nướchình thànhlớpvỏhidrat, lớp
vỏnàycũngngănkhôngchocáchạtkeogầnnhauvàđôngtụ.
Nguyên nhân tại sao dung dịch keo lại bền vững: các hạt keo tích điện cùng dấu sẽ
đẩy nhau
Có thể xác minh sự tích điện của các hạt keo bằng thực nghiệm: cho dòng điện một chiềuquadungdịchkeomangđiện(vídụđiệnâm)sẽdờivềcựcdươngvàngượclại.đó
là sự điện chuyển. (ứng dụng: tách sắt oxit ra khỏi đất sét)
5.2.4 Điều chế và tinh chế các dung dịch keo
a.Điềuchếdungdịchkeo
♠ Phương pháp phân tán: chianhỏhệthô
-Dùngcốixaykeođểnghiềncáchạtlớnthànhcáchạtnhỏhơn.Cóthểnghiềnhạtđến đườngkính10nm.
♠ Phương pháp ngưng tụ: tập hợp các nguyên tử, phân tử hay ion thành hệ có kích thướclớnhơn
♦ Ngưng tụ bằng phương pháp hóa học:
Điều chế dung dịch keo Fe(OH)3 bằng cách thêm từng giọt FeCl3 vào nước đang sôi, lúcđósẽxảyrasựthủyphântạorahidroxitsắt(III):
FeCl3 +3H2O Fe(OH)3 +3HCl
Trongđiềukiệnnày,Fe(OH)3 sinhrakhônglắngxuốngchokếttủamàphântántrong dungdịchtạothànhdungdịchkeocómàuđỏsẫmhaynâuđỏ.
Ví dụ 2:
Điều chế dung dịch keo AgI bằng cách cho AgNO3 tác dụng với dung dịch KI, một tronghaichấtđượclấydư: AgNO3 +KI AgI+KNO3
♦ Ngưng tụ bằng cách thay thế dung môi:
Ví dụ: Điềuchếkeolưuhuỳnh
Lưu huỳnh tan trong rượu nhưng không tan trong nước. Lấy một lượng nhỏ dung dịch lưu huỳnh tan trong rượu cho vào bình đựng nước lắc đều. Lúc này lượng rượu ít, lượng nước nhiều nên nước là dungmôi.Cácphântửlưuhuỳnhkhôngtantrongnướcsẽkếthợplạivớinhauthànhkeo lưuhuỳnh.
♦ Ngưng tụ bằng hồ quang điện: Cho hai điện cực kim loại nhúng vào môi trường phân tán. Nếu điện thế lớn, khi đưa hai điện cực đến gần nhau sẽ sinh ra hồ quang làm bay hơi các nguyên tử kim loại làm điện cực. Hơi kim loại bị làm lạnh trong môi trường phân tán sẽ ngưng tụ lại thành các tiểuphâncókíchthướccủahệkeo.
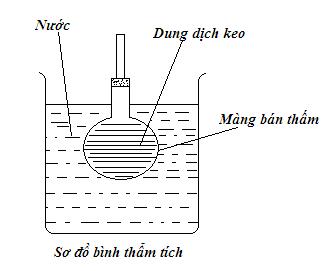
b.Tinhchếdungdịchkeo
♠ Thẩm tích thường
Dungdịchkeosaukhiđiềuchếluônchứacácchấtđiệnlilạ,làmsaikháccáctínhchất của dung dịch keo. Vì thế, người ta phải tách bỏ các chất điện li lạ có trong dung dịch keo.Quátrìnhtáchbỏchấtđiệnliđượcgọilà thẩm tích.Dụngcụtươngứnggọilà bình thẩm tích.
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
Sựthẩmtíchdựatrêncơsởtốcđộkhuếchtánkhácnhaucủacácionvàcủacáchạtkeo quamàngbánthấm.
Sơ đồ bình thẩm tích đơn giản nhất: túi đựngdungdịch keo được làm bằngmàngbán thấm, được nhúng vào một cốc nước tinh khiết (nước được thay đổi liên tục hay gián đoạn,tùyđiềukiện)(hìnhvẽ)
Cácphântửvàion chuyểnquamàngbánthấmdễdàng,cáchạt keobị giữlại.Khitúi
đựngdungdịchkeonhúngvàonướcthì:
ioncácchấtđiệnlikhuếchtán:dungdịchkeo nước
còncácphântửnước:nước dungdịchkeo
dungdịchkeođượclàmsạchkhỏichấtđiệnli.Tuynhiên,nếuthẩmtíchquálâuthì
khôngnhữngchấtđiệnlibịloạibỏmàcảcácchấtổnđịnhkeocũngmấtdần.
Nhượcđiểmcủaphươngphápnàylàlâu(mộtvàingàyđếnmộtvàituần)vàtốnnhiều nướccất.
♠ Điện thẩm tích:
Đểtăngtốcđộkhuếchtániontừdungdịchkeovàonước,ngườitakếthợpsựthẩmtích
thường và điện phân. Phương pháp đó được gọi là điện thẩm tích. Dụng cụ tương ứng
đượcgọilà bình điện thẩm tích (hìnhvẽ)
Dướitácdụngcủađiệntrườngcáccationchuyểnvềcatod,anionchuyểnvềanod,hoặc phóngđiệnhoặckhôngvàđềubị nướccuốnđi.Sựlàmsạchkeobằngphươngphápnày chỉđòihỏimộtvàigiờ.
Trong kỹ thuật, điện thẩm tích được ứng dụng làm sạch hệ keo, gelatin, chất màu và nhiềuchấtkhác.
Ngoàiphươngphápthẩmtíchngườitacònlàmsạchhệkeobằngphươngphápsiêulọc, quamànglọccókíchthướcnhỏhơnkíchthướchạtkeo.
5.3Độbềncủadungdịchkeovàsựkeotụ
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM HóaĐạiCương
5.3.1 Độ bền của dung dịch keo
Tínhbềnvữngcủakeokịnướclàdosựtíchđiệncùngdấucủacáchạtkeoquyếtđịnh.
Tính bền vững của keo ưa nước là do lớp vỏ hidrat quyết định. Lớp vỏ này ngăn cản
khôngchocáchạtkeodínhlại.
Ngoàiratínhbềnvữngcủacácdungdịchkeocòndosựchuyểnđộngnhiệtcủacáchạt keo. (tính bền động học)
5.3.2 Sự keo tụ hệ keo
Nếu bằngcách nào đó làm giảm haytrunghòa điện tích của các hạt keo kị nước hoặc làmmấtlớpvỏhidratcủacáchạtkeoưanướcthìcáchạtkeosẽdínhlạivớinhauvàkết tủa.Quátrìnhđóđượcgọilà sự đông tụ keo Cáckết tủakeocó cócấutrúckhácnhau. Loại keokị nướckhi lắngxuốngkhôngkéo nước theo nên kết tủa dưới dạngbột rất nhỏ haygiốngnhư bông. Ngược lại, các keo ưa nướckhilắngxuốngkéotheomộtlượngnướctươngđốilớnnênkếttủacótínhnhầy(gọi là hidrogel).Vídụ:thịtđông.
Dướiđâytaxétmộtsốphươngpháplàmđôngtụkeo.
a.Đôngtụbằngchấtđiệnli -Khichochấtđiệnlivàodungdịchkeokịnước,donồngđộiontrongdungdịchtăng lên nên các hạt keo sẽ hấp phụ thêm các ion ngược dấu làm điện tích của chúng giảm nhanh,kếtquảlàcósựđôngtụkeo.

Ví dụ: Sự tạo thành các châu thổ ở các cửa sông đổ ra biển là kết quả của sự đông tụ keobằngchấtđiệnlitrongnhiềunăm.Khinướcsôngvànướcbiểntrộnlẫnvớinhau,các hạtkeo,huyềnphùđấtsétdotácdụngcủacácmuốitrongnướcbiểnsẽbịkeotụ.
- Làm đôngtụ keo ưa nướckhóhơn nhiềuvì lớpvỏhidrat rất bền.Muốnlàmđôngtụ keoưanướcphảithêmmộtlượnglớnchấtđiệnliđểphávỡlớpvỏhidrat.
Ví dụ: trongnhàmáyxàphòng,ngườitaphávỡkeoxàphòngbằngcáchchomột lượng lớn tinh thể NaCl vào. Cũng có thể dùng các chất khử nước như axeton, rượu etylic,…đểgâyđôngtụkeo.
Khả năng đông tụ keo của một chất điện li phụ thuộc nhiều vào điện tích của ion trái dấuvớihạtkeo.Điệntíchcủaionnàycàngcaothìtácdụngđôngtụkeocàngmạnh,tức lượngchấtđiệnlidùngđôngtụkeocàngbé.
Ví dụ: tácdụngđôngtụkeoâmAs2S3 củacáccationnhưsau:
K+ :Ca2+ :Al3+ =1:20:1000
Trường Đại học Tài Nguyên và Môi Trường Tp.HCM
HóaĐạiCương
Phầnlớncácionhữucơ,H+,OH‾vàionkimloạinặngcókhảnănggâyđôngtụmạnh
hơnnhữngloạiionkháccócùngđiệntích.
b.Đôngtụbằngkeotíchđiệntráidấu
Khitrộnlẫnhaidungdịchkeotíchđiệntráidấu,cáchạtkeosẽtrunghòađiệntíchlẫn
nhauvàkếttủalắngxuống.
Ví dụ: QuátrìnhlàmtrongnướcbằngphènchuaK2SO4.Al2(SO4)3.24H2O:cáchạtkeo
đất sét, cát…làm nước đục là những hạt keo âm, khi gặp keo dương Al(OH)3 tạo thành trongnướcdosựthủyphânmuốiAl3+ sẽlắngxuốngthànhkếttủanênlàmnướctrong.
c.Đôngtụbằngcáchđunnónghaylàmlạnh
Mộtsốkeo,nhấtlàkeovôcơkhiđunnóngdễbịđôngtụ.Dokhinhiệtđộtăng,sựhấp phụ ion giảm, làm giảm điện tích của hạt keo, cùng lúc chuyển động nhiệt lại tăng nên
cáchạtkeodễvachạmvớinhaugâyđôngtụ.Hiệntượngnàyxảyrakhitađunnóngsữa.
Tínhbềncủakeovớinhiệtđộcókhácnhau:keoAs2S3 dễbịđôngtụkhiđunnóng,còn
keoFe(OH)3 khôngbịảnhhưởng.
Khilàmlạnhhệkeonướcđếnnhiệtđộđôngđặc,nước(môitrườngkhuếchtán)bịtách
ra,dođódungdịchkeobịkeotụ.
BÀITẬPCHƯƠNG1
PhầnI:Hiệuứngnhiệtcủaphảnứng
1.Biếthiệuứngnhiệtcủacácphảnứng:
2KClO3 2KCl+3O2 =-23,6kcal
KClO4 KCl+2O2 =+7,9kcal
Hãytínhhiệuứngnhiệtcủaphảnứng:4KClO3 3KClO4 +KCl
2.Xácđịnhsinhnhiệtcủarượumetylic(lỏng),biết:
(1)CH3OH(l) + O2(k) CO2(k) +2H2O(l) =-170,9kcal
(2)C(r) +O2(k) CO2(k) =-94,0kcal
(3)H2(k) +
O2(k)
H2O(l)
3.Viếtphươngtrìnhnhiệthóahọccủaphảnứng: Fe2O3(r) +3CO(k)
2Fe(r) +3CO2(k)
=-68,3kcal
Biếtrằngkhikhử53,23gFe2O3 bằngCOở điềukiệnđẳngápthì thấythoátra một nhiệtlượnglà2,25kcal.Cho
=159,69g
4.Khicho32,69gZntácdụngvớidungdịchH2SO4loãng trongđiềukiệnđẳngtíchở 25oC, người ta thấy thoát ra 17,10kcal. Tìm hiệu ứng nhiệt đẳng tích và hiệu ứng nhiệtđẳngáp.BiếtMZn =65,38;R=1,987.10-3kcal.
5.Tínhhiệuứngnhiệtđẳngtích
a.Fe2O3(r) +3CO(k)
b.2SO2(k) +O2(k)
Ucủacácphảnứngsauở25oC:
2Fe(r) +3CO2(k)
2SO3(k)
=-6,74kcal
=-46,88kcal
6.Ở25oC,1atm,2,1gbộtsắtkếthợpvớilưuhuỳnhtỏara0,87kcal(trongđiềukiện đẳngáp).Tìmnhiệtphânhủycủasắtsunfua.
7. Khihóahợp2,1gamsắtvớilưuhuỳnh,ngoàit oraFe c ntỏaramộtlượng nhiệtbằng3,77k .Hiệusuấtphảnứnglà100 .Tínhnhiệtt othànhcủaFe
8 Chocácphươngtrìnhnhiệthóahọcsau:
PbO + S +3/2O2 → Pb O4 ∆H1 =-165500cal
PbO + H2SO4.5H2O → Pb O4 + 6H2O ∆H2 =-23300cal
SO3 + 6H2O → H2SO4.5H2O ∆H3 =-49200cal
S +3/2O2 → O3 ∆H4
Tìm∆H4
9.Tínhnhiệtt othànhtiêuchuẩncủaFe2O3(r)từcácdữkiệnsau:
Fe2O3(r) +3CO(k)
C(thanchì)+O2(k)
C(thanchì)+
O2(k)
2Fe(r) +3CO2(k)
CO2(k)
CO(k)
=-6,74kcal
=-94,1kcal
=-26,42kcal
10.Tìmnhiệtt othànhtiêuchuẩncủaCa3(PO4)2 tinhthể,biết:
(1)12gCacháytỏa45,57kcal;
(2)6,2gPcháytỏa37,00kcal;
(3)168gCaOtácdụngvới142gP2O5 tỏa160,5kcal.
Hiệuứngnhiệtphảnứngđotrongđiềukiệnđẳngáp.
O2(k) CO2(k)
11.Phảnứng:CO+
o 398 ,pư=?
Biết: , pư= -67,64kcal/mol và nhiệt dung đẳng áp Cp của các chất CO(k), O2(k), CO2(k) lầnlượtlà:6,97;7,05;8,06(cal/mol.độ)
12.Tínhlượngnhiệtcầnthiếtđểnângnhiệtđộcủa0,5molnướctừ-50oClên500oC
ở áp suất 1atm. Biết: nhiệt nóng chảy của nước ở 273oK là 6004 /mol, nhiệt bay hơi của nước ở 373oK là 40660J/mol, = 35,56 /mol.độ; = 75,3 /mol.độ; =30,2–10-2T /mol.độ.
13.HãyxácđịnhnănglượngliênkếtC-HtrongphântửCH4,biết: =-18 kcal/mol; =104,2kcal/mol; =172kcal/mol.
14.Tínhhiệuứngnhiệtcủacácphảnứngsauở298oK
a)CaCO3(r) CaO(r)+CO2(k)
b)CH3CH2OH(l)+3O2(k) 2CO2(k)+3H2O(k)
c)C6H12O6(r)+6O2(k) 6CO2(k)+6H2O(l)
d)2SO2(k)+O2(k) 2SO3(k)
e)2Mg(r) + CO2(k) CO(k)+MgO(r)
C(r)+O2 (k)→CO2 (k) -94,4kcal.mol–1
H2 (k)+½O2(k)→H2O(l) -68,5kcal.mol –1
CH3OH(l)+1,5O2 (k)→CO2(k)+2H2O(l) -171kcal.mol–1
Tínhhiệuứngnhiệtcủaphảnứng:CO(k)+½O2 (k)→CO2(k)
PhầnII:Entropi–Thếđẳngnhiệtđẳngáp
20.Tínhbiếnthiênentropyở25oC(Δ )củacácphảnứng:
a)C(gr)+O2(k) CO2(k)
b)C(gr)+2H2(k) CH4(k)
c)SO2(k)+½O2(k) SO3(k)
d)N2(k)+2O2 (k) 2NO2(k)
e)CH4(k)+2O2 (k) 2CO2(k)+2H2O(k)
g)H2(k)+Cl2 (k) 2HCl(k)
-1) -66,37 -70,76 -94,4 -26,41 -143,84
15. Khi đốt cháy than chì bằng oxi ở 25oC người ta thu được 33 gam khí CO2 và 70,9kcalthoátra.Nhiệtt othànhtiêuchuẩncủakhíCO2 làbaonhiêu?
16.Căncứvàonănglượngliênkết: Liênkết
H C C H(k) + 2Cl Cl(k) H C C H(k)
C C C-C C-Cl Cl-Cl
Lưuhuỳnhthỏivàlưuhuỳnhđơntàlàhaid ngthùhìnhcủalưuhuỳnh.Hỏi:
a/Ở250C,d ngthùthìnhnàobềnhơn?
b/Nếugiảthiếtđơngiản:biếnthiênentanpivàentropiphảnứngítbiếnđổitheo nhiệtđộ,thìt inhiệtđộnàohaid ngthùhìnhcânbằngnhau?
S(thoi) (đơntà)
(kJ/mol) 0 0,3
Nănglượngliênkết(k /mol) 812 347 339 242,7
Cl Cl Cl Cl
Tínhbiếnthiênentanpitiêuchuẩncủaphảnứngsau:
17.Biếtnănglượngliênkết:
N N:941,4(kJ.mol–1);O=O:498,7(kJ.mol–1);N=O:629,7(kJ.mol–1)
Tínhenthalpyt othànhtiêuchuẩncủakhínitơoxit
18.Ở25oC1atm9gamnhômkếthợpoxitỏara278,3k .Tìmenthalpyt othành
tiêuchuẩncủanhômoxit
19.Chocácphươngtrìnhnhiệthóahọcsauđây:
(J.mol-1.K-1) 31,9 32,6
22.Tínhbiếnthiênthếđẳngnhiệtđẳngáp(ΔGo)củacácphảnứnghóahọcsau(xét ở25oC)
a)H2O2(l) 2H2O(l)+O2(k)
Cho:ΔH
=-384,07kJ.mol-1 ΔS
b)NH3(k)+HCl(k) NH4Cl(r)
Cho:ΔH
=-176,89kJ ΔS
c)3O2(k) 2O3(k)
ChoΔH
=+284,4kJ ΔS
=+235,31J.K–1
=-284,7J.K–1
=-139,89J.K–1
23.Dựavàotiêuchuẩnnàođểbiếtchiềutựdiễnbiếncủamộtquátrìnhhóahọc?
Chobiếtchiềutựdiễnbiếncủaquátrìnhsau:H2(k)+I2(k) 2HI(k)
ChoΔG (kJ.mol–1)H2 =0 I2 :19,37 HI:1,3
24.Xétchiềutựdiễnbiếncủaphảnứng:Fumarat+H2O malat
ChoΔH (kcal.mol-1)Fumarat144,4 H2O:56,7 malat:202 osánhđộbềncủafumaratvàmalat
25.Chophảnứng:N2O4 (k) 2NO2 (k)Chocácsốliệunhưsau:
ΔH (kcal.mol-1): N2O4 (k):2,31 NO2 (k):8,09
S
(cal.mol–1.K-1)N2O4 (k):72,73 NO2 (k):57,46
a)Ở100oCphảnứngxảyratheochiềunào?
b)Ở0oCphảnứngxảyratheochiềunào?
(cal/mol): 84,3 74,6 53,3
Giảthiết , khôngthayđổitheonhiệtđộ.
31.Biếtsinhnhiệttiêuchuẩn vàentropychuẩn o củacácchấtnhưsau:
Chất Fe(r) O2(k) FeO(r) Fe2O3(r) Fe3O4(r) (kcal/mol) 0 0 -63,7 -169,5 -266,9
So (cal/mol.oK) 6,5 49 14 20,9 36,2
Hãytínhbiếnthiênthếđẳngápt othànhcủacácoxitsắt,từđóchobiếtởđiềukiện chuẩn,oxitsắtnàobềnnhất?
32.Biếtnhiệtsinhtiêuchuẩn vàentropychuẩn o củacácchấtnhưsau:
Chất Ca(r) C(r) CO2(k) CaO(r) CO(k)
ởđiềukiệnchuẩn
o1 298,f H(kJ.mol) -102,3 -22,1 -98,6 -68,3
(kcal/mol) 0 0 -94,25 -151,96 -26,42
So(cal/mol.oK) 10 2 51,1 9,5 47,22
26.TínhbiếnthiênnănglượngtựdocủaphảnứngkhichoNaOHtácdụngvớiHCl
Chobiết NaOH(r) HCl(k) NaCl(r) H2O(l)
So(cal.mol-1.K-1) 125,12 44,7 17,32 16,7
27.Chophảnứng:2NO2(k) → N2O4 (k)
Chobiết NO2(k) N2O4 (k)
o1 298,tt H(kJ.mol) 8,09 2,309
So(cal.mol-1.K-1) 57,2 72,2
o1 298,f H(kJ.mol)
-Tínhbiếnthiênnănglượngtựdocủaphảnứngở0oCvà100oC
-Chobiếtchiềutựdiễnbiếncủaphảnứngởnhữngnhiệtđộđó
-XácđịnhxemởnhiệtđộnàothìΔG=0
Hãyxétxemởđiềukiệnchuẩn,CacóthểcháytrongkhíquyểnCO2 đượckhông?
33.Tính biếnthiênnănglượngtựdo Gibbs củaquátrìnhhìnhthành1molnướctừ
cácđơnchấtở25oC,1atm.Biết:
H2(k) +
O2(k)
H2O(l)
31,20 49,01 16,78 (cal.mol-1.K-1)
Nhiệtt othànhtiêuchuẩncủanướclỏnglà-68,317kcal.
35.Nănglượngtựdot othànhtiêuchuẩncủakhíetylenlà:68,43k /mol.Chobiết:
a.Etylencókhảnăngtựphânhủythànhthanchìvàkhíhidroở25oCkhông?
b. Thực tế người ta vẫn sử dụng, vận chuyển etylen trong các bình chứa kim lo i.
Điềunàycómâuthuẫnvớikếtluậntrênhaykhông?
36.Chobiếtnhiệtt othànhtiêuchuẩn,entropytiêuchuẩncủatừngchấtdướiđây:
CH3OH(l) +
O2(k)
CO2(k) +2H2O(k)
o1 f G(kJ.mol)
28.Chophảnứngnhưsau:NH4COONH2 (tt)
CO2 (k)+2NH3 (k)
Chobiết: NH4COONH2(thể tích) CO2 (k) NH3 (k)
-645,2 -393,5 -46,2
-458,0 -394,4 -16,64
Nếuphảnứngtrênđượcthựchiệnởthểtíchkhôngđổithìởđiềukiệnchuẩnvà
27oCphảnứngxảyratheochiềunào?
29.Giảthiếtcóphảnứng:H2S(k) +
O2(k)
H2O(k) +S(r).Hãychobiếthỗnhợphai
(kJ/mol) -238,66 0 -393,51 -241,82
(J/mol.K) 126,80 205,03 213,63 188,72
Tính hiệu ứng nhiệt đẳng áp phản ứng, hiệu ứng nhiệt đẳng tích phản ứng, biến thiênentropyphảnứng,biếnthiênthếđẳngápphảnứngởđiềukiệnchuẩn.
37.Trongcácphảnứngsau,phảnứngnàocó
a.C(r) +CO2(k)
b.CO(k) +
O2(k)
c.H2(k) +Cl2(k)
S>0;
S<0;
ítthayđổi?
2CO(k)
CO2(k)
2HCl(k)
khíoxivàH2 ởđiềukiệnchuẩncóbềnkhông?BiếtsinhnhiệtcủaH2O(k) vàH2S(k)
lầnlượtlà:-57,80;-48,00kcal/mol;
45,13;49,10;49,01và7,62cal/mol.K.
30.Ởnhiệtđộnàophảnứng:PCl5(k)
o s 298
S298 củaH2O(k),H2S(k),O2(k),S(r) lầnlượtlà
PCl3(k) +Cl2(k) xảyra.Biết:
(kcal/mol): -88,3 -66,7
d.S(r) +O2(k)
SO2(k)
38. a. Nhiệt nóng chảy của nước đá ở 0oC là 1436,3cal/mol. Hảy tính
của quá trìnhnóngchảy?
b.
củanướclà16,72cal/mol.độ;Cp củanướclà18cal/mol.độvàkhôngthayđổi
theonhiệtđộ.Xácđịnhentropytuyệtđốicủanướcở0oC.
PhầnIII:Độnghóahọc
39.Chophảnứng:H2 +I2
2HI
a.Viếtbiểuthứctốcđộchophảnứngbiếtrằng:
-Nếutăngnồngđộhiđrogấp đôi,giữnguyênnồngđộiôtthìtốcđộcũngtănggấp đôi.
-Nếugiữnguyênnồngđộhiđrovàtăngnồngđộiôtlêngấp3thìtốcđộcũngtăng gấp3.
b.Chobiếtbậcphảnứngvàphântửsố.
c.Tínhtốcđộbanđầu(vo)vàtốcđộsau20giây(v)củaphảnứng,biếtrằng:lúcđầu
có2,5molH2 tácdụngvới2,5molI2 trongbìnhdungtích10lit. au20(s)t othành
0,2molHI.Hằngsốtốcđộkcủaphảnứnglà8,33.10-3mol-1.l.s-1
40.Phảnứng:CH3Br+OH– CH2OH+Br–
Tốcđộbanđầuvo vànồngđộbanđầu[CH3Br]o và[KOH]o nhưsau:
Thínghiệm [CH3Br]o,M [KOH]o,M vo,mol.l
0,10
2 0,10 0,17
3 0,033 0,20
a.XácđịnhbậcriêngphầncủaCH3Br,củaKOHvàbậccủaphảnứng.
b.Tínhhằngsốtốcđộkcủaphảnứng.
41. Viết biểu thức tốc độ cho phản ứng sau, giả thiết chúng là các phản ứng một
chiềuđơngiản:
(1)2SO2(k) +O2(k)
(2)PCl5(k)
(3)C(r) +O2(k)
2SO3(k)
PCl3(k) +Cl2(k)
CO2(k)
(4)2Fe3+ (dd) +Sn2+ (dd)
2Fe2+ (dd) +Sn4+ (dd)
42.Phảnứng:2NO(k) +O2(k)
2NO2(k)
Tốcđộphảnứngthayđổinhưthếnàokhi:
a. tăngtốcđộoxilên4lần
b. giảmbớtnồngđộnitơoxit1/3sovớibanđầu
c. nồngđộNOvàO2 đềutănglên3lần
d. giảmnồngđộNO2 hailần
BÀITẬPCHƯƠNG2
1.Tínhhằngsốcânbằngở25oCcủacácphảnứngsau:
a. N2(k) + H2(k)NH3(k)
b.N2(k) +3H2(k)2NH3(k)
c.NH3(k) N2(k) + H2(k)
Chobiết =-16,5kJ.mol-1
2. Tính biến thiên thế đẳng áp và hằng số cân bằng của phản ứng sau đây ở điều kiệnchuẩn:NO(k) +O3(k)NO2(k) +O2(k)
Cho biết giá trị thế đẳng áp t o thành
O3 lầnlượtlà:51,29;0;86,25;163,2.
3.Cócânbằngsau:2A(k) +B(k)C(k) +D(k)
(kJ.mol-1) của các chất NO
2, O2, NO,
Cho10molkhíAvà4molkhíBvàomộtbìnhcódungtíchlà8litởnhiệtđộkhông đổi57oC.Khiđ tcânbằngtronghỗnhợpc nl i30 lượngchấtbanđầu.Tínhcác giátrịKp,Kc củaphảnứngt inhiệtđộtrên.
4.Chophảnứng:H2(k) +I2(k)2HI(k)
Ở 410oC các hằng số tốc độ phản ứng (theo nồng độ) kt = 0,0659 và kn = 0,00137.
Tính:
a.HằngsốcânbằngKc
b.Nếubanđầutrộn1molH2 với1molI2 trongbìnhcóthểtích1lít,thìkhiđ tđến cânbằngở410oC,nồngđộmỗichấttronghệlàbaonhiêu?
5.Tínhhằngsốcânbằngcủaphảnứngở25oC:
CH3COOH(l) +C2H5OH(l)CH3COOC2H5(l) +H2O(l)
Biếtphảnứngcó
=-3,828kJ/mol,
=8,7J/mol.K
6.TínhhằngsốcânbằngKp ở325oCcủaphảnứngt othànhNO2 sauđây: NO(k) +
O2(k)NO2(k)
Biếtphảnứngcó
=-56,484kJvàKp =1,3.106ở25oC.
7. Trộn 0,292mol H2(k), 0,292mol I2(k) và 3,96mol HI(k) vào một bình dung tích 2lít ở430oCxảyraphảnứngsau: H2(k) +I2(k)2HI(k) Kc =54,3
a.Hỏichiềucủaphảnứngnày?
b.Tínhnồngđộcáckhílúcđ ttớitr ngtháicânbằng.
8.Chophảnứng:CO(k) + H2O(k) CO2(k) +H2(k)
Hằngsốcânbằngcủaphảnứngở6900Klà10;Hiệuứngnhiệtcủaphảnứngtrong khoảng nhiệt độ này là - 42,67K /mol. Tính hằng số cân bằng của phản ứng ở 8000K.
9.Trộn1molkhíCOvới3molhơinướcở8500Ctrongbình1lít
CO(k) + H2O(k) CO2(k) + H2(k)
KhicânbằngđượcthiếtlậpsốmolCO2 là0,75mol.TínhKp vàKC
10.Viếtcáchằngsốcânbằngchocácphảnứngsau:
a)2CO(k) +O2(k) 2CO2(k)
b)CO(k)+1/2O2(k) CO2(k)
c)HCl.aq + AgNO3.aq AgCl(r)+HNO3.aq
11. Cho phản ứng: A + B C + D. Nếu tăng gấp đôi nồng độ của A, giữ nguyên nồngđộcủaBthìtốcđộphảnứngkhôngđổi.NếutănggấpđôinồngđộcủaB,giữ nguyênnồngđộcủaAthìtốcđộphảnứngtănggấpđôi.Viếtbiểuthứctốcđộphản
ứngtrên
12.XácđịnhchiềucủaphảnứngsauởnhiệtđộT=1000K: CO2 +H2 CO+
H2O(k) KP =0,71
13.T i3750CPhảnứngthuậnnghịchN2(k) + 3H2(K) 2NH3(k)cógiátrịhằng sốcânbằngKP =4,3.10-4 .TínhKc.
14.Chophảnứng:H2(k) +I 2(k)⇌2HI (k)
Ởnhiệtđộ430°C,hằngsốcânbằng KCcủaphảnứngtrênbằng53,96.Đunnóng một bình kín dung tích không đổi 10 lít chứa 2 mol H2và 1,6 mol I2. Tính nồng độ molcủaHIkhihệphảnứngđ ttr ngtháicânbằngở430°C.
15.Chophảnứngthuậnnghịch:2NO2(k)↔2NO(k) + O2(k)
Bằng thực nghiệm quang phổ xác định được nồng độ NO2 lúc cân bằng là 0,06M.
Xác định hằng số cân bằng KC của phản ứng trên, biết rằng nồng độ ban đầu của NO2 là0,3M.
BÀITẬPCHƯƠNG3
1.Hòatan50gKNO3 vào200gddNaCl10 .TìmC từngchất.
2.CầnlấybaonhiêugamNaOHđểphachế3lítddNaOH10 (d=1,115g/ml)?
3.Hòatan100gCuSO4.5H2Ovào400gddCuSO4 4 .TìmC ddmới.
4.Hòatan25gCaCl2.6H2Otrong300mlH2O.Ddcód=1,08g/ml.TìmC%,CM dd thuđược.
5.Trộn100gdungdịch10 vào50gdd40 cùngchấttan.TìmC củaddmới.
6.TìmsốgamddNaOH10 cầnthêmvào100gddNaOH30 đểđượcddNaOH 26%.
7. Tính thể tích dd axit HCl 38 (d1 = 1,194) và thể tích dd HCl 8 (d2 = 1,039) cầnđểphachếthành4lítdd20 (d=1,100).
8a. Tìm CN của dd H2SO4 khi pha 49g H2SO4 nguyên chất thành 200ml dd. Biết rằngkhichoddnàytácdụngvớiddNaOHtheophảnứngsau:
H2SO4 +2NaOH
Na2SO4 +2H2O
8b.Natricacbonatthamgiaphảnứng: Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
CầnlấybaonhiêugamNa2CO3.10H2Ođểphachế1litdungdịchNa2CO30,1N.
8c. Tìm thể tích dung dịch KMnO4 0,25N vừa đủ để oxi hóa 50 ml dung dịch NaNO20,2Mtheophươngtrìnhphảnứng(chưacânbằng): NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O
9.CầnbaonhiêumlddH2SO496 (d=1,84)đểphachếthành1lítdd0,5N?
10.TìmđộtancủaBaCl2 trongH2Oở0oCbiếtrằngt inhiệtđộđó13,1gddBaCl2 bãoh acóchứa3,1gBaCl2.
11.ĐịnhC ,độ tan ,CM củadungdịch(NH4)2SO4 bãoh a,nếu như20ml dung dịchđónặng20,94gchứa3,24gmuối(NH4)2SO4
12. Ở 80oC một dung dịch muối có khối lượng 310g. Khối lượng nước trong dung dịch nhiều hơn khối lượng muối 90g. Có bao nhiêu gam muối bị kết tinh l i nếu làml nhdungdịchđến0oC?Biếtđộtancủamuốiở80oClà55g,ở0oClà14,3g.
13.Tính hằng sốđiện licủaCH3COOH,biết rằngtrong dung dịch 0,1Mđộ điệnli
=0,0132.
14.Tínhđộđiện licủa axitxyanhidricHCNtrongdung dịchnồngđộ0,05M? Cho biếthằngsốđiệnlicủaHCNbằng7.10-10
15. Trong dung dịch nồng độ 0,1M, độ điện li của axit axêtic bằng 1,32 . Ở nồng độnàocủaddđểđộđiệnlicủanóbằng90 ?
16. Hòa tan 3,65g HCl thành 2 lít dd (A) và 0,01mol Ba(OH)2 thành 2lít dd (B).
Tínhnồngđộcáciontrongtừngddtrên.
17. Cần thêm bao nhiêu nước vào 300ml dd axit axêtic 0,2M (K = 1,8.10-5) để độ điệnlicủanótănggấpđôi?
18.Trộng20mlddNaOH0,1Mvới30mlddHCl0,08Mđược50mlddhỗnhợp.
a.Tínhnồngđộđầucácchấtphảnứng.
b. Tìm nồng độ cân bằng các ion H+ và Cl‾ trong dung dịch t o thành (bỏ qua sự điệnlicủanước).
19.Xácđịnhbazơliênhợpcủacácaxitsau:NH
,HNO3,HCOOHvàaxitliênhợp củacácbazơsau:NH3,CN‾,OH‾,Cl‾.
20.Hãychobiếtmôitrườngcủabadungdịchsau:NaOCl,Fe(NO3)3,KCl.Giải thích.
21.TínhpHcủacácdungdịchsau:
a.8gNaOHtrong1lítdungdịch.
b.CH3COOH0,1M,Ka =1,75.10-5
c.CH3COOH10-4M.
d.NaCH3COO10-2M.
e.NH4NO2 10-2M,Ka (NH )=5,56.10-10;Kb (NO )=2.10-11 .
22.BaonhiêugamKOHchứatrong10litdungdịchcópH=11?
23.TínhpHcủadungdịchchứađồngthờiCH3COOH0,1MvàHCl10-3M.BiếtKa
(CH3COOH)=1,75.10-5
24.TínhđộđiệnlivàpHcủadungdịchHCOOH1MvàcủadungdịchHCOOH
10-2M. osánhđộđiệnlicủaHCOOHởhaidungdịch.Giảithích.Ka(HCOOH)=
1,7.10-4
25.Cót othànhkếttủaMg(OH)2 khôngkhi:
a.Trộn100mlddMg(NO3)2 1,5.10-3Mvới50mlddNaOH3.10-5M.
b.TrộnhaithểtíchbằngnhaucủahaidungdịchMg(NO3)2 2.10-3MvàNH3 4.10-3
M.
BiếtT
=10-11;Kb(NH
) =1,8.10-5
26.Tínhđộh atanmol.l-1 củaBa O4 trongnướcnguyênchấtvàtrongdungdịch
BaCl2 10-2M.
27.Độh atancủaMg(OH)2 trongnướcnguyênchấtở25oCvà100oClầnlượtlà
8,99.10-3 g.l-1 và4,002.10-2 g.l-1
a.TínhtíchsốtancủaMg(OH)2 ởhainhiệtđộtrên.
b.TínhpHcủadungdịchbãoh aMg(OH)2 ở25oC.
Mg=24;O=16;H=1
BÀITẬPCHƯƠNG4
Câu1.Chobiếtchấtoxihóa,chấtkhửtrongtừngphươngtrìnhphảnứngdướiđây; chỉrõcáccặpoxihóa–khửliênhợptươngứng:
a. H2 +Cl2 HCl
b. Fe3+ +I‾ Fe2+ +I2
c. Mg+HNO3 Mg(NO3)2 +N2O +H2O
d. Cl2 +NaOH NaCl+NaOCl+H2O
Câu2.Chocácsơđồpinsau:
a. (Pt(r)),H2(k)│ H+ (dd) ║ Ag+ (dd) │ Ag(r)
b. Cu(r) │ Cu2+ (dd) ║ Cl‾(dd) │Cl2 (k),(Pt(r))
c. Zn(r) │ Zn2+ (dd) ║ Fe3+,Fe2+ │ Pt(r)
d. Fe(r) │ Fe2+ (dd) ║ Sn2+ (dd) │ Sn(r)
e. Zn(r) │ Zn2+ (dd) ║ H+ (dd) │H2 (k),(Pt(r))
1. Viết phản ứng ở các điện cực (anod, catod) và của pin cho từng nguyên tố Galvanictrên.
2.ViếtcôngthứcNernstđểtínhthếoxyhóachomỗiđiệncựcở25oC.
3.ViếtbiểuthứctínhsứcđiệnđộngcủacácnguyêntốGanvanictrên.
Câu3.Viếtcácsơđồpin(nguyêntốGanvanic)tươngứngvớiphảnứng:
a. Ag+ +Cu 2Ag +Cu2+
b. 2Fe2+ +Cl2 2Fe3+ +2Cl‾
c. Cl2 +H2 2H+ +2Cl‾
Nêurõanod,catod,dấuđiệncực,hướngchuyểndờicủae‾trêndâydẫnm chngoài vàchiềuquiướccủad ngđiện.
Câu 4. Hãy thiết lập một pin gồm hai điện cực chuẩn ở 25oC. Một điện cực là Pt trongdungdịch n4+/Sn2+,điệncựckialàPttrongdungdịchFe3+/Fe2+ :
a. Tính sức điện động tiêu chuẩn của pin, biến thiên thế đẳng áp đẳng nhiệt tiêu chuẩnởđiềukiệnchuẩnvàở25oC,biếtrằngφo(Fe3+/Fe2+)=0,771V;φo(Sn4+/Sn2+) =0,15V.
b. Nếu nồng độ của n4+ = 0,01M, của n2+ = 0,1M; của Fe3+ = 0,1M và Fe2+ = 0,001Mthìsứcđiệnđộngở25oCcủapinnàylàbaonhiêu?
Câu5:Chothếoxihóacủacáccặpsauở25oC: φ o(Fe3+/Fe2+)=0,771V;φo(Ag+/Ag)=0,7991V
a. Viếtphươngtrìnhhóa họcxảyrakhichocác cặpphảnứngvớinhauởđiều kiệnchuẩnvà25oC.
b. Trộn 50ml dung dịch AgNO3 0,01M với 25ml dung dịch Fe(NO3)2 0,02M, 25mldungdịchFe(NO3)3 0,05MvàbộtAgdư.
Hãytính∆Gcủaphảnứngsautrongđiềukiệnnàyở25oC: Fe2+ +Ag+ Fe3+ +Ag(tt)
Từkếtquảthuđượcchobiếtchiềuphảnứngtrên.
Câu6: ứcđiệnđộngcủapinsauở25oCbằng0,303V: Pt,H2 (1atm) │ NH4Cl0,1M ║ HCl1M │ H2 (1atm),Pt
TínhhằngsốđiệnliaxitKa củaNH và∆Gcủaphảnứngxảyratrongpin, biếtrằngcácquátrìnhhóahọcxảyraởcácđiệncựcnhưsau:
Anod:H2 +2H2O 2H3O+ +2e
Catod:2H3O+ +2e H2 +2H2O
Câu 7: Tính độ h a tan mol.l-1 trong nước ở 25oC của Ag2SO4 dựa vào suất điện
độngcủapinsauở25oClà0,109V: Ag │ ddAg2SO4 bãoh a ║ AgNO3 2M │ Ag
Câu8:Phảnứngnàodướiđâycóthểxảyrađược(cácchấtởtr ngtháichuẩn):
a. Zn+2H+ Zn2+ +H2
b. Cu+2H+ Cu2++H2
c. I2 +2Fe2+ 2I‾+2Fe3+
d. 2Fe3+ +Fe 2Fe2+
Câu9:Biếtthếđiệncựcoxyhóachuẩncủamộtsốnửaphảnứng:
Al Al3+ + 3e φ o =-1,663V
H2 2H+ + 2e φ o =0,000V
Co Co2+ + 2e φ o =-2,282V
Ag Ag+ + e φ o =0,799V
Zn Zn2+ + 2e φ o =-0,763V
Fe2+ Fe3+ + e φ o =0,771V
a. Xếpcácchấtoxihóatheotrậttựtínhoxihóatăngdần.
Xếpcácchấtkhửtheotrậttựtínhkhửgiảmdần.
b. Trongsốcáckimlo iđãcho,kimlo inàotácdụngđượcvớiddHClloãng?
Câu10:Biếtsứcđiệnđộngcủahainguyêntốsauđâyởđiềukiệntiêuchuẩn:
(-) Zn │ Zn2+ ║ Pb2+ │ Pb (+) Eo =0,637V
(-) Pb │ Pb2+ ║ Cu2+ │ Cu (+) Eo =0,463V
Tìmsứcđiệnđộngcủanguyêntốsauởđiềukiệnchuẩn:
(-) Zn │ Zn2+ ║ Cu2+ │ Cu (+)
Câu11:TínhhằngsốcânbằngKởđiềukiệntiêuchuẩncủaphảnứng: Zn+Cu2+ Zn2+ +Cu
Biết: φo (Zn2+/Zn)=-0,76V;φo (Cu2+/Cu)=0,34V
1. NHIỆTHÓA
HỌC
1.Chocácphươngtrìnhnhiệthóahọcsau:
S(thoi)+O2(k) SO2(k) ; Ho =-296,06kJ
(đơntà)+O2(k) SO2(k); Ho =-296,36kJ
Vậybiếnthiênentanpytiêuchuẩncủaquátrình: (thoi) (đơntà)là
A.–0,30kJ. B.+592,42kJ. C.–592,42kJ. D.+0,30kJ.
2.ChophảnứngCH4(k)+2O2(k) →CO2(k)+2H2O(k)
Biết H0 298,tt (CO2(k))=–393,5kJ/mol
H0 298,tt (H2O(k))=–241,8kJ/mol
H0 298,tt (CH4(k))=–74,9kJ/mol
Hiệuứngnhiệtcủaphảnứngtrênlà
A.+802,2kJ. B.–802,2kJ. C.–560,4kJ. D.+560,4kJ.
3.Chophươngtrìnhnhiệthóahọc:C(gr) +2N2O(k) CO2(k)+2N2(k) ; H0 =–557,5kJ
BiếtnhiệthìnhthànhcủaCO2(k) =–393,5k /mol;NhiệthìnhthànhcủaN2Olà
A.+164kJ/mol. B.+82kJ/mol. C.–82kJ/mol. D.–164 kJ/mol.
4.Phươngtrìnhcơbảncủanhiệtđộnghóahọclà
A.∆G=∆H+T∆ . B.∆G=∆H–T∆ . C.G=H+TS. D.G=H–TS.
5 Khihóahợp2,1gsắtvớilưuhuỳnhcótỏaramộtlượngnhiệtbằng3,77k ,hiệu suấtphảnứnglà100 .Nhiệtt othànhcủaFe là:
A.+100,5kJ/mol. B.+10,05kJ/mol.
C.-10,05kJ/mol. D.-100,5kJ/mol.
6.Chophươngtrìnhnhiệthóahọcsau: 2H2(k) + O2(k) →2H2O(l) ;∆Ho 298 =-571,68kJ
NhiệtphânhủycủaH2O(l)là
A.–571,68kJ/mol. B.–285,84kJ/mol.
C.+571,68kJ/mol. D.+285,84kJ/mol.
7.ChophảnứngCH4(k)+2O2(k) →CO2(k)+2H2O(l)
Biết H0 298,tt (CO2(k))=–393,5kJ/mol
H0 298,tt (H2O(l))=–285,8kJ/mol
/Cl‾)ở25oCdựavàocácsốliệusau: a. Fe3+
Fe
Cl2(k)
V o 0,036
H0 298,tt (CH4(k))=–74,9kJ/mol
NhiệtđốtcháycủaCH4 là
A.+560,4kJ/mol. B.–890,2kJ/mol.
C.+802,2kJ/mol. D.–604,4kJ/mol.
8.Chocácphươngtrìnhnhiệthóahọcsau
2KClO3 2KCl+3O2H =–23,6kcal
KClO4 KCl+2O2H =+7,9kcal
Hiệuứngnhiệtcủaphảnứng:4KClO3 3KClO4 + KCl là
A.–15,7kcal. B.-70,9kcal. C.–90,9kcal. D.+15,7kcal.
9.Chophươngtrìnhnhiệthóahọcsau:
2H2(k) + O2(k) →2H2O(l) ;∆Ho 298 =-571,68kJ
Nhiệtt othànhcủaH2O(l)là
A.–571,68kJ/mol. B.+571,68kJ/mol.
C.–285,84kJ/mol. D.+285,84kJ/mol.
10.Xácđịnh H0 298 củaphảnứng:N2(k)+O2(k) =2NO(k); Biết: N2(k)+2O2(k) →2NO2 ; H0 298 =+67,6kJ NO(k)+½O2(k) →NO2 ; H0 298 =–56,6kJ
A. –124,2kJ B. +124,2kJ C. –180,8kJ. D. +180,8kJ
11.Tínhhiệuứngnhiệtcủaphảnứngt othànhcủaC6H6 từC2H2 quaphảnứng trùnghợp.BiếtthiêunhiệtcủaC2H2 là:-310,62kcal,củaC6H6 là:–780,98kcal
A.+150,88kcal B.+94,52kcal
C.–150,88kcal D.–94,52kcal
12.TínhsinhnhiệtcủaC2H6.Biết Hc (C)=–94,05kcal/mol; Hc (H2)=–63,8 kcal/molvà Hc (C2H6)=–372,8kcal/mol.
A. –11,3kcal/mol. B. –6,7 kcal/mol. C.11,3kcal/mol.D. +6,7kcal/mol.
13.Chocácphảnứng: MgO(r)+2H+ (dd)→ Mg2+ (dd) +H2O(l) ; H0 298 =–145,6kJ
H2O(l) → H+ (dd) +OH–(dd) ; H0 298 =+57,5kJ
Tính H0 298 củaphảnứng:MgO(r)+H2O(l) =Mg2+ (dd) +2OH–(dd)
A. +203,1kJ B. –203,1kJ C. +30,6kJ D. –30,6kJ
14.Tính H0 298 củaphảnứng:2Mg(r)+CO2(k) →2MgO(r)+C(gr)
Biếtrằng H0 298,s (CO2)=–393,5kJ
H0 298,s (MgO)=–601,8kJ
A. +208,3kJ B. –208,3kJ C. +810,1kJ D. –810,1Kj
15.Chọnphươngánsai.Cácđ ilượngdướiđâyđềulàhàmtr ngthái:
a) Entanpi,nhiệtdungđẳngáp.
b) Nhiệtđộ,ápsuất.
c) Nhiệt,công.
16.Chọntrườnghợpđúng
d) Nội năng, nhiệt dung đẳng tích.
Đ ilượngnàosauđâylàhàmtr ngtháicóthuộctínhcườngđộ:
a) NhiệtđộT
b) CôngchốngápsuấtngoàiA
17.Chọnphươngánđúng:
c) NộinăngU
d) ThểtíchV
Xét hệ phản ứng NO(k) + 1/2O2(k) NO2(k) = -7.4 kcal. Phản ứng
đượcthựchiệntrongbìnhkíncóthểtíchkhôngđổi,sauphảnứngđượcđưavề
nhiệtđộbanđầu.Hệnhưthếlà:
a) Hệcôlập
b) Hệkínvàđồngthể
18.Chọnphươngánsai:
c) Hệkínvàdịthể
d) Hệcôlậpvàđồngthể
a) Hệđo nnhiệtlàhệ khôngtraođổichấtvànhiệt,songcóthểtraođổicông vớimôitrường.
b) Hệ hở là hệ không bị ràng buộc bởi h n chế nào, có thể trao đổi chất và nănglượngvớimôitrường.
c) Hệ cô lập là hệ không có trao đổi chất, không trao đổi năng lượng dưới d ngnhiệtvàcôngvớimôitrường.
d) Hệ kín là hệ không trao đổi chất và công, song có thể trao đổi nhiệt với môitrường.
20.ChọnphátbiểuchínhxácvàđầyđủcủađịnhluậtHess:
a) Hiệu ứng nhiệt đẳng áp hayđẳng tích của quá trình hóa học chỉ phụ thuộc vào bản chất và tr ng thái của các chất đầu và sản phẩm chứ không phụ thuộcvàođườngđicủaquátrình.
b) Hiệu ứng nhiệt của quá trình hóa học chỉ phụ thuộc vào bản chất và tr ng thái của các chất đầu và sản phẩm chứ không phụ thuộc vào đường đi của quátrình.
c) Hiệu ứng nhiệt đẳng áp hayđẳng tích của quá trình hóa học chỉ phụ thuộc vàobảnchấtcủacácchấtđầuvàsảnphẩmchứkhôngphụthuộcvàođường đicủaquátrình.
d) Hiệu ứng nhiệt đẳng áp của quá trình hóa học chỉ phụ thuộc vào bản chất vàtr ngtháicủacácchấtđầuvàsảnphẩmchứkhôngphụthuộcvàođường đicủaquátrình.
21.Chọnphươngánđúng:
của một quá trình hóa học khi hệ chuyển từ tr ng thái thứ nhất (I) sang tr ngtháithứhai(II)bằngnhữngcáchkhácnhaucóđặcđiểm:
a) Cóthểchotabiếtmứcđộdiễnracủaquátrình
b) Khôngđổitheocáchtiếnhànhquátrình.
c) Cóthểchotabiếtchiềutựdiễnbiếncủaquátrìnhởnhiệtđộcao.
d) Cóthểchotabiếtđộhỗnlo ncủaquátrình
22.Chọnphươngánđúng: củamộtphảnứnghoáhọc
a) Tùythuộcvàonhiệtđộlúcdiễnraphảnứng.
b) Tùythuộcvàođườngđitừchấtđầuđếnsảnphẩm.
c) Tùythuộcvàocáchviếtcáchệsốtỉlượngcủaphươngtrìnhphảnứng.
d) Không phụ thuộc vào bản chất và tr ng thái của các chất đầu và sản phẩm phảnứng.
23. Chọn phương án đúng: Trong điều kiện đẳng tích, phản ứng phát nhiệt là phản ứngcó:
a) A<0 b) U>0 c) ∆H<0 d) U<0
24.Chọnphươngánđúng: Chophảnứng:N2 (k)+O2 (k)=2NO(k) có =+180.8kJ.
Ở điều kiện tiêu chuẩn ở 25oC , khi thu được 1 mol khí NO từ phản ứng trên thì:
a) Lượngnhiệtthuvàolà180.8k .
b) Lượngnhiệttỏaralà90.4k .
25.Chọnphươngánđúng:
c) Lượngnhiệtthuvào là90.4k .
d) Lượngnhiệttỏaralà180.8k .
Hệthốnghấpthumộtnhiệtlượngbằng300k .Nộinăngcủahệtăngthêm250 k .Vậytrongbiếnđổitrêncôngcủahệthốngcógiátrị:
a)-50k ,hệsinhcông
b)50k ,hệsinhcông
c)-50k ,hệnhậncông
d)50k ,hệnhậncông
26.Chọnphươngánđúng: Trongmộtchutrình,cônghệnhậnlà2kcal.Tínhnhiệtmàhệtraođổi:
a) -2kcal b) +4kcal c) +2kcal d) 0
27.Chọnphươngánđúng:
Mộthệcónộinănggiảm(∆U<0),khiđitừtr ngthái1sangtr ngthái2trong
điềukiệnđẳngáp.Biếtrằngtrongquátrìnhbiếnđổinàyhệtỏanhiệt(<0),
vậyhệ:
a) Sinhracông
b) Nhậncông
28.Chọnphươngánđúng:
c) Khôngtraođổicông
d) Khôngdựđoánđượcdấucủacông
Trongđiềukiệnđẳngáp,ởmộtnhiệtđộxácđịnh,phảnứng:
A(r) + 2B(k) = C(k) + 2D(k) phátnhiệt.Vậy:
a) U<H
b) U = H
29.Chọnphươngánđúng:
c) U>H
d) Chưađủdữliệuđểsosánh
Tính sự chênh lệch giữa hiệu ứng nhiệt phản ứng đẳng áp và đẳng tích của
phảnứngsauđâyở25oC:
C2H5OH(ℓ) + 3O2 (k) = 2CO2(k) + 3H2O(ℓ) (R=8.314 /mol.K)
a) 4539J b) 2478J c) 2270J d) 1085J
30 Chọnphươngánđúng:
Một phản ứng có H = +200 k . Dựa trên thông tin này có thể kết luận phản
ứngt iđiềukiệnđangxét:
1)thunhiệt.
2)xảyra nhanh.
3)khôngtựxảyrađược.
a) 2,3 b) 1 c) 1,2,3 d) 1,3
31 Chọngiátrịđúng.
Khiđốtcháythanchìbằngoxyngườitathuđược33gkhícacbonicvàcó70.9
kcal thoát ra ở điều kiện tiêu chuẩn, vậy nhiệt t o thành tiêu chuẩn của khí
cacboniccógiátrị(kcal/mol).
a) -70.9 b) 94.5 c) -94.5 d) 68.6
32 Chọnphươngánđúng:
Tính củaphảnứngsau:H2C=CH–OH⇄H3C–CH=O
Chobiếtnănglượngliênkết(k /mol)ở250C,1atm:
EC=C =612kJ/mol EC–C =348kJ/mol
EC–O =351kJ/mol EC=O =715kJ/mol
EO–H =463kJ/mol EC–H =412kJ/mol
a) -49kJ b) +49kJ c) +98kJ d) –98kJ
33. Lượng nhiệt tỏa ra khi đốt cháy 3g kim lo i Mg bằng O2(k) t o ra MgO(r) là
76k ởđiềukiệntiêuchuẩn.
Nhiệtt othànhtiêuchuẩn(kJ/mol)củaMgO(r)là:(MMg =24g).
a) +608kJ b) –608kJ c) +304kJ d) –304kJ
34.Chọnphươngánđúng:Phảnứng:
Mg(r)+½O2(k) MgO(r)
làphảnứngtỏanhiệtm nh.Xétdấu o , So , Go củaphảnứngnàyở25oC:
a) Ho<0; So<0; Go<0
b) Ho>0; So>0; Go>0
c) Ho<0; So>0; Go>0
d) Ho>0; So>0; Go<0
35.Chọnphươngánđúng:
PhảnứngH2O2 (ℓ) H2O(ℓ) +½O2 (k)tỏanhiệt,vậyphảnứngnàycó:
a) H>0; S<0; G<0 cóthểxảyratựphátởnhiệtđộthường.
b) H>0; S>0; G>0 khôngthểxảyratựphátởnhiệtđộthường.
c) H<0; S>0; G<0 cóthểxảyratựphátởnhiệtđộthường.
d) H<0; S>0; G>0 khôngthểxảyratựphátởnhiệtđộthường.
36.Chọncâuđúng.Phảnứng:2A(r)+B(ℓ)=2C(r)+D(ℓ) có:
a) S=0
b) S 0
c) S>0
d) S<0
37.Chophảnứng:2NO+2H2 →N2 +2H2O
Biếtrằng: khităng nồngđộNO lêngấp đôithìtốcđộphảnứngtăng4lần,c n khităngnồngđộH2 lêngấpđôithìtốcđộphảnứngtănglên2lần.
Phảnứngtrêncóphươngtrìnhtốcđộlà
A.v=k[NO][H2]. B.v=k[NO]2[H2]2 .
C.v=k[NO]2[H2]. D.v=k[NO][H2]2 .
38.Chophảnứngđơngiản:2NO(k)+Cl2(k) 2NOCl(k).Tốcđộcủaphảnứng thayđổinhưthếnàokhităngnồngđộNOlên2lần?
A.Tăng2lần. B.Tăng4lần. C.Tăng6lần.
D.Tăng8lần
39.Chophảnứng: 2NO+2H2 N2 +2H2O
Biết rằng khi tăng nồng độ NO lên gấp đôi thì tốc độ phản ứng tăng 4 lần, c n khităngnồngđộH2 lêngấpđôithìtốcđộphảnứngtănglên2lần.Biểuthứctốcđộ củaphảnứngtrênlà:
A.v=k[NO]2[H2]2 B.v=k[NO][H2]. C.v=k[NO][H2]2 D.v= k[NO]2[H2].
40.Chọncâusai: Tốcđộphảnứngphụthuộcvào
A.Bềmặttiếpxúcgiữacácchấtphảnứng. B.Nồngđộcácchấtthamgiaphản ứng.
C.Thờigianxảyraphảnứng. D.Chấtxúctác.
2. CÂNBẰNGHÓAHỌC
1.Cho2,75molkhíHIvàobìnhdungtích1lít,ở250oC,xảyraphảnứngphânhủy HI:
2HI(k) H2 (k)+I2(k)
Ởtr ng tháicânbằng [H2]=0,275 mol/lít.HằngsốcânbằngK của phảnứng ở nhiệtđộđóbằng
A.10. B.64. C.0,0164. D.0,0156.
2.Chophảnứng:Fe2O3(r) +3CO(k) =2Fe(r) +3CO2(k),hằngsốcânbằng Kp cód ng: A.
