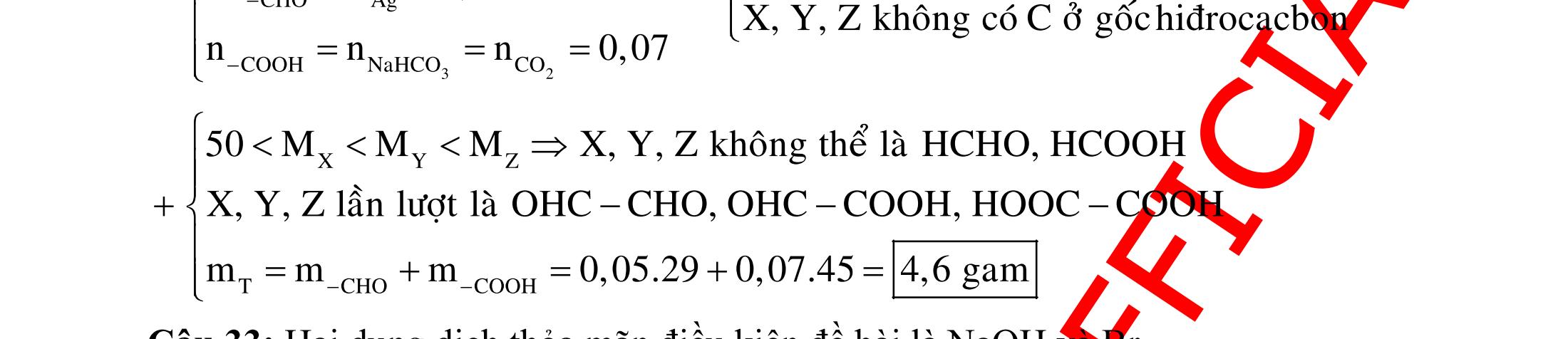
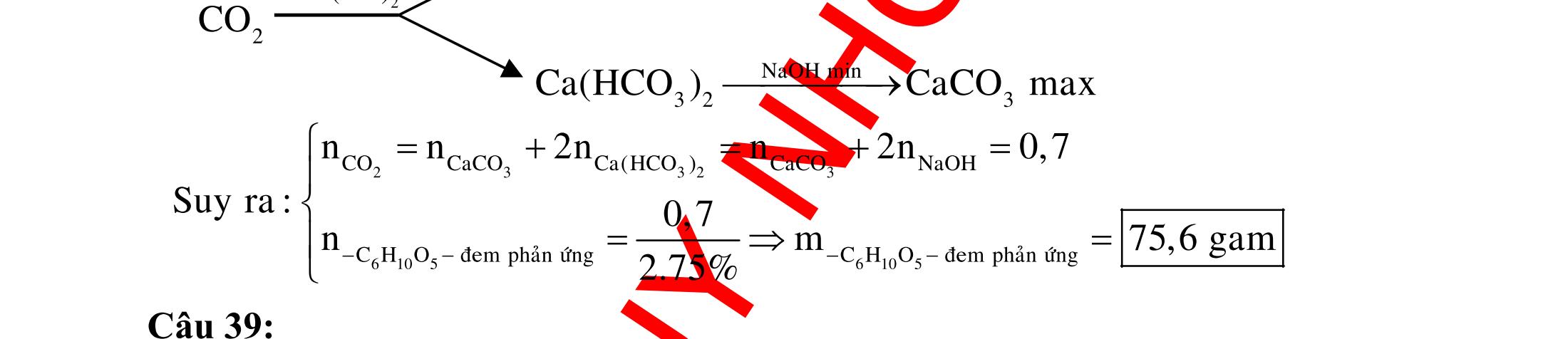
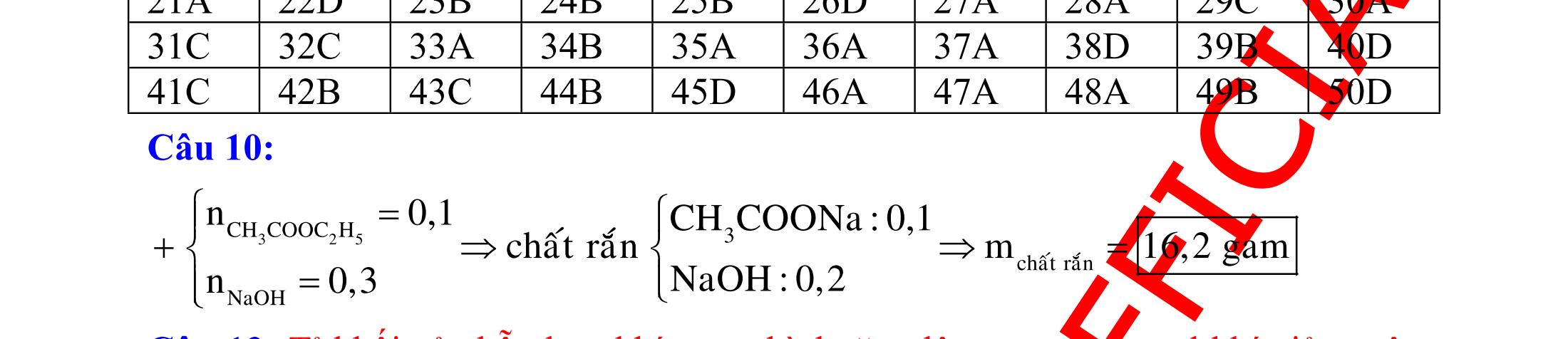
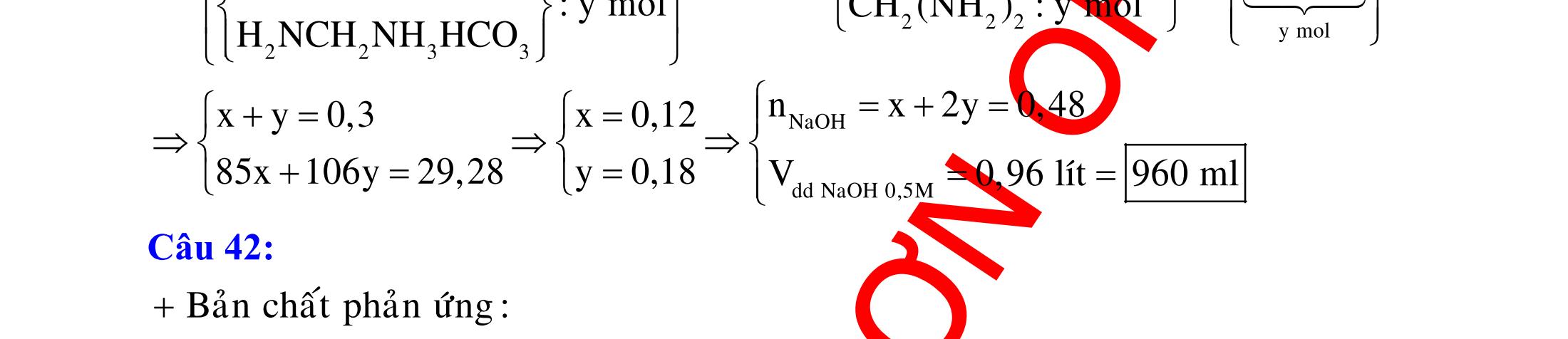
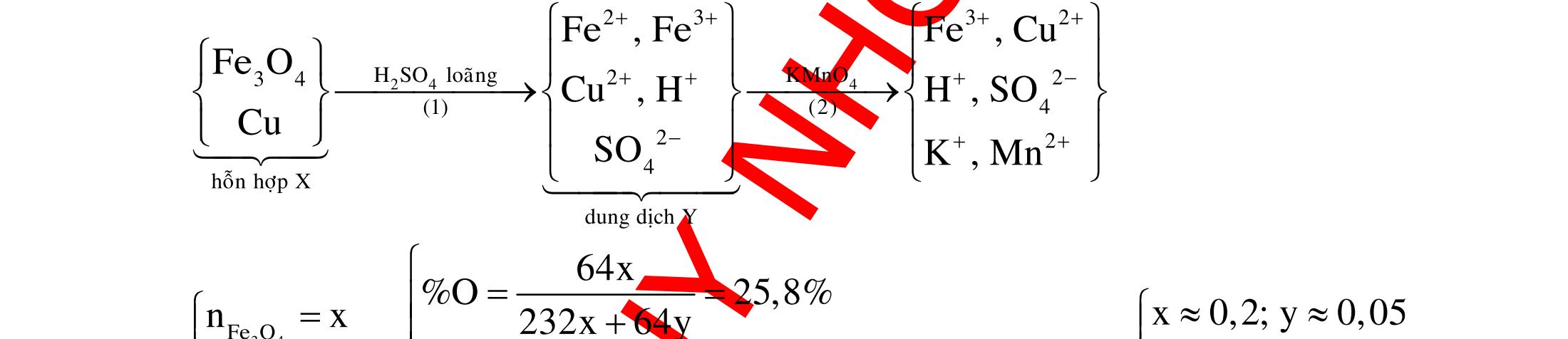
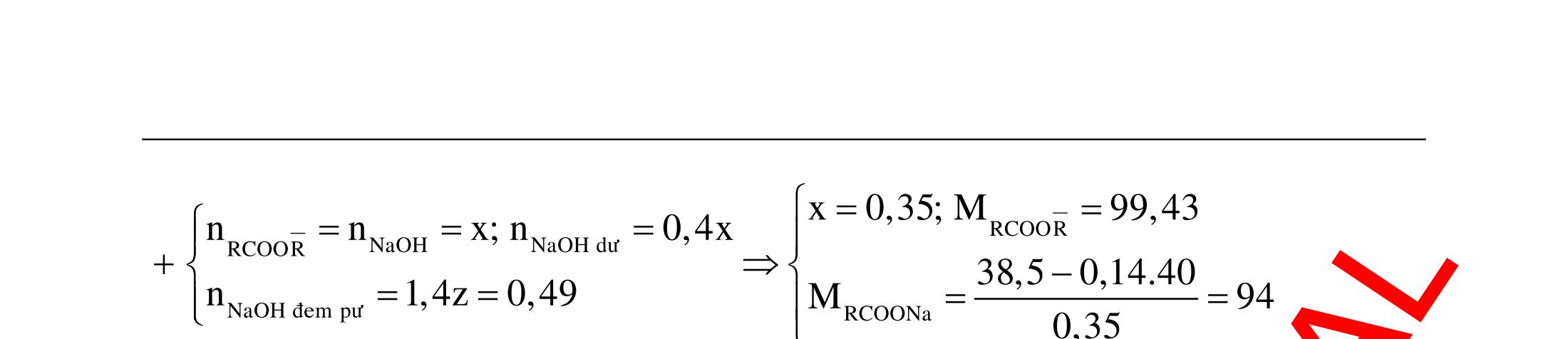
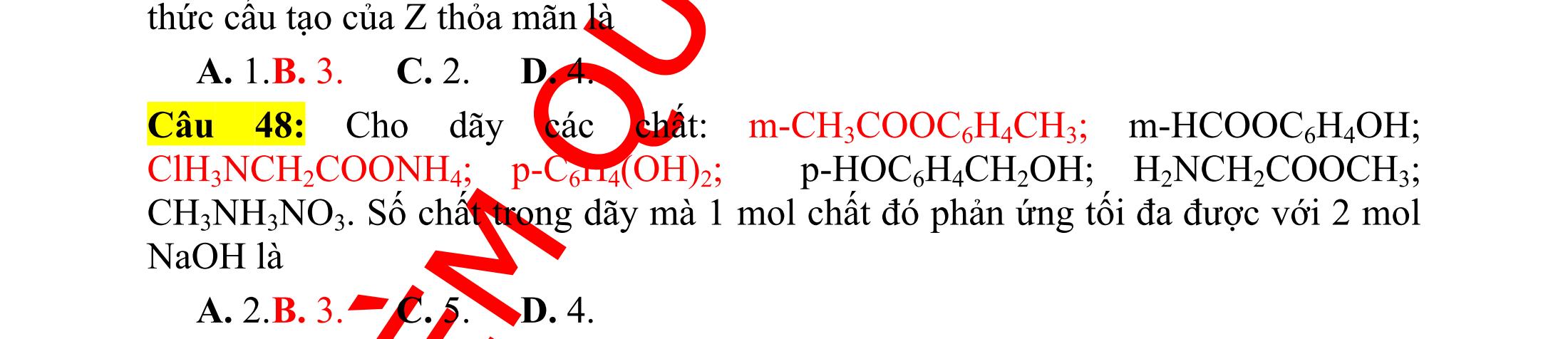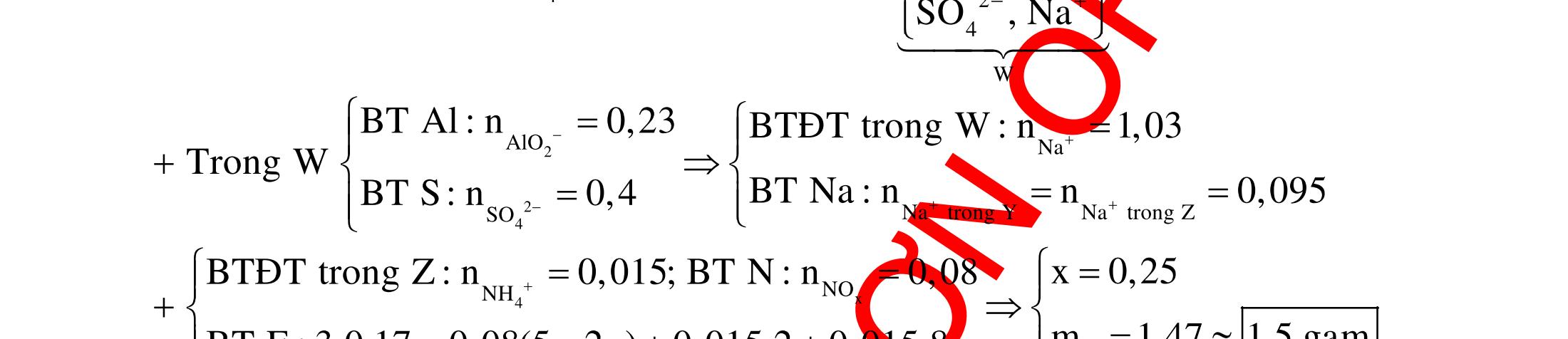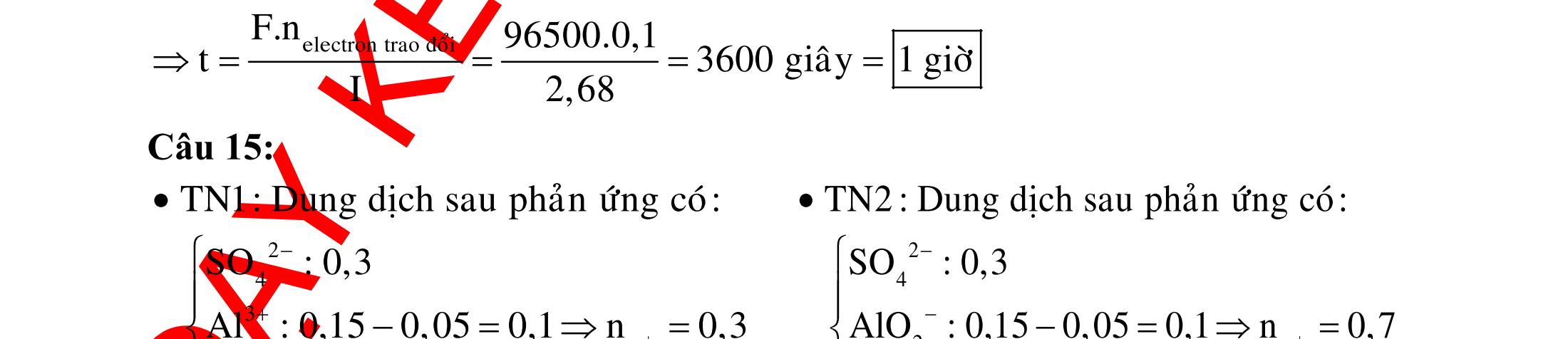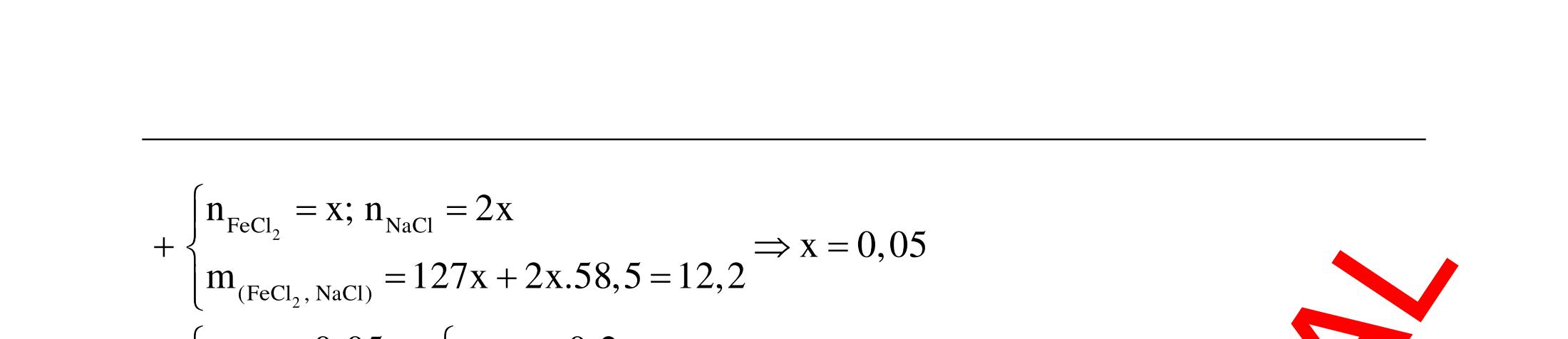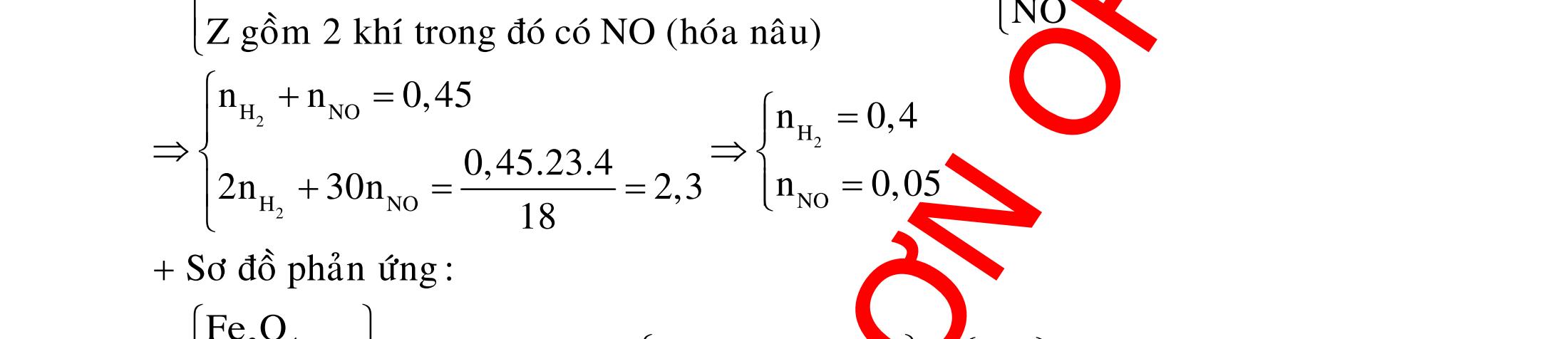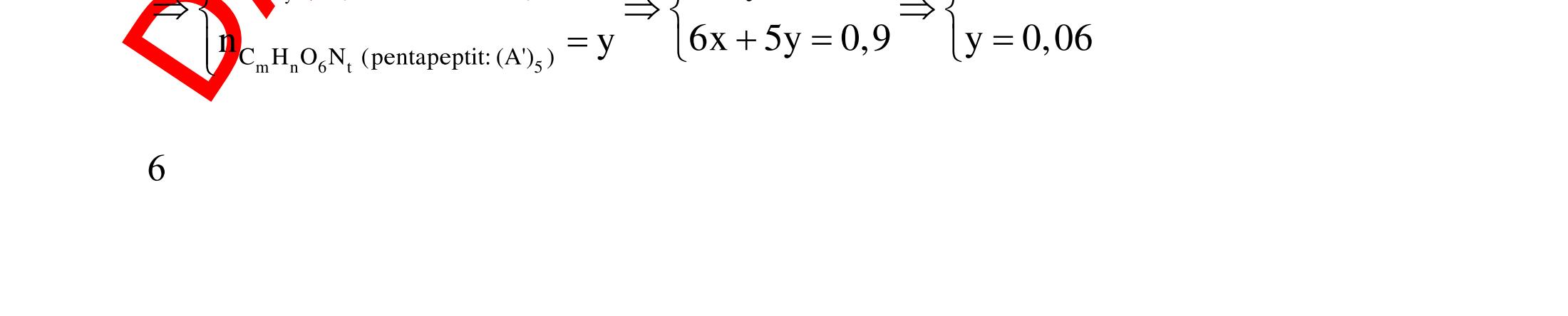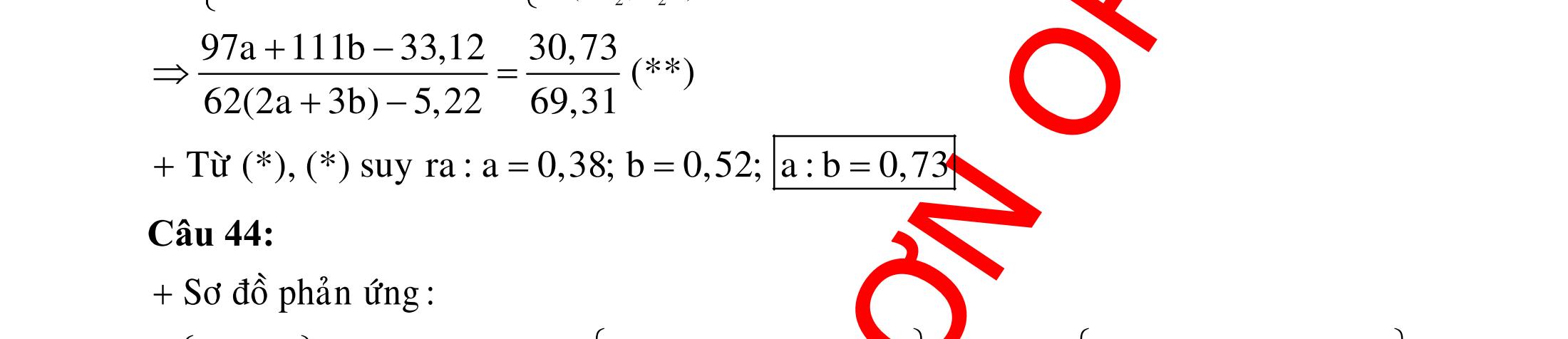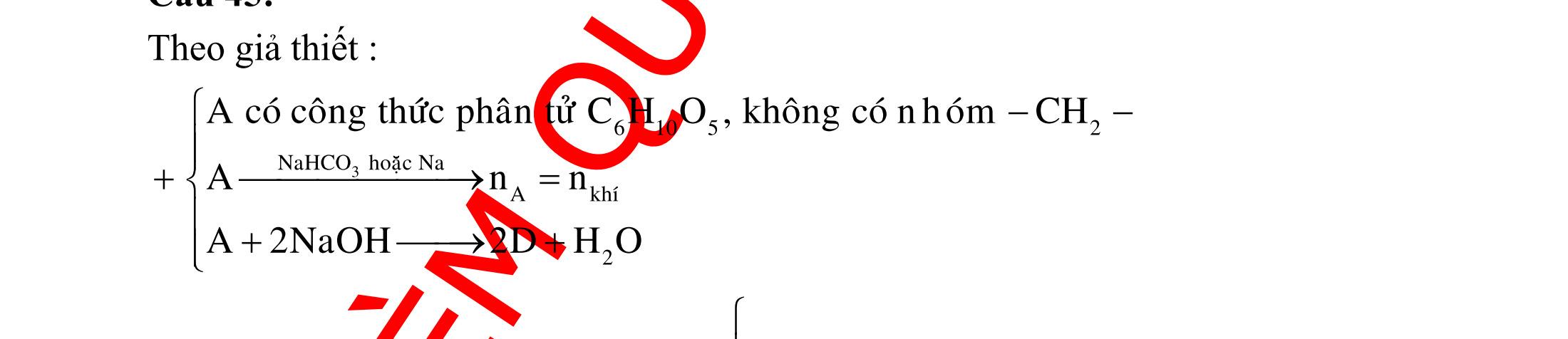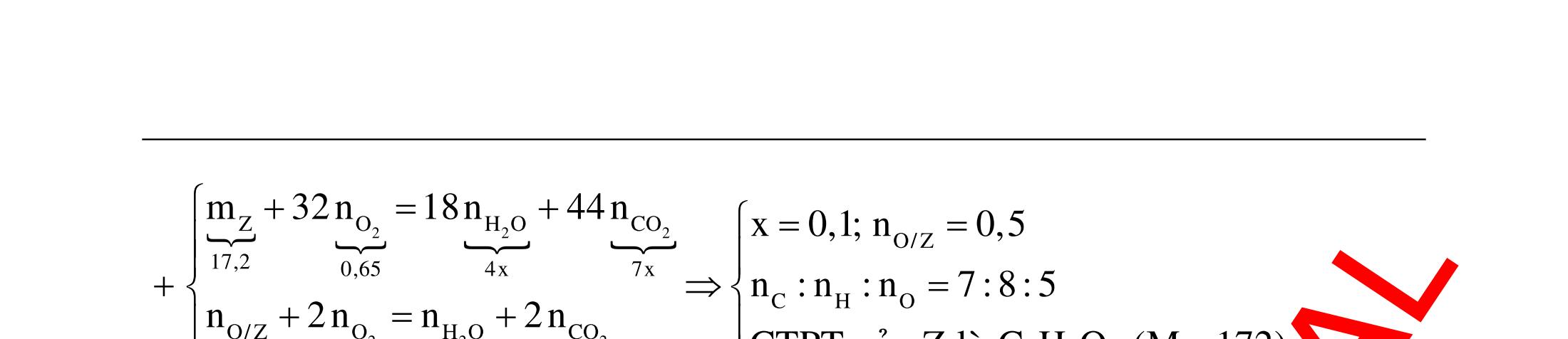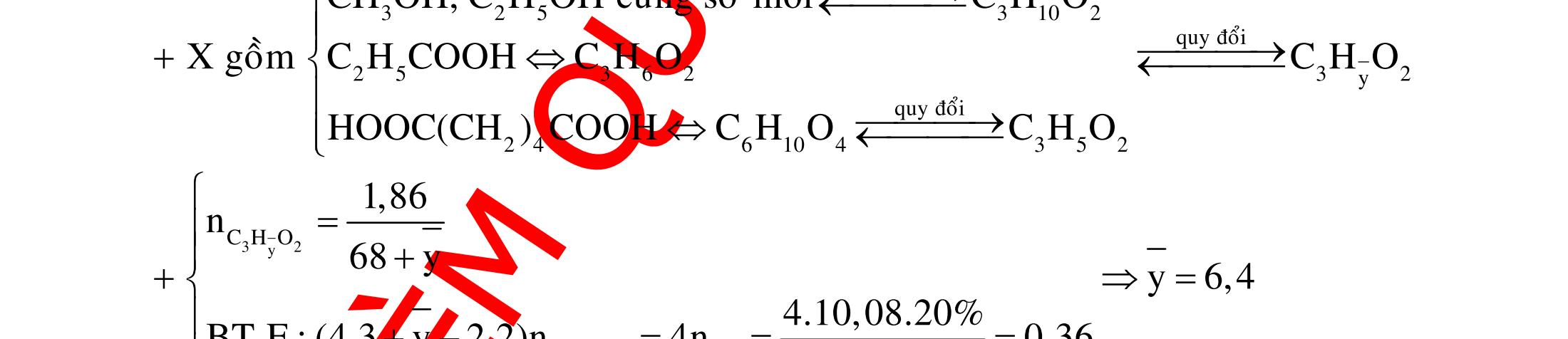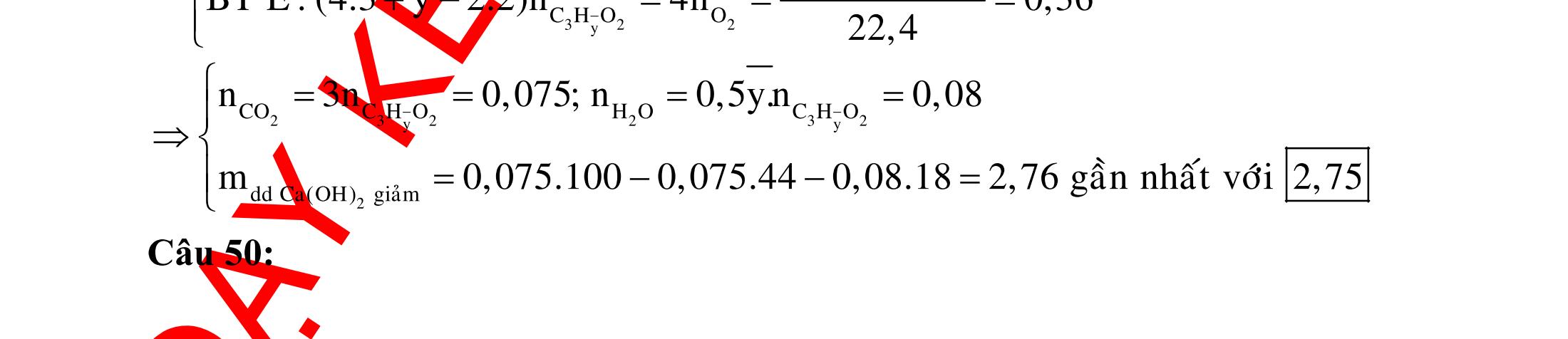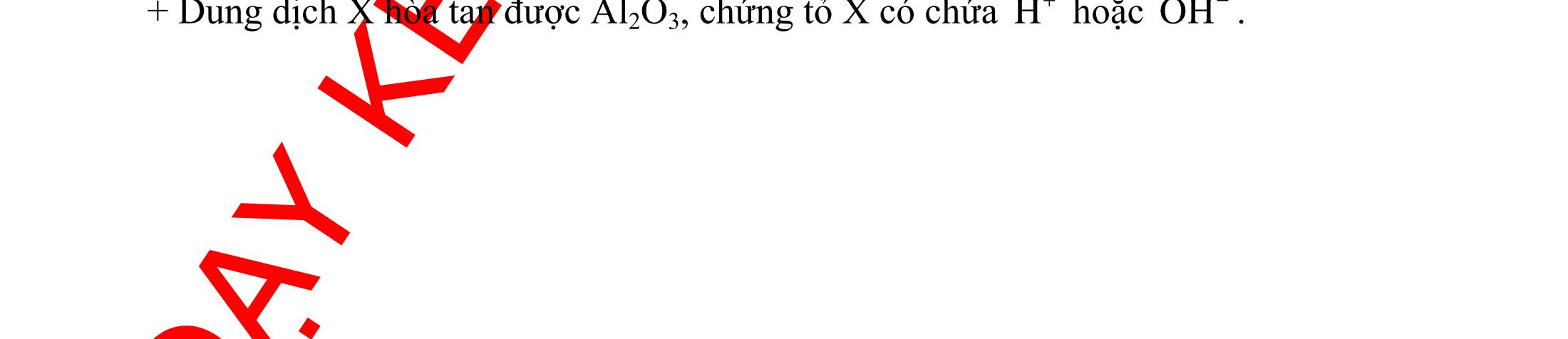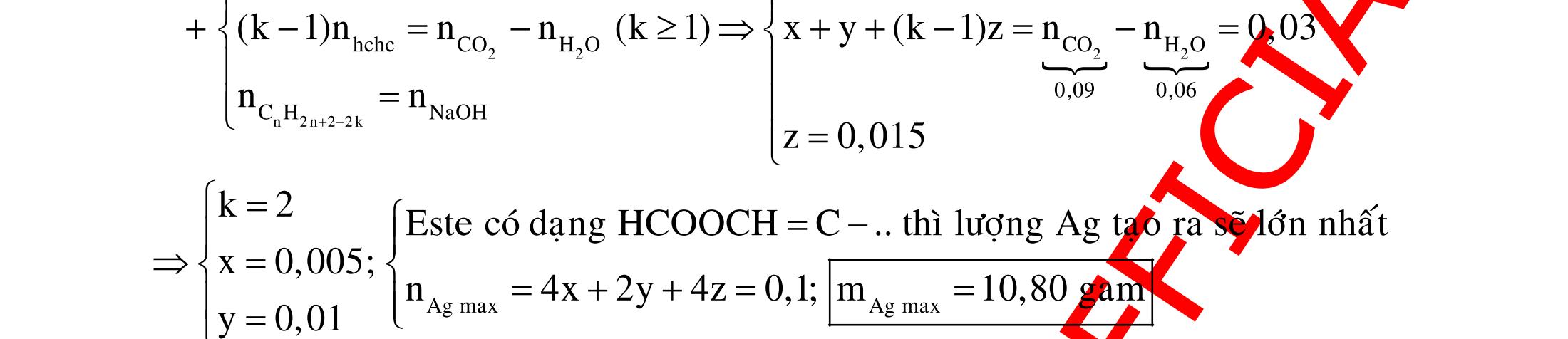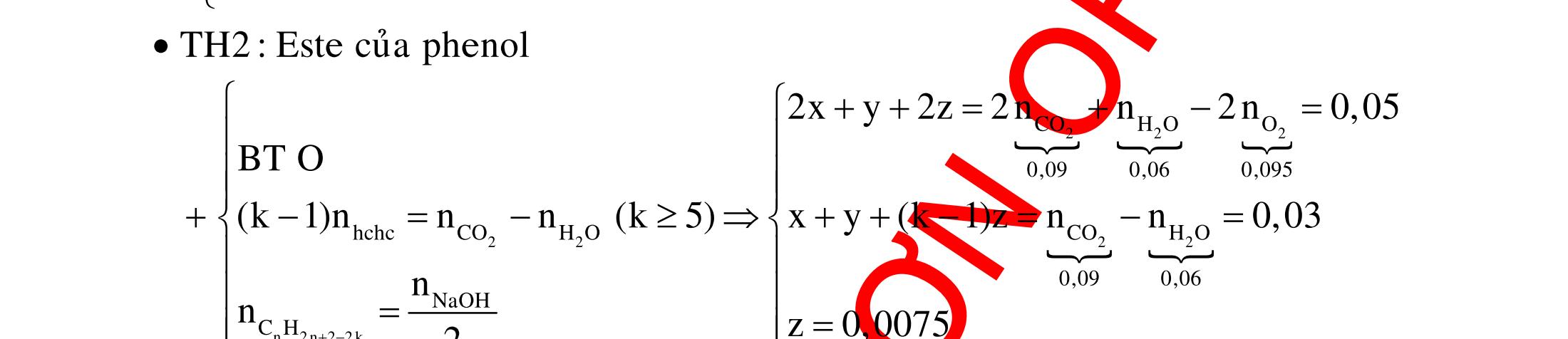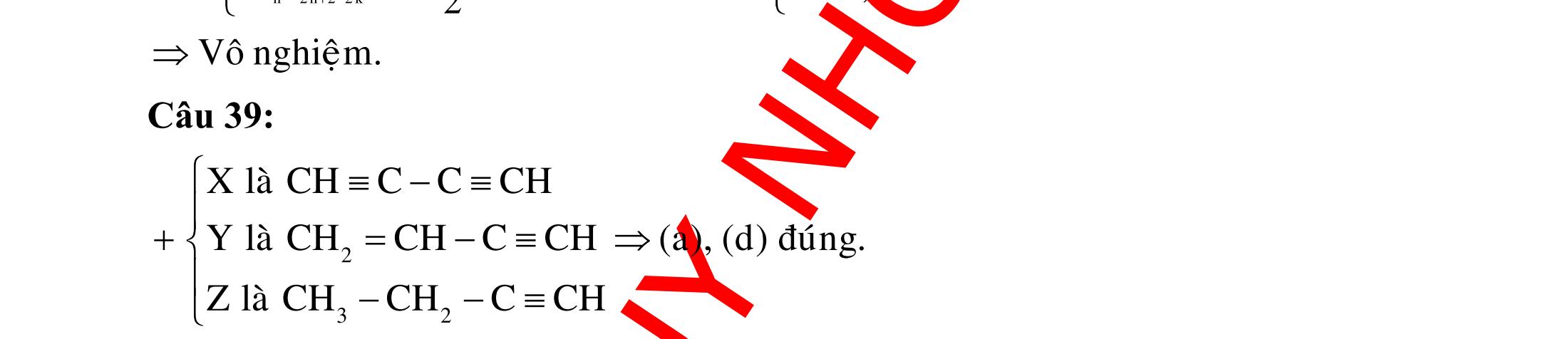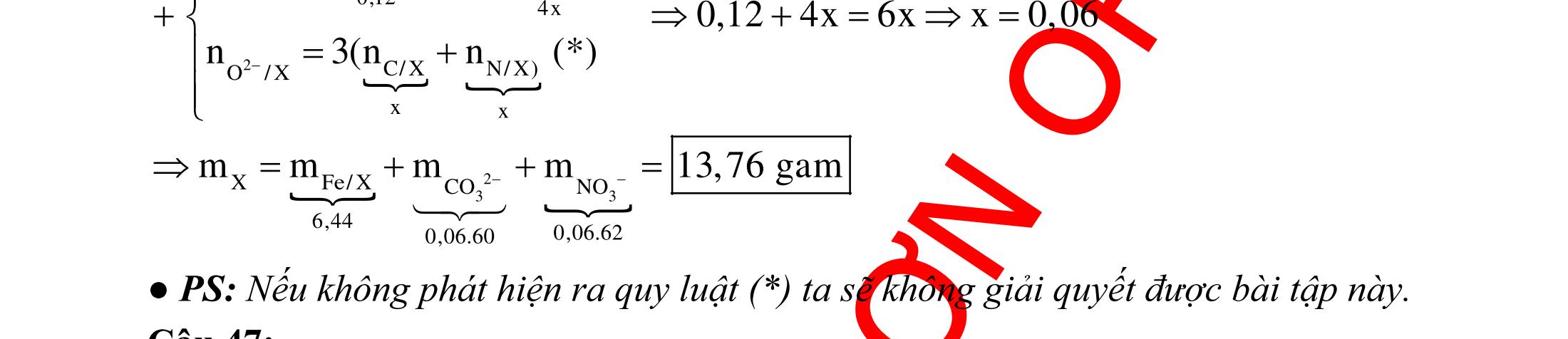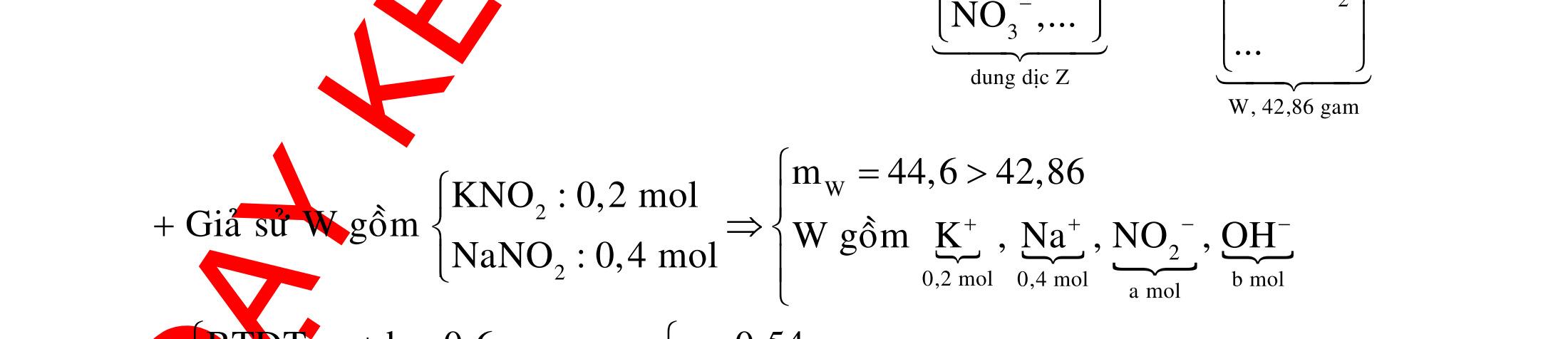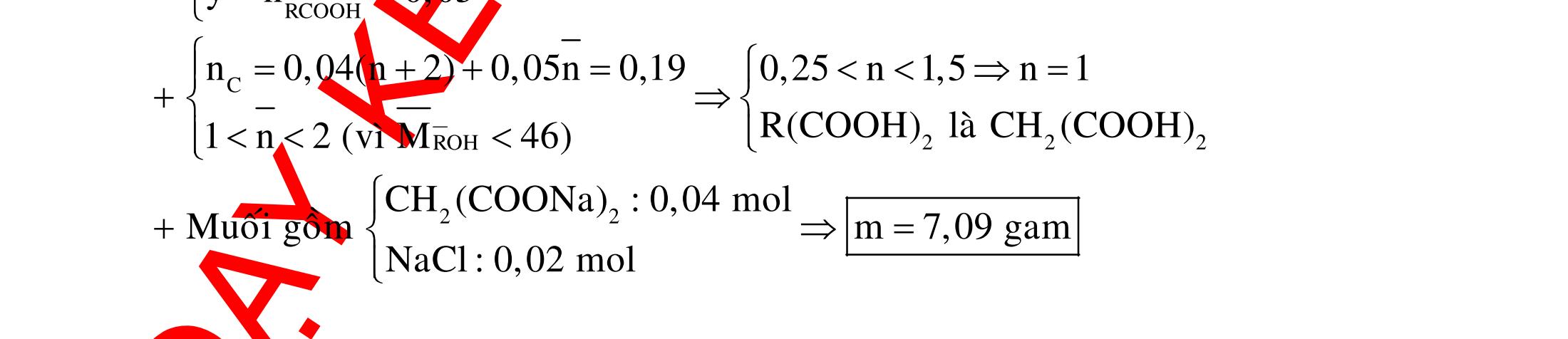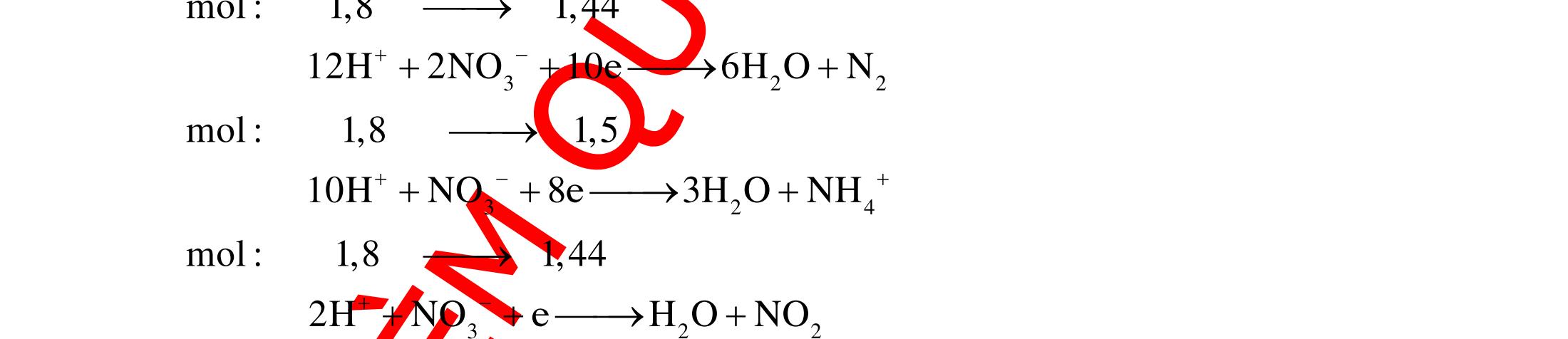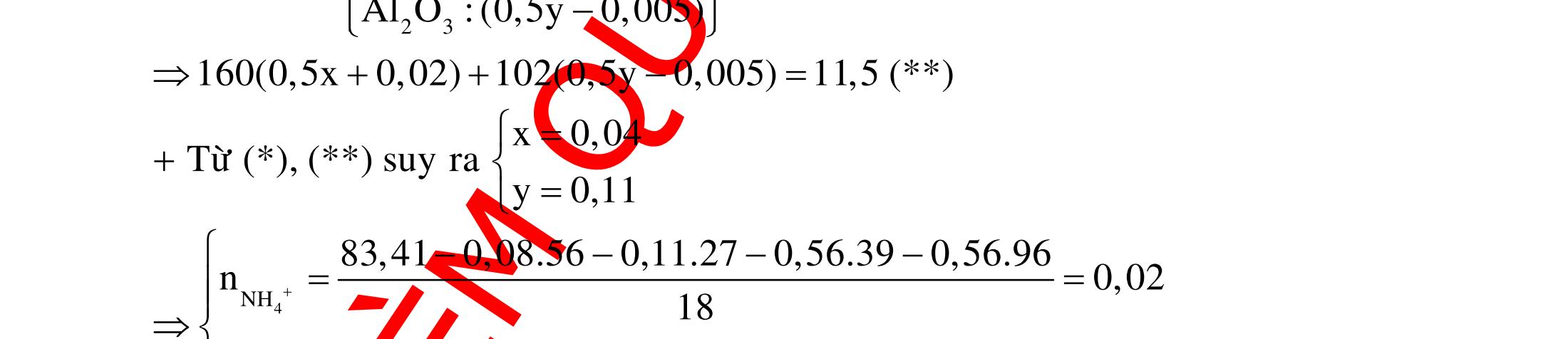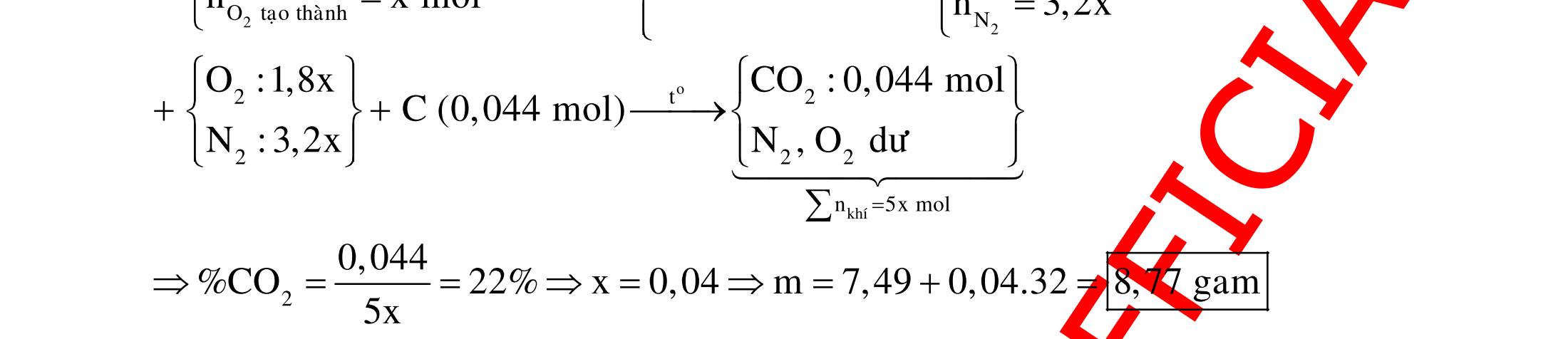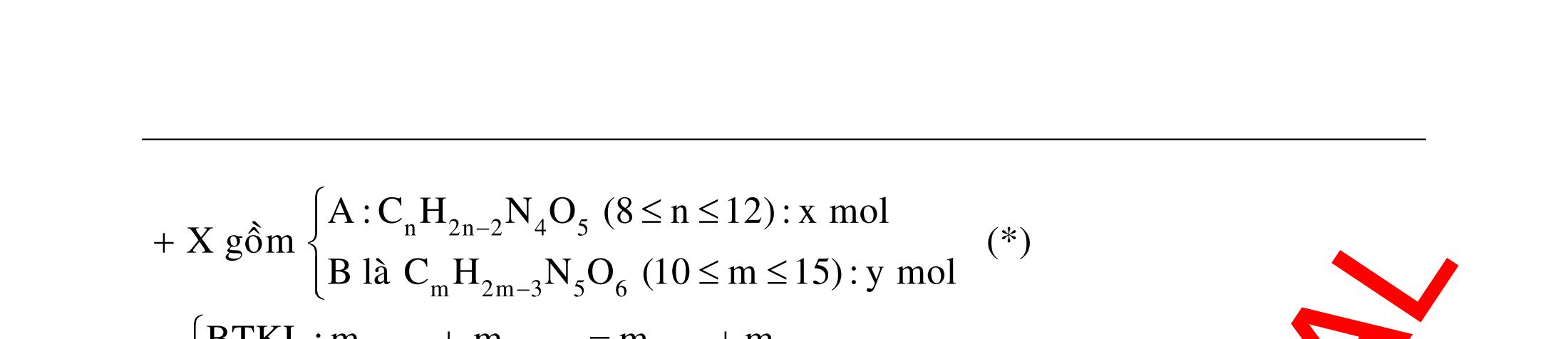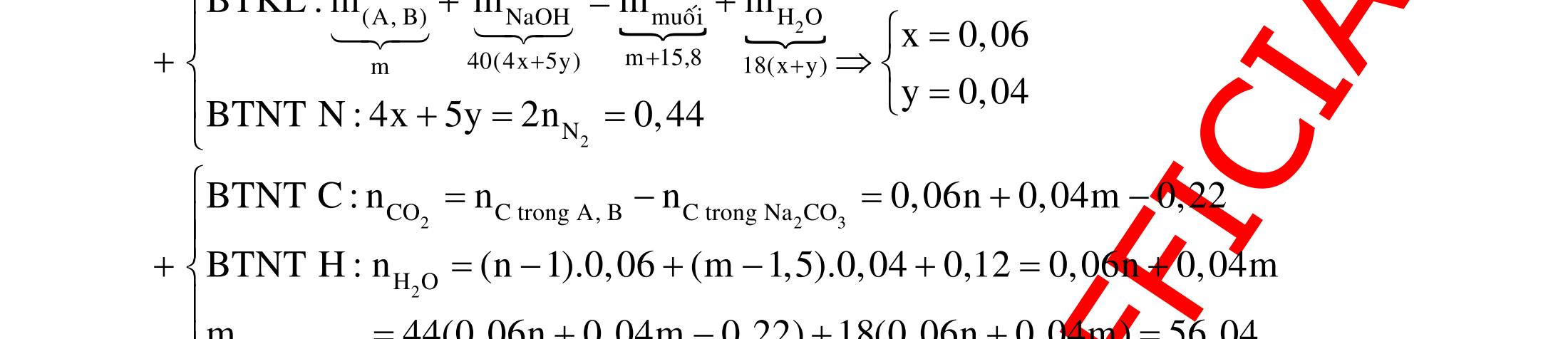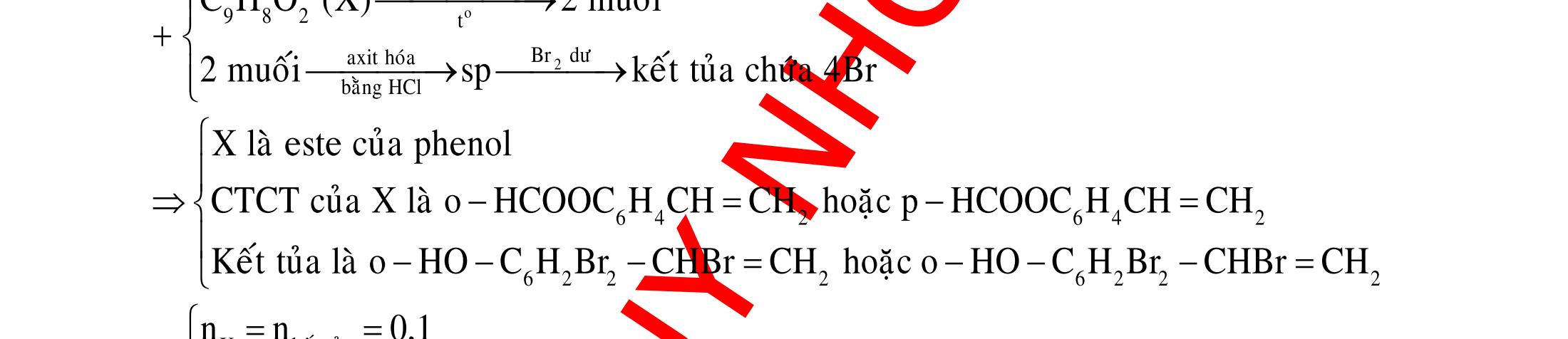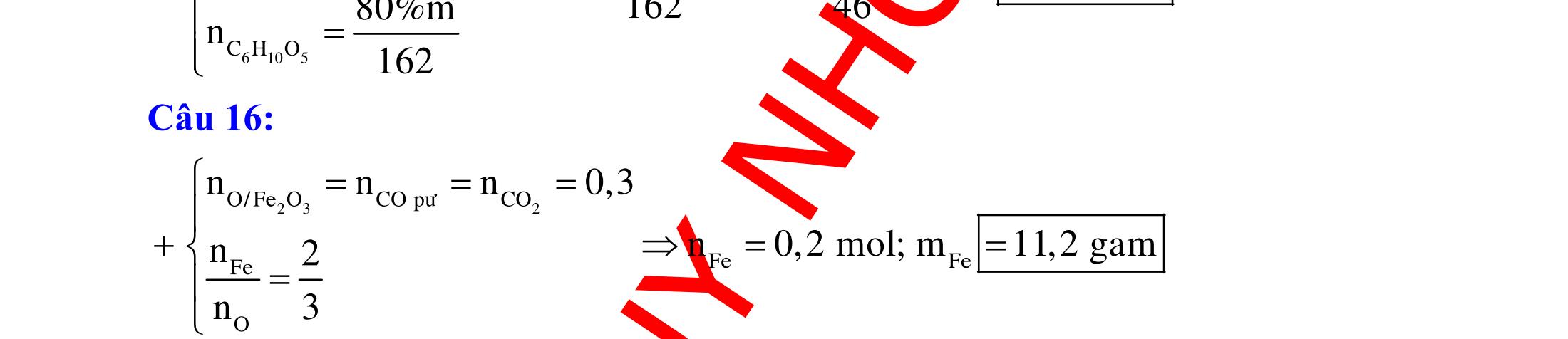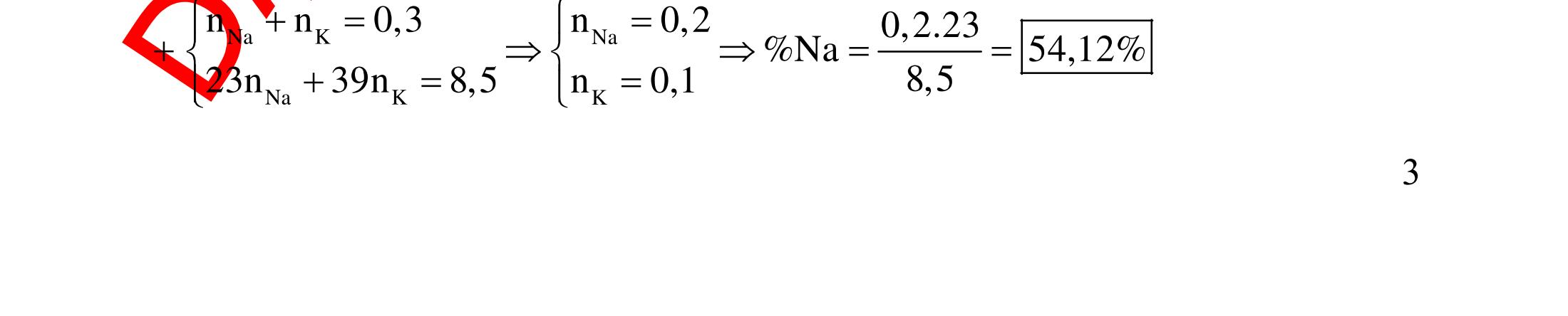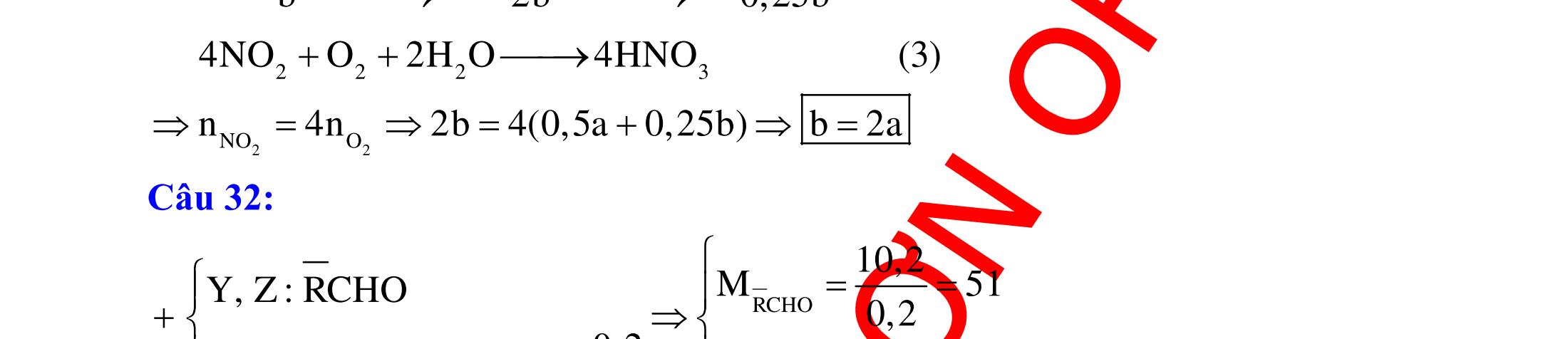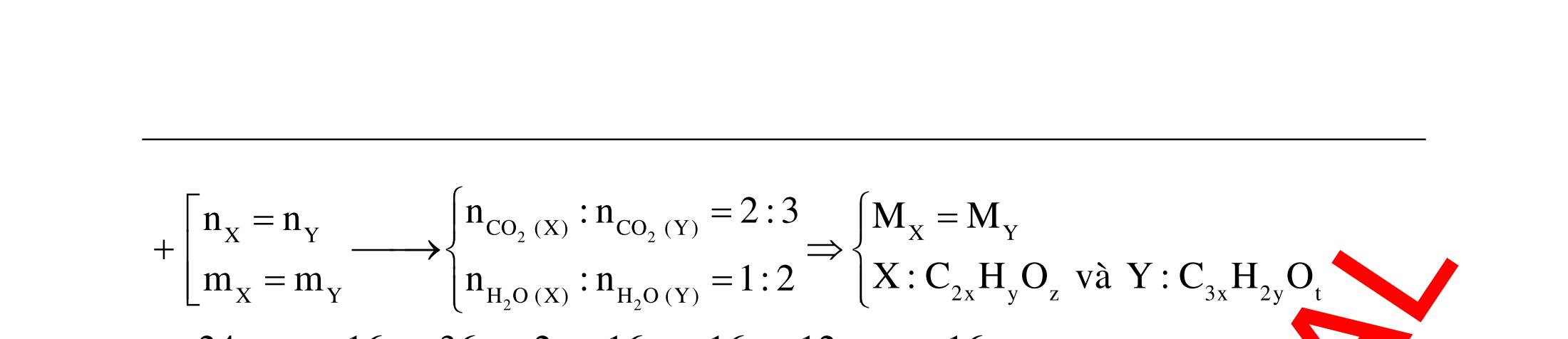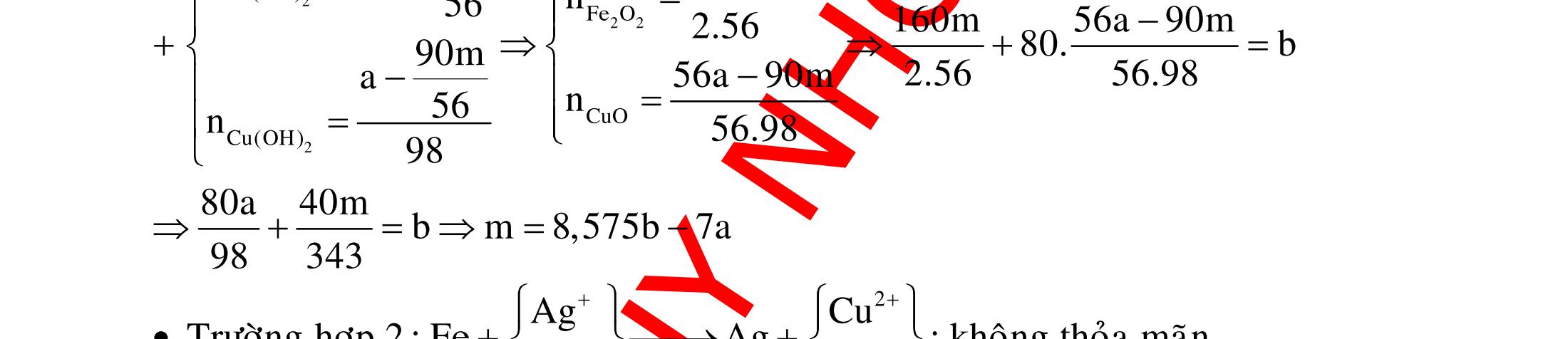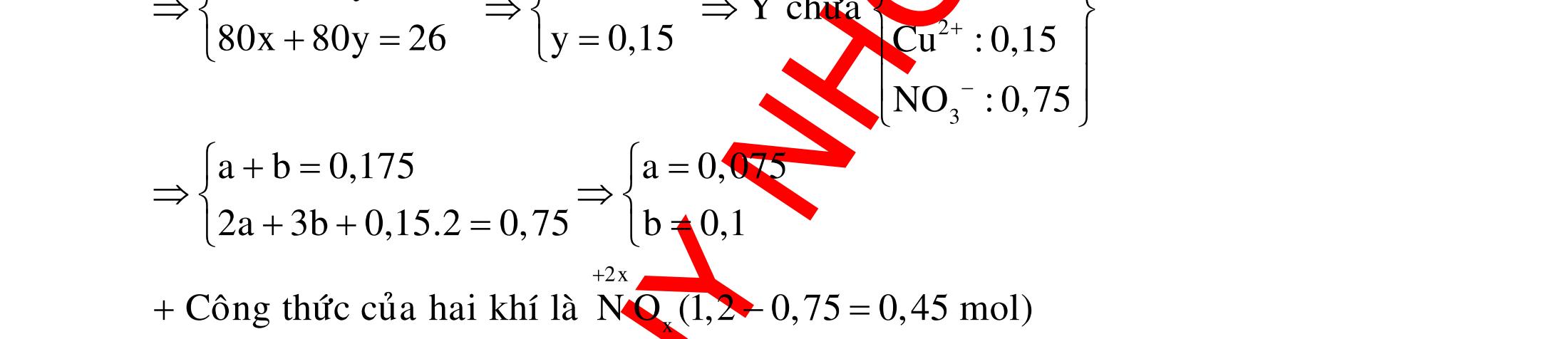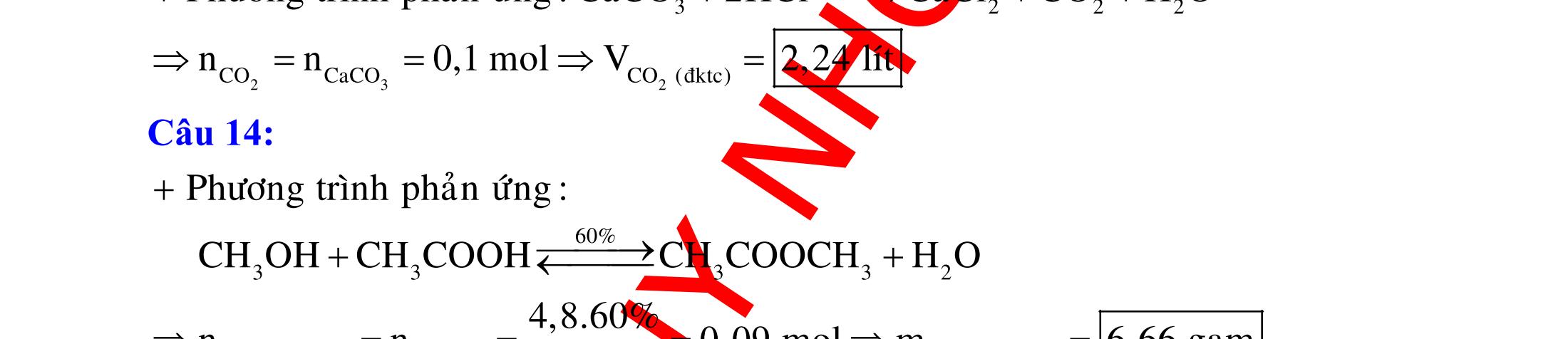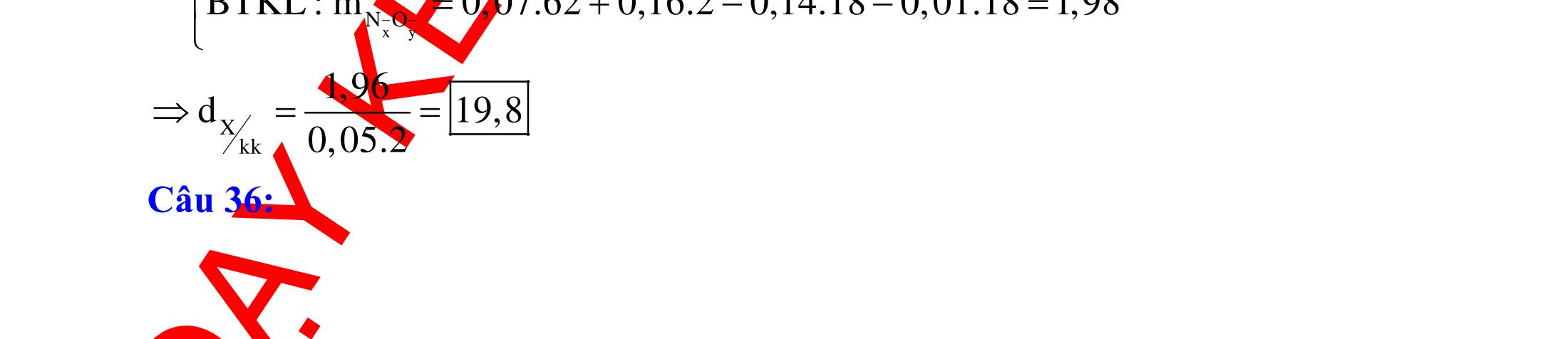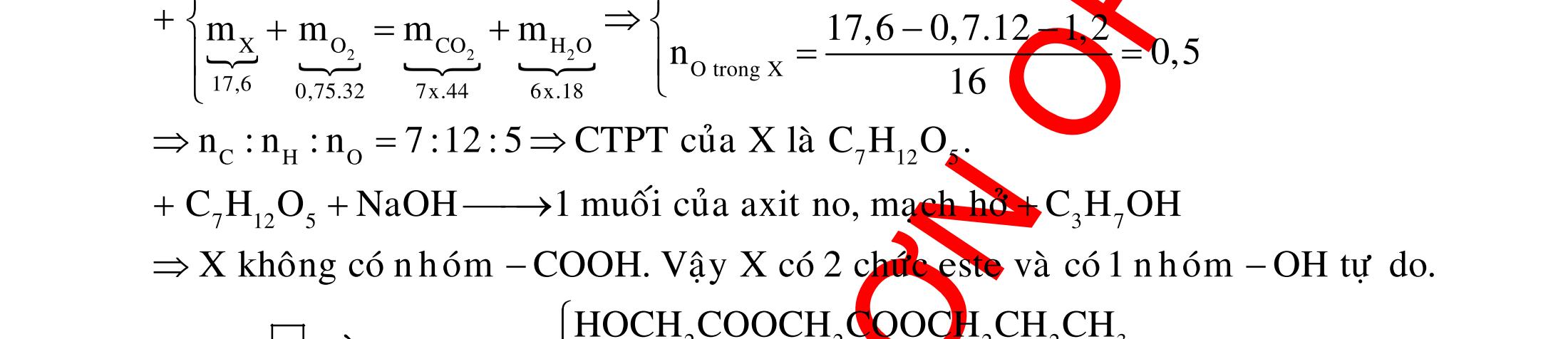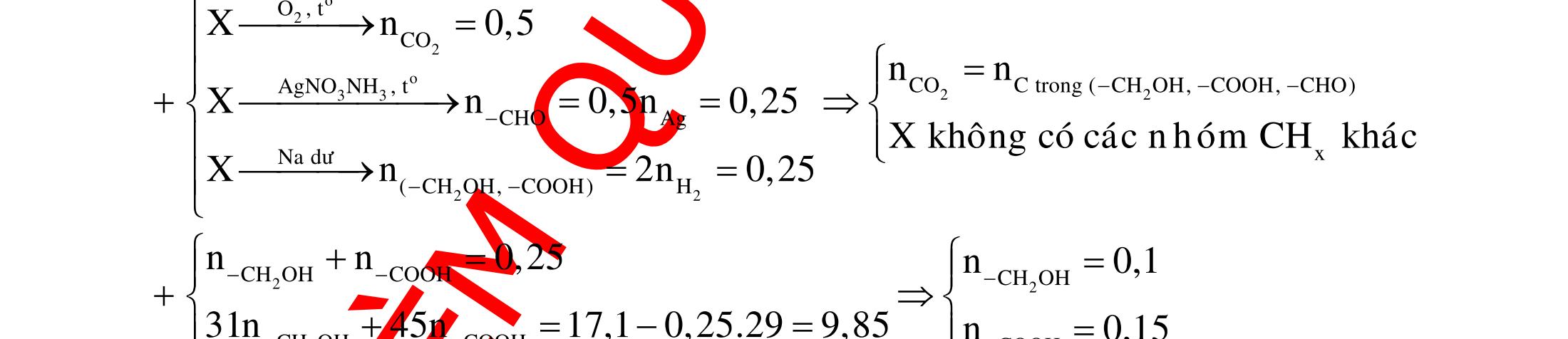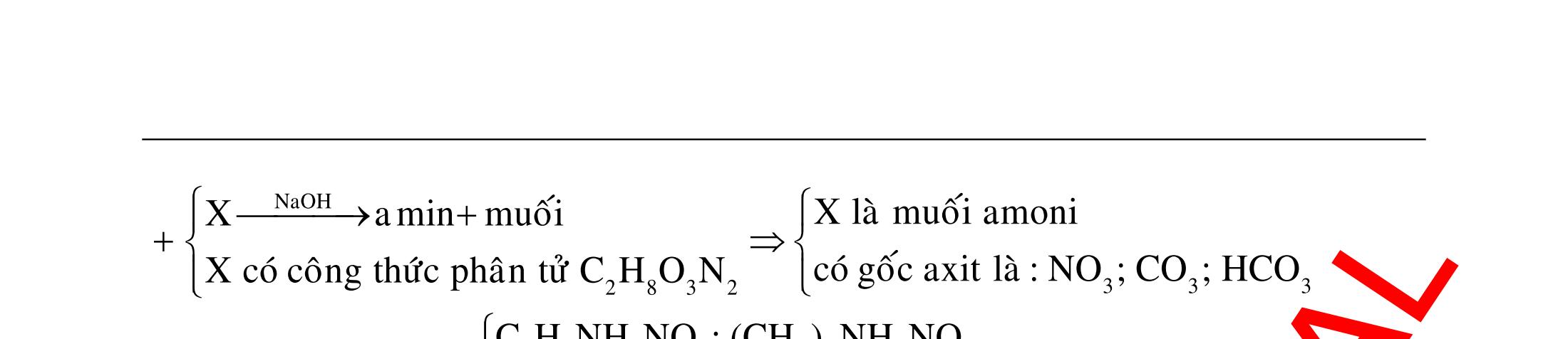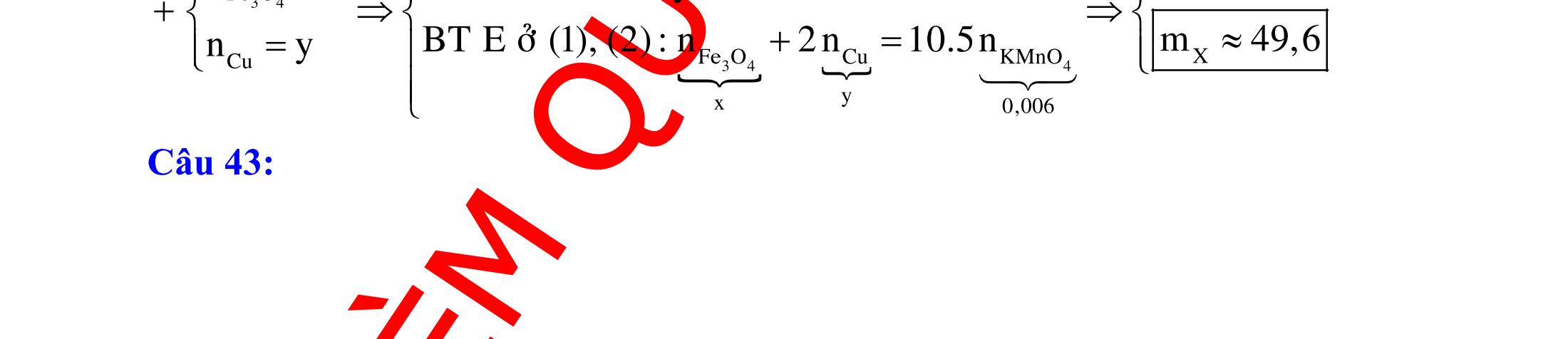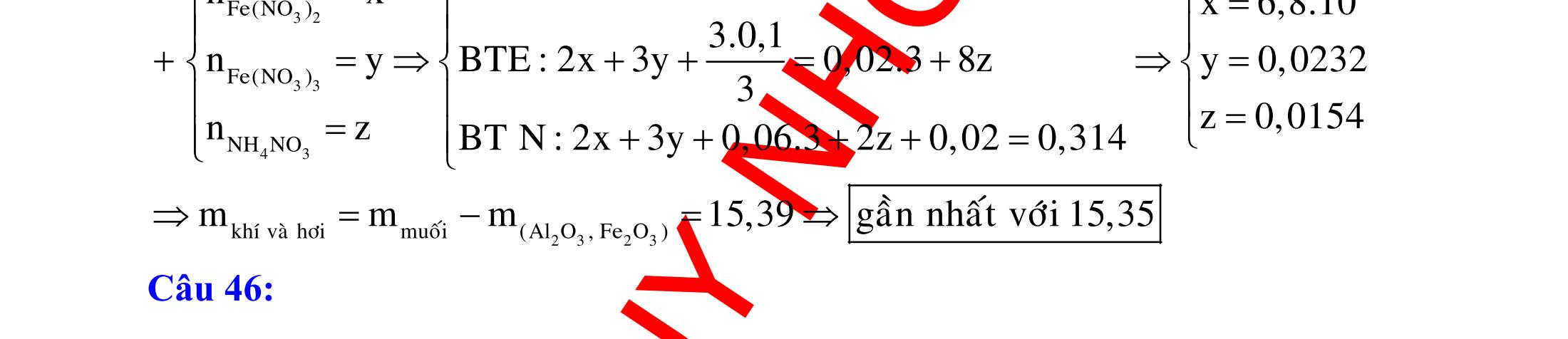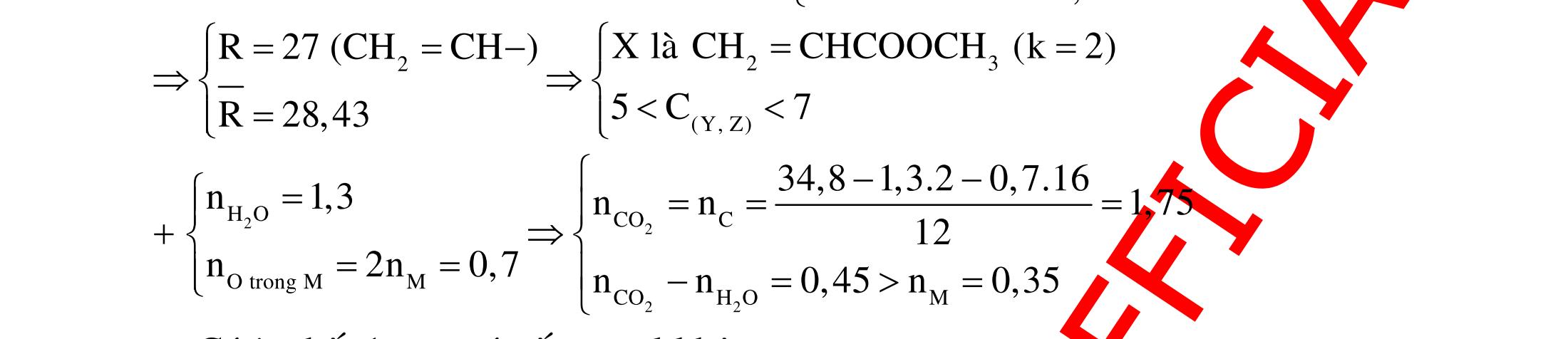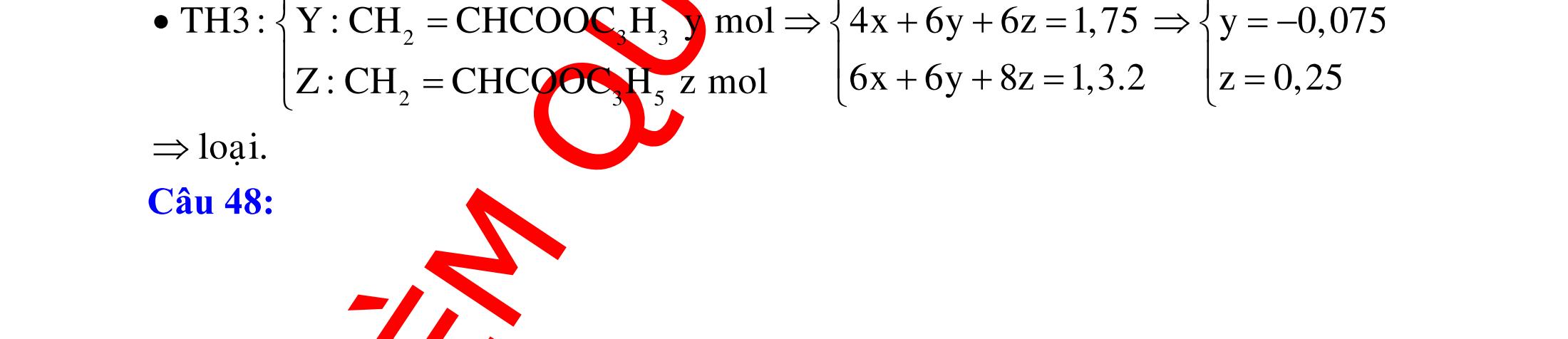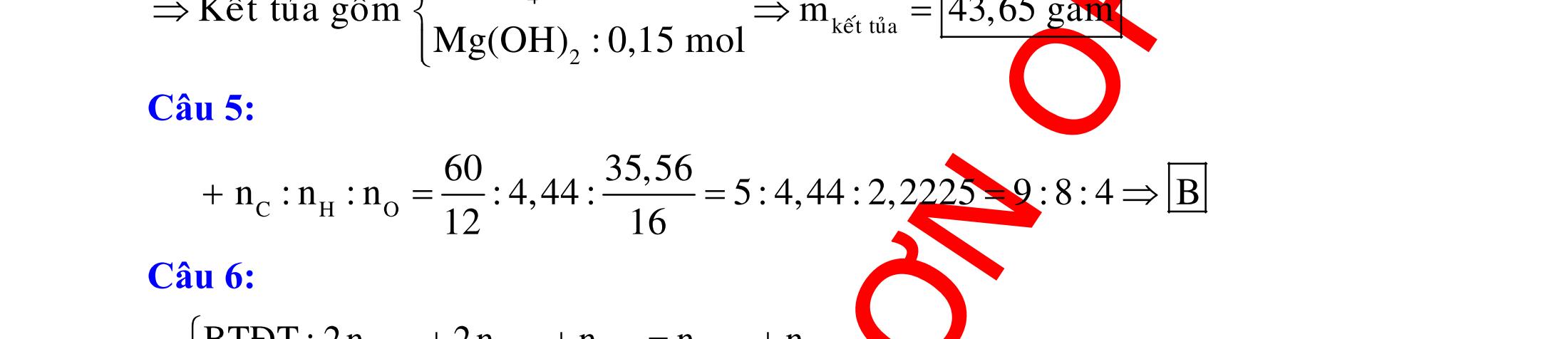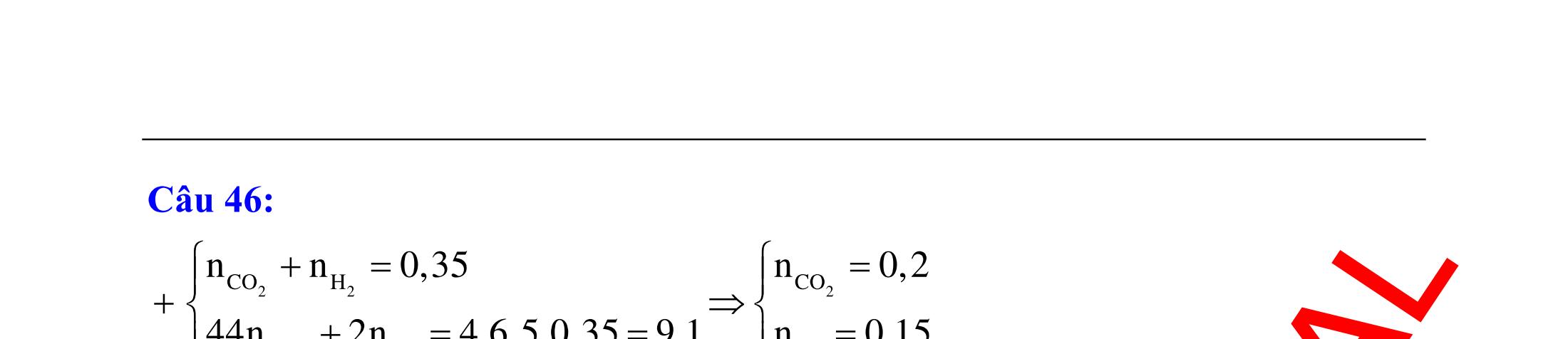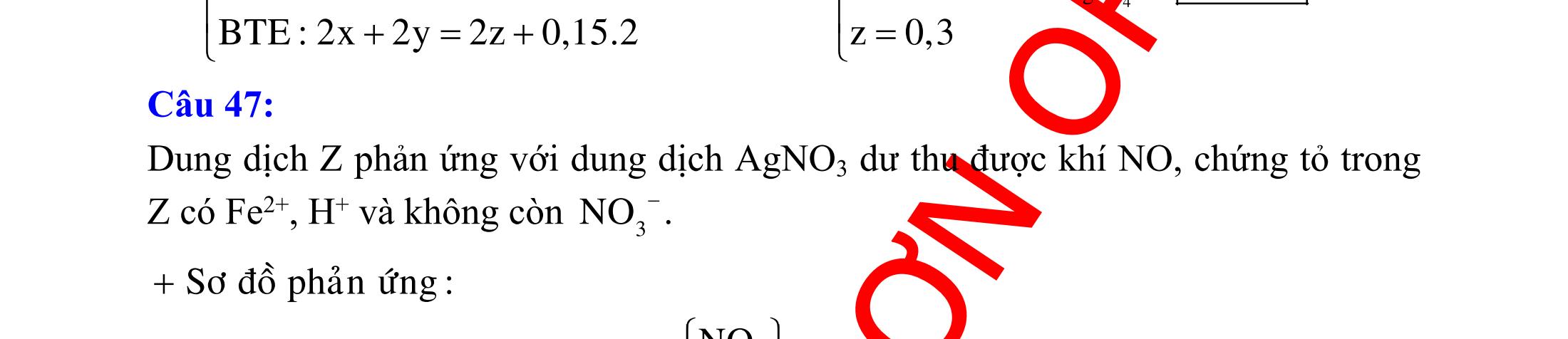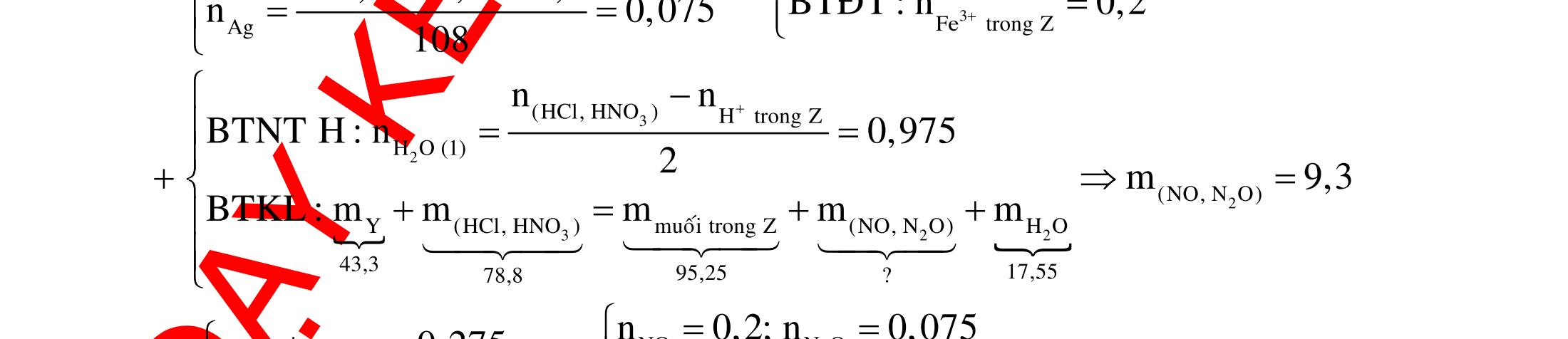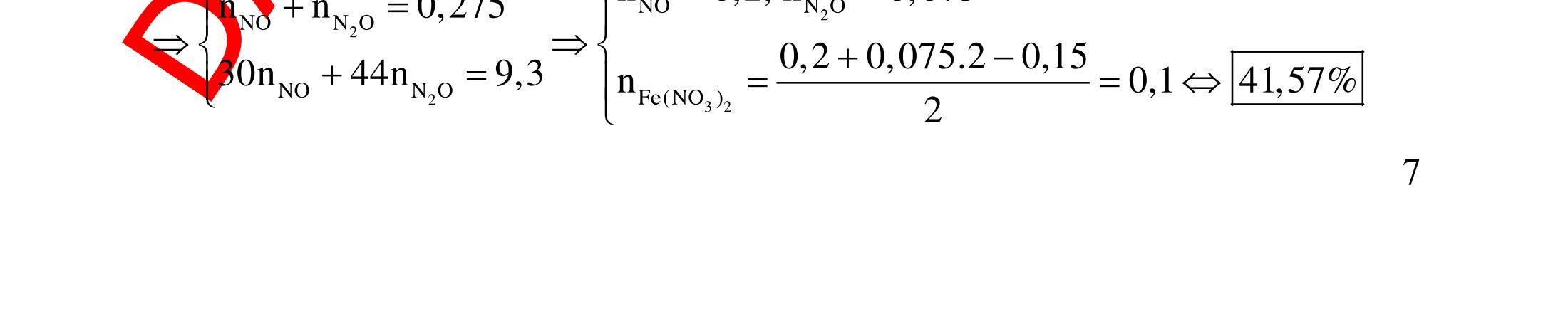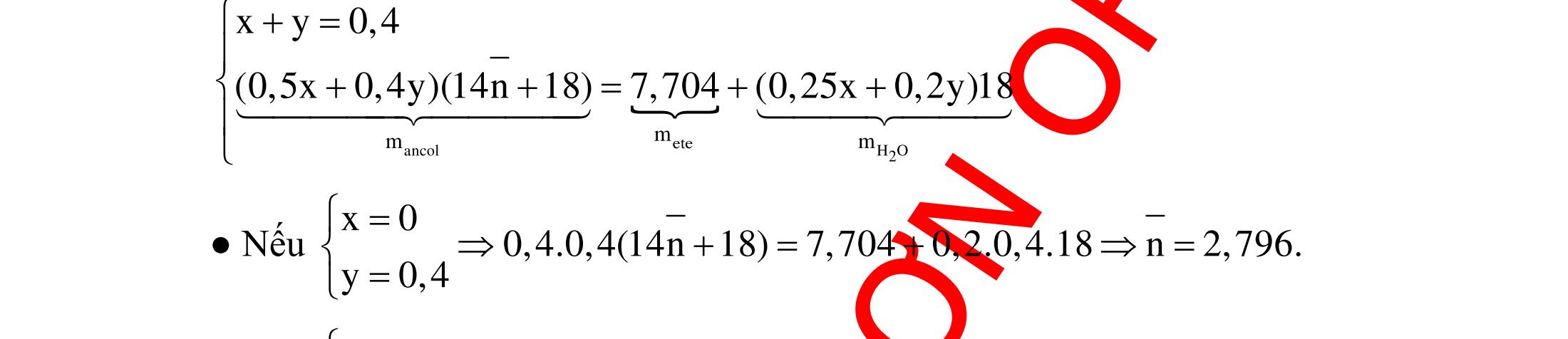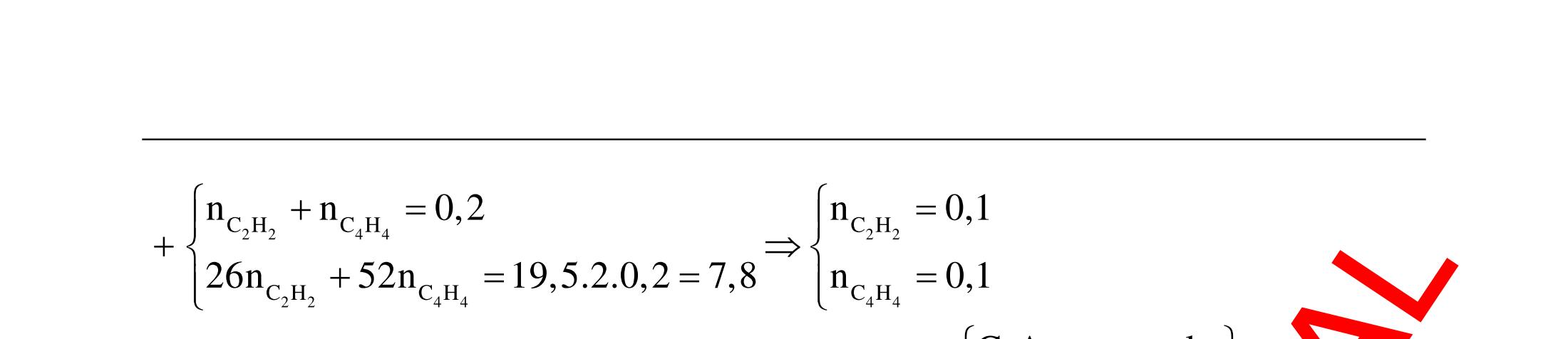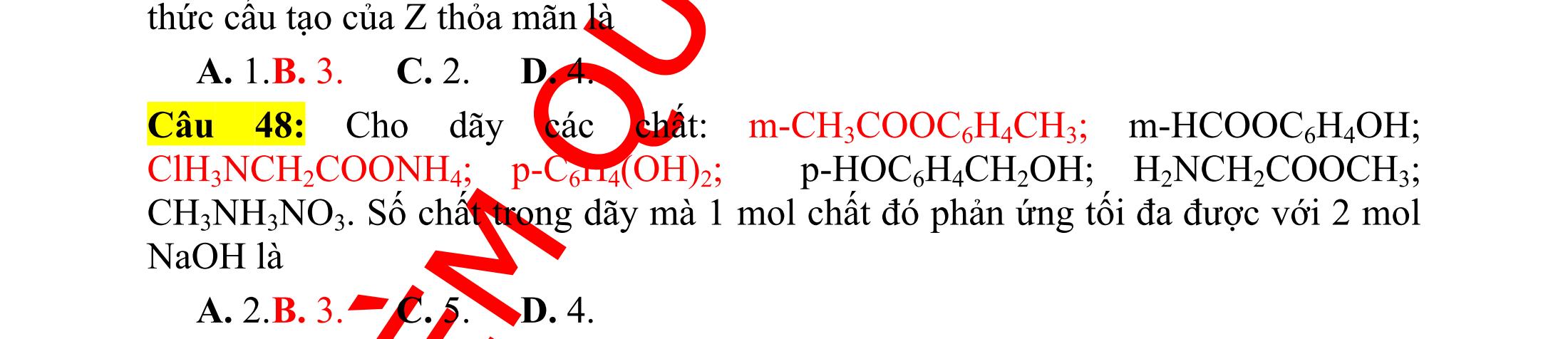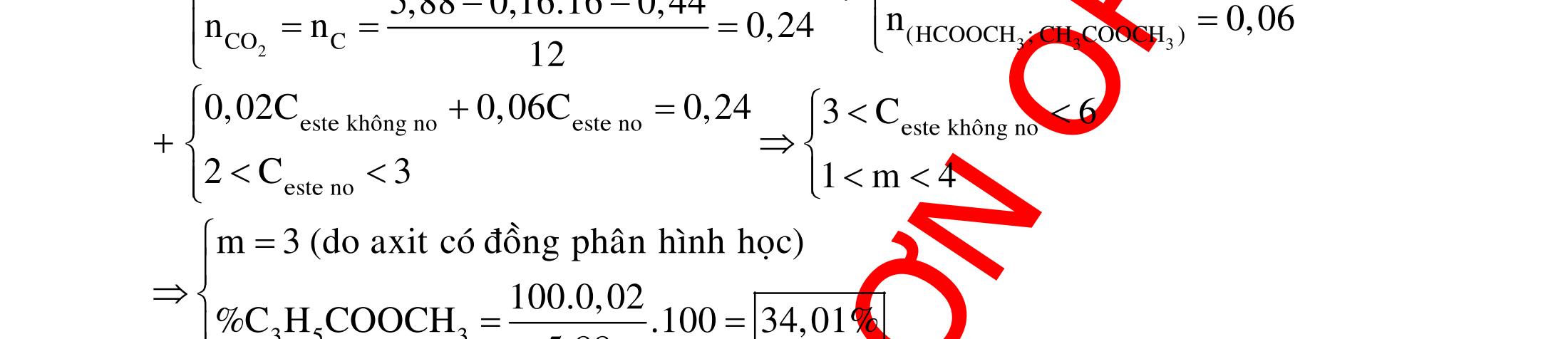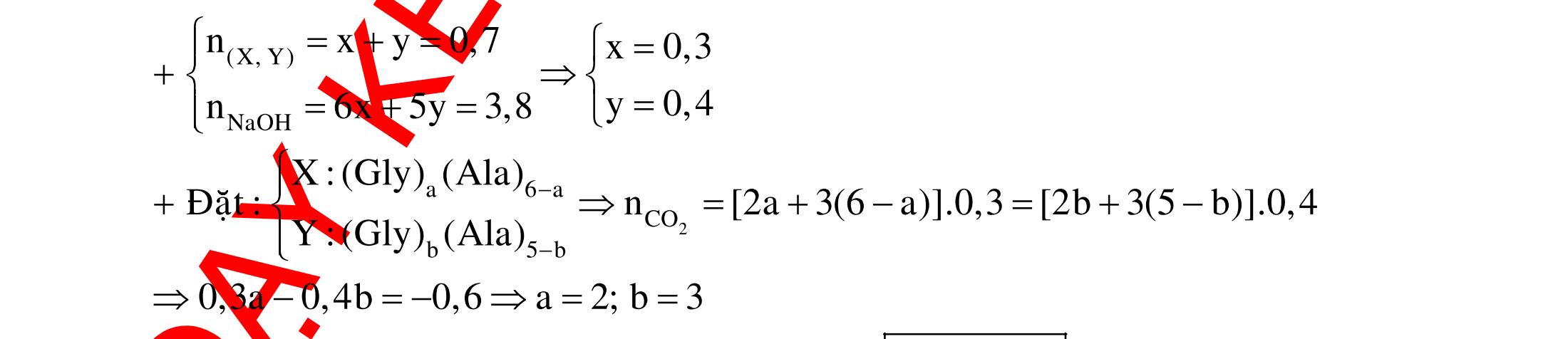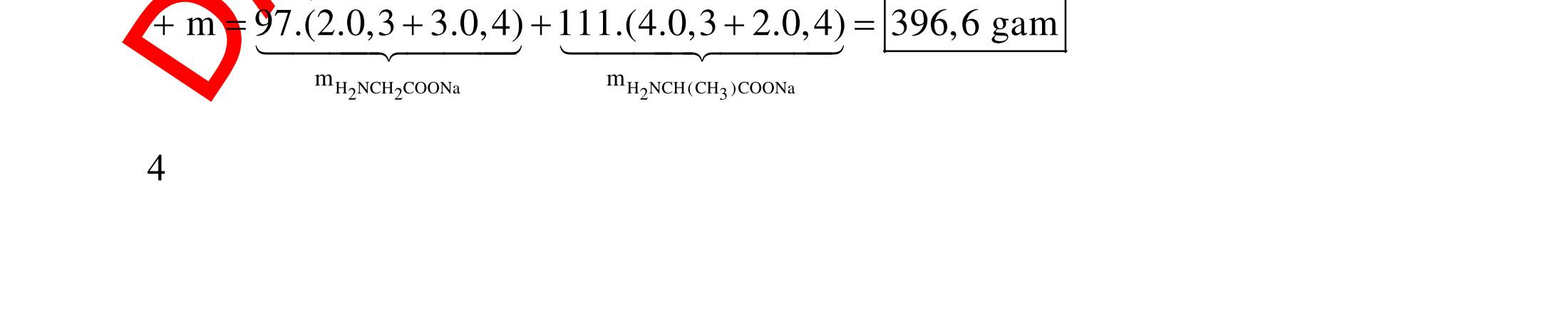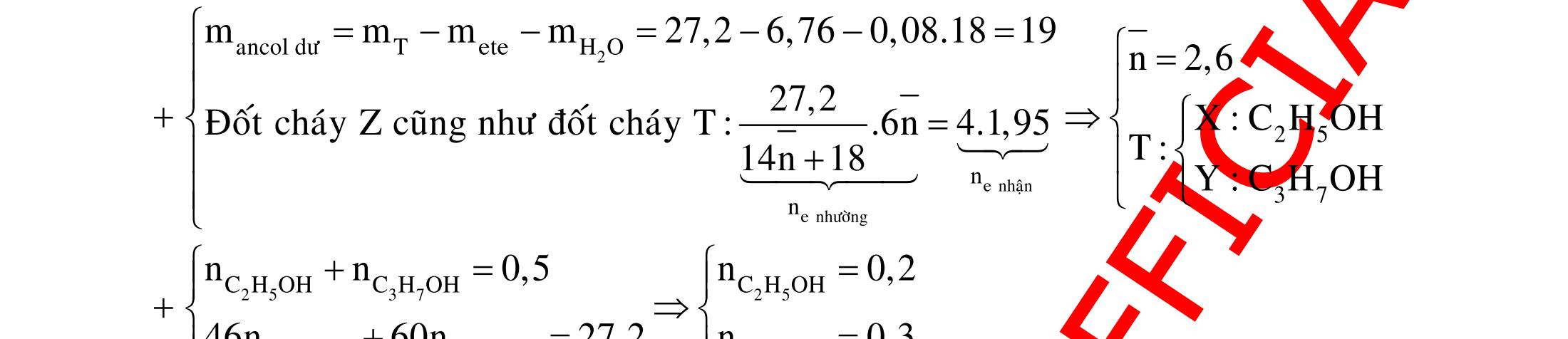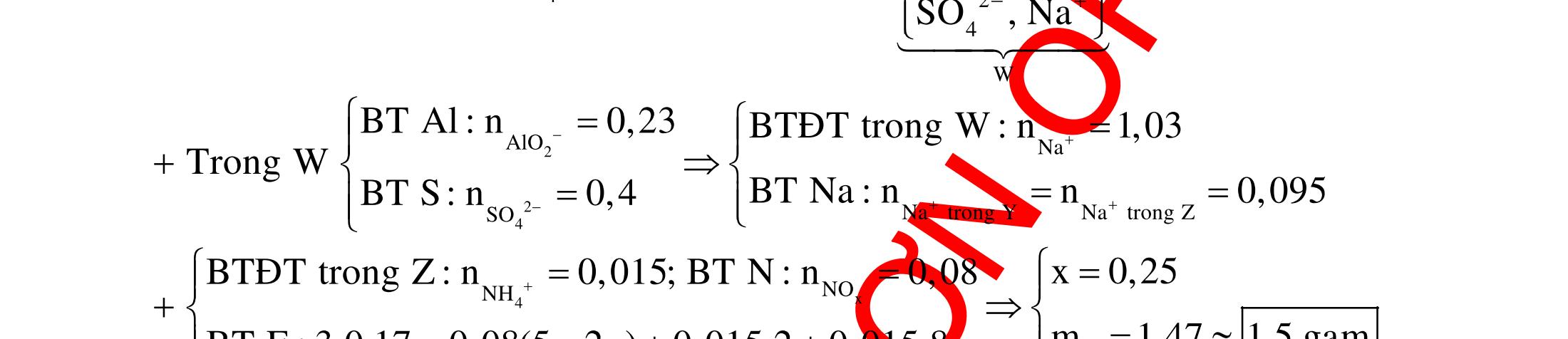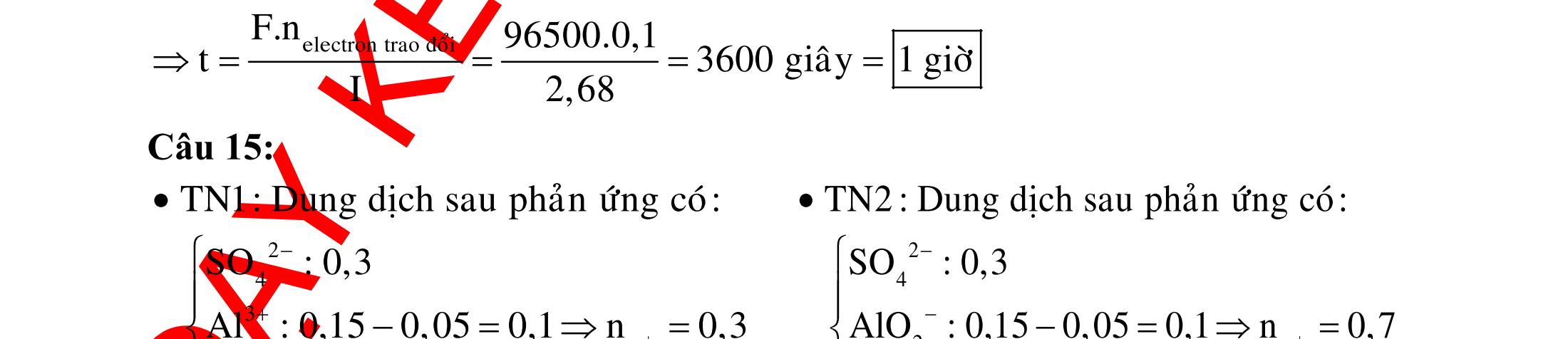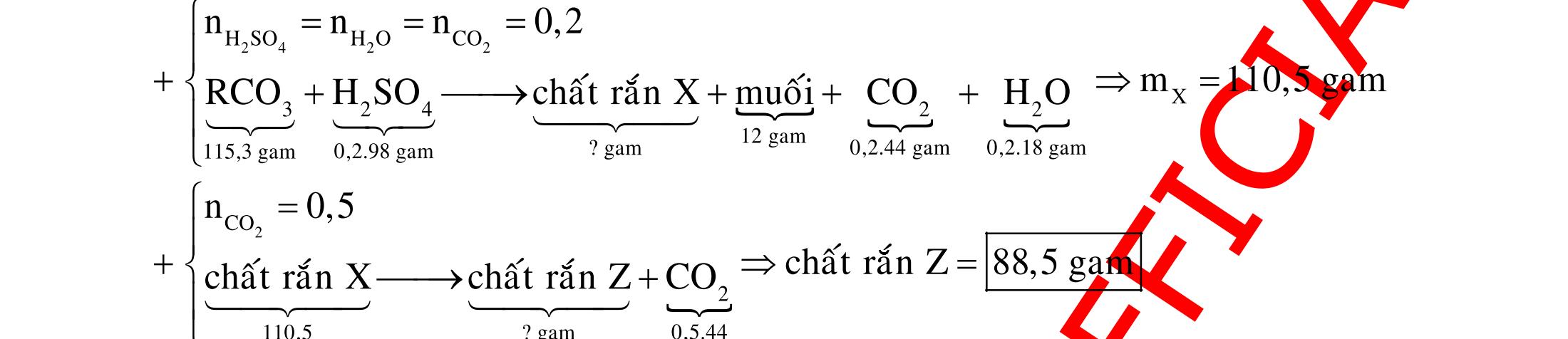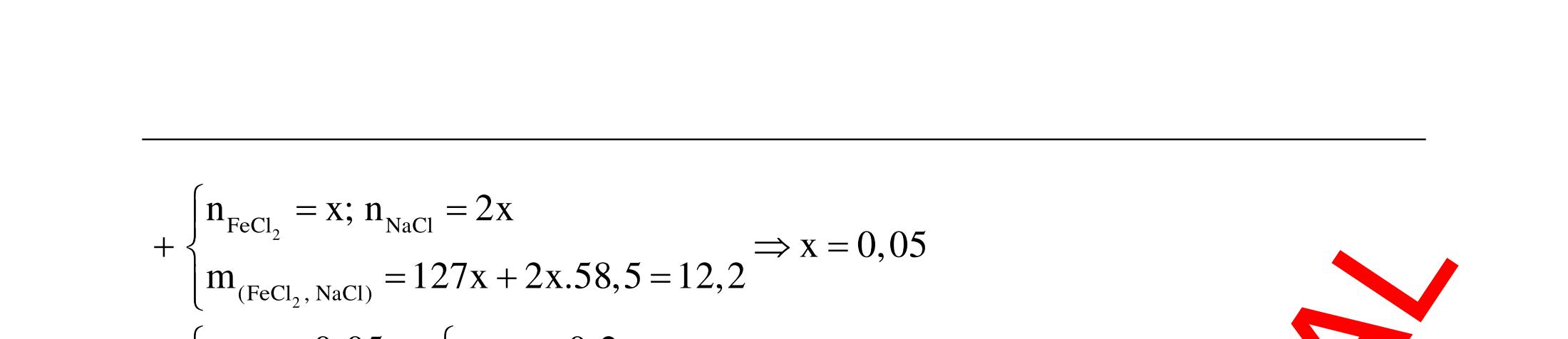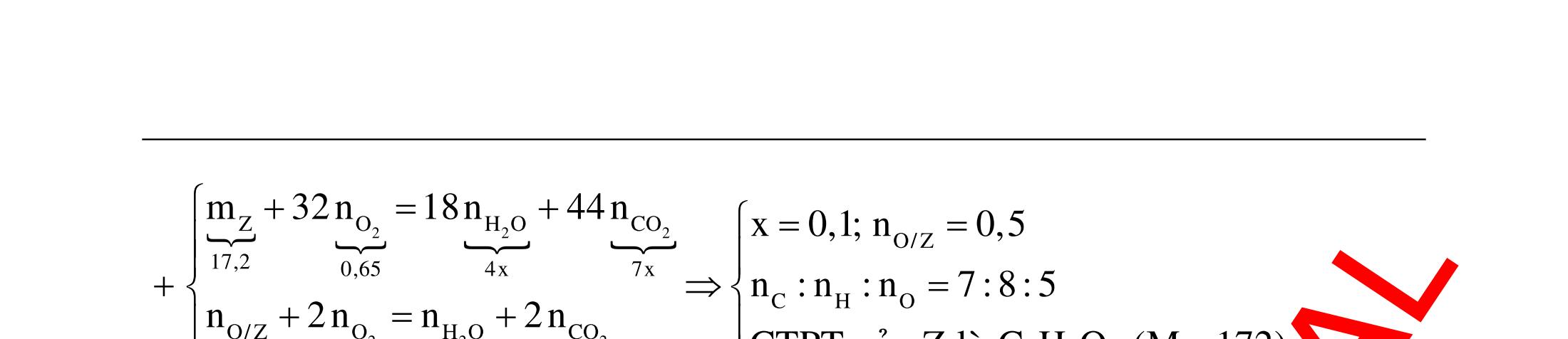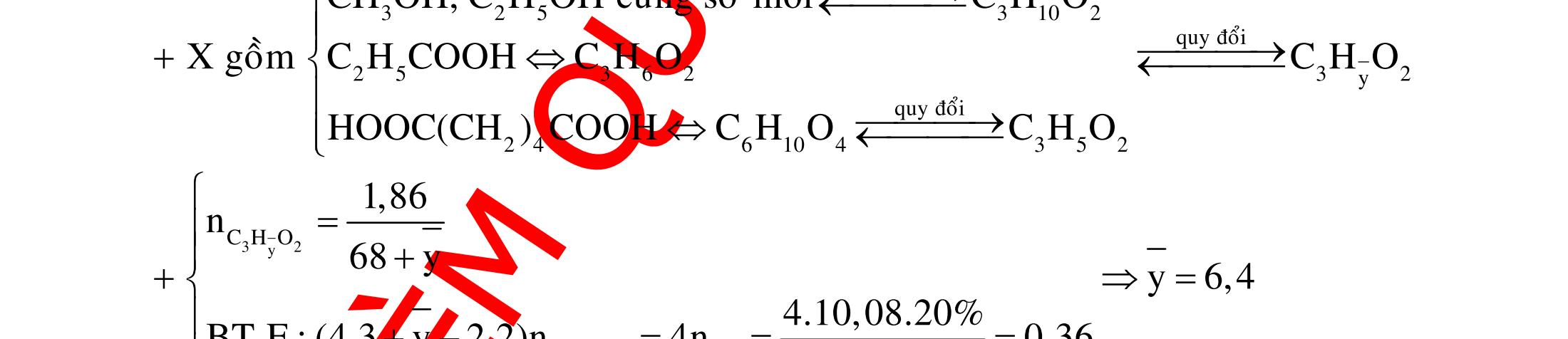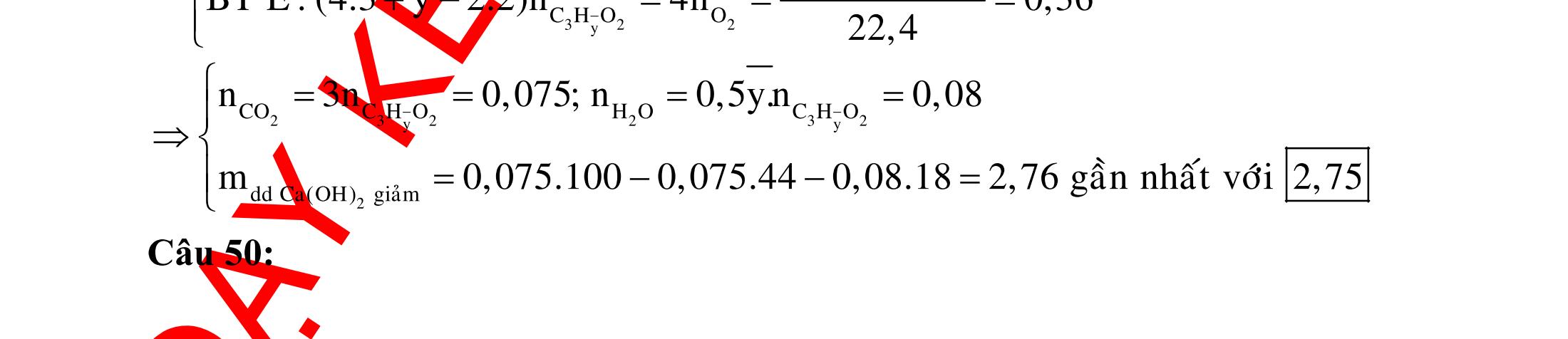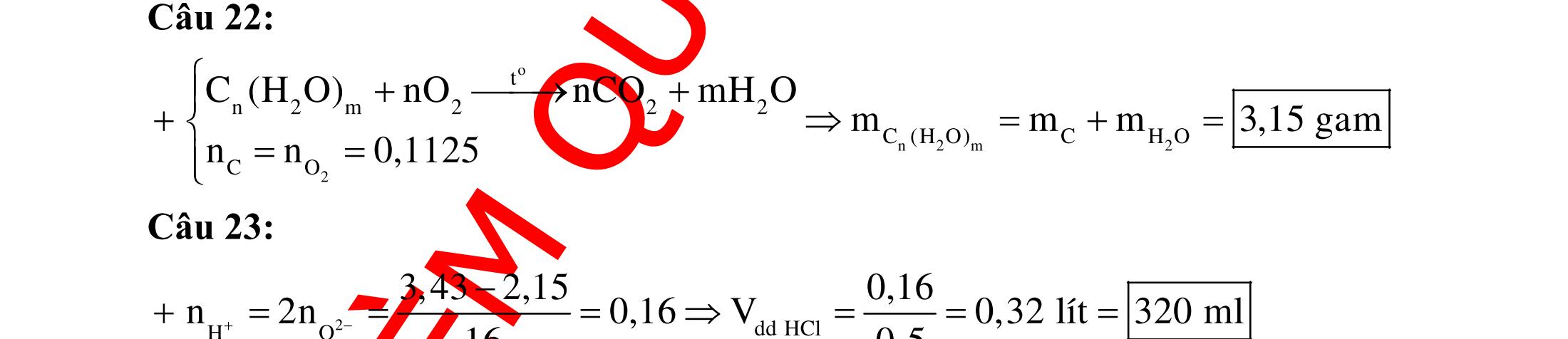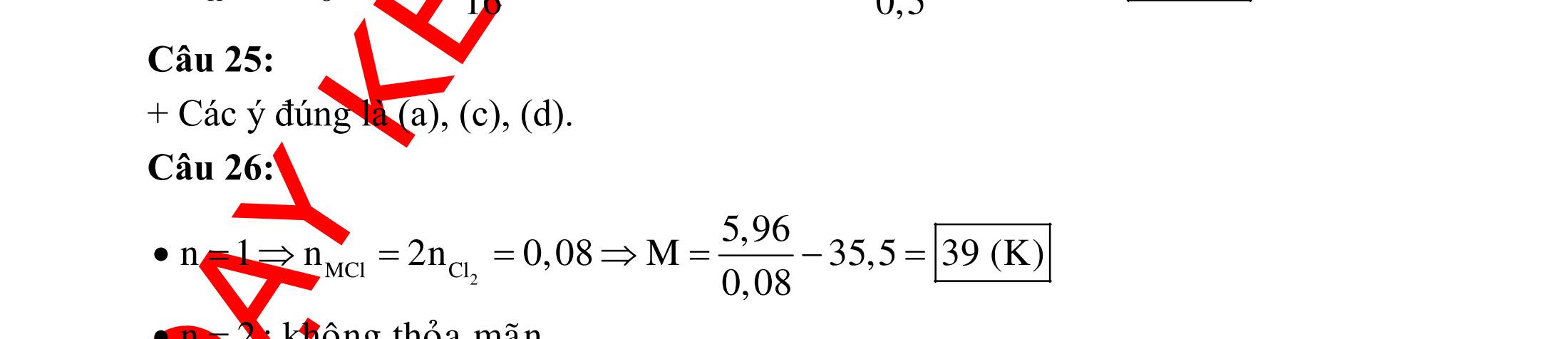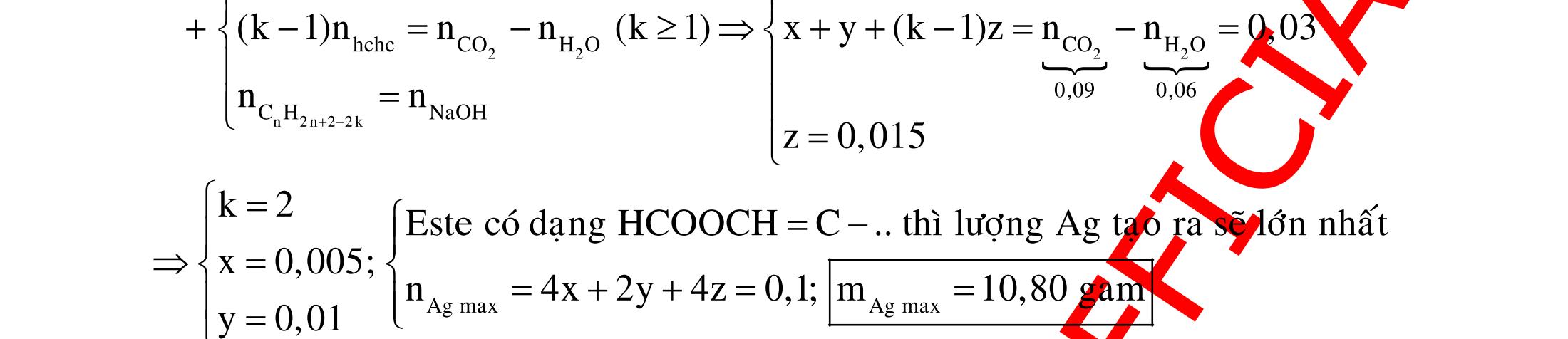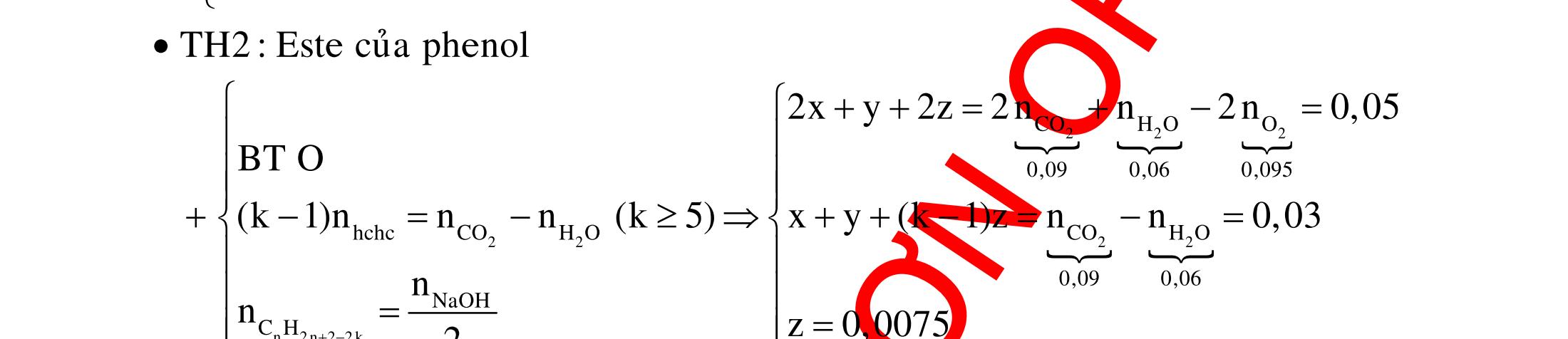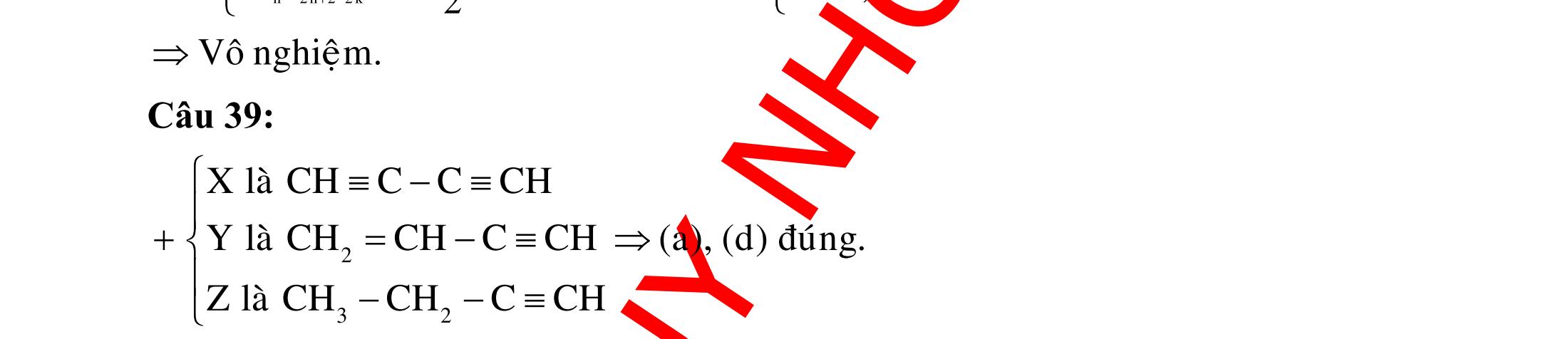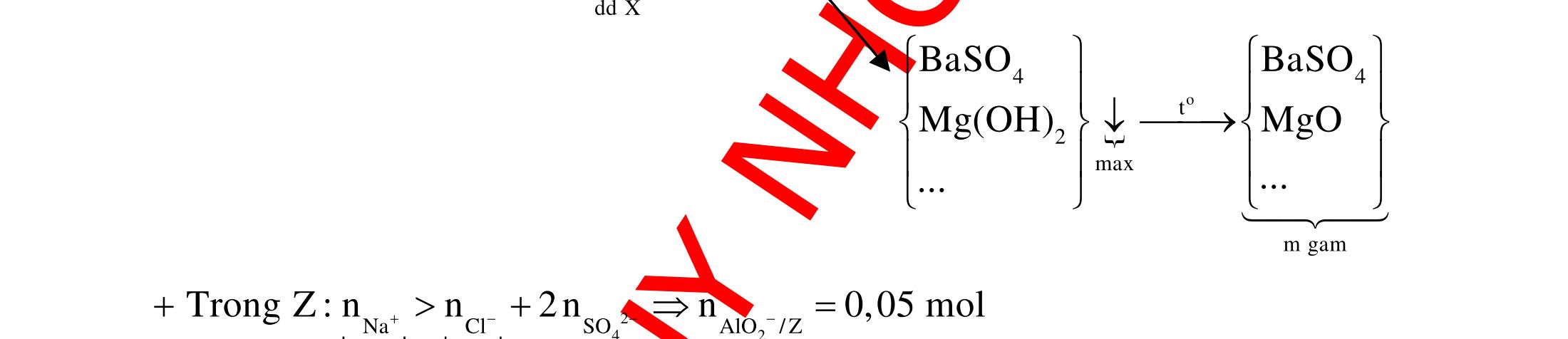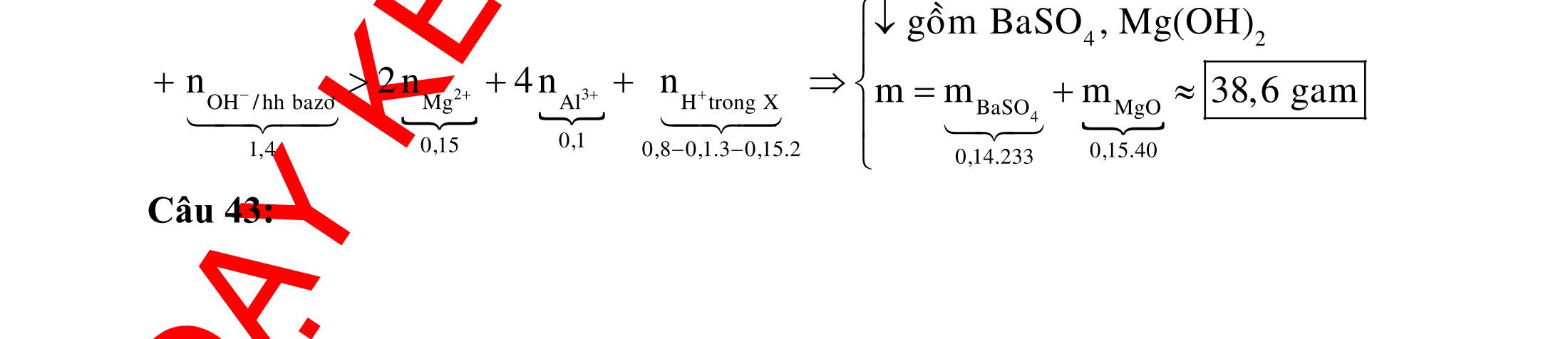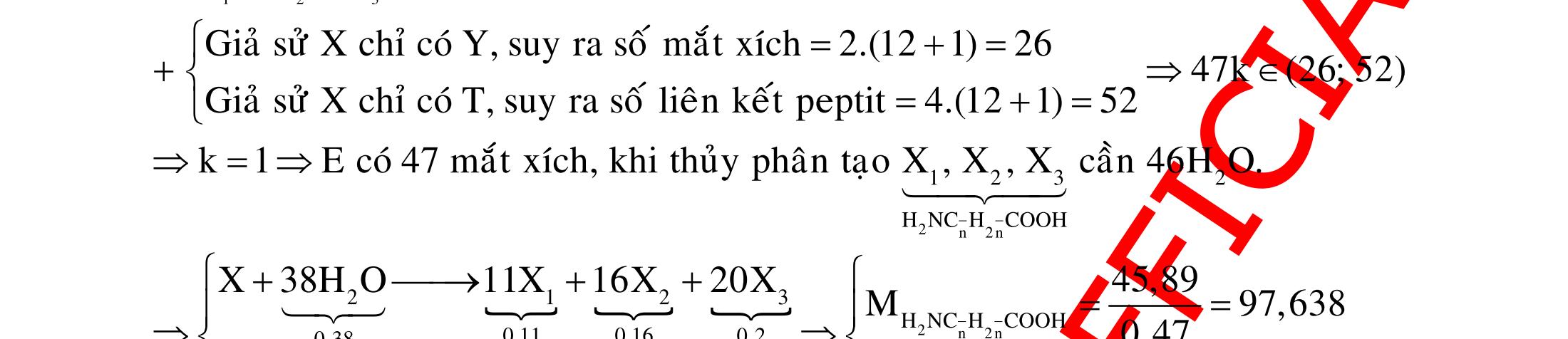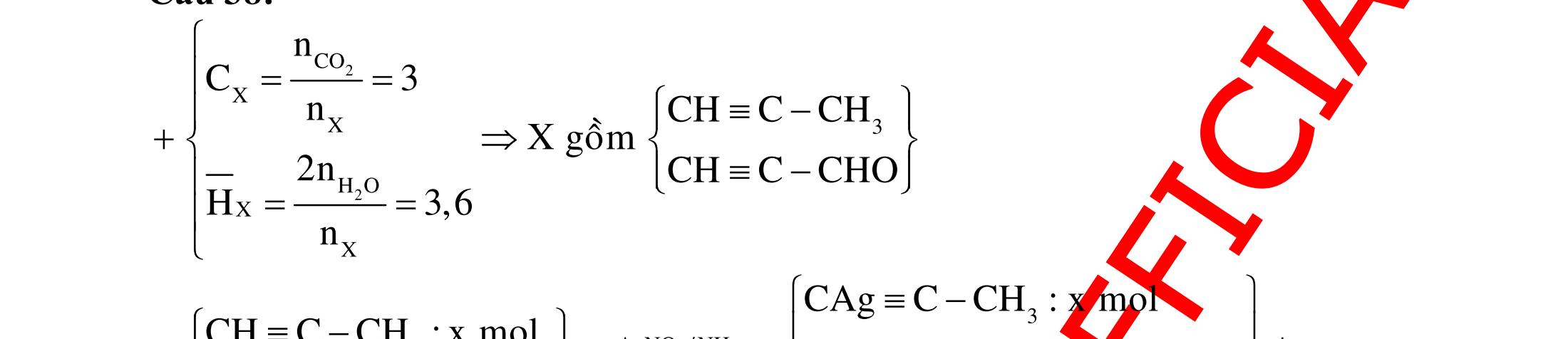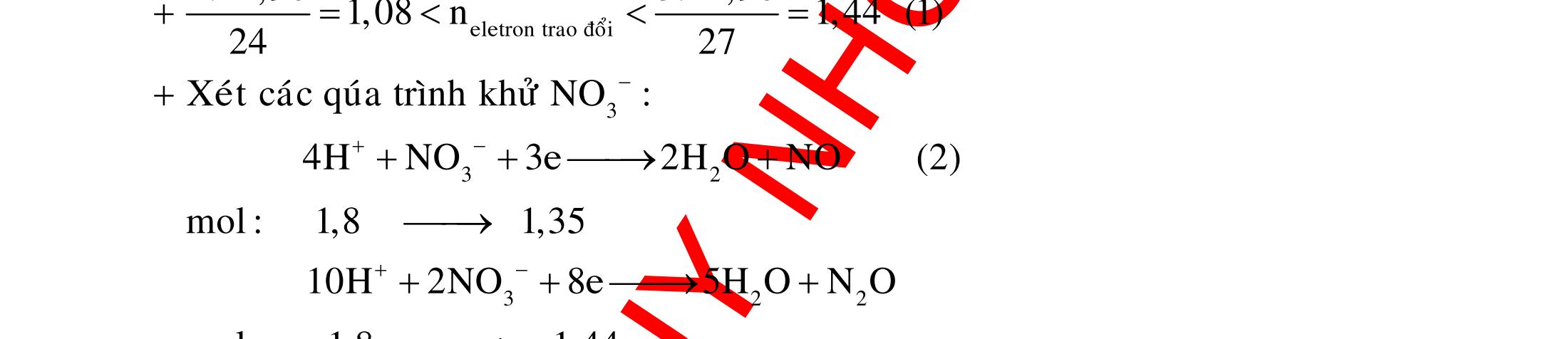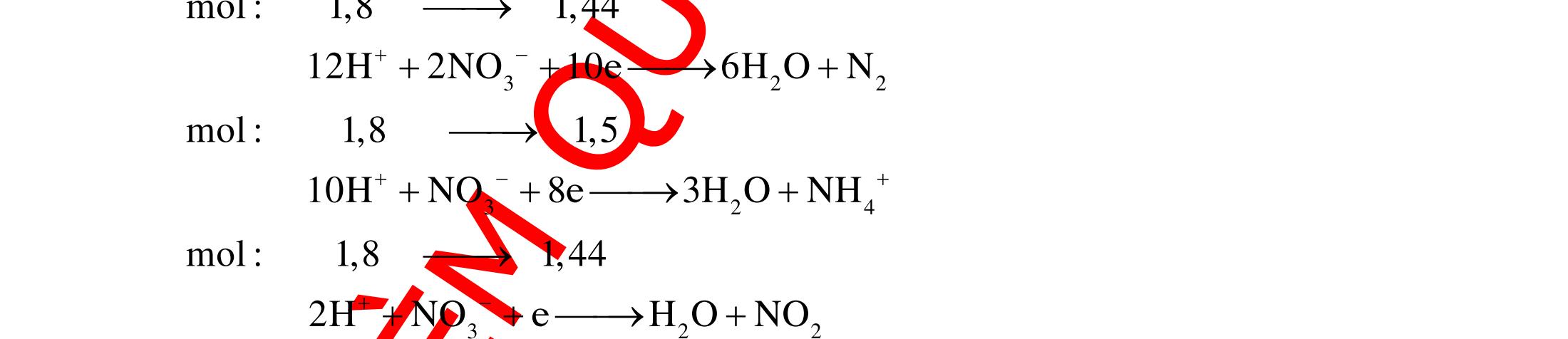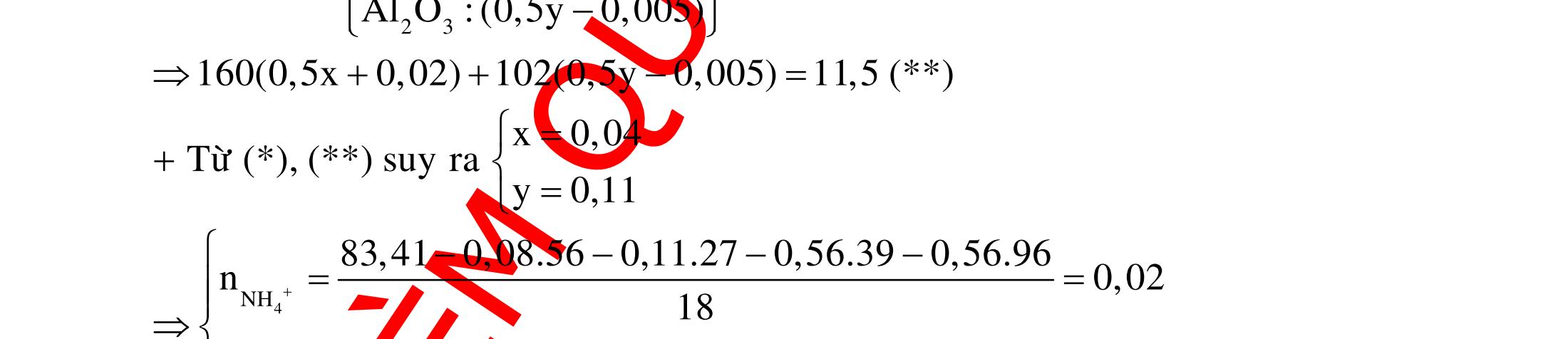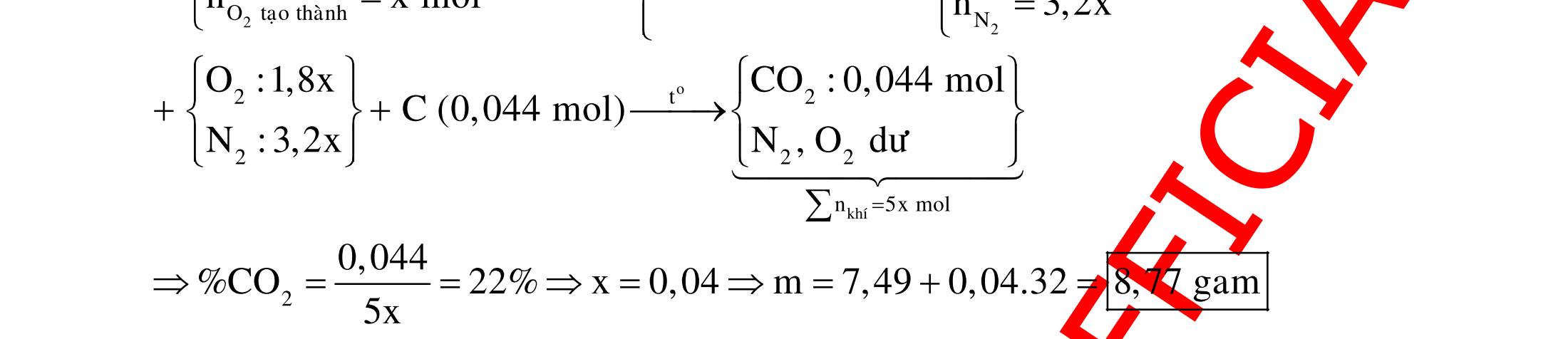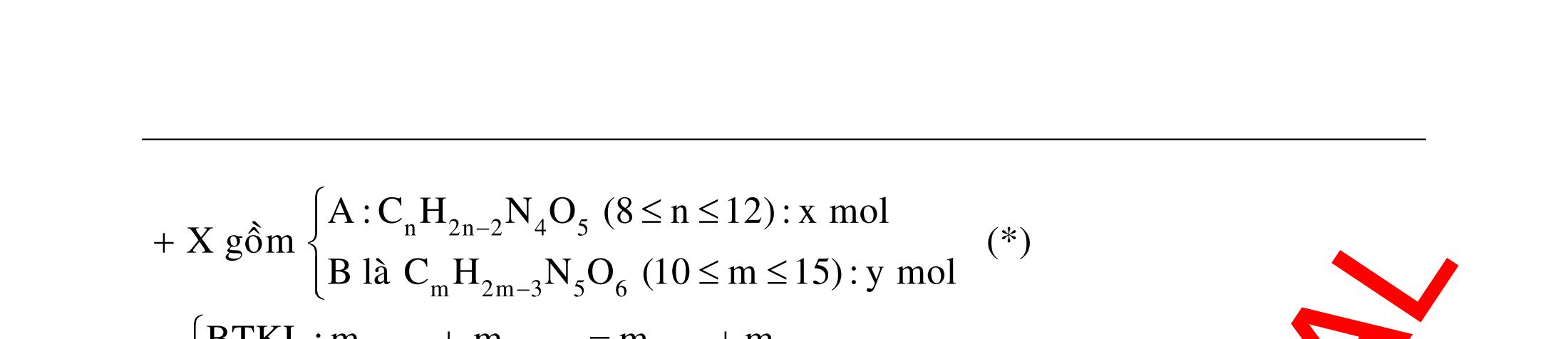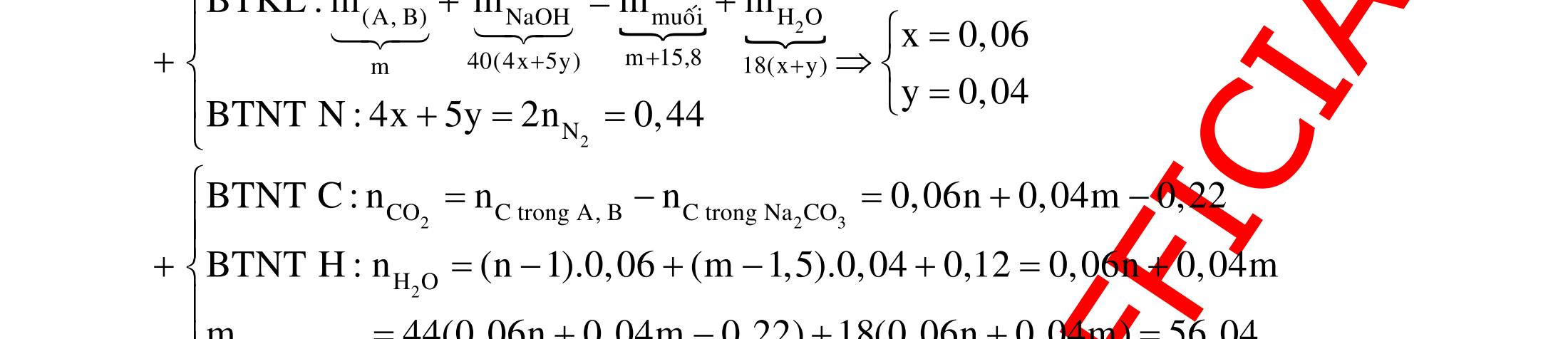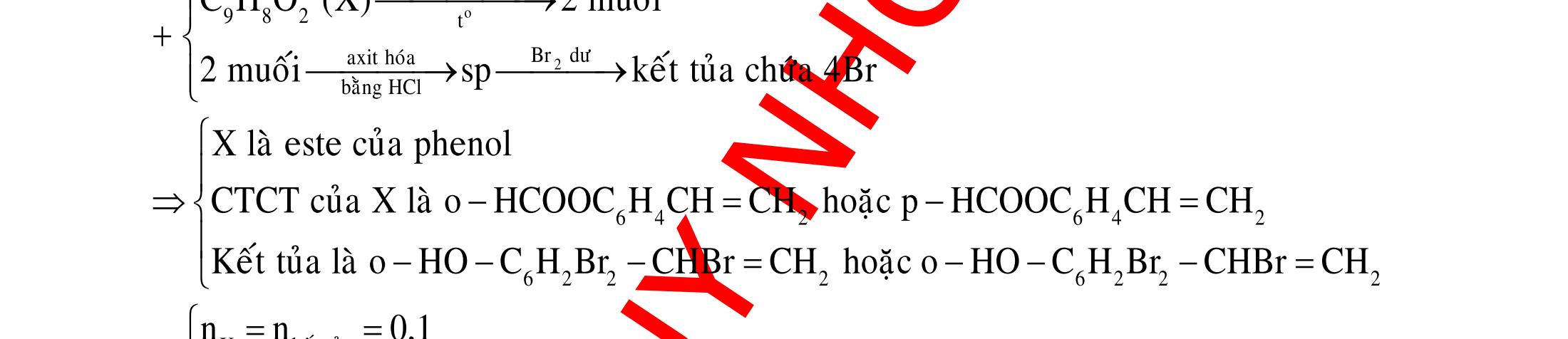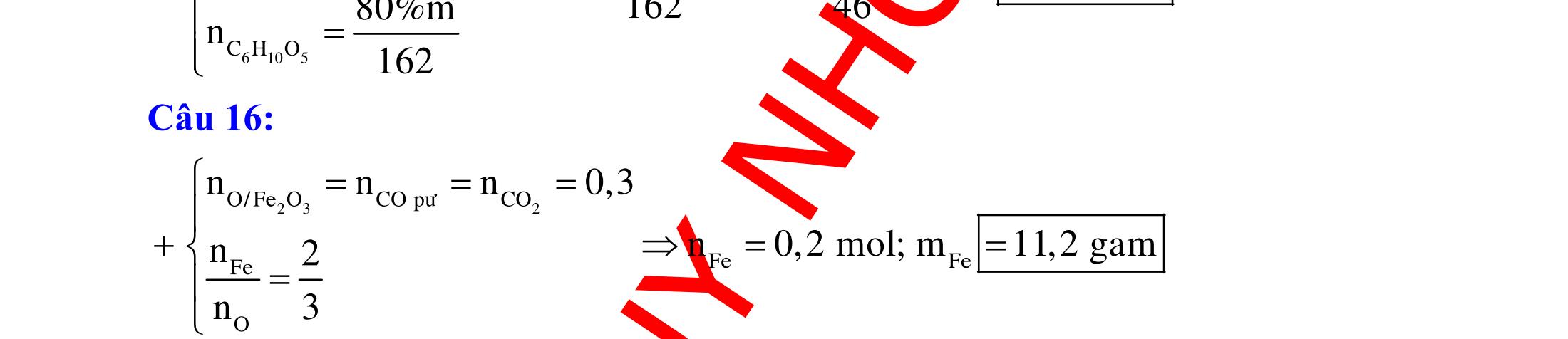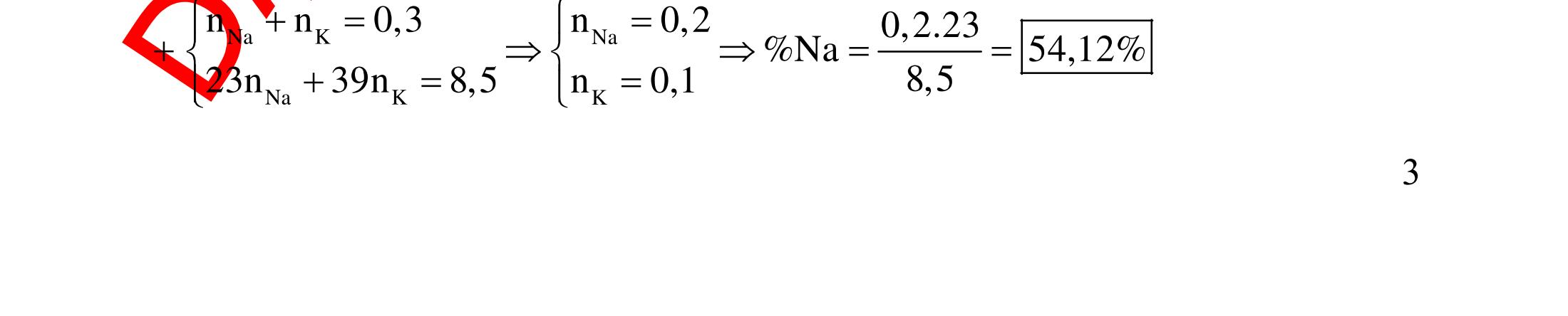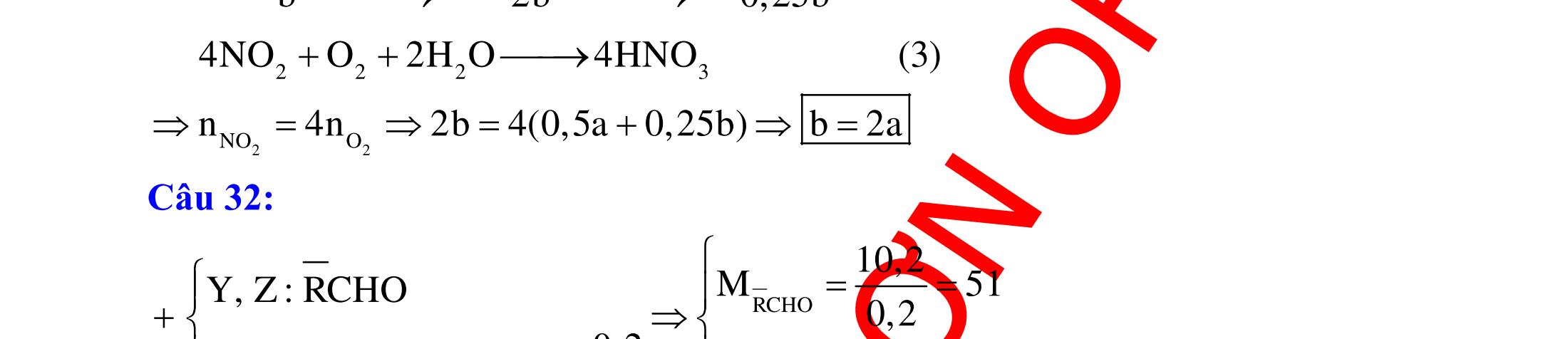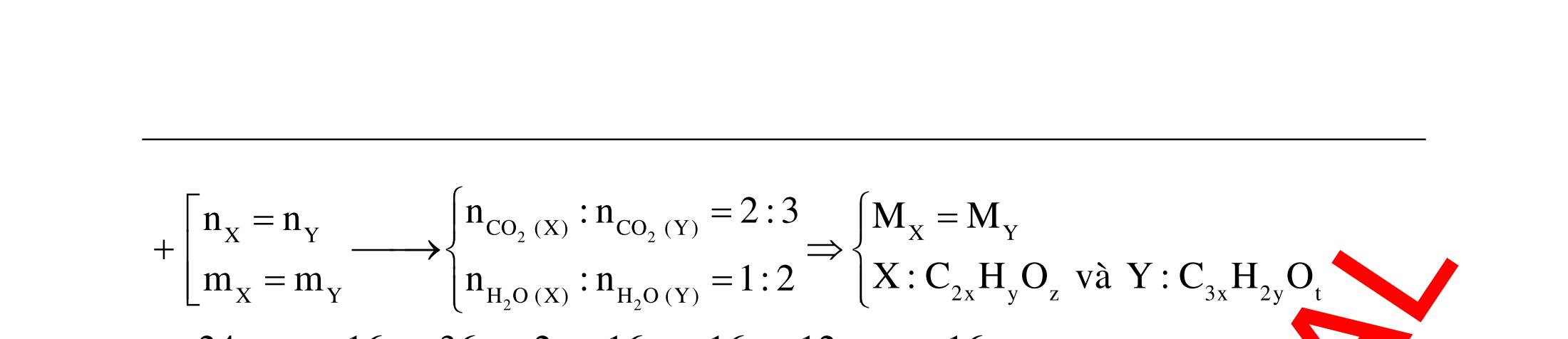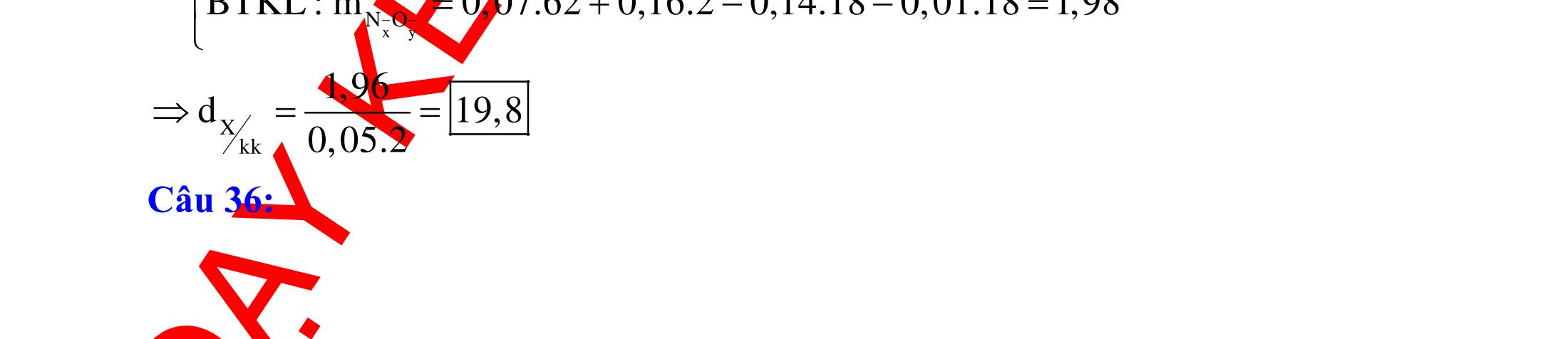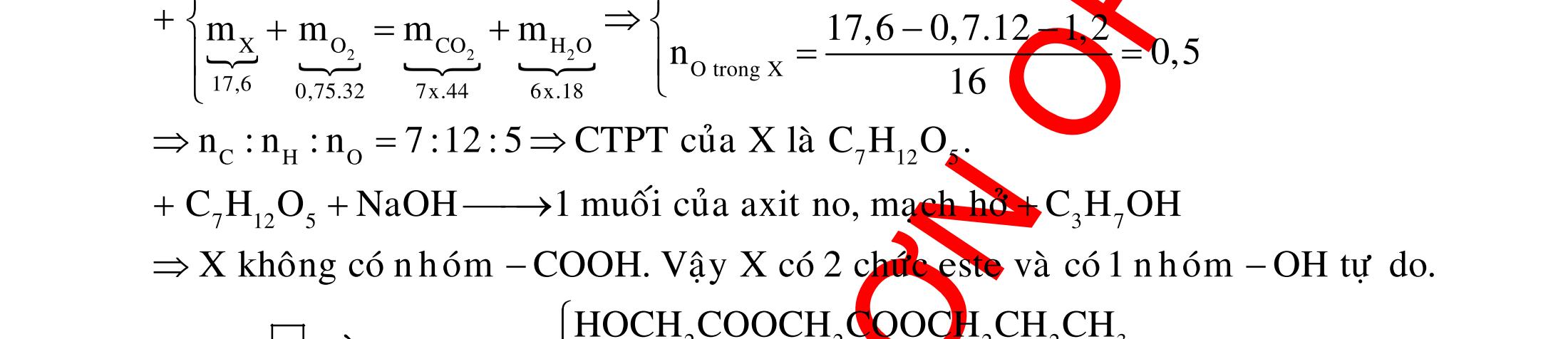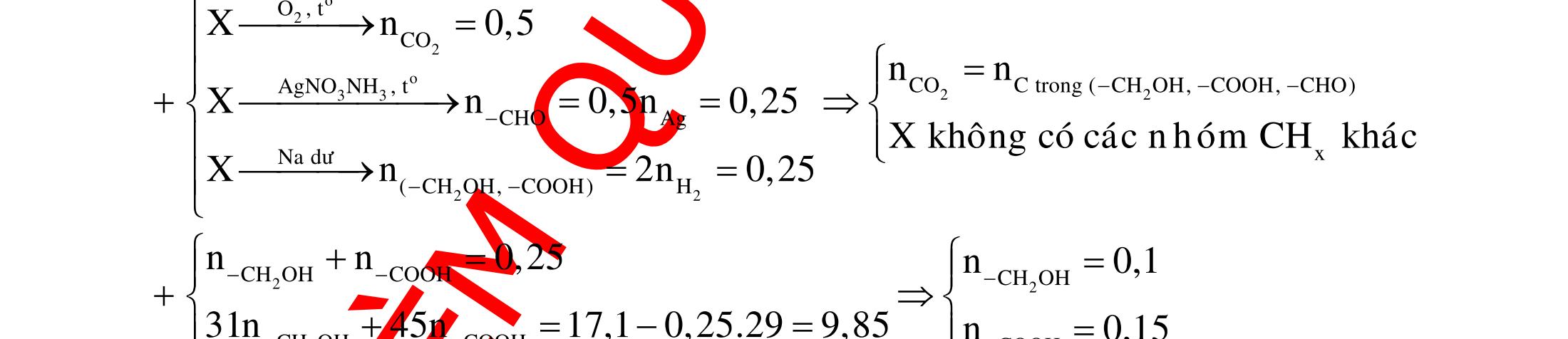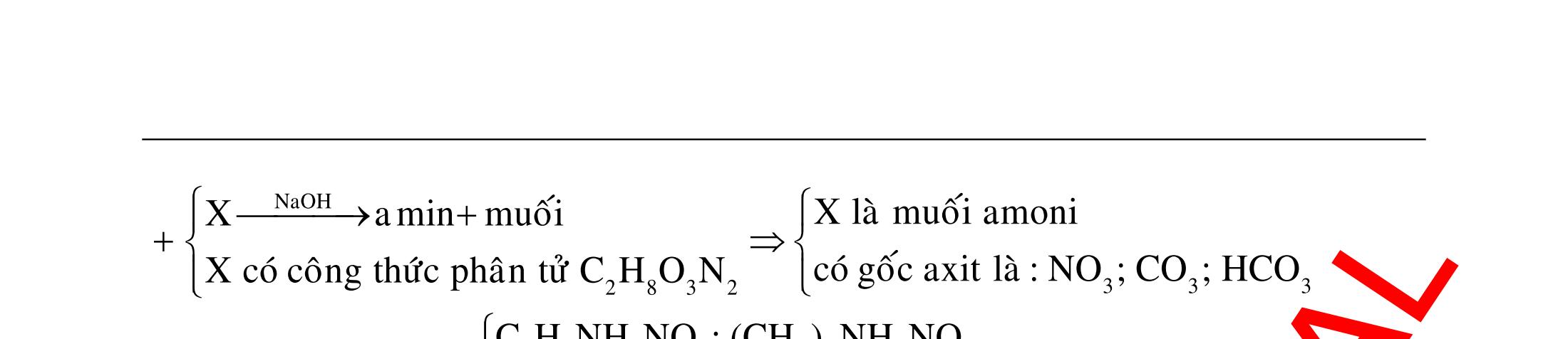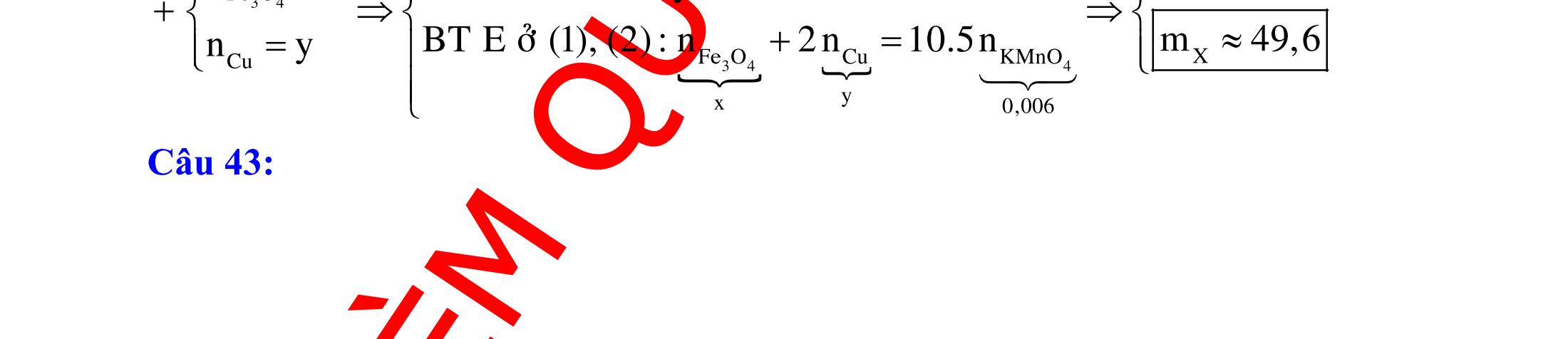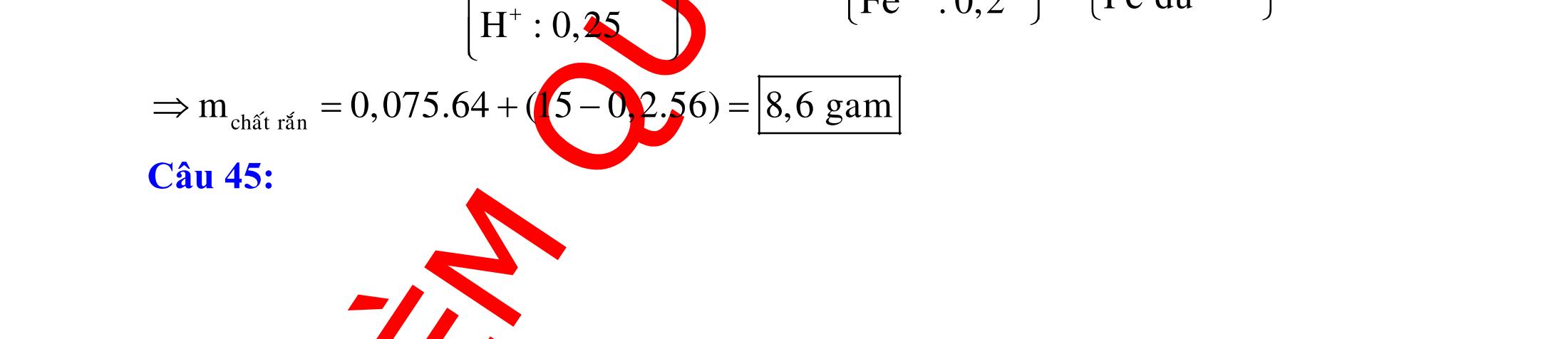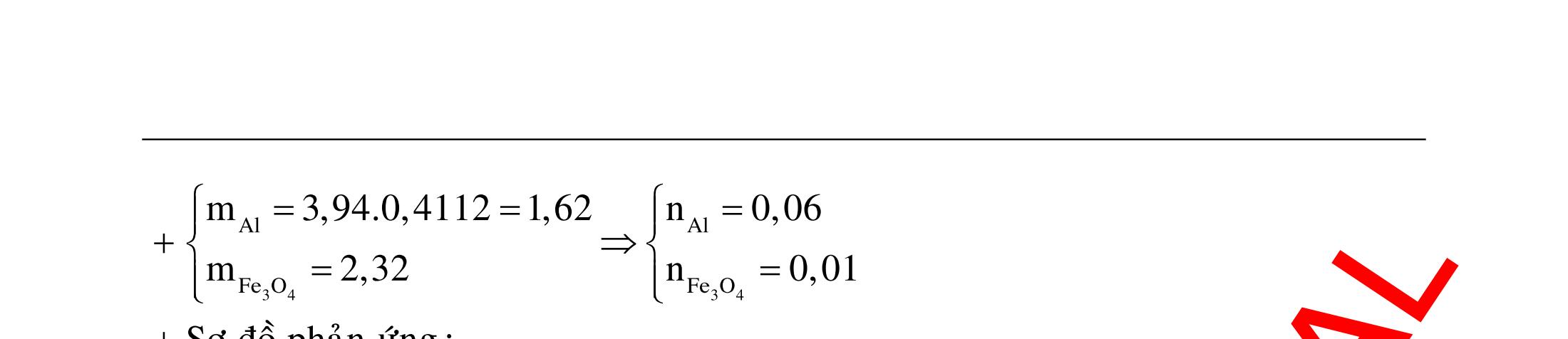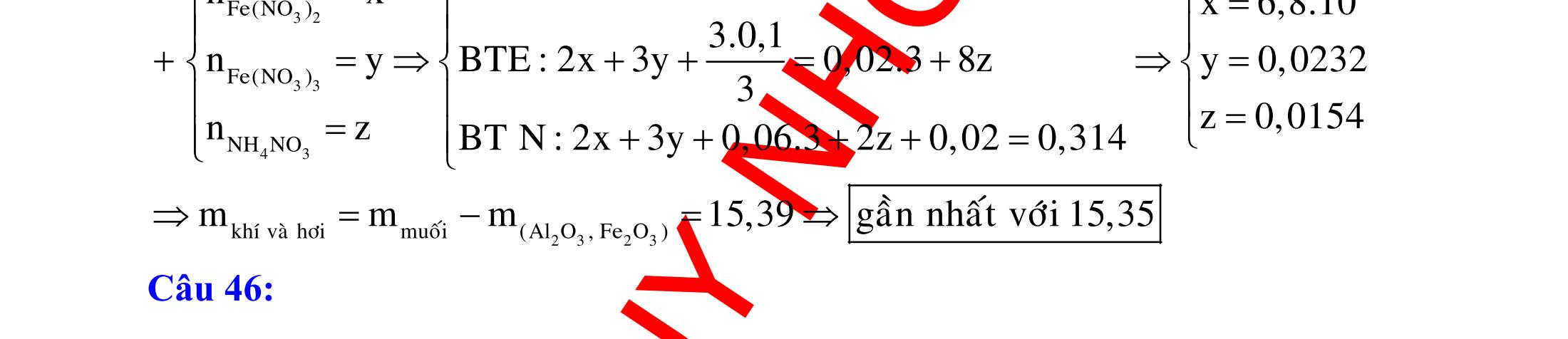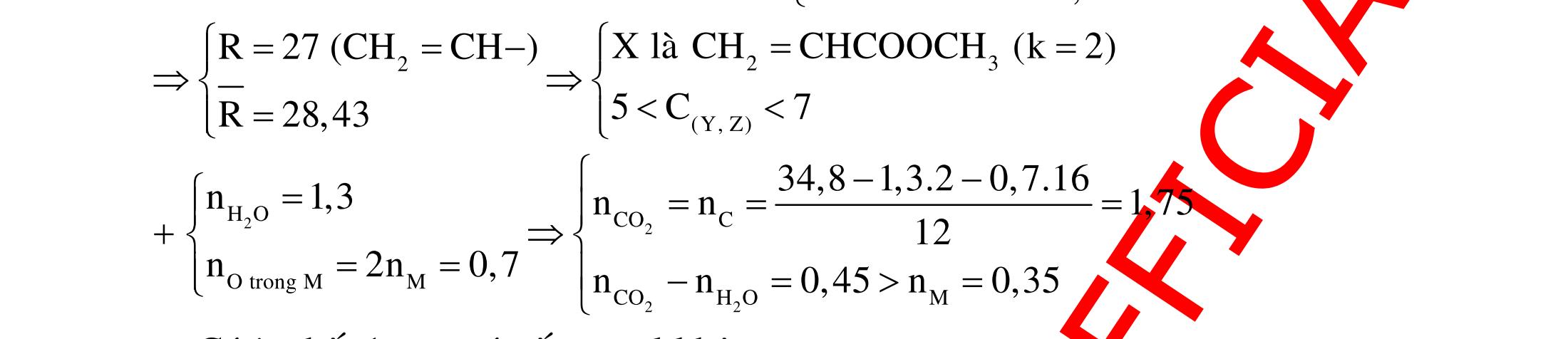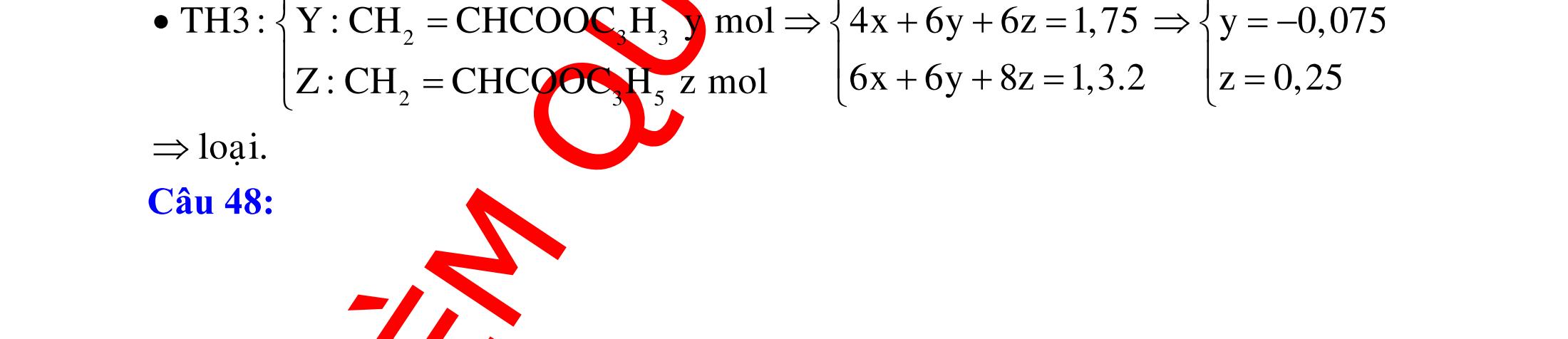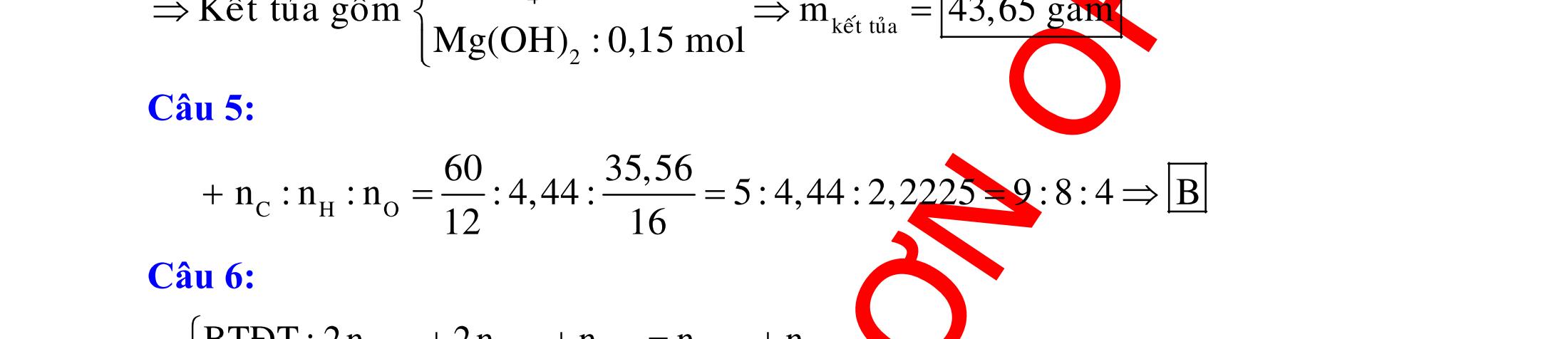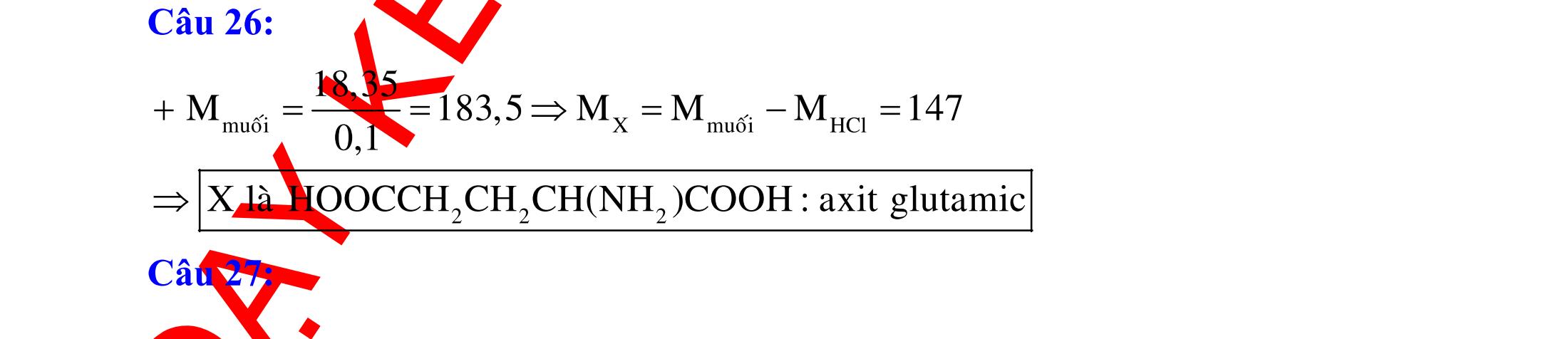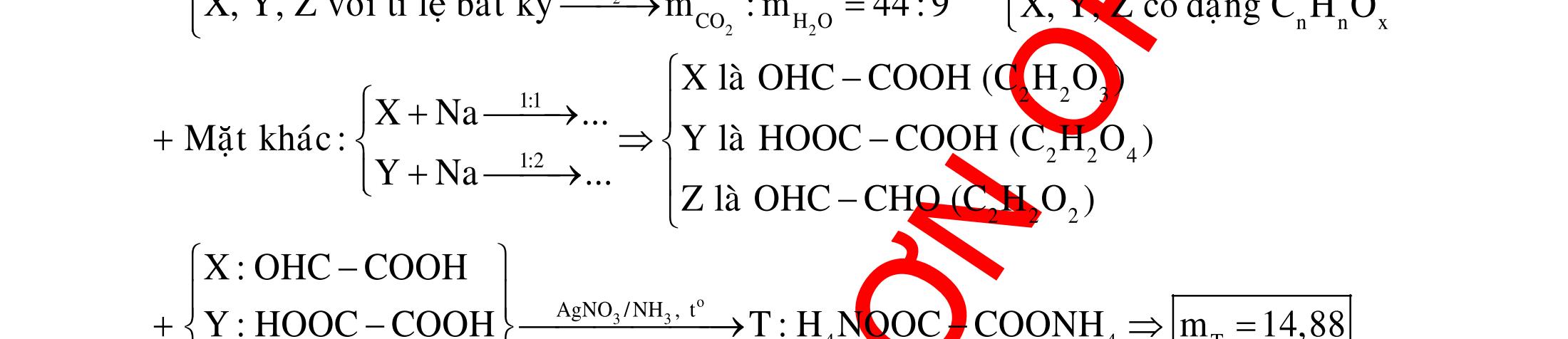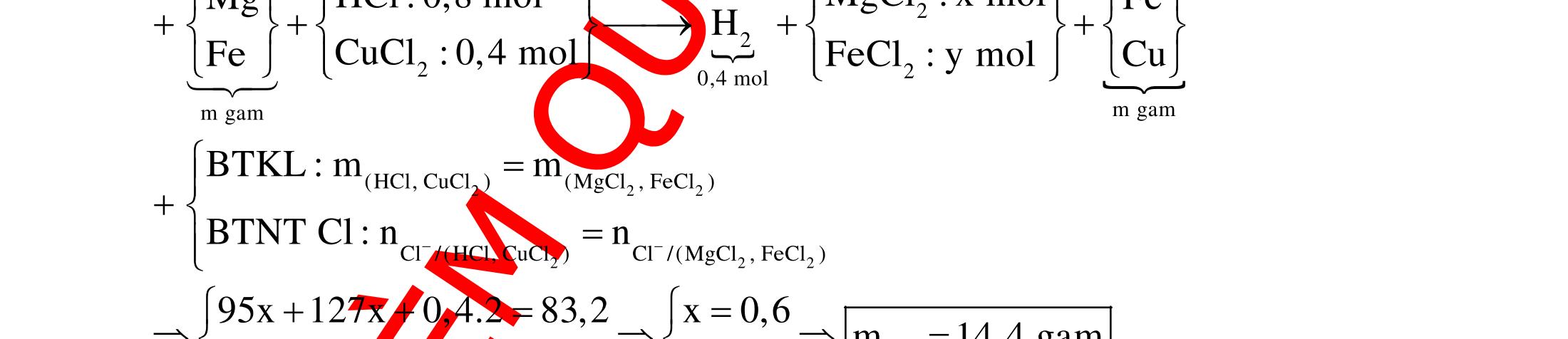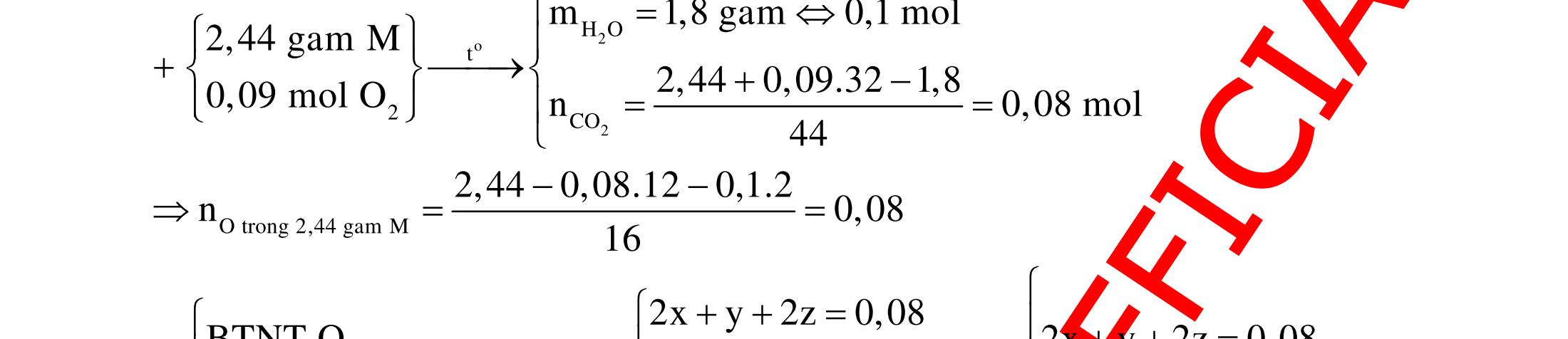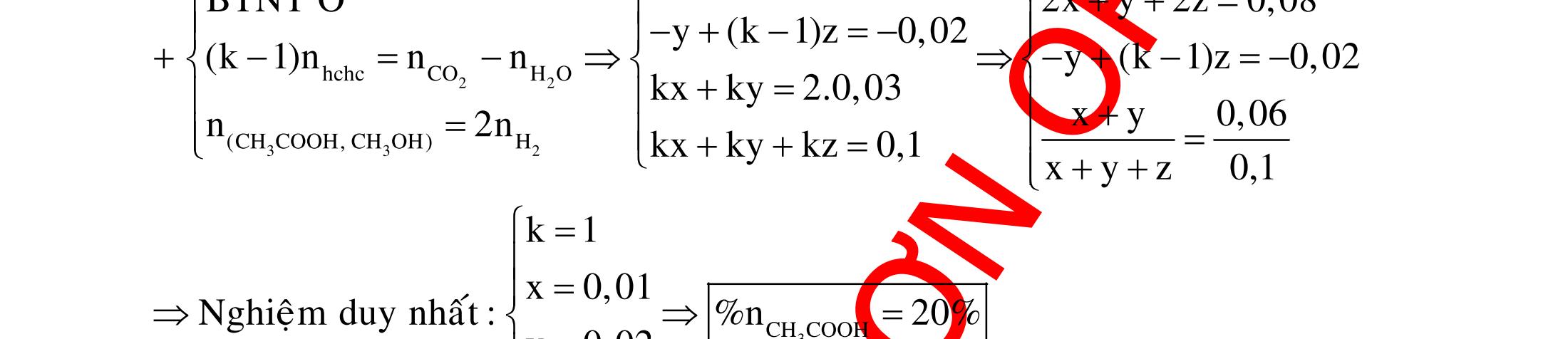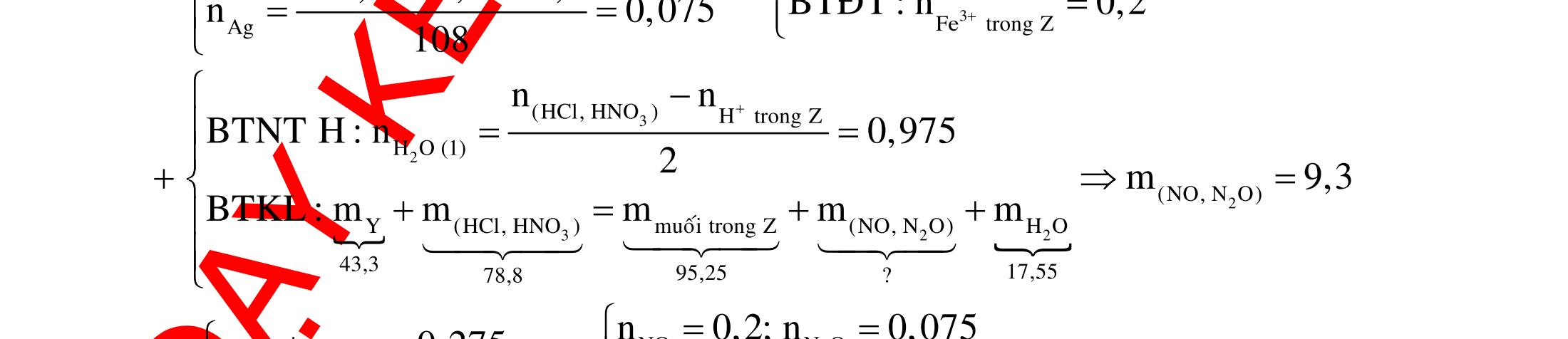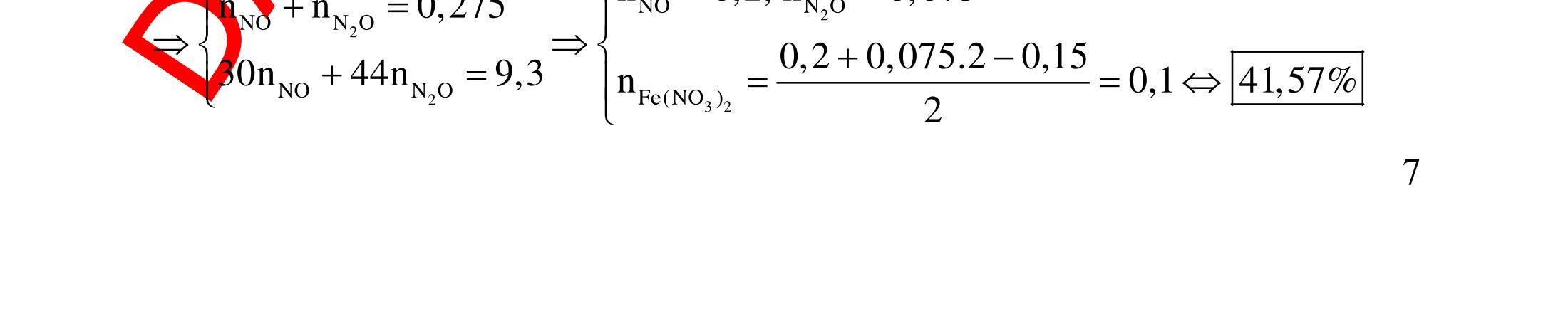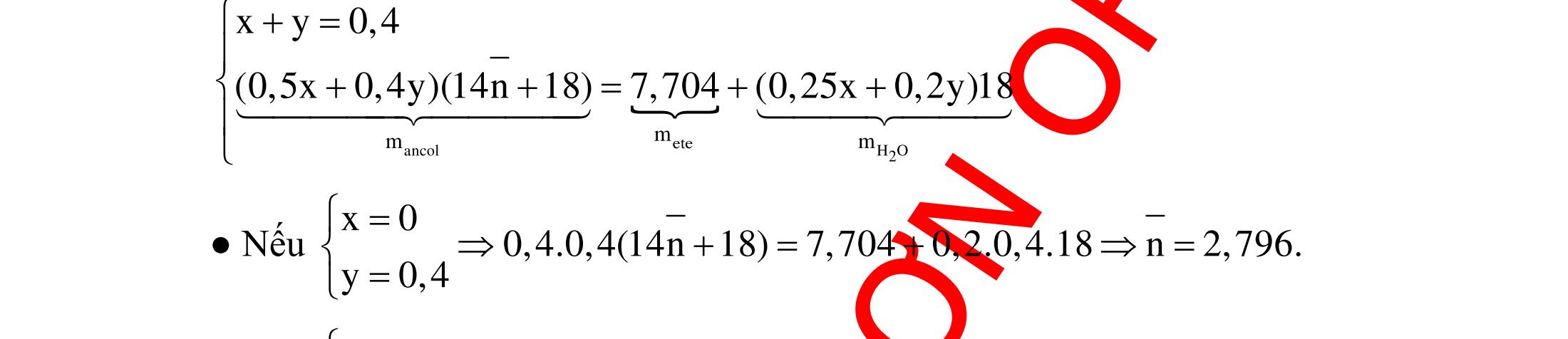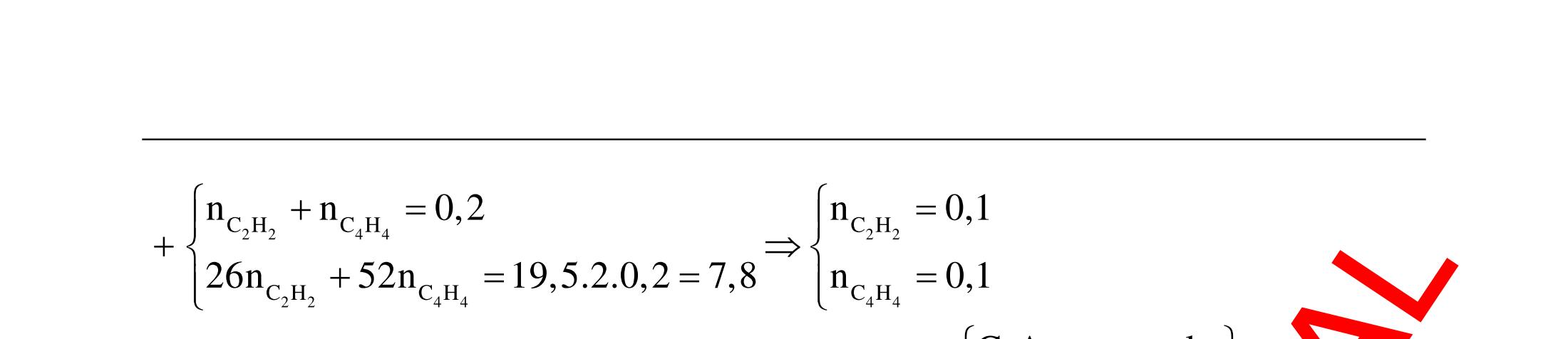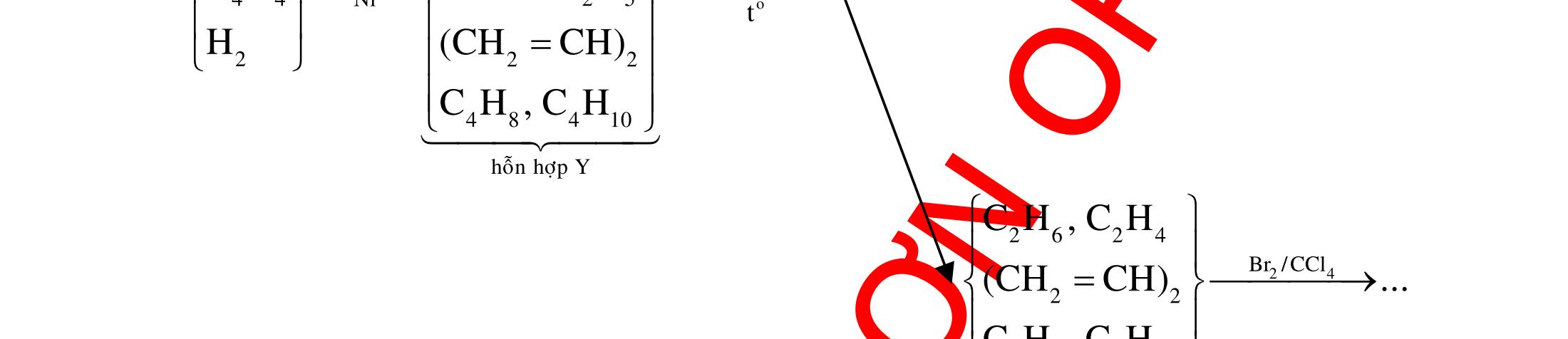BÀI TẬP VẬN DỤNG CAO MÔN HÓA HỌC Ths Nguyễn Thanh Tú eBook Collection CHUYÊN ĐỀ BÀI TẬP VẬN DỤNG CAO HÓA HỌC LỚP 12 ĐIỂM 9, 10 - ĐIỆN PHÂN - VÔ CƠ TỔNG HỢP - ESTE - HỮU CƠ TỔNG HỢP - VÔ CƠ 8, 9, 10 - HỮU CƠ 8, 9, 10 - ĐỒ THỊ, HÌNH VẼ THÍ NGHIỆM - NHẬN BIẾT, TÌM CHẤT WORD VERSION | 2022 EDITION ORDER NOW / CHUYỂN GIAO QUA EMAIL TAILIEUCHUANTHAMKHAO@GMAIL COM Hỗ trợ trực tuyến Fb www.facebook.com/DayKemQuyNhon Mobi/Zalo 0905779594 Tài liệu chuẩn tham khảo Phát triển kênh bởi Ths Nguyễn Thanh Tú Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group vectorstock com/28062440
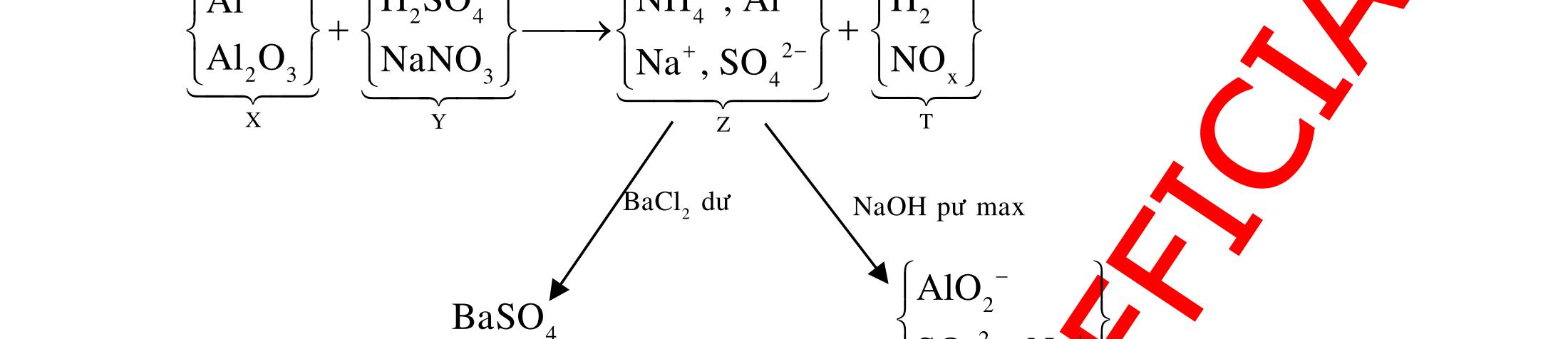
CHUYÊN ĐỀ 11 : PHÂN DẠNG CÂU HỎI TỔNG HỢP KIẾN THỨC
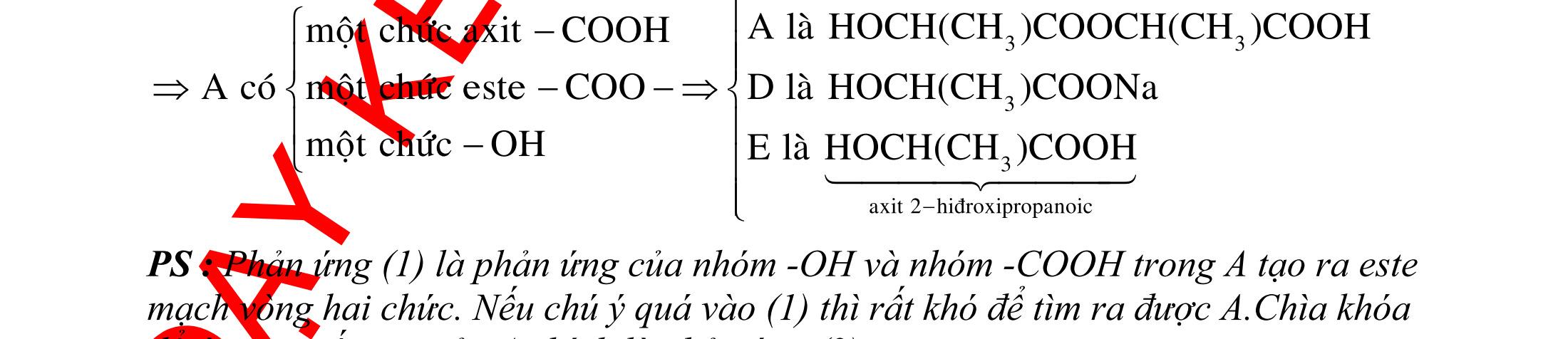
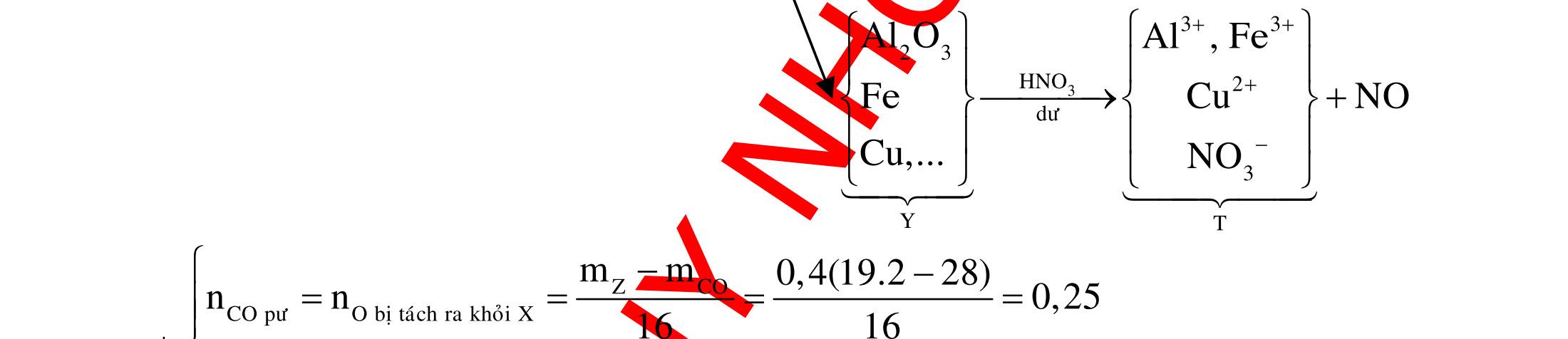
A. PHÂN DẠNG CÂU HỎI VÀ VÍ DỤ MINH HỌA I. Xác định chất phản ứng với H2 1. Những vấn đề lý thuyết cần lưu ý Những hợp chất có khả năng phản ứng với H2 (to, xt) bao gồm : - Các hợp chất không no : Là những hợp chất trong phân tử có liên kết CC;CC - Các hợp chất chứa chức anđehit, xeton CHO;CO.
2. Ví dụ minh họa
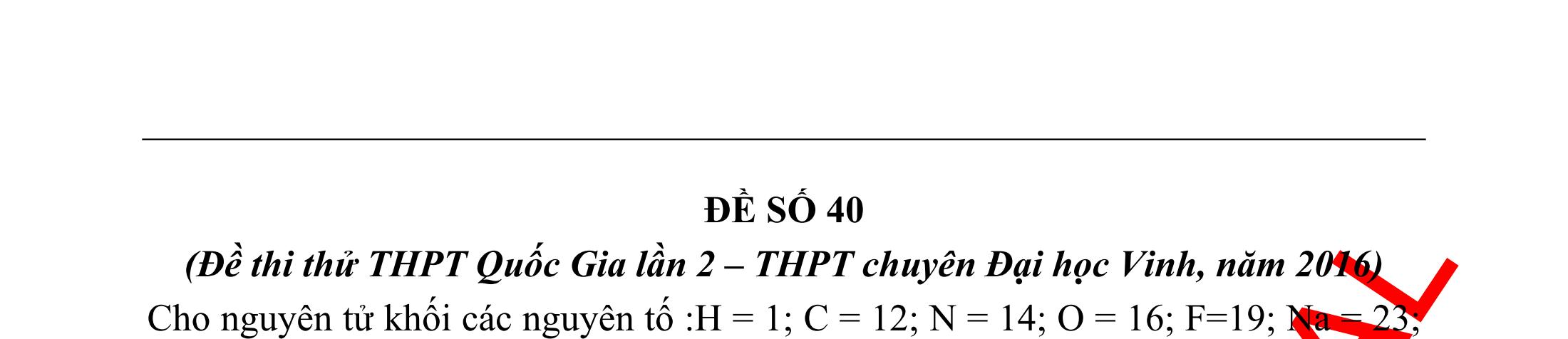
Ví dụ 1: Hãy cho biết những chất nào sau đây có khi hiđro hóa cho cùng sản phẩm?
A. but-1-en, buta-1,3-đien, vinyl axetilen. B. propen, propin, isobutilen.
C. etyl benzen, p-xilen, stiren. D. etilen, axetilen và propanđien.
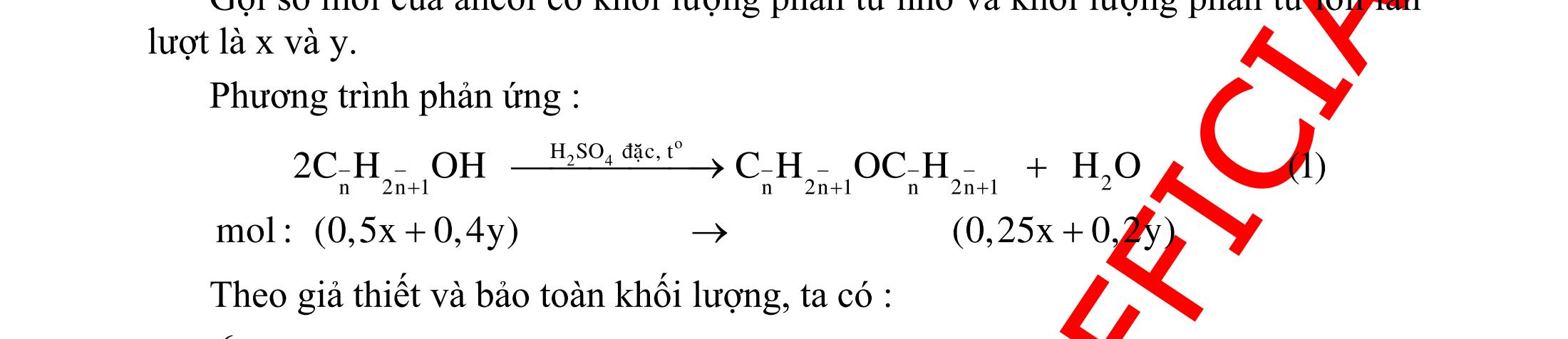
Hướng dẫn trả lời
Những chất khi hiđro hóa cho cùng một sản phẩm là but-1-en, buta-1,3-đien, vinyl axetilen. Phương trình phản ứng :
DẠYKÈMQUYNHƠN
1
OFFICIAL
o o o
2
t,Ni 2 2 2
t,Ni 2 2
CHCHCHCHH CHCHCHCH CHCHCHCH2H CHCHCHCH CHCHCCH3H CHCHCHCH Ví dụ 2: Trong các chất: stiren, axit acrylic,
và
có khả năng tham gia phản ứng
A. 3. B. 5.
2. D. 4. Hướng dẫn trả lời Trong số các chất trên, có 3 chất trong phân tử có liên kết kém bền, có thể tham gia phản ứng cộng H2 (to, Ni), đó là stiren, axit acrylic, vinylaxetilen. Phương trình phản ứng : o o o t,Ni 65 22 652 3 t,Ni 2 2 3 2 t,Ni 2 2 3 2 2 3 CHCHCHH CHCHCH CHCHCOOHH CHCHCOOH CHCCHCH3H CHCHCHCH Ví dụ tương tự :
t,Ni
2 32 3 2 2 3
3 2 2 3
3 2 2 3
axit axetic, vinylaxetilen
butan, số chất
cộng hiđro (xúc tác Ni, đun nóng) là
C.
Ví dụ 3: Trong các chất: stiren, axit acrylic, axit axetic, vinylaxetilen, axeton và butan, số chất có khả năng tham gia phản ứng cộng hiđro (xúc tác Ni, đun nóng). A. 3. B. 4. C. 2. D. 5. (Đề thi thử THPT Quốc Gia lần 2 – THPT Nguyễn Khuyến – TP.HCM, năm 2015)
Ví dụ 4: Cho các chất : but-1-en, but-1-in, buta-1,3-đien, vinylaxetilen, isobutilen. Có bao nhiêu chất trong số các chất trên khi phản ứng hoàn toàn với khí H2 dư (xúc tác Ni, đung nóng) tạo ra butan ? A. 5. B. 6. C. 3. D. 4. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 3B 4D II. Xác định chất phản ứng với dung dịch Br2 1. Những vấn đề lý thuyết cần lưu ý
Những hợp chất hữu cơ có khả năng phản ứng với dung dịch nước brom bao gồm :
OFFICIAL
- Hợp chất không no (hiđrocacbon không no, ancol không no, anđehit không no,...).
- Hợp chất có nhóm –CHO (anđehit, axit fomic, muối của axit fomic, este của axit fomic, glucozơ).
- Phenol. - Anilin.
2. Ví dụ minh họa
Ví dụ 1: Cho dãy các chất: CH≡C–CH=CH2; CH3COOH; CH2=CH–CH2–OH;
DẠYKÈMQUYNHƠN
2
CH
. Số chất
A. 5. B. 3. C. 4. D. 2.
Hướng dẫn trả lời Số chất làm mất màu nước brom là 4, đó là CH≡C–CH=CH2; CH2=CH–CH2–OH; CH3COOCH=CH2; CH2=CH2. Phương trình phản ứng : 2 2 2 2 2 2 2 2 2 2 3 22 3 2 2 22 2 2 CHCCHCH3BrCHBrCHBrCHBrCHBr CHCHCHOHBrCHBrCHBrCHOH CHCOOCHCHBrCHCOOCHBrCHBr CHCHBrCHBrCHBr Ví dụ 2: Trong các chất : etilen, benzen, stiren, metyl acrylat, vinyl axetat, đimetyl ete, số chất có khả năng làm mất màu nước brom là A. 5. B. 4. C. 3. D. 6. Hướng dẫn trả lời
CH3COOCH=CH2;
2=CH2
trong dãy làm mất màu nước brom là
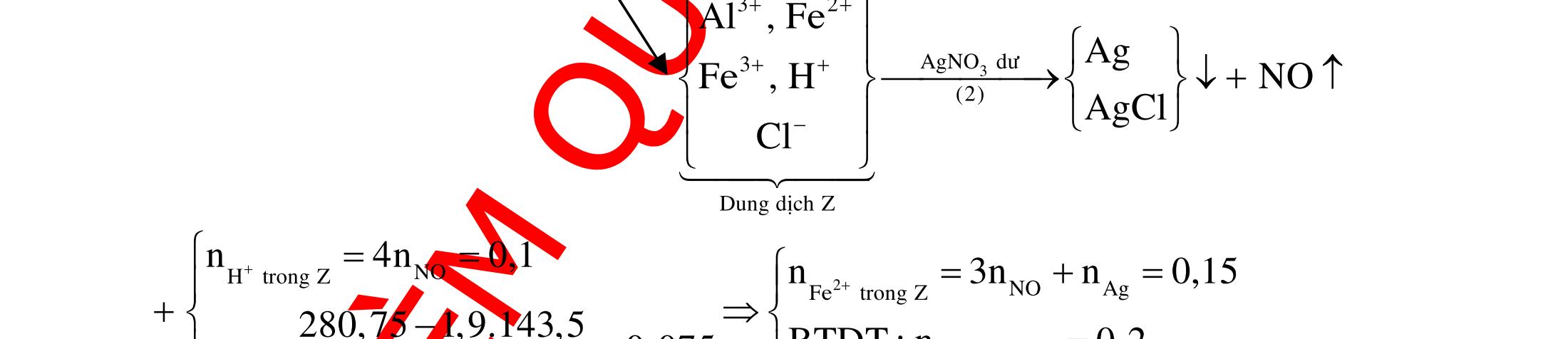
(Kỳ thi THPT Quốc Gia, năm 2016)
Trong các chất trên, có 4 chất làm mất màu nước brom là etilen, stiren, metyl acrylat, vinyl axetat.
trình phản ứng
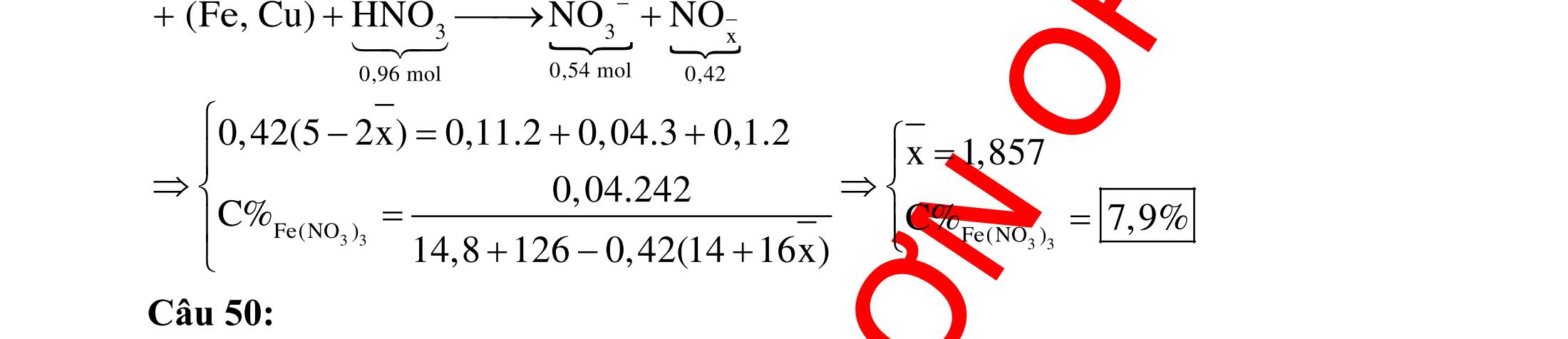
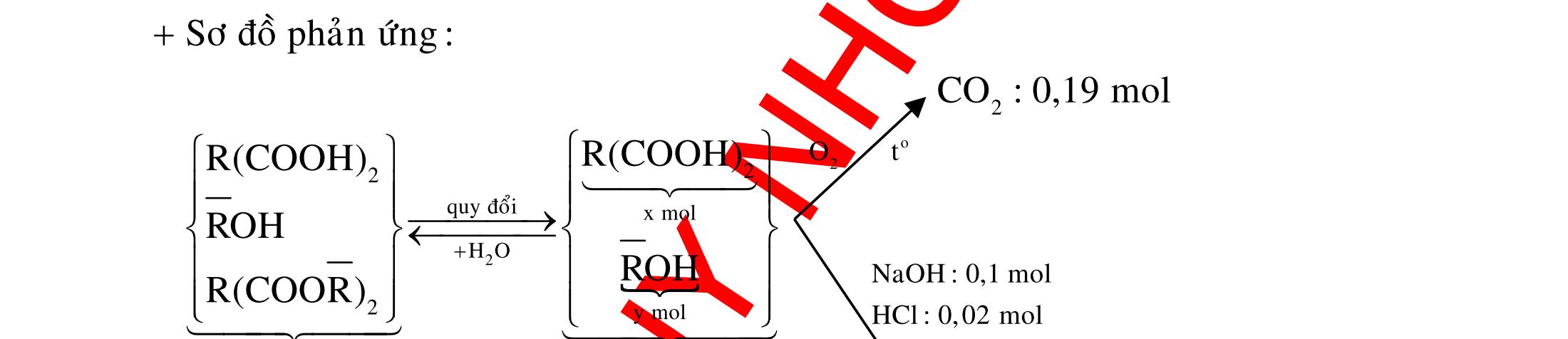
Ví dụ 3: Cho dãy các chất: stiren, ancol benzylic, anilin, toluen, phenol (C6H5OH). Số chất trong dãy có khả năng làm mất màu nước brom là A. 2. B. 5. C. 4. D. 3.
Hướng dẫn trả lời
Trong dãy chất trên, số chất có khả năng làm mất màu nước brom là 3, đó là stiren, anilin và phenol. Phương trình phản ứng : NH2 +3Br2
NH2 Br Br Br
+3HBr OH +3Br2
OH Br Br Br
+3HBr CHCH2 + Br2
CHBrCH2Br
Ví dụ 4: Cho các chất sau : etilen, axetilen, phenol (C6H5OH) , buta-1,3-đien, toluen, anilin. Số chất làm mất màu nước brom ở điều kiện thường là A. 4. B. 2. C. 5 D. 3. Hướng dẫn trả lời
DẠYKÈMQUYNHƠN OFFICIAL 3
Phương
: 2 22 2 2 65 2265 2 2 3 32 2 3 3 3 22 3 2 CHCHBrCHBrCHBr CHCHCHBrCHCHBrCHBr CHC(CH)COOCHBrCHBrCBr(CH)COOCH CHCOOCHCHBrCHCOOCHBrCHBr
2
2
Br Br
2
2
Br
dụ 5: Cho dãy các chất: CH4, C2H2, C2H4, C2H5OH, CH2=CH-COOH, C6H5NH2 (anilin), C6H5OH (phenol), C6H6 (benzen). Số chất trong dãy phản ứng được với nước brom là : A. 6. B. 7. C. 5. D. 8. Hướng dẫn trả lời Những chất phản ứng được với nước brom : Hợp chất không no (hiđrocacbon không no, ancol không no, anđehit không no,...); hợp chất có nhóm –CHO (anđehit, axit fomic, muối của axit fomic, este của axit fomic, glucozơ); phenol; anilin. Suy ra trong dãy chất trên, có 5 chất phản ứng được với nước brom là C2H2, C
DẠYKÈMQUYNHƠN OFFICIAL 4
CHCHCHCH2BrCHBrCHBrCHBrCHBr OH +3Br
2 2 2 2 22 2 2 2 2 2 CHCH2BrCHBrCHBr CHCHBrCHBrCHBr CHCHCOOHBrCHBrCHBrCOOH CHCH2 + Br2 CHBrCH2Br
Có 5 chất làm mất màu dung dịch nước Br2 ở nhiệt độ thường là etilen, axetilen, buta-1,3-đien, phenol (C6H5OH) , anilin. Phương trình phản ứng : 2 2 2 2 22 2 2 2 2 2 2 2 CHCH2BrCHBrCHBr CHCHBrCHBrCHBr
OH Br
+3HBr NH
+3Br
NH
Br Br
+3HBr Ví
2H4, CH2=CH-COOH, C6H5NH2 (anilin), C6H5OH (phenol). Phương trình phản ứng :
OH
+3Br2
OH Br Br Br
+3HBr
Ví dụ tương tự :
Ví dụ 6: Cho các chất : phenol, stiren, benzen, toluen, anilin, triolein, glixerol. Số chất tác dụng được với nước brom là A. 6. B. 5. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 1 – THPT Thanh Chương 1 – Nghệ An, năm 2015)
Ví dụ 7: Cho dãy các chất: isopentan, lysin, glucozơ, isobutilen, propanal, isopren, axit metacrylic, phenylamin, m-crezol, cumen, stiren. Số chất trong dãy phản ứng được với nước brom là: A. 6. B. 9. C. 8. D. 7. (Đề thi thử THPT Quốc Gia lần 1 – THPT Chúc Động – Hà Nội, năm 2015)
Ví dụ 8: Cho các chất sau: axetilen, phenol, glucozơ, toluen, isopren, axit acrylic, axit oleic, etanol, anilin. Số chất làm mất màu nước brom ở điều kiện thường là A. 7. B. 6. C. 4. D. 5. (Đề thi thử THPT Quốc Gia lần 1 – THPT Sào Nam – Quảng Nam, năm 2015)
Ví dụ 9: Cho các chất sau: o-crezol, axit phenic, ancol benzylic, axit acrylic, axit fomic, anilin, anlen, etan, glucozơ, fructozơ, etanal, axeton, metylphenyl ete, phenyl amoni clorua. Số chất không làm mất màu dung dịch nước brom ở điều kiện thường là: A. 5. B. 6. C. 7. D. 4.
(Đề thi chọn học sinh giỏi tỉnh Thái Bình, năm 2015)
Ví dụ 10: Trong các chất : metan, etilen, benzen, stiren, glixerol, anđehit axetic, đimetyl ete, axit axetic, số chất có khả năng làm mất màu nước brom là A. 2. B. 3. C. 5. D. 4. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Nguyễn Quang Diệu – Đồng Tháp, năm 2015)
DẠYKÈMQUYNHƠN
5
OFFICIAL
ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 6C 7C 8A 9A 10A
III. Xác định chất phản ứng với dung dịch AgNO3/NH3
1. Những vấn đề lý thuyết cần lưu ý
Những hợp chất có khả năng phản ứng với dung dịch AgNO3/NH3 bao gồm :
- Phân tử có nhóm –CHO (anđehit, axit fomic, muối của axit fomic, este của axit fomic, glucozơ); fructozơ (chuyển hóa thành glucozơ trong môi trường kiềm). Bản chất phản ứng là Ag+ oxi hóa nhóm –CHO thành nhóm –COONH4 và giải phóng Ag, gọi là phản ứng tráng gương.
- Phân tử có liên kết (Ank-1-in,...). Bản chất phản ứng là sự thay thế CHC H ở nguyên tử C có liên kết ba bằng nguyên tử Ag, tạo ta kết tủa màu vàng nhạt. 2. Ví dụ minh họa
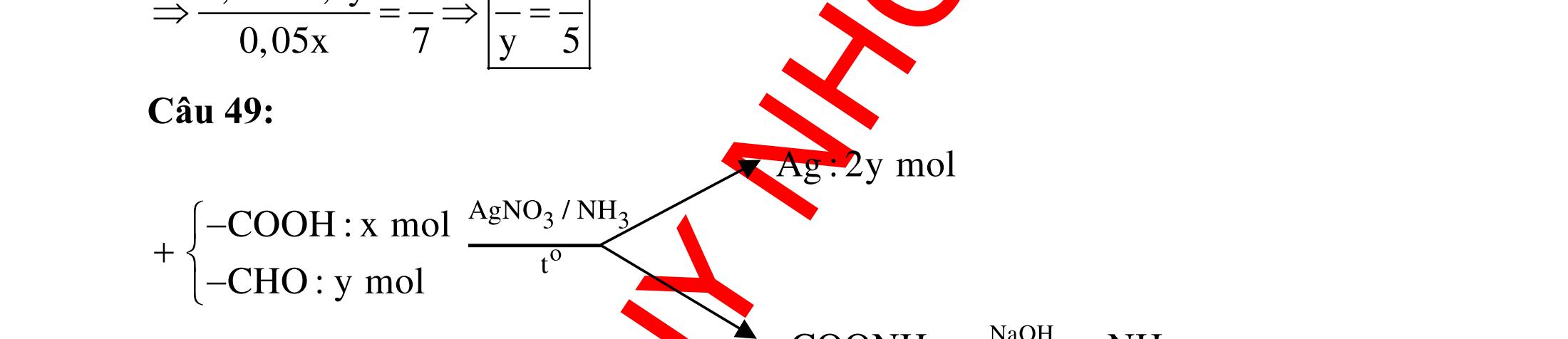
Ví dụ 1: Cho các chất sau : axetilen, vinylaxetilen, anđehit fomic, axit fomic, metyl fomat, glixerol, saccarozơ, fructozơ, penta-1,3-điin. Số chất tham gia phản ứng với dung dịch AgNO3 trong NH3 dư có kết tủa vàng nhạt là A. 5. B. 3. C. 4. D. 6. Hướng dẫn trả lời Các chất có khả năng tạo kết tủa vàng khi phản ứng với AgNO3/NH3 là những chất có liên kết ở đầu mạch cacbon. Suy ra có 3 chất thỏa mãn là axetilen, CC vinylaxetilen và penta-1,3-điin. Phương trình phản ứng :
A. vinylaxetilen, glucozơ, đimetylaxetilen.
B. vinylaxetilen, glucozơ, axit propionic. C. vinylaxetilen, glucozơ, anđehit axetic. D. glucozơ, đimetylaxetilen, anđehit axetic.
DẠYKÈMQUYNHƠN
6
OFFICIAL
o o o t 3 3 43 t 2 3 3 2 43 2 3 3 t 2 43 CHCH2AgNO2NHCAgCAg2NHNO CHCCHCHAgNONHAgCCCHCHNHNO CHCCHCCH2AgNO2NH CAgCCHCCAg2NHNO Ví dụ 2: Cho dãy các chất : anđehit axetic, axetilen, glucozơ, axit axetic,
axetat. Số chất trong dãy có khả năng tham gia phản ứng tráng bạc là A. 2. B. 4. C. 5. D. 3. Hướng dẫn trả lời Chất có phản ứng tráng bạc là chất có chức –CHO.
metyl
Suy ra trong số các chất trên có 2 chất tham gia phản ứng tráng gương là anđehit axetic và glucozơ. Ví dụ 3: Các chất trong dãy nào sau đây đều tạo kết tủa khi cho tác dụng với dung dịch AgNO3 trong NH3 dư, đun nóng?
Hướng dẫn trả lời
Dãy gồm các chất đều tạo kết tủa khi cho phản ứng với AgNO3/NH3 là : vinylaxetilen, glucozơ, anđehit axetic.
Ví dụ 4: Dãy gồm các chất đều phản ứng được với AgNO3/NH3 tạo ra kim loại Ag là :
A. benzanđehit, anđehit oxalic, etyl fomat, etyl axetat.
B. benzanđehit, anđehit oxalic, saccarozơ, metyl fomat.
C. axetilen, anđehit oxalic, etyl fomat, metyl fomat.
D. benzanđehit, anđehit oxalic, amoni fomat, metyl fomat. Hướng dẫn trả lời
Dãy gồm các chất đều phản ứng được với AgNO3/NH3 tạo ra kim loại Ag là : benzanđehit (C6H5CHO), anđehit oxalic (OHC – CHO), amoni fomat (HCOONH4), metyl fomat (HCOOCH3). Tất cả các chất trong dãy này đều có nhóm –CHO nên có phản ứng tráng gương.
OFFICIAL
Các dãy chất còn lại có những chất không có nhóm –CHO nên không có phản ứng tráng gương là : axetilen, etyl axetat, saccarozơ.
Ví dụ 5: Cho các chất: (1) axetilen; (2) but–2–in ; (3) metyl fomat; (4) glucozơ; (5) metyl axetat, (6) fructozơ, (7) amonifomat. Số chất tham gia phản ứng tráng gương là :
A. 5. B. 4. C. 6. D. 3.
Hướng dẫn trả lời
Trong số các chất đề cho, có 4 chất có khả năng tham gia phản ứng tráng gương là (3), (4), (6), (7). Các chất (3), (4), (7) trong phân tử có nhóm –CHO nên có phản ứng tráng gương. Chất (6) tuy không có nhóm –CHO nhưng trong môi trường kiềm lại chuyển hòa thành hợp chất có nhóm –CHO nên cũng có phản ứng tráng gương.
Ví dụ 6: Cho dãy các chất : C2H2, HCHO, HCOOH, CH3CHO, HCOONa, HCOOCH3, C6H12O6 (glucozơ). Số chất trong dãy tham gia được phản ứng tráng gương là : A. 5. B. 4. C. 7. D. 6. Hướng dẫn trả lời Các chất có phản ứng tráng gương khi trong phân tử của chúng có nhóm –CHO hoặc có thể chuyển hóa thành nhóm –CHO trong môi trường kiềm. Suy ra trong dãy chất trên, có 6 chất có thể tham gia phản ứng tráng gương là HCHO, HCOOH, CH3CHO, HCOONa, HCOOCH3, C6H12O6 (glucozơ). Ví dụ 7: Cho các hợp chất hữu cơ: C2H2, C2H4, CH2O, CH2O2 (mạch hở), C3H4O2 (mạch hở, đơn chức). Biết C3H4O2 không làm chuyển màu quỳ tím ẩm. Số chất tác dụng được với dung dịch AgNO3 trong NH3 tạo ra kết tủa là A. 4. B. 3. C. 2. D. 5.
DẠYKÈMQUYNHƠN
7
Hướng dẫn trả lời Hợp chất C3H4O2 mạch hở, đơn chức, không làm chuyển màu quỳ tím ẩm, chứng tỏ nó là este, có công thức là HCOOCH=CH2.
Các chất hữu cơ phản ứng với AgNO3/NH3 tạo ra kết tủa gồm : Hợp chất có liên kết ở đầu mạch; hợp chất có nhóm –CHO.
CC
Suy ra : Trong số các hợp chất hữu cơ đề cho, có 4 chất là CH2O (HCHO), CH2O2 (HCOOH), HCOOCH=CH2 và thỏa mãn điều kiện đề bài. CHCH
Ví dụ minh họa : Ví dụ 8: Dãy gồm các dung dịch đều tham gia phản ứng tráng bạc là:
A. Glucozơ, axit fomic, anđehit axetic. B. Glucozơ, glixerol, mantozơ, axit fomic. C. Frutozơ, glixerol, anđehit axetic. D. Glucozơ, frutozơ, saccarozơ.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Tĩnh Gia 2 – Thanh Hóa, năm 2015)
OFFICIAL
Ví dụ 9: Cho dãy các chất: CH3CHO, HCOOH, C2H5OH, CH3COCH3. Số chất trong dãy có khả năng tham gia phản ứng tráng bạc là
A. 1. B. 3. C. 2. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Đại học Vinh – Nghệ An, năm 2015)
Ví dụ 10: Cho các chất sau: Axit fomic, metylfomat, axit axetic, glucozơ, tinh bột, xenlulozơ, anđehit axetic. Số chất có phản ứng với dung dịch AgNO3/NH3 cho ra Ag là A. 4. B. 2. C. 3. D. 5. (Đề thi thử THPT Quốc Gia – Sở GD & ĐT TP.HCM, năm 2015)
Ví dụ 11: Cho dãy các chất: HCOONH4, HCHO, CH3COOH, CH3COOC2H5, HCOOH, C2H5OH, HCOOCH3, HCOONa. Số chất trong dãy tham gia phản ứng tráng bạc là: A. 6. B. 4. C. 5. D. 3. (Đề thi thử THPT Quốc Gia – Sở GD & ĐT Thanh Hóa, năm 2015)
Ví dụ 12: Cho các hợp chất: glucozơ, saccarozơ, anđehit axetic, axit fomic, metyl fomat, axetilen, but-2-in, vinyl axetilen. Số hợp chất có khả năng khử được ion Ag+ trong dung dịch AgNO3/NH3 khi đun nóng là: A. 5. B. 7. C. 4. D. 6. (Đề thi chọn học sinh giỏi tỉnh Thái Bình, năm 2015)
Ví dụ 13: Cho các chất sau: glucozơ, axetilen, saccarozơ, anđehit axetic, but-2-in, etyl fomat. Số chất khi tác dụng với dung dịch AgNO3 (NH3, to) cho kết tủa là
DẠYKÈMQUYNHƠN
8
A. 3. B. 2. C. 5. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đoàn Thượng – Hải Dương, năm 2015) Ví dụ 14: Cho các chất sau: axetilen, fomanđehit, phenyl fomat, glucozơ, anđehit axetic, metyl axetat, saccarozơ, anbumin, natri fomat, axeton, but-1-in. Số chất có thể tạo kết tủa khi tác dụng với dung dịch AgNO3 trong NH3 là A. 7. B. 5. C. 8. D. 6. (Đề thi thử THPT Quốc Gia lần 3 – THPT Chúc Động – Hà Nội, năm 2015) ĐÁP ÁN
hữu
có khả năng hòa tan được Cu(OH)2 bao gồm : - Các hợp chất có ít nhất 2 nhóm liền kề. Dung dịch thu được có màu OH xanh thẫm.
- Axit cacboxylic. Dung dịch thu được có màu xanh nhạt - Peptit có từ 2 liên kết peptit trở lên. Dung dịch thu được có màu tím.
2. Ví dụ minh họa
Ví dụ 1: Cho các chất : rượu (ancol) etylic, glixerin (glixerol), glucozơ, đimetyl ete và axit fomic. Số chất tác dụng được với Cu(OH)2 là : A. 2. B. 3. C. 1. D. 4. Hướng dẫn trả lời
Những chất hữu cơ tác dụng được với Cu(OH)2 ở nhiệt độ thường là : axit cacboxylic, hợp chất có ít nhất 2 nhóm –OH liền kề nhau. Suy ra trong các chất trên, có 3 chất phản ứng được với Cu(OH)2 là glixerol, glucozơ, axit fomic. Ví dụ 2: Cho các chất : saccarozơ, glucozơ, frutozơ, etyl fomat, axit fomic và anđehit axetic. Trong các chất trên, số chất vừa có khả năng tham gia phản ứng tráng bạc vừa có khả năng phản ứng với Cu(OH)2 ở điều kiện thường là : A. 4. B. 3. C. 2. D. 5. Hướng dẫn trả lời Các chất vừa có khả năng tham gia phản ứng tráng gương, vừa có khả năng phản ứng được với Cu(OH)2 ở nhiệt độ thường thì phải thỏa mãn hai điều kiện : Thứ nhất, trong phân tử phải có nhóm –CHO hoặc có thể chuyển hóa thành hợp chất có nhóm –CHO trong môi trường NH3; thứ hai, phải là ancol đa chức có ít nhất 2 nhóm –OH liền kề hoặc phải có nhóm –COOH. Thỏa mãn đồng thời cả hai điều kiện này chỉ có glucozơ, frutozơ và axit fomic. Vậy số chất vừa có khả năng tham gia phản ứng tráng bạc vừa có khả năng phản ứng với Cu(OH)2 ở điều kiện thường là 3.
DẠYKÈMQUYNHƠN OFFICIAL 9
VÍ DỤ
TỰ 8A 9C 10A 11C 12C 13D 14A IV. Xác định chất hòa tan được Cu(OH)2 1.
TƯƠNG
Những vấn đề lý thuyết cần lưu ý Những hợp chất
cơ
Ví dụ 3: Tiến hành các thí nghiệm sau :
(1) Cho Cu(OH)2 vào dung dịch lòng trắng trứng.
(2) Cho dung dịch iot vào dung dịch hồ tinh bột ở nhiệt độ thường.
(3) Cho Cu(OH)2 vào dung dịch glixerol.
(4) Cho Cu(OH)2 vào dung dịch axit axetic.
(5) Cho Cu(OH)2 vào dung dịch propan -1,3-điol.
Màu xanh xuất hiện ở những thí nghiệm nào ? A. (1), (2), (3), (4), (5). B. (2), (3), (4), (5). C. (2), (4), (5). D. (2), (3), (4).
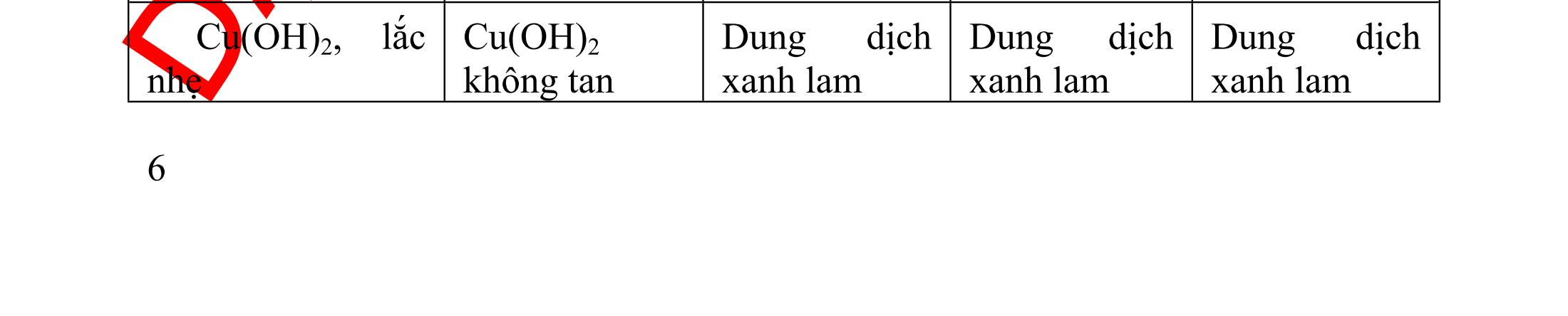
Hướng dẫn trả lời
Phản ứng của Cu(OH)2 với dung dịch lòng trắng trứng tạo ra dung dịch phức màu tím.
Phản ứng của dung dịch iot với dung dịch hồ tinh bột tạo ra dung dịch màu xanh.
Phản ứng của Cu(OH)2 với dung dịch glixerol tạo ra dung dịch phức màu màu xanh thẫm.
Phản ứng của Cu(OH)2 với dung dịch axit axetic tạo ra muối (CH3COO)2 Cu có màu xanh nhạt.
Cu(OH)2 không phản ứng được với dung dịch propan-1,3-điol.
Suy ra : Màu xanh xuất hiện ở các thí nghiệm (2), (3), (4). Ví dụ tương tự : Ví dụ 4: Phản ứng hóa học không tạo ra dung dịch có màu là
A. glixerol với Cu(OH)2.
B. dung dịch axit axetic với Cu(OH)2
C. dung dịch lòng trắng trứng với Cu(OH)2 D. Glyxin với dung dịch NaOH. (Đề thi thử THPT Quốc Gia lần 1 – THPT Can Lộc – Hà Tĩnh, năm 2015)
Ví dụ 5: Cho các dung dịch chứa các chất hữu cơ mạch hở sau: glucozơ, glixerol, ancol etylic, axit axetic, propan-1,3-điol, etylen glicol, sobitol, axit oxalic. Số hợp chất đa chức trong dãy có khả năng hòa tan Cu(OH)2 ở nhiệt độ thường là:
DẠYKÈMQUYNHƠN
10
OFFICIAL
4D 5A V. Xác định chất phản ứng với dung dịch kiềm (NaOH, KOH,...) 1. Những vấn đề lý thuyết cần lưu ý Những hợp chất hữu cơ có khả năng phản ứng với dung dịch kiềm (NaOH, KOH,...) bao gồm :
A. 4. B. 6. C. 5. D. 3. (Đề thi chọn học sinh giỏi tỉnh Thái Bình, năm 2015) ĐÁP ÁN VÍ DỤ TƯƠNG TỰ
- Phenol, axit cacboxylic, este, chất béo, amino axit, muối amoni, peptit, protein, polieste, poliamit.
2. Ví dụ minh họa
Ví dụ 1: Cho dãy các chất : phenol, anilin, phenylamoni clorua, natri phenolat, etanol. Số chất trong dãy phản ứng được với NaOH (trong dung dịch) là A. 2. B. 4. C. 1. D. 3.
Hướng dẫn trả lời
Trong các chất đề cho, có 2 chất phản ứng được với dung dịch NaOH là phenol, và phenylamoni clorua. Phương trình phản ứng :
Ví dụ 2: Cho dãy các dung dịch: axit axetic, phenylamoni clorua, natri axetat, metylamin, glyxin, phenol (C6H5OH). Số dung dịch trong dãy tác dụng được với dung dịch NaOH là A. 5. B. 6. C. 3. D. 4. Hướng dẫn trả lời Số chất tác dụng được với dung dịch NaOH là 4, gồm : axit axetic, phenylamoni clorua, glyxin, phenol. Phương trình phản ứng :
Ví dụ 3: Cho các chất : axit glutamic, saccarozơ, metylamoni clorua, vinyl axetat, phenol, glixerol, Gly-Gly. Số chất tác dụng với dung dịch NaOH loãng, nóng là A. 6. B. 4. C. 5. D. 3. Hướng dẫn trả lời Trong dãy chất trên, có 5 chất tác dụng được với dung dịch NaOH loãng là axit glutamic, metylamoni clorua, vinyl axetat, phenol, Gly-Gly. Phương trình phản ứng :
DẠYKÈMQUYNHƠN
11
OFFICIAL
65 65 2 653 652 2 CHOHNaOHCHONaHO
3 3 2 653 652
22 22
65 65 2 CHCOOHNaOHCHCOONaHO CHNHClNaOHCHNHNaClHO HNCHCOOHNaOHHNCHCOONaHO CHOHNaOHCHONaHO
CHNHClNaOHCHNHNaClHO
2
2
Ví dụ 4: Cho các chất: etyl axetat, anilin, ancol (rượu) etylic, axit acrylic, phenol, phenylamoni clorua, ancol (rượu) benzylic, p-crezol. Trong các chất này, số chất tác dụng được với dung dịch NaOH là : A. 4. B. 3. C. 6. D. 5. Hướng dẫn trả lời Các chất phản ứng với NaOH là etyl axetat, axit acrylic, phenol, phenylamoni clorua, p-crezol. Phương trình phản ứng :
PS : Các hợp chất hữu cơ phản ứng được với dung dịch NaOH gồm : phenol, axit cacboxylic, este, muối amoni, peptit và protein, polieste, poliamit. Ví dụ 5: Cho dãy các chất: Phenyl axetat, anlyl axetat, metyl axetat, etyl fomat, tripanmitin. Số chất trong dãy khi thủy phân trong dung dịch NaOH (dư), đun nóng sinh ra ancol là : A. 4. B. 5. C. 2. D. 3. Hướng dẫn trả lời
Các este tạo bởi axit cacboxylic và ancol, khi thủy phân trong môi trường axit hoặc môi trường kiềm đều thu được ancol. Suy ra trong dãy chất trên có 4 chất khi thủy phân trong dung dịch NaOH (dư), đun nóng sinh ra ancol, đó là anlyl axetat, metyl axetat, etyl fomat, tripanmitin.
Phương trình phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 12 22 2 axitglutamic 22 2 2 33 32 2 metylamoniclorua 3 2 vinylaxetat HOOCCHCHCH(NH)COOH2NaOH NaOOCCHCHCH(NH)COONa2HO CHNHClNaOHCHNHNaClHO CHCOONCHCH ot 3 3 65 65 2 phenol 22 2 22 2 GlyGly NaOHCHCOONaCHCHO CHOHNaOHCHONaHO HNCHCONHCHCOOH2NaOH2HNCHCOONaHO
t 3 25 3 25 2 2 2 65 65 2 653 652 2 364
CHCOOCHNaOHCHCOONaCHOH CHCHCOOHNaOHCHCHCOONaHO CHOHNaOHCHONaHO CHNHClNaOHCHNHNaClHO pCHCHOHNaOHpCHCHONaHO
o
364 2
Ví dụ minh họa : Ví dụ 6: Chất nào sau đây không phản ứng với dung dịch NaOH?
A. Axit axetic. B. Anilin. C. Alanin. D. Phenol. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Long An, năm 2015)
Ví dụ 7: Cho dãy các chất sau: toluen, phenyl fomat, saccarozơ, glyxylvalin (GlyVal), etylen glicol, triolein. Số chất bị thuỷ phân trong môi trường kiềm là A. 5. B. 3. C. 4. D. 6. (Đề thi thử THPT Quốc Gia lần 2 – THPT Nguyễn Khuyến – TP.HCM, năm 2015)
Ví dụ 8: Cho các chất: axit glutamic, saccarozơ, metylamoni clorua, vinyl axetat, phenol, glixerol, Gly-Gly. Số chất tác dụng với dung dịch NaOH loãng, nóng là A. 6. B. 3. C. 5. D. 4. (Đề thi thử THPT Quốc Gia lần 2 – THPT Nguyễn Khuyến – TP.HCM, năm 2015)
Ví dụ 9: Cho các chất sau: etyl axetat, etanol, axit acrylic, phenol, anilin, phenyl amoniclorua, ancol benzylic, p-crezol, m-xilen. Trong các chất trên, số chất phản ứng với NaOH là A. 3. B. 4. C. 5. D. 6. (Đề thi thử THPT Quốc Gia lần 1 – Sở Giáo Dục và Đào Tạo Vĩnh Phúc, năm 2016)
Ví dụ 10: Cho dãy các chất: etyl axetat, anilin, ancol etylic, axit acrylic, phenol, phenylamoni clorua, ancol benzylic, p-crezol, cumen. Số chất trong dãy tác dụng được với dung dịch NaOH là
4.
DẠYKÈMQUYNHƠN OFFICIAL 13 o o o o t 3 2 2 3
2
t 3 3
t
t 35
CHCOOCHCHCHNaOHCHCOONaCHCHCHOH CHCOOCHNaOHCHCOONaCHOH
2
ancolanlylic
3 3 ancolmetylic
25 25 ancoletylic
15313 35
HCOOCHNaOHHCOONaCHOH CH(OOCCH)3NaOHCH(OH)
31531 glixerol 3CHCOONa
A. 5. B. 6. C. 3. D.
(Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm 2016) ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 6B 7B 8C 9C 10A VI. Xác định chất phản ứng với dung dịch axit HCl, H2SO4 loãng 1. Những vấn đề lý thuyết cần lưu ý
Những hợp chất hữu cơ có khả năng phản ứng với dung dịch axit HCl, H2SO4 loãng bao gồm :
- Amin, amino axit, muối amoni của axit hữu cơ, muối amoni axit cacbonic, peptit, protein, amit. Những hợp chất có khả năng thủy phân trong môi trường axit bao gồm : - Este, chất béo, đisaccarit, polisaccarit; peptit, amit.
2. Ví dụ minh họa
Ví dụ 1: Cho dãy các chất sau: toluen, phenyl fomat, fructozơ, glyxylvalin (Glyval), etylen glicol, triolein. Số chất bị thủy phân trong môi trường axit là: A. 6. B. 5. C. 4. D. 3.
Hướng dẫn trả lời
Trong dãy chất trên, có 3 chất bị thủy phân trong môi trương axit, đó là phenyl fomat, glyxylvalin (Gly-val), triolein. Phương trình phản ứng :
Ví dụ 2: Trong số các chất : metyl axetat, tristearin, Glucozơ, fructozơ, saccarozơ, tinh bột, xenlulozơ, anilin, alanin, protein. Số chất tham gia phản ứng thủy phân là A. 9. B. 8. C. 6. D. 7. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Nguyễn Quang Diệu – Đồng Tháp, năm 2015) Hướng dẫn trả lời Số chất tham gia phản ứng thủy phân là 6, đó là : metyl axetat, tristearin, saccarozơ, tinh bột, xenlulozơ, protein.
VII. Chọn phát biểu đúng, số phát biểu đúng; đếm số phản ứng xảy ra Ví dụ 1: Cho các phát biểu sau:
(a) Ở nhiệt độ thường, Cu(OH)2 tan được trong dung dịch glixerol.
(b) Ở nhiệt độ thường, C2H4 phản ứng được với nước brom.
(c) Đốt cháy hoàn toàn CH3COOCH3 thu được số mol CO2 bằng số mol H2O.
(d) Glyxin (H2NCH2COOH) phản ứng được với dung dịch NaOH. Số phát biểu đúng là A. 3. B. 4. C. 1. D. 2. (Đề thi THPT Quốc Gia, năm 2015) Hướng dẫn trả lời
Cả 4 phát biểu đều đúng.
DẠYKÈMQUYNHƠN
14
OFFICIAL
o o o t,H
22 3 2 t,H 22 2
t,H 35
2
652 65
3
17333
3531733 HCOOCHHOHCOOHCHOH HNCHCONHCH(CH)COOHHO HNCHCOOHHNCH(CH)COOH CH(OOCCH)3HOCH(OH)3CHCOOH
Ví dụ 2: Cho các phát biểu sau:
(a) Glucozơ được gọi là đường nho do có nhiều trong quả nho chín.
(b) Chất béo là đieste của glixerol với axit béo.
(c) Phân tử amilopectin có cấu trúc mạch phân nhánh.
(d) Ở nhiệt độ thường, triolein ở trạng thái rắn.
(e) Trong mật ong chứa nhiều fructozơ.
(f) Tinh bột là một trong những lương thực cơ bản của con người.
Số phát biểu đúng là A. 4. B. 6. C. 5. D. 3.
(Đề thi THPT Quốc Gia, năm 2016) Hướng dẫn trả lời
Số phát biểu đúng là 4, bao gồm (a), (c), (e), (f).
Ví dụ 3: Phát biểu nào sau đây là đúng?
OFFICIAL
A. Tất cả các este đều tan tốt trong nước, không độc, được dùng làm chất tạo hương trong công nghiệp thực phẩm, mỹ phẩm.
B. Phản ứng giữa axit axetic với ancol benzylic (ở điều kiện thích hợp), tạo thành benzyl axetat có mùi thơm của chuối chín.
C. Trong phản ứng este hóa giữa CH3COOH với CH3OH, H2O tạo nên từ –OH trong nhóm –COOH của axit và H trong nhóm –OH của ancol.
D. Để phân biệt benzen, toluen và stiren (ở điều kiện thường) bằng phương pháp hóa học, chỉ cần dùng thuốc thử là nước brom. Hướng dẫn trả lời
Phát biểu đúng là “Trong phản ứng este hóa giữa CH3COOH với CH3OH, H2O tạo nên từ –OH trong nhóm –COOH của axit và H trong nhóm –OH của ancol”.
Các phát biểu còn lại đều sai.
Không thể phân biệt benzen, toluen và stiren bằng dung dịch nước Br2, vì chỉ có stiren phản ứng làm mất màu nước brom.
Các este đều rất ít tan trong nước.
Mùi thơm của chuối chín là mùi của este iso – amylaxetat. Ví dụ 4: Điều nào sau đây sai ?
A. Ứng với công thức phân tử C4H8 có 3 anken mạch hở.
B. Tách một phân tử H2 từ butan thu được 3 anken.
C. Cho propen đi qua dung dịch H3PO4 thu được 2 ancol.
D. Đốt cháy bất kì một anken nào đều thu được số mol nước và số mol CO2 như nhau.
Hướng dẫn trả lời
Trong các phát biểu đề cho, phát biểu sai là "Ứng với công thức phân tử C4H8 có 3 anken mạch hở".
Thực tế, ứng với công thức phân tử C4H8 có 4 đồng phân anken mạch hở.
DẠYKÈMQUYNHƠN
15
DẠYKÈMQUYNHƠN OFFICIAL 16
Đốt
ot n2n 2 2 2 3n CHOnCOnHO 2 Ví dụ 5: Cho các
(a)
(b)
o
o
CH2 CHCH2 CH3 CH2 CCH3 CH3 CC CH3 H CH3 H CC CH3 H CH3 H Các phát biểu còn lại đều đúng : Tách một phân tử H2 từ butan thu được 3 anken : CC CH3 H CH3 H CH3CH2CH2CH3 CC CH3 H CH3 H CH2 CHCH2CH3 Cho propen đi qua dung dịch H3PO4 thu được 2 ancol : CH2 CHCH3+H2O CH3 CHCH3 OH HOCH2 CH2 CH3
cháy bất kì một anken nào đều thu được số mol nước và số mol CO2 như nhau :
phát biểu sau:
Các chất CH3NH2, C2H5OH, NaHCO3 đều có khả năng phản ứng với HCOOH.
Phản ứng thế brom vào vòng benzen của phenol (C6H5OH) dễ hơn của benzen.
2 t H
H,t
(c) Oxi hóa không hoàn toàn etilen là phương pháp hiện đại để sản xuất anđehit axetic.
(d) Phenol (C6H5OH) tan ít trong etanol.
Trong các phát biểu trên, số phát biểu đúng là A. 2. B. 1. C. 3. D. 4. Hướng dẫn trả lời
Trong các phát biểu trên, có 3 phát biểu đúng là :
(a) Các chất CH3NH2, C2H5OH, NaHCO3 đều có khả năng phản ứng với HCOOH. Phương trình phản ứng :
(b) Phản ứng thế brom vào vòng benzen của phenol (C6H5OH) dễ hơn của benzen.
Trong phân tử phenol, do ảnh hưởng của nhóm –OH đến vòng benzen nên mật độ electron trên vòng benzen ở các vị trí 2, 4, 6 tăng lên, dẫn đến phản ứng thế br vào vòng benzen của phenol dễ hơn của benzen.
(c) Oxi hóa không hoàn toàn etilen là phương pháp hiện đại để sản xuất anđehit axetic.
Phương trình phản ứng : o t,xt 2 22 3 2CHCHO 2CHCHO
Ví dụ 6: Cho các phát biểu sau:
(a) Khi đốt cháy hoàn toàn một hiđrocacbon X bất kì, nếu thu được số mol CO2 lớn hơn số mol H2O thì X là ankin.
(b) Trong thành phần hợp chất hữu cơ nhất thiết phải có cacbon.
(c) Liên kết hóa học chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
(d) Những hợp chất hữu cơ khác nhau có cùng phân tử khối là đồng phân của nhau
(e) Phản ứng hữu cơ thường xảy ra nhanh và không theo một hướng nhất định
(g) Hợp chất C9H14BrCl có vòng benzen trong phân tử Số phát biểu đúng là :
A. 4. B. 5. C. 3. D. 2. Hướng dẫn trả lời
Trong số các phát biểu trên, có 2 phát biểu đúng là (b) và (c). Các phát biểu còn lại đều sai. Vì :
DẠYKÈMQUYNHƠN OFFICIAL 17
t,xt 25 252 3 2 2
HCOOHCHOHHCOOCHHO HCOOHNaHCOHCOONaCOHO
o 32 33
HCOOHCHNHHCOOHNCH
Khi đốt cháy hoàn toàn một hiđrocacbon X bất kì, nếu thu được số mol CO2 lớn hơn số mol H2O thì X có thể là ankin, akađien hoặc benzen và các đồng đẳng.
Đồng phân là những chất khác nhau có cùng công thức phân tử.
Phản ứng hữu cơ thường xảy ra chậm và không theo một hướng xác định.
Hợp chất C9H14BrCl có độ bất bão hòa bằng 2 nên phân tử không thể có vòng benzen. Phân tử hợp chất hữu cơ chỉ có thể có vòng benzen khi số nguyên tử C trong phân tử lớn hơn hoặc bằng 6 và độ bất bão hòa k lớn hơn hoặc bằng 4. Ví dụ 7: Tiến hành các thí nghiệm sau :
(a) Sục khí etilen vào dung dịch KMnO4 loãng.
(b) Cho hơi ancol etylic đi qua bột CuO nung nóng.
(c) Sục khí etilen vào dung dịch Br2 trong CCl4.
(d) Cho dung dịch glucozơ vào dung dịch AgNO3 trong NH3 dư, đun nóng.
(e) Cho Fe2O3 vào dung dịch H2SO4 đặc, nóng.
OFFICIAL
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng oxi hóa - khử là A. 5. B. 2. C. 4. D. 3. Hướng dẫn trả lời
Trong số các thí nghiệm trên, có 4 thí nghiệm xảy ra phản ứng oxi hóa – khử là:
DẠYKÈMQUYNHƠN
18
o 2 2 7 2 2 4 2 1 1 7 2 2 2 1 2 1 0 t 3 2 3 2 2 2 1 1 2 22 2 2 1 1 2 4 3 32 3 2 4 4 (a):3CHCH2KMnO4HO 3CHOHCHOH2KOH2MnO (b):CHCHOHCuOCHCHOCuHO (c):CHCHBrCHBrCHBr (d):CHOH(CHOH)CHO2AgNO3NHHO CHOH(CHOH)COONH 0 432Ag2NHNO Thí nghiệm còn lại không xảy ra phản ứng oxi hóa – khử : ot 23 24ñac 243 2 FeO3HSO Fe(SO)3HO Ví dụ 8: Cho lần lượt Na, dung dịch NaOH vào các chất phenol, axit axetic, anđehit axetic, ancol etylic. Số lần có phản ứng xảy ra là A. 3. B. 4. C. 5. D. 6. Hướng dẫn trả lời Số lần phản ứng xảy ra là 5, cụ thể là :
DẠYKÈMQUYNHƠN OFFICIAL 19 65 65 2 3 3 2 25 25 2 65 65 2 3 3 2
NaOHCHCOOHCHCOONaHO Ví dụ 9: Trong các chất: HOOCCH2CH(NH2)COOH, m-HOC6H4OH, pCH3COOC6H4OH, CH3CH2COOH, (CH3NH3)2CO3, ClH3NCH(CH3
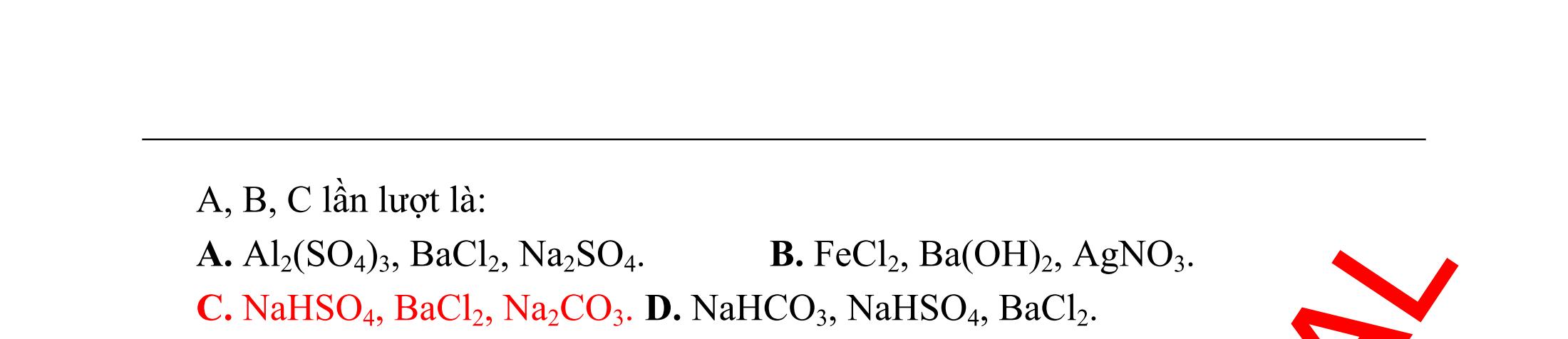
Có bao nhiêu chất mà 1 mol chất đó phản ứng được tối đa với 2 mol NaOH? A. 4. B. 3. C. 6. D. 5. (Đề thi thử THPT Quốc Gia lần 1 – THPT
Vinh –
Hướng dẫn trả lời Có 4 chất thỏa
:
2CH(NH
3
2
3
2
2 3323
3
2
Ví dụ 10: Có các chất sau: C2H5OH, CH3COOH, C6H5ONa (natri
C6H5NH2 (anilin). Số cặp chất có khả năng tác dụng được với nhau là A. 2. B. 4. C. 5. D. 3. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Đại học Vinh – Nghệ An, năm 2015) Hướng dẫn trả lời Số cặp chất phản ứng được với nhau là 3, cụ thể là : 24 HSOñac 25 3 3 252 3 65 3 65 3 652 3 365 CHOHCHCOOH CHCOOCHHO CHCOOHCHONaCHCOONaCHOH CHCOOHCHNHCHCOOHNCH Ví dụ tương tự : Ví dụ 11: Phát biểu nào sau đây là sai? A. Anilin tác dụng với nước brom tạo thành kết tủa trắng. B. Dung dịch lysin làm xanh quỳ tím. C. Dung dịch glyxin không làm đổi màu quỳ tím. D. Cho Cu(OH)2 vào dung dịch lòng trắng trứng thấy xuất hiện màu vàng.
2Na2CHOH2CHONaH 2Na2CHCOOH2CHCOONaH 2Na2CHOH2CHONaH NaOHCHOHCHONaHO
)COOH.
chuyên Đại học
Nghệ An, năm 2015)
mãn yêu cầu đề bài là
HOOCCH
2)COOH, m-HOC6H4OH, (CH3NH
)
CO
, ClH3NCH(CH3)COOH. Phương trình phản ứng :
2 2 2 2 64 64
3223
3
3 2 HOOCCHCH(NH)COOH2NaOHNaOOCCHCH(NH)COONa2HO HOCHOH2NaOHNaOCHONa2HO (CHNH)CO2NaOH2CHNHNaCO ClNHCH(CH)COOH2NaOHNHCH(CH)COONaNaCl2HO
phenolat),
(Đề thi tuyển sinh Đại học khối A, năm 2014)
Ví dụ 12: Phát biểu nào sau đây không đúng?
A. Khi tham gia phản ứng tráng bạc, glucozơ thể hiện tính oxi hóa.
B. Khi đun nóng dung dịch saccarozơ có axit vô cơ làm xúc tác, saccarozơ bị thủy phân thành glucozơ và fructozơ.
C. Trong dạ dày của động vật ăn cỏ như trâu, bò, dê … xenlulozơ bị thủy phân thành glucozơ nhờ enzim xenlulaza.
D. Trong cơ thể người và động vật, tinh bột bị thủy phân thành glucozơ nhờ các enzim.
(Đề thi thử THPT Quốc Gia lần 1 – Sở Giáo Dục và Đào Tạo Vĩnh Phúc, năm 2016)
Ví dụ 13: Có các phát biểu sau đây:
(1) Amilozơ có cấu trúc mạch phân nhánh.
(2) Glucozơ bị khử bởi dung dịch AgNO3 trong NH3.
(3) Xenlulozơ có cấu trúc mạch phân nhánh.
(4) Saccarozơ làm mất màu nước brom.
(5) Fructozơ có phản ứng tráng bạc.
(6) Glucozơ tác dụng được với dung dịch thuốc tím.
OFFICIAL
(7) Trong dung dịch, glucozơ tồn tại chủ yếu ở dạng mạch vòng và một phần nhỏ ở dạng mạch hở.
Số phát biểu đúng là: A. 6 B. 5 C. 3 D. 4 (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm 2016)
Ví dụ 14: Phát biểu không đúng là :
A. Axit axetic phản ứng với dung dịch NaOH, lấy muối thu cho tác dụng với khí CO2 lại thu được axit axetic.
B. Phenol phản ứng với dung dịch NaOH, lấy muối vừa tạo ra cho tác dụng với dung dịch HCl lại thu được phenol.
C. Anilin phản ứng với dung dịch HCl, lấy muối vừa tạo ra cho tác dụng với dung dịch NaOH lại thu được anilin.
D. Dung dịch C6H5ONa phản ứng với khí CO2, lấy kết tủa cho tác dụng với dung dịch NaOH lại thu được C6H5ONa.
Ví dụ 15: Cho các phát biểu sau :
(1) quỳ tím đổi màu trong dung dịch phenol.
(2) este là chất béo.
(3) các peptit có phản ứng màu biure.
(4) chỉ có một axit đơn chức tráng bạc.
(5) điều chế nilon-6 có thể thực hiện phản ứng trùng hợp hoặc trùng ngưng.
(6) có thể phân biệt glucozơ và fuctozơ bằng vị giác.
DẠYKÈMQUYNHƠN
20
Phát biểu đúng là A. (2), (3), (6). B. (4), (5), (6). C. (1), (4), (5), (6). D. (1), (2), (3), (5).
Ví dụ 16: Cho các phát biểu sau:
(a) Đốt cháy hoàn toàn este no, đơn chức, mạch hở luôn thu được số mol CO2 bằng số mol H2O.
(b) Trong hợp chất hữu cơ nhất thiết phải có cacbon và hiđro.
(c) Những hợp chất hữu cơ có thành phần nguyên tố giống nhau, thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 là đồng đẳng của nhau.
(d) Dung dịch glucozơ bị khử bởi AgNO3 trong NH3 tạo ra Ag.
(e) Saccarazơ chỉ có cấu tạo mạch vòng. Số phát biểu đúng là A. 2. B. 3. C. 5. D. 4.
OFFICIAL
Ví dụ 17: Cho các phát biểu sau:
(a) Hiđro hóa hoàn toàn glucozơ tạo ra axit gluconic.
(b) Ở điều kiện thường, glucozơ và saccarozơ đều là những chất rắn, dễ tan trong nước.
(c) Xenlulozơ trinitrat là nguyên liệu để sản xuất tơ nhân tạo và chế tạo thuốc súng không khói.
(d) Amilopectin trong tinh bột chỉ có các liên kết α-1,4-glicozit.
(e) Sacarozơ bị hóa đen trong H2SO4 đặc.
(f) Trong công nghiệp dược phẩm, saccarozơ được dùng để pha chế thuốc. Trong các phát biểu trên, số phát biểu đúng là A. 2. B. 3. C. 5. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Diễn Châu 5 – Nghệ An, năm 2015)
Ví dụ 18: Cho các phát biểu sau:
(a) Anđehit vừa có tính oxi hóa vừa có tính khử. (b) Phenol không tham gia phản ứng thế. (c) Nitro benzen phản ứng với HNO3 đặc (xúc tác H2SO4 đặc) tạo thành mđinitrobenzen. (d) Dung dịch lòng trắng trứng tác dụng được với Cu(OH)2 cho dung dịch phức có màu xanh tím. (e) Nguyên liệu để điều chế CH3CHO bằng phương pháp hiện đại để là C2H2. Có bao nhiêu phát biểu đúng? A. 2. B. 3. C. 5. D. 4 (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Long An, năm 2015)
DẠYKÈMQUYNHƠN
21
Ví dụ 19: Cho các phát biểu sau:
(a) Đốt cháy hoàn toàn este no, đơn chức, mạch hở luôn thu được số mol CO2 bằng số mol H2O.
(b) Trong hợp chất hữu cơ nhất thiết phải có cacbon và hiđro.
(c) Những hợp chất hữu cơ có thành phần nguyên tố giống nhau, thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 là đồng đẳng của nhau.
(d) Dung dịch glucozơ bị khử bởi AgNO3 trong NH3 tạo ra Ag.
(e) Saccarozơ chỉ có cấu tạo mạch vòng.
Số phát biểu đúng là
A. 5. B. 3. C. 4. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Quảng Xương 3 – Thanh Hóa, năm 2015)
OFFICIAL
Ví dụ 20: Cho các phát biểu sau:
(1) Anđehit vừa có tính oxi hóa vừa có tính khử.
(2) Phenol tham gia phản ứng thế brom khó hơn benzen.
(3) Anđehit tác dụng với H2 (dư) có xúc tác Ni đun nóng, thu được ancol bậc một.
(4) Dung dịch axit axetic tác dụng được với Cu(OH)2
(5) Dung dịch phenol trong nước làm quỳ tím hóa đỏ.
(6) Trong công nghiệp, anđehit axetic được sản xuất từ etilen.
Số phát biểu đúng là A. 5. B. 4. C. 3. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Can Lộc – Hà Tĩnh, năm 2015) Ví dụ 21: Trong số các phát biểu sau:
(1) Anilin là chất lỏng màu đen, rất độc, ít tan trong nước
(2) Kim cương, than chì, fuleren là các dạng thù hình của cacbon.
(3) Phenol dùng để sản xuất thuốc nổ, chất kích thích sinh trưởng thực vật
(4) Toluen tham gia phản ứng thế brom và thế nitro khó hơn benzen Số phát biểu đúng là A. 1. B. 2. C. 3. D. 4.
thi thử THPT Quốc Gia lần 1 – THPT Đa Phúc – Hà Nội, năm 2015) Ví dụ 22: Cho các phát biểu sau: (a) Chất béo được gọi chung là triglixerit hay triaxylglixerol. (b) Hiđro hóa hoàn toàn tri olein thu được tri stearin. (c) Muối Na, K của các axit béo dùng điều chế xà phòng.
DẠYKÈMQUYNHƠN
22
(Đề
(d) Tri stearin có công thức là (C17H33COO)3C3H5.
(e) Axit stearic là đồng đẳng của axit axetic.
(g) Metyl amin có lực bazơ mạnh hơn anilin.
(h) Có thể nhận biết phenol(C6H5OH) và anilin bằng dung dịch brom loãng. Số phát biểu đúng là: A. 4. B. 5. C. 6. D. 3. (Đề thi thử THPT Quốc Gia lần 1 – THPT Bắc Đông Quan – Thái Bình, năm 2015)
OFFICIAL
Ví dụ 23: Cho dãy các chất: m-CH3COOC6H4CH3; m-HCOOC6H4OH; ClH3NCH2COONH4; p-C6H4(OH)2; p-HOC6H4CH2OH; H2NCH2COOCH3; CH3NH3NO3. Số chất trong dãy mà 1 mol chất đó phản ứng tối đa được với 2 mol NaOH là A. 2. B. 3. C. 5. D. 4. (Đề thi minh họa kì thi THPT Quốc Gia, năm 2015)
Ví dụ 24: Cho các chất: isopren, stiren, cumen, ancol allylic, anđehit acrylic, axit acrylic, triolein. Số chất khi cho tác dụng với H2 dư (Ni, to) thu được sản phẩm hữu cơ, nếu đốt cháy sản phẩm này cho số mol H2O lớn hơn số mol CO2 là: A. 5. B. 3. C. 4. D. 6. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đặng Thúc Hứa – Nghệ An, năm 2015)
Ví dụ 25: Cho các chất sau: phenol, etanol, axit axetic, natri phenolat, natri hiđroxit. Số cặp chất tác dụng được với nhau là A. 1. B. 3. C. 4. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Tĩnh Gia 2 – Thanh Hóa, năm 2015)
Ví dụ 26: Cho dãy các chất: H2NCH2COOH, HCOONH4, (CH3NH3)2CO3, C6H5NH2, C2H5NH2, CH3COOH, H2NCH2CONHCH(CH3)COOH. Số chất trong dãy phản ứng được với dung dịch NaOH và HCl là A. 2. B. 5. C. 3. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Trần Bình Trọng – Phú Yên, năm 2015)
Ví dụ 27: Cho
DẠYKÈMQUYNHƠN
23
các chất sau: ClH3NCH2COOH, HCOOC6H5 (thơm), C6H5COOCH3 (thơm), HO-C6H4-CH2OH (thơm), CH3-COOCH=CH2. Có bao nhiêu chất khi tác dụng với dung dịch NaOH đặc, dư, ở nhiệt độ và áp suất cao cho sản phẩm có 2 muối? A. 3. B. 4. C. 5. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Chúc Động –
Nội, năm 2015)
Hà
Ví dụ 28: Có các hợp chất có CTPT lần lượt là CH2O; CH2O2; C2H2O3 và C3H4O3. Số chất vừa tác dụng với với Na, vừa tác dụng với dung dịch NaOH, vừa có phản ứng tráng gương là: A. 3. B. 4. C. 1. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Chúc Động – Hà Nội, năm 2015) ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 11D 12A 13C 14A 15B 16A 17B 18B 19D 20B 21B 22B 23B 24B 25B 26D 27D 28A
B. CÂU HỎI VẬN DỤNG
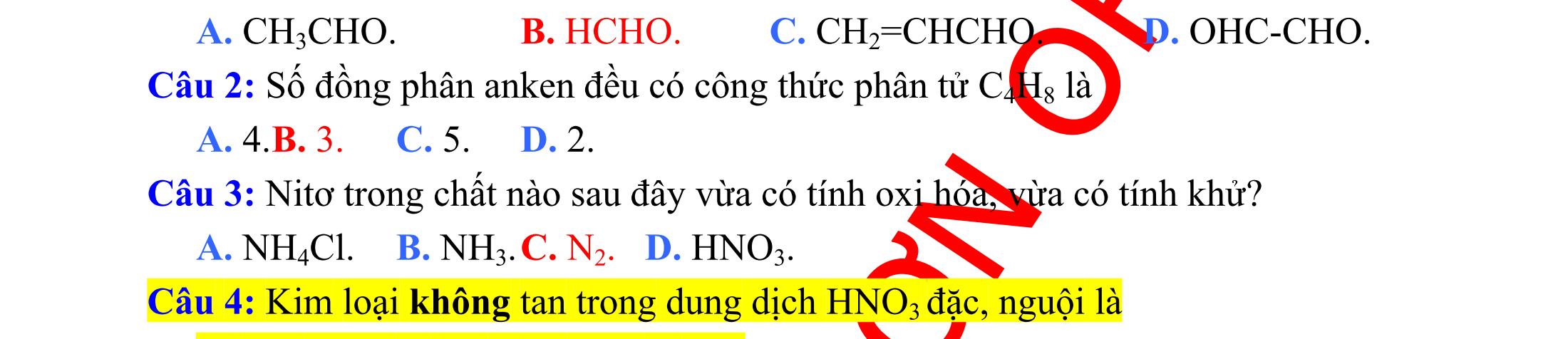
I. Nhận biết chất
Câu 1: Cho các chất riêng biệt sau: Dung dịch glucozơ, dung dịch hồ tinh bột. Thuốc thử dùng để nhận biết các chất là
A. quỳ tím. B. dung dịch NaOH. C. dung dịch I2. D. Na. (Đề thi thử THPT Quốc Gia lần 4 – THPT Việt Yên – Bắc Giang, năm 2015) Câu 2: Để phân biệt ba chất: CH3COOH, CH3CH2NH2 và H2NCH2COOH chỉ cần dùng thuốc thử nào sau đây?
A. dung dịch quỳ tím. B. dung dịch NaOH. C. dung dịch HCl. D. dung dịch phenolphtalein. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đinh Chương Dương – Thanh Hóa, năm 2015)
Câu 3: Với thuốc thử duy nhất là quỳ tím sẽ nhận biết được dung dịch các chất nào sau đây ?
A. CH3COOH; C6H5OH (phenol); H2NCH2COOH.
B. C6H5NH2 (anilin); H2NCH2COOH; CH3COOH. C. C6H5NH2 (anilin); C6H5OH (phenol); H2NCH2COOH.
D. CH3COOH; C6H5OH (phenol); CH3CH2NH2. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Lê Quy Đôn, năm 2016)
Câu 4: Bằng phương pháp hóa học, thuốc thử để phân biệt 3 dung dịch: metylamin, anilin, axit axetic là
A. Natri hiđroxit. B. natri clorua. C. phenol phtalein. D. Quì tím. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên ĐHSP Hà Nội, năm 2016)
Câu 5: Thuốc thử dùng để phân biệt metyl acrylat và etyl axetat là
A. dung dịch NaOH. B. dung dịch AgNO3/NH3.
C. Cu(OH)2/OH. D. dung dịch Br2. (Đề thi thử THPT Quốc Gia lần 1– THPT Sở GD và ĐT Quảng Nam, năm 2016)
DẠYKÈMQUYNHƠN
24
OFFICIAL
Câu 6: Để phân biệt C2H5OH, C6H5OH (phenol) và dung dịch CH3CH=O chỉ cần dùng một thuốc thử là
A. Cu(OH)2. B. Dung dịch AgNO3/NH3.
C. Dung dịch NaOH. D. Nước brom. (Đề thi thử THPT Quốc Gia lần 1 – THPT Hàn Thuyên – Bắc Ninh, năm 2016)
Câu 7: Để nhận biết Gly-Ala và Gly-Gly-Gly-Ala trong hai lọ riêng biệt, thuốc thử cần dùng là:
A. Cu(OH)2 B. NaOH. C. HCl. D. NaCl. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đặng Thúc Hứa – Nghệ An, năm 2015)
II. Xác định chất phản ứng với dung dịch Br2
Câu 1: Chất nào sau đây không làm mất màu dung dịch nước brom?
A. Vinyl axetat. B. Fructozơ. C. Glucozơ. D. Stiren. (Đề thi thử THPT Quốc Gia lần 1– THPT Sở GD và ĐT Quảng Ninh, năm 2016)
OFFICIAL
Câu 2: Chất nào sau đây có thể làm mất màu dung dịch brom?
A. axit axetic. B. axit acrylic. C. etylen glicol. D. axit oxalic. (Đề thi thử THPT Quốc Gia lần 1 – THPT Việt Yên – Bắc Giang, năm 2016)
Câu 3: Hợp chất nào sau đây không có khả năng làm mất màu dung dịch nước brom?
A. Glixerol. B. Phenol. C. Axit acrylic. D. Glucozơ. (Đề thi thử THPT Quốc Gia lần 1 – THPT Việt Yên – Bắc Giang, năm 2016)
Câu 4: Cho các chất sau: etilen, axetilen, glucozơ, axit axetic, anilin. Số chất làm mất màu nước brom ở điều kiện thường là
A. 5. B. 4 C. 3. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Nguyễn Trãi – Hải Dương, năm 2016)
Câu 5: Cho dãy các chất sau: stiren, phenol, ancol benzylic, phenyl acrylat. Số chất làm mất màu nước brom là A. 2. B. 3. C. 1. D. 4. III. Xác định chất phản ứng với dung dịch AgNO3/NH3 Câu 1: Chất nào dưới đây không có khả năng tham gia phản ứng tráng gương?
DẠYKÈMQUYNHƠN
25
A. CH3COOH. B. HCOOCH3. C. OHC-CHO. D. CH2=CHCHO. (Đề thi thử THPT Quốc Gia lần 4 – THPT Ngô Gia Tự – Vĩnh Phúc, năm 2016) Câu 2: Dãy gồm các chất đều không tham gia phản ứng tráng bạc là A. saccarozơ, tinh bột, xelulozơ. B. fructozơ, tinh bột, anđehit fomic. C. anđehit axetic, fructozơ, xenlulozơ. D. axit fomic, anđehit fomic, glucozơ. (Đề thi thử THPT Quốc Gia lần 1 – THPT Yên Lạc – Vĩnh Phúc, năm 2016)
Câu 3: Các chất trong dãy nào sau đây đều tạo kết tủa khi cho tác dụng với dung dịch AgNO3 trong NH3 dư, đun nóng?
A. vinylaxetilen, glucozơ, axit propionic.
B. vinylaxetilen, glucozơ, anđehit axetic. C. glucozơ, đimetylaxetilen, anđehit axetic.
D. vinylaxetilen, glucozơ, đimetylaxetilen. (Đề thi thử THPT Quốc Gia lần 2 – THPT Hùng Vương – Quảng Bình, năm 2016)
Câu 4: Cho các chất sau: axit axetic (X); axit fomic (Y); glucozơ (Z); etyl fomat (T); axit glutamic (M). Những chất tác dụng được với dung dịch AgNO3/NH3 tạo kết tủa là:
OFFICIAL
A. Y, Z, T. B. X, Y, Z. C. T, X, Y. D. Z, T, X. (Đề thi thử THPT Quốc Gia lần 1 – THPT Sở GD và ĐT Thanh Hóa, năm 2016) Câu 5: Cho các chất: HCHO, CH3COOH, CH3COOC2H5, HCOOH, C2H5OH, HCOOCH3. Số chất có khả năng tham gia phản ứng tráng bạc là
A. 4. B. 5. C. 3. D. 6. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Tuyên Quang, năm 2016)
Câu 6: Cho dãy các chất: glucozơ, xenlulozơ, etyl fomat, metylamin. Số chất trong dãy có thể tham gia phản ứng tráng gương là
A. 3. B. 1. C. 2. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Yên Lạc – Vĩnh Phúc, năm 2016)
Câu 7: Cho các chất sau đây: propin, glucozơ, propyl fomat, etilen, saccarozơ, etyl axetat, vinyl axetilen, tinh bột, anđehit oxalic. Số chất có phản ứng với dung dịch AgNO3 trong NH3 đun nóng là
A. 6. B. 7. C. 8. D. 5. (Đề thi thử THPT Quốc Gia lần 1 – THPT Yên Lạc – Vĩnh Phúc, năm 2016)
IV. Xác định chất hòa tan được Cu(OH)2
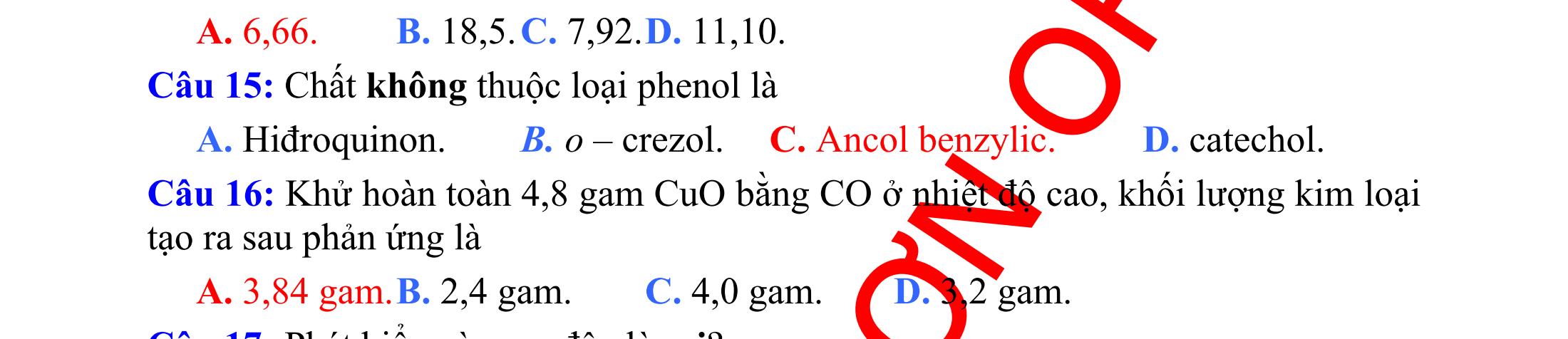
Câu 1: Chất hòa tan được Cu(OH)2 trong dung dịch NaOH ở nhiệt độ thường thu được phức chất màu tím là
A. Glixerol. B. Gly-Ala. C. Lòng trắng trứng. D. Glucozơ. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực – Thái Bình, năm 2016) Câu 2: Dung dịch nào sau đây không có khả năng hòa tan được Cu(OH)2 ở nhiệt độ thường?
A. Fomalin. B. Etylen glicol. C. Glixerol. D. Giấm ăn. (Đề thi thử THPT Quốc Gia lần 1 – THPT Nguyễn Trãi – Thanh Hóa, năm 2016) Câu 3: Dãy gồm các dung dịch đều hòa tan được Cu(OH)2 ở nhiệt độ phòng là
A. glucozơ, fructozơ và tinh bột. B. glucozơ, fructozơ và xenlulozơ. C. glucozơ, fructozơ và saccarozơ. D. glucozơ, fomalin và tinh bột.
DẠYKÈMQUYNHƠN
26
(Đề thi thử THPT Quốc Gia lần 1 – THPT Long Phu – Vĩnh Long, năm 2016)
Câu 4: Dãy nào dưới đây gồm các chất có khả năng hòa tan Cu(OH)2 tạo hợp chất màu tan trong trong nước?
A. Etylen glicol, axit axetic và Gly-Ala-Gly.
B. Ancol etylic, fructozơ và Gly-Ala-Lys-Val.
C. Glixerol, glucozơ và Gly-Ala.
D. Ancol etylic, axit fomic và Lys-Val. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lê Quy Đôn – Đà Nẵng, năm 2016)
Câu 5: Cho dãy các chất sau: axit axetic, anđehit fomic, ancol benzylic, cumen, etyl axetat, glucozơ, etylamin. Số chất trong dãy có thể tác dụng với Cu(OH)2 ở điều kiện thích hợp là
A. 3. B. 2. C. 4. D. 5. (Đề thi thử THPT Quốc Gia lần 1– THPT Sở GD và ĐT Đồng Tháp, năm 2016)
OFFICIAL
Câu 6: Cho dãy các hợp chất sau: glucozơ, fructozơ, saccarozơ, glixerol, ancol etylic, axit axetic, propan-1,3-điol. Số hợp chất không có khả năng hòa tan Cu(OH)2 ở nhiệt độ thường là:
A. 2. B. 0. C. 3. D. 1. (Đề thi thử THPT Quốc Gia lần 1 – THPT Lý Thường Kiệt, năm 2016)
Câu 7: Cho các dung dịch sau : saccarozơ; propan-1,2-điol; etylen glicol; anbumin; axit axetic; glucozơ; anđehit axetic; Gly-Ala. Số dung dịch hòa tan Cu(OH)2 ở nhiệt độ thường là :
A. 4. B. 6. C. 5. D. 7. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên KHTN Hà Nội, năm 2016)
Câu 8: Cho dãy các dung dịch sau: glucozơ, saccarozơ, etanol, axit axetic, anđehit axetic, Ala-Gly, anbumin. Số dung dịch trong dãy hòa tan được Cu(OH)2 ở điều kiện thường là
A. 5. B. 2. C. 3. D. 4. (Đề thi thử THPT Quốc Gia lần 2 – THPT Lý Thái Tổ – Bắc Ninh, năm 2016) Câu 9: Cho các chất sau : C2H5OH; HOCH2CH2OH; HOCH2CH(OH)CH2OH; CH3COOH. Số chất vừa phản ứng với Na vừa phản ứng với Cu(OH)2 ở nhiệt độ thường là : A. 2. B. 3 C. 4. D. 1. (Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Bắc Ninh, năm 2016) Câu 10: Cho dung dịch các chất : CH3COOH; C3H5(OH)3; Ala-Gly-Ala; C12H22O11(saccarozơ); CH3CHO; HOCH2CH2CH2OH; C2H3COOH. Số chất hòa tan được Cu(OH)2 ở điều kiện thường là : A. 6. B. 4. C. 5. D. 3. (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên KHTN Hà Nội, năm 2016)
DẠYKÈMQUYNHƠN
27
Câu 11: Cho dãy các dung dịch: glucozơ, saccarozơ, etanol, glixerol. Số dung dịch trong dãy phản ứng được với Cu(OH)2 ở nhiệt độ thường tạo thành dung dịch có màu xanh lam là
A. 2. B. 3 C. 1. D. 4. (Đề thi thử THPT Quốc Gia lần 1– THPT chuyên Hạ Long, năm 2016)
V. Xác định chất phản ứng với dung dịch kiềm (NaOH, KOH,...)
Câu 1: Chất nào sau đây phản ứng được với dung dịch NaOH?
A. C3H5(OH)3 B. CH3NHCH3 C. C2H5OH. D. H2NCH2COOH. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phan Ngọc Hiển – Cà Mau, năm 2016) Câu 2: Dãy gồm các chất đều tác dụng với dung dịch NaOH là
A. metyl axetat, glucozơ, etanol.
B. metyl axetat, alanin, axit axetic.
OFFICIAL
C. etanol, fructozơ, metylamin.
D. glixerol, glyxin, anilin. (Đề thi thử THPT Quốc Gia lần 1– THPT chuyên Hạ Long, năm 2016)
Câu 3: Cho các chất sau đây: triolein, etyl axetat, saccarozơ, fructozơ, Ala-GlyAla, glucozơ, xenlulozơ, vinyl fomat, anbumin. Số chất bị thủy phân trong môi trường kiềm là
A. 8. B. 7. C. 6. D. 5. (Đề thi thử THPT Quốc Gia lần 1 – THPT Yên Lạc – Vĩnh Phúc, năm 2016)
Câu 4: Cho dãy các dung dịch: axit axetic, phenylamoni clorua, natri axetat, metylamin, glyxin, phenol (C6H5OH). Số dung dịch trong dãy tác dụng được với dung dịch NaOH là
A. 4. B. 3. C. 6. D. 5. (Đề thi thử THPT Quốc Gia lần 2 – THPT Ngô Sĩ Liên – Bắc Giang, năm 2016)
Câu 5: Cho các chất: axit glutamic, phenylamoni clorua, metyl metacrylat, phenol, glixerol, Gly-Ala-Val, anilin. Số chất tác dụng với dung dịch NaOH loãng, nóng là A. 7. B. 4. C. 6. D. 5. Câu 6: Cho dãy các chất sau: H2NCH(CH3)COOH; C6H5OH (phenol); CH3COOC2H5; C2H5OH; CH3NH3Cl. Số chất trong dãy phản ứng được với dung dịch KOH đun nóng là : A. 3. B. 2. C. 5. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên ĐHSP Hà Nội, năm 2016) Câu 7: Cho các chất: etyl axetat, anilin, ancol (rượu) etylic, axit acrylic, phenol, phenylamoni clorua, ancol benzylic, p-crezol. Trong các chất này, số chất tác dụng được với dung dịch NaOH là : A. 4. B. 3. C. 6. D. 5. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phú Nhuận – TP. HCM, năm 2016)
DẠYKÈMQUYNHƠN
28
Câu 8: Cho các chất: axit glutamic, saccarozơ, metylamoni clorua, vinyl axetat, phenol, glixerol, Gly-Gly. Số chất tác dụng với dung dịch NaOH loãng, nóng là : A. 5. B. 4. C. 6. D. 3. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phú Nhuận – TP. HCM, năm 2016)
Câu 9: Cho các chất sau: etyl axetat, lòng trắng trứng, etanol, axit acrylic, phenol, anilin, phenyl amoniclorua, ancol benzylic, p-crezol. Trong các chất trên, số chất tác dụng với dung dịch NaOH trong điều kiện thích hợp là
A. 7. B. 5. C. 6. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực – Thái Bình, năm 2016)
Câu 10: Cho dãy các chất: m-CH3COOC6H4CH3; m-HCOOC6H4OH; ClH3NCH2COONH4; p-C6H4(OH)2; p-HOC6H4CH2OH; H2NCH2COOCH3; CH3NH3NO3. Số chất trong dãy mà 1 mol chất đó phản ứng tối đa được với 2 mol NaOH là
A. 2. B. 3. C. 5. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Tĩnh Gia – Thanh Hóa, năm 2016)
OFFICIAL
Câu 11: Trong các chất: triolein, saccarozơ, tinh bột, anbumin, glucozơ, glyxin, alanin, fructozơ. Số chất có thể tham gia phản ứng thủy phân là A. 7. B. 4 C. 5. D. 6. (Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Vĩnh Phúc, năm 2016)
Câu 12: Cho các chất: etyl axetat, ancol etylic, axit acrylic, phenol, phenylamoni clorua, p-crezol, axit lactic, alanin. Số chất tác dụng với dung dịch NaOH và dung dịch nước brom là: A. 7 và 4. B. 6 và 3. C. 5 và 4. D. 7 và 3. (Đề thi thử THPT Quốc Gia lần 2 – THPT Ngô Sĩ Liên – Bắc Giang, năm 2016) VI. Xác định chất phản ứng với dung dịch axit HCl, H2SO4 loãng Câu 1: Cho dãy các chất: H2NCH2COOH, C2H5NH2, CH3NH2, CH3COOH. Số chất trong dãy phản ứng với HCl trong dung dịch là: A. 3. B. 1. C. 2. D. 4. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên ĐHSP Hà Nội, năm 2016) Câu 2: Trong số các chất : C2H5OH; CH3NH2; CH3NH3Cl; CH3COONa; CH3CHO; CH2 = CH2; CH3COOH; CH3COONH4; C6H5ONa. Số chất tác dụng với dung dịch HCl loãng là : A. 7. B. 6. C. 4. D. 5. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên KHTN Hà Nội, năm 2016) Câu 3: Cho dãy gồm các chất: metyl metacrylat; triolein; saccarozơ; xenlulozơ; glyxylalanin; tơ nilon-6,6. Số chất trong dãy bị thủy phân khi đun nóng trong môi trường axit là : A. 3. B. 4. C. 5. D. 6. (Đề thi thử THPT Quốc Gia lần 5 – THPT chuyên KHTN Hà Nội, năm 2016)
DẠYKÈMQUYNHƠN
29
VII. Chọn phát biểu đúng, sai; số phát biểu đúng; đếm số phản ứng xảy ra
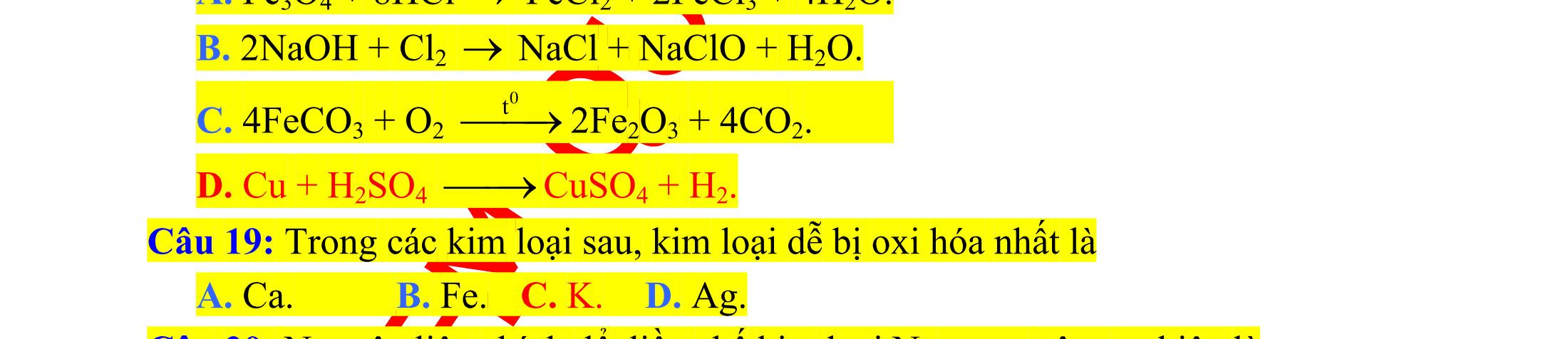
Câu 1: Thí nghiệm nào sau đây không xảy ra?
A. Cho phenol vào dung dịch Br2.
B. Cho nhựa PVC vào dung dịch HCl.
C. Sục khí metylamin vào dung dịch CH3COOH.
D. Cho dung dịch axit fomic vào ung dịch Br2. (Đề thi thử THPT Quốc Gia lần 2 – THPT Quỳnh Lưu 1 – Nghệ An, năm 2016)
Câu 2: Cách làm nào dưới đây không nên làm?
A. Giảm mùi tanh của cá (có metylamin, etylamin, trimetylamin,...) bằng giấm ăn.
B. Giảm vết sưng hoặc ngứa do ong đốt bằng cách bôi vôi.
C. Dùng than củi để giảm bớt mùi khê cho cơm khi cơm bị khê.
D. Ướp cá biển bằng phân đạm để cá tươi lâu.
Câu 3: Nhận xét nào dưới đây là đúng?
A. Tripeptit hòa tan Cu(OH)2 trong môi trường kiềm tạo dung dịch xanh lam.
B. Trong phân tử protein luôn có nguyên tử nitơ.
C. Tinh bột và xenlulozơ là đồng phân của nhau.
D. Este là những chất hữu cơ dễ tan trong nước. (Đề thi thử THPT Quốc Gia lần 1 – THPT Lục Ngạn 1 – Bắc Giang, năm 2016)
Câu 4: Kết luận nào sau đây không đúng?
A. Phenol (C6H5OH) và anilin không làm đổi màu quỳ tím.
B. Tinh bột và xenlulozơ thuộc nhóm polisaccarit.
C. Isoamyl axetat có mùi dứa.
D. Tơ nilon-6,6 được cấu tạo bởi 4 nguyên tố hóa học. (Đề thi thử THPT Quốc Gia lần 1 – THPT Lương Thế Vinh – Hà Nội, năm 2016)
Câu 5: Phát biểu sai là
A. Stiren làm mất màu dung dịch brom.
B. Phenol tác dụng được với Na và dung dịch NaOH.
C. Đốt cháy hoàn toàn ancol etylic thu được số mol CO2 bằng số mol H2O.
D. Dung dịch glucozơ hòa tan được Cu(OH)2 ở nhiệt độ thường. (Đề thi thử THPT Quốc Gia lần 3 – THPT Lý Thái Tổ – Bắc Ninh, năm 2016)
Câu 6: Cho dãy các chất sau: vinyl fomat, metyl acrylat, glucozơ, saccarozơ, etylamin, alanin. Phát biểu nào sau đây sai?
A. Có 2 chất tham gia phản ứng tráng bạc.
B. Có 3 chất bị thủy phân trong môi trường kiềm.
C. Có 3 chất hữu cơ đơn chức, mạch hở.
D. Có 3 chất làm mất màu nước brom.
DẠYKÈMQUYNHƠN
30
OFFICIAL
(Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Tuyên Quang, năm 2016)
Câu 7: Cho dãy các chất sau: fructozơ, vinyl fomat, metyl acrylat, glucozơ, saccarozơ, etylamin, glyxin và etanol. Phát biểu nào sau đây sai?
A. Có 3 chất làm mất màu nước brom.
B. Có 3 chất bị thủy phân trong môi trường kiềm.
C. Có 4 chất hữu cơ đơn chức, mạch hở.
D. Có 3 chất tham gia phản ứng tráng bạc. (Đề thi thử THPT Quốc Gia lần 1 – THPT Thuận Thành 3 – Bắc Ninh, năm 2016)
Câu 8: Nhận xét không đúng là : Trong số các các chất : vinylaxetilen; axit fomic; etylen glicol; axit glutamic; axetanđehit có :
A. 3 chất tác dụng với AgNO3/NH3
B. 2 chất tác dụng với nước Br2.
OFFICIAL
C. 2 chất tham gia phản ứng tráng bạc.
D. 2 chất tác dụng với C2H5OH tạo este.
(Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên KHTN Hà Nội, năm 2016)
Câu 9: So sánh nào sau đây không đúng:
A. Tính Bazơ tăng dần : C6H5NH2, CH3NH2, (CH3)2NH.
B. pH tăng dần (dd có cùng CM) : Alanin, Axit glutamic, Glyxin, Valin.
C. Số đồng phân tăng dần : C4H10, C4H9Cl, C4H10O, C4H11N.
D. Nhiệt độ sôi tăng dần : C4H10, CH3COOC2H5, C2H5OH, CH3COOH. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Thái Bình, năm 2016) Câu 10: Phát biểu nào sau đây sai?
A. Tơ visco thuộc loại tơ bán tổng hợp (tơ nhân tạo).
B. Tinh bột, xenlulozơ không bị thủy phân trong môi trường axit.
C. Hợp kim của sắt chứa từ 0,01% - 2% khối lượng C và một số nguyên tố khác gọi là thép.
D. Ở người, nồng độ glucozơ trong máu được giữ ổn định ở mức 0,1%. (Đề thi thử THPT Quốc Gia lần 1 – THPT Thuận Thành 3 – Bắc Ninh, năm 2016) Câu 11: Phát biểu nào sau đây là đúng?
A. Tính bazơ của các amin tăng dần theo thứ tự: C6H5NH2 < NH3 < CH3CH2NH2 < CH3NHCH3.
B. Các ancol đa chức đều phản ứng với Cu(OH)2 tạo dung dịch màu xanh lam.
C. Anilin có công thức phân tử là C6H5OH.
D. Benzen làm mất màu nước brom ở nhiệt độ thường.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Thuận Thành 3 – Bắc Ninh, năm 2016)
Câu 12: Phát biểu nào sau đây đúng ?
DẠYKÈMQUYNHƠN
31
A. Tính bazơ của các chất: NaOH, C2H5NH2, CH3NH2, NH3 giảm dần từ trái sang phải.
B. Toluen làm mất màu dung dịch thuốc tím ở điều kiện thường.
C. Glucozơ, metyl fomat, fructozơ, fomanđehit là những cacbohidrat có phản ứng tráng bạc.
D. Nhóm các chất: Val, Glu, Lys đều làm đổi màu quỳ tím ẩm. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Tuyên Quang, năm 2016)
Câu 13: Cho các phát biểu sau:
(a) Ở nhiệt độ thường, Cu(OH)2 tan được trong dung dịch glixerol.
(b) Ở nhiệt độ thường, C2H4 phản ứng được với nước brom.
(c) Đốt cháy hoàn toàn CH3COOCH3 thu được số mol CO2 bằng số mol H2O.
(d) Glyxin (H2NCH2COOH) phản ứng được với dung dịch NaOH. Số phát biểu đúng là
OFFICIAL
A. 3. B. 4. C. 1. D. 2. (Đề thi thử THPT Quốc Gia lần 3 – THPT Trung Nghĩa – Phú Thọ, năm 2016)
Câu 14: Có các kết luận sau:
(a) Từ glyxin, alanin và valin sẽ tạo ra được 6 tripeptit chứa đồng thời glyxin, alanin và valin.
(b) C8H10O có 4 ancol thơm khi bị oxi hóa bởi CuO tạo ra sản phẩm có khả năng tham gia phản ứng tráng gương.
(c) C4H8 có 4 đồng phân mạch hở làm mất màu dung dịch brom.
(d) C4H11N có 4 đồng phân khi tác dụng với HCl tạo ra muối dạng RNH3Cl. Số kết luận đúng là
A. 2. B. 4. C. 3. D. 1. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Tuyên Quang, năm 2016) Câu 15: Cho các phát biểu sau:
(1) Glucozơ vừa có tính oxi hóa vừa có tính khử.
(2) Hiđro hóa hoàn toàn axetilen (Ni, to) thu được etilen.
(3) Oxi hóa ancol bậc 1 bằng CuO, to thu được anđehit.
(4) Dung dịch axit axetic tác dụng được với CaCO3.
(5) Phân tử toluen có chứa vòng benzen.
(6) Tính bazơ của anilin mạnh hơn của amoniac.
(7) Cao su Buna thuộc loại polime thiên nhiên.
(8) Hàm lượng glucozơ trong máu người là khoảng 0,1%.
Số phát biểu luôn đúng là
A. 7. B. 5. C. 6. D. 8. (Đề thi thử THPT Quốc Gia lần 3 – THPT Lý Thái Tổ – Bắc Ninh, năm 2016)
Câu 16: Cho các phát biểu sau:
DẠYKÈMQUYNHƠN
32
(1) Anđehit vừa có tính oxi hoá vừa có tính khử.
(2) Phenol tham gia phản ứng thế brom khó hơn benzen.
(3) Oxi hoá ancol bậc 1 thu được anđehit.
(4) Dung dịch axit axetic tác dụng được với CaCO3.
(5) Dung dịch phenol trong nước làm quỳ tím hoá đỏ.
(6) Tính bazơ của anilin mạnh hơn của amoniac.
(7) Cao su buna-N thuộc loại cao su thiên nhiên.
(8) Thuỷ phân este trong môi trường axit thu được sản phẩm là axit và ancol. Số phát biểu luôn đúng là A. 5. B. 4. C. 3. D. 2. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Tuyên Quang, năm 2016)
Câu 17: Cho các phát biểu sau:
(a) Anđehit vừa có tính oxi hóa vừa có tính khử.
OFFICIAL
(b) Gly-Ala có thể hòa tan Cu(OH)2 tạo dung dịch màu tím.
(c) Amin bậc 2 có lực bazơ mạnh hơn amin bậc 1.
(d) Phenol có tính axit nên dung dịch phenol trong nước làm quỳ tím hóa đỏ.
(e) Chỉ dùng dung dịch KMnO4 có thể phân biệt được toluen, benzen và stiren.
(f) Trong y học, glucozơ được dùng làm thuốc tăng lực.
(g) Để khử mùi tanh của cá, người ta có thể dùng dung dịch giấm ăn. Số phát biểu đúng là: A. 5. B. 3. C. 4. D. 6. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Tuyên Quang, năm 2016) Câu 18: Cho các phát biểu sau:
(a) Có hai dung dịch làm quì tím hóa xanh trong số các dung dịch: Glyxin, alanin, valin, axit glutamic, lysin, anilin.
(b) Có hai chất tham gia tráng gương trong dãy các chất: Glucozơ, saccarozơ, tinh bột, xenlulozơ, fructozơ.
(c) Có hai polime được điều chế từ phản ứng trùng ngưng trong số các polime: tơ olon, tơ lapsan, PE, tơ nilon-6,6.
(d) Ancol thơm C8H10O có hai đồng phân tách nước tạo ra sản phẩm có khả năng tham gia phản ứng trùng hợp. Số phát biểu đúng là
A. 1. B. 2. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Quốc Học Huế, năm 2016)
Câu 19: Cho các phát biểu sau :
(a) Khi đốt cháy hoàn toàn 1 hiđrocacbon X bất kì, nếu thu được số mol CO2 bằng số mol nước thì X là anken.
DẠYKÈMQUYNHƠN
33
(b) Trong phản ứng este hóa giữa CH3COOH và CH3OH, H2O được tạo nên từ OH trong nhóm -COOH của axit và H của nhóm -OH của ancol.
(c) Liên kết của nhóm CO với nhóm NH giữa 2 đơn vị α-amino axit được gọi là liên kết peptit
(d) Những hợp chất hữu cơ khác nhau có cùng phân tử khối là đồng phân của nhau.
(e) Glucozơ và saccarozơ đều tác dụng với H2 (xúc tác Ni, đun nóng).
(f) Hợp chất C9H15Cl có vòng benzen trong phân tử.
(g) Trong dạ dày của động vật ăn cỏ như trâu, bò, dê,…. Xenlulozo bị thủy phân thành glucozo nhờ xenlulaza. Số phát biểu đúng là: A. 2. B. 5. C. 3. D. 4. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Phan Bội Châu, năm 2016)
Câu 20: Cho các nhận xét sau:
OFFICIAL
(1) Thủy phân saccarozơ với xúc tác axit thu được cùng một loại monosaccarit.
(2) Từ caprolactam bằng phản ứng trùng ngưng trong điều kiện thích hợp người ta thu được tơ capron.
(3) Tính bazơ của các amin giảm dần: đimetylamin > metylamin > anilin > điphenylamin.
(4) Muối mononatri của axit 2 – aminopentanđioic dùng làm gia vị thức ăn, còn được gọi là bột ngọt hay mì chính.
(5) Cho Cu(OH)2 vào ống nghiệm chứa anbumin thấy tạo dung dịch màu xanh thẫm.
(6) Peptit mà trong phân tử chứa 2, 3, 4 nhóm -NH-CO- lần lượt gọi là đipeptit, tripeptit và tetrapeptit.
(7) Glucozơ, axit glutamic, axit lactic, sobitol, fructozơ và axit ađipic đều là các hợp chất hữu cơ tạp chức. Số nhận xét đúng là A. 5. B. 4. C. 3. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lê Khiết – Quảng Ngãi, năm 2016)
Câu 21: Có các nhận xét sau :
(1) Tinh bột và xenlulozơ là hai đồng phân cấu tạo của nhau.
(2) Hai đồng phân amino axit của C3H7NO2 tạo ra tối đa 3 đipeptit.
(3) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag.
(4) Thủy phân hoàn toàn tinh bột và xenlulozơ mỗi chất chỉ cho 1 loại monosaccarit duy nhất
(5) Nồng độ glucozơ trong máu người bình thường khoảng 5%.
(6) Tất cả các dung dịch protein đều có phản ứng màu biure
DẠYKÈMQUYNHƠN
34
Số nhận xét đúng là :
A. 5. B. 6. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên KHTN Hà Nội, năm 2016)
Câu 22: Có các nhận xét sau
(1) Dung dịch của glyxin và anilin trong H2O đều không làm đổi màu quì tím.
(2) Các amino axit điều kiện thường đều ở trạng thái rắn.
(3) Đường sacarozơ tan tốt trong nước và có phản ứng tráng bạc.
(4) Đường glucozơ (rắn) bị hóa đen khi tiếp xúc với dung dịch H2SO4 đặc (98%).
(5) Phân tử xenlulozơ chỉ chứa các mắt xích α–glucozơ. Trong các nhận xét trên, số nhận xét đúng là A. 2. B. 3. C. 4. D. 5. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Biên Hòa – Hà Nam, năm 2016) Câu 23: Cho các phát biểu sau :
OFFICIAL
(a) Các amin đều có khả năng nhận proton (H+).
(b) Tính bazơ của các amin đều mạnh hơn amoniac.
(c) Để tách riêng hỗn hợp khí CH4 và CH3NH2 thì hóa chất cần dùng là dung dịch HCl và dung dịch NaOH.
(d) Để làm sạch lọ đựng anilin thì rửa bằng dung dịch HCl sau đó rửa lại bằng nước.
(e) Anilin có tính bazơ, dung dịch anilin có thể làm hồng phenolphthalein.
(f) Đốt cháy hoàn toàn 1 anken thu được số mol CO2 bằng số mol H2O.
(g) Sobitol là hợp chất hữu cơ đa chức. Số phát biểu đúng là ? A. 6. B. 4. C. 7. D. 5 (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Bến Tre, năm 2016) Câu 24: Cho các phát biểu sau:
(a) Đun nóng dung dịch saccarozơ trong môi trường axit chỉ thu được glucozơ.
(b) Nhỏ dung dịch brom vào dung dịch phenol lấy dư thấy xuất hiện kết tủa màu trắng.
(c) Propin phản ứng với dung dịch AgNO3 trong NH3 thu được kết tủa màu vàng nhat.
(d) Có thể sử dụng Cu(OH)2 để phân biệt hai dung dịch chứa Gly-Gly và Gly-AlaAla.
Số phát biết đúng là
A. 1. B. 4. C. 3. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Sở GD và ĐT Bắc Giang, năm 2016)
C. ĐÁP ÁN VÀ HƯỚNG DẪN TRẢ LỜI Nhận biết chất
DẠYKÈMQUYNHƠN
35
1C 2A 3D 4D 5D 6D 7A
Câu 1: Thuốc thử để nhận biết glucozơ và tinh bột là dung dịch I2. Dung dịch I2 làm tinh bột chuyển sang màu xanh tím và không có phản ứng với glucozơ.
Chất
Thuốc thử
Hiện tượng Glucozơ
dung dịch I2
dung dịch hồ tinh bột
Câu 2:
Chất
CH3COOH
CH3CH2NH2
H2NCH2COOH
Câu 3:
Chất
CH3COOH
Thuốc thử
Dung dịch quỳ tím
Dung dịch thu được có màu tím (màu của iot)
Dung dịch thu được có màu xanh (màu của hợp chất tạo thành giữa tinh bột và iot)
Hiện tượng
Làm quỳ tím hóa đỏ
Làm quỳ tím hóa xanh
OFFICIAL
Không làm đổi màu quỳ tím
Thuốc thử Hiện tượng
Làm quỳ tím hóa đỏ
CH3CH2NH2 Làm quỳ tím hóa xanh
C6H5OH (phenol)
Câu 4:
Dung dịch quỳ tím
Không làm đổi màu quỳ tím
Chất
Thuốc thử
Hiện tượng axit axetic
Làm quỳ tím hóa đỏ metylamin Làm quỳ tím hóa xanh anilin Quỳ tím Không làm đổi màu quỳ tím Câu 5:
Chất
Thuốc thử
Hiện tượng metyl acrylat
Dung dịch Br2 bị nhạt màu etyl axetat Dung dịch Br2 Màu dung dịch Br2 không thay đổi Câu 6: Chất
Thuốc thử
Hiện tượng CH3CH=O Nước brom bị nhạt màu C6H5OH (phenol) Dung dịch Br2 Nước brom bị nhạt màu và đồng thời xuất hiện kết tủa trắng
C2H5OH Màu dung dịch Br2 không thay đổi Câu 7:
Chất
Thuốc thử
Hiện tượng Gly-Ala Cu(OH)2 Cu(OH)2 không bị hòa tan
DẠYKÈMQUYNHƠN
36
Gly-Gly-Gly-Ala
Cu(OH)2 bị hòa tan và tạo thành dung dịch màu tím
Xác định chất phản ứng với dung dịch Br2
1B 2B 3A 4B 5B
Câu 4: 4 chất thỏa mãn điều kiện là etilen, axetilen, glucozơ, anilin.
Câu 5: 3 chất thỏa mãn điều kiện là stiren, phenol, phenyl acrylat.
Xác định chất phản ứng với dung dịch AgNO3/NH3
1A 2A 3B 4A 5C 6C 7D
Câu 5: 3 chất thỏa mãn điều kiện là HCHO, HCOOH, HCOOCH3
Câu 6: 2 chất thỏa mãn điều kiện là glucozơ, etyl fomat.
Câu 7: 5 chất thỏa mãn điều kiện là propin, glucozơ, propyl fomat, vinyl axetilen, anđehit oxalic.
Xác định chất hòa tan được Cu(OH)2
OFFICIAL
1C 2A 3C 4A 5B 6A 7C 8D 9B 10C 11B
Câu 5: 2 chất thỏa mãn điều kiện là axit axetic, glucozơ.
Câu 6: 2 chất thỏa mãn điều kiện là ancol etylic, propan-1,3-điol.
Câu 7: 5 chất thỏa mãn điều kiện là saccarozơ; etylen glicol; anbumin; axit axetic; glucozơ.
Câu 8: 4 chất thỏa mãn điều kiện là glucozơ, saccarozơ, axit axetic, anbumin.
Câu 9: 4 chất thỏa mãn điều kiện là HOCH2CH2OH; HOCH2CH(OH)CH2OH; CH3COOH.
Câu 10: 5 chất thỏa mãn điều kiện là CH3COOH; C3H5(OH)3; Ala-Gly-Ala; C12H22O11(saccarozơ); C2H3COOH.
Câu 11: 3 chất thỏa mãn điều kiện là glucozơ, saccarozơ, glixerol.
V. Xác định chất phản ứng với dung dịch kiềm (NaOH, KOH,...) 1D 2B 3D 4A 5D 6D 7D 8A 9C 10B 11B 12D Câu 3: 5 chất thỏa mãn điều kiện là triolein, etyl axetat, Ala-Gly-Ala, vinyl fomat, anbumin.
Câu 4: 4 chất thỏa mãn điều kiện là axit axetic, phenylamoni clorua, glyxin, phenol (C6H5OH).
Câu 5: 5 chất thỏa mãn điều kiện là axit glutamic, phenylamoni clorua, metyl metacrylat, phenol, Gly-Ala-Val.
Câu 6: 4 chất thỏa mãn điều kiện là H2NCH(CH3)COOH; C6H5OH (phenol); CH3COOC2H5; CH3NH3Cl.
DẠYKÈMQUYNHƠN
37
Câu 7: 5 chất thỏa mãn điều kiện là etyl axetat, axit acrylic, phenol, phenylamoni clorua, p-crezol.
Câu 8: 5 chất thỏa mãn điều kiện là axit glutamic, metylamoni clorua, vinylaxetat, phenol, Gly-Gly.
Câu 9: 6 chất thỏa mãn điều kiện là etyl axetat, lòng trắng trứng, axit acrylic, phenol, anilin, phenyl amoniclorua, p-crezol.
Câu 10: 3 chất thỏa mãn điều kiện là m-CH3COOC6H4CH3; ClH3NCH2COONH4; p-C6H4(OH)2.
Câu 11: 4 chất thỏa mãn điều kiện là triolein, saccarozơ, tinh bột, anbumin.
Câu 12: 7 chất phản ứng với dung dịch NaOH là etyl axetat, axit acrylic, phenol, phenylamoni clorua, p-crezol, axit lactic, alanin.
3 chất phản ứng với dung dịch brom là axit acrylic, phenol, p-crezol.
Xác định chất phản ứng với dung dịch axit HCl, H2SO4 loãng 1A 2D 3D
Câu 1: 3 chất thỏa mãn điều kiện là H2NCH2COOH, C2H5NH2, CH3NH2 Câu 2: 5 chất thỏa mãn điều kiện là CH3NH2; CH3COONa; CH2=CH2; CH3COONH4; C6H5ONa.
Câu 3: 6 chất thỏa mãn điều kiện là metyl metacrylat; triolein; saccarozơ; xenlulozơ; glyxylalanin; tơ nilon-6,6.
Chọn phát biểu đúng, sai; số phát biểu đúng; đếm số phản ứng xảy ra
1B 2D 3B 4C 5C 6C 7B 8B 9B 10B 11A 12A 13B 14B 15C 16C 17C 18D 19C 20D 21D 22B 23D 24C
Câu 15: 6 phát biểu đúng là (1), (2), (3), (4), (5), (8).
Câu 16: 3 phát biểu đúng là (1), (3), (4).
Câu 17: 4 phát biểu đúng là (a), (e), (f), (g).
Câu 18: 3 phát biểu đúng là (b), (c), (d).
Câu 19: 3 phát biểu đúng là (b), (c), (g).
Câu 20: 2 phát biểu đúng là (3), (4).
Câu 21: 3 phát biểu đúng là (3), (4), (6).
Câu 22: 3 phát biểu đúng là (1), (2), (4).
Câu 23: 5 phát biểu đúng là (a), (c), (d), (f), (g).
Câu 24: 3 phát biểu đúng là (b), (c), (d).
DẠYKÈMQUYNHƠN
38
OFFICIAL
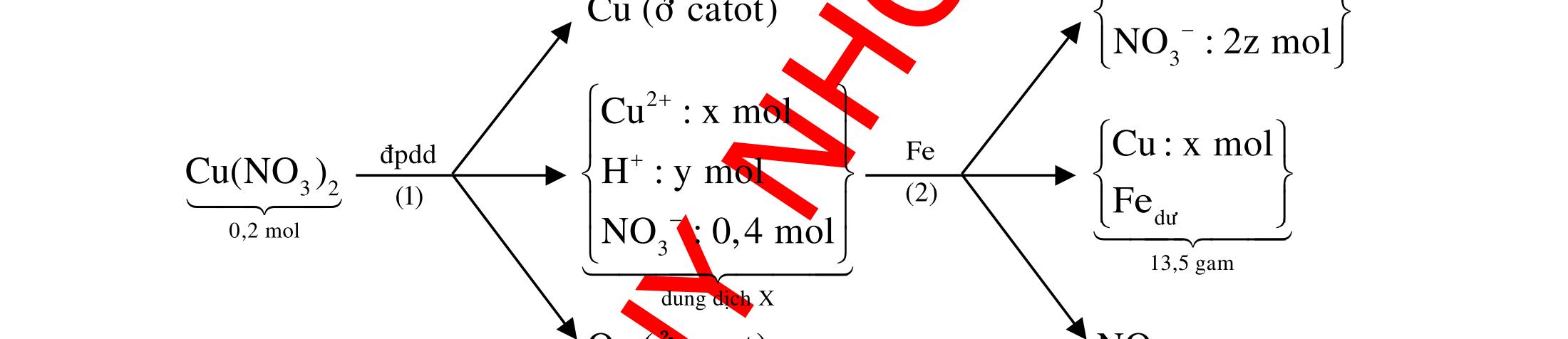
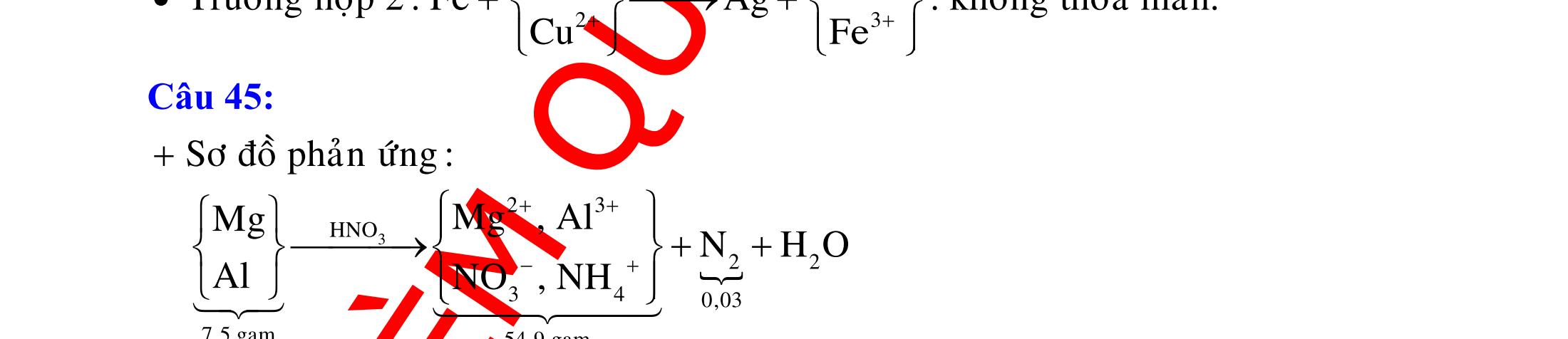
DẠYKÈMQUYNHƠN OFFICIAL 3 CHUYÊN
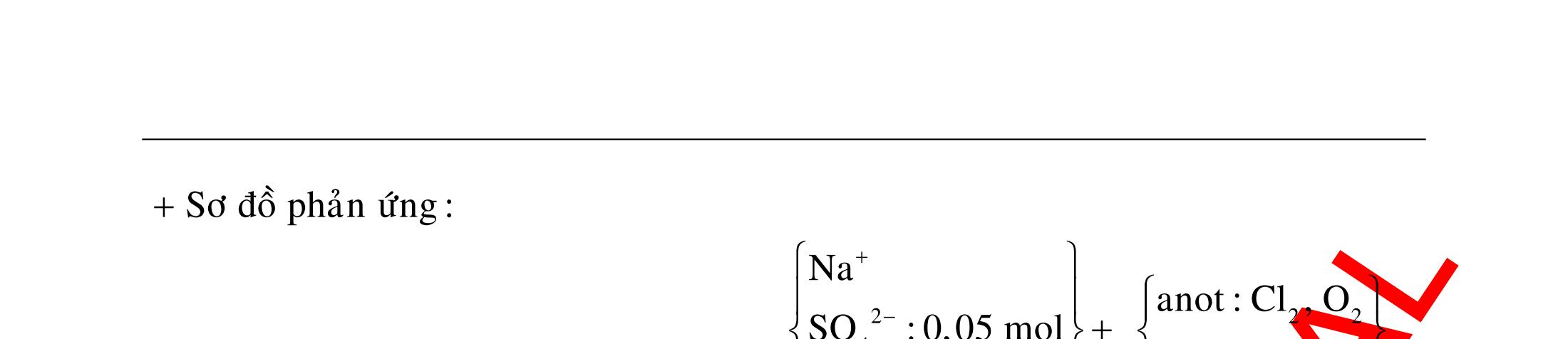
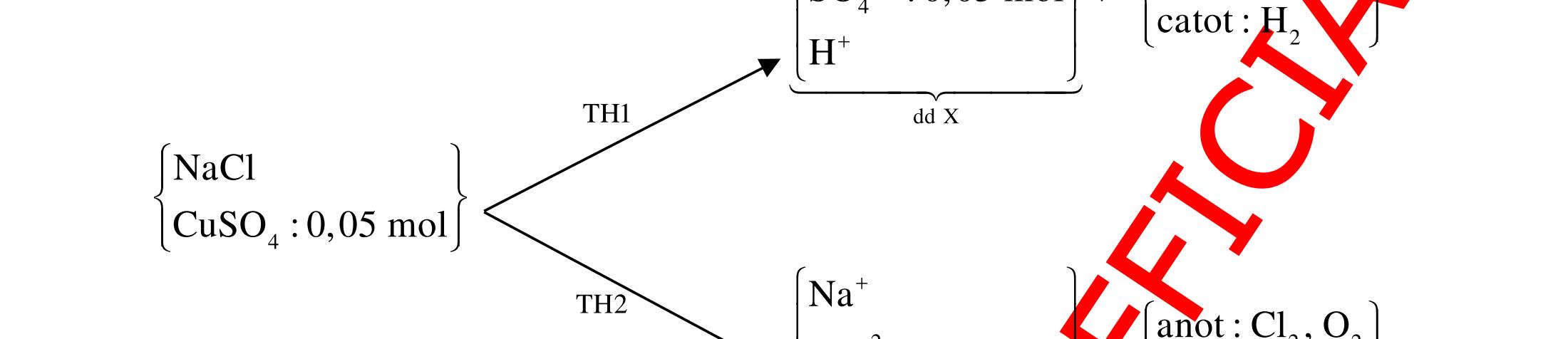
12 :
A. PHÂN DẠNG CÂU HỎI VÀ VÍ DỤ MINH HỌA I. Phản ứng tạo ra đơn chất (kim loại, phi kim) 1. Một số phản ứng tạo ra đơn chất thường gặp Bảng 1 Đơn chất Công thức Phương trình phản ứng H2 o n 24loang 2 2 2 2 2 2 2 ñac2 23 2 t 2(hôi) 2 2M2nH(HCl,HSO)2MnH (MlakimloaitröñöngtröôcH) 2Al2OH2HO2AlO3H Zn2OHZnOH Si2NaOHHONaSiO2H CHO COH O2 o o 2 o o o t 4(ran) 24 22 MnO,t 3(ran) 2 t 3n 2n 2 t 3n 2n 2 2 t 3n 2 2 22 2KMnO KMnOMnOO 2KClO 2KCl3O 2M(NO)2M(NO)nO (MñöngtröôcMg) 4M(NO)2MO4nNOnO (MtöMgñenCu) 2M(NO)2M2nNOnO (MñöngsauCu) 2HO o 2 MnO(ran),t (dungdòch) 2 2 3 2 2 3 2 22 2 2 2 2HOO OAgOAgO O2KIHO2KOHOI 2F2HO4HFO Phi kim S o o oxihoacham 22 2 2 2 2 t 22 t 2 22324 2 2 24 2HSO 2S2HO SO2HS3S2HO ClHSS2HCl SO2Mg2MgOS NaSOHSOSSOHONaSO
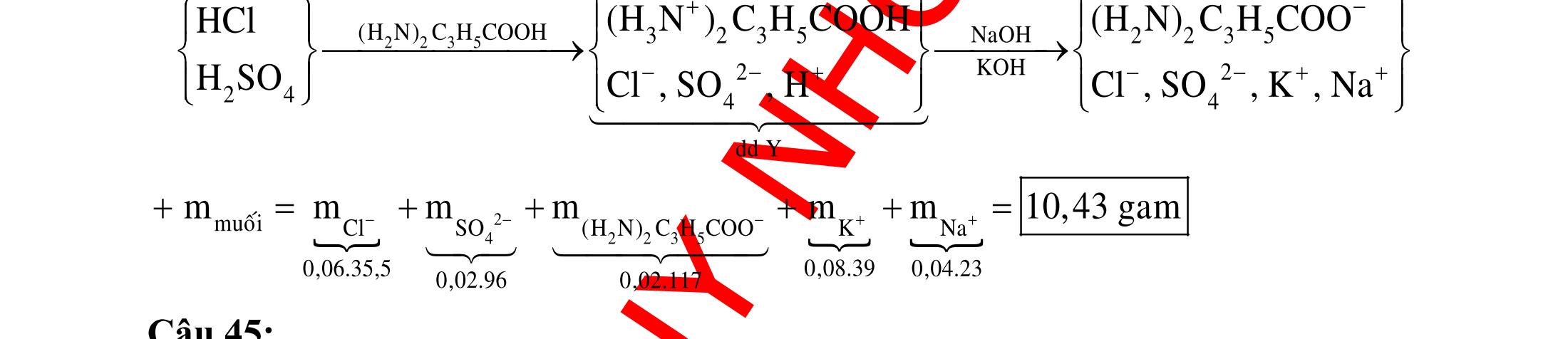
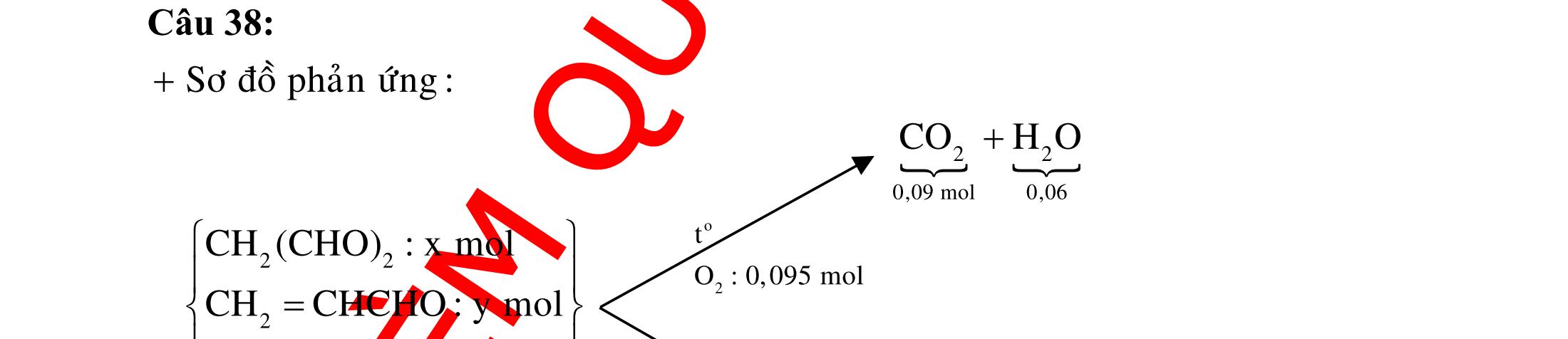
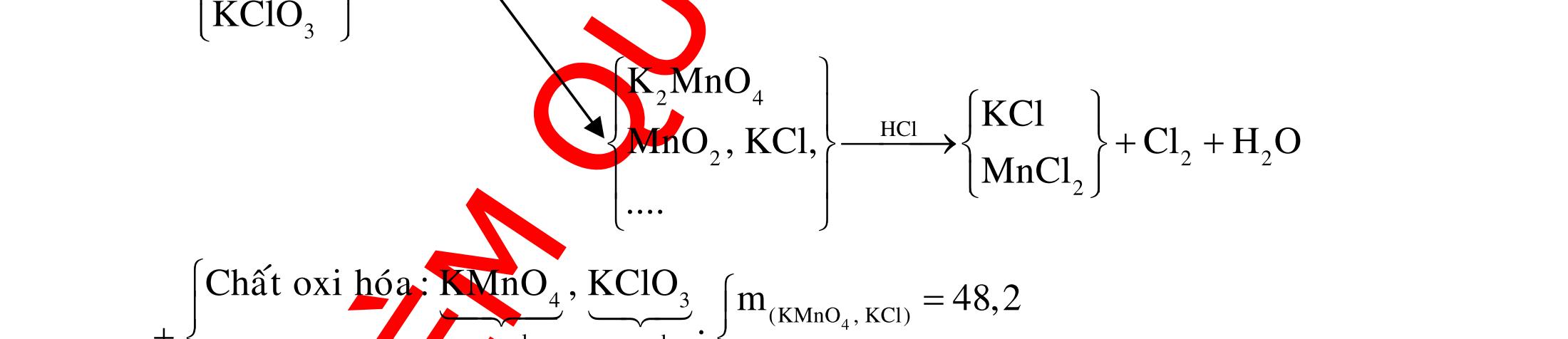
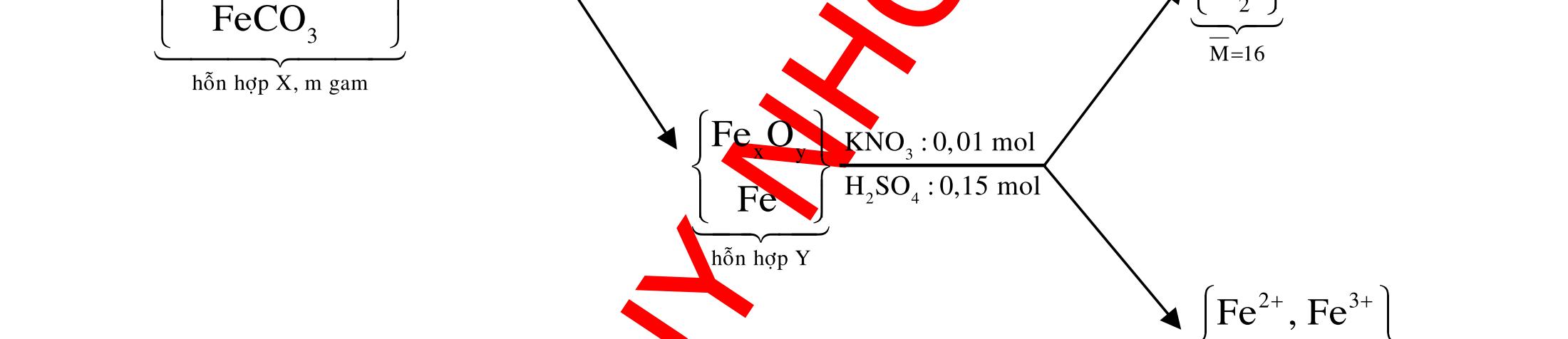
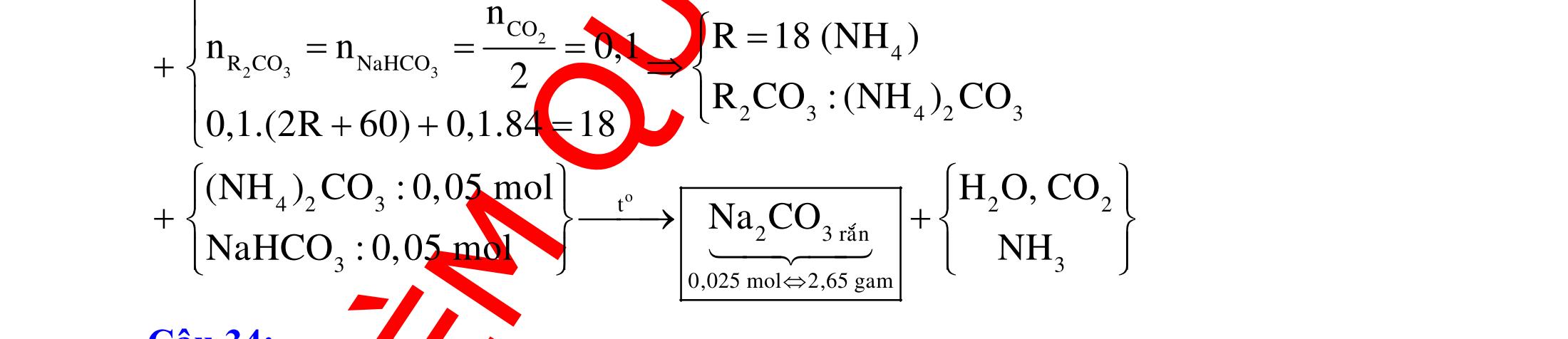
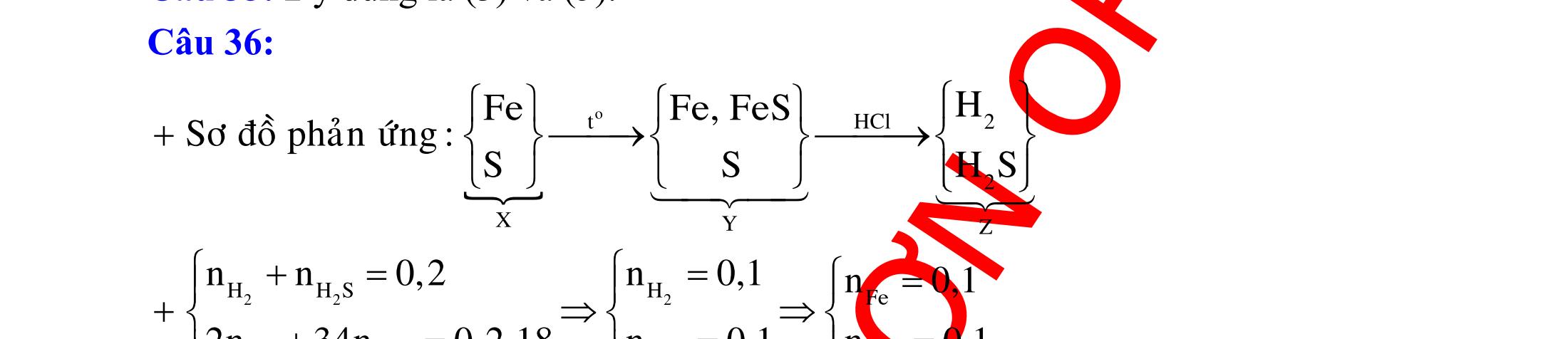
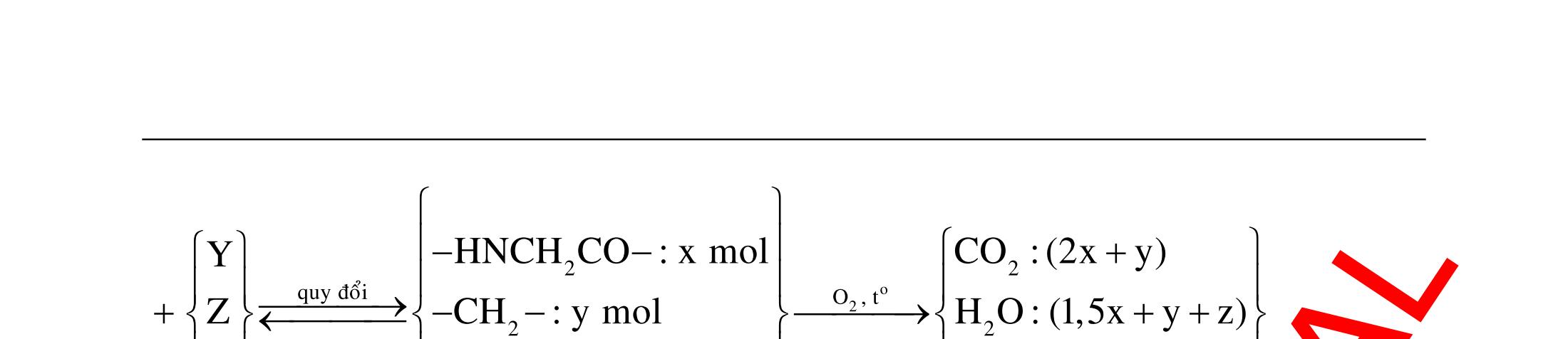
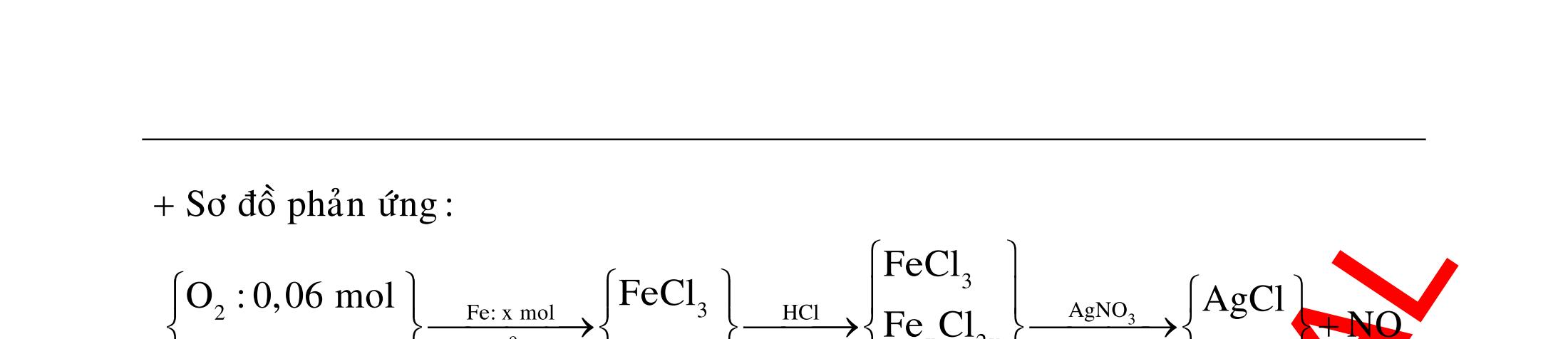
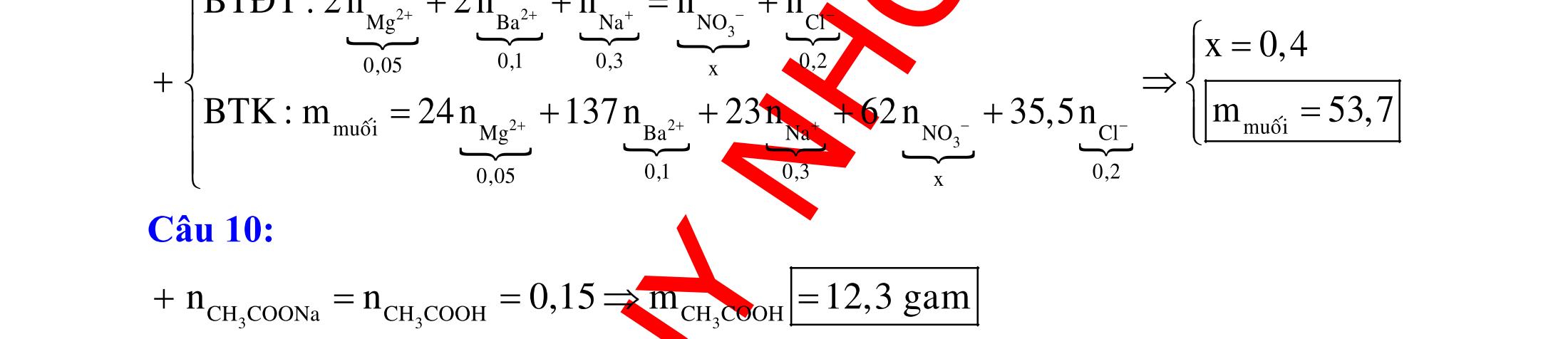
ĐỀ
PHÂN DẠNG CÂU HỎI TỔNG HỢP KIẾN THỨC
DẠYKÈMQUYNHƠN OFFICIAL 4 Cl2 ot 2 ñac 2 22 2 4 ñac 2 2 2 3227 2 ñac 22 2 MnO4HClClMnCl2HO (PbO) 2KMnO16HCl2KCl2MnCl5Cl8HO (KClO,KCrO) CaOCl2HClCaClClHO I2 2 2 2 2 xy 22 2 3 2 22 24ñac 2 2 2 Cl2NaI2NaClI Br2NaI2NaBrI FeOHIFeIIHO 2y2 x O2KIHO2KOHOI HSO8HI4IHS4HO N2 3 2 2 2NH3CuO3CuN3HO C 1:2 2 CO2MgC2MgO (Na,K,Al) Si 1:2 2 SiO2MgSi2MgO (Na,K,Al) Ag o o n 3 t 3 2 2 ñpdd 3 2 2 3 t 22 2 2 3 MnAgNOMnAg (MlakimloaiñöngtröôcAg) 2AgNO2Ag2NOO 4AgNO2HO4AgO4HNO AgSO2AgSO AgFeAgFe Kim Cu o 2 2 t 2 2 ñpdd 32 2 2 3 comangngan 4 32 MCuMCu (MñöngtröôcCu) CuOCOCuCO (H,C,Al) 2Cu(NO)2HO CuO4HNO (cothethaythebangcacmuoinhö:CuSO,Cu(NO))
DẠYKÈMQUYNHƠN OFFICIAL 5 Fe o 2 2 3 2 dö t xy 2 2 MFeMFe 3M2Fe3M2Fe
FeOyCOxFeyCO
Al 3 ñpnc 23 2 criolit:3NaFAlF4AlO 2Al3O loại Na,K(M)
ñpnc
ñpnc 2
RClRCl
Hướng
o 3 2 22 22 2 t 2 22 2 O2KIHOOI2KOH 1 FHO2HFO 2 MnO4HClñacMnClCl2HO Phản ứng (4) không tạo ra đơn chất : 22 2 244ClHS4HO8HClHSO Ví dụ 2: Cho các phản ứng sau: (a) (b) Si + dung dịch NaOH ot 2(hôi)CHO (c) (d) O3 + Ag otFeOCO (e) (f) ot 32Cu(NO) ot 4KMnO Số phản ứng sinh ra đơn chất là A. 4.B. 6. C. 5. D. 3.
(MñöngtröôcFe)
(H,C,Al)
Ca,Ba(R)
2
2 2MCl2MCl
2. Ví dụ minh họa Ví dụ 1: Cho các phản ứng : (1) O3 + dung dịch KI (2) F2 + H2O (3) MnO2 + HCl đặc (4) Cl2 + dung dịch H2S Các phản ứng tạo ra đơn chất là : A. (1), (2), (3). B. (1), (2), (4). C. (1), (3), (4). D. (2), (3), (4). (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Hùng Vương – Phú Thọ, năm 2016)
dẫn giải Các phản ứng tạo ra đơn chất là (1), (2), (3) :
DẠYKÈMQUYNHƠN OFFICIAL 6 (Đề thi tuyển sinh Đại học khối B, năm 2014) Hướng dẫn giải Cả 6 phản ứng đều tạo ra đơn chất : (a) o o t 2 2 t 2 22 CHOCOH C2HOCO2H (b) ot 2 232 Si2NaOHHONaSiO2H (c) ot 2FeOCOFeCO (d) 3 222AgOAgOO (e) ot 32 222Cu(NO)2CuO4NOO (f) ot 42422 2KMnOKMnOMnOO Ví dụ 3: Cho các phản ứng sau : (a) H2S + SO2 (b) Na2S2O3 + dung dịch H2SO4 (loãng) (c) SiO2 + Mg (d) Al2O3 + dung dịch NaOH ot tælemol1:2 (e) Ag + O3 (g) SiO2 + dung dịch HF Số phản ứng tạo ra đơn chất là A. 4.B. 5. C. 6. D. 3. Hướng dẫn giải Trong các phản ứng trên, có 4 phản ứng tạo thành đơn chất là (a), (b), (c), (e). Phương trình phản ứng : 2 2 2 22324loang 24 2 2 natrithiosunfat 1:2 2 3 2 2 (a):2HSSO3S2HO (b):NaSOHSONaSOSSOHO (c):SiO2MgSi2MgO (e):2AgOAgOO Các phản ứng còn lại không tạo thành đơn chất : 23 22 2 4 2 (d):AlO2NaOHNaAlOHO (g):SiO4HFSiF2HO Ví dụ 4: Tiến hành các thí nghiệm sau (1) Cho Zn vào dung dịch AgNO3; (2) Cho Fe vào dung dịch Fe2(SO4)3; (3) Cho Na vào dung dịch CuSO4; (4) Dẫn khí CO (dư) qua bột CuO nóng.
Các thí nghiệm có tạo thành kim loại là A. (3) và (4).B. (2) và (3). C. (1) và (4). D. (1) và (2). Hướng dẫn giải Các thí nghiệm có kim loại tạo thành là (1) và (4). Phương trình phản ứng :
loại
dụ 5: Thực hiện các thí nghiệm sau :
(a) Nhiệt phân AgNO3. (b) Nung FeS2 trong không khí.
(c) Nhiệt phân KNO3.
(d) Cho dung dịch AlCl3 vào dung dịch NaOH(dư). (e) Cho Fe vào dung dịch CuSO4. (g) Cho Zn vào dung dịch FeCl3 (dư).
(h) Cho Mg dư vào dung dịch FeCl3. (i) Cho Ba vào dung dịch CuSO4 (dư). Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là : A. 2.B. 4. C. 3. D. 5.
DẠYKÈMQUYNHƠN OFFICIAL 7
o 3 32 t 2 Zn2AgNOZn(NO)2Ag COCuOCuCO
Các thí nghiệm (2) và (3) không tạo thành kim
: 2 2 4 24 2 243 4 2Na2HO2NaOHH 2NaOHCuSONaSOCu(OH) FeFe(SO)3FeSO
Ví
Hướng dẫn giải Trong các thí nghiệm trên, có 3 thí nghiệm sau khi các phản ứng thu được kim loại là (a), (e), (h). Phương trình phản ứng : ot 3 2 2 4 4 3 2 2 2 2 2AgNO2Ag2NOO FeCuSOFeSOCu Mg2FeCl2FeClMgCl MgFeClFeMgCl Các phản ứng còn lại đều không thu được kim loại. Ví dụ tương tự : Ví dụ 6: Trong các thí nghiệm sau : (1) Cho SiO2 tác dụng với axit HF. (2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
Số thí nghiệm tạo ra đơn chất là : A. 4.B. 5. C. 7. D. 6.
Ví dụ 7: Tiến hành các thí nghiệm sau ở điều kiện thường:
(a) Sục khí vào dung dịch H2S 2SO
(b) Sục khí F2 vào nước
(c) Cho KMnO4 vào dung dịch HCl đặc
(d) Sục khí CO2 vào dung dịch NaOH
(e) Cho Si vào dung dịch NaOH
(g) Cho Na2SO3 vào dung dịch H2SO4 Số thí nghiệm có sinh ra đơn chất là A. 6. B. 3. C. 5. D. 4.
Ví dụ 8: Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư
(b) Sục khí Cl2 vào dung dịch FeCl2
(Đề thi THPT Quốc Gia, năm 2015)
(c) Dẫn khí H2 dư qua bột CuO nung nóng
(d) Cho Na vào dung dịch CuSO4 dư
(e) Nhiệt phân AgNO3 (g) Đốt FeS2 trong không khí
(h) Điện phân dung dịch CuSO4 với điện cực trơ Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là A. 3. B. 2. C. 4. D. 5. (Đề thi THPT Quốc Gia, năm 2016)
Ví dụ 9: Tiến hành các thí nghiệm sau :
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư
(b) Dẫn khí CO dư qua bột MgO nung nóng
(c) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư
(d) Cho Na vào dung dịch MgSO4
(e) Nhiệt phân Hg(NO3)2
(g) Đốt Ag2S trong không khí Số thí nghiệm không tạo thành kim loại là : A. 2. B. 5. C. 3. D. 4.
DẠYKÈMQUYNHƠN
8
OFFICIAL
DẠYKÈMQUYNHƠN OFFICIAL 9 (Đề thi thử THPT Quốc Gia
1 – THPT Trực
–
ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 6B 7D 8A 9C II. Phản ứng
1.
Phản
gặp : Bảng 2 Loại phản ứng Loại chất kết tủa Phương trình phản ứng Hiđroxit kim loại nM(OH) n dö n 22323 n 3dö 2 n 4 2222 2 2 2 3 3 MnOHM(OH) (TröKLK,Ca,Ba,Al,Zn,Cr) MnNHnHOM(OH)nNH (TröKLK,Ca,Ba,Zn,Cu,Ag) AlOCO2HOAl(OH)HCO Muối 3 4 34 2 2 2 2 2 2 4 4 2 2 3 3 2 2 2 3 3 4 AgClAgCl (Br,I) 3AgPOAgPO Cu SCuS (Pb,Ag)(HS) BaSOBaSO Ba COBaCO (Ca,Mg)(SO,PO) Phản ứng trao đổi Axit 22 23 2323 COHONaSiONaCOHSiO Phản ứng oxi hóa –khử 2 2 2 32 2 22324 2 2 24 HSSO3S2HO 2FeS2FeS NaSOHSOSSOHONaSO 2. Một số phản ứng tạo khí thường gặp Bảng 3 Loại phản ứng Phương trình phản ứng
lần
Ninh
Nam Định, năm 2016)
tạo kết tủa, tạo khí
Một số phản ứng tạo kết tủa thường gặp
ứng tạo kết tủa thường là phản ứng trao đổi ion trong dung dịch. Ngoài ra còn có một số phản ứng oxi hóa – khử. Dưới đây là một số phản ứng thường
dung dịch các chất FeCl2, FeCl3, ZnCl2, CuSO4 có 2 chất tạo kết tủa khi phản ứng với khí H2S. Phương trình phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 10 Phản ứng trao đổi ot 4 3 2 2 dö 3 2 2 2 2 3 3 3 43 2 3 4 2 2 22 2 22 2 423 4 3 2 NHOHNHHO HCOCOHO (HCO,HSO,SO,HS,S) AlC12HO4Al(OH)3CH (HCl) CaC2HOCHCa(OH) (HCl) UreOH (NH)CO2HO(NH)CO NHOHNHHO Phản ứng oxi hóa – khử 2 3 3 2 3Fe4HNO3FeNO2HO Xemthembang1. 3. Ví
minh họa Ví dụ 1: Cho các dung dịch : FeCl2, FeCl3, ZnCl2, CuSO4. Có bao nhiêu dung dịch tạo kết tủa với khí H2S ? A. 1. B. 2. C. 3. D. 4. Hướng dẫn giải Trong số
(d)
(e)
Sau
A. 2 B. 3 C. 5 D. 4
Hướng
Số trường
dụ
32 2 42 24 2FeClHSS2FeCl2HCl CuSOHSCuSHSO
Ví dụ 2: Tiến hành các thí nghiệm sau (a) Cho dung dịch NH3 vào dung dịch BaCl2 (b) Sục khí SO2 vào dung dịch H2S (c) Cho dung dịch AgNO3 vào dung dịch H3PO4
Cho dung dịch AgNO3 vào dung dịch HCl
Cho dung dịch AgNO3 vào dung dịch HF
khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là
(Đề thi tuyển sinh Đại học khối B, năm 2014)
dẫn giải
hợp thu được chất kết tủa là 2 :
(b) 22 2 SO2HS3S2HO
(d) 3 3AgNOHClAgClHNO
Các trường hợp còn lại (a), (c), (e) đều không xảy ra phản ứng.
Ví dụ 3: Tiến hành các thí nghiệm sau :
(1) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
(2) Cho dung dịch HCl tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]).
(3) Sục khí H2S vào dung dịch FeCl2.
(4) Sục khí NH3 tới dư vào dung dịch AlCl3.
(5) Sục khí CO2 tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]). (6) Sục khí etilen vào dung dịch KMnO4. Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa ? A. 3.B. 4. C. 6. D. 5. Hướng dẫn giải Trong 6 thí nghiệm trên, có 4 thí nghiệm sau khi phản ứng kết thúc thu được kết tủa là (1), (4), (5) và (6). Phương trình phản
DẠYKÈMQUYNHƠN
11
OFFICIAL
ứng : 3 4 32 3 23 2 3 2 3 3 4 Al3Cl 3NH3OH 2 2 2 3 3 24 4 2 24 2 2 (1):Ca(HCO)2NaOHCaCONaCO2HO (4):3NH3HOAlClAl(OH)3NHCl (5):CO2HONaAlOAl(OH)NaHCO (6):3CH2KMnO4HO3CH(OH)2MnO2KOH Ở thí nghiệm (2), lúc đầu phản ứng tạo kết tủa, sau đó kết tủa tan : 22 3 3 3 2 HClNaAlOHOAl(OH)NaCl 3HClAl(OH)AlCl2HO Ví dụ 4: Có các thí nghiệm : cho dd NH3 dư vào dd AlCl3 (TN1); sục khí CO2 dư vào dd NaAlO2 (TN2); cho dd NaOH dư vào dd Ba(HCO3)2 (TN3); cho dd HCl loãng dư vào dd NaAlO2 (TN4). Trong số các thí nghiệm trên, có mấy thí nghiệm không thu được kết tủa sau phản ứng ? A. 1.B. 2. C. 3. D. 4. Hướng dẫn giải Trong các thí nghiệm đề cho, có 3 thí nghiệm thu được kết tủa sau phản ứng là TN1, TN2, TN3. 3 2 3 3 4 22 2 3 3 33 23 3 2 3NH3HOAlClAl(OH)3NHCl COHONaAlOAl(OH)NaHCO 2NaOHBa(HCO)NaCOBaCO2HO
Ví dụ 5: Có năm dung dịch đựng riêng biệt trong năm ống nghiệm: (NH4)2SO4, FeCl2, Cr(NO3)3, K2CO3, Al(NO3)3. Cho dung dịch Ba(OH)2 đến dư vào năm dung dịch trên. Sau khi phản ứng kết thúc, số ống nghiệm có kết tủa là : A. 2.B. 5. C. 3. D. 4.
Hướng dẫn giải
Cho dung dịch Ba(OH)2 đến dư vào năm dung dịch (NH4)2SO4, FeCl2, Cr(NO3)3, K2CO3, Al(NO3)3. Sau khi phản ứng kết thúc, số ống nghiệm có kết tủa là 3. Đó là các ống nghiệm chứa (NH4)2SO4, FeCl2, K2CO3 Phương trình phản ứng:
DẠYKÈMQUYNHƠN OFFICIAL 12 Có
2 2 3 3
HClHONaAlOAl(OH)NaCl
1 thí nghiệm không tạo kết tủa là TN4 :
3 2
3HClAl(OH)AlCl3HO
2
2
2 2
3
Cho dung dịch Ba(OH)2 đến dư vào 2 dung dịch Cr(NO3)3, Al(NO3)3 thì lúc đầu tạo ra kết tủa, nhưng sau đó kết tủa tan. Phương trình phản ứng : 3 3 3 2 2 3 3 3 2 2 Al3OHAl(OH) Al(OH)OHAlO2HO Cr3OHCr(OH) Cr(OH)OHCrO2HO Ví dụ 6: Cho các dung dịch sau : NaHCO3, Na2S, Na2SO4, Fe(NO3)2, FeSO4, Fe(NO3)3 lần lượt vào dung dịch HCl. Số trường hợp có khí thoát ra là : A. 2.B. 3.C. 4. D. 5. Hướng dẫn giải Cho các dung dịch NaHCO3, Na2S, Na2SO4, Fe(NO3)2, FeSO4, Fe(NO3)3 lần lượt vào dung dịch HCl. Số trường hợp có khí thoát ra là 3, đó là NaHCO3, Na2S và Fe(NO3)2 Phương trình phản ứng : 3 22 2 2 2 3 3 2 NaHCOHClNaClCOHO NaS2HCl2NaClHS 3Fe4HNO3FeNO2HO Ví dụ 7: Thực hiện các thí nghiệm sau: (a) Nung NH4NO3 rắn.
424 4 3 2
2 2
23
Ba(OH)(NH)SOBaSO2NH2HO Ba(OH)FeClBaClFe(OH) Ba(OH)NaCOBaCO2NaOH
(b) Đun nóng NaCl tinh thể với dung dịch H2SO4 (đặc).
(c) Sục khí Cl2 vào dung dịch NaHCO3
(d) Sục khí CO2 vào dung dịch Ca(OH)2 (dư).
(e) Sục khí SO2 vào dung dịch KMnO4
(g) Cho dung dịch KHSO4 vào dung dịch NaHCO3
(h) Cho PbS vào dung dịch HCl (loãng). (i) Cho Na2SO3 vào dung dịch H2SO4 (dư), đun nóng. Số thí nghiệm sinh ra chất khí là : A. 5.B. 6. C. 2. D. 4.
DẠYKÈMQUYNHƠN OFFICIAL 13
dẫn giải
sinh ra khí là (a), (b), (c), (g), (i). Phương trình phản ứng : o o t 43 2 2 t (tinhthe)24ñac 4 22 3 2 2 4 3 24 24 2 2 2324dö 24 2 2 (a):NHNONO2HO (b):NaClHSO NaHSOHCl ClHOHClHClO (c): HClNaHCONaClCOHO (g):2KHSO2NaHSOKSONaSO2HO2CO (i):NaSOHSONaSOSOHO Thí nghiệm (d), (e) không tạo ra khí, thí nghiệm (h) không xảy ra phản ứng : 2 2 3 2 2 4 2 24 4 24 (d):COCa(OH)CaCOHO (e):5SO2KMnO2HOKSO2MnSO2HSO Ví dụ 8: Trong các phản ứng sau : (1) dd Na2CO3 + dd H2SO4 (2) dd NH4HCO3 + dd Ba(OH)2 (3) dd Na2CO3 + dd CaCl2 (4) dd NaHCO3 + dd Ba(OH)2 (5) dd (NH4)2SO4 + dd Ba(OH)2 (6) dd NaHSO4 + dd BaCO3 Các phản ứng có đồng thời cả kết tủa và khí là A. (1), (3), (6). B. (2), (5), 6. C. (2), (3), (5). D. (2), (5). Hướng dẫn giải Trong các phản ứng đề cho, có 3 phản ứng có đồng thời kết tủa và khí là : 43 2 3 3 2 424 2 4 3 2 4 3 24 4 2 2 (2):NHHCOBa(OH)BaCONH2HO (5):(NH)SOBa(OH)BaSO2NH2HO (6):2NaHSOBaCONaSOBaSOCOHO Ví dụ tương tự : Ví dụ 9: Thí nghiệm nào sau đây có kết tủa sau phản ứng?
Hướng
Trong số các thí nghiệm trên, có 5 thí nghiệm
A. Cho dung dịch NaOH đến dư vào dung dịch Cr(NO3)3.
B. Thổi CO2 đến dư vào dung dịch Ca(OH)2.
C. Cho dung dịch HCl đến dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]).
D. Cho dung dịch NH3 đến dư vào dung dịch AlCl3.
Ví dụ 10: Cho từ từ đến dư dung dịch NaOH loãng vào mỗi dung dịch sau: FeCl3, CuCl2, AlCl3, FeSO4. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp thu được kết tủa là
A. 3 B. 2. C. 4. D. 1.
Ví dụ 11: Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là
A. 4.B. 5. C. 7. D. 6. Ví dụ 12: Tiến hành các thí nghiệm sau :
(1) Sục khí H2S vào dung dịch FeSO4.
(2) Sục khí H2S vào dung dịch CuSO4.
(3) Sục khí CO2 (dư) vào dung dịch Na2SiO3.
OFFICIAL
(4) Sục khí CO2 (dư) vào dung dịch Ca(OH)2.
(5) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch Al2(SO4)3.
(6) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3. Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là :
A. 4.B. 3. C. 6. D. 5.
Ví dụ 13: Cho từ từ Na dư vào các dung dịch các chất sau : CuSO4, NH4Cl, NaHCO3, Ba(HCO3)2, Al(NO3)3, FeCl2, ZnSO4. Hãy cho biết có bao nhiêu trường hợp vừa có khí thoát ra vừa có kết tủa sau phản ứng ? (Biết rằng lượng nước luôn dư) A. 3.B. 4. C. 5. D. 2. Ví dụ 14: Cho các phản ứng sau: (1) (NH2)2CO + Ca(OH)2; (2) Na2CO3 + dung dịch H2SO4; (3) Al4C3 + H2O; (4) Al2(SO4)3 + dung dịch BaCl2; (5) Na2CO3 + dung dịch AlCl3; (6) Na2S2O3 + dung dịch HCl. Số các phản ứng vừa tạo kết tủa, vừa có khí thoát ra là A. 3.
DẠYKÈMQUYNHƠN
14
B. 6. C. 4. D. 5. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 9D 10A 11B 12A 13A 14C III. Xác định khả năng xảy ra phản ứng Đây là dạng bài tập có tính tổng hợp rất cao. Ngoài việc nắm được bản chất hóa học của các loại phản ứng, các em cần có một vài lưu ý sau :
ứng hóa học ?
A. Sục khí H2S vào dung dịch FeCl2.
B. Cho Fe vào dung dịch H2SO4 loãng, nguội.
C. Sục khí H2S vào dung dịch CuCl2.
D. Sục khí Cl2 vào dung dịch FeCl2.
Hướng dẫn giải Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch chất điện li là phản ứng tạo ra chất kết tủa hoặc chất bay hơi hoặc chất điện li yếu. Suy ra sục khí H2S vào dung dịch FeCl2 sẽ không có phản ứng xảy ra. Các trường hợp còn lại đều xảy ra phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 15 2 3 3 2 2 3 424 n 2 2n n 2n 2 2 3 3 2 2 4 HCOOHCOHO (HSO,HS,HPO,HPO) 2MHSMS2H (MlakimloaitöPbtrôvecuoiday) MS2H2MHS (MlakimloaiñöngtröôcPb) 3Fe4HNO3FeNO2HO 5FeMnO8H5Fe 3 2 2 2 4 2 334 Mn4HO SiO4HFSiF2HO AgNOHPO Ví
dụ 1: Trường hợp nào sau đây không xảy ra phản
24loang 42 2 2 3 2 2 FeHSOFeSOH Cl2FeCl2FeCl HSCuClCuS2HCl Ví dụ 2: Trường hợp nào sau đây không xảy ra phản ứng ở điều kiện thường? A. Dẫn khí Cl2 vào dung dịch H2S. B. Cho dung dịch Ca(HCO3)2 vào dung dịch NaOH. C. Cho dung dịch Na3PO4 vào dung dịch AgNO3. D. Cho CuS vào dung dịch HCl. Hướng dẫn giải Trường hợp không xảy ra phản ứng là “Cho CuS vào dung dịch HCl”. Các trường hợp đều xảy ra phản ứng : 222 24 32 3232 34 334 3 4ClHS4HO8HClHSO Ca(HCO)2NaOHCaCONaCO2HO NaPO3AgNOAgPO3NaNO
Ví dụ 3: Có các cặp chất sau : Cu và dung dịch FeCl3; H2S và dung dịch Pb(NO3)2; H2S và dung dịch ZnCl2; dung dịch AgNO3 và dung dịch FeCl3. Số cặp chất xảy ra phản ứng ở điều kiện thường là A. 3. B. 2. C. 1. D. 4. Hướng dẫn giải Trong số các cặp chất đề cho, có 3 cặp chất xảy ra phản ứng ở điều kiện thường là :
Cặp H2S và dung dịch ZnCl2 không xảy ra phản ứng. Ví dụ 4: Thực hiện các thí nghiệm sau :
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(b) Cho FeS vào dung dịch HCl.
(c) Cho Si vào dung dịch NaOH đặc.
(d) Cho dung dịch AgNO3 vào dung dịch NaF.
(e) Cho Si vào bình chứa khí F2.
(f) Sục khí SO2 vào dung dịch H2S. Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng
DẠYKÈMQUYNHƠN OFFICIAL 16
3 3 2 2 32
3 3 33 2FeClCu2FeClCuCl HSPb(NO)PbS2HNO 3AgNOFeClFe(NO)AgCl
3
A. 4. B. 3. C. 6. D. 5. Hướng dẫn giải Trong số các thí nghiệm trên, có 5 thí nghiệm xảy ra phản ứng là : 2 3 3 2 22 ñac2 23 2 2 4 2 2 2 (a):4HNO3Fe3FeNO2HO (b):FeS2HClFeClHS 3 (c):Si2NaOHHONaSiOH 2 (e):Si2FSiF (f):SO2HS3S2HO Ví dụ 5: Thực hiện các thí nghiệm sau (ở điều kiện thường): (a) Cho đồng kim loại vào dung dịch sắt(III) clorua. (b) Sục khí hiđro sunfua vào dung dịch đồng(II) sunfat. (c) Cho dung dịch bạc nitrat vào dung dịch sắt(III) clorua. (d) Cho bột lưu huỳnh vào thủy ngân. Số thí nghiệm xảy ra phản ứng là
là
DẠYKÈMQUYNHƠN OFFICIAL 17 A. 2. B. 1. C. 3. D. 4. Hướng dẫn giải Cả 4 thí nghiệm trên đều xảy ra phản ứng : 3 2 2 2 4 24 3 3 33 (a):Cu2FeClCuCl2FeCl (b):HSCuSOCuSHSO (c):3AgNOFeClFe(NO)3AgCl (d):HgSHgS Ví dụ 6: Cho hỗn hợp gồm Fe2O3 và Cu vào dung dịch H2SO4 loãng dư, thu được chất rắn X và dung dịch Y. Dãy nào dưới đây gồm các chất đều tác dụng được
23 24 243 2 243 4 4 FeO3HSOFe(SO)3HO CuFe(SO)CuSO2FeSO Vậy chất rắn X là Cu; dung dịch Y gồm các ion : 22 2 4
Dãy gồm các chất đều tác dụng
với
Y
Phương trình phản ứng : 2 3 2 2 3 3 2 2 3 2 4 2 2FeBr2Fe2Br 3FeNO4H3FeNO2HO 5FeMnO8H5FeMn4HO Ví dụ 7: Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng (dư), thu được dung dịch X. Trong các chất: NaOH, Cu, Fe(NO3)2, KMnO4, BaCl2, Cl2 và Al, số chất có khả năng phản ứng được với dung dịch X là A. 5. B. 4. C. 6. D. 7. Hướng dẫn giải Hòa tan Fe3O4 vào H2SO4 loãng dư : 34 24 243 4 2 FeO4HSOFe(SO)FeSO4HO Dung dịch X gồm : . Suy ra dung dịch X có thể phản ứng được 23 Fe,Fe,H với tất cả các chất : NaOH, Cu, Fe(NO3)2, KMnO4, BaCl2, Cl2 và Al. Phương trình phản ứng :
với dung dịch Y ? A. KI, NH3, NH4Cl. B. NaOH, Na2SO4, Cl2. C. Br2, NaNO3, KMnO4. D. BaCl2, HCl, Cl2 Hướng dẫn giải Bản chất phản ứng của Fe2O3 và Cu với dung dịch H2SO4 loãng dư là :
Fe,Cu,H,SO.
được
dung dịch
là : Br2, NaNO3, KMnO4
dụ 8: Trường hợp nào sau đây không xảy ra phản ứng ở điều kiện thường? A. Dẫn khí Cl2 vào dung dịch H2S.
B. Cho dung dịch Ca(HCO3)2 vào dung dịch NaOH. C. Cho dung dịch Na3PO4 vào dung dịch AgNO3 D. Cho CuS vào dung dịch HCl (Đề thi tuyển sinh Cao Đẳng, năm 2014)
Ví dụ 9: Phương trình hóa học nào sau đây không đúng?
A. Ca + 2H2O Ca(OH)2 + H2.B. 2Al + Fe2O3 Al2O3 + 2Fe. to
C. 4Cr + 3O2 2Cr2O3. D. 2Fe + 3H2SO4(loãng) Fe2(SO4)3 + 3H2. to (Đề thi tuyển sinh Đại học khối B, năm 2014)
Ví dụ 10: Thực hiện các thí nghiệm sau ở điều kiện thường:
(a) Sục khí H2S vào dung dịch Pb(NO3)2.
(b) Cho CaO vào H2O.
(c) Cho Na2CO3 vào dung dịch CH3COOH.
(d) Sục khí Cl2 vào dung dịch Ca(OH)2. Số thí nghiệm xảy ra phản ứng là
A. 3. B. 4. C. 2. D. 1. (Đề thi THPT Quốc Gia, năm 2015)
Ví dụ 11: Thực hiện các thí nghiệm sau ở nhiệt độ thường:
(a) Cho bột Al vào dung dịch NaOH.
(b) Cho bột Fe vào dung dịch AgNO3.
DẠYKÈMQUYNHƠN OFFICIAL 18 2 2 2 3 3 3 2 2 2 3 3 2 2 3 2 4 2 2 2 4 4 2 3 2 3 2 3 2 OHHHO 2OHFeFe(OH) 3OHFe2Fe(OH) Cu2FeCu2Fe 3Fe4HNO3FeNO2HO MnO8H5Fe5FeMn4HO BaSOBaSO Cl2Fe2Cl2Fe 2Al6HAl3H Al3Fe3Fe 3 2 3 Al 2Al3Fe2Al3Fe Ví dụ tương tự : Ví
(c) Cho CaO vào nước.
(d) Cho dung dịch Na2CO3 vào dung dịch CaCl2.
Số thí nghiệm có xảy ra phản ứng là
A. 2. B. 4. C. 3. D. 1.
(Đề thi THPT Quốc Gia, năm 2016)
Ví dụ 12: Trong các dung dịch: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2, dãy gồm các chất đều tác dụng được với dung dịch Ba(HCO3)2 là :
A. HNO3, Ca(OH)2, KHSO4, Mg(NO3)2.
B. HNO3, NaCl, Na2SO4. C. HNO3, Ca(OH)2, KHSO4, Na2SO4. D. NaCl, Na2SO4, Ca(OH)2
Ví dụ 1: Phản ứng nhiệt phân không đúng là :
A. NH4Cl NH3 + HCl.
B. 2KNO3 2KNO2 ot ot + O2.
C. NaHCO3 NaOH + CO2.
D. NH4NO3 N2O ot ot + 2H2O.
Hướng dẫn giải
Phản ứng nhiệt phân không đúng là “NaHCO3 NaOH + CO2”. ot Phản ứng đúng phải là : ot 3 23 2 2 2NaHCONaCOCOHO
Ví dụ 2: Phát biểu nào sau đây là đúng?
A. Thành phần chính của supephotphat kép gồm hai muối Ca(H2PO4)2 và CaSO4.
B. Phân lân cung cấp nitơ cho cây trồng. C. Urê có công thức là (NH2)2CO.
D. Supephotphat đơn chỉ có Ca(H2PO4)2. Hướng dẫn giải Phát biểu đúng là : “Urê có công thức là (NH2)2CO”. Các phát biểu còn lại đều sai. Vì : + Thành phần chính của supephotphat kép là muối Ca(H2PO4)2. Bản chất của quá trình hóa học điều chế supephotphat kép là : 342 34 242Ca(PO)4HPO3Ca(HPO) + Supephotphat đơn có Ca(H2PO4)2 và CaSO4. Bản chất quá trình hóa học điều chế supephotphat đơn là :
DẠYKÈMQUYNHƠN
19
OFFICIAL
ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 8D 9D 10B 11B 12C IV. Các dạng câu hỏi tổng hợp khác 1. Chọn số ý đúng, số phản ứng thỏa mãn điều kiện cho trước
Ví dụ 3: Khi làm thí nghiệm với SO2 và CO2, một học sinh đã ghi các kết luận sau :
(1) SO2 tan nhiều trong nước, CO2 tan ít.
(2) SO2 làm mất màu nước brom, còn CO2 không làm mất màu nước brom.
(3) Khi tác dụng với dung dịch Ca(OH)2, chỉ có CO2 tạo kết tủa.
(4) Cả hai đều là oxit axit.
Trong các kết luận trên, các kết luận đúng là
A. Cả (1), (2), (3), (4). B. (1), (2), (4). C. (2), (3), (4). D. (2) và (4).
Hướng dẫn giải
Trong các kết luận về tính chất của SO2 và CO2, có 3 kết luận đúng là :
(1) SO2 tan nhiều trong nước, CO2 tan ít. (2) SO2 làm mất màu nước brom, còn CO2 không làm mất màu nước brom. (4) Cả hai đều là oxit axit.
Giải thích : CO2 là phân tử không phân cực nên tan ít trong nước. SO2 là phân tử phân cực nên tan nhiều trong nước.
SO2 làm mất màu nước brom vì SO2 có tính khử : . CO2 không có tính khử nên không có khả 22 2 24 SOBr2HOHSO2HBr năng làm mất màu nước brom.
Cả CO2, SO2 đều tan trong nước tạo thành dung dịch axit nên chúng là các oxit axit.
Có 1 kết luận sai là : (3) Khi tác dụng với dung dịch Ca(OH)2, chỉ có CO2 tạo kết tủa. Thực tế, khi tác dụng với Ca(OH)2 thì cả CO2 và SO2 đều tạo ra kết tủa là CaCO3 và CaSO3.
Ví dụ 4: Cho các phát biểu sau:
(1) Để xử lý thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh.
(2) Khi thoát vào khí quyển, freon phá hủy tần ozon.
(3) Trong khí quyển, nồng độ CO2 vượt quá tiêu chuẩn cho phép gây ra hiệu ứng nhà kính.
(4) Trong khí quyển, nồng độ NO2 và SO2 vượt quá tiêu chuẩn cho phép gây ra hiện tượng mưa axit
Trong các phát biểu trên, số phát biểu đúng là:
A. 4. B. 3. C. 2. D. 1. Hướng dẫn giải
Cả 4 phát biểu trên đúng :
DẠYKÈMQUYNHƠN
20
OFFICIAL
342 24 242 4Ca(PO)2HSOCa(HPO)2CaSO
(1) Để xử lý thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh .
(2) Khi thoát vào khí quyển, freon phá hủy tần ozon
(3) Trong khí quyển, nồng độ CO2 vượt quá tiêu chuẩn cho phép gây ra hiệu ứng nhà kính.
(4) Trong khí quyển, nồng độ NO2 và SO2 vượt quá tiêu chuẩn cho phép gây ra hiện tượng mưa axit. Ví dụ 5: Thực hiện thí nghiệm theo các sơ đồ phản ứng : Mg + HNO3
DẠYKÈMQUYNHƠN
21
OFFICIAL
NaHSO
+
Z Ca(HCO
+
khí T Cho
X, Y, Z, T
dịch NaOH
phản ứng trên có bao nhiêu phản ứng oxi hoá - khử ? A. 4. B. 3 C. 2. D. 5. Hướng dẫn giải Phương trình phản ứng : 3(ñacdö) 32 2 2 X 2 22 2 Y 324 24 2 2 Z 32 3 32 2 2 T 2 2 32 2 Mg4HNO Mg(NO)2NO2HO (1) CaOCl2HClCaClClHO (2) 2NaHSOHSONaSO2SO2HO (3) Ca(HCO)2HNOCa(NO)2CO2HO (4) 2NO2NaOHNaNONaNOHO (5) Cl2N 2 2 232 2 232 aOHNaClNaClOHO (6) SO2NaOHNaSOHO (7) CO2NaOHNaCOHO (8) Trong tất cả các phản ứng trên, có 4 phản ứng oxi hóa – khử là (1), (2), (5) và (6). Ví dụ 6: Cho các oxit SO2, NO2, CrO3, CO2, CO, P2O5. số oxit trong dãy tác dụng với nước trong điều kiện thường là : A. 4. B. 5. C. 6. D. 3. Hướng dẫn giải Trong các oxit SO2, NO2, CrO3, CO2, CO, P2O5, có 5 oxit tác dụng với nước trong điều kiện thường, đó là SO2, NO2, CrO3, CO2, P2O5.
đặc, dư khí X CaOCl2 + HCl khí Y
3
H2SO4 khí
3)2
HNO3
các khí
lần lượt tác dụng với dung
dư. Trong tất cả các
Ví dụ tương tự : Ví dụ 7: Phát biểu không đúng là
A. Trong phòng thí nghiệm, nitơ được điều chế bằng cách đun nóng dung dịch
NH4NO2 bão hòa.
B. Photpho trắng rất độc, có thể gây bỏng nặng khi rơi vào da.
C. Đám cháy Mg có thể dập tắt bằng CO2.
D. Khí CO2 là một khí thải gây hiệu ứng nhà kính.
Ví dụ 8: Phát biểu nào sau đây sai?
A. Sắt có trong hemoglobin (huyết cầu tố) của máu.
B. Phèn chua được dùng để làm trong nước đục.
C. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng đơn chất.
D. Hợp kim liti – nhóm siêu nhẹ, được dùng trong kĩ thuật hàng không. (Đề thi THPT Quốc Gia, năm 2015)
Ví dụ 9: Nhận định nào dưới đây là sai?
A. Nguyên tử của các nguyên tố Na, Cr và Cu đều có một electron ở lớp ngoài cùng.
B. Bán kính Na lớn hơn bán kính Na+ và bán kính Fe2+ lớn hơn bán kính Fe3+ . C. Các nguyên tố, mà nguyên tử của nó số electron p bằng 2, 8, và 14 thuộc cùng một nhóm.
D. Al là kim loại có tính lưỡng tính. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm 2016)
Ví dụ 10: Phát biểu nào sau đây là đúng ?
A. Trong công nghiệp nhôm được sản xuất từ quặng đolomit.
B. Tất cả các phản ứng của lưu huỳnh với kim loại đều cần đun nóng.
DẠYKÈMQUYNHƠN OFFICIAL 22 Phương trình phản ứng : 22 23 22 3 32 24 32 227 22 23 252 34 SOHOHSO 3NOHONO2HNO CrOHOHCrO 2CrOHOHCrO COHOHCO PO3HO2HPO
CrO3 tác
Có
C. Ca(OH)2 được dùng làm mất tính cứng vĩnh cửu của nước. D.
dụng với nước tạo ra hỗn hợp axit. Ví dụ 11:
các phát biểu sau : (1) Lưu huỳnh, photpho đều bốc cháy khi tiếp xúc với CrO3.
(2) Ion Fe3+ có cấu hình electron viết gọn là [Ar]3d5 .
(3) Bột nhôm tự bốc cháy khi tiếp xúc với khí clo.
(4) Phèn chua có công thức Na2SO4.Al2(SO4)3.24H2O. Các phát biểu đúng là A. (1), (2), (3). B. (1), (3), (4). C. (1), (2), (4). D. (2), (3), (4).
Ví dụ 12: Cho các phát biểu sau:
(a) Độ dinh dưỡng của phân đạm được đánh giá theo phần trăm khối lượng nguyên tố nitơ.
(b) Thành phần chính của supephotphat kép gồm Ca(H2PO4)2 và CaSO4
(c) Kim cương được dùng làm đồ trang sức, chế tạo mũi khoan, dao cắt thủy tinh.
OFFICIAL
(d) Amoniac được sử dụng để sản xuất axit nitric, phân đạm. Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 1.
Ví dụ 13: Cho các phát biểu sau:
(1) K2CrO4 có màu da cam, là chất oxi hóa mạnh.
(2) Kim loại Al và Cr đều tan trong dung dịch kiềm đặc.
(3) Kim loại Cr có độ cứng cao nhất trong tất cả các kim loại
(4) Cr2O3 được dùng để tạo màu lục cho đồ sứ, đồ thủy tinh.
(5) Ở trạng thái cơ bản kim loại crom có 6 electron độc thân.
(6) CrO3 là một oxit axit, là chất oxi mạnh, bốc cháy khi tiếp xúc với lưu huỳnh, photpho,…
Số phát biểu đúng là A. 3. B. 5. C. 4. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm 2016)
Ví dụ 14: Cho các kết luận
(1) Độ dinh dưỡng trong phân lân được đánh giá bằng hàm lượng nguyên tố photpho.
(2) Công thức chung của oleum là H2SO4.nSO3.
(3) SiO2 có thể tan được trong các dung dịch axit thông thường như H2SO4, HCl, HNO3
(4) Au, Ag, Pt là các kim loại không tác dụng với oxi.
(5) Dẫn H2S qua dung dịch Pb(NO3)2 có kết tủa xuất hiện.
(6) CO có thể khử được các oxit như CuO, Fe3O4 đốt nóng.
Số kết luận đúng là: A. 6. B. 4. C. 5. D. 3.
DẠYKÈMQUYNHƠN
23
(Đề thi thử THPT Quốc Gia lần 1 – Sở Giáo Dục và Đào Tạo Vĩnh Phúc, năm 2016)
Ví dụ 15: Cho các chất riêng biệt sau: FeSO4, AgNO3, Na2SO3, H2S, HI, Fe3O4, Fe2O3 tác dụng với dung dịch H2SO4 đặc, nóng. Số trường hợp xảy ra phản ứng oxi hóa - khử là A. 6. B. 3. C. 4. D. 5.
Ví dụ 16: Cho phản ứng sau : KMnO4 + HCl đặc, nóng; SO2 + dd KMnO4; Cl2 + dd NaOH; H2SO4 đặc, nóng + NaCl; Fe3O4 + HNO3 loãng, nóng; C6H5CH3 + Cl2 (Fe, to); CH3COOH và C2H5OH (H2SO4 đặc). Hãy cho biết có bao nhiêu phản ứng xảy ra thuộc loại phản ứng oxi hóa - khử ? A. 7. B. 4. C. 6. D. 5. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ
OFFICIAL
8C 9D 10D 11A 12C 13B 14D 15C 16D 2. Phản ứng thỏa mãn điều kiện cho trước Ví dụ 1: Cho các chất: Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, K2SO3, (NH4)2CO3. Số chất đều phản ứng được với dung dịch HCl và dung dịch NaOH là : A. 4. B. 5. C. 6. D. 7.
Hướng dẫn giải
Trong số các chất trên, có 5 chất đều tác dụng được với dung dịch HCl và dung dịch NaOH là : Al, Al2O3, Zn(OH)2, NaHS, (NH4)2CO3. Trong đó Al2O3, Zn(OH)2, NaHS, (NH4)2CO3 là các chất lưỡng tính, còn Al tan trong dung dịch kiềm vì Al(OH)3 có tính lưỡng tính. Phương trình phản ứng :
DẠYKÈMQUYNHƠN
24
7C
Thực hiện các thí nghiệm sau
(I) Cho dung dịch NaCl vào dung dịch KOH.
(II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2.
(III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn. (IV) Cho Cu(OH)2 vào dung dịch NaNO3. (V) Sục khí NH3 vào dung dịch Na2CO3. (VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2. Các thí nghiệm đều điều
DẠYKÈMQUYNHƠN OFFICIAL 25 23 22 23 32 2 222 2 22 22 2 423 23 3 2 423 4 2 2 AlO2NaOH2NaAlOHO
Zn(OH)2NaOHNaZnO2HO
NaHSNaOHNaSHO NaHSHClNaClHS (NH)CO2NaOHNaCO2NH2HO (NH)CO2HCl2NHClCOHO 2Al6HC 32 2 3 2 3 22 2 2 2 l2AlCl3H 3 Al3HOAl(OH)H 2 Al(OH)NaOHNaAlO2HO 3 AlNaOHHONaAlOH 2 Ví dụ
AlO6HCl2AlCl3HO
Zn(OH)2HClZnCl2HO
2:
:
A.
B.
V
D.
III
VI. Hướng dẫn giải Các thí nghiệm đều điều chế được NaOH là (II),
Phương trình phản ứng : 23 2 3 ñienphandungdòch 2 22 comangngan 24 2 4 NaCOCa(OH)CaCO2NaOH 2NaCl2HO 2NaOHHCl NaSOBa(OH)BaSO2NaOH Ví dụ 3: Cho các cặp chất với tỉ lệ số mol tương ứng như sau : (a) Fe3O4 và Cu (1:1)(b) Sn và Zn (2:1) (c) Zn và Cu (1:1) (d) Fe2(SO4)3 và Cu (1:1) (e) FeCl2 và Cu (2:1)(g) FeCl3 và Cu (1:1)
chế được NaOH là:
I, II và III.
II,
và VI. C. I, IV và V.
II,
và
(III), (VI).
hợp, mỗi hỗn
rắn có số mol bằng nhau: Na
, Cu và FeCl3, BaCl2 và CuSO4, Ba và NaHCO3. Số hỗn hợp có thể tan hoàn toàn trong nước (dư) chỉ tạo ra dung dịch là: A. 4. B. 2. C. 3. D. 1. Hướng dẫn giải Trong số 4 hỗn hợp trên, chỉ có một hỗn hợp có thể hòa tan hoàn toàn trong nước dư là Na2O và Al2O3. Phương trình phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 26
34 2 3 2 3 2 2 22 22 243 4 4 FeO8HClFeCl2FeCl4HO mol:1 2 (a) Cu2FeCl2FeClCuCl mol:12 Sn2HClSnClH (b) Zn2HClZnClH (d):Fe(SO)Cu2FeSOCuSO mol:11 Ví dụ 4:
2 2 23 22 NaOHO2NaOH mol:1 2 2NaOHAlONaAlOHO mol:21 Như vậy, dung dịch sau phản ứng chứa một muối tan là NaAlO2 3 hỗn hợp còn lại khi phản ứng với nước đều tạo ra kết tủa. 3 2 22FeClCu2FeClCuCl mol:21 Vì các chất trong hỗn hợp có số mol bằng nhau nên sau phản ứng Cu còn dư. 2 24 4 BaClNaSOBaSO2NaCl Phản ứng tạo thành kết tủa trắng BaSO4.
Số cặp chất tan hoàn toàn trong một lượng dư dung dịch HCl loãng nóng là A. 2. B. 4. C. 5. D. 3. Hướng dẫn giải Số cặp chất tan hoàn toàn trong một lượng dư dung dịch HCl loãng nóng là 3, gồm các cặp (a), (b), (d).
Cho bốn hỗn
hợp gồm hai chất
2O và Al2O3
Phản ứng tạo ra kết tủa trắng là BaCO3. Ví dụ 5: Thực hiện các thí nghiệm với hỗn hợp gồm Ag và Cu (hỗn hợp X) :
(a) Cho X vào bình chứa một lượng dư khí O3 (ở điều kiện thường).
(b) Cho X vào một lượng dư dung dịch HNO3 (đặc).
(c) Cho X vào một lượng dư dung dịch hỗn hợp gồm NaNO3 và HCl.
(d) Cho X vào một lượng dư dung dịch FeCl3.
Thí nghiệm mà Cu bị oxi hóa còn Ag không bị oxi hóa là : A. (a). B. (c). C. (d). D. (b).
Hướng dẫn giải Hỗn hợp X gồm Ag và Cu. Thí nghiệm mà Cu bị oxi hóa còn Ag không bị oxi hóa là (d) : Cho X vào một lượng dư dung dịch FeCl3. Phương trình phản ứng : 3
DẠYKÈMQUYNHƠN OFFICIAL 27
2 22 2 3 3 2 Ba2HOBa(OH)H Ba(OH)NaHCONaOHBaCOHO
Ở
o 3 2 2 3 2 t 2 2AgO2AgOO CuOCuOO 2CuO2CuO Ở thí nghiệm (b), cả Cu và Ag đều bị oxi hóa : 3 32 2 2 3 3 2 2 Cu4HNOCu(NO)2NO2HO Ag2HNOAgNONOHO Ở thí nghiệm (d), cả Cu và Ag đều bị oxi hóa : 2 3 2 3 2 3Cu8H2NO3Cu2NO4HO 3Ag4HNO3AgNO2HO Ví dụ 6: Thực hiện các thí nghiệm sau : (a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường. (b) Cho Fe3O4 vào dung dịch HCl loãng (dư). (c) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng (dư). (d) Hòa tan hết hỗn hợp Cu và Fe2O3 (có số mol bằng nhau) vào dung dịch H2SO4 loãng (dư). Trong các thí nghiệm trên, sau phản ứng, số thí nghiệm tạo ra hai muối là A. 1. B. 4. C. 2. D. 3.
2 22FeClCu2FeClCuCl
thí nghiệm (a), cả Ag và Cu đều bị oxi hóa :
số thí nghiệm tạo ra hai muối là 3. Ví dụ 7: Cho các phản ứng sau : a) FeO + HNO3 (đặc, nóng) b) FeS + H2SO4 (đặc, nóng) c) Al2O3 + HNO3 (đặc, nóng) d) Cu + dung dịch FeCl3 e) CH3CHO + H2 (Ni, to) f) glucozơ + AgNO3 trong dung dịch NH3 (to) g) C2H4 + Br2 h) glixerol (glixerin) + Cu(OH)2 Dãy gồm các phản ứng đều thuộc loại phản ứng oxi hóa - khử là : A. a, b, d, e, f, g. B. a, b, c, d, e, h. C. a, b, c, d, e, g. D. a, b, d, e, f, h.
Hướng
dẫn giải Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình oxi hóa và quá trình khử, làm thay đổi số oxi hóa của các nguyên tố tham gia phản ứng. Các phản ứng a, b, d, e, f, g thuộc loại phản ứng oxi hóa – khử. Sơ đồ phản ứng
DẠYKÈMQUYNHƠN OFFICIAL 28
Các thí nghiệm tạo ra hai muối là : 2 2 34 2 3 2 23 24 243 2 243 4 4 (a):Cl2NaOHNaClONaClHO (b):FeO8HClFeCl2FeCl4HO FeO3HSOFe(SO)3HO(d) Fe(SO)Cu2FeSOCuSO
Thí nghiệm còn lại chỉ tạo ra một muối : ot 34 24 243 2 2 2FeO10HSOñac3Fe(SO)SO10HO
Vậy
: o o o o 2 5 3 4 t 3ñac 33 2 2 22 6 3 4 t 2 24ñac 43 22 03 2 2 3 2 2 1 0 1 t,Ni 3 2 32 1 1 2 4 3 32 t 2 a.FeOHNO Fe(NO)NO2HO b.FeSHSO Fe(SO)SOHO d.CuFeClCuClFeCl e.CHCHOH CHCHOH f.CHOH(CHOH)CHOAgNONHHO CHOH( 3 0 4 4 43 2 0 1 1 2 24 242 CHOH)COONHAgNHNO g.CHBrCHBr Ví dụ tương tự :
Ví dụ 8: Để thu lấy Ag tinh khiết từ hỗn hợp X (gồm a mol Al2O3, b mol CuO, c mol Ag2O), người ta hoà tan X bởi dung dịch chứa (6a + 2b + 2c) mol HNO3 được dung dịch Y, sau đó thêm (giả thiết hiệu suất các phản ứng đều là 100%)
A. 2c mol bột Cu vào Y. B. c mol bột Cu vào Y. C. c mol bột Al vào Y. D. 2c mol bột Al vào Y.
Ví dụ 9: Cho dãy các chất: Al, Al(OH)3, Zn(OH)2, NaHCO3, Na2SO4. Số chất trong dãy vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH là
A. 2. B. 3. C. 4. D. 5.
Ví dụ 10: Hỗn hợp rắn X gồm Al, Fe2O3 và Cu có số mol bằng nhau. Hỗn hợp X tan hoàn toàn trong dung dịch
A. AgNO3 (dư). B. NaOH (dư). C. HCl (dư). D. NH3 (dư).
OFFICIAL
Ví dụ 11: Cho các dung dịch loãng : (1) FeCl3, (2) FeCl2, (3) H2SO4, (4) HNO3, (5) hỗn hợp gồm HCl và NaNO3. Những dung dịch phản ứng được với kim loại Cu là : A. (1), (3), (5). B. (1), (4), (5). C. (1), (2), (3). D. (1), (3), (4).
Ví dụ 12: Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH.
(c) Cho KMnO4 vào dung dịch HCl đặc, dư.
(d) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl dư.
(e) Cho CuO vào dung dịch HNO3.
(f) Cho KHS vào dung dịch NaOH vừa đủ. Số thí nghiệm thu được hai muối là
DẠYKÈMQUYNHƠN
29
A. 4. B. 6. C. 3. D. 5. (Đề thi THPT Quốc Gia, năm 2016) Ví dụ 13: Cho các chất khí sau: SO2; NO2; Cl2; N2O; H2S; CO2. Các chất khí khi phản ứng với NaOH ở nhiệt độ thường luôn cho hai muối là A. Cl2; NO2. B. SO2; CO2. C. SO2; CO2; H2S. D. CO2; Cl2; H2S. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 8B 9C 10C 11B 12A 13A 3. Xác định chất phản ứng và sản phẩm tạo thành Ví dụ 1: Khi cho hỗn hợp gồm MgSO4, Ba3(PO4)2, FeCO3, FeS, Ag2S vào dung dịch HCl dư thì phần không tan chứa những chất nào ? A. FeS, AgCl, Ba3(PO4)2. B. Ag2S, BaSO4.
Ví dụ 2: Cho Fe vào dung dịch AgNO3 dư, thu được dung dịch X. Sau đó ngâm Cu dư vào dung dịch X, thu được dung dịch Y. Dung dịch X, Y gồm :
A. X: Fe(NO3)3; Y: Fe(NO3)2 và Cu(NO3)2 B. X: Fe(NO3)2; Y: Fe(NO3)2; Cu(NO3)2 và AgNO3 dư. C. X: Fe(NO3)2 và AgNO3 dư; Y: Fe(NO3)2 và Cu(NO3)2 D. X: Fe(NO3)3 và AgNO3 dư ; Y: Fe(NO3)2 và Cu(NO3)2 Hướng dẫn giải Cho Fe tác dụng với dung dịch AgNO3 dư thì Fe bị AgNO3 oxi hóa lên Fe3+ Vậy dung dịch X gồm Fe(NO3)3 và AgNO3 dư. Cho Cu dư tác dụng với dung dịch X thì Cu sẽ khử hết Ag+ về Ag và Fe3+ về Fe2+ . Vậy dung dịch Y gồm Fe(NO3)2 và Cu(NO3)2.
DẠYKÈMQUYNHƠN OFFICIAL 30
342 2 34 2 4 4 2 Ba(PO)6HCl3BaCl2HPO BaClMgSOBaSOMgCl Các chất còn lại đều phản ứng với HCl tạo ra
tan : 3 2 2 2 22 FeCO2HClFeClCOHO FeS2HClFeClHS
C. FeS, AgCl, BaSO4 D. Ba3(PO4)2, Ag2S. Hướng dẫn giải Khi cho hỗn hợp gồm MgSO4, Ba3(PO4)2, FeCO3, FeS, Ag2S vào dung dịch HCl dư thì phần không tan chứa các chất Ag2S và BaSO4. Trong đó Ag2S không tan trong nước, còn BaSO4 sinh ra như sau:
muối
Sơ
phản ứng
33 3 ddX 32 32 ddY Ag Ag Cudö Fe Fe(NO) AgNO Cu(NO) Fe(NO) Ví dụ 3: Hoà tan hỗn hợp gồm : K2O, BaO, Al2O3, Fe3O4 vào nước (dư), thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là : A. Al(OH)3 B. Fe(OH)3 C. BaCO3 D. K2CO3. 3 ddAgNOdö Cudö
đồ
:
sử trong Y có thì do CO2 có dư nên xảy ra phản ứng : OH
COOHHCO
Do đó không thể có kết tủa BaCO3. Ví dụ 4: Hoà tan hoàn toàn hỗn hợp gồm MgO, Zn(OH)2, Al, FeCO3, Cu(OH)2, Fe trong dung dịch H2SO4 loãng dư, sau phản ứng thu được dung dịch X. Cho vào dung dịch X một lượng Ba(OH)2 dư thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi được hỗn hợp rắn Z, sau đó dẫn luồng khí CO dư (ở nhiệt độ cao) từ từ đi qua Z đến khi phản ứng xảy ra hoàn toàn thu được chất rắn G. Trong G chứa
DẠYKÈMQUYNHƠN OFFICIAL 31 Hướng dẫn giải Sơ đồ phản ứng : 2 34 2 2334 2 CO 3 2 FeO, ... KO,BaO AlO,FeO K,Ba,Al(OH) AlO,... Chất rắn Y có Fe3O4 và có thể còn Al2O3 chưa phản ứng hết. Dung dịch X có có Ba2+, K+, và có thể có . Sục CO2 dư vào X chỉ thu được kết tủa là 2AlO OH Al(OH)
2
A. MgO, BaSO4, Fe, Cu, ZnO. B. BaO, Fe, Cu, Mg, Al2O3 C. BaSO4, MgO, Zn, Fe, Cu. D. MgO, BaSO4, Fe, Cu. Hướng dẫn giải Sơ đồ phản ứng : 24 2 o 2 2 22 2 HSOloang Ba(OH)dö 22 2 3 3 2 2 4 2 4 X Y O,t 23 4 Mg(OH) MgO,Zn(OH) Mg,Fe Fe(OH) Al,FeCO Cu,Zn Cu(OH) Al,H,SO Cu(OH),Fe BaSO MgO,FeO CuO,BaSO oCO,t 4 G Z MgO,Fe Cu,BaSO
3. Phương trình phản ứng :
22 3 3AlOCOHOAl(OH)HCO
Giả
2 3
Vậy chất rắn G gồm MgO, BaSO4, Fe, Cu.
PS :
+ Zn(OH)2, Al(OH)3 là hiđroxit lưỡng tính nên tan hết trong dung dịch kiềm dư.
+ Fe(OH)2 bị oxi oxi hóa bởi oxi tạo ra Fe(OH)3
+ CO chỉ khử được các oxit kim loại từ Zn trở về cuối dãy.
+ BaSO4 là chất kết tủa rất bền với nhiệt.
Ví dụ 5: Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là : A. amoni nitrat. B. amophot. C. natri nitrat. D. urê.
Hướng dẫn giải
OFFICIAL
Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Suy ra X có chứa ion âm. 3NO X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Suy ra X chứa ion dương 4NH
Vậy X là NH4NO3 (amoni nitrat). Phương trình phản ứng :
DẠYKÈMQUYNHƠN
32
2 3 2 2 2 khongmau maunau 4 3 2 muikhai 3Cu8H2NO3Cu2NO4HO 2NOO2NO NHOHNHHO Ví dụ 6: Cho sơ đồ biến hóa sau : X A(mïitrøngthèi) X+D B Y+Z E A+G +H2 +B +O2,to +Fe +YhoÆcZ +D,Br2 Trong các phản ứng trên có bao nhiêu phản ứng oxi hóa - khử ? A. 6. B. 5. C. 3. D. 4. Hướng dẫn giải Khí A có mùi trứng thối, chứng tỏ A là H2S. Từ đó suy ra : X là S, B là SO2, E là FeS, D là H2O, Y là HBr, Z là H2SO4, G là H2O.
Hướng dẫn giải Dựa vào sơ đồ phản ứng điện phân, ta thấy X2 là dung dịch kiềm. Dựa vào sơ đồ phản ứng còn lại, ta thấy X2, X4 là hợp chất của K và Ba. Vậy hai chất X2, X4 lần lượt là KOH, Ba(HCO3)2. Phương trình phản ứng minh họa :
khi đun nóng được chất rắn Y. Cho Y vào dung dịch HCl dư, khuấy kĩ, sau đó lấy dung dịch thu được cho tác dụng với dung dịch NaOH loãng, dư. Lọc lấy kết tủa tạo thành đem nung trong không khí đến khối lượng không đổi thu được chất rắn Z. Biết các phản ứng xảy ra hoàn toàn. Thành phần của Z gồm : A. Fe2O3, CuO, Ag. B. Fe2O3, Al2O3. C. Fe2O3, CuO. D. Fe2O3, CuO, Ag2O.
DẠYKÈMQUYNHƠN OFFICIAL 33 Phương trình phản ứng : o o o 00 2 t 22 00 4 t 2 2 0022 t 4 20 22 2 40 6 1 22224 22 SHHS SOSO SFeFeS SO2HS3S2HO SOBr2HOHSO2HBr FeS2HBrFeBrHS Vậy có 5 phản ứng là thuộc loại phản ứng oxi hóa – khử. Ví dụ 7: Cho các phản ứng xảy ra theo sơ đồ sau: X1 + H2O X2 + X3 + H2 ñienphan comangngan X2 + X4 BaCO3 + K2CO3 + H2O Hai chất X2, X4 lần
lượt là : A. KHCO3, Ba(OH)2. B. NaHCO3, Ba(OH)2. C. NaOH, Ba(HCO3)2. D. KOH, Ba(HCO3)2.
2
comangngan 32 3 23 2 2KCl2HO 2KOHClH 2KOHBa(HCO)BaCOKCO2HO Ví dụ tương tự : Ví dụ 8: Cho Fe tác dụng với dung dịch H2SO4 loãng tạo thành khí X; nhiệt phân tinh thể KNO3 tạo thành khí Y; cho tinh thể KMnO4 tác dụng với dung dịch HCl đặc tạo thành khí Z. Các khí X, Y và Z lần lượt là A. SO2, O2 và Cl2. B. Cl2, O2 và H2S. C. H2, O2 và Cl2. D. H2, NO2 và Cl2 Ví dụ 9: Cho hỗn hợp X gồm Cu, Ag, Fe, Al tác dụng với oxi
ñienphandungdòch
2 2
dư
Ví dụ 10: Hòa tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là
A. hỗn hợp gồm BaSO4 và Fe2O3.
B. hỗn hợp gồm BaSO4 và FeO.
C. hỗn hợp gồm Al2O3 và Fe2O3.
D. Fe2O3. Ví dụ 11: Cho chất vô cơ X tác dụng với một lượng vừa đủ dung dịch KOH, đun nóng, thu được khí X1 và dung dịch X2. Khí X1 tác dụng với một lượng vừa đủ CuO nung nóng, thu được khí X3, H2O, Cu. Cô cạn dung dịch X2 được chất rắn khan X4 (không chứa clo). Nung X4 thấy sinh ra khí X5 (M = 32 đvC). Nhiệt phân X thu được khí X6 (M = 44 đvC) và nước. Các chất X1, X3, X4, X5, X6 lần lượt là: A. NH3; NO; KNO3; O2; CO2.
OFFICIAL
B. NH3; N2; KNO3; O2; N2O. C. NH3; N2; KNO3; O2; CO2. D. NH3; NO; K2CO3; CO2; O2.
Ví dụ 12: Các dung dịch riêng biệt : Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau:
Dung dịch (1) (2) (4) (5) (1) khí thoát ra có kết tủa (2) khí thoát ra có kết tủa có kết tủa (4) có kết tủa có kết tủa (5) có kết tủa Các dung dịch (1), (3), (5) lần lượt là: A. H2SO4, NaOH, MgCl2. B. Na2CO3, NaOH, BaCl2. C. H2SO4, MgCl2, BaCl2. D. Na2CO3, BaCl2, BaCl2. (Đề
DẠYKÈMQUYNHƠN
34
thi thử THPT Quốc Gia lần 1 – Sở Giáo Dục và Đào Tạo Vĩnh Phúc, năm
Ví dụ 13: Cho sơ đồ phản ứng sau: R + 2HCl(loãng) RCl2 + H2 to 2R + 3Cl2 2RCl3 to R(OH)3 + NaOH(loãng) NaRO2 + 2H2O Kim loại R là A. Cr. B. Al. C. Mg. D. Fe. (Đề thi tuyển sinh Đại học khối B, năm 2014) ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 8C 9C 10A 11B 12A 13A
2016)
B. CÂU HỎI VẬN DỤNG
I. Phản ứng tạo ra đơn chất (kim loại, phi kim)
Câu 1: Trường hợp nào sau không tạo ra đơn chất?
A. Sục khí F2 vào dung dịch H2SO4 (loãng).
B. Cho khí NH3 đi qua CuO nung nóng.
C. Sục khí HI vào dung dịch FeCl3.
D. Cho dung dịch FeCl3 vào dung dịch AgNO3. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Biên Hòa – Hà Nam, năm 2016)
Câu 2: Thực hiện các thí nghiệm sau:
(1) Cho kim loại Mg tới dư vào dung dịch FeCl3.
(2) Cho kim loại Na vào dung dịch CuSO4 dư.
(3) Cho AgNO3 vào dung dịch Fe(NO3)2.
(4) Nhiệt phân AgNO3.
(5) Cho khí CO đi qua ống đựng bột Al2O3 nung nóng. Thí nghiệm thu được kim loại khi kết thúc phản ứng là
A. (1), (2), (3), (4). B. (1), (3), (4), (5). C. (2), (5). D. (1), (3), (4). (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Hạ Long – Quảng Ninh, năm 2016)
Câu 3: Tiến hành các thí nghiệm sau :
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Sục khí Cl2 vào dung dịch FeCl2
(c) Dẫn khí H2 dư qua bột CuO nung nóng.
(d) Cho Na vào dung dịch CuSO4 dư.
(e) Nhiệt phân AgNO3
(g) Đốt FeS2 trong không khí.
(h) Điện phân dung dịch CuSO4 với điện cực trơ.
Sau khi kết thúc phản ứng, số thí nghiệm thu được kim loại là A. 5. B. 2. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lam Sơn – Thanh Hóa, năm 2016)
Câu 4: Tiến hành các thí nghiệm sau :
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Dẫn khí H2 dư qua bột MgO nung nóng.
(c) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư.
(d) Cho Na vào dung dịch MgSO4.
DẠYKÈMQUYNHƠN
35
OFFICIAL
(e) Nhiệt phân Hg(NO3)2.
(g) Đốt Ag2S trong không khí
Số thí nghiệm không tạo thành kim loại là :
A. 2. B. 5. C. 3. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Trực Ninh – Nam Định, năm 2016)
Câu 5: Tiến hành các thí nghiệm sau :
(a) Cho NH4Cl tác dụng với NaOH.
(b) Cho NH3 tác dụng với O2 dư ở nhiệt độ cao.
(c) Nhiệt phân Cu(NO3)2.
(d) Cho HCl tác dụng với dung dịch KMnO4.
(e) Sục khí CO2 qua nước vôi trong dư.
(f) Điện phân dung dịch CuCl2 với điện cực trơ.
(g) Dẫn khí CO dư qua bột MgO nung nóng.
OFFICIAL
Sau khi phản ứng kết thúc, số thí nghiệm thu được đơn chất là ?
A. 5. B. 6. C. 4. D. 7. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Biên Hòa – Hà Nam, năm 2016) Câu 6: Tiến hành các thí nghiệm sau ở điều kiện thích hợp :
(a) Sục khí SO2 vào dung dịch H2S.
(b) Sục khí F2 vào nước.
(c) Cho KMnO4 vào dung dịch NaOH đặc.
(d) Sục khí CO2 vào dung dịch NaOH.
(e) Cho Si vào dung dịch NaOH đặc. (g) Cho Na2SO3 vào dung dịch H2SO4. Số thí nghiệm sinh ra đơn chất là ? A. 5. B. 4. C. 3. D. 6. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lam Sơn – Thanh Hóa, năm 2016)
Câu 7: Cho các phản ứng: (1) dung dịch FeCl3 + Cu; (2) Hg + S; (3) F2 + H2O; (4) MnO2 + HCl đặc; (5) K + H2O; (6) H2S + O2 dư (to); (7) SO2 + dung dịch Br2; (8) Mg + dung dịch
DẠYKÈMQUYNHƠN
36
HCl. Trong các phản ứng trên, số phản ứng tạo đơn chất là: A. 5.B. 3. C. 6 D. 4. (Đề thi thử THPT Quốc Gia lần 3 – THPT Quỳnh Lưu 1 – Nghệ An, năm 2016) Câu 8: Trong các thí nghiệm sau: (1) Cho SiO2 tác dụng với axit HF. (2) Cho khí SO2 tác dụng với khí H2S. (3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
Số thí nghiệm tạo ra đơn chất là
A. 4. B. 6. C. 3. D. 5. (Đề thi thử THPT Quốc Gia lần 2 – THPT Tĩnh Gia – Thanh Hóa, năm 2016)
Câu 9: Cho các phản ứng sau?
(a) C + H2O (hơi) (b) Si + dung dịch NaOH ot
(c) FeO + CO (d) O3 + Ag ot
(e) Hg(NO3)2 (f) KMnO4 ot ot
(g) F2 + H2O
(h) H2S + SO2 ot Số phản ứng sinh ra đơn chất là
OFFICIAL
A. 7. B. 5. C. 8. D. 6.
Câu 10: Tiến hành các thí nghiệm sau :
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Sục khí Cl2 vào dung dịch CuSO4 dư.
(c) Dẫn khí CO dư qua bột CuO nung nóng.
(d) Cho Ba vào dung dịch CuSO4 dư.
(e) Nung hỗn hợp Cu(OH)2 và (NH4)2CO3.
(g) Đốt FeS2 trong không khí. Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là :
A. 4. B. 5. C. 3. D. 2. (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên KHTN Hà Nội, năm 2016) II. Phản ứng tạo kết tủa, tạo khí 1. Phản ứng tạo kết tủa Câu 1: Trường hợp nào dưới đây không thu được kết tủa sau khi phản ứng
DẠYKÈMQUYNHƠN
37
xảy ra hoàn toàn? A. Sục CO2 vào lượng dư dung dịch Ca(OH)2 B. Sục khí CO2 dư vào dung dịch NaAlO2 C. Cho kim loại Cu vào lượng dư dung dịch Fe2(SO4)3 D. Cho dung dịch
thi
AlCl3 dư vào dung dịch NaOH. (Đề
thử THPT Quốc Gia lần 1 – THPT chuyên Tuyên Quang, năm 2016) Câu 2: Nhỏ từ từ đến dư dung dịch NaOH loãng vào mỗi dung dịch sau: FeCl3, CrCl3, AlCl3, MgSO4. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp thu được kết tủa là A. 1. B. 2. C. 3. D. 4.
(Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lê Quý Đôn – Đà Nẵng, năm 2016)
Câu 3: Nhỏ từ từ đến dư dung dịch NaOH loãng vào mỗi dung dịch sau: FeCl3, CuCl2, AlCl3, FeSO4, BaCl2. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp thu được kết tủa là : A. 5. B. 3. C. 2. D. 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phú Nhuận – TP. HCM, năm 2016)
Câu 4: Cho dung dịch AgNO3 lần lượt vào các dung dịch : HCl; HF; Na3PO4; Fe(NO3)2; FeCl2. Sau khi các phản ứng hoàn toàn, số trường hợp có tạo kết tủa là : A. 3. B. 5. C. 2. D. 4. (Đề thi thử THPT Quốc Gia lần 5 – THPT chuyên KHTN Hà Nội, năm 2016)
Câu 5: Có các thí nghiệm sau
(a) Cho kim loại Na vào dung dịch CuSO4.
(b) Sục CO2 đến dư vào dung dịch Ca(OH)2.
OFFICIAL
(c) Cho từ từ dung dịch NaOH đến dư vào dung dịch Al2(SO4)3.
(d) Cho từ từ dung dịch NaOH đến dư vào dung dịch FeCl3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
A. 5. B. 3. C. 2. D. 4. (Đề thi thử THPT Quốc Gia – Sở GD và ĐT Đồng Tháp, năm 2016)
Câu 6: Cho các thí nghiệm sau :
(1) Đun nóng nước cứng tạm thời.
(2) Cho phèn chua vào dung dịch Ba(OH)2 dư.
(3) Cho dung dịch NaOH dư vào dung dịch AlCl3.
(4) Cho khí CO2 dư vào dung dịch NaAlO2.
(5) Cho khí NH3 dư vào dung dịch AlCl3.
Số thí nghiệm thu được kết tủa là?
A. 4. B. 3. C. 2. D. 5. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Bến Tre, năm 2016)
Câu 7: Thực hiện các phản ứng hóa học sau :
(a) Đun nóng dung dịch hỗn hợp stiren và thuốc tím.
(b) Sục khí CO2 dư vào dung dịch Ba(OH)2.
(c) Cho khí hidroclorua vào dung dịch natri silicat.
(d) Sục khí CO2 dư vào dung dịch kali aluminat.
(e) Sục khí H2S dư vào dung dịch muối sắt(II) sunfat.
Số trường hợp thí nghiệm thu được kết tủa khi kết thúc phản ứng là :
A. 5. B. 2. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên KHTN Hà Nội, năm 2016)
DẠYKÈMQUYNHƠN
38
Câu 8: Tiến hành các thí nghiệm sau:
(a) Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
(b) Sục khí CO2 dư vào dung dịch NaAlO2.
(c) Cho dung dịch NaF vào dung dịch AgNO3.
(d) Sục khí NH3 dư vào dung dịch AlCl3.
(e) Cho hỗn hợp Al4C3 và CaC2 (tỉ lệ mol 1: 2) vào nước dư.
(g) Sục khí SO2 vào dung dịch H2S.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là A. 3. B. 6. C. 5. D. 4. (Đề thi thử THPT Quốc Gia lần 3 – THPT Lý Thái Tổ – Bắc Ninh, năm 2016)
Câu 9: Tiến hành các thí nghiệm sau:
(1) Cho dung dịch Ba(OH)2 dư vào dung dịch Cr2(SO4)3.
(2) Sục khí CO2 dư vào dung dịch Na[Al(OH)4] hoặc NaAlO2.
(3) Cho dung dịch NaF vào dung dịch AgNO3.
(4) Sục khí NH3 dư vào dung dịch FeCl2.
(5) Cho Na2SiO3 vào dung dịch HCl.
(6) Sục khí SO2 vào dung dịch H2S.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
A. 5. B. 4. C. 3. D. 6. (Đề thi thử THPT Quốc Gia lần 1 – THPT Thuận Thành 3 – Bắc Ninh, năm 2016)
Câu 10: Có các dung dịch riêng biệt sau: NaCl, AgNO3, Pb(NO3)2, NH4NO3, ZnCl2, CaCl2, CuSO4, FeCl2, FeCl3, AlCl3. Cho dung dịch Na2S vào các dung dịch trên, số trường hợp sinh ra kết tủa là A. 5 B. 6. C. 7. D. 8 (Đề thi thử THPT Quốc Gia lần 1 – THPT Yên Định 2 – Thanh Hóa, năm 2016) Câu 11: Tiến hành các thí nghiệm sau:
dịch NH3 đến dư vào dung dịch Al2(SO4)3
(6) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3 Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là:
A. 3. B. 6. C. 4 D. 5. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Thái Bình, năm 2016)
Câu 12: Tiến hành các thí nghiệm sau :
(1) Cho dung dịch NH3 dư vào dung dịch AgNO3
DẠYKÈMQUYNHƠN
39
OFFICIAL
(1) Sục khí H2S vào dung dịch ZnSO4 (2) Sục khí H2S vào dung dịch CuSO4 (3) Sục khí CO2 (dư) vào dung dịch Na2SiO3 (4) Sục khí CO2 (dư) vào dung dịch Ca(OH)2 (5) Nhỏ từ từ dung
(2) Sục khí SO2 vào dung dịch H2S.
(3) Cho dung dịch AgNO3 vào dung dịch H3PO4.
(4) Cho dung dịch AgNO3 vào dung dịch HCl.
(5) Cho dung dịch NaOH dư vào dung dịch AlCl3.
Sau khi kết thúc thí nghiệm, số trường hợp tạo thành kết tủa là :
A. 5. B. 2. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 2 – THPT Đồng Đậu – Vĩnh Phúc, năm 2016)
Câu 13: Tiến hành các thí nghiệm sau:
(a) Cho dung dịch Na2S2O3 vào dung dịch H2SO4 loãng.
(b) Sục khí CO2 vào dung dịch Na2SiO3.
(c) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
(d) Dẫn khí etilen qua dung dịch KMnO4.
(e) Cho Al4C3 vào dung dịch NaOH dư.
Sau khi thí nghiệm kết thúc, số trường hợp thu được kết tủa là
A. 2. B. 4. C. 3. D. 5.
Câu 14: Cho các thí nghiệm sau :
(a) Sục khí CO2 dư vào dung dịch natri aluminat.
(b) Cho dung dịch NaHCO3 vào dung dịch BaCl2.
(c) Cho dung dịch HCl dư vào dung dịch natri aluminat.
(d) Dung dịch NaOH dư vào dung dịch AlCl3.
(e) Dung dịch NaOH dư vào dung dịch Ba(HCO3)2.
(g) Sục khí H2S vào dung dịch FeSO4.
(h) Cho NH3 dư vào dung dịch AlCl3.
(i) Sục CO2 dư vào dung dịch Ca(OH)2.
(k) Cho AgNO3 vào dung dịch Fe(NO3)2 dư.
(l) Sục khí H2S vào dung dịch AgNO3. Số thí nghiệm thu được kết tủa sau phản ứng là :
A. 5. B. 7. C. 8. D. 6.
Câu 15: Tiến hành các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HCl.
(b) Cho Al2O3 vào dung dịch NaOH loãng dư.
(c) Cho Cu vào dung dịch HCl đặc, nóng dư.
(d) Cho Ba(OH)2 vào dung dịch KHCO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được chất rắn là
A. 2. B. 1. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Hà Giang, năm 2016)
DẠYKÈMQUYNHƠN
40
OFFICIAL
Câu 16: Cho các cặp dung dịch loãng:
(1) NaAlO2 dư và HCl; (2) FeCl2 và H2S; (3) Ca(OH)2 và NaHCO3; (4) H2SO4 và Ba(NO3)2; (5) Fe(NO3)2 và HCl; (6) FeCl3 và K2CO3; (7) H2S và Cl2; (8) AlCl3 và CH3NH2 Số cặp các chất khi trộn lẫn với nhau không có kết tủa tách ra là
A. 1. B. 2. C. 3 D. 4.
2. Phản ứng tạo khí
Câu 17: Có các thí nghiệm sau được thực hiện ở nhiệt độ thường:
(a) Cho Be vào H2O.
(b) Sục khí F2 vào H2O.
(c) Cho bột Si vào dung dịch NaOH.
(d) Cho bột Al vào dung dịch NaOH.
(e) Cho Sn vào dung dịch HCl.
(f) Nhỏ dung dịch HCl đặc vào dung dịch KMnO4
Số thí nghiệm sinh ra khí H2 sau phản ứng là
A. 5. B. 3 C. 2. D. 4.
Câu 18: Cho phương trình hóa học của các phản ứng sau :
(1) (NH4)2Cr2O7 ot
(2) AgNO3 ot
(3) Cu(NO3)2 ot
(4) CuO + NH3 (kh) ot
(5) CrO3 + NH3 (kh) ot Có bao nhiêu phản ứng sản phẩm sinh ra cho khí N2 ? A. 5. B. 2. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Hà Giang, năm 2016)
Câu 19: Thực hiện các thí nghiệm sau :
(a) Nung AgNO3 rắn.
(b) Đun nóng NaCl tinh thể với H2SO4 (đặc).
(c) Hòa tan Ure trong dung dịch HCl.
(d) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(e) Hòa tan Si trong dung dịch NaOH.
(f) Nung Na2CO3 (rắn).
(g) Cho Na2S2O3 vào dung dịch HCl.
Số thí nghiệm tạo ra chất khí là :
A. 5. B. 6. C. 3. D.7. (Đề thi thử THPT Quốc Gia lần 5 – THPT chuyên KHTN Hà Nội, năm 2016)
DẠYKÈMQUYNHƠN
41
OFFICIAL
Câu 20: Thực hiện các thí nghiệm sau:
(a) Cho đồng kim loại vào dung dịch HNO3 đặc, nguội.
(b) Cho PbS vào dung dịch H2SO4 loãng.
(c) Đun nhẹ dung dịch Ca(HCO3)2.
(d) Cho mẩu nhôm vào dung dịch Ba(OH)2.
(e) Cho dung dịch H2SO4 đặc tác dụng với muối NaNO3 (rắn), đun nóng.
(f) Cho Si tác dụng với dung dịch KOH loãng. Số thí nghiệm tạo ra chất khí là A. 5. B. 3. C. 4. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực – Thái Bình, năm 2016)
III. Xác định khả năng xảy ra phản ứng
Câu 1: Thực hiện các thí nghiệm sau ở điều kiện thường:
(a) Sục khí H2S vào dung dịch AgNO3.
(b) Cho CaCO3 vào H2O.
(c) Cho SiO2 vào dung dịch HF.
(d) Sục khí Cl2 vào dung dịch KOH.
Số thí nghiệm xảy ra phản ứng là
A. 3. B. 4. C. 2. D. 1. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Biên Hòa – Hà Nam, năm 2016)
Câu 2: Tiến hành các thí nghiệm sau:
(a) Cho Ca vào dung dịch CuSO4.
(b) Dẫn khí H2 qua Al2O3 nung nóng.
(c) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(d) Cho Cr vào dung dịch KOH đặc, nóng. Số thí nghiệm xảy ra phản ứng là
A. 3. B. 2. C. 1. D. 4.
Câu 3: Thực hiện các thí nghiệm sau ở điều kiện thường:
(a) Sục khí H2S vào dung dịch NaOH.
(b) Cho NaCl vào dung dịch KNO3.
(c) Cho Na2CO3 vào dung dịch HCl.
(d) Cho dung dịch CuSO4 vào dung dịch Ba(OH)2.
Số thí nghiệm xảy ra phản ứng là
A. 1. B. 3. C. 4. D. 2. (Đề thi thử THPT Quốc Gia lần 2 – THPT Tĩnh Gia – Thanh Hóa, năm 2016)
Câu 4: Cho các cặp dung dịch sau:
DẠYKÈMQUYNHƠN
42
OFFICIAL
(1) Na2CO3 và AlCl3; (2) NaNO3 và FeCl2; (3) HCl và Fe(NO3)2; (4) NaHCO3 và BaCl2; (5) NaHCO3 và NaHSO4. Hãy cho biết cặp nào xảy ra phản ứng khi trộn các chất trong các cặp đó với nhau (nhiệt độ thường)?
A. (3), (2), (5). B. (1), (3), (4). C. (1), (3), (5) D. (1), (4), (5). (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Thái Bình, năm 2016) Câu 5: Tiến hành các thí nghiệm sau:
(a) Dẫn khí Cl2 vào dung dịch H2S.
(b) Cho dung dịch Ca(HCO3)2 vào dung dịch NaOH.
(c) Cho dung dịch Na3PO4 vào dung dịch AgNO3.
(d) Cho CuS vào dung dịch HCl.
(e) Cho Cu vào dung dịch chứa HCl và NaNO3.
(g) Cho AgNO3 vào dung dịch NaF.
Số thí nghiệm có xảy ra phản ứng ở điều kiện thường là
OFFICIAL
A. 2. B. 5. C. 3. D. 4.
Câu 6: Thực hiện các thí nghiệm sau ở điều kiện thường:
(a) Cho Fe tác dụng với dung dịch axit sunfuric đặc.
(b) Cho ure (NH2)2CO tác dụng với H2O.
(c) Sục khí SO2 vào dung dịch Br2.
(d) Cho Na2CO3 vào dung dịch HCl.
Số thí nghiệm xảy ra phản ứng là A. 2. B. 3. C. 4. D. 1. (Đề thi thử THPT Quốc Gia lần 2 – THPT Quỳnh Lưu 1 – Nghệ An, năm 2016)
Câu 7: Thực hiện các thí nghiệm sau:
(a) Cho Al vào dung dịch HCl.
(b) Cho Al vào dung dịch AgNO3.
(c) Cho Na vào H2O.
(d) Cho Ag vào dung dịch H2SO4 loãng.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Số thí nghiệm xảy ra phản ứng là : A. 5. B. 3. C. 4. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phú Nhuận – TP. HCM, năm 2016)
Câu 8: Cho các cặp chất sau :
(a) Dung dịch FeCl3 và dung dịch AgNO3.
(b) Cu và dung dịch FeSO4.
(c) F2 và H2O.
(d) Cl2 và dung dịch KOH.
(e) H2S và dung dịch Cl2.
DẠYKÈMQUYNHƠN
43
(f) H2SO4 loãng và dung dịch NaCl.
Số cặp chất có phản ứng ở điều kiện thường là :
A. 5. B. 6. C. 3. D. 4. (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên KHTN Hà Nội, năm 2016)
Câu 9: Cho các cặp chất sau:
(1) Khí Br2 và khí O2.
(2) Khí H2S và dung dịch FeCl3.
(3) Khí H2S và dung dịch Pb(NO3)2.
(4) CuS và dung dịch HCl.
(5) Dung dịch AgNO3 và dung dịch Fe(NO3)2.
(6) Dung dịch KMnO4 và khí SO2.
(7) Hg và S.
(8) Khí Cl2 và dung dịch NaOH. Số cặp chất xảy ra phản ứng hóa học ở nhiệt độ thường là
OFFICIAL
A. 8. B. 6. C. 7. D. 5.
Câu 10: Cho hỗn hợp X gồm Cu và Fe3O4 vào lượng dư dung dịch H2SO4 loãng. Kết thúc các phản ứng thu được dung dịch Y và chất rắn Z. Dãy chỉ gồm các chất mà khi cho chúng tác dụng lần lượt với dung dịch Y thì đều có phản ứng oxi hóakhử xảy ra là
A. KMnO4, NaNO3, Fe, Cl2.
B. Fe2O3, K2MnO4, K2Cr2O7, HNO3.
C. BaCl2, Mg, SO2, KMnO4.
D. NH4NO3, Mg(NO3)2, KCl, Cu. IV. Các dạng câu hỏi tổng hợp khác
1. Chọn số ý đúng
Câu 1: Trong các phát biểu sau :
(1) Theo chiều tăng dần điện tích hạt nhân, các kim loại kiềm thổ (từ Be đến Ba) có nhiệt độ nóng chảy giảm dần.
(2) Kim loại Cs được dùng để chế tạo tế bào quang điện.
(3) Kim loại Mg có kiểu mạng tinh thể lập phương tâm diện.
(4) Các kim loại Na, Ba, Be đều tác dụng với nước ở nhiệt độ thường.
(5) Kim loại Mg tác dụng với hơi nước ở nhiệt độ cao.
Số nhận xét đúng là
A. 1. B. 3. C. 4. D. 2.
Câu 2: Cho các phát biểu sau:
(a) Trong bảng tuần hoàn các nguyên tố hóa học, crom thuộc nhóm VIIIB.
(b) Crom không tác dụng với dung dịch axit HNO3 và H2SO4 đặc nguội.
(c) Khi thêm dung dịch kiềm vào muối cromat sẽ tạo thành đicromat.
(d) Trong môi trường axit, muối crom(VI) bị khử thành muối crom(III).
DẠYKÈMQUYNHƠN
44
(e) CrO là oxit bazơ, Cr2O3 là oxit lưỡng tính, CrO3 là oxit axit.
(g) CuO nung nóng khi tác dụng với NH3 hoặc CO đều thu được Cu.
(h) Lưu huỳnh, photpho, ancol etylic đều bốc cháy khi tiếp xúc với CrO3. Số phát biểu đúng là
A. 5. B. 6. C. 4. D. 7. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Quốc Học Huế, năm 2016)
2. Phản ứng thỏa mãn điều kiện cho trước
Câu 3: Cho dãy các chất: Ca3(PO4)2, BaSO4, KNO3, CuO, Cr(OH)3, AgCl và BaCO3. Số chất trong dãy không tan trong dung dịch HNO3 loãng là
A. 1. B. 2. C. 4. D. 3. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Thoại Ngọc Hầu – An Giang, năm 2016)
Câu 4: Thực hiện các thí nghiệm sau:
(1) Cho dung dịch NaCl vào dung dịch Ba(OH)2
(2) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2
OFFICIAL
(3) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn.
(4) Cho Cu(OH)2 vào dung dịch Na2SO4
(5) Cho từ từ dung dịch HCl vào dung dịch Na2CO3 Số thí nghiệm đều tạo ra được NaOH là: A. 3. B. 4. C. 1. D. 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Thuận Thành 3 – Bắc Ninh, năm 2016)
Câu 5: Thực hiện các thí nghiệm sau:
(a) Đốt dây sắt trong khí clo dư.
(b) Đốt nóng hỗn hợp bột Fe và S (không có oxi).
(c) Cho FeO vào dung dịch HNO3 loãng (dư).
(d) Cho Fe vào dung dịch AgNO3 dư.
(e) Cho Fe3O4 vào dung dịch H2SO4 loãng (dư).
(f) Cho dung dịch Fe(NO3)2 vào dung dịch HCl.
(g) Cho Fe3O4 vào dung dịch HI (dư).
Trong các thí nghiệm trên, số thí nghiệm tạo ra muối Fe(III) là A. 6. B. 3. C. 4. D. 5 (Đề thi thử THPT Quốc Gia lần 1 – THPT Yên Định 2 – Thanh Hóa, năm 2016)
Câu 6: Trong các phản ứng sau: (a) Nhiệt phân KClO3 có xúc tác MnO2; (b) nhiệt phân CaCO3; (c) nhiệt phân KMnO4; (d) nhiệt phân NH4NO3; (e) nhiệt phân AgNO3, có bao nhiêu phản ứng là phản ứng oxi hóa – khử nội phân tử ?
A. 2. B. 3. C. 4. D. 5. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Lam Sơn – Thanh Hóa, năm 2016)
DẠYKÈMQUYNHƠN
45
Câu 7: Thực hiện các thí nghiệm sau :
(1) Sục khí SO2 vào dung dịch KMnO4.
(2) Sục khí Cl2 vào dung dịch H2S.
(3) Sục hỗn hợp khí thu được khi nhiệt phân Cu(NO3)2 vào nước.
(4) Cho Na2CO3 vào dung dịch AlCl3.
(5) Cho HCl vào dung dịch Fe(NO3)2.
(6) Cho Fe2O3 vào dung dịch HI. Số thí nghiệm có phản ứng oxi hóa – khử xảy ra là : A. 3. B. 5. C. 6. D. 4. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Hạ Long – Quảng Ninh, năm 2016)
Câu 8: Thực hiện các thí nghiệm sau ở điều kiện thường
(a) Sục khí H2S vào dung dịch NaOH.
(b) Cho kim loại Na và nước.
(c) Sục khí Cl2 vào dung dịch Ca(OH)2.
(d) Trộn dung dịch NH4Cl với dung dịch NaOH.
(e) Cho bột Zn vào dung dịch HNO3.
(f) Trộn dung dịch FeCl2 với dung dịch AgNO3 dư. Số thí nghiệm xảy ra phản ứng oxi hóa – khử là : A. 3. B. 4. C. 2. D. 5. (Đề thi thử THPT Quốc Gia – Sở GD và ĐT Nam Định, năm 2016)
Câu 9: Cho các thí nghiệm sau:
(1) Sục Cl2 vào dung dịch NaOH.
(2) Sục CO2 vào dung dịch clorua vôi.
(3) Sục O3 vào dung dịch KI.
(4) Cho AgNO3 dư vào dung dịch FeCl2.
(5) Cho Cu vào dung dịch FeCl3.
(6) Cho dung dịch H2SO4 đặc nóng vào NaBr tinh thể. Số trường hợp xảy ra phản ứng oxi hóa – khử là:
A. 4. B. 3. C. 6. D. 5. (Đề thi thử THPT Quốc Gia lần 1 – THPT Thuận Thành 3 – Bắc Ninh, năm 2016) Câu 10: Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Sục khí Cl2 dư vào dung dịch FeSO4.
(c) Cho hỗn hợp KHSO4 và KHCO3 (tỉ lệ 1: 1) vào nước.
(d) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ 1 : 1) vào dung dịch HCl dư.
(e) Cho hỗn hợp Fe(NO3)2 và AgNO3 (tỉ lệ 1 : 1) vào nước.
DẠYKÈMQUYNHƠN
46
OFFICIAL
Sau khi các phản ứng kết thúc, số thí nghiệm thu được hai muối là
A. 2. B. 4. C. 5. D. 3. (Đề thi thử THPT Quốc Gia – Sở GD và ĐT Nam Định, năm 2016)
Câu 11: Thực hiện các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Cho Fe3O4 vào dung dịch HCl loãng (dư).
(c) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng (dư).
(d) Hòa tan hết hỗn hợp Cu và Fe2O3 (có số mol bằng nhau) vào dung dịch H2SO4 loãng (dư).
Trong các thí nghiệm trên, sau phản ứng, số thí nghiệm tạo ra hai muối là
A. 2. B. 4. C. 1. D. 3. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Hạ Long – Quảng Ninh, năm 2016)
OFFICIAL
Câu 12: Cho các phản ứng:
(a) Cl2 + NaOH; (b) Fe3O4 + HCl; (c) KMnO4 + HCl; (d) FeO + HCl; (e) CuO + HNO3; (f) KHS + KOH. Số phản ứng tạo ra hai muối là A. 5. B. 3 C. 4. D. 2. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Thoại Ngọc Hầu – An Giang, năm 2016)
Câu 13: Cho các phản ứng:
(a) Fe3O4 + HNO3 dư; (b) NO2 + NaOH dư; (c) Ca(HCO3)2 + NaOH dư; (d) CO2 + Ca(OH)2 dư; (e) Cl2 + KOH dư; (g) Cu + Fe2(SO4)3 dư. Số phản ứng thu được hỗn hợp 2 muối là A. 3. B. 4. C. 5. D. 6. 3. Xác định chất phản ứng và sản phẩm tạo thành
Câu 14: Cho hỗn hợp X gồm Fe2O3 và ZnO, Cu tác dụng với dung dịch HCl (dư) thu được dung dịch Y và phần không tan Z. Cho Y tác dụng với dung dịch NaOH (loãng, dư) thu được kết tủa gồm:
A. Fe(OH)2 và Cu(OH)2. B. Fe(OH)2; Cu(OH)2 và Zn(OH)2. C. Fe(OH)3. D. Fe(OH)3 và Zn(OH)2. Câu 15: Hoà tan hoàn toàn FeS2 vào cốc chứa dung dịch HNO3 loãng được dung dịch X và khí NO thoát ra. Thêm bột Cu dư và axit sunfuric vào dung dịch X, được dung dịch Y có màu xanh, nhưng không có khí thoát ra. Các chất tan có trong dung dịch Y là:
A. Cu(NO3)2; Fe(NO3)2; H2SO4. B. CuSO4; FeSO4; H2SO4. C. CuSO4; Fe2(SO4)3; H2SO4. D. Cu(NO3)2; Fe(NO3)3; H2SO4.
DẠYKÈMQUYNHƠN
47
Câu 16: Nung nóng hỗn hợp Fe và S trong bình kín có chứa O2. Sau phản ứng hoàn toàn thu được rắn X và khí Y. Hòa tan X trong HCl dư thu được hỗn hợp khí Z. Khí Trong Y và Z lần lượt là: A. O2 và H2, H2S. B. SO2 và H2, SO2 C. SO2 và H2, H2S D. SO2, O2 và H2, H2S. C. ĐÁP ÁN VÀ HƯỚNG DẪN TRẢ LỜI I. Phản ứng tạo ra đơn chất (kim loại, phi kim) 1D 2D 3D 4C 5C 6C 7D 8D 9C 10D Câu 1: Phản ứng không tạo ra đơn chất là :
Câu 3: 3 thí nghiệm tạo ra kim loại là (c), (e), (h).
Câu 4: 3 thí nghiệm không tạo ra kim loại là (a), (b), (d).
Câu 5: 4 thí nghiệm tạo ra kim loại là (b), (c), (d), (f).
Câu 6: 3 phản ứng tạo ra đơn chất là (a), (b), (e).
Câu 7: 4 thí nghiệm tạo ra đơn chất là (3), (4), (5), (8).
Câu 8: 5 thí nghiệm tạo ra đơn chất là (2), (3), (4), (5), (6).
Câu 10: Hai thí nghiệm thu được kim loại là (c) và (e). Bản chất của thí nghiệm (e) như sau:
nghiệm tạo ra kết tủa là (a), (d).
Câu 6: 4 thí nghiệm tạo ra kết tủa là (1), (2), (4), (5).
Câu 7: 3 thí nghiệm thu được kết tủa là (a), (c), (d).
Câu 8: 4 thí nghiệm tạo ra kết tủa là (a), (b), (d), (g).
Câu 9: 5 thí nghiệm tạo ra kết tủa là (1), (2), (4), (5), (6).
Câu 10: 6 trường hợp tạo ra kết tủa là khi cho Na2S vào các dung dịch : AgNO3, Pb(NO3)2, ZnCl2, CuSO4, FeCl2, FeCl3, AlCl3.
Câu 11: 4 thí nghiệm tạo ra kết tủa là (2), (3), (5), (6).
DẠYKÈMQUYNHƠN
48
OFFICIAL
FeCl3AgNOFe(NO)AgCl
3 3 33
o o o t 2 2 t 423 3 22 t 3 2 2 Cu(OH)CuOHO (NH)CO2NHCOHO 3CuO2NH3Cu3HON II. Phản ứng tạo kết tủa, tạo khí 1C 2B 3B 4D 5C 6A 7D 8D 9A 10C 11C 12B 13B 14A 15C 16C 17B 18D 19B 20A Câu 2: 2 thí nghiệm thu được kết tủa là cho NaOH vào dung dịch : FeCl3, MgSO4. Câu 3: 3 trường hợp tạo ra kết
tủa là cho dung dịch NaOH vào các dung dịch : FeCl3, CuCl2, FeSO4 Câu 4: 4 trường hợp tạo ra kết tủa là cho AgNO3 vào các dung dịch : HCl; Na3PO4; Fe(NO3)2; FeCl2. Câu 5: 2 thí
Câu 12: 2 thí nghiệm thu được kết tủa là (2), (4).
Câu 13: 4 thí nghiệm tạo ra kết tủa là (a), (b), (c), (d).
Câu 14: 5 thí nghiệm tạo ra kết tủa là (a), (e), (h), (k), (l).
Câu 15: 3 thí nghiệm thu được chất rắn là (a), (c), (d).
Câu 16: 3 thí nghiệm không tạo ra kết tủa là (2), (5), (7).
Câu 17: 3 thí nghiệm tạo ra H2 là (c), (d), (e).
Câu 18: 3 thí nghiệm tạo ra khí N2 là (1), (4), (5).
Câu 19: 6 phản ứng thu được chất khí là (a), (b), (c), (d), (e), (g).
Câu 20: 5 thí nghiệm tạo ra kết tủa (a), (c), (d), (e), (f).
III. Xác định khả năng xảy ra phản ứng 1A 2B 3B 4C 5D 6B 7C 8D 9B 10A
Câu 1: 3 thí nghiệm xảy ra phản ứng là (a), (c), (d).
Câu 2: 2 thí nghiệm tạo ra kết tủa là (a), (c).
Câu 3: 3 thí nghiệm xảy ra phản ứng là (a), (c), (d).
Câu 5: 4 thí nghiệm xảy ra phản ứng là (a), (b), (c), (e).
Câu 6: 3 thí nghiệm xảy ra phản ứng là (b), (c), (d).
Câu 7: 4 thí nghiệm tạo ra phản ứng là (a), (b), (c), (e).
Câu 8: 4 thí nghiệm xảy ra phản ứng là (a), (c), (d), (e).
Câu 9: 6 cặp chất xảy ra phản ứng là (2), (3), (5), (6), (7), (8).
Câu 10: Dung dịch Y chứa FeSO4, CuSO4, H2SO4; chất rắn Z là Cu.
IV. Các dạng câu hỏi tổng hợp khác 1B 2A 3B 4D 5D 6C 7B 8B 9D 10D 11D 12B 13A 14A 15B 16C
Câu 1: 3 nhận xét đúng là (2), (3), (5).
Câu 2: 5 phát biểu đúng là (b), (d), (e), (g), (h).
Câu 3: 2 chất không tan trong dung dịch HNO3 loãng là BaSO4 và AgCl.
Câu 4: 2 thí nghiệm tạo ra NaOH là (2), (3).
Câu 5: 5 thí nghiệm tạo ra muối sắt(III) là (a), (c), (d), (e), (f).
Câu 6: 4 phản ứng oxi hóa – khử nội phân tử là (a), (c), (d), (e).
Câu 7: 5 thí nghiệm xảy ra phản ứng oxi hóa – khử là (1), (2), (3), (5), (6).
Câu 8: 4 thí nghiệm xảy ra phản ứng oxi hóa – khử là (b), (c), (e), (f).
Câu 9: 5 phản ứng oxi hóa – khử là (1), (3), (4), (5), (6).
Câu 10: 3 thí nghiệm tạo ra 2 muối là (a), (b), (d).
Câu 11: 3 thí nghiệm tạo ra 2 muối là (a), (b), (d).
Câu 12: 3 thí nghiệm tạo ra 2 muối là (a), (b), (c).
Câu 13: 3 thí nghiệm thu được 2 muối là (b), (c), (e).
Câu 14: Sơ đồ phản ứng :
DẠYKÈMQUYNHƠN
49
OFFICIAL

DẠYKÈMQUYNHƠN OFFICIAL 50 Z 23 X 2 NaOHdö 2 2 2 2 Y Cu FeO ZnO,Cu FeCl Fe(OH) CuCl Cu(OH) ZnCl Câu 15: Dung dịch X hòa tan được Cu (vì tạo ra dung dịch Y có màu xanh), nhưng không có khí thoát ra, suy ra X có chưa Fe3+ nhưng không có ion Vậy dung 3NO dịch X chứa Fe2(SO4)3, H2SO4; dung dịch Y chứa CuSO4; FeSO4; H2SO4. Câu 16: Khí Y là SO2. Chất rắn X tan trong HCl tạo ra hỗn hợp khí nên đó là H2 và H2S. HCl (6)
CHUYÊN ĐỀ : PHẢN ỨNG TẠO MUỐI AMONI 4 () NH
Phản ứng tạo muối amoni là một trong những dạng bài tập hóa vô vơ hay và khó. Nếu như đề thi trước năm 2014 dừng lại ở việc tạo ra NH4NO3 thì từ năm 2014 đến nay, mức độ khó đã tăng lên đáng kể. Phản ứng vẫn tạo ra NH4NO3 nhưng sau đó ion bị khử hết thành các sản phẩm khác. 3NO Dưới đây là các dạng thường gặp :
I. Phản ứng tạo ra NH4NO3
1. Những vấn đề cần lưu ý
Dấu hiệu nhận biết phản ứng tạo muối NH4NO3 : Hỗn hợp chất rắn chứa kim loại hoạt động mạnh như Mg, Al, Zn phản ứng với dung dịch HNO3 tạo ra các khí N2, N2O, NO,…
2. Ví dụ minh họa : Ví dụ 1: Đốt cháy 10,08 gam Mg trong oxi một thời gian, thu được m gam hỗn hợp rắn X. Hòa tan hết X trong dung dịch gồm HCl 0,9M và H2SO4 0,6M, thu được dung dịch Y chỉ chứa các muối có khối lượng 3,825m gam. Mặt khác, hòa tan hết 1,25m gam X trong dung dịch HNO3 loãng dư, thu được dung dịch Z chứa 82,5 gam muối và hỗn hợp khí T gồm N2 và 0,015 mol khí N2O. Số mol HNO3 phản ứng là A. 1,23 mol. B. 1,32 mol. C. 1,42 mol. D. 1,28 mol.
OFFICIAL
Hướng dẫn giải
A gồm Ca và CaO. Cho chất rắn A tác dụng vừa đủ với axit trong dung dịch gồm HCl 1M và H2SO4 0,5M, thu được H2 và dung dịch B. Cô cạn dung dịch B thu được (m + 21,14) gam chất rắn khan. Nếu hòa tan hết m gam chất rắn A vào dung dịch HNO3 loãng dư, thu được 0,896 lít NO (đktc) và dung dịch X. Cô cạn dung dịch X thu được bao nhiêu gam chất rắn khan? A. 47,52 gam. B. 48,12 gam. C. 45,92 gam. D. 50,72 gam. Ví dụ 2: Hòa tan hết 30 gam rắn gồm Mg, MgO, MgCO3 trong HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau phản ứng thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị của m là A. 134,80 B. 143,20 C. 153,84 D. 149,84 Hướng dẫn giải
DẠYKÈMQUYNHƠN
3
2 4 2 Cl SO Mg
Mg
BTKL:n 43 2 2 3 2 2 43 NHNOtrongZ N HNO N NONHNO Mg 82,51,250,421480,06 80 0,375.20,06.80,015.8BTE:n 0,015 10 n2n2n2n2n1,23mol Ví dụ tương tự : Ví dụ 1.1: Đốt cháy 11,2 gam bột Ca bằng O2
gam
MgO
n0,9x BTÑT:0,9x20,6x20,42TrongYn0,6xBTKL:35,5.0,9x96.0,6x3,825m10,08 n0,42 1,25.(1210,08) n 0,15 x0,4Trong1,25mgamXco 16 m12 n1,250,420,150,375
, thu được m
chất rắn
dụ 2.1: Hòa tan hoàn toàn 5,22 gam hỗn hợp bột M gồm Mg, MgO, Mg(OH)2, MgCO3, Mg(NO3)2 bằng một lượng vừa đủ 0,26 mol HNO3. Sau khi phản ứng kết thúc thu được dung dịch X và 0,448 lít hỗn hợp khí gồm N2O và CO2. Dung dịch X phản ứng vừa đủ với 250 ml dung dịch NaOH 1M, sau phản ứng thu được 6,96 gam kết tủa màu trắng. Phần trăm theo khối lượng của Mg(OH)2 trong hỗn hợp đầu gần nhất là A. 11,11%. B. 22,22%. C. 33,33%. D. 44,44%. Ví dụ 2.2: Hòa tan hết m gam hỗn hợp M chứa Mg, MgCO3 và FeCO3 trong dung dịch HCl loãng dư, thu được hỗn hợp khí X và dung dịch chứa các chất tan có cùng nồng độ mol. Mặt khác, m gam hỗn hợp trên phản ứng hoàn toàn với dung dịch chứa 1,02 mol HNO3, kết thúc phản ứng thu được dung dịch Y và 5,6 lít (đktc) hỗn hợp khí Z gồm 2 khí có tỉ khối so với H2 bằng 22. Cô cạn cẩn thận dung dịch Y thu được (2m + 17,8) gam muối khan. Giá trị m là A. 54,0. B. 40,5. C. 27,0. D. 39,15. Ví dụ 3: Cho 9,6 gam hỗn hợp X gồm Mg và Fe3O4 vào 300 ml dung dịch HNO3 2M, thu được dung dịch Y và 0,896 lít (đktc) hỗn hợp N2O và NO có tỉ khối so với hiđro là 16,75. Trung hòa Y cần dùng 40 ml NaOH 1M thu được dung dịch Z, cô cạn Z thu được m gam muối khan. Biết rằng phản ứng xảy ra hoàn toàn và khi cô cạn muối không bị nhiệt phân. Giá trị m là A. 42,26. B. 19,76. C. 28,46. D. 72,45. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Vận dụng 45 chuyên đề giải nhanh đặc sắc và sáng tạo vào 82 đề thi thử THPT Quốc gia Hóa học, Quyển 1 4 2 3 2 2 NOCO NO MgCO CO NO CO 2 4 3 3 2 3 2,15mol honhôpX ddY M nn0,2 n0,1 n0,1n0,130n44n0,218,527,4 Sôñophanöng: Mg;NH Mg,MgO NO HNO MgCO CO NO n 4 3 NH g MgO NOtrongY X muoitrongY anx ; BTN:n 2,05x nb BTE:2a8x0,13 a0,65 BTÑTtrongY:2(ab0,1)x2,05xb0,15 m24a40b0,18430 x0,125 m 143,2gam Ví dụ tương tự :
Ví
3HNO 0,6mol
luồng khí O2 đi qua 63,6 gam hỗn hợp kim loại Mg, Al và Fe thu được 92,4 gam chất rắn X. Hòa tan hoàn toàn lượng X trên bằng dung dịch HNO3 (dư). Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y và 3,44 gam hỗn hợp khí Z. Biết có 4,25 mol HNO3 tham gia phản ứng, cô cạn cẩn thận dung dịch Y thu được 319 gam muối. Phần trăm khối lượng của nitơ có trong 319 gam hỗn hợp muối trên là A. 18,082%. B. 18,125%. C. 18,038%. D. 18,213%.
Ví dụ 3.2: A là hỗn hợp chứa Fe, Al, Mg. Cho một luồng khí O2 đi qua 21,4 gam A nung nóng thu được 26,2 gam hỗn hợp rắn B. Cho toàn bộ B vào bình chứa 400 gam dung dịch HNO3 (dư 10% so với lượng phản ứng). Sau khi các phản ứng xảy ra hoàn toàn thấy có NO và N2 thoát ra với tỉ lệ mol 2 : 1. Biết khối lượng dung dịch C sau phản ứng là 421,8 gam, số mol HNO3 phản ứng là 1,85 mol. Tổng khối lượng các chất tan có trong bình sau phản ứng gần nhất với
A. 156. B. 134. C. 124. D. 142. Ví dụ 3.3: Hoà tan hết 15,44 gam hỗn hợp gồm Fe3O4, Fe và Al (trong đó oxi chiếm 20,725% về khối lượng) bằng 280 gam dung dịch HNO3 20,25% (dùng dư), thu được 293,96 gam dung dịch X và 0,896 lít hỗn hợp khí X gồm NO và N2O. Để tác dụng tối đa các chất trong dung dịch X cần 450 ml dung dịch NaOH 2M. Nếu cô cạn dung dịch X thu được chất rắn Z. Nung Z đến khối lượng không đổi, thấy khối lượng chất rắn giảm m gam. Giá trị m là A. 44,12. B. 46,56. C. 43,72. D. 45,84. Ví dụ 4: Hòa tan m gam hỗn hợp A gồm Mg, Al, MgO và Al2O3 bằng dung dịch HCl vừa đủ thì được dung dịch chứa (m + 70,295) gam muối. Cho m gam hỗn hợp A tác dụng với dung dịch H2SO4 đặc nóng dư, thu được 13,328 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp A tác dụng với dung dịch HNO3 loãng dư, thu được 3,808 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hiđro là , dung dịch Y. Cô cạn dung dịch Y thu 318 17 được 162,15 gam muối khan. Giá trị của m là A. 30,99. B. 40,08. C. 29,88. D. 36,18. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL 5 2 2 2 2 3 NONO NO NO NO NO 2 34 honhôpX 23 4 3 dd YchöaHNOdönenYkhongchöaFe nn0,04 n0,03 n0,01
Sôñophanöng: NO NO Mg FeO Mg,Fe NH,NO H 2 4 3 34 3 23 NaOH 4 3 trunghoa Y ddZ NH Mg Mg FeO NOtrongZ Fe X Mg,Fe NH,NO Na nznxnx ; ny BTN:n 0,55z n3y m24x232y9,6 BTE:2xy0,0330,0188z BTÑTtrongZ:2x9y 3 2 4 3 muoitrongZFe Mg NH NaNO x0,11 y0,03 z0,040,55zz0,01 m mmmmm42,26gam Ví dụ tương tự : Ví dụ 3.1:
30n44n0,0416,7521,34
Cho một
dụ 4.1: Hỗn hợp
gồm
, Fe, MgO và Mg. Cho m gam hỗn hợp X tác dụng với dung dịch HNO3 dư, thu được 6,72 lít hỗn hợp khí N2O và NO (đktc) có tỉ khối so với hiđro là 15,933 và dung dịch Y. Cô cạn dung dịch Y thu được 129,4 gam muối khan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng dư, thu được 15,68 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch Z. Cô cạn dung dịch Z thu được 104 gam muối khan. Giá trị của m là
A. 27,20. B. 28,80. C. 26,16. D. 22,86. Ví dụ 4.2: Đốt cháy 16,96 gam hỗn hợp gồm Fe và Mg trong oxi một thời gian, thu được hỗn hợp rắn X. Hòa tan hết X trong 242 gam dung dịch HNO3 31,5%, thu được dung dịch Y chỉ chứa các muối có khối lượng 82,2 gam và 1,792 lít (đktc) hỗn hợp khí Z gồm N2O và NO có tỉ khối so với He bằng 10,125. Cho NaOH dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được 25,6 gam chất rắn khan. Nồng độ C% của Fe(NO3)
DẠYKÈMQUYNHƠN OFFICIAL Vận dụng 45 chuyên đề giải nhanh đặc sắc và sáng tạo vào 82 đề thi thử THPT Quốc gia Hóa học, Quyển 1 6 2 2 2 NONO NO NO NO NO nn0,17 n0,08 0,173182 n0,09 30n44n 6,36 17 23 23 quyñoi honhôpA 2 33 32 2 43 Sôñophanöng: Mg,Al Cl Al,AlO Al,Mg O Mg,MgO SO Al(NO) NO Mg(NO) NO NHNO 2 2 2 2 CelectronmaMg,Alnhöông l Cl O electronmaMg,Alnhöông SO O 0,595 Cl O BTÑTcho(1):nn n2n1,19(*) BTEcho(2):n 2n2n Theo(1)vasötanggiamkhoilöông,taco:35,5n16n70,295(**) Tö(*)va(**)su 2 2 43 43 4 Cl O electronmaMg,AlnhöôngNONONHNO
2,21 ? (Al,Mg)muoikhan NHNO
NHNO n2,21
n 3 (Al,Mg) 0,02875 m22,830,51.1630,99gam m22,83 Ví
:
O 0,08 0,51 0,09
electronmaMg,Alnhöông 2,21
yra:n0,51 BTEcho(3):n 3n8n8n2n mm80n62n
dụ tương tự
Ví
X
FexOy
12%.
13%.
D.
ĐÁP ÁN HƯỚNG VÀ DẪN GIẢI MỘT SỐ BÀI KHÓ 1.1A 2.1A 2.2C 3.1B 3.2B 3.3C 4.1B 4.2B Ví dụ 2.1: ● Cách tiếp cận thứ nhất :
3 trong Y có giá trị gần nhất với: A.
B.
C. 14%.
15%.
HCl (1) 24ñacHSO (2) 3 HNO(3)
Gặp bài tập này, tôi đã rất lúng túng vì hỗn hợp có tới 5 chất. Loay hoay mãi, vẫn không tìm được cách nào cho đơn giản. Vì thế đành quay lại cách thông thường, đó là đặt x, y, z, t, v ứng với số mol của các chất trong M. Rồi dựa vào giả thiết và áp dụng các định luật bảo toàn lập hệ phương trình. Có 4 phương trình, nhưng lại có 5 ẩn số! Ngán quá đi! Cách này không ổn rồi! Nhưng thử biến đổi toán học thêm một chút nữa, tôi đã tìm được số mol của Mg(OH)2.
● Cách tiếp cận thứ hai : Trời! Ai ra cái bài này mà ghê thế chứ! Chẳng lẽ cứ phải làm thế này cho những bài tương tự sao. Không! Phải có cách nào khác đơn giản hơn chứ,
OFFICIAL
DẠYKÈMQUYNHƠN
7
tôi cứ nghĩ như thế và rồi đã tìm thấy nó : 3 3 3 4 2 2 4 NONa HNONONH Mg(OH)Mg 2 32 NH 2 2 2 (OH,O)trongM nn0,25 nnn Xco:nn0,12 NOdoNtrongMg(NO)taora n0,01 Mg(OH):xmol Mg:(0,12x)molQuyñoiMthanhO:ymol (NOCO):0,02mol m 34x16y 2Mg(OH)
Với
cận
vấn đề đã được giải quyết đơn giản hơn, nhưng tính khái quát vẫn chưa cao. ● Cách tiếp cận thứ ba : Ví dụ 2.2: 3 2 2 4 NONa Mg(OH) muoi Mg NH 2 2 3 3 3 0,26mol 4 32 18,56gam 5,22gam nn0,25 Xco:nn0,12m18,56gam n0,01 Mg,MgO Mg Mg(OH) CO Sôñophanöng: HNONO MgCO NH Mg(NO) 2 2 2 2 2 2 ?mol 0,02mol HO Mg(OH) Mg(OH) HO NO 5,220,26.6318,560,02.44BTKL:n 0,12 18 %m11,11% 0,12.20,01.40,26BTNTH:n 0,01 2 Ta thấy : Dung dịch Y gồm các ion , có thể có và hai ion kim loại có số mol bằng nhau. 3 2 3Fe,Mg,NO 4NH Hai khí là CO2 và N2O. ● Cách tiếp cận thứ nhất : Đặt ẩn x, y , z cho các chất Mg, MgCO3 và FeCO3 Số mol của CO2 thì có thể tính theo y, z. Nhưng số mol của N2O thì còn phụ thuộc vào số
1x0,01;y0,07 ,46 %m11,11%BTE:2(0,12x)2y0,01.8
cách tiếp
này,
mol của HNO3 và các ion trong dung dịch Y, như vậy sẽ cần thêm một ẩn nữa cho ion . Như vậy là có 4 ẩn rồi, lại còn ẩn m nữa chứ, ôi sao mà nản quá! 4NH Nếu nghĩ thêm một chút nữa thì có thể làm mất ẩn m, nhưng 4 ẩn là đủ mệt rồi. ● Cách tiếp cận thứ hai :
DẠYKÈMQUYNHƠN OFFICIAL Vận dụng 45 chuyên đề giải nhanh đặc sắc và sáng tạo vào 82 đề thi thử THPT Quốc gia Hóa học, Quyển 1 8 3 2 3 quyñoi HNO 2
4 2 2 3 ddY
muoi M
y0,21m27 z0,02 ● Cách tiếp cận thứ ba : 2 23 2 3 3 2 2 4 3 ?gam 1,02mol 3 0,25mol (2m17,8)gam mgam HO Mg COMg,FeSôñophanöng:MgCOHNO HO NONH,NO FeCO BTKL:m35,46mm35,46C Ví dụ 3.1: Ví dụ 3.2: 2 4 3 HO NHtrongY NOtrongY 92,44,25.633193,44BTKL:n 2,095 18 4,252,095.2 BTNTN:n 40,015%NtrongY18,125% 31963,60,015.18 BTKLn 4,115 62 2 4 3 NO N NH NO ñientíchdöôngcuaionkimloai chattantrongX n2x;nx 26,2400421,8BTKL:x 0,05 88 na;BTNTN:n1,65a TrongC: a0,025 26,221,4 n 2. 0,88a 16 m 1,85.10%.630,025.1821,41,625.62134, 225134 Ví dụ 3.3:
1,02mol
Sôñophanöng: Mg:xmol Mg:xmol Fe:xmolCO:ymol Fe:xmol M O:ymol NH:z NO:(0,25y)mol CO:ymol NO BTNvaBTÑTtrongY:5xz1
,02z2(0,25y) BTE:5x2y8z8(0,25y) m2m62[1,02z2(0,25y)]18z2(4416)y80x17,8 x0,18
zmol;n 0,9mol
DẠYKÈMQUYNHƠN OFFICIAL 9 3 4 NaOH HNObanñau NHtrongX 2 2 3 ddY QuyñoihonhôpbanñauthanhAl(xmol),Fe(ymol),O(0,2mol).
Sôñophanöng: NO NO AlO:x Al Fe
A 33 4 3 ddX 2 23 2 23 3 chatranZ l,Fe NH,H NO O FeO NO AlO NH 2 2 2 NONO NO NO NO NO (Al,Fe) nn0,04 n0,02 n0,0230n44n15,44280293,961,48 m27x56y12,24 BTE:3x3y8z0,0230,0280,22 BTNvaBTÑTtrongZ:0,9x0,9z0,020,02.2 x0,08
z0,02 3 33 33NOtrongmuoiAl(NO),Fe(NO) n 0,78mol 0,78 m0,02.8062.0,7816.43,72gam 2 Ví dụ 4.1: 2 2 2 2 2 4 4 NONO NO NO NO NO 4 SO NONO NH NH 0,26 0,7 0,04 ? muoinitratkimlo QuyñoiXthanhFe(xmol),Mg(ymol),O. nn0,3 n0,26 n0,0430n44n15,933.2.0,3 GiasötrongYcoNH,taco: BTE:2n8n3n8nn0,0375. m 2 ai muoisunfatkimloai FeMg OSO O X 0,4 ? 0,2 0,7 242x148y129,40,037580x0,4 m 200x120y104 y0,2 BTE:3n2n2n2nn0,1m28,8gam Ví dụ 4.2: 3HNO NaOH cocan,nung
n0,9;n
Na:0,9 O NO:0,9x
y0,18
H2. 3 ( ) HvaNO
Giải thích : Như ta biết, tính oxi hóa của mạnh hơn H+, nên phản ứng tạo ra H2 thì chứng tỏ trong dung 3NO dịch thu được không thể có . 3NO
2. Ví dụ minh họa
Ví dụ 1: Cho 4,32 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X; 0,896 lít (đktc) hỗn hợp khí Y có khối lượng 0,92 gam gồm 2 khí không màu có một khí hóa nâu trong không khí và còn lại 2,04 gam chất rắn không tan. Cô cạn cẩn thận dung dịch X, thu được m gam muối khan. Giá trị của m là A. 18,27. B. 14,90. C. 14,86. D. 15,75. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên
DẠYKÈMQUYNHƠN OFFICIAL Vận dụng 45 chuyên đề giải nhanh đặc sắc và sáng tạo vào 82 đề thi thử THPT Quốc gia Hóa học, Quyển 1 10 2 2 2 23 NONO NO NO NO NO
Mg
Fe 2 3 2 4 3
33 OtrongZ Fe(NO) ab0,2
0,2420,230,0230,0680,0258a0,06n
2
0,14242 C% 100 z0,025 16,960,17.22423,24 %13% II. Phản ứng ion , còn đã bị khử hết 4NH 3NO 1. Những vấn đề cần lưu ý Dấu hiệu nhận biết phản ứng tạo ra ion : Xảy ra phản ứng của kim loại hoạt động
(Mg,
với 4NH . Sản phẩm khử
N2
2
còn có cả
(Mg,Fe)
(FeO,MgO)
nn0,08 n0,02 n0,0630n44n0,08.10,125.43,24 m24x56y16,96nx x0,24 m 40x80y25,6y0,2 ny Fe:a Fe:b Yco:Mg:0,24 NH:z BTN:NO:(
18z62(1,07z)82,216,9665,24 2a3b0,24.2z1,07z 1,07z)
0,17
b0,14
mạnh
Al, Zn)
ngoài
, N
O,… thì
giải 2khí 2 3 2 3 2 2 24 4 4 0,095mol ddY MgpöH H:0,01 M23 2khíla XkhongcoNO. NO:0,03 comotkhílaNO(hoanau) Sôñophanöng: NaNO Mg;NaH Mg HSO SO;NHNO BTE:2n2n 2 4 4 3 4 3 3 2 4 2 2 4 4 NONH NH NONO NH NaNO NaNO SO muoitrongXMg NaNH SO 3n8n n0,01 BTN:nnn nn0,04 BTÑT:nn BTÑTtrongY:n0,12 m mmmm14,9gam Ví dụ tương tự :
Đại học Vinh – Nghệ An, năm 2015) Hướng dẫn
Ví dụ 1.1: Cho Zn tới dư vào dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m là A. 61,375. B. 64,05. C. 57,975. D. 49,775. Ví dụ 1.2: Cho 3,48 gam bột Mg tan hết trong dung dịch hỗn hợp gồm HCl (dư) và KNO3, thu được dung dịch X chứa m gam muối và 0,56 lít (đktc) hỗn hợp khí Y gồm N2 và H2. Khí Y có tỉ khối so với H2 bằng 11,4. Giá trị của m là
A. 16,085. B. 14,485. C. 18,300. D. 18,035. (Đề thi tuyển sinh khối B năm 2014)
Ví dụ 1.3: Cho 5 gam bột Mg vào dung dịch KNO3 và H2SO4. Đun nhẹ trong điều kiện thích hợp đến khi phản ứng xảy ra hoàn toàn, thu được dung dịch X chứa m gam muối và 1,792 lít hỗn hợp khí Y (đktc) gồm 2 khí không màu, trong đó có 1 khí hoá nâu ngoài không khí và còn lại 0,44 gam chất rắn không tan. Biết tỉ khối hơi của Y đối với H2 là 11,5. Giá trị của m là : A. 27,96. B. 31,08. C. 36,04. D. 29,72. (Đề thi thử Đại học lần 1 – THPT Hồng Lĩnh, năm học 2013 – 2014) Ví dụ 2: Cho 5,6 gam hỗn hợp X gồm Mg và MgO có tỉ lệ mol tương ứng là 5 : 4 tan vừa đủ trong dung dịch hỗn hợp chứa HCl và KNO3. Sau khi kết thúc phản ứng, thu được 0,224 lít khí N2O duy nhất (đktc) và dung dịch Y chỉ chứa muối clorua. Biết các phản ứng hoàn toàn. Cô cạn cẩn thận Y thu được m gam muối. Giá trị của m là : A. 20,51. B. 18,25. C. 23,24. D. 24,17. Hướng dẫn giải
OFFICIAL
hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch A chỉ chứa m gam hỗn hợp các muối và 4,48 lít (đktc) hỗn hợp khí B gồm N2O và H2. Khí B có tỷ khối so với H2 bằng 11,5. Giá trị m gần nhất với A. 240 B. 255. C. 132. D. 252.
Ví dụ 2.2: Nung m gam hỗn hợp gồm Mg và Cu(NO3)2 trong điều kiện không có không khí, sau một thời gian thu được chất rắn X và 10,08 lít (đktc) hỗn hợp khí gồm NO2 và O2. Hòa tan hoàn toàn X bằng 650 ml dung dịch HCl 2M, thu được dung dịch Y chỉ chứa 71,87 gam muối clorua và 0,05 mol hỗn hợp khí Z gồm N2 và H2. Tỉ khối của Z so với He bằng 5,7. Giá trị của m gần giá trị nào nhất sau đây? A.
DẠYKÈMQUYNHƠN
11
2 xmol
2
ddY
Mg
NO MKNO
BTE:0,120,0188y BTN:xy0,01.2 BTÑTtrongY:0,182xyz muoi/Y y0,015 x0,035m20,51gam z0,41 Ví dụ tương tự : Ví dụ 2.1: Cho 31,15 gam hỗn hợp bột Zn và Mg (tỉ lệ mol 1 : 1) tan
0,18mol 0,1mol
3 4 0,01mol zmol 0,08mol ymol
Sôñophanöng: Mg;K
HCl
gO: NH;Cl
50. B. 55. C. 45. D.
Ví dụ 3: Cho 7,65 gam hỗn hợp X gồm Al và Al
3
2SO4 và NaNO3,
Z chỉ
0,015 mol H2). Cho dung dịch BaCl2 dư vào Z
cho Z phản ứng với NaOH thì lượng NaOH
nhất sau đây? A. 2,5. B. 3,0. C. 1,0. D.
60.
2O
(trong đó Al chiếm 60% khối lượng) tan hoàn toàn trong dung dịch Y gồm H
thu được dung dịch
chứa 3 muối trung hòa và m gam hỗn hợp khí T (trong T có
đến khi các phản ứng xảy ra hoàn toàn, thu được 93,2 gam kết tủa. Còn nếu
phản ứng tối đa là 0,935 mol. Giá trị của m gần giá trị nào
1,5 (Đề thi THPT Quốc Gia, năm 2015) Hướng dẫn giải
Al, Al2O3, Fe và Fe3O4 trong đó oxi chiếm 26,86% về khối lượng. Hòa tan hết 41,7 gam X cần vừa đủ 1525 ml dung dịch HNO3 1,5M, thu được dung dịch Y và 2,24 lít hỗn hợp Z (đktc) gồm NO và N2O có tỉ khối so với H2 là 18,5. Làm bay hơi dung dịch Y thu được m gam muối. Giá trị của m là A. 162,2 gam. B. 64,6 gam. C. 160,7 gam. D. 151,4 gam. Ví dụ 3.2: Hỗn hợp X gồm Al, Mg, FeO, Fe3O4 trong đó oxi chiếm 20,22% khối lượng hỗn hợp. Cho 25,32 gam hỗn hợp X tác dụng với dung dịch HNO3 dư, thu được 3,584 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hiđro là 15,875 và dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan. Nung muối khan này trong không khí đến khối lượng không đổi thu được 30,92 gam chất rắn khan. Giá trị gần nhất của m là
A. 106. B. 103. C. 105. D. 107. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Bến Tre, năm 2015)
Ví dụ 4: Cho 66,2 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,1 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 466,6 gam muối sunfat trung hòa và 10,08 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 23/18. Phần trăm khối lượng của Al trong hỗn hợp X gần nhất với giá trị nào sau đây?
A. 15. B. 20. C. 25. D. 30. (Đề minh họa kỳ thi THPT Quốc Gia, năm 2015) Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Vận dụng 45 chuyên đề giải nhanh đặc sắc và sáng tạo vào 82 đề thi thử THPT Quốc gia Hóa học, Quyển 1 12 23 4 Al AlO BaSO NaOH 3 24 4 2 2 23 3 x 4 X T Y Z 2 4 Taco:n0,17mol;n0,03mol;n0,4mol;n0,935mol. Sôñophanöng: HSO NH,AlH Al AlONaNO NO
AlO BaSO 2 2 4 x 4 2 4 W AlO Na NatrongYNatrongZ SO NO NH SO,Na BTAl:n0,23BTÑTtrongW:n1,03 TrongW BTNa:n n 0,095 BTS:n0,4 BTÑTtrongZ:n0,015;BTN:n0,08 BTE:30,170,08(52x)0,01520,015 T
Ví dụ tương tự : Ví dụ 3.1: Hỗn hợp X gồm
Na,SO
x0,25 8m1,471,5gam
2 BaCldö NaOHpömax
dụ 4.1: Đốt 58,05 gam Al bằng 16,8 lít khí O2 (đktc) thu được hỗn hợp A. Hòa tan hỗn hợp A trong 800 gam dung dịch B chứa H2SO4 và NaNO3, thu được dung dịch C chỉ chứa muối và m gam hỗn hợp khí (trong đó có 0,4 gam khí H2). Cho BaCl2 dư vào C thấy có 838,8 gam kết tủa xuất hiện. Mặt khác, cho 39 gam K vào dung dịch C sau khi các phản ứng xảy ra thì thấy khối lượng dung dịch tăng 12,9 gam. (Biết các phản ứng xảy ra hoàn toàn và giả thiết chất khí không hòa tan vào nước). Nồng độ phần trăm của muối Al trong dung dịch C là A. 42,26%. B. 41,15%. C. 43,27%. D. 38,35%. Ví dụ 4.2: Cho 82,05 gam hỗn hợp A gồm Al và Al2O3 (có tỷ lệ mol 2,3 : 1) tan hoàn toàn trong dung dịch B chứa H2SO4 và NaNO3 thu được dung dịch C chỉ chứa 3 muối và m gam hỗn hợp khí D (trong D có 0,2 mol khí H2). Cho BaCl2 dư vào C thấy có 838,8 gam kết tủa xuất hiện. Mặt khác cho 23 gam Na vào dung dịch C sau khi các phản ứng xảy ra hoàn toàn thì thấy khối lượng dung dịch giảm 3,1 gam. Giá trị của m gần nhất với A. 16. B. 13. C. 12. D. 15. Ví dụ 4.3: Hòa tan 54,24 gam hỗn hợp X gồm Mg, Fe3O4, MgCO3 và Fe(NO3)2 (trong đó oxi chiếm 31,858% về khối lượng hỗn hợp) vào dung dịch chứa 0,04 mol NaNO3 và 2,24 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và 0,16 mol hỗn hợp khí Z gồm 2 khí có tỉ khối so với He bằng 11. Cho dung dịch AgNO3 dư vào dung dịch Y, kết thúc phản ứng, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 334,4 gam kết tủa. Nếu cô cạn dung dịch Y thu được 111,44 gam muối. Phần trăm khối lượng của Fe3O4 có trong hỗn hợp X là A. 25,66% B. 28,32%. C. 39,82%. D. 6,19%. Ví dụ 5: Cho m1 gam hỗn
Al, Fe(NO3)2 và 0,1 mol Fe3O4 tan hết trong dung dịch chứa 1,025 mol
5,04 lít (đktc) hỗn hợp khí Y gồm hai khí có tỉ khối so với H2 là 31/3, trong đó có một khí hóa nâu ngoài không khí và dung dịch Z chỉ chứa các muối sunfat trung hòa. Cho Z phản ứng với dung dịch NaOH dư, không thấy tạo kết tủa nâu đỏ. Cho BaCl2 vào Z để kết tủa vừa hết ion , sau đó cho tiếp dung 2 4SO dịch AgNO3 dư vào thì thu được m2 gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của tổng (m1 + m2) là A. 389,175. B. 585,0. C. 406,8. D. 628,2. Hướng dẫn giải
phản
DẠYKÈMQUYNHƠN OFFICIAL 13 2 2 2 Z 2 HNO H NO H NO 34 32 4 3,1mol 66,2gam 23.4 H M
Zgom 18 NO Zgom2khítrongñocoNO(hoanau) nn0,45 n0,4 0,45.23.4 n0,05 2n30n
18 Sôñophanöng: FeO Fe(NO)KHSO Al 2 4 32 34 233 2 2 2 4 4 ?mol 2,3gam 466,6gam HO NH Fe(NO) FeO Fe,Fe,AlHHO NH,SO NO 66,23,1136466,62,3BTKL:n 1,05 18 3,11,0520,42BTH:n 0,05 4 BTN:n0,05 1,050,05BT:n Al Al m10,8 A %m16,3% 0,05.60,2 4 Ví dụ
tự : Ví
5,11
2,3
tương
hợp X chứa
H2SO4. Sau
ứng thu được
24HSO 1,025mol
dụ tương tự : Ví dụ 5.1: Cho 50,82 gam hỗn hợp X gồm NaNO3, Fe3O4, Fe(NO3)2 và Mg tan hoàn toàn trong dung dịch chứa 1,8 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 275,42 gam muối sunfat trung hòa (không có Fe3+) và 6,272 lít khí (đktc) Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 11. Phần trăm khối lượng của Mg trong hỗn hợp X là A. 25,5% B. 20,2%. C. 19,8%. D. 22,6%. Ví dụ 6: Hòa tan hết 13,52 gam hỗn hợp X gồm Mg(NO3)2, Al2O3, Mg và Al vào dung dịch chứa hai chất tan NaNO3 và 1,08 mol HCl. Sau khi kết thức phản ứng, thu được dung dịch Y chỉ chứa các muối và 3,136 lít (đktc) hỗn hợp khí Z gồm N2O và H2, có tỉ khối so với He bằng 5. Dung dịch Y tác dụng tối đa với dung dịch chứa 1,14 mol NaOH, lấy kết tủa nung ngoài không khí tới khối lượng không đổi thu được 9,6 gam rắn. Phần trăm khối lượng của Al có trong hỗn hợp X là : A. 31,95%. B. 19,97%. C. 23,96%. D. 27,96%.
Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Vận dụng 45 chuyên đề giải nhanh đặc sắc và sáng tạo vào 82 đề thi thử THPT Quốc gia Hóa học, Quyển 1 14 2 Y Y 3 2 khíY 32 34 Ygom2khí,motkhíhoanau
ZNaOHdö:khongtaokettuanauñoZkhongcoFe.
Al
FeO 2 3 1 2 24 2 2 2 4 4 32 choBaCltröôc 2sauñochoAgNO 4 4 dungdòchZ honhôpX,mgam mgam 2 HSO H HOHO NH BaSO Al,Fe AgCl NH,SO Ag :0,1mol HO BTH:2n2n4n2nn0,8752n 4 32 4 2 2 2 3 4 2 3 2 4 NH Fe(NO)NONH 0,15 x y (NO,H) HO NO OH NH 02,05 ,4 (0,952y) 4,65 y 2x Fe 1 Al BaClBaSO BTN:2nnn BTKL:62n16nnm18n18n n0,4x0,1TrongZ m52gam y0,05 BTÑT:n0,4 nn1,02 2 4 AgCl AgFe 12 2BaSOAgClAg 5;n2,05;nn0,4
YH:0,075mol gom 31.2 M;n0,225 NO:0,15mol 3
Sôñophanöng: H:0,075 NO:0,15
Fe(NO):x
mm628,2 mmmm576,2gam
Ví
ot
HCl:1,08mol NaNO:amol NaOH 1,14mol
3
vào dung dịch B đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì dùng hết 865 ml. Mặt khác, cho 94,64 gam BaCl2 vào B sau đó cho tiếp AgNO3 dư vào thì thu được 256,04 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 28,4. B. 27,2 C. 32,8. D. 34,6. Ví dụ 6.2: Cho 87,35 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,425 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 516,125 gam muối và 8,12 lít hỗn hợp khí Z gồm 2 khí (đktc) trong đó có 1 khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là . 365 58 Phần trăm khối lượng của Al trong X gần nhất với
DẠYKÈMQUYNHƠN OFFICIAL 15 2 2 2 0,24mol honhôpZ 32 23 2 13,52gamhonhôpX 3 2 4 dungdòchY 2 Sôñophanöng: NO:0,06mol HOMgO H:0,08mol Mg(NO) AlO Mg(OH) Al,Mg Al,Mg Na,NH Cl Na,Cl AlO dungdòchZ 2 3 2 4 2 AlO ClNa 108a114?(a0,06) Al Mg Na Cl NH muoi/Y H HO ddZ:nnn 3(a0,06)0,24.2ab1,08(1)na0,06;n0,24 ddY: na;n1,08:nb m27(a0,06)0,24.2423a18b1,08.35,550a18b45,72 n n 2 4 NaNO X 3(NOH) HCl muoi/Y 22 HO 2 ClH NH m m m m m m 2n4n1,080,08.24b(0,462b) 2 2 13,521,08.36,585a2,850a18b45,7218(0,462b)(2) 4ab0,42a0,1Tö(1),(2)suyra:35a18b3,86 2 3 4 32 2 2 4 NO NaNONH Mg(NO) Mg Al AlMg H NONH ? 0,220,080,06 0,02 b0,02 2nnn n 0,02;n0,22n0,12 2 3n2n2n8n8n %Al23,96% Ví dụ tương tự : Ví dụ 6.1: Hòa tan hết m gam hỗn hợp rắn A gồm Mg, Cu(NO3)2, Fe, FeCO3 vào dung dịch chứa H2SO4 và 0,045 mol NaNO3 thu được dung dịch B chỉ chứa 62,605 gam
gồm N2, NO2, N2O, NO, H2, CO2 có tỉ khối so với H2 bằng
304
1M
các muối và thấy thoát ra 3,808 lít (đktc) hỗn hợp khí C
(trong C có chứa 0,02 mol H2). Cho dung dịch
17 NaOH
A. 11%. B. 10%.
C. 12%. D. 13%.
ĐÁP ÁN VÍ DỤ TƯƠNG TỰ
1.1B 1.2D 1.3B 2.1A 2.2B 3.1A 3.2C 4.1A 4.2C 4.3A 5.1A 6.1B 6.2A
Vận dụng 45 chuyên đề giải nhanh đặc sắc và sáng tạo vào 82 đề thi thử THPT Quốc gia Hóa học, Quyển 1 16
DẠYKÈMQUYNHƠN OFFICIAL
(6)
CHUYÊN ĐỀ : VẬN DỤNG LINH HOẠT CÁC ĐỊNH LUẬT BẢO TOÀN ĐỂ GIẢI NHANH BÀI TẬP ĐIỆN PHÂN HAY VÀ KHÓ
Để làm tốt các dạng bài tập điện phân trong dung dịch, trước tiên các em cần nắm vững thứ tự khử trên catot và thứ tự oxi hóa trên anot. Sau đó vận dụng các định luật bảo toàn để tìm ra kết quả của bài toán.
Các em cũng có thể sử dụng phương pháp tính theo phương trình phản ứng, nhưng cách đó thường mất nhiều thời gian hơn.
Có những bài chỉ cần áp dụng bảo toàn electron, bảo toàn nguyên tố, nhưng có những bài cần áp dụng thêm bảo toàn điện tích trong dung dịch. Dưới đây là các ví dụ minh họa :
Ví dụ 1: Hòa tan 13,68 gam muối MSO4 vào nước được dung dịch X. Điện phân X (với điện cực trơ, cường độ dòng điện không đổi) trong thời gian t giây, được y gam kim loại M duy nhất ở catot và 0,035 mol khí ở anot. Còn nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 0,1245 mol. Giá trị của y là : A. 4,480. B. 3,920. C. 1,680. D. 4,788. (Đề thi tuyển sinh Đại học khối A, năm 2011) Hướng dẫn giải
OFFICIAL
phân trong thời gian t giây.
Ví dụ tương tự : Ví dụ 1.1: Hòa tan 2,88 gam XSO4 vào nước thu được dung dịch Y. Điện phân dung dịch Y (với điện cực trơ) trong thời gian t giây thì được m gam kim loại ở catot và 0,007 mol khí ở anot. Nếu thời gian điện phân là 2t giây thì ở catot thu được kim loại và tổng số mol khí (ở cả 2 bên điện cực) là 0,024 mol. Giá trị của m là : A. 0,784. B. 0,91. C. 0,896. D. 0,336. Ví dụ 1.2: Điện phân (với điện cực trơ, cường độ dòng điện không đổi) dung dịch chứa 17 gam muối M(NO3)n trong thời gian t, thấy khối lượng dung dịch giảm 9,28 gam và tại catot chỉ có a gam kim loại M bám vào. Sau thời gian 2t, khối lượng dung dịch giảm đi 12,14 gam và tại catot thấy thoát ra 0,672 lít khí (đktc). Vậy giá trị của a là A. 6,40. B. 8,64. C. 2,24. D. 6,48. Ví dụ 2: Điện phân với điện cực trơ dung dịch chứa 0,2 mol Cu(NO3)2, cường độ dòng điện 2,68A, trong thời gian t (giờ), thu được dung dịch X. Cho 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và 13,5 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phân là 100%. Giá trị của t là A. 0,60. B. 1,00. C. 0,25. D. 1,20. (Đề minh họa kỳ thi THPT Quốc Gia, năm 2015) Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang 1/5 - Mã đề thi 357
2 2 2 2 2 2 2
H
M
●
2 2 2
Cu
+ Vì ion không bị oxi hóa nên ở anot H2O bị oxi hóa tạo ra khí O2. 2 4SO + Ở catot thứ tự khử như sau : M2+ > H2O. ● Điện phân trong thời gian 2t giây.
OH H M 0,0352?
O
? ?0,0352 Theogiathietvabaotoanelectron,taco: nn0,1245n0,0545;n0,0855 13,682n2n4nM09664(Cu) ,0855
Điện
O
Cupö Cupö 0,035 ? Theobaotoanelectron,taco: 2n4nn0,07molym0,07644,48gam
dụ tương tự
dụ 2.1: Điện phân 150 ml dung dịch AgNO3 1M với điện cực
trong t giờ, cường độ dòng điện không đổi 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 12,6 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 14,5 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là : A. 0.8. B. 0,3. C. 1,0. D. 1,2. (Đề thi tuyển sinh đại học khối A năm 2012) Ví dụ 3: Điện phân dung dịch X chứa a mol CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của a là A. 0,26. B. 0,24. C. 0,18. D. 0,15 (Đề thi tuyển sinh Đại học khối A, năm 2014) Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang 2/5 - Mã đề thi 357 2 Cu
2 3 2 32 dö 02mol 3
n
Fe:zmol
Cu:xmol
5gam 2
NOn chatran electrontraoñoi BTÑTtrongX:2xy0,4
z0,1875 m:64x(14,456z)13,5 F.n 96500.0,1 t 3600giay1giô I 2,68 Ví
Cu2+ >
●
+
nguyên tố Cl, giả thiết và bảo toàn electron, ta có : 2 2 2 2 2 2 2 Cl O Cl Cl etraoñoiCl O ClO 10,2 n0,1;n0,01 nn 0,1 22 n2n4n0,24 nn0,11 ● Điện phân trong thời gian 2t giây. + Theo bảo toàn electron và giả thiết, ta có : Fe (2) ñpdd (1)
CutrongX
13, dungdòchX
0,2m12,8gamChatrancoFedö. Sôñophanöng:
Cu(ôcatot) NO:2zmol
Cu:xmol Cu(NO) H:ymol Fe NO:0,4mol
O(ôanot) NO
x0,15 BTEchopö(2):2z2x3(0,42z)y0,1
: Ví
trơ
+ Thứ tự khử trên catot :
H2O; Thứ tự oxi trên anot : 2 ClHO.
Điện phân dung dịch trong thời gian t giây.
Theo bảo toàn
dụ tương tự
Ví dụ 3.1: Điện phân dung dịch chứa m gam hỗn hợp NaCl và Cu(NO3)2 đến khi dung dịch hết màu xanh thì ở anot thu được 3,36 lít (đktc) hỗn hợp khí A. Biết tỉ khối của A so với H2 là 29. Giá trị m là A. 53. B. 49,3. C. 32,5. D. 30,5. (Đề thi thử Đại học lần 1 – THPT chuyên ĐHSP Hà Nội, năm học 2013 – 2014)
Ví dụ 3.2: Điện phân 2 lít dung dịch hỗn hợp gồm NaCl và CuSO4 đến khi H2O bị điện phân ở hai điện cực thì dừng lại, tại catot thu được 1,28 gam kim loại và tại anot thu 0,336 lít khí (đktc). Coi thể tích dung dịch không đổi thì pH của dung dịch thu được là : A. 3. B. 2. C. 12. D. 13. Ví dụ 3.3: Dung dịch X gồm Cu(NO3)2 và HCl. Điện phân một nửa dung dịch X (điện cực trơ, cường độ dòng điện không đổi), sau một thời gian thu được 0,14 mol một khí duy nhất ở anot. Dung dịch sau điện phân phản ứng vừa đủ 550 ml dung dịch NaOH 0,8M, thu được 1,96 gam kết tủa. Khối lượng Cu tối đa có thể hòa tan trong một nửa dung dịch X (giải phóng khí NO, sản phẩm khử duy nhất) là
A. 9,6. B. 12,8. C. 6,4. D. 19,2. (Đề thi thử Đại học lần 1 – THPT Lục Ngạn số 1 – Bắc Giang, năm học 2013 – 2014)
Ví dụ 3.4: Điện phân dung dịch gồm 18,8 gam Cu(NO3)2 và 29,8 gam KCl (điện cực trơ, màng ngăn). Sau một thời gian khối lượng dung dịch giảm 17,15 gam so với ban đầu, thể tích dung dịch là 400 ml. Nồng độ mol/lít các chất trong dung dịch sau điện phân là:
A. 3 [KCl]0,5M;[KNO]0,25M;[KOH]0,25M
B. 3 [KCl]0,25M;[KNO]0,25M;[KOH]0,25M
C. 3 [KCl]0,375M;[KNO]0,25M;[KOH]0,25M.
D. 3 [KCl]0,25M;[KNO]0,5M;[KOH]0,25M.
(Đề thi thử Đại học lần 1 – THPT chuyên Quốc Học Huế, năm học 2013 – 2014) Ví dụ 3.5: Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO3)2 với điện cực trơ, sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào dung dịch X đến khi các phản ứng xảy ra hoàn toàn, thấy khối lượng thanh sắt giảm 1,8 gam và thấy thoát ra khí NO duy nhất. Giá trị của x là: A. 0,4. B. 0,5. C. 0,6. D. 0,3. (Đề thi thử Đại học lần 1 – THPT chuyên KHTN Huế, năm học 2013 – 2014) Ví dụ 4: Điện phân dung dịch hỗn hợp NaCl và 0,05 mol CuSO4 bằng dòng điện một chiều có cường độ 2A (điện cực trơ, có màng ngăn). Sau thời gian t giây thì ngừng điện phân, thu được khí ở hai điện cực có tổng thể tích là 2,352 lít (đktc)
DẠYKÈMQUYNHƠN OFFICIAL Trang 3/5 - Mã đề thi 357 2 2 2 2 2 2 2 2 2 2
Cl O
?
O H Cu
H Cu
electrontraoñoi
0,1
ClOH 01??
electrontraoñoi
? 009 0,48 ôanot:n 0,482n4n ôcaanotvacatot:nnn0,26 n0,07;n0,09 n0,15 ôcatot:n 2n2n
Ví
:
và dung dịch X. Dung dịch X hoà tan được tối đa 2,04 gam Al2O3. Giả sử hiệu xuất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của t là A. 9408. B. 7720. C. 9650. D. 8685. (Đề thi THPT Quốc Gia, năm 2016) Hướng dẫn giải + Thứ tự khử trên catot : Cu2+ > H2O; Thứ tự oxi trên anot : 2 ClHO + Dung dịch X hòa tan được Al2O3, chứng tỏ X có chứa hoặc . H OH
đây là ví dụ tương tự : Ví dụ 4.1: Điện phân dung dịch hỗn hợp CuSO4 (0,05 mol) và NaCl bằng dòng điện có cường độ không đổi 2A (điện cực trơ, màng ngăn xốp). Sau thời gian t giây thì ngừng điện phân, thu được dung dịch Y và khí ở hai điện cực có tổng thể tích là 2,24 lít (đktc). Dung dịch Y hòa tan tối đa 0,8 gam MgO. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của t là A. 6755. B. 772. C. 8685. D. 4825.
(Đề thi tuyển sinh Cao đẳng, năm 2014)
Ví dụ 5: Điện phân (điện cực trơ, màng ngăn xốp) một dung dịch chứa m gam hỗn hợp CuSO4 và NaCl cho tới khi nước bắt đầu bị điện phân ở cả hai điện cực thì dừng lại, thu được dung dịch X và 0,56 lít khí (đktc) ở anot. Dung dịch X có thể hoà tan tối đa 0,85 gam Al2O3 Khối lượng của m là : A. 5,5916. B. 6,2125. C. 5,5916 hoặc 7,4625. D. 5,5916 hoặc 6,2125. (Đề
DẠYKÈMQUYNHƠN OFFICIAL Trang 4/5 - Mã đề thi 357 2 22 4 2 ddX 4 2 22 4 2 ddX Sôñophanöng: Na
Na
3 23 2 4 23 2 2 2 4 23 AlO H Al Na SO H 23 AlO OHAlO Cl Na SO OH TH1: BTÑTtrongpöcuaXvôiAlO:n3n6n0,12
2 2 2 2 2 2 2 2 2 ClOH O 0,07?? Cl O H H Cu 0,05 0,07 ? ? electrontraoñoi 07 GT:nnn0,105 n0,005 BTE:2n4n2n2nn0,03
t
I 2
anot:Cl,O SO:0,05mol catot:H H NaCl CuSO:0,05mol
anot:Cl,O SO:0,05mol catot:H OH
BTÑTtrongX:n2nn0,02(loai) TH2: BTÑTtrongpöcuaXvôiAlO:nn2n0,04 n0, BTÑTtrongX:n2nn0,14
Fn 96500.(2.0,074.0,005)
7720giay
Dưới
thử THPT
tự khử trên
+
dịch X hòa tan
thi
Quốc Gia lần 2 – THPT chuyên Hùng Vương – Phú Thọ, năm 2016) Hướng dẫn giải + Thứ
catot : Cu2+ > H2O; Thứ tự oxi trên anot : 2 ClHO.
Dung
được Al2O3, chứng tỏ X có chứa hoặc . H OH TH1 TH2
TH1 TH2
5.1: Tiến hành điện phân dung dịch chứa m gam hỗn hợp CuSO4 và NaCl (hiệu suất 100%, điện cực trơ, màng ngăn xốp), đến khi nước bắt đầu bị điện phân ở cả hai điện cực thì ngừng điện phân, thu được dung dịch X và 6,72 lít khí (đktc) ở anot. Dung dịch X hòa tan tối đa 20,4 gam Al2O3. Giá trị của m là A. 25,6. B. 23,5 C. 51,1. D. 50,4. (Đề thi tuyển sinh Đại học khối A năm 2013)
Ví dụ 5.2: Điện phân dung dịch chứa m gam hỗn hợp 2 muối CuSO4 và NaCl bằng điện cực trơ đến khi nước bị điện phân ở cả hai điện cực thì dừng lại. Dung dịch thu được sau điện phân hoàn tan vừa đủ 1,6 gam CuO và ở anot của bình điện phân có 448 ml khí bay ra (đktc). Giá trị của m là : A. 5,97. B. 7,14. C. 4,95. D. 3,87.
ĐÁP ÁN CÁC VÍ DỤ TƯƠNG TỰ 1.1C 1.2B 2.1C 3.1B 3.2B 3.3A 3.4D 3.5B 4.1C 5.1C 5.2A
DẠYKÈMQUYNHƠN OFFICIAL Trang 5/5 - Mã đề thi 357 2 4 22
ddX 4 2 4 2
ddX Sôñophanöng: Na:xmol
H NaCl:xmol CuSO:ymol Na:xmol
OH 2 2 3 23 2 4 2 23 2 2 ClO AlO H Al 0,5x0,0125 NaH SO O H x0,05 y AlO OHAlO Cl TH1: nn0,025n3n6n0,05 x0,025 ; 1 nn2ny0,0375nn0,0125 4 m0,025.58,50,0375.1607,4625gam. TH2: 1 nn2n 60 n0,5x0, 2 4 Na SO OH x
Ví dụ tương tự : Ví dụ
0,5xmol
0,5xmol
SO:ymolanot:Cl,O
SO:ymolanot:Cl
y1/60 025x0,05 1 m0,0558,51605,5916gam n2nn 1 60 y15 m7,4625gamhoacm5,5916gam
CHUYÊN ĐỀ : GIẢI NHANH BÀI TẬP LIÊN MÔN HÓA - TOÁN
Từ năm 2014 đến nay, trong đề thi Đại học và đề thi THPT Quốc Gia thường xuất hiện dạng bài tập hóa học mà sự biến thiên lượng chất được biểu diễn bằng đồ thị. Điều này đã làm cho một lượng lớn thí sinh lúng túng, còn một số khác thì không tìm được hướng giải.
Chuyên đề này sẽ giúp các em làm quen, hiểu và vận dụng thành thạo kiến thức liên môn Hóa – Toán để tìm ra phương pháp giải tối ưu nhất. Dưới đây là các ví dụ minh họa :
Ví dụ
1: Cho 3 thí nghiệm sau:
(1) Cho từ từ dung dịch AgNO3 đến dư vào dung dịch Fe(NO3)2.
(2) Cho bột sắt từ từ đến dư vào dung dịch FeCl3
(3) Cho từ từ dung dịch AgNO3 đến dư vào dung dịch FeCl3. Trong mỗi thí nghiệm, số mol ion Fe3+ biến đổi tương ứng với đồ thị nào sau đây? Fe3+ Fe3+ Fe3+ t t t (a) (b) (c) A. 1-a, 2-c, 3-b. B. 1-a, 2-b, 3-c. C. 1-b, 2-a, 3-c.D. 1-c, 2-b, 3-a. Hướng dẫn giải + Đồ thị (a) cho thấy lượng Fe3+ từ 0 tăng dần sau đó không đổi nên ứng với thí nghiệm (1). Phương trình phản ứng : 2 3AgFeAgFe + Đồ thị (b) cho thấy lượng Fe3+ giảm dần về 0 nên ứng với phản ứng (2). Phương trình phản ứng : 3 2Fe2Fe3Fe
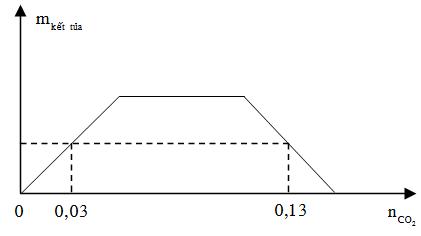
+ Đồ thị (c) cho thấy lượng Fe3+ không đổi nên ứng với phản ứng (3). Phương trình phản ứng : AgClAgCl
Vậy đáp án đúng là B. Ví dụ 2: Sục khí CO2 vào V lít dung dịch hỗn hợp NaOH 0,2 M và Ba(OH)2 0,1M. Đồ thị biểu diễn khối lượng kết tủa theo số mol CO2 như sau: Giá trị của V là : A. 300. B. 250. C. 400. D. 150. (Đề thi THPT Quốc Gia, năm 2016) Hướng dẫn giải + Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị sau :
DẠYKÈMQUYNHƠN
Trang 1/10 - Mã đề thi 357
OFFICIAL
+ Dựa vào tính tính của đồ thị, ta có : 0,1V0,030,130,3VV0,4lít
Ví dụ tương tự : Ví dụ 2.1: Cho hỗn hợp kim loại gồm x mol Na và y mol Ba vào nước dư, thu được V lít H2 (đo ở điều kiện tiêu chuẩn) và dung dịch X. Khi cho CO2 hấp thụ từ từ đến dư vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tỉ lệ x : y là
A. 2 : 1. B. 1 : 3. C. 1 : 1. D. 1 : 2.

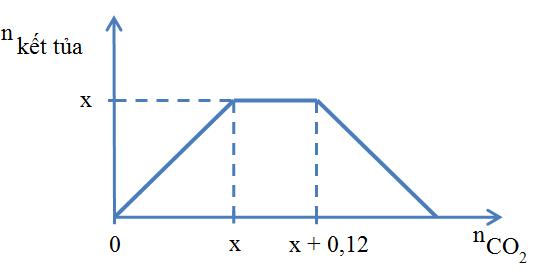
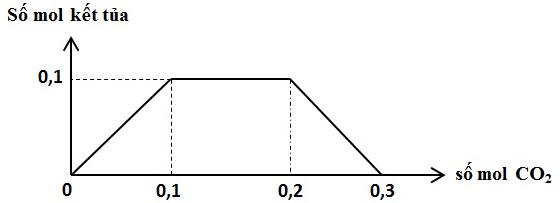
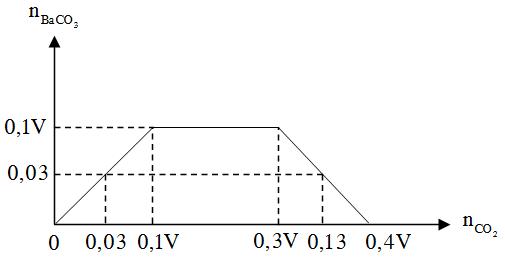
Ví dụ 2.2: Cho a mol Na và b mol Ba vào 200 ml dung dịch BaCl2 0,3M, thu được dung dịch X. Dẫn từ từ tới dư khí CO2 vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau :
Giá trị của a là
A. 0,18. B. 0,06. C. 0,24. D. 0,12.
Ví dụ 3: Cho từ từ dung dịch HCl vào dung dịch chứa a mol Ba(AlO2)2 và b mol Ba(OH)2 Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tỉ lệ a : b là A. 7 : 4. B. 4 : 7. C. 2 : 7. D. 7 : 2. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lý Tự Trọng – Cần Thơ, năm 2015) Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang 2/10 - Mã đề thi 357
OFFICIAL
gồm x mol Ba(OH)2 và y mol Ba[Al(OH)4]2 (hoặc Ba(AlO2)2), kết quả thí nghiệm được biểu diễn trên đồ thị sau: 0,1
SomolAl(OH)3 0,3 0,7 SomolHCl 0
0,2 Giá trị của x và y lần lượt là A. 0,05 và 0,15. B. 0,10 và 0,30. C. 0,10 và 0,15. D. 0,05 và 0,30. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Đại học Vinh – Nghệ An, năm 2015) Ví dụ 3.2: Cho từ từ HCl vào dung dịch A chứa a mol Ba(OH)2 và b mol Ba(AlO2)2 Đồ thị biểu diễn số mol Al(OH)3 theo số mol HCl như sau : nHCl 0,2 0,6 1,1 0

nAl(OH)3 Nếu cho dung dịch A ở trên tác dụng với 700 ml dung dịch H2SO4 1M thì thu được bao nhiêu gam kết tủa? A. 202,0 gam. B. 116,6 gam. C. 108,8 gam. D. 209,8 gam. Ví dụ 4: Cho m gam Al tác dụng với O2, sau một thời gian thu được (m + 2,88) gam hỗn hợp X. Cho hỗn hợp X tác dụng với dung dịch HCl dư, thu được a mol H2 và dung dịch Y. Rót từ từ dung dịch NaOH vào dung dịch Y ta có đồ thị sau :
0,3
DẠYKÈMQUYNHƠN OFFICIAL Trang 3/10 - Mã đề thi 357 Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị : Từ đồ thị và tính chất hình học
đồ
: 2 OH AlO n2b0,8;n2a
Ví dụ tương tự : Ví dụ 3.1: Khi nhỏ từ từ đến dư dung dịch
vào
dịch
của
thị, suy ra
b0,4a7 b4a0,73.[(0,82a)2]2,8(0,82a)
HCl
dung
hỗn hợp
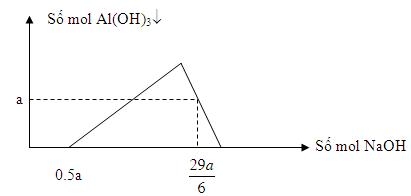
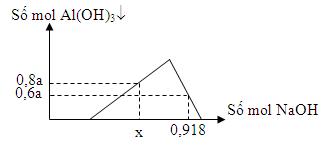
DẠYKÈMQUYNHƠN OFFICIAL Trang 4/10 - Mã đề thi 357 Cho hỗn hợp X tác dụng với dung dịch HNO3 dư, thu được V lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hiđro là 16,75 và dung dịch Z. Cô cạn dung dịch Z thu, được (m + 249a) gam chất rắn khan. Giá trị của V gần nhất với giá trị nào dưới đây ? A. 2,3. B. 2,1. C. 1,9. D. 1,7. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Bến Tre, năm 2015) Hướng dẫn giải 2 2 3 3 43 3 AlO H NaOHpö Al(OH)bòtan H Al 3 NHNO electronXnhöôngchoHNO A 3m2,8842a BTE:3n4n2n 2732 29a3mm Ñothò:nn3nn 0,5a a 6 2727 6,482490,180,24213 n 2,25.10 m6,48 80 a0,18n 3n 2 2 lO 3 NO NO 4n0,36 3x8y32,25100,36x0,0623;y0,0207nx 30x44yny 16,752 V1,85921,9lít xy Ví dụ tương tự : Ví dụ 4.1: Dung dịch X chứa a mol AlCl3 và 2a mol HCl. Rót từ từ dung dịch NaOH vào dung dịch X ta có đồ thị
sau : Giá trị của x là A. 0,624. B. 0,748. C. 0,756. D. 0,684. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Bến Tre, năm 2015) Ví dụ 4.2: Cho x gam Al tan hoàn toàn vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau:
Giá trị của x là
A. 27,0. B. 26,1. C. 32,4. D. 20,25. Ví dụ 4.3: Hỗn hợp X gồm Cu và Al2O3 có tỉ lệ mol tương ứng là 4 : 3. Cho m gam hỗn hợp X tác dụng với dung dịch HCl dư thu được chất rắn Y và dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Rót từ từ dung dịch NaOH vào dung dịch Z ta có đồ thị sau:
Cho chất rắn Y tác dụng với dung dịch HNO3 dư, thu được x mol khí NO2 (sản phẩm khử duy nhất). Giá trị của x là:
A. 0,48. B. 0,36. C. 0,42. D. 0,40. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực – Thái Bình, năm 2016)
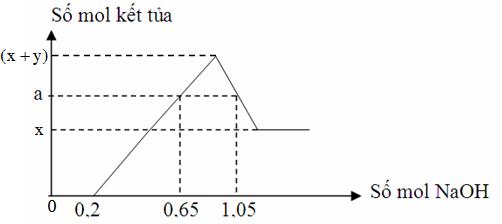

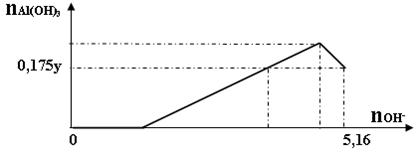
Ví dụ 5: Nhỏ từ từ dung dịch NaOH vào dung dịch X chứa 41,575 gam gồm các chất HCl, MgCl2, AlCl3 Tiến trình phản ứng được biểu diễn bởi đồ thị sau :
Giá trị của a là
A. 0,15. B. 0,2. C. 0,3. D. 0,35. Hướng dẫn giải
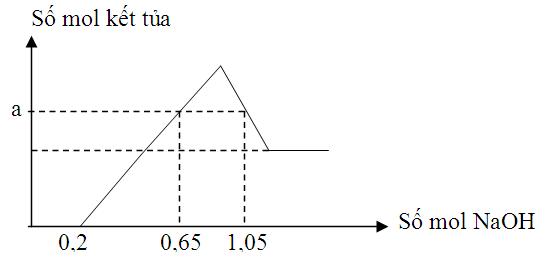
+ Gọi số mol của MgCl2 và AlCl3 lần lượt là x và y. Ta có đồ thị sau :
+ Từ đồ thị suy ra Ta có : HCl n0,2.
DẠYKÈMQUYNHƠN
Trang 5/10 - Mã đề thi 357
OFFICIAL
m95x133,5y0,2.36,541,575 x0,5 n 2x3(ax)0,20,65 y0,5 a0,2 n 2x3y(xya)0,21,05
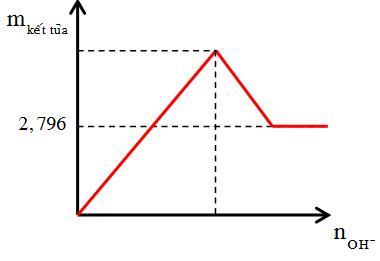
Để lượng kết tủa không đổi thì thể tích
dung d

DẠYKÈMQUYNHƠN OFFICIAL Trang 6/10 - Mã đề thi 357
X OHmintaoraamolkettua OHmaxtaoraamolkettua
Ví dụ tương tự : Ví dụ 5.1: Dung dịch X chứa AlCl3, HCl và MgCl2, trong đó số mol MgCl2 bằng tổng số mol HCl và AlCl3. Rót từ từ dung dịch NaOH vào dung dịch X ta có đồ thị sau :
ị
ấ
ầ
A. 30 ml. B. 60 ml. C. 45 ml. D. 80 ml. Hướng dẫn giải + Dựa vào bản chất phản ứng và đồ thị, ta thấy : 3 2 4 4 2 3 2 4 OHminñemkhongñoiAl BaSO SO Ba(OH)minñemkhongñoi Al SO 2,796 n 4n0,032 nn 0,012 233 0,032 2 V 0,08lít nn0,008 2.0,2 3 Ví dụ tương tự : Ví dụ 6.1: Nhỏ từ từ dung dịch Ba(OH)2 0,5M vào ống nghiệm chứa V lít dung dịch Al2(SO4)3 x mol/lít. Quá trình phản ứng được biểu diễn trên đồ thị sau :
Với x1 + x2=0,48. Cho m gam AgNO3 vào dung dịch X, thu được m1 gam kết tủa và dung dịch chứa 45,645 gam chất tan. Giá trị của m1 là : A. 55,965. B. 58,835. C. 111,930. D. 68,880. Ví dụ 6: Nhỏ từ từ dung dịch Ba(OH)2 0,2M vào ống nghiệm chứa V lít dung dịch Al2(SO4)3 C (mol/l). Mối quan hệ giữa khối lượng kết tủa (gam) và số mol được biểu diễn bằng đồ thị sau : OH
ch Ba(OH)2 nhỏ nh
t c
n dùng là :
Để lượng kết tủa không đổi thì thể tích dung dịch Ba(OH)2 nhỏ nhất cần dùng là
A. 0,24 lít. B. 0,30 lít. C. 0,32 lít. D. 0,40 lít.
Ví dụ 6.2: Nhỏ từ từ dung dịch đến dư Ba(OH)2 0,2M vào 100 ml dung dịch A chứa Al2(SO4)3 xM. Mối quan hệ giữa khối lượng kết tủa và số mol được biểu diễn bằng đồ thị sau: OH
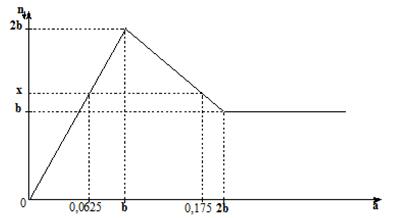
Nếu cho 100 ml dung dịch hỗn hợp Ba(OH)2 0,2M và NaOH 0,3M vào 100 ml dung dịch A thì khối lượng kết tủa thu được là bao nhiêu?
A. 5,44 gam. B. 4,66 gam. C. 5,70 gam. D. 6,22 gam. (Đề thi thử THPT Quốc Gia lần 3 – THPT Quỳnh Lưu – Nghệ An, năm 2016)

Ví dụ 6.3: Cho từ từ dung dịch chưa a mol Ba(OH)2 vào dung dịch chưa b mol ZnSO4 Đồ thị biểu diễn số mol kết tủa theo giá trị của a như sau:
Giá trị của b là : A. 0,1. B. 0,12. C. 0,08. D. 0,11. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Hạ Long – Quảng Ninh, năm 2016)
Ví dụ 7: Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch hỗn hợp Al2(SO4)3 và AlCl3, thu được kết tủa có khối lượng theo số mol Ba(OH)2 như đồ thị:
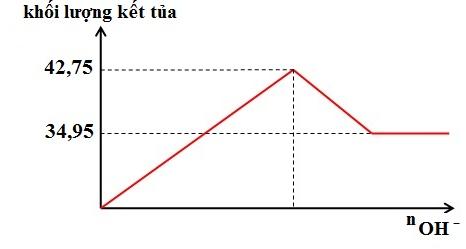
DẠYKÈMQUYNHƠN
Trang 7/10 - Mã đề thi 357
OFFICIAL
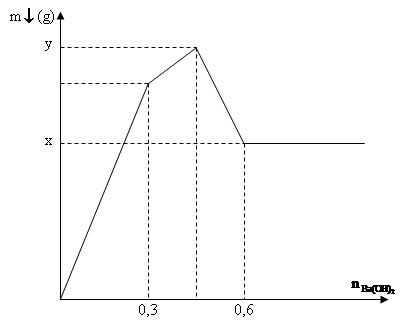


DẠYKÈMQUYNHƠN OFFICIAL Trang 8/10 - Mã đề thi 357
bị hòa tan
3 243 243 3 3 3 3 4 Al(SO) OHlamkettuahetAltrongAl(SO) AlCl OHlamkettuahetAltrongAlClvalamtanhetAl(OH) BaSO A n 6a na nbn 3b(2ab) n3a0,3 6a0,32 a0,1 n3b(2ab)2(0,60,3)b0,1 3 4 4 3 l(OH) BaSO BaSOAl(OH) (2ab)0,3 xm69,9 xy163,2 ymm93,3 Ví dụ tương tự : Ví dụ 7.1: Cho từ từ dung dịch Ba(OH)2 vào dung dịch chứa Al2(SO4)3 và AlCl3 thì khối lượng kết tủa sinh ra được biểu diễn bằng đồ thị sau. Giá trị của x gần với giá trị nào nhất sau đây? (1) (2) (3)
Tổng giá trị (x + y) bằng A. 163,2. B. 162,3. C. 132,6. D. 136,2. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Vĩnh Phúc, năm 2015) Hướng dẫn giải + Ta thấy đồ thị được hình thành bởi 3 đường : (1) là kết tủa tạo thành khí Al2(SO4)3 phản ứng với Ba(OH)2 ; (2) là kết tủa tạo thành khi AlCl3 phản ứng với Ba(OH)2 ; (3) là kết tủa Al(OH)3 sinh ra
hết.
A. 0,029. B. 0,025. C. 0,019. D. 0,015. Ví dụ 8: Dung dịch A chứa a mol ZnSO4; dung dịch B chứa b mol AlCl3; dung dịch C chứa c mol NaOH. Tiến hành 2 thí nghiệm sau:


Thí nghiệm 1: Cho từ từ dung dịch C vào dung dịch A; Thí nghiệm 2: Cho từ từ dung dịch C vào dung dịch B.
Lượng kết tủa ở 2 thí nghiệm biến đổi theo đồ thị sau đây: n nNaOH
b 4a 0,32 0 x
a __
Tổng khối lượng kết tủa ở 2 thí nghiệm khi dùng x mol NaOH gần nhất với giá trị nào sau đây ? A. 9. B. 8. C. 8,5. D. 9,5. (Đề thi thử THPT Quốc Gia lần 2 – THPT Thị Xã Quảng Trị, năm 2015) Hướng dẫn giải
Gọi lượng kết tủa tạo thành trong 2 thí nghiệm khi dùng x mol NaOH, ta có đồ thị :
+ Dựa bản chất phản ứng của dung dịch NaOH với dung dịch AlCl3 và dạng hình học của đồ thị, ta thấy : 4a3b a0,06 3(0,324a)4ab0,08
Dựa bản chất phản ứng của dung dịch NaOH với dung dịch ZnSO4, AlCl3 và dạng hình học của 2 đồ thị, ta thấy :
DẠYKÈMQUYNHƠN
Trang 9/10 - Mã đề thi 357
OFFICIAL
kettua
x3y x3y0
: Đồ
Mg vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X được biểu diễn như hình vẽ dưới đây: Sau khi phản ứng xảy ra hoàn toàn rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5 Tỉ lệ a : b là A. 1 : 6. B. 1 : 8. C. 1 : 10. D. 1 : 12.
+
x0,114;y0,0484ax2yx2y0,24 m0,048(9978)8,4968,5
Ví dụ 9
thị biểu diễn sự phụ thuộc của khối lượng

DẠYKÈMQUYNHƠN OFFICIAL Trang 10/10 - Mã đề thi 357 (Đề thi thử THPT Quốc Gia lần 1 – THPT Tiên Du – Bắc Ninh, năm 2016) Hướng dẫn giải Sự biến thiên khối lượng thanh Mg được hợp bởi 3 đường : (1) là Mg phản ứng với ; (2) là Mg 3
phản ứng với Cu2+; (3) là Mg phản ứng với H+ . + Từ đường (1) và bản chất phản ứng, ta có : 3 3 3 MgpöNONO NO 18:24 Hphanöng HphanöngNO BTE:2n3n3n n0,5 a0,25 n 2 Banphanöng:n 4n + Từ đường (3) và bản chất phản ứng, ta có : 2 2 Mgpö Hpö Mg HCl MgHpö (m8)(m14) n0,5 nn 0,25 24 bn20,52,5 2nn
ĐÁP ÁN VÍ DỤ TƯƠNG TỰ
(HvaNO)
a:b1:10
2.1C 2.2C 3.2A 3.2C 4.1B 4.2C 4.3A 5.1A 6.1D 6.2A 6.3A 7.1B (1) (3) (2)
CHUYÊN ĐỀ 4 : SỬ DỤNG PHƯƠNG PHÁP BẢO TOÀN ELECTRON ĐỂ GIẢI NHANH BÀI TẬP ĐỐT CHÁY HỢP CHẤT HỮU CƠ
1. Cơ sở của phương pháp
Trong phản ứng đốt cháy hợp chất hữu cơ, tổng số mol electron hợp chất hữu cơ nhường bằng tổng số mol electron oxi nhận.
2. Tính nhanh số mol electron nhường, nhận trong phản ứng đốt cháy hợp chất hữu cơ
Trong hợp chất, tổng số oxi hóa của các nguyên tố bằng 0. Suy ra : Trong phân tử hợp chất hữu cơ có thể coi số oxi hóa của từng nguyên tố bằng 0.
của Y so với metan bằng 1,9625. Để đốt cháy hoàn toàn m gam hỗn hợp X trên cần dùng V lít khí O2 (đktc). Giá trị của V là : A. 29,12 lít. B. 17,92 lít. C. 13,36 lít. D. 26,88 lít. (Đề thi thử Đại học lần 2 – THPT Đinh Chương Dương – Thanh Hóa, năm học 2013 – 2014)
DẠYKÈMQUYNHƠN
Trang 1/7 - Mã đề thi 357
OFFICIAL
: o 00000 42120 t 2 xyzt2 2 2CHONOCOHON Suy ra : 2 2electronOnhanOn 4n xyzt xyzt electronCHONnhöông CHON n (4xy2z)n 3. Ví dụ minh họa Ví dụ 1 : Đốt cháy hỗn hợp X gồm 0,1 mol CH4, 0,15 mol C2H2, 0,2 mol C2H4 và 0,25 mol
V lít
2
V là
2
t 24 2 2 2
ot 2 22
Từ các phản ứng và giả thiết, ta có : 2 2 O O(ñktc) n1,425mol,V31,92lít ● Cách 2 : Sử dụng bảo toàn electron Theo bảo toàn electron, ta có : 2 4 22 24 2 2 O CH CH CH HCHO 0,25 ? 0,1 0,15 0,2 O O(ñktc) 4n8n10n12n4n n1,425mol,V31,92lít Ví dụ 2: Crackinh m gam butan, thu được hỗn hợp khí X (gồm 5 hiđrocacbon). Cho toàn bộ X qua bình đựng dung dịch nước brom dư,
Y không bị hấp thụ, tỉ khối hơi
Sơ đồ phản ứng cháy
HCHO cần
O
(ở đktc). Giá trị của
: A. 63,84 lít. B. 34,72 lít. C. 31,92 lít. D. 44,8 lít. (Đề thi thử Đại học lần 2 – THPT chuyên Hùng Vương – Phú Thọ, năm học 2013 – 2014) Hướng dẫn giải ● Cách 1 : Tính toán theo phương trình phản ứng: o o o t 4 2 2 2 t 22
22
CH2O CO2HO mol:0,10,2 CH2,5O 2COHO mol:0,150,375 CH3O 2CO2HO mol:0,20,6
HCHOO COHO mol:0,250,25
thấy khối lượng bình brom tăng 5,32 gam và còn lại 4,48 lít (đktc) hỗn hợp khí
Hỗn hợp khí X gồm O2 và O
tỉ
của
so
H2 là 17,6. Hỗn hợp khí Y gồm C2H4 và CH4, tỉ khối của Y so với H2 là 11. Thể tích hỗn hợp khí X (đktc) tối thiểu cần dùng để đốt cháy hoàn toàn 0,044 mol hỗn hợp khí Y là : A. 3,36 lít. B. 2,24 lít. C. 1,12 lít. D. 4,48 lít. (Đề thi thử Đại học lần 1 – Trường THPT Chuyên – Đại học Vinh, năm học 2013 – 2014) Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang 2/7 - Mã đề thi 357 Hướng dẫn giải Sơ đồ phản ứng : 362 242 436 crackinh 410 2624 410 X 4 26 410 Y,0,2mol CHBr CHBr CH,CH CH CH,CH CHdö CH CH CH Theo giả thiết và bảo toàn khối lượng, ta có : Đốt cháy X cũng chính là đốt cháy C4H10 ban đầu. 410bñ 2 410bñ CH XbìnhBrtang Y 0,21,962516 5,32 CH mmm m11,6 11,6 n 0,2 58 Áp dụng bảo toàn electron trong phản ứng đốt cháy C4H10, ta có : 2 410
2 2 O O n1,3molV29,12lít Ví
Nhận thấy : 424 (CH,CH) 1628 M 22 2 4 24CHCH 0,044 nn 0,022. 2 Quy đổi O2 và O3 thành O. Theo bảo toàn electron và bảo toàn khối lượng, ta có : 4 24 23 23 23 23 OCH CH ?0,022 0,022 (O,O)O O (O,O)O (O,O) (O,O) 2n8n12n mm n0,22 mm0,22163,52 3,52 n 0,1 17,62 V0,1.22,42,24lít Ví dụ 4: Cho hỗn hợp chất rắn gồm CaC2, Al4C3, Ca vào nước, thu được hỗn hợp X gồm 3 khí, trong đó có hai khí có cùng
2Br
O CH ? 02 4n26n
dụ 3:
3,
khối
X
với
số mol. Lấy 8,96 lít hỗn hợp X (đktc) chia làm 2 phần bằng nhau. Phần 1 cho vào dung dịch AgNO3 (dư) trong NH3, sau phản ứng hoàn toàn thấy tách ra 24 gam kết tủa. Phần 2 cho qua Ni, đun nóng thu được hỗn hợp khí Y. Thể tích O2 vừa đủ (đktc) cần dùng để đốt cháy hoàn toàn Y là:
Đun nóng hỗn hợp X một thời gian thu được 1,792 lít hỗn hợp khí Y (ở đktc). Hỗn hợp khí Y phản ứng vừa đủ với dung dịch chứa 25,6 gam Br2 Thể tích không khí (chứa 20% O2 và 80% N2 về thể tích, ở đktc) cần dùng để đốt cháy hoàn toàn hỗn hợp Y là A. 35,840. B. 38,080. C. 7,616. D. 7,168. (Đề thi thử Đại học lần 1 – THPT Cẩm Lý – Bắc Giang, năm học 2013 – 2014) Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang 3/7 - Mã đề thi 357
Theo giả thiết, bảo toàn
2242 22 22 22 4 2 2 22 4 2 2 2 1 (CH,CH,H)trongX 2 CAg CHCAg CHH O CH CH H ? 0,1 0,050,05 O O(ñktc) 8,96 n 0,2 22,4.2 24 n 0,1 240 nn0,1 nn0,05 4n10n8n2n n0,375;V8,4lít Ví dụ 5: Hỗn hợp X gồm vinylaxetilen và hiđro có
Sử dụng sơ đồ đường
: 44 2
Hbanñau n 32233x n 523222x Gọi a là số mol H2 phản ứng. Theo sự bảo toàn số liên kết , bảo toàn C và sự tăng giảm số mol khí, ta có : 44 2 2 CH4y Hdö 2 CHBrphanöngHphanöng 3x 0,16 a Y n n 3nn n 1,792n3x(2xa) 0,08 22,4 9x0,16ax0,02 5xa0,08a0,02 Đốt cháy hỗn hợp Y cũng chính là đốt cháy hỗn hợp X. Theo bảo toàn electron, ta có : 2 44 2 2 O CH H O ? 0,0230,022 khongkhí(ñktc) 4n20n2nn0,32 V 0,32.5.22,435,84lít Ví dụ 6: Hỗn hợp X gồm HCHO, CH3COOH, HCOOCH3 và CH3CH(OH)COOH. Đốt cháy hoàn toàn X cần V lít O2 (đktc), hấp thụ hết sản phẩm cháy vào một lượng dư nước vôi trong thu được 50 gam kết tủa. Giá trị của V là : A. 7,84. B. 8,40. C. 11,2. D. 16,8. (Đề thi thử Đại học lần 2 – THPT Cẩm Khê – Phú Thọ, năm học 2013 – 2014) Hướng dẫn giải
A. 5,6 lít. B. 8,4 lít C. 8,96 lít. D. 16,8 lít. (Đề thi thử Đại học lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2013 – 2014) Hướng dẫn giải
nguyên tố C và bảo toàn electron, ta có :
tỉ khối hơi so với H2 là 16.
chéo, ta có
CHbanñau
Dễ thấy các chất trong X đều có công thức phân tử là CxH2xOx Trong phản ứng đốt cháy, theo bảo toàn nguyên tố C và bảo toàn electron, ta có:
7: Đốt cháy hoàn toàn hỗn hợp X gồm 2 ancol (đa chức, cùng dãy đồng đẳng) cần vừa đủ V lít khí O2 (đktc). Sau phản ứng thu được 0,25a mol CO2 và 6,3a gam H2O. Biểu thức tính V theo a là A. V= 7,28a. B. V=14,56a. C. V= 4,48a. D. V= 8,96a. (Đề thi thử Đại học lần 1 – THPT Tĩnh Gia 2 – Thanh Hóa, năm học 2013 – 2014) Hướng dẫn giải Theo giả thiết, ta có :
Oxi hoá hoàn toàn m gam hỗn hợp X gồm hai anđehit no, đơn chức, mạch hở, kế tiếp nhau trong dãy đồng đẳng, thu được (m + 8) gam hỗn hợp Y gồm hai axit. Mặt khác, đem đốt cháy hết hỗn hợp X cần vừa đủ 12,32 lít O2 (ở đktc). Giá trị m là A. 15,47. B. 17,81. C. 15,48. D. 17,80. (Đề thi thử Đại học lần 2 – THPT Xuân Áng 1, Khê – Phú Thọ, năm học 2013 – 2014) Hướng dẫn giải Đặt công thức của hai anđehit trong X là n2n CHO. Theo sự tăng khối lượng trong phản ứng oxi hóa X và bảo toàn electron trong phản ứng của X với O2, ta có
DẠYKÈMQUYNHƠN OFFICIAL Trang 4/7 - Mã đề thi 357
x2xx 2 3 x2xx 2 2 2 CHOCOCaCO CHO O ? 0,5 O O(ñktc)
xnnn
Ví
2 2 2 X CO X HOCO OtrongX n
n
nn
2 2 2
Ví
: 2 n2n n2n 2 n2n CHOCHO CHOO 0,55 0,5 8 nn 0,5 16 (6n2)n4n Suy ra :
50
0,5 100 4xn4n n0,5 V0,522,411,2lít
dụ
2 2 HO CO 6,3a n 0,35an0,25a 18
Xgom2ancolno
C 2,5
Xgom2ancolno,2chöc n2(0,35a0,25a)0,2a
Theo bảo toàn nguyên tố C, H và bảo toàn electron, ta có :
CCO HHO CHO OtrongX 00,7a ,25a V 0,2a 22,4 nn0,25a;n2n0,7a 4nn4n2n V7,28a
dụ 8:
5,23,88 nn 0,06 22 3,88 M(14n32)0,06
Ví dụ 9: Trung hòa 3,88 gam hỗn hợp X gồm 2 axit cacboxylic no, đơn chức, mạch hở bằng một lượng vừa đủ NaOH, sau đó cô cạn dung dịch thì thu được 5,2 gam muối khan. Nếu đốt cháy hết 3,88 gam X thì thể tích oxi (đktc) cần dùng là A. 4,48 lít. B. 2,24 lít. C. 3,36 lít. D. 1,12 lít. (Đề thi thử Đại học lần 2 – THPT Cẩm Khê – Phú Thọ, năm học 2013 – 2014) Hướng dẫn giải O CHO ? 0,06 O O(ñktc)
toàn 7 n 3 4n(4n2n2.2)n n0,15,V3,36lít
2 n2 2n 2 2
cháy X, ta có
Ví dụ
10: Cho
7,45 gam hỗn hợp X gồm các axit hữu
cơ
(phân tử chỉ chứa một loại nhóm chức) tác dụng hết với dung dịch NaHCO3 dư, thấy giải phóng 3,36 lít khí CO2 (đktc). Mặt khác, đốt cháy hoàn toàn 7,45 gam hỗn hợp X cần dùng vừa hết 2,52 lít O2 (đktc), thu được sản phẩm gồm CO2 và hơi nước. Dẫn toàn bộ sản phẩm cháy vào 150 ml dung dịch Ba(OH)2 1M, sau khi phản ứng xảy ra hoàn toàn thấy khối lượng dung dịch Ba(OH)2
ứng đốt cháy X, ta có : 3 2 2 2 2 COOHNaHCOCO O/axit COOH CH O/axit 0,3 CHO/axitO 0,30,1125 CO C HO H nnn0,15 n2n0,3 12nn16n7,45 4nn2n4n n0,2n0,2 n0,125n0,25 2 2 3 2 2 2 3 2 2 CO Ba(OH) BaCO Ba(OH)CO ddBa(OH)giamBaCOCOHO 0,2440,125180,1197 Vìn0,2,n0,15 n2nn0,1 m mmm8,65gam
DẠYKÈMQUYNHƠN OFFICIAL
5/7 - Mã đề thi 357
Theo sự tăng giảm khối lượng, giả thiết và bảo
Trang electron trong phản ứng đốt
n2n CHO : 2 2 n2n n2n1 n2 2n
3,2 n 3 143,2 m0,5(16)15,47gam 3 CHOCHONa CHO
Hướng dẫn : Dựa vào bản chất phản ứng của X với
A. giảm 8,65 gam. B. giảm 19,7 gam. C. tăng 11,05 gam. D. giảm 18,5 gam. (Đề thi chọn học sinh giỏi tỉnh Nam Định, năm học 2012 – 2013)
NaHCO3, bảo toàn nguyên tố O; bảo toàn electron trong phản
Ví dụ 11: Hỗn hợp X gồm 2 amino axit no (chỉ có nhóm chức –COOH và –NH2 trong phân tử), trong đó tỉ lệ mO : mN = 80 : 21. Để tác dụng vừa đủ với 3,83 gam hỗn hợp X cần 30 ml dung dịch HCl 1M. Mặt khác, đốt cháy hoàn toàn 3,83 gam hỗn hợp X cần 3,192 lít O2 (đktc). Dẫn toàn bộ sản phẩm cháy (CO2, H2O và N2) vào nước vôi trong dư thì khối lượng kết tủa thu được là A. 20 gam. B. 13 gam. C. 10 gam. D. 15 gam. (Đề thi tuyển sinh Đại học khối A năm 2012)
Thuỷ phân hoàn toàn m gam một pentapeptit mạch hở M, thu được hỗn hợp gồm hai amino axit X1, X2 (đều no, mạch hở, phân tử chứa một nhóm -NH2 và một nhóm -COOH). Đốt cháy toàn bộ lượng X1, X2 ở trên cần dùng vừa đủ 0,255 mol O2, chỉ thu được N2, H2O và 0,22 mol CO2. Giá trị của m là A. 6,34. B. 7,78. C. 8,62. D. 7,18. (Đề thi thử Đại học lần 1 – THPT chuyên KHTN Huế, năm học 2013 – 2014) Hướng dẫn giải
DẠYKÈMQUYNHƠN
Trang 6/7 - Mã đề thi 357
OFFICIAL
Theo giả
ta có : 2 NNHHCl O O N nnn0,03 n0,1mol n80215 : n16141,5 Áp dụng bảo toàn khối lượng cho hỗn hợp X, bảo toàn electron trong phản ứng đốt cháy X và bảo toàn nguyên
ta có : 2 3 2 3 CHXNO ??3,830,03140,116 CHOO ??0,10,1425 C H CaCOCOC CaCO 12nnmmm1,81 4nn2n4n0,77
Ví
Đặt
Áp dụng bảo toàn nguyên tố C và bảo toàn electron trong phản ứng đốt cháy X1 và X2, ta có: 2 2 n2n1 2 2 n2n1 2n2n1 2n2n1 CHONCO CHONO 0,255 CHON CHON n.n n0,22 (6n3)n 4n1,02 n.n 0,22 n2,2 n 0,1 2 2 n2n1 pentapeptitM (5CHON4HO)M 317 Theo bảo toàn nguyên tố C, ta có : 2 2 2 n2n1 n2n1 2 2 n2n1 2 2 n2n1 (5CHON4HO)CHON (5CHON4HO) (5CHON4HO) 5n n 0,1 n 0,02 m 6,34gam
Hướng dẫn giải
thiết,
tố C,
n0,13;n0,25 nnn0,13 m0,1310013gam
dụ 12:
công thức phân tử trung bình của X1, X2 là 2n2n1 CHON
Ví dụ 13: X và Y lần lượt là các tripeptit và hexapeptit được tạo thành từ cùng một amoni axit no mạch hở, có một nhóm –COOH và một nhóm –NH2 Đốt cháy hoàn toàn 0,1 mol X bằng O2 vừa đủ, thu được sản phẩm gồm CO2, H2O và N2, có tổng khối lượng là 40,5 gam. Nếu cho 0,15 mol Y tác dụng hoàn toàn với NaOH (lấy dư 20%), sau phản ứng cô cạn dung dịch thu được bao nhiêu gam chất rắn ? A. 9,99 gam. B. 87,3 gam. C. 94,5 gam D. 107,1 gam. (Đề thi thử Đại học lần 1 – THPT Hồng Lĩnh, năm học 2013 – 2014) Hướng dẫn giải Theo giả
DẠYKÈMQUYNHƠN
Trang 7/7 - Mã đề thi 357
OFFICIAL
n2n12 2 n2n12 2
Theo
và
2 2 222 O X X O
Y
m
Trong phản ứng của Y với NaOH, theo bản chất phản ứng và bảo toàn khối lượng, ta có : 2 2 0,15mol0,9mol 0,15mol Y NaOH chatranHO 0,15360(0,90,920%)40 0,1518 ? Y6NaOHmuoiHO mmmm chatran m94,5gam
thiết, suy ra :
Xla(3CHON2HO)(M42n105) Yla(6CHON5HO)(M84n192)
giả thiết
bảo toàn electron và bảo toàn khối lượng, ta có :
(CO,HO,N) 0,1(42n105)0,025(18n9)32 40,5
4n(18n9)n(18n9).0,1
mm n2 M84n192360
CHUYÊN ĐỀ 3: GIẢI NHANH BÀI TẬP HÓA HỮU CƠ BẰNG PHƯƠNG PHÁP BẢO TOÀN NGUYÊN TỐ
1. Nội dung phương pháp bảo toànnguyên tố
- Cơ sở của phương pháp bảo toàn nguyên tố là định luật bảo toàn nguyên tố : Trong phản ứng hóa học, các nguyên tố được bảo toàn.
- Hệ quả của của định luật bảo toàn nguyên tố: Trong phản ứng hóa học, tổng số mol của một nguyên tố tham gia phản ứng bằng tổng số mol nguyên tố đó tạo thành sau phản ứng.
- Phương pháp bảo toàn nguyên tố là phương pháp sử dụng hệ quả của định luật bảo toàn nguyên tố để giải bài tập hóa học.
- Tính nhanh số mol nguyên tố, nhóm nguyên tố: Số mol nguyên tố X hoặc nhóm nguyên tố X = số nguyên tử hoặc nhóm nguyên tử X trong đơn chất, hợp chất số mol chất đó. Ví dụ : Đốt cháy hỗn hợp gồm C2H4, C2H6, C2H2, H2 thu được CO2 và H2O thì theo bảo toàn nguyên tố H, ta có : 2 22 24 26 2 HOCH
H2n2n4n6n2n - Sử dụng phương pháp bảo toàn nguyên tố khi giữa lượng chất cần tính và lượng chất đã biết đều có chứa cùng 1 nguyên tố hoặc một nhóm nguyên tố. 2.Ví dụ minh họa Ví dụ 1: Dẫn V lít (đktc) hỗn hợp X gồm axetilen và hiđro có khối lượng là m gam đi qua ống sứ đựng bột niken nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3, thu được 12 gam kết tủa. Khí đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam brom và còn lại khí Z. Đốt cháy hoàn toàn khí Z được 2,24 lít khí CO2 (đktc) và 4,5 gam H2O. Giá trị của V là : A. 11,2.B. 13,44. C. 5,60.D. 8,96. (Đề thi thử Đại học lần 2 – THPT chuyên Hùng Vương – Phú Thọ, năm học 2013 – 2014) Hướng dẫn giải ● Cách 1: Tính toán theo phương trình phản ứng Theo giả thiết, suy ra : Y gồm C2H2, C2H4, C2H6 và có thể có H2. Z có C2H6 và có thể có H2 Dựa vào số mol của các chất Br2, C2Ag2, CO2, H2O và bản chất phản ứng, ta có :
OFFICIAL
DẠYKÈMQUYNHƠN
Trang 1/6 - Mã đề thi 357
o 33 o o o o 24 2 242 AgNO/NH,t 22 22 t 26 2 2 2 t 22 2 t,Ni 222 24 t,Ni 22 2 CHBrCHBr
CH CAg
0,05 CH3,5O 2CO3HO mol:0,05 0,10,15 2HO2HO mol:0,1(0,250,15)0,1 CHH CH mol:0,10,1 0,1 CH2H 26CH mol:0,050,1 0,05 Suy ra : 2 22 22 2 HtrongX CHtrongX X(ñktc)CHH n 0,3;n 0,2 VVV11,2lít ● Cách 2: Sử dụng phương pháp bảo toàn nguyên tố Theo giả thiết, suy ra : 22 22CHdöCAg nn0,05;
CH CH
mol:0,10,1
mol:0,05
Nhận xét: Các chất trong X đều chứa 2 nguyên tử H. Mặt khác, số mol của C2H2 dư, C2H4 và H2O đều đã biết. Vậy áp dụng bảo toàn nguyên tố H là tính được số mol của hỗn hợp X. Vì thế không mất nhiều thời gian viết phương trình phản ứng và tính toán như cách 1. Áp dụng bảo toàn nguyên tố đối với H, ta có :
Ví dụ 2: Oxi hoá 2,3 gam ancol etylic bằng CuO đun nóng, thu được 3,3 gam hỗn hợp X gồm anđehit, axit, ancol dư và nước. Hỗn hợp này tác dụng hết với Na sinh ra 0,84 lít H2 (đktc). Hiệu suất phản ứng oxi hoá ancol là :
A. 25%. B. 50%. C. 75%. D. 90%. (Đề thi thử lần 2 – Trường THPT Cẩm Khê – Phú Thọ, năm học 2013 – 2014) Hướng dẫn giải
● Cách 1: Tính toán theo phương trình phản ứng Khối lượng hỗn hợp X tăng lên so với khối lượng ancol ban đầu là do lượng O trong CuO phản ứng đã chuyển vào H2O và CH3COOH. Theo giả thiết, suy ra : 2H n0,0375; Gọi số mol của ancol tham gia phản ứng là x, y và số mol CuOphanöngOphanöngn n (3,32,3):160,0625 ancol dư là z. Phương trình phản ứng
DẠYKÈMQUYNHƠN
Trang 2/6 - Mã đề thi 357
2 22 22 24 2 X HCH CHdö CH HO
n
X X(ñktc) 2(nn)2n4n2n n0,5molV11,2lít
OFFICIAL
24 2 2 CHBr HO nn0,1;n0,25
0,1 0,25
0,05
25 3 2 25 3 2 25 25 2 3 3 2 2 CHOHCuOCHCHOCuHO xx x CHOH2CuOCHCOOH2CuHO y2yy y 2CHOH2Na2CHONaH z 0,5z 2CHCOOH2Na2CHCOONaH y 0,5y 2HOH2Na2NaOHH (xy) 0,5(xy) 25 2 CHOHbñ H CuOpö n xyz0,05 n0,5y0,5z(0,5x0,5y)0,0375 nx2y0,0625 x0,0125;y0,025;z0,0125 H0,050,012575% 0,05 ● Cách 2: Sử dụng phương pháp bảo toàn nguyên tố Sơ đồ phản ứng : o 3 3 CuO,t Na 25 25 25 2 (1) (2) 3 CHCOOH CHCOONa CHOHdö CHOH CHONaH HOH NaOH CHCHO
:
Bản chất phản ứng (1) là C2H5OH bị oxi hóa bởi CuO, khối lượng hỗn hợp sau phản ứng tăng lên là do O trong CuO chuyển vào H2O và CH3COOH. Ở phản ứng (2), CH3COOH, C2H5OH dư, HOH có nguyên tử H linh động trong nhóm –OH nên tham gia phản ứng thế Na giải phóng H2, CH3CHO không tham gia phản ứng này. Sử dụng bảo toàn nguyên tố O trong phản ứng oxi hóa ancol và bảo toàn nguyên tố H của nhóm –OH trong phản ứng của X với Na, ta có :
DẠYKÈMQUYNHƠN
Trang 3/6 - Mã đề thi 357
OFFICIAL
3 3 25 2 25 HOHCHCOOHOphanöng HOHCHCOOHCHOHdöH CHOHdö nnn
nnn
n 0,0125 H0,050,012575% 0,05 Ví dụ 3: Đốt
2 xy 2 xy xy 2 2 2 2 2 2 CO CHOHOCHO CHOOpöCOHO OdöObñOpö nx.n;2nyn n2n2nn nnn 2 2 2 2 222 2 2 410 CO HO Opö Odö (CO,HO,Odö) Opö Obñ CHO n0,1x;n0,05y
n
yy10;x4 10 xm7,4gam 5 Ví dụ 4: Cho 0,1 mol CH3COOH vào cốc
Cô cạn dung dịch sau phản ứng rồi đốt
gam hỗn hợp gồm CO2, hơi nước bay ra. Giá trị của m là :
B. 9,3.
(Đề thi thử Đại học lần 1 – THPT chuyên KHTN – ĐHQG Hà Nội, năm học
–
Hướng dẫn giải Sau tất cả các phản ứng, R trong ROH đã chuyển hết vào R2CO3 Áp dụng bảo toàn nguyên tố đối với R, ta có : 23 23 ROHRCO ROH RCO 30.1,2.20%9,54n2n 2. R172R60 R23(Na);n0,18;n0,09. Sơ đồ phản ứng :
0,0625
2n0,075
cháy hoàn toàn 0,1 mol một ancol đơn chức trong 0,7 mol O2 (dư), thu được tổng số mol các khí và hơi bằng 1 mol. Khối lượng (gam) ancol ban đầu đem đốt cháy là : A. 8,6. B. 6,0. C. 9,0. D. 7,4. (Đề thi tuyển sinh Đại học khối B năm 2014) Hướng dẫn giải Theo bảo toàn nguyên tố C, H, O, ta có :
n0,1x0,025y0,05 n0,750,1x0,025y
0,025y0,751 n0,1x0,025y0,05n0,7
chứa 30 ml dung dịch ROH 20% (d =1,2 g/ml, R là một kim loại kiềm).
cháy hoàn toàn chất rắn khan thì thu được 9,54 gam chất rắn và có m
A. 10,02.
C. 7,54. D. 8,26.
2011
2012)
C, H, O tác
NaOH vừa đủ, sau đó chưng khô thì phần bay hơi chỉ có nước, phần chất rắn khan còn lại chứa hai muối của natri chiếm khối lượng 9,44 gam. Nung hai muối này trong oxi dư, sau khi phản ứng hoàn toàn thu được 6,36 gam Na2CO3, 5,824 lít khí CO2 (đktc) và 2,52 gam nước. Số mol oxi có trong X là : A. 0,24. B. 0,06. C. 0,12. D. 0,20. (Đề thi thử Đại học lần 1 – THPT Yên Lạc – Vĩnh Phúc, năm học 2013 – 2014)
Hướng dẫn giải Gọi số mol H2O sinh ra trong phản ứng thủy phân và phản ứng đốt cháy lần lượt là và. Áp 2 HO(1)n 2 HO(2)n dụng bảo toàn nguyên tố Na cho toàn bộ quá trình phản ứng và bảo toàn khối lượng trong phản ứng của X với NaOH, ta có :
DẠYKÈMQUYNHƠN OFFICIAL Trang 4/6 - Mã đề thi 357 o 2 2 01mol 3 0,1mol O,t 2 3 23 (2) 2 0,09mol mgam HO CHCOOH CO CHCOOR RCO HO ROHdö Áp dụng bảo toàn nguyên tố đối với C và H cho toàn bộ quá trình phản ứng, ta có : 3 23 2 3 2 2 2 2 2 2 CHCOOHRCOCO ? 0,09 0,1 CHCOOHROH HO(1)HO(2) 0,18 0,1 ? 0,1 CO HO(2) COHO(2) 2nnn 4nn2n2n n0,11;n0,19 mmm8,26gam Ví dụ 5:
cơ X
Cho 6,08 gam chất hữu
chứa
dụng với dung dịch
23 2 2 NaOHNaCO XNaOHmuoi HO(1)
9,440,1240 ? HO(1)
mmm18n n0,08 Theo bảo toàn nguyên tố C, H và giả thiết, ta có: 2 23 2 2 C/XCONaCO 0,260,06 H/XHO(1)HO(2)NaOH 0,12 0,08 0,14 O/X nnn0,32 n2n2nn0,32 6,080,32.120,32 n 0,12mol 16 Ví dụ 6: Xà phòng hoá hoàn toàn 0,1 mol một este no, đơn chức bằng 26 gam dung dịch MOH 28% (M là kim loại kiềm), rồi tiến hành chưng cất sản phẩm, thu được 26,12 gam chất lỏng X và 12,88 gam
hoàn toàn chất
và
0,18mol ROH (1)
6,08
n2n26,36:1060,12
chất rắn khan Y. Đốt cháy
rắn Y, thu được H2O, V lít CO2 (đktc) và 8,97 gam một muối duy nhất. Giá trị của V là: A. 5,264 lít. B. 14,224 lít. C. 6,160 lít. D. 5,600 lít. (Đề thi chọn học sinh giỏi tỉnh Nam Định, năm học 2011 – 2012) Hướng dẫn giải Theo giả thiết
bảo toàn nguyên tố M, ta có :
Thủy phân không hoàn toàn a gam tetrapeptit Gly-Ala-Gly-Val trong môi trường axit, thu được 0,2 mol Gly-Ala, 0,3 mol Gly-Val, 0,3 mol Ala và m gam hỗn hợp 2 amino axit Gly và Val. Giá trị của m là : A. 57,2. B. 82,1. C. 60,9. D. 65,2. (Đề thi thử Đại học lần 1 – THPT Hùng Vương –Phú Thọ, năm học 2013 – 2014) Hướng dẫn giải Theo giả thiết và sử dụng bảo
m là : A. 7,56. B. 6,93. C. 5,67. D. 9,24. (Đề thi thử Đại học lần 1
DẠYKÈMQUYNHƠN OFFICIAL Trang 5/6 - Mã đề thi 357 Khi đốt 23 23 23 MOHMCO MOH MCO 0,1mol KOH KCO 0,03mol n7,28n2n M17 8;7,282.8,97 ,97 n M172M602M60 RCOOK M39(K) n0,13YgomKOHdö n0,065 25 Y CH m0,1(R83)0,035612,88R29 cháy Y, C trong C2H5COOK chuyển hết vào K2CO3 và CO2. Theo bảo toàn nguyên tố C, ta có : 25 2 23 2 2 CHCOOKCOKCO ? 0,1 0,065 CO CO(ñktc) 3n nn n0,235mol,V 5,264lít Ví dụ
GlyAlaGlyValGlyAlaAla 0,30,2 GlyGlyAlaGlyValGlyAlaGlyVal ? 0,2 0,3 0,5 ValGlyValGlyAlaGlyVal ? 0,3 0,5 Gly Val (Gly,Val) n nn0,5 nnn2n nnn n0,5,n0,2 m Glym Val 0,5750,211760,9gam Ví dụ
Đốt
−COOH
nhóm −NH2, thu được 4,032 lít
2
gam X trong 100 ml dung dịch NaOH 2M, rồi cô cạn
Đặt công thức của tripeptit .xy43 XlaCHON Theo bảo toàn nguyên tố C và H, ta có : xy43 2 xy43 2 CHONCO 0,18 0,02 91743 CHON HO 0,17 0,02 x.n n x9;y17 XlaCHON yn 2n Suy ra amino axit là H2NCH(CH3)COOH. Trong phản ứng thủy phân hoàn toàn X bằng dung dịch NaOH, sau đó cô cạn dung dịch thì chất rắn thu được là muối H2NCH(CH3)COONa (hay có công thức phân tử là C3H6O2NNa) và có thể còn NaOH dư. Theo bảo toàn nguyên tố Na và giả thiết, ta có :
7:
toàn nhóm Ala, Gly và Val, ta có :
8:
cháy hoàn toàn 0,02 mol tripeptit X tạo thành từ amino axit mạch hở A có chứa một nhóm
và một
CO
(đktc) và 3,06 gam H2O. Thủy phân hoàn toàn m
thu được 16,52 gam chất rắn. Giá trị của
– THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2013 – 2014) Hướng dẫn giải
OFFICIAL Trang 6/6 - Mã đề thi 357
DẠYKÈMQUYNHƠN
362 362 CHONNaNaOHdöNaOHbñ CHONNa NaOHdö n nn0,2 111n 40n16,52
362 CHONNa NaOHdö n 0,12;n0,08
Theo bảo toàn nguyên tố C, ta có : 91743 362 91743 CHONCHONNa CHON X 9n 3n 30,120,36 n 0,04molm9,24gam
Suy ra : Lượng kết tủa tăng dần đến cực đại a mol ứng với phản ứng (1), phản ứng này cần a mol CO2. Sau đó lượng kết tủa tan dần đến hết ứng với phản ứng (2), phản ứng này cũng cần a mol CO2 Vậy sự biến thiên lượng kết tủa BaCO3 hoặc CaCO3 theo lượng CO2 được biểu diễn bằng đồ thị sau :
Nhận xét: Dựa vào dạng hình học của đồ thị, ta thấy đường biến thiên lượng kết tủa hợp với trục hoành tạo thành một tam giác vuông cân. Suy ra : Nếu phản ứng tạo ra một lượng kết tủa x mol (như đồ thị dưới đây) thì ta dễ dàng tính được số mol CO2 tham gia phản ứng là x mol hoặc .y(2ax)mol
DẠYKÈMQUYNHƠN OFFICIAL Trang 1/16 - Mã đề thi 357
ĐỀ 12: GIẢI NHANH BÀI TẬP HÓA VÔ CƠ DỰA VÀO ĐỒ THỊ I.Các dạng đồ thị cơ bản 1.
2
2
2 3 22 32
CHUYÊN
Sục khíCO
vàodung dịch Ba(OH)2 hoặc Ca(OH)2 Bản chất phản ứng :
2 3
COBa(OH)BaCOHO(1) mol:aa a BaCOCOHOBa(HCO)(2) mol:aa
2. Sục khíCO2 vàodung dịch chứa hỗn hợp các bazơ NaOH (hoặc KOH)vàBa(OH)2 (hoặc Ca(OH)2) Bản chất phản ứng : 2 2 3 2 2 232 23 22 3 3 22 32 Ca(OH)COCaCOHO(1) mol:aaa 2NaOHCONaCOHO (2) mol:b0,5b0,5b NaCOCOHO2NaHCO(3) mol:0,5b0,5b CaCOCOHOCa(HCO)(4) mol:aa Suy ra : Lượng kết tủa tăng dần đến cực đại a mol ứng với phản ứng (1), phản ứng này cần a mol CO2 Lượng kết tủa không thay đổi một thời gian ứng với phản ứng (2) và (3), phản ứng này cần b mol CO2. Sau đó lượng kết tủa tan dần đến hết ứng với phản ứng (4), lượng CO2 cần dùng trong phản ứng này là a mol. 0 a 2a a 2COn 3BaCOn 0 a 2a a 2COn 3BaCOn x y x
Vậy sự biến thiên lượng kết tủa BaCO3 hoặc CaCO3 theo lượng CO2 được biểu diễn bằng đồ thị sau :
a ab
Nhận xét: Dựa vào dạng hình học của đồ thị, ta thấy đường biến thiên lượng kết tủa hợp với trục hoành tạo thành một hình thang cân. Suy ra : Nếu phản ứng tạo ra một lượng kết tủa x mol (nhỏ hơn lượng kết tủa cực đại) thì ta dễ dàng tính được số mol CO2 tham gia phản ứng là x mol hoặc .y(2abx)mol
3OHAlAl(OH) (1) mol:3aa a OHAl(OH)AlO2HO(2) mol:aa
DẠYKÈMQUYNHƠN
Trang 2/16 - Mã đề thi 357
OFFICIAL
3. Phản ứng của dung dịch bazơ (chứa ion) với dung dịch chứa muối Al3+ OH Bản chất phản ứng : 3 3 3 2 2
a
3BaCOn 2CO
3
n a 0 3a4a OH n a
0 3BaCOn 2CO
x x
3Al(OH)n a x
Suy ra : Lượng kết tủa tăng dần đến cực đại a mol ứng với phản ứng (1), phản ứng này cần 3a mol . Sau OH đó lượng kết tủa tan dần đến hết ứng với phản ứng (2), phản ứng này cần a mol . OH Vậy sự biến thiên lượng kết tủa Al(OH)3 theo lượng được biểu diễn bằng đồ thị sau : OH Nhận xét: Dựa vào dạng hình học của đồ thị, suy ra : Nếu phản ứng tạo ra x mol kết tủa (x < a) thì có thể dễ dàng tính được lượng tham ra phản ứng là 3x mol hoặc . OH y(4ax)mol
2ab 0
n
Al(OH)
a ab 2ab
n
y
OHHHO (1) mol:bb 3OHAlAl(OH) (2) mol:3aa a OHAl(OH)AlO2HO(3) mol:aa
ứng của dung dịch axit (chứa ionH+) với dung dịch chứa ion hay 2AlO 4 [()] AlOH Bản chất phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL Trang 3/16 - Mã đề thi 357
4. Phản ứng của dung dịch bazơ (chứa ion) với dung dịch chứa cácionH+ vàAl3+ OH Bản chất phản ứng : 2 3 3 3 2 2
2 2 3 3 3 2
a
Suy ra : Lượng kết tủa tăng dần đến cực đại a mol ứng với phản ứng (1), phản ứng này
mol
+. Sau đó
ứng
Vậy sự biến thiên lượng kết tủa theo lượng H+ được biểu diễn bằng đồ thị sau : OH n b b3a
0 3Al(OH)n a 3Al(OH)n a 0 a 4a H n
Suy ra : Ở phản ứng (1), dùng để trung hòa H+ nên lúc đầu chưa xuất hiện kết tủa. Sau một thời gian, kết OH tủa bắt đầu xuất hiện và tăng dần đến cực đại a mol ứng với phản ứng (2), phản ứng này cần 3a mol . OH Cuối cùng kết tủa bị hòa tan dần đến hết ứng với phản ứng (3), phản ứng này cần a mol . OH Vậy sự biến thiên lượng kết tủa Al(OH)3 theo lượng được biểu diễn bằng đồ thị sau : OH 5. Phản
HAlOHOAl(OH) (1) mol:aa
3HAl(OH)Al3HO (2) mol:3aa
cần a
H
kết tủa bị hòa tan dần đến hết
với phản ứng (2), phản ứng này cần 3a mol H+
b4a
HOHHO (1) mol:bb HAlOHOAl(OH) (2) mol:aa a 3HAl(OH)Al3HO (3) mol:3aa
Suy ra : Ở (1), H+ dùng để phản ứng với nên lúc đầu chưa xuất hiện kết tủa. Sau một thời gian, kết tủa bắt đầu OH xuất hiện và tăng dần đến cực đại a mol ứng với phản ứng (2), phản ứng này cần a mol H+ . Cuối cùng kết tủa bị hòa tan dần đến hết ứng với phản ứng (3), phản ứng này cần a mol 3a mol H+ . Vậy sự biến thiên lượng kết tủa Al(OH)3 theo lượng H+ được biểu diễn bằng đồ thị sau :
2Zn(OH)n a
a OH n 4a 2a 0
Suy ra : Lượng kết tủa tăng dần đến cực đại a mol ứng với phản ứng (1), phản ứng này cần 2a mol . Sau OH đó lượng kết tủa tan dần đến hết ứng với phản ứng (2), phản ứng này cũng cần 2a mol . OH Vậy mối liên hệ giữa lượng kết tủa Zn(OH)2 và lượng được biểu diễn bằng đồ thị sau : OH 8. Phản ứng của dung dịch bazơ (chứa ion) với dung dịch chứa cácionH+ vàZn2+ OH Bản chất phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL Trang 4/16 - Mã đề thi 357
2
3
6. Phản ứng của dung dịch axit (chứa ionH+) với dung dịch chứa cácion và ( OH 2AlO 4 [()] AlOH Phương trình phản ứng : 2 2
3
3 2
7. Phản ứng của dung dịch bazơ (chứa ion) với dung dịch chứa ionZn2+ OH Bản chất phản ứng : 2 2 2 22 2
2OHZnZn(OH) (1) mol:2aa a 2OHZn(OH)NaZnO2HO(2) mol:2aa
3Al(OH)n H n b4a ba 0b
HOHHO (1) mol:bb 2OHZnZn(OH) (2) mol:2aa a 2OHZn(OH)NaZnO2HO(3) mol:2aa
Suy ra : Phản ứng (1) là phản ứng trung hòa nên chưa có kết tủa. Sau đó lượng kết tủa tăng dần đến cực đại a mol ứng với phản ứng (2), phản ứng này cần 2a mol . Sau đó lượng kết tủa tan dần đến hết ứng với phản OH ứng (2), phản ứng này cũng cần 2a mol . OH Vậy mối liên hệ giữa lượng kết tủa Zn(OH)2 và lượng tham giả phản ứng được biểu diễn bằng đồ thị sau OH : II.Ví
DẠYKÈMQUYNHƠN OFFICIAL Trang 5/16 - Mã đề thi 357
2 2 2 2 22 2
1:
cho 0,02 hoặc 0,04 mol
nhau. Số mol Ba(OH)2 có trong
: A. 0,01 mol. B. 0,02 mol. C.
Gọi a là số mol Ba(OH)2 Căn cứ vào bản chất
và
sau
OH n b4a b2a 0 2Zn(OH)n a b 3BaCOn 0 a 2COn a 2a0,04 0,02 0,02
dụ minh họa Ví dụ
Khi
CO2 hấp thụ hết vào dung dịch Ba(OH)2 thì lượng kết tủa thu được đều như
dung dịch là
0,03 mol. D. 0,04 mol. Hướng dẫn giải
phản ứng
giả thiết, ta có đồ thị
:
Suy ra : 2a0,040,02a0,03
Hoặc có thể tính như sau : 0,04aa0,02a0,03
Ví dụ 2*: Cho m gam hỗn hợp X gồm Ba, BaO, Ba(OH)2 có cùng số mol vào nước, thu được 500 ml dung dịch Y và V lít H2 (đktc). Hấp thụ 3,6V lít CO2 (đktc) vào 500 ml dung dịch Y, thu được 37,824 gam kết tủa. Giá trị của m là: A. 41,49 gam. B. 36,88 gam. C. 32,27 gam. D. 46,10 gam. (Đề thi thử Đại học lần 1 – THPT Cẩm Khê – Phú Thọ, năm học 2013 – 2014)
DẠYKÈMQUYNHƠN
Trang 6/16 - Mã đề thi 357
OFFICIAL
BaH
Ví dụ 3*: Thổi khí CO2 vào dung dịch
Giá trị của m là : 2CO
B. 0m3,94. 0m0,985. C. D. 0,985m3,94 0,985m3,152 (Đề thi thử Đại học lần 2 – THPT Xuân Áng – Phú Thọ, năm học 2013 – 2014) Hướng dẫn giải Ta có đồ thị sau : 3BaCOn 0 3V 22,4 2COn 3V 22,4 6V 22,4 3,6V 22,4 0,192 2COn 0 0,02 0,02 0,040,024 0,016 0,005 0,005 2Ba(OH)n
Hướng dẫn giải Theo bảo toàn electron, ta có : 2 2 2 2 3
Ba(OH)BaBaOBa(OH) CO BaCO V 3V nn (mol)nnnn (mol); 22,4 22,4 3,6V 37,824 n ;n 0,192mol. 22,4 197
Ta có đồ thị : Căn cứ vào tính chất của đồ thị, suy ra : 6V3,6V 1,792 0,192V1,972m(137153171)36,88gam22,422,4 22,4
chứa 0,02 mol Ba(OH)2, thu được m gam kết tủa. Biết số
0,005n0,024
A.
Ta thấy : Khi thì (biểu diễn bằng nét đậm). Suy ra 2CO 0,005n0,024 3BaCO 0,005n0,02 3BaCO 0,985n3,94 Ví dụ 4*: Hấp thụ hết V lít khí CO2 vào dung dịch chứa 0,42 mol Ca(OH)2, thu được a gam kết tủa. Tách lấy kết tủa, sau đó thêm tiếp 0,6V lít khí CO2 nữa, thu thêm 0,2a gam kết tủa. Thể tích các khí đo ở đktc. Giá trị của V là: A. 7,84 lít. B. 5,60 lít. C. 6,72 lít. D. 8,40 lít. (Đề thi thử đại học lần 4 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012)
Hướng dẫn giải
Theo giả thiết, suy ra : Khi cho V lít CO2 vào dung dịch chứa 0,42 mol Ca(OH)2 thì chưa có hiện tượng hòa tan kết tủa. Sau khi lọc bỏ kết tủa thêm tiếp 0,6V lít CO2 vào thì đã có hiện tượng hòa tan một phần kết tủa (nếu không có hiện tượng hòa tan kết tủa thì lượng kết tủa thu được phải là 0,6a gam).
Xét toàn bộ quá trình phản ứng, ta có :
Kết quả thí nghiệm được biểu diễn bằng đồ thị sau :
DẠYKÈMQUYNHƠN
Trang 7/16
Mã đề thi 357
OFFICIAL
-
đồ
Ví dụ 5:
biểu diễn bằng đồ thị sau : Nồng độ % chất tan trong dung dịch sau phản ứng là : A. 34,05%. B. 30,45%. C.
D.
Hướng dẫn giải Dựa vào đồ thị, ta thấy bản chất của phản ứng là : Sục 1,2 mol CO2 vào dung dịch chứa 0,8 mol Ca(OH)2, lượng kết tủa tăng dần đến cực đại sau đó bị hòa tan một phần. Kết quả thu được : 0 0,42 0,84 0,42 2COn 3CaCOn 0,012a 1,6V 22,4 0,01a V 22,4 3CaCOn 2COn 1,2 0 0,8
2 3 CO CaCO 1,6V 1,2a n mol;n mol 22,4 100
Từ
thị, suy ra : V 0,01a a30gam 22,4 1,6V V6,72lít 0,84 0,012a 22,4
Sục CO2 vào 200 gam dung dịch Ca(OH)2, kết quả thí nghiệm được
35,40%.
45,30%.
0,4mol 0,4162 C% 100%30,45% 2001,2.440,4.100
Ví dụ 6: Sục 4,48 lít khí CO2 (đktc) vào 1 lít dung dịch hỗn hợp Ba(OH)2 0,12M và NaOH 0,06M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là A. 19,70. B. 23,64. C. 7,88. D. 13,79. (Đề thi tuyển sinh Đại học khối B năm 2012) Hướng dẫn giải Theo giả thiết, ta có :
n0,2mol;n0,12mol;n0,06mol
Gọi a là số mol BaCO3 tạo thành trong phản ứng. Căn cứ vào bản chất phản ứng và giả thiết, ta có đồ thị sau : Suy ra :
Ví dụ 7: Sục 4,48 lít CO2 (đktc) vào 2 lít dung dịch Ba(OH)2 2x mol/lít và NaOH x mol/lít. Sau khi các phản ứng xảy ra hoàn toàn thu được 19,7 gam kết tủa. Giá trị của x là: A. 0,025 hoặc 0,03. B. 0,03. C. 0,025. D. 0,025 hoặc 0,02. (Đề thi thử Đại học lần 2 – THPT chuyên KHTN Hà Nội, năm học 2012 – 2013) Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang 8/16 - Mã đề thi 357
3 2 2 32 32 CaCO Ca(OH)CO Ca(HCO) Ca(HCO) n2nn0,4moln
2 2 CO Ba(OH) NaOH
3BaCO a0,030,020,01m19,7gam
xét :
2 3 COphanöngBaCOtaothanh 0,2 0,1 n n Trường hợp 1: Kết tủa không bị hòa tan Suy ra : 2 3 2 Ba(OH)BaCO (Ba(OH),NaOH)nn4x0,1x0,025n 6x0,15mol Quan sát đồ thị ta thấy : Nếu thì không có hiện tượng hòa tan kết tủa. Trên thực tế thì 2 2 CO(Ba(OH),NaOH)nn nên đã có hiện tượng hòa tan kết tủa. Vậy trường hợp này không thỏa mãn. 2 2 CO(Ba(OH),NaOH) 02 0,1 nn Trường hợp 2: Kết tủa bị hòa tan một phần Ta có đồ thị : 0,12 00,120,180,3 3BaCOn 2COn 0,2 a 4x 04x6x10x 3BaCOn 2COn 0,2 0,1
Nhận
nên có hai khả năng xảy ra.
Suy ra : 10x0,20,1x0,03
Ví dụ 8: Dung dịch X chứa đồng thời các chất tan: NaOH 0,2M và Ba(OH)2 0,1M. Khi dẫn 0,336 lít khí CO2 hoặc 1,456 lít khí CO2 vào V ml dung dịch X đều thu được kết tủa có số gam bằng nhau (các thể tích khi đo ở điều kiện tiêu chuẩn). Thể tích V là A. 200. B. 300. C. 240. D. 150. (Đề thi thử Đại học lần 4 – THPT chuyên ĐHSP Hà Nội, năm học 2011– 2012) Hướng dẫn giải
Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị :
Dựa vào đồ thị ta thấy : 0,0650,3V0,1V0,015V0,2lít200ml
Ví dụ 9*: Sục V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 thì thu được 19,7 gam kết tủa (TN1). Mặt khác, sục V lít CO2 (đktc) vào dung dịch chứa a mol Ba(OH)2 và a mol NaOH thì thu được 39,4 gam kết tủa (TN2). Giá trị của V và a tương ứng là: A. 6,72 và 0,1. B. 5,6 và 0,2. C. 8,96 và 0,3. D. 6,72 và 0,2. (Đề thi thử Đại học lần 3 – THPT chuyên KHTN Hà Nội, năm học 2012 – 2013) Hướng dẫn giải Lượng CO2 tham gia phản ứng và lượng Ba(OH)2 ở hai thí nghiệm đều bằng nhau, nhưng ở TN1 thu được lượng kết tủa ít hơn ở TN2. Suy ra ở TN1 kết tủa đã bị hòa tan một phần. Dựa vào tính chất của đồ thị ở TN1 suy ra
DẠYKÈMQUYNHƠN
Trang 9/16 - Mã đề thi 357
OFFICIAL
2 2 3
Đồ
Dựa vào 2 đồ thị, ta thấy nên ở TN2
Vậy 2 3 2 Ba(OH)BaCO CO ann0,2moln2a0,10,3mol V6,72lítvaa0,2mol Ví dụ 10: Cho 18,3 gam hỗn hợp X gồm Na và Ba vào nước, thu được dung dịch Y và 4,48 lít H2 (đktc). Xác định thể tích CO2 (đktc) cho vào dung dịch Y để thu được kết tủa cực đại? 0,1V 0,1V 0,3V0,4V 0 3BaCOn 2COn 0,015 0,065 a a2a 0 3BaCOn 2COn 2a0,1 a a 2a3a 0 3BaCOn 2COn 2a0,1 0,1
: .
CO Ba(OH)BaCO n2nn(2a0,1)mol
thị biểu diễn sự biến thiên lượng kết tủa theo lượng CO2 ở TN1 và TN2 :
kết tủa đạt cực đại. Suy ra : a2a0,12a
A. 2,24 lít ≤ V ≤ 4,48 lít. B. 2,24 lít ≤ V ≤ 6,72 lít. C. 1,12 lít ≤ V ≤ 6,72 lít. D. 4,48 lít ≤ V ≤ 6,72 lít. (Đề thi thử Đại học lần 1 – THPT chuyên Lê Quy Đôn – Quảng Trị, năm học 2013 – 2014) Hướng dẫn giải Trong phản ứng của X với H2O, theo giả thiết và bảo toàn eclectron, ta có :
2nn2n0,4 n0,1 n0,1 TrongYco n0,2137n23n18,3 n0,2
biểu diễn bằng đồ thị sau : Dựa vào đồ thị suy ra : Khi 2 2 CO CO(ñktc) 0,1n0,3hay2,24lítV6,72lít Thì kết tủa đại giá trị cực đại là 0,1 mol hay 19,7 gam. Ví dụ 11: Dẫn V lít khí CO2 (đktc) vào 200 ml dung dịch chứa KOH 0,2M và Ba(OH)2 0,1M, thu được m gam kết tủa trắng. Nếu thì giá trị m là : 0,112V1,456 A. . B. . 0,985m3,94 2,955m3,94 C. D. kết quả khác. 0,985m2,955 (Đề thi thử Đại học lần 3 – THPT chuyên ĐHSP Hà Nội, năm 2013) Hướng dẫn giải Theo giả thiết ta có :
DẠYKÈMQUYNHƠN OFFICIAL Trang 10/16 - Mã đề thi 357
2 2 BaNaH
Ba Na Ba Na NaOH
Khi sục khí CO2 vào dung dịch Y, sự biến thiên lượng kết tủa theo lượng CO2 được
đồ thị : Khithì lượng kết tủa biến thiên theo đường nét đậm trên đồ thị. Điểm cực đại là 2CO 0,005moln0,065mol 0,02 và cực tiểu là 0,005. Suy ra : 2BaCO 0,985gamm3,94gam Ví dụ 12: Sục V lít khí CO2 (đktc) vào dung dịch chứa hỗn hợp Ca(OH)2 và NaOH, kết quả thí nghiệm được biểu diễn bằng đồ thị sau : 0,1 0,1 0,30,4 0 3BaCOn 2COn 0,02 0,02 0,060,08 0 3BaCOn 2COn 0,005 0,065 0,005 0,015 x 3CaCOn
Ba(OH)
2 2 KOH Ba(OH) CO n0,04mol;n0,02mol;0,005moln0,065mol
Dựa vào bản chất phản ứng và giả thiết, ta có
Giá trị của x là : A. 0,07. B. 0,06. C. 0,04. D. 0,05. Hướng dẫn giải
Căn cứ vào bản chất phản ứng và giả thiết, ta có đồ thị : Nhìn vào đồ thị ta thấy : Ở thí nghiệm này kết tủa đã bị tan một phần. 2 2 Ca(OH) NaOH COphanöngn0,1mol;n0,12mol;n 0,27mol.
Căn cứ vào dạng hình học của đề thí, suy ra : 0,1x0,270,22x0,05 Ví dụ 13: Sục V lít khí CO2 (đktc) vào dung dịch chứa hỗn hợp Ba(OH)2 và KOH, kết quả thí nghiệm được biểu diễn bằng đồ thị sau :
DẠYKÈMQUYNHƠN
Trang 11/16 - Mã đề thi 357
OFFICIAL
Giá trị của V bằng bao nhiêu để thu được kết tủa cực đại ? A. B. 4,48V8,96 2,24V6,72 C. D. 4,2V8,904 2,24V5,376 Hướng dẫn giải Căn cứ vào đồ thị ta thấy : Suy ra để hòa tan hết kết tủa thì 2Ba(OH) NaOH n1,25amol;n1,4amol 2 2 CO Ba(OH)NaOH n2nn3,9amol. Mặt khác, theo đồ thị, để hòa tan hết lượng kết tủa cần 0,585 mol CO2. Suy ra : 3,9a0,585a0,15. Để thu được kết tủa cực đại thì 2 2 CO CO(ñktc) 1,25a0,1875n2,65a0,39754,2lítV8,904lít Ví dụ 14: Cho hỗn hợp X gồm x mol NaOH và y mol Ba(OH)2 từ từ vào dung dịch chứa z mol AlCl3 thấy kết tủa xuất hiện, kết tủa tăng dần và tan đi một phần. Lọc thu đựơc m gam kết tủa. Giá trị của m là : 1,25a 0 1,25a 2,65a0,585 3BaCOn 2COn x 0 0,1 0,220,27 3CaCOn 2COn x
A. 78(4z – x – 2y). B. 78(2z – x – y). C. 78(4z – x – y). D. 78(2z – x – 2y). Hướng dẫn giải Theo giả thiết :
3m n2nn(2yx)mol;nzmol;n mol. 78
Ba(OH)NaOH
Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị : Dựa vào tính chất hình học của đồ thị, ta có : m 74z2yxm78(4z2yx) 8 Ví dụ 15: Trong một cốc đựng 200 ml dung dịch AlCl3 2M. Rót vào cốc V ml dung dịch NaOH có nồng độ a mol/lít, ta được một kết tủa; đem sấy khô và nung đến khối lượng không đổi được 5,1 gam chất rắn. Nếu V = 200 ml thì a có giá trị nào? A. 2M. B. 1,5M hay 3M. C. 1M hay 1,5M. D. 1,5M hay 7,5M. Hướng dẫn giải Theo giả thiết, ta có : 3 3 23 Al(OH) AlO Al 25,1n0,4mol;n2n 0,1mol. 102 Căn cứ
DẠYKÈMQUYNHƠN OFFICIAL Trang 12/16 - Mã đề thi 357
3 2 3
Al(OH) OH Al
vào bản chất phản ứng và giả thiết, ta có đồ thị sau : Dựa vào tính chất hình học của đồ thị, ta thấy : 3Al(OH)n z 0 3z4z OH n x2y m 78 3m 78 3Al(OH)n 0,4 0 1,21,6 OH n 1,5 0,1 0,3
n 9xmol n 189 n0,04mol; n 7437n 37xmol
Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị : Dựa vào tính chất hình học của đồ thị, ta có : 0,004.9.400,1637x3xx0,004C% 8%C8 18
DẠYKÈMQUYNHƠN OFFICIAL Trang 13/16 - Mã đề thi 357
3 min OHmin Al(OH) OHmax max 0,3[NaOH] Ví dụ 17: Hòa tan hoàn toàn m gam hỗn hợp NaOH và KOH vào nước, thu được dung dịch Z, trong đó . Cho dung dịch Z phản ứng với dung dịch chứa 0,04 mol AlCl3, khối lượng kết tủa thu OH 0,1n0,14££ được là m gam. Giá trị của m là : A. B. 1,56m2,6. m2,6. C. D. 1,56m3,12. m3,12. (Đề thi thử ĐH lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2013 – 2014) Hướng dẫn giải Dựa vào bản chất của phản ứng và giả thiết, ta có đồ thị : 3Al(OH)n 0,04 0 0,120,16 OH n 37x 3x 9x 3Al(OH)n 0,04 0 012016 OH n 014 0,02 9x01 0,1/3
1,5M n0,3 0,2 n0,1 n1,5 1,5[NaOH] 7,5M 0,2
Ví dụ 16: X là dung dịch NaOH C%. Lấy 18 gam X hoặc 74 gam X tác dụng với 400 ml AlCl3 0,1M thì lượng kết tủa vẫn như nhau. Giá trị của C là : A. 4. B. 8. C. 7,2. D. 3,6. Hướng dẫn giải Theo giả thiết, ta có : 3 NaOH/18gamdd NaOH/18gamdd Al NaOH/74gamdd NaOH/74gamdd
Căn cứ vào dạng hình học của đồ thị, ta thấy khi thì lượng kết tủa biến thiên theo đường nét OH 0,1n0,14 đậm trên đồ thị. Suy ra : 3 3 Al(OH)min Al(OH)max 3 3
Al(OH) Al(OH) n n 0,02n 0,041,56m3,12
Ví dụ 18: X là dung dịch Al(NO3)3 aM. Thêm 6,21 gam Na vào 100 ml dung dịch X (TN1) thu được m gam kết tủa. Mặt khác, nếu thêm 6,44 gam Na vào 100 ml dung dịch X (TN2) thì thu được 0,8m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị của a là A. 1,2M. B. 0,9M. C. 0,8M. D. 1,24M. (Đề thi thử Đại học lần 2 – Trường THPT chuyên Lê Hồng Phong –Nam Định, năm học 2012 – 2013) Hướng dẫn giải
Ta có : NaOH/TN1Na NaOH/TN2Na n n0,27mol;n n0,28mol Theo giả thiết,
DẠYKÈMQUYNHƠN
Trang 14/16 - Mã đề thi 357
OFFICIAL
suy ra : Ở TN2 kết tủa đã bị hòa tan một phần; ở TN1 kết tủa có thể đã bị hòa tan hoặc chưa. ● Nếu ở TN1 kết tủa chưa bị hòa tan thì căn cứ vào dạng
học của đồ thị, ta có: 3 3 3 OH Al(OH) Al(OH) AlOH m n TN1:0,09 TN1:n m7,02 78 3 0,8m a0,88TN2:n4nnTN2:40,1a0,28 78
3 OH Al(OH) n
● Nếu ở TN1 kết tủa đã bị hòa tan thì căn cứ vào dạng hình học của đồ thị, ta có : 3 3 3 3 Al(OH) AlOH Al(OH) AlOH m TN1:40,1a0,27TN1:n4nn m3,9 78 TN2:n4nn 0,8m a0,8TN2:4.0,1a0,28 78 Ví dụ 19: Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được 7,8 gam kết tủa. Giá trị lớn nhất của V để thu được lượng kết tủa trên là : A. 0,35. B. 0,25. C. 0,45. D. 0,05. Hướng dẫn giải Ta có : 3 24 243 3 HSO Al(SO) Al(OH) H Al n2n0,2mol;n2n0,2mol;n0,1mol Dựa vào bản chất phản ứng và giả thiết, ta có đồ thị : 3Al(OH)n 0,2 3Al(OH)n a 0 3a4a OH n 3x x 4ax
hình
Suy ra : Vì như thế có nghĩa là đã có hiện tượng hòa tan kết tủa.
TN1:n0,08830,09(loai)
DẠYKÈMQUYNHƠN OFFICIAL Trang 15/16 - Mã đề thi 357 Dựa
3Al(OH) NaOHmax
Ví dụ 20:
từ từ đến
Tỉ
3
vào dạng hình học của đồ thị, ta thấy :
ddNaOH2M 0,9 n0,1moln 0,9molV 0,45lít 2
Khi nhỏ
dư dung dịch NaOH vào dung dịch hỗn hợp gồm a mol HCl và b mol AlCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau :
lệ a : b là A. 2 : 1. B. 2 : 3. C. 4 : 3. D. 1 : 1. (Đề thi tuyển sinh Đại học khối A năm 2014) Hướng dẫn giải Căn cứ vào bản chất phản ứng và giả thiêt, ta có đồ thị : Suy ra : HClH ann0,8 a0,8a4 b3b0,6(3b0,82)3(2,83b0,8)
NaOHn 0,82,0 2,8 0
Al(OH)n 0,4 NaOHn 0,20,5 0,9 0 0,1 0,81,0 NaOHn 0,82,0 2,8 0 3Al(OH)n 0,4 b 3b0,8
Trang 16/16 - Mã đề thi 357
DẠYKÈMQUYNHƠN OFFICIAL
(công thức cấu tạo) của hợp chất hữu cơ thì điều quan trọng là phải biết đặc điểm cấu tạo hoặc dự đoán được đặc điểm cấu tạo của hợp chất. Từ đó, dựa vào hóa trị và các kiểu liên kết của các nguyên tố trong hợp chất để viết đồng phân.
Muốn biết đặc điểm cấu tạo của hợp chất hữu cơ, ta dựa vào độ bất bão hòa (độ không no) của hợp chất đó.
Độ bất bão hòa của hợp chất hữu cơ là đại lượng đặc trưng cho độ không no của phân tử hợp chất hữu cơ, được tính bằng tổng số liên kết và số vòng có trong hợp chất đó. Độ bất bão hòa có thể được ký hiệu là k, a, ,... Thường ký hiệu là k. Công thức tính độ bất bão hòa : [songuyentö.(hoatròcuanguyento2)]2 k 2 Đối với hợp chất CxHyOzNt, ta có : kx(42)y(12)z(22)t(32)22xyt2(kN) 2 2
Nếu k = 0 thì hợp chất hữu cơ là hợp chất no, mạch hở. Nếu k = 1 thì đó là hợp chất không no, mạch hở, có 1 liên kết hoặc là hợp chất hữu cơ no, mạch vòng đơn Ví dụ : Hợp chất C3H6 có độ bất bão hòa k = 1, có thể có các đồng phân: + Hợp chất không no, mạch hở, có 1 liên kết CH2 CH CH3
theo thứ tự : Đồng phân mạch không nhánh viết trước, đồng phân mạch nhánh viết sau.
các đồng phân mạch nhánh lại viết đồng phân có một nhánh trước, mạch nhiều nhánh sau. Đối với các hợp chất có liên kết bội (liên kết đôi hoặc liên kết ba) hoặc có nhóm chức, thì luân chuyển liên kết bội hoặc nhóm chức trên mạch C để tạo ra các đồng phân khác nhau.
DẠYKÈMQUYNHƠN OFFICIAL Trang 1/26 - Mã đề thi 357 CHUYÊN ĐỀ 1: KĨ THUẬT XÁC ĐỊNH NHANH SỐ ĐỒNG PHÂN 1. Dạng 1 : Tính số đồng phân cấu tạo của hợp chất hữu cơ a. Bảng hóa trị và các kiểu liên
ết của
tố Nguyên tố
trị Các
ểu liên kết C 4 C C C C N 3 N N N O 2 O O H hoặc X (X là halogen) 1 H X b.
bước viết đồng
k
các nguyên
Hóa
ki
Các
phân Để viết đồng phân cấu tạo
bước viết đồng
Bước 1 : Tính độ bất
2 : Viết
Ví
+ Hoặc hợp chất no, mạch vòng đơn : CH2 CH2 H2C hay Các
phân cấu tạo của hợp chất hữu cơ :
bão hòa k, suy ra đặc điểm cấu tạo của hợp chất hữu cơ. Bước
đồng phân
Trong
c. Ví dụ minh họa
dụ 1: X là hiđrocacbon có công thức phân tử là C3H6 Số công thức cấu tạo của X là:
A. 1. B. 3. C. 2. D. 4. (Đề thi thử Đại học lần 1 – THPT Lương Đắc Bằng – Thanh Hóa, năm học 2013 – 2014) Trả lời Ứng với công thức phân tử C3H6 có đồng phân cấu tạo là : 2 CH2 CH CH3 CH2 CH2 H2C hay Ví dụ 2: Trong số các chất : C3H8, C3H7Cl, C3H8O và C3H9N; chất có nhiều đồng phân cấu tạo nhất là A. C3H7Cl. B. C3H8O. C. C3H8 D. C3H9N. (Đề thi tuyển sinh Đại học khối A năm 2010) Trả lời
C N Suy ra : C3H8 có một đồng phân; C3H7Cl có hai đồng phân; C3H8O có 3 đồng phân; C3H9N có 4 đồng phân. Vậy chất có nhiều đồng phân nhất là 39 CHN ● Cách 2 : Phân tích, đánh giá tìm nhanh đáp án đúng Các hợp chất hữu cơ đều có 3 nguyên tử C, nên sự chênh lệch về số đồng phân giữa chúng không phụ thuộc vào số nguyên tử C và tất nhiên cũng không phụ thuộc vào số nguyên tử H. Số lượng đồng phân của các hợp chất hữu cơ phụ thuộc vào số nguyên tử còn lại trong hợp chất. N có hóa trị 3, có nhiều kiểu liên kết với các nguyên tử
C hơn so với O có hóa trị 2 và Cl có hóa trị 1. Vậy hợp chất sẽ có nhiều đồng phân 39 CHN nhất.
dụ
phân hiđrocacbon thơm ứng với công thức phân tử C8H10 là
DẠYKÈMQUYNHƠN OFFICIAL Trang 2/26 - Mã đề thi 357
Ví
● Cách 1 : Viết đầy đủ số đồng phân của các chất, từ đó rút ra kết luận Công thức phân tử Các đồng phân C3H8 C C C C3H7Cl C C C Cl C C C Cl C C C O C C C O 3: Số đồng
C3H8O C C C O C C C N C C C N : A. 5. B. 2. C. 3. D.
C3H9N C C C N C C ● Cách 1 : Viết cụ thể
4. (Đề thi tuyển sinh Đại học khối A năm 2008) Trả lời
từng đồng phân
Cách viết này mất nhiều thời gian hơn so với cách viết sau đây : ● Cách 2 : Vẽ định hướng nhanh số đồng phân C C
Ví dụ 4: Cho iso-pentan tác dụng với Cl2 theo tỉ lệ số mol 1 : 1, số sản phẩm monoclo tối đa thu được là : A. 3. B. 5. C. 4. D. 2. (Đề thi tuyển sinh Đại học khối A năm 2008) Trả lời Iso – pentan tác dụng với Cl2 theo tỉ lệ mol 1 : 1 thì số sản phẩm monoclo tối đa thu được là : 4 C C C C C Cl C C C C C
Cl C C C C C Cl
C C C C C Cl
Ví dụ 5: Cho C7H16 tác dụng với clo có chiếu sáng theo tỉ lệ mol 1 : 1,
DẠYKÈMQUYNHƠN OFFICIAL Trang 3/26 - Mã đề thi 357
CH2 CH3 CH3 CH3 CH3 CH3 CH3 CH3
thu được hỗn hợp gồm 3 dẫn xuất monoclo. Số công thức cấu tạo của C7H16 có thể có là A. 4. B. 5. C. 2. D. 3. (Đề thi thử Đại học lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012) Trả lời C7H16 có 9 đồng phân : C C C C C C C (1) C C C C C C C (2) C C C C C C C (3) C C C C C C C (4)
Trong đó có đồng phân thỏa mãn điều kiện đề bài là : Đồng phân (5), (7), (8), (9). 4
Ví dụ 6: Hiđro hóa hoàn toàn hiđrocacbon mạch hở X thu được isopentan. Số công thức cấu tạo có thể có của X là A. 6. B. 5. C. 7. D. 4. (Đề thi tuyển sinh Đại học khối A năm 2012) Trả lời
Hiđro hóa hoàn toàn hiđrocacbon X mạch hở, thu được isopentan, chứng tỏ X có 5 nguyên tử C, mạch cacbon có 1 nhánh và phân tử phải chứa liên kết . Với đặc điểm cấu tạo như vậy, X sẽ có đồng phân :
DẠYKÈMQUYNHƠN OFFICIAL Trang 4/26 - Mã đề thi 357
C C C C C C C (5) C C C C C C C (6) C C C C C C C (7) C C C C C C C (8) C C C C C C C (9)
C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C C Ví dụ 7: C6H12 khi tác dụng với dung dịch HBr chỉ tạo ra 1 sản phẩm
duy nhất. Số công thức cấu tạo của C6H12 thỏa mãn điều kiện trên là: A. 4. B. 2. C. 3. D. 1. (Đề thi thử Đại học lần 1 – THPT Việt Yên 1, năm học 2013 – 2014) Trả lời Số đồng phân cấu tạo thỏa mãn điều kiện đề bài là : 3 C C C C C C C C C C C C Ví dụ 8: Số đồng phân cấu tạo của C5H10 phản ứng được với dung dịch brom là :
7
monobrom
A. 8 B. 9 C. 5 D. 7 (Đề thi tuyển sinh Đại học khối B năm 2011) Trả lời
Theo giả thiết, C5H10 phản ứng được với dung dịch brom. Mặt khác, độ bất bão hòa của nó bằng 1. Suy ra C5H10 có thể là anken hoặc xicloankan có vòng 3 cạnh. Có đồng phân cấu tạo của C5H10 thỏa mãn thỏa mãn 8 điều kiện đề bài :
Đồng phân mạch hở có 1 liên kết đôi C C C C C C C C C C C C C C
Đồng phân mạch vòng 3 cạnh
Ví dụ 9: Cho isopren tác dụng với HBr theo tỉ lệ 1 : 1 về số mol thì tổng số đồng phân cấu tạo có thể thu được là A. 5. B. 6. C. 4. D. 7. (Đề thi thử Đại học lần 1 – THPT Tĩnh Gia 2 – Thanh Hóa, năm học 2013 – 2014) Trả lời Cho isopren tác dụng với HBr theo tỉ lệ 1 : 1 về số mol thì tổng số đồng phân cấu tạo có thể thu được là 6 :
Ví dụ 10:
DẠYKÈMQUYNHƠN
Trang 5/26 - Mã đề thi 357
OFFICIAL
C C C C C C C C C C C
C C C C C Br H C C C C C Br H C C C C C Br H C C C C C Br H C C C C C Br H C C C C C Br H
Hiđrocacbon X có công thức phân tử C5H8. Khi cho X tác dụng với dung dịch AgNO3 trong
3, sinh ra kết tủa màu vàng nhạt. Số công thức cấu tạo thỏa
trên của X là A. 1. B. 3. C. 2. D. 4. (Đề thi thử Đại học lần 4 – THPT Chuyên – Đại học Vinh – Nghệ An, năm học 2012 – 2013) Trả lời Để phản ứng được với dung dịch AgNO3/NH3 thì C5H8 phải có liên kết ba ở đầu mạch. Có hai đồng phân cấu tạo thỏa mãn là :
NH
mãn điều kiện
Ví dụ 11: Số hiđrocacbon ở thể khí (đktc) tác dụng được với dung dịch AgNO3 trong NH3 là: A. 2. B. 4. C. 3. D. 5. (Đề thi thử Đại học lần 1 – THPT Hồng Lĩnh, năm học 2013 – 2014) Trả lời Các hiđrocacbon ở thể khí, phản ứng được với dung dịch AgNO3 là những hiđrocacbon có số nguyên tử C nhỏ hơn hoặc bằng 4 và có liên kết ba ở đầu mạch. Có
DẠYKÈMQUYNHƠN OFFICIAL Trang 6/26 - Mã đề thi 357
CH C CH2 CH2 CH3 CH3 CH C CH CH3
CHCH 3CHCCH 23CHCCHCH 2CHCCHCH CHCCCH Ví dụ
Với
hiđrocacbon thỏa mãn điều kiện là : 5
12:
công thức phân tử C3H6Cl2 thì có bao nhiêu chất khi tác dụng với dung dịch NaOH dư, đun nóng, cho sản phẩm có phản ứng với Cu(OH)2 ở điều kiện thích hợp? A. 1. B. 2. C. 4. D. 3. (Đề thi thử Đại học lần 2 – THPT Chuyên – Đại học Vinh – Nghệ An, năm học 2012 – 2013) Trả lời C3H6Cl2 tác dụng với dung dịch NaOH dư, đun nóng, tạo ra sản phẩm phản ứng được với Cu(OH)2 Chứng tỏ sản phẩm tạo thành phải là anđehit hoặc ancol hai chức có hai nhóm –OH liền kề nhau. Suy ra C3H6Cl2 có đồng phân thỏa mãn với tính chất : 2 32 2CHCHCHCl 3 2 CHCHClCHCl Sơ đồ phản ứng : o 2 o NaOH,t 32 2 32 2 32 HO NaOH,t 3 2 3 2 CHCHCHCl CHCHCH(OH) CHCHCHO CHCHClCHCl CHCHOHCHOH
Ví dụ 13: Chất X có công thức phân tử C3H5Br3, đun X với dung dịch NaOH dư, thu được chất hữu cơ Y có khả năng tác dụng với Cu(OH)2 Số cấu tạo X thỏa mãn là: A. 4. B. 2. C. 3. D. 5. (Đề thi thử Đại học lần 4 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2010 – 2011) Trả lời Phân tử C3H5Br3 có 5 đồng phân : Br C C C Br Br (1) Br C C C Br Br (2) Br C C C Br Br (3) Br C C C Br Br (4) Br C C C Br Br (5) Chất Y sinh ra từ phản ứng của X với NaOH, có khả năng phản ứng với Cu(OH)2, suy ra Y là ancol đa chức, có ít nhất hai nhóm –OH liền kề nhau hoặc Y là anđehit. Vậy X có đồng phân thỏa mãn tính chất là 3 (2), (3), (5). Sơ đồ phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL Trang 7/26 - Mã đề thi 357 o 2 o 2 NaOH,t 222 222 22 (2) HO NaOH,t 2 3 2 3 HO (3) CHBrCHCHBr CH(OH)CHCHOHOHCCHCHOH CHBrCHBrCH CH(OH)CHOHCH OHCCHO o 3 NaOH,t 2 2 2 2 (5) HCH CHBrCHBrCHBr CHOHCHOHCHOH Ví dụ 14*: Số đồng phân có vòng benzen, có công thức phân tử C7H6Cl2 là : A. 8. B. 9. C. 11. D. 10. (Đề thi thử Đại học lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2012 – 2013)
Hợp chất
C7
6Cl2
CHCl2 (1) CH2Cl Cl (2) CH2Cl Cl (3) CH2
Cl
CH3 Cl Cl (5) CH3 Cl Cl (6) CH3 Cl Cl
CH3
CH3 Cl Cl (9) CH
Ví
15: Khi phân tích thành phần một ancol đơn chức X thì thu được kết quả: tổng khối lượng của cacbon và hiđro gấp 3,625 lần khối lượng oxi. Số đồng phân ancol ứng với công thức phân tử của X là : A. 2. B. 4 C. 1 D. 3 (Đề thi tuyển sinh Đại học khối A năm 2008) Trả lời Đặt công thức của X là CxHyO. Theo giả thiết, ta có : 410 x4 12xy3,625.1658 XlaCHO. y10 ● Cách 1 : Viết cụ thể từng đồng phân
Trả lời
thơm
H
có đồng phân : 10
Cl
(4)
(7)
Cl Cl (8)
3 Cl Cl (10)
dụ
DẠYKÈMQUYNHƠN OFFICIAL Trang 8/26 - Mã đề thi 357 CH3 CH2 CH2 CH2 OH CH3 CH2 CH CH3 OH CH3 CH CH3 CH2 OH CH3 C CH3 CH2 OH ● Cách 2 : Vẽ định hướng nhanh số đồng phân C C C C C C C C O Ví dụ 16: Số ancol bậc I là đồng phân cấu tạo của nhau có công thức phân tử C5H12O là A. 4. B. 1 C. 8. D. 3 (Đề thi tuyển sinh Cao đẳng năm 2012) Trả lời ● Cách 1 : Viết cụ thể từng đồng phân CH3 CH2 CH2 CH2 CH2 OH CH3 CH2 CH CH2 OH CH3 CH2 CH2 CH CH3 CH3 HO C CH2 CH3 CH3 CH3 OH ● Cách 2 : Vẽ định hướng nhanh số đồng phân C C C C C C C C C C C CC C C O Ví dụ 17: Số ancol đồng phân cấu tạo của nhau có công thức phân tủ C5H12O, tác dụng với CuO đun nóng sinh ra xeton là : A. 4. B. 2. C. 5. D. 3. (Đề thi tuyển sinh Cao đẳng năm
Trả lời Ancol bị oxi hóa không hoàn toàn bởi CuO sinh ra xeton, suy ra đó là các ancol bậc 2. ● Cách 1 : Viết cụ thể từng đồng phân CH3 CH2 CH CH2 OH CH3 CH3 CH2 CH CH2 OH CH3
2011)
DẠYKÈMQUYNHƠN OFFICIAL Trang 9/26 - Mã đề thi 357 CH3 CH CH OH CH3 CH3 ● Cách 2 : Vẽ định hướng nhanh số đồng phân C C C C C C C C C C O Ví dụ 18: Đốt cháy hoàn toàn m gam một ancol no X thu được m gam H2O. Biết khối lượng phân tử của X nhỏ hơn 100 (đvC). Số đồng phân cấu tạo của ancol X là: A. 5. B. 6. C. 3. D. 4. (Đề thi thử Đại học lần 1 – THPT Lý Thường Kiệt, năm học 2013 – 2014) Đặt công thức của ancol no X là CnH2n+2-b(OH)b. 2 n2n2bb HO CH(OH) n1 Chonm18 18 n 14n216b Theo giả thiết và bảo toàn nguyên tố H, ta có : n2n2b(OH) 2 b CH HO 482 n4 (2n2)18 (2n2)n 2n 24bn4 XlaCH(OH). 14n216b b2 X có đồng phân là : 6 C C C C OH OH C C C C OH C C C COH OH Ví dụ 19: X là một ancol có công thức phân tử C3H8On, X có khả năng hòa tan Cu(OH)2 ở nhiệt độ thường. Số đồng phân của X là: A. 3. B. 4. C. 2. D. 1. (Đề thi thử Đại học lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012) Trả lời Theo giả thiết : X có khả năng hòa tan được Cu(OH)2 ở nhiệt độ thường, chứng tỏ X là ancol đa chức, có 2 nhóm –OH liền kề nhau trở lên. Vậy số đồng phân của X là : C C C OH OH C C C OH OH OH
Ví dụ 20: Ứng với công thức C4H10O3 có bao nhiêu đồng phân bền chỉ chứa nhóm chức –OH trong phân tử có thể hoà tan được Cu(OH)2 ? A. 4. B. 2. C. 3. D. 1. (Đề thi thử Đại học lần 1 – THPT Vĩnh Bảo – Hải Phòng, năm học 2013 – 2014) Trả lời Để hòa tan được Cu(OH)2 thì C4H10O3 phải có ít nhất 2 nhóm –OH liền kề nhau. Suy ra C4H10O3 có đồng 3 phân : CCCC OHOHOH
CCCC OHOH OH CCC OHOHOH
C
C OH C 2 đồng phân 3 đồng phân Tổng số : 5 đồng phân M M16 %O100%M 108XlaCHO M %O14,81% X có đồng phân : 5 ● Cách 1 : Viết cụ thể từng đồng phân CH2OH O CH3 CH3 OH
Ví dụ 22: Chất hữu cơ X chứa vòng benzen có công thức phân tử là CxHyO. Biết % O = 14,81% (theo khối lượng). Số công thức cấu CH3 OH
CH3 OH ● Cách 2 : Viết định hướng nhanh số đồng phân
DẠYKÈMQUYNHƠN
Trang 10/26 - Mã đề thi 357
OFFICIAL
Ví dụ 21: Số hợp chất đồng phân cấu tạo của nhau có công thức phân tử C8H10O, trong phân tử có vòng benzen, tác dụng được với Na, không tác dụng được với NaOH là : A. 4. B. 6. C. 7. D. 5. (Đề thi tuyển sinh Cao đẳng năm 2011) Trả lời Theo giả thiết : C8H10O có vòng benzen; tác dụng được với Na, không tác dụng được với NaOH. Chứng tỏ chúng là các ancol thơm. Số đồng phân cấu tạo thỏa mãn tính chất là : 5 C C OH tạo phù hợp của X là A. 8. B. 6. C. 7. D. 5. (Đề thi chọn học sinh giỏi tỉnh Thái Bình, năm học 2012 – 2013) Trả lời Vì O O X 78 X
Ví dụ 23: Số chất ứng với công thức phân tử C7H8O (là dẫn xuất của benzen) đều tác dụng được với dung dịch NaOH là :
A. 2. B. 4. C. 3. D. 1. (Đề thi tuyển sinh Đại học khối B năm 2007) Trả lời
Theo giả thiết, C7H8O có vòng benzen và đều tác dụng được với NaOH nên chúng là các phenol. Số đồng phân thỏa mãn là : 3
CH3 OH
CH3 OH
CH3 OH
CH3 OH
CH3 OH 25: X là hợp chất thơm có công thức phân tử C7H8O2 tác dụng với dung dịch Br2 tạo ra được dẫn xuất tribrom. X tác dụng được với dung dịch NaOH theo tỉ
CH2OH O CH3 Ví dụ
lệ mol 1 : 1. Số đồng phân của X là:
A. 2. B.
(Đề thi
DẠYKÈMQUYNHƠN
Trang 11/26 - Mã đề thi 357 C
OFFICIAL
O
Ví dụ 24: Ứng với công thức phân tử C7H8O có bao nhiêu đồng phân là dẫn xuất của benzen và số đồng phân đều tác dụng được với các chất: K, KOH, (CH3CO)2O: A. 5 và 2. B. 5 và 3 C. 4 và 2. D. 4 và 3. (Đề thi chọn học sinh giỏi Tỉnh Thái Bình, năm học 2011 – 2012) Trả lời Ứng với công thức C7H8O có đồng phân là dẫn xuất của benzen trong đó có đồng phân phenol đều 5 3 phản ứng được với các chất K, KOH và (CH3CO)2O. Phenol Ancol thơm Ete thơm CH3 OH
6. C. 5. D. 4.
thử Đại học lần 4 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012) Trả lời Theo giả thiết : X phản ứng được với dung dịch NaOH theo tỉ lệ mol 1 : 1, chứng tỏ X có 1 nhóm –OH phenol (nhóm –OH gắn vào vòng benzen); X phản ứng với dung dịch Br2 tạo ra dẫn xuất tribrom, chứng tỏ các vị trí 2, 4, 6 trên vòng benzen (so với vị trí số 1 có nhóm –OH) phải còn nguyên tử H. Vậy X có đồng phân 2 là :
OH CH2OH
OH OCH3
Ví dụ 26: X có công thức phân tử là C8H10O. X tác dụng được với NaOH. X tác dụng với dung dịch brom cho Y có công thức phân tử là C8H8OBr2. Hãy cho biết X có bao nhiêu công thức cấu tạo thỏa mãn ? A. 6. B. 5. C. 4. D. 3. (Đề thi thử Đại học lần 4 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2010 – 2011) Trả lời X có công thức là C8H10O, tác dụng được với NaOH, chứng tỏ X là phenol. X tác dụng được với dung dịch Br2 cho Y có công thức phân tử là C8H8OBr2, chứng tỏ có hai nguyên tử H trên vòng benzen bị thay thế bởi 2 nguyên tử Br. Suy ra đã có một vị trí chẵn trên vòng benzen (so với nhóm –OH ở vị
số 1) liên kết với gốc ankyl.
H
tạo thỏa mãn : 5
thức
3
3
H5
3
3
dụ 27: Cho công thức phân tử của hợp chất thơm X là C7H8O2. X tác dụng với dung dịch NaOH theo tỉ lệ mol 1 : 1. Số chất X thỏa mãn là A. 5. B. 3. C. 6. D. 2. (Đề thi thử Đại học lần 1 – THPT Quất Lâm – Nam Định, năm học 2013 – 2014) Trả lời Hợp chất thơm C7H8O2 phản ứng với NaOH theo tỉ lệ mol 1 : 1. Suy ra X chứa một nhóm –OH phenol (gắn trực tiếp vào vòng benzen). Nguyên tử O còn lại nằm trong chức –OH ancol hoặc chức ete. Vậy X có 6 đồng phân : OH CH2OH
OH OCH3 Ví dụ 28: Hợp chất hữu cơ X chứa vòng benzen có công thức phân tử trùng với công thức đơn giản nhất. Trong X, tỉ lệ khối lượng các nguyên tố là mC : mH : mO = 21 : 2 : 8. Biết khi X phản ứng hoàn toàn với Na thì thu được số mol khí hiđro bằng số mol của X đã phản ứng. X có bao nhiêu đồng phân (chứa vòng benzen) thỏa mãn các tính chất trên ?
DẠYKÈMQUYNHƠN
Trang 12/26 - Mã đề thi 357
OFFICIAL
trí
Vậy X có công
cấu
OH C2
5 OH C2
OH CH
CH
OH CH3 CH3 OH CH
CH
Ví
Phản ứng của X với Na, thu được , chứng tỏ trong X có hai nguyên tử H linh động. Vậy X có 2 2 HXnn nhóm –OH. X có đồng phân cấu tạo thỏa mãn là : 9 C OH OH OH
C OH 3 đồng phân 6 đồng phân Tổng : 9 đồng phân Ví dụ 29: X là hợp chất thơm có công thức phân tử C7H8O khi cho X tác dụng với nước Br2 tạo ra sản phẩm Y có chứa 69,565% Br về khối lượng. X là: A. o-crezol. B. m-crezol. C. Ancol benzylic. D. p-crezol. (Đề thi thử Đại học lần 3 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2010 – 2011) Trả lời
là hợp
chất thơm, X tác dụng với dung dịch Br2, chứng tỏ X là phenol. Theo giả thiết, ta có :
trí
chẵn trên vòng benzen của X không có nhóm thế. Vậy Z là m – crerol. Thật ra bài này có thể
duy nhanh như sau : X là hợp chất thơm, X tác dụng với dung dịch Br2, chứng tỏ X là phenol. Vậy loại ngay phương án C. Ở phương án A hoặc D, một vị trí chẵn 2 hoặc 4 trên vòng benzen có nhóm CH3- nên khi phản ứng với Br2 sẽ cho sản phẩm có phần trăm khối lượng của Br như nhau. Vậy loại A và D (vì chỉ có một
2008)
DẠYKÈMQUYNHƠN OFFICIAL Trang 13/26 - Mã đề thi 357
X
2Br 78 78xx X Y 753 Br/Y CHOCHBrO x3 Y:CHBrO 80x %m 69,565% 10879x Suy
phương án đúng).
A. 9. B. 3. C. 7. D. 10. (Đề thi tuyển sinh Đại học khối A năm 2011) Trả lời Theo giả thiết, suy ra : CHO 782 218 n:n:n:2:1,75:2:0,57:8:2XcoCTPTlaCHO 1216 Ví dụ 30: Số đồng phân xeton ứng với công thức phân tử C5H10O là : A. 5. B. 4. C. 3. D. 6. (Đề thi tuyển sinh Đại học khối A năm
Trả lời ● Cách 1 : Viết cụ thể từng đồng phân C C C O C C C C C C C O C C C O C C ● Cách 2 : Vẽ định hướng nhanh số đồng phân
C OH
ra các vị
tư
Suy ra đáp án là B.
O
C C C C C
Ví dụ 31: Ứng với công thức phân tử C3H6O có bao nhiêu hợp chất mạch hở bền khi tác dụng với khí H2 (xúc tác Ni, to) sinh ra ancol ? A. 3. B. 4. C. 2. D. 1. (Đề thi tuyển sinh Cao đẳng năm 2010) Trả lời Độ bất bão hòa của C3H6O mạch hở bằng 1, chứng tỏ trong phân tử của nó phải có 1 liên kết . Mặt khác, C3H6O phản ứng với H2 (Ni, to) sinh ra ancol nên suy ra : C3H6O là ancol không no, đơn chức; anđehit hoặc xeton no, đơn chức. Có hợp chất thỏa mãn điều kiện là : 3 CH2 CH CH2 OH CH3 CH2 C
O H
CH3 C CH3 O
Ví dụ 32: Có bao nhiêu chất hữu cơ mạch hở dùng để điều chế 4-metylpentan-2-ol chỉ bằng phản ứng cộng H2 (xúc tác Ni, to)? A. 3. B. 5. C. 2. D. 4. (Đề thi tuyển sinh Đại học khối B năm 2010) Trả lời Theo giả thiết : Hôpchathöucô + H2 C C C C C
DẠYKÈMQUYNHƠN
Trang 14/26 - Mã đề thi 357
OFFICIAL
C C C C C
C C
C OH C
C
C C
C C O C C
C C O C C C C C C O
C OH 1 2 3 4 5 4-metylpantan-2-ol Ni,to Suy ra : Hợp chất hữu cơ là ancol không no, bậc 2; xeton không no hoặc xeton no. Có hợp chất thỏa 5 mãn là :
C C C
C C C C
OH
C C
C C
Ví dụ 33: Số đồng phân este ứng với công thức phân tử C4H8O2 là : A. 6. B. 4. C. 5. D. 2. (Đề thi tuyển sinh Đại học khối A năm 2008) Trả lời Số đồng phân este ứng với công thức phân tử C4H8O2 là : 4 HCOO CH2 CH2 CH3 CH3
HCOO CH CH3 CH3COO CH2 CH3 CH3 CH2 CH3 COO
Ví dụ 34: Khi xà phòng hóa triglixerit X bằng dung dịch NaOH dư, đun nóng, thu được sản phẩm gồm glixerol, natri oleat, natri stearat và natri panmitat. Số đồng phân cấu tạo thỏa mãn tính chất trên của X là A. 2. B. 1. C. 3. D. 4. (Đề thi tuyển sinh Cao đẳng năm 2013) Trả lời
Số đồng phân thỏa mãn là 3 : C3H5 OOCC15H31 OOCC17H33
OOCC17H35 C3H5 OOCC17H35 OOCC17H33
OOCC15H31 C3H5 OOCC17H33 OOCC17H35
OOCC15H31
Ví dụ 35: Cho glixerol phản ứng với hỗn hợp axit béo gồm C17H35COOH và C15H31COOH, số loại trieste được tạo ra tối đa là : A. 6. B. 3. C. 5. D. 4. (Đề thi tuyển sinh Đại học khối B năm 2007) Trả lời
● Cách 1 : Viết cụ thể từng đồng phân Cho glixerol phản ứng với hỗn hợp axit béo gồm C17H35COOH và C15H31COOH, số loại trieste được tạo ra tối đa là : 6
DẠYKÈMQUYNHƠN OFFICIAL Trang 15/26 - Mã đề thi 357
OOCC
H35 OOCC17H35 OOCC17H35 C3H5 OOCC15H31 OOCC15H31 OOCC15
31 C3H5 OOCC
C3H5 OOCC17H35 OOCC15H31 OOCC15H31 C3H5 OOCC17H35 OOCC15H31 OOCC17H35 C3H5 OOCC15
31 OOCC
● Cách 2 : Tính nhanh số đồng phân bằng công thức Có n axit béo khác nhau thì có thể tạo thành chất béo khác nhau. Suy ra số loại chất béo khác 2 n(n1) 2 nhau được tạo thành từ glixerol và hai loại axit béo khác nhau là : 2 2(21)6 2 Ví dụ 36: Số trieste khi thủy phân đều thu được sản phẩm gồm glixerol, axit CH3COOH và axit C2H5COOH là A. 9. B. 4. C. 6. D. 2. (Đề thi tuyển sinh Đại học khối B năm 2012) Trả lời Số trieste khi thủy phân đều thu được sản phẩm gồm glixerol, axit CH3COOH và axit C2H5COOH là : 4
C3H5
17
H
15H31 OOCC17H35 OOCC15H31
H
17H35 OOCC17H35
C3H5 OOCCH3 OOCC2H5
OOCCH3 C3H5 OOCC2H5 OOCCH3
OOCCH3 C3H5 OOCC2H5 OOCC2H5
OOCCH3 C3H5 OOCCH3 OOCC2H5
OOCC2H5
Ví dụ 37: Tổng số hợp chất hữu cơ no, đơn chức, mạch hở, có cùng công thức phân tử C5H10O2, phản ứng được với dung dịch NaOH nhưng không có phản ứng tráng bạc là A. 4. B. 5. C. 8. D. 9. (Đề thi tuyển sinh Đại học khối B năm 2010)
Trả lời Các hợp chất no, đơn chức, mạch hở có công thức phân tử C5H10O2 là các axit cacboxylic và este no, đơn chức, mạch hở. Vì không có phản ứng tráng gương nên este không chứa gốc axit HCOO–. Vậy có hợp chất 9 thỏa mãn tính chất là :
Axit cacboxylic
DẠYKÈMQUYNHƠN
Trang 16/26 - Mã đề thi 357
OFFICIAL
CH3 CH
CH
CH
CH
CH3 CH
CH
CH
CH3
CH
2COOCH2CH3 CH3CH2CH2COOCH3 CH3 CH3
3 Ví dụ 38: Hợp chất hữu cơ X có công thức phân tử C6H10O2, cho 9,12 gam X tác dụng với dung dịch NaOH vừa đủ thu được dung dịch Y, cho dung dịch Y tác dụng với dung dịch AgNO3 dư trong NH3 đun nóng thu được 34,56 gam Ag. Số đồng phân cấu tạo của X là: A. 4. B. 5 C. 2. D. 3. (Đề thi thử Đại học lần 2 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012) Trả lời Ta có : Cả hai sản phẩm trong Y đều tham gia phản ứng tráng 6102chathöucôtrongYCHO Ag chathöucôtrongY n 2n0,16 n 0,322 n 0,16 gương. Số đồng phân cấu tạo của X thỏa mãn là : HCOOCH CHCH2CH2CH3 HCOOCH CCH2CH3 CH3 HCOOCH CHCHCH3 CH3 Ví dụ 39: Số đồng phân axit và este có công thức phân tử C4H8O2 là A. 4. B. 5. C. 3. D. 6
2
2 COOH CH2
3 CH3 CH COOH CH2
3
COOH CH2
3
3 C COOH CH3 Este
COOCH2CH2CH3 CH3COOCHCH3 CH3
3CH
CHCOOCH
(Đề thi thử Đại học lần 1 – THPT Vĩnh Bảo – Hải Phòng, năm học 2013 – 2014) Trả lời
Tổng số đồng phân axit và este có công thức C4H8O2 là : 6 Axit CH3 CH2 CH2 COOH CH3
CH3 CH COOH Este HCOO CH2 CH2 CH3 CH3
HCOO CH CH3 CH3COO CH2 CH3 CH3 CH2 CH3 COO
Ví dụ 40: Tổng số chất hữu cơ mạch hở, có cùng công thức phân tử C2H4O2 là A. 3 B. 1 C. 2 D. 4 (Đề thi tuyển sinh Đại học khối A năm 2010) Trả lời C2H4O2 có hợp chất hữu cơ mạch hở là : 3 CH3COOH HCOOCH3 HOCH2CHO
dụ
đồng phân cấu tạo của amin bậc một có cùng công thức
DẠYKÈMQUYNHƠN OFFICIAL Trang 17/26 - Mã đề thi 357
● Cách 2 : Vẽ định hướng nhanh số đồng phân C C C C C C C C C N Ví dụ 42: Thành phần % khối lượng của nitơ trong hợp chất hữu cơ CxHyN là 23,73%. Số đồng phân amin bậc một thỏa mãn các dữ kiện trên là : A. 2. B. 3. C. 4. D. 1. (Đề thi tuyển sinh Đại học khối A năm
Ví
41: Số
phân tử C4H11N là : A. 5. B. 4. C. 3. D. 2. (Đề thi tuyển sinh Cao đẳng năm 2009) Trả lời ● Cách 1 : Viết cụ thể từng đồng phân Số đồng phân cấu tạo của amin bậc một có cùng công thức phân tử C4H11N là : 4 CH3 CH2 NH2 CH2 CH3 NH2 CH3 CH CH3 NH CH3 CH CH3 CH3 N CH3 Cách viết này mất nhiều thời gian hơn so với cách viết sau đây.
2011)
Trả lời Theo giả thiết, ta có : xy 39 x3 14%N 23,73%12xy45 CHNlaCHN 12xy14 y9
● Cách 1 : Viết cụ thể từng đồng phân C3H9N có đồng phân amin bậc 1 : 2 CH3 CH CH3 NH2
● Cách 2 : Viết định hướng nhanh tổng số đồng phân C C C N
CH2 CH2 CH3 NH2
Ví dụ 43: Cho 11,8 gam amin đơn chức X tác dụng vừa đủ với dung dịch HCl, sau khi
DẠYKÈMQUYNHƠN OFFICIAL Trang 18/26 - Mã đề thi 357
ứng
toàn thu được dung dịch Y. Làm bay hơi dung dịch Y được 19,1 gam muối
Số
thức
ứng
thức phân tử của X là
Đại
1 – THPT Quất
Trả lời Ta có : xy xy X(CHN)HCl xy 39 CHN 19,111,8 n n 0,2 36,5 CHNlaCHN. M11,859 0,2 X có đồng phân : 4 CH3 CH2 NH2 CH2 CH3 NH2 CH3 CH CH3 NH CH3 CH CH3 CH3 N CH3 Ví dụ 44: Số đồng phân amin bậc một, chứa vòng benzen, có cùng công thức phân tử C7H9N là A. 3. B. 5. C. 2. D. 4. (Đề thi tuyển sinh Đại học khối B năm 2013) Trả lời ● Cách 1 : Viết cụ thể từng đồng phân CH2NH2 CH3 NH2 CH3 NH2 CH3 NH2 ● Cách 2 : Vẽ định hướng nhanh số các đồng phân
phản
xảy ra hoàn
khan.
công
cấu tạo
với công
A. 5. B. 4. C. 6. D. 3. (Đề thi thử
học lần
Lâm – Nam Định, năm học 2013 – 2014)
DẠYKÈMQUYNHƠN OFFICIAL Trang 19/26 - Mã đề thi 357 C N Ví dụ 45: Ứng với công thức phân tử C2H7O2N có bao nhiêu chất vừa phản ứng được với dung dịch NaOH vừa phản ứng được với dung dịch HCl ? A. 2. B. 3. C. 1. D. 4. (Đề thi tuyển sinh Cao đẳng năm 2010) Trả lời Có hai đồng phân thỏa mãn tính chất là : Đồng phân 33 HCOOHNCH(metylamonifomat) Phản ứng 33 32 2 33 33 HCOOHNCHNaOHHCOONaCHNHHO HCOOHNCHHClHCOOHCHNHCl Đồng
3 4 CHCOONH(amoniaxetat)
3 4 3 3 2 3 4 3 4 CHCOONHNaOHCHCOONaNHHO CHCOONHHClCHCOOHNHCl Ví
: HCOOH3
2H5 HCOOH2
3 CH3 CH
Suy ra có 4 cặp chất X, Y thỏa mãn điều kiện trên là HCOOH và C2H5NH2 HCOOH và (CH3)2NH CH3COOH và CH3NH2 C2H5COOH và NH3 Ví dụ 47*: X có công thức C4H14O3N2. Khi cho X tác dụng với dung dịch NaOH thì thu được hỗn hợp Y gồm 2 khí ở điều kiện thường và đều có khả năng làm xanh quỳ tím ẩm. Số công thức cấu tạo phù hợp của X là: A. 5. B. 3. C. 4. D. 2. (Đề thi thử Đại học lần 2 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012) Trả lời X tác dụng với dung dịch NaOH, thu được hỗn hợp khí đều có khả năng là xanh giấy quỳ tím ẩm. Chứng tỏ : X là muối amoni; hai khí là NH3 và amin hoặc là 2 amin Amin ở thể khí nên số nguyên tử C trong phân tử bằng 1 hoặc 2, nếu có
phân
Phản ứng
dụ 46: Cho axit cacboxylic X phản ứng với chất Y thu được một muối có công thức phân tử C3H9O2N (sản phẩm duy nhất). Số cặp chất X và Y thỏa mãn điều kiện trên là A. 3. B. 2. C. 4. D. 1. (Đề thi tuyển sinh Đại học khối B năm 2012) Trả lời Axit cacboxylic X phản ứng với chất Y tạo ra muối có công thức là C3H9O2N, chứng tỏ Y là amin hoặc NH3. Có 4 muối ứng với công thức C3H9O2N là
NC
NCH
3COOH3NCH3 C2H5COONH4
3 nguyên tử C thì phải là amin bậc 3. Vì hai nguyên tử N đã nằm trong hai khí nên gốc axit trong X không thể chứa N. Mặt khác, gốc axit có 3 nguyên tử O, suy ra X là muối amoni của axit cacbonic, chứa gốc để liên kết với hai gốc amoni. 2 3CO Số công thức cấu tạo của X thỏa mãn là : 3
NH CH3 CH3 CH3
O O C O H4N
CH3
CH2 CH3
CH3
CH3 CH3
O O C O H3N NH2
O O C O H3N NH2
PS : Đối với câu hỏi này, học sinh trung bình và khá sẽ cảm thấy khó, còn học sinh giỏi thì lại làm ra đáp án là 5 vì cho rằng amin có 3 nguyên tử C có 3 đồng phân. Tuy nhiên, amin có 3 nguyên tử C thì chỉ có amin bậc 3 là ở thể khí ở điều kiện thường, các amin khác ở thể lỏng.
Ví dụ 48: Số đồng phân amino axit có công thức phân tử C3H7O2N là : A. 2. B. 4. C. 3. D. 1. (Đề thi tuyển sinh Đại học khối A năm 2011) Trả lời
● Cách 1 : Viết cụ thể các đồng phân C3H7O2N có đồng phân amino axit : 2 CH3 CH COOH NH2
● Cách 2 : Viết định hướng nhanh số đồng phân C C COOH N
Ví dụ 49: Số đipeptit tối đa có thể tạo
CH2 CH2 COOH NH2
DẠYKÈMQUYNHƠN OFFICIAL Trang 20/26 - Mã đề thi 357
ra từ một hỗn hợp gồm alanin và glyxin là : 4 HOOC CH2 N CH2 NH2 C O H hoặc có thể biểu diễn đơn giản là : Gly – Gly HOOC CH2 N CH NH2 CH3 C O H hoặc có thể biểu diễn đơn giản là : Gly – Ala N CH NH2 CH3 HOOC CH CH3 C O H hoặc có thể biểu diễn đơn giản là : Ala – Ala N CH2 NH2 HOOC CH CH3 C O H hoặc có thể biểu diễn đơn giản là : Ala – Gly Ví dụ 50: Có bao nhiêu tripeptit (mạch hở) khác loại mà khi thuỷ phân hoàn toàn đều thu được 3 aminoaxit: glyxin, alanin và phenylalanin? A. 3. B. 9. C. 4. D. 6. (Đề thi tuyển sinh Đại học khối A năm 2010)
ra từ một hỗn hợp gồm alanin và glyxin là A. 2. B. 3. C. 4. D. 1. (Đề thi tuyển sinh Đại học khối B năm 2009) Trả lời Số đipeptit tối đa có thể tạo
Trả lời
● Cách 1 : Viết đầy đủ các đồng phân Có tripeptit khác nhau khi thủy phân đều thu được glyxin, alanin và phenylalanin : 6
Gly – Ala – Phe Gly – Phe – Al Ala – Phe – Gly Ala – Gly – Phe Phe – Ala – Gly Phe – Gly – Ala
● Cách 2 : Dùng công thức tính nhanh Với n amino axit khác nhau sẽ tạo ra được n! n-peptit chứa đồng thời n gốc amino axit khác nhau. Suy ra : số tripeptit thủy phân đều thu được glyxin, alanin và phenylalanin là 3! = 3.2.1 = 6
Ví dụ 51: Cho một đipeptit Y có công thức phân tử C6H12N2O3. Số đồng phân peptit của Y (chỉ chứa gốc - amino axit) mạch hở là: A. 5. B. 4. C. 7. D. 6. (Đề thi thử Đại học lần 2 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012) Trả lời Y có đồng phân : 5
Ví dụ 52: Hợp chất hữu cơ X mạch hở có khối lượng mol là 56 đvC. Khi đốt cháy X bằng oxi thu được sản phẩm
DẠYKÈMQUYNHƠN
21/26 - Mã đề thi 357
OFFICIAL Trang
C N O H COOH C C C C H2N C N O H COOH C C C C H2N C N O H COOH C C C C H2N C N O H COOH C C C H2N C C N O H COOH C C C H2N C
2
X
Thái
Trả lời Nếu X không chứa O thì công thức phân tử của X là C4H8 (M = 56). Nếu X có O thì công thức phân tử của X là C3H4O. X có cấu tạo mạch hở và làm mất màu nước brom nên X có công thức cấu tạo thỏa mãn : 6 32 2CHCHCHCH 3 3CHCHCHCH 2 3 3CHC(CH)CH 2 CHCHCHO 2 CHCCHOH 3CHCOCH 2 CHCHCHO 2 CHCCHOH 3CHCOCH Ví dụ 53: Một este E mạch hở có công thức phân tử C5H8O2 Đun nóng E với dung dịch NaOH thu được hai sản phẩm hữu cơ X, Y, biết rằng Y làm mất màu dung dịch nước Br2. Có các trường hợp sau về X, Y: 1. X là muối, Y là anđehit. 2. X là muối, Y là ancol không no. 3. X là muối, Y là xeton. 4. X là ancol, Y là muối của axit không no. Số trường hợp thỏa mãn là : A. 1. B. 3. C. 2. D. 4.
chỉ gồm CO2 và H
O.
làm mất màu dung dịch brom. Số công thức cấu tạo có thể có của X là: A. 4. B. 7. C. 6. D. 5. (Đề thi chọn học sinh giỏi Tỉnh
Bình, năm học 2011 – 2012)
2
23
2.XlaCHCOONa,YlaCHCHCHOH,ElaCHCOOCHCHCH. 3.XlaHCOONa,YlaCHCOCHCH,ElaHCOOC(CH)CH. 4.XlaCHCHCOONa,YlaCHOH,ElaCHCHCOOCHCH. 2. Dạng 2 : Xác định các chất có đồng phân hình học a. Khái niệm về đồng phân hình học Đồng phân hình học là các đồng phân có thành phần cấu tạo như nhau nhưng khác nhau về sự phân bố không gian của các nguyên tử trong phân tử Điều kiện để hợp chất hữu cơ có đồng phân hình học là : Phân tử phải có liên kết đôi C = C (1); các nguyên tử, nhóm nguyên tử liên kết với nguyên tử C có liên kết đôi phải khác nhau (2). C b
d e
a ab de 1
2 Đồng phân hình học tồn tại theo từng cặp cis – trans : cis là đồng phân mà các nhóm thế có khối lượng lớn ở cùng phía của mặt phẳng liên kết pi; trans là đồng phân mà các nhóm thế có khối lượng lớn nằm ở hai phía khác nhau của mặt phẳng liên kết pi. b. Các ví dụ minh họa Ví dụ 1: Chất nào sau đây có đồng phân hình học ?
C
A. But-2-in. B. But-2-en. C. 1,2-đicloetan. D. 2-clopropen. (Đề thi tuyển sinh Cao đẳng năm 2010) Trả lời Chất có đồng phân hình học là But – 2 – en vì phân tử có liên kết đôi C = C và hai nhóm nguyên tử liên kết với mỗi nguyên tử có liên kết đôi khác nhau.
DẠYKÈMQUYNHƠN OFFICIAL Trang 22/26 - Mã đề thi 357 (Đề thi
Đại
–
Cả
thử
học lần 4
THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2011 – 2012) Trả lời
4 trường hợp đều thỏa mãn, ví dụ :
32 3 32 2 3 2 2 3
2 3 23 25 2 2 25 2
1.XlaCHCHCOONa,YlaCHCHO,ElaCHCHCOOCHCH.
C C H3C CH3 H H cis C C H3C H CH3 H trans Ví dụ 2: Chất nào sau đây có đồng phân
? A. CH2=CH–CH=CH2.
CH3–CH=CH–CH=CH2. C. CH3–CH=C(CH3)2
CH2=CH–CH2–CH3
Chất có đồng phân
là
CH3 – CH = CH – CH3
hình học
B.
D.
(Đề thi tuyển sinh Cao đẳng năm 2011) Trả lời
hình học
: CH3–CH=CH–CH=CH2
C C H3C CH H H cis
CH2 C C
H3C H CH H trans CH2
Ví dụ 3: Cho các chất: CH2=CH–CH=CH2; CH3–CH2–CH=C(CH3)2; CH3–CH=CH–CH=CH2; CH3–CH=CH2; CH3–CH=CH–COOH. Số chất có đồng phân hình học là : A. 4. B. 3. C. 2. D. 1. (Đề thi tuyển sinh Cao đẳng năm 2009) Trả lời
Số chất có đồng phân hình học là : 2 CH3–CH=CH–CH=CH2
C C H3C CH H H cis
CH2
C C
H3C H CH H trans CH2 CH3–CH=CH–COOH C C H3C COOH H H cis C C
H3C H COOH H trans
Ví dụ 4: Cho các chất sau: CH2=CH-CH2-CH2-CH=CH2, CH2=CH-CH=CH-CH2-CH3, CH3-C(CH3)=CH-CH3, CH2=CH-CH2-CH=CH2 Số chất có đồng phân hình học là : A. 4. B. 1. C. 2. D. 3. (Đề thi tuyển sinh Đại học khối A năm 2008) Trả lời Số chất có đồng phân hình học là 1 : CH2=CH-CH=CH-CH2-CH3
DẠYKÈMQUYNHƠN
Trang 23/26 - Mã đề thi 357
OFFICIAL
C C CH H H cis H5C2 CH2 C C H5C2 H CH H trans CH2 Ví dụ 5: Hợp chất C5H10 có bao nhiêu đồng phân anken ? A. 4. B. 5. C. 6. D. 7. (Đề thi thử Đại học lần 1 – THPT Lương Đắc Bằng – Thanh Hóa, năm học 2013 – 2014) Trả lời C5H10 có đồng phân anken : 6
H3C H CH2 H trans CH3
CH2 C CH2 CH3
CH3 CH3 C CH CH3 phân của X là: A. 4. B. 3. C. 6. D. 5. (Đề thi thử Đại học lần 1 – THPT chuyên Bắc
CH2 Ví dụ 6: Cho buta-1,3-đien phản ứng cộng với Br2 theo tỉ lệ mol 1:1. Số dẫn xuất đibrom (đồng phân cấu tạo và đồng phân hình học) thu được là : A. 3. B. 1. C. 2. D. 4. (Đề thi tuyển sinh Đại học khối A năm 2011) Trả lời Số dẫn xuất đibrom (đồng phân cấu tạo và đồng phân hình học) thu được là : 3 Cl C C CH3 H
C C CH2Br H H cis BrH2C C C CH2Br H H trans BrH2C CH2Br CHBr CH CH2 Ví dụ 7: Chất hữu cơ X có công thức phân tử C3H5Cl. Số đồng H trans
CH3 CH3 CH CH CH3 Trả lời Phân tử C3H5Cl có độ bất bão hòa nên có cấu tạo mạch hở, có 1 liên kết đôi hoặc k3.25121 2 cấu tạo mạch vòng đơn. X có đồng phân : 5 C C CH3 H H cis
Ninh, năm học 2012 – 2013) Cl C C C Cl
C C C Cl Cl Ví dụ 8: Hợp chất hữu cơ X có công thức phân tử là C3H4ClBr. Số đồng phân mạch hở của X là: A. 8. B. 10. C. 13 D. 12. (Đề thi thử Đại học lần 1 – THPT chuyên Hùng Vương – Phú Thọ, năm học 2013 – 2014) Trả lời
DẠYKÈMQUYNHƠN OFFICIAL Trang 24/26 - Mã đề thi 357
CH2 CH CH2 CH2 CH3 C C H3C CH2 H H cis
CH3 C C
Phân tử C3H4ClBr mạch hở có độ bất bão hòa . Suy ra X có cấu tạo mạch hở, k3.241121 2
phân tử có 1 liên kết đôi. Số đồng phân mạch hở của X là : 13 C C C Br Cl gồm cis và trans
C C C Br Cl gồm cis và trans
C C C Br Cl gồm cis và trans
C C C Br Cl
C C C Br Cl gồm cis và trans C C C Cl Br gồm cis và trans
C C C Cl Br Ví dụ 9: Este X có CTPT C5H8O2 khi tác dụng với NaOH tạo ra 2 sản phẩm đều có khả năng tham gia phản ứng tráng gương. Số chất X thỏa mãn điều kiện trên là: A. 2. B. 1. C. 3. D. 4. (Đề thi thử Đại học lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2010 – 2011) Trả lời
Số chất X thỏa mãn điều kiện đề bài là : 3 C C HCOO CH3 H H cis
C C C Br Cl
CH2 C C HCOO CH3 H
H trans
CH2 HCOOCH C CH3 CH3
Ví dụ 10: Thủy phân este X mạch hở có công thức phân tử C4H6O2, sản phẩm thu được có khả năng tráng bạc. Số este X thỏa mãn tính chất trên là A. 4. B. 3. C. 6. D. 5. (Đề thi tuyển
DẠYKÈMQUYNHƠN OFFICIAL Trang 25/26 - Mã đề thi 357
Trả
Số este thỏa mãn tính chất là : 5 C C HCOO CH3 H H cis C C HCOO CH3 H H trans HCOOCH2CH CH2 HCOOC CH2 CH3 COOCH CH2 CH3 Ví dụ 11: Đun
sinh Đại học khối B năm 2012)
lời
nóng hỗn hợp gồm etanol và butan-2-ol với H2SO4 đặc thì thu được tối đa bao nhiêu sản phẩm hữu cơ? (Không kể sản phẩm của phản ứng giữa ancol với axit)
A. 7. B. 6. C. 5. D. 8. (Đề thi thử Đại học lần 1 – THPT Quất Lâm – Nam Định, năm học 2013 – 2014) Trả lời
Đun nóng ancol trong H2SO4 đặc thì có thể xảy ra các loại phản ứng : Phản ứng tách nước nội phân tử để tạo ra anken và tách nước liên phân tử để tạo ra ete.
Từ hỗn hợp gồm n ancol khác nhau sẽ tạo ra ete khác nhau. Với n = 2 thì số ete tạo ra là 3. n(n1) 2
Từ etanol tách nước nội phân tử sẽ tạo ra etilen; từ butan – 2 – ol tách nước nội phân tử sẽ tạo ra 3 anken là but – 1 – en, cis – but – 2 – en và trans – but – 2 – en.
Vậy số sản phẩm hữu cơ tối đa thu được là . 7
DẠYKÈMQUYNHƠN
Trang 26/26 - Mã đề thi 357
OFFICIAL
25 25CHOCH 25 32CHOCH(CH) 32 32(CH)CHOCH(CH) 2 2CHCH 2 23CHCHCHCH C C H3C CH3 H H cis C C H3C H CH3 H trans
CHUYÊN ĐỀ 14 : SỬ DỤNG DUNG DỊCH ẢO ĐỂ GIẢI NHANH BÀI TẬP HÓA VÔ CƠ
1. Cơ sở của phương pháp
Coi dung dịch chứa ion là dung dịch chứa 2 ion . Ta có thể làm tương tự với các ion 3HCO 2 3H,CO . 2 2 3 424 HSO,HPO,HPO
2. Ví dụ minh họa
Ví dụ
1: Cho 100 ml dung dịch NaOH 4M tác dụng với 100 ml dung dịch H3PO4 aM, thu được dung dịch chứa 25,95 gam hỗn hợp hai muối. Giá trị của a là: A. 1,5. B. 1,75. C. 1,25. D. 1. (Đề thi thử Đại học lần 1 – THPT chuyên Hùng Vương – Phú Thọ, năm học 2010 – 2011)
Hướng dẫn giải
● Cách 1 : Sử dụng phương pháp bảo toàn khối lượng Vì phản ứng tạo ra hai muối nên NaOH đã phản ứng hết. Sơ đồ phản ứng :
H3PO4 + NaOH muối + HOH (H2O) Bản chất phản ứng là : H+ + HOH OH Nhận thấy : HOHONaOH H nnn0,4mol Từ đó sẽ tính được khối lượng của H2O. Mặt khác, khối lượng của hỗn hợp muối đã biết và dễ dàng tính được khối lượng của NaOH (vì đã biết số mol). Theo bảo toàn khối lượng, ta có :
DẠYKÈMQUYNHƠN
Trang 1/4 - Mã đề thi 357
OFFICIAL
HPONaOHmuoiHOHPO 34 2 34 0,44025,950,418 ? mmmmm17,15gam HPO 34 34 17,15 0,175 n 0,175mol[HPO] 1,75M 98 0,1 ● Cách 2 : Sử dụng dung dịch ảo Coi dung dịch sau phản ứng chứa các ion . 3 4 PO,Na,H Ta có : 3 34 4 34 OH Hbanñau HPO NaOH PO Na HPONaOHH/ddsauphanöng n n nn0,1amol;nn0,4mol; n 3nn(0,3a0,4)mol. Theo giả thiết và bảo toàn khối lượng, ta có : P3 O Na H 4 muoi m m m m0,1a.950,4.230,3a0,425,95a1,75 Ví dụ 2: Cho m gam P2O5 tác dụng với 253,5 ml dung dịch NaOH 2M, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X. Cô cạn dung dịch X, thu được 3m gam chất rắn khan. Giá trị của m là A. 21,30. B. 8,52. C. 12,78. D. 7,81. (Đề thi tuyển sinh Đại học khối B năm 2014) Hướng dẫn giải ● Cách 1 : Sử dụng bảo toàn nguyên tố và bảo toàn khối lượng Bản chất phản ứng của P2O5 với dung dịch NaOH là phản ứng của H3PO4 với dung dịch NaOH.
Nếu H3PO4 còn dư sau phản ứng thì không thể cô cạn dung dịch, do H3PO4 không bay hơi. Như vậy H3PO4 đã phản ứng hết. Chất rắn là muối hoặc hỗn hợp gồm muối trung hòa và NaOH dư.
* Trường hợp 1 : Ion chuyển hết vào H2O H
Theo bảo toàn nguyên tố P và bảo toàn nguyên tố H trong phản ứng của H3PO4 với NaOH, ta có: 34 25 34 HPO PO HOHHPO 2m 6m n2n ;n3n 142 142
Theo bảo toàn khối lượng, ta có :
* Trường hợp 2 : Ion chuyển hết vào H2O OH
Theo bảo toàn nguyên tố P và bảo toàn nhóm OH trong phản ứng của H3PO4 với NaOH, ta có: 34 25 HPO PO HOHNaOH 2m n2n ;nn0,507 142
DẠYKÈMQUYNHƠN
Trang 2/4 - Mã đề thi 357
OFFICIAL
34 2 HPONaOHchatranHO 0,50740 6m18 3m 2m98 142 142 mmmmm8,52gam
34 2 HPONaOHchatranHO
2m98 142
Với
OH ● Cách 2 : Sử dụng dung dịch ảo * Trường hợp 1 : Nếu ion hết thì coi dung dịch sau phản ứng chứa các ion . OH 3 4Na,H,PO 3 25 4 3 4 PO NaOH PO Na HbñPO OH H/ddsauphanöng
Theo giả thiết và bảo toàn
ta có : Na P3 O H 4 muoi m m m 2m 6m m950,507230,5073mm6,88gam 142 142 Với H OH m6,88n0,29n0,507:khongthoaman * Trường hợp 2 : Nếu ion dư thì coi dung dịch sau phản ứng chứa các ion . Ta có : OH 3 4Na,OH,PO OH/ddsauphanöng 6m n (0,507)mol. 142 Theo giả thiết và bảo toàn khối lượng, ta có : Na P3 O OH 4 chatran m m m 2m 6m m95.0,507.2317.(0,507)3mm8,52gam 142 142 Ví dụ 3: Dung dịch X chứa các ion: , , , 0,1 mol , 0,3 mol và 1 mol K+ . 2 3CO 2 3SO 2 4SO 3HCO 3HSO Thêm V lít dung dịch Ba(OH)2 1M vào X thì thu được lượng kết tủa lớn nhất. Giá trị nhỏ nhất của V là : A. 0,15. B. 0,25. C. 0,20. D. 0,30. Hướng dẫn giải Chuyển dung dịch X thành dung dịch ảo X’ gồm các ion , , , 0,4 mol , và 0,1 mol 2 3CO2 3SO2 4 SOH K+ Cho Ba(OH)2 vào X’ tạo ra kết tủa là BaCO3, BaSO3, BaSO4. Như vậy các ion H+, K+ được thay thế bằng ion Ba2+ .
Theo bảo toàn khối lượng, ta có :
0,50740 0507183m
mmmmm6,88gam
m = 6,88 gam thì tức là dư: Không thỏa mãn. OHH nn
2m n2n mol;nn0,507mol. 142 6m 6m n3n mol;n0,507mol;n (0,507)mol. 142 142
khối lượng,
ddBa(OH)1M(min) 2V 0,25lít
Ví dụ 4: Một loại nước cứng có chứa Ca2+ 0,002M; Mg2+ 0,003M và . Hãy cho biết cần lấy bao nhiêu 3HCO ml dung dịch Ca(OH)2 0,05M để biến 1 lít nước cứng đó thành nước mềm (coi như các phản ứng xảy ra hoàn toàn và kết tủa thu được gồm CaCO3 và Mg(OH)2). A. 200 ml. B. 140 ml. C. 100 ml. D. 160 ml. Hướng dẫn giải Sử dụng bảo toàn điện tích trong dung dịch nước
dụ
Dung dịch E gồm x mol Ca2+, y mol Ba2+, z mol . Cho từ từ dung dịch Ca(OH)2 nồng độ a 3HCO mol/l vào dung dịch E đến khi thu được lượng kết tủa lớn nhất thì vừa hết V lít dung dịch Ca(OH)2. Biểu thức liên hệ giữa các giá trị V, a, x, y là A. B. C. D. xy a V x2y
DẠYKÈMQUYNHƠN OFFICIAL Trang 3/4 - Mã đề thi 357
cứng, ta có : 22 HCOCaMg 3 0,00210,0031 n2n2n0,01mol. Chuyển dung dịch nước cứng thành dung dịch ảo X chứa 0,002 mol Ca2+, 0,003 mol Mg2+, 0,01 mol H+ và
mol . 2 3CO Sơ đồ phản ứng của X với dung dịch Ca(OH)2 : 22 Ca(OH) 2 2 2 2 3 3 Mg(OH) Ca,Mg HO CaCO
a V V2a(xy) Va(2xy) (Đề thi tuyển sinh Cao đẳng năm
Hướng dẫn giải Chuyển E thành dung dịch ảo E’ gồm : x mol Ca2+, y mol Ba2+, z mol và z mol . Áp dụng bảo H+ 2 3CO toàn điện tích cho dung dịch E’, ta có : 22 2BaCaHCO3 zyx z 2n2nn2nz2x2y Sơ đồ phản ứng : 22 2 ymolxmol aVmol 3 2 2 3 3 (2x2y)mol 2aVmol(2x2y)mol Ba,CaCa BaCO HO H,COOCaCO H Áp dụng bảo toàn điện tích trong phản ứng của Ba2+, Ca2+ với ion , ta có: 2 3CO B222 aCaCO3 yxaV2x2y xynnnV a Hoặc áp dụng bảo toàn điện tích trong phản ứng của ion H+ với ion , ta có: OH-
Áp dụng bảo toàn điện tích, ta có :
2 2 Ba(OH)2 BaHKBa 0,40,1 2nnnn0,25moln0,25mol
0,01
H,CO
Khi cho V lít dung dịch Ca(OH)2 0,05M vào X, xảy ra phản ứng của ion Ca2+ (trong X và trong Ca(OH)2), với ion tạo kết tủa. Ta có : 2 3CO C22 aCO3 nn0,0020,05V0,01V0,16lít160ml
Ví
5:
2012)
nn2x2y2aVV a ++ =Þ+=Þ=
HOH xy
Ví dụ 6: Dung dịch X chứa a mol Na+; b mol ; c mol và d mol . Để tạo kết tủa lớn nhất 3HCO 2 3CO 2 4SO
người ta phải dùng 100 ml dung dịch Ba(OH)2 x mol/l. Biểu thức tính x theo a và b là : A. . B. . C. . D. . ab x 0,1 ab x 0,2 ab x 0,3 ab x 2 (Đề thi thử Đại học lần 1 – THPT chuyên Hùng Vương – Phú Thọ, năm học 2012 – 2013)
Hướng dẫn giải
Chuyển ion thành 2 ion ảo là và H+ . 3HCO 2 3CO Chuyển dung dịch X thành dung dịch ảo X’ gồm : a mol Na+; b mol H+, (b+c) mol và d mol . 2 3CO 2 4SO Cho Ba(OH)2 vào dung dịch X’ sẽ tạo ra kết tủa là BaSO4 và BaCO3. Như vậy, các ion Na+ và H+ đã được thay thế bằng ion Ba2+ Áp dụng bảo toàn điện tích, ta có :
dụ
Dung dịch X chứa a mol Na+; b mol ; c mol và d mol . Để tạo kết tủa lớn nhất 3HCO 2 3CO 3HSO người ta phải dùng vừa hết 100 ml dung dịch Ca(OH)2 x mol/l. Biểu thức tính x theo a và b là: A. . B. . C. . D. . ab x 0,1
abc x 0,2
ab x 0,3
abd x 0,2
Hướng dẫn giải Chuyển dung dịch X thành dung dịch ảo X’ gồm các ion , , (b + d) mol , và a mol Na+ 2 3CO2 3SO H Cho Ca(OH)2 vào X’ tạo ra kết tủa là CaCO3, CaSO3. Như vậy các ion H+, Na+ được thay thế bằng ion Ca2+ Áp dụng bảo toàn điện tích, ta có :
DẠYKÈMQUYNHƠN
Trang 4/4 - Mã đề thi 357
OFFICIAL
2 2 Ca(OH)2 CaHNaCa ?bda abd abd 2nnnn moln=mol 2 2 2 abd[Ca(OH)]0,2
2 2 Ba(OH)2 BaNaHBa ab abab2nnnnmolnmolx 2 20,2
Ví
7:
CHUYÊN ĐỀ 08: TÌM QUY LUẬT CHUNG CỦA CÁC CHẤT HỮU CƠ TRONG HỖN HỢP
I. QUY LUẬT CHUNG VỀ THÀNH PHẦN NGUYÊN TỐ VÀ CẤU TẠO
1. Các chất trong hỗn hợp có cùng công thức phân tử Ví dụ 1: Cho 28,8 gam hỗn hợp X gồm propinal, glucozơ, fructozơ tác dụng với lượng dư dung dịch AgNO3 trong NH3 thì thu được 103,6 gam chất rắn. Phần trăm khối lượng của propinal trong X là A. 42,5%. B. 85,6%. C. 37,5%. D. 40,0%. (Đề thi thử ĐH lần 2 – THPT Chuyên – Đại học Vinh, năm học 2012 – 2013) Hướng dẫn giải Hỗn hợp X gồm propinal (), glucozơ (CH2OH(CHOH)4CHO) và fructozơ CHCCHO (CH2OH(CHOH)3COCH2OH). Trong một trường kiềm (NaOH, KOH, NH3,...) thì . OH fructozô glucozô Quy luật chung: Glucozơ và fructozơ đều có công thức phân
Ví dụ 2*: Hỗn hợp X gồm axit oxalic, axetilen, propanđial và vinyl fomat (trong đó số mol của axit oxalic và axetilen bằng nhau). Đốt cháy hoàn toàn m gam hỗn hợp X cần dùng vừa đủ 1,125 mol O2, thu được H2O và 55 gam CO2 Nếu cho m gam hỗn hợp X tác dụng với dung dịch NaHCO3 dư thì thu được tối đa bao nhiêu lít CO2 (ở đktc) ? A. 2,8 lít. B. 8,6 lít. C. 5,6 lít. D. 11,2 lít. (Đề thi thử Đại học lần 2 – THPT Chuyên – Đại học Vinh, năm học 2012 – 2013) Hướng dẫn giải Các chất trong X gồm : HOOC–COOH, ,
DẠYKÈMQUYNHƠN
Trang 1/8 - Mã đề thi 357
OFFICIAL
là
12
và khi
tráng
thì . AgCHO
n2n Sơ đồ phản ứng: 4 o xmol AgNO/NH,t xmol 33 6126 ymol 2(xy)mol
CAgCCOONH CHCCHO CHO Ag Ta có: 54x180y28,8 54x180y28,8x0,2 2(xy)108194x103,6410x216y103,6y0,1
OHC–CH2–CHO và HCOOCH = CH2. CHCH Quy luật chung: propanđial, vinyl fomat có cùng công thức phân tử là C3H4O2 Đặt HOOCCOOHCHCH (OHCCHCHO,HCOOCHCH) 2 2 n nxmol;n ymol. Theo bảo toàn nguyên tố C, H, O, ta có : HtrongXHO HOHO 2 2 2 n 2n2x2x4y2nn(2x2y)mol OtrongXOCOHO 2 22 4x2y1,1251,252x2y n 2n2nnx0,125 Khi cho X phản ứng với NaOH, chỉ có HOOC–COOH phản ứng: 3 2 2 HOOCCOOH2NaHCONaOOCCOONa2CO2HO mol:0,125 0,25 Suy ra : CO(ñktc) 2 V 0,2522,45,6lít 2. Các chất trong hỗn hợp cócùngcông thức tổng quát
tử
C6H
O6
tham gia phản ứng
gương
6126
28,8gam 103,6gam
Suy ra : CHCCHO 0,2.54 %m .100%37,5% 28,8
Ví dụ 3: Đốt cháy hoàn toàn 80,08 gam hỗn hợp X gồm C3H7OH, C2H5OH và CH3OC3H7 thu được 95,76 gam H2O và V lít khí CO2 (đktc). Giá trị của V là? A. 129,6 lít. B. 87,808 lít. C. 119,168 lít. D. 112 lít. (Đề thi thử Đại học lần 4 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2010 – 2011)
Hướng dẫn giải Quy luật chung: Các chất trong X đều có công thức phân tử tổng quát là CnH2n+2O (k = 0). Suy ra : Khi đốt cháy X cho . CHOHOCO n2n22 2
cháy hoàn toàn 4,02 gam hỗn hợp gồm axit acrylic, vinyl axetat và metyl metacrylat rồi cho toàn bộ sản phẩm cháy vào bình 1 đựng dung dịch H2SO4 đặc, bình 2 đựng dung dịch Ba(OH)2 dư thấy khối lượng bình 1 tăng m gam, bình 2 xuất hiện 35,46 gam kết tủa. Giá trị của m là A. 2,70. B. 2,34. C. 3,24. D. 3,65. (Đề thi chọn HSG tỉnh Thái Bình, năm học 2012 – 2013) Hướng dẫn giải Axit acrylic, vinyl axetat và metyl metacrylat có công thức cấu tạo lần lượt là CH2=CHCOOH, CH3COOCH=CH2, CH2=C(CH3)COOCH3.
Quy luật chung: Các chất trên đều có công thức phân tử tổng quát là CnH2n-2O2 (k = 2). Theo giả thiết ta thấy : Kết tủa ở bình 2 là BaCO3, khối lượng bình 1 tăng là khối lượng của H2O. Gọi tổng số mol của các chất là x mol. Theo giả thiết và bảo toàn nguyên tố C, ta có :
lít khí CO2 (đktc). Giá trị của m là : A. 44 gam. B. 22 gam. C. 35,2 gam. D. 66 gam. (Đề thi thử Đại học lần 1 – THPT chuyên Hùng Vương – Phú Thọ, năm học 2010 – 2011) Hướng dẫn giải Quy luật chung: OtrongXOtrongnhomCOOHCOOHn n 2n Bản chất phản ứng của X với NaHCO3 :
DẠYKÈMQUYNHƠN
Trang 2/8 - Mã đề thi 357
OFFICIAL
Theo
HO
Theo
lượng và
OtrongXCHOHOCO
2 OtrongX CHCHO
n2nHO
22 n n nn 16n 12nnm OtrongXCO OtrongX 2 CO OtrongXCO 2 2 n n5,32 n 1,4
16n
CO(ñktc) 2 V
Ví
n nn
giả thiết :
2 95,76 n 5,32mol 18
bảo toàn khối
bảo toàn nguyên tố C, H, O, ta có :
n2n22
n2n2
CO 80,08
n3,92
12n69,44
3,9222,487,708lít
dụ 4: Đốt
CtrongCHOCOBaCO n2n22 2 3 CHOn2n22 n nn0,18nx0,18 nx0,18 (14n30)x4,02x0,05 m 4,02 Sử dụng công thức suy ra : hôpchathöucôCOHO 22 (k1).n nn HOCOCHO HO 2 2n2n22 2 0,18 0,05 nnn 0,13molm0,13182,34gam 3. Các chất có những đặc điểm cấu tạo giống nhau Ví dụ 5: Đốt cháy hoàn toàn 29,6 gam hỗn hợp các axit gồm CH3COOH, CxHyCOOH, (COOH)2, thu được 14,4 gam nước và m gam CO2 Mặt khác, cho 29,6 gam hỗn hợp các axit đó tác dụng với NaHCO3 dư thì thu được
11,2
Trong phản ứng đốt cháy Y, ta có: (CH,CHOH)HOCO 2625 2 2 n nn0,20,150,05mol(1).
Trong phản ứng của X với H2, ta có : Hphanöng(CH,CHCHO)(CH,CHOH) 2 243 2625 n n n (2) Từ (1) và (2), suy ra : Hphanöng(CH,CHOH) H(ñktc) 2 2625 2 n n 0,05molV 0,0522,41,12lít
Ví dụ 7: Hỗn hợp X gồm hiđro, propen, axit acrylic, ancol anlylic (C3H5OH). Đốt cháy hoàn toàn 0,75 mol X, thu được 30,24 lít khí CO2 (đktc). Đun nóng X với bột Ni một thời gian, thu được hỗn hợp Y. Tỉ khối hơi của Y so với X bằng 1,25. Cho 0,1 mol Y phản ứng vừa đủ với V lít dung dịch Br2 0,1M. Giá trị của V là A. 0,6. B. 0,5. C. 0,3. D. 0,4. (Đề thi tuyển sinh Đại học khối B năm 2013) Hướng dẫn giải Quy luật
DẠYKÈMQUYNHƠN OFFICIAL Trang 3/8 - Mã đề thi 357
Sơ đồ phản
2 33 22 o o 0,15molO,t Ni,t 2 3 32 2 3 3 0,2mol X Y CO CHCH(k0) CHCH CHCHO
HO
3 2 2 COOHNaHCOCOONa+COHO(1) mol:0,5 0,5 Theo (1) và bảo toàn O trong hỗn hợp X, ta có : COOHCO2 nn0,5mol OtrongXOtrongnhomCOOHCOOHn n 2n1mol
Áp dụng bảo toàn nguyên tố H trong phản ứng đốt cháy hỗn hợp X, ta có : HtrongXHO 2 14,4 n 2n2.1,6mol 18 COCtrongX 2 29,6161,6 nn 1mol 12 CO2 m44gam Ví dụ 6: Hỗn hợp khí và hơi X gồm C2H4, CH3CHO, CH3COOH. Trộn X với V lít H2 (đktc) rồi cho qua Ni nung nóng, thu được hỗn hợp Y (gồm khí và hơi). Đốt cháy hoàn toàn Y thu được 0,15 mol CO2 và 0,2 mol H2O. Giá trị của V là A. 4,48. B. 2,24. C. 0,672. D. 1,12. (Thi thử Đại học lần 1 – THPT Chuyên – Đại học Vinh, năm học 2011 – 2012) Hướng dẫn giải
ứng:
CHCHOH(k0)
CHCOOH CHCOOH(k1)
Quy luật chung: C2H4 và CH3CHO đều có 1 liên kết có khả năng phản ứng với H2.
chung: Các chất propen (CH2=CH–CH3), axit acrylic (CH2=CH–COOH), ancol anlylic (CH2=CH–CH2OH) đều có 3 nguyên tử C và có 1 liên kết tham gia phản ứng với H2 và dung dịch Br2. Đặt công thức của 3 chất propen, axit acrylic, ancol anlylic là C3HyOz. Trong 0,75 mol X, ta có : CO2 CHO3yz CHO3yz H2 n n 0,45mol 0,45 %n .100%60%. 3 0,75 n0,750,450,3mol Theo bảo toàn khối lượng, ta có:
II.QUY LUẬT CHUNG VỀ TÍNH CHẤT HÓA HỌC
1.Quy luật thứ nhất: Trong phản ứng của n – peptit (đipeptit, tripeptit, tetrapeptit,...) mạch hở, tạo bởi các - amino axit có chứa 1 nhóm – COOH và 1 nhóm – NH2 với dung dịch HCl, ta thấy : Phân tử n – peptit có (n – 1) liên kết peptit và có n gốc - amino axit. Khi phản ứng với dung dịch HCl sẽ xảy ra hai phản ứng: (1) Thủy phân (n – 1) liên kết peptit, phản ứng này cần (n – 1) phân tử H2O và tạo ra n phân tử amino axit; (2) Phản ứng của n phân tử amino axit với HCl tạo ra muối, phản ứng này cần n phân tử HCl (vì mỗi amino axit có 1 nhóm – NH2). Tổng hợp các phản ứng (1) và (2), ta có : 2(1) npeptitnHOnHClmuoi
Ví dụ 1: Lấy 8,76 gam một đipeptit tạo ra từ glyxin và alanin cho tác dụng vừa đủ với dung dịch HCl 1M. Thể tích dung dịch HCl tham gia phản ứng là: A. 0,12 lít. B. 0,24 lít. C. 0,06 lít. D. 0,1 lít. (Đề thi thử Đại học lần 4 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2010 – 2011) Hướng dẫn giải Đipeptit tạo bởi glyxin (H2NCH2COOH) và alanin (H2NCH(CH3)COOH) có thể là Gly – Ala hoặc Ala –Gly. Chúng đều có khối lượng phân tử M = 75 + 89 – 18 =146. Quy luật phản ứng : đipeptit + H2O + 2HCl muối (1) Suy ra : HClñipeptit ddHCl1M 8,76 n2n20,12molV 0,12lít 146
Ví dụ 2: Thủy phân hoàn toàn 60 gam hỗn hợp hai đipetit thu được 63,6 gam hỗn hợp X gồm các amino axit (các amino axit chỉ có một nhóm amino và một nhóm cacboxyl trong phân tử). Nếu cho hỗn hợp X tác 1 10 dụng với dung dịch HCl (dư), cô cạn cẩn thận dung dịch, thì lượng muối khan thu được là : A. 7,09 gam. B. 16,30 gam C. 8,15 gam D. 7,82 gam. (Đề thi tuyển sinh Đại học khối A năm 2011) Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL Trang 4/8 - Mã đề thi 357
Với
Vì C3HyOz có
n n n
XY X Y XYX Y YX nM mmnMnM 1,25 nM
Y X n0,1moln0,11,250,125mol
CHO3yz Hphanöng 2 nnXY n0,125.60%0,075 n 0,1250,10,025
1 liên kết phản ứng nên:
CHOHphanöngBrphanöng 3xy2 2 0,025 ? 0,075
Brphanöng ddBr0,1M 2 2 0,05 n 0,05molV 0,5lít 0,1
Quy luật phản ứng : đipeptit + H2O
Theo bảo toàn khối lượng trong phản ứng thủy phân peptit
ñipeptitHOaminoaxitHO HO 2 2 2 60 63,6 ? 3,6 mmm m3,6gamn 0,2mol 18 HClHO 2 n2n20,20,4mol
+ 2HCl muối (1)
và (1), ta có :
2.Quy luật thứ hai: Trong phản ứng của n-peptit (đipeptit, tripeptit, tetrapeptit,...) mạch hở, tạo bởi các - amino axit có chứa 1 nhóm – COOH và 1 nhóm – NH2 với dung dịch NaOH, ta thấy : Phân tử n – peptit có (n – 1) liên kết peptit và có n gốc - amino axit. Khi phản ứng với dung dịch NaOH sẽ xảy ra hai phản ứng : (1) Thủy phân (n – 1) liên kết peptit, phản ứng này cần (n – 1) phân tử H2O và tạo ra n phân tử amino axit; (2) Phản ứng của n phân tử amino axit với NaOH tạo thành muối và H2O, phản ứng này cần n phân tử NaOH (vì mỗi amino axit có 1 nhóm – COOH) và giải phóng ra n phân tử H2O. Tổng hợp các phản ứng (1) và (2), ta có :
Ví dụ 3: Thủy phân hoàn toàn 4,34 gam tripeptit mạch hở X (được tạo nên từ hai -amino axit có công thức a dạng ) bằng dung dịch NaOH dư, thu được 6,38 gam muối. Mặt khác, thủy phân hoàn 2xy HNCHCOOH toàn 4,34 gam X bằng dung dịch HCl dư, thu được m gam muối. Giá trị của m là A. 6,53. B. 8,25. C. 5,06. D. 7,25. (Đề thi tuyển sinh Đại học khối A năm 2014) Hướng dẫn giải Sử dụng các quy luật chung trong phản ứng của peptit với dung dịch NaOH; dung dịch HCl và áp dụng bảo toàn khối lượng, ta có :
DẠYKÈMQUYNHƠN OFFICIAL Trang 5/8 - Mã đề thi 357
muoi m m
1 m
0
Theo bảo toàn khối lượng trong phản ứng của hỗn hợp các amino axit với HCl, ta có :
aminoaxitHCl
1(63,60,436,5)7,82gam
2
npeptitnNaOHmuoiHO
2 3x x XNaOHmuoiHO 2 4,34403x6,3818x 2 0,06 0,02 0,04 muoiXHOHCl 2 4,34 0,0636,50,0418 tripeptitX3NaOHmuoiHO x0,02 mmmm tripeptitX2HO3HClmuoi mmmm7,25g ì ï + ®+ ï ï ï ï Þ= í ï+ =+ ï ï ï ï î ++® =++= am ì ï ï ï ï ï ï í ï ï ï ï ï ï î Ví dụ 4: Tripeptit X có công thức sau C8H15O4N3 Thủy phân hoàn toàn 0,1 mol X trong 400 ml dung dịch NaOH 1M. Khối lượng chất rắn thu được khi cô cạn dung dịch sau phản ứng là A. 31,9 gam. B. 35,9 gam. C. 28,6 gam D. 22,2 gam. (Đề thi thử ĐH lần 1 – THPT Quỳnh Lưu 1 – Nghệ An, năm học 2012 – 2013) Hướng dẫn giải Quy luật phản ứng : 2 Tripeptit3NaOHmuoiHO(1) mol:0,10,3 0,1 Từ (1) và giả thiết ta thấy NaOH có dư. Áp dụng bảo toàn khối lượng, ta có : peptitNaOHmuoiHO 2 muoi m m m peptitNaOHHO 2 mmmm m0,12170,4400,11835,9gam Ví dụ 5: Đun nóng m gam hỗn hợp gồm a mol tetrapeptit mạch hở X và 2a mol tripeptit mạch hở Y với 600 ml dung dịch NaOH 1M (vừa đủ). Sau khi các phản ứng kết thúc, cô cạn dung dịch thu được 72,48 gam muối khan của các amino axit đều có một nhóm –COOH và một nhóm –NH2 trong phân tử. Giá trị của m là A. 51,72. B. 54,30. C. 66,00. D. 44,48. (Đề thi tuyển sinh Đại học khối B năm 2012)
Hướng dẫn giải Quy luật phản ứng : 2 Tripeptit3NaOHmuoiHO(1) mol:2a 6a 2a 2 Tetrapeptit4NaOHmuoiHO(2) mol:a 4a a
Theo (1), (2) và giả thiết, ta có : NaOH HO 2 n10a0,6a0,06moln3a0,18mol. Áp dụng bảo toàn khối lượng cho phản ứng (1) và (2), ta có :
Ví dụ 6: Cho hỗn hợp 2 amino axit no chứa 1 chức –COOH và 1 chức –NH2 tác dụng với 110 ml dung dịch HCl 2M được dung dịch X. Để tác dụng hết với các chất trong X, cần dùng 140 ml dung dịch KOH 3M. Tổng số mol 2 aminoaxit là : A. 0,1. B. 0,2. C. 0,3. D. 0.4. Hướng dẫn giải Quy luật phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL Trang 6/8 - Mã đề thi 357
3.Quyluậtthứ ba:Phản ứngcủaaminoaxitvớidungdịchaxit,dungdịchbazơ a. Quy luật phản ứng của dạng bài tập
Theo (1), (2) ta thấy : COOHOH H nnn KOH HClHHRCOOH HHRCOOH 2 2 0,42 0,22 ? nn nn
Ví
7:
mol hỗn hợp axit glutamic
đủ 800 ml
m gam rắn khan. Giá trị của m là : A. 61,9 gam. B. 55,2 gam. C. 31,8 gam. D. 28,8 gam. (Đề thi thử ĐH lần 3 – THPT Quỳnh Lưu 1 – Nghệ An, năm học 2010 – 2011) Hướng dẫn giải Quy luật phản ứng : 2 2 HOHHO (1) mol:0,40,40,4 COOHOHCOOHO(2) mol:0,4(0,80,4)0,4 0,4 Theo (1), (2) và giả thiết suy ra số mol nhóm –COOH là 0,4 mol. Gọi số mol của H2NC3H5(COOH)2 và H2NCH2COOH là x và y, ta có :
(X,Y)NaOHmuoiHO 2 (X,Y) m m m muoiHONaOH 2 mmmm m72,480,18.180,6.4051,72gam
“Cho amino axit phản ứng với dung dịch axit (HCl, H2SO4,...), thu được dung dịch X. Cho dung dịch X phản ứng hết với dung dịch bazơ (NaOH, KOH,...) là : 2 2 OO OO HOHHO CHOHCHO
2 2 HOHHO (1) COOHOHCOOHO(2)
0,2mol
dụ
Cho 0,3
và glyxin vào dung dịch 400 ml HCl 1M, thu được dung dịch Y. Y tác dụng vừa
dung dịch NaOH 1M, thu được dung dịch Z. Làm bay hơi Z thu được
DẠYKÈMQUYNHƠN OFFICIAL Trang 7/8 - Mã đề thi 357 aminoaxit COOH n xy0,3x0,1 y0,2n2xy0,4 Theo bảo toàn khối
ta
: aminoaxitHClNaOHchatranHO 2 chatran m m m m aminoaxit
m mmmm m1470,1750,20,436,50,8400,81861,9gam Ví dụ 8:
x
2 2 HOHHO COOHOHCOOHO Theo
(KOH,NaOH) COOHOHH NaOH 0,20,2 KOH NaOHKOH n nnn0,4 n0,1 n0,3 n:n1:3
-
- -
2 2 2 2 13,1 m 13,1M 131 0,1 HNR(COOH) NtrongX 2 2 14 M 133%m 100%10,526% 133 b. Quy luật phản ứng của dạng bài tập“Cho amino axit phản ứng với
2 2 3 OHHHO NHHNH
9: Hỗn hợp X gồm H2NCH2CH2COOH và CH3CH(NH2)COOH. Cho 13,35 gam X tác dụng với V ml dung dịch NaOH 1M, thu được dung dịch Y. Để trung hoà hết Y cần vừa đủ 250 ml dung dịch HCl 1M. Giá trị của V là : A. 100. B. 150. C. 200. D. 250. Hướng dẫn giải Hỗn hợp X chứa hai chất là đồng phân của nhau. NHhonhôpaminoaxit HCl 2 H 13,35 nn 0,15mol,nn0,25.10,25mol. 89 Quy luật phản ứng : 2 2 3 OHH HO(1) NHHNH (2) Theo (1), (2) và giả thiết, ta có : NH NaOH NH 2 2 OH H OHH 0,250,15 nnnnnnn0,1mol
lượng,
có
HClNaOHHO 2
Amino axit X có công thức H2NC
Hy(COOH)2. Cho 0,1 mol X vào 0,2 lít dung dịch H2SO4 0,5M, thu được dung dịch Y. Cho Y phản ứng vừa đủ với dung dịch gồm NaOH 1M và KOH 3M, thu được dung dịch chứa 36,7 gam muối. Phần trăm khối lượng của nitơ trong X là A. 9,524%. B. 10,687%. C. 10,526%. D. 11,966%. (Đề thi tuyển sinh Đại học khối B năm 2013) Hướng dẫn giải Quy luật phản ứng :
giả thiết:
Theo bảo toàn khối lượng, ta có :
2HNR(COO)KNaSO 2 2 4 0,3390,123 ? 0,196 m mmm36,7
HNR(COO) HNR(COO)
dung dịch bazơ (NaOH, KOH,...) thu được dung dịch X. Cho dung dịch X phản ứng hết với dung dịch axit (HCl, H2SO4,...” là :
Ví dụ
Ví dụ 10: Cho hỗn hợp X gồm 0,15 mol H2NC3H5(COOH)2 (axit glutamic) và 0,1 mol H2N(CH2)4CH(NH2)COOH (lysin) vào 250 ml dung dịch NaOH 2M, thu được dung dịch Y. Cho HCl dư vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, số mol HCl đã phản ứng là : A. 0,75. B. 0,65. C. 0,70. D. 0,85. Hướng dẫn giải Theo giả thiết, suy ra :
DẠYKÈMQUYNHƠN OFFICIAL Trang 8/8 - Mã đề thi 357
2 2 3
ddNaOH1MV 0,1lít
NHlysinaxitglutamic NaOH 2 OH 0,1 0,15 n2nn 0,35mol,nn2.0,250,5mol.
Quy luật phản ứng :
OHH HO(1) NHHNH (2)
Theo (1), (2) và giả thiết, ta có: HCl NH2HOH nnnn0,50,350,85mol
DẠYKÈMQUYNHƠN OFFICIAL Trang 1/14 - Mã đề thi 357
2
3
●
●
●
: ot
3 2 2 2NHClCa(OH) 2NH2HOCaCl ● Điều chế CO2 : ot 23ran24 24 2 2 3 NaCOHSONaSOCOHO (CaCO)(HCl) ● Điều chế CH4 : o o 43(ran) 3 4 43(ran) 3 4 CaOt 3 (ran) (ran) 4 23 CaOt 2 2(ran) (ran) 4 23 AlC12HOH4Al(OH)3CH hoacAlC12HCl4AlCl3CH CHCOONaNaOH CHNaCO CH(COONa)2NaOH CH2NaCO ● Điều chế C2H4 : 24 HSOñac 25(dd) 24 2 CHOH CHHO
CHUYÊN ĐỀ : PHƯƠNG PHÁP TRẢ LỜI NHANH CÂU HỎI VỀ THÍ NGHIỆM HÓA HỌC Câu hỏi về thí nghiệm hóa học thường có một số dạng sau : I. Điều chế và thu khí trong phòng thí nghiệm 1. Những vấn đề lý thuyết cần lưu ý : a. Điều chế khí : ● Điều chế Cl2 : ot 2 ñac 2 2 2
4 ñac 2 2 2
MnO4HClClMnCl2HO (PbO) 2KMnO16HCl2KCl2MnCl5Cl8HO (KClO)
● Điều chế khí HCl, HF : ot (ran)24(ñac) 4 2(ran) NaClHSO NaHSOHCl (CaF) (HF) ● Điều chế O2 : o o 2 o 2 t 4(ran) 24 22 MnO,t 3(ran) 2 MnO(ran),t 22(dungdòch) 2 2 2KMnO KMnOMnOO 2KClO 2KCl3O 2HO 2HOO ● Điều chế SO2 : ot 23ran24 24 2 2 23 NaSOHSONaSOSOHO (KSO)(HCl)
Điều chế H2S : 24 42 ZnSHSOZnSOHS (FeS)(HCl)
Điều chế N2: ot 43(dd) 2(dd) 2 2 3 NHNONaNO N2HONaNO
Điều chế NH3
4(ran) 2(ran)
● Điều chế C2H2 : 2 222 CaC2HOHCa(OH)CH
b. Tính tan (trong nước của các khí) Không tan hoặc tan ít Tan vừa phải
Tan nhiều N2, H2, O2, CO2, CH4, H2S, C2H4, C2H2
Cl2 SO2, HCl, NH3


c. Thu khí : Trong phòng thí nghiệm, người ta thường thu khí bằng cách đẩy nước hoặc đẩy không khí. Cách thu khí Hình vẽ minh họa Thu khí
Thu các khí không tan hoặc rất ít tan trong nước như O2, H2, CO2, N2,…

Đẩy nước
Thu các khí nặng hơn không khí như O2, CO2, SO2, Cl2, NO2,… Đẩy không khí
Thu các khí nhẹ hơn không khí như H2, NH3, H2S,…
DẠYKÈMQUYNHƠN
Trang 2/14 - Mã đề thi 357
OFFICIAL
Ví
1: Hình vẽ sau mô tả thí nghiệm điều chế khí Z: Phương trình hoá học điều chế khí Z là A. 4HCl (đặc) + MnO2 Cl2↑ + MnCl2 + 2H2O. ot B. 2HCl (dung dịch) + Zn H2↑ + ZnCl2 C. H2SO4 (đặc) + Na2SO3 (rắn) SO2↑ + Na2SO4 + H2O. D. Ca(OH)2 (dung dịch) + 2NH4Cl (rắn) 2NH3↑ + CaCl2 + 2H2O. ot (Kỳ thi THPT Quốc Gia, năm 2016) Hướng dẫn giải
2. Ví dụ minh họa
dụ
Từ hình vẽ thí nghiệm ta thấy khí Z không tan trong nước và được điều chế từ dung dịch X và chất rắn Y. Suy ra phương trình điều chế khí Z là : 2HCl (dung dịch) + Zn H2↑ + ZnCl2 Ví dụ 2: Khí X được điều chế bằng cách cho axit phản ứng với kim loại hoặc muối và được thu vào ống nghiệm theo cách sau :
Khí X được điều chế bằng phản ứng nào sau đây?
A. Zn + 2HCl ZnCl2 + H2
B. CaCO3 + 2HCl CaCl2 + CO2 + H2O.
C. 2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
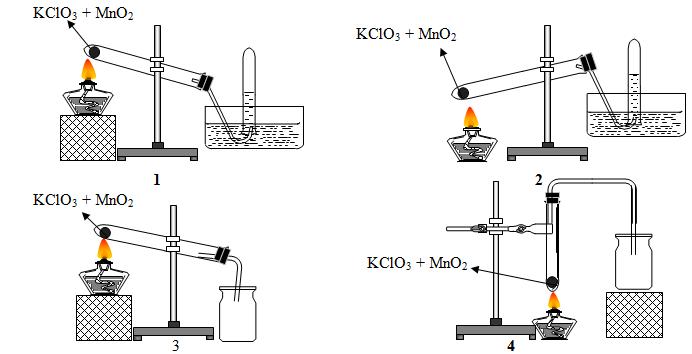

D. Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O. (Đề thi thử THPT lần 3 – THPT chuyên KHTN Hà Nội, năm 2016) Hướng dẫn giải
Từ cách thu khí ta suy ra X là khí nhẹ hơn không khí. Vậy đáp án đúng là A. Ví dụ 3: Trong phòng thí nghiệm khí oxi có thể được điều chế bằng cách nhiệt phân muối KClO3 có MnO2 làm xúc tác và có thể được thu bằng cách đẩy nước hay đẩy không khí Trong các hình
DẠYKÈMQUYNHƠN
Trang 3/14 - Mã đề thi 357
OFFICIAL
– Nghệ An,
Hướng dẫn giải Hình vẽ mô tả điều chế khi O2 đúng cách là 1 và 3. Vì O2 nặng hơn không khí và không tan trong nước nên
thể thu O2 bằng cách đẩy nước hoặc đẩy không khí. Ống nghiệm chứa O2 hơi trúc xuống để oxi và hơi nước thoát ra dễ dàng hơn (KClO3 trong PTN thường bị ẩm). Ví dụ 4: Cho hình thí nghiệm sau: chất B và chất X tương ứng lần lượt là
vẽ cho ở trên, hình vẽ mô tả điều chế và thu khí oxi đúng cách là A. 1 và 2. B. 2 và 3. C. 1 và 3. D. 3 và 4. (Đề thi thử THPT Quốc Gia lần 1 – THPT Cờ Đỏ
năm 2015)
có


DẠYKÈMQUYNHƠN OFFICIAL Trang 4/14 - Mã đề thi 357
THPT Quốc Gia lần 1 – THPT Đông Hiếu – Nghệ An, năm 2015) Hướng dẫn giải Từ hình vẽ ta thấy khí C nặng hơn không khí. Mặt khác, khí C được điều chế từ dung dịch B và chất rắn A nên khí C có thể là Cl2, NO2, SO2, CO2 Phương trình phản ứng : 4 2 2 2 B A 3ñac 32 2 2 A B 2324 24 2 2 B A 2324 24 2 2 B A KMnO16HCl2KCl2MnCl5Cl8HO Cu4HNO Cu(NO)2NO2HO NaSOHSONaSOSOHO NaCOHSONaSOCOHO Ví dụ tương tự : Ví dụ 6: Bộ dụng cụ như hình vẽ bên có thể dùng để điều chế và thu khí.
A. KClO3 và O2. B. MnO2 và Cl2. C. Zn và H2 D. C2H5OH và C2H4 (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Trần Phú – Hải Phòng, năm 2015) Hướng dẫn giải Từ hình vẽ ta thấy X là khí nặng hơn không khí và X được điều chế từ chất rắn B và dung dịch A. Suy ra B là MnO2 và Z là Cl2. Phương trình phản ứng : 2 22 2 MnO4HClMnClCl2HO Ví dụ 5: Trong phòng thí nghiệm, bộ dụng cụ vẽ dưới đây có thể dùng điều chế bao nhiêu khí trong số các khí sau: Cl2, NO2, NH3, SO2, CO2, H2, C2H4 A. 2. B. 4. C. 1. D. 3. (Đề thi thử
Cho biết bộ dụng cụ này có thể dùng cho trường hợp điều chế và thu khí nào trong số các trường hợp dưới đây?
A. Điều chế và thu khí H2S từ FeS và dung dịch HCl.
B. Điều chế và thu khí SO2 từ Na2SO3 và dung dịch HCl.
C. Điều chế và thu khí HCl từ NaCl và H2SO4 đậm đặc.
D. Điều chế và thu khí O2 từ H2O2 và MnO2.
Ví dụ 7: Cho mô hình thí nghiệm điều chế và thu khí như hình vẽ sau:
Phương trình hóa học nào sau đây không phù hợp với hình vẽ trên ?
A. CaC2 + H2O Ca(OH)2 + C2H2
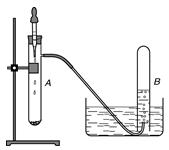
B. CaCO3 + HCl CaCl2 + CO2 + H2O.
C. NH4Cl + NaNO2 NaCl + N2 + H2O.
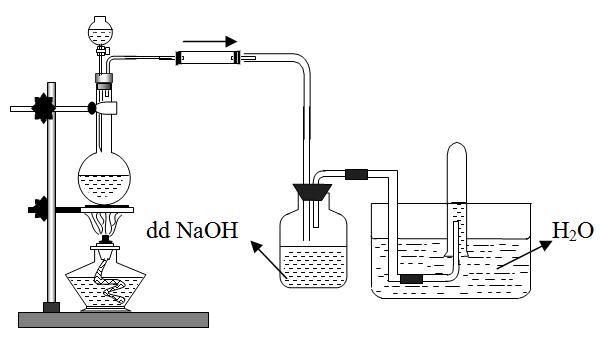
D. Al4C3 + 12H2O 4Al(OH)3 + 3CH4 (Đề thi thử THPT Quốc Gia lần 1 – THPT Đô Lương 1 – Nghệ An, năm 2015)
Ví dụ 8: Trong phòng thí nghiệm, bộ dụng vụ vẽ dưới đây có thể dùng để điều chế những chất khí nào trong các chất khí sau: Cl2, O2, NH3, SO2, CO2, H2, C2H4 ?
A. Cl2, NH3, CO2, O2 B. Cl2, SO2, H2, O2 C. Cl2, SO2, NH3, C2H4. D. Cl2, SO2, CO2, O2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Liễn Sơn – Vĩnh Phúc, năm 2015)
Ví dụ 9: Trong phòng thí nghiệm, khí C được điều chế bằng bộ dụng cụ như hình vẽ:
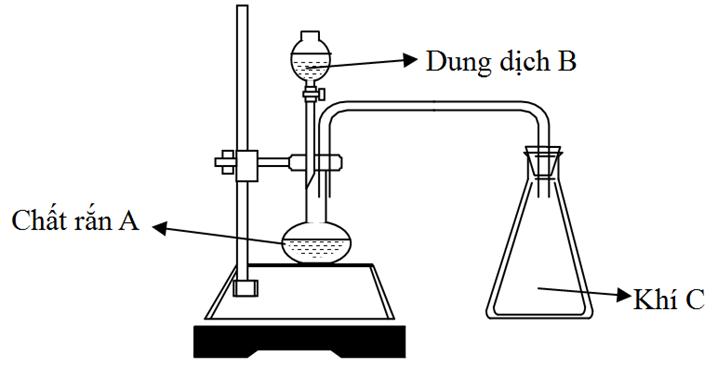
DẠYKÈMQUYNHƠN
Trang 5/14 - Mã đề thi 357
OFFICIAL
Khí C có thể là dãy các khí nào sau đây?
A. NO, CO2, C2H6, Cl2 B. N2O, CO, H2, H2S. C. NO2, Cl2, CO2, SO2 D. N2, CO2, SO2, NH3 (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Hạ Long, năm 2016)


Ví dụ 10: Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ dung dịch X
Hình vẽ trên minh họa phản ứng nào sau đây ?
A. NH4Cl + NaOH NaCl + NH3 + H2O. ot
NaCl (rắn) + H2SO4 (đặc) NaHSO4 + HCl. ot

DẠYKÈMQUYNHƠN
Trang 6/14 - Mã đề thi 357
OFFICIAL
D.
B.
C. C2H5OH C2H4 + H2O. o 24 HSOñac,t D. CH3COONa (rắn) + NaOH (rắn) Na2CO3 + CH4. oCaO,t Ví dụ 11: Cho thí nghiệm được mô tả như hình vẽ Phát biểu nào sai ? A. Khí Y là O2 B. X là hỗn hợp KClO3 và MnO2 C. X là KMnO4
X là CaSO3 (Đề thi thử THPT Quốc Gia lần – Sở Giáo Dục Và Đào Tạo Hồ Chí Minh, năm 2015) Ví dụ 12: Sơ đồ mô tả cách điều chế khí SO2 trong phòng thí nghiệm
Các chất X, Y, Z lần lượt là
A. HCl, CaSO3, NH3 B. H2SO4, Na2CO3, KOH. C. H2SO4, Na2SO3, NaOH. D. Na2SO3, NaOH, HCl. (Đề thi thử THPT Quốc Gia lần 2 – THPT Triệu Sơn – Thanh Hóa, năm 2015) ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 6D 7B 8D 9C 10C 11D 12C II. Dạng 2 : Tính chất vật lý, hóa học của các chất 1. Tính chất vật lý Ví dụ 1: Cho đồ thị biểu diễn nhiệt độ sôi của ba chất sau:

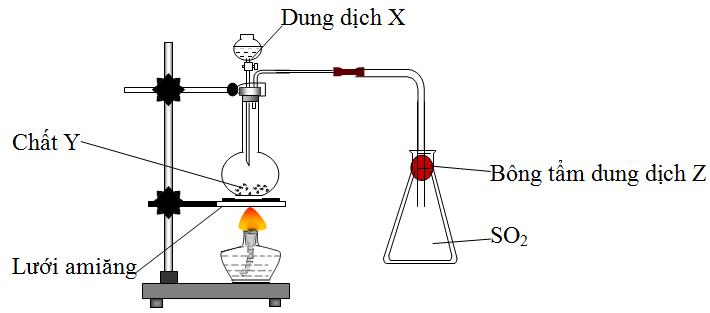
Chất A, B, C lần lượt là các chất sau
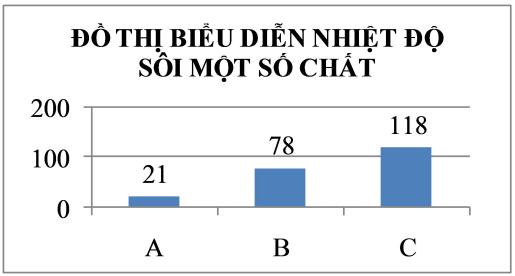
A. CH3CHO, CH3COOH, C2H5OH B. CH3COOH, C2H5OH, CH3CHO. C. C2H5OH, CH3CHO, CH3COOH. D. CH3CHO, C2H5OH, CH3COOH. Hướng dẫn giải + Các chất A, B, C lần lượt là CH3CHO, C2H5OH, CH3COOH.
● Giải thích: CH3CHO có nhiệt độ sôi thấp nhất vì giữa các phân tử không có liên kết hiđro. Hai chất còn lại giữa các phân tử đều có liên kết hiđro, nhưng liên kết hiđro giữa các phân tử axit bền hơn nên nhiệt độ sôi của nó cao hơn ancol.
DẠYKÈMQUYNHƠN
Trang 7/14 - Mã đề thi 357
OFFICIAL
Ví
Ví
2: Tiến
4
gồm C2H5OH, CH3CHO, CH3COOH và C2H5NH2 được biểu diễn bằng giản
sau: Chọn câu trả lời đúng A. Chất X là C2H5OH. B. Chất Y là C2H5NH2 C. Chất Z là CH3COOH. D. Chất T là CH3CHO. Ví dụ 3: Cho đồ thị biểu diễn nhiệt độ sôi của ba chất sau:
dụ tương tự :
dụ
hành thí nghiệm tìm hiểu nhiệt độ sôi của
chất hữu cơ
đồ
Các chất A, B ,C lần lượt là A. C2H5OH, CH3CHO, CH3COOH. B. CH3CHO, CH3COOH, C2H5OH. C. CH3COOH, C2H5OH, CH3CHO. D. CH3CHO, C2H5OH, CH3COOH. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 2B 3D 2. Tính chất hóa học Ví dụ 1: Cho sơ đồ điều chế axit clohiđric trong phòng thí nghiệm như sau :

Phát biểu nào sau đây là đúng ?
A. Không được sử dụng H2SO4 đặc vì nếu dùng H2SO4 đặc thì sản phẩm thành Cl2
B. Do HCl là axit yếu nên phản ứng mới xảy ra. C. Để thu được HCl người ta đun nóng dung dịch hỗn hợp NaCl và H2SO4 loãng.
D. Sơ đồ trên không thể dùng điều chế HBr, HI và H2S. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đặng Thúc Hứa – Nghệ An, năm 2015) Hướng dẫn giải Phát biểu đúng là : Sơ
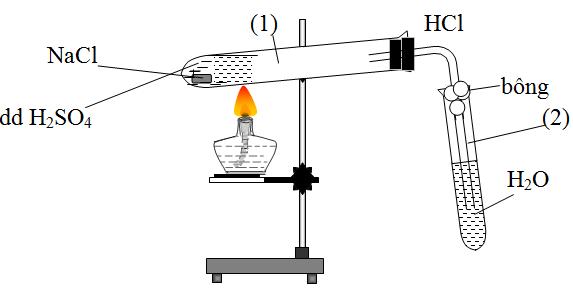
DẠYKÈMQUYNHƠN OFFICIAL Trang 8/14 - Mã đề thi 357
đồ trên
2
khử mạnh nên bị H2SO4
oxi
ứng : o o o t 24ñac 2 2 24 2 t 24ñac 22 24 2 t 2 24ñac 2 24 2 2NaBr2HSO BrSONaSO2HO 8NaBr5HSO 4BrHS4NaSO4HO NaS4HSO 4SONaSO4HO Ví dụ 2: Trong thí nghiệm ở hình bên người ta dẫn khí clo mới điều chế từ MnO2 rắn và dung dịch axit HCl đặc. Trong ống hình trụ có đặt một miếng giấy màu. Hiện tượng gì xảy ra với giấy màu khi lần lượt: a) Đóng khóa K ; b) Mở khóa K
không thể dùng điều chế HBr, HI và H2S. Vì trong các chất HBr, 2Br,I,S HI, H
S có tính
đặc
hóa. Phương trình phản
A. a) Mất màu; b) Không mất màu.
B. a) Không mất màu; b) Mất màu.
C. a) Mất màu; b) Mất màu.
D. a) Không mất màu; b) Không mất màu. (Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Lê Quý Đôn – Quảng Trị, năm 2015) Hướng dẫn giải

● PS : + Cl2 được điều chế từ MnO2 và HCl đặc thường lẫn hơi nước.
+ Cl2 ẩm là chất có khả năng tẩy màu.
Khi đóng khóa K, khí Cl2 có lẫn hơi nước sẽ đi qua dung dịch H2SO4 đặc, tại đây H2O bị hấp thụ hết. Cl2 khô sau đó đi theo ống dẫn khí sang ống hình trụ nên không làm mất màu miếng giấy.


Khi mở khóa K, khí Cl2 có hai con đường để đi đến ống hình trụ chứa giấy màu.
Theo con đường (2) khí Cl2 đến ống hình trụ là khí Cl2 ẩm nên làm mất màu mảnh giấy màu.
Ví dụ 3: Cho sơ đồ thí nghiệm như hình vẽ
Biết các khí có cùng số mol. Nghiêng ống nghiệm
DẠYKÈMQUYNHƠN
Trang 9/14 - Mã đề thi 357
OFFICIAL
để nước ở nhánh A chảy hết sang nhánh B. Xác định thành phần của chất khí sau phản ứng A. CO2, O2 B. CO2 C. O2, CO2, I2 D. O2 (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên Vĩnh Phúc, năm 2015) Hướng dẫn giải Khi nghiêng ống nghiệm để nước ở nhánh A chảy hết sang nhánh B sẽ xảy ra các phản ứng : 32 2 2 2xmol xmol 2 232 2xmolxmol 2KIOHO2KOHIO 2KOHCOKCOHO (1) (2)
Vậy thành phần khí còn lại là O2
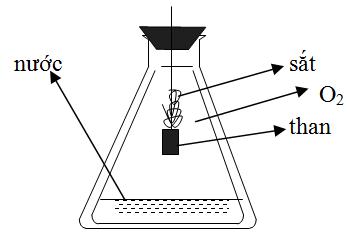
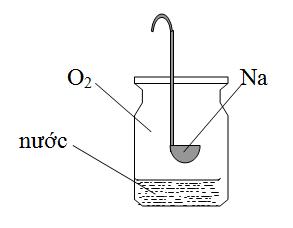
Ví dụ 4: Cho phản ứng của oxi với Na. Phát biểu nào sau đây không đúng ?
A. Na cháy trong oxi khi nung nóng.
B. Lớp nước để bảo vệ đáy bình thủy tinh.
C. Đưa ngay mẫu Na rắn vào bình phản ứng.
D. Hơ cho Na cháy ngoài không khí rồi mới đưa nhanh vào bình.
Hướng dẫn giải Phát biểu không đúng là “Đưa ngay mẫu Na rắn vào bình phản ứng.” Để thực hiện thí nghiệm trên thì Na phải được đốt cháy ngoài không khí trước khi đưa vào bình chứa O2 Đây là thí nghiệm chứng minh O2 có tính oxi hóa mạnh. Ví dụ tương tự : Ví dụ 5: Tiến hành thí nghiệm như hình vẽ bên: Sau một thời gian thì ở ống nghiệm chứa dung dịch Cu(NO3)2 quan sát thấy
A. không có hiện tượng gì xảy ra. B. có sủi bột khí màu vàng lục, mùi hắc. C. có xuất hiện kết tủa màu đen. D. có xuất hiện kết tủa màu trắng. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Hùng Vương – Phú Thọ, năm 2015)
Ví dụ 6: Cho phản ứng của Fe với oxi như hình vẽ sau. Vai trò của lớp nước ở đáy bình là
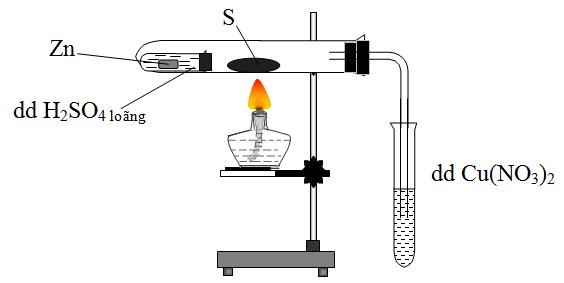
DẠYKÈMQUYNHƠN
Trang 10/14 - Mã đề thi 357
OFFICIAL
A. Giúp cho phản ứng của Fe với oxi xảy ra dễ dàng hơn.
B. Hòa tan oxi để phản ứng với Fe trong nước.
C. Tránh vỡ bình vì phản ứng tỏa nhiệt nhanh.
D. Cả 3 vai trò trên.
Ví dụ 7: Cho hình vẽ biểu diễn thí nghiệm của oxi với Fe. Điền tên đúng cho các kí hiệu 1, 2, 3 đã cho
A. 1: dây sắt; 2: khí oxi; 3: lớp nước
B. 1: mẫu than; 2: khí oxi; 3: lớp nước.
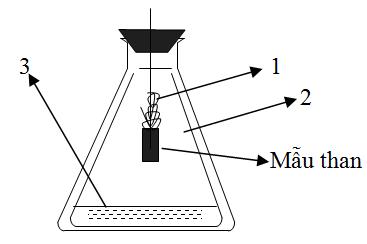
C. 1: khí oxi; 2: dây sắt; 3: lớp nước.
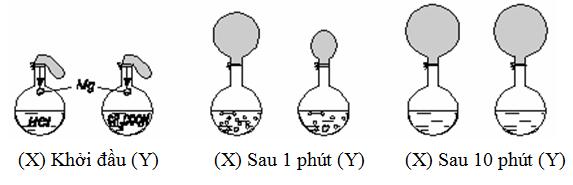
D. 1: lớp nước; 2: khí oxi; 3: dây sắt.

Ví dụ 8: Hình vẽ dưới đây mô tả thí nghiệm chứng minh
A. Khả năng bốc cháy của P trắng dễ hơn P đỏ
B. Khả năng bay hơi của P trắng dễ hơn P đỏ.
C. Khả năng bốc cháy của P đỏ dễ hơn P trắng.
D. Khả năng bay hơi của P đỏ dễ hơn P trắng. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Phan Bội Châu – Nghệ An, năm 2015) Ví dụ 9: Ở ống nghiệm nào không có phản ứng xảy
Cho các phát biểu sau: (1) Sau 1 phút, khí H2 thoát ra ở bình X nhiều hơn ở bình Y. (2) Sau 1 phút, khí H2 thoát ra ở bình Y nhiều hơn ở bình X.

DẠYKÈMQUYNHƠN
Trang 11/14 - Mã đề thi 357
OFFICIAL
3. B. 1. C. 2. D.
4. Ví
10: Hai bình như nhau, bình X chứa 0,5
axit
ric
ứa 0,5 lít axit axetic 2M,
c bịt kín bởi 2 bóng cao su như nhau. Hai mẩu Mg khối lượng như nhau được thả xuống
một
sau 1 phút và sau 10 phút (phản ứng đã
ế
c thể
ệ
ư ở
ra: A. 1,
2,
dụ
lít
clohiđ
2M, bình Y ch
đượ
cùng
lúc. Kết quả
k
t thúc) đượ
hi
n nh
hình dưới đây:
(3) Sau 1 phút, khí H2 thoát ra ở 2 bình X và Y bằng nhau.
(4) Sau 10 phút, khí H2 thoát ra ở 2 bình X và Y bằng nhau.

(5) Sau 10 phút, khí H2 thoát ra ở 2 bình X nhiều hơn ở bình Y.
(6) Sau 1 phút hay sau 10 phút, khí H2 thoát ra luôn bằng nhau. Các phát biểu đúng đúng là
A. (1), (4), (5). B. (2), (4), (5), (6). C. (1), (4). D. (3), (4), (6).
Ví dụ 11: Để bảo vệ con người khỏi sự ô nhiễm không khí, một công ty của Anh đã cho ra đời sản phẩm khẩu trang khá đặc biệt, không những có thể lọc sạch bụi mà còn có thể loại bỏ đến 99% các virus, vi khuẩn và khí ô nhiễm.
Theo em trong loại khẩu trang này có chứa chất nào trong số các chất sau ?
A. than hoạt tính. B. ozon. C. hiđropeoxit. D. nước clo. Ví dụ 12: Cho hình vẽ mô tả thí nghiệm tạo “khói trắng” từ hai dung dịch X và Y:
Biết mỗi dung dịch chỉ chứa một chất tan duy nhất. X, Y không phải cặp chất nào dưới đây ?
A. NH3 và HCl. B. CH3NH2 và HCl. C. (CH3)3N và HCl. D. Benzen và Cl2

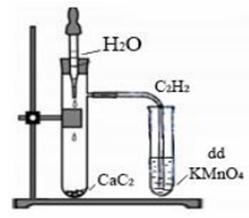

Ví dụ 13: Thí nghiệm nào sau đây chứng minh nguyên tử H trong ank-1-in linh động hơn ankan ?
A. B.
DẠYKÈMQUYNHƠN
Trang 12/14 - Mã đề thi 357
OFFICIAL
C. D.
Ví dụ 14: Trong chế biến thực phẩm, không nên dùng hoá chất nào dưới đây ?
A. Hàn the B. Đường mạch nha. C. Kẹo đắng. D. Bột nở. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 5C 6C 7A 8A 9B 10C 11A 12D 13C 14A


III. Dạng 3 : Vai trò của các dụng cụ thí nghiệm
Ví dụ 1: Cho hình vẽ mô tả quá trình chiết 2 chất lỏng không trộn lẫn vào nhau: Phát biểu nào sau đây là không đúng?
A. Chất lỏng nặng hơn sẽ được chiết trước.
B. Chất lỏng nặng hơn sẽ ở phía dưới đáy phễu chiết.
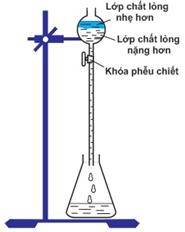

C. Chất lỏng nhẹ hơn sẽ nổi lên trên trên phễu chiết.
D. Chất lỏng nhẹ hơn sẽ được chiết trước.
Hướng dẫn giải
Phương pháp chiết để tách các chất lỏng không tan vào nhau, trong phễu chiết thì chất lỏng nào nhẹ hơn ở trên, chất lỏng nào nặng ở dưới và được chiết ra trước.
DẠYKÈMQUYNHƠN
Trang 13/14 - Mã đề thi 357
OFFICIAL
Ví dụ 2: Cho hình vẽ của bộ dụng cụ chưng cất thường. Cho biết ý nghĩa các chữ số trong hình vẽ bên.
A. 1- Nhiệt kế, 2 - đèn cồn, 3 - bình cầu có nhánh, 4 - sinh hàn, 5 - bình hứng (eclen).
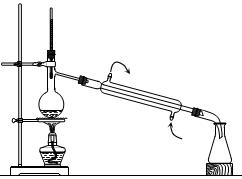
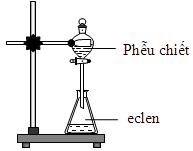
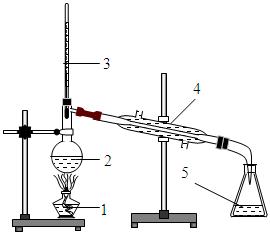
B. 1 - đèn cồn, 2 - bình cầu có nhánh, 3nhiệt kế, 4 - sinh hàn, 5 - bình hứng (eclen).
C. 1 - Đèn cồn, 2 - nhiệt kế, 3 - sinh hàn, 4bình hứng (eclen), 5 - Bình cầu có nhánh.
D. 1 - Nhiệt kế, 2 - bình cầu có nhánh, 3đèn cồn, 4 - sinh hàn, 5 - bình hứng (eclen).
Ví dụ 3: Chất lỏng trong eclen là chất lỏng
A. Nặng hơn chất lỏng ở phễu chiết.
B. Nhẹ hơn chất lỏng ở phễu chiết.
C. Hỗn hợp cả hai chất.
D. Dung môi.
Ví dụ 4: Cho bộ dụng cụ chưng cất thường như hình vẽ: Phương pháp chưng cất dùng để:
A. Tách các chất lỏng có nhiệt độ sôi khác nhau nhiều.
B. Tách các chất lỏng có nhiệt độ sôi gần nhau.
C. Tách các chất lỏng có độ tan trong nước khác nhau.
D. Tách các chất lỏng không trộn lẫn vào nhau. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 2B 3A 4A
DẠYKÈMQUYNHƠN
Trang 14/14 - Mã đề thi 357
OFFICIAL
CHUYÊN ĐỀ 10 : TÌM CHẤT
A. PHÂN DẠNG BÀI TẬP VÀ VÍ DỤ MINH HỌA
1. Dạng lời dẫn Ví dụ 1: Cho 3 hiđrocacbon mạch hở X, Y, Z (MX < MY < MZ < 62) có cùng số nguyên tử cacbon trong phân tử, đều phản ứng với dung dịch AgNO3 trong NH3 dư. Trong các phát biểu sau:
(a) 1 mol X phản ứng tối đa với 4 mol H2 (Ni, to).
(b) Chất Z có đồng phân hình học.
(c) Chất Y có tên gọi là but-1-in.
(d) Ba chất X, Y và Z đều có mạch cacbon không phân nhánh. Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3. (Đề thi THPT Quốc Gia năm 2016) Hướng dẫn trả lời + Theo giả thiết, suy ra : 2 2 3
+ Vậy các ý (a), (d) đúng. Ví dụ 2: Ứng với công thức phân tử C3H6O có bao nhiêu hợp chất mạch hở bền khi tác dụng với khí H2 (xúc tác Ni, to) sinh ra ancol ? A. 4. B. 2. C. 3. D. 1. Hướng dẫn trả lời Có 3 hợp chất bền có công thức phân tử là C3H6O khi phản ứng với H2 (xúc tác Na, to) sinh ra ancol.
DẠYKÈMQUYNHƠN
1
OFFICIAL
ứng với chất Y tạo ra anđehit axetic; chất X phản ứng với chất Z tạo ra ancol etylic. Các chất X, Y, Z lần lượt là : A. C2H4, O2, H2O. B. C2H2, H2O, H2. C. C2H4, H2O, CO. D. C2H2, O2, H2O. Hướng dẫn trả lời Chất X phản ứng với chất Y tạo ra anđehit axetic; chất X phản ứng với chất Z tạo ra ancol etylic. Suy ra X là C2H4 Y là O2 và Z là H2O. Phương trình phản ứng :
XlaCHCCCH YlaCHCCHCH ZlaCHCCHCH
2 2 CHCHCHOH ancol anlylic
3 2 CHCHCHO anđehit propionic 3 3CHCCH O axeton Ví dụ 3: Ở điều kiện thích hợp: chất X phản
Ví dụ 4: Ba chất hữu cơ X, Y, Z mạch hở có cùng công thức phân tử C2H4O2 và có tính chất sau :
- X tác dụng được với Na2CO3 giải phóng CO2.
- Y tác dụng được với Na và có phản ứng tráng gương. - Z tác dụng được với dung dịch NaOH, không tác dụng được với Na.
Các chất X, Y, Z là :
A. X : HCOOCH3; Y : CH3COOH; Z : CH2(OH)CHO.
B. X : CH2(OH)CHO; Y : CH3COOH; Z : HCOOCH3.
C. X : CH3COOH; Y : HCOOCH3; Z : CH2(OH)CHO.
D. X : CH3COOH; Y : CH2(OH)CHO; Z : HCOOCH3. Hướng dẫn trả lời
X, Y, Z có công thức phân tử là C2H4O2.
X tác dụng được với Na2CO3 giải phóng CO2, suy ra X là axit CH3COOH.
Y tác dụng được với Na và có phản ứng tráng gương, suy ra Y có đồng thời 2 nhóm chức là –CHO và –OH. Y có công thức là HOCH2CHO.
Z tác dụng được với dung dịch NaOH, không tác dụng được với Na, suy ra Z là este có công thức là HCOOCH3. Ví dụ 5: Bốn chất hữu cơ đơn chức có công thức phân tử : CH2O, CH2O2, C2H4O2, C2H6O chúng thuộc các dãy đồng đẳng khác nhau, trong đó có hai chất tác dụng Na sinh ra H2 Hai chất đó có công thức phân tử là A. CH2O2, C2H6O. B. CH2O, C2H4O2. C. C2H4O2, C2H6O. D. CH2O2, C2H4O2. Hướng dẫn trả lời Bốn chất đơn chức CH2O, CH2O2, C2H4O2, C2H6O thuộc các dãy đồng đẳng khác nhau. Suy ra công thức cấu tạo tương ứng của chúng là HCHO, HCOOH, HCOOCH3, C2H5OH hoặc CH3OCH3. Vì HCHO và HCOOCH3 không có phản ứng với Na và trong 4 chất có 2 chất phản ứng với Na nên C2H6O có công thức cấu tạo là C2H5OH. Vậy hai chất có khả năng phản ứng với Na là CH2O2, C2H6O.
Ví dụ 6: Chất X có công thức phân tử C6H8O4. Cho 1 mol X phản ứng hết với dung dịch NaOH, thu được chất Y và 2 mol chất Z. Đun Z với dung dịch H2SO4 đặc, thu được đimetyl ete. Chất Y phản ứng với dung dịch H2SO4 loãng (dư), thu được chất T. Cho T phản ứng với HBr, thu được hai sản phẩm là đồng phân cấu tạo của nhau. Phát biểu nào sau đây đúng?
A. Chất T không có đồng phân hình học.
B. Chất X phản ứng với H2 (Ni, to) theo tỉ lệ mol 1 : 3.
C. Chất Y có công thức phân tử C4H4O4Na2
D. Chất Z làm mất màu nước brom.
DẠYKÈMQUYNHƠN OFFICIAL 2
o o t,xt 2 22 3 t,xt 2 22 25 2CHCHO 2CHCHO CHCHHOCHOH
Hướng dẫn trả lời
Đun Z với dung dịch H2SO4 đặc, thu được đimetyl ete. Suy ra Z là CH3OH. Thủy phân 1 mol C6H8O4 trong dung dịch NaOH, thu chất chất Y và 2 mol CH3OH. Suy ra C6H8O4 là este hai chức, phản ứng với NaOH theo tỉ lệ mol là 1 : 2. Theo bảo toàn nguyên tố ta thấy Y là NaOOC – CH = CH – COONa hoặc CH2=C(COONa)2.
Theo giả thiết thì T là HOOC – CH = CH – COOH hoặc CH2=C(COOH)2. Vì T phản ứng với HBr cho hai sản phẩm là đồng phân của nhau nên T phải là CH2=C(COOH)2. Chất X là CH2=C(COOCH3)2.
OFFICIAL
Vậy phát biểu đúng là : “Chất T không có đồng phân hình học”. Các phát biểu còn lại đều sai. Vì : Chất X chỉ phản ứng được với H2 (to, Ni) theo tỉ lệ mol là 1 : 1. Chất Y có công thức phân tử là C4H2O4Na2. CH3OH không làm mất màu nước brom.
Ví dụ tương tự :
Ví dụ 7: Ba chất hữu cơ đơn chức, mạch hở X, Y, Z có cùng công thức phân tử C3H6O2 và có các tính chất: X, Y, Z đều phản ứng được với dung dịch NaOH; X, Z đều không có khả năng tác dụng với kim loại Na; khi đun nóng chất X với dung dịch H2SO4 loãng thì trong số các sản phẩm thu được, có một chất có khả năng tham gia phản ứng tráng bạc. Các chất X, Y, Z lần lượt là
A. CH3COOCH3, C2H5COOH, HCOOC2H5.
B. HCOOC2H5, CH3COOCH3, C2H5COOH.
C. HCOOC2H5, C2H5COOH, CH3COOCH3.
D. C2H5COOH, HCOOC2H5, CH3COOCH3. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Đại học Vinh – Nghệ An, năm 2015)
Ví dụ 8: Cho tất cả các đồng phân mạch hở, có cùng công thức phân tử C2H4O2 lần lượt tác dụng với Na, NaOH, CH3OH (ở điều kiện thích hợp). Số phản ứng xảy ra là: A. 5. B. 3. C. 4. D. 6. (Đề thi thử THPT Quốc Gia lần 3 – THPT Yên Định 2 – Thanh Hóa, năm 2015) Ví dụ 9: Cho 7,5 gam hợp chất hữu cơ X (M < 90) mạch hở phản ứng hoàn toàn với
DẠYKÈMQUYNHƠN
3
4,6 gam kim loại Na, thu được 11,975 gam chất rắn khan. Số lượng hợp chất hữu cơ X thỏa mãn là A. 2. B. 4. C. 3. D. 5. (Đề thi thử THPT Quốc Gia lần 1 – THPT Yên Viên – Hà Nội, năm 2015) Ví dụ 10: Hợp chất hữu cơ X có công thức phân tử C5H6O4. X tác dụng với NaOH trong dung dịch theo tỉ lệ mol 1 : 2, tạo ra muối của axit no Y và ancol Z. Dẫn Z
qua CuO nung nóng thu được anđehit T có phản ứng tráng bạc, tạo ra Ag theo tỉ lệ mol 1 : 4. Biết Y không có đồng phân nào khác. Phát biểu nào sau đây là đúng?
A. Ancol Z không no có 1 liên kết C=C.
B. Axit Y có tham gia phản ứng tráng bạc. C. Ancol Z không hoà tan Cu(OH)2 để tạo dung dịch màu xanh. D. Anđehit T là chất đầu tiên trong dãy đồng đẳng. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Hùng Vương – Phú Thọ, năm 2016)
DẠYKÈMQUYNHƠN OFFICIAL 4
2.
2 2 2
3 24 HO H HO 2
Tên gọi của X và Z lần lượt là: A. axetilen và etylen glicol. B.
C. etan và etanal. D.
Hướng dẫn trả lời Từ sơ đồ phản ứng ta thấy X là C2H2, Y là C2H4 và Z là C2H5OH. Phương trình phản ứng : 2 o 3 2 o 24 2 2 2 X H 2 2 2 t,Pd/PbCO X Y HO 2 22 25HSO,t Y Z CaC2HOCHCHCa(OH) CHCHH CHCH CHCHHO CHOH Ví dụ 2: Cho sơ đồ sau : X X1 PE M Y Y1 Y2 thuỷ tinh hữu cơ Công thức cấu tạo của X là A. CH=CH2COOCH=CH2. B. CH2=C(CH3)COOC2H5. C. C6H5COOC2H5 D. C2H3COOC3H7 Hướng dẫn trả lời Theo sơ đồ, suy ra : Y2 là metyl metacrylat, Y1 là axit metacrylic, Y là muối của axit metacrylic; X1 là etilen, X là ancol etylic. Vậy M là CH2=C(CH3)COOC2H5. Phương trình phản ứng :
ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 7C 8A 9C 10C
Dạng sơ đồ chuyển hóa Ví dụ 1: Cho dãy chuyển hóa sau:
o o
Pd/PbCO,t HSO,t CaC X Y Z
axetilen và ancol etylic.
etilen và ancol etylic.
+ X
5 + 2H2O Phân tử khối của X5 là A. 202. B. 174. C. 198. D. 216. Hướng dẫn trả lời Từ (b) và (c), suy ra X3 là axit ađipic, X1 là NaOOC(CH2)4COONa. Áp dụng bảo toàn nguyên tố cho phản ứng (a), suy ra X2 là C2H5OH và X là HOOC(CH2)4COOC2H5 Từ (d) suy ra X5 là C2H5OOC(CH2)4COOC2H5 và
DẠYKÈMQUYNHƠN OFFICIAL 5 o o 24 1 o 1 t 2 3 25 2 3 25 M Y X HSOñac,t 25 2 22 X X t,p,xt 2 2 2 2n X PE 2 3 Y CHC(CH)COOCHNaOHCHC(CH)COONaCHOH CHOH CHCHHO nCHCH (CHCH) 2CHC(CH)COONa 1 o 24 1 2 o 2 24loang 2 3 24 Y HSOñac,t 2 3 3 2 3 3 Y Y t,p,xt 2 3 3 2 Y HSO2CHC(CH)COOHNaSO CHC(CH)COOHCHOH CHC(CH)COOCH nCHC(CH)COOCH (CH(CH 3 3n thuytinhhöucô )C(COOCH)) Ví dụ 3: Hợp chất X có công thức C8H14O4. Từ X thực hiện các phản ứng
X
2X
24 25 24 25 2 24 24 24 24 HOOC(CH)COOCH2NaOHNaOOC(CH)COONaCHOHHO NaOOC(CH)COONaHSOHOOC(CH)COOHNaSO H2N(CH2)6NH2+HOOC(CH2)4COOH to n n N H (CH2)6N H C O (CH2)4C O n +2nH2O o 24ñac HSO,t 24 25 25 24 252 HOOC(CH)COOH2CHOH CHOOC(CH)COOCH2HO Ví dụ 4: Cho sơ đồ chuyển đổi sau (E, Q, X, Y, Z là hợp chất hữu cơ, mỗi mũi tên biểu thị một phản ứng hoá học) :
(theo đúng tỉ lệ mol): (a) X + 2NaOH X1 + X2 + H2O(b)
1 + H2SO4
X3 + Na2SO4 (c) nX3 + nX4 nilon-6,6 + 2nH2O(d)
2
3 X
Phương trình phản ứng minh họa : 5X M202.
E
C2H5OH
CO2
X Z
Y
Công thức của E, Q, X, Y, Z phù hợp với sơ đồ trên lần lượt là :
A. (C6H10O5)n, C6H12O6, CH3CHO, CH3COOH, CH3COOC2H5. B. C6H10O5)n, C6H12O6, CH3CHO, CH3COOH, CH3COONa. C. C12H22O11, C6H12O6, CH3COOH, CH3COOC2H5, CH3COONa. D. (C6H10O5)n, C6H12O6, CH3CHO, CH3COONH4, CH3COOH.
Hướng dẫn trả lời
Theo sơ đồ ta thấy :
+ Từ CO2 tạo ra được cả E và Q và từ E có thể tạo thành Q. Suy ra : E là tinh bột, Q là glucozơ. + Z không thể là CH3COOH hoặc CH3COONa, những chất này không thể chuyển hóa thành C2H5OH bằng 1 phản ứng. Vậy E, Q, X, Y, Z lần lượt
DẠYKÈMQUYNHƠN
6
OFFICIAL
Q
10
n
Phương
o o o 24 anhsang,chatdiepluc 2 2
2 2
2 t 25 3 2 t,xt 3 2 3 HSOñac,t 3 25 6nCO5nHO (CHO)6nO 6CO6HO CHO6O CHOHCuOCHCHOCuHO 2CHCHOO 2CHCOOH CHCOOHCHOH o 3 25 t 3 25 3 25 CHCOOCH CHCOOCHNaOHCHCOONaCHOH Ví dụ tương tự : Ví dụ 5: Hợp chất hữu cơ X (chứa C, H, O) trong đó oxi chiếm 50% về khối lượng. Từ chất X thực hiện chuyển hoá sau: Phát biểu nào sau đây là không đúng? A. Chất X và Y đều tan vô hạn trong nước. B. Chất Z tác dụng được với kim loại Na và dung dịch NaOH đun nóng. C. Chất Y và Z hòa tan được Cu(OH)2 ở nhiệt độ thường D. Chất T tác dụng với NaOH (dư) trong dung dịch theo tỉ lệ mol 1 : 2. Ví dụ 6: Cho sơ đồ phản ứng :
là : (C6H
O5)
, C6H12O6, CH3CHO, CH3COOH, CH3COOC2H5
trình phản ứng :
6105n 2 anhsang,chatdiepluc
6126
(1) X + O2 axit cacboxylic Y1 oxt,t (2) X + H2 ancol Y2 oxt,t (3) Y1 + Y2 Y3 + H2O oxt,t Biết Y3 có công thức phân tử C6H10O2. Tên gọi của X là : A. Anđehit metacrylic. B. Anđehit acrylic. C. Anđehit axetic. D. Anđehit propionic. Ví dụ 7: Cho các phản ứng xảy ra theo sơ đồ sau :
(3)
Chất X là A. etyl fomat. B. metyl acrylat. C. vinyl axetat D. etyl axetat. Ví dụ 8: Cho sơ đồ chuyển hoá sau : C3H4O2 + NaOH X + Y X + H2SO4 loãng Z + T Biết Y và Z đều có phản ứng tráng gương. Hai chất Y, Z tương ứng là : A. HCHO, HCOOH. B. HCHO, CH3CHO. C. HCOONa, CH3CHO. D. CH3CHO, HCOOH. Ví dụ 9: Hợp chất hữu cơ mạch hở X có công thức phân tử C5H10O. Chất X không phản ứng với Na, thỏa mãn sơ đồ chuyển hóa sau: Este có mùi chuối chín.
DẠYKÈMQUYNHƠN OFFICIAL 7
YNaOH CHNaCO
2 o
X + NaOH (dung dịch) Y + Z(1) ot Y + NaOH (rắn) T + P(2) oCaO,t T Q + H2 (3) o 1500C Q + H2O Z(4) o t,xt Trong sơ đồ
(1) ot XNaOHYZ (2) oCaO,t (ran) (ran) 4 23
ot 332 3443 Z2AgNO3NHHOCHCOONH2NHNO2Ag
3
24 CHCOOH H HSO,ñac Ni,t XY Tên của X là A. 3 - metylbutanal. B. pentanal. C. 2 - metylbutanal. D. 2,2 - đimetylpropanal. Ví dụ 10: Cho sơ đồ các phản ứng:
trên, X và Z lần lượt là A. HCOOCH=CH2 và HCHO. B. CH3COOC2H5 và CH3CHO.
C. CH3COOCH=CH2 và HCHO. D. CH3COOCH=CH2 và CH3CHO.
Ví dụ 11: Cho sơ đồ chuyển hóa sau:
(a) C3H4O2 + NaOH X + Y
(b) X + H2SO4 (loãng) Z + T
(c) Z + dung dịch AgNO3/NH3 (dư) E + Ag + NH4NO3
(d) Y + dung dịch AgNO3/NH3 (dư) F + Ag +NH4NO3
Chất E và chất F theo thứ tự là A. (NH4)2CO3 và CH3COONH4.
B. (NH4)2CO3 và CH3COOH.
C. HCOONH4 và CH3COONH4 D. HCOONH4 và CH3CHO.
Ví dụ 12: Cho các chuyển hoá sau :
(1) X + H2O Y o t,xt
OFFICIAL
(2) Y + H2 Sobitol o t,Ni (3) Y + 2AgNO3 + 3NH3 + H2O Amoni gluconat + 2Ag + NH4NO3 ot (4) Y E + Z o t,xt (5) Z + H2O X + G as,clorophin X, Y và Z lần lượt là : A. tinh bột, glucozơ và ancol etylic.
B. xenlulozơ, fructozơ và khí cacbonic. C. tinh bột, glucozơ và khí cacbonic. D. xenlulozơ, glucozơ và khí cacbon oxit. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 5C 6B 7C 8D 9A 10D 11A 12C 3. Dạng bảng biểu
Ví
DẠYKÈMQUYNHƠN
8
dụ 1: Cho ba hiđrocacbon X, Y, Z. Nếu đốt cháy 0,23 mol mỗi chất thì thể tích khí CO2 thu được không quá 17 lít (đo ở đktc). Thực hiện các thí nghiệm thấy có hiện tượng như bảng sau : Phản ứng với X Y Z Dung dịch AgNO3/NH3 Kết tủa vàng Không có kết tủa Không có kết tủa Dung dịch brom Mất màu Mất màu Không mất màu A. CH3–CC–CH3; CH2=CH–CH=CH2; CH3–CH2–CH2–CH3. B. CH2=C=CH2; CH2=CH–CH3; CH3–CH2–CH3. C. CHCH; CH2=CH–CH=CH2; CH3–CH3. D. CHC – CH3; CH2=CH–CH3; CH3–CH3.
độ sôi (
C)
-33,4
(dung dịch nồng độ 0,001M) 6,48 7,82 10,81 10,12 Nhận xét nào sau đây đúng? A. Y là C6H5OH. B. Z là CH3NH2 C. T là C6H5NH2 D. X là NH3. Hướng dẫn trả lời T có nhiệt độ sôi thấp nhất nên T là NH3. Vậy kết luận T là C6H5NH2, X là NH3 không đúng. Nếu Y là C6H5OH thì pH của dung dịch này phải nhỏ hơn 7 do phenol có tính axit. Vậy kết luận Y là C6H5OH không đúng. Suy ra kết luận đúng là : Z là CH3NH2. Ví dụ 3: Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất sau ở dạng dung dịch nước : X, Y, Z, T và Q Chất Thuốc thử
X Y Z T Q Quỳ tím không đổi màu không đổi màu không đổi màu không đổi màu không đổi màu
Dung dịch AgNO3/NH3, đun nhẹ không có kết tủa Ag không có kết tủa
không có kết tủa Ag
Cu(OH)2, lắc nhẹ Cu(OH)2 không tan dung dịch xanh lam
dung dịch xanh lam
không có kết tủa không có kết tủa
Cu(OH)2 không tan Cu(OH)2 không tan Nước brom Kết tủa trắng không có kết tủa không có kết tủa
Các chất X, Y, Z, T và Q lần lượt là
A. Glixerol, glucozơ, etylen glicol, metanol, axetanđehit. B. Phenol, glucozơ, glixerol, etanol, anđehit fomic.
DẠYKÈMQUYNHƠN OFFICIAL 9 (Đề thi thử
–
Hướng dẫn trả
2CO (X,Y,Z) 17 17 n C 3,299Dñung. 22,4 22,4.0,23 Döavaobangthongtinñecho Ví dụ 2:
5
sau:
X
Z T
THPT Quốc Gia lần 1
THPT Thanh Oai A – Hà Nội, năm 2016)
lời
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: CH3NH2, NH3, C6H-
OH (phenol), C6H5NH2 (anilin) và các tính chất được ghi trong bảng
Chất
Y
Nhiệt
o
182 184 -6,7
pH
C. Anilin, glucozơ, glixerol, anđehit fomic, metanol.
D. Fructozơ, glucozơ, axetanđehit, etanol, anđehit fomic. (Đề thi THPT Quốc Gia, năm 2015)
Hướng dẫn trả lời
Theo kết quả thí nghiệm và đáp án, ta thấy : X có thể là phenol; Y là glucozơ; Z là glixerol; T là ancol etylic; Q là anđehit fomic.
Ví dụ 4: Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau: Mẫu thử Thuốc thử Hiện tượng
X Dung dịch I2
Có màu xanh tím Y Cu(OH)2 trong môi trường kiềm
Có màu tím Z Dung dịch AgNO3 trong NH3, đun nóng dư, đun nóng
Kết tủa Ag trắng sáng T Nước Br2 Kết tủa trắng
Dung dịch X, Y, Z, T lần lượt là:
A. Hồ tinh bột, lòng trắng trứng, anilin, glucozơ.
B. Lòng trắng trứng, hồ tinh bột, glucozơ, anilin.
C. Hồ tinh bột, lòng trắng trứng, glucozơ, anilin.
D. Hồ tinh bột, anilin, lòng trắng trứng, glucozơ.
(Đề thi THPT Quốc Gia, năm 2016) Hướng dẫn trả lời
Theo kết quả thí nghiệm và đáp án, ta thấy : X là hồ tinh bột; Y là lòng trắng trứng; Z là glucozơ; T là anilin.
Ví dụ tương tự :
Ví dụ 5: Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: CH3COOH, CH3OH,CH3CHO, HCOOH và các tính chất được ghi trong bảng sau: Chất X Y Z T Nhiệt độ sôi (oC) 64,7 100,8 21,0 118,0 pH (dung dịch nồng độ 0,001M)
DẠYKÈMQUYNHƠN
10
OFFICIAL
A.
Ví
độ nóng chảy, nhiệt độ sôi và độ tan trong nước của ba chất hữu cơ X, Y, Z được trình bày trong bảng sau: Độ tan trong nước (g/100ml) Nhiệt độ sôi (oC) Nhiệt độ nóng chảy (oC) 20oC 80oC X 181,7 43 8,3 Y Phân hủy trước khi sôi 248 23 60
7,00 3,47 7,00 3,88 Chuyển hóa nào sau đây không thực hiện được bằng 1 phản ứng trực tiếp?
X T. B. X Y. C. Z Y.
D. Z T.
dụ 6: Nhiệt
Z 118,2 16,6 Các chất X, Y, Z lần lượt là
A. Phenol, glyxin, axit axetic. B. Glyxin, phenol, axit axetic. C. Phenol, axit axetic, glyxin. D. Axit axetic, glyxin, phenol. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Hùng Vương – Phú Thọ, năm 2016) Ví dụ 7: Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH; CH3COOH; HCl; C6H5OH (phenol) và pH của các dung dịch trên được ghi trong bảng sau: Chất X Y Z T pH dd nồng độ 0,01M, 25oC 6,48 3,22 2,00 3,45 Nhận xét nào sau đây đúng?
A. T cho được phản ứng tráng bạc.
B. X được điều chế trực tiếp từ ancol etylic. C. Y tạo kết tủa trắng với nước brom. D. Z tạo kết tủa trắng với dung dịch AgNO3 (Đề thi thử THPT Quốc Gia lần 1 – THPT Lê Lợi – Thanh Hóa, năm 2016) Ví dụ 8: Có các chất lỏng X, Y, Z, T, E trong số các chất: benzen, ancol etylic, axit axetic, dung dịch glucozơ, nước? Biết kết quả của những thí nghiệm như sau: Các chất lỏng X, Y, Z, T, E lần lượt là
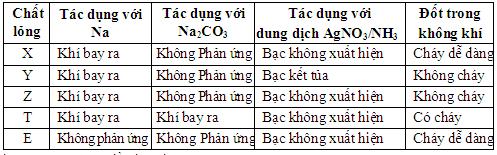
A. Ancol etylic, dung dịch glucozơ, nước, axit axetic, benzen.
B. Dung dịch glucozơ, nước, ancol etylic, axit axetic, benzen.
C. Axit axetic, ancol etylic, nước, dung dịch glucozơ, benzen.
D. Benzen, dung dịch glucozơ, nước, ancol etylic, axit axetic. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 5C 6A 7D 8A
DẠYKÈMQUYNHƠN
11
OFFICIAL
B.
CÂU HỎI VẬN DỤNG
Câu 1: Cho hợp chất hữu cơ X tác dụng với dung dịch AgNO3/NH3 (dư) thu được sản phẩm Y. Cho Y tác dụng với dung dịch HCl hoặc dung dịch NaOH đều sinh ra chất khí vô cơ. X là
A. CH3CHO. B. (NH4)2CO3 C. C2H2 D. HCOONH4.
OFFICIAL
Câu 2: Hai chất X và Y có cùng công thức phân tử C2H4O2. Chất X phản ứng được với kim loại Na và tham gia phản ứng tráng bạc. Chất Y phản ứng được với kim loại Na và hoà tan được CaCO3. Công thức của X, Y lần lượt là: A. HOCH2CHO, CH3COOH. B. CH3COOH, HOCH2CHO. C. HCOOCH3, HOCH2CHO. D. HCOOCH3, CH3COOH. (Đề thi thử THPT Quốc Gia lần 1 – THPT Ngô Gia Tự – Vĩnh Phúc, năm 2016) Câu 3: Cho 3 chất X,Y, Z vào 3 ống nghiệm chứa sẵn Cu(OH)2 trong NaOH lắc đều và quan sát thì thấy: Chất X thấy xuất hiện màu tím, chất Y thì Cu(OH)2 tan và có màu xanh nhạt, chất Z thì Cu(OH)2 tan và có màu xanh thẫm. X, Y, Z lần lượt là :
A. Protein, CH3CHO, saccarozơ. B. Lòng trắng trứng, CH3COOH, glucozơ. C. Hồ tinh bột, HCOOH, saccarozơ. D. Lòng trắng trứng, C2H5COOH, glyxin. (Đề thi thử THPT Quốc Gia lần 1 – THPT Lương Ngọc Quyến – Thái Nguyên, năm 2016)
Câu 4: Một chất hữu cơ X có công thức C3H9O2N. Cho X phản ứng với dung dịch NaOH đun nhẹ, thu được muối Y và khí Z làm xanh giấy quì tím ẩm. Cho Y tác dụng với NaOH rắn, nung nóng có CaO làm xúc tác thu được metan. Công thức cấu tạo thu gọn của X là
A. CH3COOH3NCH3
B. CH3CH2COONH4 C. CH3CH2NH3COOH. D. CH3NH3CH2COOH. (Đề thi thử THPT Quốc Gia lần 1– THPT Sở GD và ĐT Quảng Nam, năm 2016) Câu 5: Ba hợp chất hữu cơ X, Y, Z có cùng công thức phân tử C3H4O2. X và Y đều tham gia phản
DẠYKÈMQUYNHƠN
12
A. OHC-CH2-CHO; HCOOCH=CH2, CH2=CH-COOH. B. CH3-CO-CHO; HCOOCH=CH2, CH2=CH-COOH. C. HCOOCH=CH2; OHC-CH2-CHO, CH2=CH-COOH. D. HCOOCH=CH2; CH2=CH-COOH, HCO-CH2-CHO. (Đề thi thử THPT Quốc
ứng tráng bạc; X, Z có phản ứng cộng hợp Br2; Z tác dụng với NaHCO3. Công thức cấu tạo của X, Y, Z lần lượt là
Gia lần 1 – THPT Yên Định – Thanh Hóa, năm 2016) Câu 6: Phenolphtalein là chất chỉ thị màu axit – bazơ trong phòng thí nghiệm có công thức đơn giản nhất là C10H7O2. Trong phân tử phenolphtalein có 3 vòng benzen, một vòng chứa oxy và một nối đôi C=O, còn lại là liên kết đơn. Công thức phân tử của phenolphtalein sẽ là:
A. C10H7O2.
B. C40H28O8. C. C20H14O4. D. C30H21O6.
(Đề thi thử THPT Quốc Gia lần 1 – THPT Nghèn – Hà Tĩnh, năm 2016)
Câu 7: Chất A có nguồn gốc thực vật và thường gặp trong đời sống chứa C, H, O; mạch hở. Lấy cùng số mol của A cho phản ứng hết với NaHCO3 hay với Na thu được số mol CO2 = 3/2 số mol H2. Chất A là :
A. axit Lauric : CH3-(CH2)10-COOH.
B. axit tatric : HOOC-CH(OH)-CH(OH)-COOH.
C. axit xitric : HOOC-CH2-C(OH)(COOH)-CH2-COOH.
D. axit malic : HOOC-CH(OH)-CH2-COOH. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên KHTN Hà Nội, năm 2016) Câu 8: Hợp chất X có công thức phân tử C11H20O4. Biết X tác dụng được với NaOH tạo ra muối của axit hữu cơ Y mạch không phân nhánh và 2 ancol là etanol và propan-2-ol. Nhận định nào dưới đây là không đúng?
A. X là đieste.
B. Từ Y có thể điều chế được tơ nilon-6,6.
C. Y là HCOO-(CH2)4-COOH (axit glutamic)
D. Tên gọi của X là etyl iospropyl ađipat. (Đề thi thử THPT Quốc Gia lần 2 – THPT Lam Kinh – Nghệ An, năm 2016) Câu 9: X1, X2, X3 là ba chất hữu cơ có phân tử khối tăng dần. Khi cho cùng số mol mỗi chất tác dụng với dung dịch AgNO3 trong NH3 dư thì đều thu được Ag và muối Y, Z. Biết rằng:
(a) Lượng Ag sinh ra từ X1 gấp hai lần lượng Ag sinh ra từ X2 hoặc X3
(b) Y tác dụng với dung dịch NaOH hoặc HCl đều tạo khí vô cơ. Các chất X1, X2, X3 lần lượt là A. HCHO, CH3CHO, C2H5CHO. B. HCHO, HCOOH, HCOONH4 C. HCHO, CH3CHO, HCOOCH3 D. HCHO, HCOOH, HCOOCH3 (Đề thi thử THPT Quốc Gia lần 1 – THPT Phan Ngọc Hiển – Cà Mau, năm 2016) Câu 10: Ba hợp chất hữu cơ X, Y, Z mạch hở ( đều chứa C, H, O) và có cùng số phân tử khối là 60. Cả 3 chất đều có phản ứng với Na giải phóng khí H2. Khi oxi hóa X có xúc tác thích hợp tạo ra X1 có khả năng tham gia phản ứng tráng bạc. Y tác dụng với NaOH còn Z có khả năng tham gia phản ứng tráng bạc. Công thức cấu tạo thu gọn của X, Y, Z lần lượt là :
3COOH; CH3OC2H5. (Đề
thử THPT Quốc Gia lần 1 – THPT Trực Ninh – Nam Định, năm 2016)
DẠYKÈMQUYNHƠN
13
OFFICIAL
3)2CHOH;
3CH2CH2OH;
3)2CHOH;
D.
3CH2CH2OH;
A. (CH
HCOOCH3; HOCH2CHO. B. CH
CH3COOH; HOCH2CHO. C. (CH
CH3COOH; HCOOCH3.
CH
CH
thi
Câu 11: Hợp chất X có công thức phân tử C6H8O6. X phản ứng với NaOH theo tỉ lệ mol 1 : 3 và phản ứng với AgNO3/NH3 theo tỉ lệ mol 1 : 6. X không phản ứng với NaHCO3. Có các kết luận sau:
(1) X có chứa liên kết ba đầu mạch.
(2) X có chứa nhóm chức axit cacboxylic.
(3) X có chứa nhóm chức este.
(4) X có nhóm chức anđehit.
(5) X là hợp chất đa chức. Số kết luận đúng về X là A. 1. B. 2 C. 3. D. 4. Câu 12: Chất X là một loại thuốc cảm có công thức phân tử C9H8O4. Cho 1 mol X phản ứng hết với dung dịch NaOH thu được 1 mol chất Y, 1 mol chất Z và 2 mol H2O. Nung Y với hỗn hợp CaO/NaOH thu được parafin đơn giản nhất. Chất Z phản ứng với dung dịch H2SO4 loãng dư thu được hợp chất hữu cơ tạp chức T không có khả năng tráng gương. Có các phát biểu sau:
OFFICIAL
(a) Chất X phản ứng với NaOH (t°) theo tỉ lệ mol 1 : 2. (b) Chất Y có tính axit mạnh hơn H2CO3. (c) Chất Z có công thức phân tử C7H4O4Na2.
(d) Chất T không tác dụng với CH3COOH nhưng có phản ứng với CH3OH (H2SO4 đặc, to). Số phát biểu đúng là A. 1 B. 2. C. 3. D. 4.
Câu 13: X là hợp chất hữu cơ đơn chức. Cho X tác dụng với NaOH thu được Y và Z. Biết Z không tác dụng được với Na và có sơ đồ chuyển hóa sau:
DẠYKÈMQUYNHƠN
14
2 o o O NaOH NaOH xt,t CaO,t ZT Y Akanñôngiannhat Thành phần phần trăm theo khối lượng của cacbon
X là A. 48,65%. B. 55,81%.
Câu 14: Cho các chất hữu cơ X, Y, Z, T, E thỏa mãn các phương trình hóa học sau: X + 3NaOH C6H5ONa + Y +CH3CHO +H2O(1) ot Y + 2NaOH T + 2Na2CO3 (2) oCaO,t CH3CHO + AgNO3 + NH3 + H2O Z + …(3) ot Z + NaOH E + ...(4) ot E + NaOH T + Na2CO3 (5) oCaO,t Công thức phân tử của X là : A. C12H20O6 B. C12H14O4 C. C11H10O4 D. C11H12O4
trong
C. 40,00%. D. 54,55%.
Câu 15: Cho sơ đồ phản ứng: 3 CHCOOH 6126 6104CHOXYTCHO
Nhận xét nào về các chất X,Y và T trong sơ đồ trên là đúng ?
A. Chất X không tan trong H2O.
B. Nhiệt độ sôi của T nhỏ hơn nhiệt độ sôi của X.
C. Chất Y phản ứng được với KHCO3 tạo khí CO2
D. Chất T phản ứng được với Cu(OH)2 ở điều kiện thường (Đề thi thử THPT Quốc Gia lần 2– THPT chuyên Biên Hòa – Hà Nam, năm 2016)
Câu 16: Cho sơ đồ sau:
(1) X + H2 Y
(2) X + O2 Z
(3) Y + Z C4H4O4 + 2H2O
Các chất Y, Z là
A. Y : CH3OH; Z : C2H2O4.
B. Y : C2H4(OH)2; Z : H2CO2. C. Y : C2H5OH; Z : C2H2O4. D. Y : C2H4(OH)2; Z : C2H2O4.
Câu 17: Khi cho chất hữu cơ A (có công thức phân tử C6H10O5 và không có nhóm CH2) tác dụng với NaHCO3 hoặc với Na thì số mol khí sinh ra luôn bằng số mol A phản ứng. A và các sản phẩm B, D tham gia phản ứng theo phương trình hóa học sau: A B + H2O (1) A + 2NaOH 2D + H2O(2) B + 2NaOH 2D(3) D + HCl E + NaCl (4) Tên gọi của E là A. axit acrylic. B. axit 2-hiđroxipropanoic. C. axit 3-hiđroxipropanoic. D. axit propionic. (Đề thi minh họa kì thi THPT Quốc Gia, năm 2015)
DẠYKÈMQUYNHƠN
15
OFFICIAL
Chất X Y Z T Nhiệt độ sôi
100,5 118,2 249,0 141,0 Nhận xét nào
? A.
Câu 18: Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: CH3COOH, C6H5COOH (axit benzoic), C2H5COOH, HCOOH và giá trị nhiệt độ sôi được ghi trong bảng sau:
(°C)
sau đây là đúng
Y là CH3COOH. B. Z là HCOOH. C. X là C2H5COOH. D. T là C6H5COOH.
(Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Nguyễn Huệ – Hà Nội, năm 2016)
Câu 19: Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất sau ở dạng dung dịch nước: X, Y, Z, E, F Chất
X Y Z E F
Thuốc thử
Dung dịch NaHCO3 Không sủi bọt khí Không sủi bọt khí Sủi bọt khí Không sủi bọt khí Không sủi bọt khí
Dung dịch AgNO3/NH3 đun nhẹ
Không có kết tủa Ag Ag Không có kết tủa Không có kết tủa
OFFICIAL
Cu(OH)2 lắc nhẹ Cu(OH)2 không tan Dung dịch xanh lam Dung dịch xanh lam Dung dịch xanh lam Cu(OH)2 không tan Nước brom Không có kết tủa Không có kết tủa Không có kết tủa Không có kết tủa có kết tủa
Các chất X, Y, Z, E, F lần lượt là
A. etyl axetat, glucozơ, axit fomic, glixerol, phenol.
B. etyl axetat, glucozơ, axit axetic, etylen glicol, anilin.
C. etyl format, glucozơ, axit formic, glixerol, anilin.
D. etyl axetic, fructozơ, axit formic, ancol etylic, phenol. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Đại học Vinh, năm 2016) Câu 20: Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất X, Y, Z, T ở dạng dung dịch với dung môi nước: Thuốc thử
DẠYKÈMQUYNHƠN
16
Chất
Dung
3
Không có kết tủa Ag↓ Không
Cu(OH)2, lắc nhẹ Cu(OH)2 không tan Dung
Dung
Mất
X Y Z T
dịch AgNO3/NH
, đun nhẹ
có kết tủa Ag↓
dịch xanh lam
dịch xanh lam Dung dịch xanh lam Nước brom
màu nước brom và có kết tủa trắng xuất hiện Mất màu nước brom Không mất màu nước brom Không mất màu nước brom Các chất X, Y, Z, T lần lượt là: A. Phenol, axit fomic, saccarozơ, glucozơ.
B. Anilin, glucozơ, glixerol, frutozơ.
C. Anilin, glucozơ, etanol, axit acrylic.
D. Phenol, glucozơ, glixerol, mantozơ. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Đại học Vinh, năm 2016) Câu 21: X, Y, Z, T là một trong những chất hữu cơ sau: HCHO, CH3CHO, HCOOH, CH3COOH. Cho bảng số liệu sau: Chất X Y Z T Độ tan trong H2O ở 25oC ∞ tan tốt ∞ tan tốt Nhiệt độ sôi (oC) 21 100,7 118,1 -19 Nhận định đúng là A. Y là HCOOH. B. T là CH3CHO. C. X là HCHO. D. Z là CH3COOH Câu 22: Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất sau ở trạng thái lỏng (nguyên chất hoặc dung dịch nước): X, Y, Z, T và Q Chất Thuốc thử X Y Z T Q Dung dịch AgNO3/NH3, đun nhẹ Không có kết tủa Không có kết tủa Không có kết tủa Không có kết tủa Ag Dung dịch NaOH - - - + -
KMnO4/H2O
mất màu ở điều kiện thường -
mất màu ở điều kiện thường Chú thích : (-) không có phản ứng; (+) có phản ứng Các chất X, Y, Z, T và Q lần lượt là A. Isopren, metyl acrylat, p-xilen, axit fomic, fructozơ. B. Vinylaxetylen, fructozơ, o-xilen, metylacrylat, anđehit fomic.
3- metylbut-1-in, hexametylenđiamin, m-xilen, phenol, metanal.
Pen-2-en, benzen, toluen, axit axetic, axetanđehit.
DẠYKÈMQUYNHƠN
17
OFFICIAL
C.
D.
mất màu khi đun nóng C.
không mất màu ở điều kiện thường ÁN VÀ HƯỚNG DẪN TRẢ LỜI 1D 2A 3B 4A 5C 6C 7C 8C 9B 10B 11B 12A 13B 14C 15D 16D 17B 18A 19A 20B 21D 22D Câu 6: Đặt công thức phân tử của phenolphtalein là (C10H7O2)n. Theo giả thiết ta thấy tổng số liên kết π và vòng của nó là : 2.10n7n2 k 341114n2 2 Vậy công thức phân tử phenolphtalein là C20H14O4. Câu 7: Đặt công thức của A là (HO)nR(COOH)m. Phương trình phản ứng :
ĐÁP
Câu 9: X1, X2, X3 lần lượt là HCHO, HCOOH, HCOONH4. Y là (NH4)2CO3. Câu 10: Theo giả thiết suy ra X,Y,Z lần lượt là : CH3CH2CH2OH; CH3COOH; HOCH2CHO
Câu 11: Từ giả thiết suy ra X là (HCOO)3C3H5. Vậy có 2 ý đúng là (3), (5).
Câu 12: Từ giả thiết suy ra X là CH3COOC6H4COOH. Vậy có 1 phát biểu đúng là (d).
Câu 13: Ankan đơn giản nhất là CH4. Suy ra Y là CH3COONa, không thể là CH2(COONa)2 vì X đơn chức; T là CH3COOH; Z là CH3CHO, không thể là C2H5OH vì khi đó Z tác dụng được với Na; X là CH3COOCH=CH2. Vậy CtrongX 12.4 %m 55,81% 86 Câu 14: Từ phản ứng (3), (4), (5) suy ra : Z là CH3COONH4, E là CH3COONa, T là CH4. Từ (2) suy ra Y là CH2(COONa)2. Từ (1) suy ra X là C6H5OOCCH2COOCH=CH2. Vậy công thức phân tử của X là C11H10O4. Phương trình phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 18 2 2 n m 3 n m
2 n m n m 2 CO
H
2
2 2
(HO)R(COOH)mNaHCO(HO)R(COONa)mCOmHO mn (HO)R(COOH)(mn)Na(NaO)R(COONa) H 2 n2m3m3 AlaHOOCCHC(OH)(COOH)CHCOOH.nmn2n1
Câu 8: Giải thích : 25 24 32 24 axitañipic etylisopropylañipat XlaCHOOC[CH]COOCH(CH);YlaHOOC[CH]COOH.

DẠYKÈMQUYNHƠN OFFICIAL 19 o o 65 2 2 X 65 3 2 22 Y CaO,t 2 2 4 23 Y T t 3 3 32 3 4 43 Z 3 4 Z CHOOCCHCOOCHCH3NaOH CHONaCHCHOCH(COONa)HO CH(COONa)2NaOH CH2NaCO CHCHO2AgNO3NHHOCHCOONH2Ag2NHNO CHCOONH o o t 3 3 E CaO,t 3 4 23 T E NaOHCHCOONaNH CHCOONaNaOH CHNaCO Câu 15: Từ sơ đồ suy ra X là C2H5OH; Y là C2H4; T là C2H4(OH)2; C6H10O4 là (CH3COO)2C2H4 Vậy nhận xét “Chất T phản ứng được với Cu(OH)2 ở điều kiện thường” là đúng. Câu 16: Từ sơ đồ suy ra : C4H4O4 là (COOCH2)2. X là (CHO)2; Y là (CH2OH)2; Z là (COOH)2. Câu 17: Theo giả thiết : 3 6105 2 NaHCOhoacNa Akhí 2 AcocongthöcphantöCHO,khongconhomCH A nn A2NaOH2DHO 3 3 3 3 axit2hiñroxipropanoic AlaHOCH(CH)COOCH(CH)COOHmotchöcaxitCOOH AcomotchöcesteCOODlaHOCH(CH)COONa motchöcOH ElaHOCH(CH)COOH
20
DẠYKÈMQUYNHƠN OFFICIAL
1. Nguyên tắc chung để nhận biết ion Để nhận biết một ion trong dung dịch, người ta thêm vào dung dịch đó một thuốc thử tạo với ion đó một sản phẩm đặc trưng như : một chất kết tủa, một hợp chất có màu hoặc một chất khí khó tan sủi bọt, bay khỏi dung dịch.
kết tủa trắng hơi xanh
kết tủa màu xanh
kết tủa trắng keo, sau đó kết tủa tan hết
kết tủa trắng keo, sau đó kết tủa tan hết
kết tủa lục xám, sau đó kết tủa tan hết
Quỳ tím hóa xanh
kết tủa màu trắng
kết tủa màu vàng
kết tủa màu vàng đậm
kết tủa trắng không tan trong axit
DẠYKÈMQUYNHƠN OFFICIAL 1
CHUYÊN ĐỀ 11 : XÁC ĐỊNH VÀ NHẬN BIẾT CHẤT VÔ CƠ A. TÓM TẮT LÝ THUYẾT I. Nhận biết ion
2. Nhận biết một số ion Ion Thuốc thử Phương trình phản ứng Hiện
H Quỳ tím Quỳ tím
đỏ 4NH o OHdö (t) ot 4 3 2 NHOHNHHO Giải phóng khí mùi
xanh
2Mg OHdö 2 2Mg2OHMg(OH) Tạo
tan 2Fe OHdö 2 2Fe2OHFe(OH) Tạo
3Fe OHdö 3 3Fe3OHFe(OH) Tạo
2Cu OHdö 2 2Cu2OHCu(OH) Tạo
2Zn
2 2 2 2 2 2 Zn2OHZn(OH) Zn(OH)2OHZnO2HO
3Al OHdö 3 3 3 2 2 Al3OHAl(OH) Al(OH)OHAlO2HO
3Cr OHdö 3 3 3 2 2 Cr3OHCr(OH) Cr(OH)OHCrO2HO
OH Quỳ tím
ClAg ClAgAgCl Tạo
BrAg BrAgAgBr Tạo
I Ag IAgAgI Tạo
2 4SO 2Ba 2 2 4 4SOBaBaSO Tạo
tượng
hóa
khai, làm
giấy quỳ tím ẩm
kết tủa trắng không
kết tủa nâu đỏ
OHdö
Tạo
Tạo
Tạo
phóng khí không màu, không mùi
Giải phóng khí không màu hóa nâu trong không khí
II. Nhận biết khí
1. Nguyên tắc chung để nhận biết chất khí Để nhận biết một chất khí người ta có thể dựa vào tính chất vật lý hoặc tính chất hóa học đặc trưng của nó. 2. Nhận biết một số khí a. Nhận biết dựa vào tính chất vật lý
DẠYKÈMQUYNHƠN OFFICIAL 2 2 2 Ba hoacCa 2 2 3 3 2 2 3 3 BaSOBaSO CaSOCaSO Tạo
Hdö 2 3 2 22HSOHOSO Giải
2 3SO 2 Br(dd) 2 2 3 22 4 SOBrHOSO2HBr Dung
2 2 Ba hoacCa 2 2 3 3 2 2 3 3 COBaBaCO COCaCaCO Tạo
2 3CO Hdö 2 3 2 22HCOHOCO Giải
3 4 POAg 3 4 34POAgAgPO Tạo
2S 2Pb 2 2 SPbPbS
3 NOCuH 3 2 2 2 2 2NO3Cu8H 3Cu2NO4HO 2NO2ONO
kết tủa trắng tan trong axit
phóng khí không màu, mùi hắc
dịch Br2 bị mất màu
kết tủa trắng tan trong axit
kết tủa vàng
Tạo kết tủa đen
2
2
2
Là khí độc 3NH Không màu Mùi khai 2NO Màu nâu đỏ Mùi hắc Là khí độc 2Cl Màu vàng lục Mùi hắc Là khí độc b. Nhận biết dựa vào tính chất hóa học Khí Thuốc thử Phương trình phản ứng Hiện tượng 2CO 2 2 Ba(OH)(dd) hoacCa(OH) 2 2 3 2 2 2 3 2 COBa(OH)BaCOHO COCa(OH)CaCOHO Tạo kết tủa trắng 2 2 Ba(OH)(dd) hoacCa(OH) 2 2 3 2 2 2 3 2 SOBa(OH)BaSOHO SOCa(OH)CaSOHO Tạo kết tủa trắng
Khí Màu sắc Mùi Ghi chú
CO Không màu Không mùi
SO Không màu Mùi hắc Là khí độc
HS Không màu Mùi trứng thối
kết tủa đen không tan trong axit
Tạo khí hóa nâu ngoài không khí B. HỆ THỐNG CÂU HỎI
I. Xác định chất
Mức độ thông hiểu Câu 1: Chất rắn X màu đỏ thẫm tan trong nước thành dung dịch màu vàng. Một số chất như S, P, C, C2H5OH… bốc cháy khi tiếp xúc với X. Chất X là A. P. B. Fe2O3. C. CrO3. D. Cu. (Đề thi minh họa kỳ thi THPT Quốc Gia, năm 2015)
Câu 2: Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có chứa khí nào sau đây?
A. NH3 B. CO2 C. H2S. D. SO2 Câu 3: Khí nào sau đây có trong không khí đã làm cho đồ dùng bằng bạc lâu ngày bị xám đen ?
A. H2S. B. SO2. C. SO3. D. O2. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Hạ Long – Quảng Ninh, năm 2016)
Câu 4: Trong thành phần của khí than ướt và khí than khô (khí lò gas) đều có khí X (không màu, không mùi, độc). X là khí nào sau đây?
A. CO2. B. CO. C. NH3. D. H2S. Câu 5: Cho Fe tác dụng với dung dịch H2SO4 loãng tạo thành khí X; nhiệt phân tinh thể KNO3 tạo thành khí Y; cho tinh thể KMnO4 tác dụng với dung dịch HCl đặc tạo thành khí Z. Các khí X, Y và Z lần lượt là
A. H2, O2 và Cl2 B. SO2, O2 và Cl2 C. Cl2, O2 và H2S. D. H2, NO2 và Cl2. Câu 6: Chất X tan trong nước và tác dụng được với dung dịch H2SO4 loãng. Chất X là chất nào sau đây?
DẠYKÈMQUYNHƠN OFFICIAL 3 2SO 2 Br(dd) 222 24SOBrHO2HBrHSO
2 HS 2 2 Pb hoacCu 2 2 2 2 HSPbPbS2H HSCuCuS2H
3NH
2
Dung dịch Br2 bị mất màu
Tạo
Giấy quỳ tím ẩm Quỳ tím chuyển sang màu xanh NO Không khí
22NOO2NO
TRẮC NGHIỆM
●
B.
(Đề thi
Câu 7: Nhỏ từ từ dung dịch
dư
xảy ra hoàn toàn chỉ thu được
CuSO4. B.
3.
(Đề thi thử THPT
8: Cho từ từ tới dư
X
A. FeS.
PbS. C. Na2S. D. CuS.
thử THPT Quốc Gia – Sở GD và ĐT Bắc Giang, năm 2016)
NaOH đến
vào dung dịch X. Sau khi các phản ứng
dung dịch trong suốt. Chất tan trong dung dịch X là A.
AlCl
C. Fe(NO3)3. D. Cu.
Quốc Gia lần 1 – THPT Long Phu – Vĩnh Long, năm 2016) Câu
dung dịch chất X vào dung dịch AlCl3, thu được kết tủa keo trắng. Chất
là:
A. HCl. B. NH3. C. NaOH. D. KOH. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên ĐHSP Hà Nội, năm 2016)
Câu 9: Chất Z có phản ứng với dung dịch HCl, còn khi phản ứng với dung dịch nước vôi trong tạo ra chất kết tủa. Chất Z là
A. NaHCO3. B. CaCO3. C. Ba(NO3)2. D. AlCl3. Câu 10: Chất X tác dụng với dung dịch HCl. Khi chất X tác dụng với dung dịch Ca(OH)2 sinh ra kết tủa. Chất X là
A. Ca(HCO3)2. B. BaCl2. C. CaCO3. D. AlCl3. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Hà Giang, năm 2016) Câu 11: Cho dung dịch NaOH vào dung dịch muối clorua X, lúc đầu thấy xuất hiện kết tủa màu trắng hơi xanh, sau đó chuyển sang màu nâu đỏ. Công thức của X là :
A. FeCl3. B. FeCl2. C. CrCl3. D. MgCl2. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên ĐHSP Hà Nội, năm 2016)
OFFICIAL
Câu 12: Cho dung dịch AgNO3 tác dụng với dung dịch chứa chất X thấy tạo kết tủa T màu vàng. Cho kết tủa T tác dụng với dung dịch HNO3 dư thấy kết tủa tan. Chất X là
A. KCl. B. KBr. C. KI. D. K3PO4.
Câu 13: Các chất khí X, Y, Z, R, T lần lượt được tạo ra từ các quá trình phản ứng sau:
(1) Thuốc tím tác dụng với dung dịch axit clohiđric đặc.
(2) Sắt sunfua tác dụng với dung dịch axit clohiđric
(3) Nhiệt phân kali clorat, xúc tác mangan đioxit.
(4) Nhiệt phân quặng đolomit.
(5) Đốt quặng pirit sắt. Số chất khí tác dụng được với dung dịch KOH là : A. 2. B. 5. C. 4 D. 3. (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên KHTN Hà Nội, năm 2016) ● Mức độ vận dụng
Câu 14: Hỗn hợp bột (chứa 2 chất có cùng số mol) nào sau đây không tan hết khi cho vào lượng dư dung dịch H2SO4 (loãng nóng, không có oxi) ? A. Fe3O4 và Cu. B. KNO3 và Cu. C. Fe và Zn. D. FeCl2 và Cu. (Đề thi thử THPT Quốc Gia lần 5 – THPT chuyên KHTN Hà Nội, năm 2016) Câu 15: Hợp chất X
DẠYKÈMQUYNHƠN
4
có các
sau: (1) Là chất có tính lưỡng
(2) Bị phân hủy khi
(3) Tác dụng với dung dịch
4 cho sản phẩm có chất
Vậy chất X là: A. NaHS B. KHCO3. C. Al(OH)3. D.
3
2. (Đề thi thử THPT
–
tính chất
tính.
đun nóng.
NaHSO
kết tủa và chất khí.
Ba(HCO
)
Quốc Gia lần 2
THPT chuyên Đại học Vinh, năm 2016)
Câu 16: Nghiên cứu một dung dịch chứa chất tan X trong lọ không dán nhãn và thu được kết quả sau:
- X đều có phản ứng với cả 3 dung dịch: NaHSO4, Na2CO3 và AgNO3
- X không phản ứng với cả 3 dung dịch: NaOH, Ba(NO3)2, HNO3.
Vậy dung dịch X là dung dịch nào sau đây?
A. Dung dịch Mg(NO3)2.
C. Dung dịch BaCl2.
B. Dung dịch FeCl2.
D. Dung dịch CuSO4. (Đề thi thử THPT Quốc Gia – Sở GD và ĐT Quảng Nam, năm 2016)
Câu 17: Ba dung dịch X, Y, Z thỏa mãn các điều kiện sau:
- X tác dụng với Y thì có kết tủa xuất hiện.
- Y tác dụng với Z thì có kết tủa xuất hiện.
- X tác dụng với Z thì có khí thoát ra.
X, Y, Z lần lượt là
A. Al2(SO4)3, BaCl2, Na2SO4. B. FeCl2, Ba(OH)2, AgNO3.
C. NaHCO3, NaHSO4, BaCl2. D. NaHSO4, BaCl2, Na2CO3. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Hạ Long – Quảng Ninh, năm 2016)
OFFICIAL
Câu 18: X, Y, Z là các dung dịch muối (trung hòa hoặc axit) ứng với 3 gốc axit khác nhau, thỏa mãn điều kiện: X tác dụng với Y có khí thoát ra; Y tác dụng với Z có kết tủa; X tác dụng với Z vừa có khí vừa tạo kết tủa. X, Y, Z lần lượt là A. NaHSO4, CaCO3, Ba(HSO3)2. B. NaHSO4, Na2CO3, Ba(HSO3)2. C. CaCO3, NaHSO4, Ba(HSO3)2. D. Na2CO3; NaHSO3; Ba(HSO3)2. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Quốc Học Huế, năm 2016) Câu 19: Chất vô cơ X trong thành phần chỉ có 2 nguyên tố. X không tan được vào H2O và dung dịch HCl. Đốt cháy X trong O2 ở nhiệt độ cao được khí Y. Khí Y tác dụng với dung dịch brom được chất Z. Z phản ứng với dung dịch BaCl2 thu được chất Q. Q không tan được vào dung dịch HNO3. Các chất X, Y, Z theo thứ tự tương ứng là: A. Fe3C, CO, BaCO3 B. CuS, H2S, H2SO4 C. CuS, SO2, H2SO4. D. MgS, SO2, H2SO4. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Biên Hòa – Hà Nam, năm 2016) Câu 20: Các dung dịch riêng biệt : Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau:
DẠYKÈMQUYNHƠN
5
(1)
(2)
(4)
(5)
Dung dịch (1) (2) (4) (5)
khí thoát ra có kết tủa
khí thoát ra có kết tủa có kết tủa
có kết tủa có kết tủa
có kết tủa Các dung dịch (1), (3), (5) lần lượt là: A. H2SO4, NaOH, MgCl2. B. Na2CO3, NaOH, BaCl2. C. H2SO4, MgCl2, BaCl2. D. Na2CO3, BaCl2, BaCl2.
(Đề thi thử THPT Quốc Gia lần 1 – Sở Giáo Dục và Đào Tạo Vĩnh Phúc, năm 2016)
Câu 21: Bốn kim loại Na, Al, Fe và Cu được ấn định không theo thứ tự X, Y, Z, T. Biết: X, Y được điều chế bằng phương pháp điện phân nóng chảy; X đẩy được kim loại T ra khỏi dung dịch muối; Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội. X, Y, Z, T lần lượt là: A. Na; Fe; Al; Cu. B. Na; Al; Fe; Cu. C. Al; Na; Cu; Fe. D. Al; Na; Fe; Cu. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lê Khiết – Quảng Ngãi, năm 2016)
Câu 22: Có 3 kim loại X, Y, Z thỏa mãn các tính chất sau:
- X tác dụng với HCl, không tác dụng với NaOH và HNO3 đặc, nguội.
- Y tác dụng được với HCl và HNO3 đặc nguội, không tác dụng với NaOH.
- Z tác dụng được với HCl và NaOH, không tác dụng với HNO3 đặc nguội. Vậy X, Y, Z lần lượt là
OFFICIAL
A. Zn, Mg, Al. B. Fe, Mg, Al. C. Fe, Al, Mg. D. Fe, Mg, Zn. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Lê Quý Đôn – Đà Nẵng, năm 2016)
Câu 23: Axit X là hóa chất quan trọng bậc nhất trong nhiều ngành sản xuất như phân bón, luyện kim, chất dẻo, acqui, chất tẩy rửa... Ngoài ra trong phòng thí nghiệm, axit X được dùng làm chất hút ẩm. Axit X là : A. HCl. B. H3PO4. C. HNO3. D. H2SO4. (Đề thi thử THPT Quốc Gia lần 5 – THPT chuyên KHTN Hà Nội, năm 2016) Câu 24: Bốn kim loại K, Al, Fe và Ag được ấn định không theo thứ tự là X, Y, Z, và T. Biết rằng X và Y được điều chế bằng phương pháp điện phân nóng chảy; X đẩy được kim loại T ra khỏi dung dịch muối; Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội. Các kim loại X, Y, Z, và T theo thứ tự là A. K, Al, Fe và Ag. B. Al, K, Ag và Fe. C. K, Fe, Al và Ag. D. Al, K, Fe, và Ag. (Đề thi thử THPT Quốc Gia lần 2 – THPT Lê Xoay – Vĩnh Phúc, năm 2016) Câu 25: Hợp chất X có các tính chất :
(1) Là chất khí ở nhiệt độ thường, nặng hơn không khí.
Làm nhạt màu dung dịch thuốc tím.
Bị hấp thụ bởi
DẠYKÈMQUYNHƠN
6
+
+
(2)
(3)
dung dịch Ba(OH)2 dư tạo kết tủa trắng. X là chất nào trong các chất sau : A. NO2. B. SO2. C. CO2. D. H2S. (Đề thi thử THPT Quốc Gia lần 7 – THPT Nguyễn Thái Học – Khánh Hòa, năm 2016) Câu 26: Cho các phản ứng sau: (1) (A)
HCl MnCl2 + (B)↑ + H2O (2) (B) + (C) nước gia-ven (3) (C)
HCl (D) + H2O (4) (D) + H2O (C) + (B)↑+ (E)↑
Khí E là chất nào sau đây?
A. O2. B. H2. C. Cl2O. D. Cl2. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm 2016)
II. Nhận biết chất
● Mức độ vận dụng Câu 1: Có 4 chất bột màu trắng: bột vôi sống, bột gạo, bột thạch cao và bột đá vôi. Chỉ dùng một chất có thể nhận biết ngay được bột gạo là A. dung dịch H2SO4 B. dung dịch Br2 C. dung dịch I2 D. dung dịch HCl. (Đề thi thử THPT Quốc Gia lần 2 – THPT Nguyễn Trãi – Thanh Hóa, năm 2016) Câu 2: Một mẫu khí thải công nghiệp có nhiễm các khí H2S, CO, CO2. Để nhận biết sự có mặt của H2S trong mẫu khí thải đó, ta dùng dung dịch: A. Pb(CH3COO)2 B. KCl. C. NaCl. D. NaNO3. (Đề thi thử THPT Quốc Gia lần 1 – THPT Trần Phú – Đà Nẵng, năm 2016) Câu 3: Trong các dung dịch sau: Ca(OH)2, BaCl2, Br2, H2S. Số dung dịch có thể dùng để phân biệt được 2 khí CO2 và SO2 là A. 1. B. 4. C. 2. D. 3. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lê Khiết – Quảng Ngãi, năm 2016) Câu 4: Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây? A. Zn, Al2O3, Al. B. Mg, K, Na. C. Mg, Al2O3, Al. D. Fe, Al2O3, Mg. (Đề thi thử THPT Quốc Gia lần 1 – THPT Lê Lợi – Thanh Hóa, năm 2016) Câu 5: Để phân biệt 2 dung dịch Fe(NO3)2 và FeCl2 người ta dùng dung dịch ? A. HCl. B. NaCl. C. NaOH. D. NaNO3. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lam Sơn – Thanh Hóa, năm 2016) Câu 6: Có thể phân biệt 3 dung dịch : KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là A. Al. B. Zn. C. BaCO3. D. giấy quỳ tím. (Đề thi thử THPT Quốc Gia – Sở GD và ĐT Thanh Hóa, năm 2016) Câu 7: Để phân biệt các dung dịch riêng biệt: NaCl, MgCl2, AlCl3, FeCl3, có thể dùng dung dịch A. HCl. B. Na2SO4. C. NaOH. D. HNO3. (Đề thi minh họa kỳ thi THPT Quốc Gia, năm 2017) Câu 8: Có bốn dung dịch chứa trong các lọ mất nhãn: AlCl
OFFICIAL
DẠYKÈMQUYNHƠN
7
4HCO3. Có
thuốc
.
3, NH4NO3, K2CO3, NH
thể dùng một thuốc thử duy nhất để phân biệt bốn dung dịch trên. Dung dịch
thử đó là: A. HCl. B. Quỳ tím. C. AgNO3 D. Ba(OH)2
(Đề thi thử THPT Quốc Gia lần 1 – THPT Thanh Oai – Hà Nội, năm 2016)
Câu 9: Để nhận biết các dung dịch muối (đựng riêng biệt trong các ống nghiệm): Al(NO3)3, (NH4)2SO4, NH4NO3, MgCl2 có thể dùng dung dịch
A. NaOH. B. Ba(OH)2 C. BaCl2 D. AgNO3 (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Tuyên Quang, năm 2016)
● Mức độ vận dụng cao
Câu 10: Có các kim loại riêng biệt sau: Na, Mg, Al, Ba. Để phân biệt các kim loại này chỉ được dùng thêm dung dịch hoá chất nào sau đây?
A. Dung dịch HCl.
B. Dung dịch NaOH rất loãng. C. Dung dịch Na2CO3. D. Nước. (Đề thi thử THPT Quốc Gia – Sở GD và ĐT Quảng Nam, năm 2016)
Câu 11: Bằng phương pháp hóa học, có thể phân biệt 3 dung dịch không màu: HCl loãng, KNO3, Na2SO4 đựng trong 3 lọ mất nhãn chỉ với thuốc thử là
A. Quỳ tím. B. dung dịch Na2CO3 C. dung dịch BaCl2 D. Bột Fe.
Câu 12: Để nhận biết dung dịch H2SO4, HCl, NaOH, K2SO4 phải dùng 1 thuốc thử duy nhất nào?
OFFICIAL
A. Qùy tím. B. Ba(HCO3)2. C. Dung dịch NH3. D. BaCl2. (Đề thi thử THPT Quốc Gia lần 1 – THPT Quỳnh Lưu 1 – Nghệ An, năm 2016)
Câu 13: Cho các dung dịch: Na2CO3, Na2SO3, Na2SO4, Na2S. Số thuốc thử tối thiểu cần để phân biệt các chất trên là:
A. 1. B. 4. C. 2. D. 3. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Biên Hòa – Hà Nam, năm 2016)
Câu 14: Để nhận biết 4 cốc nước: cốc 1 chứa nước cất, cốc 2 chứa nước cứng tạm thời, cốc 3 chứa nước cứng vĩnh cửu, cốc 4 chứa nước cứng toàn phần. Có thể làm bằng cách là: A. chỉ dùng dung dịch HCl.
B. đun sôi nước, dùng dung dịch Na2CO3 C. chỉ dùng Na2CO3
D. đun sôi nước, dùng dung dịch NaCl.
(Đề thi thử THPT Quốc Gia – Sở GD và ĐT Thanh Hóa, năm 2016)
Câu 15: Chỉ dùng CO2 và H2O nhận biết được bao chất bột trắng (trong các lọ không nhãn) trong số các chất sau: NaCl, Na2CO3, Na2SO4, BaCO3, BaSO4 A. 2.B. 4. C. 5. D. 3.
DẠYKÈMQUYNHƠN
8
riêng biệt, mất nhãn: NaCl, HCl, NaHSO4, Na2CO3 là A. KNO3. B. NaOH. C. BaCl2. D. NH4Cl. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Đại học Vinh, năm 2016) C. ĐÁP ÁN VÀ HƯỚNG DẪN TRẢ LỜI I. Xác định chất 1C 2C 3A 4B 5A 6C 7B 8B 9A 10A 11B 12D 13C 14D 15D 16C 17D 18B 19C 20A 21D 22B 23D 24D 25B 26B
(Đề thi thử THPT Quốc Gia lần 3 – THPT Quỳnh Lưu 1 – Nghệ An, năm 2016) Câu 16: Thuốc thử dùng để phân biệt các dung dịch
DẠYKÈMQUYNHƠN OFFICIAL 9 Câu 1: X là CrO3. Câu 2: Từ giả thiết suy ra khí thải nhà máy có chứa H2S. Phương trình phản ứng : 322 3Pb(NO)HSPbS2HNO Câu 3: Khí có trong không khí đã làm cho đồ dùng bằng bạc lâu ngày bị xám đen là H2S. Phương trình phản ứng : 2 2 2 2 mauñen 4AgO2HS2AgS2HO Câu 4: Khí X là CO. Thành phần của các loại khí than : 22 22Khíthanöôt:CO,CO,H;khíthankho:CO,CO,O Câu 5: Phương trình phản ứng : o 24loang 42 khíX t 3 22 khíY 4 ñac 2 2 2 khíZ FeHSO FeSOH 2KNO2KNOO 2KMnO16HCl5Cl2KCl2MnCl8HO Câu 6: Chỉ cần sử dụng giả thiết X tan được trong nước và đáp án là có thể xác định được X là Na2S. Phương trình phản ứng của X với H2SO4 loãng : 2 24 242 NaSHSONaSOHS Câu 7: Từ giả thiết suy ra X là dung dịch AlCl3. Phương trình phản ứng : 3 3 löôngtính 3 2 2 muoitan 3NaOHAlClAl(OH)NaCl NaOHAl(OH)NaAlO2HO Dung dịch trong suốt chứa NaOH và NaAlO2. Câu 8: Theo giả thiết suy ra X là NH3. Phương trình phản ứng : 3 4 3 3 2 3 4 Al3Cl NHOH AlCl3NH3HOAl(OH)3NHCl Câu 9: Theo giả thiết suy ra Z là NaHCO3. Phương trình phản ứng : 3 2 2 3 2 3 2 NaHCOHClNaClCOHO NaHCOCa(OH)NaOHCaCOHO Câu 10: Theo giả thiết suy ra Z là Ca(HCO3)2. Phương trình phản ứng : 32 2 2 2 32 2 3 2 Ca(HCO)2HClCaCl2CO2HO Ca(HCO)Ca(OH)2CaCO2HO Câu 11: X là FeCl2. Phương trình phản ứng :
Trong 5 khí trên thì có 4 khí phản ứng được với dung dịch KOH là Cl2, H2S, CO2 và SO2. Câu 14: Hỗn hợp bột (chứa 2 chất có cùng số mol) không tan hết khi cho vào lượng dư dung dịch H2SO4 (loãng nóng, không có oxi) là FeCl2 và Cu. Các hỗn hợp còn lại đều có thể tan hết trong H2SO4 (loãng nóng, không có oxi). Bản chất phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 10 2 2 tranghôixanh 22 2 3 nauño FeCl2NaOHFe(OH)2NaCl 4Fe(OH)O2HO4Fe(OH) Câu 12: X là K3PO4, phản ứng tạo kết tủa : 334 34 3 mauvang AgNOKPOAgPO3KNO Câu 13: Phương trình phản ứng : o 2 o o 4 2 2 2 X 22 Y MnO,t 3 2 Z t 3 3 2 R t 2 2 23 2 T 2KMnO16HCl2KCl2MnCl5Cl8HO FeS2HClFeClHS 2KClO 2KCl3O CaCO.MgCOCaO.MgO2CO 4FeS11O2FeO8SO
2 3 2 amol 2a mol 3 3 2 34 2 2amol amol 3 2 2 2amolamol 2 2 2 2 3Cu2NO8H3Cu2NO4HO FeO8H2FeFe4HO 2FeCu2FeCu Fe2HFeH Zn2HZnH Câu 15: X là Ba(HCO3)2. Phương trình phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 11 o 32 2 2 2 32 3 23 2 t 32 3 2 2 32 4 4 24 2 2 Ba(HCO)2HClBaCl2CO2HO (1) Ba(HCO)2NaOHBaCONaCO2HO (2)Ba(HCO)BaCOCOHO (3)Ba(HCO)2NaHSOBaSONaSO2CO2HO Câu 16: Dựa vào giả thiết và đáp án ta thấy X là dung dịch BaCl2. Phương trình phản ứng : 2 2 4 2 4 4 Ba2ClNaHSO 2 23 3 2 3 32 BaClNaHSOBaSONaClHCl BaClNaCOBaCO2NaCl BaCl2AgNOBa(NO)2AgCl Câu 17: X, Y, Z lần lượt là NaHSO4, BaCl2, Na2CO3. Phương trình phản ứng : 4 2 4 2 23 3 4 23 24 2 2 NaHSOBaClBaSONaClHCl BaClNaCOBaCO2NaCl 2NaHSONaCO2NaSOCOHO Câu 18: X, Y, Z lần lượt là NaHSO4, Na2CO3, Ba(HSO3)2. Phương trình phản ứng: 4 23 24 2 2 X Y 23 32 3 3 Y Z 4 32 4 24 2 2 X Z 2NaHSONaCO2NaSOCOHO NaCOBa(HSO)BaCO2NaHSO 2NaHSOBa(HSO)BaSONaSO2SO2HO Câu 19: X, Y, Z lần lượt là CuS, SO2, H2SO4. Phương trình phản ứng : ot 2 2 X Y 222 24 Y Z 24 2 4 Z Q 2CuS3O2CuOSO SOBrHOHSO2HBr HSOBaClBaSO2HCl Câu 20: Từ bảng kết quả thí nghiệm, ta thấy (1), (3), (5) lần lượt là H2SO4, NaOH, MgCl2. Thật vậy :
DẠYKÈMQUYNHƠN OFFICIAL 12 24 23 24 2 2 24 24 2 4 2324 2 2 24 23 23 2 3 23 2 3 2 2 HSONaCONaSOCOHO dd(1)laHSO:
BaCl dd(4)laBaCl: 23 3 224 3 2 2 23 3 NaCOBaCO2NaCl BaClHSOBaSO2NaCl dd(5)laMgCl:MgClNaCOMgCO2NaCl
Câu 21: Từ giả thiết, ta thấy X, Y, Z, T lần lượt là Al; Na; Fe; Cu. Phương trình phản ứng minh họa : o ñpnc 23 2 criolit X ñpnc 2 Y 2 3 X T t 24ñac 243 22 Z 24ñacnguoi Z 2AlO 4Al3O 2NaCl2NaCl 2Al3Cu2Al3Cu FeHSO Fe(SO)SOHO FeHSO Câu 22: Từ giả thiết suy ra X, Y, Z lần lượt là Fe, Mg, Al. Câu 23: Từ giả thiết suy ra X là H2SO4. Câu 24: Từ giả thiết suy ra X, Y, Z, T lần lượt là Al, K, Fe, và Ag. Câu 25: Khí X là SO2. Chứng minh : 2SO khongkhí 2 4 2 24 4 24 2 2 3 2 MM 5SO2KMnO2HOKSO2MnSO2HSO SOBa(OH)BaSOHO Câu 26: Phương trình phản ứng :
HSOBaClBaSO2HCl NaCOHSOCOHONaSO dd(2)laNaCO:NaCOBaClBaCO2NaCl NaCOMgClMgCO2NaCl
Conlaidd(3)laNaOH
DẠYKÈMQUYNHƠN OFFICIAL 13 2 22 2 B 2 2 C B nöôcGiaVen 2 D C ñpdd 2 2 2 comangngan D E B MnO4HClMnClCl2HO Cl2NaOHNaClNaClOHO NaOHHClNaClHO 2NaCl2HO 2NaOHHCl II. Nhận biết chất 1C 2A 3C 4C 5A 6C 7C 8D 9B 10C 11D 12B 13A 14B 15C 16C Câu 1: Thuốc thử để nhận biết ra bột gạo là dung dịch I2 : 2 botgaoIddmauxanhtím Câu 2: Để nhận biết sự có mặt của H2S ta dùng thuốc thử là Pb(CH3COO)2. Phản ứng tạo ra kết tủa màu đen : 3 22 3 Pb(CHCOO)HSPbS2CHCOOH Câu 3: Có 2 thuốc thử có thể phân biệt SO2 và CO2 là dung dịch Br2; dung dịch H2S. 2 2 2 2 mauvang 2 2 2 2 2 2 24 maudacam khongmau 2 2 2 maudacam ÑoivôithuocthöHS: 2HSSO3S2HO HSCO ÑoivôithuocthöBr: Br2HOSO2HBrHSO Br2HOCO Câu 4: Dùng dung dịch KOH có thể nhận biết nhóm chất Mg, Al2O3, Al. Chất Phương trình phản ứng Hiện tượng Mg MgNaOH Chất rắn không bị hòa tan. Al2O3 23 22 AlO2NaOH2NaAlOHO Chất rắn bị hòa tan, nhưng không giải phóng khí. Al 2 2 22Al2NaOH2HO2NaAlO3H Chất rắn bị hòa tan và giải phóng khí. Câu 5: Thuốc thử là dung dịch HCl. Dung dịch Phương trình phản ứng Hiện tượng
khí không màu và bị hóa nâu trong không khí.
kết tủa trắng không tan.
kết tủa màu nâu đỏ.
DẠYKÈMQUYNHƠN OFFICIAL 14 Fe(NO3)2 2 3 3 2 khongmau 3FeNO4H3FeNO2HO 2 2 maunau 2NOO2NO
FeCl2 2 FeHCl Không
Câu 6: Thuốc thử cần dùng là BaCO3 Dung dịch Phương trình phản ứng Hiện
KOH 3 BaCOKOH Không
HCl 3 2 2 2 BaCO2HClBaClCOHO Tạo
H2SO4 (loãng) 324 4 2 2 BaCOHSOBaSOCOHO Tạo
Câu 7: Thuốc thử cần dùng là dung dịch
NaCl NaOHNaCl
2 2 2NaOHMgClMg(OH)2NaCl
AlCl
3 3 3 22 3NaOHAlClAl(OH)3NaCl NaOHAl(OH)NaAlO2HO
3 3 3NaOHFeClFe(OH)3NaCl Tạo
Câu 8: Dung dịch để phân biệt 4 dung dịch AlCl3, NH4NO3, K2CO3, NH4HCO3 là Ba(OH)2. Dung dịch Phương trình phản ứng Hiện tượng AlCl3 2 3 2 3 2 3 22 2 3Ba(OH)2AlCl3BaCl2Al(OH) Ba(OH)2Al(OH)Ba(AlO)4HO Tạo kết
sau đó kết tủa tan hết. NH4NO3 2 43 32 3 2 Ba(OH)2NHNOBa(NO)2NH2HO Tạo khí mùi khai. K2CO3 223 3 Ba(OH)KCOBaCO2KOH Tạo kết tủa trắng. NH4HCO3 2 43 3 3 2 Ba(OH)NHHCOBaCONH2HO Tạo kết tủa trắng
khí
Tạo
có hiện tượng xảy ra.
tượng
có hiện tượng xảy ra.
khí không màu, không mùi.
khí không màu, không mùi và kết tủa trắng.
NaOH : Dung dịch Phương trình phản ứng Hiện tượng
Không có hiện tượng xảy ra. MgCl2
Tạo
3
Tạo kết tủa trắng keo, sau đó kết tủa tan hết. FeCl3
tủa trắng keo,
và
mùi khai.
kết tủa trắng keo, sau đó kết tủa tan hết.
kết tủa trắng và khí mùi khai.
Kim loại tan, giải phóng khí và tạo kết tủa trắng.
Kim loại tan và giải phóng khí. Al 2 AlHO
Kim loại không tan. Mg 2 MgHO
Kim loại không tan. Như vậy ta đã nhận biết được 2 kim loại Ba, Na. Đối với Mg, Al ta đem cho phản ứng với dung dịch NaOH vừa thu được. Nếu thấy kim loại bị tan và giải phóng khí thì đó là Al. Nếu thấy kim loại không tan thì đó là Mg. Câu 11: Thuốc thử phân biệt 3 dung dịch HCl loãng, KNO3, Na2SO4 là Fe. Đầu tiên ta nhận biết được dung dịch HCl do có phản ứng tạo khí không màu H2 :
DẠYKÈMQUYNHƠN OFFICIAL 15 Câu
thử
.
Phương
ứng Hiện
Al(NO3)3 2 33 32 3 2 3 222 3Ba(OH)2Al(NO)3Ba(NO)2Al(OH) Ba(OH)2Al(OH)Ba(AlO)4HO Tạo
(NH4
2SO4 2 424 4 3 2 Ba(OH)(NH)SOBaSO2NH2HO Tạo
NH4
3 2 43 32 3 2 Ba(OH)2NHNOBa(NO)2NH2HO Tạo khí
MgCl2 2 2 2 2MgClBa(OH)Mg(OH)BaCl Tạo kết tủa trắng. Câu 10: Thuốc thử để nhận biết 4 kim loại Na, Mg, Al, Ba là dung dịch Na2CO3. Chất Phương trình phản ứng Hiện tượng Ba 2 22 2 23 3 Ba2HOBa(OH)H Ba(OH)NaCOBaCO2NaOH
9: Thuốc
cần dùng là Ba(OH)2
Dung dịch
trình phản
tượng
)
NO
mùi khai
2 2
Na
2Na2HO2NaOHH
. 22
Sau đó trộn dung dịch HCl với 2
ứng với Fe. Mẫu nào phản ứng tạo khí không màu hóa nâu thì xác định đó là KNO3, có phản ứng tạo khí không màu là Na2SO4. Phương trình phản ứng : 3 3 2 khongmau 2 2 maunau FeNO4HFeNO2HO 2NOO2NO Câu 12: Thuốc thử để nhận biết 4 dung dịch H2SO4, HCl, NaOH, K2SO4 là dung dịch Ba(HCO3)2. Dung dịch Phương trình phản ứng Hiện tượng
Fe2HClFeClH
dung dịch còn lại để tạo ra 2 mẫu thử mới và cho phản
H2SO4 24 32 4 2 2 HSOBa(HCO)BaSO2CO2HO Tạo khí và kết tủa. HCl 32 2 2 2 2HClBa(HCO)BaCl2CO2HO Tạo khí. NaOH 32 3 23 2 2NaOHBa(HCO)BaCONaCO2HO Tạo kết tủa. K2SO4 24 32 4 3KSOBa(HCO)BaSO2KHCO Tạo kết tủa. Như vậy ta đã nhận biết được H2SO4, HCl. Đối với 2 dung dịch còn lại, ta lấy HCl phản ứng với kết tủa tạo thành ở thí nghiệm trên. Nếu kết tủa tan và giải phóng khí, suy ra đó là BaCO3 và dung dung dịch ban đầu là NaOH; nếu kết tủa không tan, suy ra đó là BaSO4 và dung dịch ban đầu là K2SO4. Câu 13: Chỉ cần dung 1 dung dịch HCl hoặc dung dịch H2SO4 loãng là có thể nhận biết được 4 dung dịch Na2CO3, Na2SO3, Na2SO4, Na2S. Dung dịch Phương trình phản ứng Hiện tượng Na2CO3 23
màu, không mùi Na2SO3 23 2 2 NaSO2HCl2NaClSOHO
Giải phóng khí không màu, mùi hắc.
Giải phóng khí mùi trứng thối.
Không giải phóng khí.
DẠYKÈMQUYNHƠN OFFICIAL 16
2
Câu 14: Ta thấy : Các loại nước Thành phần Nước cất H2O Nước cứng tạm thời H2O, 22 3Mg,Ca,HCO Nước cứng vĩnh cửu H2O, 22 2 4Mg,Ca,Cl,SO Nước cứng toàn phần H2O, 22 2 3 4Mg,Ca,HCO,Cl,SO Đun sôi kỹ 4 mẫu nước ta sẽ nhận biết được hai nhóm. Nhóm 1 gồm nước cứng tạm thời và nước cứng toàn phần; nhóm 2 gồm nước cứng vĩnh cửu và
nguyên chất. Dung dịch Phương trình phản ứng Hiện tượng Nước cất Không xảy ra phản ứng
2 2 NaCO2HCl2NaClCOHO Giải phóng khí không
Na2S 2
NaS2HCl2NaClHS
Na2SO4 24 NaSO2HCl
nước
Không có hiện tượng xảy ra.
Nước
tạm
Tạo kết tủa trắng.
Không xảy ra phản ứng Không có hiện tượng xảy ra. Nước cứng toàn phần
o o t 3 3 2 2 t 3 3 2 2 Ca2HCOCaCOCOHO Mg2HCOMgCOCOHO
Lấy dung dịch thu được ở nhóm 1 cho phản ứng với Na2CO3. Nếu không thấy xuất hiện kết tủa thì suy ra mẫu ban đầu là nước cứng tạm thời; nếu thấy tạo kết tủa thì mẫu ban đầu là nước cứng toàn phần. Làm tương tự với nhóm 2. Nếu không thấy kết tủa là nước cất; nếu thấy kết tủa là nước cứng vĩnh cửu.
Câu 15: Hòa tan 5 chất vào nước, 3 mẫu tan là NaCl , Na2CO3, Na2SO4; 2 mẫu không tan là BaCO3 , BaSO4. Tiếp tục sục CO2 vào hai mẫu không tan, nếu thấy mẫu nào tan thì đó là BaCO3; mẫu không tan là BaSO4. Phương trình phản ứng : 3 22 32BaCOCOHOBa(HCO)
BaCl2 không tạo kết tủa không tạo kết tủa tạo kết tủa tạo kết tủa
Giờ ta chia 4 dung dịch ban đầu thành 2 nhóm : (1) không tạo kết tủa; (2) tạo kết tủa.
Lấy một trong hai dung dịch ở nhóm (1) cho phản ứng với nhóm (2). Nếu không có hiện tượng gì xảy ra thì dung dịch ở nhóm (1) là NaCl, dung dịch còn lại là HCl. Cho HCl vào 2 dung dịch ở nhóm (2), nếu không có hiện tượng gì thì đó là NaHSO4, có khí bay ra là Na2CO3 Nếu một mẫu giải phóng khí thì dung dịch ở nhóm (1) là HCl, dung dịch còn lại là NaCl; dung dịch ở nhóm (2) là Na2CO3, dung dịch còn lại là NaHSO4.
DẠYKÈMQUYNHƠN OFFICIAL 17
cứng
thời o o t 32 3 2 2 t 32 3 2 2 Ca(HCO)CaCOCOHO Mg(HCO)MgCOCOHO
Nước cứng vĩnh cửu
Tạo kết tủa trắng.
Lấy Ba(HCO3)2 cho vào 3 mẫu tan, mẫu không tạo kết tủa là NaCl; hai mẫu tạo kết tủa là Na2CO3 và Na2SO4 Tiếp tục làm tương tự như trên để tìm ra Na2CO3 và Na2SO4. Câu 16: Thuốc thử nhận biết 4 dung dịch NaCl, HCl, NaHSO4, Na2CO3 là BaCl2. dung dịch thuốc thử NaCl HCl NaHSO4 Na2CO3
Câu 1: Có 4 dung dịch: Al(NO3)3, NaNO3, Na2CO3, NH4NO3. Chỉ dùng một dung dịch nào sau đây để phân biệt các chất trong các dung dịch trên ?
A. H2SO4. B. NaCl. C. K2SO4. D. Ba(OH)2. Câu 2: Chỉ dùng thêm một thuốc thử nào sau đây có thể phân biệt được các dung dịch: NaCl, NH4Cl, AlCl3, FeCl2, CuCl2, (NH4)2SO4 ?
A. Dung dịch BaCl2
C. Dung dịch NaOH. D. Quỳ tím. Câu 3: Có 5 dung dịch riêng rẽ, mỗi dung dịch chứa 1 cation sau đây: NH4 +, Mg2+ , Fe2+, Fe3+, Al3+ (có nồng độ khoảng 0,1M). Dùng dung dịch NaOH cho lần lượt vào từng dung dịch trên, có thể nhận biết tối đa được mấy dung dịch?
A. 2 dung dịch. B. 3 dung dịch. C. 1 dung dịch. D. 5 dung dịch. Câu 4: Có 5 lọ chứa hoá chất mất nhãn mỗi lọ đựng một trong các dung dịch chứa cation sau (nồng độ dung dịch khoảng 0,01M): Fe2+, Cu2+, Ag+, Al3+, Fe3+ . Chỉ dùng một dung dịch thuốc thử là KOH có thể nhận biết được tối đa mấy dung dịch?
OFFICIAL
B. Dung dịch Ba(OH)2
A. 2 dung dịch. B. 3 dung dịch. C. 1 dung dịch. D. 5 dung dịch. Câu 5: Có 5 dung dịch hoá chất không nhãn, mỗi dung dịch nồng độ khoảng 0,1M của một trong các muối sau: KCl, Ba(HCO3)2, K2CO3, K2S, K2SO3 Chỉ dùng một dung dịch thuốc thử là dung dịch H2SO4 loãng nhỏ trực tiếp vào mỗi dung dịch thì có thể phân biệt được tối đa mấy dung dịch ?
A. 2 dung dịch. B. 3 dung dịch. C. 1 dung dịch. D. 5 dung dịch. Câu 6: a. Có các lọ hoá chất mất nhãn trong mỗi lọ đựng một trong các dung dịch sau: FeCl2, (NH4)2SO4, FeCl3, CuCl2, AlCl3, NH4Cl. Chỉ dùng các ống nghiệm và dung dịch NaOH lần lượt thêm vào từng dung dịch có thể nhậ biết tối đa được mấy dung dịch trong số các dung dịch kể trên ?
A. 6 dung dịch. B. 3 dung dịch. C. 4 dung dịch. D. 5 dung dịch. b. Nếu thay dung dịch NaOH bằng dung dịch Ba(OH)2 thì nhận biết được mấy dung dịch?
A. 6 dung dịch. B. 3 dung dịch. C. 4 dung dịch. D. 5 dung dịch. Câu 7: Có 5 dung dịch hoá chất không nhãn, mỗi dung dịch có nồng độ khoảng 0,1M của một trong các muối sau: KCl, Ba(HCO3)2, K2CO3, K2S, K2SO4. Chỉ dùng dung dịch H2SO4 loãng, nhỏ trực tiếp vào từng dung dịch thì có thể nhận biết được những dung dịch nào?
A. Hai dung dịch: Ba(HCO3)2, K2CO3. B. Ba dung dịch: Ba(HCO3)2, K2CO3, K2S.
C. Hai dung dịch: Ba(HCO3)2, K2S. D. Hai dung dịch: Ba(HCO3)2, K2SO4. Câu 8:
các lọ hoá chất không nhãn, mỗi lọ đựng một trong các dung dịch không màu sau: Na2SO4, Na2S, Na2CO3, Na3PO4, Na2SO3 Chỉ dùng thuốc thử là dung dịch H2SO4 loãng, nhỏ trực tiếp vào từng dung dịch thì có thể nhận được các dung dịch:
DẠYKÈMQUYNHƠN
1
Có
A. Na2CO3, Na2S, Na2SO3.
C. Na2CO3, Na2S, Na3PO4.
B. Na2CO3, Na2S.
D. Na2SO4, Na2S, Na2CO3, Na3PO4, Na2SO3.
Câu 9: Có 5 ống nghiệm không nhãn, mỗi ống đựng một trong các dung dịch sau đây (nồng độ khoảng 0,1M): NH4Cl, FeCl2, AlCl3, MgCl2, CuCl2 Chỉ dùng dung dịch NaOH nhỏ từ từ vào từng dung dịch, có thể nhận biết được tối đa các dung dịch nào sau đây?
A. Hai dung dịch: NH4Cl, CuCl2.
B. Ba dung dịch: NH4Cl, CuCl2, MgCl2.
C. Bốn dung dịch: NH4Cl, CuCl2, MgCl2 , AlCl3.
D. Cả 5 dung dịch. Câu 10: Có 4 ống nghiệm không nhãn, mỗi ống đựng một trong các dung dịch sau (nồng độ khoảng 0,01M): NaCl, Na2CO3, KHSO4 và CH3NH2. Chỉ dùng giấy quỳ tím lần lượt nhúng vào từng dung dịch, quan sát sự biến đổi màu của nó có thể nhận biết được dãy các dung dịch nào?
OFFICIAL
A. Dung dịch NaCl. B. Hai dung dịch NaCl và KHSO4.
C. Hai dung dịch KHSO4 và CH3NH2. D. Ba dung dịch NaCl, KHSO4 và Na2CO3.
Câu 11: Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn: ZnSO4, Mg(NO3)2, Al(NO3)3. Để phân biệt các dung dịch trên có thể dùng:
A. quỳ tím. B. dung dịch NaOH.
C. dung dịch Ba(OH)2. D. dung dịch BaCl2.
Câu 12: Để phân biệt các dung dịch đựng trong các lọ riêng biệt, không dán nhãn: MgCl2, ZnCl2, AlCl3, FeCl2, KCl bằng phương pháp hoá học, có thể dùng
A. dung dịch NaOH. B. dung dịch NH3. C. dung dịch Na2CO3. D. quỳ tím.
Câu 13: Để phân biệt các dung dịch: ZnCl2, MgCl2, CaCl2 và AlCl3 đựng trong các lọ riêng biệt có thể dùng :
A. dung dịch NaOH và dung dịch NH3 B. quỳ tím.
C. dung dịch NaOH và dung dịch Na2CO3 D. A hoặc C. Câu 14: Có thể dùng chất nào dưới đây để phân biệt các dung dịch: BaCl2, Na2SO4, MgSO4, ZnCl2, KNO3 và KHCO3?
A. Kim loại Na. B. Dung dịch HCl. C. Khí CO2. D. Dung dịch Na2CO3. Câu 15: Để phân biệt các dung dịch: Na2CO3, Na2SO3, NaHSO3 và NaHCO3 đựng trong các lọ riêng biệt, có thể dùng:
A. axit HCl và nước brom. B. nước vôi trong và nước brom.
DẠYKÈMQUYNHƠN
2
C. dung dịch CaCl2 và nước brom. D. nước vôi trong và axit HCl.
Câu 16: Để phân biệt các dung dịch loãng: HCl, HNO3, H2SO4 có thể dùng thuốc thử nào sau đây ?
A. Dung dịch Ba(OH)2 và bột Cu kim loại. B. Kim loại sắt và đồng.
C. Dung dịch Ca(OH)2 D. Kim loại nhôm và sắt.
Câu 17: Không thể dùng thuốc thử nào phân biệt 2 dung dịch Na2CO3 và Na2SO3 ?
A. dung dịch HCl. B. nước brom.
C. dung dịch Ca(OH)2. D. dung dịch H2SO4.
Câu 18: Có các dung dịch muối Al(NO3)3, (NH4)2SO4, NaNO3, NH4NO3, MgCl2, FeCl2 đựng trong các lọ riêng biệt bị mất nhãn. Nếu chỉ dùng một hoá chất làm thuốc thử để phân biệt các muối trên thì chọn chất nào sau đây:
A. Dung dịch Ba(OH)2. B. Dung dịch BaCl2.
OFFICIAL
C. Dung dịch NaOH. D. Dung dịch Ba(NO3)2. Câu 19: Có các dung dịch: NaCl, Ba(OH)2 , NH4HSO4 , HCl, H2SO4 , BaCl2. Chỉ dùng dung dịch Na2CO3 nhận biết được mấy dung ?
A. 4 dung dịch. B. Cả 6 dung dịch.
C. 2 dung dịch. D. 3ung dịch. Câu 20: Để phân biệt các dung dịch riêng biệt gồm NaOH, NaCl, BaCl2, Ba(OH)2 chỉ cần dùng thuốc thử
A. H2O và CO2 B. quỳ tím.
C. dung dịch H2SO4 D. dung dịch (NH4)2SO4 Câu 21: Trong các thuốc thử sau : (1) dung dịch H2SO4 loãng, (2) CO2 và H2O, (3) dung dịch BaCl2, (4) dung dịch HCl .Thuốc tử phân biệt được các chất riêng biệt gồm CaCO3, BaSO4, K2CO3, K2SO4 là:
A. (1) và (2). B. (2) và (4). C. (1), (2), (3). D. (1), (2), (4.)
Câu 22: Thuốc thử duy nhất dùng để nhận biết các chất sau: Ba(OH)2, NH4HSO4, BaCl2, HCl, NaCl,H2SO4 dựng trong 6 lọ bị mất nhãn.
A. dd H2SO4. B. dd AgNO3. C. dd NaOH. D. quỳ tím.
Câu 23: Có các lọ riêng biệt đựng các dung dịch không màu: AlCl3, ZnCl2. FeSO4 Fe(NO3)3, NaCl. Chỉ dùng dung dịch nào dưới đây để phân biệt các lọ mất nhãn trên ?
A. Na2CO3. B. Ba(OH)2. C. NH3. D. NaOH.
Câu 24: Có 3 dung dịch hỗn hợp X (NaHCO3 và Na2CO3); Y (NaHCO3 và Na2SO4); Z (Na2CO3 và Na2SO4). Để nhận biết được 3 dung dịch trên, cần dùng 2 dung dịch là:
DẠYKÈMQUYNHƠN
3
A. NaOH và NaCl. B. NH3 và NH4Cl. C. HCl và NaCl. D. HNO3 và Ba(NO3)2.
Câu 25: Dãy gồm 3 dung dịch có thể nhận biết bằng phenolphtalein là:
A. KOH, NaCl, H2SO4. B. KOH, NaCl, K2SO4. C. KOH, NaOH, H2SO4. D. KOH, HCl, H2SO4.
Câu 26: Có 4 lọ mất nhãn đựng 4 dung dịch sau: HCl, H2SO4, BaCl2, Na2CO3. Để nhận biết 4 dung dịch trên, chỉ cần dùng một thuốc thử duy nhất là dung dịch: A. quỳ tím. B. NaOH. C. NaCl. D. KNO3
Câu 27: Có 6 dung dịch riêng rẽ sau: BaCl2, MgCl2, FeCl2, FeCl3, NH4Cl, (NH4)2SO4. Có thể nhận biết 6 dung dịch trên bằng kim loại: A. Na. B. Mg. C. Al. D. Cu.
OFFICIAL
Câu 28: Có 5 dung dịch riêng rẽ sau: NaHSO4, KHCO3, Mg(HCO3)2, Ba(HCO3)2, Na2SO3. Chỉ được dùng thêm cách đun nóng thì có thể nhận được mấy dung dịch ?
A. 5 dung dịch. B. 3 dung dịch. C. 2 dung dịch. D. 1 dung dịch. Câu 29: Có 4 chất bột màu trắng là NaCl, AlCl3, MgCO3, BaCO3. Chỉ dùng nước cùng các thiết bị cần thiết (như lò nung, bình điện phân v.v...) có thể:
A. không nhận được chất nào. B. nhận được cả 4 chất
C. nhận được NaCl và AlCl3. D. nhận được MgCO3, BaCO3
Câu 30: Có thể nhận biết 2 dung dịch riêng rẽ ZnSO4 và Al2(SO4)3 bằng thuốc thử duy nhất là:
A. dung dịch Ba(OH)2. B. dung dịch NH3. C. dung dịch Na2CO3. D. dung dịch quỳ tím. Câu 31: Có 3 dung dịch đựng trong 3 lọ bị mất nhãn là MgCl2, NH4Cl, NaCl. Để nhận được cả 3 dung dịch, chỉ cần dùng một thuốc thử duy nhất là dung dịch
A. Na2CO3. B. NaOH. C. quỳ tím. D. dung dịch NH3.
Câu 32: Có 3 dung dịch axit đậm đặc là HCl, HNO3, H2SO4 đựng trong 3 lọ riêng biệt bị mất nhãn. Để nhận biết 3 dung dịch axit trên, chỉ cần dùng một thuốc thử duy nhất là: A. CuO. B. dd BaCl2 C. Cu. D. dd AgNO3. Câu 33: Có 5 lọ bị mất nhãn đựng 5 dung dịch sau: NaOH; MgCl2; CuCl2; AlCl3; FeCl3. Số lượng thuốc thử tối thiểu cần dùng để có thể nhận được 5 dung dịch trên là: A. 3. B. 2. C. 1. D. 0.
DẠYKÈMQUYNHƠN
4
Câu 34: Có các dung dịch riêng rẽ sau: AlCl3, NaCl, MgCl2, H2SO4. Để nhận biết được 4 dung dịch trên, chỉ cần dùng một thuốc thử duy nhất là dung dịch:
A. NaOH. B. BaCl2. C. AgNO3. D. quỳ tím.
Câu 35: Các dung dịch loãng sau: Na2SO4, Na2CO3, NaCl, H2SO4, BaCl2, NaOH. Chỉ dùng quỳ tím có thể nhận được:
A. 2 dung dịch. B. 3 dung dịch. C. 4 dung dịch. D. 6 dung dịch. Câu 36: Cho các dung dịch: NaCl, AlCl3, Al2(SO4)3, FeCl2, MgCl2, NH4Cl, (NH4)2CO3. Để nhận biết được các dung dịch trên, chỉ cần dùng một dung dịch duy nhất là:
A. NaOH. B. CaCl2. C. Ba(OH)2. D. H2SO4.
Câu 37: Cho 3 bình đựng các dung dịch mất nhãn là X gồm (KHCO3 và K2CO3), Y gồm (KHCO3 và K2SO4), Z gồm (K2CO3 và K2SO4). Để nhận biết được X, Y, Z, cần dùng 2 dung dịch là:
OFFICIAL
A. Ba(OH)2 và HCl. B. HCl và BaCl2. C. BaCl2 và H2SO4. D. H2SO4 và Ba(OH)2.
Câu 38: Có 6 dung dịch sau: NH4NO3, Al(NO3)3, Pb(NO3)2, FeCl2, HCl, KOH. Số lượng thuốc thử tối thiểu cần dùng để có thể nhận được 6 dung dịch trên là: A. 3. B. 2. C. 1. D. 0. Câu 39: Có thể dùng chất nào dưới đây để phân biệt các dung dịch riêng biệt chứa các cation: Na+, Mg2+, Al3+? A. HCl. B. BaCl2 C. NaOH D. K2SO4.
Câu 40: Để nhận biết anion NO3 - có thể dùng kim loại Cu và dung dịch H2SO4 loãng, đun nóng vì:
A. tạo ra khí có màu nâu.
B. tạo ra khí không màu, hoá nâu trong không khí. C. tạo ra dung dịch có màu vàng. D. tạo ra kết tủa màu xanh.
Câu 41: Để nhận biết cation Fe3+ có thể dùng ion nào?
A. SCN. B. SO4 2. C. Cl.
D. NO3.
Câu 42: Có 3 dung dịch muối chứa các anion sau : Dung dịch (1): CO3 2-; dung dịch (2): HCO3 - ; dung dịch (3): CO3 2-, HCO3. Để phân biệt 3 dung dịch trên ta có thể dùng cách nào sau đây ?
A. Cho dung dịch NaCl dư, lọc, cho axit HCl vào nước lọc.
B. Cho dung dịch NH4Cl dư, lọc, cho axit H2SO4 vào nước lọc.
C. Cho dung dịch BaCl2 dư, lọc, cho axit H2SO4 vào nước lọc.
DẠYKÈMQUYNHƠN
5
D. Cho dung dịch KOH dư, lọc, cho axit H2SO4 vào nước lọc.
Câu 43: Để phân biệt anion CO3 2- và anion SO3 2- có thể dùng:
A. quỳ tím. B. dung dịch HCl. C. dung dịch CaCl2.
D. dung dịch Br2.
Câu 44: Không thể nhận biết các khí CO2, SO2 và O2 đựng trong các bình riêng biệt, nếu chỉ dùng
A. nước brom và tàn đóm cháy dở.
B. nước brom và dung dịch Ba(OH)2.
C. nước vôi trong và nước brom.
D. tàn đóm cháy dở và nước vôi trong.
Câu 45: Để phân biệt các khí CO, CO2, O2 và SO2 có thể dùng:
A. tàn đóm cháy dở, nước vôi trong và nước brom.
B. tàn đóm cháy dở, nước vôi trong và dung dịch K2CO3.
OFFICIAL
C. dung dịch Na2CO3 và nước brom.
D. tàn đóm cháy dở và nước brom.
Câu 46: Để phân biệt O2 và O3, người ta có thể dùng:
A. que đóm đang cháy. B. hồ tinh bột.
C. dung dịch KI có hồ tinh bột. D. dung dịch KBr có hồ tinh bột.
Câu 47: Có 6 mẫu chất rắn riêng rẽ sau: CuO, FeO, Fe3O4, MnO2, Ag2O và hỗn hợp Fe + FeO. Chỉ dùng dung dịch HCl có thể nhận được:
A. 2 mẫu. B. 3 mẫu. C. 4 mẫu. D. 6 mẫu.
Câu 48: Cho các chất rắn riêng rẽ sau: BaSO4, BaCO3, KCl, Na2CO3, MgCO3. Có thể nhận được các chất trên bằng nước và một thuốc thử khác là dung dịch: A. H2SO4 B. HCl. C. CaCl2 D. AgNO3. Câu 49: Cho các oxit: K2O, Al2O3, CaO, MgO. Để nhận được các oxit nói trên, chỉ dùng 1 thuốc thử là: A. H2O. B. dd Na2CO3. C. dd NaOH. D. dd HCl.
Câu 50: Cho 4 chất rắn riêng rẽ: Na2O; Al2O3; Fe2O3; Al. Chỉ dùng nước có thể nhận được
A. 0 chất. B. 1 chất. C. 2 chất. D. 4 chất.
Câu 51: Có 4 mẫu kim loại là Na, Ca, Al, Fe. Chỉ dùng thêm nước làm thuốc thử có thể nhận biết được tối đa: A. 1 chất. B. 2 chất. C. 3 chất. D. 4 chất.
Câu 52: Có 6 kim loại riêng rẽ sau: Ba, Mg, Fe, Ag, Al, Cu. Chỉ dùng dung dịch H2SO4 loãng có thể nhận được:
DẠYKÈMQUYNHƠN
6
A. 1 kim loại. B. 2 kim loại. C. 4 kim loại. D. 6 kim loại. Câu 53: Cho các kim loại: Mg, Al, Fe, Cu. Để nhận được các kim loại trên, cần sử dụng 2 dung dịch là: A. HCl, NaOH. B. NaOH và AgNO3 C. AgNO3 và H2SO4 đặc nguội. D. H2SO4 đặc nguội và HCl. Câu 54: Dãy ion nào sau đây cùng tồn tại trong một dung dịch ?
A. Mg2+, SO4 2-, Cl-, Ba2+ B. H+, Cl-, Na+, Al3+ C. S2-, Fe2+, Cu2+, Cl- D. Fe3+, OH-, Na+, Ba2+ Câu 55: Cho dung dịch chứa các anion: Na+, NH4 +, CO3 2-, PO4 3-, NO3 -, SO4 2Dùng chất nào sau đây có thể loại bỏ được nhiều anion nhất?
A. KCl. B. Ba(NO3)2. C. NaOH. D. HCl. Câu 56: Phòng thí nghiệm bị ô nhiễm bởi khí Cl2. Dùng chất nào sau đây có thể khử được Cl2 một cách tương đối an toàn?
OFFICIAL
A. Dung dịch NaOH loãng. B. Dùng khí NH3 hoặc dung dịch NH3.
C. Dùng khí H2S. D. Dùng khí CO2. Câu 57: Khí CO2 có tạp chất khí là HCl. Để loại bỏ HCl nên cho khí CO2 đi qua dung dịch nào sau đây ?
A. Dung dịch NaOH dư. B. Dung dịch NaHCO3 bão hoà dư.
C. Dung dịch Na2CO3 dư. D. Dung dịch NH3 dư. Câu 58: Cho dung dịch chứa các cation sau: Na+, Ca2+, Mg2+, Ba2+, H+ Muốn loại được nhiều cation ra khỏi dung dịch mà không đưa thêm ion lạ vào dung dịch, có thể dùng chất nào sau đây? A. Dung dịch K2CO3.
B. Dung dịch Na2CO3.
C. Dung dịch NaOH.
D. Dung dịch Na2SO4. Câu 59: Trong dung dịch X có chứa đồng thời các cation: K+, Ag+, Fe2+, Ba2+ và chỉ chứa 1 loại anion. Anion đó là: A. Cl- B. NO3. C. SO4 2. D. PO4 3Câu 60: Nước của một số giếng khoan có chứa hợp chất của sắt, thường gặp ở dạng cation Fe2+ và anion: A. CO3 2. B. Cl. C. NO2. D. HCO3. Câu 61: Sục một khí vào nước brom, thấy nước brom bị nhạt màu. Khí đó là A. CO2. B. CO. C. SO2. D. HCl. Câu 62: Khí nào sau đây có trong không khí đã làm cho các đồ dùng bằng bạc lâu ngày bị xám đen? A. CO2. B. SO2. C. O2. D. H2S.
DẠYKÈMQUYNHƠN
7
Câu 63: Hỗn hợp khí nào sau đây tồn tại ở bất kì điều kiện nào ?
A. H2 và Cl2. B. N2 và O2. C. H2 và O2. D. HCl và CO2.
Câu 64: Hoà tan một chất khí vào nước, lấy dung dịch thu được cho tác dụng với dung dịch ZnSO4 đến dư thấy có kết tủa trắng rồi kết tủa lại tan ra. Khí đó là
A. HCl. B. SO2 C. NO2 D. NH3
Câu 65: Khi tiến hành phân tích chuẩn độ, người ta đựng dung dịch cần chuẩn độ trong:
A. Bình cầu B. Bình định mức C. Bình tam giác D. Cốc thuỷ tinh
Câu 66: a. Để đo chính xác thể tích của dung dịch chuẩn trong chuẩn độ thể tích người ta thườngdùng dụng cụ nào sau đây?
OFFICIAL
A. Bình định mức. B. Buret. C. Pipet. D. Ống đong. b. Để đo chính xác thể tích của dung dịch cần chuẩn độ trong chuẩn độ thể tích người ta thường dùng dụng cụ nào sau đây?
A. Bình định mức. B. Buret. C. Pipet. D. Ống đong.
Câu 67: Khi cần pha chế một dung dịch chuẩn để chuẩn độ thể tích cần dùng dụng cụ nào sau đây?
A. Bình cầu B. Bình định mức C. Bình tam giác D. Cốc thuỷ tinh
Câu 68: Thời điểm mà chất cần xác định nồng độ vừa tác dụng hết với dung dịch chuẩn gọi là: A. điểm cuối. B. điểm tương đương. C. điểm kết thúc. D. điểm ngừng chuẩn độ.
Câu 69: Để nhận biết thời điểm tương đương, người ta dùng những chất gây ra những hiện tượng mà ta dễ quan sát được bằng mắt, những chất đó gọi là:
A. chất gốc. B. chất chỉ thị.
D. dung dịch chuẩn.
C. chất tương đương.
Câu 70: Với mỗi phản ứng chuẩn độ axit - bazơ, người ta chọn chất chỉ thị axitbazơ có đặc điểm là:
A. Màu sắc của dạng phân tử và dạng ion khác nhau.
B. Màu sắc của chất chỉ thị phụ thuộc vào pH.
C. Có khoảng pH đổi màu trùng hoặc rất sát với pH của điểm tương đương.
D. Gây ra những hiện tượng dễ quan sát bằng mắt.
Câu 71: Khi chuẩn độ để tránh những sai số lớn, người ta dùng dung dịch chuẩn có nồng độ
DẠYKÈMQUYNHƠN
8
A. Lớn hơn nhiều nồng độ của dung dịch chất cần xác định.
B. Bé hơn nhiều nồng độ của dung dịch chất cần xác định.
C. Đúng bằng nồng độ của dung dịch chất cần xác định
D. Xấp xỉ với nồng độ của dung dịch chất cần xác định.
Câu 72: Cần phải thêm bao nhiêu ml dung dịch NaOH 0,25M vào 50ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có pH = 2,0?
A. 43,75 ml. B. 36,54 ml. C. 27,75 ml. D. 40,75 ml.
Câu 73: Chuẩn độ 30 ml dung dịch H2SO4 chưa biết nồng độ đã dùng hết 30 ml dung dịch NaOH 0,1M. Nồng độ mol của dung dịch H2SO4 là A. 0,02M. B. 0,03M. C. 0,04M. D. 0,05M.
OFFICIAL
Câu 74: Để xác định hàm lượng FeCO3 trong quặng xiđerit, người ta làm như sau: cân 0,600 gam mẫu quặng, chế hoá nó theo một quy trình hợp lí, thu được dung dịch FeSO4 trong môi trường H2SO4 loãng. Chuẩn độ dung dịch thu được bằng dung dịch chuẩn KMnO4 0,025M thì dùng vừa hết 25,2 ml dung dịch chuẩn. Thành phần phần trăm theo khối lượng của FeCO3 trong quặng là:
A. 12,18%. B. 60,9%. C. 24,26%. D. 30,45%. Câu 75: Khối lượng K2Cr2O7 đã phản ứng khi chuẩn độ dung dịch chứa 15,2 gam FeSO4 (có H2SO4 loãng làm môi trường) là:
A. 4,5 gam. B. 4,9 gam. C. 9,8 gam. D. 14,7 gam.
Câu 76: Dùng dung dịch KMnO4 0,02M để chuẩn độ 20 ml dung dịch FeSO4 đã được axit hoá bằng dung dịch H2SO4 loãng. Sau khi cho được 20ml KMnO4 vào thì dung dịch bắt đầu chuyển sang màu hồng. Nồng độ mol của dung dịch FeSO4 là:
A. 0,025M. B. 0,05M. C. 0,1M. D. 0,15M.
Câu 77: Hoà tan a gam FeSO4.7H2O vào nước được dung dịch A. Khi chuẩn độ dung dịch A cần dùng 20 ml dung dịch KMnO4 0,1M (có H2SO4 loãng làm môi trường). Giá trị của a là : A. 1,78 gam. B. 2,78 gam. C. 3,78 gam. D. 3,87 gam. Câu 78: Để chuẩn độ 10 ml một mẫu thử có hàm lượng etanol là 0,46 gam/ml thì thể tích dung dịch K2Cr2O7 0,005M cần dùng là (biết C2H5OH bị oxi hóa thành CH3CHO):
DẠYKÈMQUYNHƠN
9
A. 12,3 ml. B. 6,67 ml. C. 13,3 ml. D. 15,3 ml.
Câu 79: Để xác định nồng độ của cation Fe2+ trong dung dịch đã được axit hoá người ta chuẩn độ bằng dung dịch KMnO4 hoặc dung dịch K2Cr2O7 theo các ớ đồ phản ứng sau: Fe2+ + MnO4 - + H+ Mn2+ + Fe3+ + H2O Fe2+ + Cr2O7 2- + H+ Cr3+ + Fe3+ + H2O
Để chuẩn độ một dung dịch Fe2+ đã axit hoá cần phải dùng 30ml dung dịch KMnO4 0,02M. Để chuẩn độ cùng lượng dung dịch Fe2+ trên bằng dung dịch K2Cr2O7 thì thể tích dung dịch K2Cr2O7 0,02M cần dùng là:
A. 10 ml. B. 15 ml. C. 20 ml. D. 25 ml.
Câu 80: Nhiên liệu nào sau đây thuộc loại nhiên liệu sạch đang được nghiên cứu sử dụng thay thế một số nhiên liệu khác gây ô nhiễm môi trường ?
OFFICIAL
A. Than đá. B. Xăng, dầu. C. Khí butan (gaz). D. Khí hiđro.
Câu 81: Người ta đã sản xuất khí metan thay thế một phần cho nguồn nhiên liệu hoá thạch bằng cách nào sau đây ?
A. Lên men các chất thải hữu cơ như phân gia súc trong hầm Biogaz.
B. Thu khí metan từ khí bùn ao.
C. Lên men ngũ cốc.
D. Cho hơi nước qua than nóng đỏ trong lò.
Câu 82: Một trong những hướng con người đã nghiên cứu để tạo ra nguồn năng lượng nhân tạo to lớn sử dụng trong mục đích hoà bình, đó là:
A. Năng lượng mặt trời.
B. Năng lượng thuỷ điện.
C. Năng lượng gió. D. Năng lượng hạt nhân.
Câu 83: Loại thuốc nào sau đây thuộc loại gây nghiện cho con người ?
A. Penixilin, amoxilin.
C. Seduxen, moocphin.
B. Vitamin C, glucozơ.
D. Thuốc cảm pamin, paradol.
Câu 84: Cách bảo quản thực phẩm (thịt, cá…) bằng cách nào sau đây được coi là an toàn ?
A. Dùng fomon, nước đá.
B. Dùng phân đạm, nước đá.
C. Dùng nước đá và nước đá khô.
D. Dùng nước đá khô, fomon.
Câu 85: Phân bón, thuốc trừ sâu, thuốc kích thích sinh trưởng,… có tác dụng giúp cây phát triển tốt, tăng năng suất cây trồng nhưng lại có tác dụng phụ gây ra những bệnh hiểm nghèo cho con người. Sau khi bón phân hoặc phun thuốc trừ sâu, thuốc kích thích sinh trưởng cho một số loại rau, quả, thời hạn tối thiểu thu hoạch để sử dụng bảo đảm an toàn thường là :
DẠYKÈMQUYNHƠN
10
A. 1 – 2 ngày. B. 2 – 3 ngày. C. 12 – 15 ngày. D. 30 – 35 ngày.
Câu 86: Trường hợp nào sau đây được coi là không khí sạch ?
A. Không khí chứa 78%N2; 21%O2; 1% hỗn hợp CO2, H2O, H2.
B. Không khí chứa 78%N2; 18%O2; 4% hỗn hợp CO2, SO2, HCl.
C. Không khí chứa 78%N2; 20%O2; 2% hỗn hợp CH4, bụi và CO2.
D. Không khí chứa 78%N2; 16%O2; 3% hỗn hợp CO2, 1%CO, 1%SO2.
Câu 87: Trường hợp nào sau đây được coi là nước không bị ô nhiễm?
A. Nước ruộng lúa có chứa khoảng 1% thuốc trừ sâu và phân bón hoá học.
B. Nước thải nhà máy có chứa nồng độ lớn các ion kim loại nặng như Pb2+ , Cd2+, Hg2+, Ni2+.
C. Nước thải từ các bệnh viện, khu vệ sinh chứa các khuẩn gây bệnh.
D. Nước sinh hoạt từ các nhà máy hoặc nước giếng khoan không có chứa các đọc tố như asen, sắt,… quá mức cho phép.
OFFICIAL
Câu 88: Môi trường không khí, đất, nước xung quanh một số nhà máy hoá chất thường bị ô nhiễm nặng bởi khí độc, ion kim loại nặng và các hoá chất. Biện pháp nào sau đây không thể chống ô nhiễm môi trường?
A. Có hệ thống sử lí chất thải trước khi xả ra ngoài hệ thống không khí, sông, hồ, biển.
B. Thực hiện chu trình khép kín để tận dụng chất thải một cách hiệu quả.
C. Thay đổi công nghệ sản xuất, sử dụng nhiên liệu sạch.
D. Xả chất thải trực tiếp ra không khí, sông và biển lớn.
Câu 89: Sau bài thực hành hoá học, trong một số chất thải ở dạng dung dịch, có chứa các ion: Cu2+, Zn2+, Fe3+, Pb2+, Hg2+…Dùng chất nào sau đây để xử lí sơ bộ các chất thải trên ?
A. Nước vôi dư.B. HNO3. C. Giấm ăn. D. Etanol.
Câu 90: Để đánh giá độ nhiễm bẩn không khí của một nhà máy, người ta tiến hành như sau: Lấy 2 lít không khí rồi dẫn qua dung dịch Pb(NO3)2 dư thì thu được chất kết tủa màu đen. Hãy cho biết hiện tượng đó chứng tỏ trong không khí đã có khí nào trong các khí sau?
DẠYKÈMQUYNHƠN
11
Khí
cao. Câu 92: Ngành sản xuất nào sau đây không thuộc về công nghiệp silicat ? A. Đồ gốm. B. Ximăng. C. Thuỷ tinh
D. Thuỷ tinh hữu cơ. Câu 93: Sự thiếu hụt nguyên tố (ở
nào
?
A. H2S. B. CO2 C. SO2 D. NH3 Câu 91: Cacbon monooxit có trong thành phần chính của loại khí nào sau đây ? A. Không khí. B. Khí thiên nhiên. C. Khí mỏ dầu. D.
lò
thường.
dạng hợp chất)
sau đây gây bệnh loãng xương
A. Sắt. B. Kẽm. C. Canxi. D. Photpho.
Câu 94: Bổ sung vitamin A cho cơ thể có thể ăn gấc vì trong quả gấc chín có chứa: A. vitamin A. B. β-caroten (thuỷ phân tạo vitamin A).
C. este của vitamin A. D. enzim tổng hợp vitamin A.
Câu 95: Khí nào sau đây gây ra hiện tượng mưa axit ?
A. CO2. B. CH4. C. SO2. D. NH3.
Câu 96: Trong khí thải công nghiệp thường có chứa các khí SO2, NO2, HF. Có thể dùng chất nào (rẻ tiền) sau đây để loại bỏ các chất khí đó ?
A. Ca(OH)2. B. NaOH. C. NH3. D. HCl. Câu 97: Không khí trong phòng thí nghiệm bị nhiễm bẩn bởi khí Cl2. Để khử độc, có thể xịt vào không khí dung dịch nào sau đây ?
OFFICIAL
A. HCl. B. NH3. C. H2SO4 loãng. D. NaCl.
Câu 98: Các tác nhân hoá học gây ô nhiễm môi trường gồm
A. các kim loại nặng: Hg, Pb, Sb….
B. các anion: NO3 -, PO4 3-, SO4 2 . -
C. thuốc bảo vệ thực vật, phân bón hóc học.
D. cả A, B, C.
Câu 99: Trong số các nguồn năng lượng sau đây, nhóm các nguồn năng lượng nào được coi là năng lượng “sạch” ?
A. Điện hạt nhân, năng lượng thuỷ triều.
B. Năng lượng gió, năng lượng thuỷ triều.
C. Năng lượng nhiệt điện, năng lượng địa điện.
D. Năng lượng mặt trời, năng lượng hạt nhân.
Câu 100: Việt Nam có mỏ quặng sắt rất lớn ở Thái Nguyên nên đã xây dựng khu liên hợp gang thép tại đây. Khu sản xuất được xây dựng ở gần khu vực khai thác mỏ là do:
A. tiện vận chuyển nguyên liệu làm cho chi phí sản xuất thấp.
B. không thể bảo quản được quặng sắt lâu dài sau khi khai thác.
C. chỉ có thể xây dựng nhà máy sản xuất gang thép tại Thái Nguyên.
D. có thể bảo quản được quặng sắt khi vận chuyển, nhưng điều kiện khí hậu ở nơi khác không đảm bảo.
Câu 101: Trong số các vật liệu sau, vật liệu nào có nguồn gốc hữu cơ ?
A. Gốm, sứ. B. Xi măng. C. Chất dẻo.
D. Đất sét nặn.
Câu 102: Người ta hút thuốc lá nhiều thường mắc các bệnh nguy hiểm về đường hô hấp. Chất gây hại chủ yếu có trong thuốc lá là :
DẠYKÈMQUYNHƠN
12
A. becberin. B. nicotin. C. axit nicotinic. D. moocphin.
Câu 103: Khí biogaz sản xuất từ chất thải chăn nuôi được sử dụng làm nguồn nhiên liệu trong sinh hoạt ở nông thôn. Tác dụng của việc sử dụng khí biogaz là
A. phát triển chăn nuôi.
B. đốt để lấy nhiệt và giảm thiểu ô nhiễm môi trường.
C. giải quyết công ăn việc làm ở khu vực nông thôn.
D. giảm giá thành sản xuất dầu, khí.
Câu 104: Hiện tượng trái đất nóng lên do hiệu ứng nhà kính chủ yếu là do chất nào sau đây ?
A. Khí clo. B. Khí cacbonic. C. Khí cacbon oxit.
D. Khí hiđro clorua.
Câu 105: Mưa axit chủ yếu là do những chất sinh ra trong quá trình sản xuất công nghiệp nhưng không được xử lí triệt để. Đó là những chất nào sau đây ?
OFFICIAL
A. SO2, NO2. B. H2S, Cl2. C. NH3, HCl. D. CO2, SO2. Câu 106: Nguyên nhân của sự suy giảm tầng ozon chủ yếu là do:
A. khí CO2. B. mưa axit. C. clo và các hợp chất của clo. D. quá trình sản xuất gang thép. Câu 107: Người ta xử lí nước bằng nhiều cách khác nhau, trong đó có thể thêm clo và phèn kép nhôm kali (K2SO4.Al2(SO4)3.24H2O). Vì sao phải thêm phèn kép nhôm kali vào nước ?
A. Để làm nước trong. B. Để khử trùng nước.
C. Để loại bỏ lượng dư ion florua. D. Để loại bỏ các rong, tảo.
Câu 108: Cá cần có oxi để tăng trưởng tốt. Chúng không thể tăng trưởng tốt nếu quá ấm. Lí do cho hiện tượng trên là :
A. Bơi lội trong nước ấm cần nhiều cố gắng hơn.
B. Oxi hoà tan kém hơn trong nước ấm.
C. Phản ứng hoá học xảy ra nhanh hơn khi nhiệt độ tăng.
D. Trong nước ấm sẽ tạo ra nhiều cacbon đioxit hơn.
Câu 109: Một chất có chứa nguyên tố oxi, dùng để làm sạch nước và có tác dụng bảo vệ các sinh vật trên Trái Đất không bị bức xạ cực tím. Chất này là :
A. ozon.
D. cacbon đioxit.
B. oxi.
C. lưu huỳnh đioxit.
Câu 110: Không khí bao quanh hành tinh chúng ta là vô cùng thiết yếu cho sự sống, nhưng thành phần của khí quyển luôn thay đổi. Khí nào trong không khí có sự biến đổi nồng độ nhiều nhất ?
A. Hơi nước. B. Oxi.
D. Nitơ.
C. Cacon đioxit.
DẠYKÈMQUYNHƠN
13
Câu 111: Dãy gồm các chất và thuốc đều có thể gây nghiện cho con người là
A. penixilin, paradol, cocain.
B. heroin, seduxen, erythromixin
C. cocain, seduxen, cafein.
D. ampixilin, erythromixin, cafein.
Câu 112: Trong số các chất sau: Ancol etylic, nicotin, cafein, moocphin, seduxen, meprobamat, amphetamin, hassish. Những chất gây nghiện là:
A. Ancol etylic, nicotin, cafein, moocphin.
B. moocphin, hassish, seduxen, meprobamat.
C. seduxen, nicotin, meprobamat, amphetamin.
D. Tất cả các chất trên.
Câu 113: Trong nước ngầm thường tồn tại ở dạng ion trong sắt (II) hiđrocacbonat và sắt (II) sunfat. Hàm lượng sắt trong nước cao làm cho nước có mùi tanh, để lâu có màu vàng gây ảnh hưởng xấu đến sức khỏe của con người nên cần phải loại bỏ. Ta có thể dùng các phương pháp nào sau đây để loại bỏ sắt ra khỏi nước sinh hoạt?
A. Sục clo vào bể nước mới hút từ giếng khoan lên với liều lượng thích hợp. (2)
B. Dùng giàn phun mưa hoặc bể tràn để cho nước mới hút từ giếng khoan lên được tiếp xúc nhiều với không khí rồi lắng, lọc. (1)
C. Sục không khí giàu oxi vào nước mới hút từ giếng khoan lên. (3)
D. (1), (2), (3) đúng.
Câu 114: Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là :
A. vôi sống. B. cát.
D. muối ăn.
C. lưu huỳnh.
DẠYKÈMQUYNHƠN
14
OFFICIAL
ĐỀ SỐ 36 (Đề thi THPT Quốc Gia, năm 2015)
Cho biết nguyên tử khối của các nguyên tố :
H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Sr = 88; Ag=108; Ba = 137. Câu 1: Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A. CaCO3 CaO + CO2. 0t
B. 2KClO3 2KCl + 3O2. 0t C. 2NaOH + Cl2 NaCl + NaClO + H2O. D. 4Fe(OH)2 + O2 2Fe2O3 + 4H2O. 0t Câu 2: Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p1 . Số hiệu nguyên tử của X là
A. 14. B. 15. C. 13 D. 27.
Câu 3: Lưu huỳnh trong chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. Na2SO4 B. H2SO4 C. SO2 D. H2S.
Câu 4: Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
A. Ca2+ B. Ag+ C. Cu2+ D. Zn2+
Câu 5: Hòa tan hoàn toàn 1,6 gam Cu bằng dung dịch HNO3, thu được x mol NO2 (là sản phẩm khử duy nhất của N+5). Giá trị của x là
A. 0,15.B. 0,05.C. 0,25.D. 0,10.
Câu 6: Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch?
A. CuSO4. B. MgCl2. C. FeCl3. D. AgNO3.
Câu 7: Quặng boxit được dùng để sản xuất kim loại nào sau đây?
A. Al. B. Na. C. Mg. D. Cu.
Câu 8: Oxit nào sau đây là oxit axit?
A. CaO. B. CrO3. C. Na2O. D. MgO.
Câu 9: Phương pháp chung để điều chế các kim loại Na, Ca, Al trong công nghiệp là
A. điện phân dung dịch. B. nhiệt luyện.
C. thủy luyện. D. điện phân nóng chảy.
Câu 10: Thực hiện các thí nghiệm sau ở điều kiện thường:
Sục khí H2S vào dung dịch Pb(NO3)2.
Cho CaO vào H2O.
Cho Na2CO3 vào dung dịch CH3COOH.
Sục khí Cl2 vào dung dịch Ca(OH)2. Số thí nghiệm xảy ra phản ứng là
DẠYKÈMQUYNHƠN
3
OFFICIAL
(a)
(b)
(c)
(d)
A. 3. B. 4. C. 2. D. 1.
Câu 11: Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước?
A. K. B. Na. C. Ba. D. Be.
Câu 12: Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam FeCl3. Giá trị của m là
A. 2,24.B. 2,80.C. 1,12.D. 0,56.
Câu 13: Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng, thu được V lít H2 (đktc). Giá trị của V là
A. 2,24.B. 3,36.C. 1,12.D. 4,48.
Câu 14: Khử hoàn toàn 4,8 gam Fe2O3 bằng CO dư ở nhiệt độ cao. Khối lượng Fe thu được sau phản ứng là
A. 3,36 gam. B. 2,52 gam. C. 1,68 gam. D. 1,44 gam.
OFFICIAL
Câu 15: Cho 0,5 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 0,28 lít H2 (đktc). Kim loại đó là
A. Ba. B. Mg. C. Ca. D. Sr.
Câu 16: Chất béo là trieste của axit béo với
A. ancol etylic. B. ancol metylic. C. etylen glicol.D. glixerol.
Câu 17: Khí thiên nhiên được dùng làm nhiên liệu và nguyên liệu cho các nhà máy sản xuất điện, sứ, đạm, ancol metylic,… Thành phần chính của khí thiên nhiên là metan. Công thức phân tử của metan là
A. CH4.B. C2H4. C. C2H2. D. C6H6.
Câu 18: Xà phòng hóa hoàn toàn 3,7 gam HCOOC2H5 bằng một lượng dung dịch NaOH vừa đủ. Cô cạn dung dịch sau phản ứng, thu được m gam muối khan. Giá trị của m là
A. 5,2. B. 3,4. C. 3,2. D. 4,8.
Câu 19: Cho các phát biểu sau:
(a) Ở nhiệt độ thường, Cu(OH)2 tan được trong dung dịch glixerol.
(b) Ở nhiệt độ thường, C2H4 phản ứng được với nước brom.
(c) Đốt cháy hoàn toàn CH3COOCH3, thu được số mol CO2 bằng số mol H2O.
(d) Glyxin (H2NCH2COOH) phản ứng được với dung dịch NaOH. Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
Câu 20: Chất nào sau đây thuộc loại amin bật một?
A. CH3NHCH3. B. (CH3)3N. C. CH3NH2. D. CH3CH2NHCH3.
Câu 21: Amino axit X trong phân tử có một nhóm –NH2 và một nhóm –COOH. Cho 26,7 gam X phản ứng với lượng dư dung dịch HCl, thu được dung dịch chứa 37,65 gam muối. Công thức của X là
A. H2N-[CH2]4-COOH. B. H2N-[CH2]2-COOH.
DẠYKÈMQUYNHƠN
4
C. H2N-[CH2]3-COOH. D. H2N-CH2-COOH.
Câu 22: Trong các chất sau đây, chất nào có nhiệt độ sôi cao nhất?
A. CH3CHO. B. CH3CH3. C. CH3COOH. D. CH3CH2OH.
Câu 23: Cho CH3CHO phản ứng với H2 (xúc tác Ni, đun nóng) thu được
A. CH3OH. B. CH3CH2OH. C. CH3COOH. D. HCOOH.
Câu 24: Chất nào sau đây không phản ứng được với dung dịch axit axetic?
A. Cu. B. Zn. C. NaOH. D. CaCO3.
Câu 25: Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn. B. Muối ăn. C. Cồn.D. Xút.
Câu 26: Quá trình kết hợp nhiều phân tử nhỏ (monome) thành phân tử lớn (polime) đồng thời giải phóng những phân tử nhỏ khác (thí dụ H2O) được gọi là phản ứng
A. trùng ngưng.B. trùng hợp. C. xà phòng hóa. D. thủy phân. Câu 27: Đốt cháy hoàn toàn chất hữu cơ nào sau đây thu được sản phẩm có chứa N2?
A. Chất béo. B. Tinh bột. C. Xenlulozơ. D. Protein.
Câu 28: Đun 3,0 gam CH3COOH với C2H5OH dư (xúc tác H2SO4 đặc), thu được 2,2 gam CH3COOC2H5. Hiệu suất của phản ứng este hóa tính theo axit là
A. 25,00%. B. 50,00%. C. 36,67%. D. 20,75%.
Câu 29: Chất nào sau đây không thủy phân trong môi trường axit?
A. Xenlulozơ. B. Saccarozơ. C. Tinh bột. D. Glucozơ.
Câu 30: Phát biểu nào sau đây sai?
A. Sắt có trong hemoglobin (huyết cầu tố) của máu.
B. Phèn chua được dùng để làm trong nước đục.
C. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng đơn chất.
D. Hợp kim liti – nhóm siêu nhẹ, được dùng trong kĩ thuật hàng không.
Câu 31: Tiến hành các thí nghiệm sau ở điều kiện thường:
(a) Sục khí SO2 vào dung dịch H2S. (b) Sục khí F2 vào nước.
(c) Cho KMnO4 vào dung dịch HCl đặc. (d) Sục khí CO2 vào dung dịch NaOH. (e) Cho Si vào dung dịch NaOH.
(g) Cho Na2SO3 vào dung dịch H2SO4.
Số thí nghiệm có sinh ra đơn chất là
A. 6. B. 3. C. 5. D. 4.
DẠYKÈMQUYNHƠN
5
OFFICIAL
Câu 32: Hòa tan 1,12 gam Fe bằng 300 ml dung dịch HCl 0,2M, thu được dung dịch X và khí H2. Cho dung dịch AgNO3 dư vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 10,23. B. 8,61.C. 7,36.D. 9,15.
Câu 33: Amino axit X chứa một nhóm -NH2 và một nhóm -COOH trong phân tử. Y là este của X với ancol đơn chất, MY = 89. Công thức của X, Y lần lượt là
A. H2N-[CH2]2-COOH, H2N-[CH2]2-COOCH3.
B. H2N-[CH2]2-COOH, H2N-[CH2]2-COOC2H5.
C. H2N-CH2-COOH, H2N-CH2-COOC2H5.
D. H2N-CH2-COOH, H2N-CH2-COOCH3. Câu 34: Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất sau ở dạng dung dịch nước : X, Y, Z, T và Q Chất
OFFICIAL
X Y Z T Q Quỳ tím không đổi màu không đổi màu không đổi màu không đổi màu không đổi màu
Thuốc thử
Dung dịch AgNO3/NH3, đun nhẹ không có kết tủa Ag không có kết tủa
Cu(OH)2, lắc nhẹ Cu(OH)2 không tan dung dịch xanh lam
dung dịch xanh lam
Nước brom kết tủa trắng không có kết tủa không có kết tủa
Các chất X, Y, Z, T và Q lần lượt là
không có kết tủa Ag
Cu(OH)2 không tan Cu(OH)2 không tan
không có kết tủa không có kết tủa
A. Glixerol, glucozơ, etylen glicol, metanol, axetanđehit.
B. Phenol, glucozơ, glixerol, etanol, anđehit fomic. C. Anilin, glucozơ, glixerol, anđehit fomic, metanol. D. Fructozơ, glucozơ, axetanđehit, etanol, anđehit fomic.
Câu 35: Tiến hành các thí nghiệm sau:
Cho Mg vào dung dịch Fe2(SO4)3 dư.
Sục khí Cl2 vào dung dịch FeCl2
Dẫn khí H2 dư qua bột CuO nung nóng.
Cho Na vào dung dịch CuSO4 dư.
Nhiệt phân AgNO3
DẠYKÈMQUYNHƠN
6
(a)
(b)
(c)
(d)
(e)