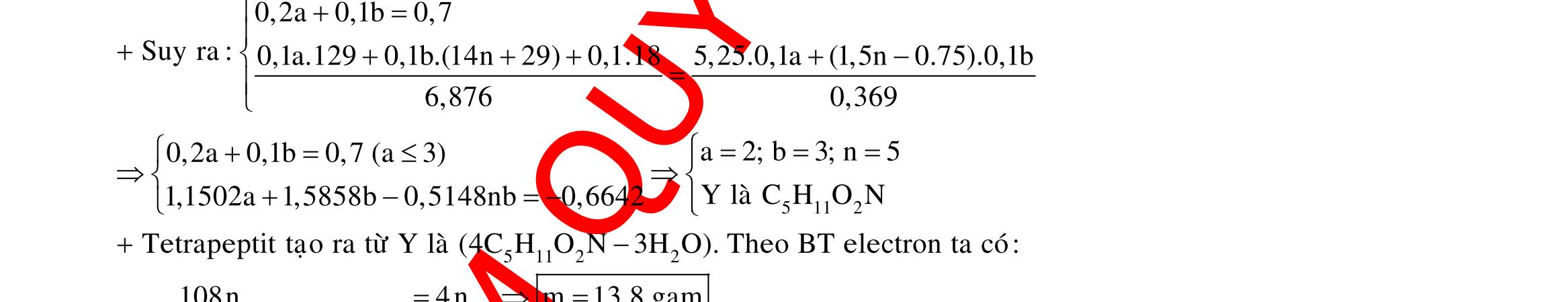
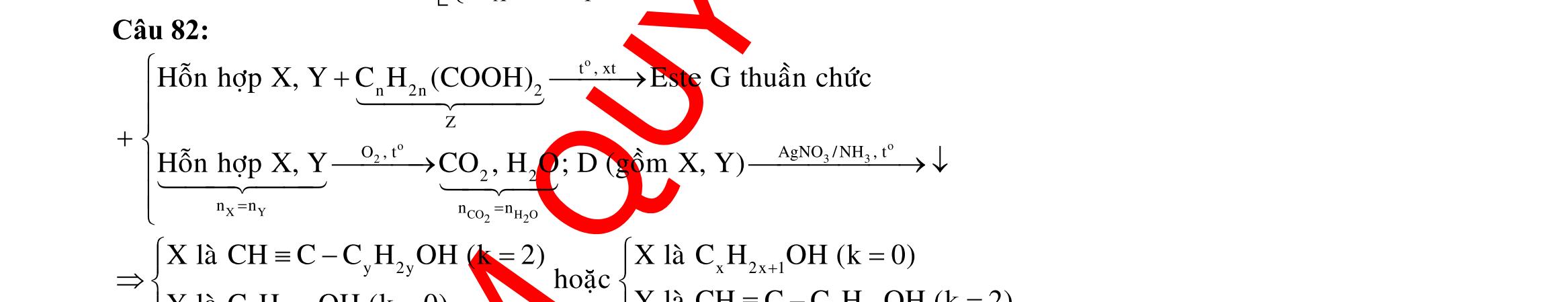
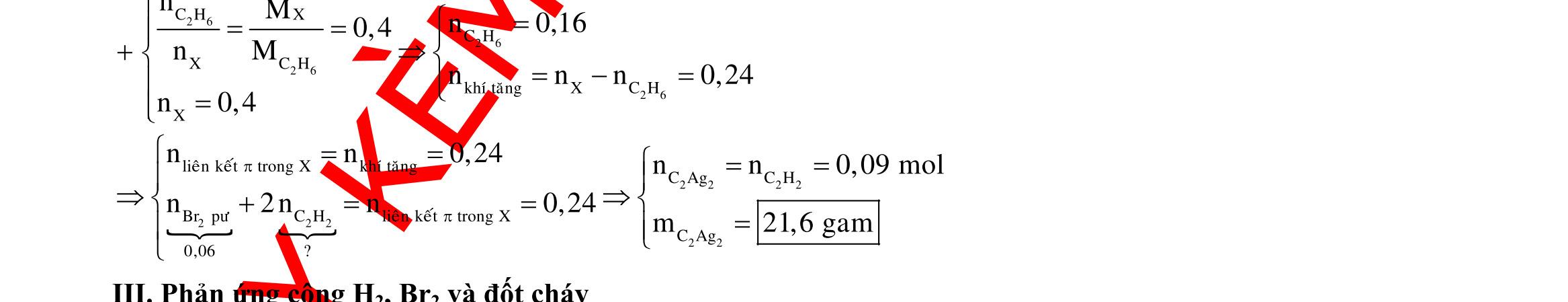
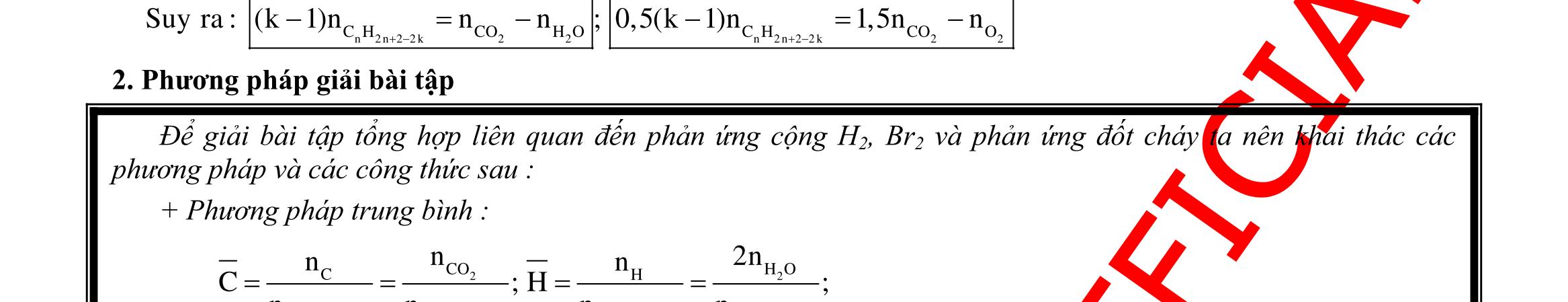
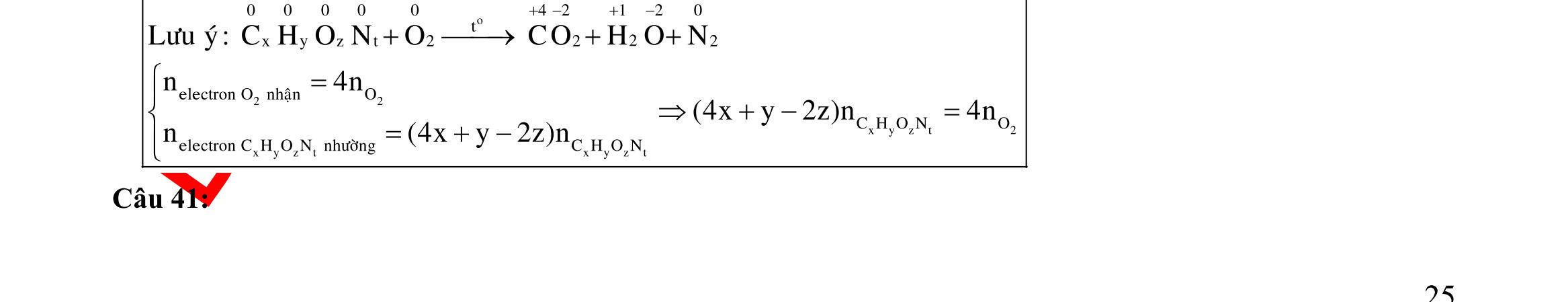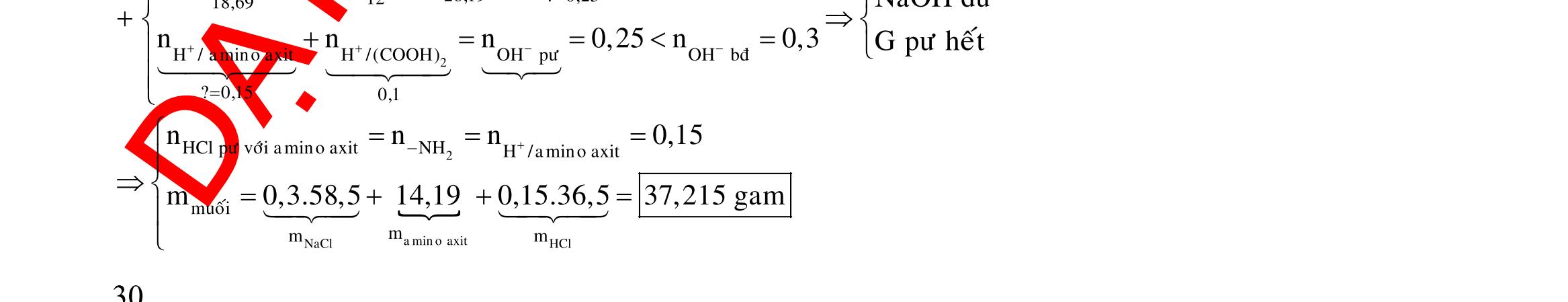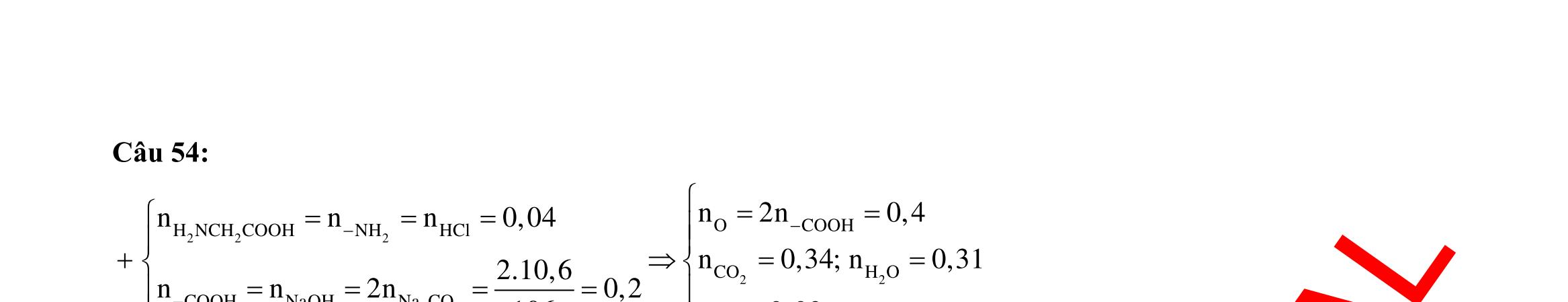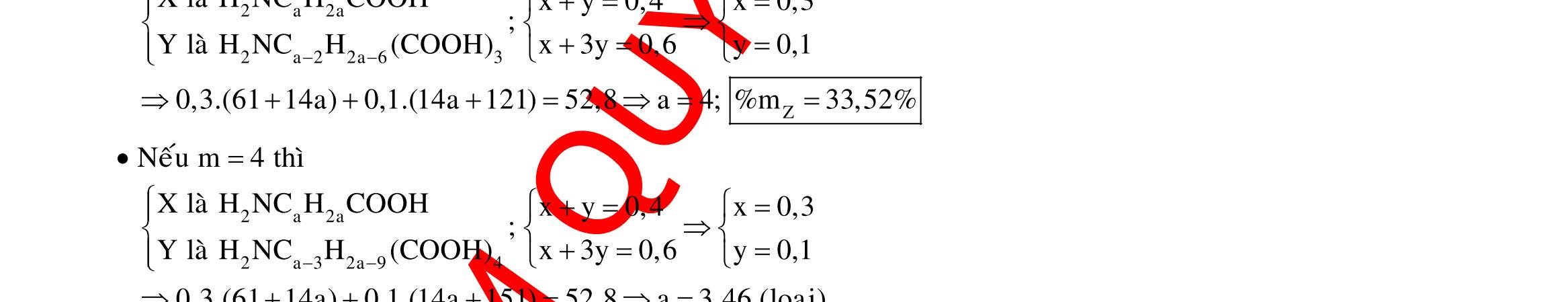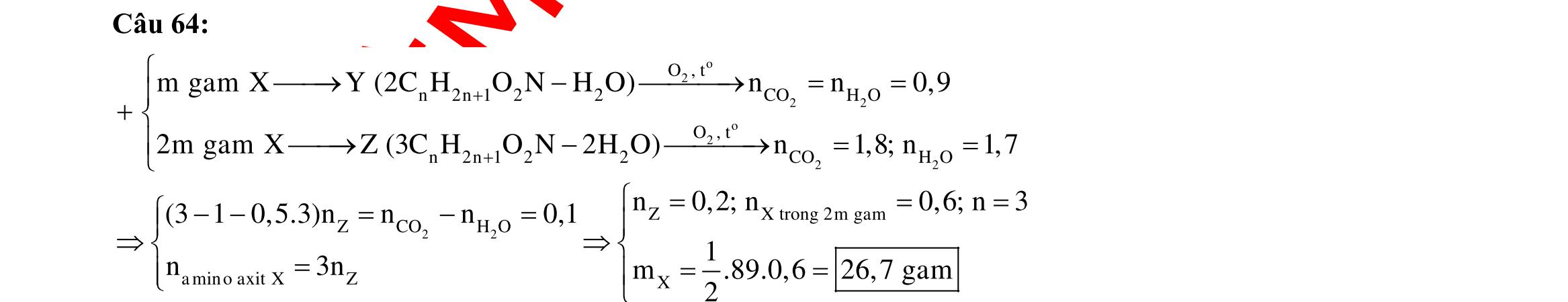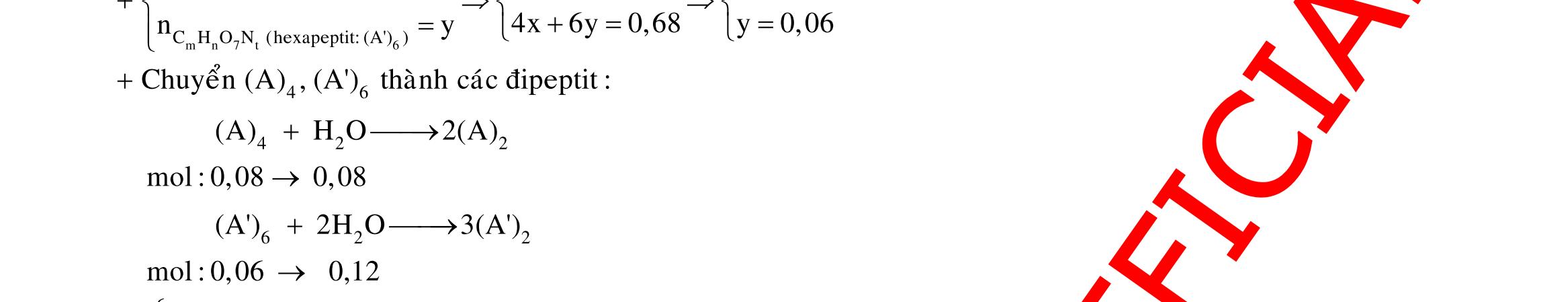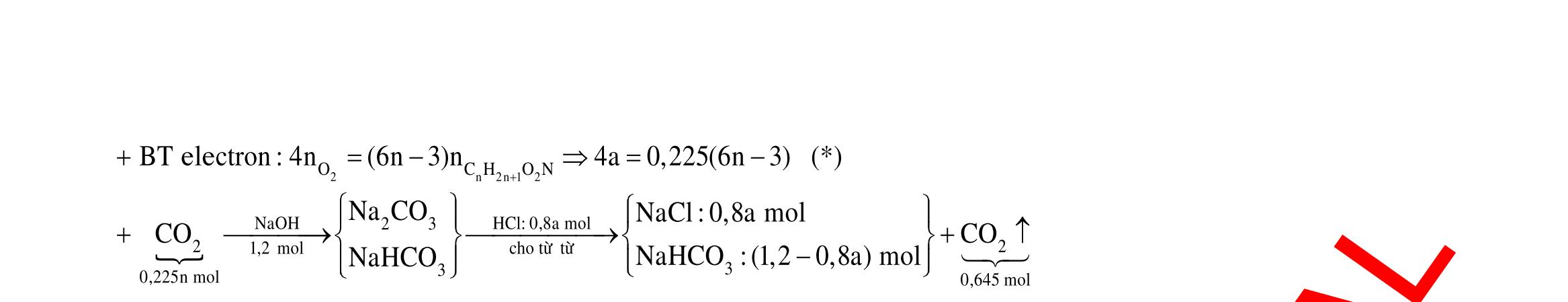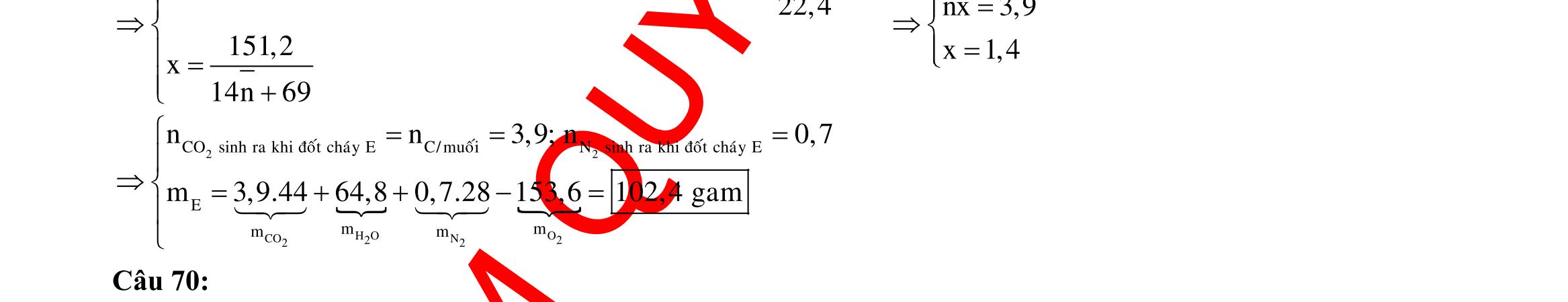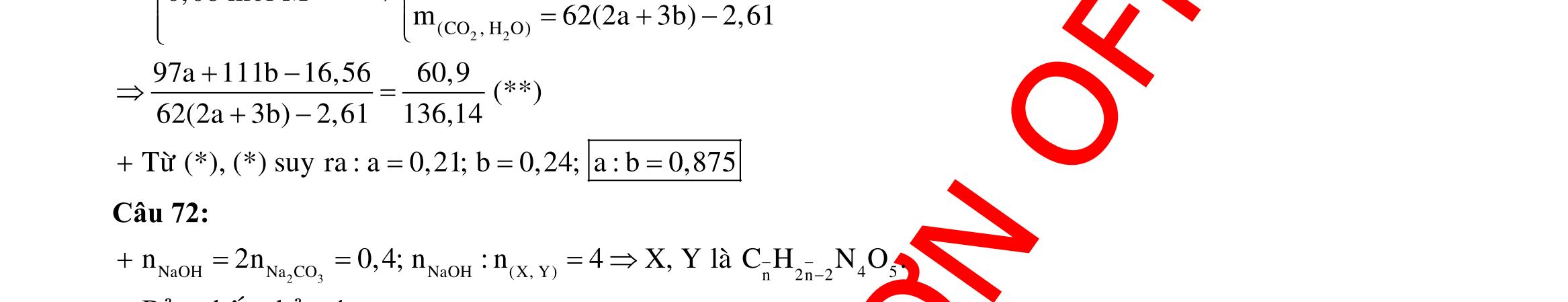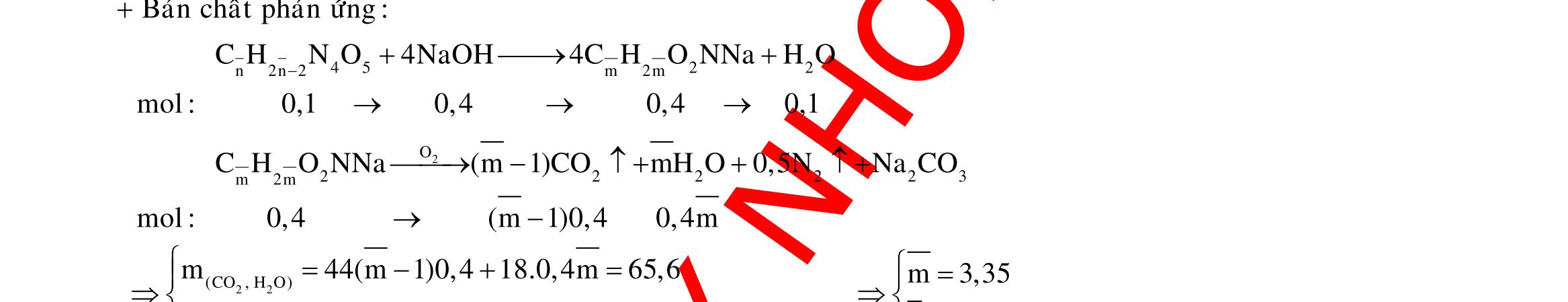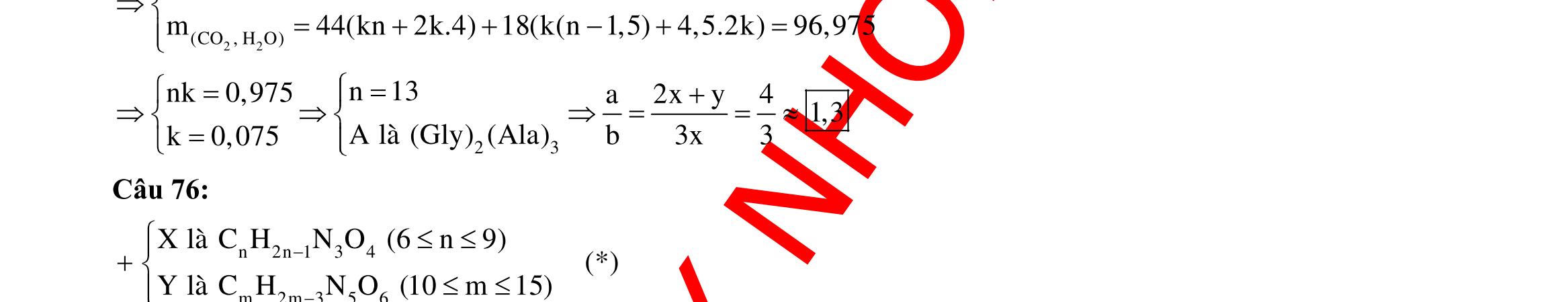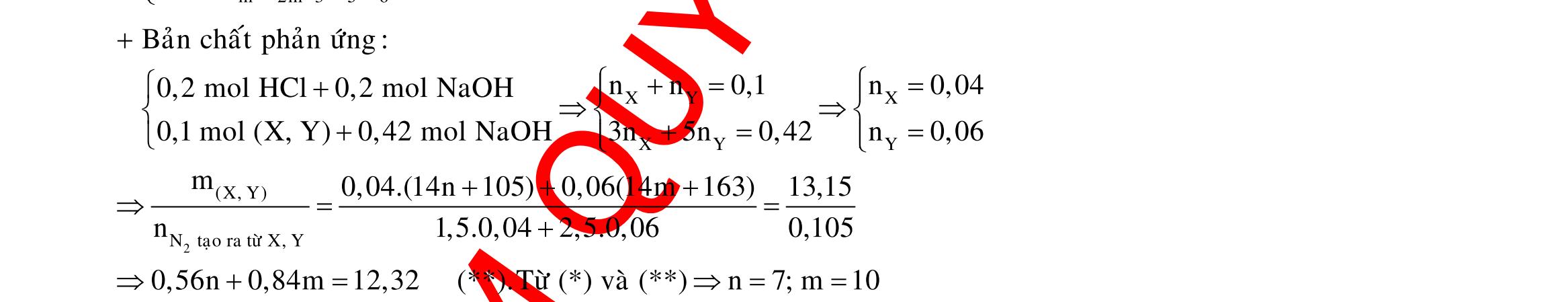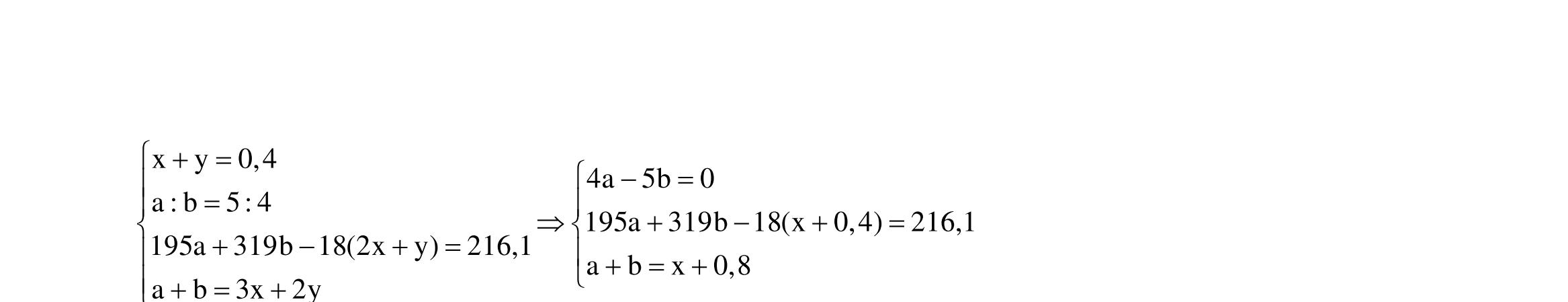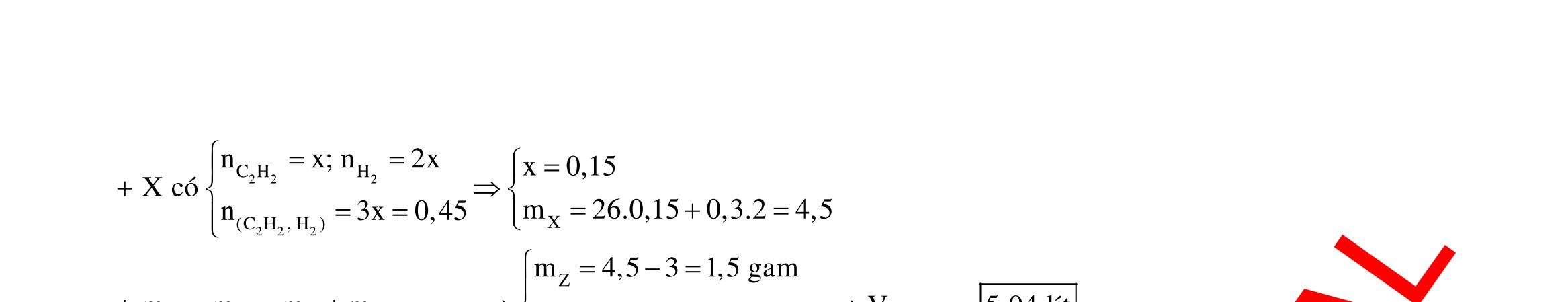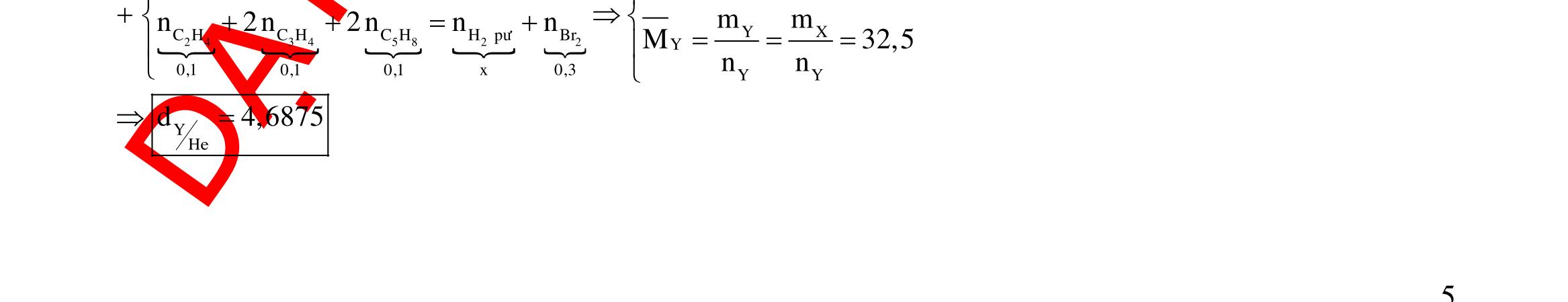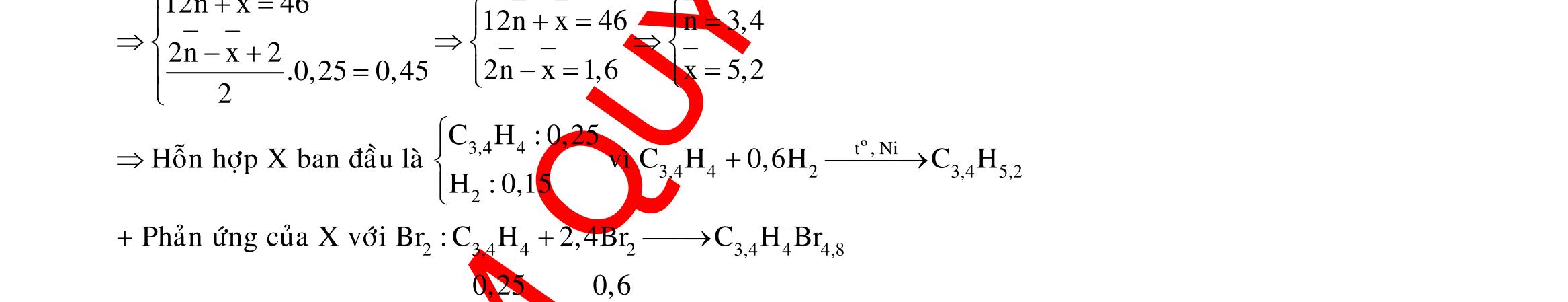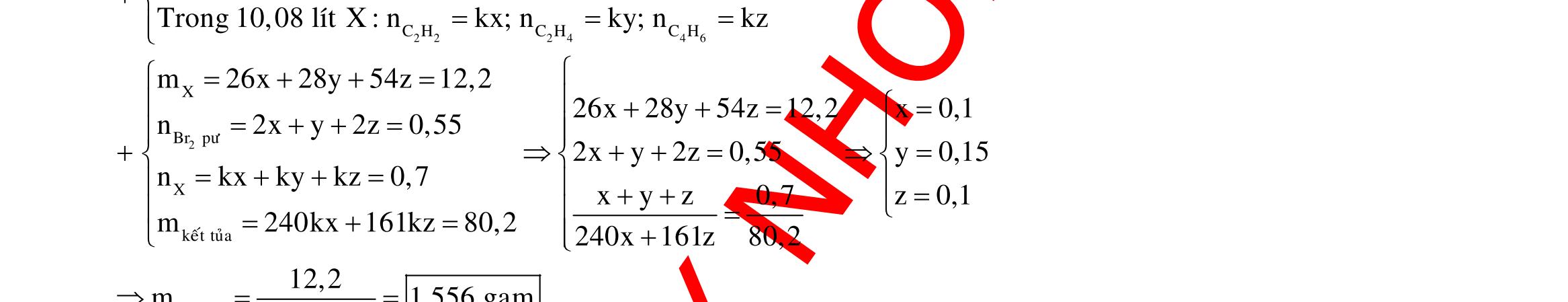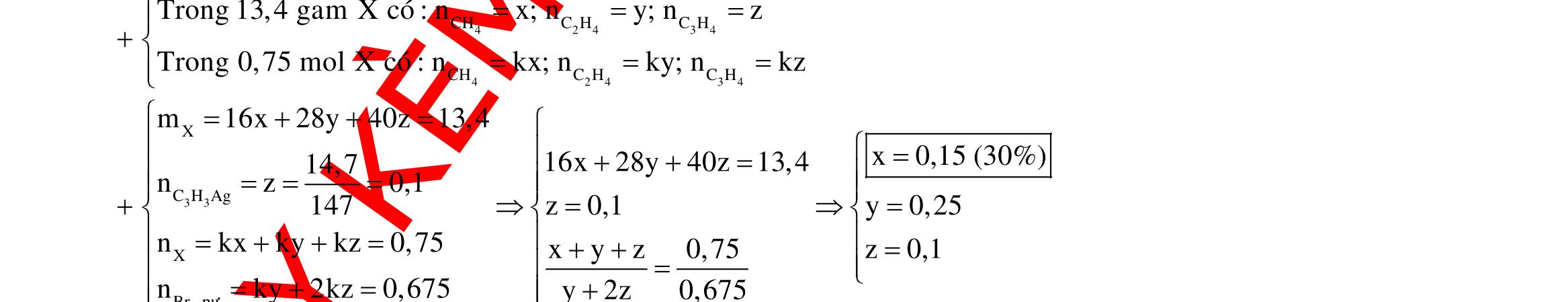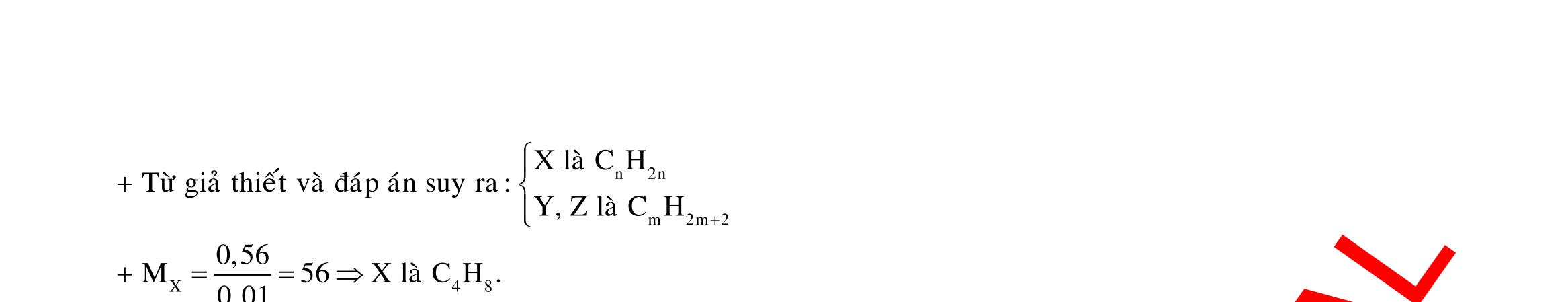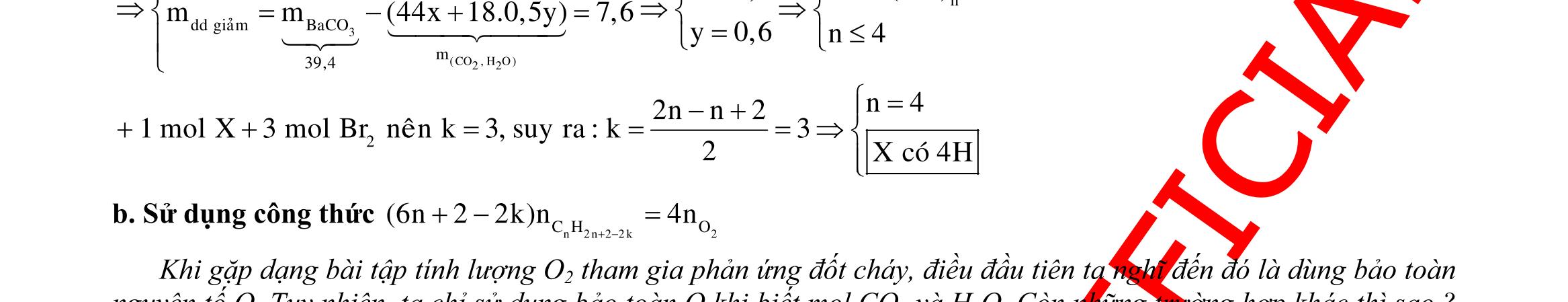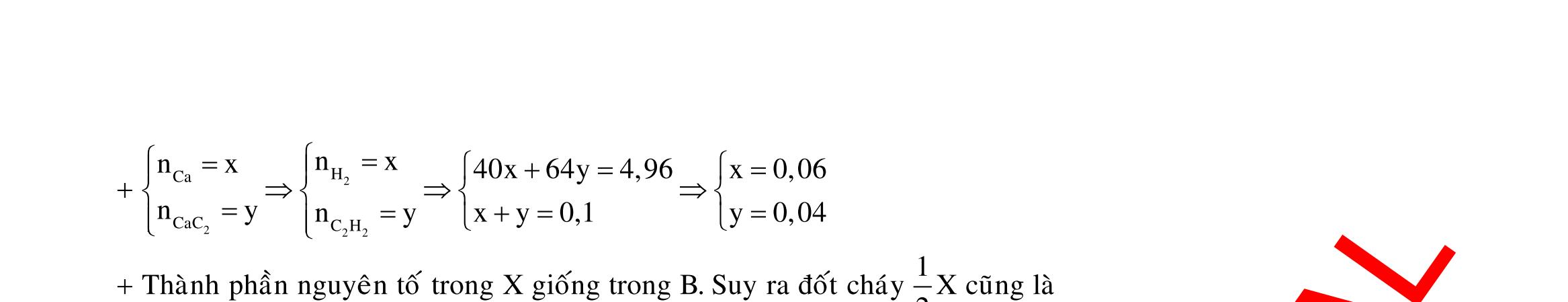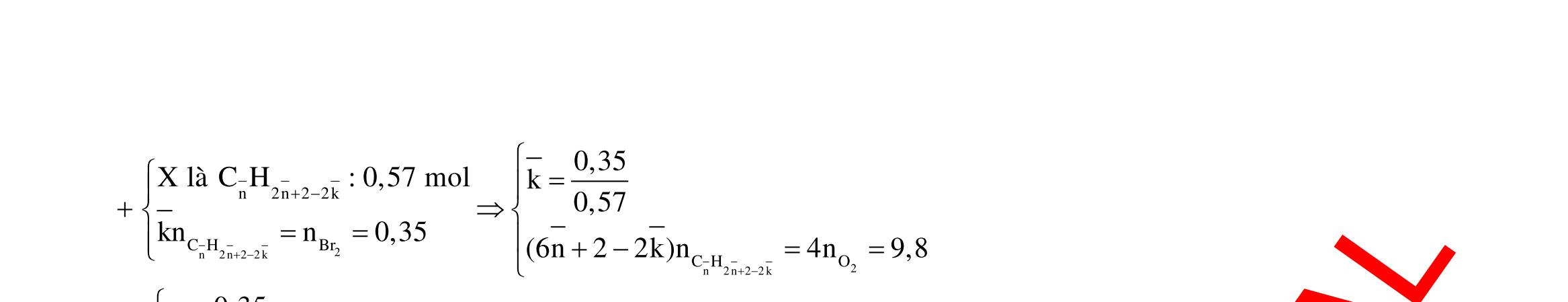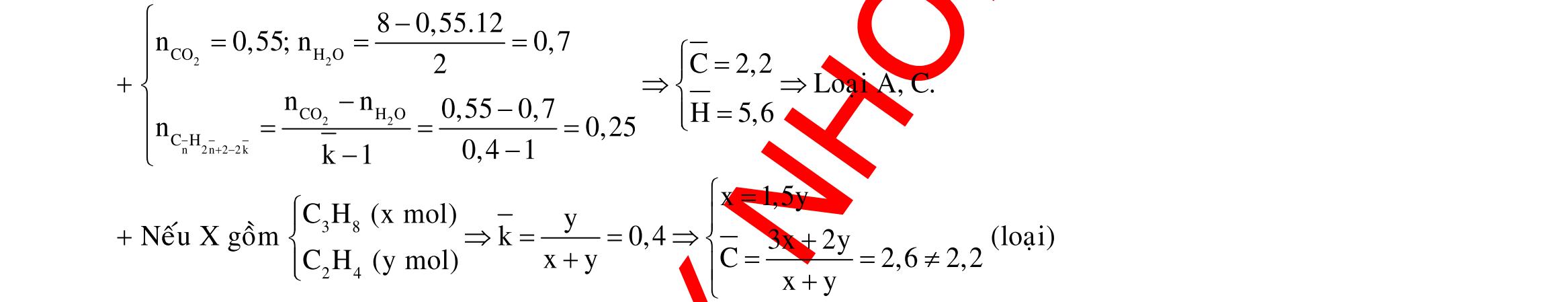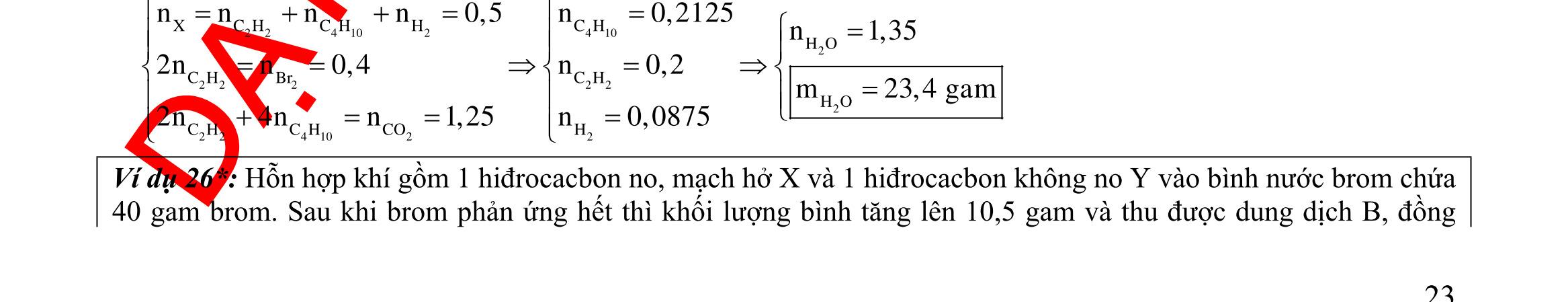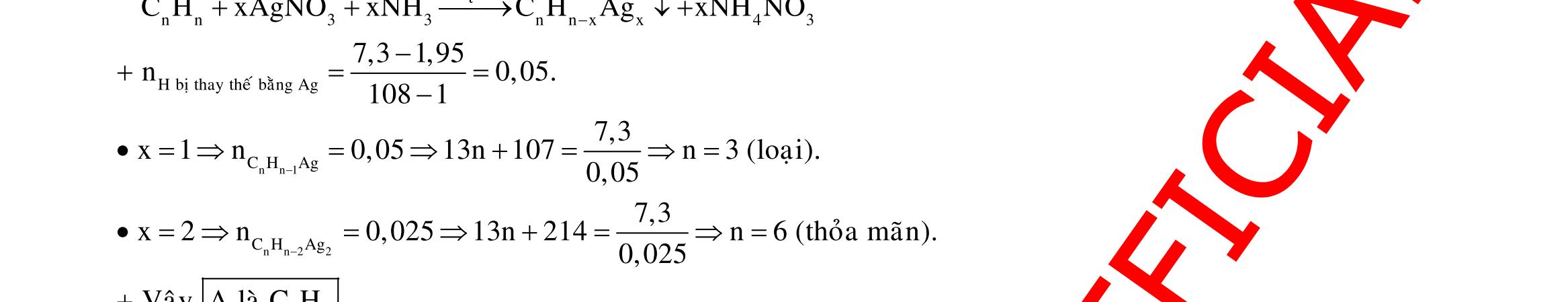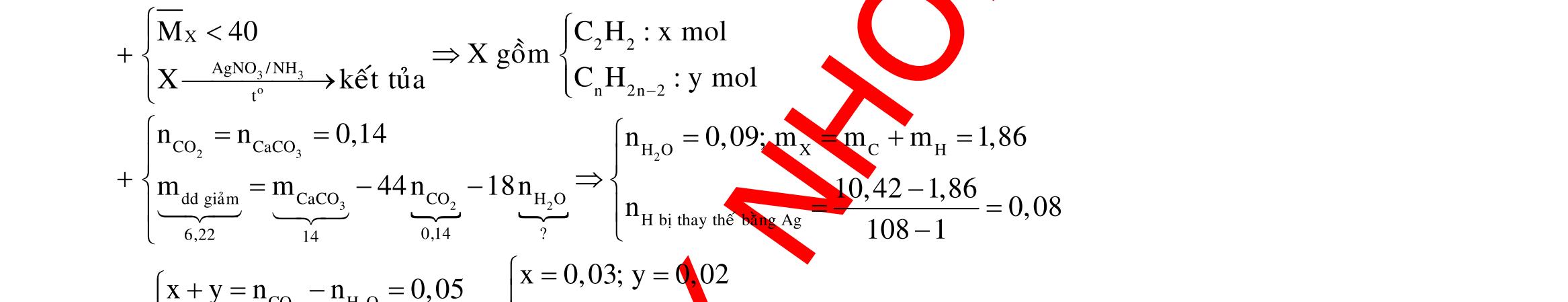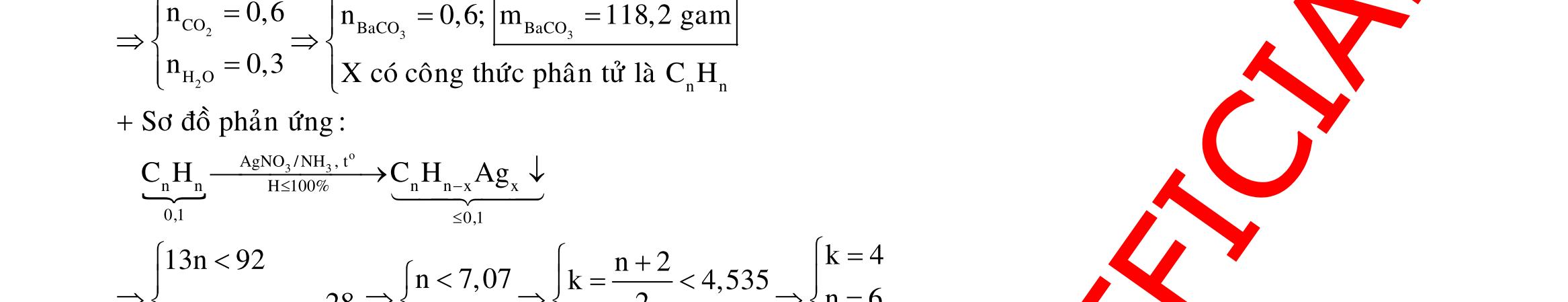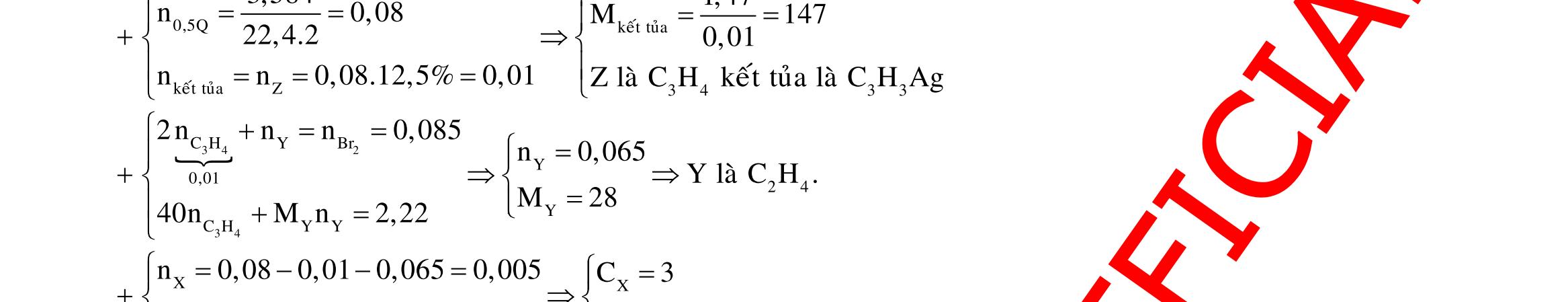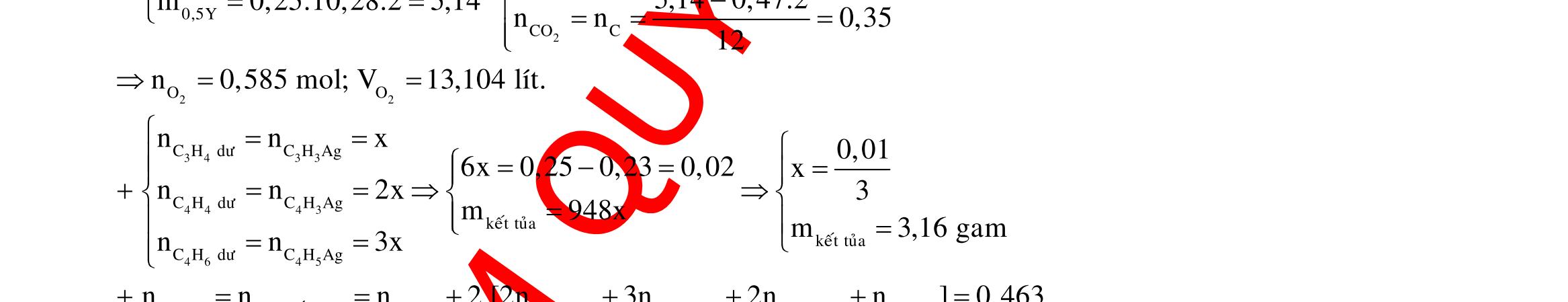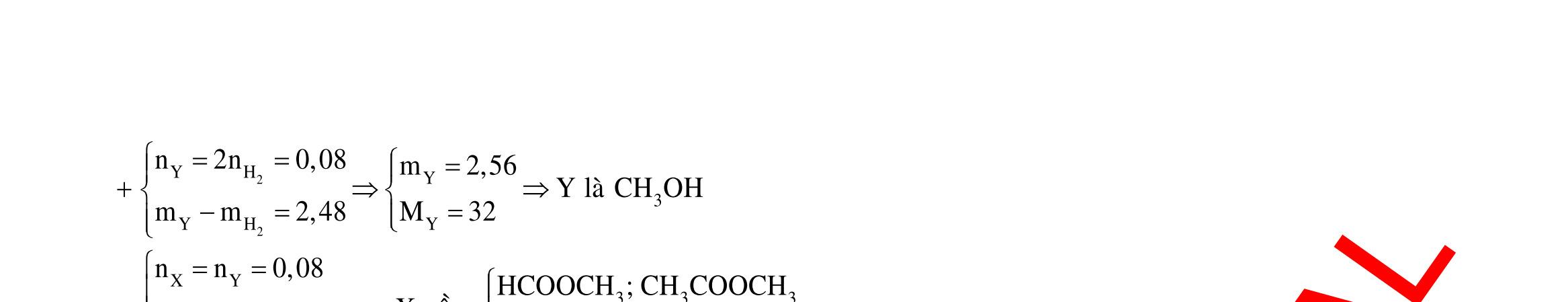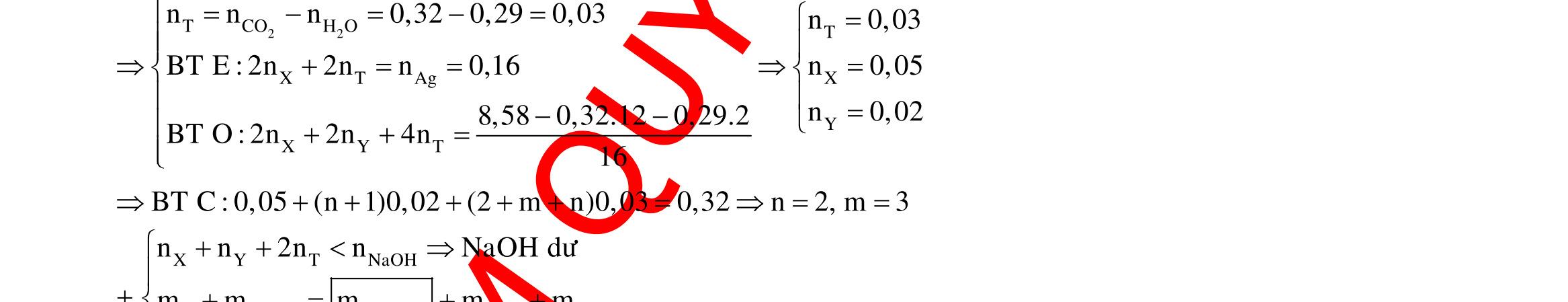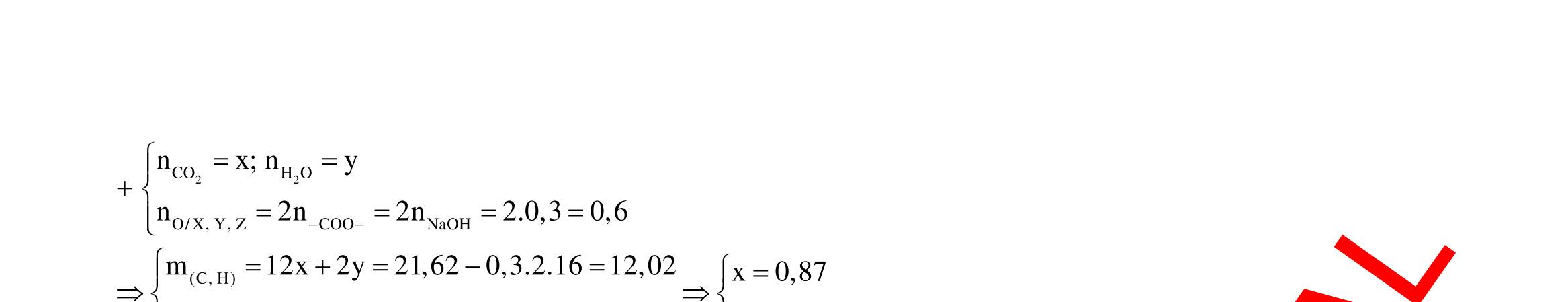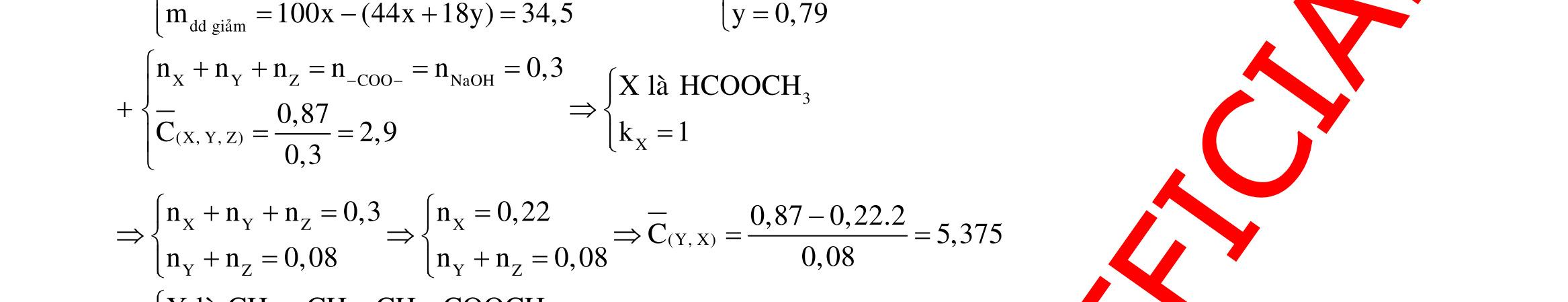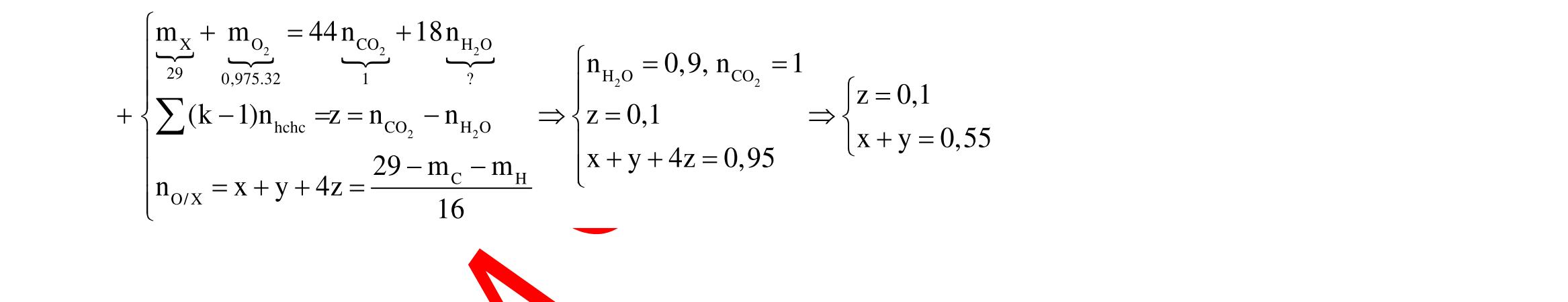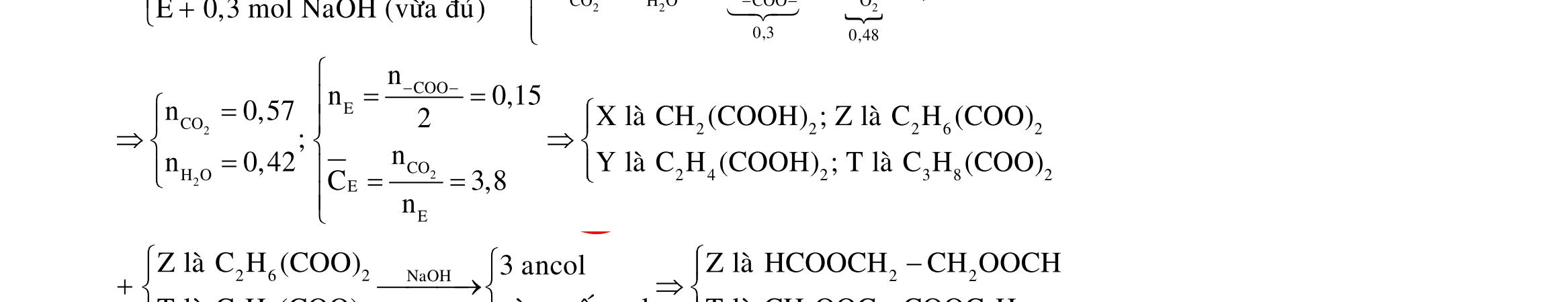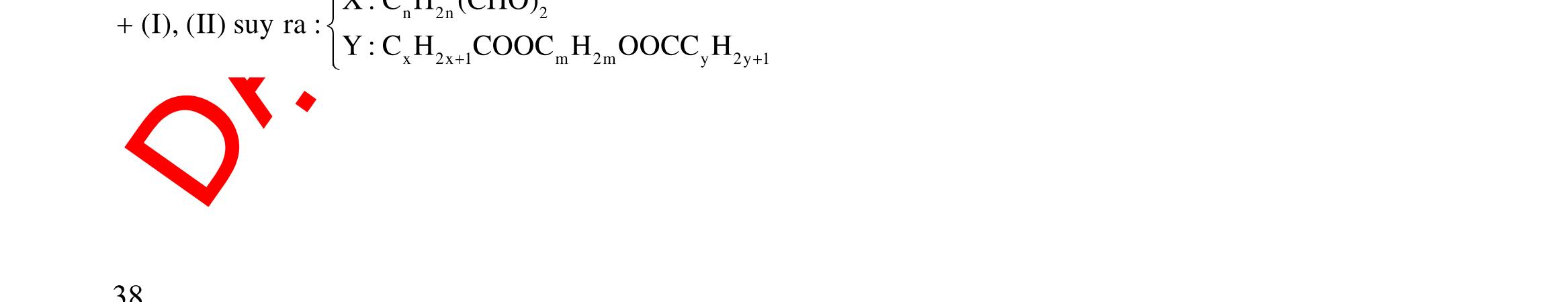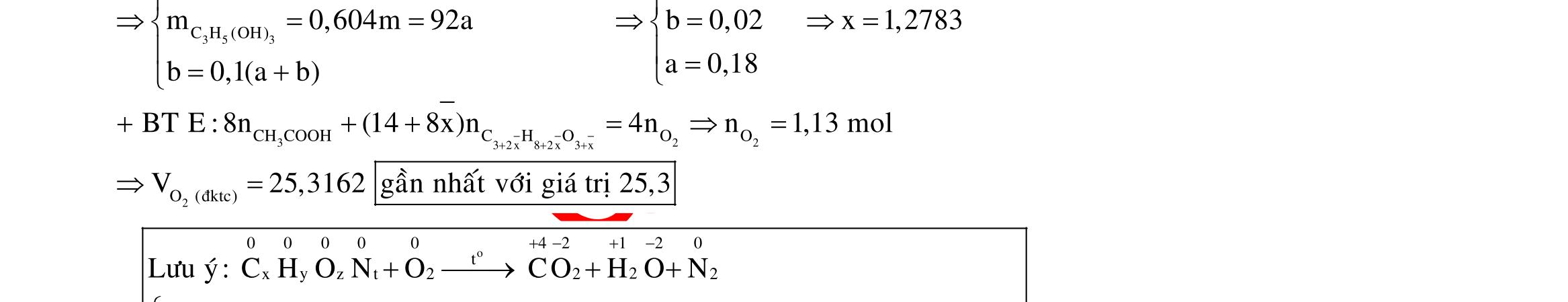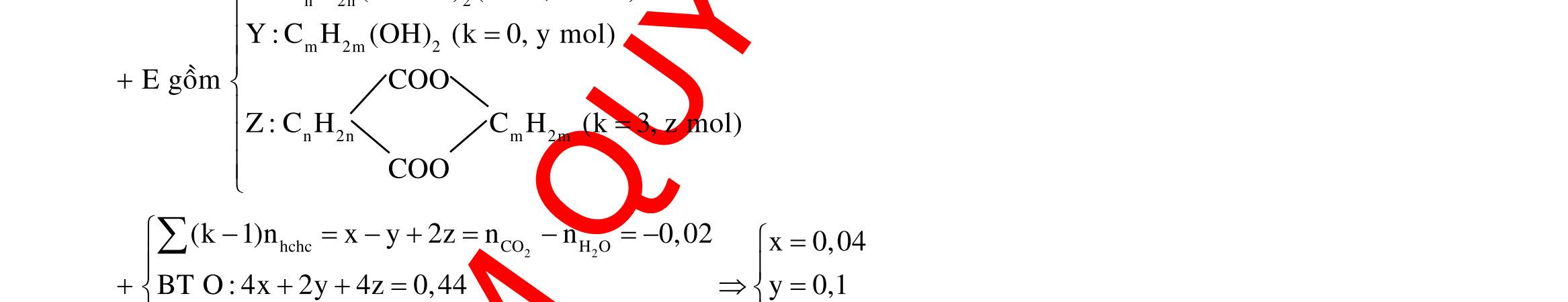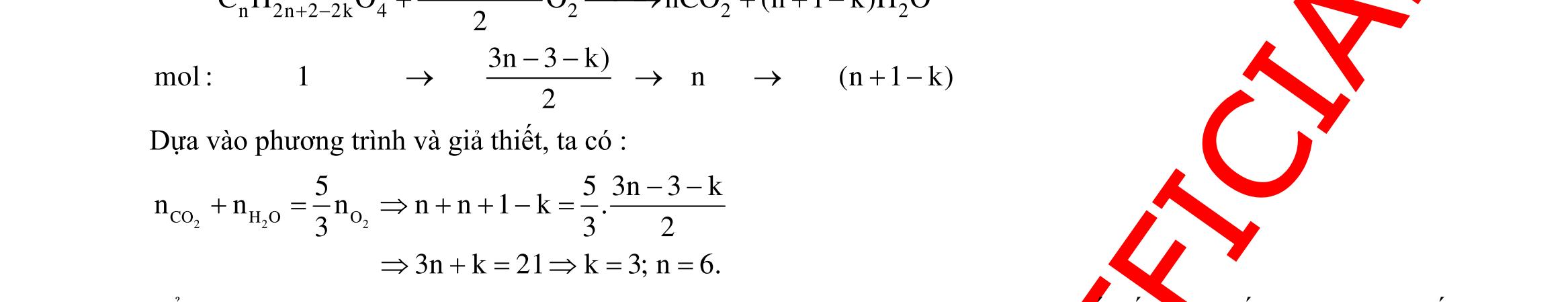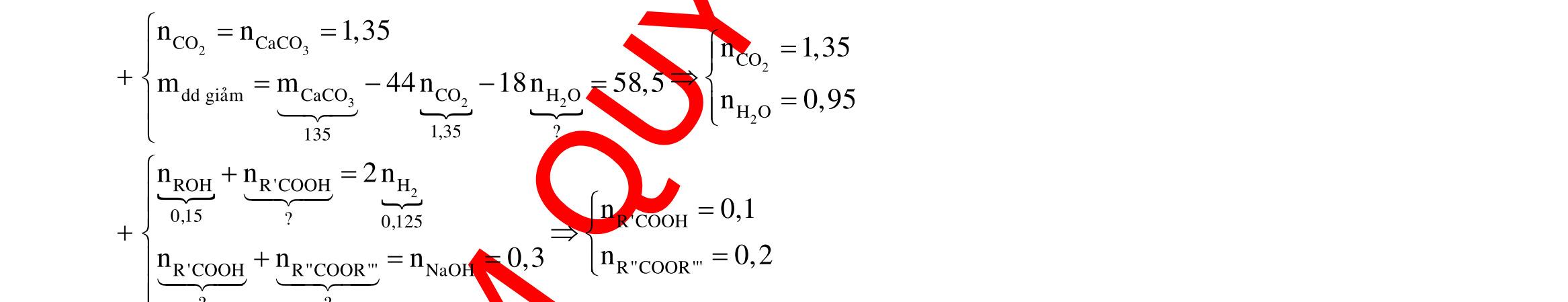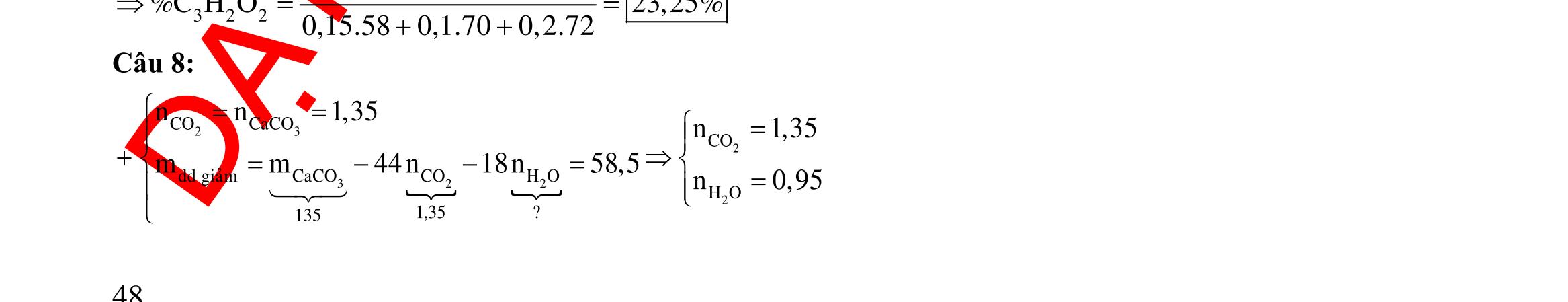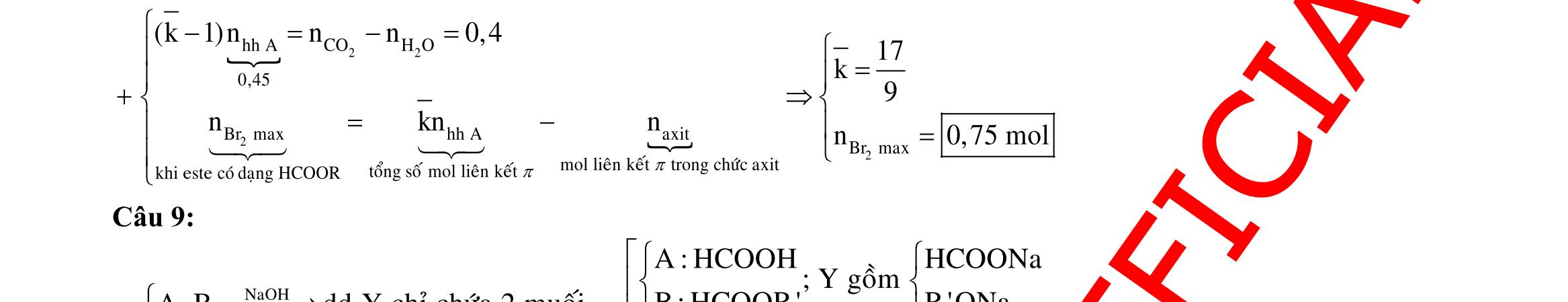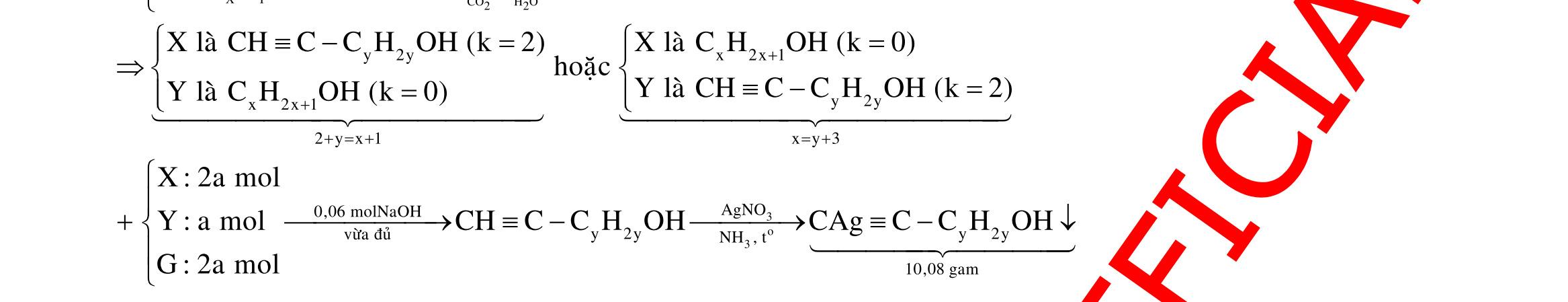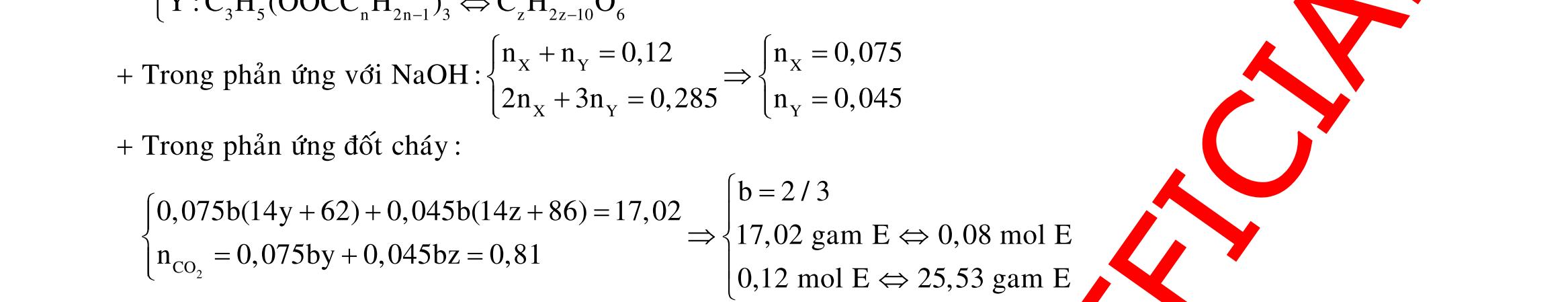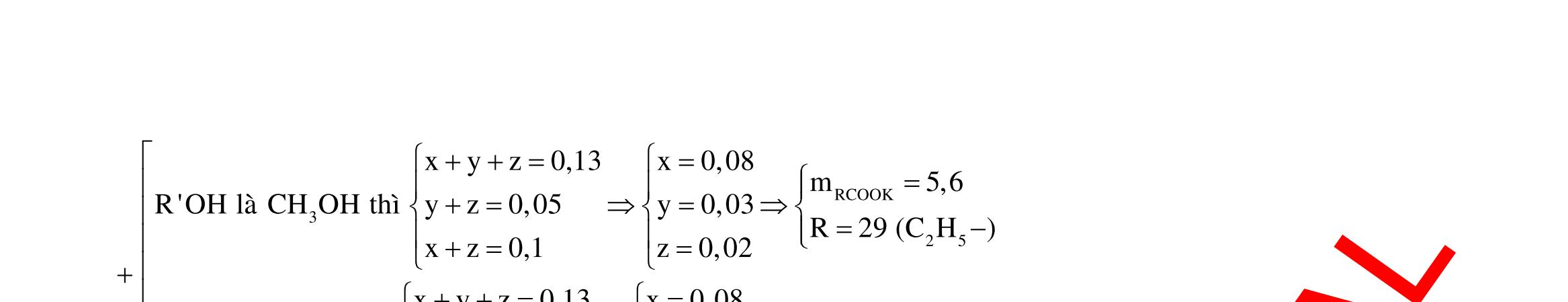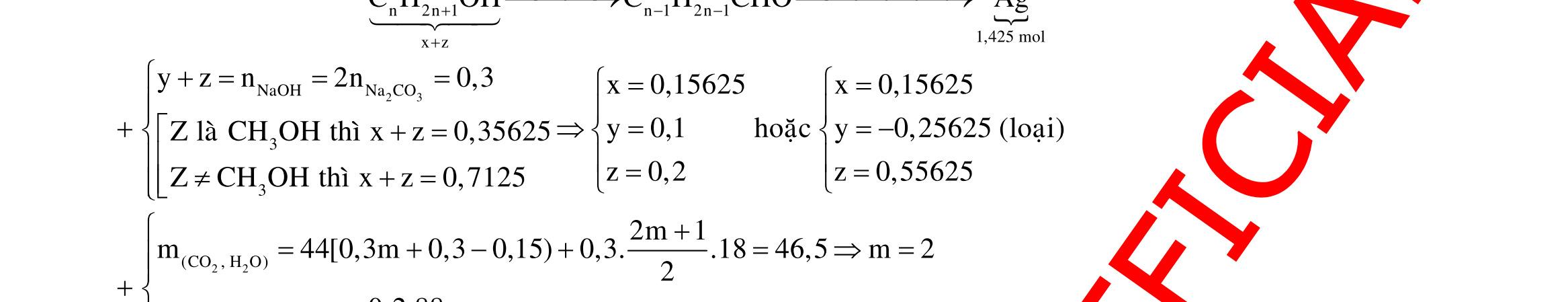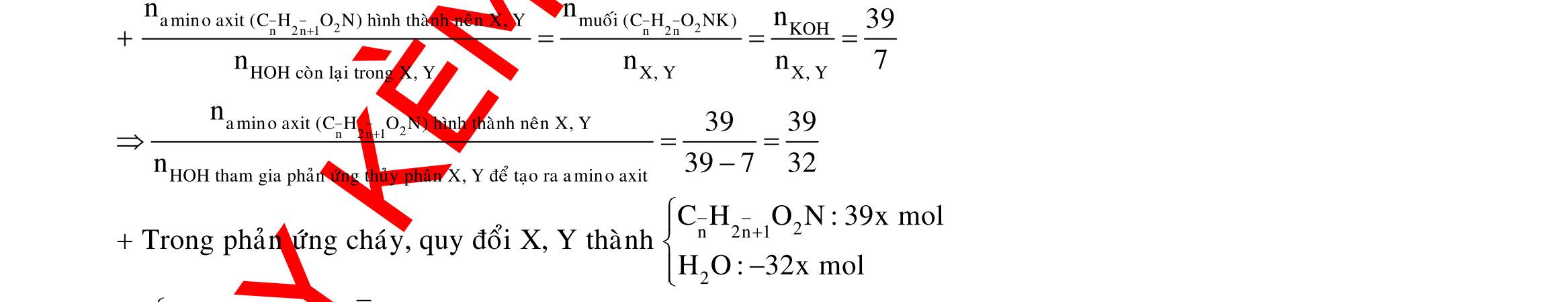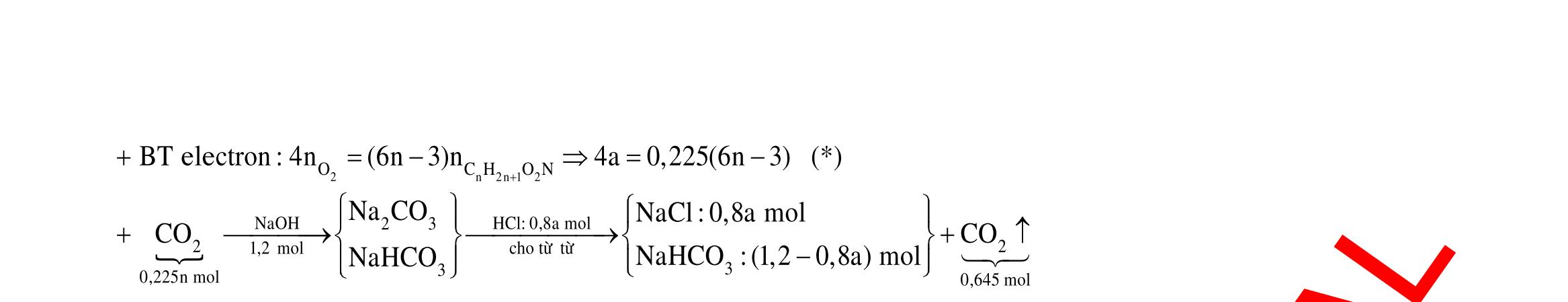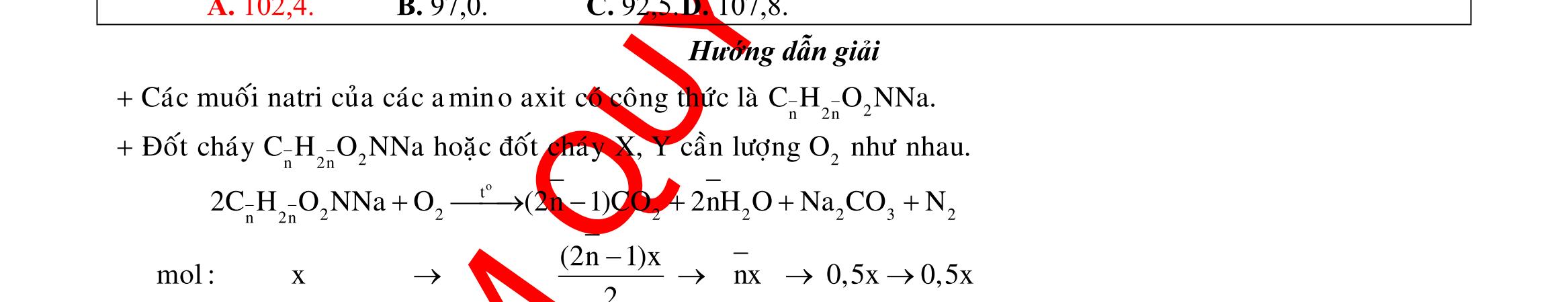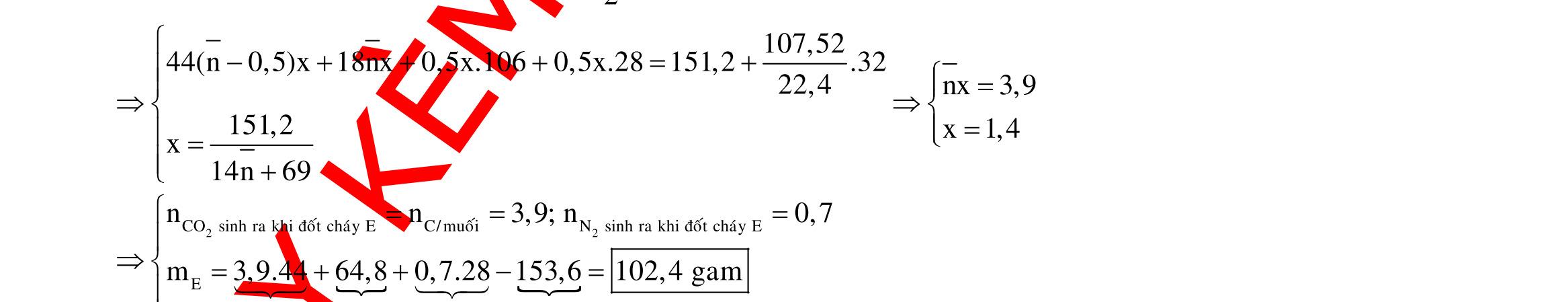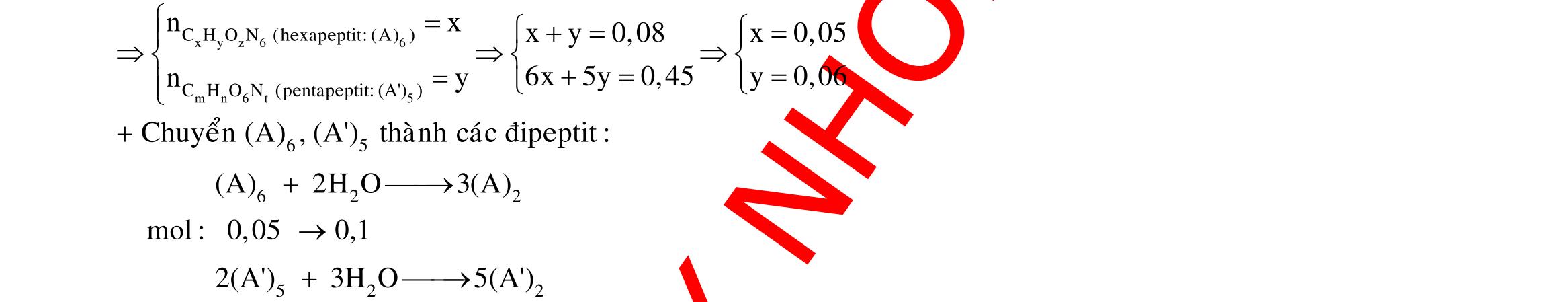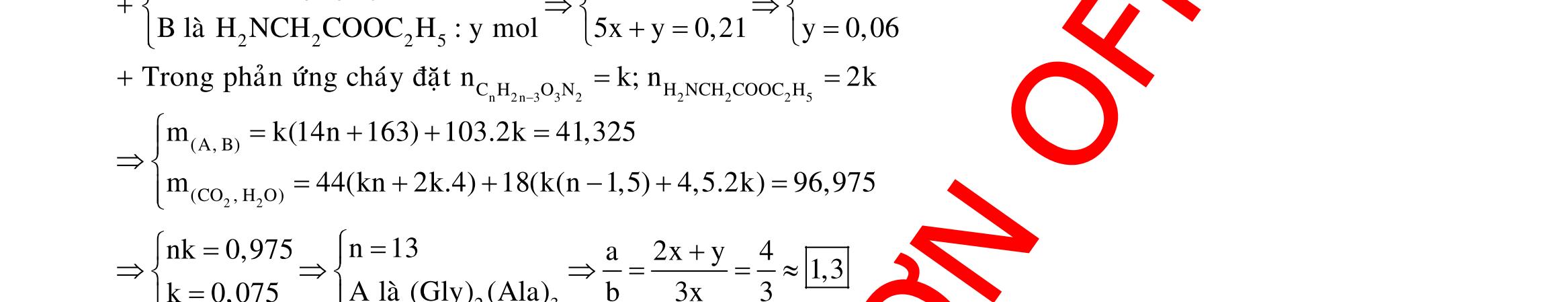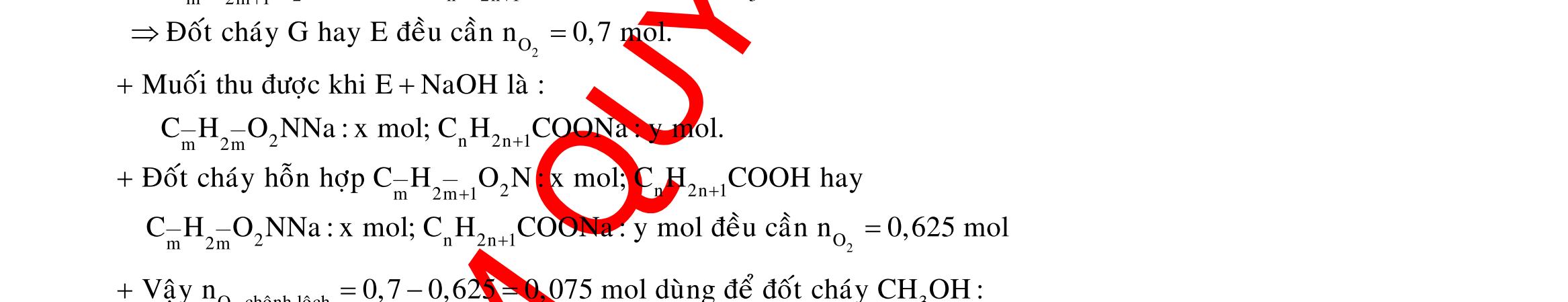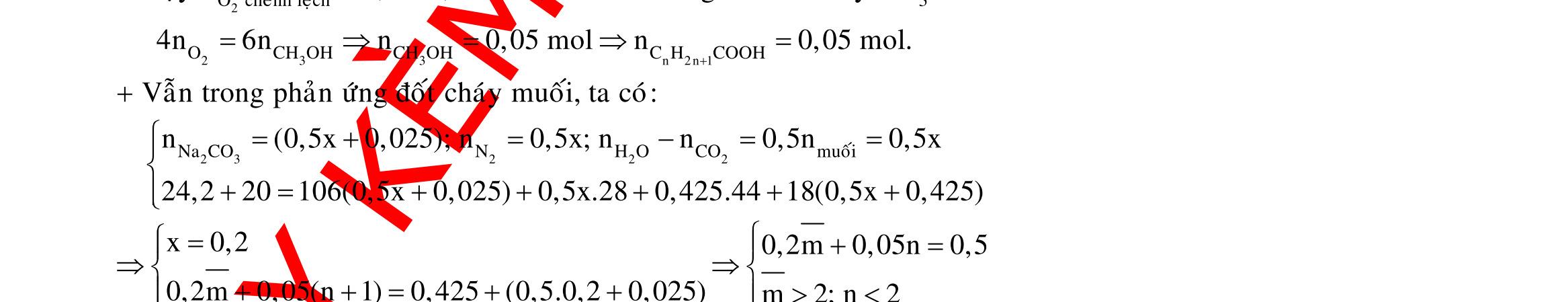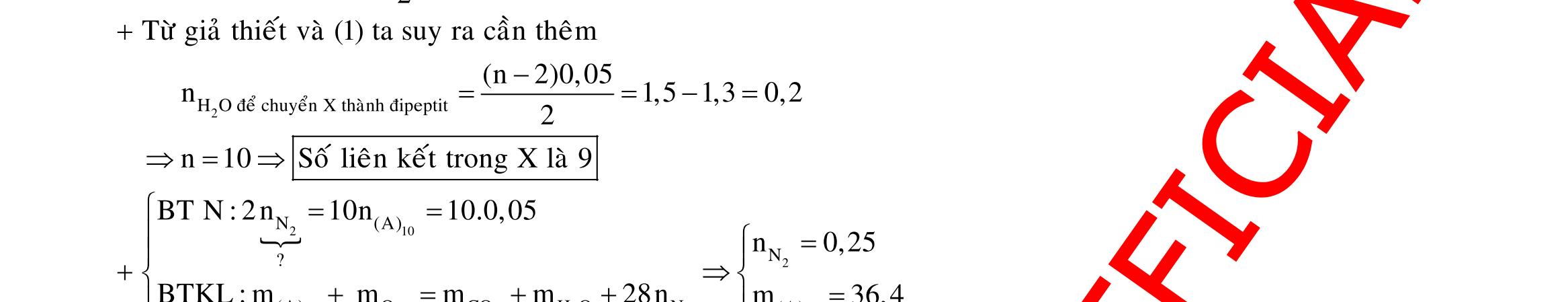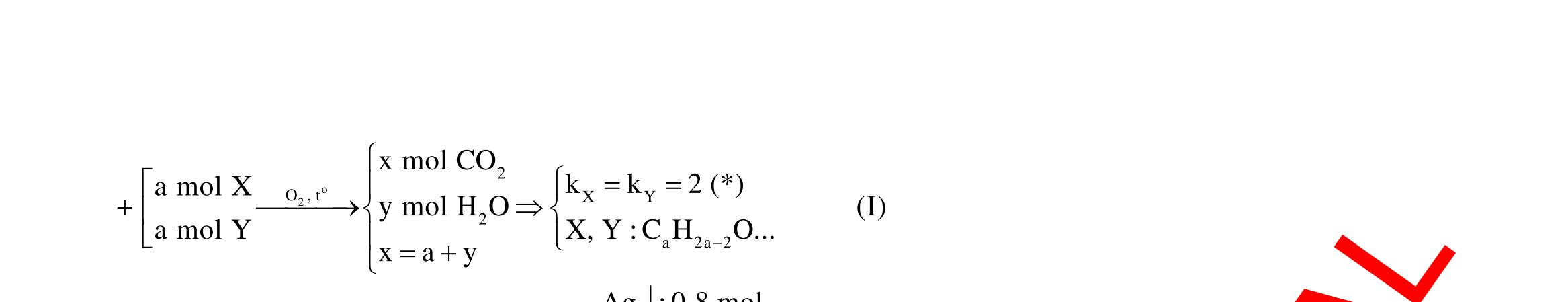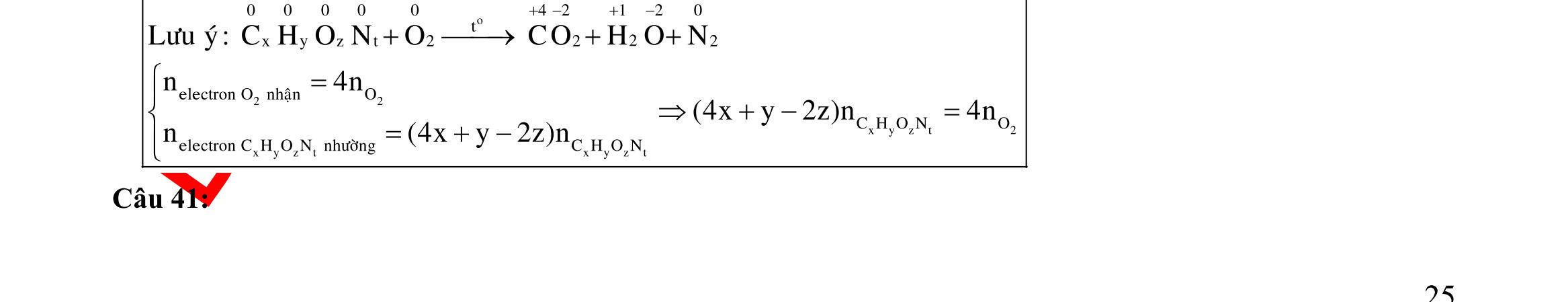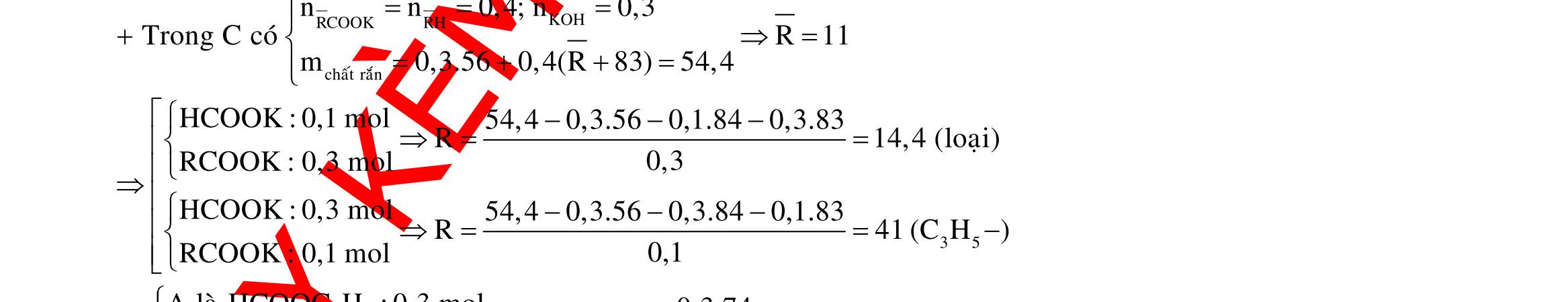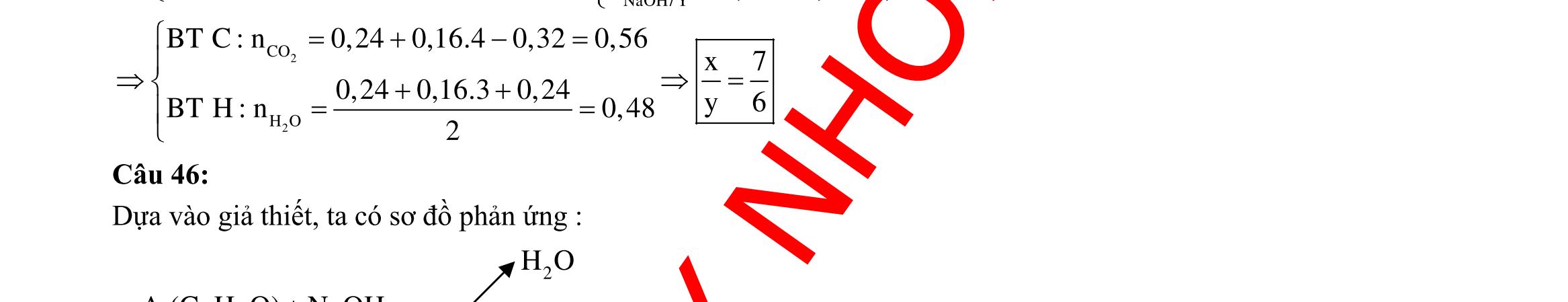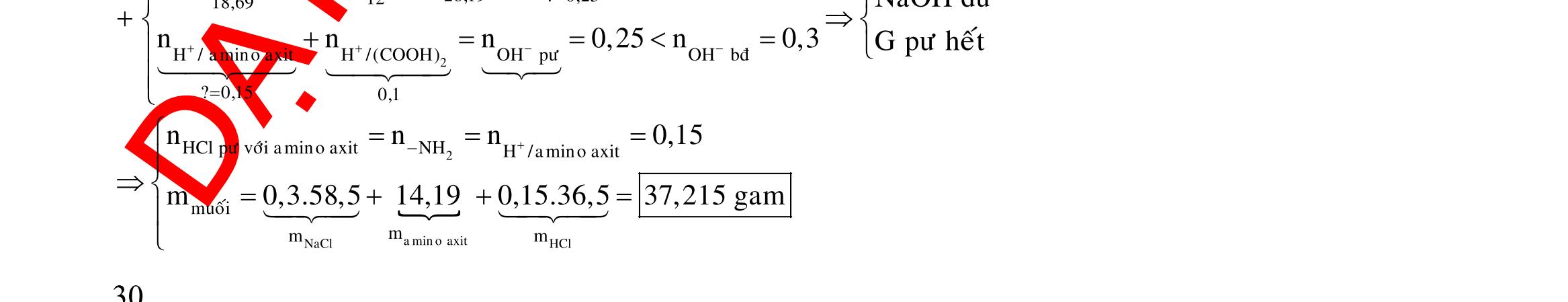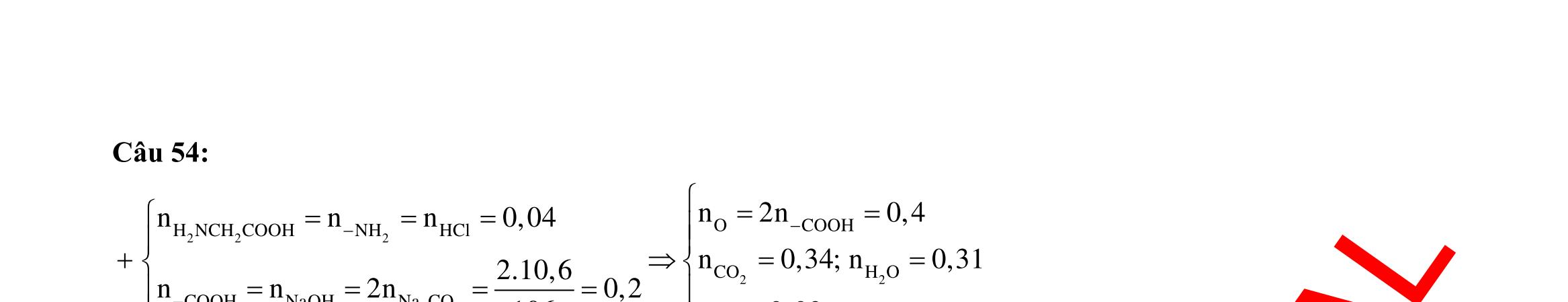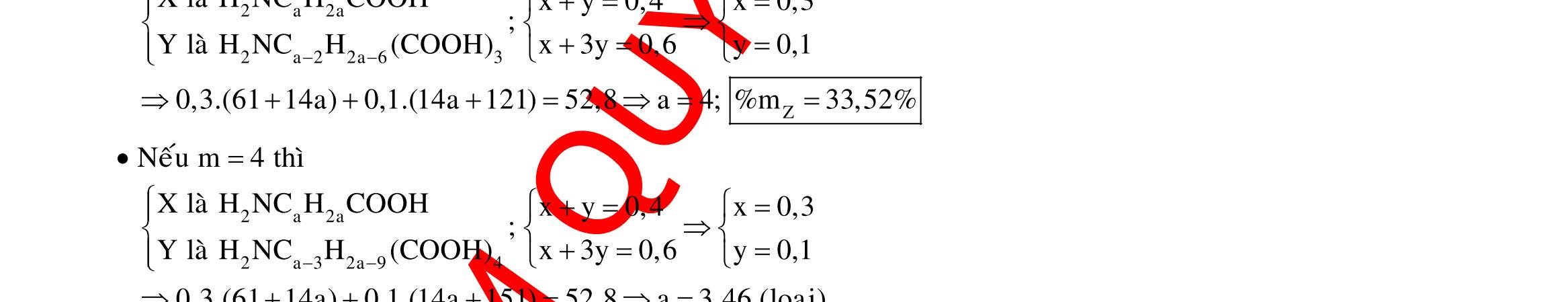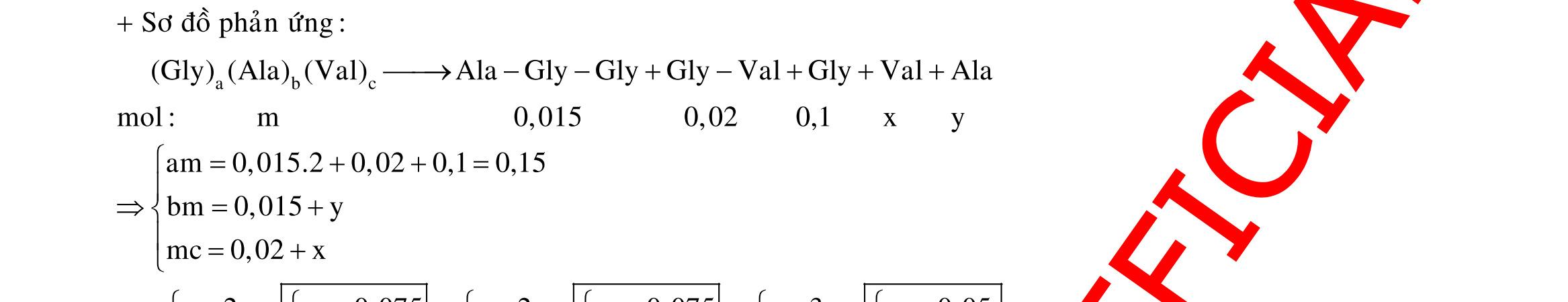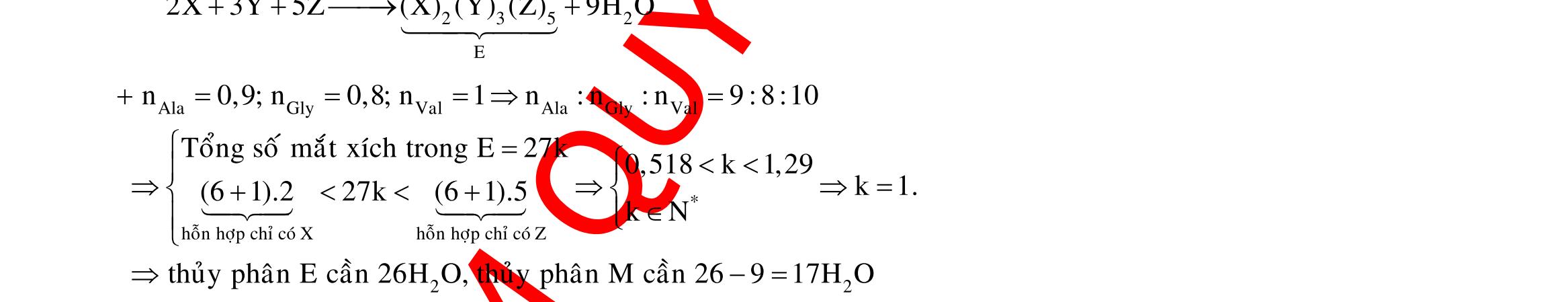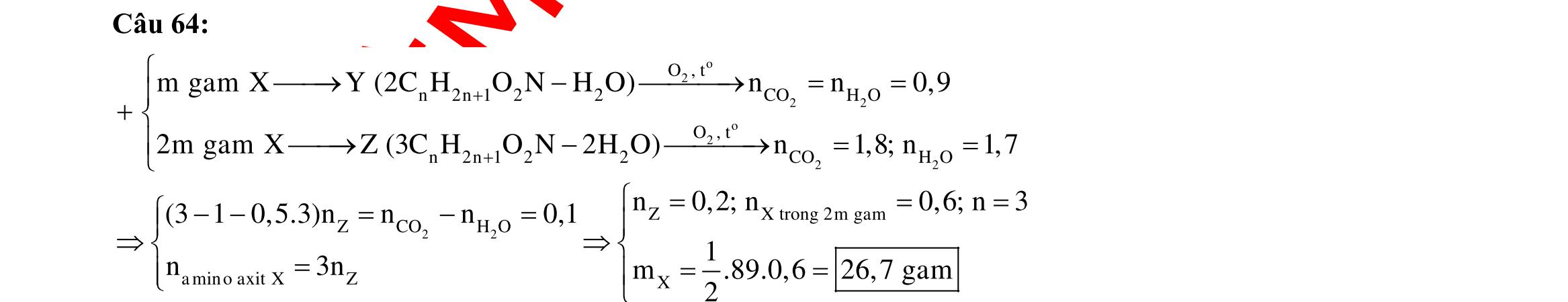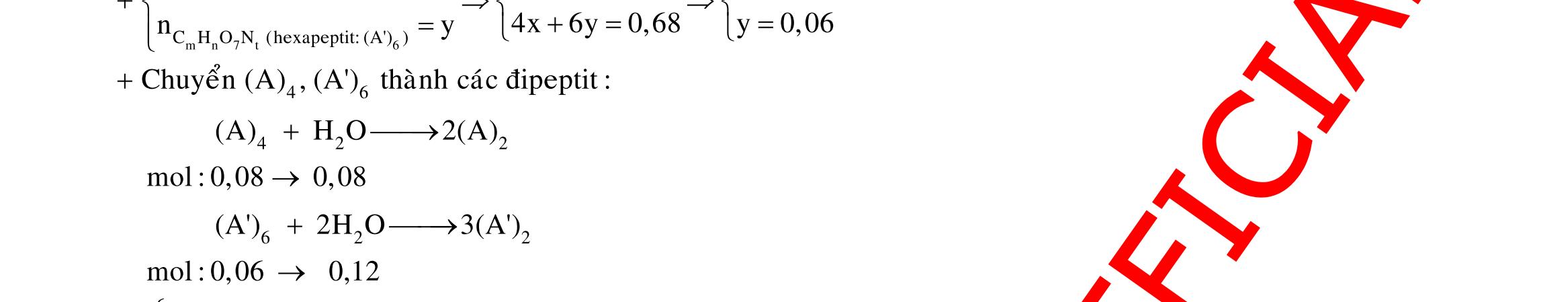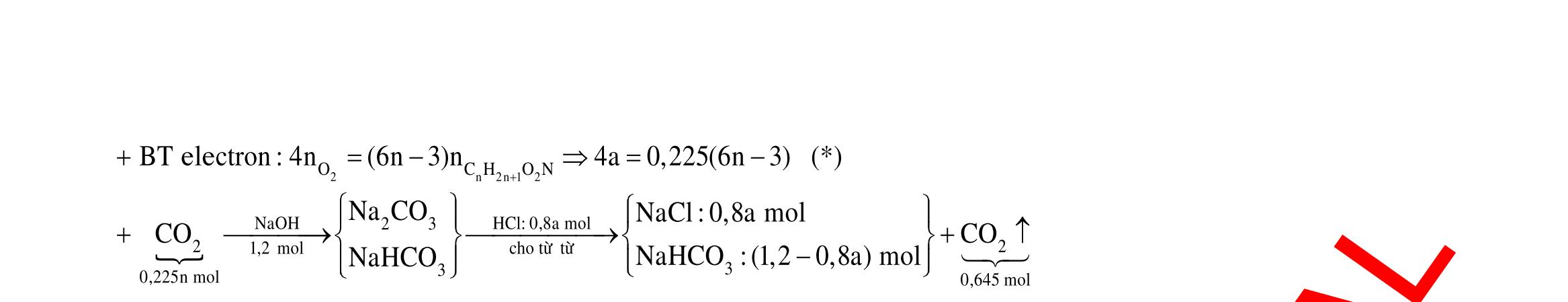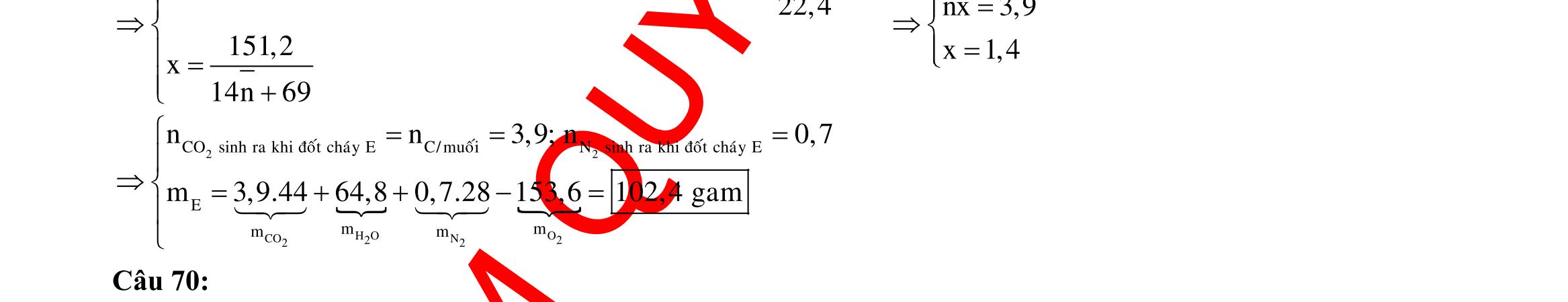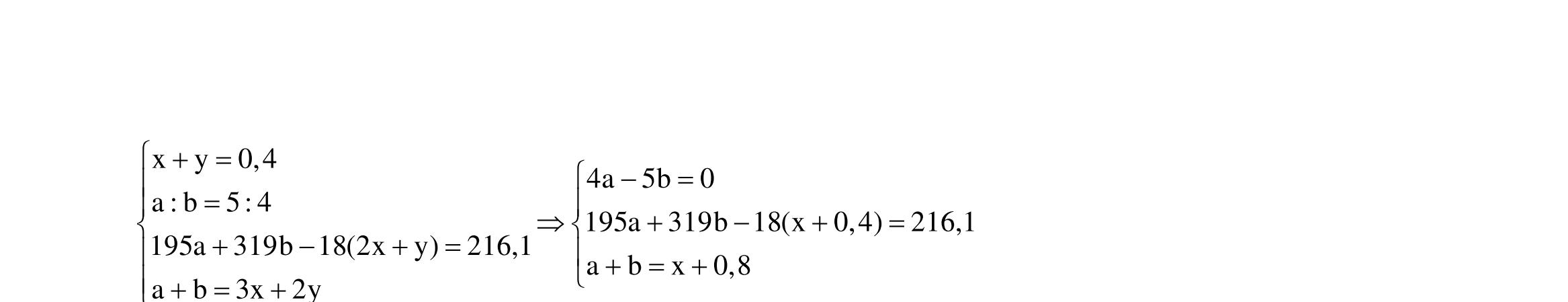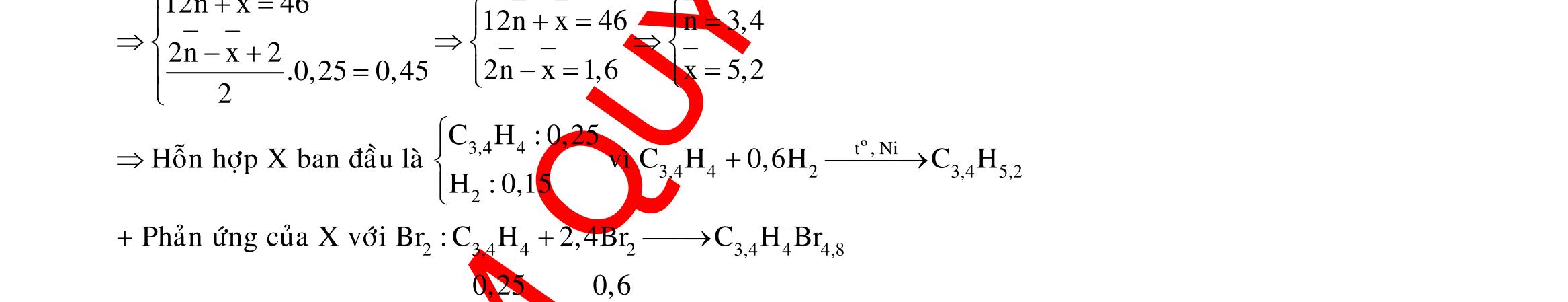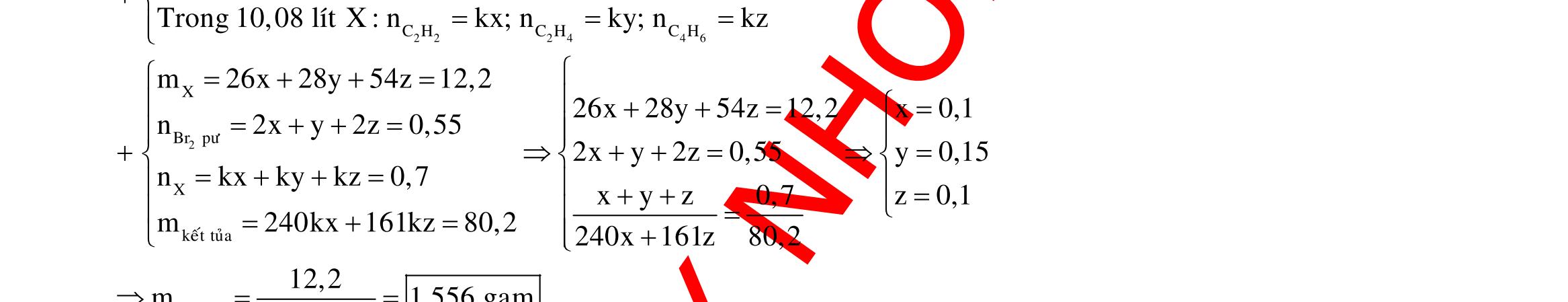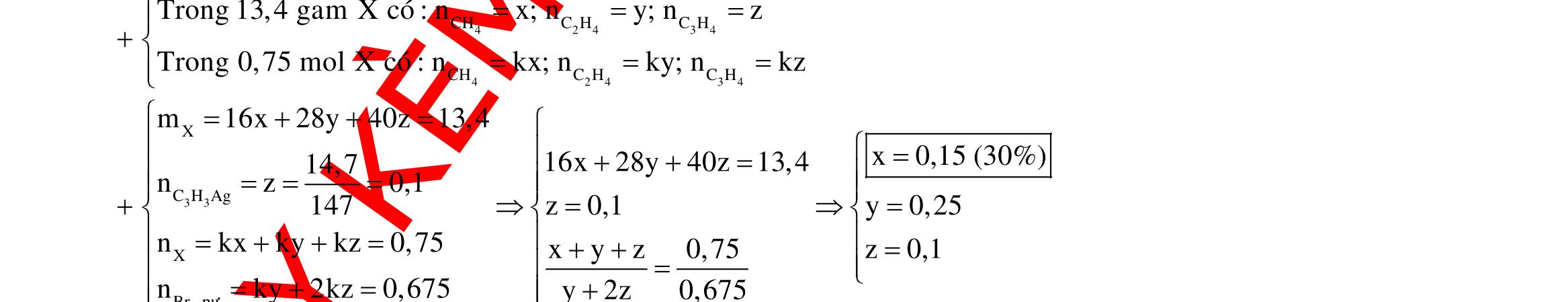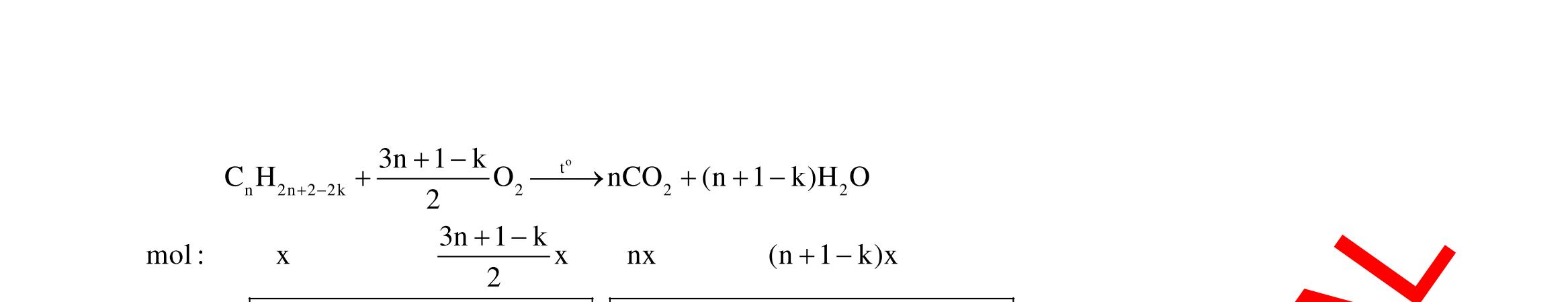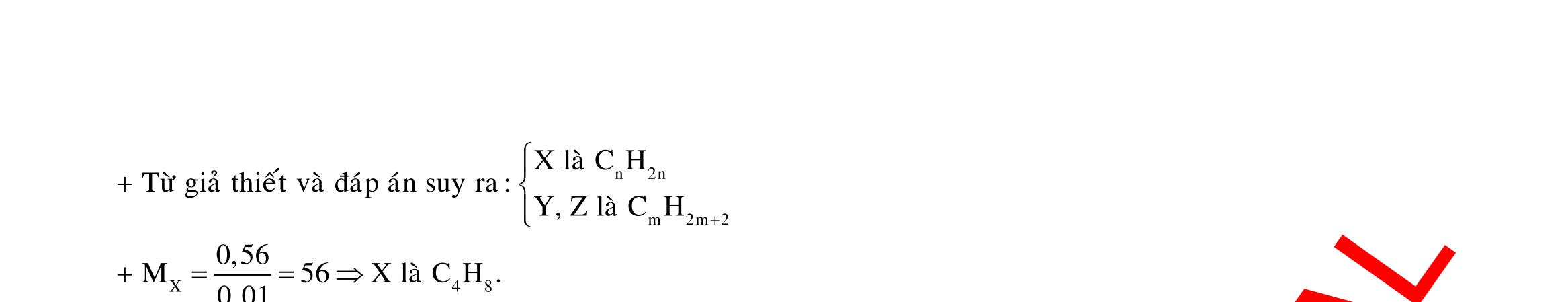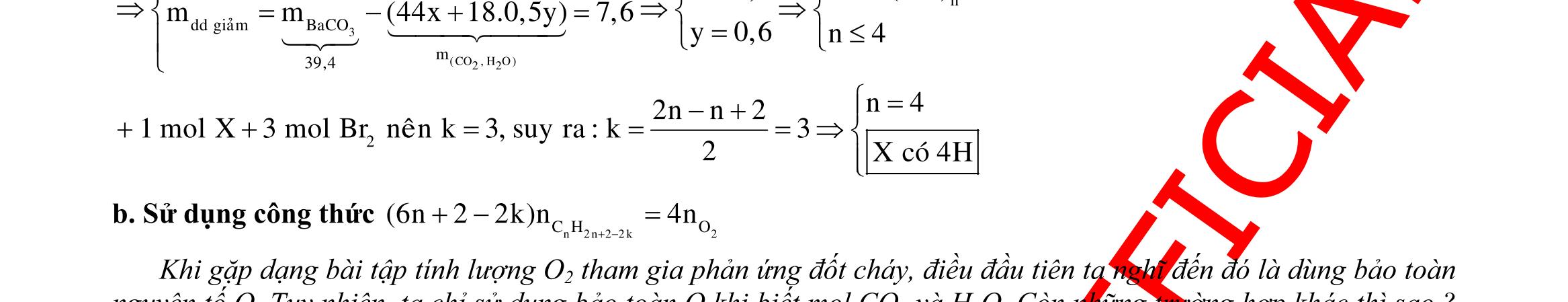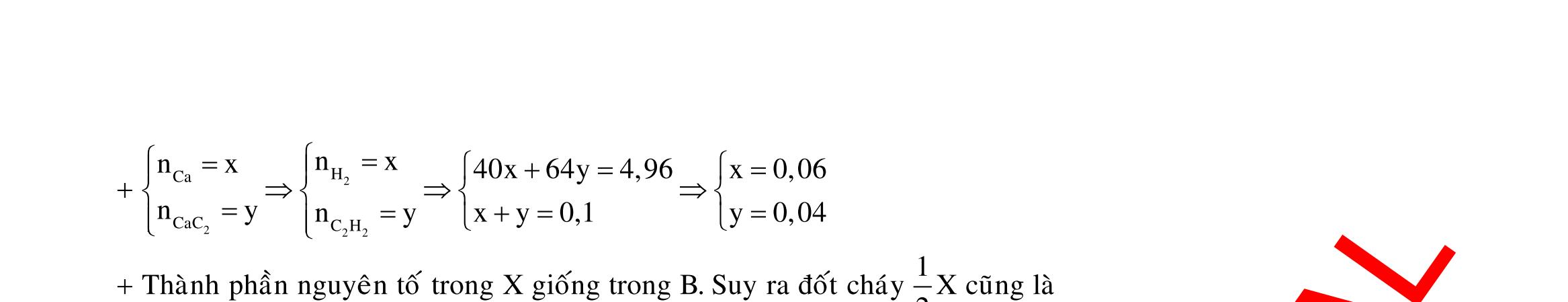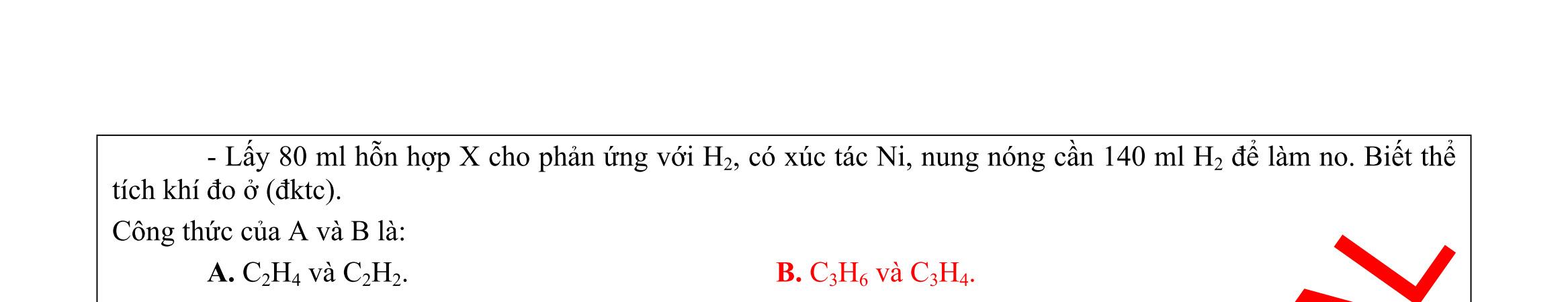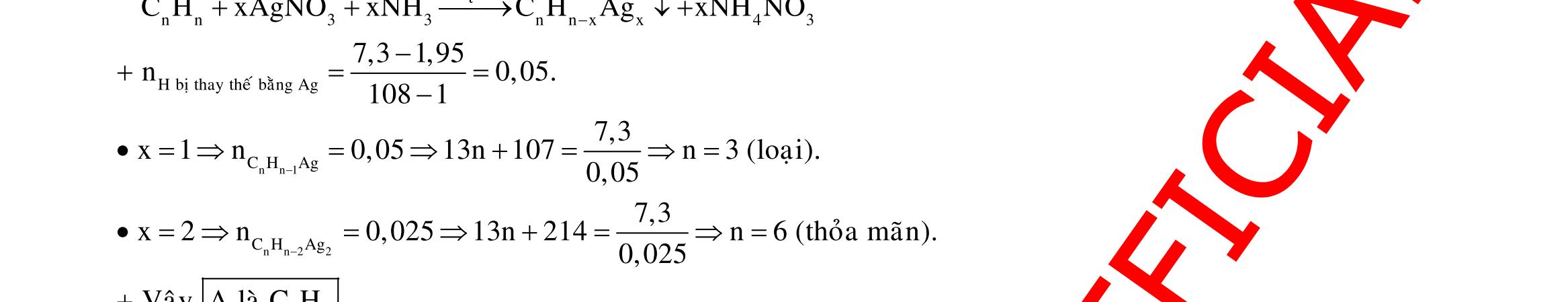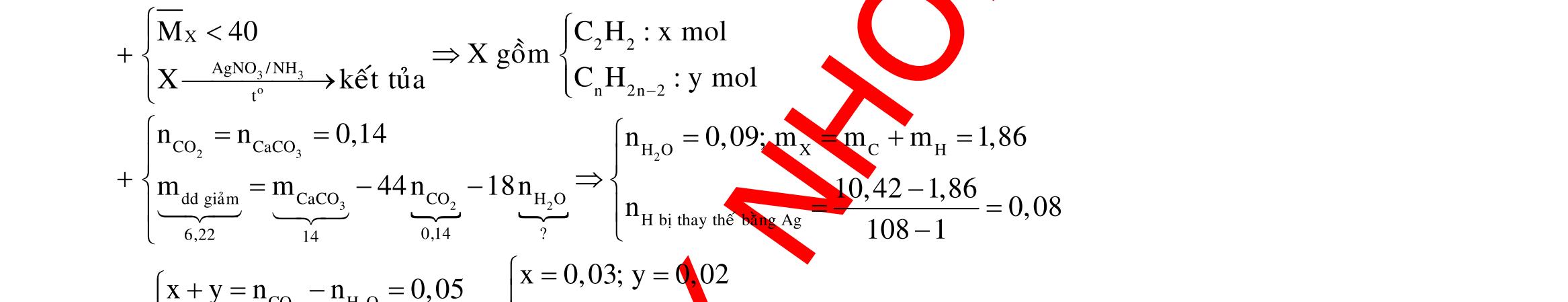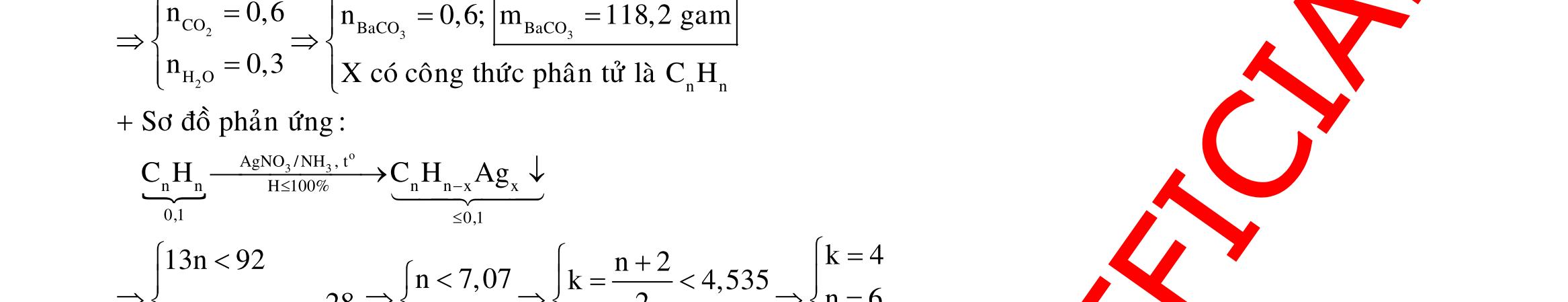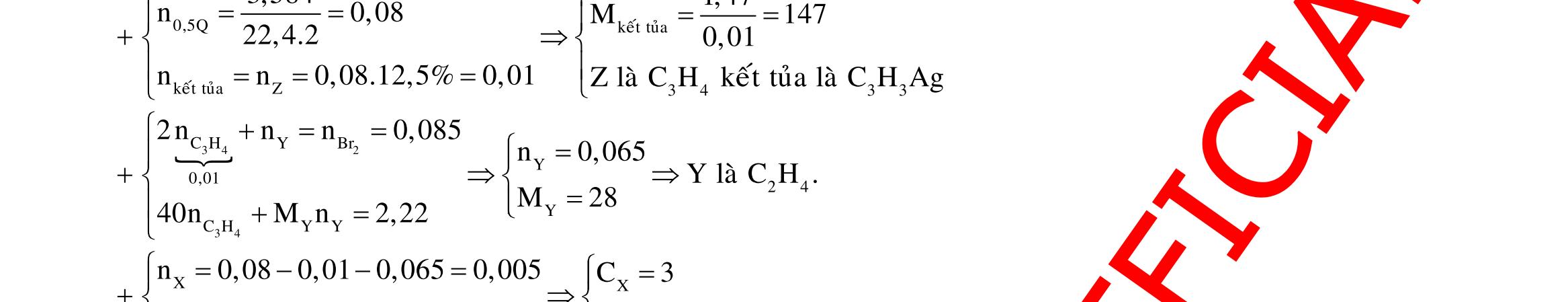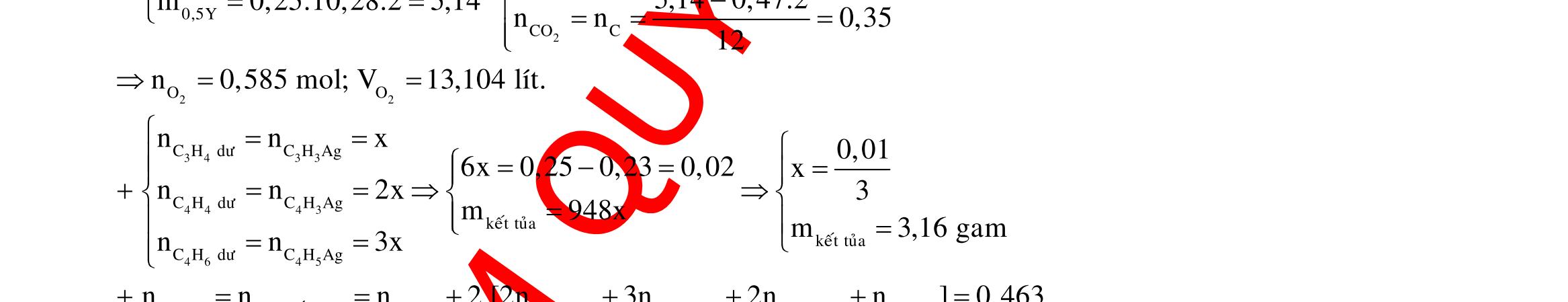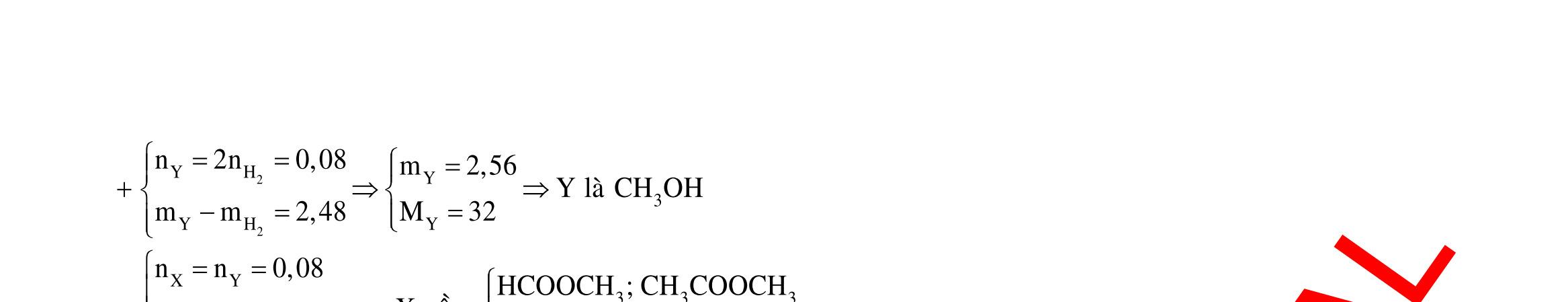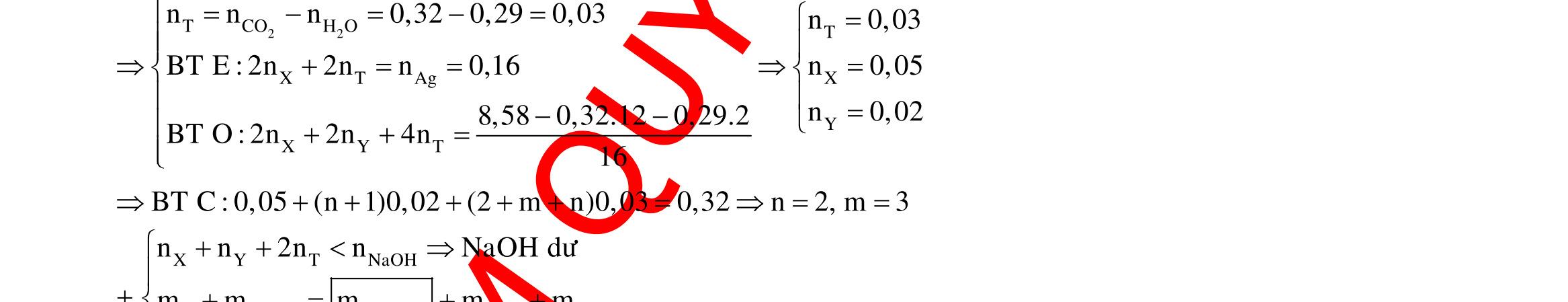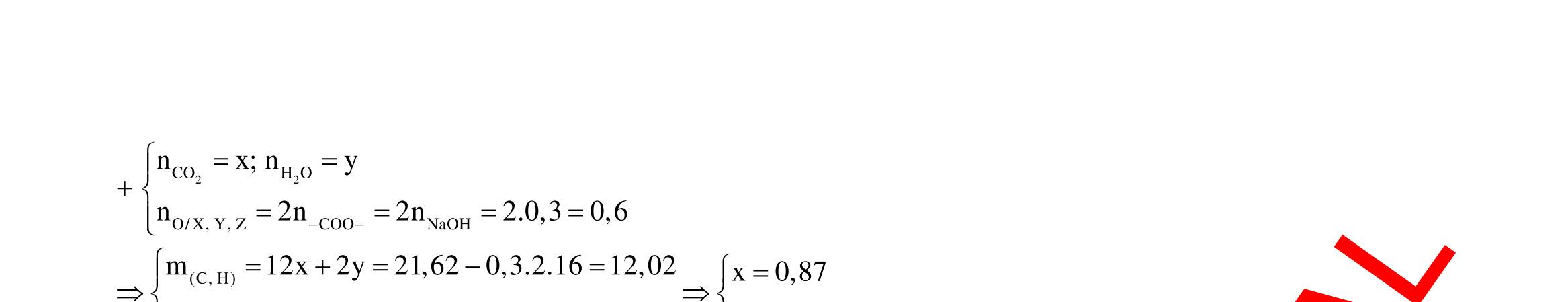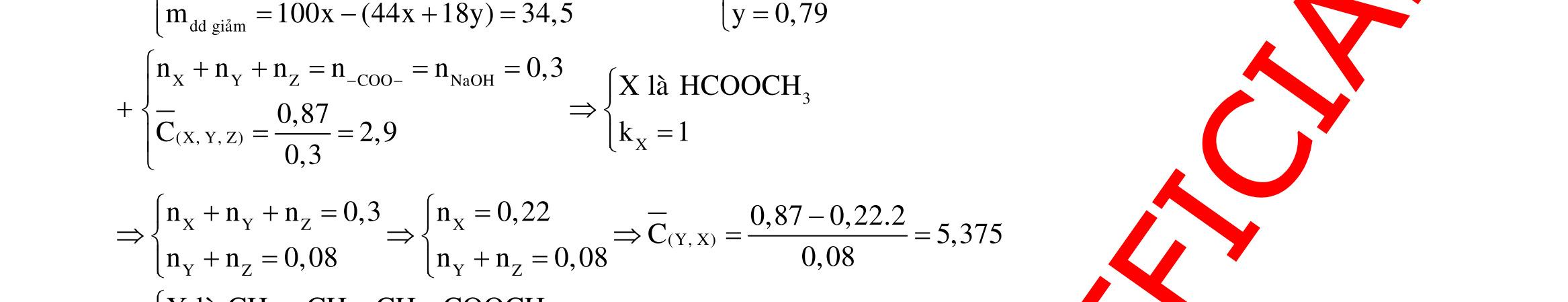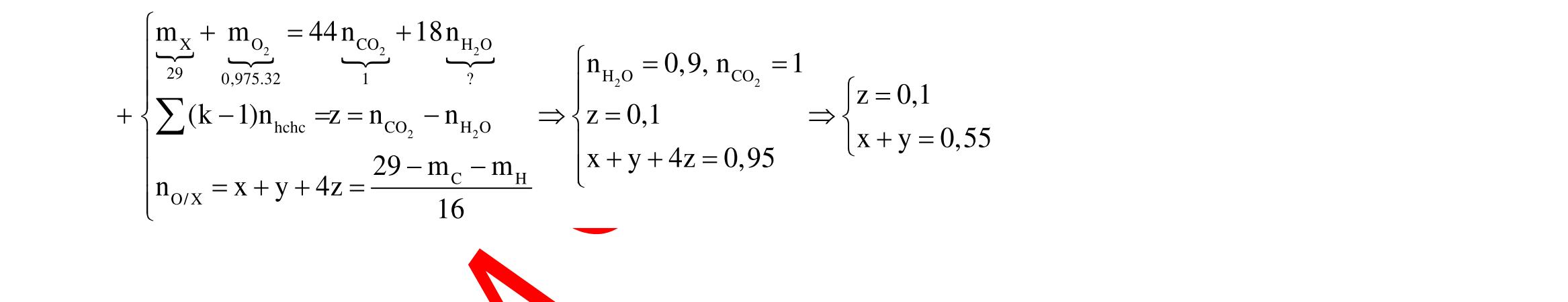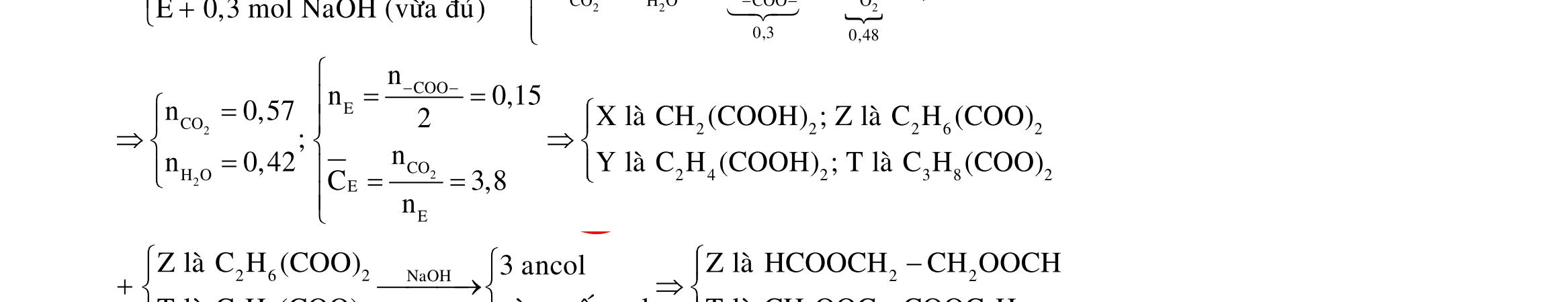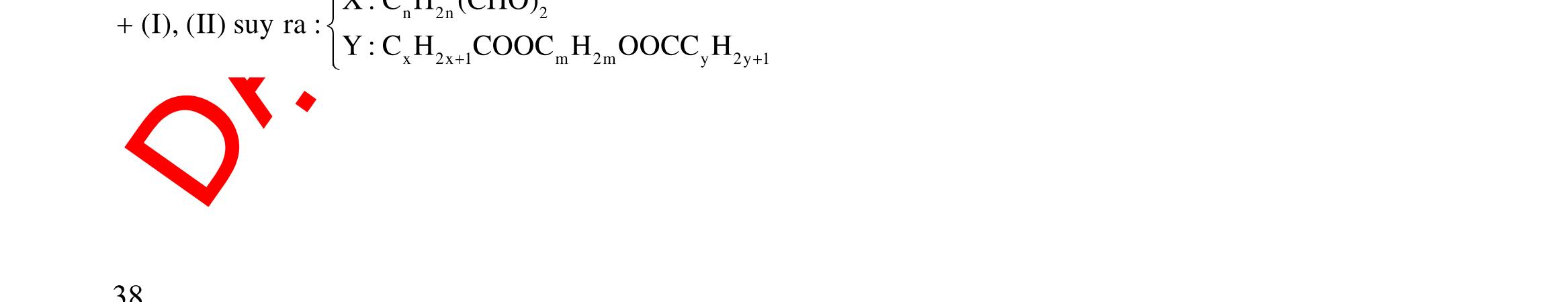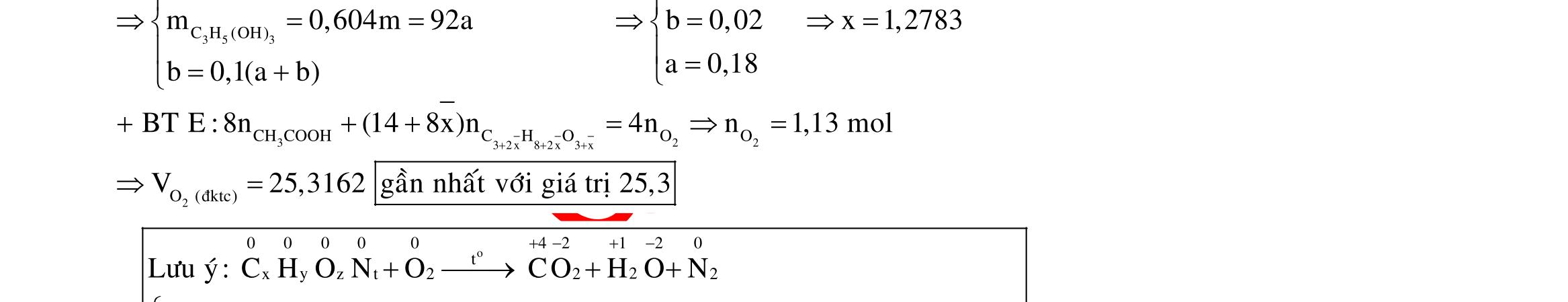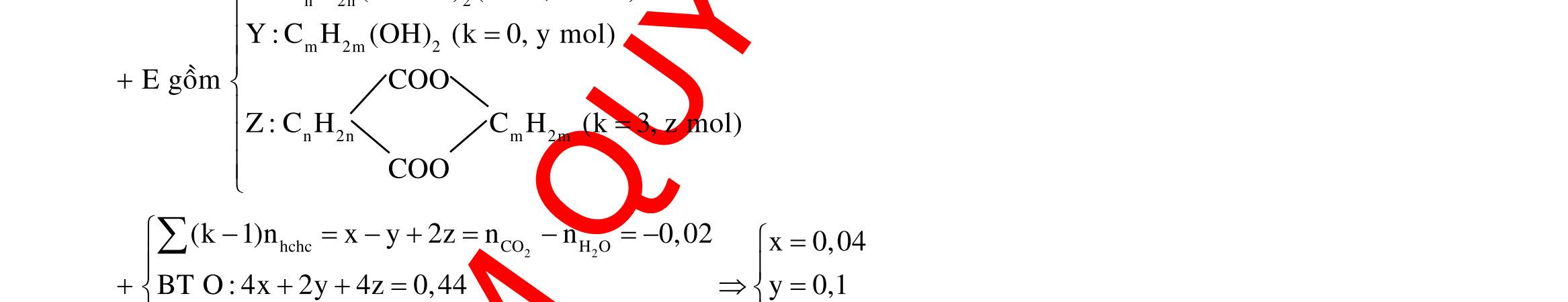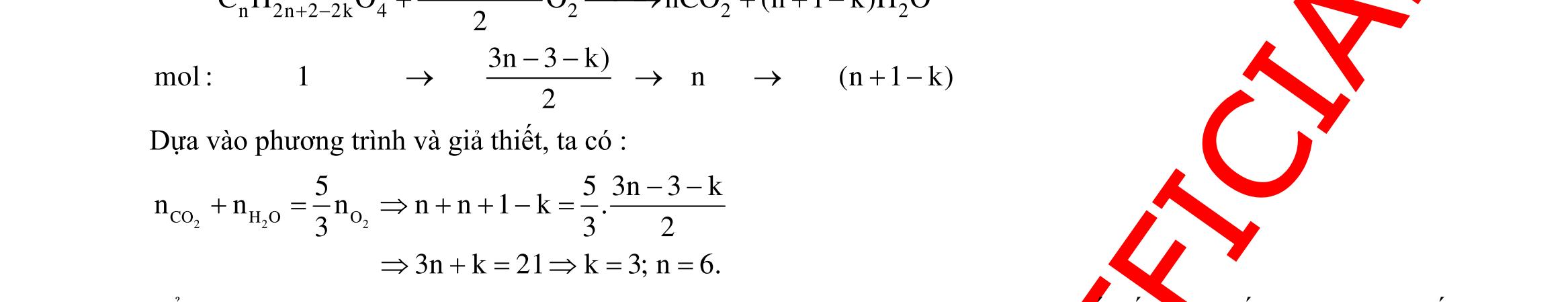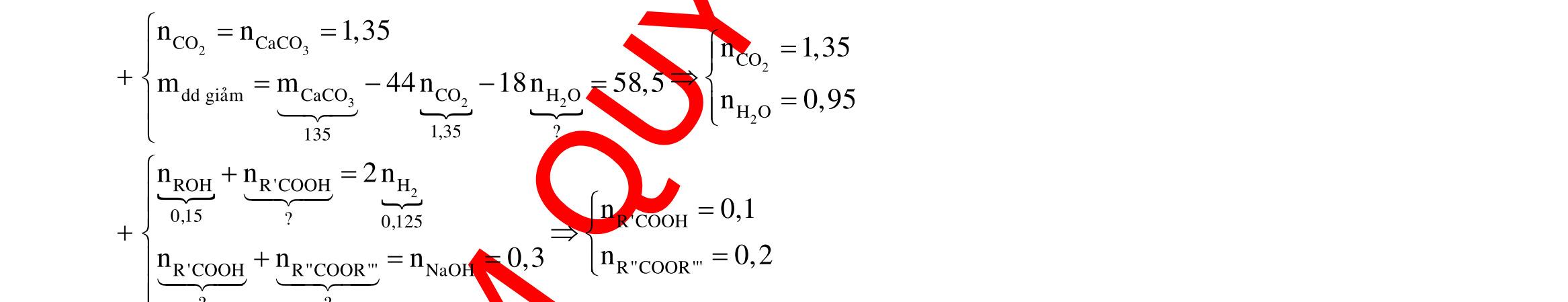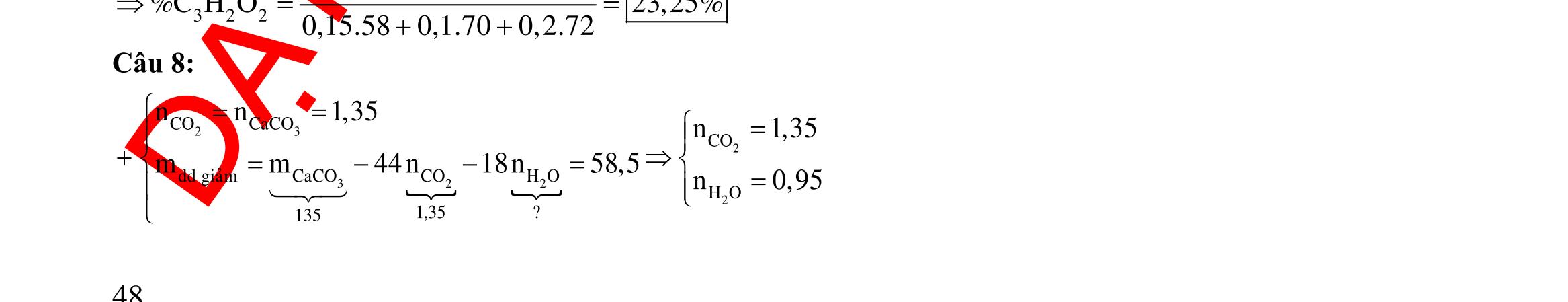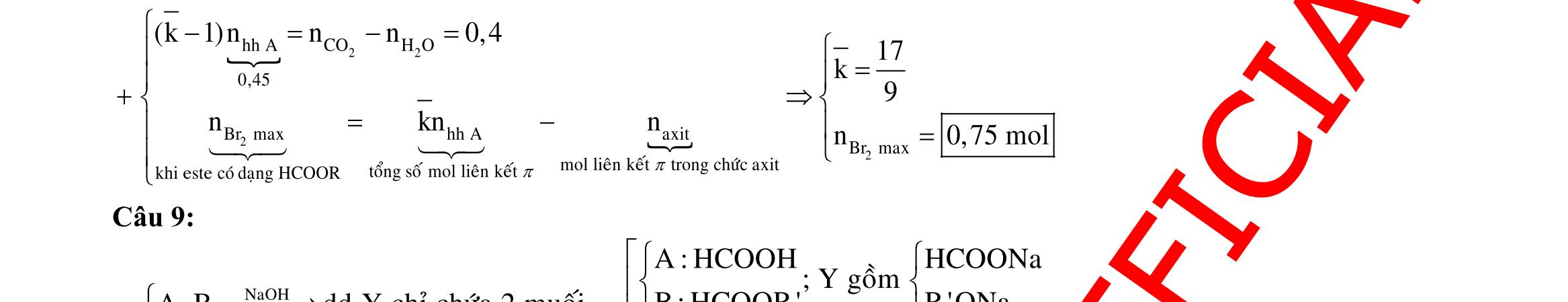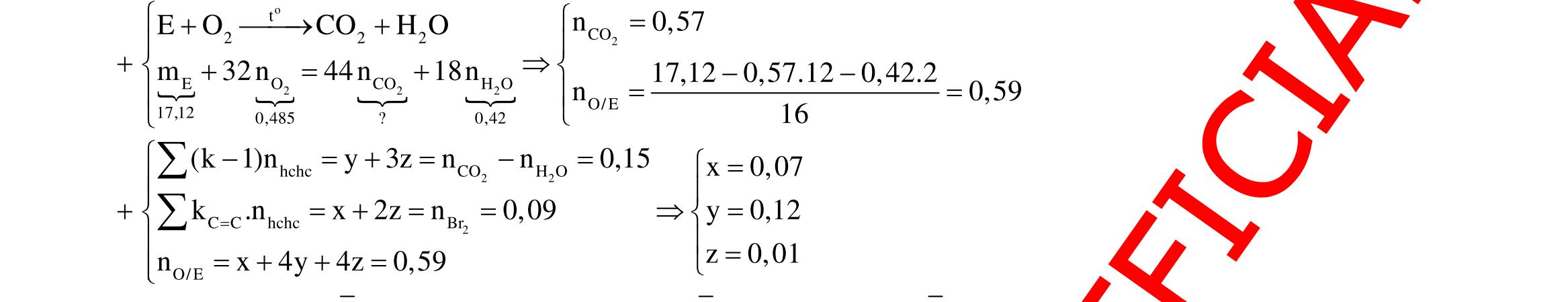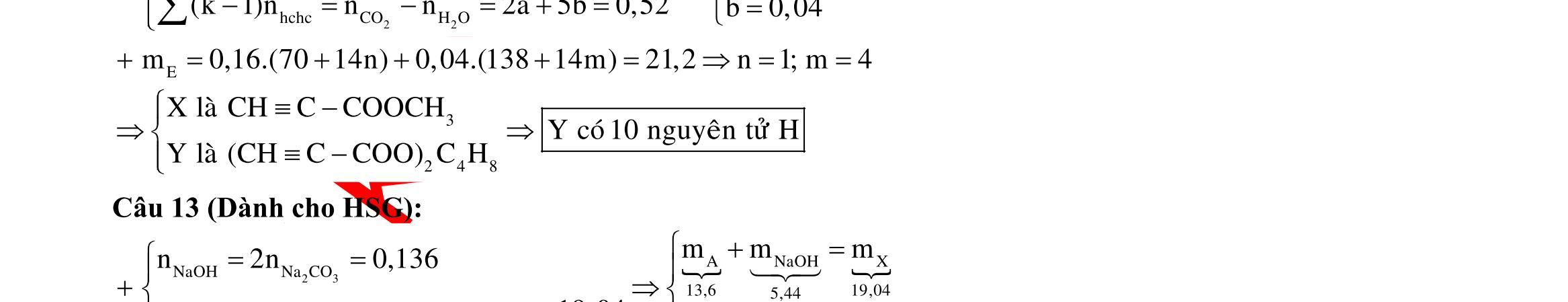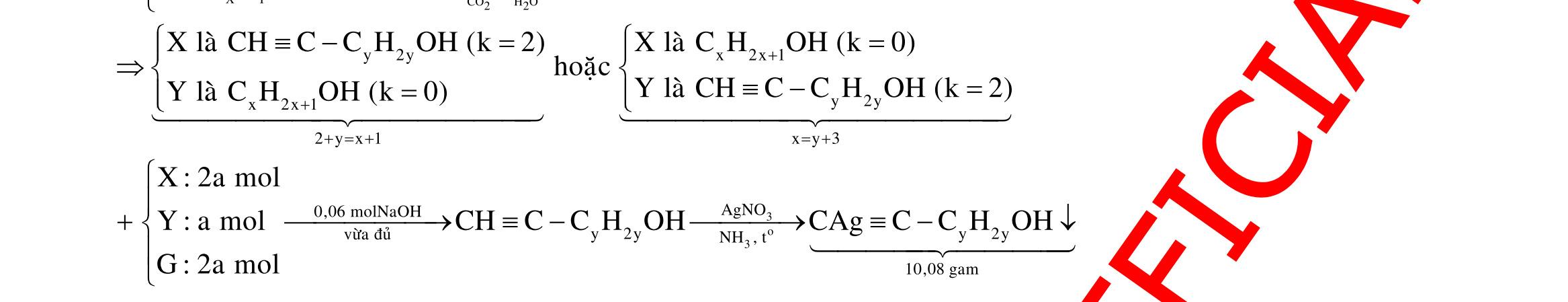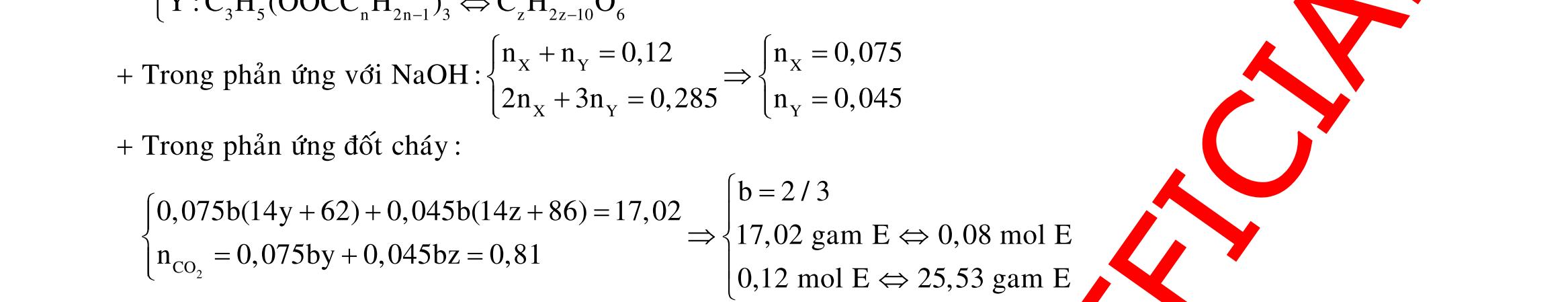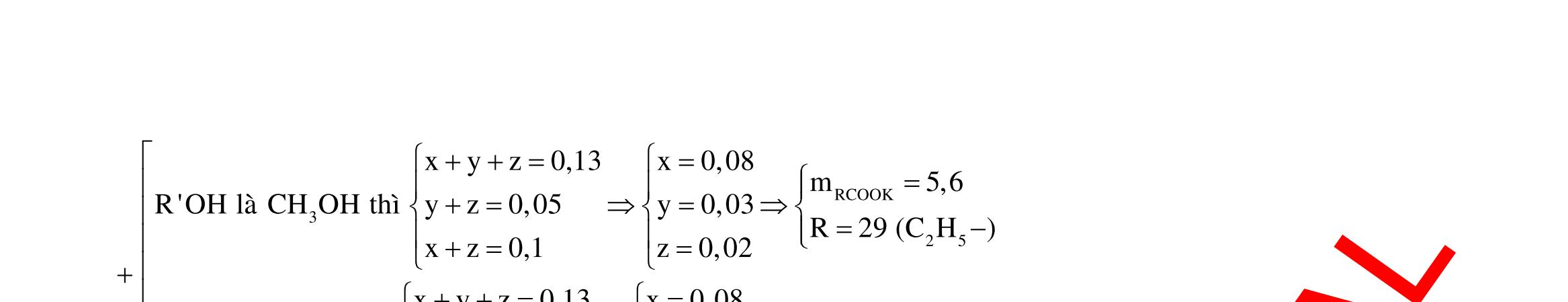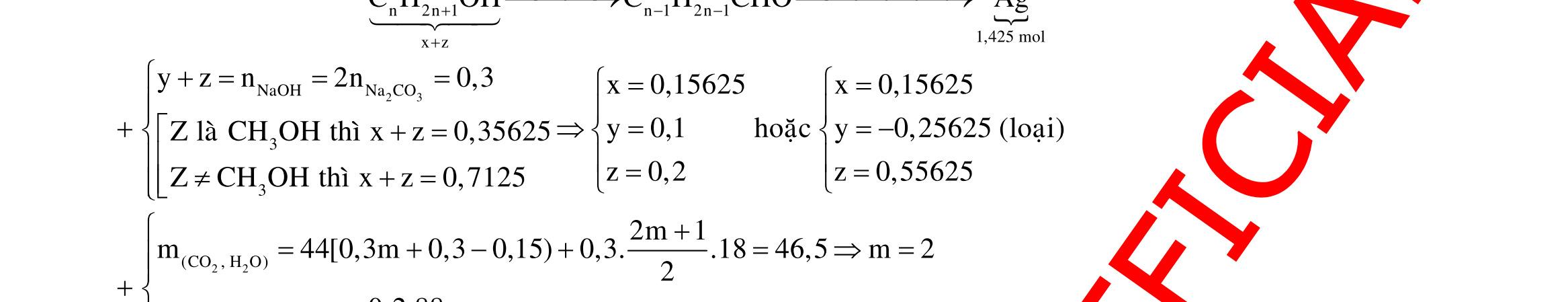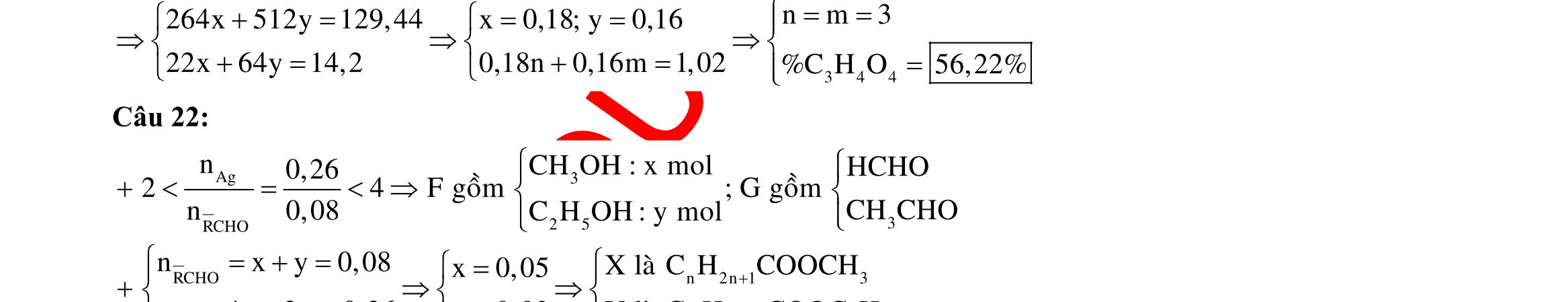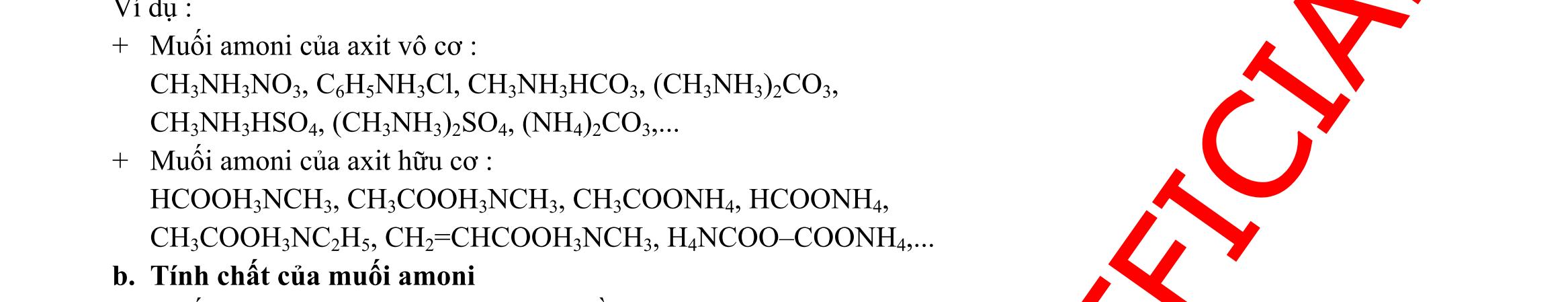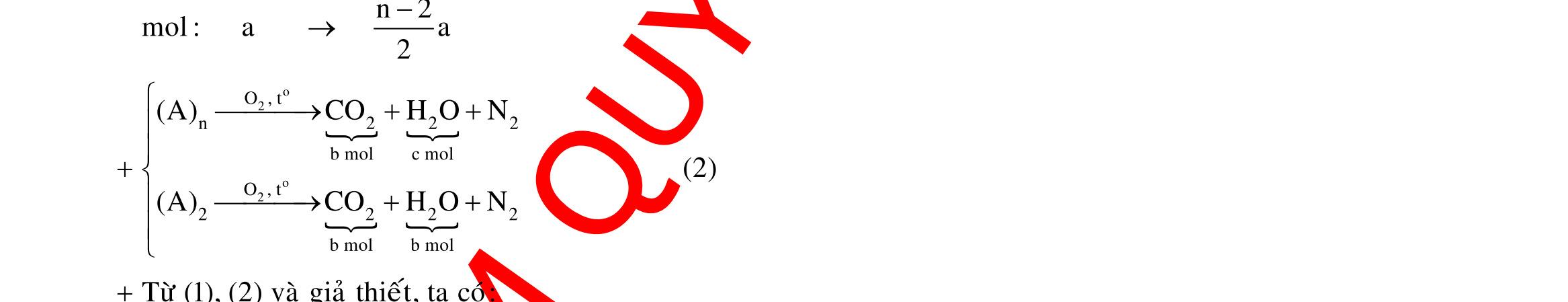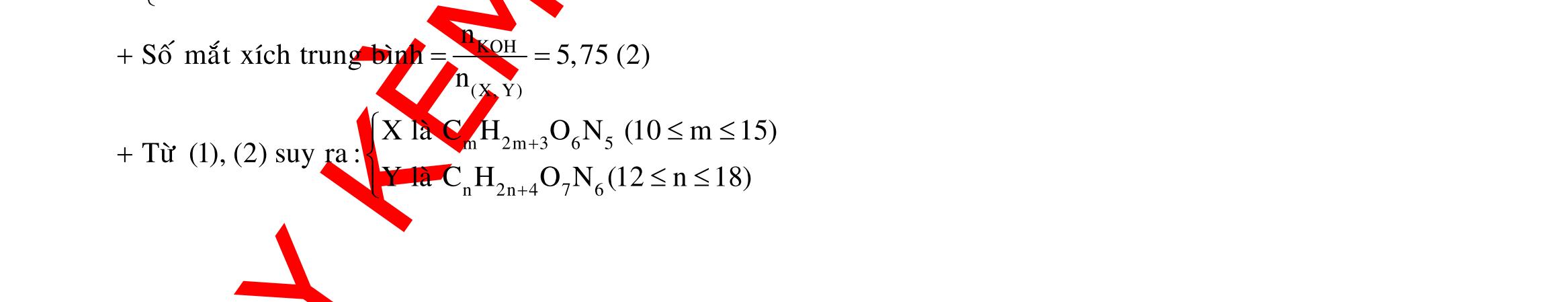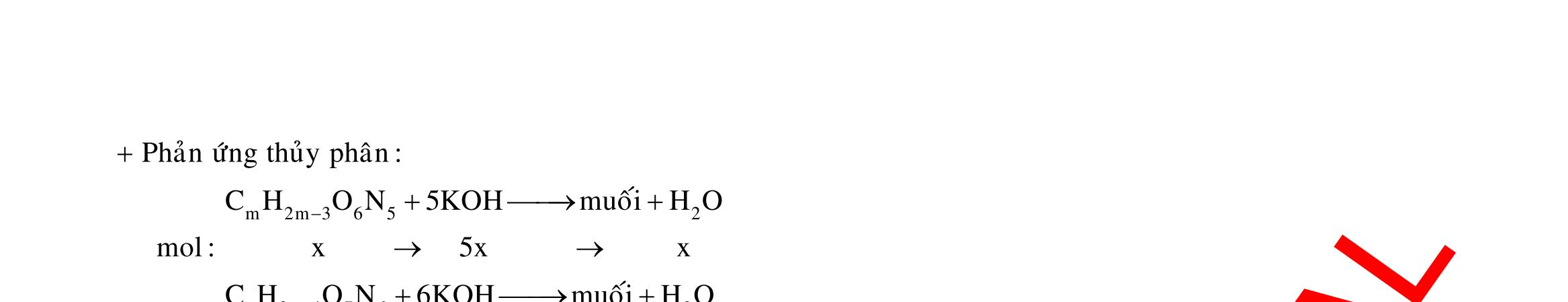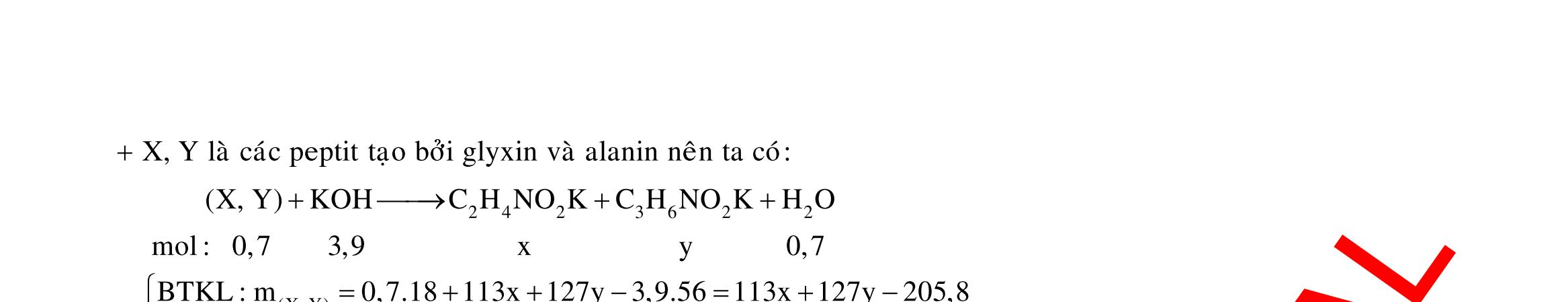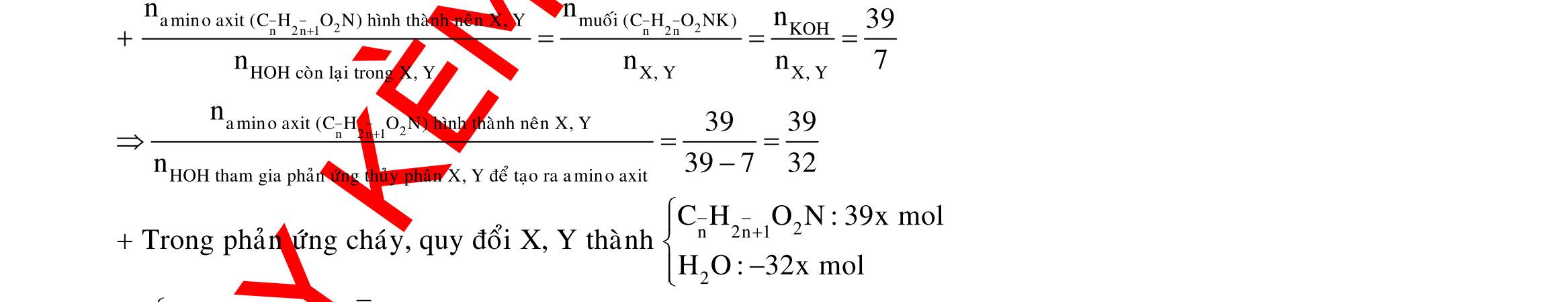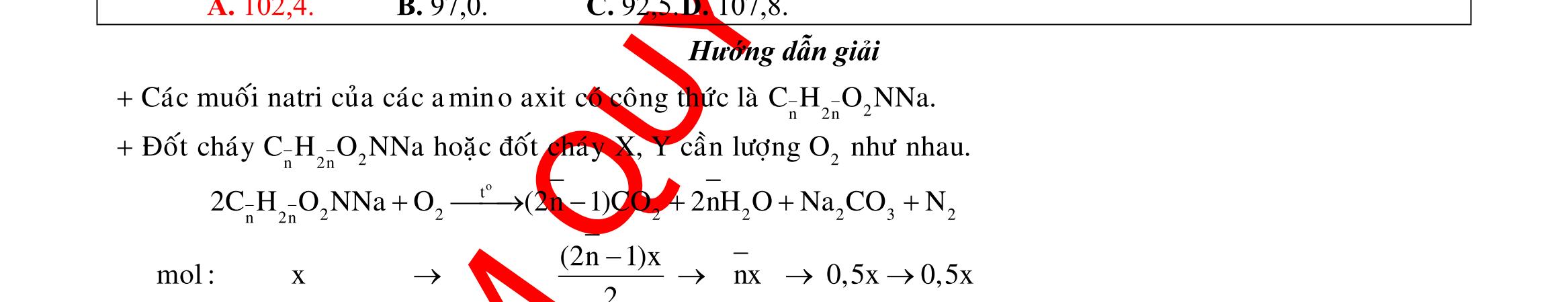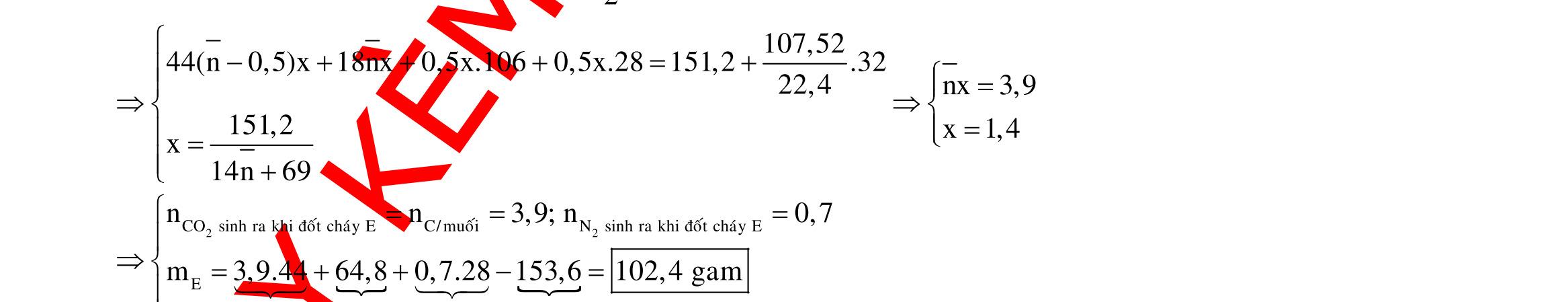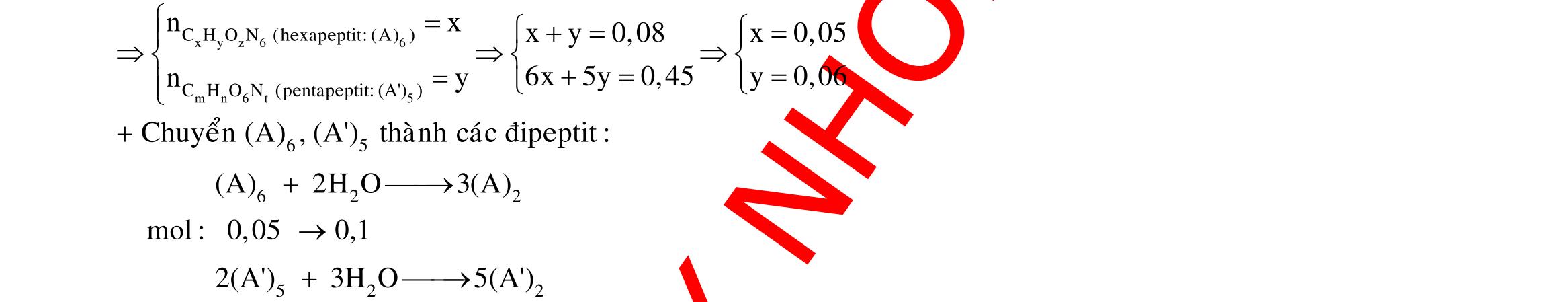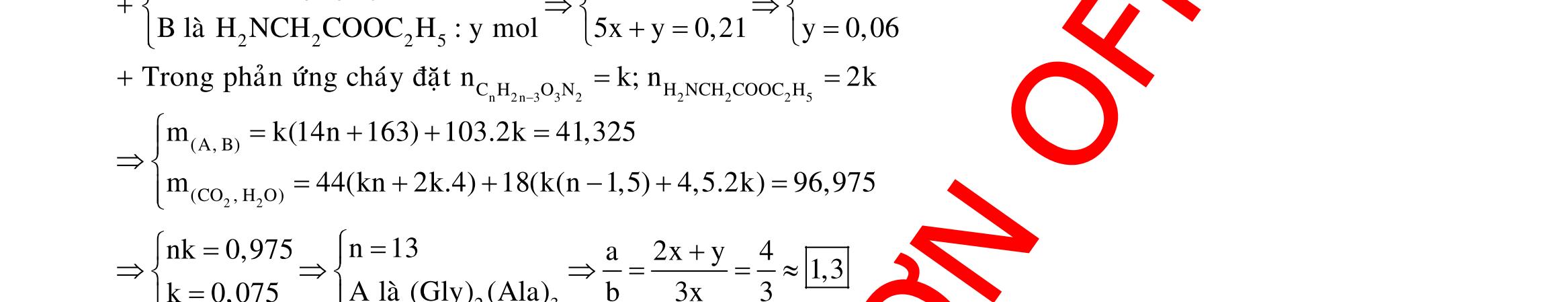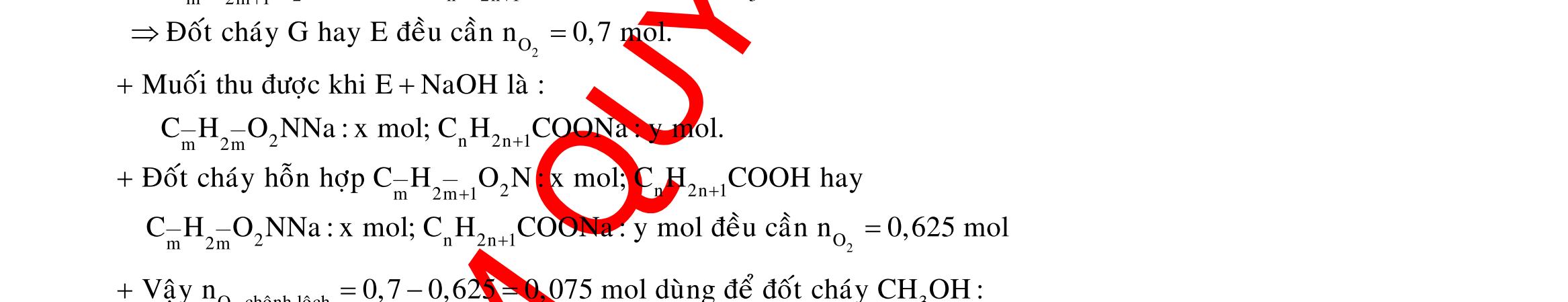BÀI TẬP VẬN DỤNG CAO MÔN HÓA HỌC Ths Nguyễn Thanh Tú eBook Collection CHUYÊN ĐỀ BÀI TẬP VẬN DỤNG CAO HÓA HỌC LỚP 12 ĐIỂM 9, 10 - ĐIỆN PHÂN - VÔ CƠ TỔNG HỢP - ESTE - HỮU CƠ TỔNG HỢP - VÔ CƠ 8, 9, 10 - HỮU CƠ 8, 9, 10 - ĐỒ THỊ, HÌNH VẼ THÍ NGHIỆM - NHẬN BIẾT, TÌM CHẤT WORD VERSION | 2022 EDITION ORDER NOW / CHUYỂN GIAO QUA EMAIL TAILIEUCHUANTHAMKHAO@GMAIL COM Hỗ trợ trực tuyến Fb www.facebook.com/DayKemQuyNhon Mobi/Zalo 0905779594 Tài liệu chuẩn tham khảo Phát triển kênh bởi Ths Nguyễn Thanh Tú Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group vectorstock com/28062440
HỆ THỐNG BÀI TẬP ĐIỆN PHÂN Ở CẤP ĐỘ VẬN DỤNG CAO
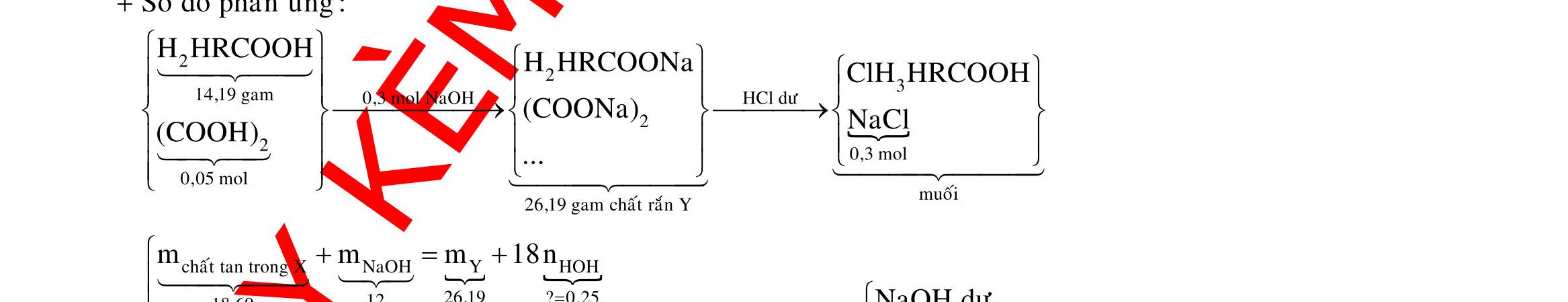
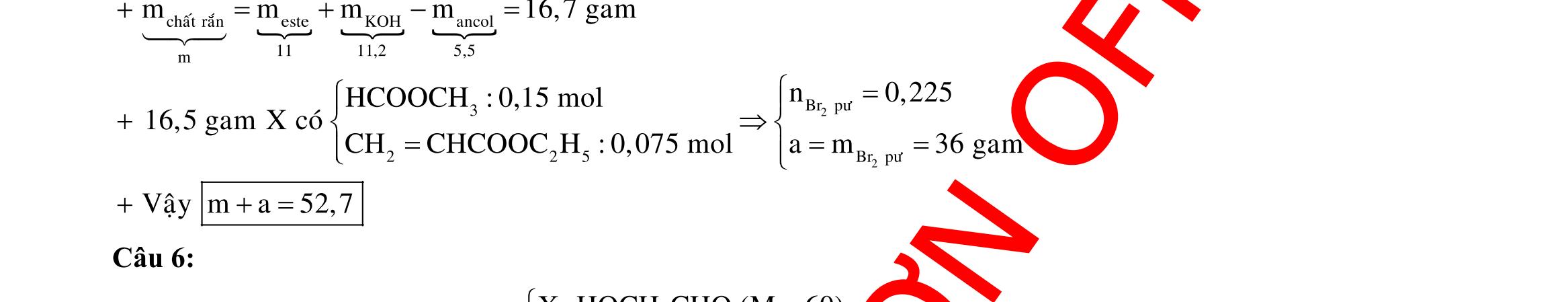
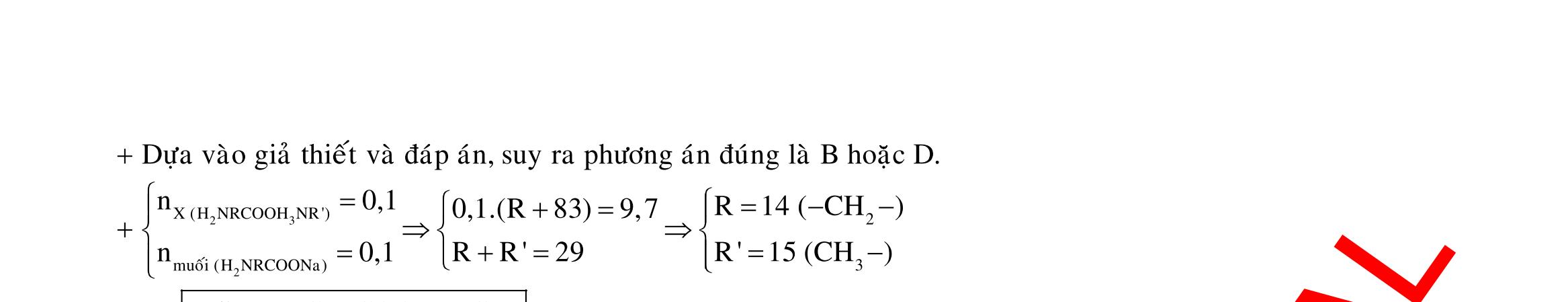
Câu 1: Hòa tan 13,68 gam muối MSO4 vào nước được dung dịch X. Điện phân X (với điện cực trơ, cường độ dòng điện không đổi) trong thời gian t giây, được y gam kim loại M duy nhất ở catot và 0,035 mol khí ở anot. Còn nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 0,1245 mol. Giá trị của y là
A. 4,480. B. 3,920. C. 1,680. D. 4,788. Câu 2: Điện phân với điện cực trơ dung dịch chứa 0,5 mol AgNO3 với cường độ dòng điện 3,86A, trong thời gian t giây, thu được dung dịch X (hiệu suất quá trình điện phân là 100%). Cho 22,4 gam bột Fe vào X, thấy thoát ra khí NO (sản phẩm khử duy nhất) và sau các phản ứng hoàn toàn thu được 42,2 gam chất rắn Y. Giá trị của t là
A. 3000. B. 2500. C. 3600. D. 5000. Câu 3: Điện phân 225 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 4,02A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 18,9 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 21,75 gam rắn T và khí NO (sản phẩm khử duy nhất của N+5). Phát biểu nào sau đây sai?
A. Chất rắn T thu được chứa 2 kim loại.
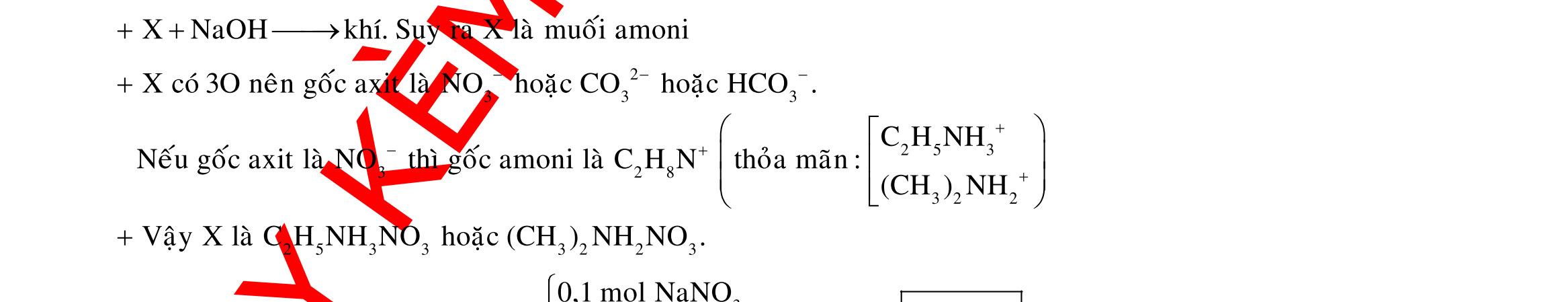
B. Do Y có chứa HNO3 nên dung dịch sau điện phân có pH<7.
C. Trước khi cho sắt vào, nước ở catot chưa bị điện phân.
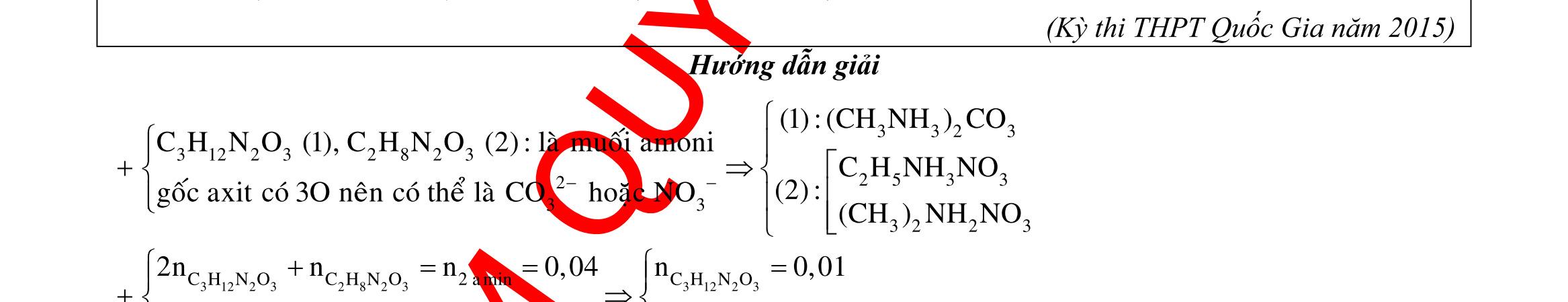
OFFICIAL
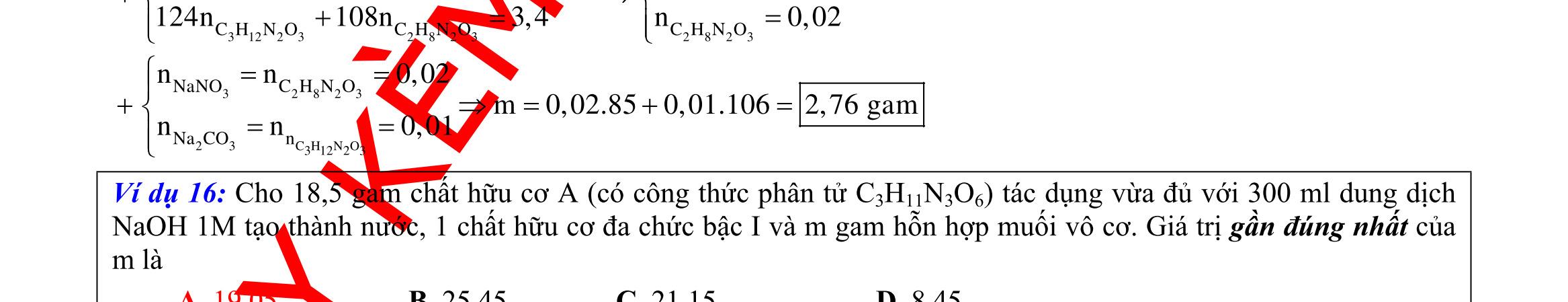
D. Quá trình điện phân được tiến hành trong 5600 giây. Câu 4: Điện phân với điện cực trơ dung dịch chứa 0,2 mol Cu(NO3)2, cường độ dòng điện 2,68A, trong thời gian t (giờ), thu được dung dịch X. Cho 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và 13,5 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phân là 100%. Giá trị của t là A. 0,60. B. 1,00. C. 0,25. D. 1,20. Câu 5: Điện phân dung dịch chứa AgNO3 điện cực trơ, với cường độ dòng điện 2A, một thời gian thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn thu được 1,58m gam hỗn hợp bột kim loại và 1,12 lít hỗn hợp khí Z (đktc) gồm NO, N2O có tỉ khối hơi đối với H2 là 19,2 và dung dịch Y chứa 37,8 gam muối. Cho toàn bộ hỗn hợp bột kim loại tác dụng với dung dịch HCl dư thu được 5,6 lít H2 (đktc). Thời gian điện phân là
A. 23160 giây. B. 24125 giây. C. 22195 giây. D. 28950 giây. Câu 6: Cho 7,76 gam hỗn hợp X gồm Fe và Cu tác dụng với dung dịch chứa 0,4 mol HNO3, thu
(n:n7:6)
được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Tiến hành điện phân dung dịch Y với điện cực trơ, cường độ dòng điện không đổi I = 9,65A trong thời gian t giây, thấy khối lượng catot tăng 4,96 gam (kim loại sinh ra bám hết vào catot). Giá trị của t là A. 2602. B. 2337. C. 2400. D. 2000. Câu 7: Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) dung dịch X chứa a mol MSO4 (M là kim loại) và 0,3 mol KCl trong thời gian t giây, thu được 2,24 lít khí ở anot (đktc) và dung dịch Y có khối lượng giảm m gam so với khối lượng dung dịch X. Nếu thời gian điện phân là 2t giây thì thu được dung dịch Z có khối lượng giảm 19,6 gam so với khối lượng dung dịch X. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Phát biểu nào sau đây là đúng?
A. Giá trị của a là 0,15.
B. Giá trị của m là 9,8.
C. Tại thời điểm 2t giây, chưa có bọt khí ở catot.
D. Tại thời điểm 1,4t giây, nước chưa bị điện phân ở anot. Câu 8: Điện phân 200 ml dung dịch X chứa CuSO4 1M và NaCl 0,75M với điện cực trơ, có màng ngăn. Sau một thời gian, thu được dung dịch Y có khối lượng nhỏ hơn dung dịch X là 16,125 gam. Dung dịch Y trên phản ứng vừa đủ với m gam Al. Giá trị m là
A. 3,24. B. 2,25. C. 2,16. D. 1,35.
DẠYKÈMQUYNHƠN
1
FeCu
Câu 9: Điện phân 200 ml dung dịch hỗn hợp gồm CuSO4 0,3M và NaCl 1M (điện cực trơ màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 0,5A trong thời gian t giây. Dung dịch sau điện phân có khối lượng giảm 9,56 gam so với dung dịch ban đầu. Giá trị của t là A. 27020. B. 30880. C. 34740. D. 28950. Câu 10: Điện phân (điện cực trơ, hiệu suất điện phân 100%) dung dịch chứa đồng thời 0,15 mol Cu(NO3)2 và 0,12 mol HCl trong thời gian t giờ với cường độ dòng điện không đổi 2,68A thì ở anot thoát ra 0,672 lít khí (đktc) và thu được dung dịch X. Dung dịch X hòa tan tối đa m gam bột sắt (sản phẩm khử của NO3 là khí NO duy nhất). Giá trị của t và m lần lượt là
A. 0,6 và 10,08. B. 0,6 và 8,96. C. 0,6 và 9,24. D. 0,5 và 8,96. Câu 11: Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch X chứa CuSO4 và NaCl (có tỉ lệ mol tương ứng 3:2) bằng dòng điện một chiều có cường độ 5A, sau thời gian t giờ thu được dung dịch Y chứa hai chất tan và thấy khối lượng dung dịch Y giảm 33,1 gam so với khối lượng của dung dịch X. Dung dịch Y hòa tan tối đa 3,6 gam Al. Giả sử khí sinh ra trong quá trình điện phân thoát hết ra khỏi dung dịch. Giá trị của t gần nhất với giá trị nào sau đây?
A. 4,5. B. 6. C. 5,36. D. 6,66. Câu 12: Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO3)2 với điện cực trơ, sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào dung dịch X đến khi các phản ứng xảy ra hoàn toàn, thấy khối lượng thanh sắt giảm 1,8 gam và thấy thoát ra khí NO duy nhất. Giá trị của x là
OFFICIAL
A. 0,4. B. 0,5. C. 0,6. D. 0,3. Câu 13: Tiến hành điện phân (với điện cực trơ, hiệu suất 100% dòng điện có cường độ không đổi) dung dịch X gồm 0,2 mol CuSO4 và 0,15 mol HCl, sau một thời gian điện phân thu được dung dịch Y có khối lượng giảm 14,125 gam so với khối lượng dung dịch X. Cho 15 gam bột Fe vào Y đến khi kết thúc các phản ứng thu được m gam chất rắn. Biết các khi sinh ra hòa tan không đáng kể trong nước. Giá trị của m là
A. 8,6. B. 15,3. C. 10,8. D. 8,0. Câu 14: Điện phân điện cực trơ màng ngăn xốp, dung dịch X chứa a gam Cu(NO3)2 và b gam NaCl đến khi có khí thoát ra ở cả 2 điện cực thì dừng lại, thu được dung dịch Y và 0,51 mol khí Z. Dung dịch Y hòa tan tối đa 12,6 gam Fe giải phóng NO (sản phẩm khử duy nhất) và dung dịch T. Dung dịch T cho kết tủa với dung dịch AgNO3 Tổng giá trị của (a + b) là
A. 135,36. B. 147,5. C. 171,525. D. 166,2.
DẠYKÈMQUYNHƠN
2
HỆ THỐNG BÀI TẬP ĐIỆN PHÂN Ở CẤP ĐỘ VẬN DỤNG CAO
Câu 1: Hòa tan 13,68 gam muối MSO4 vào nước được dung dịch X. Điện phân X (với điện cực trơ, cường độ dòng điện không đổi) trong thời gian t giây, được y gam kim loại M duy nhất ở catot và 0,035 mol khí ở anot. Còn nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 0,1245 mol. Giá trị của y là
A. 4,480. B. 3,920. C. 1,680. D. 4,788. Câu 2: Điện phân với điện cực trơ dung dịch chứa 0,5 mol AgNO3 với cường độ dòng điện 3,86A, trong thời gian t giây, thu được dung dịch X (hiệu suất quá trình điện phân là 100%). Cho 22,4 gam bột Fe vào X, thấy thoát ra khí NO (sản phẩm khử duy nhất) và sau các phản ứng hoàn toàn thu được 42,2 gam chất rắn Y. Giá trị của t là
A. 3000. B. 2500. C. 3600. D. 5000. Câu 3: Điện phân 225 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 4,02A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 18,9 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 21,75 gam rắn T và khí NO (sản phẩm khử duy nhất của N+5). Phát biểu nào sau đây sai?
A. Chất rắn T thu được chứa 2 kim loại.
B. Do Y có chứa HNO3 nên dung dịch sau điện phân có pH<7.
C. Trước khi cho sắt vào, nước ở catot chưa bị điện phân.
OFFICIAL
D. Quá trình điện phân được tiến hành trong 5600 giây. Câu 4: Điện phân với điện cực trơ dung dịch chứa 0,2 mol Cu(NO3)2, cường độ dòng điện 2,68A, trong thời gian t (giờ), thu được dung dịch X. Cho 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và 13,5 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phân là 100%. Giá trị của t là A. 0,60. B. 1,00. C. 0,25. D. 1,20. Câu 5: Điện phân dung dịch chứa AgNO3 điện cực trơ, với cường độ dòng điện 2A, một thời gian thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn thu được 1,58m gam hỗn hợp bột kim loại và 1,12 lít hỗn hợp khí Z (đktc) gồm NO, N2O có tỉ khối hơi đối với H2 là 19,2 và dung dịch Y chứa 37,8 gam muối. Cho toàn bộ hỗn hợp bột kim loại tác dụng với dung dịch HCl dư thu được 5,6 lít H2 (đktc). Thời gian điện phân là
A. 23160 giây. B. 24125 giây. C. 22195 giây. D. 28950 giây. Câu 6: Cho 7,76 gam hỗn hợp X gồm Fe và Cu tác dụng với dung dịch chứa 0,4 mol HNO3, thu
(n:n7:6)
được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Tiến hành điện phân dung dịch Y với điện cực trơ, cường độ dòng điện không đổi I = 9,65A trong thời gian t giây, thấy khối lượng catot tăng 4,96 gam (kim loại sinh ra bám hết vào catot). Giá trị của t là A. 2602. B. 2337. C. 2400. D. 2000 Câu 7: Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) dung dịch X chứa a mol MSO4 (M là kim loại) và 0,3 mol KCl trong thời gian t giây, thu được 2,24 lít khí ở anot (đktc) và dung dịch Y có khối lượng giảm m gam so với khối lượng dung dịch X. Nếu thời gian điện phân là 2t giây thì thu được dung dịch Z có khối lượng giảm 19,6 gam so với khối lượng dung dịch X. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Phát biểu nào sau đây là đúng?
A. Giá trị của a là 0,15.
B. Giá trị của m là 9,8.
C. Tại thời điểm 2t giây, chưa có bọt khí ở catot.
D. Tại thời điểm 1,4t giây, nước chưa bị điện phân ở anot. Câu 8: Điện phân 200 ml dung dịch X chứa CuSO4 1M và NaCl 0,75M với điện cực trơ, có màng ngăn. Sau một thời gian, thu được dung dịch Y có khối lượng nhỏ hơn dung dịch X là 16,125 gam. Dung dịch Y trên phản ứng vừa đủ với m gam Al. Giá trị m là
A. 3,24. B. 2,25. C. 2,16. D. 1,35.
DẠYKÈMQUYNHƠN
1
FeCu
Câu 9: Điện phân 200 ml dung dịch hỗn hợp gồm CuSO4 0,3M và NaCl 1M (điện cực trơ màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 0,5A trong thời gian t giây. Dung dịch sau điện phân có khối lượng giảm 9,56 gam so với dung dịch ban đầu. Giá trị của t là A. 27020. B. 30880. C. 34740. D. 28950. Câu 10: Điện phân (điện cực trơ, hiệu suất điện phân 100%) dung dịch chứa đồng thời 0,15 mol Cu(NO3)2 và 0,12 mol HCl trong thời gian t giờ với cường độ dòng điện không đổi 2,68A thì ở anot thoát ra 0,672 lít khí (đktc) và thu được dung dịch X. Dung dịch X hòa tan tối đa m gam bột sắt (sản phẩm khử của NO3 là khí NO duy nhất). Giá trị của t và m lần lượt là
A. 0,6 và 10,08. B. 0,6 và 8,96. C. 0,6 và 9,24. D. 0,5 và 8,96. Câu 11: Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch X chứa CuSO4 và NaCl (có tỉ lệ mol tương ứng 3:2) bằng dòng điện một chiều có cường độ 5A, sau thời gian t giờ thu được dung dịch Y chứa hai chất tan và thấy khối lượng dung dịch Y giảm 33,1 gam so với khối lượng của dung dịch X. Dung dịch Y hòa tan tối đa 3,6 gam Al. Giả sử khí sinh ra trong quá trình điện phân thoát hết ra khỏi dung dịch. Giá trị của t gần nhất với giá trị nào sau đây?
A. 4,5. B. 6. C. 5,36. D. 6,66. Câu 12: Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO3)2 với điện cực trơ, sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào dung dịch X đến khi các phản ứng xảy ra hoàn toàn, thấy khối lượng thanh sắt giảm 1,8 gam và thấy thoát ra khí NO duy nhất. Giá trị của x là
OFFICIAL
A. 0,4. B. 0,5. C. 0,6. D. 0,3. Câu 13: Tiến hành điện phân (với điện cực trơ, hiệu suất 100% dòng điện có cường độ không đổi) dung dịch X gồm 0,2 mol CuSO4 và 0,15 mol HCl, sau một thời gian điện phân thu được dung dịch Y có khối lượng giảm 14,125 gam so với khối lượng dung dịch X. Cho 15 gam bột Fe vào Y đến khi kết thúc các phản ứng thu được m gam chất rắn. Biết các khi sinh ra hòa tan không đáng kể trong nước. Giá trị của m là
A. 8,6. B. 15,3. C. 10,8. D. 8,0. Câu 14: Điện phân điện cực trơ màng ngăn xốp, dung dịch X chứa a gam Cu(NO3)2 và b gam NaCl đến khi có khí thoát ra ở cả 2 điện cực thì dừng lại, thu được dung dịch Y và 0,51 mol khí Z. Dung dịch Y hòa tan tối đa 12,6 gam Fe giải phóng NO (sản phẩm khử duy nhất) và dung dịch T. Dung dịch T cho kết tủa với dung dịch AgNO3 Tổng giá trị của (a + b) là
A. 135,36. B. 147,5. C. 171,525. D. 166,2.
DẠYKÈMQUYNHƠN
2
DẠYKÈMQUYNHƠN OFFICIAL 1
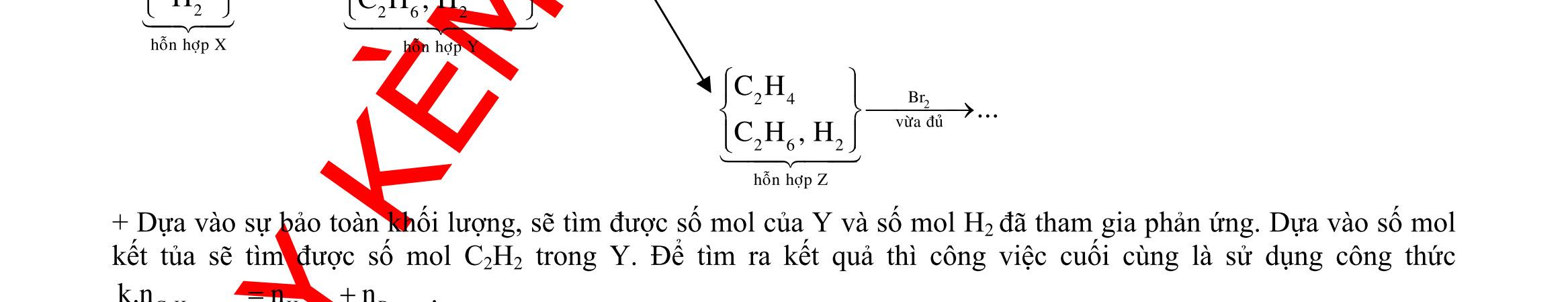
2 2 2 2 2 2 2 OH H
H
?
●
2 2 2O Cu Cupö Cupö
?
Câu
22,4gamFe ñpdd 3 0,5mol H Fepö NO Agtaothanh
3 ddX Y
m
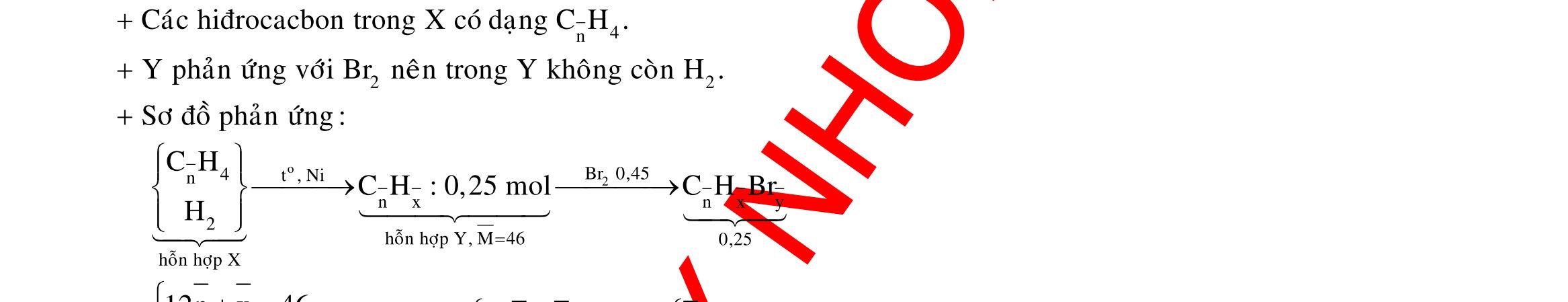
Câu 3: 18,9gamFe ñpdd 3 0,225mol H Fepö NO Agtaothanh FepöNOAg 3 ddY ddAgNO ddY 21,75gamranT H:x n n0,11250,125x n 0,25xAg:0,225x;4 n 0,225x BTE:2n3nnNO:0,225 T electrontraoñoi electrontraoñoiH m18,956(0,11250,125x)108(0,225x)21,75x0,15. TcoFedövaAg DungdòchYcopH7 Ôcatotnöôcchöabòñienphan n F n n0,15tI3600giay Vayketluansa ila:Quatrìnhñienphanñöôctienhanhtrong5600giay Câu 4:
ĐÁP ÁN CHI TIẾT Câu 1: + Vì ion không bị oxi hóa nên ở anot H2O bị oxi hóa tạo ra khí O2. 2 4SO + Ở catot thứ tự khử như sau : M2+ > H2O. ● Điện phân trong thời gian 2t giây.
M 0,0352?
O M
?0,0352 Theogiathietvabaotoanelectron,taco: nn0,1245n0,0545;n0,0855 13,682n2n4nM09664(Cu) ,0855
Điện phân trong thời gian t giây.
0,035
Theobaotoanelectron,taco: 2n4nn0,07molym0,07.644,48gam
2:
FepöNOAg
ddAgNO ddX 42,2gamchatranY H:x n n0,250,125x n 0,25xAg:0,5x;4 n 0,5x BTE:2n3nnNO:0,5
electrontraoñoi electrontraoñoiH 22,456(0,250,125x)108(0,5x)42,2x0,2. n F n n0,2tI5000giay
DẠYKÈMQUYNHƠN OFFICIAL 2 2
2
2
3
2
NOn chatran electrontraoñoiH BTÑTtrongX:2xy0,4
n
2 144gamFe ñpdd 32 0,2mol H Fepö 2 NO Cutaothanh FepöNOCu 3 ddX
H:x
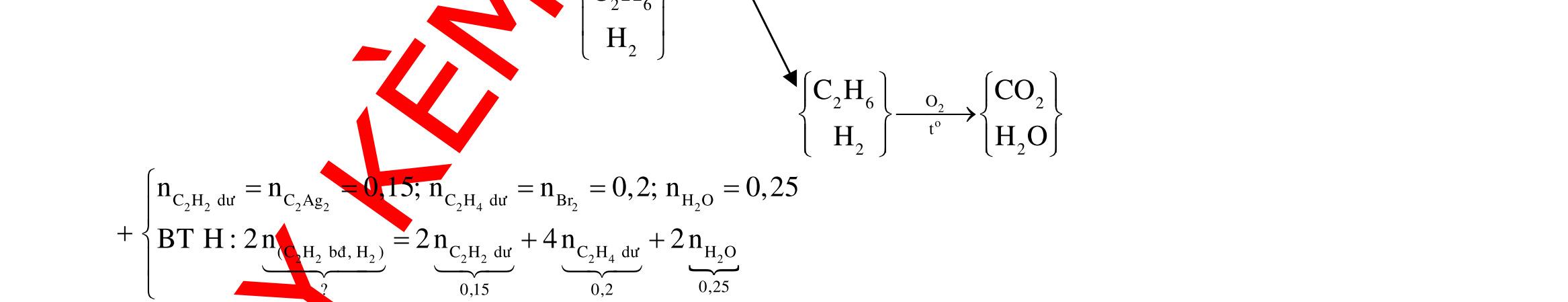
Y electrontraoñoi m14,456(0,20,125x)64(0,20,5x)13,5x0,1 F.n 965000,1 t 3600giay1giô I 2,68 Câu 5: 2 2 2 NONO NO NO NO NO HCl 2 0,25mol 1,58mgam 3 32 ñpdd 3 3dö 43 X nn0,05 n0,02 n0,0330n44n0,05.19,2.21,92 Sôñophanöng: Mgdö H Ag HNO Mg(NO) AgNO AgNO NHNO muoi Ym378gam 2 Z NO:0,02mol NO:0,03mol Fe (2) ñpdd (1) Mg mgam
Cu CutrongX
3
32 dö 0,2mol
dungdòchX Cach1: n 0,2m12,8gamChatrancoFedö Sôñophanöng: Fe:zmol Cu(ôcatot) NO:2zmol Cu:xmol Cu:xmol Cu(NO) H:ymol Fe NO:0,4mol
13,5gam
O(ôanot) NO
x0,15 BTEchopö(2):2z2x3(0,42z)y0,1 z0,1875 m:64x(14,456z)13,5 965000,1
n0,1t23600giay1giô ,68
Cach2: ddCu(NO)ddX 13,5gamranY
n n0,20,125x n 0,25xCu:0,20,5x;4 n 0,20,5x BTE:2n3n2n NO:0,4
DẠYKÈMQUYNHƠN OFFICIAL 3 43 32 2 5 NHNO Mg(NO)MgbñMgdöMgbñH Ag mu TrongphanöngcuaXvôiMg:ChatkhölaMg,chatoxihoalaN,Ag m
n
m
24
m 3 2 43 oi etraoñoiHNO/XNO NO NHNO m12
m
24 nF nn4n10n10n0,48t23160giay
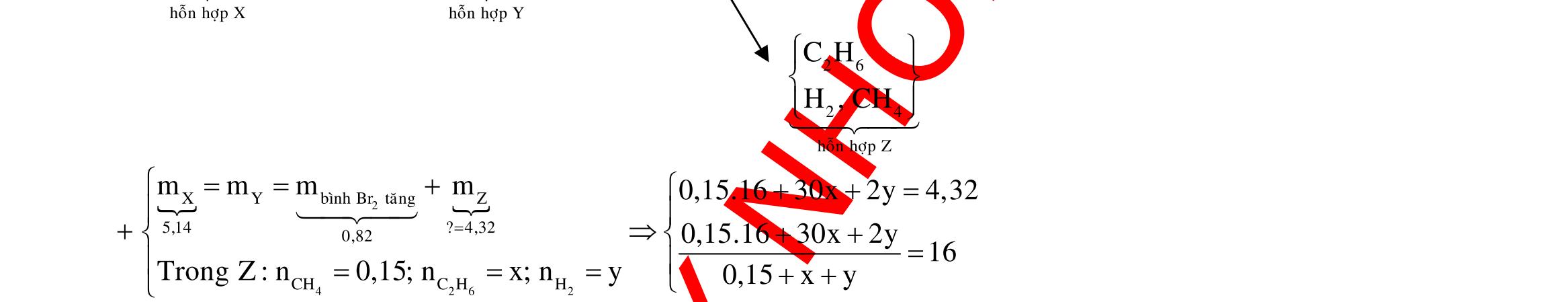
Câu 6: Fe Fe Cu Cu FeCu electrondoFe,CunhöôngFeCu 3 2 elcctrondoNnhan 0,1 0,4 0,3 2 3 n7x n0,07 7x.566x.647,76x0,01 n6x n0,06 2n2n0,26n 3n2n0,33 n 0,3(Vì4HNO3eNO2HO) YFe:xmol,Fe: co 2 3 2 2 2 3 ñpdd Fe I9,65A,tgiay Fepö electrontraoñoiFe Cu Fepö ymolxy0,07 x0,03
Cu:0,06mol,NO:0,3 4,960,0664 Y 4,96gamCu,Fenn
56 BTE:n n2n2n0,2t nF I2000giay Câu 7: 2 eletrontraoñoiCl ñpdd 4 2 tgiay DungdòchX electrontraoñ Thötöoxihoatrenanot:ClHO n n0,3thìanotmôithoatkhí MSOamol 0,1molkhíôanot,ñaylakhíCl KCl:0,3mol Öngvôit(s)thìn oi electrontraoñoi 0,2mol D Öngvôi1,4t(s)thìn 0,280,3 Câu 8:
nx;nnnnn 0,25 24 1,58m0,2524
108
1,58m0,2524BTE:20,250,0230,0388x
108
x0,01
1480,2580x37,8
I
2x3y0,0620,3y0,04
0,02
DẠYKÈMQUYNHƠN OFFICIAL 4 2 2 2 2 4 ñpdd 2 4 2 catot 2 ddX a ddY Thötökhötrencatot:CuHO;Thötöoxihoa:ClHO Sôñophanöng: SO:0,2 Cl:0,075 CuSO:0,2 Na:0,15Cu O:x NaCl:0,15 Cu H 2 2 2 2 not CuCl O ddgiam Cu Cl O Cu 2 4 2 ddY BTE:2n2n4n m64n71n32n16,125 n0,0752x x0,0375 64(0,0752x)0,0757132x16,125 SO:0,2 Na:0,15 Cu:0,20,150,05 BTÑTH:0,15 2 4 2 3 Al SO:0,2 AlNa:0,15 CuH
BTÑTAl:
m2,25gam Câu 9: 2 4 2 eClnhöôngeCunhan 2 2 2 2 CuSO NaCl Cu Cl n n 2 ClCu ddgiam Thötöoxihoatrenanot:ClHO;thötökhötrencatot:CuHO
GiasöCubòoxikhöhet,BTE:nn0,06mol
2 2 2 2 2 2 2 2 2 electrontraoñoiCuH Cl 0,06 H ? ? ddgiam CuH Cl Cl 0,06 ? ? electrontraoñoi 8,1gam9,56gam ÔcatotCubòkhöhet,HOñabòkhötaoraH BTE:n 2n2n2n n0,02 m64n2n71n9,56n0,08 n F0,16. t I 96500 030880giay ,5 Câu 10:
0,25
3
n0,06mol;n0,2mol2nn.
m0,06640,0671
DẠYKÈMQUYNHƠN OFFICIAL 5 2 2 2 2 2 2Cl 2
electrontraoñoi 2
2 2 Fe(max) 3 0,12 4 3 X Fe Fe Fe
Fe:?
am Câu 11: 2 ñpdd 2 4 4 2 comangngan x 2 x ddX ddY ddgiam Al
2x Tröônghôp1:
anot ñpdd 2 4 4 2 2
3 x a ddX ddY x0,245loai
Tröônghôp2: Na:2x CuSO:3xmol
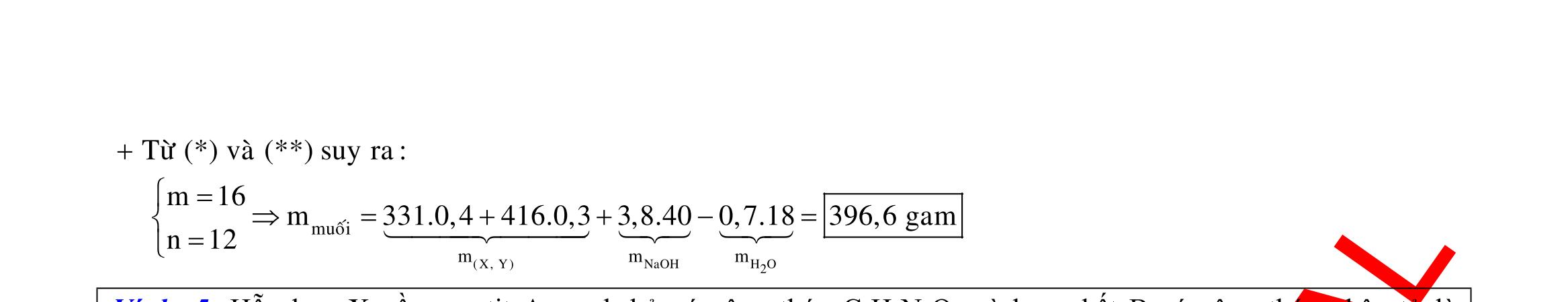
NaCl:2xmol H:4x 2 2 2 2 2 2 catot 2 x b ddgiamClOCuH Cl O CuH Al H H mmmmm BTEtrongpöñp:2n4n2n2n BTEcho(YAl):n3n 71x3x6432a2b33,1x0,1;a0,2:b0,2 2x4a6x2b t(0,1.20,2.4).965005 4x0,4 53600 ,36giô Chuy:TínhmolHtrongYbangbaotoanñientích Câu 12:
CuCl
Thötökhötrencatot:CuHHO;thötöoxihoatrenanot:ClHO. ÔanotkhíthoatralaCl;n0,03 ÔcatotCubòkhö:BTE:nn0,03 n F0,03296500 t 0,6giô I 2,68.3600 Cu:
0,150,030,12
NO:0,3 NOCl:0,06 H:0,12 0,12 NO:0,30,27 Cl:0,120,0320,06 4 0,270,06 nn 20,165m9,24g
CutrongY 3,6/27
Na:2x CuSO:3xmol SO:3xClCu NaCl:2xmol Cu:2x m71x64x33,1 BTE:3n2n
comangngan
x0,1
SO:3xClOCu
DẠYKÈMQUYNHƠN OFFICIAL 6 2 2 2 2 2 2 2 3 2 O Cl Cl CuCl O Thötökhötrencatot:CuHO;Thötöoxihoa:ClHO
na n
2 2 Cu ddgiam O H Cu 3 3 0,2 2 0,05 4 2
BTÑTFe:x0,12 Cu:x0,2 x0,2 FepöCutaothanh Cu 5 mmm 56.(x0,125)64.(x0,2)1,8x0,5 Câu 13: 2 2 2 2 CutaothanhClmax 2 ddgiammax Cl Cu 2 2 0,0750,075 CuCl O ?0,075? dd GiasöôanotchæcoClbòoxihoa,suyra: BTE:n n0,075 HOôanotñabòoxihoa m 71n64n10,12514,125ÔanotthuñöôcClvaO BTE:nn2n m 2 2 2 Cu O giam Cu Cl O ? 0,075 ? 2 4 2 Fe 2 4 15gam 2 ddY cha n0,125 n0,02564n71n32n14,125 SO:0,2 SO:0,2Cu:0,075 Cu:0,20,1250,075 FedöFe:0,2 H:0,25 m Cu Fedö tran m m 0,075.64(150,2.56)8,6gam Câu 14:
NO:2xmol Na:0,2molFeddXNOXgom vaClñahet H Cu(cotheconhoachet)
n0,5n0,1 BTE:2n2n4n
0,12a m64(0,12a)32a0,17121,5 a0,05ddsauñienphanco:n4n0,2;nx0,2. NO:2x NO:2x0,05 Na:0,2FeNONa:0,2 H:0,2
DẠYKÈMQUYNHƠN OFFICIAL 7 2 2 Z,anot 2 Fe 32 max 3 3 X Y T c Sôñophanöng: Cl :0,51mol O Cu(NO):xmol Na,H Fe:0,225NO NO Na,NO NaCl:ymol Cu 2 2 2 2 3 2 atot FeNO NO H HObòoxihoa NO H H HObòoxihoa Cl NaCl O NOtrongY Cl NaCl n BTE:2n3nn0,15 YFe: n 0,3 n4n n0,6 2 n nn2n0,72 n 0,15 Zco 2 BTÑT:n 0,720,61,32 n0,510,150,36 n0,72 n 32 honhôp Cu(NO)0m166,2 ,66 TIN NHẮN KHÔNG KÍ TỰ CỦA BỐ ñpdd
Bố hơn 70 tuổi, tôi mua cho cụ một chiếc điện thoại di động để tiện liên lạc. Bố cầm điện thoại, sờ sờ, ấn ấn, nâng niu như một vật báu. Nhìn thấy ảnh mình trong điện thoại, bố có vẻ thích lắm. Cụ cười vui như đứa trẻ được quà. Tôi biết một người cả đời vất vả, cần kiệm như bố sẽ không nỡ gọi điện thoại nên tôi dạy bố cách nhắn tin. Bố già rồi, những thứ hiện đại thế này rất khó để nắm bắt. Tôi chỉ cho bố từng chút một, bố gật đầu ậm ừ nhưng nhìn vào đôi mắt đục đang nheo lên đầy căng thẳng, tôi biết bố vẫn chưa hiểu rõ cách dùng. Khi sắp về thành phố, tôi nói với cụ: “Bố ơi, có chuyện gì thì bố cứ gọi điện thoại cho con nhé!” Bố tôi giơ chiếc điện thoại lên: “Bố sẽ nhắn tin cho. Ừm, nhắn tin cho đỡ tốn tiền.”
Tôi cười nhẹ, tôi rất hiểu bố.
Khi lên xe, điện thoại báo tin nhắn đến. Là tin nhắn của bố. Nhưng là một tin nhắn trắng. Tôi mỉm cười, lòng ấm áp lạ. Tôi hiểu bố muốn hỏi tôi đã lên xe chưa.
Tôi lập tức nhắn tin lại. “Bố ơi, con lên xe rồi ạ.”
Về đến nhà, bố lại gửi cho tôi một tin nhắn không lời. “Con về đến nơi rồi bố ạ. Bố ở nhà giữ gìn sức khỏe nhé!”
Những ngày sau đó, cách 3 ngày, bố lại gửi cho tôi một tin nhắn. Tin nhắn không có nội dung nhưng tôi hiểu những điều bố muốn nói. Lần nào tôi cũng trả lời tin nhắn của cụ.
OFFICIAL
“Bố ơi, cả nhà con đều rất tốt ạ!”
“Bố, công việc của vợ chồng con rất thuận lợi. Anh Tùng được lên chức trưởng phòng rồi ạ.”
“Bé Bông học hành tiến bộ lắm bố ạ! Con bé nhớ ông ngoại, cuối tuần này vợ chồng con cho bé về thăm ông.”
........
Cứ như vậy, tôi luôn nhận được những tin nhắn không lời nhưng đầy ắp quan tâm của bố. Tôi có thể tưởng tượng ra cảnh bố đang ngồi trên chiếc tràng kỷ quen thuộc, cẩn thận dò từng số, nhắn tin cho tôi. Tôi còn tưởng ra nét mặt vui mừng khi cụ nhận được những tin nhắn bình an từ con gái. 17 tháng 5 sinh nhật lần thứ 40 của tôi. Ngày hôm đó, khi đang cùng bạn bè tổ chức bữa tiệc nhỏ, điện thoại tôi rung lên. Là tin nhắn của bố, tôi hết sức ngạc nhiên vì đó không phải là tin nhắn trắng. Trong tin nhắn ghi vẻn vẹn con số “40”.
Tôi không biết bố đã phải mày mò bao lâu để có thể viết ra được con số đó nhưng tôi biết đằng sau con số ấy, đằng sau tin nhắn ấy là tình yêu thương, là sự quan tâm, là niềm hạnh phúc của bố tôi. Tôi đã 40 tuổi, bố cũng đã già hơn rất nhiều. Đọc tin nhắn của bố, bất giác sống mũi tôi cay cay, nước mắt tràn ra lúc nào không biết... Chuyện đẹp nhất trên đời chính là: Khi con trưởng thành, cha mẹ vẫn chưa già, con có khả năng báo đáp thì cha mẹ vẫn khỏe mạnh.
(SƯU TẦM)
DẠYKÈMQUYNHƠN
8
HỆ THỐNG BÀI TẬP KIM LOẠI KIỀM, KIỀM THỔ, NHÔM, SẮT VÀ HỢP CHẤT Ở CẤP ĐỘ VẬN DỤNG CAO
Câu 1: Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư, thấy có 0,7 mol axit phản ứng và còn lại 0,35a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp A bằng H2 dư, thu được 34,4 gam chất rắn. Phần trăm khối lượng Cu trong hỗn hợp A gần nhất với giá trị nào sau đây? A. 25,0%. B. 16,0%. C. 40,0%. D. 50,0%. Câu 2: Nung m gam hỗn hợp gồm Mg và Cu(NO3)2 trong điều kiện không có không khí, sau một thời gian thu được chất rắn X và 10,08 lít (đktc) hỗn hợp khí gồm NO2 và O2. Hòa tan hoàn toàn X bằng 650 ml dung dịch HCl 2M, thu được dung dịch Y chỉ chứa 71,87 gam muối clorua và 0,05 mol hỗn hợp khí Z gồm N2 và H2 Tỉ khối của Z so với He bằng 5,7. Giá trị của m gần giá trị nào nhất sau đây?
OFFICIAL
A. 50. B. 55. C. 45. D. 60. Câu 3: Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4 +) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất), đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3:2:1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với giá trị nào sau đây? A. 48%. B. 58%. C. 54%. D. 46%. Câu 4: Hỗn hợp X gồm Cu và Fe3O4 Khử m gam hỗn hợp X bằng khí CO dư (đun nóng), thu được 0,798m gam hỗn hợp kim loại. Cho m gam hỗn hợp X tác dụng với dung dịch HCl lấy dư, thu được dung dịch Y và chất rắn Z. Cho dung dịch Y tác dụng với dung dịch AgNO3 dư, thu được 427,44 gam kết tủa và V lít khí NO (đktc). Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư thu được 2,75V lít NO (sản phẩm khử duy nhất, đktc). Giá trị gần nhất của V là A. 2,24. B. 2,68. C. 2,82. D. 2,71. Câu 5: Lấy hỗn hợp X gồm Zn và 0,3 mol Cu(NO3)2 nhiệt phân một thời gian, thu được hỗn hợp rắn Y và 10,08 lít hỗn hợp khí Z gồm NO2 và O2. Y tác dụng vừa đủ với dung dịch chứa 2,3 mol HCl, thu được dung dịch T chỉ chứa các muối clorua và 2,24 lít (đktc) hỗn hợp khí E gồm 2 đơn chất không màu có tỉ khối so với H2 là 7,5. Tổng khối lượng muối trong dung dịch T có giá trị gần nhất với A. 154,5. B. 155,5. C. 155,0. Câu 6: Trộn 58,75 gam hỗn hợp X gồm Fe(NO3)2 và kim loại M với 46,4 gam FeCO3 được hỗn hợp Y. Cho toàn bộ Y vào lượng vừa đủ dung dịch KHSO4, thu được dung dịch Z chỉ chứa 4 ion (không kể H+ và OH của H2O) và 16,8 lít hỗn hợp T (đktc) gồm 3 khí trong đó có 2 khí có cùng phân tử khối và 1 khí hóa nâu trong không khí. Tỉ khối của T so với H2 là 19,2. Cô cạn 1/10 dung dịch Z thu được m gam rắn khan. Giá trị của m là A. 39,385. B. 37,950. C. 39,835. D. 39,705.
Câu 7: Hòa tan hoàn toàn 29,6 gam hỗn hợp H gồm FeS2 và CuO vào 500 gam dung dịch HNO3 C% (dùng dư 10% so với lượng phản ứng), cô cạn dung dịch sau phản ứng thu được 56,12 gam hỗn hợp muối khan. Biết trong quá trình xảy ra phản ứng chỉ có NO2 là sản phẩm khử duy nhất. Giá trị C gần nhất với giá trị nào sau đây? A. 31,6. B. 28,7. C. 39,4. D. 52,9. Câu 8: Cho m gam hỗn hợp X gồm Cu và Fe2O3 vào 200,0 ml dung dịch chứa NaNO3 1M và H2SO4 2M, thu được dung dịch Y và thấy thoát ra 1,12 lít khí NO. Thêm dung dịch HCl dư vào dung dịch Y, lại thấy thoát ra 1,12 lít khí NO. Biết NO là sản phẩm khử duy nhất của ion nitrat và thể tích khí đo ở đktc. Giá trị của m là A. 18,4 B. 24,0. C. 25,6. D. 26,4. Câu 9: Hòa tan hoàn toàn 8,6 gam hỗn hợp Al, Mg, Fe, Zn vào 100 gam dung dịch gồm KNO3 1M và H2SO4 2M, thu được dung dịch X chứa 43,25 gam muối trung hòa và hỗn hợp khí Y (trong đó H2 chiếm 4% khối lượng Y). Cho một lượng KOH vào X, thu được dung dịch chỉ chứa một chất tan và kết tủa Z (không có khí thoát ra). Nung Z trong không khí đến khối lượng không đổi được 12,6 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X gần giá trị nào nhất sau đây? A. 7,50%. B. 7,00%. C. 7,75%. D. 7,25%.
DẠYKÈMQUYNHƠN
1
Câu 10: Hòa tan hết 17,6 gam hỗn hợp rắn X gồm Cu, Mg, Fe3O4 và Fe(NO3)2 trong dung dịch chứa 0,55 mol KHSO4 loãng, đun nóng. Kết thúc phản ứng thu được dung dịch Y chỉ chứa 87,63 gam muối trung hòa và 1,68 lít hỗn hợp khí Z gồm NO và H2 (ở đktc) có tỉ khối hơi so với H2 là 6,6. Biết trong Y không chứa muối Fe3+. Cho Ba(OH)2 dư vào Y thì thấy m gam kết tủa xuất hiện. Giá trị của m là A. 150,53. B. 122,78. C. 120,84. D. 146,36. Câu 11: Hoà tan hết 15,44 gam hỗn hợp gồm Fe3O4, Fe và Al (trong đó oxi chiếm 20,725% về khối lượng) bằng 280 gam dung dịch HNO3 20,25% (dùng dư), thu được 293,96 gam dung dịch X và 0,896 lít hỗn hợp khí X gồm NO và N2O. Để tác dụng tối đa các chất trong dung dịch X cần 450 ml dung dịch NaOH 2M. Nếu cô cạn dung dịch X thu được chất rắn Z. Nung Z đến khối lượng không đổi, thấy khối lượng chất rắn giảm m gam. Giá trị m là A. 44,12. B. 46,56. C. 43,72. D. 45,84. Câu 12: Hỗn hợp X gồm FeO, Fe2O3, S, FeS2 và CuS trong đó O chiếm 4,6997% khối lượng. Cho 15,32 gam X tác dụng vừa đủ với 0,644 mol H2SO4 đặc (đun nóng) sinh ra 14,504 lít khí SO2 (là sản phẩm khử duy nhất) và dung dịch Y. Nhúng thanh Mg dư vào Y sau khi các phản ứng xảy ra hoàn toàn lấy thanh Mg ra cân lại thấy tăng 5,14 gam (Giả sử 100% kim loại sinh ra bám vào thanh Mg). Đốt cháy hoàn toàn 15,32 gam X bằng lượng vừa đủ V lít (đktc) hỗn hợp khí A gồm O2 và O3 tỉ lệ mol 1:1. Giá trị gần nhất của V là A. 4,3. B. 10,5. C. 5,3. D. 3,5. Câu 13: Hòa tan hoàn toàn 17,44 gam hỗn hợp X gồm Fe, Fe3O4, Fe2O3, CuO, Cu, Mg, MgO (trong đó oxi chiếm 18,35% về khối lượng) trong dung dịch chứa 0,804 mol HNO3 loãng (dư 20% so với lượng cần cho phản ứng), kết thúc các phản ứng thu được dung dịch Y và V lít (đktc) hỗn hợp khí Z gồm N2 và N2O (tỷ lệ số mol tương ứng là 2:3). Cho dung dịch NaOH tới dư vàoY rồi đun nóng, không có khí thoát ra. Giá trị của V là A. 0,56. B. 0,448. C. 1,39. D. 1,12. Câu 14: Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al, Fe2O3, CuO trong khí trơ ở nhiệt độ cao, sau một thời gian thu được hỗn hợp rắn Y. Cho Y tác dụng với dung dịch NaOH dư, thu được 21,504 lít khí H2 (đktc) và còn lại hỗn hợp rắn Z. Cho Z tác dụng với dung dịch CuSO4 dư, thấy khối lượng chất rắn T thu được sau phản ứng tăng 1,6 gam so với khối lượng của Z. Hòa tan hoàn toàn T bằng 426 gam dung dịch HNO3 35% (dư 25% so với lượng cần thiết), thu được 8,8 gam NO (sản phẩm khử duy nhất của N+5) và thấy khối lượng dung dịch tăng 40,16 gam. Phần trăm về khối lượng của Fe2O3 trong hỗn hợp X gần nhất với giá trị nào sau đây?
OFFICIAL
A. 38%. B. 39%. C. 36%. D. 37%. Câu 15: Hòa tan 22 gam hỗn hợp X gồm Fe, FeCO3, Fe3O4 vào 0,5 lít dung dịch HNO3 2M thì thu được dung dịch Y (không có NH4NO3) và hỗn hợp khí Z gồm CO2 và NO. Lượng HNO3 dư trong Y tác dụng vừa đủ với 13,44 gam NaHCO3. Cho hỗn hợp Z vào bình kín có dung tích không đổi 8,96 lít chứa O2 và N2 tỉ lệ thể tích 1 : 4 ở 00C và áp suất 0,375 atm. Sau đó giữ bình ở nhiệt độ 00C thì trong bình không còn O2 và áp suất cuối cùng là 0,6 atm. Phần trăm khối lượng của Fe3O4 trong hỗn hợp X là A. 52,73%. B. 26,63%. C. 63,27%. D. 42,18%. Câu 16: Cho 33,35 gam hỗn hợp X gồm Fe3O4, Fe(NO3)3, Cu tan hoàn toàn trong dung dịch chứa 0,414 mol H2SO4 (loãng), thu được khí NO sản phẩm khử duy nhất và dung dịch Y chỉ chứa 2 muối. Cho bột Cu vào dung dịch Y thấy phản ứng không xảy ra. Cô cạn Y thu được m gam muối khan. Giá trị của m là A. 65,976. B. 75,922. C. 61,520. D. 64,400. Câu 17: Hòa tan m gam hỗn hợp A gồm Mg, Al, MgO và Al2O3 bằng dung dịch HCl vừa đủ thì được dung dịch chứa (m + 70,295) gam muối. Cho m gam hỗn hợp A tác dụng với dung dịch H2SO4 đặc nóng dư, thu được 13,328 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp A tác dụng với dung dịch HNO3 loãng dư, thu được 3,808 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hiđro là , dung dịch Y. Cô cạn dung dịch Y thu 318 17 được 162,15 gam muối khan. Giá trị của m là A. 30,99. B. 40,08. C. 29,88. D. 36,18. Câu 18: Hòa tan hết 20 gam hỗn hợp X gồm Cu và các oxit sắt (trong hỗn hợp X oxi chiếm 16,8% về khối lượng) cần vừa đúng dung dịch hỗn hợp A chứa b mol HCl và 0,2 mol HNO3 thu được 1,344 lít NO (đktc) là sản phẩm khử duy nhất và dung dịch Y. Cho dung dịch Y tác dụng với một lượng dung dịch AgNO3 vừa đủ thu được m gam kết tủa và dung dịch Z. Cho dung dịch Z tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa, nung đến khối lượng không đổi thu được 22,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
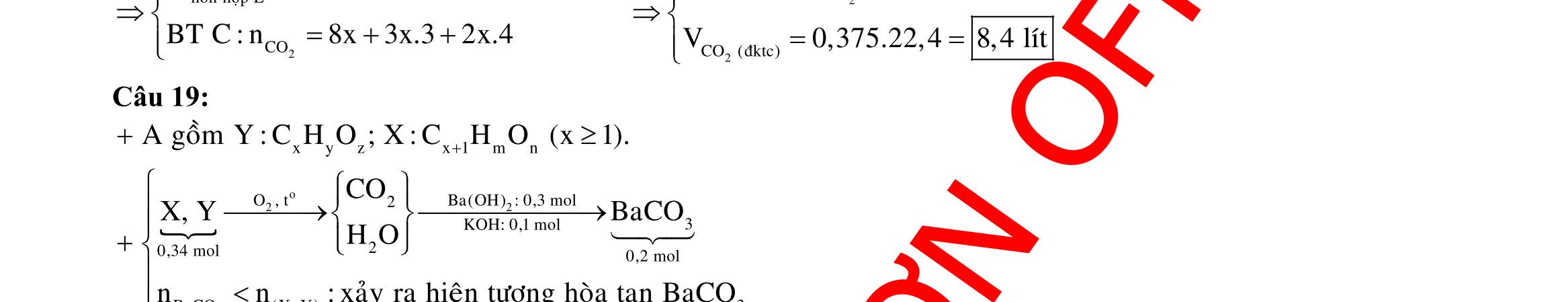
A. 70,33. B. 76,81. C. 83,29. D. 78,97. Câu 19: Hòa tan hết 16,32 gam hỗn hợp Fe và Cu trong 134,4 gam dung dịch HNO3 45%, thu được dung dịch X (không chứa muối amoni). Cho X phản ứng với 400 ml dung dịch hỗn hợp gồm NaOH 1M và KOH 0,5M, thu
DẠYKÈMQUYNHƠN
2
được kết tủa Y và dung dịch Z. Nung Y trong trong không khí đến khối lượng không đổi, thu được 21,6 gam hỗn hợp Fe2O3 và CuO. Cô cạn Z, thu được hỗn hợp chất rắn khan T. Nung T đến khối lượng không đổi, thu được 43,44 gam hỗn hợp chất rắn. Nồng độ phần trăm của Fe(NO3)3 trong X gần giá trị nào nhất sau đây?
A. 20. B. 6. C. 10. D. 4. Câu 20: Hòa tan hết hỗn hợp X gồm 5,6 gam Fe; 27 gam Fe(NO3)2 và m gam Al trong dung dịch chứa 0,61 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 47,455 gam muối trung hòa và 2,352 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16. Giá trị của m là
A. 1,080. B. 4,185. C. 5,400. D. 2,160. Câu 21: Hỗn hợp X gồm Al và Fe. Cho X tan vừa hết trong 352 ml dung dịch HNO3 2,5M, thu được dung dịch Y chứa 53,4 gam hỗn hợp muối và 2,24 lít hỗn hợp khí Z gồm NO, N2O (đktc) có tỉ khối hơi đối với H2 là 17,1. Cho dung dịch Y tác dụng với một lượng dung dịch NH3 dư, lọc thu được m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị m gần giá trị nào nhất sau đây?
A. 5,95. B. 20,00. C. 20,45. D. 17,35. Câu 22: Hỗn hợp X gồm Al, Al2O3, Fe3O4, CuO, Fe và Cu, trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 gam X nung nóng, sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với H2 bằng 18. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HNO3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có muối NH4NO3 sinh ra) và 4,48 lít (đktc) hỗn hợp khí T gồm NO và N2O. Tỉ khối của T so với H2 là 16,75. Giá trị của m là
OFFICIAL
A. 96,25. B. 117,95. C. 80,75. D. 139,50. Câu 23: Hòa tan hết 23,76 gam hỗn hợp X gồm FeCl2, Cu và Fe(NO3)2 vào 400 ml dung dịch HCl 1M, đến khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho từ từ dung dịch chứa AgNO3 1M vào Y đến khi phản ứng hoàn thấy dùng hết 580 ml, thu được m gam kết tủa và thoát ra 0,448 lít khí (đktc). Biết NO là sản phẩm khử duy nhất của N+5 trong cả quá trình, giá trị của m gần nhất với giá trị nào sau đây?
A. 82. B. 84. C. 80. D. 86. Câu 24: Cho 20 gam hỗn hợp X gồm Fe, FeCO3, Fe2O3 vào ống sứ nung nóng và dẫn từ từ 0,2 mol hỗn hợp khí Y gồm CO và H2 (tỉ khối so với H2 bằng 4,25) qua ống sứ, sau một thời gian thu được hỗn hợp rắn X1 và khí Y1. Cho khí Y1 hấp thụ vào dung dịch Ca(OH)2 dư, thu được 7 gam kết tủa và 0,06 mol khí Y2 (tỉ khối so với H2 bằng 7,5). Hoà tan X1 bằng dung dịch HNO3 (đặc, nóng, dư), thu được dung dịch Z và 0,62 mol hỗn hợp 2 khí, trong đó có một khí màu nâu đỏ là sản phẩm khử duy nhất của N+5 Nếu cho X tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thì thu được 0,225 mol hỗn hợp 2 khí. Phần trăm khối lượng của Fe2O3 trong X là
A. 32%. B. 48%. C. 16%. D. 40%. Câu 25: Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2, thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng, thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z, thu được 73,23 gam kết tủa. Mặt khác, hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5%, thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ phần trăm của Fe(NO3)3 trong dung dịch T gần nhất với giá trị nào sau đây? A. 5%. B. 7%. C. 8%. D. 9%. Câu 26: Hỗn hợp X gồm Al, Fe3O4, FeO, Cu2O trong đó oxi chiếm 17,827% khối lượng hỗn hợp. Nếu cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng (dư), thu được 8,736 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng (dư), thu được 4,48 lít NO (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 145,08 gam muối khan. Giá trị của m là A. 46,15. B. 42,79. C. 43,08. D. 45,14. Câu 27: Hỗn hợp X gồm Na2SO3, CuO, CuCO3. Hòa tan m gam hỗn hợp X trong dung dịch hỗn hợp HCl 1M và H2SO4 0,5M vừa đủ, thu được dung dịch Y chứa (m + 8,475) gam chất tan gồm muối clorua và sunfat trung hòa; 5,6 lít hỗn hợp khí (đktc) có tỉ khối so với hiđro là 27,6. Điện phân dung dịch Y với điện cực trơ, màng ngăn xốp đến khi lượng Cu2+ còn lại bằng 6% lượng Cu2+ trong dung dịch Y thì dừng lại thu được dung dịch Z. Cho 0,14m gam Fe vào dung dịch Z đến khi phản ứng kết thúc thu được m1 gam chất rắn. Giá trị của m1 là A. 4,5118. B. 4,7224. C. 4,9216. D. 4,6048. Câu 28: Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4 +) và hỗn hợp khí gồm NO và 0,3 mol NO2 Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng khôi đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây?
DẠYKÈMQUYNHƠN
3
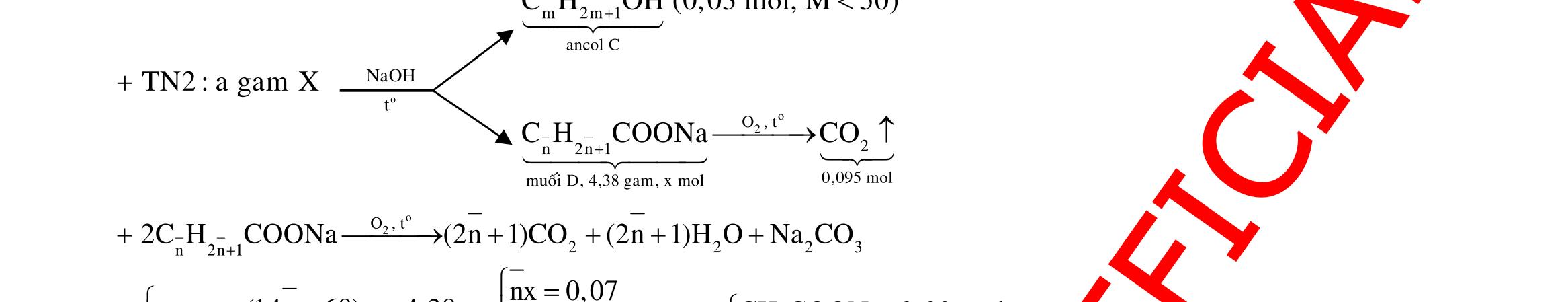
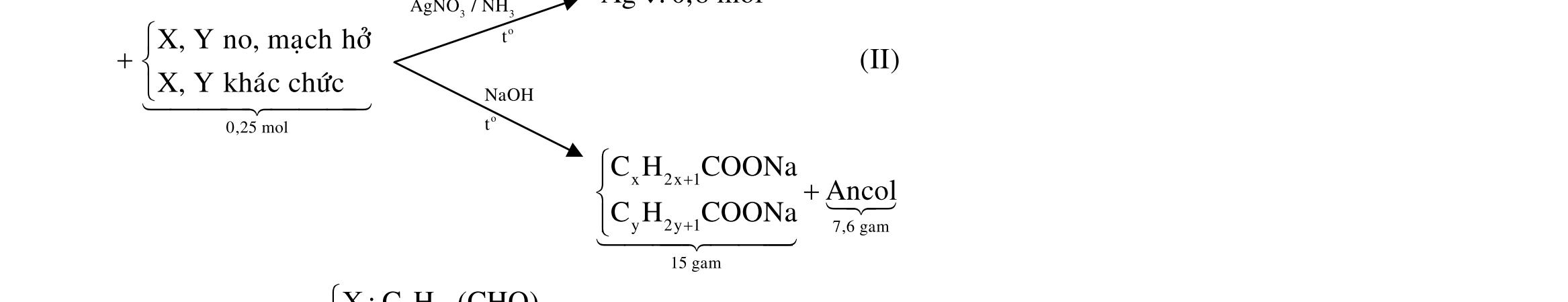
A. 19,0. B. 21,0. C. 18,0. D. 20,0. Câu 29: Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp X là
A. 13,664%. B. 14,228%. C. 15,112%. D. 16,334%.
OFFICIAL
Câu 30: Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO và Al2O3 (trong đó oxi chiếm 64/205 về khối lượng) tan hết vào X, sau khi các phản ứng kết thúc thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít hỗn hợp khí T có tổng khối lượng 1,84 gam gồm 5 khí (đktc), trong đó về thể tích H2, N2O, NO2 lần lượt chiếm 4/9, 1/9 và 1/9. Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây? A. 40. B. 35. C. 20. D. 30. Câu 31: Cho 87,35 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,425 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 516,125 gam muối sunfat trung hòa và 8,12 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là . Phần trăm khối lượng của Al trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây? 365 58 A. 10%. B. 11%. C. 12%. D. 13%. Câu 32: Hòa tan hết m gam hỗn hợp rắn X gồm Mg, Cu(NO3)2, Fe, FeCO3 vào dung dịch chứa H2SO4 và 0,045 mol NaNO3, thu được dung dịch Y chỉ chứa 62,605 gam các muối (không có ion Fe3+) và thấy thoát ra 3,808 lít (đktc) hỗn hợp khí T gồm N2, NO2, N2O, NO, H2, CO2 có tỉ khối so với H2 bằng 304/17 (trong T có chứa 0,02 mol H2). Cho dung dịch NaOH 1M vào dung dịch Y đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì dùng hết 865 ml. Mặt khác, cho 94,64 gam BaCl2 vừa đủ vào Y sau đó cho tiếp AgNO3 dư vào thì thu được 256,04 gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của m là A. 27,2. B. 28,4. C. 24,36. D. 32,8. Câu 33: Cho hơi nước đi qua than nóng đỏ thu được hỗn hợp X gồm CO2, CO, H2, H2O. Dẫn X đi qua 25,52 gam hỗn hợp Fe3O4 và FeCO3 nung nóng thu được chất rắn Y gồm Fe, FeO, Fe3O4; hơi nước và 0,2 mol CO2. Chia Y thành 2 phần bằng nhau:
- Phần 1: Hòa tan hết trong dung dịch chứa a mol HNO3 và 0,025 mol H2SO4, thu được 0,1 mol khí NO duy nhất. - Phần 2: Hòa tan hết trong dung dịch H2SO4 đặc nóng, thu được dung dịch chứa hai muối có số mol bằng nhau và 0,15 mol khí SO2 duy nhất. Giá trị của a là A. 0,40 mol. B. 0,45 mol. C. 0,35 mol. D. 0,50 mol. Câu 34: Cho m gam hỗn hợp M gồm Al (6x mol), Zn (7x mol), Fe3O4, Fe(NO3)2 tác dụng hết với 250 gam dung dịch H2SO4 31,36%, thu được dung dịch X chỉ chứa các muối trung hòa và 0,16 mol hỗn hợp Y chứa hai khí NO, H2 có đối với He bằng 6,625. Cô cạn dung dịch X thu được (m + 60,84) gam muối. Nếu nhỏ từ từ dung dịch KOH 2M vào dung dịch X đến khi không còn phản ứng nào xảy ra thì vừa hết 1 lít dung dịch KOH. Nồng độ phần trăm của FeSO4 có trong dung dịch X là A. 10,28%. B. 10,43%. C. 19,39%. D. 18,82%. Câu 35: Hỗn hợp X gồm Cu2O, FeO, M (kim loại M có hóa trị không đổi), trong X số mol của ion O2- gấp 2 lần số mol M. Hòa tan 38,55 gam X trong dung dịch HNO3 loãng dư thấy có 1,5 mol HNO3 phản ứng, sau phản ứng thu được 118,35 gam hỗn hợp muối và 2,24 lít NO (đktc). Tính phần trăm khối lượng của M trong X? A. 25,29%. B. 50,58%. C. 16,86%. D. 24,5%.
DẠYKÈMQUYNHƠN
4
HỆ THỐNG BÀI TẬP KIM LOẠI KIỀM, KIỀM THỔ, NHÔM, SẮT VÀ HỢP CHẤT Ở CẤP ĐỘ VẬN DỤNG CAO
Câu 1: Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư, thấy có 0,7 mol axit phản ứng và còn lại 0,35a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp A bằng H2 dư, thu được 34,4 gam chất rắn. Phần trăm khối lượng Cu trong hỗn hợp A gần nhất với giá trị nào sau đây? A. 25,0%. B. 16,0%. C. 40,0%. D. 50,0%. Câu 2: Nung m gam hỗn hợp gồm Mg và Cu(NO3)2 trong điều kiện không có không khí, sau một thời gian thu được chất rắn X và 10,08 lít (đktc) hỗn hợp khí gồm NO2 và O2. Hòa tan hoàn toàn X bằng 650 ml dung dịch HCl 2M, thu được dung dịch Y chỉ chứa 71,87 gam muối clorua và 0,05 mol hỗn hợp khí Z gồm N2 và H2 Tỉ khối của Z so với He bằng 5,7. Giá trị của m gần giá trị nào nhất sau đây?
OFFICIAL
A. 50. B. 55. C. 45. D. 60. Câu 3: Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4 +) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất), đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3:2:1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với giá trị nào sau đây? A. 48%. B. 58%. C. 54%. D. 46%. Câu 4: Hỗn hợp X gồm Cu và Fe3O4 Khử m gam hỗn hợp X bằng khí CO dư (đun nóng), thu được 0,798m gam hỗn hợp kim loại. Cho m gam hỗn hợp X tác dụng với dung dịch HCl lấy dư, thu được dung dịch Y và chất rắn Z. Cho dung dịch Y tác dụng với dung dịch AgNO3 dư, thu được 427,44 gam kết tủa và V lít khí NO (đktc). Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư thu được 2,75V lít NO (sản phẩm khử duy nhất, đktc). Giá trị gần nhất của V là A. 2,24. B. 2,68 C. 2,82. D. 2,71. Câu 5: Lấy hỗn hợp X gồm Zn và 0,3 mol Cu(NO3)2 nhiệt phân một thời gian, thu được hỗn hợp rắn Y và 10,08 lít hỗn hợp khí Z gồm NO2 và O2. Y tác dụng vừa đủ với dung dịch chứa 2,3 mol HCl, thu được dung dịch T chỉ chứa các muối clorua và 2,24 lít (đktc) hỗn hợp khí E gồm 2 đơn chất không màu có tỉ khối so với H2 là 7,5. Tổng khối lượng muối trong dung dịch T có giá trị gần nhất với A. 154,5. B. 155,5. C. 155,0. Câu 6: Trộn 58,75 gam hỗn hợp X gồm Fe(NO3)2 và kim loại M với 46,4 gam FeCO3 được hỗn hợp Y. Cho toàn bộ Y vào lượng vừa đủ dung dịch KHSO4, thu được dung dịch Z chỉ chứa 4 ion (không kể H+ và OH của H2O) và 16,8 lít hỗn hợp T (đktc) gồm 3 khí trong đó có 2 khí có cùng phân tử khối và 1 khí hóa nâu trong không khí. Tỉ khối của T so với H2 là 19,2. Cô cạn 1/10 dung dịch Z thu được m gam rắn khan. Giá trị của m là A. 39,385. B. 37,950. C. 39,835. D. 39,705.
Câu 7: Hòa tan hoàn toàn 29,6 gam hỗn hợp H gồm FeS2 và CuO vào 500 gam dung dịch HNO3 C% (dùng dư 10% so với lượng phản ứng), cô cạn dung dịch sau phản ứng thu được 56,12 gam hỗn hợp muối khan. Biết trong quá trình xảy ra phản ứng chỉ có NO2 là sản phẩm khử duy nhất. Giá trị C gần nhất với giá trị nào sau đây? A. 31,6. B. 28,7. C. 39,4. D. 52,9. Câu 8: Cho m gam hỗn hợp X gồm Cu và Fe2O3 vào 200,0 ml dung dịch chứa NaNO3 1M và H2SO4 2M, thu được dung dịch Y và thấy thoát ra 1,12 lít khí NO. Thêm dung dịch HCl dư vào dung dịch Y, lại thấy thoát ra 1,12 lít khí NO. Biết NO là sản phẩm khử duy nhất của ion nitrat và thể tích khí đo ở đktc. Giá trị của m là A. 18,4 B. 24,0. C. 25,6. D. 26,4. Câu 9: Hòa tan hoàn toàn 8,6 gam hỗn hợp Al, Mg, Fe, Zn vào 100 gam dung dịch gồm KNO3 1M và H2SO4 2M, thu được dung dịch X chứa 43,25 gam muối trung hòa và hỗn hợp khí Y (trong đó H2 chiếm 4% khối lượng Y). Cho một lượng KOH vào X, thu được dung dịch chỉ chứa một chất tan và kết tủa Z (không có khí thoát ra). Nung Z trong không khí đến khối lượng không đổi được 12,6 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X gần giá trị nào nhất sau đây? A. 7,50%. B. 7,00%. C. 7,75%. D. 7,25%.
DẠYKÈMQUYNHƠN
1
Câu 10: Hòa tan hết 17,6 gam hỗn hợp rắn X gồm Cu, Mg, Fe3O4 và Fe(NO3)2 trong dung dịch chứa 0,55 mol KHSO4 loãng, đun nóng. Kết thúc phản ứng thu được dung dịch Y chỉ chứa 87,63 gam muối trung hòa và 1,68 lít hỗn hợp khí Z gồm NO và H2 (ở đktc) có tỉ khối hơi so với H2 là 6,6. Biết trong Y không chứa muối Fe3+. Cho Ba(OH)2 dư vào Y thì thấy m gam kết tủa xuất hiện. Giá trị của m là A. 150,53. B. 122,78. C. 120,84. D. 146,36. Câu 11: Hoà tan hết 15,44 gam hỗn hợp gồm Fe3O4, Fe và Al (trong đó oxi chiếm 20,725% về khối lượng) bằng 280 gam dung dịch HNO3 20,25% (dùng dư), thu được 293,96 gam dung dịch X và 0,896 lít hỗn hợp khí X gồm NO và N2O. Để tác dụng tối đa các chất trong dung dịch X cần 450 ml dung dịch NaOH 2M. Nếu cô cạn dung dịch X thu được chất rắn Z. Nung Z đến khối lượng không đổi, thấy khối lượng chất rắn giảm m gam. Giá trị m là A. 44,12. B. 46,56. C. 43,72. D. 45,84. Câu 12: Hỗn hợp X gồm FeO, Fe2O3, S, FeS2 và CuS trong đó O chiếm 4,6997% khối lượng. Cho 15,32 gam X tác dụng vừa đủ với 0,644 mol H2SO4 đặc (đun nóng) sinh ra 14,504 lít khí SO2 (là sản phẩm khử duy nhất) và dung dịch Y. Nhúng thanh Mg dư vào Y sau khi các phản ứng xảy ra hoàn toàn lấy thanh Mg ra cân lại thấy tăng 5,14 gam (Giả sử 100% kim loại sinh ra bám vào thanh Mg). Đốt cháy hoàn toàn 15,32 gam X bằng lượng vừa đủ V lít (đktc) hỗn hợp khí A gồm O2 và O3 tỉ lệ mol 1:1. Giá trị gần nhất của V là A. 4,3. B. 10,5. C. 5,3. D. 3,5. Câu 13: Hòa tan hoàn toàn 17,44 gam hỗn hợp X gồm Fe, Fe3O4, Fe2O3, CuO, Cu, Mg, MgO (trong đó oxi chiếm 18,35% về khối lượng) trong dung dịch chứa 0,804 mol HNO3 loãng (dư 20% so với lượng cần cho phản ứng), kết thúc các phản ứng thu được dung dịch Y và V lít (đktc) hỗn hợp khí Z gồm N2 và N2O (tỷ lệ số mol tương ứng là 2:3). Cho dung dịch NaOH tới dư vàoY rồi đun nóng, không có khí thoát ra. Giá trị của V là A. 0,56. B. 0,448. C. 1,39. D. 1,12. Câu 14: Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al, Fe2O3, CuO trong khí trơ ở nhiệt độ cao, sau một thời gian thu được hỗn hợp rắn Y. Cho Y tác dụng với dung dịch NaOH dư, thu được 21,504 lít khí H2 (đktc) và còn lại hỗn hợp rắn Z. Cho Z tác dụng với dung dịch CuSO4 dư, thấy khối lượng chất rắn T thu được sau phản ứng tăng 1,6 gam so với khối lượng của Z. Hòa tan hoàn toàn T bằng 426 gam dung dịch HNO3 35% (dư 25% so với lượng cần thiết), thu được 8,8 gam NO (sản phẩm khử duy nhất của N+5) và thấy khối lượng dung dịch tăng 40,16 gam. Phần trăm về khối lượng của Fe2O3 trong hỗn hợp X gần nhất với giá trị nào sau đây?
OFFICIAL
A. 38%. B. 39%. C. 36%. D. 37%. Câu 15: Hòa tan 22 gam hỗn hợp X gồm Fe, FeCO3, Fe3O4 vào 0,5 lít dung dịch HNO3 2M thì thu được dung dịch Y (không có NH4NO3) và hỗn hợp khí Z gồm CO2 và NO. Lượng HNO3 dư trong Y tác dụng vừa đủ với 13,44 gam NaHCO3. Cho hỗn hợp Z vào bình kín có dung tích không đổi 8,96 lít chứa O2 và N2 tỉ lệ thể tích 1 : 4 ở 00C và áp suất 0,375 atm. Sau đó giữ bình ở nhiệt độ 00C thì trong bình không còn O2 và áp suất cuối cùng là 0,6 atm. Phần trăm khối lượng của Fe3O4 trong hỗn hợp X là A. 52,73%. B. 26,63%. C. 63,27%. D. 42,18%. Câu 16: Cho 33,35 gam hỗn hợp X gồm Fe3O4, Fe(NO3)3, Cu tan hoàn toàn trong dung dịch chứa 0,414 mol H2SO4 (loãng), thu được khí NO sản phẩm khử duy nhất và dung dịch Y chỉ chứa 2 muối. Cho bột Cu vào dung dịch Y thấy phản ứng không xảy ra. Cô cạn Y thu được m gam muối khan. Giá trị của m là A. 65,976. B. 75,922. C. 61,520. D. 64,400. Câu 17: Hòa tan m gam hỗn hợp A gồm Mg, Al, MgO và Al2O3 bằng dung dịch HCl vừa đủ thì được dung dịch chứa (m + 70,295) gam muối. Cho m gam hỗn hợp A tác dụng với dung dịch H2SO4 đặc nóng dư, thu được 13,328 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp A tác dụng với dung dịch HNO3 loãng dư, thu được 3,808 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hiđro là , dung dịch Y. Cô cạn dung dịch Y thu 318 17 được 162,15 gam muối khan. Giá trị của m là A. 30,99. B. 40,08. C. 29,88. D. 36,18. Câu 18: Hòa tan hết 20 gam hỗn hợp X gồm Cu và các oxit sắt (trong hỗn hợp X oxi chiếm 16,8% về khối lượng) cần vừa đúng dung dịch hỗn hợp A chứa b mol HCl và 0,2 mol HNO3 thu được 1,344 lít NO (đktc) là sản phẩm khử duy nhất và dung dịch Y. Cho dung dịch Y tác dụng với một lượng dung dịch AgNO3 vừa đủ thu được m gam kết tủa và dung dịch Z. Cho dung dịch Z tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa, nung đến khối lượng không đổi thu được 22,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 70,33. B. 76,81. C. 83,29. D. 78,97. Câu 19: Hòa tan hết 16,32 gam hỗn hợp Fe và Cu trong 134,4 gam dung dịch HNO3 45%, thu được dung dịch X (không chứa muối amoni). Cho X phản ứng với 400 ml dung dịch hỗn hợp gồm NaOH 1M và KOH 0,5M, thu
DẠYKÈMQUYNHƠN
2
được kết tủa Y và dung dịch Z. Nung Y trong trong không khí đến khối lượng không đổi, thu được 21,6 gam hỗn hợp Fe2O3 và CuO. Cô cạn Z, thu được hỗn hợp chất rắn khan T. Nung T đến khối lượng không đổi, thu được 43,44 gam hỗn hợp chất rắn. Nồng độ phần trăm của Fe(NO3)3 trong X gần giá trị nào nhất sau đây?
A. 20. B. 6. C. 10. D. 4. Câu 20: Hòa tan hết hỗn hợp X gồm 5,6 gam Fe; 27 gam Fe(NO3)2 và m gam Al trong dung dịch chứa 0,61 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 47,455 gam muối trung hòa và 2,352 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16. Giá trị của m là
A. 1,080. B. 4,185. C. 5,400. D. 2,160. Câu 21: Hỗn hợp X gồm Al và Fe. Cho X tan vừa hết trong 352 ml dung dịch HNO3 2,5M, thu được dung dịch Y chứa 53,4 gam hỗn hợp muối và 2,24 lít hỗn hợp khí Z gồm NO, N2O (đktc) có tỉ khối hơi đối với H2 là 17,1. Cho dung dịch Y tác dụng với một lượng dung dịch NH3 dư, lọc thu được m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị m gần giá trị nào nhất sau đây?
A. 5,95. B. 20,00. C. 20,45. D. 17,35. Câu 22: Hỗn hợp X gồm Al, Al2O3, Fe3O4, CuO, Fe và Cu, trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 gam X nung nóng, sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với H2 bằng 18. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HNO3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có muối NH4NO3 sinh ra) và 4,48 lít (đktc) hỗn hợp khí T gồm NO và N2O. Tỉ khối của T so với H2 là 16,75. Giá trị của m là
OFFICIAL
A. 96,25. B. 117,95. C. 80,75. D. 139,50. Câu 23: Hòa tan hết 23,76 gam hỗn hợp X gồm FeCl2, Cu và Fe(NO3)2 vào 400 ml dung dịch HCl 1M, đến khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho từ từ dung dịch chứa AgNO3 1M vào Y đến khi phản ứng hoàn thấy dùng hết 580 ml, thu được m gam kết tủa và thoát ra 0,448 lít khí (đktc). Biết NO là sản phẩm khử duy nhất của N+5 trong cả quá trình, giá trị của m gần nhất với giá trị nào sau đây?
A. 82. B. 84. C. 80. D. 86. Câu 24: Cho 20 gam hỗn hợp X gồm Fe, FeCO3, Fe2O3 vào ống sứ nung nóng và dẫn từ từ 0,2 mol hỗn hợp khí Y gồm CO và H2 (tỉ khối so với H2 bằng 4,25) qua ống sứ, sau một thời gian thu được hỗn hợp rắn X1 và khí Y1. Cho khí Y1 hấp thụ vào dung dịch Ca(OH)2 dư, thu được 7 gam kết tủa và 0,06 mol khí Y2 (tỉ khối so với H2 bằng 7,5). Hoà tan X1 bằng dung dịch HNO3 (đặc, nóng, dư), thu được dung dịch Z và 0,62 mol hỗn hợp 2 khí, trong đó có một khí màu nâu đỏ là sản phẩm khử duy nhất của N+5 Nếu cho X tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thì thu được 0,225 mol hỗn hợp 2 khí. Phần trăm khối lượng của Fe2O3 trong X là
A. 32%. B. 48%. C. 16%. D. 40%. Câu 25: Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2, thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng, thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z, thu được 73,23 gam kết tủa. Mặt khác, hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5%, thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ phần trăm của Fe(NO3)3 trong dung dịch T gần nhất với giá trị nào sau đây? A. 5%. B. 7%. C. 8%. D. 9%. Câu 26: Hỗn hợp X gồm Al, Fe3O4, FeO, Cu2O trong đó oxi chiếm 17,827% khối lượng hỗn hợp. Nếu cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng (dư), thu được 8,736 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng (dư), thu được 4,48 lít NO (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 145,08 gam muối khan. Giá trị của m là A. 46,15. B. 42,79. C. 43,08 . D. 45,14. Câu 27: Hỗn hợp X gồm Na2SO3, CuO, CuCO3. Hòa tan m gam hỗn hợp X trong dung dịch hỗn hợp HCl 1M và H2SO4 0,5M vừa đủ, thu được dung dịch Y chứa (m + 8,475) gam chất tan gồm muối clorua và sunfat trung hòa; 5,6 lít hỗn hợp khí (đktc) có tỉ khối so với hiđro là 27,6. Điện phân dung dịch Y với điện cực trơ, màng ngăn xốp đến khi lượng Cu2+ còn lại bằng 6% lượng Cu2+ trong dung dịch Y thì dừng lại thu được dung dịch Z. Cho 0,14m gam Fe vào dung dịch Z đến khi phản ứng kết thúc thu được m1 gam chất rắn. Giá trị của m1 là A. 4,5118. B. 4,7224. C. 4,9216. D. 4,6048. Câu 28: Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4 +) và hỗn hợp khí gồm NO và 0,3 mol NO2 Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng khôi đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây?
DẠYKÈMQUYNHƠN
3
A. 19,0. B. 21,0. C. 18,0. D. 20,0. Câu 29: Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp X là
A. 13,664%. B. 14,228%. C. 15,112%. D. 16,334%.
OFFICIAL
Câu 30: Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO và Al2O3 (trong đó oxi chiếm 64/205 về khối lượng) tan hết vào X, sau khi các phản ứng kết thúc thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít hỗn hợp khí T có tổng khối lượng 1,84 gam gồm 5 khí (đktc), trong đó về thể tích H2, N2O, NO2 lần lượt chiếm 4/9, 1/9 và 1/9. Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây? A. 40. B. 35. C. 20. D. 30. Câu 31: Cho 87,35 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,425 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 516,125 gam muối sunfat trung hòa và 8,12 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là . Phần trăm khối lượng của Al trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây? 365 58 A. 10%. B. 11%. C. 12%. D. 13%. Câu 32: Hòa tan hết m gam hỗn hợp rắn X gồm Mg, Cu(NO3)2, Fe, FeCO3 vào dung dịch chứa H2SO4 và 0,045 mol NaNO3, thu được dung dịch Y chỉ chứa 62,605 gam các muối (không có ion Fe3+) và thấy thoát ra 3,808 lít (đktc) hỗn hợp khí T gồm N2, NO2, N2O, NO, H2, CO2 có tỉ khối so với H2 bằng 304/17 (trong T có chứa 0,02 mol H2). Cho dung dịch NaOH 1M vào dung dịch Y đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì dùng hết 865 ml. Mặt khác, cho 94,64 gam BaCl2 vừa đủ vào Y sau đó cho tiếp AgNO3 dư vào thì thu được 256,04 gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của m là A. 27,2. B. 28,4. C. 24,36. D. 32,8. Câu 33: Cho hơi nước đi qua than nóng đỏ thu được hỗn hợp X gồm CO2, CO, H2, H2O. Dẫn X đi qua 25,52 gam hỗn hợp Fe3O4 và FeCO3 nung nóng thu được chất rắn Y gồm Fe, FeO, Fe3O4; hơi nước và 0,2 mol CO2. Chia Y thành 2 phần bằng nhau:
- Phần 1: Hòa tan hết trong dung dịch chứa a mol HNO3 và 0,025 mol H2SO4, thu được 0,1 mol khí NO duy nhất. - Phần 2: Hòa tan hết trong dung dịch H2SO4 đặc nóng, thu được dung dịch chứa hai muối có số mol bằng nhau và 0,15 mol khí SO2 duy nhất. Giá trị của a là A. 0,40 mol. B. 0,45 mol. C. 0,35 mol. D. 0,50 mol. Câu 34: Cho m gam hỗn hợp M gồm Al (6x mol), Zn (7x mol), Fe3O4, Fe(NO3)2 tác dụng hết với 250 gam dung dịch H2SO4 31,36%, thu được dung dịch X chỉ chứa các muối trung hòa và 0,16 mol hỗn hợp Y chứa hai khí NO, H2 có đối với He bằng 6,625. Cô cạn dung dịch X thu được (m + 60,84) gam muối. Nếu nhỏ từ từ dung dịch KOH 2M vào dung dịch X đến khi không còn phản ứng nào xảy ra thì vừa hết 1 lít dung dịch KOH. Nồng độ phần trăm của FeSO4 có trong dung dịch X là A. 10,28%. B. 10,43%. C. 19,39%. D. 18,82%. Câu 35: Hỗn hợp X gồm Cu2O, FeO, M (kim loại M có hóa trị không đổi), trong X số mol của ion O2- gấp 2 lần số mol M. Hòa tan 38,55 gam X trong dung dịch HNO3 loãng dư thấy có 1,5 mol HNO3 phản ứng, sau phản ứng thu được 118,35 gam hỗn hợp muối và 2,24 lít NO (đktc). Tính phần trăm khối lượng của M trong X? A. 25,29%. B. 50,58%. C. 16,86%. D. 24,5%.
DẠYKÈMQUYNHƠN
4
DẠYKÈMQUYNHƠN OFFICIAL 1 ĐÁP
Câu
34 2 23 2 A,ma(g) A 2 TN1: Cu:0,35a(g) FeO FeCl:x FeO CuCl:y Cu HO 34 H2 23 2 to 34,4(g) A,ma(g) A TN2:
Fe FeO HO Cu Cu O/AHO HCl 2 Cudö (Cu,Fe) Cu/A TN1:nn0,5n0,35a0,35.1634,440 TN1:m0,354014 TN1:m34,4 T56x64y34,41420,4x0,25 N1:
y0,1 %140,164 m 451%gannhatvôi50% 0 Câu 2: 2 2 2 2 2 2 o HN H H N N t 2 32 2 32 m(g) X nn0,05
Sôñophanöng: Mg,MgONO Mg:xmol CuO Cu(NO):ymol O Cu(NO) muoi 2 0,45mol 2 HCl 2 2 2 1,3mol 2 32 4 Z X Y,m71,87(g) O/XHOCu(NO MgCl:x Mg,MgO N:0,04 CuO CuCl:y HO H:0,01 Cu(NO) NHCl BTNTO:nn6n 32 22 4 ) (NO,O) NHCl muoi 2n6y0,9 1,30,01.22(6y0,9)BTNTH:n (0,773y) 4 m95x135y53,5(0,773y)71,87x0,39 y0,25 BTNTCl:2x2y(0,773y)1,3 m56,36gannhatvôi55 Câu 3: HCl 0,7
ÁN CHI TIẾT
1:
FeO
xy0,35
n0,01 TrongZ:2n28n0,05.5,7.41,14n0,04
DẠYKÈMQUYNHƠN OFFICIAL 2 34
3 3 2 Fe
NO
2 2 3 2 2 2 2 2
Fe NONO NO
BTÑTchoYn0,18m
2 2 32 NO NO Fe(NO)
BTNTN:n(0,080,0420,04)/20,06
BTNTFe:x3y32y2y0,060,31
Câu 4: 34 2 2 O FeO 2 HCldö 2 Z Cu Y 3 AgClFeCl CuClHC nm0,798m0,202m n FeCl:0,606m/64 416464 CuCl:0,202m/64Cu 232.0,202m m 0,26775m HCldö 64 n 64 64 AgClYAgNOdöNO Ag n2n2nn 2 2 2 34 lFeCl CuCl NO NOAg Fe 3FeO CuNO 1,616m4V2n2n4n
427,44143,5
0,606m3Vn3nn (*) 6422,4 108 BTEchopöXHNO:n2n3n 0,202m2.0,26775m2,75V.3(**) 64 6422,4 Tö(*)va(** m85,6 )suyra: V2,678gannhatvôi2,68 Câu 5:
23 32
FeO FeO FeO Fe(NO) HCl:0,88mol HNO:004mol 23 AgNOdö
HtrongY NOAgFetrongY TrongX:nx;n3y;n2y;ny;nz PÖ1:X ddYYCl:0,88mol chöa H,Fe,Fe PÖ2:Y NO n 4n0,08 n 3nn
HOtaoraôPÖ1 FetrongY cacchattantrongY
NOXaxitchattantrongYHO 0,880,040,08 n 0,42 2 (133,840,88.143,5) n 3.0,02 0,13 108
48,68 nn0,12 46n44nmmm m5,4
n0,08 4n0,04
x0,14(54%)
y0,01 BTE:3x3y2y0,060,080,04.80,13
6422,4 1,616m4V
6422,4
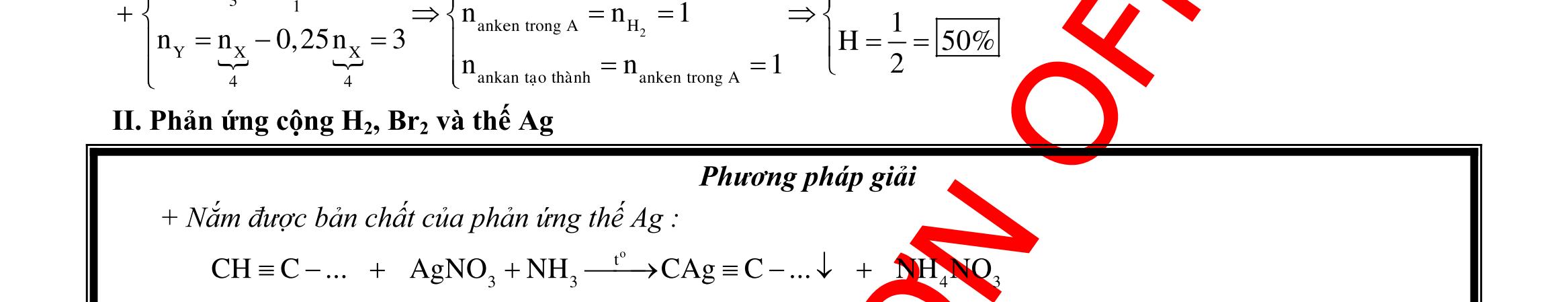
DẠYKÈMQUYNHƠN OFFICIAL 3 2 2 2 2 2 2 o HN H H N N t 2 32 2 32 X Z Y nn0,1 n0,05 TrongE:2n28n0,1.7,5.21,5n0,05 Sôñophanöng: Zn,ZnONO Zn CuO Cu(NO):0,3mol O Cu(NO) 2 32 22 4 ,0,45mol 2 HCl 2 2 2 0,23mol 2 32 4 E Y T HOCu(NO) (O,NO) NHN ZnCl Zn,ZnO N CuO CuCl:0,3mol HO H Cu(NO) NHCl BTNTO:n6n2n0,9 BTNTH:n 2 2 3 4 2 2 HClH HO O HClNHClCuCl ZnCl muoi n2n2n 0,1 4 nn2n BTNTCl:n 0,8 2 m154,65gannhatvôi154,5 Câu 6: 2 3 2 2 2 3 2 3n 2 2 4 COFeCO NO NO NO NO H CO NO(M44) ZFe,M gom ;TgomCO(M44) K,SO NO(hoanau) nn0,4xy0,40,75 x0,05 44x30y0,44419,220,7528,8y0,3nx;ny n4n10n2n2, 4 2 KHSO HO muoitrong1/10ddZ 5n2,5;n1,25. 58,7546,42,5.1361,25.1828,8 BTKL:m 39,385 10 Câu 7:
DẠYKÈMQUYNHƠN OFFICIAL 4 2 4 2 3 2 2 muoichöacacion 32 32 cocan 2 4 3 2 4 3 SO FeS CuO NO/muoi Sôñophanöng: NO FeS CuO Fe,Cu Fe,Cu SO,NO SO,NO H n2xnx n 3x2y4x2yx ny 1 3 2 2 3 2 2 3 4 3 3 HNOpöNO FeS NO/muoi Fe Cu SO HNOñempö HNO 20x80y29,6 x0,14 56x64y2x.9662(2yx)56,12y0,16 nnn 15n(3n2n2n)2,28 n 2,282,28.10%2,508C%31,6% Câu 8: 3 24 3 2 NO NaNO 3 223 HSO:0,4 NaNO:0,2 0,05mol 23 3 X DungdòchYcoFenenchoHClvaocoNObayra n0,1n0,2nencuoicungdungdòchconNO Banchatphanöng: Cu:x NCuFe,Fe O FeO:y NO, 2 2 4 Y 32 223 HCl 2 4 2 2 0,05mol 3 4 3 Y CuNOCu HO SO BTNTH:0,420,05423yy0,1 Fe,Cu CuFe,Fe NONa,SOHO NO,SO NO 3(0,050BTE:2n3nn 2,05)0,15m0,1.1600,15.6425,6gam Câu 9: 3HNO
DẠYKÈMQUYNHƠN OFFICIAL 5 3
2
4
KNO HSO
H Y
324 24 3
ddX ddX KOHKSOKNO 24 KOH
KOHXddchæchöaKSOZ
2 2 2 4 2 oxihoaFe 2 2 Fe O FeSO 5 0,45molOH0,225molO KhinungZsexayraquatrình: O zmolO 0,2251616z12,68,6z0,025BTE:n2n0,05 152.0,05C% 100%7,48%gannhatvôi7,5%101,56875 Câu 10:
24
2 324 2
4243 243 424
muoi/X
HO kimloai(KNO,HSO)muoiYHO MgSO,FeSO,Fe(SO) TögiathietsuyraXchöaAl(SO),ZnSO,KSO nx;n2xm8,639x2x9643,25x0,15 nym50y,n0,3y. BTKL:mm mmm BTKL
kimloaidd(KNOHSO)ddXY
OHtrongZ :mm mm 8,60,15.1010,3.9843,2550y18(0,3y)y0,140625 8,6100m50y m101,56875 n2nn0,45
n n0,4
SO:ymol 160x120y22,4x0,08 FeSO:0,11 xy0,16 y0,08 KSO:0,275 (NH)SO:0,005
kettua m150,53
DẠYKÈMQUYNHƠN OFFICIAL 6 2 2 4 4 34 4 424 2 2 32 424 Z X Y NOH
Sôñophanöng:
2 2 4 32 34 NO H HO NH Fe(NO) FeO 4
4 4 24 424 Y 5 2 2 2 2
Câu 11:
NOH
CuSO,FeSO Cu,FeO NO KHSOMgSO,KSO HO H Mg,Fe(NO) (NH)SO nn0,075 30n2n0,07513,20,9
n0,03 9n0,045 17,60,55.13687,630,99BTKL:n 0,21 18 0,550,045.20,21.2BTNTH:n 0,01 4 0,010,03BTNTN:n 0,02 2 0,210,030,026BTNTO:n 0,03 4 CuSO:xmol Mg
BaSO:0,55 Fe(OH):0,11YBa(OH)döKettuagom Cu(OH):0,08 Mg(OH):0,08
n0,9;n zmol;n 0,9mol.
DẠYKÈMQUYNHƠN OFFICIAL 7 3 4 NaOH HNObanñau NHtrongX 2 2 3 ddY QuyñoihonhôpbanñauthanhAl(xmol),Fe(ymol),O(0,2mol)
Sôñophanöng: NO NO AlO:x Al Fe
A 33 4 3 ddX 2 23 2 23 3 chatranZ l,Fe NH,H NO O FeO NO AlO NH 2 2 2 NONO NO NO NO NO (Al,Fe) nn0,04 n0,02 n0,02
m27x56y12,24 BTE:3x3y8z0,02.30,02.80,2.2 BTNvaBTÑTtrongZ:0,9x0,9z0,020,022
3 33 33NOtrongmuoiAl(NO),Fe(NO) n 0,78mol 0,78 m0,0280620,781643,72gam 2 Câu 12: 3HNO NaOH cocan,nung
Na:0,9 O NO:0,9x
30n44n15,44280293,961,48
x0,08 y0,18 z0,02
DẠYKÈMQUYNHƠN OFFICIAL 8 24 HSOñac 2 243 2 0,674mol Quyñoi 23 4 Y X' X47%O Sôñophanöng: FeO Fe:x FeS Fe(SO):0,5x Cu:y SO FeO S:z CuSO:y O:0,045 S,CuS 0,6475mol Mg 243 4 4 (1,5xy)mol Y X' Fe(SO):0,5x Fe CMgSO u CuSO:y m 56x64y32z14,6 x0,047 BTNTSz0,6441,5xy0,6475y0 m 56x64y24(1,5xy)4,94 23 23 quyñoi Opö 23 (O,O)Opö OpöO/X'FeCuS (O,O) ,1 z0,174 n0,4735 (O,O) O mm7,576BTE:2n2n3n2n4n 32x48x7,576x0,0947V4,24gannhatvôi4,3lít Câu 13: 3 3 3 2 2 2 3 3 4 HNOpö HNOpö HNOpö HO O/X N NO NOtaomuoi xy 3 HNO YNaOHkhonggiaiphongkhíYkhongchöaNH.
Sôñophanöng: Fe,FeO
3 2 2 3 3 2 2 3 2 3 2 32 2 2 32 O/XHNO NOHONOtaomuoi HNO NONNOtaomuoi 3 (N,N ) N Cu(NO) HO NO Mg(NO) BTNTO:n3n3n nn BTNTN:nn 2n2n x510;y0,620,20,6733y3x0,335 0,67y2.3x2.2x V 2 3 O)5.5.10.22,40,56lít Câu 14:
n20%n0,804n0,67;n0,335 n0,2;n2x;n3x;n y
Fe(NO Cu,CuO Mg,MgO
DẠYKÈMQUYNHƠN OFFICIAL 9 2 23 23 Al/YH Al/Y Fe/YCutaothanh FeObòkhö Cu/Y Cu/TCu/Y CuObòkhö Cu/Y NO AlkhöFeO,CuO Al/ BTE:3n2nn0,64mol.
n
BTE:2(n0,2)3n
3 3 3 3 32 33 X 32 3 33 2 23 3 T HNOpö HNOpö HNOpö HNOpöCu(NO) Fe(NO)NO ddtangTNO 1 Cu(NO) Cu:0,44 CuO:zHNOFe(NO)NOHO FeO:t HNO n0,25n4260,35/63n1,8933 n2n3nn2(0,44 mmm 23 FeO/X CuO/X Al/X 23
n0,2;n0,3;n1
0,21600,38027 Câu 15: 3 3 3 22 HNOpövôiXHNObanñauNaHCO 2 3 3 33 2 0,84
34 Z
2 2 22 2 O NOpöO
NOtaothanh X 8,96.0,375 n0,03 0,15 0,082273 n2n0,06giam0,03mol. 8,96.0,6 n 0,24n 0,06 0,082273 m56x116y232z22 BTE:3xyz3(0,843x3y9z) 0,15[y(0,843x3y 34FeO x0,02 y0,06 9z)]0,030,24z0,06 %0,06232 m .100%63,27% 22 Câu 16:
nn xm8x1,6x0,2n 0,1 n0,24 nn0,2
0,24
0,1.60,24.2 n 0,36n 3
z)6t0,29331,8933 0,44.6480z160t8,840,16
z0,06 0,2.160 t0,1%FeO 38,55%gannhatvôi39%
xy3z
(N,O) 13,44 n n n0,5.2 0,84. 84 Fe:x CO:yFeCO:yHNOFe(NO) HO NO:(0,843x3y9z) FeO:z n
(N,NO,NOdö)
DẠYKÈMQUYNHƠN OFFICIAL 10 24 X 4 4 34 HSO 4 33
4 Y Xm3335(g) CuSO
Sôñophanöng:
34 33 2 X 2 4 CuFeOFe(NO) NO muoi/Y NOHO m
x0,069 y0,023m64,4gam
Câu 17: 2 2 2 NONO NO NO NO NO nn0,17 n0,08 0,17.318.2 n0,09
17 23 23 quyñoi honhôpA 2 33 32 2 43 Sôñophanöng: Mg,Al Cl Al,AlO Al,Mg O Mg,MgO SO Al(NO) NO Mg(NO) NO NHNO 2 2 2 2 CelectronmaMg,Alnhöông l Cl O electronmaMg,Alnhöông SO O 0595 Cl O BTÑTcho(1):nn n2n1,19(*) BTEcho(2):n 2n2n Theo(1)vasötanggiamkhoilöông,taco:35,5n16n70,295(**) Tö(*)va(**)su 2 2 43 43 4 Cl O electronmaMgAlnhöôngNONONHNO O 008 051 0,09 221 ? (Al,Mg)muoikhan NHNO electronmaMg,Alnhöông 2,21 NHNO n2,21 yra:n0,51 BTEcho(3):n 3n8n8n2n mm80n62n n 3 (Al,Mg) 0,02875 m22,830,511630,99gam m22,83 Câu 18: HCl (1) 24ñacHSO (2) 3 HNO(3)
0,414mol
Ychöa2muoi Yco YkhongphanöngvôiCu FeSO
FeO:x CuSO:z Fe(NO):y FeSO:(3xy) Cu:z
232x242y64z33,35 BTSO (3xy)z0,414 2z2xy33yBTE:2n2nn3n
z0,184
30n44n 6,36
DẠYKÈMQUYNHƠN OFFICIAL 11 3 23 HCl 2 3 HNO:0,2mol Quyñoi xy X Y 23 2 3 Y Sôñophanöng: Fe,Fe Cu Cu,Fe Cu,NONO FeO O Cl AgCl Ag Fe,Fe Cu,NO Cl Fe o 2 2 3 3 32 NaOH 3t 23 2 3 NO HCl H O O AgCl HHClHNO NO NO/Y Fe Cu Fe(OH) ,Cu FeO Cu(OH) NO CuO 20.16,8% n2n4n0,66 n 0,21 n0,46 16 ; n0,46 nnnn0,06;n0,14 nx ny 23 2 23 3 2 (Fe,Cu) (FeO,CuO) Fe (FeFe) Fe AgAgFe m56x64y202016,8%16,64x0,16 m 80x80y22,4 y0,12 nan ab0,16 a0,12 nb b0,04BTÑT/Y:2a3b0,460,142.0,12 nnn0,12 m0, 46.143,50,12.10878,97 Câu 19: AgNO3 vöañu
DẠYKÈMQUYNHƠN OFFICIAL 12 2 2 KNOKOH 2 T 2 NaNONaOH 2 nn0,2
Na:0,4;K:0,2xy0,6
(1) 3 2 3 honhôp Fe Cu 3 H100% 23 FeCu Fe CuNOtrongX Fe 32 Cu m56n64n16,32ZcoK,Na,NO,OHdö 21,616,32 Fe,Cu FeO,CuOBTE:3n2n2. 16 3n2nn 0,56 n0,12((2) 3);Tö n0,15 (3)VayXcoFe,Fe,C 2 3 2 2 3 2 3 3 ab 3 2 3 2 3 FeFe Fe Fe FeNO Cu Fe 3 3 2 ab 0,56mol048mol 0,96mol NO HNO HO NO ddX(Cu,Fe) u,NO nn0,12 n0,1 2n3nn2n0,26n0,02 BTNTH:HNONOHONO BTKL:mmmm17,12 mm 3 ab 33 ddHNONO Fe(NO) 0,02.242mm133,6C% 4% 133,6 Câu 20: 2 2 2 NONO NO NO NO NO 23 3 32 0,61 4 3 47,455gam nn0,105 n0,09 n0,01530n44n0,105.16.23,36 Sôñophanöng: Fe,Fe
Al:x
2 2 2 HO
0,614yBTNTH:n 20,3052y BTNTO:0,090,015(0,3052y)3z0,1560,9 BTNTN:yz0,090,01520,1520,3 BTKL:27x18y62z0,25.560,61.35,547,455 2y3z0,49 Al x0,04 yz0,18 y0,01m1,08 27x18y62z11,8z0,17 Câu 21:
KNO m44,643,44 GiasöTchöa NaNOnn0,4Tconchöacabazô(1)
x0,56(2) Ttaobôicacion: 46x17y26,44y0,04NO:x;OH:y
Fe:0,1mol
Fe(NO):0,15molHCl NH:y Al:xmol NO:z
NO:0,09HO NO:0,015
DẠYKÈMQUYNHƠN OFFICIAL 13 3 2 2 2 2 23 HNO 3 3 2 0,88 2 4 X Y Y NONO NO NO NO NO HO Fe,Fe NO Al Sôñophanöng: Al,NO HO NO Fe NH:xmol nn0,1 n0,07 n0,0330n44n17,120,13,42 BTNTH:n 3 2 3 NO/Y (Al,Fe) (Al,Fe)muoikhíHOHNO 3 OH 0,884x0,442x 2 x0,03BTNTN:n0,880,070,03.2x0,75x m8,22 BTNTH:30,883(0,75x)0,030,07(0,442x) BTKL:mmmmm YddNHkettua BTÑT:n3n 3 3 2 Al Fe Fe kettuakimloaiOH 3n2n(0,750,03)0,030,69 mmm8,220,69.1719,9520 Câu 22: + Sơ đồ phản ứng: 2 Z 23 32 34 3 3 X 23 Y 2 T CO CO Al,AlO Fe,Cu Fe,FeO Al,NO Cu,CuO Cu,Fe AlO,... NO NO 2 2 2 O/X O/X (ionFe,Al,Cu)/X Z 2 Z OtrongY m35,2520,4255%7,2 n0,45(1) m 35,257,228,05 CO:xBTNTC:xy0,3x0,15 M36ZgomCO:ym28x44y0,3.36y0,15(2) (1)va(2)n 0,450,150,3 Tco 2 2 2 2 3 2 3 NONO NO NO NO NO HNO NO NO O/Y muoi NO/muoi nn0,2 n0,15 n0,0530n44n0,216,752 n2n4n10n1,7 m28,051,45.62117,95 n 1,70,150,0521,45 Câu 23: o CO t 3 HNOdö
DẠYKÈMQUYNHƠN OFFICIAL 14 X 2 32 X,m23,76gam 23 3 2 2 3 ddY ddZ Sôñophanöng: NO FeCl:x Cu:y NO:0,02mol Fe(NO):z Fe,Fe Fe:(xz) Cu,H Cu:y Cl NO Ag AgCl 3 3 2 NOô(2) AgNONOô(2) H/Y NO/Z HClH/Y NOô(1) X AgClFeClHCl n4n0,08 nnn0,56 nn 0,08 z 0,04 n 0,08 2 4 m127x64y0,0418023,76x0,08 y0,1BTÑTtrongZ:3(x0,04)2y0,56 BTNTCl:n2nn0 3 (Ag,AgCl) AgAgNOAgCl
m 82,52gannhatvôi82 BTNTAg:nnn0,02 Câu 24: 3 o 1 2 1 HNOñ23 2 33 t,(2) 3 2 X 23 2 2 3 Y X Ca(OH) 2 (3) 2 Y TN1: FeO,FeO CO Fe(NO) Fe,FeCO NO Fe,FeOCO HO(hôi) HFeCO CO,H C CO 2 o 3 2 0,07mol Y t 24 243 22 2 CO aCO H TN2:XHSOñacFe(SO)(SO,CO)HO (1)HCl 0,4mol (2)AgNO 0,58mol 3 ot (1)
,56
DẠYKÈMQUYNHƠN OFFICIAL 15 2 2 2 2 2 2 2 2 3 2 HCO H 1 Hpö
H CO CO COtaothanhtöCO HCO H COtachratöFeCO 2 H CO CO nn0,2
n
(CO,H)pö NO 2 2 3 3 2 3 3 24 n n Fe FeCO 0,05 TN1:ChatkhölaFe,FeCO,CO,H;chatoxihoalaHNO TN2:ChatkhölaFe,FeCO;chatoxihoalaHSO BTEchoTN1:3xy2(0,120,02)0,62(y0,05) nx ny SO2 23 n FeO BTEchoTN2:3xy2(0,225y) x0,09;%200,09560,06116 m 40% 20 y0,06 Câu 25: 3 22 2 2 2 2 AgNOdö (ClO) HCl 2 0,13mol X,m(g) Y(m611)g 73,23(g) Zco2muoi OCl O Cl CuCl Cu oxit AgCl TN1: Fe muoi ... nn0,13 32n71n6,11 2 2 2 2 2 2 2 O O Cl HClO AgClClHCl FeCl/ZAg Ag CuCl n0,08n0,16 n0,05n2n0,32 BNTNCl:n2nn0,42nn0,12 73,230,42.143,5 0,420,12.2 n 0,12 n 0,09 108 2 m0,12.560,09.6412,48 Cu TN2: Fe 3 3 33 32 32 33 HNO 32 2 31,5% 0,15mol 32 X,m(g) HNO Fe(NO) Fe(NO) Cu(NO)NO F Fe(NO):xmol Fe(NO):ymolNOHO Cu(NO):0,09mol BTE:3x2y0,0920,153x0,03 BTNTFe:xy0,12 y0,09 BTNTN:n3n2n2nn0,6 C% 33e(NO) 0,03242 5,67%gannhat5%12,480,663:31,5%0,1530
COpö
n0,15 Yco n0,12;n0,022n28n8,5.0,2n0,05 n 0,02 nn0,06 n0,03
Yco 2n28n15.0,06n0,03
DẠYKÈMQUYNHƠN OFFICIAL 16 Câu 26: 24 2 quyñoi34 2 X' X,m(g) HSOñac 24n 2 2 X' electronMnhöôngOSO Al,FeO M:0,82173m(g) O:0,17827m(g) FeO,CuO M TH1: M(SO)SOHO O 20,17827m n 2n2n 1 3 Y 4 3 4 n 3 4 n HNO 4 2 0,2mol 3 X Ym14508(g) electronMnhöôngO NO NH electronMnhöôngNO/Y NH muoiM NO NH 0,78 6 M M TH2: NH:xNOHO O NO n 2n8n3n nn n mmmm 0,788x0,6 0, x0,0225 20,17827m82173m6210,78x18x145,08m43,08 6 Câu 27: 3 2 2 2 2 2 2 23 CuCO COSO CO CO SO SO NaSO 24 22 2 xmol0,5xmol xmol n0,11 nn0,25 n0,11 44n64n27,620,2513,8n0,14n0,14 BTNTH:hhX(HCl,HSO)ddY(CO,SO)HO BTKL:m36,5x49x(m8,475)13,8 2 4 2 2 2 ñpdd 4 18x Na:0,28;Cl:0,33;SO:0,165
2
1 0272 0,0114molCu0,0942molFeddZchatran m4,6048 0,0692molFe
x0,33Yco0,165.20,330,28 Cu: 0,19
m0,11.1240,14.12680.(0,190,11)37,68 Cu:0,0114;Na:0,28:SO:0,165YddZ H0,165.20,280,0114.20,
NO:0,3 NO:z Na:0,26 CuS:x SO:x2y FeS:y NO:0,520,3z
DẠYKÈMQUYNHƠN OFFICIAL 17 Câu
2 2 2 4 2 3 ddZ 23 2 4 3 ddX 3 2 Sôñophanöng:
Cu,Fe
23 64(g) 2 3 2 4 3 FeO CuO
H chattan/X
Câu 29: HNO 0,52
28:
H,SO NO Fe(OH) Cu(OH)
BTNTFe,Cu:2x.800,5y.1606,4x0,03 BTE:10x15y3z0,3 y0,02 BTÑT/Z:0,262(x2y)(0,22z)z0,1 Cu:0,06mol Fe:0,02mol Xco:SO:0,07mol NO:0,12mol H:?mol
BTÑT:n0,08 m19,2gannhatvôi19
3 NaOH 0,26
DẠYKÈMQUYNHƠN OFFICIAL 18 2 2 2 Z 2 HNO H H NO NO 32 4 1,16mol 2964gam H M1,947,6
nn0,3
Sôñophanöng: FeO Fe(NO)KHSO Al,Mg 2 4 32 233 2 2 2 4 4 ?mol 228gam 17972gam HO NH Fe(NO) Fe,Fe,AlHHO NH,SO NO 29,641,16.136179,722,28BTKL:n 0,3 18
BTH:n 0,02 4 0,060,02BTN:n 0,04 2 BTO:n FeO Alzn Al 0,30,060,0460,12 x0,15 nnx %m13,664%27x65x29,640,041800,1272 Câu 30: 4 4 33 2 2 2 2 KHSOBaSO Fe(NO) H NONO NO N 3 3 2 216,551,53.136nn1,53;n 0,035 242 n0,04 xy0,03x0,01Tconn0,01 30x28y0,86y0,02 nx;ny Tínhoxihoa:NO/HH TrongZkhongcoNO ddXYH... 33 2 2 2 4 4 2 2 4 33 2 2 2 4 2 Fe(NO) N NONONONH KHSO H HO NH OtrongYFe(NO)NONONOHO NH HO O OtrongY BTNTN:3n2n2nnnn BTNTH:n2n4n2n BTNTO:n9nnn2nn n0,025 160,464n0,675%m m20,5gannham205 n0,4 tvôi20 Câu 31:
Zgom NO Zgom2khítrongñocoNO(hoanau)
n0,24 2n30n0,37,62,28n0,06
1,160,24.20,3.2
DẠYKÈMQUYNHƠN OFFICIAL 19 2 2 2 Z 2 HNO H NO H NO 34 32 87,35gam 3654 H M
Zgom2khítrongñocoNO(hoanau)
Sôñophanöng: FeO Fe(NO) Al 2 4 233 2 4 2 2 4 4 ?mol 3,425mol 9,125gam
HO NH Fe( Fe,Fe,AlHKHSO HO NH,SO NO 87,353,425136516,1259,125BTKL:n
18
BTH:n 0,05 4 BTN:n 32 34 Al Al NO) FeO m9,45 %m11% 0,175 1,550,30,1756BTO:n 0,2 4 Câu 32: 4 2 2 2 24 3 24 2 4 4 4 424 BaSOBaCl AgClBaCl BaCl Ag NaSO NaNO HSOBaCl FeSOAg CuSO MgSO (NH)SO nn0,455;n2n0,91 n0,455 256,040,455.2330,91.143,5 n 0,18 108 n0,5n0,0225;nn0,455mol;nn0,18 nx;ny;n z Mg,C 24 4 22 32 3 4 2 3 24 4 22 48,415gam mgam 6,08gam 424 62,605gam NaSO FeSO N,NO u(NO)NaNO MgSO NO,NO Fe,FeCO HSO CuSO CO,H (NH)SO 4 4 4 424 2 2 2 4 4 4 424 24 2 ? NaOHFeSO MgSO CuSO (NH)SO kettuaFe(OH)Cu(OH)Mg(OH) muoiFeSOMgSOCuSO(NH)SONaSO HO n2n2n2n2n mmmm mmmmm m 0,8650,18.22y2x2z 31,72900,1898x58y 62,605152 24 424 2 2 2 324 2 HSO (NH)SO H HO HO 0,455 0,0125 0,02 ? X(NaNO,HSO)muoikhíHO x0,04 y0,2 0,18120y160x132z1420,0225z0,0125 BTNTH:2n8n 2n2n n0,385 m27,2 BTKL:mm mmm
25,17 Zgom 58 NO
nn0,3625 n0,0625 0,3625.365.4 n0,3 2n30n 9,125 58
516,125gam
1,55
3,4251,5520,06252
DẠYKÈMQUYNHƠN OFFICIAL 20
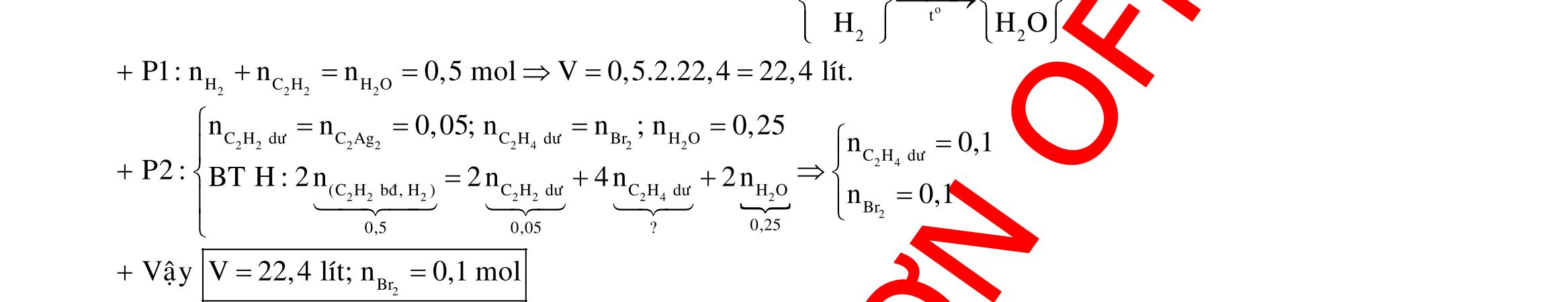
o X
34 C 2 t 34 3
Y
34
24 o HSOñac 4 2 t 243
0,5Y X FeSO:zmol
Fe,FeO F 3 24 3 2 HNO:amol
2 0,1 34 3 4 0,5Y Fe:0,1,Fe:0,05
BTÑT:0,1.30,05.20,025.2(a0,1)a0,45 Chú ý: Vì số mol electron trao đổi ở 2 phần bằng nhau nên lượng muối sắt sinh ra trong các dung dịch sau phản ứng cũng bằng nhau.
Câu 33:
OtrongY
Otrong0,5Y 0,2mol
X,m25,52(g)
Banchatphanöng: n(4x3y0,4) FeO:xmol Fe,FeOCO FeO FeCO:ymol n (2x1,5y0,2) Fe,FeO FeO
0,15mol
SO Fe(SO):zmol m232x116y25,52 x0,08 BTE:2z32z0,1522(2x1,5y0,2)y0,06 BTNTFe:3xy2(z2z) z0,05
HSO:0,025mol
NO eO NO:(a0,1),SO:0,025
1 ZnSO:7xmol Al(SO):3xmol KSO:0,8mol FeSO:ymol KOHKAlO:6xmol Fe(SO):zmol KZnO:7xmol (NH)SO:0,01mol
DẠYKÈMQUYNHƠN OFFICIAL 21
2
(1)
X
2 2 2 4 32 34 NO H NOH HO NH Fe(NO) FeO 16
4 243 24 4 2 2mol 243 22 Z 424 X
4FeSO BTNTFe:y2z0,38 x0,02 BTNTS:7x9xy3z0,010,8y0,2 BTNTK:0,826x7x22 z0,09 0,2.152 C% 10,28% 60,022770,02650,081800,12322504,24 Câu 35:
Câu 34:
4243 34
24 4243 2 2 320,8mol 424 Y M
NOH Sôñophanöng: ZnSO,Al(SO) Al,FeO NO HSOFeSO,Fe(SO) HO H Zn,Fe(NO) (NH)SO nn0,
n0,14 n0,0230n2n0,16.26,54,24 m78,4(m60,84)4,24BTKL:n 0,74 18 0,820,0220,742BTNTH:n 0,02 4 Ô(1): 0,140,02BTNTN:n 0,08 2 0,740,140,086BTNTO:n 0, 4
DẠYKÈMQUYNHƠN OFFICIAL 22 3 X 2 4 23 2 HNO n 4 2
3 X,m38,55(g)
HO NH
3 3 4 2 4 HNONO NO NH O kimloai M O CuOFeONONH
n
n1 x0,2538,551440,25720,05
1,5mol 0,1mol
118,35(g)
CuO:xmol Cu,Fe FeO:ymol M,NHNOHO M NO 38,551,563118,350,130BTKL:n 0,65 18 1,50,BTNTH:n
65.2 0,05 4 38,5533,75BTNTN:nnnn1,35n 0,3 16 m118,351,35.620,05.1833,75n0,15
xy0,3 BTE:2nn3n8n2xy0,15n0,130,058
M 7(loai). 0,15 y0,05 x0,138,55144.0,172.0,2n2 M 65(Zn)%Zn25,29% 0,15 y0,2
HỆ THỐNG BÀI TẬP ESTE Ở CẤP ĐỘ VẬN DỤNG CAO
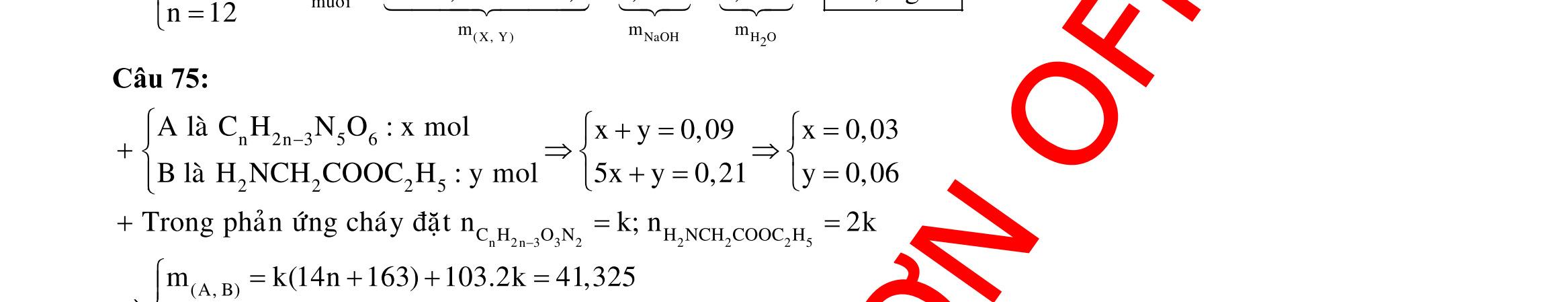
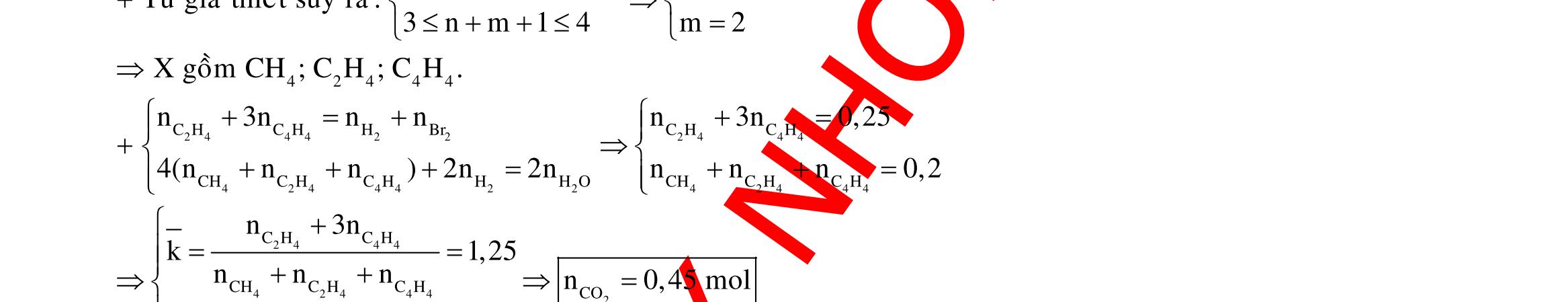
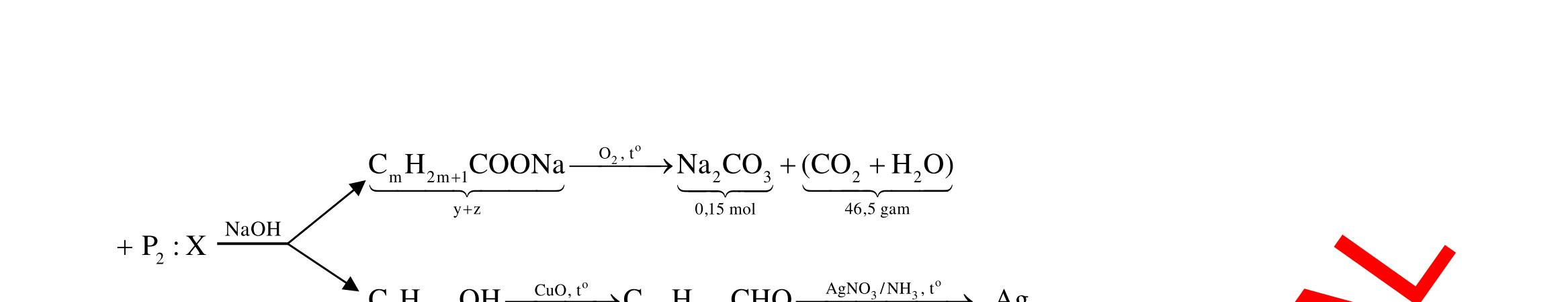
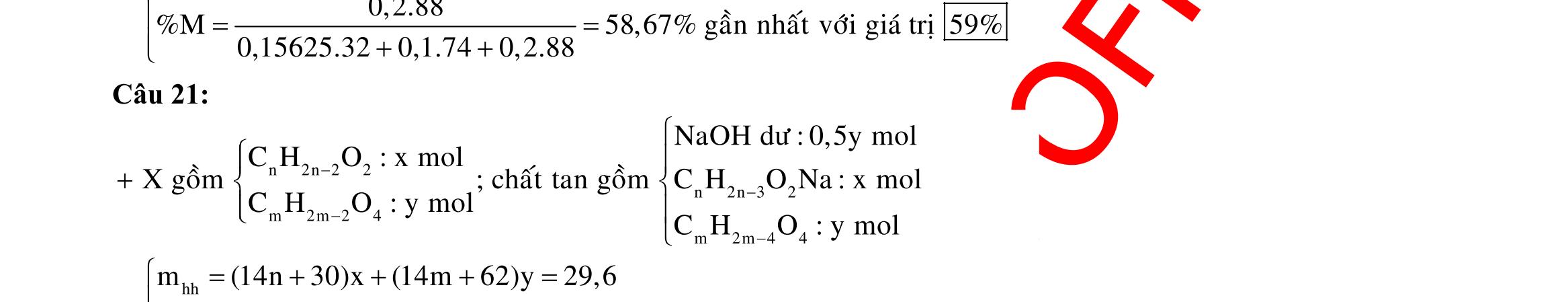
Câu 1: Hỗn hợp X gồm một ancol và một axit cacboxylic đều no, đơn chức, mạch hở, có cùng số nguyên tử cacbon trong phân tử. Đốt cháy hoàn toàn 51,24 gam X, thu được 101,64 gam CO2 Đun nóng 51,24 gam X với xúc tác H2SO4 đặc, thu được m gam este (hiệu suất phản ứng este hóa bằng 60%). Giá trị m gần giá trị nào nhất sau đây?
A. 25,5. B. 28,5. C. 41,8. D. 47,6. Câu 2: Hỗn hợp Z gồm ancol X no, mạch hở và axit cacboxylic Y no, đơn chức, mạch hở (X và Y có cùng số nguyên tử C trong phân tử). Đốt cháy hoàn toàn 0,4 mol Z cần 31,36 lít (đktc) khí O2, thu được 26,88 lít (đktc) khí CO2 và 25,92 gam H2O. Mặt khác, nếu đun nóng 0,4 mol Z với H2SO4 đặc để thực hiện phản ứng este hóa (hiệu suất 75%) thì thu được m gam este. Giá trị của m là
OFFICIAL
A. 10,4. B. 36,72 gam. C. 10,32 gam. D. 12,34 gam. Câu 3: X là este 3 chức. Xà phòng hóa hoàn toàn 2,904 gam X bằng dung dịch NaOH, thu được chất hữu cơ Y có khối lượng 1,104 gam và hỗn hợp 3 muối của 1 axit cacboxylic thuộc dãy đồng đẳng của axit axetic và 2 axit cacboxylic thuộc dãy đồng đẳng của axit acrylic. Cho toàn bộ lượng Y tác dụng hết với Na, thu được 0,4032 lít H2 (đktc). Hỏi khi đốt cháy hoàn toàn 2,42 gam X thu được tổng khối lượng H2O và CO2 là bao nhiêu gam? A. 6,10. B. 5,92. C. 5,04. D. 5,22. Câu 4: Hỗn hợp X gồm 1 ancol đơn chức và 1 este đơn chức (mạch hở, cùng số nguyên tử cacbon). Đốt cháy hoàn toàn m gam X cần dùng vừa đủ V lít O2, thu được 17,472 lít CO2 và 11,52 gam nước. Mặt khác, m gam X phản ứng với dung dịch KOH dư thì thu được 0,26 mol hỗn hợp ancol. Biết X không tham gia phản ứng tráng gương, các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị V là bao nhiêu? A. 21,952. B. 21,056. C. 20,384. D. 19,6. Câu 5: Một hợp chất hữu cơ X có công thức phân tử C10H8O4 trong phân tử chỉ chứa 1 loại nhóm chức. 1 mol X phản ứng vừa đủ với 3 mol NaOH tạo thành dung dịch Y gồm 2 muối (trong đó có 1 muối có M < 100), 1 anđehit no (thuộc dãy đồng đẳng của metanal) và nước. Cho dung dịch Y phản ứng với lượng dư AgNO3/NH3 thì khối lượng kết tủa thu được là
A. 162 gam. B. 432 gam. C. 162 gam. D. 108 gam. Câu 6: Đốt cháy hoàn toàn 17,6 gam hợp chất hữu cơ X mạch hở, cần dùng vừa đủ 16,8 lít O2 (đktc), thu được CO2 và H2O theo tỉ lệ số mol tương ứng là 7 : 6. Biết X có công thức phân tử trùng với công thức đơn giản nhất, X phản ứng hết với lượng dư dung dịch NaOH chỉ sinh ra một muối của axit no, mạch hở và một ancol có công thức phân tử C3H7OH. Số công thức cấu tạo của X thỏa mãn các điều kiện trên là A. 8. B. 4. C. 2. D. 3.
Câu 7: X là este đơn chức, mạch hở tác dụng vừa đủ với dung dịch KOH 11,666%. Sau phản ứng thu được dung dịch Y. Cô cạn Y thì phần hơi chỉ có H2O với khối lượng 86,6 gam, còn lại chất rắn Z có khối lượng là 23 gam. Có bao nhiêu đồng phân cấu tạo của X thoả mãn tính chất trên? A. 1. B. 2. C. 3. D. 4. Câu 8: Ancol X (MX= 76) tác dụng với axit cacboxylic Y thu được hợp chất Z mạch hở (X và Y đều chỉ có một loại nhóm chức). Đốt cháy hoàn toàn 17,2 gam Z cần vừa đủ 14,56 lít khí O2 (đktc), thu được CO2 và H2O theo tỉ lệ số mol tương ứng là 7 : 4. Mặt khác, 17,2 gam Z lại phản ứng vừa đủ với 8 gam NaOH trong dung dịch. Biết Z có công thức phân tử trùng với công thức đơn giản nhất. Số công thức cấu tạo của Z thỏa mãn là A. 1. B. 3. C. 2. D. 4. Câu 9: Thủy phân hoàn toàn 4,84 gam este A bằng một lượng dung dịch NaOH vừa đủ, rồi cô cạn chỉ thu được hơi nước và hỗn hợp X gồm hai muối (đều có khối lượng phân tử lớn hơn 68). Đốt cháy hoàn toàn lượng muối trên cần đúng 6,496 lít O2 (đktc), thu được 4,24 gam Na2CO3; 5,376 lít CO2 (đktc) và 1,8 gam H2O. Thành phần phần trăm khối lượng muối có khối lượng phân tử nhỏ hơn trong X là A. 27,46%. B. 37,16%. C. 36,61%. D. 63,39%.
DẠYKÈMQUYNHƠN
1
Câu 10: Este A tạo bởi 2 axit cacboxylic X, Y (đều mạch hở, đơn chức) và ancol Z. Xà phòng hóa hoàn toàn a gam A bằng 140 ml dung dịch NaOH tM thì cần dùng 80 ml dung dịch HCl 0,25M để trung hòa vừa đủ lượng NaOH dư, thu được dung dịch B. Cô cạn B thu được b gam hỗn hợp muối khan N. Nung N trong NaOH khan dư có thêm CaO thu được chất rắn R và hỗn hợp khí K gồm 2 hiđrocacbon có tỉ khối với oxi là 0,625. Dẫn K lội qua nước brom thấy có 5,376 lít 1 khí thoát ra, cho toàn bộ R tác dụng với axit H2SO4 loãng dư thấy có 8,064 lít khí CO2 sinh ra. Đốt cháy hoàn toàn 2,76 gam Z cần dùng 2,352 lít oxi sinh ra nước CO2 có tỉ lệ khối lượng 6 : 11. Biết các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị a gần nhất với giá trị nào sau đây?
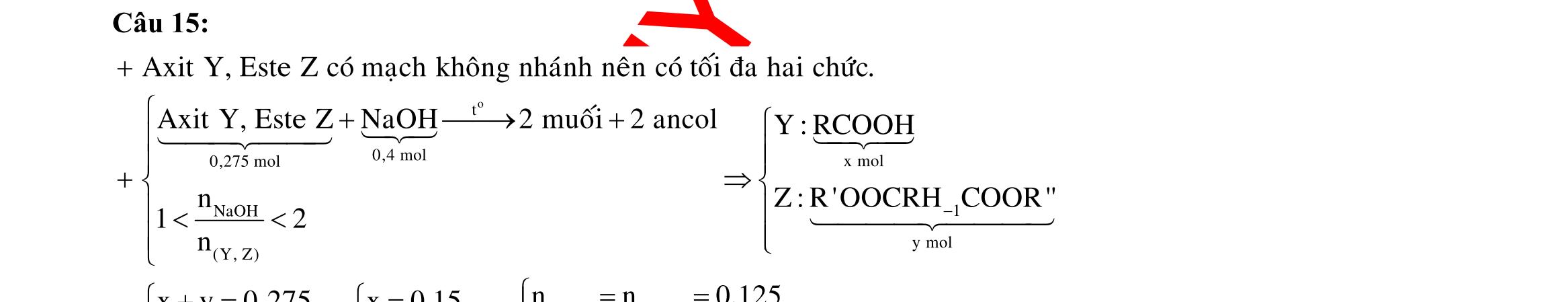
OFFICIAL
A. 26. B. 27. C. 28. D. 29. Câu 11: X là este đơn chức; Y là este hai chức (X, Y đều mạch hở). Đốt cháy 21,2 gam hỗn hợp E chứa X, Y thu được x mol CO2 và y mol H2O với x = y + 0,52. Mặt khác, thủy phân hoàn toàn 21,2 gam E cần dùng 240 ml dung dịch KOH 1M, thu được một muối duy nhất và hỗn hợp F chứa 2 ancol đều no. Dẫn toàn bộ F qua bình đựng Na dư thấy khối lượng bình tăng 8,48 gam. Số nguyên tử H (hiđro) có trong este Y là A. 14. B. 12. C. 10. D. 8. Câu 12: X là một axit cacboxylic, Y là một este hai chức, mạch hở (được tạo ra khi cho X phản ứng với ancol đơn chức Z). Cho 0,2 mol hỗn hợp gồm X và Y phản ứng hoàn toàn với dung dịch KHCO3 lấy dư, thu được 0,11 mol CO2. Mặt khác, đốt cháy hoàn toàn 0,2 mol hỗn hợp trên, thu được 0,69 mol CO2 và m gam H2O. Giá trị của m là A. 6,21. B. 10,68. C. 14,35. D. 8,82. Câu 13: Xà phòng hoá hoàn toàn m gam một este no, đơn chức, mạch hở E bằng 28 gam dung dịch KOH 28%. Cô cạn hỗn hợp sau phản ứng thu được 25,68 gam chất lỏng X và chất rắn khan Y. Đốt cháy hoàn toàn Y, thu được sản phẩm gồm CO2, H2O và K2CO3, trong đó tổng khối lượng của CO2 và H2O là 18,34 gam. Mặt khác, cho X tác dụng với Na dư, thu được 13,888 lít khí H2 (đktc). Giá trị m gần nhất với A. 11. B. 12. C. 10. D. 14. Câu 14: X là este no, đơn chức; Y là este đơn chức, không no chứa một liên kết đôi C=C (X, Y đều mạch hở). Đốt cháy hoàn toàn 0,08 mol hỗn hợp E chứa X, Y (số mol X lớn hơn số mol Y) cần dùng 7,28 lít O2 (đktc). Mặt khác, đun nóng 0,08 mol E với dung dịch NaOH (lấy dư 20% so với phản ứng), cô cạn dung dịch sau phản ứng thu được m gam rắn khan và hỗn hợp F chứa 2 ancol đồng đẳng kế tiếp. Đun nóng F với CuO thu được hỗn hợp G chứa 2 anđehit, lấy toàn bộ hỗn hợp G tác dụng với AgNO3/NH3 thu được 28,08 gam Ag. Giá trị m là A. 6,86. B. 7,28. C. 7,92. D. 6,64. Câu 15: Hỗn hợp E gồm este X đơn chức và axit cacboxylic Y hai chức (đều mạch hở, không no có một liên kết đôi C = C trong phân tử). Đốt cháy hoàn toàn một lượng E thu được 0,43 mol khí CO2 và 0,32 mol hơi nước. Mặt khác, thủy phân 46,6 gam E bằng lượng NaOH vừa đủ rồi cô cạn dung dịch thu được 55,2 gam muối khan và phần hơi có chứa chất hữu cơ Z. Biết tỉ khối của Z so với H2 là 16. Phần trăm khối lượng của Y trong hỗn hợp E có giá trị gần nhất với
A. 46,5%.
B. 48,0%. C. 43,5%.
D. 41,5%.
Câu 16: X là este no, đơn chức, Y là axit cacboxylic đơn chức, không no chứa một liên kết đôi C=C; Z là este 2 chức tạo bởi etylen glicol và axit Y (X, Y, Z, đều mạch hở, số mol Y bằng số mol Z). Đốt cháy a gam hỗn hợp E chứa X, Y, Z cần dùng 0,335 mol O2 thu được tổng khối lượng CO2 và H2O là 19,74 gam. Mặt khác, a gam E phản ứng vừa đủ với 0,03 mol H2. Khối lượng của X trong E là A. 8,6. B. 6,6. C. 6,8. D. 7,6. Câu 17: X, Y là hai chất hữu cơ kế tiếp thuộc dãy đồng đẳng của ancol anlylic; Z là axit no, hai chức; T là este tạo bởi X, Y, Z. Đốt cháy 17,12 gam hỗn hợp E chứa X, Y, Z, T (đều mạch hở) cần dùng 10,864 lít (đktc) khí O2, thu được 7,56 gam H2O. Mặt khác, 17,12 gam E làm mất màu vừa đủ dung dịch chứa 0,09 mol Br2 Nếu đun nóng 0,3 mol hỗn hợp E với 450 ml dung dịch KOH 1M, cô cạn dung dịch sau phản ứng lấy phần lỏng chứa các chất hữu cơ đi qua bình đựng Na (dư) thấy khối lượng bình tăng m gam. Giá trị của m gần nhất với giá trị nào sau đây?
A. 8,4. B. 8,5. C. 8,6. D. 8,7. Câu 18: Đốt cháy hoàn toàn 26,72 gam hỗn hợp X gồm axit metacrylic, axit ađipic, axit axetic và glixerol (trong đó số mol axit metacrylic bằng số mol axit axetic) bằng O2 dư, thu được hỗn hợp Y gồm khí và hơi. Dẫn Y vào dung dịch chứa 0,76 mol Ba(OH)2, thu được 98,5 gam kết tủa và dung dịch Z. Đun nóng Z lại xuất hiện kết tủa. Cho 26,72 gam hỗn hợp X tác dụng với 150 ml dung dịch KOH 2M, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được m gam chất rắn khan. Giá trị của m gần giá trị nào nhất ?
A. 30,1. B. 35,6. C. 24,7. D. 28,9. Câu 19: Hỗn hợp X gồm 2 chất hữu cơ đơn chức A và B (chứa C, H, O và đều có phân tử khối lớn hơn 50). Lấy m gam X tác dụng vừa đủ với dung dịch NaOH, sau phản ứng hoàn toàn thu được sản phẩm là dung dịch Y chỉ chứa
DẠYKÈMQUYNHƠN
2
hai muối, trong đó có một muối chứa 19,83% natri về khối lượng. Chia dung dịch Y thành 2 phần bằng nhau. Phần 1 đem thực hiện phản ứng tráng bạc, thu được tối đa 16,2 gam Ag. Phần 2 đem cô cạn rồi đốt cháy hoàn toàn thu được CO2, H2O và 10,6 gam Na2CO3. Giá trị m là A. 13,85. B. 30,40. C. 41,80. D. 27,70. Câu 20: Hỗn hợp E gồm X là một axit cacboxylic có mạch cacbon không phân nhánh và Y là một ancol hai chức mạch hở (trong đó số mol X nhỏ hơn số mol Y). Đốt cháy hoàn toàn 3,36 gam hỗn hợp E thu được 5,5 gam CO2 và 2,34 gam H2O. Mặt khác, khi cho cùng một lượng E trên phản ứng với Na dư thì thu được 784 ml khí H2 (đktc). Z được tạo thành khi este hoá hỗn hợp E, biết Z có cấu tạo mạch hở và có một nhóm chức este. Số đồng phân cấu tạo có thể có của Z là
A. 6. B. 8. C. 7. D. 9.
Câu 21: Hợp chất hữu cơ X (chứa C, H, O) chỉ có một loại nhóm chức. Cho 0,15 mol X phản ứng vừa đủ với 180 gam dung dịch NaOH, thu được dung dịch Y. Làm bay hơi Y, chỉ thu được 164,7 gam hơi nước và 44,4 gam hỗn hợp chất rắn khan Z. Đốt cháy hoàn toàn Z, thu được 23,85 gam Na2CO3; 56,1 gam CO2 và 14,85 gam H2O. Mặt khác, Z phản ứng với dung dịch H2SO4 loãng (dư), thu được hai axit cacboxylic đơn chức và hợp chất T (chứa C, H, O và MT < 126). Số nguyên tử H trong phân tử T bằng A. 8. B. 6. C. 10. D. 12.
OFFICIAL
DẠYKÈMQUYNHƠN
3
HỌC LỰC LÀ QUÁ KHỨ, HỌC TẬP MỚI THỂ HIỆN TƯƠNG LAI
Có một anh tiến sĩ được phân đến một viện nghiên cứu, là người có học vị cao nhất ở đây. Có một hôm anh ta ra hồ sau viện nghiên cứu câu cá, giám đốc và phó giám đốc cũng ngồi câu cá ở hai bên. Anh ta chỉ gật đầu chào hỏi cho có, hai tên chỉ tốt nghiệp đại học có gì để nói chuyện?
Một lúc sau, ông giám đốc đặt cần câu xuống, vươn vai, đạp lên mặt nước như bay đến nhà vệ sinh. Anh tiến sĩ mắt trợn trừng như sắp long ra đến nơi. Bay trên mặt nước? Không phải chứ? Đây là cái hồ nước đó!
Lúc ông giám đốc đi vệ sinh cũng đạp nước quay về.
Chuyện gì thế? Anh tiến sĩ ngại không dám hỏi, bản thân là tiến sĩ mà!
Một lúc sau, phó giám đốc cũng đứng lên, bước vài bước, rồi đạp nước bay đến nhà vệ sinh. Lần này anh tiến sĩ ngất: “Không nhầm chứ, mình đang ở nơi toàn cao thủ giang hồ?”
Anh tiến sĩ cũng mót rồi. Cái hồ này hai bên là tường bao, muốn đến chỗ nhà vệ sinh phải đi đường vòng hết 10 phút, mà nếu quay về cơ quan để dùng thì lại xa quá, làm sao bây giờ? Anh ta cũng không muốn hỏi hai vị giám đốc, nhịn cả nửa ngày, cuối cùng cũng đứng lên đi ra chỗ mặt nước: “Ta không tin là tốt nghiệp đại học bay qua mặt nước được, còn tiến sĩ ta lại không thể.”
Tùm! Anh tiến sĩ ngã nhào xuống nước. Hai vị giám đốc vội vàng kéo anh ta lên, hỏi sao lại nhảy xuống nước làm gì, anh ta hỏi lại: “Sao hai ông đi qua được vậy?”
OFFICIAL
Hai vị giám đốc nhìn nhau cười: “Cái hồ này có hai hàng cọc, hai hôm nay trời mưa nước dâng lên. Chúng tôi đều biết vị trí của hàng cọc, vì vậy có thể đi trên đó. Sao anh không hỏi một tiếng?”
Bài học: Học lực là thứ thể hiện quá khứ, chỉ có học tập mới thể hiện tương lai. Tôn trọng, học tập những người có kinh nghiệm, mới có thể tránh được đường vòng. Một nhóm tốt cũng là một nhóm không ngừng học tập.
(SƯU TẦM)
trải nghiệm bản thân. Là một người lính đặc nhiệm SEAL của Hải quân Mỹ trong 36 năm, cuộc đời binh nghiệp của ông thử thách nhất khi tham gia khóa huấn luyện cơ bản của SEAL. Huấn luyện SEAL giống như thách thức cả cuộc đời, được nhét vào trong vỏn vẹn 6 tháng trời.
Trong giai đoạn huấn luyện chiến đấu trên bộ, các học viên được đưa tới đảo San Clemente, nằm ngoài khơi San Diego.
Vùng nước ngoài khơi San Clemente đầy cá mập trắng. Để vượt qua hoạt động huấn luyện SEAL, các học viên phải thực hiện nhiều bài bơi cự ly dài, với một bài diễn ra trong đêm.
Trước bài đó, các thầy vui vẻ hướng dẫn cho học viên biết thông tin về mọi loài cá mập đang sống ở vùng nước ngoài khơi San Clemente.
DẠYKÈMQUYNHƠN
4
BÀI HỌC CUỘC ĐỜI Ý NGHĨA TỪ LÍNH ĐẶC NHIỆM NAVY SEAL McRaven, cựu tư lệnh Bộ chỉ huy các lực lượng đặc biệt Mỹ (USSOC), người tổ chức cuộc đột kích tiêu diệt trùm khủng bố Osama Bin Laden, đã chia sẻ bài học cuộc đời thông qua chính
Họ đảm bảo với bạn rằng không một sinh viên nào từng bị cá mập ăn thịt, ít nhất là cho tới gần đây. Nhưng bạn cũng được cho biết rằng nếu cá mập bắt đầu bơi lòng vòng quanh mình, hãy ở yên một chỗ. Đừng bơi đi, nhưng cũng đừng tỏ ra sợ hãi.
Và nếu con cá mập, dĩ nhiên đang đói nên mói mò đi kiếm ăn trong đêm, lao về phía bạn thì hãy dồn toàn bộ sức mạnh để đấm vào miệng nó. Con vật sẽ xoay mình và bỏ đi.
Thế giới có rất nhiều cá mập. Nếu muốn hoàn thành chặng bơi của mình, bạn sẽ phải đương đầu với chúng.
Vì thế, nếu bạn muốn thay đổi thế giới, hãy đừng sợ cá mập.
Trong cuộc sống hiện nay, “cá mập” tượng trưng cho những khó khăn, thử thách của cuộc đời. Hoặc là bạn để nỗi sợ cá mập khuất phục bạn, hoặc là bạn phải đủ mạnh mẽ để đối đầu với cá mập hung dữ đang trong cơn đói. Thế hệ trẻ chúng ta giờ đây còn đang sống trong nỗi sợ. Chúng ta sợ thất bại, chúng ta sợ khó khăn, sợ thử thách, hay nói cách khác là chúng ta sợ “những con cá mập đói khát và hung dữ”. Chúng ta sợ mất việc, chúng ta sợ kinh tế khủng hoảng, chúng ta sợ rủi ro khi khởi nghiệp, chúng ta sợ lạm phát, chúng ta sợ toàn cầu,... Cho nên, nếu muốn thay đổi cuộc đời mình, thì bạn ngay từ bây giờ phải vượt qua nỗi sợ “cá mập”.
5
DẠYKÈMQUYNHƠN OFFICIAL
HỆ THỐNG BÀI TẬP ESTE Ở CẤP ĐỘ VẬN DỤNG CAO
Câu 1: Hỗn hợp X gồm một ancol và một axit cacboxylic đều no, đơn chức, mạch hở, có cùng số nguyên tử cacbon trong phân tử. Đốt cháy hoàn toàn 51,24 gam X, thu được 101,64 gam CO2 Đun nóng 51,24 gam X với xúc tác H2SO4 đặc, thu được m gam este (hiệu suất phản ứng este hóa bằng 60%). Giá trị m gần giá trị nào nhất sau đây?
OFFICIAL
A. 25,5. B. 28,5. C. 41,8. D. 47,6. Câu 2: Hỗn hợp Z gồm ancol X no, mạch hở và axit cacboxylic Y no, đơn chức, mạch hở (X và Y có cùng số nguyên tử C trong phân tử). Đốt cháy hoàn toàn 0,4 mol Z cần 31,36 lít (đktc) khí O2, thu được 26,88 lít (đktc) khí CO2 và 25,92 gam H2O. Mặt khác, nếu đun nóng 0,4 mol Z với H2SO4 đặc để thực hiện phản ứng este hóa (hiệu suất 75%) thì thu được m gam este. Giá trị của m là A. 10,4. B. 36,72 gam. C. 10,32 gam. D. 12,34 gam. Câu 3: X là este 3 chức. Xà phòng hóa hoàn toàn 2,904 gam X bằng dung dịch NaOH, thu được chất hữu cơ Y có khối lượng 1,104 gam và hỗn hợp 3 muối của 1 axit cacboxylic thuộc dãy đồng đẳng của axit axetic và 2 axit cacboxylic thuộc dãy đồng đẳng của axit acrylic. Cho toàn bộ lượng Y tác dụng hết với Na, thu được 0,4032 lít H2 (đktc). Hỏi khi đốt cháy hoàn toàn 2,42 gam X thu được tổng khối lượng H2O và CO2 là bao nhiêu gam? A. 6,10. B. 5,92. C. 5,04. D. 5,22. Câu 4: Hỗn hợp X gồm 1 ancol đơn chức và 1 este đơn chức (mạch hở, cùng số nguyên tử cacbon). Đốt cháy hoàn toàn m gam X cần dùng vừa đủ V lít O2, thu được 17,472 lít CO2 và 11,52 gam nước. Mặt khác, m gam X phản ứng với dung dịch KOH dư thì thu được 0,26 mol hỗn hợp ancol. Biết X không tham gia phản ứng tráng gương, các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị V là bao nhiêu? A. 21,952. B. 21,056. C. 20,384. D. 19,6. Câu 5: Một hợp chất hữu cơ X có công thức phân tử C10H8O4 trong phân tử chỉ chứa 1 loại nhóm chức. 1 mol X phản ứng vừa đủ với 3 mol NaOH tạo thành dung dịch Y gồm 2 muối (trong đó có 1 muối có M < 100), 1 anđehit no (thuộc dãy đồng đẳng của metanal) và nước. Cho dung dịch Y phản ứng với lượng dư AgNO3/NH3 thì khối lượng kết tủa thu được là
A. 162 gam. B. 432 gam. C. 162 gam. D. 108 gam. Câu 6: Đốt cháy hoàn toàn 17,6 gam hợp chất hữu cơ X mạch hở, cần dùng vừa đủ 16,8 lít O2 (đktc), thu được CO2 và H2O theo tỉ lệ số mol tương ứng là 7 : 6. Biết X có công thức phân tử trùng với công thức đơn giản nhất, X phản ứng hết với lượng dư dung dịch NaOH chỉ sinh ra một muối của axit no, mạch hở và một ancol có công thức phân tử C3H7OH. Số công thức cấu tạo của X thỏa mãn các điều kiện trên là
A. 8. B. 4. C. 2. D. 3.
Câu 7: X là este đơn chức, mạch hở tác dụng vừa đủ với dung dịch KOH 11,666%. Sau phản ứng thu được dung dịch Y. Cô cạn Y thì phần hơi chỉ có H2O với khối lượng 86,6 gam, còn lại chất rắn Z có khối lượng là 23 gam. Có bao nhiêu đồng phân cấu tạo của X thoả mãn tính chất trên? A. 1. B. 2. C. 3. D. 4. Câu 8: Ancol X (MX= 76) tác dụng với axit cacboxylic Y thu được hợp chất Z mạch hở (X và Y đều chỉ có một loại nhóm chức). Đốt cháy hoàn toàn 17,2 gam Z cần vừa đủ 14,56 lít khí O2 (đktc), thu được CO2 và H2O theo tỉ lệ số mol tương ứng là 7 : 4. Mặt khác, 17,2 gam Z lại phản ứng vừa đủ với 8 gam NaOH trong dung dịch. Biết Z có công thức phân tử trùng với công thức đơn giản nhất. Số công thức cấu tạo của Z thỏa mãn là A. 1. B. 3. C. 2. D. 4. Câu 9: Thủy phân hoàn toàn 4,84 gam este A bằng một lượng dung dịch NaOH vừa đủ, rồi cô cạn chỉ
DẠYKÈMQUYNHƠN
1
thu được hơi nước và hỗn hợp X gồm hai muối (đều có khối lượng phân tử lớn hơn 68). Đốt cháy hoàn toàn lượng muối trên cần đúng 6,496 lít O2 (đktc), thu được 4,24 gam Na2CO3; 5,376 lít CO2 (đktc) và 1,8 gam H2O. Thành phần phần trăm khối lượng muối có khối lượng phân tử nhỏ hơn trong X là A. 27,46%. B. 37,16%. C. 36,61%. D. 63,39%.
Câu 10: Este A tạo bởi 2 axit cacboxylic X, Y (đều mạch hở, đơn chức) và ancol Z. Xà phòng hóa hoàn toàn a gam A bằng 140 ml dung dịch NaOH tM thì cần dùng 80 ml dung dịch HCl 0,25M để trung hòa vừa đủ lượng NaOH dư, thu được dung dịch B. Cô cạn B thu được b gam hỗn hợp muối khan N. Nung N trong NaOH khan dư có thêm CaO thu được chất rắn R và hỗn hợp khí K gồm 2 hiđrocacbon có tỉ khối với oxi là 0,625. Dẫn K lội qua nước brom thấy có 5,376 lít 1 khí thoát ra, cho toàn bộ R tác dụng với axit H2SO4 loãng dư thấy có 8,064 lít khí CO2 sinh ra. Đốt cháy hoàn toàn 2,76 gam Z cần dùng 2,352 lít oxi sinh ra nước CO2 có tỉ lệ khối lượng 6 : 11. Biết các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị a gần nhất với giá trị nào sau đây?
OFFICIAL
A. 26. B. 27. C. 28. D. 29. Câu 11: X là este đơn chức; Y là este hai chức (X, Y đều mạch hở). Đốt cháy 21,2 gam hỗn hợp E chứa X, Y thu được x mol CO2 và y mol H2O với x = y + 0,52. Mặt khác, thủy phân hoàn toàn 21,2 gam E cần dùng 240 ml dung dịch KOH 1M, thu được một muối duy nhất và hỗn hợp F chứa 2 ancol đều no. Dẫn toàn bộ F qua bình đựng Na dư thấy khối lượng bình tăng 8,48 gam. Số nguyên tử H (hiđro) có trong este Y là A. 14. B. 12. C. 10. D. 8. Câu 12: X là một axit cacboxylic, Y là một este hai chức, mạch hở (được tạo ra khi cho X phản ứng với ancol đơn chức Z). Cho 0,2 mol hỗn hợp gồm X và Y phản ứng hoàn toàn với dung dịch KHCO3 lấy dư, thu được 0,11 mol CO2. Mặt khác, đốt cháy hoàn toàn 0,2 mol hỗn hợp trên, thu được 0,69 mol CO2 và m gam H2O. Giá trị của m là A. 6,21. B. 10,68. C. 14,35. D. 8,82. Câu 13: Xà phòng hoá hoàn toàn m gam một este no, đơn chức, mạch hở E bằng 28 gam dung dịch KOH 28%. Cô cạn hỗn hợp sau phản ứng thu được 25,68 gam chất lỏng X và chất rắn khan Y. Đốt cháy hoàn toàn Y, thu được sản phẩm gồm CO2, H2O và K2CO3, trong đó tổng khối lượng của CO2 và H2O là 18,34 gam. Mặt khác, cho X tác dụng với Na dư, thu được 13,888 lít khí H2 (đktc). Giá trị m gần nhất với A. 11. B. 12. C. 10. D. 14. Câu 14: X là este no, đơn chức; Y là este đơn chức, không no chứa một liên kết đôi C=C (X, Y đều mạch hở). Đốt cháy hoàn toàn 0,08 mol hỗn hợp E chứa X, Y (số mol X lớn hơn số mol Y) cần dùng 7,28 lít O2 (đktc). Mặt khác, đun nóng 0,08 mol E với dung dịch NaOH (lấy dư 20% so với phản ứng), cô cạn dung dịch sau phản ứng thu được m gam rắn khan và hỗn hợp F chứa 2 ancol đồng đẳng kế tiếp. Đun nóng F với CuO thu được hỗn hợp G chứa 2 anđehit, lấy toàn bộ hỗn hợp G tác dụng với AgNO3/NH3 thu được 28,08 gam Ag. Giá trị m là A. 6,86. B. 7,28. C. 7,92. D. 6,64. Câu 15: Hỗn hợp E gồm este X đơn chức và axit cacboxylic Y hai chức (đều mạch hở, không no có một liên kết đôi C = C trong phân tử). Đốt cháy hoàn toàn một lượng E thu được 0,43 mol khí CO2 và 0,32 mol hơi nước. Mặt khác, thủy phân 46,6 gam E bằng lượng NaOH vừa đủ rồi cô cạn dung dịch thu được 55,2 gam muối khan và phần hơi có chứa chất hữu cơ Z. Biết tỉ khối của Z so với H2 là 16. Phần trăm khối lượng của Y trong hỗn hợp E có giá trị gần nhất với
A. 46,5%.
B. 48,0%. C. 43,5%.
D. 41,5%.
Câu 16: X là este no, đơn chức, Y là axit cacboxylic đơn chức, không no chứa một liên kết đôi C=C; Z là este 2 chức tạo bởi etylen glicol và axit Y (X, Y, Z, đều mạch hở, số mol Y bằng số mol Z). Đốt cháy a gam hỗn hợp E chứa X, Y, Z cần dùng 0,335 mol O2 thu được tổng khối lượng CO2 và H2O là 19,74 gam. Mặt khác, a gam E phản ứng vừa đủ với 0,03 mol H2. Khối lượng của X trong E là A. 8,6. B. 6,6. C. 6,8. D. 7,6. Câu 17: X, Y là hai chất hữu cơ kế tiếp thuộc dãy đồng đẳng của ancol anlylic; Z là axit no, hai chức; T là este tạo bởi X, Y, Z. Đốt cháy 17,12 gam hỗn hợp E chứa X, Y, Z, T (đều mạch hở) cần dùng 10,864 lít (đktc) khí O2, thu được 7,56 gam H2O. Mặt khác, 17,12 gam E làm mất màu vừa đủ dung dịch chứa 0,09 mol Br2 Nếu đun nóng 0,3 mol hỗn hợp E với 450 ml dung dịch KOH 1M, cô cạn dung dịch sau phản ứng lấy phần lỏng chứa các chất hữu cơ đi qua bình đựng Na (dư) thấy khối lượng bình tăng m gam. Giá trị của m gần nhất với giá trị nào sau đây?
A. 8,4. B. 8,5. C. 8,6. D. 8,7. Câu 18: Đốt cháy hoàn toàn 26,72 gam hỗn hợp X gồm axit metacrylic, axit ađipic, axit axetic và glixerol (trong đó số mol axit metacrylic bằng số mol axit axetic) bằng O2 dư, thu được hỗn hợp Y gồm khí và hơi. Dẫn Y vào dung dịch chứa 0,76 mol Ba(OH)2, thu được 98,5 gam kết tủa và dung dịch Z. Đun nóng Z lại xuất hiện kết tủa. Cho 26,72 gam hỗn hợp X tác dụng với 150 ml dung dịch KOH 2M, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được m gam chất rắn khan. Giá trị của m gần giá trị nào nhất ?
A. 30,1. B. 35,6. C. 24,7. D. 28,9. Câu 19: Hỗn hợp X gồm 2 chất hữu cơ đơn chức A và B (chứa C, H, O và đều có phân tử khối lớn hơn 50). Lấy m gam X tác dụng vừa đủ với dung dịch NaOH, sau phản ứng hoàn toàn thu được sản phẩm là dung dịch Y chỉ chứa
DẠYKÈMQUYNHƠN
2
hai muối, trong đó có một muối chứa 19,83% natri về khối lượng. Chia dung dịch Y thành 2 phần bằng nhau. Phần 1 đem thực hiện phản ứng tráng bạc, thu được tối đa 16,2 gam Ag. Phần 2 đem cô cạn rồi đốt cháy hoàn toàn thu được CO2, H2O và 10,6 gam Na2CO3. Giá trị m là A. 13,85. B. 30,40. C. 41,80. D. 27,70. Câu 20: Hỗn hợp E gồm X là một axit cacboxylic có mạch cacbon không phân nhánh và Y là một ancol hai chức mạch hở (trong đó số mol X nhỏ hơn số mol Y). Đốt cháy hoàn toàn 3,36 gam hỗn hợp E thu được 5,5 gam CO2 và 2,34 gam H2O. Mặt khác, khi cho cùng một lượng E trên phản ứng với Na dư thì thu được 784 ml khí H2 (đktc). Z được tạo thành khi este hoá hỗn hợp E, biết Z có cấu tạo mạch hở và có một nhóm chức este. Số đồng phân cấu tạo có thể có của Z là
A. 6. B. 8. C. 7. D. 9.
Câu 21: Hợp chất hữu cơ X (chứa C, H, O) chỉ có một loại nhóm chức. Cho 0,15 mol X phản ứng vừa đủ với 180 gam dung dịch NaOH, thu được dung dịch Y. Làm bay hơi Y, chỉ thu được 164,7 gam hơi nước và 44,4 gam hỗn hợp chất rắn khan Z. Đốt cháy hoàn toàn Z, thu được 23,85 gam Na2CO3; 56,1 gam CO2 và 14,85 gam H2O. Mặt khác, Z phản ứng với dung dịch H2SO4 loãng (dư), thu được hai axit cacboxylic đơn chức và hợp chất T (chứa C, H, O và MT < 126). Số nguyên tử H trong phân tử T bằng A. 8. B. 6. C. 10. D. 12.
OFFICIAL
DẠYKÈMQUYNHƠN
3
DẠYKÈMQUYNHƠN OFFICIAL 1 ĐÁP
Câu
2 2 25 37 CO n2n2 X n2n2 X X 37 CO 25 CHCOOCH n2,31CHO:xmol
n
m60x74y51,24
n 25 37CHCOOCH 0,36.60%0,216mol m 25,056gamgannhatvôigiatrò25,5gam Câu 2: 2 2 2 2 2 2 24 O O/Z O/ZO COHO Z CO HO O XY 353 25 HSOñac,t n n1,04;O2,6 n2n2nn n n1,2;n1,44;n1,4C1,2 C 3 0,4 XlaCH(OH):xmolBT:3x2y1,04x0,24 YlaCHCOOH:ymolBTC:xy0,4y0,16 COOHOH o 2 H75% OH COOH OHpöCOOHpö este COOHO n0,72n0,16 nn
920,12 m30,12.740,12.1810,4gam Câu 3: 3 3 3 2 3 3 6n2n8 11146 2 22 1114 3 COO CC R(OH)R(OOCR) 3 2 R(OH) H 3 3n2n8 R(OH)R(OOCR) CHO CHO O ? 0,01 (COHO)CHO Xla:R(OOCR)(k 5) n n0,012 3n2n0,036 R(OOCR)CHO n n M 242n11 46n4n m m 2 22 11146 2 6 2 O (COHO)CHO O O 0,115322,42 n0,115 m mm6,1gam m Câu 4:
ÁN CHI TIẾT
1:
51,24n Xgom 2M ,31 2,31 CHO:ymoln
51,24n14n18 14n322,23,91n3 2,31
CHOH x0,41 Xgom ;nxy0,77CHCOOH y0,36
0,16.75%0,12mol
DẠYKÈMQUYNHƠN OFFICIAL 2 33 2 2 estevaancolcocungsoC AgNO/NH 3 3 (RCOOR',R''OH)(R'OH,R''OH) co6H CO HO X X 2 X X co XgomRCOOR'vaR''OH RCOOHCOO X Ag CHCOOCH:xmol n n 0,26 Xgom n 2n CHCCHOH C 3;H 4,923 n n 2 2 2 2 2 4H O O/X O COHO O(ñktc) 0,38?091078064 :ymol x0,12;y0,14 n0,91mol xy0,26 n2n2nn 6x4y1,28 V20,384lít Câu 5: X 64 XNaOH NaOH n2n1 X 64 2 1mol3mol Theogiathiet: O42(COO)Xcodang:COOCHCOO(*) n:n1:3 CHCHO X(C10) (**) RCOONa(M100) n1;RlaH Tö(*)va(**),suyra:XlaHCOOCHCOOCHCH X3NaOH 3 64 3 1mol 1mol AgHCOONaCHCHO Ag HCOONaNaOCHCOONaCHCHO n2n2n4m432gam Câu 6: 2 2 2 2 2 CO HO C H XO COHO OtrongX 17,60,75327x446x18 CHO 7125 7125 37 n7x;n6x x0,1;n0,7;n1,2 17,60,7121,2 mmmm n 0,5 16 n:n:n7:12:5CTPTcuaXlaCHO CHONaOH1muoicuaaxitno,machhôCHOH X 2 2 223 2 2 32 khongconhomCOOH.VayXco2chöcestevaco1nhomOHtödo. HOCHCOOCHCOOCHCHCH Xco2ñongphanla: HOCHCOOCHCOOCH(CH) PS : Nếu giả thiết “X phản ứng hết với lượng dư dung dịch NaOH chỉ sinh ra một muối của axit no, mạch hở và một ancol có công thức phân tử C3H7OH” bằng giả thiết “X phản ứng hết với lượng dư dung dịch NaOH sinh ra một muối của axit no, mạch hở và một ancol có công thức phân tử C3H7OH” thì X sẽ có 8 đồng phân. Câu 7:
DẠYKÈMQUYNHƠN OFFICIAL 3 + Este X đơn chứa, mạch hở tác dụng với dung dịch KOH vừa đủ, thu được
thì
o 2 2 RCOOR' t 2
2 chatranHO(1) RCOOR' 882 23 18x 643 643 643 3 65 x0,1 mm M136(CHO) oHCOOCHCH,mHCOOCHCH Xco4ñongphan: pHCOOCHCHvaCHCOOCH Câu 8: 2 2 2 2 2 2 785 Z O HO CO O/Z 17,2 065 4x 7x CHO O/ZOHOCO 785 ? 0,654x 7x NaOH CHO 2 M72 m32n18n44nx0,1;n0,5 n:n:n7:8:5 n2nn2n
n0,22 n0,1 XlaR'(OH) 2chöceste
2 2 36 M72 2 R'25(loai) YlaR(COOH)
Zco3ñongphanla:
2 3 222 2 3 HCHOHCH HOOCCCCOOCHCHCHOH HOOCCCCOOCH(CHOH)CH Câu 9:
dung dịch Y. Cô cạn dung dịch Y
phần hơi chỉ có nước, chứng tỏ X là este của phenol.
HO/ddKOHddKOHKOH HOsinhraô(1) hôinöôc RCOOR'KOH xM 2x56 Phöôngtrìnhphanöng: RCOOR'2KOHRCOOKR'OKHO(1) mol:x2x x 2x.56 m mm 2x.56848x 11,666% m 18x m848x18x86,6 BTKL:mm
CTPTcuaZlaCHO(M172)
Zco motchöcOH
1chöceste XlaR'(OH)R'42(CH) Zco1chöcaxit R24(CC)YlaR(COOH)vamotchöcOH
HOOCCCCOOC
DẠYKÈMQUYNHƠN OFFICIAL 4 o 2 23 2 23 2 2 2 ? 4,84gam Ot 23 22 (2) 0,24mol1,8gam ?gam 0,04mol NaOHNaCO 2muoiCONaCOHO(2)O ANa Sôñophanöng: HO EsteANaOH 2muoiZNaCOCOHO Alaestecuaphenol. n2n0,08 mmmmm7,32 mm 2 2 2 2 23 2 2 OHmuoi HO(1) HO(1) H/ANaOHHO(1)HO(2) H/A C/ANaCOCO CHO ACH 752n O/A NaOHHO(1) 752n m18n n0,04 nn2n2n n0,2 nnn0,28n:n:n7:5:2 mmm Ala(CHO) n 0,08 16 n2;Aln:n2 Ala(CHO) 65 65 65 aCHOOCCOOCH 0,04.116%CHONa 63,39% 7,32 Câu 10: 2 2 2 2 2 2 2 2 ZO COHO 2,76 CO 0,1053211x6x OtrongZO COHO HO OtrongZ 0,10511x/446x/18 ? CHO 353 mmmm x0,36;n0,09 n2n2nnn0,12;n0,09 n:n:n0,09:0,24:0,093:8:3ZlaCH(OH). 23 2 xy COO NaCOCORCOONa CH 4 K xy24 xy 3 235 2 COO A A nnnn0,36M200,360,241628 0,12 CH:0,24mol M20Kgom CHlaCHCH:0,12mol Ala(CHCOO)CHOOCCHCH n n30,12;m2300,1227,6gam28gam Câu 11: (1)
DẠYKÈMQUYNHƠN OFFICIAL 5 KOH n2n1 0,24mol 2m2m E E OHancolKOH ancolgocancolatHtrongOH XlaRCOOCH Xlaesteñônchöc
Ylaestehaichöc
nn0,24;mmm 8 2 o RCOOKEKOHancol RCOOK 2 3 O quyñoi 2 224 t 2 2 E ,480,248,72gam.
mmmm25,92M
CHCCOOCH:xmol CO:(4x8yz)mol E (CHCCOO)CH:ymol
CH:zmol m84x166 2 2 2 2 KOH CHY COHO 2 248 y14z21,2x0,16CHnamtrongY nx2y0,24 y0,04n:n2 z0,08nn2x5y0,52 Canthem2nhomCHvaoYYla(CHCCOO)CHYco10H Câu 12: 2 X 3 2 2 Y 0,11 0,11 2 O quyñoi 32 2 NhieukhanangXlaaxitno,haichöc;Zlaancolno,ñônchöc. n0,11:20,055 COOHKHCOCOHOCOOK n0,20,0550,145 (COOH):0,055 X,Y (COOCH):0,145 CH:x o 2 2 2 ,t 2 2 CO HO HO CO:(0,69x)mol HO:(0,49x)mol n0,69x0,69x0n0,49m8,82gam Câu 13: 2 2 2 ROH HO KOH R'OH R'OHHOH R'OH n 25 ? 1,12 RCOORROH RCOORROH quyñoi m28(10028)%20,16gam1,12mol E:RCOOR' Xgomn0,14 m5,52gam nn2n1,24n0,12;M46(CHOH) nn0,12 nn KOH:0,02:m Y o 2 22 2 23 O,t 2 2 2 (CO,HO) CHHCOOK 25 25E KCO:0,07mol ol HCOOK:0,12mol CO:(0,05x) CH:xmol HO:(0,07x) m (0,05x).44(0,07x).1818,34x0,24n:n2 E:CHCOOCH;m0,12.10212,24gamgannhatvôi1 2gam Câu 14:
muoiduynhat
haiancolnoYla(RCOO)CH
25,92
108RlaCH 0,24
HO:(2x3yz)mol
DẠYKÈMQUYNHƠN OFFICIAL 6 Ag
o
XY
3
2
2 2
HCOOCH:0,05mol
HO CH:xmol BTE:6x80,05240,03 2 2 25CHCHCHCOOCH 3 35
2 35 chatran
Câu 15: o 2 23 3 quyñoi Z 22 2 3 2 23 3 O,t 2 22 2 2 2 23 3 CHCOOCH
2 2 23
22 2
2 2 46,6gam
CO HO E' muoi
n4x4yz0,43 n3x2yz0,32 m86x116y14z m94x160y 2 2 35 3 46 2 x0,05zx2y y0,031CHvaoestetrongE' 4z0,112CHvaoaxittrongE' 6,6 14z55,2 XlaCHCOOCH:0,05 Egom %Y46,35%gannhatvôi46,5% YlaCH(COOH):0,03 Câu 16:
3 3 25 RCHO RCHO n2n1 3 Ag m2m1 25 n CHOH:xmol HCHO 0,26 Vì2 4Fgom ;GgomCHCHO n0,08 CHOH:ymol nxy0,08 XlaCHCOOCH:0,05molx0,05 n4x2y0,26y0,03YlaCHCOOCH:0,03mol CXno,Ykho huy:
2 n2n1 25
m2m1 3
O,t 2
25 0325mol
XlaCHCOOCH:0,03ngnoloaitröônghôp nn YlaCHCOOCH:0,05
CO X,YCHCHCOOCH:0,03mol
25
40,325x0,03 n:n 1:1 XlaHCOOCH YlaCHCOOCH1CHnamtronggocaxitkhongno HCOONa:0,05 ChatrangomCHCOONa:0,03 m7,28gam NaOH:20%0,080,016
M32 E E'gomCH(COOH) ZlaCHOH CH CHCOOCH:xmol CO:(4x4yz)mol TN1:CH(COOH):ymol HO:(3x2yz)mol CH:zmol CHCOOCH:kxmol TN2:C
NaOH
22 2
55,2gam
CHCOONa:kxmol H(COOH):kymol CH(COONa):kymol CH:kzmol CH:kzmol
m6,6ga Zla(CHCHCOO)CH:0,01mol
DẠYKÈMQUYNHƠN OFFICIAL 7 o 2 3
quyñoi 2 2
2 2 224
2 (C
Ñetìmx,y,ztaconhöngcachsau:
22 2 2 2 2 2 22 2 2 2 2 O,HO) HpövôiE hchcCOHO COHO
CO HO
H 44.(2x11yz)18.(2x7yz)19,74y0,01
m
n n 2 2
3 2 X 2 224
m
2 2 2 2 quyñoi 2 2 2 2 honhôp Brpö 2 HO
n 2 2 2 NaOH 2 2 07
Nhanxet:tynenkhongtheghepCHvaoaxit,cungkhongtheghepCH
2 2 NaOH Na 35 35 2 2 bìnhtangancolCHH/OHbòtachra 09mol CH:0,04mol CHOH:0,135mol CHONa:0,135mol 0,3molE CH:0,06mol CH:0,06mol mmmm 8,535gannhatvôigiatrò8,5gam Câu 18:
O,t
0,335mol
19,74gam
HCOOCH:xmol CO:(2x11yz) CHCHCOOH:ymol E HO:(2x7yz) (CHCHCOO)CHymol CH:zmol
Cach1: m
(COHO)
HpövôiE
BTE:8x46y6z0,335.4 x0,11 n 3y0,03 z0 Cach2: (k1)nnny3ynn
44n18n19,74
CO pövôiE HO
y0,01 n0,33 3y0,03n0,29 BTO:2x6y0,33520,3320,29x0,11 BTChoacH:z0 XlaHCOOCH:0,11mol EgomYlaCHCHCOOH:0,01mol
Câu 17:
CHCHCHOH:xmol (COOH):ymol E (COOCHCHCH):zmol CH:tmol m 58x90y170z14t17,12x0, n x2z0,09 16x2y34z6t40,485BTEchoEO 3xy5zt0,42
y0,12 z0,01 t0,04
vaogocaxittrongestevìtrongEchæcomotaxit.VayCHnamtrongancol. CHCHCHOH:0, (xyz)0,2molE
6a3b1,02 b0,1 26,72gamX0,3
DẠYKÈMQUYNHƠN OFFICIAL 8 2 3 32
3
chatran
Câu
33 NaOH AgNO/NH
A:HCOOH
B:HCOOR'
A,BddYchæchöa2muoi A:R'OH
Y Ag
B:HCOOR'
%NatrongHCOONa18,93% R'77(CH
%NatrongR'ONa
65 65 23 5 65 HCOONaAg HCOONa 65 CHONa HCOONaCHONaNaCO 65 ) R'COONaCHONa 2nn0,15 n0,075A:HCOOCH
B:CHOH
Câu
2 2 2 HO CO n2n 2 COOH OH H
23,360,1320,12512 xy 0,1 nx x0,03 16 ny 20,784 y xy2n 0,07 22.4 n2n2 2 CH(OH) R(COOH) 48 2 2 XY 0,04 n 0,02m:soCtrongR n4 n 0,0150,02n0,015.(m2)0,125m1 YlaCH(OH):co6ñongphanZco9ñongphan XlaHOOCCHCOOH *Xkhongthelañônchöcvìkhiñonn:trai vôigiathiet Câu
COBaCOBa(HCO) 2 3 242 2
242 2 353 nn2n 0,52(0,760,5)1,02 CHC(CH)COOH:xmol (CH)(COOH):xmol CHCOOH:xmol X(CH)(COOH):amol146a92b26,72a0,12 CH(OH):bmol
242 2
(CH)(COOK):0,12molmolKOHchatran KOHdö:0,06 m30gamgannhatvôi30,1gam
19:
6
HCOONa ;Ygom
R'ONa
HCOONa
;Ygom
R'ONa
23
19,83% R'39
n0,125nn2n0,2
m2(0,0751220,0594)27,7gam
20:
XcomachCkhongphannhanh,suyraXcotoiñahaichöc n0,13n0,125Ylaancolno,haichöc:CH(OH).
21:
DẠYKÈMQUYNHƠN OFFICIAL 9 2
Sôñophanöng:
chatX
23 2 2 23 2 2 2 NaOHNaCO XZHOddNaOH HO(1)XNaOHZ CtrongXNaCOCO
HtrongXHO(1)HO(2)NaOH 0,45 0,15 0,825 OtrongX n2n0,45mmmm29,1 ;mmmm2,7nnn1,5 n2n2nn1,5 29,11,5121,5 n 10104 24 trongXtrongX trongX 10104 NaOHCHO HSO T 642 2axit 1,5CH 10; 0,15 O0,64;XlaCHO 0,6 0,15 16 1estecuaancol Xco2chöceste n:n3:1 1cuaphenol Z RCOOHT(M126) HCOOCHCHOOCC Xla 3 3 642 642 H CHCOOCHCHOOCH ZlaHOCHCHOHZco8nguyentöH CÂU CHUYỆN VỀ CÂY BÚT CHÌ lam bayhôi o 2 Ot (2) 24 (3)HSOloang,dö
ddNaOH 22 2 2 180g(1) 1,275mol0,825mol 015mol 0,225mol 44,4gam T 2axit
HO:164,7gam
ddY NaCOCOHO chatranZ RCOOHT(C,H,O;M126)
29,1 44,40,4540
Khi ra đời, một cây bút chì luôn thắc mắc không biết cuộc sống bên ngoài xưởng làm bút chì sẽ ra sao bởi thỉnh thoảng nó nghe những người thợ làm bút chì nói chuyện với nhau. Bút chì băn khoăn mãi, anh em của nó cũng không biết gì hơn. Cuối cùng, trước hôm được mang đến các cửa hàng, bút chì mạnh dạn hỏi người thợ làm bút rằng nó và anh em của nó sẽ ra sao ở bên ngoài cuộc sống rộng lớn kia.
Người thợ làm bút mỉm cười. Ông nói:
Có 5 điều con và các anh em của con nên nhớ khi bắt đầu cuộc sống. Nếu con nhớ và làm được thì con sẽ trở thành cây bút chì tốt nhất.
Thứ nhất: Con có thể làm được những điều kỳ diệu nhất nếu con nằm trong bàn tay một người nào đó và giúp họ làm việc.
Thứ hai: Con sẽ cảm thấy đau đớn mỗi khi bị gọt, nhưng phải trải qua như thế con mới trở nên tốt hơn và có thể tiếp tục cuộc sống của mình.
Thứ ba: Nếu con viết sai một lỗi, con hãy nhớ sửa lại.
Thứ tư: Điều quan trọng nhất đối với con và những người dùng con không phải là nước sơn bên ngoài con mà là những gì bên trong con đấy.
Và cuối cùng, trong bất cứ trường hợp nào, con cũng phải tiếp tục viết.
Đó là cuộc sống của con. Cho dù con gặp tình huống khó khăn như thế nào cũng vẫn phải viết thật rõ ràng, viết để để lại những dấu ấn của mình.
(SƯU TẦM)
(SƯU TẦM)
DẠYKÈMQUYNHƠN
10
OFFICIAL
HỆ THỐNG BÀI TẬP TỔNG HỢP KIẾN THỨC HÓA HỮU CƠ Ở CẤP ĐỘ VẬN DỤNG CAO
Câu 1: Hỗn hợp X gồm hai chất hữu cơ no, mạch hở (đều chứa C, H, O), trong phân tử mỗi chất có hai nhóm chức trong số các nhóm -OH, -CHO, -COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 4,05 gam Ag và 1,86 gam một muối amoni hữu cơ. Cho toàn bộ lượng muối amoni hữu cơ này vào dung dịch NaOH (dư, đun nóng), thu được 0,02 mol NH3. Giá trị của m là
A. 1,24. B. 2,98. C. 1,22. D. 1,50. Câu 2: Hỗn hợp X gồm (CH3COO)3C3H5, CH3COOCH2CH(OOCCH3)CH2OH, CH3COOH, CH3COOCH2CHOHCH2OH và CH2OHCHOHCH2OH trong đó CH3COOH chiếm 10% tổng số mol hỗn hợp. Đun nóng m gam hỗn hợp X với dung dịch NaOH vừa đủ, thu được dung dịch chứa 20,5 gam natri axetat và 0,604m gam glixerol. Để đốt cháy m gam hỗn hợp X cần V lít O2 (đktc). Giá trị của V gần nhất là
A. 25,3. B. 24,6. C. 24,9. D. 25,5. Câu 3: Đốt cháy 0,15 mol hỗn hợp X gồm metyl acrylat, etylen glicol, axetanđehit và ancol metylic cần dùng a mol O2 Sản phẩm cháy dẫn qua 200 ml dung dịch Ba(OH)2 1M, lọc bỏ kết tủa, cho dung dịch Ca(OH)2 dư vào phần nước lọc thì thu được thêm 53,46 gam kết tủa nữa. Giá trị của a là bao nhiêu?
OFFICIAL
A. 0,215. B. 0,625. C. 0,455. D. 0,375. Câu 4: Cho hỗn hợp X gồm 1 este no, đơn chức Y và 1 ancol đơn chức Z tác dụng vừa đủ với 200 ml dung dịch NaOH 1M, thu được 0,35 mol ancol Z. Cho Z tách nước ở điều kiện thích hợp thu được chất hữu cơ T có tỉ khối hơi so với Z là 1,7. Mặt khác, đốt cháy hoàn toàn X cần dùng 44,24 lít O2 (đktc). Công thức phân tử của axit tạo Y là
A. C5H10O2 B. C4H8O2 C. C3H6O2 D. C2H4O2 Câu 5: Hỗn hợp X gồm C2H5OH, HCHO, CH3COOH, HCOOCH3, CH3COOC2H3, CH2OHCH(OH)CHO và CH3CH(OH)COOH. Đốt cháy hoàn toàn 13,8 gam X cần dung vừa đủ 12,04 lít O2 (đktc), thu được CO2 và 9 gam H2O. Thành phần phần trăm theo khối lượng của CH3COOC2H3 trong X là A. 15,58%. B. 12,46%. C. 31,16%. D. 24,92%. Câu 6: Ba chất hữu cơ bền X, Y, Z chứa C, H, O có phân tử khối lập thành một cấp số cộng. Khi đốt cháy một lượng với tỉ lệ bất kỳ của X, Y, Z đều thu được khối lượng CO2 gấp 44/9 lần khối lượng H2O. X và Y tác dụng với Na với tỉ lệ mol tương ứng là 1:1 và 1:2. Cho 0,12 mol hỗn hợp cùng số mol của X, Y, Z tác dụng với lượng dư dung dịch AgNO3 trong NH3, sau các phản ứng hoàn toàn đều tạo ra một sản phẩm hữu cơ duy nhất T trong dung dịch. Khối lượng của T có thể là A. 18,44 gam. B. 14,88 gam. C. 16,66 gam. D. 8,76 gam. Câu 7: Hỗn hợp A gồm một axit đơn chức, một ancol đơn chức và 1 este đơn chức (các chất trong A đều có nhiều hơn 1C trong phân tử). Đốt cháy hoàn toàn m gam A rồi hấp thụ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư thấy có 135 gam kết tủa xuất hiện, đồng thời khối lượng dung dịch giảm 58,5 gam. Biết số mol ancol trong m gam A là 0,15. Cho Na dư vào m gam A thấy có 2,8 lít khí (đktc) thoát ra. Mặt khác m gam A tác dụng vừa đủ dung dịch chứa 12 gam NaOH. Cho m gam A vào dung dịch nước brom dư. Phần trăm khối lượng của axit trong A là A. 47,84%. B. 28,9%. C. 23,25%. D. 24,58%. Câu 8: Cho X,
thuộc dãy đồng đẳng của axit acrylic và MX < MY; Z là ancol có cùng số nguyên tử cacbon với X (MZ < 100); T là hợp chất chứa hai chức este tạo bởi X, Y và Z. Đốt cháy hoàn toàn 64,6 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 59,92 lít khí O2 (đktc), thu được khí CO2 và 46,8 gam nước. Mặt khác, 64,6 gam E tác dụng tối đa với dung dịch chứa 0,2 mol Br2 Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với KOH dư là
A. 21,6 gam. B. 23,4 gam. C. 32,2 gam. D. 25,2 gam. Câu 9: X, Y là 2 axit cacboxylic đều mạch hở; Z là ancol no; T là este hai chức, mạch hở được tạo bởi X, Y, Z. Đun nóng 37,36 gam hỗn hợp E chứa X, Y, Z, T với 400 ml dung dịch NaOH 1M (vừa đủ), thu được ancol Z và hỗn hợp F gồm 2 muối có tỉ lệ mol 1 : 1. Dẫn toàn bộ Z qua bình đựng Na dư thấy khối lượng bình tăng 19,24 gam; đồng thời thu được 5,824 lít khí H2 (đktc). Đốt cháy hoàn toàn F cần dùng 0,5 mol O2, thu được CO2, Na2CO3 và 0,4 mol H2O. Phần trăm khối lượng của T trong hỗn hợp E là A. 39,08%. B. 48,56%. C. 56,56%. D. 40,47%.
DẠYKÈMQUYNHƠN
1
Y là hai chất
Câu 10: X, Y là 2 axit cacboxylic đều mạch hở; Z là ancol no; T là este hai chức, mạch hở được tạo bởi X, Y, Z. Đun nóng 38,86 gam hỗn hợp E chứa X, Y, Z, T với 400 ml dung dịch NaOH 1M (vừa đủ), thu được ancol Z và hỗn hợp F gồm 2 muối có tỉ lệ mol 1 : 1. Dẫn toàn bộ Z qua bình đựng Na dư thấy khối lượng bình tăng 19,24 gam; đồng thời thu được 5,824 lít khí H2 (đktc). Đốt cháy hoàn toàn F cần dùng 0,7 mol O2, thu được CO2, Na2CO3 và 0,4 mol H2O. Phần trăm khối lượng của T trong hỗn hợp E là
A. 8,88%. B. 26,40%. C. 13,90%. D. 50,82%. Câu 11: T là hỗn hợp chứa hai axit đơn chức, một ancol no hai chức và một este hai chức tạo bởi các axit và ancol trên (tất cả đều mạch hở). Đốt cháy hoàn toàn 24,16 gam T thu được 0,94 mol CO2 và 0,68 mol H2O. Mặt khác, cho lượng T trên vào dung dịch AgNO3/NH3 dư thấy có 0,32 mol Ag xuất hiện. Biết tổng số mol các chất có trong 24,16 gam T là 0,26 mol. Phần trăm khối lượng của axit có khối lượng phân tử lớn hơn trong T là A. 23,84%. B. 5,13%. C. 11,42%. D. 59,61%. Câu 12: X là amino axit có công thức H2NCnH2nCOOH, Y là axit cacboxylic no, đơn chức, mạch hở. Cho hỗn hợp E gồm peptit Ala-X-X và Y tác dụng vừa đủ với 450 ml dung dịch NaOH 1M, thu được m gam muối Z. Đốt cháy hoàn toàn Z cần 25,2 lít khí O2 (đktc), thu được N2, Na2CO3 và 50,75 gam hỗn hợp gồm CO2 và H2O. Khối lượng của muối có phân tử khối nhỏ nhất trong Z là A. 14,55 gam. B. 12,30 gam. C. 26,10 gam. D. 29,10 gam. Câu 13: Hỗn hợp E gồm X, Y và Z là 3 peptit đều mạch hở (MX > MY > MZ). Đốt cháy 0,16 mol X hoặc Y hoặc Z đều thu được số mol CO2 lớn hơn số mol H2O là 0,16 mol. Nếu đun nóng 69,8 gam hỗn hợp chứa X, Y và 0,16 mol Z với dung dịch NaOH vừa đủ thu được dung dịch chứa 101,04 gam hai muối của alanin và valin. Biết nX < nY. Phần trăm khối lượng của X trong E gần nhất với A. 12%. B. 95%. C. 54%. D. 10%. Câu 14: Hỗn hợp E gồm 3 chất: X (là este của amino axit); Y và Z là hai peptit mạch hở, hơn kém nhau một nguyên tử nitơ (đều chứa ít nhất hai loại gốc amino axit, MY < MZ). Cho 36 gam E tác dụng vừa đủ với 0,44 mol NaOH, thu được 7,36 gam ancol no, đơn chức, mạch hở và 45,34 gam ba muối của glyxin, alanin, valin (trong đó có 0,1 mol muối của alanin). Mặt khác, đốt cháy hoàn toàn 36 gam E trong O2 dư, thu được CO2, N2 và 1,38 mol H2O. Phần trăm khối lượng của Y trong E là A. 18,39%. B. 20,72%. C. 27,58%. D. 43,33%.
OFFICIAL
DẠYKÈMQUYNHƠN
2
NGƯỜI HẠNH PHÚC NHẤT
KHÔNG PHẢI LÀ NGƯỜI CÓ NHỮNG THỨ TỐT NHẤT
Một nhóm sinh viên giờ đã thành đạt trong công việc cùng nhau về thăm thầy giáo cũ. Cuộc nói chuyện nhanh chóng được chuyển sang những vấn đề trong cuộc sống và công việc… Muốn mời những học trò cũ uống cà phê, ông giáo vào bếp và quay lại với rất nhiều cà phê đựng trong những chiếc cốc khác nhau: cái bằng sứ, cái bằng nhựa, cái bằng thủy tinh, cái bằng pha lê, một số trông rất đơn giản, số khác lại có vẻ đắt tiền, vài cái được chế tác rất tinh xảo… Khi tất cả mọi người đều đã cầm cốc cà phê trong tay, ông giáo nhẹ nhàng lên tiếng: “Không biết các trò có chú ý không, nhưng những chiếc cốc trông đẹp đẽ, đắt tiền luôn được lựa chọn trước, để lại những cái trông đơn giản và rẻ tiền.
Mặc dù rất đơn giản và dễ hiểu khi các trò muồn điều tốt đẹp nhất cho bản thân nhưng đó cũng là nguồn gốc, nguyên nhân của mọi vấn đề căng thẳng của các trò.
Một điều chắc chắn rằng cái cốc không phải là thứ quyết định chất lượng của cà phê đựng bên trong. Một số trường hợp, nó chỉ đơn giản là cái vỏ đắt tiền hơn và một số khác thậm chí che giấu cái mà nó đang chứa đựng.
Điều các trò thực sự muốn là cà phê chứ không phải cái cốc, nhưng các trò vẫn có ý thức lựa chọn cái cốc tốt nhất. Sau đó các trò mới để mắt đến những cái cốc khác.
Cũng như vậy, cuộc sống của chúng ta là cà phê, công việc, tiền bạc và vị trí xã hội là những cái cốc. Chúng chẳng qua chỉ bao bọc lấy cuộc sống. Và loại cốc mà trò có không làm nên cũng như không thay đổi cuộc đời mà trò đang sống…”.
Đôi khi, chúng ta chỉ quan tâm đến cốc mà quên thưởng thức thứ cà phê ông trời đã ban tặng cho chúng ta. Người hạnh phúc nhất không phải là người có những thứ tốt nhất mà là người biết biến những thứ mình đang có thành thứ tốt nhất.
(SƯU TẦM)
DẠYKÈMQUYNHƠN
3
OFFICIAL
HỆ THỐNG BÀI TẬP TỔNG HỢP KIẾN THỨC HÓA HỮU CƠ Ở CẤP ĐỘ VẬN DỤNG CAO
Câu 1: Hỗn hợp X gồm hai chất hữu cơ no, mạch hở (đều chứa C, H, O), trong phân tử mỗi chất có hai nhóm chức trong số các nhóm -OH, -CHO, -COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 4,05 gam Ag và 1,86 gam một muối amoni hữu cơ. Cho toàn bộ lượng muối amoni hữu cơ này vào dung dịch NaOH (dư, đun nóng), thu được 0,02 mol NH3. Giá trị của m là
A. 1,24. B. 2,98. C. 1,22. D. 1,50. Câu 2: Hỗn hợp X gồm (CH3COO)3C3H5, CH3COOCH2CH(OOCCH3)CH2OH, CH3COOH, CH3COOCH2CHOHCH2OH và CH2OHCHOHCH2OH trong đó CH3COOH chiếm 10% tổng số mol hỗn hợp. Đun nóng m gam hỗn hợp X với dung dịch NaOH vừa đủ, thu được dung dịch chứa 20,5 gam natri axetat và 0,604m gam glixerol. Để đốt cháy m gam hỗn hợp X cần V lít O2 (đktc). Giá trị của V gần nhất là
A. 25,3. B. 24,6. C. 24,9. D. 25,5. Câu 3: Đốt cháy 0,15 mol hỗn hợp X gồm metyl acrylat, etylen glicol, axetanđehit và ancol metylic cần dùng a mol O2 Sản phẩm cháy dẫn qua 200 ml dung dịch Ba(OH)2 1M, lọc bỏ kết tủa, cho dung dịch Ca(OH)2 dư vào phần nước lọc thì thu được thêm 53,46 gam kết tủa nữa. Giá trị của a là bao nhiêu?
OFFICIAL
A. 0,215. B. 0,625. C. 0,455. D. 0,375. Câu 4: Cho hỗn hợp X gồm 1 este no, đơn chức Y và 1 ancol đơn chức Z tác dụng vừa đủ với 200 ml dung dịch NaOH 1M, thu được 0,35 mol ancol Z. Cho Z tách nước ở điều kiện thích hợp thu được chất hữu cơ T có tỉ khối hơi so với Z là 1,7. Mặt khác, đốt cháy hoàn toàn X cần dùng 44,24 lít O2 (đktc). Công thức phân tử của axit tạo Y là
A. C5H10O2 B. C4H8O2 C. C3H6O2 D. C2H4O2 Câu 5: Hỗn hợp X gồm C2H5OH, HCHO, CH3COOH, HCOOCH3, CH3COOC2H3, CH2OHCH(OH)CHO và CH3CH(OH)COOH. Đốt cháy hoàn toàn 13,8 gam X cần dung vừa đủ 12,04 lít O2 (đktc), thu được CO2 và 9 gam H2O. Thành phần phần trăm theo khối lượng của CH3COOC2H3 trong X là A. 15,58%. B. 12,46%. C. 31,16%. D. 24,92%. Câu 6: Ba chất hữu cơ bền X, Y, Z chứa C, H, O có phân tử khối lập thành một cấp số cộng. Khi đốt cháy một lượng với tỉ lệ bất kỳ của X, Y, Z đều thu được khối lượng CO2 gấp 44/9 lần khối lượng H2O. X và Y tác dụng với Na với tỉ lệ mol tương ứng là 1:1 và 1:2. Cho 0,12 mol hỗn hợp cùng số mol của X, Y, Z tác dụng với lượng dư dung dịch AgNO3 trong NH3, sau các phản ứng hoàn toàn đều tạo ra một sản phẩm hữu cơ duy nhất T trong dung dịch. Khối lượng của T có thể là A. 18,44 gam. B. 14,88 gam. C. 16,66 gam. D. 8,76 gam. Câu 7: Hỗn hợp A gồm một axit đơn chức, một ancol đơn chức và 1 este đơn chức (các chất trong A đều có nhiều hơn 1C trong phân tử). Đốt cháy hoàn toàn m gam A rồi hấp thụ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư thấy có 135 gam kết tủa xuất hiện, đồng thời khối lượng dung dịch giảm 58,5 gam. Biết số mol ancol trong m gam A là 0,15. Cho Na dư vào m gam A thấy có 2,8 lít khí (đktc) thoát ra. Mặt khác m gam A tác dụng vừa đủ dung dịch chứa 12 gam NaOH. Cho m gam A vào dung dịch nước brom dư. Phần trăm khối lượng của axit trong A là A. 47,84%. B. 28,9%. C. 23,25%. D. 24,58%. Câu 8: Cho X,
thuộc dãy đồng đẳng của axit acrylic và MX < MY; Z là ancol có cùng số nguyên tử cacbon với X (MZ < 100); T là hợp chất chứa hai chức este tạo bởi X, Y và Z. Đốt cháy hoàn toàn 64,6 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 59,92 lít khí O2 (đktc), thu được khí CO2 và 46,8 gam nước. Mặt khác, 64,6 gam E tác dụng tối đa với dung dịch chứa 0,2 mol Br2 Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với KOH dư là
A. 21,6 gam. B. 23,4 gam. C. 32,2 gam. D. 25,2 gam. Câu 9: X, Y là 2 axit cacboxylic đều mạch hở; Z là ancol no; T là este hai chức, mạch hở được tạo bởi X, Y, Z. Đun nóng 37,36 gam hỗn hợp E chứa X, Y, Z, T với 400 ml dung dịch NaOH 1M (vừa đủ), thu được ancol Z và hỗn hợp F gồm 2 muối có tỉ lệ mol 1 : 1. Dẫn toàn bộ Z qua bình đựng Na dư thấy khối lượng bình tăng 19,24 gam; đồng thời thu được 5,824 lít khí H2 (đktc). Đốt cháy hoàn toàn F cần dùng 0,5 mol O2, thu được CO2, Na2CO3 và 0,4 mol H2O. Phần trăm khối lượng của T trong hỗn hợp E là A. 39,08%. B. 48,56%. C. 56,56%. D. 40,47%.
DẠYKÈMQUYNHƠN
1
Y là hai chất
Câu 10: X, Y là 2 axit cacboxylic đều mạch hở; Z là ancol no; T là este hai chức, mạch hở được tạo bởi X, Y, Z. Đun nóng 38,86 gam hỗn hợp E chứa X, Y, Z, T với 400 ml dung dịch NaOH 1M (vừa đủ), thu được ancol Z và hỗn hợp F gồm 2 muối có tỉ lệ mol 1 : 1. Dẫn toàn bộ Z qua bình đựng Na dư thấy khối lượng bình tăng 19,24 gam; đồng thời thu được 5,824 lít khí H2 (đktc). Đốt cháy hoàn toàn F cần dùng 0,7 mol O2, thu được CO2, Na2CO3 và 0,4 mol H2O. Phần trăm khối lượng của T trong hỗn hợp E là
A. 8,88%. B. 26,40%. C. 13,90%. D. 50,82%. Câu 11: T là hỗn hợp chứa hai axit đơn chức, một ancol no hai chức và một este hai chức tạo bởi các axit và ancol trên (tất cả đều mạch hở). Đốt cháy hoàn toàn 24,16 gam T thu được 0,94 mol CO2 và 0,68 mol H2O. Mặt khác, cho lượng T trên vào dung dịch AgNO3/NH3 dư thấy có 0,32 mol Ag xuất hiện. Biết tổng số mol các chất có trong 24,16 gam T là 0,26 mol. Phần trăm khối lượng của axit có khối lượng phân tử lớn hơn trong T là A. 23,84%. B. 5,13%. C. 11,42%. D. 59,61%. Câu 12: X là amino axit có công thức H2NCnH2nCOOH, Y là axit cacboxylic no, đơn chức, mạch hở. Cho hỗn hợp E gồm peptit Ala-X-X và Y tác d
OFFICIAL
c số mol CO2 lớn hơn số mol H2O là 0,16 mol. Nếu đun nóng 69,8 gam hỗn hợp chứa X, Y và 0,16 mol Z với dung dịch NaOH vừa đủ thu được dung dịch chứa 101,04 gam hai muối của alanin và valin. Biết nX < nY. Phần trăm khối lượng của X trong E gần nhất với A. 12%. B. 95%. C. 54%. D. 10%. Câu 14: Hỗn hợp E gồm 3 chất: X (là este của amino axit); Y và Z là hai peptit mạch hở, hơn kém nhau một nguyên tử nitơ (đều chứa ít nhất hai loại gốc amino axit, MY < MZ). Cho 36 gam E tác dụng vừa đủ với 0,44 mol NaOH, thu được 7,36 gam ancol no, đơn chức, mạch hở và 45,34 gam ba muối của glyxin, alanin, valin (trong đó có 0,1 mol muối của alanin). Mặt khác, đốt cháy hoàn toàn 36 gam E trong O2 dư, thu được CO2, N2 và 1,38 mol H2O. Phần trăm khối lượng của Y trong E là A. 18,39%. B. 20,72%. C. 27,58%. D. 43,33%.
DẠYKÈMQUYNHƠN
2
hoàn toàn Z cần 25,2 lít khí O2 (đktc), thu được N2, Na2CO3 và 50,75 gam hỗn hợp gồm CO2 và H2O. Khối lượng của muối có phân tử khối nhỏ nhất trong Z là A. 14,55 gam. B. 12,30 gam. C. 26,10 gam. D. 29,10 gam. Câu 13: Hỗn hợp E gồm X, Y và Z là 3 peptit đều mạch hở (MX > MY > MZ). Đốt cháy 0,16 mol X hoặc Y hoặc Z đều thu đượ
CUỘC SỐNG KHÔNG TỆ NHƯ BẠN NGHĨ
ụng vừa đủ với 450 ml dung dịch NaOH 1M, thu được m gam muối Z. Đốt cháy
Xưa có một người đàn ông nghèo sống cùng vợ, năm đứa con trai và con dâu trong một gian nhà gỗ chật hẹp, vừa ẩm thấp vừa cũ kỹ. Cuộc sống thiếu thốn trăm bề khiến ông chán nản. Một hôm, ông quyết định đi tìm nhà hiền triết để mong giúp đỡ.
Ông nói với nhà hiền triết: – Cả nhà chúng tôi đông người mà phải sống chung trong một gian nhà gỗ nhỏ bé, rất chật chội, cả ngày cãi vã không đứt. Cuộc sống như thế khác nào địa ngục. Tôi thật không còn muốn sống tiếp nữa!
Nhà hiền triết hỏi trong nhà ông có những gì. Ông ta đáp, nhà mình chỉ có một con bò, con dê núi và đàn gà.
Nhà hiền triết liền bảo:
– Ông chỉ cần làm theo cách của tôi, mọi thứ sẽ ổn thỏa cả thôi.
Thì ra nhà hiền triết bảo ông ta về nhà rồi cho bò, đê và đàn gà vào sống chung. Có như thế ông ta mới thoát khỏi hoàn cảnh khó khăn. Người đàn ông nghe xong rất ngạc nhiên, nhưng ông vẫn đồng ý làm theo.
Chỉ vài hôm sau, người đàn ông này lại chạy đến tìm nhà hiền triết và khổ sở than rằng:
– Ông bày cho tôi cách quỷ quái gì vậy? Mọi chuyện không những không tốt lên mà chỉ thảm hại hơn thôi. Bây giờ nhà tôi thực sự biến thành địa ngục rồi. Tôi thật không muốn sống nữa. Nhà hiền triết cười nói với ông ta:
– Được rồi, thế ông về nhà không cho gà ở chung nữa là được thôi. Không lâu sau, người đàn ông này lại đến tìm nhà hiền triết. Vẫn mang bộ mặt buồn thảm đó, ông ta vừa khóc vừa kể:
- Con dê núi nhai hết mọi thứ trong nhà, làm cho cuộc sống của tôi trở thành ác mộng. Nhà hiền triết nhẹ nhàng nói:
– Cho dê ra ngoài là được. Sau đó, ông ta lại đến kêu ca với nhà hiền triết:
– Con bò biến nhà tôi thành cái chuồng bò rồi. Người làm sao sống chung với súc vật được chứ? Nhà hiền triết khuyên:
– Thế ông mau về nhà và cho con bò ra ngoài ở đi. Ít hôm sau, ông nhà nghèo lại chạy đến, lần này với vẻ mặt tươi tỉnh. Ông nói với nhà hiền triết: – Cám ơn ông đã giúp tôi tìm thấy cuộc sống ngọt ngào. Bây giờ, tất cả gia súc đều ra ngoài ở, căn nhà nhỏ bé của tôi trở nên yên tĩnh, rộng rãi và sạch sẽ rồi. Tôi vui lắm!
Hoàn cảnh có thể không được như ý bạn muốn và nhìn bề ngoài thì có vẻ rất tồi tệ. Nhưng cuộc sống còn nhiều thứ kinh khủng hơn thế.
Cho nên bạn đừng quá thất vọng hay sầu não dù có bất cứ điều gì xảy ra.
Hãy lạc quan lên, bạn sẽ thấy cuộc đời thật đẹp!
(SƯU TẦM)
DẠYKÈMQUYNHƠN
3
OFFICIAL
DẠYKÈMQUYNHƠN OFFICIAL 1 ĐÁP
3 3
3 3 353 3
35 3 3x x
3 CH(OH) CHCOOH
2 2 32x82x3x 2 CHO O O O(ñktc)
o 2 2 xyzt 2 xyzt xyzt 00000 42120 t y 2 x zt2 2 2 electronOnhanO CHON O electronCHONnhöông CHON Löuy:CHONOCOHON n 4n (4xy2z)n4n n (4xy2z)n Câu 3: 2 2 2 3462422 2 2 262222 x22 3 242222 3 4 22 3 O 2 x22 2 Ca(OH) 3 32 3 CHCHCOOCHCHOCH2HO CHOHCHOHCHOCH.2HO Xgom X:CHyHO CHCHOCHOCH.HO CHOHCHOCHHO BaCO:xmol CO CHyHOHO BaCO:ymol Ba(HCO) CaCO:ymol 2 2 2 2 CO Ba(OH) kettua XO O n0,38 nxy0,2 y0,18 0,38x0,02m100y197y53,46 x 0,15 0,381BTelectron:(4x2)n4nn .0,150,455mol 0,152 Câu 4: 33 o AgNO/NH t 2Ba(OH)
ÁN CHI TIẾT Câu 1:
NaOH 4 3 0,02mol xy
Xmuoi Ag:2ymol COOH:xmol CHO:ymol COONH NH y0,018752y0,0375 xy0,02x1,2510 mm1,861,25.10(6245)0,01875(6229)1,22gam
Câu 2:
HOHCHCOOH
NaOHCHCOONa
nnbCH(OH)(OOCCH):amol Xgom ; nn 0,25 CHCOOH:bmol BTKL:m1020,50,604m18bm27,424 m 0,604m92a b0,02x1,2783 a0,18 b0,1(ab) BTE:8n
(148x)n 4nn1,13mol V25,3162gannhatvôigiatrò25,3
DẠYKÈMQUYNHƠN OFFICIAL 2 o 24 HSOñac,t ZmôitaothanhesteYNaOH T ZcosantrongX Z 37 n2n1 37 37 37 Z(ROH) T n nn0,2 ;M n 0,350,20,15 1,7 M TlaRORR43(CH)
X: 2R161ROHlaCHOHZlaCHOH ,7 R17 o 2 t 2 22 Z YO 3 242 0,15 0,21,795 :0,15mol XOCOHO n1 BTE:18n(6n20)n4naxittaoYlaCHCOOHhayCHO Câu 5: 25 2 3 242 2 Quyñoi 3 25 2 3 23 363 3 3 23 X CHOH;HCHOCHO CHCOOH CHO CHO:xmol HCOOCH Xgom CHOH:ymol CHOHCHOHCHO CHCOOCH:zmol CHO CHCHOHCOOH CHCOOCH m30x46y86z 3 23CHCOOCH 13,8
29
Câu 6: 2 2 2 2 2 CO C HO H XYZ O COHO nnx 2 1:1 1:2 n n X,Y,ZchöaC,H,O 1 1 n0,5n1 M,M,Mlapthanhcapsocong X,Y,Zvôitælebatkym:m44:9X,Y,ZcodangCHO XlaOHCCOOH(CH XNa Matkhac: YNa... o 33 23 224 222 AgNO/NH,t 4 4 T 012mol 0,12mol O) YlaHOOCCOOH(CHO) ZlaOHCCHO(CHO) X:OHCCOOH Y:HOOCCOOH T:HNOOCCOONHm14,88 Z:OHCCHO Câu 7:
YlaCHCOOCH:0,2mol
x0,35 412,04BTE:4x12y18z y0,025%m 15,58% 22,4z0,025
BTH:2x6y6z18
DẠYKÈMQUYNHƠN OFFICIAL 3 2 3 2 3 2 2 2 2 COCaCO CO ddgiamCaCO CO HO HO 1,35 ? 135 ROHR'COOHH 0,15 ? R'COOH 0,125 R''COOR''' R'COOHR''COOR'''NaOH ? ? nn1,35 n1,35 mm44n18n58,5n0,95 nn2n n0,1 n 0,2 nn n0,3 2 2 CO A 3x A 3y2 HO A 3z2 A 322 n1,35 ancol:CHO C 3 n0,45 axit:CHO 2n0,95.2 este:CHO H 4,22 n0,45 0,15x0,1y0,2z1,9x6;y2;z4 0,1.70 %CHO 23,25% 0,15580,1700,272 Câu 8: 2 2 2 22 X Y ZX Z EOCOHO 64,659,92?103,446,8 32 362 22,4 Z 353 COHO C3,C3;CC3
mmmm Zlaancolno CH(OH)
CH(OH)
2 2 353 2 Br O quyñoi 2 353 2 2 2 E
CHCHCOOH:0,2mol(n) CO:2,35mol CH(OH):xmol E HO:2,6mol CH:ymol HO:zmol m 2 2 CO HO KOHdö 2 muoi 2 36 720,292x14y18z64,6x0,55 n0,233xy2,35 y0,1 z0,1 n0,224xyz2,6 CHCHCOOK:0,2 E muoi m23,4gam CH:0,1 NeutröônghôptrenkhongñungthìZlaCH 2 (OH)vatalamtöôngtö Câu 9:
Tögiathietsuyra:OH2
M100,Zla
n:n2,35:2,60,9031 Nhanñònh:Nhieukhanang
ZselaCH(OH)vìñenoiTlahôpchatchöa haichöcestethayvìTlaestehaichöc
DẠYKÈMQUYNHƠN OFFICIAL 4 2 NaOH
ZH Z 3
o 2 2 6 2 O,t quyñoi NaOH 36 2
2 E 37,36gam CO 23 2 2 0,4mol?mol 0,2mol
RCOOH:0,4mol
BTO:n0,4 NaCOCOHO
3 R T 36 3 36 2 3 XlaHCOOH:0,2mol
x
18
Câu 10: 2 NaOHRCOO ZH Z 3 X,Ylaaxitcacboxylicmachhô Zlaancol2chöc Zlaancolno X,YñeuñônchöcTlaestehaichöc,machhôtaobôiX,Y,Z X,YRCOOHnn0,4mol 19,240,262nn0,26molM 76ZlaC 0,26 o 2 2 6 2 O,t quyñoi NaOH 36 2 0,7mol 0,4mol 2 E 38,86gam CO 23 2 2 0,4mol?mol 0,2mol H(OH). RCOOH:0,4mol X,Y CH(OH):0,26mol RCOONa Z,T HO:xmol BTO:n0,6 NaCOCOHOBTC: R 23 R T 36 23 36 2 23 XlaHCOOH:0,2molC1 YlaCHCOOH:0,2mol H2 38,860,2460,27219,76 x 0,25n0,125mol 18 T:HCOOCHOOCCH:0,125 EZ:CH(OH):0,135 gom % X:HCOOH:0,075 Y:CHCOOH:0,075 T50,82% Câu 11:
RCOO
X,Ylaaxitcacboxylicmachhô Zlaancol2chöc Zlaancolno X,YñeuñônchöcTlaestehaichöc,machhôtaobôiX,Y,Z X,YRCOOHnn0,4mol 19,240,26.2nn0,26molM 76ZlaC 0,26
0,5mol 0,4mol
H(OH).
X,Y CH(OH):0,26mol RCOONa Z,T HO:xmol
BTC:
YlaCHCOOH:0,2molC0,5 37,360,2460,26019,76
0,2n0,1mol
T:HCOOCHOOCCH:0,1 EZ:CH(OH):0,16 gom %T39,08% X:HCOOH:0,1 Y:CHCOOH:0,1
n 0,16mol 2 (k1)nnn0,26 estecok3 k2 axitconlaicok2 n0,26 Giasöaxitconlaicok2,quyñoiTthanh: HCOOH:0,16mol CH(OH):xmol CHCHCOOH:ymol CH:zmol H
CO:(0,162x3yz) HO:(0,163x2yzt)
n0,162x3yz0,94 x0,12 n0,163x2yzt0,68 y0 n0,16xyt0,26 m0,16.4662x72y14z18t24,16
DẠYKÈMQUYNHƠN OFFICIAL 5 2 2
2 2 2 2
o 2 2 2 O,t 2 2 CO HO T T
este 24 2 24 2 23 2
HCOOCHOOCCHCH:0,1
Câu
quyñoi 2n 3 2 2m E 2 NaOH 0,45mol 2 2 CO:3xy AlaXXH(HN[CH]CO)OH:xmol
CO:3xy
2 22 O 2 2 23 1,125mol 2 1,5xz0,2253xyz0,225 0,225 Z (CO,HO) 3x COHONaCO CH:z NaOH:0,45 BTNa:3xy0,45 BTE:2(3xy)3x6z1,1254 m 44(3xyz0,225)18(1,5xz0,225)50,75 3 (Ala,X,Y) C(peptit,Y)Cpeptit Y Y 22 3 CHCOONa x0,1 z3xy n n C 2,22 3xy y0,15 C 2 n XlaHNCHCOOH(2C)z0,55 MuoicoMbenhatlaCHCOONam 0,15.8212,3gam Câu 13:
Ag HCOOhonhôpCOHO honhôp 24
n
O:tmol(t0)
,18n0,1 z0 t0,2
TCH(OH):0,02mol gom %CHCOOH23,84% HCOOH:0,160,10,06 CHCHCOOH:0,180,10,08
12:
NH:3x CH:z Y:H(CH)COOH:ymol HO:xy
CO:3xy NH:3x NH: CH:z HO:xy
DẠYKÈMQUYNHƠN OFFICIAL 6 2 2 n2n22ktxt n2n2tt1t peptitCOHO 0,16 0,16 69
HonhôpE 2 10104gam 4tmol tmol ,8gam,tmol AlaNa ValNa AlaNa AlaNaValNa ValNa XYZ E 4NaOHmuoiHO t0,22 BTKL:69,840.4t101,0418t 111n139n101,04n0,76 nn0,88 n0,12 MMM M69,8 0 4 (X,Y) 3 3 3 4 XY ValNaX Zla(Ala)(M302)
317,27M
Yla(Ala)Val(M330) TYla(Ala)Val(M330)
Y XY XY ValNaXY
Câu 14:
CongthöcchungcuahôpchathöucôlaCHON. Ñoivôipeptitthìkt,xt1nencongthöcselaCHON Taco:(0,5t1)nnnt4X,Y,Zlatetrapeptit
69,80,16302
358 ,22 0,220,16
H1: hoacTH2: Xla(Val)Ala(M386) Xla(Val)(M414) nn0,06 TH1: n4nn
x0,02;y0,04 %0,04414 X 11,86gannhatvôi12% 0,12 69,8 nn0,06 x0,03 TH2: loaivìnn. n3nn0,12y0,03
DẠYKÈMQUYNHƠN OFFICIAL 7 o 2 muoi 45,34gam
2
044mol
AlaNa:0,1
E1,38molHOn2,76mol HonhôpENaOH n2n1 2
ENaOHancolmuoi H/EH/NaOHH/ancolH/muoi H/
GlyNa:0,31
BTKL:mmmm18a
BTNTH:nnnn2a n ancol H/ancol 25 NaOH 22
NaOH
n
XlaHNCHCOOCH(M103)GlyNa:0,16mol (*)
muoitaoratöXY (XY) a5a YZ Y YZ Z
n N 5,6 n
Y:(Gly)(Ala)
32 32
KHÔNG BAO GIỜ GỤC NGÃ
O,t
HtrongE
36gam,amol
BTNTNa:xy0,10,44 x0,31 GlyNa:xm97x139y0,111145,34y0,03ValNa:y
amol 7,36gam 4534gam
2,760,44 ? 2,14
CHOHAlaNa:0,1(*)HO ValNa:0,03
a0,05
25 0,16mol
0,96 7,36(2n2)
0,96n2ancollaCHOH(0,16mol)(**)14n18
GlyNa:0,15mol (**)Y,Z AlaNa:0,1mol ValNa:0,0
b5b
3mol
nn0,05n0,02Ylapentapeptit Zlahexapeptit5n6n0,28n0,03Z:(Gly)(Ala)Val a3 0,02a0,03b0,15 b3
Yla(Gly)(Ala)(M331)%0,02331 Y 18,38% 36 Zla(Gly)(Ala)Val(M430)
Nhiều năm về trước, khi khai quật một ngôi mộ cổ Ai Cập, một nhà khảo cổ đã tìm thấy những hạt giống vùi trong một miếng gỗ. Khi được trồng trở lại, những hạt giống ấy đã nảy mầm, bộc lộ sức sống tiềm tàng sau hơn 3.000 năm bị chôn vùi. Phải chăng điều kiện sống của con người chúng ta quá chán nản, quá dễ thất bại mà chúng ta – vì không nhận ra được những tiềm năng vốn có của mình – đã cam chịu sống trong những thất bại và tuyệt vọng câm nín? Hay trong chúng ta cũng có những hạt mầm của những khả năng, như một sự thôi thúc vươn lên mạnh mẽ đến nỗi mọi vỏ cứng của nghịch cảnh cũng sẽ bị chọc thủng? Hãy suy ngẫm câu chuyện từng được phát rộng rãi trên AP vào ngày 23 tháng 5 năm 1984 như sau: Khi còn là một cô bé, Mary Groda không thể học đọc và viết được. Các chuyên gia cho rằng cô bé mắc chứng chậm phát triển. Khi đến tuổi dậy thì, cô lại bị gán cho là “kẻ bất trị” và bị giam hai năm trong trại cải tạo. Thật kỳ lạ, chính tại nơi đây, Mary bắt đầu học và cô học 16 giờ mỗi ngày. Sự nỗ lực của cô đã được đền đáp bằng tấm bằng tốt nghiệp trung học. Thế nhưng những bất hạnh vẫn tiếp tục đến với Mary. Sau khi rời trại cải tạo, cô mang thai mà không nhận được sự trợ giúp nào. Rồi hai năm sau, lần mang thai thứ hai đã khiến cô bị một cơn đột quỵ, mất hẳn khả năng đọc và viết mà khó khăn lắm cô mới có được. Với sự trợ giúp và ủng hộ của người cha, Mary đã chiến đấu chống trả bệnh tật, giành lại được những gì đã mất.
Trong điều kiện tài chính eo hẹp, Mary vẫn cố gắng vượt qua tất cả. Để thoát khỏi bước đường cùng, cô nhận nuôi bảy đứa trẻ cùng lúc. Cùng thời gian đó, cô bắt đầu học tại một trường cao đẳng cộng đồng. Khi hoàn thành khóa học, cô nộp đơn và được chấp thuận vào học tại trường Y khoa Albany. Vào mùa xuân năm 1984 tại Oregon, Mary Groda Lewis – giờ đây đã lập gia đình – bước lên sân khấu nhận tấm bằng tốt nghiệp trong trang phục cử nhân. Không ai biết được Mary đang nghĩ gì khi cô đưa tay nhận tấm bằng minh chứng cho sự tự tin vào bản thân và lòng kiên trì của mình. Tấm bằng đã cho cả thế giới biết rằng: Nơi đây, ngay tại một điểm rất nhỏ trên trái đất này, có một con người dám ước mơ một giấc mơ tưởng chừng không thể, một con người đã khẳng định với tất cả chúng ta về những khả năng tuyệt diệu mà con người có thể làm được. Nơi đây, người đang hiên ngang ngẩng cao đầu chính là Mary Groda Lewis, tiến sĩ y khoa.
(SƯU TẦM)
DẠYKÈMQUYNHƠN
8
OFFICIAL
NGÀY THỨ NHẤT – 25/01/2017
Câu 32 (rất khó): Hòa tan hết 16,32 gam hỗn hợp Fe và Cu trong 134,4 gam dung dịch HNO3 45%, thu được dung dịch X (không chứa muối amoni). Cho X phản ứng với 400 ml dung dịch hỗn hợp gồm NaOH 1M và KOH 0,5M, thu được kết tủa Y và dung dịch Z. Nung Y trong trong không khí đến khối lượng không đổi, thu được 21,6 gam hỗn hợp Fe2O3 và CuO. Cô cạn Z, thu được hỗn hợp chất rắn khan T. Nung T đến khối lượng không đổi, thu được 43,44 gam hỗn hợp chất rắn. Nồng độ phần trăm của Fe(NO3)3 trong X gần giá trị nào nhất sau đây?
OFFICIAL
DẠYKÈMQUYNHƠN
1
A.
B.
(Đề thi thử THPT Quốc Gia lần 2 – THPT
Vương
2 2 KNOKOH 2 T 2 NaNONaOH 2 nn0,2KNO m44,643,44 GiasöTchöa NaNOnn0,4Tconchöacabazô(1) Na:0,4;K:0,2xy0,6 x0,56(2) Ttaobôicacion: 46x17y26,44y0,04NO:x;OH:y (1) 3 2 3 honhôp Fe Cu 3 H100% 23 FeCu Fe CuNOtrongX Fe 32 Cu m56n64n16,32ZcoK,Na,NO,OHdö 21,616,32 Fe,Cu FeO,CuOBTE:3n2n2. 16 3n2nn 0,56 n0,12((2) 3);Tö n0,15 (3)VayXcoFe,Fe,C 2 3 2 2 3 2 3 3 ab 3 2 3 2 3 FeFe Fe Fe FeNO Cu Fe 3 3 2 ab 0,56mol0,48mol 0,96mol NO HNO HO NO ddX(Cu,Fe) u,NO nn0,12 n0,1 2n3nn2n0,26n0,02 BTNTH:HNONOHONO BTKL:mmmm17,12 mm 3 ab 33 ddHNONO Fe(NO) 0,02.242mm133,6C% 4% 133,6
20.
6. C. 10. D. 4.
chuyên Hùng
– Phú Thọ, năm 2016)
Câu 35: Cho 20 gam hỗn hợp X gồm Fe, FeCO3, Fe2O3 vào ống sứ nung nóng và dẫn từ từ 0,2 mol hỗn hợp khí Y gồm CO và H2 (tỉ khối so với H2 bằng 4,25) qua ống sứ, sau một thời gian thu được hỗn hợp rắn X1 và khí Y1. Cho khí Y1 hấp thụ vào dung dịch Ca(OH)2 dư, thu được 7 gam kết tủa và 0,06 mol khí Y2 (tỉ khối so với H2 bằng 7,5). Hoà tan X1 bằng dung dịch HNO3 (đặc, nóng, dư), thu được dung dịch Z và 0,62 mol hỗn hợp 2 khí, trong đó có một khí màu nâu đỏ là sản phẩm khử duy nhất của N+5. Nếu cho X tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thì thu được 0,225 mol hỗn hợp 2 khí. Phần trăm khối lượng của Fe2O3 trong X là A. 32%. B. 48%.C. 16%. D. 40%. (Đề thi thử THPT Quốc
OFFICIAL
DẠYKÈMQUYNHƠN
2
Gia lần 2 – THPT chuyên Hùng Vương – Phú Thọ, năm 2016) 3 o 1 2 1 HNOñ23 2 33 t,(2) 3 2 X 23 2 2 3 Y X Ca(OH) 2 (3) 2 Y TN1: FeO,FeO CO Fe(NO) Fe,FeCO NO Fe,FeOCO HO(hôi) HFeCO CO,H C CO 2 o 3 2 0,07mol Y t 24 243 22 2 CO aCO H TN2:XHSOñacFe(SO)(SO,CO)HO 2 2 2 2 2 2 2 2 3 2 HCO H 1 Hpö COpö H CO CO COtaothanhtöCO HCO H COtachratöFeCO 2 H CO CO nn0,2 n0,15 Yco n0,12;n0,022n28n8,5.0,2n0,05 n 0,02 nn0,06 n0,03 n Yco 2n28n15.0,06n0,03 (CO,H)pö NO 2 2 3 3 2 3 3 24 n n Fe FeCO 0,05 TN1:ChatkhölaFe,FeCO,CO,H;chatoxihoalaHNO TN2:ChatkhölaFe,FeCO;chatoxihoalaHSO BTEchoTN1:3xy2(0,120,02)0,62(y0,05) nx ny SO2 23 n FeO BTEchoTN2:3xy2(0,225y) x0,09;%200,09.560,06.116 m 40% 20 y0,06 ot (1)
Câu 48: Cho m gam hỗn hợp X gồm Ba, BaO, Al vào nước dư, phản ứng kết thúc thu được 3,024 lít khí (đktc), dung dịch Y và 0,54 gam chất rắn không tan. Cho 110 ml dung dịch HCl 1M vào dung dịch Y được 5,46 gam kết tủa. Giá trị của m là A. 8,74. B. 7,21.C. 8,2. D. 8,58. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Hùng Vương – Phú Thọ, năm 2016)
2 HO (1)
Câu 46: Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO và Al2O3 (trong đó oxi chiếm 64/205 về khối lượng) tan hết vào X, sau khi các phản ứng kết thúc thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít hỗn hợp khí T có tổng khối lượng 1,84 gam gồm 5 khí (đktc), trong đó về thể tích H2, N2O, NO2 lần lượt chiếm 4/9, 1/9 và 1/9. Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây? A. 40. B. 35. C. 20. D. 30.
DẠYKÈMQUYNHƠN OFFICIAL 3
2 X 2 2 HCl:0,11mol 3 (2) 3 2 0,07mol Z Y Sôñophanöng: Al:0,02mol Al,Ba H:0,135mol BaO Ba Ba,ClAl(OH) AlO Al 2 2HOH Ba BaO Al BaBaOAl BTNTH:nn0,135 nxBTEcho(1):2x3(z0,02)2.0,135x0,015 nyBTÑTchoZ:2(xy)3(z0,09)0,11y0,025 BTNTO:y0,1352(z0,02) z0,1 nz mmmm8,58gam
47: Điện phân (với điện cực trơ, màng ngăn xốp) dung dịch X chứa CuSO4 và NaCl (có tỉ lệ mol tương ứng 3:2) bằng dòng điện một chiều có cường độ 5A, sau thời gian t giờ thu được dung dịch Y chứa hai chất tan và thấy khối lượng dung dịch Y giảm 33,1 gam so với khối lượng của dung dịch X. Dung dịch Y hòa tan tối đa 3,6 gam Al. Giả sử khí sinh ra trong quá trình điện phân thoát hết ra khỏi dung dịch. Giá trị của t gần nhất với giá trị nào sau đây?
A. 4,5. B. 6. C. 5,36. D. 6,66.
DẠYKÈMQUYNHƠN OFFICIAL 4 4 4 33 2 2 2 2 KHSOBaSO Fe(NO) H NONO NO N 3 3 2 216,551,53.136nn1,53;n 0,035 242 n0,04 xy0,03 x0,01 Tconn0,01 30x28y0,86y0,02 nx;ny Tínhoxihoa:NO/HH TrongZkhongcoNO ddXYH... 33 2 2 2 4 4 2 2 4 33 2 2 2 4 2 Fe(NO) N NONONONH KHSO H HO NH OtrongYFe(NO)NONONOHO NH HO O OtrongY BTNTN:3n2n2nnnn BTNTH:n2n4n2n BTNTO:n9nnn2nn n0,025 16.0,4205n0,675%m m20,5gannham64 n0,4 tvôi20
Câu
Câu 49: Hòa tan hoàn toàn 22,4 gam Fe trong 500 ml dung dịch hỗn hợp NaNO3 và HCl 2,6M, đến phản ứng hoàn toàn thu được dung dịch X và 7,84 lít hỗn hợp khí NO và H2 với tỉ lệ mol lần lượt là 4:3, cho dung dịch AgNO3 dư vào dung dịch X thu được
DẠYKÈMQUYNHƠN OFFICIAL 5 2 ñpdd 2 4 4 2 comangngan x 2 x ddX ddY ddgiam Al CutrongY 3,6/27 2x Tröônghôp1: Na:2x CuSO:3xmol SO:3xClCu NaCl:2xmol Cu:2x m71x64x33,1 BTE:3n2n anot ñpdd 2 4 4 2 2 comangngan 3 x a ddX ddY x0,245loai. x0,1 Tröônghôp2: Na:2x CuSO:3xmol SO:3xClOCu NaCl:2xmol H:4x 2 2 2 2 2 2 catot 2 x b ddgiamClOCuH Cl O CuH Al H H mmmmm BTEtrongpöñp:2n4n2n2n BTEcho(YAl):n3n 71x3x.6432a2b33,1x0,1;a0,2:b0,2 2x4a6x2b t(0,1.20,2.4).965005 4x0,4 5.3600
dịch Y và
duy nhất của N+5). A. 218,95. B. 16,2. C. 186,55. D.
2 2 2 NO NO H H NO Agbòkhö Fe H NOAgbòkhö 0,250,40,15 ? AgClCl n4x n0,2 77,84 x x0,05 n3x n0,15 22,4 Xettoanboquatrìnhphanöng: 2,60,50,152 n 0,25 4 n 0 BTE:3n2n3nn nn1,3 Agtaothanh chatran(Ag,AgCl) ,15n 0,15 mm 202,75gam
,36giô Chuy:TínhmolHtrongYbangbaotoanñientích.
dung
m gam chất rắn. Giá trị của m là (Biết NO là sản phẩm khử
202,75.
Câu 43: Hỗn hợp X gồm Al, FexOy. Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X trong điều kiện không có không khí thu được hỗn hợp Y. Chia Y thành 2 phần:
- Phần 1 cho tác dụng với dung dịch NaOH dư, thu được 1,008 lít H2 (đktc) và còn lại 5,04 gam chất rắn không tan.
- Phần 2 có khối lượng 29,79 gam, cho tác dụng với dung dịch HNO3 loãng dư, thu được 8,064 lít NO (đktc, là sản phẩm khử duy nhất).
hợp
X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4 +) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất), đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3:2:1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với giá trị nào sau đây? A. 48% B. 58% C. 54%
DẠYKÈMQUYNHƠN
6
OFFICIAL
A.
và FeO B.
C.
o 2 H100% t NaOH 23 2 Al AlH Al Fe Fe YôP2 YôP1 Al Fe A X YYAl,Fe co AlO YH n0,03BTE:3n2n n1 P1: 5,04 n3 n 0,09 chatranlaFe 56 x0,09;m3m nx;n3x P2: 3.8,064BTE:3x3.3x n 22,4 23lO FeO 34 29,790,09.270,27.560,12 102 n:n0,27:0,12.33:4oxitlaFeO 29,79m29,79339,72gam Câu
khó).
gam
Giá trị của m và công thức của oxit sắt là:
39,72 gam
39,72 gam và Fe3O4
38,91 gam và FeO D. 36,48 gam và Fe3O4
44 (rất
Cho 27,04
hỗn
rắn
D. 46%
Câu 49: Hỗn hợp X gồm Na2SO3, CuO, CuCO3. Hòa tan m gam hỗn hợp X trong dung dịch hỗn hợp HCl 1M và H2SO4 0,5M vừa đủ, thu được dung dịch Y chứa (m + 8,475) gam chất tan gồm muối clorua và sunfat trung hòa; 5,6 lít hỗn hợp khí (đktc) có tỉ khối so với hiđro là 27,6. Điện phân dung dịch Y với điện cực trơ, màng ngăn xốp đến khi lượng Cu2+ còn lại bằng 6% lượng Cu2+ trong dung dịch Y thì dừng lại thu được dung dịch Z. Cho 0,14m gam Fe vào dung dịch Z đến khi phản ứng kết thúc thu được m1 gam chất rắn. Giá trị của m1 là
A. 4,5118. B. 4,7224. C. 4,9216. D. 4,6048.
DẠYKÈMQUYNHƠN OFFICIAL 7 34 23 32 3 3 2 Fe FeO FeO FeO Fe(NO) HCl:0,88mol HNO:0,04mol 23 AgNOdö NOHtrongY NOAgFetrongY TrongX:nx;n3y;n2y;ny;nz PÖ1:X ddYYCl:0,88mol chöa H,Fe,Fe PÖ2:Y NO... n 4n0,08 n 3nn 2 2 3 2 2 2 2 2 HOtaoraôPÖ1 FetrongY cacchattantrongY Fe NONO NO NOXaxitchattantrongYHO 0,880,040,08 n 0,42 2 (133,840,88.143,5) n 30,02 0,13 108 BTÑTchoYn0,18m 48,68 nn0,12 46n44nmmm m5,4 2 2 32 NO NO Fe(NO) n0,08 4n0,04 BTNTN:n(0,080,0420,04)/20,06
BTNTFe:x3y32y2y0,060,31 y0,01 BTE:3x3y2y0,060,080,04.80,13
x0,14(54%)
47:
m gam hỗn hợp X gồm một kim loại kiềm M và Al vào nước dư, thu được dung dịch Y; 0,4687m gam chất rắn không tan và 7,2128 lít H2 (đktc). Cho từ từ dung dịch HCl có số mol lớn hơn 0,18 mol vào dung dịch Y, ngoài kết tủa còn thu được dung dịch Z. Cô cạn dung dịch Z thu được 11,9945 gam chất rắn khan. Giá trị m gần nhất với giá trị
DẠYKÈMQUYNHƠN OFFICIAL 8 3 2 2 2 2 2 2 23 CuCO COSO CO CO SO SO NaSO
2 4 2 2 2 ñpdd 4 18x
1 0272 0,0114molCu0,0942molFeddZchatran
0,0692molFe Câu
nào sau đây? A. 18. B. 17. C
15. D
2 2 22 xmol 2 3 3 0,18mol0,161mol ddZ XHOthuñöôcchatran,ñolaAldö(M,Al)HOMAlOH. 7,2128BTE:x3x2. x0,161 22,4 M:0,161;Cl0,18 MAlOHClAl(OH)A0,180,161 l 3 0,01911,99450,18.35,527. 3 M 33,74 0,161 M23(Na)230,1610,01627m0,4687mm15 M7(Na)7.0,1610,016.27m0,4687mm10,3(khongcoñapan). NGÀY THỨ HAI– 26/01/2017
24 22 2 xmol0,5xmol xmol n0,11 nn0,25 n0,11 44n64n27,6.2.0,2513,8n0,14n0,14 BTNTH:hhX(HCl,HSO)ddY(CO,SO)HO BTKL:m36,5x49x(m8,475)13,8
Na:0,28;Cl:0,33;SO:0,165 x0,33Yco0,16520,330,28 Cu: 0,19 2 m0,11.1240,14.12680.(0,190,11)37,68 Cu:0,0114;Na:0,28:SO:0,165YddZ H0,165.20,280,0114.20,
m4,6048
Cho
.
. 14.
TN1:200mlAl(SO)xM300mlBa(OH)yM8,55gamkettua TN2:200mlAl(SO)xM500mlBa(OH)yM12,045gamkettua ÔTN1Al(SO)chöaphanönghet Ba(OH) BaSOBa(OH) Al(OH) kettua BaSO Al(SO) Al(OH) AlOH
0,075
ÔTN2Al(SO)ñaphanönghet,Al(OH)ñabòtanmotphan 2n nn0,3y;n 0,2y TN1: y0,1 3 m0,3y.2330,2y.788,55 n3n0,6x 0,6x.23378(1,6xy)12,045 TN2: n4nn1,6xyvôiy0,1 y
DẠYKÈMQUYNHƠN OFFICIAL 9
Câu 5: X là dung dịch Al2(SO4)3, Y là dung dịch Ba(OH)2. Trộn 200 ml X với 300 ml Y được 8,55 gam kết tủa. Trộn 200 ml X với 500 ml Y được 12,045 gam kết tủa. Nồng độ mol/l của dung dịch X và Y lần lượt là: A. 0,1M và 0,05M B. 0,05M và 0,075M C. 0,1M và 0,2M D. 0,075M và 0,1M 243 2 243 2 243 243 3 2 4 2 3 4 243 3 3
Câu 18 (khó): Hòa tan 11,6 gam hỗn hợp M gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí R (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của Fe(NO3)3 trong X là A. 13,56%. B. 20,20%. C. 40,69%. D. 12,20%.
OFFICIAL
DẠYKÈMQUYNHƠN
10
2 T 2KNOKOH 2 3 H100% 23 m42,541,05GiasöTchöaKNOnn0,5 TconchöacaKOH(1) K:0,5 xy0,5 x0,45(2) Ttaobôicacion: 46x17y21,55y0,05NO:x;OH:y ZcoK,NO,OHdö (1) Fe,Cu FeO,C 3 2 3 2 3 2 3 3 honhôp Fe Cu FeCu Fe CuNOtrongX Fe 322 Cu 3 FeFe Fe FeNO m56n64n11,6 1611,6uOBTE:3n2n2. 16 3n2nn 0,45 n0,15((2) 3);Tö n0,05 (3)VayXcoFe,Fe,Cu,NO nn0,15 2n3nn 2 2 3 ab 3 2 3 3 ab 33 Fe Cu Fe 3 3 2 ab 0,45mol0,35mol 0,7mol NO HNO HO NO ddX(Cu,Fe)ddHNONO Fe(NO) n0,1 2n0,35n0,05 BTNTH:HNONOHONO BTKL:mmmm9,9 0,05.242mmmm89,2C% 13,56% 89,2
Câu 31: Cho 87,35 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,425 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 516,125 gam muối sunfat trung hòa và 8,12 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là . Phần trăm khối lượng của Al trong hỗn hợp X có giá trị
DẠYKÈMQUYNHƠN OFFICIAL 11
nhất
nào sau đây? A. 10%. B. 11%. C. 12%. D. 13%. 2 2 2 Z 2 HNO H NO H NO 34 32 87,35gam 3654 H M 25,17 Zgom 58 NO Zgom2khítrongñocoNO(hoanau) nn0,3625 n0,0625 0,3625.365.4 n0,3 2n30n 9,125 58 Sôñophanöng: FeO Fe(NO) Al 2 4 233 2 4 2 2 4 4 ?mol 3,425mol 9,125gam 516,125gam HO NH Fe( Fe,Fe,AlHKHSO HO NH,SO NO 87,353,425.136516,1259,125BTKL:n 1,55 18 3,4251,5520,06252BTH:n 0,05 4 BTN:n 32 34 Al Al NO) FeO m9,45 %m11% 0,175 1,550,30,175.6BTO:n 0,2 4 Câu 49: Điện phân dung dịch chứa a mol CuSO4 và
n cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây thu được 4,48 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t thì tổng thể tích khí thu được ở cả 2 điện cực là 10,08 lít (đktc). Biết hiệu suất điện phân 100%. Giá trị của a là A. 0,20. B. 0,15.C. 0,25.D. 0,22.
365 58 gần
với giá trị
0,4 mol KCl (điệ
Câu 1: Cho 7,749 gam Al vào dung dịch hỗn hợp chứa x mol FeCl3 và y mol CuCl2, sau khi phản ứng kết thúc thu được 18,028 gam hỗn hợp 2 kim loại. Cho 7,749 gam Al vào dung dịch hỗn hợp chứa y mol FeCl3 và x mol CuCl2, sau khi phản ứng kết thúc thu được 21,988 gam hỗn hợp 2 kim loại. Điện phân dung dịch hỗn hợp chứa (x + y) mol FeCl3 và (x + y) mol CuCl2 với điện cực trơ, màng ngăn xốp cường độ dòng điện 10A trong 14764,5 giây thì khối lượng kim loại bám trên catot là A. 35,20 gam. B. 34,08 gam. C. 34,36 gam. D. 34,64 gam.
DẠYKÈMQUYNHƠN OFFICIAL 12 ñpddcomangngan
2 2
2 amolCu
4 2 tgiay electrontraoñoitrongthôigiantgiay
4 CuSO:amol TN1: 0,2molClôanot KCl:0,4mol n 0,220,4mol 0,2molCl anot 0,1molO CuSO:amol TN2: KCl:0,4mol ca
tot (0,450,3)molH BTEôTN2:2a0,15.20,8a0,25
3 2 2 3 2 2 Cu Fe Cu Fe AlFe Cu Febòkhö AlFe Cu Febòkhö 18,02864y
TN1:ny;n
. 56 56 BTEôTN1:3nn2n2n BTEôTN2:3nn2n2n 18,02864y3.0,287x2y2.56 21,99864x30,287y2x256 etñ1,53mol Cu ñpdd 3 KL n 2 Fe Ôcatot x0,26 y0,15 n0,41 FeCl:0,41 m34,64 1,530,410,41.2 CuCl:0,41 n 0,15 2 ñpddcomangngan 2tgiay
21,99864x
;TN2:nx;n
Câu 42 (rất khó): Hòa tan hết m gam hỗn hợp rắn X gồm Mg, Cu(NO3)2, Fe, FeCO3 vào dung dịch chứa H2SO4 và 0,045 mol NaNO3, thu được dung dịch Y chỉ chứa 62,605 gam các muối (không có ion Fe3+) và thấy thoát ra 3,808 lít (đktc) hỗn hợp khí T gồm N2, NO2, N2O, NO, H2, CO2 có tỉ khối so với H2 bằng 304/17 (trong T có chứa 0,02 mol H2). Cho dung dịch NaOH 1M vào dung dịch Y đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì dùng hết 865 ml. Mặt khác, cho 94,64 gam BaCl2 vừa đủ vào Y sau đó cho tiếp AgNO3 dư vào thì thu được 256,04 gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của m là A. 27,2 B. 28,4. C. 24,36. D. 32,8.
DẠYKÈMQUYNHƠN
13
OFFICIAL
4 2 2 2 24 3 24 2 4 4 4 424 BaSOBaCl AgClBaCl BaCl Ag NaSO NaNO HSOBaCl FeSOAg CuSO MgSO (NH)SO nn0,455;n2n0,91 n0,455 256,040,455.2330,91.143,5 n 0,18 108 n0,5n0,0225;nn0,455mol;nn0,18 nx;ny;n z Mg,C 24 4 22 32 3 4 2 3 24 4 22 48,415gam mgam 6,08gam 424 62,605gam NaSO FeSO N,NO u(NO)NaNO MgSO NO,NO Fe,FeCO HSO CuSO CO,H (NH)SO 4 4 4 424 2 2 2 4 4 4 424 24 2 ? NaOHFeSO MgSO CuSO (NH)SO kettuaFe(OH)Cu(OH)Mg(OH) muoiFeSOMgSOCuSO(NH)SONaSO HO n2n2n2n2n mmmm mmmmm m 0,8650,18.22y2x2z 31,7290.0,1898x58y 62,605152. 24 424 2 2 2 324 2 HSO (NH)SO H HO HO 0,455 0,0125 0,02 ? X(NaNO,HSO)muoikhíHO x0,04 y0,2 0,18120y160x132z142.0,0225z0,0125 BTNTH:2n8n 2n2n n0,385 m27,2 BTKL:mm mmm
Câu 45: Rót từ từ dung dịch chứa a mol HCl vào dung dịch hỗn hợp chứa a mol NaHCO3 và b mol Na2CO3,thu được (a+b)/7 mol khí CO2 và dung dịch X. Hấp thụ a mol CO2 vào dung dịch hỗn hợp chứa a mol Na2CO3 và b mol NaOH, thu được dung dịch Y. Tổng khối lượng chất tan trong 2 dung dịch X và Y là 59,04 gam. Cho dung dịch BaCl2 dư vào dung dịch Y thu được m1 gam kết tủa. Giá trị của m1 là
Câu 43 (khó): Hỗn hợp X gồm Cu và Fe3O4. Khử m gam hỗn hợp X bằng khí CO dư (đun nóng), thu được 0,798m gam hỗn hợp kim loại. Cho m gam hỗn hợp X tác dụng với dung dịch HCl lấy dư, thu được dung dịch Y và chất rắn Z. Cho dung dịch Y tác dụng với dung dịch AgNO3 dư, thu được 427,44 gam kết tủa và V lít khí NO (đktc). Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư thu được 2,75V lít NO (sản phẩm khử duy nhất, đktc). Giá trị gần nhất của V là A. 2,24. B. 2,68. C. 2,82. D. 2,71.
DẠYKÈMQUYNHƠN OFFICIAL 14
A.
B.
C.
15,76. 2 2 3 3 COHCO Na chattantrongX Cl HCO 3 23 23 2 23 23 amol 6a8b0 ab TN1:nnn ab 7 ab na2b Xco m 23(a2b)35,5a2b.61 na;n2b NaHCO NaCO NaCO:amol TN2:CO HCO NaCO NaOH NaOH:bmol bmol chattantrongY chattantrongXvaY 3 23 HOH m 62a106a40b18b m 226,5a190b59,04 6a8b0 a0,16 226,5a190b59,04b0,12 YNaHCO:yBTNTNa:2xy0,44x0,12 chöa NaCO:xBTNTC:xy0,32y0,2 3 2 3 BaCO
19,70.
29,55.
23,64. D.
YBaCldö0,12molBaCOm23,64gam
Câu 40: Trộn 58,75 gam hỗn hợp X gồm Fe(NO3)2 và kim loại M với 46,4 gam FeCO3 được hỗn hợp Y. Cho toàn bộ Y vào lượng vừa đủ dung dịch KHSO4, thu được dung dịch Z chỉ chứa 4 ion (không kể H+ và OH của H2O) và 16,8 lít hỗn hợp T (đktc) gồm 3 khí trong đó có 2 khí có cùng phân tử khối và 1 khí hóa nâu trong không khí. Tỉ khối của T so với H2 là 19,2. Cô cạn 1/10 dung dịch Z thu được m gam rắn khan. Giá trị của m là A. 39,385. B. 37,950. C. 39,835.
DẠYKÈMQUYNHƠN OFFICIAL 15 34 2 2 O FeO 2 HCldö 2 Z Cu Y 3 AgClFeCl CuClHC nm0,798m0,202m n FeCl:0,606m/64 416464 CuCl:0,202m/64Cu 232.0,202m m 0,26775m HCldö 64 n 64 64 AgClYAgNOdöNO Ag n2n2nn 2 2 2 34 lFeCl CuCl NO NOAg Fe 3FeO CuNO 1,616m4V2n2n4n 6422,4 1,616m4V427,44143,5 6422,4 0,606m3Vn3nn (*) 6422,4 108 BTEchopöXHNO:n2n3n 0,202m20,26775m2,75V3(**) 64 6422,4 Tö(*)va(** m85,6 )suyra: V2,678gannhatvôi2,68
(Đề thi thử THPT Quốc Gia lần 2 – THPT Thị Xã Quảng Trị, năm
2 3 2 2 2 3 2 3n 2 2 4 COFeCO NO NO NO NO H CO NO(M44) ZFe,M gom ;TgomCO(M44) K,SO NO(hoanau) nn0,4xy0,40,75 x0,05 44x30y0,4.4419,2.2.0,7528,8y0,3nx;ny n4n10n2n2, 4 2 KHSO HO muoitrong1/10ddZ 5n2,5;n1,25. 58,7546,42,5.1361,25.1828,8 BTKL:m 39,385 10
D. 39,705.
2015)
NGÀY THỨ BA – 27/01/2017
Câu 45 (rất khó): Hòa tan hoàn toàn 8,6 gam hỗn hợp Al, Mg, Fe, Zn vào 100 gam dung dịch gồm KNO3 1M và H2SO4 2M, thu được dung dịch X chứa 43,25 gam muối trung hòa và hỗn hợp khí Y (trong đó H2 chiếm 4% khối lượng Y). Cho một lượng KOH vào X, thu được dung dịch chỉ chứa một chất tan và kết tủa Z (không có khí thoát ra). Nung Z trong không khí đến khối lượng không đổi được 12,6 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X gần giá trị nào nhất sau đây?
0,55 mol KHSO4 loãng, đun nóng. Kết thúc phản ứng thu được dung dịch Y chỉ chứa 87,63 gam muối trung hòa và 1,68 lít hỗn hợp khí Z gồm NO và H2 (ở đktc) có tỉ khối hơi so với H2 là 6,6. Biết trong Y không chứa muối Fe3+. Cho Ba(OH)2 dư vào Y thì thấy m gam kết tủa xuất hiện. Giá trị của m là A. 150,53. B. 122,78. C. 120,84. D. 146,36.
DẠYKÈMQUYNHƠN OFFICIAL 16
A.
3 24 2 2 324 2 4 4243 243 424 KNO HSO muoi/X H Y HO kimloai(KNO,HSO)muoiYHO MgSO,FeSO,Fe(SO) TögiathietsuyraXchöaAl(SO),ZnSO,KSO nx;n2xm8,639x2x.9643,25x0,15. nym50y,n0,3y. BTKL:mm mmm BTKL 324 24 3 kimloaidd(KNO,HSO)ddXY ddX ddX KOHKSOKNO 24 KOHOHtrongZ :mm mm 8,60,15.1010,3.9843,2550y18(0,3y)y0,140625 8,6100m50y m101,56875 n2nn0,45 KOHXddchæchöaKSOZ n n0,4 2 2 2 4 2 oxihoaFe 2 2 Fe O FeSO 5 0,45molOH0,225molO KhinungZsexayraquatrình: O zmolO 0,2251616z12,68,6z0,025BTE:n2n0,05 152.0,05C% .100%7,48%gannhatvôi7,5%101,56875 Câu 46: Hòa tan hết 17,6 gam
X
chứa
7,50%. B. 7,00%. C. 7,75%. D. 7,25%.
hỗn hợp rắn
gồm Cu, Mg, Fe3O4 và Fe(NO3)2 trong dung dịch
Câu 50: Cho m gam hỗn hợp M gồm Al (6x mol), Zn (7x mol), Fe3O4, Fe(NO3)2 tác dụng hết với 250 gam dung dịch H2SO4 31,36%, thu được dung dịch X chỉ chứa các muối trung hòa và 0,16 mol hỗn hợp Y chứa hai khí NO, H2 có đối với He bằng 6,625. Cô cạn dung dịch X thu được (m + 60,84) gam muối. Nếu nhỏ từ từ dung dịch KOH 2M vào dung dịch X đến khi không còn phản ứng nào xảy ra thì vừa hết 1 lít dung dịch KOH. Nồng độ phần trăm của FeSO4 có trong dung dịch X là A. 10,28%. B. 10,43%. C. 19,39%. D. 18,82%.
DẠYKÈMQUYNHƠN OFFICIAL 17 2 2 4 4 34 4 424 2 2 32 424 Z X Y NOH NOH Sôñophanöng: CuSO,FeSO Cu,FeO NO KHSOMgSO,KSO HO H Mg,Fe(NO) (NH)SO nn0,075 30n2n0,075.13,20,9 2 2 4 32 34 NO H HO NH Fe(NO) FeO 4 n0,03 9n0,045 17,60,5513687,630,99BTKL:n 0,21 18 0,550,045.20,21.2BTNTH:n 0,01 4 0,010,03BTNTN:n 0,02 2 0,210,030,02.6BTNTO:n 0,03 4 CuSO:xmol Mg 4 4 24 424 Y 5 2 2 2 2 SO:ymol 160x120y22,4x0,08
xy0,16
BaSO:0,55
YBa(OH)döKettuagom
kettua
FeSO:0,11
y0,08 KSO:0,275 (NH)SO:0,005
Fe(OH):0,11
Cu(OH):0,08 Mg(OH):0,08
m150,53
DẠYKÈMQUYNHƠN OFFICIAL 18 2 4243 34 (1) 24 4243 2 2 320,8mol 424 Y M X NOH Sôñophanöng: ZnSO,Al(SO) Al,FeO NO
Zn,Fe(NO)
nn0, 2 2 2 4 32 34 NO H NOH HO NH Fe(NO) FeO 16 n0,14 n0,0230n2n0,16.26,54,24 m78,4(m60,84)4,24BTKL:n 0,74 18 0,8.20,02.20,74.2BTNTH:n
Ô(1):
BTNTN:n
BTNTO:n
4 4 243 24 4 2 2mol 243 22 Z 424 X
4FeSO ... BTNTFe:y2z0,38 x0,02 BTNTS:7x9xy3z0,010,8y0,2 BTNTK:0,8.26x7x.22 z0,09 0,2.152 C% 10,28% 6.0,02.277.0,02.650,08.1800,1.2322504,24
HSO FeSO,Fe(SO) HO H
(NH)SO
0,02 4
0,140,02
0,08 2 0,740,140,08.6
0,
1 ZnSO:7xmol Al(SO):3xmol KSO:0,8mol FeSO:ymol KOHKAlO:6xmol Fe(SO):zmol KZnO:7xmol (NH)SO:0,01mol
Câu 48 (khó): Cho hỗn hợp M gồm Ba, Na, K, Al (Na và K có số mol bằng nhau) tác dụng hết với 300 ml dung dịch HCl 2M, sau phản ứng thu được dung dịch X trong suốt và 10,752 lít H2 (đktc). Nhỏ từ từ 150 ml dung dịch H2SO4 0,4M vào dung dịch X thì lượng kết tủa Al(OH)3 đạt giá trị cực đại. Lọc bỏ kết tủa và cô cạn dung dịch còn lại thì thu được 44,4 gam muối khan. Phần trăm khối lượng của Ba trong M gần nhất với giá trị nào sau đây? A. 49%. B. 53%. C. 48%. D. 31%.
DẠYKÈMQUYNHƠN
19
OFFICIAL
2 4 3 M 2 2 X Y Sôñophanöng: H BaSO K,Na Ba,Al Al(OH) Ba,Na K,AlO Cl,OH Na,K Cl,... 2 24 H HCl HSO 2 4 NaK Ba chattantrongY Al n0,48;n0,6;n0,06 TH1:YcoK,Na,Cl,SO nnxBTEcho(1)2x2y3z2.0,48 ny;BTÑTchoY2x0,62(0,06y) m 23x39x0,6.35,596(0,06y)44,4 nz x0,328 y0,0 Ba 2 NaK Ba chattantrongY Al 0,0315.137 315%m 16,1% 0,328.620,0315.1370,08.27 z0,08 TH2:YcoK,Na,Cl,Ba nnxBTEcho(1)2x2y3z2.0,48 ny;BTÑTchoY2x2(y0,06)0,6 m 23x39x0,635,513 nz Ba 7(y0,06)44,4 x0,24 0,12.137 y0,12%m 49% 0,24.620,12.1370,08.27 z0,08 ddHCl (1) 24ddHSO (2)
Câu 44 (hay): Hòa tan hoàn toàn 29,6 gam hỗn hợp H gồm FeS2 và CuO vào 500 gam dung dịch HNO3 C% (dùng dư 10% so với lượng phản ứng), cô cạn dung dịch sau phản ứng thu được 56,12 gam hỗn hợp muối khan. Biết trong quá trình xảy ra phản ứng chỉ có NO2 là sản phẩm khử duy nhất. Giá trị C gần nhất với giá trị nào sau đây? A. 31,6 B. 28,7. C. 39,4. D. 52,9.
3HNO
Câu 33: Điện phân 225 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 4,02A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 18,9 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 21,75 gam rắn T và khí NO (sản phẩm khử duy nhất của
N+5
). Phát biểu nào sau đây sai?
A. Chất rắn T thu được chứa 2 kim loại.
B. Do Y có chứa HNO3 nên dung dịch sau điện phân có pH<7.
C. Trước khi cho sắt vào, nước ở catot chưa bị điện phân.
D. Quá trình điện phân được tiến hành trong 5600 giây.
DẠYKÈMQUYNHƠN OFFICIAL 20
2 4 2 3 2 2 muoichöacacion 32 32 cocan 2 4 3 2 4 3 SO FeS CuO NO/muoi Sôñophanöng: NO FeS CuO Fe,Cu Fe,Cu SO,NO SO,NO H n2xnx n 3x2y4x2yx ny 1 3 2 2 3 2 2 3 4 3 3 HNOpöNO FeS NO/muoi Fe Cu SO HNOñempö HNO 20x80y29,6 x0,14 56x64y2x.9662(2yx)56,12y0,16 nnn 15n(3n2n2n)2,28 n 2,282,28.10%2,508C%31,6%
Câu 46: Hòa tan hoàn toàn 31 gam hỗn hợp M gồm Fe và Mg vào 250 gam dung dịch H2SO4 73,1276% đun nóng, thu được dung dịch X; 1,68 gam rắn không tan; 32,287 gam hỗn hợp khí Y gồm H2S và SO2 có tỉ khối so với hiđro là a. Cho từ từ dung dịch Ba(OH)2 0,75M vào dung dịch X đến khi kết tủa đạt cực đại thì thấy vừa hết 1,65 lít. Lọc lấy kết tủa đem cân thì thấy có khối lượng là 359,7125 gam. Giá trị của a là A. 32,01. B. 28,05. C. 25,06. D. 27,05.
DẠYKÈMQUYNHƠN OFFICIAL 21
ñpdd
H Fepö
3 ddY T
H:x n
m18,956( electrontraoñoi electrontraoñoiH
TcoFedövaAg DungdòchYcopH7 Ôcatotnöôcchöabòñienphan n .F n
I3600giay VayketluansailaQuatrìnhñie nphanñöôctienhanhtrong5600giay
2 2 2 Y 3 243 Ba(OH) 4 2 (2) 24 4 M X Sôñophanöng: SO HS Fe(OH) Fe(SO) Fe MgSO Mg(OH) Mg HSO BaSO S 24HSO (1)
18,9gamFe
3
NO Agtaothanh FepöNOAg
AgNO ddY 21,75gamranT
n0,11250,125x n 0,25xAg:0,225x;4 n 0,225x BTE:2n3nnNO:0,225
0,11250,125x)108(0,225x)21,75x0,15.
n0,15t
49: Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al, Fe2O3, CuO trong khí trơ ở nhiệt độ cao, sau một thời gian thu được hỗn hợp rắn Y. Cho Y tác dụng với dung dịch NaOH dư, thu được 21,504 lít khí H2 (đktc) và còn lại hỗn hợp rắn Z. Cho Z tác dụng với dung dịch CuSO4 dư, thấy khối lượng chất rắn T thu được sau phản ứng tăng 1,6 gam so với khối lượng của Z. Hòa tan hoàn toàn T bằng 426 gam dung dịch HNO3 35% (dư 25% so với lượng cần thiết), thu được 8,8 gam NO (sản phẩm khử duy nhất của N+5) và thấy khối lượng dung dịch tăng 40,16 gam. Phần trăm về khối lượng của Fe2O3 trong hỗn hợp X gần nhất với giá trị nào sau đây?
A. 38%. B. 39%. C. 36%. D. 37%.
DẠYKÈMQUYNHƠN OFFICIAL 22 243 3 4 2 24 4 Fe(SO)
TrongYco:ny
2 2 22 2 2 HSSO (HS,SO) HS SO 31.20,0525.68n2n m 34n64n32,287 x0,1515 32,287 a 28,05
y0,424
FeFe(OH) MgSO MgMg(OH) HSO BaSO n0,5xnnx
nny nz n(1,5xyz) 56x24y31 x0,125 1,5xyz1,2375 y1 107x58y1,2375.233359,7125z0,05 BTEcho(1):0,125.
2(0,15150,424)
Câu
DẠYKÈMQUYNHƠN OFFICIAL 23 2 23 23 Al/YH Al/Y Fe/YCutaothanh FeObòkhö Cu/Y Cu/TCu/Y CuObòkhö Cu/Y NO AlkhöFeO,CuO Al/ BTE:3n2nn0,64mol. nn xm8x1,6x0,2n 0,1 n0,24 nn0,2 n 0,24 BTE:2(n0,2)3n 0,1.60,24.2 n 0,36n 3 3 3 3 3 32 33 X 32 3 33 2 23 3 T HNOpö HNOpö HNOpö HNOpöCu(NO) Fe(NO)NO ddtangTNO 1. Cu(NO) Cu:0,44 CuO:zHNOFe(NO)NOHO FeO:t HNO n0,25n426.0,35/63n1,8933 n2n3nn2(0,44 mmm 23 FeO/X CuO/X Al/X 23 z)6t0,29331,8933 0,446480z160t8,840,16 n0,2;n0,3;n1 z0,06 0,2160 t0,1%FeO 38,55%gannhatvôi39%0,21600,38027
Câu 46 (khó): Cho m gam hỗn hợp E gồm NaHCO3, Fe2O3, ZnO, MgCO3 tác dụng vừa đủ với dung dịch H2SO4 24,5%, thu được dung dịch X chứa (m + 37,24) gam muối trung hòa và 193,08 gam H2O và có khí CO2 thoát ra. Dung dịch X tác dụng với dung dịch BaCl2 dư thì xuất hiện 139,8 gam kết tủa. Biết phân tử khối trung bình của E bằng 94,96. Phần trăm khối lượng Fe2O3 trong E là A. 26,96% B. 24,88%. C. 27,58%. D. 34,12%.
NGÀY THỨ TƯ –
28/01/2017
Câu 40 (khó): Điện phân dung dịch gồm 28,08 gam NaCl và m gam Cu(NO3)2 (điện cực trơ, màng ngăn xốp) đến khi khối lượng dung dịch giảm 51,60 gam thì ngừng điện phân, thu được dung dịch X. Cho thanh sắt vào X, sau khi các phản ứng kết thúc thấy khối lượng thanh sắt giảm 6,24 gam và thu được khí NO (sản phẩm khử). m có thể nhận giá trị gần nhất nào sau đây?
A. 180. B. 160. C. 170. D. 190.
DẠYKÈMQUYNHƠN
24
OFFICIAL
24 4 2 24 2 2 2 2 24 2 3 2 24 HSOBaSO CO EddHSO muoi COHO m37,24
?193,08 HOthuñöôcHOtrongddHSO HOtaothanh NaHCO HOtaothanhHSO BTNTS:nn0,6 n0,22BTKL:mmm44nm m m n 0,66 18 BTNTH:n2n 2n 24 24 3 HSO 4 3 243 23 4 E 0,12 NaSO:0,06mol NaHCO:0,12mol MgSO:0,1mol EMgCO:0,1mol co ... Fe(SO):xmol FeO:xmol ZnSO:ymol ZnO:ymol BTNTS:3xy0,10,060,6 M0,22.84160x81y 0,22xy 23 x0,08
m0,698:24,5%
94,96y0,2 0,08160 %FeO 26,96% 94,96(0,220,080,2)
DẠYKÈMQUYNHƠN OFFICIAL 25 ñpdd 3Fe 32 X TH1 TH2 3 3 2 2 NaCl:0,48mol Na,NO NOXcoH Cu(NO):xmol ... Na,NO Na,NO ÔanotHOñabòoxihoaXco hoac H,Cu H 2 2 2 2 2 2 2 Cl O CuCl O ddgiam O H CutrongX FeNOCu Fe H NO TH1 Ôanot:n0,24mol;ny;BTE:Ôcatotnn2n0,242y m0,24.7132y(0,242y).6451,6 y0,12 n4n4y0,48 n x2y0,24x0,48 2n3n2n n n n 4 32 2 2 2 3 thanhFegiam Cu(NO) Cl O Cu H ddgiam HNONa x0,3 m 56(x0,3)64(x0,48)6,24 x0,96m180,48 TH2 Ôanot:n0,24mol;ny Ôcatotnx;nz BTE:0,242yxz m0,24.7132y64x2z51,6 nnn2x0 Fe FeNO thanhFegiam H NO ,48 n0,75x0,18 2n3n m 56(0,75x0,18)6,24 n n 4 y0,2775x0,38857 (thoaman)m73,05 z0,4063 ChonA
Câu 9. Tiến hành phản ứng nhiệt nhôm m gam hỗn hợp X gồm bột Al và một sắt oxit trong điều kiện không có không khí, được hỗn hợp Y. Nghiền nhỏ, trộn đều Y rồi chia thành hai phần:
- Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 (dư) đun nóng, được dung dịch Z và 3,696 lít khí NO duy nhất (đktc).
- Phần 2 tác dụng với lượng dư dung dịch NaOH đun nóng, thấy giải phóng 0,336 lít khí H2 (đktc) và còn lại 2,52 gam chất rắn. Các phản ứng đều xảy ra hoàn toàn. Giá trị của m là A. 21,735. B. 28,980. C. 19,320. D. 43,470.
Câu 22: Hỗn hợp X gồm FeO, Fe2O3, S, FeS2 và CuS trong đó O chiếm 4,6997% khối lượng. Cho 15,32 gam X tác dụng vừa đủ với 0,644 mol H2SO4 đặc (đun nóng) sinh ra 14,504 lít khí SO2 (là sản phẩm khử duy nhất) và dung dịch Y. Nhúng thanh Mg dư vào Y sau khi các phản ứng xảy ra hoàn toàn lấy thanh Mg ra cân lại thấy tăng 5,14 gam (Giả sử 100% kim loại sinh ra bám vào thanh Mg). Đốt cháy hoàn toàn 15,32 gam X bằng lượng vừa đủ V lít (đktc) hỗn hợp khí A gồm O2 và O3 tỉ lệ mol 1:1. Giá trị gần nhất của V là A. 4,3. B. 10,5. C. 5,3. D. 3,5.
DẠYKÈMQUYNHƠN
26
OFFICIAL
thi thử THPT Quốc Gia
GD
2 NaOH Fe Fe AlH Al Al Fe Al FeôP1 FeôP2 P1P2 chatranlaFen0,045n4,5 P2 BTE:3n2n n1n0,01 x0,03 n4,5x;nx n P1: 4,5.0,033 BTE:4,5xx0,165n0,045 14,49mmm14,49319,32gam
(Đề
– Sở
& ĐT Thanh Hóa, năm 2015)
Câu 49: Hòa tan hoàn toàn hỗn hợp X gồm a mol CuxFeSy và b mol FeSy ( a: b =1: 3; x,y nguyên dương) trong dung dịch HNO3 đặc nóng thu được dung dịch Y chỉ gồm 2 muối sunfat, đồng thời giả phóng 43,008 lít ( đktc) hỗn hợp 2 khí có tỉ khối so với He là 12,9375. Giá trị a, b lần lượt là: A. 0, 03375; 0,10125 B. 0;035; 0,105 C. 0,0335 ; 0, 1005 D. 0,0375 ; 0,01125
DẠYKÈMQUYNHƠN OFFICIAL 27 24 HSOñac 2 243 2 0,674mol Quyñoi 23 4 Y X' X,4,7%O Sôñophanöng: FeO Fe:x FeS Fe(SO):0,5x Cu:y SO FeO S:z CuSO:y O:0,045 S,CuS 0,6475mol Mg 243 4 4 (1,5xy)mol Y X' Fe(SO):0,5x Fe CMgSO u CuSO:y m 56x64y32z14,6 x0,047 BTNTSz0,6441,5xy0,6475y0 m 56x64y24(1,5xy)4,94 23 23 quyñoi Opö 23 (O,O)Opö OpöO/X'FeCuS (O,O) ,1 z0,174 n0,4735 (O,O) O mm7,576BTE:2n2n3n2n4n 32x48x7,576x0,0947V4,24gannhatvôi4,3lít
Gia lần 1 – THPT Trần
Trọng
3 o 3 o 3 o HNOñac 2 4 t 2 HNOñac 24 t 3 xy HNOñac 2 2 t 2 y 24 4 S SO NO:xxy1,92 x1,68 2khíla NO:y46x92y99,36y0,24 X 2khí Fe:4a CuFeS:a NO Cu:ax FeS:3a NO SO:4ay xy y CuFeS FeS BTÑT:12a2ax8ay 6x4y BTE:2ax3a6ay9a18ay1,680,24.2(12a2ax)24ay2,16 n0,03375 x2;y2a0,03375 ay0,0675 n0,10125
(Đề thi thử THPT Quốc
Bình
– Phú Yên, năm 2015)
Câu 8: Hòa tan hoàn toàn 17,44 gam hỗn hợp X gồm Fe, Fe3O4, Fe2O3, CuO, Cu, Mg, MgO (trong đó oxi chiếm 18,35% về khối lượng) trong dung dịch chứa 0,804 mol HNO3 loãng (dư 20% so với lượng cần cho phản ứng), kết thúc các phản ứng thu được dung dịch Y và V lít (đktc) hỗn hợp khí Z gồm N2 và N2O (tỷ lệ số mol tương ứng là 2:3). Cho dung dịch NaOH tới dư vàoY rồi đun nóng, không có khí thoát ra. Giá trị của V là A. 0,56. B. 0,448. C. 1,39. D. 1,12. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Lý Tự Trọng – Cần Thơ, năm 2015)
dung dịch chứa b mol HCl thu được dung dịch Y chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Y ta có đồ thị
Cho a mol Al tác dụng với dung dịch hỗn hợp chứa 0,15b mol FeCl3 và 0,2b mol CuCl2. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là A. 11,776 B. 12,896 C. 10,874 D. 9,864 (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Bến Tre, năm 2015)
DẠYKÈMQUYNHƠN
28
OFFICIAL
3 3 3 2 2 2 3 3 4 HNOpö
HNOpö HO O/X N NO NOtaomuoi xy 3 HNO YNaOHkhonggiaiphongkhíYkhongchöaNH. n20%n0,804n0,67;n0,335 n0,2;n2x;n3x;n y Sôñophanöng: Fe,FeO Fe(NO Cu,CuO Mg,MgO 3 2 2 3 3 2 2 3 2 3 2 32 2 2 32 O/XHNO NOHONOtaomuoi HNO NONNOtaomuoi 3 (N,N ) N Cu(NO) HO NO Mg(NO) BTNTO:n3n3n nn BTNTN:nn 2n2n x5.10;y0,620,20,67.33y3x0,335 0,67y2.3x2.2x V 2 3 O)551022,40,56lít Câu 45: Cho a mol Al tan
HNOpö
hoàn toàn vào
sau :
DẠYKÈMQUYNHƠN OFFICIAL 29 3 AlCl:amol Ychöa: ab3ahay4ab. HCl:(b3a)mol + Dựa vào bản chất của phản ứng và đồ thị, ta bổ sung các điểm trên đồ thị như sau: 3 HCl/Y HCl/YAl(OH)max 3 2 xnb3a yn4n (b3a)4aba Döavaotínhchatñothò,taco:0,1875bba0,68. 4ab a0,16 0,1875bba0,68b0,64 FeCl:0,096mol ApdungBTEchophanöng:0,16molAl CuCl:0,1 2 3 2 2 FeFepö AlFe Cu Fepö Cu 0,16 0,1280,096 ? 28mol nn0,064 3nn2n3n m11,776 n0,128
58,4.12% n 0,192mol 36,5 MCl:xmol TH1:Yco RCl:xmol BTNTCl:3x0,192x0,0640,064M0,064R8,496(loai). MCl:xmol TH1:YcoRCl:xmol HCl:xmol BTNTCl:4x0,192x0,0480,048M0,048R8,448 M137
(Ba);R39(K)m8,332
DẠYKÈMQUYNHƠN OFFICIAL 30
Câu 6: Hỗn hợp X gồm M và R2O trong đó M là kim loại kiềm thổ và R là kim loại kiềm. Cho m gam hỗn hợp X tan hết vào 58,4 gam dung dịch HCl 12% thu được dung dịch Y chứa 15,312 gam các chất tan có cùng nồng độ mol. Biết Y chỉ chứa 1 loại anion. Giá trị của m là A. 8,832 B. 3,408 C. 4,032 D. 8,064 (Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực – Thái Bình, năm 2015) HCl 2 2
Câu 32: Hỗn hợp X gồm Mg, Cu và Al. Cho 19,92 gam hỗn hợp X tác dụng với dung dịch HCl dư thu được 9,856 lít H2 (đktc) và còn m1 gam chất rắn không tan. Cho 19,92 gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư thu được V lít NO (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 97,95 gam muối khan. Cho m1 gam chất rắn không tan tác dụng với dung dịch HNO3 loãng dư thu được 0,32V lít NO (đktc, sản phẩm khử duy nhất). Phần trăm khối lượng Mg trong hỗn hợp X gần nhất với giá trị nào sau đây? A. 10% B. 12% C. 11% D. 9% (Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực – Thái Bình, năm 2015)
0050: Cho hai dung dịch: dung dịch X chứa NaOH 1M và Ba(OH)2 0,5M; dung dịch Y chứa AlCl3 1M và Al2(SO4)3 0,5M. - Cho V1 lít dung dịch X vào V2 lít dung dịch Y thu được 56,916 gam kết tủa.
- Nếu cho dung dịch BaCl2 dư vào V2 lít dung dịch Y thu được 41,94 gam kết tủa.
Tỉ lệ V1/V2 là: A. 169/60 hoặc 3,2. B. 153/60 hoặc 3,6. C. 149/30 hoặc 3,2. D. 0,338 hoặc 3,6. (Đề thi chọn học sinh giỏi tỉnh Thái Bình năm 2015)
DẠYKÈMQUYNHƠN OFFICIAL 31 2 1 3 43 Al Cu Mg electrondoXnhöôngH NO(sinhratöpömgamchatranHNO) muoinitratkimloai 3 muoiNHNO TrongXco:nx;ny;nz 0,96V n 2n3n 0,88 22,4 0,96V 59,52V m 19,92620,88 74,48 22,4 22,4 XHNOthì m 97 X Mg 59,52V 59,52V ,9574,48 23,47 22,4 22,4 m27x64y24z19,92 V8,4 BTE:3x2z0,88 x0,24 0,96VBTE:2y y0,18 22,4 00,96V3V23,4759,52Vz0,08 ,88 8 22,422,48022,4.80 %0,08 m 19,
9.100%9,64%gannhatvôi10% 2
Câu 6: Hỗn hợp X gồm Al, Fe3O4 và CuO, trong đó oxi chiếm 25% khối lượng hỗn hợp. Cho 1,344 lít khí CO (đktc) đi qua m gam X nung nóng, sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 bằng 18. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng (dư), thu được dung dịch chứa 3,08m gam muối và 0,896 lít khí NO (ở đktc, là sản phẩm khử duy nhất). Giá trị m gần giá trị nào nhất sau đây?
A. 8,0. B. 9,5. C. 8,5. D. 9,0. (Đề thi tuyển sinh Đại học khối A, năm 2014)
DẠYKÈMQUYNHƠN OFFICIAL 32 2 4 3 3 2 4 2 3 2 2 SO 2 Al 2 Al 1 SO OH 1 Ba Al ddX ddY 41,94 V0,12 n1,5V 0,18 TrongVlítddY: 233 n0,24 n2V n0,18n2V 56,916gamkettua n0,5Vn0,24 TH1 2 2 3 4 2 4 3 2 2 3 4 1 1 BaSO OH Al BaSO 1 Ba 1 1 1 OH 1 Al(OH) 12 1 1 BaSO OH Al :nn0,5V0,18V0,36;n0,723n0,72 nn0,5V 78.2V 233.0,5V 56,916V0,3377 n2V 3 n 33 V:V2,814. TH2:nn0,5V0,18V0,36;n0,723n0 2 4 3 3 BaSOBa 1 1 Al(OH) AlOH 12 12 12 ,72 nn0,18 233.0,1878.(0,962V)56,916V0,384
V:V3,2 V:V2,814hoacV:V3,2
n4nn
Câu 23: Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y, thu được 7,8 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4 , thu được dung dịch chứa 15,6 gam muối sunfat và 2,464 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất của H2SO4). Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 5,04. B. 6,29. C. 6,48. D. 6,96. (Đề thi tuyển sinh Đại học khối A, năm 2014)
DẠYKÈMQUYNHƠN OFFICIAL 33
ng
Al AlH2 AlO23 AlAlOAl(OH) 23 3 O/FeOO/AlO xy 23 2 electrontraoñoiSO2SOtaomuoi 4 Fetrongmuoi 2 muSOtaomuoi 4 2.0,672 n0,02 3n2n 0,06 22,4 n0,04 n2nn 0,1 n n 0,12mol 2.2,464 2n n 2n 0,22 22,4 m 96n m oi FetrongFeOFetrongmuoi 2 xy SOtaomuoi 4 FeOOFe Fetrongmuoi xy 15,6 m m 5,04 n 0,11 mmm0,12.165,046,96gam m 5,04 Câu 28: Có ba dung dịch riêng biệt : H2SO4 1M; KNO3 1M; HNO3 1M được đánh số ngẫu nhiên là (1), (2), (3). - Trộn 5 ml dung dịch (1) với 5 ml dung dịch (2), thêm bột Cu dư, thu được V1 lít khí NO. - Trộn 5 ml dung dịch (1) với 5 ml dung dịch (3), thêm bột Cu dư, thu được 2V1 lít khí NO.
ZCObanñau COphanöngOphanöng electrondokimloainhöôngCOONO 0,030,25m0,04 16 electrondokimloainhöông electrondokimloainhöôNO3 mm 18.2.0,0628.0,06 n n 0,03 16 16 n 2n2n3n n 0,060,03125m nn
muoikimloaiNOtaomuoi 3 mmm 3,08m0,75m62(0,060,03125m)m9,447gam9,5gam
- Trộn 5 ml dung dịch (2) với 5 ml dung dịch (3), thêm bột Cu dư, thu được V2 lít khí NO. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. So sánh nào sau đây đúng? A. B. C. D. 21 V2V. 21 2VV. 21 V3V. 21 VV. (Đề thi tuyển sinh Đại học khối A, năm 2014) Coi 3 phản ứng tương ứng với các thí nghiệm 1 (TN1), TN2, TN3. Bản chất phản ứng là Cu bị oxi hóa trong môi trường H+ . 3NO Quá trình khử : 3 2 4HNO3eNOHO
Câu 33: Điện phân dung dịch X chứa a mol CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của a là A. 0,26. B. 0,24. C. 0,18. D. 0,15. (Đề thi tuyển sinh Đại học khối A, năm 2014)
DẠYKÈMQUYNHƠN
34
OFFICIAL
Nhận thấy khi trộn 2 dung dịch với nhau, không có trường hợp nào . H NO3 n 4 n Suy ra trong các phản ứng đều có dư, H+ hết; tỉ lệ mol khí NO thoát ra ở 3NO các thí nghiệm bằng tỉ lệ H+ trong các thí nghiệm. 3 HôTN2NOôTN2NOôTN2 3 NOôTN1NOôTN1HôTN1 24 2NOôTN3HôTN3 21 1NOôTN1HôTN1 dungdòch(1)laKNO n n V 2dungdòch(2)laHNO n n V dungdòch(3)laHSO n VV 3V3V VV n
Câu 39: Đốt cháy 4,16 gam hỗn hợp gồm Mg và Fe trong khí O2, thu được 5,92 gam hỗn hợp X chỉ gồm các oxit. Hòa tan hoàn toàn X trong dung dịch HCl vừa đủ, thu được dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 6 gam chất rắn. Mặt khác cho Y tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là A. 10,80. B. 32,11. C. 32,65 D. 31,57. (Đề thi tuyển sinh Đại học khối A, năm 2014)
thu được 7,84 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là A. 0,25. B. 0,30. C. 0,15. D. 0,20. (Đề thi tuyển sinh Đại học khối B, năm 2014) Nếu trong Y có kim loại dư. Giả sử có Al dư, theo bảo toàn electron và giả thiết, ta có :
DẠYKÈMQUYNHƠN OFFICIAL 35
O2 H2 etraoñoi 2H
Cu Cu
?0,09
n0,07 0n0,09
n0,15mol
Mg Fe O2 Ag AgC Agpö MgFeO2Agpö 0,07 Cl 0,01 0,055? 2O2ClO 0,055 nx24x56y4,16x0,01 40x160.0,5y6y0,07ny 5,924,16 n 0,055 32 n0,01n0,01;n 2n3n4nn n0,22 n2n4n0,22 l (Ag,AgCl) 0,22 m 32,65gam Câu 45: Cho hỗn hợp X gồm Al và Mg tác dụng với 1 lít dung dịch gồm AgNO3 a mol/l và Cu(NO3)2 2a mol/l, thu được 45,2 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng (dư),
Cl Cl 2Cl 2 ClO O 22 2 etraoñoiClOetraoñoi 22 etraoñoi ClO22 0,1? ClOH 222 n0,5n n0,1 Trongthôigiant(s):nn0,11 n0,01 n2n4nn0,24 ôanot:n0,482n4n Trongthôigian2t(s): ôcaanotvacatot:nnn
22
0,48
CuSO4
,26 Ôcatot:n2n2nn0,15
6: Điện phân có màng ngăn với điện cực trơ 400 ml dung dịch hỗn hợp gồm CuSO4 xM và NaCl 1M với cường độ dòng điện 5A trong 3860 giây. Sau khi ngừng điện phân thấy khối lượng dung dịch tạo thành bị giảm so với ban đầu là 10,4 gam. Giá trị của x là A. 0,2. B. 0,1. C. 0,129. D. 0,125.
DẠYKÈMQUYNHƠN OFFICIAL 36 AlAgCuSO2 2aba Al Ag Cu 2a b a 3nn2n2n0,7 b0,106 27n108n64n45,2a0,203 ì ï++== ï ï ì ï ï=- ï ï Þ í í ï ï + += = ï ï î ï ï ï î Suy ra kim loại không còn dư, Y chỉ có Ag và Cu. Theo bảo toàn electron và giả thiết, ta có : 2 electrontraoñoiSO2AgCupö 2 Ag Cupö n2n n 2n0,7 108n64n 45,2 Ag C2upö n0,3 a0,3 n 0,2 Câu
Cl Cl2
2H 2 2 Cu Cu
2H
2
Cu
Trongphanöngñienphan: BTE:2n2n0,2 n0,05 m64n2n0,1.7110,4n0,05 0,4x0,05x0,125 NGÀY THỨ NĂM – 29/01/2017 Câu 49: Hòa tan hết 10,4 gam hỗn hợp Fe, Mg vào 500ml dung dịch hỗn hợp H2SO4 0,4M và HCl 0,8M thu được dung dịch Y và 6,72 lít H2 (đktc). Cô cạn dung dịch Y thu được m gam muối khan. Giá trị của m là A. 34,2≤ m ≤ 39,2 B. 36,7 C. 34,2 D. 39,2 24 2 22 22 HSOHCl 2 H Cocan 2 4 0,40,2 4 0,2 HHpö muoi Y muoi Mg,Fe Mg,Fe n2nn0,8 SO:0,2 SO:0,2HCl Cl:0,4 n2n0,6 Cl:0,2 H:0,2 m10,40, 2.960,2.35,536,7gam
etraoñoi
ddgiam
H
2
n0,4 ÔanotchæcoClbòoxihoa,n0,1 n 0,2
Câu 7: Cho m gam hỗn hợp CuSO4 và NaCl vào nước thu được dung dịch X. Điện phân X với điện cực trơ, màng ngăn xốp, đến khi trên catot thu được 4,48 lít khí ở (đktc) thì ngừng điện phân. Khi đó thu được dung dịch Y và trên anot thu được 6,72 lít khí ở (đktc). Dung dịch Y hòa tan tối đa 10,2 gam Al2O3. Giá trị lớn nhất của m là: A. 53,25 gam. B. 61,85 gam. C. 57,55 gam. D. 77,25 gam. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đặng Thúc Hứa – Nghệ An, năm 2015)
DẠYKÈMQUYNHƠN
37
OFFICIAL
+
+
ị
X
c Al2O3, chứng tỏ X có chứa hoặc . H OH 22 0,5xmol 2 4 2 ymol0,2mol ddX 4 22 0,5xmol 2 4 ddX Sôñophanöng: anot:Cl,ONa:xmol SO:ymol catot:Cu,H H NaCl:xmol CuSO:ymol anot:Cl,ONa:xmol SO:ymolcatot:Cu OH 2 0,2mol H TH1 TH2 ñpdd
Thứ tự khử trên catot : Cu2+ > H2O; Thứ tự oxi trên anot : 2 ClHO.
Dung d
ch
hòa tan đượ
Câu 12: Cho 39,84 gam hỗn hợp X gồm Fe3O4 và kim loại M vào dung dịch HNO3 đun nóng, khuấy đều hỗn hợp để phản ứng xảy ra hoàn toàn thu được 4,48 lít NO2 sản phẩm khử duy nhất (ở đktc), dung dịch G và 3,84 gam kim loại M. Cho dung dịch NaOH dư vào dung dịch G thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 40 gam chất rắn R. Biết M có hóa trị không đổi trong các phản ứng trên. Phần trăm khối lượng của M trong X gần nhất với giá trị nào
DẠYKÈMQUYNHƠN OFFICIAL 38 3 23 2 2 2 2 2 2 4 23 2 AlO H Al ClO Cl O CuH NaH SO AlO OHAlO TH1: BTÑTBTNT:n3n6n0,6 Ôanot:nn0,3 2.0,5x4(0,30,5x)2y0,4
x0,62y BTÑT:nn2n x0,1
y0,35 TH2:
2 2 2 2 2 2 4 ClO Cl O CuH Na SO OH max Ôanot:nn0,3 20,5x4(0,30,5x)2y0,4BTE:2n4n2n2n x2y0,2 BTÑT:n2nn x0,5
A. 40%. B. 32%.C. 10%. D. 50%. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đặng Thúc Hứa – Nghệ An, năm 2015) 3n 32 232n (FeO,M)pö 34 R VìMcondönentrongYcoM(NO)vaFe(NO);RgomFeOvaMO. m 232xMy39,843,84x0,1 M BTE:ny0,22x My12,832 n m160.1,5x0,5y(2M16n)40ny0,4 n2;M64(Cu)%12,8 Cu y0,2 33,8441,76%gannhatvôi40% 9,84
BTE:2n4n2n2n
m61,85
nn2n0,2
m53,25 y0,15 m61,85
sau đây:
Câu 45: Hòa tan 22 gam hỗn hợp X gồm Fe, FeCO3, Fe3O4 vào 0,5 lít dung dịch HNO3 2M thì thu được dung dịch Y (không có NH4NO3) và hỗn hợp khí Z gồm CO2 và NO. Lượng HNO3 dư trong Y tác dụng vừa đủ với 13,44 gam NaHCO3. Cho hỗn hợp Z vào bình kín có dung tích không đổi 8,96 lít chứa O2 và N2 tỉ lệ thể tích 1 : 4 ở 00C và áp suất 0,375 atm. Sau đó giữ bình ở nhiệt độ 00C thì trong bình
DẠYKÈMQUYNHƠN OFFICIAL 39
không còn O2 và áp suất cuối cùng là 0,6 atm. Phần trăm khối lượng của Fe3O4 trong hỗn hợp X là A. 52,73%. B. 26,63%. C. 63,27%. D. 42,18%. 3 3 3 22 HNOpövôiXHNObanñauNaHCO 2 3 3 33 2 0,84 xy3z 34 Z (N,O) 13,44 n n n0,5.2 0,84. 84 Fe:x CO:yFeCO:yHNOFe(NO) HO NO:(0,843x3y9z) FeO:z n 2 2 22 2 O NOpöO (N,NO,NOdö) NOtaothanh X 8,96.0,375 n0,03 0,15 0,082.273 n2n0,06giam0,03mol 8,96.0,6 n 0,24n 0,06 0,082.273 m56x116y232z22 BTE:3xyz3(0,843x3y9z) 0,15[y(0,843x3y 34FeO
Câu
tỉ khối so với H2 là 15 và dung dịch Y
dịch Y, thu được 59,6 gam muối khan. Giá trị của m là A. 46,6. B. 37,6.C. 18,2.D. 36,4. 22 22 (CO,H) ddHCl ddKCl XddY(CO,H)ddHCl HClKCl 6,72 m .15.29 22,4 0,8.36,5 m 200 59,6 14,6% m 237,6 25,0841% mmmm46,6gam nn0,8
x0,02 y0,06 9z)]0,030,24z0,06 %0,06.232 m .100%63,27% 22
36: Hòa tan hoàn toàn m gam hỗn hợp X gồm K, K2O, KOH, KHCO3, K2CO3 trong lượng vừa đủ dung dịch HCl 14,6%, thu được 6,72 lít (đktc) hỗn hợp gồm hai khí có
có nồng độ 25,0841%. Cô cạn dung
Câu 37: Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa và 3,92 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol của Mg trong hỗn hợp X có thể nhận giá trị nào sau đây? A. 25. B. 15. C. 40. D.
DẠYKÈMQUYNHƠN OFFICIAL 40
2 24 2 2 4 Z 2 HO HSO HOH NH Zgom2khívachöakhíNO(hoanau) NO:xmol Zco H:ymol M18 xy0,175 x0,1 30x2y0,175.183,15y0,075 38,550,725.9896,553,15BTKL:n 0,55 18 2n2n2n BTNTH:n 0,05 4 BTNTN 4 32 2 32 32 3) 2 4 2 NONH Fe(NO) ZnOHONOFe(NO) 3 X Al MgZnOFe(NO) Al Mg AlMgFe(NO NOH Al NH nn :n 0,075 2 BTNTO:nnn6n0,2 NeumuoisattrongYlaFe m27n24nmm38,5527n24n8,85 BTE:3n2nn3n2n8n3n 32 2 4 Mg Al Mg Mg 2 X Al MgZnOFe(NO) Al Mg AlMgNOH AlMg NH 2n0,775 n0,05 0,3125 %n 49% n0,3125 0,050,31250,0750,2 NeumuoisattrongYlaFe m27n24nmm38,5527n24n8,85 BTE:3n2n3n2n8n 3n2n Al Mg Mg Mg 0,85 n0,15 0,2 %n 32% n0,2 0,150,20,0750,2 Kethôpvôiñapansuyra:%n40%
30.
Câu 43: Hòa tan hoàn toàn m gam MSO4 (M là kim loại) vào nước thu được dung dịch X. Điện phân dung dịch X (điện cực trơ, hiệu suất 100%) với cường độ dòng điện 7,5A không đổi, trong khoảng thời gian 1 giờ 4 phút 20 giây, thu được dung dịch Y và khối lượng catot tăng a gam. Dung dịch Y tác dụng vừa đủ với 200 ml dung dịch chứa KOH 1M và NaOH 1M, sinh ra 4,9 gam kết tủa. Coi toàn bộ lượng kim loại sinh ra đều bám hết vào catot. Giá trị của m và a lần lượt là A. 24 và 9,6.B. 32 và 4,9. C. 30,4 và 8,4. D. 32 và 9,6.
NGÀY THỨ SÁU – 30/01/2017
Câu 18: Chom gam hỗn hợp Fe và Cu (Fe chiếm 36% về khối lượng) tác dụng với dung dịch chứa 0,7 mol HNO3 tới khi phản ứng hoàn toàn, thu được0,68m gam chất rắn X, dung dịch Y và 6,72 lít hỗn hợp khí Z (đktc) gồm NO2 và NO. %V của NO trong hỗn hợp Z gần với giá trị nào
DẠYKÈMQUYNHƠN
41
OFFICIAL
2 2 2 2 2 2 2 2 ñpdd 42 242 Mpö etraoñoiMpö Htaothanh HtaothanhMpö M(OH)M H MdöOH M(OH)Mdö BCPÖ:MSOHOMHSOO 7,5.(36004.6020) n0,15 BTE:2nn 0,3 96500 n 0,3 BTÑT:n 2n nnn2nn0,4 nn dö0,05 M4,93464(Cu) 0,05 m(0,150,05).16032 a0,15.649,6
A.
C.
D.
30,7molHNO 2 2 0,68m(g) 0,3mol 32 3 32 0,32m0,7 56 Fe:0,36m(g) NO chatranXHO NO Cu:0,64m(g) XchöaCuvaFedö,muoitaothanhlaFe(NO). BTNTFe,H:FeHNOFe(NO) 2 2 2 22 0,3 0,32m 56 NONO NO NO NONO NONOHO 2.0,32mBTNTN:0,7 0,3 56 nn0,3 n0,05(16,67%17% m35 2.0,32.35 n0,25 3nn 0,4 56
nhất?
34%. B. 25%.
17%.
50%.
Câu 18 (khó): Hòa tan 11,6 gam hỗn hợp M gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí R (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe, Cu trong M và giá trị của V lần lượt là A. 72,41%; 27,59% và 5,6
OFFICIAL
DẠYKÈMQUYNHƠN
42
2 T
2 3 H100% 23 m42,541,05GiasöTchöaKNOnn0,5 TconchöacaKOH(1) K:0,5 xy0,5 x0,45(2) Ttaobôicacion: 46x17y21,55y0,05NO:x;OH:y ZcoK,NO,OHdö (1) Fe,Cu FeO,C 3 2 3 2 honhôp Fe Cu FeCu Fe Fe Cu Cu Fe CuNOtrongX 322 3 Fe m56n64n11,6 1611,6uOBTE:3n2n2. 16 n0,15%m72,41% (3) n0,05%m25,59% 3n2nn 0,45 T(2) ö (3)VayXcoFe,Fe,Cu,NO n 3 2 2 3 2 3 3 ab 3 2 3 Fe Fe Fe FeNO Cu Fe 3 3 2 ab 0,45mol0,35mol 0,7mol NO HNO HO NO N ab O n0,15 n0,1 2n3nn2n0,35n0,05 BTNTH:HNONOHONO BTKL:mmmm9,9 n0,70,450,25 TrongNOco9,90, n 1,6 1,6 3,2 ab 1,6 NO NO NONO.2514 0,4 16 BTE:0,1.20,05.30,05.2(53,2)nn0,255,6lít
B. 48,28%; 51,72% và 6,72 C. 67,59%; 32,41% và 4,48 D. 57,93%; 42,07% và 8,96
2KNOKOH
43
DẠYKÈMQUYNHƠN OFFICIAL
DẠYKÈMQUYNHƠN OFFICIAL
Câu 42: Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO3)2 (điện cực trơ, màng ngăn xốp) sau một thời gian thu được dung dịch X, khối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào X đến khi các phản ứng xảy ra hoàn toàn, khối lượng thành sắt giảm 2,6 gam và thoát ra khí NO (sản phẩm khử duy nhất của N+5). Giá trị của x là A. 0,2. B. 0,3. C. 0,5. D. 0,4. (Đề thi thử THPT Quốc Gia lần 2 – THPT Thị Xã Quảng Trị, năm 2015)
1
DẠYKÈMQUYNHƠN OFFICIAL 2 2 2 2 3 3 2 Thötöoxihoatrenanot:ClHO;thötökhötrencatot:CuHO.
NO,Na NO,Na Xchöa hoac H,Cu H TH1:Öngvôitröônghôpna 2 2 2 2 3 2 2 CuCl O ddgiam OH/X Cu NO Na ytathay: ôanotthuñöôcCl(0,1mol),O(ymol) ôcatotthuñöôcCu,BTE:nn2n(0,12y)mol m0,1.7132y64(0,12y)21,5y0,05 n4n4y0,2 nx(0,12y)(x0,2) n2x n0,2 2 3 Fe 0,2:40,05 2 ddX Fe NO:2x0,05 CuNOddNa:0,2 Fe:? 2x0,25 2x0,25 n m56 64(x0,2)2,6x0,4 2 2 TH2:Öngvôitröônghôpnaytathay: ôanott 3 2 2 2 ddgiam 3 NO Fe Na (2x0,2):4 H ddX huñöôcCl(0,1mol),O(ymol) ôcatotthuñöôcCu(xmol),H(zmol) BTE:0,124y2x2z (*)m0,1.7132y64x2z21,5 NO:2 n2x n0,2 NOdd n2x0,2 2 2 thanhFegiam Fe 2x0,2 x 4 Na:0,2 Fe:? 1,5x0,15 1,5x0,15 n m 56 2,6x0,16 2 2 Thayx0,16vao(*)taco: 0,1.24y2.0,162z y0,1188(thoama 0,1.7132y64.0,162z21,5z0,1777 n).
FeddX,sauphanöngthaykhoilöôngthanhgiam,suyra:
Câu 47: Hòa tan hết 23,76 gam hỗn hợp X gồm FeCl2, Cu và Fe(NO3)2 vào 400 ml dung dịch HCl 1M, đến khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho từ từ dung dịch chứa AgNO3 1M vào Y đến khi phản ứng hoàn thấy dùng hết 580 ml, thu được m gam kết tủa và thoát ra 0,448 lít khí (đktc). Biết NO là sản phẩm khử duy nhất của N+5 trong cả quá trình, giá trị của m gần nhất với giá trị nào sau đây?
DẠYKÈMQUYNHƠN OFFICIAL 3
A.
(Đề thi thử THPT Quốc Gia lần 2 – THPT Thị Xã Quảng Trị,
X 2 32 X,m23,76gam 23 3 2 2 3 ddY ddZ Sôñophanöng: NO FeCl:x Cu:y NO:0,02mol Fe(NO):z Fe,Fe Fe:(xz) Cu,H Cu:y Cl NO Ag AgCl 3 3 2 NOô(2) AgNONOô(2) H/Y NO/Z HClH/Y NOô(1) X AgClFeClHCl n4n0,08 nnn0,56 nn 0,08 z 0,04 n 0,08 2 4 m127x64y0,0418023,76x0,08 y0,1BTÑTtrongZ:3(x0,04)2y0,56 BTNTCl:n2nn0 3 (Ag,AgCl) AgAgNOAgCl ,56 m 82,52gannhatvôi82 BTNTAg:nnn0,02 (1)HCl 0,4mol (2)AgNO 0,58mol 3
82. B. 84. C. 80. D. 86.
năm 2015)
Câu 41. Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2, thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng, thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z, thu được 73,23 gam kết tủa. Mặt khác, hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5%, thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ phần trăm của Fe(NO3)3 trong dung dịch T gần nhất với giá trị nào sau đây?
DẠYKÈMQUYNHƠN
4
OFFICIAL
D.
3 22 2 2 2 2 AgNOdö (Cl,O) HCl 2 0,13mol X,m(g) Y,(m6,11)g 73,23(g) Zco2muoi OCl O Cl CuCl Cu oxit AgCl TN1: Fe muoi ... ... nn0,13 32n71n6,11 2 2 2 2 2 2 2 O O Cl HClO AgClClHCl FeCl/ZAg Ag CuCl n0,08n0,16 n0,05n2n0,32 BNTNCl:n2nn0,42nn0,12 73,230,42143,5 0,420,122 n 0,12 n 0,09 108 2 m0,12.560,09.6412,48 Cu TN2: Fe 3 3 33 32 32 33 HNO 32 2 31,5% 0,15mol 32 X,m(g) HNO Fe(NO) Fe(NO) Cu(NO)NO F Fe(NO):xmol Fe(NO):ymolNOHO Cu(NO):0,09mol BTE:3x2y0,09.20,15.3x0,03 BTNTFe:xy0,12 y0,09 BTNTN:n3n2n2nn0,6 C% 33e(NO) 0,03.242 5,67%gannhat5%12,480,6.63:31,5%0,15.30
A. 5%. B. 7%. C. 8%.
9%.
Câu 50. Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4 +) và hỗn hợp khí gồm NO và 0,3 mol NO2 Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng khôi đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây?
A. 19,0. B. 21,0. C.18,0. D. 20,0.
5
DẠYKÈMQUYNHƠN OFFICIAL
DẠYKÈMQUYNHƠN OFFICIAL 6 2 2 2 4 2 3 ddZ 23 2 4 3 ddX 3 2 Sôñophanöng: NO:0,3 NO:z Na:0,26 CuS:x SO:x2y FeS:y NO:0,520,3z Cu,Fe H,SO NO Fe(OH) Cu(OH) 23 6,4(g) 2 3 2 4 3 FeO CuO BTNTFe,Cu:2x.800,5y.1606,4x0,03 BTE:10x15y3z0,3 y0,02 BTÑT/Z:0,262(x2y)(0,22z)z0,1 Cu:0,06mol Fe:0,02mol Xco:SO:0,07mol NO:0,12mol H:?mol H chattan/X BTÑT:n0,08 m19,2gannhatvôi19 Câu 48: Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư, thấy có 0,7 mol axit phản ứng và còn lại 0,35a gam chất rắn
tan.
khử hoàn toàn a gam hỗn hợp A bằng H2 dư, thu được
lượng Cu trong
A gần
HNO
3 NaOH
không
Mặt khác,
34,4 gam chất rắn. Phần trăm khối
hỗn hợp
nhất với giá trị nào sau đây?
0,52
0,26
DẠYKÈMQUYNHƠN OFFICIAL 7 A. 25,0%. B. 16,0%. C. 40,0%. D. 50,0%. 34 2 23 2 A,ma(g) A 2 TN1: Cu:0,35a(g) FeO FeCl:x FeO CuCl:y Cu HO 34 H2 23 2 to 34,4(g) A,ma(g) A TN2: FeO Fe FeO HO Cu Cu O/AHO HCl 2 Cudö (Cu,Fe) Cu/A TN1:nn0,5n0,35a0,35.1634,440 TN1:m0,354014 TN1:m34,4 T56x64y34,41420,4x0,25 N1: xy0,35 y0,1 %140,1.64 m 451%gannhatvôi50% 0 HCl 0,7
Câu 27: Cho một luồng khí O2 đi qua ống đựng 63,6 gam hỗn hợp kim loại Mg, Al và Fe nung nóng thu được 92,4 gam chất rắn X. Hòa tan hoàn toàn lượng X trên bằng dung dịch HNO3 (dư). Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y và 3,44 gam hỗn hợp khí Z. Biết có 4,25 mol HNO3 tham gia phản ứng, cô cạn cẩn thận dung dịch Y thu được 319 gam muối. Phần trăm khối lượng của N có trong 319 gam hỗn hợp muối trên là A. 18,082%. B. 18,125%. C. 18,038%.
3 HNOdö pö:4,25mol
nhiệt nhôm hỗn hợp X gồm (Al và Fe2O3) trong điều kiện không có không khí đến phản ứng hoàn toàn thu được hỗn hợp Y. Chia Y thành hai phần.
- Phần một: cho tác dụng với dung dịch NaOH (dư), thu được 0,896 lít khí (đktc) và còn lại chất rắn không tan chiếm 44,8% khối lượng phần một.
- Phần hai: cho tác dụng với dung dịch HCl (dư), thu được 2,688 lít khí (đktc). Khối lượng nhôm đem trộn là A. 8,1 gam. B. 7,2 gam. C. 5,4 gam. D. 4,5 gam.
DẠYKÈMQUYNHƠN OFFICIAL 8
+ Sơ đồ phản ứng: 2 o X
O t 63,6(g) X,m92,4(g) 23 cocan 3 3 319(g) 4 Y hhZ Mg,Al oxit Fe kimloai Mg,Fe Al,NO hhmuoi NH 2 3 2 3 2 4 4 3 3 4 3 4 HOXHNOmuoiZ HO HNO HO NH NH N/muoi NO (ionkimloai) NO NH N/muoi NONH N/muoi BTKL:18nmmmmn2,095 n0,015 BTNTH:n2n4n n4,115;m57,82 62n18nm 319 57,82 m14(nn) %m 18, 319 125% Câu
ứng
D. 18,213%.
3,44gam
32: Thực hiện phản
và Cu rồi nung nóng tới phản ứng hoàn toàn thấy khối lượng chất rắn tăng 5,12 gam và thu được m gam hỗn hợp oxit. Mặt khác, cho hỗn hợp kim loại trên vào dung dịch HNO3 thu được 2,688 (lít) khí NO đktc (sản phẩm khử duy nhất) và 2m/7 gam chất rắn chỉ chứa một kim loại. Giá trị m gần nhất với
DẠYKÈMQUYNHƠN OFFICIAL 9 o 2 23 2 t,H100% chiathanh 1 (1) 23 2 X NaOH 2 23 (2) H AlOFeO Al 1 Fe P1:mgam Al Y FeO P2:mgam P1HYchöaAl,Fe,AlO;chatranthuñöôctö(2)laFe. 2n0,08nnBTE:n 33 0,448m n 56 3 23 23 1 Fe 1 1 1 AlO Fe AlAlOFe 1 Al/P1 Al Fe Al/P1 00,224m ,5n 56 1020,224m 27.0,08 m 0,448m 3 56 n0,02;n0,04;Ycon:n:n4:3:6 m5 0,08 m270,02.31,8 3 n4x;n6x x0,01 P2: mBTE:3.4x2.6x2.0,12 Al/P2 Al/X :m2:3 1,8.3m1,824,5gam Câu
3 dư vào
A.
3 3 3 O (Cu,Fe) O 23 (1) mgam electrontraoñoi chatrantang 2 HNO 2 (2) 3 (m5,12)g m(m5,12);m5,12(Cu,Fe)(CuO,FeO) 6.5,12 n 0,64 m 5,12gam 48 Cu:xmol Cu TN2: Fe:ymol Fe NO 0,12mol2m/7(g) (Cu,Fe)pö NOCudö m 56x64y(m5,12)2m/7x0,08 BTEcho(2):2x2y0,12.3 y0,1 22m m22,4gannhatvôi20 BTEcho(1),(2):3x2y 0,64 7.64
31: Cho O
bình kín chứa hỗn hợp Fe
15,0. B. 20,0. C. 25,0. D. 26,0.
Câu 38 (hay): Hỗn hợp X gồm khí Cl2 và O2. Cho 4,928 lít X (ở đktc) tác dụng hết với 15,28 gam hỗn hợp Y gồm Mg và Fe, thu được 28,56 gam hỗn hợp Z. Các chất trong Z tác dụng hết với dung dịch HNO3 loãng (dùng vừa đủ), thu được dung dịch T và 2,464 lít khí không màu hóa nâu trong không khí (là sản phẩm khử duy nhất và ở đktc). Khối lượng muối khan thu được khi cô cạn dung dịch T là A. 73,34 gam. B. 63,9 gam. C. 70,46 gam. D. 61,98 gam.
Câu 41: Hoà tan bột Fe vào 200 ml dung dịch chứa NaNO3 và H2SO4. Sau phản ứng hoàn toàn thu
DẠYKÈMQUYNHƠN
10
OFFICIAL
22 X,n0,22 3 X o Y Z (Cl,O) 23 HNO (2) t(1) 0,11mol 3
T
C Sôñophanöng: muoi Mg,Fe Mg:x oxit NO Fe:y Cl,NO ... n 2 2 2 2 2 2 3 lO Cl Cl O O Y NO muoi/T n0,22 n0,16 71n32n28,5615,28n0,06 BTEcho(1),(2):2x3y0,16.20,06.40,11.3x0,1 m24x56y15,28 y0,23 BTÑTchoT:0,1.20,23.30,16.2n BTKL:m15,280,32. 3 3 NO NO muoi/T
chất rắn
A.
B.
2 3 2 2 NO H NaNONO 3 3 2 324 Na NOH Fe n2x;nx3x0,3x0,1nn0,2. Tínhoxihoa:NO/HH XkhongcoNO Fe(NaNOHSO)chatran...Fedö,XchæcoiondöôngFe n0,2 3n2n0,2.30,1.2XchöaBTE:n 0,4 2 2 BTÑT 2 2 4 Fe Na SO cocan 2nn0,4.20,2 :n 0,5 2 2 X0,2.230,4.560,5.9675gam
Y,m15,28(g)
Z,m28,56(g)
n0,57 35,562nm61,98
được dung dịch X; 6,72 lít hỗn hợp khí Y (đktc) gồm NO, H2 có tỉ lệ mol 2 : 1 và 3 gam
không tan. Biết dung dịch X không chứa muối amoni. Cô cạn dung dịch X thu được khối lượng muối khan là
126 gam.
75 gam. C. 120,4 gam. D. 70,4 gam.
Câu 23: X là hỗn hợp chứa Fe, Al, Mg. Cho một luồng khí O2 đi qua 21,4 gam X nung nóng, thu được 26,2 gam hỗn hợp rắn Y. Cho toàn bộ Y vào bình chứa 400 gam dung dịch HNO3 (dư 10% so với lượng phản ứng). Sau khi các phản ứng xảy ra hoàn toàn thấy có NO và N2 thoát ra với tỉ lệ mol 2 : 1. Biết khối lượng dung dịch Z sau phản ứng là 421,8 gam, số mol HNO3 phản ứng là 1,85 mol. Tổng khối lượng các chất tan có trong bình sau phản ứng gần nhất với A. 156. B. 134. C. 124. D. 142. + Sơ đồ phản ứng:
DẠYKÈMQUYNHƠN
11
OFFICIAL
ddZ 2 o X Y 3 43 3n 2
quyñoi O t
2 HNOdö NHNO M(NO) HO Fe,Al oxit M Mg kimloai NO:2x N:x 2 2 2 3 2 43 2 2 43 O O HNO NO N NHNO O 0,1 1,85 0,3 0,05 ? eMnhöông NO N NHNO O 0,1 0,3 0,05 ? BTKL:16n21,426,2 n0,3 BTKL:2x.3028x26,2400421,8x0,05 BTH:n2n4n12n10n BTE:n 2n3n10n8n 43 3 3 43 3n NHNO eMnhöông NO/Z chattantrongZHNOdöNHNOM(NO) 1,8510%630,02580(21,41,662) n0,025 n 1,6 n1,6mol m mmm123,7655gannhatvôi134 3ddHNO 400(g)
Z,m421,8(g)
X,m21,4(g) Y,m26,2(g)
Câu 12. Cho 33,35 gam hỗn hợp X gồm Fe3O4, Fe(NO3)3, Cu tan hoàn toàn trong dung dịch chứa 0,414 mol H2SO4 (loãng), thu được khí NO sản phẩm khử duy nhất và dung dịch Y chỉ chứa 2 muối. Cho bột Cu vào dung dịch Y thấy phản ứng không xảy ra. Cô cạn Y thu được m gam muối khan. Giá trị của m là A. 65,976.
75,922. C. 61,520. D. 64,400.
DẠYKÈMQUYNHƠN OFFICIAL 12
24 X 4 4 34 HSO 4 33
4 Y X,m33,35(g) CuSO Ychöa2muoi Yco YkhongphanöngvôiCu FeSO Sôñophanöng: FeO:x CuSO:z Fe(NO):y FeSO:(3xy) Cu:z 34 33 2 X 2 4 CuFeOFe(NO) NO muoi/Y NOHO m 232x242y64z33,35 BTSO (3xy)z0,414 2z2xy3.3yBTE:2n2nn3n x0,069 y0,023m64,4gam z0,184 Câu
khối lượng) vào nước, thu
1M vào X đến
thúc, thu được m gam kết tủa. Giá trị của m là A. 0,990. B. 0,198. C. 0,297. D. 0,495. 2 2 2 ZnOO 2 2 ñt() HOHH/HO 2 2 HCl 2 2 0,088 2 Na,K,Ba 4,667.5,14% nn 0,015 16 XchöaZnO:0,015 nnn2n0,064 OH:0,034 Na,K,Ba Na,K,Ba ZnO:0,015 Cl:0,088 0,0880, OH:0,034 Zn: 2 2 0,003mol Zn(OH) Zn(OH) 064 0,012 2 m0,297gam
B.
0,414mol
24: Hòa tan hết 4,667 gam hỗn hợp Na, K, Ba và ZnO (trong đó oxi chiếm 5,14%
được dung dịch X và 0,032 mol khí H2. Cho 88 ml dung dịch HCl
khi các phản ứng kết
Câu 24 : Hỗn hợp X gồm các chất CuO, Fe3O4, Al có số mol bằng nhau. Thực hiện phản ứng nhiệt nhôm 33,9 gam X trong môi trường khí trơ, sau một thời gian thu được hỗn hợp chất rắn Y. Cho Y tác dụng hết với dung dịch HNO3 dư, thu được hỗn hợp sản phẩm khử Z chỉ gồm NO2, NO có tổng thể tích 4,48 lít (đktc). Tỉ khối của Z so với heli là A. 10,5.
14: Hỗn hợp X gồm Al, Al2O3, Fe3O4, CuO, Fe và Cu, trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 gam X nung nóng, sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với H2 bằng 18. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HNO3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có muối NH4NO3 sinh ra) và 4,48 lít (đktc) hỗn hợp khí T gồm NO và N2O. Tỉ khối của T so với H2 là 16,75. Giá trị của m là A. 96,25. B. 117,95. C. 80,75. D. 139,50. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Đại học Vinh – Nghệ An, năm 2015) + Sơ đồ phản ứng:
DẠYKÈMQUYNHƠN OFFICIAL 13
D. 19,0. 34 o 3 CuOAlFeO 33 HNOdö t 34 32 23 2 33 Y Z X 33,9 nnn 0,1mol. 8027232 Sôñophanöng: Fe(NO) CuO Fe,Cu NO FeO Cu(NO) AlO,... NO Al Al(NO) C 2 2 2 34 34 3 NONO NONO Z NONO AlFeO Z/He hatkhölaAl,FeO;chatoxihoalaHNO nn0,1 nn0,2 0,1.300,1.46BTE:3nn3nn0,4M 38 0,2 d38:49,5
B. 21,0. C. 9,5.
Câu
DẠYKÈMQUYNHƠN OFFICIAL 14 2 Z 23 32 34 3 3 X 23 Y 2 T CO CO Al,AlO Fe,Cu Fe,FeO Al,NO Cu,CuO Cu,Fe AlO,... NO NO 2 2 2 O/X O/X (ionFe,Al,Cu)/X Z 2 Z OtrongY m35,25.20,4255%7,2 n0,45(1) m 35,257,228,05 CO:xBTNTC:xy0,3x0,15 M36ZgomCO:ym28x44y0,3.36y0,15(2) (1)va(2)n 0,450,150,3. Tco 2 2 2 2 3 2 3 NONO NO NO NO NO HNO NO NO O/Y muoi NO/muoi nn0,2 n0,15 n0,0530n44n0,216,752 n2n4n10n1,7 m28,051,4562117,95 n 1,70,150,05.21,45 Câu 1: Hoà tan hỗn hợp X gồm Cu và Fe2O3 trong 400 ml dung dịch HCl a mol/lít được dung dịch Y và còn lại 1 gam đồng không tan. Nhúng
dịch Y, sau khi phản ứng xong,
ban đầu và có 1,12 lít
đều
o CO t 3 HNOdö
thanh Mg vào dung
nhấc thanh Mg ra thấy khối lượng tăng 4 gam so với
khí H2 (đktc) bay ra. (Giả thiết toàn bộ lượng kim loại thoát ra
bám vào thanh Mg). Khối lượng của Cu trong X và giá trị của a là:
DẠYKÈMQUYNHƠN OFFICIAL 15 A.
gam và 1. B.
2. C.
và
D.
(Đề thi thử THPT
– THPT chuyên Nguyễn Huệ – Hà
+ Sơ đồ phản ứng: 23 X 2 Mg 2 2 2 Y Cudö Cu FeO CuCl Cu FeCl HMgCl Fe HCl 2 2 23 2 2 2 2 Cupö CuCl FeCl FeO MgpöHCuClFeCl thanhMgtang Cu HClMgCl nxBTE:2x2y Ñat ddYconx;n2x.ny nnnn(0,053x) x0,05. m 64x56.2x24(0,053x)4 m0,05.6414,2 n2n0,4a1 HCl
4,2
4,8 gam và
1,0 gam
1
3,2 gam và 2.
Quốc Gia lần 3
Nội, năm 2015)
Câu 20: Hoà tan 14,2 gam hỗn hợp X gồm MgCO3 và một muối cacbonat của kim loại M vào một lượng vừa đủ axit HCl 7,3%, thu được dung dịch Y và 3,36 lít khí CO2 (đktc). Nồng độ MgCl2 trong Y là 6,028%. Cho dung dịch NaOH dư vào dung dịch Y, lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thì thu được m gam chấy rắn. Giá trị của m là A. 7,6. B. 10,4.C. 8,0. D. 12,0.
Câu 49: Điện phân (điện cực trơ, có màng ngăn) 2 lít dung dịch gồm CuSO4 và 0,01 mol NaCl đến khi cả 2 điện cực đều thoát ra 448ml khí (đktc) thì ngừng điện phân. Giả sử nước bay hơi không đáng kể trong quá trình điện phân. Giá trị pH dung dịch sau điện phân là
DẠYKÈMQUYNHƠN OFFICIAL 16
(Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Nguyễn Huệ – Hà Nội, năm 2015) 2 3 2 2 3 23n 2 323n 2 3 2 2 HClCO ddspö MgCOMgCl CO M(CO) M CO/M(CO) 2HCOCOHOn2n2.0,150,3. 0,336,5m14,2 0,15.44157,6 7,3% 6,028%.157,6BTMg:nn 0,1 95 2n0,1 m 5,8 n nn n 0,150,10,050,1M5, n 23 chatran 80,05602,8 MgO:0,1mol;FeO:0,025mol n2 M 28 Chatrangom
n M56(Fe)
B. 1,7. C. 1,2. D. 2,0. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Nguyễn Huệ – Hà Nội, năm 2015) 2 2 2 2 2 2 2 2 2 2 2 electrontraoñoi H Cl O Cu O ? 0,02 ?0,005 khíôanotClO Cu ?0,005 Thötöoxihoatrenanot:ClHO;thötökhötrencatot:CuHO. n 2n2n2n4n n0,015 nnn0,02 n0,015 n ddsauñienphanco: 2 2 4SO Cu Na H n0,015 [0,02 H] 0,01 2 n0,01 pH2n0,015.20,010,02
m8
A. 1,4.
Câu 18: Hòa tan hoàn toàn 12,84 gam hỗn hợp gồm Fe, Al và Mg có số mol bằng nhau trong dung dịch HNO3 loãng (dư), thu được dung dịch X chứa 75,36 gam muối và hỗn hợp khí Y gồm N2, N2O, NO và NO2. Trong Y, số mol N2 bằng số mol NO2. Biết tỉ khối của Y so với H2 bằng 18,5. Số mol HNO3 đã tham gia phản ứng là A. 1,275 mol. B. 1,080 mol. C. 1,140 mol. D. 1,215 mol. (Đề
DẠYKÈMQUYNHƠN OFFICIAL 17
– Đăk Nông, năm 2015) 22 Y' Y AlFeMg 2 quyñoi(chuyen1OtöNOsangN) 2 2 2 Y',M37 Y,M37 12,84 nnn 0,12 275624 N:amol NO NO:amol NO NO,NO n Södungsôñoñöôngcheosuyra: 2 3 3 NO NO 33 HNO 2 2 3 2 4 X NO/X muoi 37301 n44371 Al,Fe Al NO:x Fe Mg,NO HO NO:x Mg NH:y BTE:8x3x8y0,12.30,12.30,12.20,96 n0,96y m12,8462(0,96y)18y 3 2 3 4 HNO NONO NONH x0,06 y0,0375 75,36 nnnn2n1,251
thi thử THPT Quốc Gia lần 1 – THPT chuyên Nguyễn Chí Thanh
Câu 25: Hòa tan hết hỗn hợp X gồm 0,01 mol Cu2S; 0,04 mol FeCO3 và x mol FeS2 bằng dung dịch HNO3 vừa đủ. Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít (đktc) hỗn hợp hai khí, trong đó có một khí màu nâu đỏ và dung dịch Y chỉ chứa muối của Cu2+, Fe3+ với một anion. Giá trị của V là A. 47,488. B. 46,592. C. 51,072. D. 50,176. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Nguyễn Chí Thanh – Đăk Nông, năm 2015)
DẠYKÈMQUYNHƠN OFFICIAL 18
3 3 2 HNO 2 2 3 2 2 4 2 X Y CuS:0,01 Fe:(0,04x)
CO:0,04
FeS:x BTÑTchoY:3(0,04x)0,02.22(0,012x)
2 3 2 2 2 NOFeCO CuS FeS NO x0,14 :nn10n15n n2,24 V22,4(2,240,04)51,072lít
NO(nauño) FeCO:0,04 Cu:0,02
SO:(0,012x)
BTE
Câu 2 : Cho 29,64 gam hỗn hợp X gồm FeO, Fe(NO3)2, Al, Zn trong đó số mol Al bằng số mol Zn tan hoàn toàn trong dung dịch hỗn hợp chứa 1,16 mol KHSO4. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 179,72 gam muối sunfat trung hòa và 6,72 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 1,9. Phần trăm khối lượng của Al trong hỗn hợp
DẠYKÈMQUYNHƠN OFFICIAL 19
2 2 2 Z 2 HNO H H NO NO 32 4 1,16mol 29,64gam H M1,9.47,6 Zgom NO Zgom2khítrongñocoNO(hoanau) nn0,3 n0,24 2n30n0,3.7,62,28n0,06 Sôñophanöng: FeO Fe(NO)KHSO Al,Mg 2 4 32 233 2 2 2 4 4 ?mol 2,28gam 179,72gam HO NH Fe(NO) Fe,Fe,AlHHO NH,SO NO 29,641,16.136179,722,28BTKL:n 0,3 18 1,160,2420,32BTH:n 0,02 4 0,060,02BTN:n 0,04 2 BTO:n FeO Alzn Al 0,30,060,04.60,12 x0,15 nnx %m13,664%27x65x29,640,04.1800,12.72 Câu 7 : Cho m gam hỗn hợp X gồm CuS; Fe3O4; Cu có tỉ lệ mol 1:1:2 vào dùng dịch HCl dư, sau khi phản ứng kết thúc lấy chất rắn không tan Y cho tác dụng với dung dịch H2SO4 đặc nóng (dư), thu được V lít khí SO2 (đktc). Hấp thụ hết khí SO2 vào 500 ml dung dịch hỗn hợp NaOH 1M và KOH 0,8M thu được dung dịch chứa 67,2 gam chất tan. Giá trị của m là A. 36,48. B. 45,60. C. 47,88. D. 38,304.
X là A. 13,664%. B. 14,228%. C. 15,112%. D. 16,334%.
HSO(KOH,NaOH)chattanHOHy0,539 (loai)
DẠYKÈMQUYNHƠN OFFICIAL 20 24 FeOCupö 34 HSOñac HCldö
34
Y X 2 23 ymol y Sôñophanöng: CuS:x Cu:x FeO:x
CuS:x Cu:2x
2 mol 23 0,9 0,4 0,5 y HOH CuCuSSO X (KOH,NaOH) TH1:KOH,NaOHhet:
nn
BTE:2n8n2nx0,1m46,5gam T 23 2y 0,4 0,5 y HOH H1:KOH,NaOHdö:
nn
NaOH:0,5
2 BTE:nn KOH:0,4 67,2(g) ymol
SO chattan
SO(KOH,NaOH)HSO
HSO(KOH,NaOH)chattanHOHy0,5 (thoaman)
82y0,4.560,5.4067,20,9.18
82y0,4.560,5.4067,22y.18
Câu 18 : Hỗn hợp X gồm Al, Fe3O4, FeO, Cu2O trong đó oxi chiếm 17,827% khối lượng hỗn hợp. Nếu cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng (dư), thu được 8,736 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng (dư), thu được 4,48 lít NO (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 145,08 gam muối khan. Giá trị của m là
DẠYKÈMQUYNHƠN
21
OFFICIAL
A. 46,15 B. 42,79 C.43,08 D. 45,14 24 2 quyñoi 34 2 X' X,m(g) HSOñac 24n 2 2 X' electronMnhöôngOSO Al,FeO M:0,82173m(g) O:0,17827m(g) FeO,CuO M TH1: M(SO)SOHO O 2.0,17827m n 2n2n 1 3 Y 4 3 4 n 3 4 n HNO 4 2 0,2mol 3 X' Y,m145,08(g) electronMnhöôngO NO NH electronMnhöôngNO/Y NH muoiM NO NH 0,78 6 M M TH2: NH:xNOHO O NO n 2n8n3n nn n mmmm 0,788x0,6 0, x0,0225 2.0,17827m82173m6210,78x18x145,08m43,08 6
Câu 26 : Hỗn hợp gồm m gam các oxit của sắt và 0,54m gam Al. Nung hỗn hợp X trong chân không cho đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp Y. Cho hỗn hợp Y tác dụng với dung dịch NaOH dư thu được V lít H2 (đktc); dung dịch Z và chất rắn T. Thổi khí CO2 dư vào dung dịch Z thu được 67,6416 gam kết tủa. Cho chất rắn T tác dụng với dung dịch HNO3 dư, thu được 1,22V lít hỗn hợp khí NO và NO2 (đktc) có tỉ khối so với hiđro là 17. Giá trị của V là
DẠYKÈMQUYNHƠN
22
OFFICIAL
A. 11,25 B. 12,34 C.
D
o o 2 xy t NaOH 2 H100% X 2 CO xyt 23 3 100% 2 Y Y X FeO YHYcoAldö. Al Sôñophanöng: H:Vlít FeO AlO NaOH Al(OH) NaAlO Fe,Al Al 3 0,8672mol HNOdö Z 2 M34 NO Fe :1,22Vlít NO 3 2 1,25 AlAl(OH) YX Al/YH Al/Y Fe/Y 2,52quyñoi 1,25 2 M34 Fe/Y NO 0,8672.27BTNTAl:nn0,8672m 43,36 0,54 mmm0,54m66,7744gam. BTE:3n2n 2V 2,5 n ;n 322,4 (NO,NO) NO BTE:3n(52,5)n 23 AlO/Y 1,22V 322,4 1 2V n 0,8672 2 3.22,4 27.2V56.2,5.1,22V102 2V 0,8672 66,7744V12,34 3.22,43.22,42 3.22,4 NaOHdö
13,32
. 14,56
Câu 26: Hỗn hợp X gồm Fe2O3 và Cu. Cho m gam hỗn hơp X tác dụng với dung dịch HCl vừa đủ, thu được dung dịch chứa 122,76 gam chất tan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 loãng vừa đủ, thu được dung dịch Y chứa 3 chất tan với tỉ lệ số mol 1:2:3. Dung dịch Y làm mất màu tối đa bao nhiêu gam KMnO4 trong môi trường axit sunfuric? A. 6,162 B. 5,846 C. 5,688 D. 6,004
Câu : Dung dịch X chứa 14,6 gam HCl và 22,56 gam Cu(NO3)2. Thêm m gam bột sắt vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp kim loại có khối lượng là 0,628m gam và chỉ tạo khí NO (sản phẩm khử duy nhất của N+5).
DẠYKÈMQUYNHƠN OFFICIAL 23
24 CuFeO23 3 24 4 HSOloang 23 4 BTE:nn 243 X Y 23 XHSOYchöa3chattanChæcomotphanFeoxihoaCu. FeSO:2xmol FeO CuSO:xmol Cu Fe(SO):3xmol FeO Cu 4 4 4 4 2 HCl 2 3 X 122,76gam 424 FeSO KMnO KMnO KMnO FeCl:2xmol CuCl:xmol2x.127135x162,5.6x122,76 FeCl:6xmol x0,09. BTEchoYKMnO/HSO: n5nn0,036m5,688gam
Quốc
Nội, năm 2015) 2 3 Fe 3 m(g) 2 2 X Y H NO Fe/Y NO/Y Cu/XFebñ 0,1264 Cl,NO HCl:0,4 Fedö NO Cu(NO):0,12 Cu Fe n n 0,1 0,40,14 n 0,27. 4 2 n0,12.20,10,14 BTKL:mm (Fedö,Cu)Fe/Y 0,2756 m 0,628m m mm20gam
Giá trị của m là A. 14,88. B. 1,92.C. 20,00. D. 9,28. (Đề thi thử THPT
Gia lần 1 – THPT Chúc Động – Hà
Câu : Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4, FeS2 cần dùng 0,6 mol O2, thu được 0,4 mol Fe2O3 và 0,4 mol SO2. Cho m gam hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là SO2 thì số mol H2SO4 tham gia phản ứng là bao nhiêu?
Câu : Cho m gam Mg tác dụng với dung dịch hỗn hợp Cu(NO3)2 và H2SO4 đun nóng, khuấy đều để phản ứng xảy ra hoàn toàn, thu được dung dịch X, 0,896 lít (đktc) hỗn hợp khí Y trong đó có một khí hóa nâu khi để ngoài không khí có tỉ khối so với He là 4 và 1,76 gam hỗn hợp 2 kim loại không tan có cùng số mol. Giá trị của m là
A. 4,08. B. 2,16. C. 1,68. D. 3,6.
DẠYKÈMQUYNHƠN OFFICIAL 24
23 2 23 2 2 X' Fe/XFeO 23 Quyñoi S/XSO 34 2 O/XFeO SO O X' X X',m n2n0,8 FeO,FeO Fe:0,8 nn0,4 FeO,Fe O:0,8 S:0,4 FeSn3n2n2n0,8 Fe:0,8 O:0,8 S:0,4 o 2 24 243 2 2 t xmol xmol 0,4mol 70,4(g) SO HSOñacFe(SO)SOHO BTNTS:n0,4x1,2x0,8 x2,4 BTKL:70,498x0,4.40064(x0,8)18x
A. 2,8 mol. B. 2,0 mol. C. 2,4 mol. D. 1,6 mol.
Câu : Cho 55,86 gam hỗn hợp X gồm K2CO3, KOH, CaCO3 và Ca(OH)2 tác dụng với dung dịch HCl dư, thu được 5,376 lít CO2 (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 33,525 gam muối kali và m gam muối canxi. Giá trị của m là
33,30. B. 36,63. C. 35,52. D. 38,85.
DẠYKÈMQUYNHƠN OFFICIAL 25 Y 2 MgdöCu 2 24 32 m(g) NO:xxy0,04 x0,02 M16 Yco H:y30x2y0,04.16y0,02 YchöaNO(hoanau) 1,76KimloaigomMgdö,Cu,nn 0,02mol 6424 Sôñophanöng: NO:0,02 H:0,02 HSO MgCu(NO) 32 32 4 2 2 4 2 2 4 4 Cu(NO)Cu Mgpö Cu(NO)NO NH MgpöNOH NH Cu Mg SO NH Cu:0,02 Mgdö:0,02 BTNTCu:nn0,02 n0,15 BTNTN:n2nn0,02 m4,08 BTE:2n3n2n8n2n
2 X X' CO KCl 2 quyñoi 23 2 2 3 0,24 2 X,m55,86(g) X',m45,3(g) X' n0,24mol;n0,45mol. K:0,45 KOH,KCO Ca:x CO Ca(OH),CaCO OH:y O:0,24 m0,45.3940x1 2 2 CaClCa CaCl 7y0,24.1645,3x0,33 y0,63 BTÑT:0,452xy0,24.2 nnm36,63gam
A.
Câu : Hòa tan hết hỗn hợp 3 kim loại Al, Zn, Mg trong dung dịch HNO3 loãng vừa đủ, thu được dung dịch X và không thấy khí thoát ra. Cô cạn dung dịch X, thu được m gam muối khan (trong đó O chiếm 54% về khối lượng). Nung m gam muối khan nói trên tới khối lượng không đổi, thu được 70,65 gam chất rắn. Giá trị của m gần giá trị nào nhất sau đây? A. 210. B. 200. C. 195. D. 185. o
Câu (hiểm): Cho m gam hỗn hợp Mg, Fe, Al2O3, Fe3O4 (trong đó oxi chiếm 20% về khối lượng) tan vừa đủ trong 140 gam dung dịch H2SO4 61,6% đun nóng nhẹ, sau phản ứng thoát ra 6,048 lít hỗn hợp 2 khí H2 và SO2 có tỉ khối so với He là 10,833. Phần dung dịch thu được đem cho tác dụng với dung dịch NH3 dư, thu được 45,52 gam kết tủa. Giá trị của m là A. 34,40. B. 27,15. C. 32,00. D. 28,00.
DẠYKÈMQUYNHƠN OFFICIAL 26
3 3 4 3 23 HNO t 2 4 23 3 70,65(g) m(g) NO electronnhöôngNH electronnhöông NO N Mg,Al Mg MgO Sôñophanöng:Al Zn,NH AlO Zn ZnO NO 0,54m n 16.3 BTE:n 8n nn n 4 2 4 O (322 Al,Zn,Mg) 2 NH oxit m H m electronnhöông O 0,54m9x(nx) 163 m4x16m9x6218x70,65 2nn m196,25gannhatvôi195 x0,2453125
DẠYKÈMQUYNHƠN OFFICIAL 27 2 2 2 2 2 2 24 quyñoi34 23 HSO H H SO SO n HSO
2 4 Fe,FeO
Sôñophanöng: M
SO 2 2 4 2 4 n 2 2 xmol 2 n 45,52(g) HO OH SO SO M(OH) SO:0,18mol SHO H:0,09mol M(OH) BTNTH:n0,880,090,79 n2n(1,42x)BTNTS:n0,88x0,180,7x m0,8m17(1,42x)45,52 B0,2m TNTO: 16 m28 x0,020,88.40,18.20,794(0,7x) 3ddNH
0,88mol
M:0,8m(g) Mg,AlO O:0,2m(g) nn0,27n0,09 2n64n11,7n0,18
M:0,8m(g) O:0,2m(g)
Câu : Hòa tan hoàn toàn hỗn hợp X gồm a mol Fe, b mol Cu và c mol Fe(NO3)2 trong dung dịch HCl dư. Sau khi kết thúc phản ứng thu được khí NO (sản phẩm khử duy nhất), dung dịch Y chỉ chứa 2 muối và HCl dư. Dung dịch Y không có khả năng hòa tan bột Cu. Biểu thức liên hệ giữa a, b, c là
a = 2(3c – b). B. b = 3(2c – a)/2. C. c = (a + b)/3. D. b = 3(2c – a).
Câu : Hòa tan hoàn toàn hỗn hợp X gồm Al, Mg, FeO, CuO cần dùng 2 lít dung dịch HNO3 0,35M, thu được dung dịch Y chỉ chứa muối nitrat (không chứa ion Fe2+) và 3,36 lít NO (đktc, sản phẩm khử duy nhất). Mặt khác, cho X tác dụng hết với dung dịch HCl vừa đủ, thêm AgNO3 (dư) vào hỗn hợp phản ứng, thu được 77,505 gam kết tủa. Tổng khối lượng của oxit kim loại trong X là
A. 7,68 gam.
B. 3,84 gam. C. 3,92 gam. D. 3,68 gam.
DẠYKÈMQUYNHƠN OFFICIAL 28
2
2
32 X Y FeCuNO Ychöa2muoivaHCldönentaco: FeCl:(ac) Fe:a Cu:b CuCl:bNOHO Fe(NO):c HCldö ab BTE:2n2n3n2a2b32cc 3
A.
HCl
2
DẠYKÈMQUYNHƠN OFFICIAL 29 3 3 3 3 3 32 HNO 3 2 2 0,7 0,15 3 X Y HNO NONO/Y NO/Y HNO (FeO,CuO)NO (FeO,CuO) TN1: Al,Cu Al,Mg CuO Fe,MgNOHO FeO NO BTNTN:nnnn0,55 BTÑT:n2n 4nn 0,05 TN2: A 3 3 3 32 32 AgNO HCl 2 2 3 2 3 77,505 X Y AgClAg AgNONO/Y AgCl Al,Cu Al,Cu l,Mg AgCl CuO Fe,Mg Fe,Mg Ag FeO Cl NO nn0,55 nn0,55 143,5n1 2 Ag AgCl FeOFe (CuO,FeO) Ag CuO 08n77,505 n0,51nn0,04 m 3,68gam n0,04n0,050,040,01 Câu 1 : Cho m
trị của m là 3 23NaHSONaSO n:n2:1. A. 4,8. B. 5,6. C. 21,0. D. 8,4. 24 23 2 2 2 2 HSOñacnong 3 NaOH:0,4mol 2 2NaSO:0,1mol 23 xmol FeS SO FeS FeS NaHSO:2ymol Sôñophanöng:FeS SO NaSO:ymol BTNTNa:4y0,6y0,15 BTNTS:x0,13yx0,35 0,7BTE:15n2nn1m5,6g 5 am
gam FeS2 tác dụng với dung dịch H2SO4 đặc, nóng (dư), thu được V lít SO2 (đktc). Hấp thụ V lít SO2 này vào 400 ml dung dịch hỗn hợp NaOH 1M và Na2SO3 0,25M, thu đựơc dung dịch Y chứa 2 muối có tỉ lệ số mol Giá
DẠYKÈMQUYNHƠN OFFICIAL
Câu 9 (rất khó) : Hỗn hợp X gồm Na và Al. Hoà tan m gam hỗn hợp X vào nước dư thu được V lít H2 (đktc) và còn a gam chất rắn không tan. Cho a gam chất rắn tác dụng với dung dịch HNO3 dư, thu được 6,272 lít NO (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 3,4m gam muối khan. Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch NaOH dư, thu được 2V lít H2 (đktc). Giá trị của V gần với A. 12,7. B. 11,9. C. 14,2. D. 15,4.
30
DẠYKÈMQUYNHƠN OFFICIAL 31 3 2 m(g) HNO 33 0,28mol a(g) 43 3,4m(g) NaOH 2 m(g) TN1: H:Vlít(ñktc) Al Na Al(NO) Al NO NHNO Al TN2: H:2Vlít(ñktc) Na 43 2 electrondoa(g)Alnhöông NHNO Alcotrongagam muoi NaAlpöH Na 2VV2V n 2 22,422,4 12V BTE:n 0,28.3 822,4 12V n 322,4 2132V802V m 0,2833,4m(*) 322,4822,4 n3n2n ÔTN2: n NaAlpö Alpö 12V nn 422,4 n 232V272V272V m(**) 422,4422,4322,4 (m22,86 *) (**)V11,9 2 HO
Câu (khó): Cho hơi nước đi qua than nóng đỏ thu được hỗn hợp X gồm CO2, CO, H2, H2O. Dẫn X đi qua 25,52 gam hỗn hợp Fe3O4 và FeCO3 nung nóng thu được chất rắn Y gồm Fe, FeO, Fe3O4; hơi nước và 0,2 mol CO2. Chia Y thành 2 phần bằng nhau:
– Phần 1: Hòa tan hết trong dung dịch chứa a mol HNO3 và 0,025 mol H2SO4, thu được 0,1 mol khí NO duy nhất. – Phần 2: Hòa tan hết trong dung dịch H2SO4 đặc nóng, thu được dung dịch chứa hai muối có số mol bằng nhau và 0,15 mol khí SO2 duy nhất. Giá trị của a là
DẠYKÈMQUYNHƠN
OFFICIAL 32
A.
B.
o X OtrongY 34 C 2 t 34 3 Otrong0,5Y 0,2mol Y X,m25,52(g) 34 Banchatphanöng: n(4x3y0,4) FeO:xmol Fe,FeOCO FeO FeCO:ymol n
Fe,FeO FeO 24 o HSOñac 4 2 t 243 0,15mol 0,5Y X FeSO:zmol SO Fe(SO):zmol m232x116y25,52 x0,08 BTE:2z3.2z0,15.22(2x1,5y0,2)y0,06 BTNTFe:3xy2(z2z) z0,05 Fe,FeO F 3 24 3 2 HNO:amol HSO:0,025mol 2 0,1 34 3 4 0,5Y Fe:0,1,Fe:0,05 NO eO NO:(a0,1),SO:0,025 BTÑT:0,130,0520,0252(a0,1)a0,45 Chú ý: Vì số mol electron trao đổi ở 2 phần bằng nhau nên lượng muối sắt sinh ra trong các dung dịch sau phản ứng cũng bằng nhau.
0,40 mol.
0,45 mol. C. 0,35 mol. D. 0,50 mol.
(2x1,5y0,2)
Câu 46. Cho m gam hỗn hợp X gồm Cu và Fe2O3 vào 200,0 ml dung dịch chứa NaNO3 1M và H2SO4 2M, thu được dung dịch Y và thấy thoát ra 1,12 lít khí NO. Thêm dung dịch HCl dư vào dung dịch Y, lại thấy thoát ra 1,12 lít khí NO. Biết NO là sản phẩm khử duy nhất của ion nitrat và thể tích khí đo ở đktc. Giá trị của m là A. 18,4 B. 24,0. C. 25,6. D. 26,4.
DẠYKÈMQUYNHƠN OFFICIAL 33
3 24 3 2 NO NaNO
223
23 3 X DungdòchYcoFenenchoHClvaocoNObayra n0,1n0,2nencuoicungdungdòchconNO Banchatphanöng: Cu:x NCuFe,Fe O FeO:y NO, 2 2 4 Y 32 223 HCl 2 4 2 2 0,05mol 3 4 3 Y CuNOCu HO SO BTNTH:0,420,05423yy0,1 Fe,Cu CuFe,Fe NONa,SOHO NO,SO NO 3(0,050BTE:2n3nn ,05)0,15. 2 m0,1.1600,15.6425,6gam
3
HSO:0,4 NaNO:0,2 0,05mol
Câu 17. Cho 8,654 gam hỗn hợp X gồm khí Cl2 và O2 tác dụng vừa đủ với 0,396 mol hỗn hợp Y gồm Mg, Zn, Al, thu được 23,246 gam hỗn hợp Z gồm muối clorua và oxit của 3 kim loại. Cho Z phản ứng vừa đủ với V ml dung dịch HCl 1M, thu được dung dịch T. Cho từ từ dung dịch Ba(OH)2 2M vào T đến khi lượng kết tủa thu được không thay đổi về khối lượng thì cần vừa đủ 286 ml. Giá trị của V là A. 780. B. 864. C. 572. D. 848.
Câu 19. Cho 7,76 gam hỗn hợp X gồm Fe và Cu tác dụng với FeCu (n:n7:6)
dung dịch chứa 0,4 mol HNO3, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Tiến hành điện phân dung dịch Y với điện cực trơ, cường độ dòng điện không đổi I = 9,65A trong thời gian t giây, thấy khối lượng catot tăng 4,96 gam (kim loại sinh ra bám hết vào catot). Giá trị của t là A. 2602. B. 2337. C. 2400. D. 2000.
DẠYKÈMQUYNHƠN OFFICIAL 34
o 2 23
t HCl1M 2 2 Vml
2 2 0,396mol
T 8,654(g) Sôñophanöng: ClMg,Aloxit Mg,Al Mg(OH) OZn muoi Zn,Cl Phanöngc 2 2 2 2 2 2 3 2 2 Mg Y Zn Y Al OH X uaTvôiBa(OH): Mg2OHMg(OH) Zn4OHZnO2HO Al4OHAlO2HO nxnxyz0,396 x0,22 nym24x65y27z23,2468,654y0,12 z0,056 nz2x4y4zn1,144 m71 2 2 2 2 2 2 2 2 Cl O Cl Cl O O O HCl1M H O n32n8,654
Ba(OH)
0,572mol
23,246(g)
n0,034 BTE:2n4n0,22.20,12.20,056.3n0,195 n2n2.2n0,78molV0,78lít780ml
45.
phân dung dịch X gồm x mol KCl
y mol Cu(NO3)2 (điện cực trơ, màng ngăn xốp), khi nước bắt đầu bị điện phân ở cả hai điện cực thì ngừng điện phân thu được dung dịch Y (làm quỳ tím hóa xanh), có khối lượng giảm 2,755 gam so với khối lượng dung dịch X ban đầu (giả thiết nước bay hơi không đáng kể). Trung hòa toàn bộ lượng Y bằng dung dịch HCl 1M thì cần 20 ml. Tỉ lệ x : y có giá trị gần nhất với A. 0,75. B. 1,25. C. 1,65. D. 3,35.
DẠYKÈMQUYNHƠN OFFICIAL 35 Fe Fe Cu Cu FeCu electrondoFe,CunhöôngFeCu 3 2 elcctrondoNnhan 0,1 0,4 0,3 2 3 n7x n0,07 7x.566x.647,76x0,01 n6x n0,06 2n2n0,26n 3n2n0,33 n 0,3(Vì4HNO3eNO2HO) YFe:xmol,Fe: co 2 3 2 2 2 3 ñpdd Fe I9,65A,tgiay Fepö electrontraoñoiFe Cu Fepö ymolxy0,07 x0,03 2x3y0,06.20,3y0,04Cu:0,06mol,NO:0,3 4,960,06.64 Y 4,96gamCu,Fenn 0,02 56 BTE:n n2n2n0,2t nF I2000giay Câu
2
ñpdd
ñenkhiHObòphanôcahaiñiencöc 32 X Y
KCl:x K,NO Cu(NO):y OH 2 2 2 anot catot HClOH ddgiam H OH Cu Cl H nn0,02BTÑTtrongY:x2y0,02 m0,01.264y0,5x.712,755n0,5n0,01 x0,05x:y3,33gannhatvôi3,35 y0,015
Điện
và
2 2
3
anotchæcoquatrìnhoxihoaClBanchatphanöng: catotcoquatrìnhkhöCuvaHO
Câu 49. Hỗn hợp X có khối lượng 15,44 gam gồm bột Cu và oxit sắt FexOy được chia thành hai phần bằng nhau:
- Phần 1 tác dụng với dung dịch HCl dư, thu được m gam chất rắn không tan. - Phần 2 cho tác dụng hoàn toàn với dung dịch HNO3 đặc, nóng (dư), thu được dung dịch Y và 1,904 lít khí NO2 (đktc, sản phẩm khử duy nhất). Cô cạn Y được 23,79 gam hỗn hợp chất rắn khan. Giá trị của m là A. 1,92. B. 0,32. C. 1,60. D. 0,64.
Câu 49. Lấy hỗn hợp X gồm Zn và 0,3 mol Cu(NO3)2 nhiệt phân một thời gian, thu được hỗn hợp rắn Y và 10,08 lít hỗn hợp khí Z gồm NO2 và O2. Y tác dụng vừa đủ với dung dịch chứa 2,3 mol HCl, thu được dung dịch T chỉ chứa các muối clorua và 2,24 lít (đktc) hỗn hợp khí E gồm 2 đơn chất không màu có tỉ khối so với H2 là 7,5. Tổng khối lượng muối trong dung dịch T có giá trị gần nhất với
A. 154,5. B. 155,5. C. 155,0. D. 154,0.
DẠYKÈMQUYNHƠN OFFICIAL 36
3
xy HNOñacnong,dö 32 2 2
Cu Fe O Cu Cu,Fe FeO O Cu(NO) PCu,Fe 2: NOHO O Fe(NO) nx64x56y1 ny nz 34 Fe O HCldö 2 34 2 CupöFeO Cudö 6z7,72x0,03 n3 188x242y23,79 y0,075n4 BTE:2x3y2z0,085z0,1 FeCl PCu:0,03mol 1: Cu FeO:0,025mol CuCl BTE:nn0,025m0,005640,32gam
quyñoi
330,085mol 7,72(g) 23,79(g)
Câu 44: Hòa tan hết m gam Cu vào dung dịch gồm Fe(NO3)3 và HCl, thu được dung dịch X và khí NO. Thêm tiếp 19,2 gam Cu vào X, sau phản ứng thu được dung dịch Y chỉ chứa 2 muối trung hòa và còn lại 6,4 gam chất rắn. Cho toàn bộ Y vào dung dịch AgNO3 dư, thu được 183 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 28,8. B. 21,6. C. 19,2. D. 32,0.
DẠYKÈMQUYNHƠN OFFICIAL 37 2 2 2 2 2 2 o HN H H N N t 2 32 2 32 X Z Y nn0,1 n0,05 TrongE:2n28n0,1.7,5.21,5n0,05 Sôñophanöng: Zn,ZnONO Zn CuO Cu(NO):0,3mol O Cu(NO) 2 32 22 4 ,0,45mol 2 HCl 2 2 2 0,23mol 2 32 4 E Y T HOCu(NO) (O,NO) NHN ZnCl Zn,ZnO N CuO CuCl:0,3mol HO H Cu(NO) NHCl BTNTO:n6n2n0,9 BTNTH:n 2 2 3 4 2 2 HClH HO O HClNHClCuCl ZnCl muoi n2n2n 0,1 4 nn2n BTNTCl:n 0,8 2 m154,65gannhatvôi154,5
Câu 31: Đốt cháy m gam hỗn hợp Mg, Fe trong oxi một thời gian, thu được (m + 4,16) gam hỗn hợp X chứa các oxit. Hòa tan hoàn toàn hỗn hợp X bằng dung dịch HCl vừa đủ, thu được dung dịch Y chứa (3m + 1,82) gam muối. Cho AgNO3 dư vào dung dịch Y thấy tạo (9m + 4,06) gam kết tủa. Mặt khác, hòa tan hết 3,75m gam hỗn hợp X bằng dung dịch HNO3 loãng (dư), thu được dung dịch Z chứa x gam muối nitrat kim loại. Giá trị của x là A. 107,6. B. 161,4. C. 158,92. D. 173,4. (Đề thi thử THPT Quốc Gia lần 2 – THPT Đồng Đậu – Vĩnh Phúc, năm 2016)
DẠYKÈMQUYNHƠN OFFICIAL 38 3 3 2 33 2 AgNO 2 183(g) Y Cu NO Fe AgFAgCl e Cl Banchatphanöng: NO Fe(NO) HCl Fe:x AgCl Cu:y Ag Cl:z BTÑTtrongY 2x2yz BTE:2nn3n2yx33x 108xnn;nn x0,1 y0,5 143,5z183z1,2 0,5.64m12,8m19,2
3 2 o 2 muoi oxit 2 AgNO O HCl t (m4,16) (3m1,82) m
O m m Cl O Mg AgCl oxit muoi Fe Ag 4,16BTKL:n 0,26 16 (3m1,82)(m4,16) BTÑT:n2n0,52 2 Cl O 2 m m AgCl Ag Cl (Fe,Mg) Fe Mg Fe Mg FeMg Ag O FeMgO 0,5235,54,16 m8,32 9.8,324,060,52.143,5nn0,52n 0,04. 108 m56n24n8,32 n0,08 n0,16BTE:3n2n2nn0,56 TrongX:n:n:n0, Oxit/3,75mgam muoi muoi 08:0,16:0,264:8:13 x0,05 m 56.4x24.8x16.13x3,75.8,3231,2 m107,6 m242.4x148.8x Cu (m12,8)g
(9m4,06)
Câu 48: Dung dịch X gồm CuCl2 0,2M; FeCl2 0,3M; FeCl3 0,3M. Cho m gam bột Mg vào 100 ml dung dịch X khuấy đều đến khi phản ứng kết thúc thu được dung dịch Y. Thêm dung dịch KOH dư vào Y được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi thu được 5,4 gam chất rắn T. Giá trị của m là A. 2,88 B. 0,84 C. 1,32 D. 1,44 (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Thái Bình, năm 2016)
Câu 49 (rất khó): Hỗn hợp X gồm Cu2O, FeO, M (kim loại M có hóa trị không đổi), trong X số mol của ion O2- gấp 2 lần số mol M. Hòa tan 38,55 gam X trong dung dịch HNO3 loãng dư thấy có 1,5 mol HNO3 phản ứng, sau phản ứng thu được 118,35 gam hỗn hợp muối và 2,24 lít NO (đktc). Tính phần trăm khối lượng của M trong X? A. 25,29%. B. 50,58%. C. 16,86%. D. 24,5%. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Thái Bình, năm 2016)
DẠYKÈMQUYNHƠN OFFICIAL 39
2 2 3 3 2 2 23 CuCl FeCl FeCl 3 2 2 23 MgFe Cu Fepö x 0,02 0,03 y Mg T MgO FeO x 0,030,5y n0,02mol;n0,03mol;n0,03mol Tínhoxihoa:FeCuFe. gomFeO,MgO BTE:2nn2n2n x0,055;y0,02 m1 m40n160n5,4 3 2 23 23 MgFe Cupö x0,03 y T MgO FeO CuO
x
0,02y
0,03 ,32 gomCuO,FeO,MgO BTE:2nn2n x0,055 y0,04(voly)m40n160n80n5,4
Câu 50: Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (oxi chiếm 8,75% về khối lượng) vào nước, thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M, thu được 400 ml dung dịch có pH = 13. Các phản ứng xảy ra hoàn toàn. Giá trị m gần giá trị nào nhất sau đây? A. 12. B. 14. C. 15. D. 13. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Thái Bình, năm 2016)
DẠYKÈMQUYNHƠN OFFICIAL 40 3 X 2 4 23 2 HNO n 4 2 1,5mol 0,1mol 3 X,m38,55(g) 118,35(g) HO NH CuO:xmol Cu,Fe FeO:ymol M,NHNOHO M NO 38,551,5.63118,350,1.30BTKL:n 0,65 18 1,50,BTNTH:n 3 3 4 2 4 HNONO NO NH O kimloai M O CuOFeONONH 65.2 0,05 4 38,5533,75BTNTN:nnnn1,35n 0,3 16 m118,351,35.620,05.1833,75n0,15 n xy0,3 BTE:2nn3n8n2xy0,15n0,1.30,05.8 n1 x0,2538,551440,25720,05
M 7(loai). 0,15 y0,05 x0,138,55144.0,172.0,2n2 M 65(Zn)%Zn25,29% 0,15 y0,2
2 HO
Câu 8. Điện phân điện cực trơ màng ngăn xốp, dung dịch X chứa a gam Cu(NO3)2 và b gam NaCl đến khi có khí thoát ra ở cả 2 điện cực thì dừng lại, thu được dung dịch Y và 0,51 mol khí Z. Dung dịch Y hòa tan tối đa 12,6 gam Fe giải phóng NO (sản phẩm khử duy nhất) và dung dịch T. Dung dịch T cho kết tủa với dung dịch AgNO3. Tổng giá trị của (a + b) là A. 135,36. B. 147,5. C. 171,525. D. 166,2.
DẠYKÈMQUYNHƠN OFFICIAL 41 2 2 2 X H 2 Y OHtrong200mlYHOHdö OHtrong400m Sôñophanöng: H:0,07mol Na,NaO K,KO Ba,BaO ... NaOH KOH OH Ba(OH) n nn0,2(0,20,152)0,40,10,14 n 2 2 2 OH lY HOpö H H OtrongX X n20,140,28n n0,21 2 n0,07 n0,280,210,07 0,0716 m812,8gannhatvôi13 ,75%
14: Hòa tan hoàn toàn 25,3 gam hỗn hợp X gồm Mg, Al, Zn bằng dung dịch HNO3. Sau khi phản ứng kết thúc thu được dung dịch Y và 4,48 lít (đktc) khí Z (gồm hai hợp chất khí không màu) có khối lượng 7,4 gam. Cô cạn dung dịch Y thu được 122,3 gam hỗn hợp muối. Số mol HNO3 đã tham gia phản ứng gần nhất với : A. 1,75 mol. B. 1,875 mol. C. 1,825 mol. D. 2,05 mol. (Đề thi thử THPT Quốc Gia lần 1 – THPT Lê Lợi – Thanh Hóa, năm 2016)
DẠYKÈMQUYNHƠN OFFICIAL 42 2 2 Z,anot 2 Fe 32 max 3 3 X Y T c Sôñophanöng: Cl :0,51mol O Cu(NO):xmol Na,H Fe:0,225NO NO Na,NO NaCl:ymol Cu 2 2 2 2 3 32 atot FeNO NO H HObòoxihoa NO H H Cl O NaCl Cl NOtrongY NaCl Cu(NO) n BTE:2n3nn0,15 YFe: n 0,3 n4n n0,6 2 nn2n0,72 n0,15 Zco BTÑT:n 0,720,61,32 n0,510,150,36 n0,72 n0,66 honhôp m166,2 Câu
ñpdd
DẠYKÈMQUYNHƠN OFFICIAL 43 3 2 Z 2 2 2 HNO 3n 43 25,3(g) 122,3 2khíkhongmau NNO Zgom Zgomhoac 7,4 NO M 37 NO 0,2 NO:xmolxy0,2 x0,1 TH1:ZgomNO:ymol30x44y7,4y0,1 M(NO)NO:0 M NHNO:z 2 3 3n 4 3 2 43 2 2 NONO NOtaomuoiM(NO) NH muoitrongY HNO NO NO NHNO 2 2 ,1HO NO:0,1 n 3n8n8n z0,05 m 25,362(1,18z)80z122,3 n4n10n10n1,9gannhatvôi1,875 N:xmolxy0,TH2:Zgom NO:ymol 3 2 2 3 3n 4 HNO 3n 2 2 43 2 25,3(g) 122,3 N NO NOtaomuoiM(NO) NH muoitrongY 2 x0,0875 28x44y7,4y0,1125 M(NO)N:0,0875 M HO NHNO:zNO:0,1125 n 10n8n8n m 25,362(1,7758z z0(loai) )80z122,3
Câu 49: Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4:5 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch T. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m+39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3 trong T gần nhất
OFFICIAL
DẠYKÈMQUYNHƠN
44
A. 9,5%. B. 9,6%. C. 9,4%. D. 9,7%. (Đề thi thử THPT Quốc Gia lần 1 – THPT Lê Lợi – Thanh Hóa, năm 2016) E 32 NaOHvöañu 3 33 2 43 (m39,1)gam T E,mmgam 2 2 0,3mol Sôñophanöng: Mg(NO) Al(OH) Al(NO) Mg(OH) NHNO Mg:4x Al:5x NO,NO N 2 2 2 2 2 2 2 2 O KOH 22 2 2 2 0,3mol 0,2mol NONO NON NO NO N N electrontraoñoi OH NO,NO NO N N nn0,30,20,1. nn0,2 n0,15 44n28n0,2.408n0,05 39 n 2.4x3.5xn 43 2 2 43 3 2 2 43 3 NHNO electrontraoñoiNONO N NHNO HNOpöNO N NO NHNO HNOñempö ddT 20% ,12x0,1 ,3 17 n0,0375 n 3n8n10n8n n4n12n10n10n2,875 n 2,87520%.2,8753,45 m0,4.240,5.273,45.630,1 33Al(NO) .3081098,85 0,5.213C%19,69%gannhatvôi9,7% 098,85 3HNO
với
Câu 43: Cho m gam bột Fe vào 200 ml dung dịch hỗn hợp X chứa H2SO4 1M, Fe(NO3)3 0,5M và CuSO4 0,25M. Khuấy đều cho đến khi các phản ứng xảy ra hoàn toàn thu được 0,75m gam chất rắn, khí NO (sản phẩm khử duy nhất của N+5) và dung dịch Y. Giá trị của m là A. 56,0. B. 32,0. C. 33,6. D. 43,2. (Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Vĩnh Phúc, năm 2016)
Câu 11: Nhiệt phân hoàn toàn hỗn hợp gồm NaNO3; Al(NO3)3; Cu(NO3)2, thu được 10 gam chất rắn Y và hỗn hợp khí. Hấp thụ khí Z vào 112,5 gam H2O được dung dịch axit có nồng độ 12,5% và có 0,56 lít một khí (đktc) duy nhất thoát ra. Phần trăm khối lượng của NaNO3 trong hỗn hợp X là A. 21,25%. B. 42,5%. C. 17,49%. D. 8,75%.
DẠYKÈMQUYNHƠN OFFICIAL 45
2 4 24 33 3 0,22 m(g) 2 01 4 4
X Y Sôñophanöng: SO:0,25 HSO:0,2 Fe FeFe(NO):0,1NO NO:0,30,10,2 Cu CuSO:0,05 Fe:? BT 2Fe 0,25.20,2ÑT:n 0,35 m43,2gam 2 BTKL:m56.0,10,05.640,75m0,35.56
thi thử THPT Quốc Gia lần
–
o o o 3 2 2 2 2 t 3 22 t 33 23 2 2 t 32 2 2 22 2 3 HNONOô(4)NOô(2),(3) HN Oô(4)Oô(2),(3) Phöôngtrìnhphanöng: 2NaNO2NaNOO (1) 3 2Al(NO)AlO6NOO(2) 2 1 Cu(NO)CuO2NOO(3) 2 4NOO2HO4HNO (4) nnn 4x C% nn x 3 3 2 3 O NaNO khíthoatra(O)ô(1) khíthoatraô(1),(2),(3) NaNO 4x.63 12,5% 4x.4632x112,5 x0,0625 n2n 20,0250,05 m 0,025.324.0,0625.4632.0,062514,3 0,05.85%m 17,49% 1014,3
0,75m(g)
(Đề
3
chuyên KHTN Hà Nội, năm 2016)
Câu 10: Hòa tan hoàn toàn m gam hỗn hợp X gồm FeO, Fe3O4, Fe(OH)2, FeCO3 (trong đó Fe3O4 chiếm 25% số mol hỗn hợp) bằng dung dịch HNO3 dư, khi phản ứng hoàn toàn thu được dung dịch Y chứa (m + 284,4) gam muối và 15,68 lít (đktc) hỗn hợp khí Z gồm NO và CO2. Tỉ khối của Z so với H2 bằng 18. Biết NO là sản phẩm khử duy nhất của N+5. Giá trị của m là A. 151,2. B. 102,8. C. 78,6. D. 199,6. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lê Quý Đôn, năm 2016)
DẠYKÈMQUYNHƠN
46
OFFICIAL
2 2 2 3 2 34 2 NOCO NO CO NO CO FeCOCO FeO FeO Fe(OH) nn0,7 n0,4 n0,330n44n0,7.2.18 nn0,3 BTE:0,3xyz3.0,4 nx y25%(0,3xyz) ny 62.3.(0,3x3yz)60.0,316x64y34z284,4 nz y0,3 x X 0,4m151,2 z0,2
Câu 36 (khó): Nung m gam hỗn hợp gồm Mg và Cu(NO3)2 trong điều kiện không có không khí, sau một thời gian thu được chất rắn X và 10,08 lít (đktc) hỗn hợp khí gồm NO2 và O2. Hòa tan hoàn toàn X bằng 650 ml dung dịch HCl 2M, thu được dung dịch Y chỉ chứa 71,87 gam muối clorua và 0,05 mol hỗn hợp khí Z gồm N2 và H2. Tỉ khối của Z so với He bằng 5,7. Giá trị của m gần giá trị nào nhất sau đây?
DẠYKÈMQUYNHƠN OFFICIAL 47
A. 50. B. 55. C. 45. D. 60. (Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Lê Quý Đôn,
2 2 2 2 2 2 o HN H H N N t 2 32 2 32 m(g) X nn0,05 n0,01 TrongZ:2n28n0,055,741,14n0,04 Sôñophanöng: Mg,MgONO Mg:xmol CuO Cu(NO):ymol O Cu(NO) muoi 2 0,45mol 2 HCl 2 2 2 1,3mol 2 32 4 Z X Y,m71,87(g) O/XHOCu(NO MgCl:x Mg,MgO N:0,04 CuO CuCl:y HO H:0,01 Cu(NO) NHCl BTNTO:nn6n 32 22 4 ) (NO,O) NHCl muoi 2n6y0,9 1,30,01.22(6y0,9)BTNTH:n (0,773y) 4 m95x135y53,5(0,773y)71,87x0,39 y0,25 BTNTCl:2x2y(0,773y)1,3 m56,36gannhatvôi55
năm 2016)
DẠYKÈMQUYNHƠN OFFICIAL 48
3 2 2 2 23 3 AgNO CO AgCl X CO AgCl X Sôñophanöng: CO:(xy) MCO:xmol MHCO:ymol MCl:zmol MCl:(2xyz) AgCl:(2xyz) nxy0,4 n2xyz0,7 m(2M60)x(M61)y(M35,5)z32,65 nxy0,4 n2xyz0,7 m M(2xyz)60(xy)y35,5z32,65 8,65 0,7M8,65y35,5zM12,357MlaLi 0,7 Câu 46: Cho x mol hỗn hợp kim loại X và Y tan hết trong dung dịch chứa y mol HNO3, sau khi kết thúc phản ứng thu được khí Z và dung dịch T chỉ chứa X2+ ; Y3+; ; trong đó số mol ion gấp 2,5 lần số mol 2 ion kim loại. Biết tỉ lệ x : y 3NO 3NO = 8 : 25. Khí Z là A. N2O B. NO2 C. NO D. N2 (Đề thi thử THPT Quốc Gia lần 1 – Sở GD và ĐT Bắc Ninh, năm 2016) 3 3 NOtaomuoi Ntrongsanphamkhö 5 electronkimloainhöôngNOtaomuoi electronkimloainhöôngele n 8.2,520 x8 Chon y25n 25205 GoinlasoelectronNnhanvaoñethanhsanphamkhö. n n 20 n n 5 ctronNnhan 5 1 2 205nn4 5n N4eNSPKlaNO HCl
Câu 34: Hỗn hợp X gồm M2CO3, MHCO3 và MCl (M là kim loại kiềm). Cho 32,65 gam X tác dụng vừa đủ với dung dịch HCl, thu được dung dịch Y và có 17,6 gam CO2 thoát ra. Dung dịch Y tác dụng với dung dịch AgNO3 dư, thu được 100,45 gam kết tủa. Kim loại M là A. Li. B. Na. C. K. D. Rb. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đồng Đậu – Vĩnh Phúc, năm 2016)
Câu 49: Cho m gam hỗn hợp X gồm MgO, CuO, MgS và Cu2S (oxi chiếm 30% khối lượng) tan hết trong dung dịch H2SO4 và NaNO3, thu được dung dịch Y chỉ chứa 4m gam muối trung hòa và 0,672 lít (đktc) hỗn hợp khí gồm NO2, SO2 (không còn sản phẩm khử khác). Cho Y tác dụng vừa đủ với dung dịch Ba(NO3)2, được dung dịch Z và 9,32 gam kết tủa. Cô cạn Z được chất rắn T. Nung T đến khối lượng không đổi, thu được 2,688 lít (đktc) hỗn hợp khí (có tỉ khối so với H2 bằng 19,5). Giá trị của m gần giá trị nào nhất sau đây? A. 3,0. B. 2,5. C. 3,5. D. 4,0. (Đề
OFFICIAL
DẠYKÈMQUYNHƠN
49
o o o 2 2 2 2 2 2 2 2 t 32 2 2 t 32 2 2 t 3 2 2 NOO NO NO O O NO Oô(1),(2) Phanöngnhietphanmuoi 1 Cu(NO)CuO2NOO(1) 2 1 Mg(NO)MgO2NOO(2) 2 1 NaNONaNOO (3) 2 nn0,12 n0,06 46n32n0,12219,54,68n0,06 n n 0, 4 2 32 32 2(3) 3 2(3) 3 2 4 4 2 2 NO (Cu(NO),Mg(NO)) O NaNO O 2 2 NO 2 4 BaSO SO NO SO 3 n 015n 0,03 2 n0,045 n2n0,09 (Cu,Mg):0,03 n0,07 SO:0,04(nn) Yco n0,090,070,02 Na:0,09 n0,030,010,01 NO:? 2 2S(Cu,Mg)SONO OS 0,0375m0,02BTE:6n2n2nn2nn 6 0,0375m0,02m0,3m32 0,09.230,07.620,04.964m 6 m2,959gannhatvôi3
thi thử THPT Quốc Gia lần 1 – THPT Phan Ngọc Hiển – Cà Mau, năm 2016)
50
DẠYKÈMQUYNHƠN OFFICIAL
CHUYÊN ĐỀ : PHẢN ỨNG TẠO MUỐI AMONI 4 () NH
Phản ứng tạo muối amoni là một trong những dạng bài tập hóa vô vơ hay và khó. Nếu như đề thi trước năm 2014 dừng lại ở việc tạo ra NH4NO3 thì từ năm 2014 đến nay, mức độ khó đã tăng lên đáng kể. Phản ứng vẫn tạo ra NH4NO3 nhưng sau đó ion bị khử hết thành các sản phẩm khác. 3NO Dưới đây là các dạng thường gặp :
I. Phản ứng tạo ra NH4NO3
1. Những vấn đề cần lưu ý
Dấu hiệu nhận biết phản ứng tạo muối NH4NO3 : Hỗn hợp chất rắn chứa kim loại hoạt động mạnh như Mg, Al, Zn phản ứng với dung dịch HNO3 tạo ra các khí N2, N2O, NO,…
2. Ví dụ minh họa :
OFFICIAL
Ví dụ 1: Đốt cháy 10,08 gam Mg trong oxi một thời gian, thu được m gam hỗn hợp rắn X. Hòa tan hết X trong dung dịch gồm HCl 0,9M và H2SO4 0,6M, thu được dung dịch Y chỉ chứa các muối có khối lượng 3,825m gam. Mặt khác, hòa tan hết 1,25m gam X trong dung dịch HNO3 loãng dư, thu được dung dịch Z chứa 82,5 gam muối và hỗn hợp khí T gồm N2 và 0,015 mol khí N2O. Số mol HNO3 phản ứng là A. 1,23 mol. B. 1,32 mol. C. 1,42 mol. D. 1,28 mol.
DẠYKÈMQUYNHƠN
1
Hướng dẫn giải 2 4 2 Cl SO Mg MgO Mg n0,9x BTÑT:0,9x20,6x20,42TrongYn0,6xBTKL:35,5.0,9x96.0,6x3,825m10,08 n0,42 1,25(1210,08) n 0,15 x0,4Trong1,25mgamXco 16 m12 n1,25.0,420,150,375 BTKL:n 43 2 2 3 2 2 43 NHNOtrongZ N HNO N NONHNO Mg 82,51,25.0,42.1480,06 80 0,375.20,06.80,015.8BTE:n 0,015 10 n2n2n2n2n1,23mol Ví dụ tương tự : Ví dụ 1.1: Đốt cháy 11,2 gam bột Ca bằng O2, thu được m gam chất rắn A gồm Ca và CaO. Cho chất rắn A tác dụng vừa đủ với axit trong dung dịch gồm HCl 1M và H2SO4 0,5M, thu được H2 và dung dịch B. Cô cạn dung dịch B thu được (m +
21,14) gam chất rắn khan. Nếu hòa tan hết m gam chất rắn A vào dung dịch HNO3 loãng dư, thu được 0,896 lít NO (đktc) và dung dịch X. Cô cạn dung dịch X thu được bao nhiêu gam chất rắn khan? A. 47,52 gam. B. 48,12 gam. C. 45,92 gam. D. 50,72 gam. Ví dụ 2: Hòa tan hết 30 gam rắn gồm Mg, MgO, MgCO3 trong HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau phản ứng thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị của m là A. 134,80 B. 143,20 C. 153,84 D. 149,84
DẠYKÈMQUYNHƠN OFFICIAL 2
Hướng
giải 2 3 2 2 NOCO NO MgCO CO NO CO 2 4 3 3 2 3 2,15mol honhôpX ddY M nn0,2 n0,1 n0,1n0,130n44n0,218,527,4 Sôñophanöng: Mg;NH Mg,MgO NO HNO MgCO CO NO n 4 3 NH g MgO NOtrongY X muoitrongY anx ; BTN:n 2,05x nb BTE:2a8x0,1.3 a0,65 BTÑTtrongY:2(ab0,1)x2,05xb0,15 m24a40b0,1.8430 x0,125 m 143,2gam Ví dụ tương tự :
dẫn
Ví dụ 2.1: Hòa tan hoàn toàn 5,22 gam hỗn hợp bột M gồm Mg, MgO, Mg(OH)2, MgCO3, Mg(NO3)2 bằng một lượng vừa đủ 0,26 mol HNO3. Sau khi phản ứng kết thúc thu được dung dịch X và 0,448 lít hỗn hợp khí gồm N2O và CO2. Dung dịch X phản ứng vừa đủ với 250 ml dung dịch NaOH 1M, sau phản ứng thu được 6,96 gam kết tủa màu trắng. Phần trăm theo khối lượng của Mg(OH)2 trong hỗn hợp đầu gần nhất là
A. 11,11%. B. 22,22%. C. 33,33%. D. 44,44%.
Ví dụ 2.2: Hòa tan hết m gam hỗn hợp M chứa Mg, MgCO3 và FeCO3 trong dung dịch HCl loãng dư, thu được hỗn hợp khí X và dung dịch chứa các chất tan có cùng nồng độ mol. Mặt khác, m gam hỗn hợp trên phản ứng hoàn toàn với dung dịch chứa 1,02 mol HNO3, kết thúc phản ứng thu được dung dịch Y và 5,6 lít (đktc) hỗn hợp khí Z gồm 2 khí có tỉ khối so với H2 bằng 22. Cô cạn cẩn thận dung dịch Y thu được (2m + 17,8) gam muối khan. Giá trị m là A. 54,0. B. 40,5. C. 27,0. D. 39,15. Ví dụ 3: Cho 9,6 gam hỗn hợp X gồm Mg và Fe3O4 vào 300 ml dung dịch HNO3 2M, thu được dung dịch Y và 0,896 lít (đktc) hỗn hợp N2O và NO có tỉ khối so với hiđro là 16,75. Trung hòa Y cần dùng 40 ml NaOH 1M thu được dung dịch Z, cô cạn Z thu được m gam muối khan. Biết rằng phản ứng xảy ra hoàn toàn và khi cô cạn muối không bị nhiệt phân. Giá trị m là A. 42,26. B. 19,76. C. 28,46. D. 72,45. Hướng dẫn giải
OFFICIAL
DẠYKÈMQUYNHƠN
3
3HNO 0,6mol
Ví dụ 3.1: Cho một luồng khí O2 đi qua 63,6 gam hỗn hợp kim loại Mg, Al và Fe thu được 92,4 gam chất rắn X. Hòa tan hoàn toàn lượng X trên bằng dung dịch HNO3 (dư). Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y và 3,44 gam hỗn hợp khí Z. Biết có 4,25 mol HNO3 tham gia phản ứng, cô cạn cẩn thận dung dịch Y thu được 319 gam muối. Phần trăm khối lượng của nitơ có trong 319 gam hỗn hợp muối trên là A. 18,082%. B. 18,125%. C. 18,038%. D. 18,213%. Ví dụ 3.2: A là hỗn hợp chứa Fe, Al, Mg. Cho một luồng khí O2 đi qua 21,4 gam A nung nóng thu được 26,2 gam hỗn hợp rắn B. Cho toàn bộ B vào bình chứa 400 gam dung dịch HNO3 (dư 10% so với lượng phản ứng). Sau khi các phản ứng xảy ra hoàn toàn thấy có NO và N2 thoát ra với tỉ lệ mol 2 : 1. Biết khối lượng dung dịch C sau phản ứng là 421,8 gam, số mol HNO3 phản ứng là 1,85 mol. Tổng khối lượng các chất tan có trong bình sau phản ứng gần nhất với A. 156. B. 134. C. 124. D. 142.
DẠYKÈMQUYNHƠN OFFICIAL 4 2 2 2 2 3 NONO NO NO NO NO 2 34 honhôpX 23 4 3 dd YchöaHNOdönenYkhongchöaFe. nn0,04 n0,03 n0,0130n44n0,04.16,75.21,34 Sôñophanöng: NO NO Mg FeO Mg,Fe NH,NO H 2 4 3 34 3 23 NaOH 4 3 trunghoa Y ddZ NH Mg Mg FeO NOtrongZ Fe X Mg,Fe NH,NO Na nznxnx ; ny BTN:n 0,55z n3y m24x232y9,6 BTE:2xy0,03.30,01.88z BTÑTtrongZ:2x9y 3 2 4 3 muoitrongZFe Mg NH NaNO x0,11 y0,03 z0,040,55zz0,01 m mmmmm42,26gam Ví
:
dụ tương tự
Ví dụ 3.3: Hoà tan hết 15,44 gam hỗn hợp gồm Fe3O4, Fe và Al (trong đó oxi chiếm 20,725% về khối lượng) bằng 280 gam dung dịch HNO3 20,25% (dùng dư), thu được 293,96 gam dung dịch X và 0,896 lít hỗn hợp khí X gồm NO và N2O. Để tác dụng tối đa các chất trong dung dịch X cần 450 ml dung dịch NaOH 2M. Nếu cô cạn dung dịch X thu được chất rắn Z. Nung Z đến khối lượng không đổi, thấy khối lượng chất rắn giảm m gam. Giá trị m là A. 44,12. B. 46,56. C. 43,72. D. 45,84. Ví dụ 4: Hòa tan m gam hỗn hợp A gồm Mg, Al, MgO và Al2O3 bằng dung dịch HCl vừa đủ thì được dung dịch chứa (m + 70,295) gam muối. Cho m gam hỗn hợp A tác dụng với dung dịch H2SO4 đặc nóng dư, thu được 13,328 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp A tác dụng với dung dịch HNO3 loãng dư, thu được 3,808 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hiđro là , dung dịch Y. Cô cạn dung dịch Y thu được 162,15 gam muối khan. Giá trị 318 17 của m là A. 30,99. B. 40,08. C. 29,88. D. 36,18. Hướng dẫn giải
OFFICIAL
DẠYKÈMQUYNHƠN
5
2 2 2 NONO NO NO NO NO nn0,17 n0,08 0,173182 n0,09 30n44n 6,36 17 23 23 quyñoi honhôpA 2 33 32 2 43 Sôñophanöng: Mg,Al Cl Al,AlO Al,Mg O Mg,MgO SO Al(NO) NO Mg(NO) NO NHNO HCl (1) 24ñacHSO (2) 3 HNO(3)
dụ 4.1: Hỗn hợp X gồm FexOy, Fe, MgO và Mg. Cho m gam hỗn hợp X tác dụng với dung dịch HNO3 dư, thu được 6,72 lít hỗn hợp khí N2O và NO (đktc) có tỉ khối so với hiđro là 15,933 và dung dịch Y. Cô cạn dung dịch Y thu được 129,4 gam muối khan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng dư, thu được 15,68 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch Z. Cô cạn dung dịch Z thu được 104 gam muối khan. Giá trị của m là A. 27,20. B. 28,80. C. 26,16. D. 22,86. Ví dụ 4.2: Đốt cháy 16,96 gam hỗn hợp gồm Fe và Mg trong oxi một thời gian, thu được hỗn hợp rắn X. Hòa tan hết X trong 242 gam dung dịch HNO3 31,5%, thu được dung dịch Y chỉ chứa các muối có khối lượng 82,2 gam và 1,792 lít (đktc) hỗn hợp khí Z gồm N2O và NO có tỉ khối so với He bằng 10,125. Cho NaOH dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được 25,6 gam chất rắn khan. Nồng độ C% của Fe(NO3)3 trong Y có giá trị gần nhất với:
DẠYKÈMQUYNHƠN OFFICIAL 6 2 2 2 2
l Cl O
Cl
BTÑTcho(1):nn
Theo(1)vasötanggiamkhoilöông,taco:35,5n16n70,295(**) Tö(*)va(**)su 2 2 43 43 4 Cl O electronmaMg,AlnhöôngNONONHNO O 0,08 0,51 0,09 2,21 ? (Al,Mg)muoikhan NHNO
NHNO n2,21 yra:n0,51 BTEcho(3):n
mm80n62n n 3 (Al,Mg) 0,02875 m22,830,51.1630,99gam m22,83 Ví dụ tương tự : Ví
ĐÁP ÁN HƯỚNG VÀ DẪN GIẢI MỘT SỐ BÀI KHÓ 1.1A 2.1A 2.2C 3.1B 3.2B 3.3C 4.1B 4.2B Ví dụ 2.1: ● Cách tiếp cận thứ nhất : Gặp bài tập này, tôi đã rất lúng túng vì
có
không tìm được cách nào cho đơn
là đặt x, y, z, t, v ứng với
các định luật
CelectronmaMg,Alnhöông
electronmaMg,Alnhöông SO O 0,595
O
n2n1,19(*) BTEcho(2):n 2n2n
electronmaMg,Alnhöông 2,21
3n8n8n2n
A. 12%. B. 13%. C. 14%. D. 15%.
hỗn hợp
tới 5 chất. Loay hoay mãi, vẫn
giản. Vì thế đành quay lại cách thông thường, đó
số mol của các chất trong M. Rồi dựa vào giả thiết và áp dụng
bảo toàn lập hệ phương trình. Có 4 phương trình, nhưng lại có 5
ẩn số! Ngán quá đi! Cách này không ổn rồi! Nhưng thử biến đổi toán học thêm một chút nữa, tôi đã tìm được số mol của Mg(OH)2. ● Cách tiếp cận thứ hai : Trời! Ai ra cái bài này mà ghê thế chứ! Chẳng lẽ cứ phải làm thế này cho những bài tương tự sao. Không! Phải có cách nào khác đơn giản hơn chứ, tôi cứ nghĩ như thế và rồi đã tìm thấy nó :
DẠYKÈMQUYNHƠN OFFICIAL 7
3 3 3 4 2 2 4 NONa HNONONH Mg(OH)Mg 2 32 NH 2 2 2 (OH,O)trongM nn0,25 nnn Xco:nn0,12 NOdoNtrongMg(NO)taora n0,01 Mg(OH):xmol Mg:(0,12x)molQuyñoiMthanhO:ymol (NOCO):0,02mol m 34x16y 2Mg(OH) 1x0,01;y0,07 ,46 %m11,11%BTE:2(0,12x)2y0,01.8 Với cách tiếp cận này, vấn đề đã được giải quyết đơn giản hơn, nhưng tính khái quát vẫn chưa cao. ● Cách tiếp cận thứ ba : 3 2 2 4 NONa Mg(OH) muoi Mg NH 2 2 3 3 3 0,26mol 4 32 18,56gam 5,22gam nn0,25 Xco:nn0,12m18,56gam n0,01 Mg,MgO Mg Mg(OH) CO Sôñophanöng: HNONO MgCO NH Mg(NO) 2 2 2 2 2 2 ?mol 0,02mol HO Mg(OH) Mg(OH) HO NO 5,220,266318,560,0244BTKL:n 0,12 18 %m11,11% 0,12.20,01.40,26BTNTH:n 0,01 2 Ví dụ 2.2: Ta thấy : Dung dịch Y gồm các ion , có thể có và hai ion 3 2 3Fe,Mg,NO 4NH kim loại có số mol bằng nhau. Hai khí là CO2 và N2O.
● Cách tiếp cận thứ nhất : Đặt ẩn x, y , z cho các chất Mg, MgCO3 và FeCO3. Số mol của CO2 thì có thể tính theo y, z. Nhưng số mol của N2O thì còn phụ thuộc vào số mol của HNO3 và các ion trong dung dịch Y, như vậy sẽ cần thêm một ẩn nữa cho ion . Như vậy là 4NH có 4 ẩn rồi, lại còn ẩn m nữa chứ, ôi sao mà nản quá! Nếu nghĩ thêm một chút nữa thì có thể làm
DẠYKÈMQUYNHƠN OFFICIAL 8
mất ẩn m, nhưng 4 ẩn là đủ mệt rồi. ● Cách tiếp cận thứ hai : 3 2 3 quyñoi HNO 2 1,02mol 4 2 2 3 ddY Sôñophanöng: Mg:xmol Mg:xmol Fe:xmolCO:ymol Fe:xmol M O:ymol NH:z NO:(0,25y)mol CO:ymol NO BTNvaBTÑTtrongY:5xz1 muoi M ,02z2(0,25y) BTE:5x2y8z8(0,25y) m2m62[1,02z2(0,25y)]18z2(4416)y80x17,8 x0,18 y0,21m27 z0,02 ● Cách tiếp cận thứ ba : 2 23 2 3 3 2 2 4 3 ?gam 1,02mol 3 0,25mol (2m17,8)gam mgam HO Mg COMg,FeSôñophanöng:MgCOHNO HO NONH,NO FeCO BTKL:m35,46mm35,46C Ví dụ 3.1: 2 4 3 HO NHtrongY NOtrongY 92,44,25.633193,44BTKL:n 2,095 18 4,252,095.2 BTNTN:n 40,015%NtrongY18,125% 31963,60,015.18 BTKLn 4,115 62 Ví dụ 3.2:
DẠYKÈMQUYNHƠN OFFICIAL 9 2 4 3 NO N NH NO ñientíchdöôngcuaionkimloai chattantrongX n2x;nx 26,2400421,8BTKL:x 0,05 88 na;BTNTN:n1,65a TrongC: a0,025 26,221,4 n 2. 0,88a 16 m 1,85.10%.630,025.1821,41,625.62134, 225134 Ví dụ 3.3: 3 4 NaOH HNObanñau NHtrongX 2 2 3 ddY QuyñoihonhôpbanñauthanhAl(xmol),Fe(ymol),O(0,2mol). n0,9;n zmol;n 0,9mol Sôñophanöng: NO NO AlO:x Al Fe Na:0,9 O NO:0,9x A 33 4 3 ddX 2 23 2 23 3 chatranZ l,Fe NH,H NO O FeO NO AlO NH 3HNO NaOH cocan,nung
DẠYKÈMQUYNHƠN OFFICIAL 10 2 2 2 NONO NO NO NO NO (Al,Fe)
BTE:3x3y8z0,0230,0280,22 BTNvaBTÑTtrongZ:0,9x0,9z0,020,02.2 x0,08 y0,18 z0,02 3 33 33NOtrongmuoiAl(NO),Fe(NO) n 0,78mol 0,78 m0,02.8062.0,7816.43,72gam 2 Ví dụ 4.1: 2 2 2 2 2 4 4 NONO NO NO NO NO 4 SO NONO NH NH 0,26 0,7 0,04 ? muoinitratkimlo QuyñoiXthanhFe(xmol),Mg(ymol),O. nn0,3 n0,26 n0,0430n44n15,933.2.0,3 GiasötrongYcoNH,taco: BTE:2n8n3n8nn0,0375 m 2 ai muoisunfatkimloai FeMg OSO O X 0,4 ? 0,2 0,7 242x148y129,40,0375.80x0,4 m 200x120y104 y0,2 BTE:3n2n2n2nn0,1m28,8gam Ví dụ 4.2:
nn0,04 n0,02 n0,0230n44n15,44280293,961,48 m27x56y12,24
vấn đề cần lưu ý Dấu hiệu nhận biết phản ứng tạo ra ion : Xảy ra phản ứng của kim loại 4NH
hoạt động mạnh (Mg, Al, Zn) với Sản phẩm khử ngoài N2, N2O,… 3 ( ) HvaNO thì còn có cả H2 Giải thích : Như ta biết, tính oxi hóa của mạnh hơn H+, nên phản ứng tạo 3NO ra H2 thì chứng tỏ trong dung dịch thu được không thể có . 3NO
2. Ví dụ minh họa
Ví dụ 1: Cho 4,32 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X; 0,896 lít (đktc) hỗn hợp khí Y có khối lượng 0,92 gam gồm 2 khí không màu có một khí hóa nâu trong không khí và còn lại 2,04 gam chất rắn không tan. Cô cạn cẩn thận dung dịch X, thu được m gam muối khan. Giá trị của m là A. 18,27. B. 14,90. C. 14,86. D. 15,75. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Đại học Vinh – Nghệ An, năm 2015)
Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL 11 2 2 2 23 NONO NO NO NO NO (Mg,Fe) Mg (FeO,MgO) Fe 2 3 2 4 3 nn0,08 n0,02 n0,0630n44n0,0810,12543,24 m24x56y16,96nx x0,24 m 40x80y25,6y0,2 ny Fe:a Fe:b Yco:Mg:0,24 NH:z BTN:NO:( 33 OtrongZ Fe(NO) ab0,2 18z62(1,07z)82,216,9665,24 2a3b0,24.2z1,07z 1,07z) 0,24.20,2.30,02.30,06.80,025.8a0,06n 0,17 2 b0,14 0,14242 C% .100 z0,025 16,960,1722423,24 %13% II. Phản ứng ion , còn đã bị khử hết 4NH 3NO 1. Những
Ví dụ tương tự : Ví dụ 1.1: Cho Zn tới dư vào dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m là A. 61,375. B. 64,05. C. 57,975. D. 49,775. Ví dụ 1.2: Cho 3,48 gam bột Mg tan hết trong dung dịch hỗn hợp gồm HCl (dư) và KNO3, thu được dung dịch X chứa m gam muối và 0,56 lít (đktc) hỗn hợp khí Y gồm N2 và H2. Khí Y có tỉ khối so với H2 bằng 11,4. Giá trị của m là A. 16,085. B. 14,485. C. 18,300. D. 18,035. (Đề thi tuyển sinh khối B năm 2014) Ví dụ 1.3: Cho 5 gam bột Mg vào dung dịch KNO3 và H2SO4 Đun nhẹ trong điều kiện thích hợp đến khi phản ứng xảy ra hoàn toàn, thu được dung dịch X chứa m gam muối và 1,792 lít hỗn hợp khí Y (đktc) gồm 2 khí không màu, trong đó có 1 khí hoá nâu ngoài không khí và còn lại 0,44 gam chất rắn không tan. Biết tỉ khối hơi của Y đối với H2 là 11,5. Giá trị của m là : A. 27,96. B. 31,08. C. 36,04. D. 29,72. (Đề thi thử Đại học lần 1 – THPT Hồng Lĩnh, năm học 2013 – 2014) Ví dụ 2: Cho 5,6 gam hỗn hợp X gồm Mg và MgO có tỉ lệ mol tương ứng là 5 : 4 tan vừa đủ trong dung dịch hỗn hợp chứa HCl và KNO3. Sau khi kết thúc phản ứng, thu được 0,224 lít khí N2O duy nhất (đktc) và dung dịch Y chỉ chứa muối clorua. Biết các phản ứng hoàn toàn. Cô cạn cẩn thận Y thu được m gam muối. Giá trị của m là : A. 20,51. B. 18,25. C. 23,24. D. 24,17. Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL 12 2khí 2 3 2 3 2 2 24 4 4 0,095mol ddY MgpöH H:0,01 M23 2khíla XkhongcoNO NO:0,03 comotkhílaNO(hoanau) Sôñophanöng: NaNO Mg;NaH Mg HSO SO;NHNO BTE:2n2n 2 4 4 3 4 3 3 2 4 2 2 4 4 NONH NH NONO NH NaNO NaNO SO muoitrongXMg NaNH SO 3n8n n0,01 BTN:nnn nn0,04 BTÑT:nn BTÑTtrongY:n0,12 m mmmm14,9gam
trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch A chỉ chứa m gam hỗn hợp các muối và 4,48 lít (đktc) hỗn hợp khí B gồm N2O và H2. Khí B có tỷ khối so với H2 bằng 11,5. Giá trị m gần nhất với A. 240. B. 255. C. 132. D. 252. Ví dụ 2.2: Nung m gam hỗn hợp gồm Mg và Cu(NO3)2 trong điều kiện không có không khí, sau một thời gian thu được chất rắn X và 10,08 lít (đktc) hỗn hợp khí gồm NO2 và O2. Hòa tan hoàn toàn X bằng 650 ml dung dịch HCl 2M, thu được dung dịch Y chỉ chứa 71,87 gam muối clorua và 0,05 mol hỗn hợp khí Z gồm N2 và H2. Tỉ khối của Z so với He bằng 5,7. Giá trị của m gần giá trị nào nhất sau đây?
A. 50. B. 55. C. 45. D. 60. Ví dụ 3: Cho 7,65 gam hỗn hợp X gồm Al và Al2O3 (trong đó Al chiếm 60% khối lượng) tan hoàn toàn trong dung dịch Y gồm H2SO4 và NaNO3, thu được dung dịch Z chỉ chứa 3 muối trung hòa và m gam hỗn hợp khí T (trong T có 0,015 mol H2). Cho dung dịch BaCl2 dư vào Z đến khi các phản ứng xảy ra hoàn toàn, thu được 93,2 gam kết tủa. Còn nếu cho Z phản ứng với NaOH thì lượng NaOH phản ứng tối đa là 0,935 mol. Giá trị của m gần giá trị nào nhất sau đây?
A. 2,5. B. 3,0. C. 1,0. D. 1,5. (Đề thi THPT Quốc Gia, năm 2015) Hướng dẫn giải
DẠYKÈMQUYNHƠN OFFICIAL 13 2 xmol0,18mol 0,1mol 2 3 4 0,01mol zmol 0,08mol ymol ddY Sôñophanöng: Mg;K Mg HCl NO MKNO gO: NH;Cl BTE:0,1.20,01.88y BTN:xy0,01.2 BTÑTtrongY:0,182xyz muoi/Y y0,015 x0,035m20,51gam z0,41 Ví dụ tương tự : Ví dụ 2.1: Cho 31,15 gam hỗn hợp bột Zn và Mg (tỉ lệ mol 1 : 1) tan
hết
Ví dụ tương tự : Ví dụ 3.1: Hỗn hợp X gồm Al, Al2O3, Fe và Fe3O4 trong đó oxi chiếm 26,86% về khối lượng. Hòa tan hết 41,7 gam X cần vừa đủ 1525 ml dung dịch HNO3 1,5M, thu được dung dịch Y và 2,24 lít hỗn hợp Z (đktc) gồm NO và N2O có tỉ khối so với H2 là 18,5. Làm bay hơi dung dịch Y thu được m gam muối. Giá trị của m là A. 162,2 gam. B. 64,6 gam. C. 160,7 gam. D. 151,4 gam. Ví dụ 3.2: Hỗn hợp X gồm Al, Mg, FeO, Fe3O4 trong đó oxi chiếm 20,22% khối lượng hỗn hợp. Cho 25,32 gam hỗn hợp X tác dụng với dung dịch HNO3 dư, thu được 3,584 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hiđro là 15,875 và dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan. Nung muối khan này trong không khí đến khối lượng không đổi thu được 30,92 gam chất rắn khan. Giá trị gần nhất của m là A. 106. B. 103. C. 105. D. 107. (Đề thi thử THPT Quốc Gia lần 2 – THPT chuyên Bến Tre, năm 2015)
Ví dụ 4: Cho 66,2 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,1 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 466,6 gam muối sunfat trung hòa và 10,08 lít (đktc) khí Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là 23/18. Phần trăm khối lượng của Al trong hỗn hợp X gần nhất với giá trị nào sau đây? A. 15. B. 20. C. 25. D. 30. (Đề minh họa kỳ thi THPT Quốc Gia, năm 2015)
DẠYKÈMQUYNHƠN OFFICIAL 14 23 4 Al AlO BaSO NaOH 3 24 4 2 2 23 3 x 4 X T Y Z 2 4 Taco:n0,17mol;n0,03mol;n0,4mol;n0,935mol. Sôñophanöng: HSO NH,AlH Al AlONaNO NONa,SO AlO BaSO 2 2 4 x 4 2 4 W AlO Na NatrongYNatrongZ SO NO NH SO,Na BTAl:n0,23BTÑTtrongW:n1,03 TrongW BTNa:n n 0,095 BTS:n0,4 BTÑTtrongZ:n0,015;BTN:n0,08 BTE:3.0,170,08(52x)0,015.20,015. T x0,25
8m1,471,5gam
2 BaCldö NaOHpömax
dụ 4.1: Đốt 58,05 gam Al bằng 16,8 lít khí O2 (đktc) thu được hỗn hợp A. Hòa tan hỗn hợp A trong 800 gam dung dịch B chứa H2SO4 và NaNO3, thu được dung dịch C chỉ chứa muối và m gam hỗn hợp khí (trong đó có 0,4 gam khí H2). Cho BaCl2 dư vào C thấy có 838,8 gam kết tủa xuất hiện. Mặt khác, cho 39 gam K vào dung dịch C sau khi các phản ứng xảy ra thì thấy khối lượng dung dịch tăng 12,9 gam. (Biết các phản ứng xảy ra hoàn toàn và giả thiết chất khí không hòa tan vào nước). Nồng độ phần trăm của muối Al trong dung dịch C là A. 42,26%. B. 41,15%. C. 43,27%. D. 38,35%. Ví dụ 4.2: Cho 82,05 gam hỗn hợp A gồm Al và Al2O3 (có tỷ lệ mol 2,3 : 1) tan hoàn toàn trong dung dịch B chứa H2SO4 và NaNO3 thu được dung dịch C chỉ chứa 3 muối và m gam hỗn hợp khí D (trong D có 0,2 mol khí H2). Cho BaCl2 dư vào C thấy có 838,8 gam kết tủa xuất hiện. Mặt khác cho 23 gam Na vào dung dịch C sau khi các phản ứng xảy ra hoàn toàn thì thấy khối lượng dung dịch giảm 3,1 gam. Giá trị của m gần nhất với A. 16. B. 13. C. 12. D. 15. Ví dụ 4.3: Hòa tan 54,24 gam hỗn hợp X gồm Mg, Fe3O4, MgCO3 và Fe(NO3)2 (trong đó oxi chiếm 31,858% về khối lượng hỗn hợp) vào dung dịch chứa 0,04 mol NaNO3 và 2,24 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung
DẠYKÈMQUYNHƠN OFFICIAL 15 Hướng dẫn giải 2 2 2 Z 2 HNO H NO H NO 34 32 4 3,1mol 66,2gam 23.4 H M 5,11 Zgom 18 NO Zgom2khítrongñocoNO(hoanau) nn0,45 n0,4 0,45234 n0,05 2n30n 2,3 18 Sôñophanöng: FeO Fe(NO)KHSO Al 2 4 32 34 233 2 2 2 4 4 ?mol 2,3gam 466,6gam HO NH Fe(NO) FeO Fe,Fe,AlHHO NH,SO NO 66,23,1136466,62,3BTKL:n 1,05 18 3,11,05.20,4.2BTH:n 0,05 4 BTN:n0,05 1,050,05BT:n Al Al m10,8 A %m16,3% 0,0560,2 4 Ví dụ
:
tương tự
Ví
dịch Y và 0,16 mol hỗn hợp khí Z gồm 2 khí có tỉ khối so với He bằng 11. Cho dung dịch AgNO3 dư vào dung dịch Y, kết thúc phản ứng, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất); đồng thời thu được 334,4 gam kết tủa. Nếu cô cạn dung dịch Y thu được 111,44 gam muối. Phần trăm khối lượng của Fe3O4 có trong hỗn hợp X là A. 25,66%. B. 28,32%. C. 39,82%. D. 6,19%.
Ví dụ 5: Cho m1 gam hỗn hợp X chứa Al, Fe(NO3)2 và 0,1 mol Fe3O4 tan hết trong dung dịch chứa 1,025 mol H2SO4. Sau phản ứng thu được 5,04 lít (đktc) hỗn hợp khí Y gồm hai khí có tỉ khối so với H2 là 31/3, trong đó có một khí hóa nâu ngoài không khí và dung dịch Z chỉ chứa các muối sunfat trung hòa. Cho Z phản ứng với dung dịch NaOH dư, không thấy tạo kết tủa nâu đỏ. Cho BaCl2 vào Z để kết tủa vừa hết ion , sau đó cho tiếp dung dịch AgNO3 dư vào thì thu được m2 gam 2 4SO kết tủa. Biết các phản ứng hoàn toàn. Giá trị của tổng (m1 + m2) là A. 389,175. B. 585,0. C. 406,8. D. 628,2. Hướng dẫn giải
OFFICIAL
DẠYKÈMQUYNHƠN
16
24HSO 1,025mol
275,42 gam muối sunfat trung hòa (không có Fe3+) và 6,272 lít khí (đktc) Z gồm 2 khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 11. Phần trăm khối lượng của Mg trong hỗn hợp X là A. 25,5%. B. 20,2%. C. 19,8%. D. 22,6%. Ví dụ 6: Hòa tan hết 13,52 gam hỗn hợp X gồm Mg(NO3)2, Al2O3, Mg và Al vào dung dịch chứa hai chất tan NaNO3 và 1,08 mol HCl. Sau khi kết thức phản ứng, thu được dung dịch Y chỉ chứa các muối và 3,136 lít (đktc) hỗn hợp khí Z gồm N2O và H2, có tỉ khối so với He bằng 5. Dung dịch Y tác dụng tối đa với dung dịch chứa 1,14 mol NaOH, lấy kết tủa nung ngoài không khí tới khối lượng không đổi thu được 9,6 gam rắn. Phần trăm khối lượng của Al có trong hỗn hợp X là :
DẠYKÈMQUYNHƠN OFFICIAL 17 2 Y Y 3 2 khíY 32 34 Ygom2khí,motkhíhoanauYH:0,075mol gom 31.2 M;n0,225 NO:0,15mol 3 ZNaOHdö:khongtaokettuanauñoZkhongcoFe. Sôñophanöng: H:0,075 NO:0,15 Al Fe(NO):x FeO 2 3 1 2 24 2 2 2 4 4 32 choBaCltröôc 2sauñochoAgNO 4 4 dungdòchZ honhôpX,mgam mgam 2 HSO H HOHO NH BaSO Al,Fe AgCl NH,SO Ag :0,1mol HO BTH:2n2n4n2nn0,8752n 4 32 4 2 2 2 3 4 2 3 2 4 NH Fe(NO)NONH 0,15 x y (NO,H) HO NO OH NH 02,05 ,4 (0,952y) 4,65 y 2x Fe 1 Al BaClBaSO BTN:2nnn BTKL:62n16nnm18n18n n0,4x0,1TrongZ m52gam y0,05 BTÑT:n0,4 nn1,02 2 4 AgCl AgFe 12 2BaSOAgClAg 5;n2,05;nn0,4 mm628,2 mmmm576,2gam Ví dụ tương tự : Ví dụ 5.1: Cho 50,82 gam hỗn hợp X gồm
3
2
dịch
thu được
NaNO3, Fe
O4, Fe(NO3)
và Mg tan hoàn toàn trong dung
chứa 1,8 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn
dung dịch Y chỉ chứa
DẠYKÈMQUYNHƠN OFFICIAL 18 A.
dẫn giải 2 2 2
honhôpZ 32 23 2 13,52gamhonhôpX 3 2 4 dungdòchY 2 Sôñophanöng: NO:0,06mol HOMgO H:0,08mol Mg(NO) AlO Mg(OH) Al,Mg Al,Mg Na,NH Cl Na,Cl AlO dungdòchZ 2 3 2 4 2 AlO ClNa 1,08a1,14?(a0,06) Al Mg Na Cl NH muoi/Y H HO ddZ:nnn 3(a0,06)0,24.2ab1,08(1)na0,06;n0,24 ddY: na;n1,08:nb m27(a0,06)0,24.2423a18b1,08.35,550a18b45,72 n n 2 4 NaNO X 3(NO,H) HCl muoi/Y 22 HO 2 ClH NH m m m m m m 2n4n1,080,08.24b(0,462b) 2 2 13,521,0836,585a2,850a18b45,7218(0,462b)(2) 4ab0,42a0,1Tö(1),(2)suyra:35a18b3,86 2 3 4 32 2 2 4 NO NaNONH Mg(NO) Mg Al AlMg H NONH ? 0,220,080,06 0,02 b0,02 2nnn n 0,02;n0,22n0,12 2 3n2n2n8n8n %Al23,96% 3 HCl:1,08mol NaNO:amol NaOH 1,14mol ot
31,95%. B. 19,97%. C. 23,96%. D. 27,96%. Hướng
0,24mol
Ví dụ tương tự : Ví dụ 6.1: Hòa tan hết m gam hỗn hợp rắn A gồm Mg, Cu(NO3)2, Fe, FeCO3 vào dung dịch chứa H2SO4 và 0,045 mol NaNO3 thu được dung dịch B chỉ chứa 62,605 gam các muối và thấy thoát ra 3,808 lít (đktc) hỗn hợp khí C gồm N2, NO2, N2O, NO, H2, CO2 có tỉ khối so với H2 bằng (trong C có chứa 0,02 mol H2). Cho 304 17
OFFICIAL
dung dịch NaOH 1M vào dung dịch B đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì dùng hết 865 ml. Mặt khác, cho 94,64 gam BaCl2 vào B sau đó cho tiếp AgNO3 dư vào thì thu được 256,04 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 28,4. B. 27,2 C. 32,8. D. 34,6. Ví dụ 6.2: Cho 87,35 gam hỗn hợp X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dung dịch chứa 3,425 mol KHSO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 516,125 gam muối và 8,12 lít hỗn hợp khí Z gồm 2 khí (đktc) trong đó có 1 khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với He là . Phần trăm khối lượng của Al trong X gần nhất với 365 58 A. 11%. B. 10%. C. 12%. D. 13%. ĐÁP ÁN VÍ DỤ TƯƠNG TỰ 1.1B 1.2D 1.3B 2.1A 2.2B 3.1A 3.2C 4.1A 4.2C 4.3A 5.1A 6.1B 6.2A
BÀI TẬP VÔ CƠ HAY VÀ KHÓ DÀNH ĐIỂM 9, 10 Câu : Cho 12 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 tác dụng với 500 ml dung dịch HNO3 aM, thu được 2,24 lít NO (đktc) và dung dịch X. X có thể hoà tan tối đa 9,24 gam sắt. Giá trị của a là (biết NO là sản phẩm khử duy nhất của N+5) A. 1,28. B. 1,64. C. 1,88. D. 1,68. Trong phản ứng của 12 gam hỗn hợp Fe và các oxit của nó với HNO3, theo bảo toàn khối lượng
DẠYKÈMQUYNHƠN
19
và
ta có
FeO Fe FeONO O 0,1 Fethamgiavaotoanboquatrìnhphanöng 56n16n12n0,18 3n2n3nn0,12 9,24 n 0,18 0,345. 56 Xét toàn bộ quá trình phản ứng, ta thấy : Sau tất cả các phản ứng, dung dịch thu được chứa muối Fe(NO3)2. Áp dụng bảo toàn electron cho toàn bộ quá trình phản ứng, ta có :
bảo toàn electron,
:
: Cho 46,8 gam hỗn hợp CuO và Fe3O4 (tỉ lệ mol 1 : 1) tan hết trong dung dịch H2SO4 (loãng, vừa đủ) thu được dung dịch (A). Cho m gam Mg vào dung dịch (A), sau khi phản ứng kết thúc thu được dung dịch (B). Thêm dung dịch KOH dư vào (B) được kết tủa (D). Nung (D) trong không khí đến khối lượng không đổi được 45,0 gam chất rắn (E). Giá trị của m là: A. 7,2 gam. B. 5,4 gam. C. 4,8 gam. D. 9,0 gam. (Đề thi thử Đại học lần 2 – THPT Đinh Chương Dương – Thanh Hóa, năm học 2013 – 2014) Bản chất phản ứng (không quan tâm đến hệ
DẠYKÈMQUYNHƠN OFFICIAL 20 FeONO
NO
HNOFe(NO)NOHNO
? nFe
n0,15
24 42 3424 42432 CuOHSOCuSOHO FeOHSOFeSOFe(SO)HO Theo giả thiết và bảo toàn electron, ta có : CuSO4 CuO FeO CuO 34 FeSO4 FeO CuOFeO 34 34 Fe(SO)
n0,15 80n232n46,8n0,15 Acon0,15;n0,15 nn n 0,15 Nếu lượng Mg cho vào dung dịch A không đủ để tạo ra Cu thì chỉ riêng khối lượng của CuO và Fe2O3 trong E đã lớn hơn 45 gam. Thật vậy : CuO FeO CuOCuSO 23 4 FeOFeO ECuOFeO 23 34 23 n0,15;n0,225 nn0,15 3n3n3.0,150,45mmm48gam(loai) Vậy khi cho Mg vào A phải có kim loại bị tách ra. Nếu chỉ có Cu bị tách ra, theo bảo toàn electron và bảo toàn nguyên tố Mg, Cu, Fe, ta có : Mg3 2 Fe Cu x0,3 y MgOCuO FeO23 0,15y x 0,225 2nn2n 2x2y0,3 40x80y340n80n160n45 x0,375(loai) y0,2250,15
0,3450,12?
3
3 32 3
2n2n3n
0,84[HNO] 1,68M n2n nn0,84 0,5
Câu
số cân bằng):
243
56n64n15,2 n0,1 3.4,48 n0,15 3n2n3n 0,6 22,4
Xét toàn bộ quá trình phản ứng ta thấy: Bản chất phản ứng là Mg, Fe, Cu tác dụng với dung dịch HNO3 giải phóng khí NO. Thứ tự tính khử của kim loại : 2 MgFeCuFe. Theo bảo toàn electron, ta có:
X
bình kín, thu được chất rắn
rắn Y
2
DẠYKÈMQUYNHƠN OFFICIAL 21 Vậy
Mg3
y MgO
Mg x
Câu
MgFeCupö NO 0,10,165 ? 2n2n2n3n3.0,210,63 Cupö Cudö chatranCudö n0,05;n0,1 mm6,4gam Câu
có cả Cu và Fe bị tách ra. Theo bảo toàn electron và bảo toàn nguyên tố Mg, Cu, Fe, ta có : hành nhiệt
2 2 FeCu Fepö x0,30,15
FeO23
0,2250,5y 2nn2n2n x0,375 2x2y0,6y0,075 40x80y9 40n160n45 m0,375.249gam
: Hòa tan hết 15,2 gam hỗn hợp gồm Fe và Cu bằng dung dịch HNO3, thu được dung dịch X và 4,48 lít khí NO ( đktc). Thêm từ từ 3,96 gam kim loại Mg vào hỗn hợp X đến khi phản ứng xảy ra hoàn toàn, thu được 224 ml khí NO (đktc), dung dịch Y và m gam chất rắn không tan. Biết NO là sản phẩm khử duy nhất của N+5 trong các phản ứng. Giá trị của m là: A. 9,6. B. 12,4. C. 15,2. D. 6,4. (Đề thi thử Đại học lần 1 – THPT Đặng Thúc Hứa – Nghệ An, năm 2014) Theo giả thiết và bảo toàn electron trong phản ứng của Fe, Cu với dung dịch HNO3, ta có : FeCu Fe Cu FeCuNO
: Tiến
phân hoàn toàn m
gam hỗn hợp
gồm Cu(NO3)
và Cu trong một
Y có khối lượng (m – 7,36) gam. Cho toàn bộ chất
tác dụng với dung dịch H2SO4 đặc, nóng (dư), đến khi phản ứng xảy ra hoàn toàn, thu được 0,672 lít SO2 (đktc) là sản phẩm khử duy nhất. Giá trị m là: A. 19,52 gam. B. 20,16 gam. C. 22,08 gam. D. 25,28 gam. (Đề thi thử ĐH lần 1 – THPT chuyên Nguyễn Huệ – Hà Nội, năm học 2013 – 2014) ● Cách 1 : Chất rắn Y tác dụng với dung dịch H2SO4 đặc giải phóng SO2, chứng tỏ trong Y còn Cu. Vậy bản chất phản ứng là : Cu(NO3)2 bị nhiệt phân tạo ra NO2 và O2;
DẠYKÈMQUYNHƠN OFFICIAL 22 O2 sinh ra oxi hóa một phần Cu, tạo ra CuO; phần Cu còn lại phản ứng với H2SO4 đặc, giải phóng SO2. Suy ra khối lượng chất rắn giảm là khối lượng của NO2. Sơ đồ phản ứng : 2 32 HSO24 42 NO Cu Cu(NO) CuO CuSOSO Cu Trong phản ứng nhiệt phân Cu(NO3)2, theo giả thiết và bảo toàn electron, ta có : NO NO 2 2 O2 ONO22 7,36 n0,16 n 0,16 46 n0,044nn0,16 Theo bảo toàn nguyên tố N và bảo toàn electron cho toàn bộ quá trình phản ứng, ta có : Cu(NO) Cu Cu(NO)NO 32 322 CuOSO Cu(NO)Cu 2 2 32 ? 0,1164 0,040,03 0,08.188 n 0,08;n0,11 2n n0,16 2n4n2n mm m22,08gam ● Cách 2 : Chất rắn Y tác dụng với dung dịch H2SO4 đặc giải phóng SO2, chứng tỏ trong Y còn Cu. Sơ đồ phản ứng : 4 2 0 25 32 6 2 4 HSO24 4 2 NO Cu Cu(NO) CuO CuSOSO Cu Căn cứ vào toàn bộ quá trình phản ứng, ta thấy : Chất khử là Cu; chất oxi hóa là và , sản phẩm khử tương ứng là Khối lượng chất rắn 5 N 6 S 4 4 2 2 NOvaSO. giảm là khối lượng của NO2 thoát ra. ot ot
Câu : Cho 0,5 mol Mg và 0,2 mol Mg(NO3)2 vào bình kín không có oxi rồi nung ở nhiệt độ cao đến phản ứng hoàn
ot
Nhỏ dung dịch HNO3 loãng, dư vào dung dịch Y thì thấy thoát ra thêm 56 ml khí NO (đktc) nữa. Cũng lượng dung dịch X ở trên, cho phản ứng với dung dịch NaOH dư, thu được 5,6 gam kết tủa. Biết NO là sản phẩm khử duy nhất của N+5. Giá trị m là
DẠYKÈMQUYNHƠN OFFICIAL 23
chất rắn X tác
Giá trị của a
Mg(NO) Mg(NO) MgO MgO Mg Fe(NO) Xét toàn bộ quá trình phản ứng, ta thấy: Chất khử là Mg; chất oxi hóa là . 53 NvaFe Theo bảo toàn nguyên tố N và bảo toàn electron, ta có : NOMg(NO) Fe(NO)max 2 32 33 MgNOFe(NO)max 2 33 33 0,50,4 ? n2n 20,20,4n 0,6 2nnn 0,6 [Fe(NO)]1,2M 0,5 PS : Lượng Fe(NO3)3 dùng nhiều nhất khi Fe3+ bị khử thành Fe2+ . Câu : Hòa tan hết m gam hỗn hợp Fe, Mg vào 100 ml dung dịch H2SO4 loãng, thu được dung dịch X. Cho dung dịch X tác dụng với lượng dư KNO3, thu được dung dịch Y và 168 ml khí NO (đktc).
Theo bảo toàn nguyên tố N và bảo toàn electron cho toàn bộ quá trình phản ứng, ta có :
Cu(NO) Cu 32 Cu(NO)NO 322 Cu(NO)Cu 32 CuNOSO 2 2 0,1164 ? 0,08188 0,160,03 7,36 n 0,08;n0,11 2n n 0,16 46 mm m22,08gam 2nn2n
toàn, thu được hỗn hợp chất rắn X. Hỗn hợp
dụng với nhiều nhất 500 ml dung dịch Fe(NO3)3 có nồng độ aM.
là A. 0,667. B. 0,4. C. 2. D. 1,2. (Đề thi thử Đại học lần 1 – THPT chuyên Quảng Bình, năm học 2013 – 2014) Sơ đồ phản ứng : 4 2 0 5 32 2 3 2 Fe(NO) 32 33 2 32 NO Mg
3,52. B. 2,96. C. 2,42. D. 2,88. (Đề thi chọn học sinh giỏi tỉnh Nam Định, năm học 2013 – 2014)
0,01 mol NO. Bản chất phản ứng (4) là phản ứng trao đổi, kết tủa thu được là Fe(OH)2 và Mg(OH)2. Theo bảo toàn electron, giả thiết và bảo toàn nguyên tố Fe, Mg, ta có :
: Dẫn 1 luồng hơi nước qua than nóng đỏ thì thu được V lít (ở đktc) hỗn hợp khí X gồm CO2, CO, H2, tỉ khối hơi của X so với H2 là 7,8. Toàn bộ V lít hợp khí X trên khử vừa đủ 24 gam hỗn hợp CuO, Fe2O3 nung nóng thu được rắn Y chỉ có 2 kim loại. Ngâm toàn bộ Y vào dung dịch HCl dư thấy có 4,48 lít H2 bay ra (ở đktc). Giá trị V là A. 13,44 lít. B. 10,08 lít. C. 8,96 lít. D. 11,20 lít. (Đề thi chọn học sinh giỏi tỉnh Nam Định, năm học 2011 – 2012)
DẠYKÈMQUYNHƠN OFFICIAL 24
Sơ
: 22 HSO24 (1) 2 4 ddX 23 22 4 3 32 2 2 4 2 3 NO Fe,Mg Fe NO Mg SO,H Fe,Fe Mg,SO K,NO Fe,Mg Mg(OH) H,SO Fe(OH) K,NO Bản
e x0,01
m
x y n3n
90n58n
FeOFeH FeO 23 2 23 (CuO,FeO)FeO 23 23 CuO CuO 2nnn0,2n0,1 m m 240,1160 n 0,1 n 80 80 3KNO (2) 3HNO (3) (4)NaOH
A.
đồ phản ứng
chất phản ứng (2), (3) là Fe2+ bị oxi hóa hoàn toàn bởi , tạo ra 3 NO/H
F2NO
Fe(OH)2Mg(OH)2
Fm e Mg
x0,03m0,03.560,05.242,88gam
5,6y0,05
Câu
Theo bảo toàn nguyên tố Fe, bảo toàn electron và bảo toàn khối lượng, ta có :
Câu : Hòa tan hoàn toàn 0,1 mol FeS2 trong 200 ml dung dịch HNO3 4M, sản phẩm thu được gồm dung dịch X và một chất khí thoát ra. Dung dịch X có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Giá trị của m là : A. 12,8. B. 6,4. C. 9,6. D. 3,2. (Đề thi tuyển sinh đại học khối B năm 2012) Sơ đồ phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 25
COCOH
COCOH CO
COCOH CO
COHCuOFeO
nnn
2 3 2 4 3 22 2 34 NO NO FeS Fe,SO NO,H Cu,Fe NO,SO Áp dụng bảo toàn electron cho toàn bộ quá trình phản ứng, bảo toàn điện tích cho dung dịch sau phản ứng và bảo toàn nguyên tố Fe, S, N, Cu, ta có : FeSCuNO 2 x y 0,1 2 2 2 Fe Cu SO4NO3 0,1 x 0,20,8y 14n2n3n 2x3y1,4x0,2 2n2n2nn 2xy1y0,6 + + -ì ï += ï ï ï ì ì ï ï ï-=- = ï ï ï Þ Þ í í í + = + ï ï ï += = ï ï ï î î ï ï ï ï î Suy ra : Cu m0,2.6412,8gam == Câu : Hòa tan hết 10,24 gam hỗn hợp X gồm Fe và Fe3O4 bằng dung dịch chứa 0,1 mol H2SO4 và 0,5 mol HNO3, thu được dung dịch Y và hỗn hợp gồm 0,1 mol NO và a mol NO2 (không còn sản phẩm khử nào khác). Chia dung dịch Y thành hai phần bằng nhau: - Phần một tác dụng với 500 ml dung dịch KOH 0,4M, thu được 5,35 gam một chất kết tủa. 3HNO Cu
Theo giả thiết, theo bảo toàn electron trong phản ứng của C với H2O và phản ứng của CO, H2 với CuO, Fe2O3, ta có :
22
22
(CO,CO,H) 22 2 22
H 2 23 2 0,1 0,1 28n44n2n 7,8.215,6
n0,1 2n4n2n n0,1n 11,2lít 2n2n2n6n n0,3
- Phần hai tác dụng với dung dịch Ba(OH)2 dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 20,62. B. 41,24. C. 20,21. D. 31,86. (Đề thi tuyển sinh khối B năm 2014)
Hướng dẫn giải Xét phản ứng của một nửa hỗn hợp X. Chất kết tủa thu được là Fe(OH)3 (0,05 mol). Theo giả thiết, bảo toàn electron, bảo toàn nguyên tố Fe, N và bảo toàn điện tích trong
Câu : Điện phân dung dịch hỗn hợp CuSO4 (0,05 mol) và NaCl bằng dòng điện có cường độ không đổi 2A (điện cực trơ, màng ngăn xốp). Sau thời gian t giây thì ngừng điện phân, thu được dung dịch Y và khí ở hai điện cực có tổng thể tích là 2,24 lít (đktc). Dung dịch Y hòa tan tối đa 0,8 gam MgO. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của t là A. 6755. B. 772. C. 8685. D. 4825. (Đề thi tuyển sinh Cao đẳng năm 2014) Hướng dẫn giải Dung dịch Y hòa tan được MgO chứng tỏ Y có chứa ion H+. Suy ra trong Y có chứa các ion H+, Na+ và . 2 4SOÁp dụng bảo toàn điện tích trong phản ứng của Y với MgO và bảo toàn điện tích trong Y, ta có :
DẠYKÈMQUYNHƠN
26
OFFICIAL
Fe FeO34 x y FeFeONONO 34 2 x 0,050,5a y 3 2 Fe K SO NO 4 3 0,2x3y0,05 0,050,250,050,5a 10,2456n232n 5,12 2 56x232y5,12 3nn3nn 3xy0,5a0,15 3x9y 3nn2n n + + -+-ì ï ï+ == ï ï ï ï += ï ï ï ï+=+ Þ+-= ï í ï + ï ï ï ï += + ï ï ï ï ï ï î x0,05 y0,01 0,5a0,25a0,02 ì ì ï ï= ï ï ï ï ï ï Þ= í í ï ï ï ï+= = ï ï ï ï î î Suy ra : 3 Ba(OH)dö 3 2 2 4 4 3 m
ettua
Fe:0,08mol Fe(OH):0,08mol SO:0,05molY
+ ++= + = ì ï ï ï ì ï ¯ ï ï ï Þ ® í í ï ï¯ ï ï î ï ï ï î
một nửa dung dịch Y, ta có :
k0,081070,0523320,21gam
1nöadungdichY
BaSO:0,05mol H,NO
: Cho a gam hỗn hợp X gồm Fe2O3, Fe3O4, Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp X bằng H2 dư, thu được 42 gam chất rắn. Tính % khối lượng Cu trong hỗn hợp X? A. 25,6%. B. 50%. C. 44,8%. D. 32%. (Đề thi thử Đại học lần 1 – THPT chuyên Chu Văn An – Hà Nội, năm 2014) Theo giả thiết, suy ra : Khử X bằng H2 dư, thu được 42 gam Fe và Cu. Áp dụng bảo toàn điện tích trong phản ứng và bảo toàn khối lượng, ta có :
DẠYKÈMQUYNHƠN OFFICIAL 27 2
H O
nn2n
+ -
+ +ì ï ï ï==== ì ï== ï ï ï ï ï Þ í í ï+= ï = ï ï ï ï î ï ï ï î Theo
2
n
+ ì ï + + = ï ï ï ï ï í ï + =
ï ï ï ï ï î
n
t
ì ï = = ï ï ï Þí
ï ï= = = ï ï î
2 2 2 2 2334 OH O
X(Cu,Fe) (Cu,Fe) O O
a 0,516 42 42 2nn1 n0,5 m0,256a12,8 mmmamm50 m 37,2 Trong phản ứng của 37,2 gam Fe2O3, Fe3O4, Cu với HCl, chất khử là Cu, chất oxi hóa là các oxit sắt. Áp dụng bảo toàn electron, bảo toàn điện tích trong dung dịch muối sau phản ứng, ta có : 34 23 2 2 34 23 FeOFeOCu z x y Fe CuCl 3x2yz FeO FeO Cu z x y nnn xyz0 x0,05 2n2nn1 6x4y2z1 y0,1 232x160y64z37,2z0,15 232n160n64n37,2 Vậy Cu/X %12,80,15.64 m .100%44,8% 50
MgO
ClNa 2 NaH SO Cl(ôanot) 4 2 ?0,040,05 2.0,8n2n2n40,04nn0,06 0
n 0,03
- +
giả thiết và bảo toàn electron, ta có : O(ôanot)H(ôcatot)Cl 2 2 2(ôanot) 0,03
H(ôcatot)Cl O(ôanot) 2 2(ôanot) 2 Cu 0,05 0,03
n n 0,1 2n2n 2n 4n
+
H(ôcatot) O(ôanot) 2 2 ClO electrontraoñoi 2 2
0,04;n 0,03 (2n4n)96500 n .F
8685giay I 2
+
Câu
Cudö
(FeO,FeO,Cu)pö
Câu : Tiến hành điện phân dung dịch chứa m gam hỗn hợp CuSO4 và NaCl (hiệu suất 100%, điện cực trơ, màng ngăn xốp), đến khi nước bắt đầu bị điện phân ở cả hai điện cực thì ngừng điện phân, thu được dung dịch X và 6,72 lít khí (đktc) ở anot. Dung dịch X hòa tan tối đa 20,4 gam Al2O3. Giá trị của m là A. 25,6. B. 23,5 C. 51,1. D. 50,4. (Đề thi tuyển sinh Đại học khối A năm 2013) Thứ tự khử trên catot : Cu2+ > H2O; Thứ tự oxi hóa trên anot: > H2O. Cl
Dung dịch X sau phản ứng điện phân hòa tan được Al2O3, chứng tỏ trong X chứa axit (H+) hoặc bazơ (). OH Nếu dung dịch X chứa thì khí sinh ra ở anot là Cl2 (0,3 mol). Trong dung OH dịch X chứa các ion âm là và và ion dương là Na+ . 2 4 SOOH Vậy ion trong NaCl đã
OFFICIAL
DẠYKÈMQUYNHƠN
28
được thay thế bằng ion và . Cl 2 4 SOOH Áp dụng bảo toàn điện tích trong dung dịch sau điện phân và trong phản ứng của Al2O3 với , ta có: OH 2 Cl2OHSOCl 4 CuSO 2 4 0,3 OH SO4 2 AlO NaCl SO 23 OH[Al(OH)] Cl 4 4 0,2 n2nn2n0,6 n0,4nn0,1 n0,1 nn 2n0,4 nn0,6 Suy ra CuSONaCl 4 0,658,50,1160 mmm51,1gam Nếu dung dịch sau điện phân chứa H+ thì khí sinh ra là Cl2 và O2. Theo giả thiết và áp dụng bảo toàn điện tích ta có: 3 AlO23 HAl O Cl 2 2 2 O2 HOtrongHO 2 n3n3.2n1,2 n0,3n0(loai) n2n 22n Câu : Hoà tan hết 12,8 gam hỗn hợp X gồm Cu2S và FeS2 trong dung dịch có chứa a mol HNO3 thu được 31,36 lít khí NO2 (ở đktc và là sản phẩm duy nhất của sự khử N+5) và dung dịch Y. Biết Y phản ứng tối đa với 4,48 gam Cu giải phóng khí NO. Tính a ? A. 1,8 mol. B. 1,44 mol. C. 1,92 mol. D. 1,42 mol. (Đề thi thử Đại học lần 2 – THPT Đoan Hùng – Phú Thọ, năm học 2013 – 2014) Theo giả thiết và áp dụng bảo toàn electron cho phản ứng của X với HNO3, ta có: CuS FeS CuS 2 2 2 CuSFeSNO FeS 2 22 2 160n120n12,8n0,02 10n15nn1,4n0,08
Câu : Cho m gam Fe vào 1 lít dung dịch X gồm H2SO4 0,1M, Cu(NO3)2 0,1M, Fe(NO3)3 0,1M. Sau khi phản ứng xảy ra hoàn toàn thu được 0,69m gam hỗn hợp kim loại, dung dịch Y và khí NO (sản phẩm khử duy nhất). Giá trị m và khối lượng chất rắn khan thu được khi cô cạn dung dịch Y là: A. 25,8 và 78,5. B. 25,8 và 55,7. C. 20 và 78,5. D. 20 và 55,7. (Đề thi thử Đại học lần 3 – THPT Cẩm Khê – Phú Thọ, năm học 2013 – 2014)
Trong phản ứng của Fe với dung dịch X, chất khử là Fe, chất oxi hóa là 3 NO/H , Fe3+ và Cu2+. Sau phản ứng thu được hỗn
DẠYKÈMQUYNHƠN OFFICIAL 29
ion
trong
để cân bằng điện tích, đó là ion . 3NO Áp dụng bảo toàn electron và bảo toàn điện tích trong dung dịch Z, ta có : CuSFeSCuNONO 2 2 2 0,07 ? NO 0,02 0,08 1,4 2 2 2 NO Cu FeSONO 3 4 3 0,110,080,18? 10n14n2nn3n n0,02 n0,02 2n2nnn Áp
Dung dịch Y gồm Fe3+, Cu2+, ,, H+. Khi cho Cu (tối đa) vào Y, Cu 2 4SO 3NO bị oxi hóa bởi (H+, ) và Fe3+ . Vậy bản chất của bài toán là: Hỗn hợp 3NO Cu2S, FeS2 và Cu tác dụng với dung dịch HNO3, giải phóng hỗn hợp khí NO, NO2 và tạo ra dung dịch muối (Z). Dung dịch Z có các ion Fe2+, Cu2+ , , 2 4SO
còn lại là H+ hoặc . Vì nên ion còn lại 3NO 2 2 2 Cu Fe SO4 2n2n2n
dung dịch Z là ion âm
dụng bảo toàn nguyên tố N, ta có:
HNONONO 32 NO3 10,02 ,4 0,02 nnnn1,44mol
hợp kim loại, chứng tỏ Fe dư nên muối tạo thành trong dung dịch là Fe2+ . Áp dụng bảo toàn electron trong phản ứng của Fe với dung dịch X, bảo toàn điện tích trong dung dịch Y và bảo toàn nguyên tố Fe, N, ta có : 3 2 2 2 4 3 Fe NO Fe Cu x y 0,1 0,1 Fe SONO x0,1 0,10,5y 2nn2n3n 2x3y0,3x0,225 2n2nn 2xy0,5y0,05 Theo bảo toàn khối lượng, ta có :
nn0,431,2mol;nn0,3520,7mol; 21,4 n 0,2mol 107 FeO x y FeONO xyz NO 3 NaFeNO3 0,7x0,21,2z
Dung dịch Z chứa và có thể còn . 3Na,NO 3Fe Quy đổi hỗn hợp X thành Fe và O. Theo bảo toàn khối lượng, bảo toàn electron, bảo toàn điện tích cho dung dịch Z và bảo toàn nguyên tố N, Fe, ta có : 56n16n19,2 x0,3 56x16y19,2y0,15 3n2n3n 3x2y3z0z0,2 3xz1,1 V4,48lít n3nn
Câu : Hòa tan hết 31,2 gam hỗn hợp Fe, FeO, Fe2O3 vào 800 ml dung dịch HNO3 2M vừa đủ, thu được V lít NO (đktc, sản phẩm khử duy nhất) và dung dịch X. Dung dịch X hòa tan tối đa 9,6 gam Cu. Giá trị của V là: A. 8,21 lít B. 6,72 lít C. 3,36 lít D. 3,73 lít (Đề thi thử Đại học lần 1 – THPT chuyên KHTN Huế, năm học 2013 – 2014) Sơ đồ phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 30
2 2 4 3 Fedö Cu muoiFe SO NO 0,325560,1960,4562 honhôpkimloai m m mmmm55,7gam m m0,225.560,1.640,69mm20gam
Câu : Hòa tan hoàn toàn 19,2 gam hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4 trong 400 ml dung dịch HNO3 3M (dư), đun nóng, thu được dung dịch Y và V lít khí NO (là sản phẩm khử duy nhất). Cho 350 ml dung dịch NaOH 2M vào dung dịch Y, thu được 21,4 gam kết tủa và dung dịch Z. Giá trị của V là : A. 3,36. B. 5,04. C. 5,6. D. 4,48. (Đề thi thử Đại học lần 1 – Trường THPT Lê Hồng Phong – Nam Định, năm học 2011 – 2012) Theo giả thiết, ta có : HNO NaOH 3 NO Na 3 Fe(OH)3
dung
HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m là A. 61,375. B. 64,05. C. 57,975. D. 49,775. (Đề thi thử Đại học lần 1 – Trường THPT Chuyên – Đại học Vinh, năm học 2013 – 2014)
Theo giả thiết, suy ra trong Y có NO (khí không màu hóa nâu trong không khí). Mặt khác, khí còn lại trong Y là H2. Vì đã có H2 sinh ra Y M12,2.224,4 nên không còn trong dung dịch X.
DẠYKÈMQUYNHƠN OFFICIAL 31 quyñoi 23 3 22 Cu 3 3 NO Fe Fe FeO O FeO Fe Fe,Cu NO NO Xét toàn bộ quá trình phản ứng, ta thấy: Chất khử là Fe, Cu; chất oxi hóa là O và trong HNO3. Theo bảo toàn electron, bảo toàn điện tích trong dung dịch 5N sau phản ứng và giả thiết, ta có : FeCuONO x0,15yz 2 2 Fe CuNO3 x 0,151,6z NO(ñktc) FeO x y 2n2n2n3n x0,5 2x2y3z0,3y0,2 2n2nn 2xz1,3 z0,3 56x16y31,2V 6,72lít 56n16n31,2
:
Câu
Cho Zn tới dư vào
dịch gồm
3
Theo
thiết, bảo toàn nguyên tố N, bảo toàn electron, ta có : NONHNObñ 4 3 0,1 NOH NO 0,15 2 H NOH ZnH NO 2 2 2NH4 ? 0,10,0250,05 nnn0,05 nn0,125 n0,1 n0,02530n2n24,4.0,125 2n2n8n3n Zn n0,375 Theo bảo toàn điện tích trong dung dịch X và bảo toàn khối lượng, ta có : 3HNO
NO
giả
Hoặc có thể tính khối lượng muối như sau :
m136n58,5n74,5n53,5n64,05gam
muoi ZnCl NaCl KCl NHCl 2 4 0,05 0,1 0,375 0,05
Đây
Theo bảo toàn electron, bảo toàn nguyên tố N trong toàn bộ quá trình phản ứng; bảo toàn điện tích và bảo toàn khối lượng trong dung dịch X, ta có :
DẠYKÈMQUYNHƠN OFFICIAL 32
2 ClZnNaKNH4 0,37500,1 ,05 0,05 muoiZ2 n Na K NH Cl 4 0,375 0,1 0,05 0,95 0,05
n2nnnn0,95 m65n23n39n18n35,5n64,05gam
là dạng bài tập mới về phản ứng tạo muối amoni. Các em học sinh cần chú ý vì đề thi Đại học năm 2015 có thể ra câu tương tự dựa trên ý tưởng này. Câu : Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3, thu được 0,45 mol khí NO2 (sản phẩm khử duy nhất của N+5) và dung dịch X. Nhỏ tiếp dung dịch H2SO4 vừa đủ vào dung dịch X thu thêm được 0,05 mol khí NO (sản phẩm khử duy nhất) và dung dịch Y. Cô cạn dung dịch Y thu được khối lượng muối khan là. A. 32,50 gam. B. 40,00 gam. C. 29,64 gam. D. 45,60 gam. (Đề thi chọn học sinh giỏi tỉnh Nam Định, năm học 2012 – 2013)
FeNONO 2 Fe ? 0,05 NO/Y 0,45 3 NO 3 2 NO/YNO/X Fe SO NO/Y 3 3 4 3 electrontraoñoiNO muoi3 2 2 NO/X FeNO/YSO 3 3 4 3nn3n n0,2;n 0,4 n nn 3n2nn n n nmmmm S2 O4 muoi n0,1 m45,6gam Câu : Oxi hóa m gam hỗn hợp X gồm Cu và Fe (có tỉ lệ số mol tương ứng là 3 : 2) trong 3,92 lít hỗn
hợp khí Y (đktc) gồm O2 và Cl2, thu được hỗn hợp rắn Z gồm các oxit kim loại và muối clorua. Để hòa tan hoàn toàn lượng hỗn hợp Z cần 150 ml dung dịch HCl 2M thu được dung dịch T, thêm tiếp dung dịch AgNO3 dư vào dung dịch T thì thu được 82,55 gam kết tủa. Giá trị của m là. A. 12,16 gam. B. 7,6 gam. C. 15,2 gam. D. 18,24 gam. (Đề thi chọn học sinh giỏi tỉnh Nam Định, năm học 2012 – 2013) Sơ đồ phản ứng :
Câu : Cho m gam hỗn hợp X gồm Na và K (tỉ lệ mol 1 : 1) vào 500 ml dung dịch chứa hỗn hợp gồm Al2(SO4)3 0,5M và H2SO4 1M sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho dung dịch Y tác dụng với 1,5 lít dung dịch HCl 1M, sau khi phản ứng xảy ra hoàn toàn thu được 23,4 gam kết tủa. Giá trị nhỏ nhất của m là A. 130,2 gam. B. 27,9 gam. C. 105,4 gam. D. 74,4 gam.
DẠYKÈMQUYNHƠN OFFICIAL 33 o AgNOdö 2 t HCl 23 2 3 3xy 2 2 honhôpXhonhôpY dungdòchT honhôpZ CuO,CuCl FeCl,FeCl CCl u Ag FeCl,FeO FeO CuCl AgCl Áp dụng bảo toàn điện tích trong phản ứng của Z với dung dịch HCl, bảo toàn nguyên tố O và giả thiết, ta có : 2O2HO O2 0,3 Cl2 OCl22 n2n4n n0,075 n0,1nn0,175 Xét toàn bộ quá trình phản ứng, ta thấy : Chất khử là Cu, Fe; chất oxi hóa là O2, Cl2, Ag+. Áp dụng bảo toàn electron cho toàn bộ quá trình phản ứng, bảo toàn nguyên tố Cl và giả thiết, ta có : CuFeOCl 2 2Ag 3x2x0,0750,1y AgCl Cl (Cu,Fe)Cu Fe 2 Cl 30,056420,0556 0,10,3 AgCl Ag 0,5 y 2n3n4n2nn y0,1;x0,05 nn2n0,5 m mm15,2gam 108n143,5n82,55
thi
Sơ đồ phản ứng : 3 HCl 24 4 3 (1) (2) 2 2 243 4 4 0,3mol honhôpX dungdòchZ dungdòchY HSO K,Na,[Al(OH)] Al,K,Na K Al(OH) NAl(SO) a SO,Cl SO,OH Khối lượng Na, K đã dùng có giá trị nhỏ nhất khi xảy ra hiện tượng hòa tan một phần kết tủa ở phản ứng (2). Theo bảo toàn nguyên tố Al, gốc và bảo 2 4SO toàn điện tích trong dung dich Z, ta có:
(Đề
chọn học sinh giỏi tỉnh Nam Định, năm học 2011 – 2012)
Câu : Hòa tan hoàn toàn m gam sắt vào dung dịch HNO3, thu được 0,45 mol khí NO2 và dung dịch X (sản phẩm khử duy nhất của N+5). Nhỏ tiếp dung dịch H2SO4 vừa đủ vào dung dịch X, thu thêm được 0,05 mol khí NO (sản phẩm khử duy nhất) và dung dịch Y. Cô cạn Y thu được khối lượng muối khan là A. 40,00 gam. B. 32,50 gam. C. 29,64 gam. D. 45,60 gam. (Đề thi thử Đại học lần 3 – THPT Cẩm Khê – Phú Thọ, năm học 2013 – 2014) Theo giả thiết : Khi cho H2SO4 vào X thấy giải phóng khí NO, chứng tỏ trong X có ion Dung dịch X có thể có ion hoặc không.
DẠYKÈMQUYNHƠN OFFICIAL 34
3 3 Al(OH)3Al/ZAlbñ 2HSOAl(SO) minKNa 24 243 SO4 1,7.391,723 3 2Al/ZKNaClSO4 xx1,50,2 1,25 nnn0,2 x1,7 nn3n 1,25mmm105,4gam 3nnnn2n
2 23 3 3 2 4 3 NO Fe NO Fe,Fe NO Fe SO,NO Ở (2), ta có: H H NO 2 3 SO4 S2 O4H NONO3 n 4 n0,2 n n0,1mol2nn0,2 nn0,05 Áp dụng bảo toàn electron cho toàn bộ quá trình phản ứng, ta có : FeNONOFe 3 2 Fe ? 0,050,45 3nn3nn0,2moln0,2mol. Áp dụng bảo toàn điện tích cho dung dịch Y, ta có : 3HNO (1) 24HSO (2)
2 Fe.
3Fe
Sơ đồ phản ứng :
Câu : Hòa tan hoàn toàn hỗn hợp gồm FeS2 và Fe3O4 bằng 100 gam dung dịch HNO3 a% vừa đủ thu được 15,344 lít hỗn hợp khí gồm NO và NO2 có khối lượng 31,35 gam và dung dịch chỉ chứa 30,15 gam hỗn hợp muối. Giá trị của a là A. 46,24. B. 43,115. C. 57,33. D. 63. (Đề thi thử Đại học lần 1 – THPT Hùng Vương – Phú Thọ, năm học
DẠYKÈMQUYNHƠN OFFICIAL 35 3
: Từ giả thiết, suy ra : NO NONO2 NO2 NONO2 15,344 n0,01 nn 0,685 22,4 n0,67530n46n31,35 Theo bảo toàn electron, bảo toàn điện tích trong dung dịch sau phản ứng và giả thiết, ta có : FeSFeONONO 234 2 0,01 x 0,675 y 3 2 Fe SO4NO3 x3y 2x z muoi 3 2 Fe SO4NO3 56(x3y)962x62z 15nn3nn0,705 15xy0,705 3n2nn x9yz0 552x504y62z30,15 mmmm30,15 HNO (NO,NO) 3 2 NO3 0,6850,225 HNO3 nnn 0,91mol x0,045 y0,03 0,9163z0,225C% 57,33% 100 Câu : Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 vào nước, thu được dung dịch X. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là A. 23,4 và 35,9. B. 15,6 và 27,7. C. 23,4 và 56,3. D. 15,6 và 55,4. (Đề thi thử Đại học lần 1 – THPT chuyên Chu Văn An – Hà Nội, năm học 2013 – 2014)
2 Fe SO4NO3 0,2 NO 0,1 ? 3 muoi 3 2 Fe SO NO muoi 4 3 0,2 0,1 ? 3n2nn n0,4 m56n96n62n m45,6gam
2013 – 2014)
Theo giả thiết : Cho từ từ 0,1 mol HCl vào dung dịch X thì bắt đầu xuất hiện kết tủa, chứng tỏ trong X có 0,1 mol , các ion còn lại là Na+ , . OH 4 [Al(OH)]
Theo giả thiết : Cho từ từ 0,3 mol HCl vào X (TN1) hoặc cho 0,7 mol HCl vào X (TN2), thu được lượng kết tủa như nhau. Ở TN1, 0,1 mol H+ để trung hòa , còn 0,2 mol H+ phản ứng với tạo ra 0,2 mol Al(OH)3. Suy ra OH 4 [Al(OH)] ở cả hai thí nghiệm
: Cho 12 gam hỗn hợp Fe và Cu vào cốc chứa 200 ml dung dịch HNO3 2M, thu được một chất khí (sản phẩm khử duy nhất) không màu, hóa nâu trong không khí và có một kim loại dư. Sau đó cho thêm dung dịch H2SO4 2M, thấy chất khí trên tiếp tục thoát ra, để hoà tan hết kim loại cần 33,33 ml. Khối lượng kim loại Fe trong hỗn hợp là A. 8,4 gam. B. 5,6 gam. C. 2,8 gam. D. 1,4 gam. (Đề thi thử Đại học lần 2 – THPT chuyên Hà Nội Amsterdam, năm 2011) Sơ đồ phản ứng :
DẠYKÈMQUYNHƠN
36
OFFICIAL
ở
tượng hòa tan
ở
Sơ đồ phản ứng : 3 4 0,2mol HO232 2 4 3 3 0,2mol Na,ClAl(OH) [Al(OH)] AlO Na,OH NaO [Al(OH)] Na,ClAl(OH) Al Áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng ở TN1, TN2, ta có: Na[Al(OH)]Cl 4 Na NaO x 0,3 2 y Al(OH)3 3 3Al NaAlCl AlO23 y x 0,7 nn n n n 0,2 x0,4 2 y0,1 nn n3nn n 0,15 2 (NaO,AlO)
m
HCl 0,3mol HCl 0,7mol
TN1 chưa có hiện Al(OH)3n 0,2mol15,6gam,
kết tủa,
TN2 đã có hiện tượng hòa tan kết tủa.
223
27,7gam
Câu
3HNO (1) 24HSO (2)
Câu : Cho một dung dịch X chứa a mol Ca2+, b mol Mg2+, c mol Na+, d mol , e mol . Có thể dùng Ca(OH)2 để làm mất hoàn toàn tính cứng của 3HCO Cl X trong trường hợp : A. d 2(a + b).
B. 2a + 2b +c = d +e. C. d a + b. D. a = d. (Đề thi thử Đại học – THPT chuyên Chu Văn An – Hà Nội, năm học 2012 – 2013) Câu : Dung dịch X gồm NaOH xM và Ba(OH)2 yM. Dung dịch Y gồm NaOH yM và Ba(OH)2 xM. Hấp thụ 3,136 lít khí CO2 (đktc) vào 200 ml dung dịch X, thu được 7,88 gam kết tủa. Hấp thụ 3,136 lít khí CO2 (đktc) vào 200 ml dung dịch Y, thu được 13,79 gam kết tủa. Giá trị thích hợp của x và y lần lượt là : A. 0,35 và 0,20. B. 0,50 và 0,25. C. 0,40 và 0,25. D. 0,40 và 0,30. (Đề thi thử Đại học – THPT chuyên Chu Văn An – Hà Nội, năm học 2012 – 2013) Để làm mất hoàn toàn tính cứng của nước thì Ca2+, Mg2+ phải chuyển hết vào kết tủa. Dung dịch thu được chỉ còn các ion, hoặc có thêm cả ion Na,Cl còn dư. Theo bảo toàn điện tích trong X và trong dung dịch sau phản 3HCO ứng, ta có :
DẠYKÈMQUYNHƠN OFFICIAL 37 22 3 trongcoc 22 2 34 NO Fe NO Cu Fe,Cu NO,Cu Fe,Cu NO,SO Thứ tự tính khử : . Suy ra : Ở phản ứng (2) để hòa tan hết kim loại thì 2CuFe chỉ có Cu phản ứng, Fe2+ chưa tham gia phản ứng. Theo giả thiết, bảo toàn electron cho toàn bộ quá trình phản ứng, bảo toàn điện tích trong dung dịch sau phản ứng và bảo toàn nguyên tố N, ta có : FeCu x y FeCuNO xyz Fe 2 2 2 Fe CuNOSO 3 4 x y 0,066660,4z 56n64n12 x0,1 56x64y12 y0,1 2n2n3n 2x2y3z0 z0,133 2x2yz0,53332 m5,6gam 2n2nn2n
Câu : Hấp thụ hết 4,48 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 200 ml dung dịch X. Lấy 100 ml dung dịch X cho từ từ vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là A. 0,06. B. 0,15. C. 0,2. D. 0,1. (Đề thi thử Đại học lần 1 – THPT chuyên Lê Quy Đôn – Quảng Trị, năm học 2013 – 2014)
Câu : Cho 4,55 gam bột Zn vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ, trong điều kiện thích hợp, đến khi phản ứng xảy ra hoàn toàn thu được dung dịch A chứa m gam muối; 0,448 lít hỗn hợp khí B (đktc) gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí và còn lại 1,3 gam chất rắn không tan. Biết tỉ khối hơi của B đối với H2 là 8. Giá trị của m là A. 9,95325 B. 10,23875. C. 9,61625. D. 9,24255. (Đề thi thử Đại học lần 1 – THPT chuyên Lê Quy Đôn – Quảng Trị, năm học 2013 – 2014)
Theo giả thiết, ta có :
DẠYKÈMQUYNHƠN OFFICIAL 38 2 2 Ca MgNaClHCO3 a ce b d NaCl ce 2n2nnnn c2a2bcd
nn
hayd2(ab)
Theo sự bảo toàn
và sự
CO
2HCO3 nnn tích
dịch X, ta có : COKCOBaCO 223 3 KCO 0,2 ? 23 COKCO 2 2 223HCO/XCO/X CO/X 3 3 3 0,2 ? HCO/X 3 2 CO2CO/XH 3 00,122 ,15.2 39,4.2 nnn 0,4 197 n0,2 nnn n n 0,06 n 0,34 n nn0,06 2 K/XCO/XHCO/X 3 3 x0,4 0,06 0,34 n2n n x0,06
nguyên tố C, công thức
bảo toàn điện
2
trong dung
Câu : Hòa tan hoàn toàn m gam Fe bằng dung dịch HNO3, thu được dung dịch X và 1,12 lít NO (đktc). Thêm dung dịch chứa 0,1 mol HCl vào dung dịch X thì thấy khí NO tiếp tục thoát ra và thu được dung dịch Y. Để phản ứng hết với các chất trong dung dịch Y cần 115 ml dung dịch NaOH 2M. Giá trị của m là A. 3,36. B. 3,92. C. 2,8. D. 3,08. (Đề thi thử Đại học lần 6 – THPT chuyên KHTN Hà Nội, năm học 2012 – 2013) Sơ đồ phản ứng :
DẠYKÈMQUYNHƠN OFFICIAL 39 NOH2 NO B khongmauhoanau NOH2 H2 2 NOH2 nn0,02NO(M30) n0,01 M16 30n2n Bgom n0,01 BchöaNO 16 H(M2) nn Vì có H2 giải phóng nên trong dung dịch sau phản ứng không còn ion 3 NO. Giả sử dung dịch sau phản ứng có chứa ion . Theo bảo toàn electron, bảo 4NH toàn điện tích trong dung dịch sau phản ứng, bảo toàn nguyên tố N và bảo toàn điện tích trong NaNO3, ta có : ZnpöNOH2NH4 0,010,05 0,01? 2 2ZnNHNaSO 4 4 0,05 ? ? ? NONaNO NH 3 4 0,01 ? ? ? 2n3n2n8n 2nnn2n nnnn 2 NH Na SO 4 4 muoi 2 2 Zn Na NH SO 4 4 0,050,016250,006250,06125 n0,00625;n0,01625;n0,06125 m65n23n18n96n9,61625
: Hòa tan hoàn toàn m gam ZnSO4 vào nước được dung dịch X. Nếu cho 110 ml dung dịch KOH 2M vào X (TN1) thì thu được 3a gam kết tủa. Mặt khác, nếu cho 140 ml dung dịch KOH 2M vào X (TN2) thì thu được 2a gam kết tủa. Giá trị của m là : A. 17,71. B. 16,10. C. 32,20. D. 24,15. (Đề thi thử
DẠYKÈMQUYNHƠN OFFICIAL 40 23 3 ddX 3 NaOH (3) 3 3 ddY ddZ NO NO Fe Fe,Fe NO Fe,Cl Na,Cl NO,... NO Áp dụng bảo toàn electron và bảo toàn điện tích cho phản ứng (1); bảo toàn điện tích cho dung dịch Z, ta có : electrontraoñoiNO/X 3 NO/X NOpöô(2) 3 3 NO NO/Z Hpöô(2) 3 NO/ZClNa 3 0,10,23 ? n n n 0,15n 0,02 33.1,12 n 0,15 22,4 n0,13n 0,08 nnn Theo bảo toàn nguyên tố H và bảo toàn điện tích cho
Y và
nguyên tố Fe, ta có : H Febñ3 Fe F3eHNOCl 3 Febñ ?0,02 0,10,13 n0,10,080,02 nn0,07mol 3nnnn
Ta có : Zn(OH)ôTN1 Zn(OH)ôTN1Zn(OH)ôTN1 2 2 2 Zn(OH)ôTN2Zn(OH)ôTN2 Zn(OH)ôTN2 2 2 2 n 3y n m 3a3 n m 2a2n 2y Từ giả thiết, suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Ở TN1 có thể kết tủa đã bị hòa tan hoặc chưa bị hòa tan. ● Nếu ở TN1 Zn(OH)2 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có : 3
HCl
dung dịch
bảo toàn
m0,07.563,92gam
Câu
Đại học lần 5 – THPT chuyên KHTN Hà Nội, năm học 2012 – 2013)
HNO (1)
(2)
Thật ra bài này thì phương pháp tối ưu là sử dụng đồ thị Câu : Hòa tan hoàn toàn 19,2 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 trong 50 ml dung dịch H2SO4 18M (đặc, dư, đun nóng), thu được V lít khí SO2 (đktc) là sản phẩm khử duy nhất và dung dịch Y. Cho 450 ml dung dịch NaOH 2M vào dung dịch Y, thu được 21,4 gam kết tủa và dung dịch Z. Giá trị của V là A. 4,48. B. 5,60. C. 6,72. D. 3,36.
DẠYKÈMQUYNHƠN OFFICIAL 41 2
Z2
6y0,22TN1:2nn(loai)
● Nếu ở TN1
2 đã bị hòa tan,
dụng bảo toàn điện tích trong
dịch sau
ứng, ta có : 2 2 K[Zn(OH)] SO 4 4 0,22 x3y x 2 2 K[Zn(OH)] SO 4 4 0,28 x2y x TN1:n2n 2n TN2:n2n 2n
thi thử Đại học
Theo giả thiết, ta có : 2HSO NaOH 24 SO Na 4 Fe(OH)3 nn18.0,050,9mol;nn0,45.20,9mol; 21,4 n 0,2mol 107 Dung dịch Z chứa và có thể còn . 2 4Na,SO 3Fe Quy đổi hỗn hợp X thành Fe và O. Theo bảo toàn khối lượng, bảo toàn electron, bảo toàn điện tích cho dung dịch Z và bảo toàn nguyên tố S, Fe, ta có :
2 KZn SO4 0,22x3y x 2 2 K[Zn(OH)] SO 4 4 0,28 x2y x TN1:n2n2n TN2:n2n 2n
nOH 0,10660,22 y0,0366;x0,1066
4x4y0,28
Zn(OH)
áp
các dung
phản
ZnSO4 x0,1;y0,034x6y0,22 m0,1.16116,1gam4x4y0,28
(Đề
lần 2 –THPT chuyên Hùng Vương – Phú Thọ, năm học 2013 – 2014)
và 0,36. C. 0,45 và 0,05. D. 0,2 và 0,1. (Đề thi thử Đại học lần 5 – THPT chuyên KHTN Hà Nội, năm học 2013 – 2014) ● Nếu thì khi cô cạn dung dịch X và nung đến khố
DẠYKÈMQUYNHƠN OFFICIAL 42 FeO x y FeOSO2 xyz SO2 3 2 NaFe SO4 0,9x0,20,9z
n3n2n Câu
X rồi lấy chất rắn đem nung đến khối lượng không đổi Cl thu được 43,6 gam chất rắn. Giá trị của x và y lần lượt là A. 0,1 và 0,4. B. 0,14
i lượng không 2 HCO3Ba n2n đổi sẽ thu được hỗn hợp gồm BaO, NaCl hoặc BaO, NaCl và BaCl2. Như vậy, ion đã được thay bằng ion . Theo giả thiết và bảo
ệ
3HCO 2O 2HCOClNaBa 3 y0,10,2 x 2 HCO3O 0,5x x 2 2 Na Ba Cl O 0,1 0,2 y 0,5x nnn2n n2n 23n137n35,5n16n43,6 ● Nếu trường hợp không thỏa mãn thì ta xét trường hợp 2 HCO3Ba n2n . Khi đó chất rắn sẽ gồm Na2CO3, BaO và NaCl. Theo giả 2 HCO3Ba n2n thiết và bảo toàn điện tích, ta có : 2HCOClNaBa 3 y0,1 0,2 x 2 2 2 2 HCO O CO Ba CO 3 3 3 0,2 0,2 x z z 2 2 2 Na Ba Cl O CO3 0,1 0,2 y 0,2 z nnn2n n2n2n2n2n 23n137n35,5n16n60n43,6 xy0,5 x1,1 x2z0,4 y1,6 35,5y60z10,7z0,75 xy0,5 x0,14 8x35,5y13,9y0,36
56n16n19,2 x0,3 56x16y19,2y0,15 3n2n2n 3x2y2z0z0,3 3x2z1,5V6,72lít
: Một dung dịch X chứa 0,1 mol Na+; 0,2 mol Ba2+; x mol và y mol 3HCO . Cô cạn dung dịch
toàn đi
n tích, ta có :
Câu : Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa và 3,92 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol của Mg trong hỗn hợp X gần nhất với giá trị nào sau đây?
A. 25. B. 15. C. 40. D. 30. (Đề thi thử THPT Quốc Gia lần 4 – THPT Chuyên Đại học Vinh, năm 2015)
OFFICIAL
Câu : Cho 26,88 gam bột Fe vào 600 ml dung dịch hỗn hợp A gồm Cu(NO3)2 0,4M và NaHSO4 1,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn B và khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m là: A. 15,92 B. 13,44 C. 17,04 D. 23,52 (Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Hà Giang, năm 2015) Câu : Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lit (đktc) hỗn hợp khí B. Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Fe(NO3)3 trong X có giá trị gần nhất với :
A. 13,0% B. 20,0% C. 40,0% D. 12,0% (Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Phan Bội Châu – Nghệ An, năm 2015)
Câu : Hoà tan hỗn hợp X gồm Cu và Fe2O3 trong 400 ml dung dịch HCl a mol/lít được dung dịch Y và còn lại 1 gam đồng không tan. Nhúng thanh Mg vào dung dịch Y, sau khi phản ứng xong, nhấc thanh Mg ra thấy khối lượng tăng 4 gam so với ban đầu và có 1,12 lít khí H2 (đktc) bay ra.(Giả thiết toàn bộ lượng kim loại thoát ra đều bám vào thanh Mg). Khối lượng của Cu trong X và giá trị của a là: A. 4,2g và a = 1M. B. 4,8g và 2M. C. 1,0g và a = 1M D. 3,2g và 2M. (Đề thi thử THPT Quốc Gia lần 3 – THPT Chuyên Nguyễn Huệ – Hà Nội, năm 2015) Câu : Cho 24,06 gam hỗn hợp X gồm Zn, ZnO và ZnCO3 có tỉ lệ số mol 3:1:1 theo thứ tự trên tan hoàn toàn trong dung dịch Y gồm H2SO4 và NaNO3, thu được dung dịch Z chỉ chứa 3 muối trung hòa và m gam hỗn hợp khí T (đktc) gồm NO, N2O, CO2, H2 (Biết số mol của H2 trong T là 0,04 mol ). Cho dung dịch BaCl2 dư vào Z đến khi các phản ứng xảy ra hoàn toàn, thu được 79,22 gam kết tủa. Còn nếu cho Z phản ứng với NaOH thì lượng NaOH phản ứng tối đa là 1,21 mol. Giá trị của m gần nhất với : A. 3,6 B. 4,3 C. 5,2 D.2,6
DẠYKÈMQUYNHƠN
43
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Hùng Vương – Phú Thọ, năm 2015) Câu : Hỗn hợp M gồm Al, Al2O3, Fe3O4, Fe2O3, FeO, CuO, Fe và Cu, trong đó oxi chiếm 20,4255% khối lượng hỗn hợp. Cho 6,72 lít khí CO (đktc) đi qua 35,25 gam M nung nóng, sau một thời gian thu được hỗn hợp rắn N và hỗn hợp khí X có tỉ khối so với H2 bằng 18. Hòa tan hết toàn bộ N trong lượng dư dung dịch HNO3 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối (không có muối NH4NO3 sinh ra) và 4,48 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16,75. Giá trị của m là : A. 117,95 B. 114,95 C. 133,45 D. 121,45 (Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Hùng Vương – Phú Thọ, năm 2015) Câu : Hòa tan hết 35,4 gam hỗn hợp gồm Mg và FeCO3 trong dung dịch HCl loãng dư thu được 20,16 lít hỗn hợp khí X (đktc). Mặt khác cũng hòa tan hết 35,4 gam hỗn hợp trên cần dùng vừa đủ V lít dung dịch chứa H2SO4 0,25M và HNO3 0,75M đun nóng. Sau khi kết thúc phản ứng thu được dung dịch Y và hỗn hợp khí Z gồm 2 khí không màu trong đó có 1 khí hóa nâu. Tỉ khối của Z so với He bằng 8,8125. Cô cạn dung dịch Y thu được m gam muối. Giá trị m là. A. 152,72 B. 172,42 C. 142,72 D. 127,52 Câu : Hỗn hợp rắn A gồm FeS2, Cu2S và FeCO3 có khối lượng 20,48 gam. Đốt cháy hỗn hợp A một thời gian bằng oxi thu được hỗn hợp rắn B và 2,24 lít (đktc) hỗn hợp khí X ( không có O2 dư ). Toàn bộ B hòa tan trong dung dịch HNO3 đặc, nóng, dư. Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Z gồm 2 khí ( không có khí SO2) và dung dịch Y. Cho Ba(OH)2 dư vào dung dịch Y thu được 34,66 gam kết tủa. Lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được 29,98 gam rắn khan. Biết rằng tỉ khối của Z so với X bằng 86/105. Phần trăm khối lượng FeS2 trong A gần nhất với : A. 23,4% B. 25,6% C. 22,2% D. 31,12% Câu : Cho a mol hỗn hợp rắn X chứa Fe3O4, FeCO3, Al (trong đó số mol của Fe3O4 là mol) tác dụng với 0,224 lít(đktc) khí O2 đun nóng, kết thúc phản ứng chỉ thu a 3 được hỗn hợp rắn Y và 0,224 lít khí CO2 . Cho Y phản ứng với HCl vừa đủ thu được 1,344 lít hỗn hợp khí Z và dung dịch T. Cho AgNO3 dư vào dung dịch T, phản ứng xảy ra hoàn toàn thấy có 101,59 gam kết tủa. Biết các khí đo ở đktc. Giá trị của a gần nhất là: A. 0,14 B. 0,22 C. 0,32 D. 0,44 Câu : Hòa tan hết 22,8 gam hỗn hợp X gồm Fe, Fe3O4 và Cu trong 348 gam dung dịch HNO3 15,75% thu được dung dịch Y và 0,784 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Mặt khác hòa tan hết 22,8 gam hỗn hợp trên trong dung dịch HCl loãng thu được dung dịch T gồm 3 chất tan có tổng khối lượng 40,4 gam (không có
OFFICIAL
DẠYKÈMQUYNHƠN
44
khí thoát ra). Trộn dung dịch Y và T thu được dung dịch G. Cho AgNO3 dư vào G thu được m gam kết tủa. Biết trong T số mol của Cu2+ gấp 2 lần số mol của Fe3+ . Giá trị của m gần nhất với : A. 126 B. 124 C. 130 D. 134 Câu : Đốt cháy 16,96 gam hỗn hợp gồm Fe và Mg trong oxi một thời gian thu được hỗn hợp rắn X. Hòa tan hết X trong 242 gam dung dịch HNO3 31,5% thu được dung dịch Y chỉ chứa các muối có khối lượng 82,2 gam và 1,792 lít (đktc) hỗn hợp khí Z gồm N2O và NO có tỉ khối so với He bằng 10,125. Cho NaOH dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được 25,6 gam rắn khan. Nồng độ C% của Fe(NO3)3 trong Y gần đúng nhất với: A. 12% B. 13% C. 14% D. 15% Câu : Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl2 và O2 thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần đúng nhất với: A. 5,6% B. 7,7% C. 8,2% D. 9,4% Câu : Hỗn hợp A gồm MgO, Fe2O3, FeS và FeS2 Người ta hòa tan hoàn toàn m gam A trong dung dịch H2SO4 (đ/n dư) thu được khí SO2, dung dịch sau phản ứng chứa gam muối. Mặt khác, hòa tan hoàn toàn m gam A trên vào dung dịch 155 m 67 HNO3 (đ/n dư) thu được 14,336 lít hỗn hợp khí gồm NO2 và SO2 có tổng khối lượng là 29,8 gam. Cô cạn dung dịch sau phản ứng thu được 28,44 gam hỗn hợp muối khan. Biết trong A oxi chiếm về khối lượng. Phần trăm khối 10 .100% 67 lượng của FeS trong A có giá trị gần đúng nhất với : A. 28% B. 30% C. 32% D. 34% Câu : Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư thấy có 0,7 mol axit phản ứng và còn lại 0,35a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp A bằng H2 dư thu được 34,4 gam chất rắn. Phần trăm khối lượng Cu trong hỗn hợp A gần đúng nhất : A. 25,0% B. 16,0%. C. 40,0% D. 50,0%. Câu : Cho một luồng khí O2 đi qua 63,6 gam hỗn hợp kim loại Mg, Al và Fe thu được 92,4 gam chất rắn X. Hòa tan hoàn toàn lượng X trên bằng dung dịch HNO3 (dư). Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y và 3,44 gam hỗn hợp khí Z. Biết có 4,25 mol HNO3 tham gia phản ứng, cô cạn cẩn thận dung
OFFICIAL
DẠYKÈMQUYNHƠN
45
dịch Y thu được 319 gam muối. Phần trăm khối lượng của N có trong 319 gam hỗn hợp muối trên là :
A. 18,082% B. 18,125% C. 18,038% D. 18,213%
Câu : Cho O3 dư vào bình kín chứa hỗn hợp Fe và Cu rồi nung nóng tới phản ứng hoàn toàn thấy khối lượng chất rắn tăng 5,12 gam và thu được m gam hỗn hợp oxit. Mặt khác, cho hỗn hợp kim loại trên vào dung dịch HNO3 thu được 2,688 (lít) khí NO đktc (sản phẩm khử duy nhất) và gam chất rắn chỉ chứa một kim loại. Giá 2 m 7 trị m gần nhất với : A.15,0 B.20,0 C. 25,0 D.26,0
Câu : Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y, trong đó có 20,52 gam Ba(OH)2. Cho toàn bộ dung dịch Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M, thu được m gam kết tủa. Giá trị của m là:
OFFICIAL
A. 27,96 B. 29,52 C. 36,51 D. 1,56
Câu : A là hỗn hợp chứa Fe, Al, Mg cho một luồng khí O2 đi qua 21,4 gam A nung nóng thu được 26,2 gam hỗn hợp rắn B. Cho toàn bộ B vào bình chứa 400 gam dung dịch HNO3 (dư 10% so với lượng phản ứng). Sau khi các phản ứng xảy ra hoàn toàn thấy có NO và N2 thoát ra với tỷ lệ mol 2 : 1. Biết khối lượng dung dịch C sau phản ứng là 421,8 gam, số mol HNO3 phản ứng là 1,85 mol. Tổng khối lượng các chất tan có trong bình sau phản ứng gần nhất với : A.156 B.134 C.124 D.142 Câu : Cho m gam hỗn hợp X gồm Cu, FeO và tan hết trong dung dịch HCl 23FeO ( vừa đủ ) thu được dung dịch (A). Cho a gam Mg vào dung dịch (A), sau khi phản ứng kết thúc thu được dung dịch (B). Thêm dung dịch KOH dư vào (B) được kết tủa (D). Nung (D) trong không khí đến khối lượng không đổi được b gam chất rắn (E). Mối quan hệ giữa a,b được biểu hiện qua sơ đồ sau : b (gam)
DẠYKÈMQUYNHƠN
46
74 68 62
OFFICIAL
0 3,6 7,2 10,8 a (gam) Mặt khác, khi cho m gam hỗn hợp X tác dụng với dung dịch HNO3, thu được V lít hỗn hợp khí T gồm NO, NO2 và N2O. Biết T có tỷ khối so với Hidro là và khối lượng HNO3 tham gia phản ứng là 158,76(g). Giá trị V gần nhất với : 164 9 A.1,9 B.1,95 C. 2,0 D. 2,05 Câu : Hòa tan hoàn toàn m gam hỗn hợp rắn A gồm Al, Mg và Fe2O3 trong V lít dung dịch HNO3 0,5M. Sau phản ứng thu được dung dịch B và 0,672 lít (đktc) hỗn hợp khí D gồm 2 khí không màu, không hóa nâu trong không khí có tỉ khối hơi so với H2 là 14,8. Đem dung dịch B tác dụng với NaOH dư thu được dung dịch C và kết tủa E nặng 47,518 gam. Đem lọc kết tủa E nung trong không khí đến khối lượng không đổi thu được 38,92 gam chất rắn F. Để hòa tan hết F cần dùng 1,522 lít dung dịch HCl 1M. Đem dung dịch C sục dư CO2 thì thu được 13,884 gam kết tủa trắng. Khối lượng muối có trong B là : A. 148,234 B. 167,479 C. 128,325 D. 142,322 Câu : Nung m gam hỗn hợp X gồm bột Al, và Fe3O4 sau một thời gian thu được chất rắn Y. Để hòa tan hết Y cần V ml dung dịch H2SO4 0,7M (loãng). Sau phản ứng thu được dung dịch Z và 9,846 lít khí (đo ở 1,5 atm, 270C). Cho dung dịch NaOH vào dung dịch Z đến dư, thu được kết tủa M. Nung M trong chân không đến khối lượng không đổi thu được 44 gam chất rắn T. Cho 50 gam hỗn hợp X1 gồm CO và CO2 qua ống sứ đựng chất rắn T nung nóng. Sau khi T phản ứng hết, thu được hỗn hợp khí X2 có khối lượng gấp 1,208 lần khối lượng X1. Giá trị của m và V lần lượt là:
A. 59,9 và 1091
B. 66,9 và 1900 C. 57,2 và 2000 D. 59,9 và 2000 (Đề thi thử THPT Quốc Gia lần 4 – THPT Chuyên KHTN Hà Nội, năm 2015) Câu : Hỗn hợp M gồm Fe, FeO, Fe2O3 nặng 14,16 gam. Chia thành 3 phần đều nhau. Cho dòng khí H2 (dư) đi qua phần 1 (nung nóng) thì thu được 3,92 gam Fe. Cho phần 2 vào lượng dư dung dịch CuSO4 thì thu được 4,96 gam hỗn hợp rắn. Phần 3, được hòa tan vừa hết bởi một lượng tối thiểu V ml dung dịch HCl 7,3% (d=1,03g/ml). Sau phản ứng thu được dung dịch X. Cho dung dịch X tác dụng với lượng dư dung dịch AgNO3, được a gam kết tủa. Các phản ứng đều xảy ra hoàn toàn. Giá trị của V lần lượt là: A. 6,25 và 15,12 B. 67,96 và 14,35 C. 56,34 và 27,65 D . 67,96 và 27,65 (Đề thi thử THPT Quốc Gia lần 4 – THPT Chuyên KHTN Hà Nội, năm 2015) Câu : Điện phân 100 ml dung dịch Cu(NO3)2 2M với điện cực trơ trong t giây, cường độ dòng điện không đổi 1,93A (hiệu suất quá trình điện phân là 100%), thu được
DẠYKÈMQUYNHƠN
47
chất rắn X, dung dịch Y và khí Z. Cho 16,8 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 15,99 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là
A. 5000. B. 4820. C. 3610. D. 6000. (Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Bảo Lộc – Lâm Đồng, năm 2015) Câu : Cho hỗn hợp X gồm CuO và NaOH có tỉ lệ số mol 1:1 tác dụng vừa đủ với dung dịch hỗn hợp HCl 1M và H2SO4 0,5M thu được dung dịch Y chỉ chứa m gam hỗn hợp muối trung hoà. Điện phân dung dịch Y với điện cực trơ màng ngăn xốp cường độ I=2,68A đến khi khối lượng dung dịch giảm 20,225 gam mất t giây thì dừng lại thu được dung dịch Z. Cho m gam Fe vào dung dịch Z sau khi phản ứng kết thúc thu được 0,9675m gam hỗn hợp 2 kim loại. Giá trị của t là A. 11522 B. 10684 C. 12124 D. 14024 (Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Bến Tre, năm 2015) Câu : Hòa tan hết 8,56 gam hỗn hợp X gồm Fe3O4 và CuO (tỉ lệ mol tương ứng là 3:2) trong lượng vừa đủ dung dịch HCl, thu được dung dịch Y. Điện phân dung dịch Y (điện cực trơ, có màng ngăn, hiệu suất 100%) với cường độ dòng điện không đổi 5A, đến khi khối lượng dung dịch giảm 11,18 gam thì dừng điện phân và thu được dung dịch Z. Dung dịch Z tác dụng vừa đủ với V ml dung dịch KMnO4 0,1M trong H2SO4 loãng. Giá trị của V là
OFFICIAL
A. 240 ml. B. 80 ml. C. 160 ml. D. 400 ml. (Đề thi thử THPT Quốc Gia lần 3 – THPT Chuyên Nguyễn Bỉnh Khiêm, năm 2015) Câu : Điện phân dung dịch chứa m gam muối AgNO3 với cường độ dòng điện I (ampe), sau thời gian t (giây) thì AgNO3 điện phân hết, ngắt dòng điện, sau khi các phản ứng xẩy ra hoàn toàn ta thu được 3,36 lít (đktc) hỗn hợp khí X gồm NO2 và O2, dung dịch Y và kim loại Ag. Giá trị lớn nhất của m là: A. 34,0. B. 68,0. C. 42,5. D. 51,0. (Đề thi chọn HSG tỉnh Thái Bình năng 2015) Câu : Điện phân dung dịch X chứa a mol CuSO4 và 0,15 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây thu được 2,24 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tông thể tích khí thu được ở 2 điện cực là 4,76 lít (đktc). Biết hiệu suất của quá trình điện phân đạt 100% và các khí sinh ra không tan trong dung dịch. Giá trị của a là A. 0,20. B. 0,15. C. 0,25. D. 0,30. (Đề thi thử THPT Quốc Gia – SGD & Đào Tạo TP. Hồ Chí Minh, năm 2015) Câu : Cho 14,625 gam NaCl vào 300ml dung dịch Cu(NO3)2 1M thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ, màng ngăn xốp tới khi dung dịch giảm 26,875 gam thì ngừng điện phân. Cho m gam bột Fe vào dung dịch sau điện phân, kết thúc phản ứng thấy có khí NO thoát ra (Sản phẩm khử duy nhất) và 0,6m gam hỗn hợp kim loại. Giá trị gần nhất với m là : A. 11. B. 12. C. 14. D. 13. Câu : Tiến hành điện phân V lít dung dịch chứa Cu(NO3)2 1M và NaCl 0,5M bằng điện cực trơ tới khi khối lượng dung dịch giảm m gam thì dừng điện phân. Cho 9,5
DẠYKÈMQUYNHƠN
48
gam Fe vào dung dịch sau điện phân, kết thúc phản ứng thu được 1,12 lít khí NO thoát ra (sản phẩm khử duy nhất) và còn lại 5,7 gam hỗn hợp rắn không tan. Giá trị của m gần nhất với : A. 12. B. 15. C. 17. D. 14. Câu : Điện phân 2000 ml ( điện cực trơ, có màng ngăn) dung dịch gồm CuSO4 và
0,01 mol NaCl đến khi cả 2 điện cực đều thoát ra 448ml khí (đktc) thì ngừng điện phân. Giả sử nước bay hơi không đáng kể trong quá trình điện phân. Giá trị pH dung dịch sau điện phân là: A. 1,4. B. 1,7. C. 1,2. D. 2,0. (Đề thi thử THPT Quốc Gia lần 3 – THPT Chuyên Nguyễn Huệ – Hà Nội, năm 2015)
OFFICIAL
Câu : Điện phân (với điện cực trơ, có màng ngăn) m gam dung dịch chứa 0,1 mol FeCl3 và 0,15 mol HCl với cường độ dòng điện không đổi 1,92A. sau thời gian t giờ thì dung dịch thu được sau điện phân có khối lượng (m – 5,156)gam. Biết trong quá trình điện phân nước bay hơi không đáng kể. Giá trị của t là: A. 2,5 B. 2,0 C. 3,0 D. 1,5 (Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Đại học Vinh, năm 2015) Câu : Điện phân 400ml dung dịch X gồm NaCl 0,2M và Cu(NO3)2 0,4M với cường độ dòng điện là 2,573 A trong thời gian t giờ thu được dung dịch Y. Cho 6,72 gam Fe vào dung dịch Y để phản ứng xảy ra hoàn toàn thu được 3,68 gam chất rắn khan. Biết NO là sản phẩm khử duy nhất. Giá trị của t gần nhất với : A. 1 B. 2,5. C. 2. D. 1,5. Câu : Điện phân (với điện cực trơ, có màng ngăn) m gam dung dịch chứa 0,1 mol FeCl3 và 0,15 mol HCl với cường độ dòng điện không đổi 1,92A. sau thời gian t giờ thì dung dịch thu được sau điện phân có khối lượng (m-5,156)gam. Biết trong quá trình điện phân nước bay hơi không đáng kể. Giá trị của t là:
A. 2,5 B. 2,0 C. 3,0 D. 1,5
Câu : Hòa tan hoàn toàn hỗn hợp gồm 2,8 gam Fe và 1,6 gam Cu trong 500ml dung dịch hỗn hợp HNO3 0,1M và HCl 0,4M, thu được khí NO (khí duy nhất) và dung dịch X. Cho X vào dung dịch AgNO3 dư, thu được m gam chất rắn .Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm duy nhất của N+5 trong các phản ứng. Giá trị của m là: A. 30,05. B. 34,10. C. 28,70. D. 5,4. Câu : Hỗn hợp X gồm FexOy, Fe, MgO và Mg. Cho m gam hỗn hợp X tác dụng với dung dịch HNO3 dư thu được 6,72 lít hỗn hợp khí N2O và NO (đktc) có tỷ khối so với hidro là 15,933 và dung dịch Y. Cô cạn dung dịch Y thu được 129,4 gam muối khan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng dư thu được 15,68 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch Z. Cô cạn dung dịch Z thu được 104 gam muối khan. Giá trị của m là : A. 27,2 B. 28,8 C. 26,16 D. 22,86 Câu : Nung nóng hỗn hợp chất rắn A gồm a mol Mg và 0,25 mol Cu(NO3)2, sau một thời gian thu được chất rắn X và 0,45 mol hỗn hợp khí NO2 và O2. X tan hoàn
DẠYKÈMQUYNHƠN
49
toàn trong dung dịch chứa vừa đủ 1,3 mol HCl, thu được dung dịch Y chứa m gam hỗn hợp muối clorua, và thoát ra 0,05 mol hỗn hợp khí Z gồm N2 và H2, tỉ khối của Z so với H2 là 11,4. Giá trị m gần nhất là
OFFICIAL
A. 82. B. 74. C. 72. D. 80. Câu : Cho 26,88 gam bột Fe vào 600 ml dung dịch hỗn hợp A gồm Cu(NO3)2 0,4M và NaHSO4 1,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn B và khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m là: A. 15,92 B. 13,44 C. 17,04 D. 23,52 (Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Hà Giang, năm 2015) Câu : Cho 3,9 gam hỗn hợp Al, Mg tỷ lệ mol 2 : 1 tan hết trong dung dịch chứa KNO3 và HCl. Sau phản ứng thu được dung dịch A chỉ chứa m gam hỗn hợp các muối trung hòa và 2,24 lít (đktc) hỗn hợp khí B gồm NO và H2. Khí B có tỷ khối so với H2 bằng 8. Giá trị của m gần giá trị nào nhất? A. 24 B. 26 C. 28 D. 30 Câu : Nung nóng hỗn hợp gồm 31,6 gam KMnO4 và 24,5 gam KClO3 một thời gian thu được 46,5 gam hỗn hợp rắn Y gồm 6 chất. Cho Y tác dụng với dung dịch HCl đặc dư, đun nóng thu được khí clo. Hấp thụ khí sinh ra vào 300ml dung dịch NaOH 5M đung nóng thu được dug dịch Z. Cô cạn Z được m(gam) chất rắn khan. Các phản ứng xảy ra hoàn toàn. Giá trị m là: A. 79,8 g B. 91,8 g. C. 66,5 g. D. 86,5 g (Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Lê Khiết, năm 2015) Câu : Cho 13,36 gam hỗn hợp X gồm Cu và Fe3O4 vào dung dịch H2SO4 đặc nóng dư thu được V1 lít SO2 và dung dịch Y. Cho Y phản ứng với dung dịch NaOH dư thu được kết tủa T, nung kết tủa này đến khối lượng không đổi thu được 15,2 gam rắn Q. Nếu cũng cho lượng X như trên vào 400 ml dung dịch P chứa HNO3, và H2SO4 thấy có V2 lít khí NO là sản phẩm khử duy nhất thoát ra, còn 0,64 gam kim loại chưa tan hết. Các phản ứng xảy ra hoàn toàn, các khí đo ở đktc. Giá trị V1, V2 là
A. 2,576 và 0,896. B. 2,576 và 0,224. C. 2,576 và 0,672. D. 2,912 và 0,224 (Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Lê Khiết, năm 2015) Câu 12: Cho 9,6 gam hỗn hợp X gồm Mg và Fe3O4 vào 300ml dung dịch HNO3 2M thu được dung dịch Y và 0,896 lít (đktc) hỗn hợp N2O và NO có tỷ khối so với hidro là 16,75. Trung hòa Y cần dùng 40ml NaOH 1M thu được dung dịch A, cô cạn A thu được m gam muối khan. Biết rằng phản ứng xảy ra hoàn toàn và khi cô cạn muối không bị nhiệt phân. Giá trị m là: A. 42,26. B. 19,76 C. 28,46 D. 72,45 (Đề thi thử THPT Quốc Gia lần 2 – THPT Chuyên Quốc Học Huế, năm 2015) Câu : Cho khí CO qua m gam hỗn hợp X gồm các oxit sắt nung nóng FeO, Fe2O3 và Fe3O4 sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Khi cho toàn bộ khí Z vào dung dịch Ca(OH)2 dư, đến phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, khi hòa tan hoàn toàn hỗn hợp chất rắn Y trong dung dịch H2SO4 đặc nóng lấy dư, thu được một dung dịch chứa 18 gam muối và một sản phẩm khí SO2 duy nhất là 1,008 lít (đktc). Giá trị của m là: A. 5,80. B. 14,32 C. 6,48 D. 7,12
DẠYKÈMQUYNHƠN
50
(Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Quốc Học Huế, năm 2015) Câu : Hoà tan bột Fe vào 200 ml dung dịch chứa NaNO3 và H2SO4. Sau phản ứng hoàn toàn thu được dung dịch A và 6,72 lit hỗn hợp khí X (đktc) gồm NO và H2 có tỉ lệ mol 2 : 1 và 3 gam chất rắn không tan. Biết dung dịch A không chứa muối amoni. Cô cạn dung dịch A thu được khối lượng muối khan là A. 126,0 gam. B. 75,0 gam. C. 120,4 gam. D. 70,4 gam. Câu : Hòa tan hết 13,52 gam hỗn hợp X gồm Mg(NO3)2, Al2O3, Mg và Al vào dung dịch NaNO3 và 1,08 mol HCl (đun nóng). Sau khi kết thức phản ứng thu được dung dịch Y chỉ chứa các muối và 3,136 lít (đktc) hỗn hợp khí Z gồm N2O và H2. Tỷ khối của Z so với He bằng 5. Dung dịch Y tác dụng tối đa với dung dịch chứa 1,14 mol NaOH, lấy kết tủa nung ngoài không khí tới khối lượng không đổi thu được 9,6 gam rắn. Phần trăm khối lượng của Al có trong hỗn hợp X là : A. 31,95% B. 19,97% C. 23,96% D. 27,96% Câu : Cho 61,2 gam hỗn hợp X gồm Cu và Fe3O4 tác dụng với dung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi các phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí NO (sản phẩm khử duy nhất, ở đktc), dung dịch Y và còn lại 2,4 gam kim loại. Cô cạn dung dịch Y, thu được m gam muối khan. Giá trị của m là A. 151,5. B. 137,1. C. 97,5. D. 108,9. (Đề thi thử THPT Quốc Gia lần 1 – THPT Bạc Liêu, năm 2015) Câu 29: Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X gồm Al , Fe , FeO , Fe3O4 , Al2O3 . Hòa tan hoàn toàn X trong dung dịch HCl dư thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là A. 41,97 B. 32,46 C. 32,79 D. 31,97 (Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Hà Giang, năm 2015)
OFFICIAL
Câu : Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y, thu được 8,58 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4, thu được dung dịch chứa 20,76 gam muối sunfat và 3,472 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất của H2SO4). Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 6,80 gam B. 8,04 gam C. 6,96 gam D. 7,28 gam (Đề thi thử THPT Quốc Gia lần 1 – THPT Chuyên Lê Quý Đôn, năm 2015)
DẠYKÈMQUYNHƠN
51
CHUYÊN ĐỀ 10 : BÀI TẬP HỮU CƠ HAY VÀ KHÓ DÀNH ĐIỂM 9, 10
Câu 1: Hỗn hợp X chứa 2 hiđrocacbon là đồng đẳng liên tiếp có phân tử khối trung bình là 31,6. Cho 6,32 gam X lội qua 200 gam dung dịch (gồm nước và chất xúc tác thích hợp), thu được dung dịch Y và thấy thoát ra V lít hỗn hợp khí khô Z (đktc), tỉ khối của hỗn hợp Z so với H2 là 16,5. Biết rằng các phản ứng chỉ tạo ra sản phẩm chính và dung dịch Y chứa anđehit có nồng độ 1,3046%. Giá trị của V là:
OFFICIAL
A. 3,316 lít. B. 3,36 lít. C. 2,24 lít. D. 2,688 lít. (Đề thi chọn HSG tỉnh Thái Bình, năm 2016) Câu 2: Hỗn hợp X gồm but-1-en và butan có tỉ lệ số mol tương ứng là 1 : 3. Dẫn X qua ống đựng xúc tác thích hợp, nung nóng thu được hỗn hợp Y gồm các chất mạch hở CH4, C2H6 C2H4, C3H6, C4H6, C4H8, C4H10, H2. Tỷ khối của Y so với X là 0,5. Nếu dẫn 1 mol Y qua dung dịch brom dư thì khối lượng brom phản ứng là: A. 80 gam. B. 120 gam. C. 160 gam. D. 100 gam. (Đề thi thử THPT Quốc Gia lần 2 – THPT Nguyễn Khuyến – TP.HCM, năm 2015) Câu 3: Hỗn hợp X gồm metan, etilen, propin, vinylaxetilen và hiđro. Dẫn X qua Ni nung nóng, sau phản ứng hoàn toàn thu được hỗn hợp Y có tỉ khối so với khí nitơ đioxit là 1. Biết 5,6 lít hỗn hợp Y (đktc) làm mất màu vừa đủ 72 gam brom trong dung dịch. Hỏi 5,6 lít hỗn hợp X (đktc) làm mất màu vừa đủ bao nhiêu gam brom trong dung dịch? A. 56 gam. B. 60 gam C. 48 gam. D. 96 gam. Câu 4: Hỗn hợp khí X gồm H2 và một hiđrocacbon Y, mạch hở. Tỉ khối của X đối với H2 bằng 3. Đun nóng X với bột Ni xúc tác, tới phản ứng hoàn toàn thu được hỗn hợp khí X1 có tỉ khối so với H2 bằng 4,5. Công thức phân tử của Y là: A. C2H2 B. C2H4 C. C3H6 D. C3H4 Đề thi thử THPT Quốc Gia lần 2 – THPT Đặng Thúc Hứa – Nghệ An, năm 2015) Câu 5: Một bình kín chỉ chứa các chất sau: axetilen (0,5 mol), vinylaxetilen (0,4 mol), hiđro (0,65 mol) và một ít bột niken. Nung nóng bình một thời gian, thu được hồn hợp khí X có tỉ khối so với H2 bằng 19,5. Khí X phản ứng vừa đủ với 0,7 mol AgNO3 trong dung dịch NH3, thu được m gam kết tủa và 10,08 lít hỗn hợp khí Y (đktc). Khí Y phản ứng tối đa với 0,55 mol Br2 trong dung dịch. Giá trị của m là A. 76,1. B. 92,0. C. 75,9. D. 91,8. (Đề thi tuyển sinh Đại học khối B, năm 2014) Câu 6: Hỗn hợp T gồm hai ancol đơn chức là X và Y (Mx < My), đồng đẳng kế tiếp của nhau. Đun nóng 27,2 gam T với H2SO4 đặc, thu được hỗn hợp các chất hữu cơ Z gồm: 0,08 mol ba ete (có khối lượng 6,76 gam) và một lượng ancol dư. Đốt cháy hoàn toàn Z cần vừa đủ 43,68 lít O2 (đktc). Hiệu suất phản ứng tạo ete của X và Y lần lượt là
A. 50% và 20%.
B. 20% và 40%. C. 40% và 30%. D. 30% và 30%.
(Kỳ thi THPT quốc gia năm 2015) Câu 7: M là hỗn hợp 3 ancol đơn chức X, Y và Z có số nguyên tử cacbon liên tiếp nhau, đều mạch hở (MX < MY < MZ); X, Y no, Z không no (có 1 liên kết C=C). Chia M thành 3 phần bằng nhau: - Đốt cháy hoàn toàn phần I được 45,024 lít CO2 (đktc) và 46,44 gam H2O. - Phần II làm mất màu vừa đủ dung dịch chứa 16 gam Br2
- Đun nóng phần III với H2SO4 đặc ở 140oC thu được 18,752 gam hỗn hợp 6 ete (T). Đốt cháy hoàn toàn T thu được 1,106 mol CO2 và 1,252 mol H2O. Hiệu suất tạo ete của X, Y và Z lần lượt là: A. 50%; 40%; 35%. B. 50%; 60%; 40%. C. 60%; 40%; 35%. D. 60%; 50%; 35%. (Đề thi chọn HSG tỉnh Thái Bình, năm 2016) Câu 8: Oxi hoá 46,08 gam ancol đơn chức (có xúc tác) thu được hỗn hợp sản phẩm X. Chia X thành ba phần bằng nhau:
Phần 1 tác dụng vừa đủ với 160 ml dung dịch KOH 1,0 M.
Phần 2 tác dụng với Na dư thu được 7,168 lít H2 (đktc).
Phần 3 tác dụng với AgNO3 dư trong NH3 đun nóng thu được m gam Ag.
Biết hiệu suất phản ứng oxi hoá ancol là 75%. Giá trị của m là :
DẠYKÈMQUYNHƠN
1
A. 86,4. B. 77,76. C. 120,96. D. 43,20. (Đề thi thử THPT Quốc Gia lần 1 – THPT Sào Nam – Quảng Nam, năm 2015) Câu 9: Oxi hóa 4,16 gam ancol đơn chức X bằng O2 (xúc tác thích hợp) thu được 7,36 gam hỗn hợp sản phẩm Y gồm ancol dư, anđehit, axit và nước. Cho Y tác dụng với Na dư thu được 2,464 lít H2 ở (đktc). Mặt khác, cho Y tác dụng với dung dịch AgNO3 dư trong NH3 dư đun nóng, đến phản ứng hoàn toàn thu được m gam Ag. Giá trị của m là:
A. 8,64. B. 56,16. C. 28,08. D. 19.44. (Đề thi thử THPT Quốc Gia lần 2 – THPT Đặng Thúc Hứa – Nghệ An, năm 2015) Câu 10: Chia 20,8 gam hỗn hợp gồm hai anđehit đơn chức là đồng đẳng kế tiếp thành hai phần bằng nhau:
- Phần một tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 đun nóng, thu được 108 gam Ag. - Phần hai tác dụng hoàn toàn với H2 dư (xúc tác Ni, t0), thu được hỗn hợp X gồm hai ancol Y và Z (MY < MZ). Đun nóng X với H2SO4 đặc ở 1400C, thu được 4,52 gam hỗn hợp ba ete. Biết hiệu suất phản ứng tạo ete của Y bằng 50%.
OFFICIAL
Hiệu suất phản ứng tạo ete của Z bằng A. 40%. B. 60%. C. 30%. D. 50%. (Đề thi tuyển sinh Đại học khối B, năm 2014) Câu 11: Hỗn hợp X gồm hai chất hữu cơ no, mạch hở (đều chứa C, H, O), trong phân tử mỗi chất có hai nhóm chức trong số các nhóm -OH, -CHO, -COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 4,05 gam Ag và 1,86 gam một muối amoni hữu cơ. Cho toàn bộ lượng muối amoni hữu cơ này vào dung dịch NaOH (dư, đun nóng), thu được 0,02 mol NH3. Giá trị của m là A. 1,24. B. 2,98. C. 1,22. D. 1,50. Câu 12: Đốt cháy hoàn toàn 0,6 mol hỗn hợp E chứa ancol X; este đơn chức Y và anđehit Z (X, Y, Z đều no, mạch hở và có cùng số nguyên tử hiđro) có tỉ lệ mol tương ứng 3 : 1 : 2 thu được 24,64 lít CO2 (đktc) và 21,6 gam nước. Mặt khác cho 0,6 mol hỗn hợp E trên tác dụng với dung dịch AgNO3 dư trong NH3, đun nóng thu được m gam Ag. Giá trị m là: A. 64,8 gam.B. 97,2 gam. C. 86,4 gam. D. 108 gam. (Đề thi chọn HSG tỉnh Thái Bình, năm 2016) Câu 13: Hỗn hợp T gồm ba chất hữu cơ X, Y, Z (50 < MX < MY < MZ và đều tạo nên từ các nguyên tố C, H, O). Đốt cháy hoàn toàn m gam T thu được H2O và 2,688 lít khí CO2 (đktc). Cho m gam T phản ứng với dung dịch NaHCO3 dư, thu được 1,568 lít khí CO2 (đktc). Mặt khác, cho m gam T phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 10,8 gam Ag. Giá trị của m là
A. 4,6. B. 4,8. C. 5,2. D. 4,4. (Đề thi minh họa kì thi THPT Quốc Gia, năm 2015) Câu 14: Chia 0,15 mol hỗn hợp X gồm một số chất hữu cơ (trong phân tử cùng chứa C, H và O) thành ba phần bằng nhau. Đốt cháy phần một bằng một lượng oxi vừa đủ rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư thu được 5 gam kết tủa. Phần hai tác dụng với một lượng dư dung dịch AgNO3 trong NH3 thu được 8,64 gam Ag. Phần ba tác dụng với một lượng Na vừa đủ thu được 0,448 lít H2 (đktc). Các phản ứng xảy ra hoàn toàn. Khối lượng của 0,15 mol hỗn hợp X là A. 6,48 gam. B. 5,58 gam. C. 5,52 gam. D. 6,00 gam. Câu 15: Hỗn hợp T gồm ba chất hữu cơ X, Y, Z (50 < MX < MY < MZ và đều tạo nên từ các nguyên tố C, H, O). Đốt cháy hoàn toàn m gam T thu được H2O và 2,688 lít khí CO2 (đktc). Cho m gam T phản ứng với dung dịch NaHCO3 dư, thu được 1,568 lít khí CO2 (đktc). Mặt khác, cho m gam T phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 10,8 gam Ag. Giá trị của m là A. 4,6. B. 4,8. C. 5,2. D. 4,4. (Đề thi minh họa kì thi THPT Quốc Gia, năm 2015) Câu 16: Hỗn
M gồm CH3CH2OH, CH2=CHCH2OH, CH3COOH, CH2=CHCOOH, HCOOCH3 Đốt cháy hoàn toàn m gam M cần dùng vừa đủ 0,4 mol O2, thu được 0,35 mol CO2 và 0,35 mol H2O. Mặt khác, cho m gam M trên tác dụng vừa đủ với 50 gam dung dịch Ba(OH)2 nồng độ x%. Giá trị của x là A. 68,40. B. 17,10. C. 34,20. D. 8,55. (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên Đại Học Vinh – Nghệ An, năm 2015) Câu 17: Đốt cháy hoàn toàn 26,72 gam hỗn hợp X gồm axit metacrylic, axit ađipic, axit axetic và glixerol (trong đó số mol axit metacrylic bằng số mol axit axetic) bằng O2 dư, thu được hỗn hợp Y gồm khí và hơi. Dẫn Y vào
DẠYKÈMQUYNHƠN
2
hợp
dung dịch chứa 0,76 mol Ba(OH)2, thu được 98,5 gam kết tủa và dung dịch Z. Đun nóng Z lại xuất hiện kết tủa. Cho 26,72 gam hỗn hợp X tác dụng với 150 ml dung dịch KOH 2M, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được m gam chất rắn khan. Giá trị của m gần giá trị nào nhất ?
A. 30,1 gam.B. 35,6 gam. C. 24,7 gam. D. 28,9 gam. (Đề thi chọn HSG tỉnh Thái Bình, năm 2016)
OFFICIAL
Câu 18: Cho 0,3 mol hỗn hợp X gồm 2 este đơn chức tác dụng vừa đủ với 200 ml dung dịch NaOH 2M đun nóng, thu được hợp chất hữu cơ no mạch hở Y có phản ứng tráng bạc và 37,6 gam hỗn hợp muối hữu cơ. Đốt cháy hoàn toàn Y rồi cho sản phẩm hấp thụ hết vào bình chứa dung dịch nước vôi trong (Ca(OH)2) dư, thấy khối lượng bình tăng 24,8 gam. Khối lượng của X là A. 30,8 gam. B. 33.6 gam. C. 32,2 gam. D. 35,0 gam. (Đề thi thử THPT Quốc Gia lần 1 – THPT Can Lộc – Hà Tĩnh, năm 2015) Câu 19: Một hợp chất hữu cơ X có công thức phân tử C10H8O4 trong phân tử chỉ chứa 1 loại nhóm chức. 1 mol X phản ứng vừa đủ với 3 mol NaOH tạo thành dung dịch Y gồm 2 muối (trong đó có 1 muối có M < 100), 1 anđehit no (thuộc dãy đồng đẳng của metanal) và nước. Cho dung dịch Y phản ứng với lượng dư AgNO3/NH3 thì khối lượng kết tủa thu được là: A. 162 gam. B. 432 gam. C. 162 gam. D. 108 gam. (Đề thi thử THPT Quốc Gia lần 1 – Thanh Hóa, năm 2015) Câu 20: Thủy phân hoàn toàn 0,1 mol este X cần 200 ml dd NaOH 1,5M. Cô cạn dung dịch sau phản ứng thu được glixerol và 24,6 gam muối khan của axit hữu cơ mạch thẳng. Hãy cho biết X có bao nhiêu công thức cấu tạo ? A. 1. B. 4. C. 7. D. 6. (Đề thi thử THPT Quốc Gia – THPT chuyên Vĩnh Phúc, năm 2015) Câu 21: Xà phòng hoá hoàn toàn m gam một este no, đơn chức, mạch hở E bằng 28 gam dung dịch KOH 28%. Cô cạn hỗn hợp sau phản ứng thu được 25,68 gam chất lỏng X và chất rắn khan Y. Đốt cháy hoàn toàn Y, thu được sản phẩm gồm CO2, H2O và K2CO3, trong đó tổng khối lượng của CO2 và H2O là 18,34 gam. Mặt khác, cho X tác dụng với Na dư, thu được 13,888 lít khí H2 (đktc). Giá trị m gần nhất với A. 11. B. 12. C. 10. D. 14. (Đề thi thử THPT Quốc Gia lần 1 – THPT Diễn Châu 5 – Nghệ An, năm 2015) Câu 22: Ancol X (MX= 76) tác dụng với axit cacboxylic Y thu được hợp chất Z mạch hở (X và Y đều chỉ có một loại nhóm chức). Đốt cháy hoàn toàn 17,2 gam Z cần vừa đủ 14,56 lít khí O2 (đktc), thu được CO2 và H2O theo tỉ lệ số mol tương ứng là 7 : 4. Mặt khác, 17,2 gam Z lại phản ứng vừa đủ với 8 gam NaOH trong dung dịch. Biết Z có công thức phân tử trùng với công thức đơn giản nhất. Số công thức cấu tạo của Z thỏa mãn là A. 1. B. 3. C. 2. D. 4. (Đề thi minh họa kì thi THPT Quốc Gia, năm 2015) Câu 23: X là este no, đơn chức; Y là este đơn chức; không no chứa một liên kết đôi C=C (X, Y đều mạch hở). Đốt cháy hoàn toàn 14,4 gam hỗn hợp E chứa X, Y cần dùng 14,336 lít O2 (đktc) thu được 9,36 gam nước. Mặt khác, thủy phân hoàn toàn E trong môi trường axit thu được hỗn hợp chứa 2 axit cacboxylic A, B (MA < MB) và ancol Z duy nhất. Cho các nhận định sau:
(1) X, A đều cho được phản ứng tráng gương.
(2) X, Y, A, B đều làm mất màu dung dịch Br2 trong môi trường CCl4.
(3) Y có mạch cacbon phân nhánh, từ Y điều chế thủy tinh hữu cơ bằng phản ứng trùng hợp.
(4) Đun Z với H2SO4 đặc ở 170oC thu được anken tương ứng.
(5) Nhiệt độ sôi tăng dần theo thứ tự X < Y < Z < A < B.
(6) Tính axit giảm dần theo thứ tự A > B > Z. Số nhận định đúng là: A. 3. B. 4. C. 5 D. 6.
Câu 24: Hỗn hợp X gồm 2 este đơn chức, tỉ lệ mol 1 : 3. Đốt cháy hoàn toàn 36,4 gam X, dẫn sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư, thu được 170 gam kết tủa, khối lượng dung dịch sau phản ứng giảm 66,4 gam. Mặt khác, thủy phân hoàn toàn 36,4 gam X trong dung dịch NaOH, thu được một ancol đơn chức và 34 gam hỗn hợp hai muối cacboxylat. Hai este trong X là: A. CH2=C(CH3)COOC2H5 và CH3COOC2H5 B. CH2=CHCOOC2H5 và CH3COOC2H5
DẠYKÈMQUYNHƠN
3
C. CH2=CHCH2COOCH3 và C2H5COOCH3
D. CH2=CHCH2COOCH3 và C2H5COOCH3
Câu 25: Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic và MX < MY; Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X, Y và Z. Đốt cháy hoàn toàn 11,16 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 13,216 lít khí O2 (đktc), thu được khí CO2 và 9,36 gam nước. Mặt khác 11,16 gam E tác dụng tối đa với dung dịch chứa 0,04 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng hết với dung dịch KOH dư là
A. 4,68 gam B. 5,44 gam C. 5,04 gam D. 5,80 gam (Đề thi tuyển sinh Đại học khối A, năm 2014)
Câu 26: Hỗn hợp X gồm 3 este đơn chức, tạo thành từ cùng một ancol Y với 3 axit cacboxylic (phân tử chỉ có nhóm -COOH); trong đó, có hai axit no là đồng đẳng kế tiếp nhau và một axit không no (có đồng phân hình học, chứa một liên kết đôi C=C trong phân tử). Thủy phân hoàn toàn 5,88 gam X bằng dung dịch NaOH, thu được hỗn hợp muối và m gam ancol Y. Cho m gam Y vào bình đựng Na dư, sau phản ứng thu được 896 ml khí (đktc) và khối lượng bình tăng 2,48 gam. Mặt khác, nếu đốt cháy hoàn toàn 5,88 gam X thì thu được CO2 và 3,96 gam H2O. Phần trăm khối lượng của este không no trong X là A. 38,76%. B. 40,82%. C. 34,01%. D. 29,25%.
OFFICIAL
(Kỳ thi THPT Quốc Gia năm 2015) Câu 27: X, Y là 2 axit đơn chức cùng dãy đồng đẳng, T là este 2 chức tạo bởi X, Y với ancol no mạch hở Z. Đốt cháy 8,58 gam hỗn hợp E gồm X, Y, T thì thu được 7,168 lít CO2 và 5,22 gam H2O. Mặt khác, đun nóng 8,58 gam E với dung dịch AgNO3/NH3 dư thì thu được 17,28 gam Ag. Tính khối lượng chất rắn thu được khi cho 8,58 gam E phản ứng với 150 ml dung dịch NaOH 1M? A. 11,04. B. 9,06.C. 12,08. D. 12,80. (Đề thi thử THPT Quốc Gia lần 1 – THPT Nguyễn Khuyến – TP. Hồ Chí Minh, năm 2015) Câu 28: X, Y, Z là 3 este đều đơn chức, mạch hở (trong đó Y và Z không no chứa một liên kết C = C và có tồn tại đồng phân hình học). Đốt cháy 21,62 gam hỗn hợp E chứa X, Y, Z với oxi vừa đủ, sản phẩm cháy dẫn qua dung dịch Ca(OH)2 dư thấy khối lượng dung dịch giảm 34,5 gam so với trước phản ứng. Mặt khác, đun nóng 21,62 gam E với 300 ml dung dịch NaOH 1M (vừa đủ), thu được hỗn hợp F chỉ chứa 2 muối và hỗn hợp gồm 2 ancol kế tiếp thuộc cùng dãy đồng đẳng. Khối lượng của muối có khối lượng phân tử lớn trong hỗn hợp F là: A. 4,68 gam. B. 8,64 gam. C. 8,10 gam. D. 9,72 gam. Câu 29: X, Y là 2 axit cacboxylic đều mạch hở; Z là ancol no; T là este hai chức, mạch hở được tạo bởi X, Y, Z. Đun nóng 38,86 gam hỗn hợp E chứa X, Y, Z, T với 400 ml dung dịch NaOH 1M (vừa đủ), thu được ancol Z và hỗn hợp F gồm 2 muối có tỉ lệ mol 1 : 1. Dẫn toàn bộ Z qua bình đựng Na dư thấy khối lượng bình tăng 19,24 gam; đồng thời thu được 5,824 lít khí H2 (đktc). Đốt cháy hoàn toàn F cần dùng 0,7 mol O2, thu được CO2, Na2CO3 và 0,4 mol H2O. Phần trăm khối lượng của T trong hỗn hợp E là: A. 8,88%. B. 26,40%. C. 13,90%. D. 50,82%.
Câu 30: Thủy phân hoàn toàn 4,84 gam este A bằng một lượng dung dịch NaOH vừa đủ, rồi cô cạn chỉ thu được hơi nước và hỗn hợp X gồm hai muối (đều có khối lượng phân tử lớn hơn 68). Đốt cháy hoàn toàn lượng muối trên cần đúng 6,496 lít O2 (đktc), thu được 4,24 gam Na2CO3; 5,376 lít CO2 (đktc) và 1,8 gam H2O. Thành phần phần trăm khối lượng muối có khối lượng phân tử nhỏ hơn trong X là A. 27,46%. B. 37,16%. C. 36,61%. D. 63,39%.
Câu 31: Este A tạo bởi 2 axit cacboxylic X, Y (đều mạch hở, đơn chức) và ancol Z. Xà phòng hóa hoàn toàn a gam A bằng 140 ml dung dịch NaOH tM thì cần dùng 80 ml dung dịch HCl 0,25M để trung hòa vừa đủ lượng NaOH dư, thu được dung dịch B. Cô cạn B thu được b gam hỗn hợp muối khan N. Nung N trong NaOH khan dư có thêm CaO thu được chất rắn R và hỗn hợp khí K gồm 2 hiđrocacbon có tỉ khối với oxi là 0,625. Dẫn K lội qua nước brom thấy có 5,376 lít 1 khí thoát ra, cho toàn bộ R tác dụng với axit H2SO4 loãng dư thấy có 8,064 lít khí CO2 sinh ra. Đốt cháy hoàn toàn 2,76 gam Z cần dùng 2,352 lít oxi sinh ra nước CO2 có tỉ lệ khối lượng 6 : 11. Biết các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị a gần nhất với giá trị nào sau đây? A. 26. B. 27. C. 28. D. 29. Câu 32: Hỗn hợp P gồm ancol X, axit caboxylic Y (đều
DẠYKÈMQUYNHƠN
4
toàn m
no, đơn chức, mạch hở) và este Z tạo ra từ X và Y. Đốt cháy hoàn
gam P cần dùng vừa đủ 0,18 mol O2, sinh ra 0,14 mol CO2. Cho m gam P trên vào 500 ml dung dịch NaOH 0,1M đun nóng, sau khi kết thúc các phản ứng thu được dung dịch Q. Cô cạn dung dịch Q còn lại 3,68 gam chất rắn khan. Người ta cho thêm bột CaO và 0,48 gam NaOH vào 3,68 gam chất rắn khan trên rồi nung trong
bình chân không. Sau khi phản ứng xảy ra hoàn toàn, thu được a gam khí. Giá trị của a gần nhất với giá trị nào sau đây?
A. 0,85 gam B. 1,25 gam. C. 1,45 gam. D. 1,05 gam. Câu 33: Ba chất hữu cơ X, Y, Z (50 < MX < MY < MZ) đều có thành phần nguyên tố C, H, O. Hỗn hợp T gồm X, Y, Z, trong đó . Đốt cháy hoàn toàn m gam T, thu được 13,2 gam CO2. Mặt khác, m gam T phản X YZ n4(nn)
OFFICIAL
ứng vừa đủ với 0,4 lít dung dịch KHCO3 0,1M. Cho m gam T phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 56,16 gam Ag. Phần trăm khối lượng của Y trong hỗn hợp T là: A. 22,26 %. B. 67,90%. C. 74,52%. D. 15,85%. Câu 34: X, Y, Z là ba axit cacboxylic đơn chức cùng dãy đồng đẳng (MX < MY < MZ), T là este tạo bởi X, Y, Z với một ancol no, ba chức, mạch hở E. Đốt cháy hoàn toàn 26,6 gam hỗn hợp M gồm X, Y, Z, T (trong đó Y và Z có cùng số mol) bằng lượng vừa đủ khí O2, thu được 22,4 lít CO2 (đktc) và 16,2 gam H2O. Mặt khác, đun nóng 26,6 gam M với lượng dư dung dịch AgNO3/NH3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 21,6 gam Ag. Mặt khác, cho 13,3 gam M phản ứng hết với 400 ml dung dịch NaOH 1M và đun nóng, thu được dịch N. Cô cạn dung dịch N thu được m gam chất rắn khan. Giá trị của m gần nhất với A. 38,04. B. 24,74 C. 16,74. D. 25,10. (Đề thi thử THPT Quốc Gia lần 4 – THPT chuyên Đại Học Vinh – Nghệ An, năm 2015) Câu 35: Đốt cháy hoàn toàn một este no đa chức X được tạo thành từ axit hai chức mạch hở và ancol ba chức mạch hở bằng oxi, sục toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư thu được 60 gam kết tủa và khối lượng dung dịch giảm 29,1 gam. Khối lượng mol của X là: A. 362. B. 348. C. 350. D. 346. (Đề thi thử Đại học lần 2 – THPT Đặng Thúc Hứa – Nghệ An, năm học 2013 – 2014) Câu 36: Hỗn hợp X gồm anđehit fomic, anđehit axetic, metyl fomat, etyl axetat và một axit cacboxylic no, hai chức, mạch hở Y. Đốt cháy hoàn toàn 29 gam hỗn hợp X (số mol của anđehit fomic bằng số mol của metyl fomat) cần dùng 21,84 lít (đktc) khí O2, sau phản ứng thu được sản phẩm cháy gồm H2O và 22,4 lít (đktc) khí CO2 Mặt khác, 43,5 gam hỗn hợp X tác dụng với 400 ml dung dịch NaHCO3 1M, sau khi kết thúc phản ứng thu được m gam muối khan. Giá trị có thể có của m là ?
A. 34,8 gam. B. 21,8 gam. C. 32,7 gam. D. 36,9 gam. Câu 37: X, Y là hai axit cacboxylic đều hai chức, mạch hở thuộc cùng dãy đồng đẳng kế tiếp; Z và T là hai este thuần chức hơn kém nhau 14 đvC, đồng thời Y và Z là đồng phân của nhau (MX < MY < MT). Đốt cháy 17,28 gam hỗn hợp E chứa X, Y, Z, T cần dùng 10,752 lít O2 (đktc). Mặt khác, đun nóng 17,28 gam E cần dùng 300 ml dung dịch NaOH 1M, thu được 4,2 gam hỗn hợp gồm 3 ancol có cùng số mol. Số mol của X trong E là: A. 0,05 mol. B. 0,04 mol. C. 0,06 mol. D. 0,03 mol. Câu 38: Cho hỗn hợp X gồm một axit no, đơn chức A và một este E tạo bởi một axit no, đơn chức B và một ancol no đơn chức C (A và B là đồng đẳng kế tiếp của nhau). Cho m gam hỗn hợp X tác dụng vừa đủ với dung dịch NaHCO3 thu được 1,92 gam muối. Nếu cho a gam hỗn hợp X tác dụng với lượng vừa đủ NaOH rồi đun nóng thì thu được 4,38 gam hỗn hợp D gồm muối của hai axit hữu cơ A, B và 0,03 mol ancol C, biết tỉ khối hơi của C so với hiđro nhỏ hơn 25 và C không điều chế trực tiếp được từ chất vô cơ. Đốt cháy hai muối trên bằng một lượng oxi vừa đủ thu được một muối vô cơ, hơi nước và 2,128 lít CO2 (đktc). Các phản ứng coi như xảy ra hoàn toàn. Giá trị của m là: A. 1,81. B. 3,7. C. 3,98. D. 4,12. Câu 39: X, Y là 2 hợp chất hữu cơ no, mạch hở, trong phân tử chỉ chứa một loại nhóm chức; X, Y khác chức hóa học (MX < MY). Đốt cháy hoàn toàn a mol X cũng như Y đều thu được x mol CO2 và y mol H2O với x = y + a. Lấy 0,25 mol hỗn hợp E chứa X, Y tác dụng với AgNO3/NH3 dư thu được 86,4 gam Ag. Mặt khác, đun nóng 0,25 mol E với dung dịch NaOH dư thì sản phẩm thu được chứa 15 gam hỗn hợp 2 muối của 2 axit hữu cơ no, đơn chức và 7,6 gam một ancol Z. Đốt cháy hoàn toàn 14,25 gam X cần dùng V lít O2 (đktc). Giá trị của V là A. 21 lít. B. 25,2 lít. C. 23,52 lít. D. 26,88. Câu 40: Hỗn hợp X gồm (CH3COO)3C3H5, CH3COOCH2CH(OOCCH3)CH2OH, CH3COOH, CH3COOCH2CHOHCH2OH và CH2OHCHOHCH2OH trong đó CH3COOH chiếm 10% tổng số mol hỗn hợp. Đun nóng m gam hỗn hợp X với dung dịch NaOH vừa đủ, thu được dung dịch chứa 20,5 gam natri axetat và 0,604m gam glixerol. Để đốt cháy m gam hỗn hợp X cần V lít O2 (đktc). Giá trị của V gần nhất là A. 25,3. B. 24,6. C. 24,9. D. 25,5. Câu 41: X là este no, đơn chức, Y là axit cacboxylic đơn chức, không no chứa một liên kết đôi C=C; Z là este 2 chức tạo bởi etylen glicol và axit Y (X, Y, Z, đều mạch hở, số mol Y bằng số mol Z). Đốt cháy a gam hỗn hợp E
DẠYKÈMQUYNHƠN
5
chứa X, Y, Z cần dùng 0,335 mol O2 thu được tổng khối lượng CO2 và H2O là 19,74 gam. Mặt khác, a gam E làm mất màu tối đa dung dịch chứa 0,14 mol Br2. Khối lượng của X trong E là: A. 8,6. B. 6,6. C. 6,8. D. 7,6. Câu 42: Thủy phân hoàn toàn m gam hỗn hợp hai este đơn chức mạch hở A, B (MA < MB) trong 700 ml dung dịch KOH 1M, thu được dung dịch X và hỗn hợp Y gồm 2 ancol là đồng đẳng liên tiếp. Đun nóng Y trong H2SO4 đặc ở 140oC, thu được hỗn hợp Z. Trong Z tổng khối lượng của các ete là 8,04 gam (Hiệu suất ete hóa của các ancol đều là 60%). Cô cạn dung dịch X được 54,4 gam chất rắn C. Nung chất rắn này với lượng dư hỗn hợp NaOH, CaO cho đến khi phản ứng xảy ra hoàn toàn, thu được 8,96 lít hỗn hợp khí T (đktc). Phần trăm khối lượng của A trong hỗn hợp ban đầu là: A. 66,89%. B. 48,96%. C. 49,68%. D. 68,94%. Câu 43: Đốt cháy 0,15 mol hỗn hợp X gồm metyl acrylat, etylen glicol, axetanđehit và ancol metylic cần dùng a mol O2 Sản phẩm cháy dẫn qua 200 ml dung dịch Ba(OH)2 1M, lọc bỏ kết tủa, cho dung dịch Ca(OH)2 dư vào phần nước lọc thì thu được thêm 53,46 gam kết tủa nữa. Giá trị của a là bao nhiêu ?
A. 0,215. B. 0,625. C. 0,455. D. 0,375.
Câu 44: X là axit cacboxylic no, hai chức; Y là ancol hai chức; Z là este thuần chức tạo bởi X và Y (X, Y đều mạch hở). Đốt cháy hoàn toàn 13,8 gam hỗn hợp E chứa X, Y, Z cần dùng 11,424 lít O2 (đktc) thu được 9,0 gam nước. Mặt khác đun nóng 13,8 gam với 120 ml dung dịch NaOH 1M (vừa đủ), rồi cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là
OFFICIAL
A. 9,72 gam. B. 12,00 gam. C. 9,00 gam. D. 8,40 gam. Câu 45: Cho 0,5 mol hỗn hợp E chứa 2 este đều đơn chức, mạch hở tác dụng với dung dịch AgNO3/NH3 đun nóng, thu được 64,8 gam Ag. Mặt khác, đun nóng 37,92 gam hỗn hợp E trên với 320 ml dung dịch NaOH 2M rồi cô cạn dung dịch sau phản ứng thu được phần rắn Y và 20,64 gam hỗn hợp chứa 2 ancol no trong đó oxi chiếm 31,0% về khối lượng. Đốt cháy hết chất rắn Y thu được Na2CO3; x mol CO2; y mol H2O. Tỉ lệ x : y là A. 17 : 9. B. 7 : 6. C. 14 : 9. D. 4 : 3. Câu 46: Thủy phân hoàn toàn 4,84 gam este hai chức A (tạo bởi axit hai chức) bằng một lượng dung dịch NaOH vừa đủ, rồi cô cạn chỉ thu được hơi H2O và hỗn hợp X gồm hai muối (đều có khối lượng phân tử lớn hơn 68). Đốt cháy toàn bộ lượng muối trên cần vừa đúng 6,496 lít O2 (đktc), thu được 4,24 gam Na2CO3; 5,376 lít CO2 (đktc) và 1,8 gam H2O. Thành phần phần trăm khối lượng của muối có khối lượng phân tử nhỏ hơn trong hỗn hợp X là A. 27,46%. B. 54,92%. C. 36,61%. D. 63,39%.
Câu 47: Hợp chất hữu cơ X có công thức phân tử trùng với công thức đơn giản nhất chứa C, H, O, N. Đốt cháy hoàn toàn 10,8 gam X thu được 4,48 lít CO2, 7,2 gam H2O và 2,24 lít khí N2 (đktc). Nếu cho 0,1 mol chất X trên tác dụng với dung dịch chứa 0,2 mol NaOH đun nóng thu được chất khí làm xanh giấy quỳ tím ẩm và dung dịch Y. Cô cạn dung dịch Y thu được m gam chất rắn khan. Giá trị của m là A. 15. B. 21,8. C. 5,7. D. 12,5. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đoàn Thượng – Hải Dương, năm 2015) Câu 48: Cho 16,5 gam chất A có công thức phân tử là C2H10O3N2 vào 200 gam dung dịch NaOH 8%. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch B và khí C. Tổng nồng độ phần trăm các chất có trong B gần nhất với giá trị : A. 8% B. 9% C. 12% D. 11% (Đề thi thử THPT Quốc Gia lần 1 – THPT
DẠYKÈMQUYNHƠN
6
chuyên Hùng Vương – Phú Thọ, năm 2015) Câu 49: Hỗn hợp X gồm chất Y (C2H10O3N2) và chất Z (C2H7O2N). Cho 14,85 gam X phản ứng vừa đủ với dung dịch NaOH và đun nóng, thu được dung dịch M và 5,6 lít (đktc) hỗn hợp T gồm 2 khí (đều làm xanh quỳ tím
nước cất). Cô cạn toàn bộ dung dịch M thu được m
A. 11,8. B. 12,5. C. 14,7. D.
(Đề thi thử THPT Quốc Gia lần 1 – THPT chuyên Đại học
Câu 50: Hỗn hợp X gồm 2 chất có công thức phân tử là C3
12N2O3 và C2H8N2O3. Cho
với dung dịch NaOH (đun
chức (đều làm xanh giấy
tẩm
gam muối khan. Giá trị của m có thể là
10,6.
Vinh – Nghệ An, năm 2015)
H
3,40 gam X phản ứng vừa đủ
nóng), thu được dung dịch Y chỉ gồm các chất vô cơ và 0,04 mol hỗn hợp 2 chất hữu cơ đơn
quỳ tím ẩm). Cô cạn Y, thu được m gam muối khan. Giá trị của m là A. 3,12. B. 2,76. C. 3,36. D. 2,97. (Kỳ thi THPT Quốc Gia năm 2015)
Câu 51: Cho 18,5 gam chất hữu cơ A (có công thức phân tử C3H11N3O6) tác dụng vừa đủ với 300 ml dung dịch NaOH 1M tạo thành nước, 1 chất hữu cơ đa chức bậc I và m gam hỗn hợp muối vô cơ. Giá trị gần đúng nhất của m là A. 19,05. B. 25,45. C. 21,15. D. 8,45.
OFFICIAL
Câu 52: Cho 0,05 mol một amino axit (X) có công thức H2NCnH2n-1(COOH)2 vào 100 ml dung dịch HCl 1,0M thì thu được một dung dịch Y. Cho Y tác dụng vừa đủ với một dung dịch Z có chứa đồng thời NaOH 1M và KOH 1M thì thu được một dung dịch T, cô cạn T thu được 16,3 gam muối, biết các phản ứng xảy ra hoàn toàn. Phần trăm về khối lượng của cacbon trong phân tử X là: A. 36,09. B. 40,81. C. 32,65. D. 24,49. (Đề thi chọn học sinh giỏi tỉnh Thái Bình, năm 2015) Câu 53: Cho 14,19 gam hỗn hợp gồm 3 amino axit (phân tử chỉ chứa một nhóm cacboxyl và một nhóm amino) vào dung dịch chứa 0,05 mol axit oxalic, thu được dung dịch X. Thêm tiếp 300 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được 26,19 gam chất rắn khan Y. Hòa tan Y trong dung dịch HCl dư, thu được dung dịch chứa m gam muối. Giá trị của m là A. 19,665. B. 35,39. C. 37,215. D. 39,04. Câu 54: Chia hỗn hợp X gồm glyxin và một số axit cacboxylic thành hai phần bằng nhau. Phần một tác dụng với dung dịch NaOH vừa đủ rồi cô cạn. Đốt cháy toàn bộ lượng muối sinh ra bằng một lượng oxi vừa đủ thu được hỗn hợp khí Y gồm CO2, H2O, N2 và 10,6 gam Na2CO3. Cho toàn bộ hỗn hợp khí Y qua bình đựng dung dịch Ca(OH)2 dư, thu được 34 gam kết tủa đồng thời thấy khối lượng bình tăng thêm 20,54 gam so với ban đầu. Phần hai tác dụng vừa đủ với 40 ml dung dịch HCl 1M. Các phản ứng xảy ra hoàn toàn, coi như N2 không bị nước hấp thụ. Thành phần phần trăm khối lượng của glyxin trong hỗn hợp X là A. 25,73%. B. 24,00%. C. 25,30%. D. 22,97%. Câu 55: Hỗn hợp X gồm hai amino axit no, mạch hở Y và Z, có cùng số nguyên tử cacbon và đều có một nhómNH2 trong phân tử (số mol của Y lớn hơn số mol của Z). Cho 52,8 gam X vào dung dịch NaOH dư, thu được 66 gam muối. Nếu cho 52,8 gam X vào dung dịch HCl dư thì thu được 67,4 gam muối. Phần trăm khối lượng của Z trong hỗn hợp X là A. 55,68%. B. 33,52%. C. 66,48%. D. 44,32%. Câu 56: Thủy phân hết một lượng pentapeptit T thu được 32,88 gam Ala-Gly-Ala-Gly; 10,85 gam Ala-Gly-Ala; 16,24 gam Ala-Gly-Gly; 26,28 gam Ala-Gly; 8,9 gam Alanin; còn lại là Glyxin và Gly-Gly với tỉ lệ mol tương ứng là 1:10. Tổng khối lượng Gly-Gly và Glyxin trong hỗn hợp sản phẩm là
A. 25,11 gam. B. 27,90 gam. C. 34,875 gam. D. 28,80 gam. (Đề thi chọn HSG tỉnh Thái Bình, năm học 2013 – 2014) Câu 57: Thủy phân một pentapeptit mạch hở, thu được 3,045 gam Ala-Gly-Gly, 3,48 gam Gly-Val, 7,5 gam Gly, x mol Val và y mol Ala. Giá trị x, y có thể là: A. 0,03; 0,035 hoặc 0,13; 0,06 hoặc 0,055; 0,135.
B. 0,055; 0,06 hoặc 0,13; 0,06 hoặc 0,03; 0,035.
C. 0,055; 0,135 hoặc 0,035; 0,06 hoặc 0,13; 0,06.
D. 0,03; 0,035 hoặc 0,13; 0,035 hoặc 0,055; 0,135. (Đề thi thử THPT Quốc Gia lần 1 – THPT Trần Bình Trọng – Phú Yên, năm 2015) Câu 58: Khi thủy phân không hoàn toàn một peptit X có khối lượng phân tử 293 g/mol và chứa 14,33%N (theo khối lượng) thu được 2 peptit Y và Z. 0,472 gam Y phản ứng vừa hết với 18 ml dung dịch HCl 0,222M. 0,666 gam peptit Z phản ứng vừa hết với 14,7 ml dung dịch NaOH 1,6% (khối lượng riêng là 1,022 g/ml). Cấu tạo có thể có của X là:
A. Phe-Ala-Gly hoặc Ala-Gly-Phe. B. Phe-Gly-Ala hoặc Ala-Gly-Phe.
C. Ala-Phe-Gly hoặc Gly-Phe-Ala. D. Phe-Ala-Gly hoặc Gly-Ala-Phe.
Câu 59: Hỗn hợp M gồm Lys-Gly-Ala, Lys-Ala-Lys-Lys-Gly, Ala-Gly trong đó nguyên tố oxi chiếm 21,3018% khối lượng. Cho 0,16 mol hỗn hợp M tác dụng với dung dịch HCl vừa đủ thu được bao nhiêu gam muối?
A. 90,48 B. 83,28. C. 93,36. D. 86,16.
Câu 60: Hỗn hợp M gồm một peptit mạch hở X và một peptit mạch hở Y (mỗi peptit được cấu tạo từ một loại αamino axit, tổng số nhóm –CO–NH– trong 2 phân tử X, Y là 5) với tỉ lệ số mol nX : nY = 1 : 3. Khi thủy phân hoàn toàn m gam M thu được 81 gam glyxin và 42,72 gam alanin. Giá trị của m là:
A. 104,28. B. 109,5. C. 116,28.
D. 110,28.
DẠYKÈMQUYNHƠN
7
(Đề thi chọn học sinh giỏi tỉnh Thái Bình, năm 2015)
Câu 61: Cho m gam hỗn hợp M gồm 3 peptit X, Y, Z đều mạch hở và có tỉ lệ số mol nX : nY : nZ = 2 : 3 : 5. Thủy phân hoàn toàn N, thu được 60 gam Gly, 80,1 gam Ala, 117 gam Val. Biết số liên kết peptit trong X, Y, Z khác nhau và có tổng là 6. Giá trị của m là
A. 226,5. B. 255,4. C. 257,1. D. 176,5. (Đề thi thử THPT Quốc Gia lần 1 – THPT Quỳnh Lưu 1 – Nghệ An, năm 2015) Câu 62: Hỗn hợp A gồm ba peptit mạch hở X, Y, Z có tỉ lệ mol tương ứng là 2 : 3 : 4. Thủy phân hoàn toàn m gam A thu được hỗn hợp sản phẩm gồm 21,75 gam Glyxin và 16,02 gam Alanin. Biết số liên kết peptit trong phân tử X nhiều hơn trong Z và tổng số liên kết peptit trong ba phân tử X, Y, Z nhỏ hơn 17. Giá trị của m là A. 30,93. B. 30,57. C. 30,21. D. 31,29. (Đề thi thử THPT Quốc Gia lần 2 – THPT Tĩnh Gia 2 – Thanh Hóa, năm 2015)
Câu 63: Đốt cháy hoàn toàn 0,3 mol hỗn hợp X gồm propilen và 2 amin no mạch hở đồng đẳng kế tiếp trong oxi dư thu được 16,8 lít CO2, 2,016 lít N2 (đktc) và 16,74 gam H2O. Khối lượng của amin có khối lượng mol phân tử nhỏ hơn là
OFFICIAL
A. 1,35 gam. B. 2,16 gam. C. 1,8 gam. D. 2,76 gam Câu 64: X là một α–amino axit no, chứa 1 nhóm –COOH và 1 nhóm –NH2. Từ m gam X điều chế được m1 gam đipeptit Y. Từ 2m gam X điều chế được m2 gam tripeptit Z. Đốt cháy m1 gam Y thu được 0,9 mol H2O. Đốt cháy m2 gam Z thu được 1,7 mol H2O. Giá trị của m là A. 11,25. B. 1335. C. 22,50. D. 26,70. ● Lưu ý : Lượng CO2 thu được khi đốt cháy Z bằng gấp 2 lần lượng CO2 thu được khi đốt cháy Y là vì : Y được điều chế từ m gam X, còn Z được điều chế từ 2m gam X. Câu 65: Đun nóng 0,14 mol hỗn hợp M gồm hai peptit X (CxHyOzN4) và Y (CnHmO7Nt) với dung dịch NaOH vừa đủ chỉ thu được dung dịch chứa 0,28 mol muối của glyxin và 0,4 mol muối của alanin. Mặt khác, đốt cháy m gam M trong O2 vừa đủ thu được hỗn hợp CO2, H2O và N2, trong đó tổng khối lượng của CO2 và nước là 63,312 gam. Giá trị m gần nhất với: A. 32. B. 18. C. 34. D. 28. (Đề thi thử THPT Quốc Gia lần 1 – THPT Diễn Châu 5 – Nghệ An, năm 2015) Câu 66: Đun nóng 0,16 mol hỗn hợp E gồm hai peptit X (CxHyOzN6) và Y (CnHmO6Nt) cần dùng 600 ml dung dịch NaOH 1,5M chỉ thu được dung dịch chứa a mol muối của glyxin và b mol muối của alanin. Mặt khác, đốt cháy 30,73 gam E trong O2 vừa đủ thu được hỗn hợp CO2, H2O và N2, trong đó tổng khối lượng của CO2 và nước là 69,31 gam. Giá trị a : b gần nhất với A. 0,730. B. 0,810. C. 0,756. D. 0,962. (Đề thi minh họa kì thi THPT Quốc Gia, năm 2015) Câu 67: Hỗn hợp X gồm 0,1 mol một α-amino axit no, mạch hở A chứa 1 nhóm –NH2, 1 nhóm –COOH và 0,025 mol pentapeptit mạch hở cấu tạo từ A. Đốt cháy hỗn hợp X cần a mol O2, sản phẩm cháy hấp thụ hết vào 1 lít dung dịch NaOH 1,2M thu được dung dịch Y. Rót từ từ dung dịch chứa 0,8a mol HCl vào dung dịch Y thu được 14,448 lít CO2 (đktc). Đốt 0,01a mol đipeptit mạch hở cấu tạo từ A cần V lít O2 (đktc). Giá trị của V là A. 2,2491. B. 2,5760. C. 2,3520. D. 2,7783. Câu 68: Đun nóng 45,54 gam hỗn hợp E gồm hexapeptit X và tetrapeptit Y cần dùng 580 ml dung dịch NaOH 1M chỉ thu được dung dịch chứa muối natri của glyxin và valin. Mặt khác, đốt cháy cùng lượng E trên trong O2 vừa đủ thu được hỗn hợp CO2, H2O, N2; trong đó tổng khối lượng của CO2 và H2O là 115,18 gam. Công thức phân tử của peptit X là
toàn m gam
Gly, Ala và Val. Mặt khác, để đốt cháy hoàn toàn m gam hỗn hợp X, Y ở trên cần 107,52 lít khí O2 (đktc) và thu được 64,8 gam H2O. Giá trị của m là A. 102,4. B. 97,0. C. 92,5.D. 107,8. Câu 70: X, Y, Z, T là các peptit đều được tạo bởi các α-amino axit no, chứa một nhóm –NH2 và 1 nhóm –COOH và có tổng số nguyên tử oxi là 12. Đốt cháy 13,98 gam hỗn hợp E chứa X, Y, Z, T cần dùng 14,112 lít O2 (đktc) thu được CO2, H2O, N2 Mặt khác, đun nóng 0,135 mol hỗn hợp E bằng dung dịch NaOH (lấy dư 20% so với phản ứng), cô cạn dung dịch sau phản ứng thu được lượng chất rắn khan là A. 31,5 gam. B. 24,51 gam. C. 36,05 gam. D. 25,84 gam.
DẠYKÈMQUYNHƠN
8
A.
17
C. C24H44N
gồm
C
H30N6O7. B. C21H38N6O7.
6O7 D. C18H32N6O7 Câu 69: Thủy phân hoàn
hỗn hợp gồm peptit X và peptit Y bằng dung dịch NaOH, thu được 151,2 gam hỗn hợp
các muối natri của
Câu 71: Đun nóng 0,08 mol hỗn hợp E gồm hai peptit X (CxHyOzN6) và Y (CnHmO6Nt) cần dùng 300 ml dung dịch NaOH 1,5M chỉ thu được dung dịch chứa a mol muối của glyxin và b mol muối của alanin. Mặt khác, đốt cháy 60,90 gam E trong O2 vừa đủ thu được hỗn hợp CO2, H2O, N2, trong đó tổng khối lượng của CO2 và H2O là 136,14 gam. Giá trị a : b là A. 0,750. B. 0,625. C. 0,775. D. 0,875. Câu 72: X và Y là hai peptit được tạo từ các α-amino axit no, mạch hở, chứa 1 nhóm –NH2 và 1 nhóm –COOH. Đun nóng 0,1 mol hỗn hợp E chứa X, Y bằng dung dịch NaOH (vừa đủ). Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Đốt cháy toàn bộ lượng muối này thu được 0,2 mol Na2CO3 và hỗn hợp gồm CO2, H2O, N2 trong đó tổng khối lượng của CO2 và H2O là 65,6 gam. Mặt khác đốt cháy 1,51m gam hỗn hợp E cần dùng a mol O2, thu được CO2, H2O và N2. Giá trị của a gần nhất với A. 2,5. B. 1,5. C. 3,5. D. 3,0. Câu 73: Đun nóng 0,045 mol hỗn hợp E chứa hai peptit X, Y (có số liên kết peptit hơn kém nhau 1) cần vừa đủ 120 ml KOH 1M, thu được hỗn hợp Z chứa 3 muối của Gly, Ala, Val trong đó muối của Gly chiếm 33,832% về khối lượng. Mặt khác, đốt cháy hoàn toàn 13,68 gam E cần dùng 14,364 lít khí O2 (đktc), thu được hỗn hợp khí và hơi trong đó tổng khối lượng của CO2 và H2O là 31,68 gam. Phần trăm khối lượng muối của Ala trong Z gần nhất với: A. 45% B. 50% C. 55% D. 60% Câu 74: Cho 0,7 mol hỗn hợp T gồm hai peptit mạch hở là X (x mol) và Y (y mol), đều tạo bởi glyxin và alanin. Đun nóng 0,7 mol T trong lượng dư dung dịch NaOH thì có 3,8 mol NaOH phản ứng và thu được dung dịch chứa m gam muối. Mặt khác, nếu đốt cháy hoàn toàn x mol X hoặc y mol Y thì đều thu được cùng số mol CO2 Biết tổng số nguyên tử oxi trong hai phân tử X và Y là 13, trong X và Y đều có số liên kết peptit không nhỏ hơn 4. Giá trị của m là A. 396,6. B. 340,8. C. 409,2. D. 399,4. (Kỳ thi THPT Quốc Gia năm 2015) Câu 75: Hỗn hợp X gồm peptit A mạch hở có công thức CxHyN5O6 và hợp chất B có công thức phân tử là C4H9NO2 Lấy 0,09 mol X tác dụng vừa đủ với 0,21 mol NaOH chỉ thu được sản phẩm là dung dịch gồm ancol etylic và a mol muối của glyxin, b mol muối của alanin. Nếu đốt cháy hoàn toàn 41,325 gam hỗn hợp X bằng lượng oxi vừa đủ thì thu được N2 và 96,975 gam hỗn hợp CO2 và H2O. Giá trị a : b gần nhất với
OFFICIAL
A. 0,50. B. 0,76. C. 1,30. D. 2,60. (Đề thi thử THPT Quốc Gia lần 3 – THPT chuyên Đại học Vinh – Nghệ An, năm 2015) Câu 76: Hỗn hợp E gồm tripeptit X và pentapeptit Y, đều được tạo thành từ amino axit no, mạch hở chỉ chứa một nhóm –NH2 và một nhóm –COOH. Cho 0,1 mol E tác dụng với 200 ml dung dịch HCl 1M thu được dung dịch Z, dung dịch Z tác dụng vừa đủ với 620 ml dung dịch NaOH 1M. Mặt khác, đốt cháy 13,15 gam E trong lượng O2 vừa đủ, lấy sản phẩm tạo thành sục vào dung dịch NaOH dư, thấy thoát ra 2,352 lít khí (ở đktc). Amino axit tạo thành X và Y là: A. gly và ala. B. gly. C. ala. D. gly và val. (Đề thi thử THPT Quốc Gia lần 1 – THPT Đặng Thúc Hứa – Nghệ An, năm 2015) Câu 77: Peptit X và peptit Y có tổng liên kết peptit bằng 8. Thủy phân hoàn toàn X cũng như Y đều thu được Gly và Val. Đốt cháy hoàn toàn hỗn hợp E chứa X và Y có tỉ lệ mol tương ứng 1 : 3 cần dùng 22,176 lít O2 (đktc). Sản phẩm cháy gồm CO2, H2O và N2. Dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch Ca(OH)2 dư thấy khối lượng bình tăng 46,48 gam, khí thoát ra khỏi bình có thể tích 2,464 lít (đktc). Thủy phân hoàn toàn hỗn hợp E thu được a mol Gly và b mol Val. Tỉ lệ a : b là A. 1 : 1 B. 1 : 2. C. 2 : 1. D. 2 : 3. (Đề thi thử THPT Quốc Gia lần 1 – THPT Phụ Dực – Thái Bình, năm 2015) Câu 78: Thủy phân m gam hỗn hợp X gồm một tetrapeptit A và một pentapeptit B (A và B chứa đồng thời glyxin và alanin trong phân tử) bằng một lượng dung dịch NaOH vừa đủ rồi cô cạn thu được (m + 15,8) gam hỗn hợp muối. Đốt cháy toàn bộ lượng muối sinh ra bằng một lượng oxi vừa đủ thu được Na2CO3 và hỗn hợp hơi Y gồm CO2, H2O và N2. Dẫn toàn bộ hỗn hợp hơi Y đi rất chậm qua bình đựng dung dịch NaOH đặc dư thấy khối lượng bình tăng thêm 56,04 gam so với ban đầu và có 4,928 lít một khí duy nhất (đktc) thoát ra khỏi bình. Xem như N2 không bị nước hấp thụ, các phản ứng xảy ra hoàn toàn. Thành phần phần trăm khối lượng của A trong hỗn hợp X là A. 55,92%. B. 35,37%. C. 30,95%. D. 53,06%.
DẠYKÈMQUYNHƠN
9
Câu 79: X là peptit mạch hở cấu tạo từ axit glutamic và α-amino axit Y no, mạch hở chứa 1 nhóm –NH2 và 1 nhóm –COOH. Để tác dụng vừa đủ với 0,1 mol X cần 0,7 mol NaOH tạo thành hỗn hợp muối trung hoà. Đốt 6,876 gam X cần 8,2656 lít O2 (đktc). Đốt m gam tetrapeptit mạch hở cấu tạo từ Y cần 20,16 lít O2 (đktc). Giá trị của m là A. 24,60. B. 18,12. C. 15,34. D. 13,80.
Câu 80: Hỗn hợp X gồm Ala–Val–Ala,Val–Val, Ala–Ala, Ala–Val, Val–Ala. Thuỷ phân hoàn toàn hỗn hợp X thu được Alanin và Valin có tỉ lệ về khối lượng là Alanin:Valin=445:468. Đốt 0,4 mol hỗn hợp X thu được tổng khối lượng CO2 và H2O là 216,1 gam. Phần trăm khối lượng Ala–Val–Ala trong hỗn hợp X là A. 31,47%. B. 33,12%. C. 32,64%. D. 34,08%.
Câu 81: Cho m gam hỗn hợp E gồm một peptit X và một amino axit Y (MX > 4MY) được trộn theo tỉ lệ mol 1 : 1 tác dụng với một lượng dung dịch NaOH vừa đủ, thu được dung dịch G chứa (m + 12,24) gam hỗn hợp muối natri của glyxin và alanin. Dung dịch G phản ứng tối đa với 360 ml dung dịch HCl 2M, thu được dung dịch T chứa 63,72 gam hỗn hợp muối. Các phản ứng xảy ra hoàn toàn. Kết luận nào sau đây đúng?
A. X có 6 liên kết peptit.
B. X có thành phần trăm khối lượng nitơ là 20,29%.
C. Y có thành phần phần trăm khối lượng nitơ là 15,73%.
D. X có 5 liên kết peptit. Câu 82: Hỗn hợp A gồm 2 ancol X, Y đều mạch hở có tỉ lệ mol 1 : 1 (X nhiều hơn Y một nguyên tử C). Đốt cháy hoàn toàn hỗn hợp A, sản phẩm chỉ chứa CO2 và H2O có tỉ lệ khối lượng tương ứng là 22 : 9. Z là axit cacboxylic no hai chức, mạch hở; G là este thuần chức được điều chế từ Z với X và Y. Hỗn hợp B gồm X, Y, G có tỉ lệ mol 2 : 1 : 2. Đun nóng 8,31 gam hỗn hợp B cần dùng 200 ml dung dịch NaOH 0,3M. Cô cạn dung dịch sau phản ứng thu được phần hơi D chứa các chất hữu cơ. Lấy toàn bộ D tác dụng với dung dịch AgNO3/NH3 dư thu được 9,78 gam kết tủa. Tên gọi của Z là
OFFICIAL
A. axit oxalic. B. axit malonic. C. axit glutaric. D. axit ađipic. ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1D 2D 3B 4A 5B 6A 7B 8C 9C 10B 11C 12D 13A 14B 15A 16B 17A 18C 19B 20D 21B 22B 23A 24B 25A 26C 27A 28B 29D 30D 31C 32A 33D 34B 35D 36C 37C 38D 39A 40A 41B 42D 43C 44A 45B 46D 47D 48B 49C 50B 51A 52A 53C 54D 55B 56B 57A 58C 59A 60A 61A 62A 63D 64D 65D 66A 67D 68A 69A 70A 71D 72C 73B 74A 75C 76A 77A 78D 79D 80A 81B 82C
DẠYKÈMQUYNHƠN
10
DẠYKÈMQUYNHƠN OFFICIAL 11 Câu
2 X HO 3 xt 3 3 3
3 3
3
CHCHO Z Z 44x C%
M
Câu 2: o o 410 48 t,xt 410 462 t,xt 410 n2nm2m2 X CH khítang X XY CH Y lienkettang YX Phöôngtrìnhphanöng: CH CH2H mol:x x2x CH CHCH mol:y yy n4n3 n4n4 Chon nM n1 n8n 4 0,5 nM Trong8molYc 2 2 Brpövôi0,1molY Brpövôi0,1molY n 0,625 o145mollienket Trong1molYco0,625mollienketm 100gam Câu 3: Ho 2O,t xt
1:
dungdòchY
M31,6 CHCH:0,12mol 6,32gamXgomCHCCH:0,08molXanñehit CHCHO:xmol CHCOCH:ymol CHCH CHCCH CHCH:(0,12x)mol CHCCH:(0,08y)mol
honhôpkhíZ
1,3046%x0,06;y0,02 20026x40y 6,3226x40y V0,06.2.22,42,688lít
16,5.2 0,12x0,08y
DẠYKÈMQUYNHƠN OFFICIAL 12
2 2 0,4molXlammatmau0,616096gamBr
Câu 4: 1 1 11 1 2 n2n 2 2 X 12 XX X X X X X X X Hpö Y n2n CHHpö X Hbñ M9TrongXcoH,Yñachuyenhetthanhhiñrocacbonno. nM4,5n.Mn.M . nM3 n4,5 Chon n1,5. n3 NeuXlaCHthì: nn1,51,514n32 M46n1(loai) ,5 n3 Ne n2n2 2 2 n2n2 CH Hpö X 22 Hbñ uXlaCHthì: n0,5n0,75 n2M0,75(14n2)3,7526 YlaCH 4,5 n3,75 Câu 5: YX Y YY HphanöngXY 2 2 mm0,5.260,4.520,65.2 n 0,9 19,52 MM n nn(0,50,40,65)0,90,65 Hphanönghet. CHdöCHdöCHAgNO 22 44 46 3 CHdöCHdöCH 22 44 46 CHdöCHdöCHCHbanñauCHbanñauBrH 22 44 4622 44 22 2nnnn0,7 nnn0,90,450,45 2n3n2n2n 3n nn1
o 2 n4 2 2 Br0,45 4 t,Ni n nx nxy 2 honhôpY,M46 0,25 honhôpX CachiñrocacbontrongXcodangCH YphanöngvôiBrnentrongYkhongconH Sôñophanöng: CH:amol CH:0,25mol CHBr H:bmol
o 3,44 t,Ni 3,44 2 3,45,2 2 23,44 2 3,444,8 12nx46 12nx46n3,4 2nx2 2nx1,6x5,20,250,45 2 CH:0,25 HonhôpXbanñaula vìCH0,6H CH H:0,15 PhanöngcuaXvôiBr:CH2,4BrCHBr 0,250,6
0,25960,25molXlammatmau060gamBr ,4
bmol;n cmol. ApdungBTC,BTKLvacongthöc(k1)nnnsuyra: 2a3b4c1,106 a0,05(hs50%) 46a60b72z18,7520,5(abc).18b0,282(hs60%) ab1,2520,5(abc)1,106 c0,04(
hs40%)
DẠYKÈMQUYNHƠN OFFICIAL 13 CHdö 22 CHdö
m
45 CH
n
2 enhan enhöông ROR
n
n
25 37 25 25 37 37 25 37 CHOHCHOH CHOH CHOH CHOH CHOH CHOHphanöngtaoete CHOHphanöngtaoete nn0,5 n0,2 46n60n27,2n0,3 n 0,2x;n 0,3y x 0,2x460,3y606,7618(0,1x0,15y) 0,2x0,3y0,08.2 0,5(50%)
2 2 2 25 3ancol
25 37 47
37 47 xyz 2 2
kettua 44 Câu 8: 2 2 2 2 2 2 3 RCHOHpöHOH RCOOHKOH RCHOHdöHOHRCOOHH RCHOHdöRCHOHpöRCOOH 0,16 ?0,48 RCHOH 3 CHOHpö Oxihoaancol:n n P1:nn0,16 P2:n nn2n0,64 n n n0,64 M46,0832(CHOH) 30,48 46, n 0,75. AgHCHOHCOOH 0,2 0,16 HCHO HCOOH Ag n4n2n1,12 08 0,36 332 n0,36n0,2m1,12108120,96gam Câu 9:
m m CAgCHAgCHAg 2243
46
0,25 n 0,1m0,252400,11590,116192gam n0,1 Câu 6:
n2n1 ancoldöTeteHO 25
37
M6,7684,5R34,252ancollaCHOH 0,08 mmmm27,26,760,08.1819n2,6 27,2 X:CHOHÑotchayZcungnhöñotchayT:.6n4.1,95T: 14n18 Y:CHOH
y0,2(20%)
Câu 7:
12ancolnoHOCO 2,582,01
2ancolkhongnoBr xmol ymol 3 CHOHpö 2,01 P:n nn0,57C 3 0,67 X:CHOH,CHOH,CHOH P:n n0,1 xy0,57 x0,1 2x3y2,0140,1y0,47 P:Ñatn amol;n
CHOHpö CHOHpö CHOCOHO
DẠYKÈMQUYNHƠN OFFICIAL 14 o o 2 3 2 2 3 t 2 2 t 2 2 Opö RCHOHpö 3 O CHOHbñ RCHOH RCHOH HOHHCOOHHCHOCHOHpö H Phöôngtrìnhphanöng: RCHOHORCHOHO RCHOH2ORCOOHHO 7,364,16 n 0,20,2n 0,1XlaCHOH 16 n n 0,13 M41,6 1 2 n nnnn n 3 3 2 HCOOH COOHHOHOpö CHOHdö HCHO CHOHdöHCOOHHOHH AgHCHOHCOOH Ag n0,09 7,364,16 nn 0,2n 0,02 16 n0,02 n nn2n0,22 n4n2n0,26molm28,08gam Câu 10: AgRCHO RCHO RCHO RCHO HCHOCHCHOAg CHOH HCHO 3 3 CHCHO HCHOCHCHO CHOH 3 3 25 2nn1n0,5 20,8 M20,8(loai) m 10,4 2 4n2n n1 n0,2n0,2 n 0,1 30n44n 10,4 n 0,1 HO ancol 2 CHOHpö 3 CHOHpö m 25 m m ete ancol HO 2 n0,5n(0,050,05h%) n 0,250%0,1 0,1320,1h%464,52(0,050,05h%)18 n 0,1.h% h%60% Câu 11: NaOH 4 3 0,02mol xy 3 3 Xmuoi Ag:2ymol COOH:xmol CHO:ymol COONH NH y0,018752y0,0375 xy0,02x1,2510 mm1,861,25.10(6245)0,01875(6229)1,22gam Câu 12: 3 2 2 3 3 (X,Y,Z) Z 2 2 (X,Y,Z) AgHCOOCHCH(CHO) Ag 21,6.2 XlaCHOH;YlaHCOOCH H 4 180,6 1,11.0,32.0,1 24,64 C 3,ZlaCH(CHO) C 1,8 0,2 22,4.0,6 n2n 4n 1molm108gam ● PS : Vì Z là hợp chất no nên chỉ cần tìm được số C và H là có thể tìm được công thức của nó. Câu 13: 33 o AgNO/NH t
DẠYKÈMQUYNHƠN OFFICIAL 15 2 3 2 CtrongTCO CtrongTCOOHCHO CHOAg COOHNaHCOCO nn0,12
X,Y,ZkhongcoCôgochiñrocacbon
XYZ T CHO COOH 50MMMX,Y,ZkhongthelaHCHO,HCOOH X,Y,ZlanlöôtlaOHCCHO,OHCCOOH,HOOCCOOH
Câu 14: 2 3 3 3 3 2 1 X X 3 1COCaCO CtrongX 3 3 CHOHHCHOHCOOH CHOH HCHO HCOOH HCHOHCOOHAg 0,15 CHOHHCOOHH n0,05 C0,051 0,05 n nn0,05XgomCHOH;HCHO;HCOOH nnn0,05n0,02;n0,01;n0,02 4n2nn0,08m nn2n0,04 molX3(0,02320,01300,0246) 5,58gam Câu 15: 2 3 2 CtrongTCO CtrongTCOOHCHO CHOAg COOHNaHCOCO nn0,12 nnn0,12 2nn0,1 X,Y,ZkhongcoCôgochiñrocacbonnnn0,07 XYZ T CHO COOH 50MMMX,Y,ZkhongthelaHCHO,HCOOH X,Y,ZlanlöôtlaOHCCHO,OHCCOOH,HOOCCOOH mmm0,05290,07454,6gam Câu 16: m42 2 2 32 n6 2 2 xmol 3 2 m42 ymol 3 CHOOH Ba(OH) Ba(OH) CHCHOH CHO CHCHCHOH BTH:6x4y0,35.2 MgomCHCOOH BTO:x2y0,25 CHCHCOOHCHO HCOOCH nn0,1x0,05 0,0517C% y0,1n0,05 1 17,1% 50 Câu 17:
nnn0,12 2nn0,1
nnn0,07
mmm0,05.290,07.454,6gam
6a3b1,02 b0,1 26,72gamX0,3
(CH)(COOK):0,12molmolKOHchatran KOHdö:0,06 m30gam30,1gam
DẠYKÈMQUYNHƠN OFFICIAL 16 2 3 32
2 3
3
chatran
Câu 18: 33 n2n NaOH X(2esteñônchöc) AgNO/NH NaOH ñônchöc X Y(CHO NaOH n 0,4 Ylaanñehitno,ñônchöc 1 n 0,3 Xestecuaphenol(xmol)
X Y Ag
x0,1;y0,2nxy0,3 nn2xy0,4 o 2 2 O,t n2n 22 02nmol02nmol 0,2mol ) 24 2 HOestecuaphenol 37,6gam 0,4mol 0,1mol0,2mol X CHO COHO 0,2 0,2n(4418)24,8n2 XNaOHmuoiCHOHO(nn ) m37,60,2440,1180,44032,2gam Câu 19: X 64 XNaOH NaOH n2n1 X 64 2 1mol3mol Theogiathiet: O42(COO)Xcodang:COOCHCOO(*) n:n1:3 CHCHO X(C10) (**) RCOONa(M100) n1;RlaH Tö(*)va(**),suyra:XlaHCOOCHCOOCHCH X3NaOH 3 64 3 1mol 1mol AgHCOONaCHCHO Ag HCOONaNaOCHCOONaCHCHO n2n2n4m432gam Câu 20: 0,10,3 35 3 13 1 1 23 23 325 33 XNaOHGlixerolmuoicuaaxithöucô XlaCH(OOCR):0,1mol24,6 R 6715 0,3 MuoilaRCOONa:0,3mol R:CH(b) R:H(a) R:H(a) R:CH(b)hoacR:CH(b)hoac R:CH(c)R:CH(b) 2 3322 R:H(a) RCHCHCH(d) SoñongphancuaXla6: (b) (a) (b) (c) (a) (a) 2 2 CHOOC CHOOC CHOOC (b) (b) (c) (a) (a) (d)
COBaCOBa(HCO)
242 2
242 2 353 nn2n 0,52(0,760,5)1,02 CHC(CH)COOH:xmol (CH)(COOH):xmol CHCOOH:xmol X(CH)(COOH):amol146a92b26,72a0,12 CH(OH):bmol
242 2
gom
estecuaankin(ymol)
(b) (c) (a) (b) (d) (a) Câu 21:
DẠYKÈMQUYNHƠN OFFICIAL 17
2
n n n 1
o 2
2 O,t 2
23
22 (CO,HO) 25 25E m
E:CHCOOCH;m0,12.10212,24gam12gam Câu 22: 2 2 2 2 2 2 785 Z O HO CO O/Z 172 0,65 4x 7x CHO O/ZOHOCO 785 ? 0,654x 7x NaOH CHO 2 M72 m32n18n44nx0,1;n0,5 n:n:n7:8:5 n2nn2n CTPTcuaZlaCHO(M172) n0,22 n0,1 XlaR'(OH) 2chöceste Zco
2 2 36 M72 2
XlaR'(OH)R'42(CH)
Zco3ñongphanla:
2 3 222 2 3 HCHOHCH HOOCCCCOOCHCHCHOH HOOCCCCOOCH(CHOH)CH Câu 23: 2 2 2 2 2 2 2 2 2 n2n2 m2m22 (X,Y)O CO HO CO O/(XY) 0,6432 ? 0,52 14,4 hchcYCOHO O/(X,Y)O COHO X 0,64 ?0,52 ? X:CHO(k1);Y:CHO(k2) mm44n18nn0,58;n0,4 (k1)nnnn0,06 n2n2nn n(0,40,06.2)/20,14 3 35 35 3 3 XlaHCOOCH;BlaCHCOOH n2 BTC:0,14n0,06m0,58 YlaCHCOOCH;AlaHCOOH m5 ZlaCHOH + Vậy có 3 kết luận đúng là : (1), (5), (6). + (2) sai vì nhóm -CHO chỉ làm mất màu dung dịch Br2 trong nước. (3) sai vì Y có thể có các công thức cấu tạo khác nhau :
m2m1
2 m2m1 m2m1 n2n1 m2m n2n1 m2m1 m2m1 n2n1 m2m1 2 KOH m2m1 CHOHHOH CHOH CHOH 25 1,12 CHCOOCH CHCOOCH CHOH E:CHCOOCH HO:20,16gam1,12mol;Xgom n0,14 CHOH:5,52gam n n2n1,24n 0,12;M 46(CHOH)
m2m1
CHOH
n2n1
n 0,12 CO:0,12(n1)0,07 KOH:0,02 2n1 Ygom HO:(0,01.0,12) CHCOOK:0,12 2 KCO:0,07
(0,12n0,05)44(0,12n0,07)1818,34n2
motchöcOH
R'25(loai) YlaR(COOH) 1chöceste
Zco1chöcaxit R24(CC)YlaR(COOH)vamotchöcOH
HOOCCCCOOC
cấu tạo ta thấy độ bất bão hòa của (X, Y), Z, T lần lượt là 1; 0; 4. Sử dụng mối liên hệ giữa độ bất bão hòa với số mol CO2, H2O và số mol của hợp chất hữu cơ; mối liên hệ giữa độ bất bão hòa với số mol Br2 phản ứng và số mol của hợp chất hữu cơ; bảo toàn nguyên tố O trong phản ứng đốt cháy, ta có :
DẠYKÈMQUYNHƠN OFFICIAL 18 2 3 3
2 2 3
3
o 2 2 2 3 2 2 3 2 2 O,t 2bìnhñöngCa(OH)dö 3 COCaCO 2 170gam HO bìnhCa(OH)giamCaCO CO HO ? ? 66,4gam 170 O/X CO X CaCO nn1,7 HO n1,6 m m44n18n 36,41,7.121,6.2 n
16 BTO: o RCOOR' R''COOR'''0,3 t 0,4mol muoi x0,1 n0,1;n 2x6x0,8 RCOOR':0,1mol RCOONa:0,1molR'OH:0,1molNaOH R''COOR''':0,3mol R''COONa:0,3molR'''OH:0,3mol m0,1(R67)0,3(R''67)34 BTKL ancol 2 253 25 R3R''72 :m0,1(R'17)0,3(R''17)14,4R'3R'''116 R27;R''15XgomCHCHCOOCH;CHCOOCH R''R'''29 EO CO HO CO HOCO 2 2 2 2 2 2 O HO E O/(X,Y,Z,T) 2 2 m32n44n18n
nn
Từ
(X,Y)ZTCOHO (X,Y) CO 22 2 E (X,Y)TBr Z E 2 T 362 (X,Y)ZT nn3nnn0,05n0,02 n C 3,6 n2nn0,04 n0,1 n n0,01ZlaCH(OH) 2n2n4n0,28 Trong phản ứng của X, Y, Z, T với KOH, ta có : HO(X,Y) 2 ancolZ muoi KOH(X,Y)T (X,Y,Z)KOHmuoiancolHO 2 0,04?0,017611,160,176 0,0218 nn0,02 nn0,01 m4,68gam nn2n0,04 m mmmm Câu 26:
CHC(CH)COOCH
CHCHCHCOOCH
3CHCHCHCOOCH
(4) sai vì CH3OH là ancol có 1 nguyên tử C nên khi tách nước ở 140 hay 170oC cũng chỉ tạo ra ete. Câu 24: Xgom:RCOOR'xmol;R''COOR''':3xmol
Câu 25:
0,8
n0,47
n0,59;n0,52;m11,16n 0,28Zlaancolno
đặc điểm
DẠYKÈMQUYNHƠN OFFICIAL 19 2 2 2 m 2 YH Y 3 YH Y XY
3 X
3 HHO
COC
2m1 3 2
esteno 35
0,06C0,243C 6 2C3 1m4 m3(doaxitcoñongphanhìnhhoc) 100.0,02%CHCOOCH 10034, 5,88 01% Câu 27: o 33 2 2 AgNO/NH,t n2n1 m2m n2n1 TCOHO T XTAg X XYT X:HCOOH(k1) E AgEgomY:CHCOOH(k1) T:HCOOCHOOCCH(k2,n2) nnn0,320,290,03 n0,03 BTE:2n2nn0,16 n0 8,580,32120,292BTO:2n2n4n 16 Y ,05 n0,02 2 362 XYTNaOH ENaOHchatranHOCH(OH)
0,0376
mmmmm Câu 28: 2 2 CO HO O/X,Y,Z COO NaOH (C,H) ddgiam XYZCOONaOH 3 (X,Y,Z) nx;ny n2n2n20,30,6 m12x2y21,620,3.2.1612,02x0,87 m100x(44x18y)34,5 y0,79 nnnnn0,3XlaHCOOCH 0,87 k C 2,9 0,3 X1 35 XYZ X (Y,X) YZ YZ 3 3 CHCOONa 3 25 nnn0,3n0,22C0,870,2225,375 0,08 nn0,08nn0,08 YlaCHCHCHCOOCH m 0,08.1088,64gam ZlaCHCHCHCOOCH Câu 29:
33
m2m1
O C
n2n0,08m2,56 YlaCHOH mm2,48M32 nn0,08 HCOOCH;CHCOOCH Xgom 5,88 CHCOOCH M 73,5 0,08 n2n0,44;n0,0820,16n 5,880,16.160,44 nn 0,24 12
2 33 3 HCOOCHCOHO (HCOOCH;CHCOOCH) estekhongno esteno estekhongno
3 nn0,02 n 0,06 0,02C
8,580,1540 0,0718?11,04
BTC:0,05(n1)0,02(2mn)0,030,32n2,m3 nn2nnNaOHdö
DẠYKÈMQUYNHƠN OFFICIAL 20 o 2 2
2
36,46gam EXlaR'COOH:xmol;YlaR''COOH:ymol
R'COONa
HonhôpE R(OH) 2 2 2 2 2 2 2 23 Na 2 2 bìnhNatang
R(OH)H R(OH) R(OH) bìnhtangR(OH)H R(OH) 36 2 0,262 1924 ? NaCO NaOH H;m
nn0,26n0,26;m19,76 mmmM19,7676:CH(OH) 0,26 n0,5n 2 2 23 2 2 muoi CO O/muoiO NaCO COHO 0,42 0,7 ?0,4 02 R'COONaR''COONa
nn0,2
2 2 2 2 3 R'COONaR''COONa COONaOH R(OH)H E T(HCOOCH nn xtyt0,2 nn xy2t0,4 nn
6 3 OOCCH)0,125.15850,82% 38,86 Câu 30: NaOH 0,4mol
(xt)mol O,t
232 05mol 0,4mol02mol (yt)mol
gomZlaR(OH):zmol;TlaR'COOROOCR'':tmol
CONaCOHO R''COONa
(zt)026 (zt)mol
19,24gam
2a 0,2 0,60,2n0,6C 2 n2n3n2nn 0,4
HCOONa0,4.20,2Haimuoila ;a 3 13 CHCOONa0,2
zt0,26 46x72y76z158t38,86 m36,46 xy xy0,075;z0,135;t0,125 2x2t0,4 %m zt0,26 118x76z158t38,86
DẠYKÈMQUYNHƠN OFFICIAL 21 o 2 23 2 23 2 2 2 ? 4,84gam O,t 23 22 (2) 0,24mol1,8gam ?gam 004mol NaOHNaCO 2muoiCONaCOHO(2)O ANa Sôñophanöng: HO EsteANaOH 2muoiZNaCOCOHO Alaestecuaphenol. n2n0,08 mmmmm7,32 mm 2 2 2 2 23 2 2 OHmuoi HO(1) HO(1) H/ANaOHHO(1)HO(2) H/A C/ANaCOCO CHO ACH 752n O/A NaOHHO(1) 752n m18n n0,04 nn2n2n n0,2 nnn0,28n:n:n7:5:2 mmm Ala(CHO) n 0,08 16 n2;Aln:n2 Ala(CHO) 65 65 65 aCHOOCCOOCH 0,04116%CHONa 63,39% 7,32 Câu 31: 2 2 2 2 2 2 2 2 ZO COHO 2,76 CO 0,1053211x6x OtrongZO COHO HO OtrongZ 0,10511x/446x/18 ? CHO 353 mmmm x0,36;n0,09 n2n2nnn0,12;n0,09 n:n:n0,09:0,24:0,093:8:3ZlaCH(OH) 23 2 xy COO NaCOCORCOONa CH 4 K xy24 xy 3 235 2 COO A A nnnn0,36M20.0,360,24.1628 0,12 CH:0,24mol M20Kgom CHlaCHCH:0,12mol Ala(CHCOO)CHOOCCHCH n n30,12;m2300,1227,6gam28gam Câu 32: 2 2 2 2 2 2 n2n1 n2 2n XHOCO x?0,14 HO OtrongPO COHO 0,180,14? x2y RCOONaNaOH:0,05mol NaOHdö XlaCHOH(k0;xmol);Y,ZlaCHO(k1;ymol) nnn n0,14x n2n2nny0,03 3,68n0,03R X,Y,Z n0,02 o 26 25 26t,CaO 25 CH 0,02.400,03.6729 0,03 RlaCH CH:0,03mol CHCOONa:0,03 m0,9gamgannhatvôigiatrò0,85 NaOH:0,020,012 Câu 33: (1)
DẠYKÈMQUYNHƠN OFFICIAL 22 2 3 CtrongTCO
COOHKHCO XYZ xm
X,Y,ZkhongcoCôgochiñrocacbon
ymol zmol ol C CHO OHCCOOH,HOOCCOOH
Câu 34: o 33 2 2 AgNO/NH,t n2n1 m2m1 n2n1 m2m1 a2a1 COHO Ag
O/M 2
z0,05
x0,05
chatran
... ● Ở bài này, nếu đi theo hướng tìm cụ thể từng chất thì mất
Xét phản ứng tạo ra este X (R, R' là các gốc no) :
CtrongTCOOHCHO 0,26 0,04 CHOAg
nn0,3nnn0,3 2nn0,52
nn0,04 50MMMX,Y,ZkhongthelaHCHO,HCOOH X,Y,ZlanlöôtlaOHCCHO,
x4(yz) x0,12 0,02.74n2x2y2z0,3y0,02%Y 15,85% 0,26290,0445 z0,01n2xy0,26
M AgX:HCOOH X:HCOOH(k1,xmol) Y:CHCOOH(k1,ymol) Z:CHCOOH(k1,ymol) T:(HCOO)(CHCOO)(CHCOO)CH(k3,zmol) 2znn10,90,1 Trong26,6gamMco:n2x2z
a2a13 0,4mol 0,125mol0,025mol,a3 13,3gam
0,2
y0,1n2x2y2y6z0,8 X:0,025mol Y:0,05mol) muoi NaOHchatran HOCH(OH) Z:0,05mol) NaOHdö T:0,025mol)
m13,30,4400,12518(14a50)0,025 a3m24,75 a4m24,4m24,74gama5m24,04
thêm khá nhiều thời gian. Câu 35:
DẠYKÈMQUYNHƠN OFFICIAL 23 R COOH COOH R
R
+ R'
R'
R R
R'
2 2 2 3 2 2 3 2 2 XCOOvong CO
X COCaCO X X XCOHO X CaCO CO HO
Câu 36: 2 2 242 2 24 24 24 482
n2n24 anñehitfomicCHO CHO
2 2 2 2 2 2 2 XO CO HO 29 HO CO 0,97532 1 ? hchc COHO CH O/X mm44n18n
0,10,55
COOH COOH
COOH COOH
HO HO HO
HO HO HO
COO COO R COO
COO CR' OO COO
HO
kkk8 n0,6;n0,25;n0,05 nn0,6 0,6 0,252 C 12;H 10 (81)nnn 0,05 0,05 M12.121012.16346gam/molm44n18n29,1
n2n24
metylfomatCHO CHO:xmol(k1) anñehitaxeticCHO Xgom CX:CHO:ymol(k1) HO etylaxetatCHO CHO:zmol(k2) axitno,2chöcmachhô Y:CHO(n2)
n0,9,n1 z0,1 (k1)nznn z0,1 xy0,55xy4z0,9529mm nxy4z16
2 2 2 24 2 3 2 BTC:x2yzn1n4,5 n2 n3 n4 hoac hoac Yla(COOH)YlaCH(COOH)YlaCH(COOH) Trong29gamXco0,1molYTrong43,5gamXco0,15mol TrongphanöngcuaXvôiNaHCO NeuYla(COOH)t
2 3 muoi 2 2 2 2 3 muoi 24 2 2 2 3 (COONa):0,15mol hìmuoilaNaHCO:0,1mol m28,5gam CH(COONa):0,15mol NeuYlaCH(COOH)thìmuoilaNaHCO:0,1mol m30,6gam CH(COONa):0,15mol NeuYlaCH(COOH)thìmuoilaNaHCO:0,1m muoi ol m32,7gam Câu 37:
DẠYKÈMQUYNHƠN OFFICIAL 24 o 2 2 2 2 2 2 2 2 2 CO HOEO t 2 22 172815,36 048mol COHO COO O 0,3 0,48 COO E CO 2 CO HO E E 44n18nmm32,64 EOCOHO 2nn2n2n1,56E0,3molNaOH(vöañu) n n 0,15 n0,57 XlaCH 2 ; nn0,42C 3,8 n 2 26 2 24 2 38 2 (COOH);ZlaCH(COO) YlaCH(COOH);TlaCH(COO) 2 26 2 2 2 NaOH 3 25 38 2 Z T (X,Y)EZT X C/(X,Y) CO Y ZlaCH(COO) ZlaHCOOCHCHOOCH 3ancol TlaCHOOCCOOCH TlaCH(COO) cungsomol na;na a0,03 62a32a46a4,2 nnnnxy0,09nx n3x4ynny C/(Z,T) x0,06
Câu 38: 3 o 2 n2n1 n12n12 m2m1 NaHCO n2n1
ancolC O,t 2
AlaCHCOOH
TN1:mgamX
TN2:agamX CHCOONaCO o 2 2 O,t 2 2 23 n2n1 muoi 3 25 CO 2CHCOONa(2n1)CO(2n1)HONaCO nx0,07m(14n68)x4,38 CHCOONa:0,03mol x0,05;Dgom (*) CHCOONa:0,02mol n(n0,5)x0,095 n1,4 C C C 25 n0,03 n0,03;M50 (**) ClaCHOHC:khongñöôcñieuchetröctieptöchatvocô 25 25 3 25 3 NaOH 25 3 a412gam CHCOONaôTN1 CHCOONaôTN2 XlaCHCOOCH:0,03mol CHCOONa:2,46gam (*) (**)YlaCHCOOH:0,02mol CHCOONa:1,92gam mm 1m4,12gam am Câu 39: o NaOH t
n0,3y0,03
m2m1
n2n1 0,095mol muoiD,4,38gam,xmol
XgomElaCHCOOCH
1,92gamCHCOONa CHOH(0,03mol;M50)