SOLO FELINA
RESPIRATORIO - Apunte práctico
¿Cómo trato el asma felino?
Susana Gª Pérez de Ayala
GI, HEPÁTICO Y PÁNCREAS - Caso clínico
Mimetización de una obstrucción intestinal por cuerpo lineal en un gato con linfoma
Elisa López; Anna Rueda; Anna Calvet; Salva Cervantes
GI, HEPÁTICO Y PÁNCREAS - Caso clínico
Gingivitis crónica felina refractaria. Manejo actual
Juanjo Vega
GI, HEPÁTICO Y PÁNCREAS - Algoritmo
Diarreas agudas en gatitos y gatos jóvenes
Alba Peruga
GI, HEPÁTICO Y PÁNCREAS - Apunte práctico
Cómo realizar una colecistocentesis y qué hacer con la muestra de bilis en gatos
Jorge Castro
ENDOCRINOLOGÍA - Caso clínico
Hipotiroidismo congénito en un gato de 3 meses
Mª Victoria Reyero; Yolanda Herrera
INFECCIOSAS - Revisión clínica
Actualización en el tratamiento de la peritonitis infecciosa felina, a propósito de un caso clínico
Tania Velasco
DERMATOLOGÍA - Atlas
15 casos breves
Massimo Becatti
Journal of Feline Medicine and Surgery en español – ISFM Consensus Guidelines
Directrices del consenso ISFM acerca del diagnóstico y control de la hipertensión en gatos
Samantha S Taylor; Andrew H Sparkes; Katherine Briscoe; Jenny Carter; Salva Cervantes; Rosanne E Jepson; Brice S Reynolds; Brian A Scansen. Revisión científica de la versión española: Salva Cervantes; Ana Sáez
Journal of Feline Medicine and Surgery en españolClinical Review

Compensando el hipertiroidismo concurrente con enfermedad renal crónica
Rebecca Geddes; Joana Aguiar. Revisión científica de la versión española: Salva Cervantes; Ana Sáez
PREGUNTAS DE AUTOEVALUACIÓN
Journal of Feline Medicine and Surgery en español – ISFM Consensus Guidelines
Directrices del consenso ISFM acerca del diagnóstico y control de la hipertensión en gatos. Samantha S Taylor; Andrew H Sparkes; Katherine Briscoe; Jenny Carter; Salva Cervantes; Rosanne E Jepson; Brice S Reynolds; Brian A Scansen. Revisión científica de la versión española: Salva Cervantes; Ana Sáez 34
Journal of Feline Medicine and Surgery en español - Clinical Review Compensando el hipertiroidismo concurrente con enfermedad renal crónica. Rebecca Geddes; Joana Aguiar. Revisión científica de la versión española: Salva Cervantes; Ana Sáez
INFECCIOSAS
REVISIÓN CLÍNICA
Actualización en el tratamiento de la peritonitis infecciosa felina, a propósito de un caso clínico
Tania Velasco, LV, GPcert Med Fel, Acred AVEPA Med Fel, NEKO Clínica Felina. Correo: cvnekos@gmail.comLa peritonitis infecciosa felina es una enfermedad producida por el coronavirus entérico felino (FCov). Hasta ahora, su desenlace era fatal, no existiendo tratamientos con eficacia real a largo plazo. En este artículo se presentan las novedades actuales respecto a su terapéutica a raíz de un caso clínico real.
Caso clínico
Acude a consulta por decaimiento y distensión abdominal un gato de raza Común Europeo, de 5 meses, recientemente adoptado de una protectora. Está correctamente desparasitado y es negativo a retrovirus felinos. Se ha comenzado el protocolo de primovacunación habitual, habiendo recibido ya la primera dosis de vacunacion trivalente (calicivirus, herpesvirus felino y panleucopenia) así como la primera dosis frente al virus de la leucemia felina (FELV).


Poco tiempo después de recibir esta última vacunación, aparecen episodios febriles, hiporexia, apatía y su pelaje es mate. Aprecian distensión abdominal y acuden a consulta para una valoración y pruebas diagnósticas.
En la exploración se aprecia expresión facial anormal, de malestar, con los ojos entrecerrados y orejas caídas, ligera ictericia, leve taquipnea, el abdomen presenta un grado importante de distensión, fluctuante, con una circunferencia de 43 cm, la temperatura es de 39,6 ºC. El desarrollo es algo inferior a lo que debería para su edad. La auscultación cardiaca es normal.
Se realizan analíticas sanguíneas que muestran anemia leve no regenerativa (hematocrito en 24%), leve monocitosis, leve hiperbilirrubinemia y aumento de proteínas totales con hiperglobulinemia moderada, la albúmina está en el límite bajo de la normalidad, y la relación entre ambas da un cociente albúmina/globulina (A/G) de 0,3.
Su radiografía muestra una cavidad abdominal distendida y excesivamente radiolúcida con pérdida de definición de límites viscerales y acúmulo ligero de gases en asas intestinales, sin indicios de efusión pleural (Figura 1 (A-B)). En la ecografia se aprecia una ascitis importante con engrosamiento difuso del peritoneo y adenopatías mesentéricas, resultando el resto del examen normal.
Se realiza una punción ecoguiada, con aguja fina, para toma de muestra del líquido ascítico con fines diagnósticos. El líquido es de colo-
ración amarillenta, viscoso; el test de Rivalta arroja un resultado positivo (compatible con trasudado modificado/exudado), su análisis muestra proteínas totales de 50 g/l y un recuento celular menor a 5 x 109 céls/l apreciándose en la citología principalmente macrófagos, neutrófilos no degenerados y algunos linfocitos. Se envía muestra de dicho líquido ascítico a laboratorio externo para la realización de RT-PCR de FCoV.
El PCR arroja un resultado positivo con mutación S1060A (mutación en el gen S en el nucleótido 23537).
Con todos los datos clínicos, analíticos y de biología molecular se establece un diagnóstico presuntivo de peritonitis infecciosa felina.
Se instaura tratamiento antiviral con un análogo de nucleósido, el GS-441524, durante 84 días, a dosis de 6 mg por kilo por vía subcutánea cada 24 horas. Desde la clínica se habla con los cuidadores, explicándoles los estudios científicos existentes sobre este fármaco así como su falta de registro y problemática legal actual. El tratamiento es aplicado en el domicilio del cuidador para evitar el estrés del desplazamiento diario al centro. Se rasura el área cervicotorácica para facilitar visualización y control del punto de inyección y posterior aplicación de espray de ácido hipocloroso. Se establecen visitas periódicas para la correcta monitorización de la enfermedad y valoración de pruebas analíticas necesarias.
A la semana de comenzar el tratamiento, en la primera visita de control se observa un aumento de la actividad en casa y del apetito, con una progresiva disminución de la circunferencia abdominal (de 43 a 34 cm) observándose en ecografía abdominal la práctica reabsorción de la efusión abdominal.
En las sucesivas visitas de control (cada 2 semanas) se observa aumento de peso, correcto desarrollo, buen pelaje y actividad normal. No vuelven a aparecer signos febriles. En las analíticas se va observando una normalización de la serie roja, desapareciendo la anemia, normalizándose la serie blanca y una paulatina disminución de las globulinas unida a un aumento de la albúmina, dando como resultado un progresivo aumento en el índice a/g, llegando hasta 0,6 en la octava semana del tratamiento antiviral.
Durante el tratamiento (octava semana) y una vez estabilizado el cuadro, se realiza orquiectomía según los protocolos anestésicos y qui-
rúrgicos habituales en el centro, transcurriendo todo con normalidad.
Se realiza una revisión completa en la semana 12 de tratamiento, observándose un hemograma con valores dentro de la normalidad, salvo leve agregación plaquetaria, y unos parámetros bioquímicos normales, con un índice albúmina/globulina ya de 0,7. Su ecografía abdominal es compatible con la normalidad. Se finaliza el tratamiento con GS, recomendándose un periodo de observación hasta considerar una posible curación del proceso de peritonitis infecciosa felina de unas 12 semanas.
Apenas 48 h tras suspender la administración del GS-441524, los cuidadores observan un cambio en su comportamiento habitual, estando más escondido, con hiporexia leve y temperaturas que oscilan en torno a los 39ºC. Se administra meloxicam, pero en otras 24 h la sintomatología progresa a tetraparesia. El examen neurológico muestra sensibilidad mantenida en las cuatro extremidades, pero perdida de propiocepción y fuerza/coordinación, los reflejos posturales están abolidos o disminuidos, los pares craneales son normales. No hay antecedentes de traumatismo, y las radiografías no muestran alteraciones que justifiquen el cuadro neurológico (Vídeo 1).
Ante dichos hallazgos se diagnostica una posible recaída en forma neurológica de su cuadro de peritonitis infecciosa, y se retoma el tratamiento con GS-441524 a dosis de 10 mg por kilo cada 24 h, vía subcutánea. Los cuidadores administran en casa nutrición forzada con jeringa, aceptándola sin complicaciones.



Durante la siguiente semana se monitoriza diariamente al paciente, observando un paulatino aumento en la capacidad motora, fuerza y coordinación de las 4 extremidades, volviendo a la normalidad en el día 7 del tratamiento (Vídeo 2).
Se mantiene la monitorización estrecha durante el resto de los 84 días de la segunda tanda de tratamiento antiviral, no presentando más complicaciones salvo irritación en los puntos de inyección y un absceso
en uno de ellos que se resuelve satisfactoriamente con la administración oral de amoxicilina a 12,5 mg por kilo cada 12 h durante 5 días.
Analíticamente el paciente presenta datos normales, observándose durante esta segunda tanda de antiviral una subida del coeficiente albumina globulina hasta llegar a 0,94 (Gráfico 1).

La ecografía abdominal no muestra hallazgos significativos.
Tras finalizar los 84 días, y tras más de un año de observación, el gato no ha vuelto a presentar alteraciones en la marcha, apetito o comportamiento, siendo su exploración física completamente normal y sus datos analíticos normales. Ha completado su desarrollo físico y lleva una vida activa (Figura 2, Vídeo 3).
Discusión
La peritonitis infecciosa felina (PIF) es una enfermedad letal producida por un coronavirus felino que, si bien puede afectar a gatos de cualquier edad, se presenta de manera más frecuente en animales de menos de 2 años, especialmente aquellos entre los 4 y 16 meses.1

Los coronavirus felinos entéricos de baja virulencia (FCoV) causan infección inaparente o enteritis leve con mucha frecuencia. Estos dos virus (FCov y FIPV) están genéticamente estrechamente relacionados y la variante virulenta (FIPV) es el resultado de una mutación in vivo en gatos individuales infectados con FCoV. El virus mutante FIPV adquiere un cambio de tropismo celular de enterocitos a macrófagos y la migración de éstos a diferentes localizaciones causando enfermedad.2,3 Los coronavirus felinos exhiben una amplia heterogeneidad genómica y probablemente no hay dos casos de PIF que sean causados por virus idénticos. Esta necesidad de mutación de FIPV desde FCoV dentro del organismo, minimiza el papel de la transmisión horizontal del virus FIPV.
Su patogenia es compleja, siendo actualmente aceptada la hipótesis de que es necesaria una combinación de factores como la susceptibilidad genética,4-6 la edad en el momento de exposición y de factores estresantes relacionados con el ambiente del gato en el momento de la infección, unidos a errores en el proceso de replicación en intestino (mutaciones).7,8
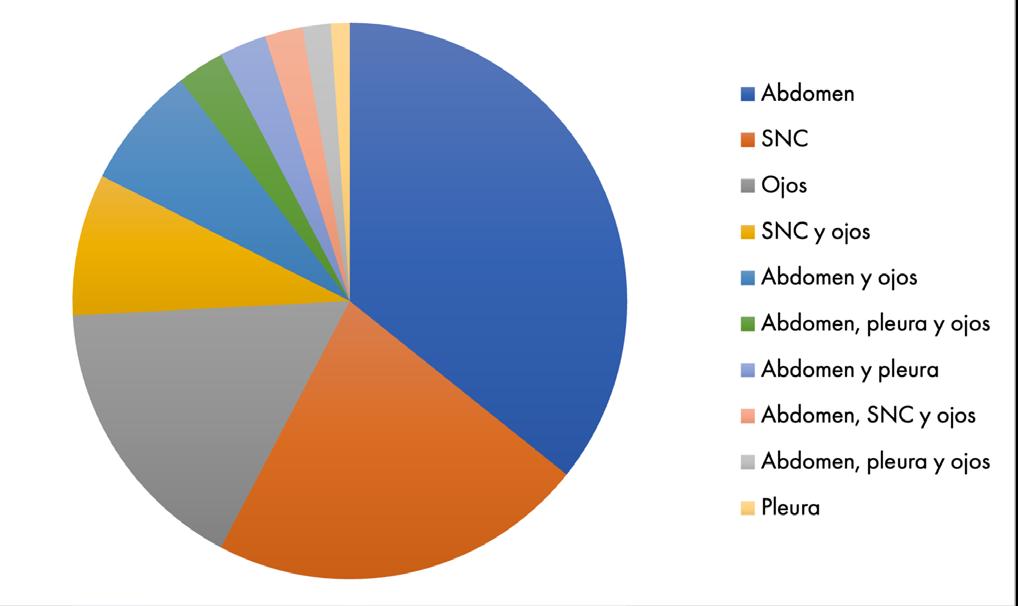
La peritonitis infecciosa felina produce numerosos síntomas, de frecuencia y significación diagnóstica variable. Es una enfermedad eminentemente inflamatoria, y aunque popularmente se habla siempre de PIF húmedo y PIF seco, realmente es un espectro de continuidad que puede evolucionar de un lado a otro, con síntomas que se superponen y cambian, no son dos enfermedades distintas. La forma efusiva se debe a una vasculitis y a una poliserositis que originan derrames pleurales9 y ascitis, mientras que la forma no efusiva o seca se caracteriza por lesiones granulomatosas en diferentes órganos. Los síntomas están asociados a la localización y extensión de las lesiones (Gráficos 2 y 3).
La forma seca10 tiene una presentación clinica más crónica, progresiva a lo largo de semanas o meses:
• Ganglios linfáticos mesentéricos inflamados que pueden ir asociados o no a lesiones solitarias en pared intestinal de colon o unión cecocólica y que ocasionan vómitos y/o diarreas.11
• Signos intraoculares: uveítis anterior, turbidez en humor acuoso, infil-
trado perivascular retiniano, precipitados queráticos corneales, coriorretinitis, desprendimiento de retina, etc.12
• Signos neurológicos: convulsiones, ataxia, síndrome vestibular, paresia/parálisis, somnolencia. Según la localización neurológica se suelen agrupar en mielopatía en T3 - L3, enfermedad vestibular central y enfermedad difusa multifocal del SNC.13
• En algunos casos se han descrito pápulas o nódulos no pruríticos en piel (dermatitis nodular piogranulomatosa).14
• Se pueden producir piogranulomas en otros órganos pudiendo ocasionar cuadros más atípicos como pneumonía piogranulomatosa, esplenitis, orquitis, renomegalia, hepatomegalia, etc (Gráfico 4).


El diagnóstico de la peritonitis infecciosa felina es complejo, siendo recomendable basarlo más en un conjunto de factores que en una única prueba (Tabla 1).
Hasta la fecha se la había considerado una enfermedad con elevada mortalidad, no existiendo (más allá de reportes aislados), tratamiento realmente eficaz a largo plazo para estos pacientes. Los primeros éxitos en el uso de fármacos antivirales anti-FCoV fueron reportados por Pedersen, realizándose entre el 2018 y 2019 varios estudios tanto in vitro30 como con pacientes con infección natural.31 Éste último estudio clínico sobre el uso del GS-441524, arrojó datos sumamente esperanzadores con resultados aproximados de un 70% de eficacia. Sin embargo, a causa de un conflicto de intereses comerciales, no se ha logrado un adecuado desarrollo de dicho fármaco (GS-441524) a nivel del mercado nacional veterinario.
Los cuidadores de gatos han podido obtener varios medicamentos anti-FCoV, fabricados por diversas empresas mimetizando el fármaco del estudio original, un análogo de nucleósido de adenosina (GS441524), a través de estudios de campo en grupos organizados en redes sociales.32 Sin embargo, estos medicamentos no tienen aún licencia en nuestro país para uso veterinario, aunque su precursor, el remdesivir (el GS-441524 es el metabolito activo del remdesivir), está comenzando a estar disponible para veterinaria en Australia y UK; estos países también disponen del GS-441524 en formato oral.
Los consensos actuales en España de tratamiento con GS-441524 en base a los “estudios de campo” y datos recabados de miles de gatos ya tratados en la comunidad internacional32 (más de 500 ya en España, Tania Velasco, datos aun no publicados), han permitido generar estas recomendaciones en las dosis (Tabla 2).
Los fracasos del tratamiento pueden deberse a un diagnóstico erróneo de PIF, dosis inadecuadas, complicaciones de la enfermedad y resistencia viral a los fármacos. Los gatos jóvenes son más fáciles de tratar y tienen una tasa de curación más alta que los gatos mayores de 7 años; los gatos con PIF húmedo o seco que no se complica con una enfermedad neurológica u ocular son más fáciles de curar que los gatos con PIF neurológico.34
Se han observado pocos efectos secundarios, siendo los más habituales, dolor en el punto de inyección y heridas (se recomienda el uso diario de ácido hipocloroso tópico) por inyecciones repetidas y acidez del fármaco, daño renal menor no progresivo (reversible, poco frecuente), vasculitis y reacciones vagales post-inyección.
El período de tratamiento de 12 semanas se basa en ensayos de campo con GC37635 y GS-44142431 (basándose en los largos tiempos de supervivencia de los macrófagos tisulares en gatos) y es el tiempo que ha proporcionado el mayor porcentaje de curaciones. No hay duda de que algunos gatos no se curan incluso después de 12 semanas y hay alguna evidencia de que algunos pueden curarse antes (es decir, de 8 a 10 semanas). Sin embargo, la interrupción temprana del tratamiento siempre conducirá a una disminución en la proporción de gatos que se curan, y cuanto antes detenga un tratamiento, mayor será la tasa de recaída.36
Muestra Procedimiento Resultados compatibles
Sangre Hemograma Anemia leve a moderada.
Anemia hemolítica severa <4,3%.
Microcitosis (con o sin anemia) 35%.
Neutrofilia 39 - 57 %.
Linfopenia 49,5% (menor frecuencia en forma seca).
Bioquímica Hiperglobulinemia 89%.
Ratio A/G decr (~ 85% será <0,8, ~ 68% será <0,6).
Hiperbilirrubinemia 21 - 63 % (menos frecuente en forma seca), no asociada a elevación de transaminasas.
AGP >1,5 g/l.
Proteinograma Hiperproteinemia y aumento de alfa2 y gammaglobulinas (menos frecuente en detecciones tempranas).
Serología FCOV
Sólo indica contacto con FCoV; muchos gatos clínicamente sanos tienen titulaciones positivas a menudo altas especialmente aquellos de ambiente multigatos y aproximadamente el 10% de los gatos con PIF son seronegativos o con titulaciones bajas (formación de complejos antígeno-anticuerpo, fases finales o extravasación a derrames), por lo que la serología no puede ser utilizada para distinguir un gato con PIF de uno sin él.
Datos publicados
Radiografía
hepatomegalia, ascitis, derrame pleural…. poco específica.
Ecografía Renomegalia, irregularidades en contorno renal y hipoecogenicidad subcapsular, signo de anillo medular, también presente en gatos sanos, linfadenopatÍas, efusiones peritoneales o retroperitoneales, cambios difusos en intestino, pueden elevar la sospecha de PIF.
Resonancia magnética Hidrocefalia obstructiva, siringomielia, herniación en foramen magno y aumento marcado de la captación del contraste en las meninges, tercer ventrículo, acueducto mesencefálico y encéfalo.
Efusiones Análisis bioquímico
Proteínas totales usualmente >35 g/l, baja ratio A/G AGP >1,55 mg/ml.
Citología Celularidad baja (<5 x 109 cels/L), macrófagos, neutrófilos no degenerados y algunos linfocitos, (en fases más crónicas puede observarse aumento de linfoplasmocitarias).
LCR Pleocitosis marcada (>100 céls/µl, en su mayoría neutrófilos); un alto nivel proteico (>200 mg/dl).
Prueba de Rivalta Valor predictivo positivo de PIF 58,4%. Valor predictivo negativo de PIF 93,4%.
RT-PCR Los gatos con PIF exhiben cargas virales mucho más altas (media 8,3 x 103 vs 25) que los gatos sanos infectados con FECV.
Especificidad ~100% (gatos con síntomas)
Sensibilidad:
• Efusión 89%.
• LCR 86%.
• Humor acuoso ~35,5%. No se recomienda su realización en sangre.
Inmunohistoquímica El gold standard hasta ahora, aunque está siendo desplazada por la mejora en las técnicas PCR. Resultados variables según tejidos. Posibles falso por escaso número de macrófagos en las muestras o unión competitiva del antígeno FCoV por anticuerpos circulantes en la efusión.
Tejidos Biopsia Inflamación granulomatosa. Perivasculitis.
RT-PCR Variable según tejidos, preferible aspirados de linfonódulos afectados.
Especificidad 90 - 96%.
Sensibilidad 89,8%.
Presentación Dosis GS-441524 * Dosis GS-441524 en recaídas Duración
Húmeda. 6 - 8 mg/kg SID. Aumentar dosis inicial en 4 - 5 mg/kg. 84 días mínimo.
Seca. 6 mg/kg SID.**
Ocular. 8 mg/kg SID.
Neurológica.33 10 mg/kg SID.*
*puede ser necesario aumentarla durante el tratamiento si la respuesta no es la adecuada; ** asegurarse de que no hay afectación neurológica u ocular.
(24)
(25–27)
(28)
Por lo general, las recaídas se producen debido a infecciones virales “escondidas” en el sistema nervioso central durante el tratamiento para PIF húmedo o seco no acompañado de signos neurológicos u oculares. La dosis de GS-441524 utilizada para tratar estas formas de PIF a menudo es insuficiente para superar de manera eficaz las barreras hematoencefálica y hemato-ocular. Este tipo de recaídas generalmente se vuelven a tratar durante al menos 8 semanas con una dosis diaria inicial de al menos 5 mg/kg más alta que la dosis utilizada durante el tratamiento primario (p. Ej., 10 , 12, 15 mg/kg al día).34 Las recidivas se observan generalmente antes de los 3 meses post tratamiento, durante los 84 días del periodo de observación. Según los datos recopilados a nivel internacional (gatos tratados en “estudios de campo”, monitorizados por veterinarios)34 el porcentaje de éxito en el tratamiento supera el 77%.
Bibliografía
1. Pedersen NC. An update on feline infectious peritonitis: diagnostics and therapeutics. Vet J Lond Engl 1997. agosto de 2014;201(2):133-41.
2. Chang HW, de Groot RJ, Egberink HF, Rottier PJM. Feline infectious peritonitis: insights into feline coronavirus pathobiogenesis and epidemiology based on genetic analysis of the viral 3c gene. J Gen Virol. febrero de 2010;91(Pt 2):415-20.
3. Pedersen NC. A review of feline infectious peritonitis virus infection: 19632008. J Feline Med Surg. abril de 2009;11(4):225-58.
4. Golovko L, Lyons LA, Liu H, Sørensen A, Wehnert S, Pedersen NC. Genetic susceptibility to feline infectious peritonitis in Birman cats. Virus Res. julio de 2013;175(1):58-63.
5. Foley JE, Pedersen NC. The inheritance of susceptibility to feline infectious peritonitis in purebred catteries. Feline Pract. enero de 1996;24(1):14-22.
6. Pedersen NC, Liu H, Durden M, Lyons LA. Natural resistance to experimental feline infectious peritonitis virus infection is decreased rather than increased by positive genetic selection. Vet Immunol Immunopathol. marzo de 2016;171:1720.
7. Emmler L, Felten S, Matiasek K, Balzer HJ, Pantchev N, Leutenegger C, et al. Feline coronavirus with and without spike gene mutations detected by real-time RT-PCRs in cats with feline infectious peritonitis. J Feline Med Surg. 15 de noviembre de 2019;1098612X19886671.
8. André NM, Cossic B, Davies E, Miller AD, Whittaker GR. Distinct mutation in the feline coronavirus spike protein cleavage activation site in a cat with feline infectious peritonitis-associated meningoencephalomyelitis. JFMS Open Rep. junio de 2019;5(1):2055116919856103.
9. Riemer F, Kuehner KA, Ritz S, Sauter-Louis C, Hartmann K. Clinical and laboratory features of cats with feline infectious peritonitis--a retrospective study of 231 confirmed cases (2000-2010). J Feline Med Surg. abril de 2016;18(4):348-56.
10. 2021-Dr. Pedersen New Year’s Update: Neurological Ocular FIP [Internet]. Sock it to fip. [citado 25 de febrero de 2021]. Disponible en: https://sockfip. org/2021-dr-pedersen-new-years-update-neurological-ocular-fip/
11. Harvey CJ, Lopez JW, Hendrick MJ. An uncommon intestinal manifestation of feline infectious peritonitis: 26 cases (1986-1993). J Am Vet Med Assoc. 15 de septiembre de 1996;209(6):1117-20.
12. Addie D, Belák S, Boucraut-Baralon C, Egberink H, Frymus T, Gruffydd-Jones T, et al. Feline infectious peritonitis. ABCD guidelines on prevention and management. J Feline Med Surg. julio de 2009;11(7):594-604.
13. Crawford AH, Stoll AL, Sanchez-Masian D, Shea A, Michaels J, Fraser AR, et al. Clinicopathologic Features and Magnetic Resonance Imaging Findings in 24 Cats With Histopathologically Confirmed Neurologic Feline Infectious Peritonitis. J Vet Intern Med. septiembre de 2017;31(5):1477-86.
14. Redford T, Al-Dissi AN. Feline infectious peritonitis in a cat presented because of papular skin lesions. Can Vet J Rev Veterinaire Can. 2019;60(2):183-5.
15. Norris JM, Bosward KL, White JD, Baral RM, Catt MJ, Malik R. Clinicopathological findings associated with feline infectious peritonitis in Sydney, Australia: 42 cases (1990-2002). Aust Vet J. noviembre de 2005;83(11):666-73.
16. Tasker S. Diagnosis of feline infectious peritonitis: Update on evidence supporting available tests. J Feline Med Surg. 2018;20(3):228-43.
17. Pedersen NC. An update on feline infectious peritonitis: diagnostics and therapeutics. Vet J Lond Engl 1997. agosto de 2014;201(2):133-41.
18. Stranieri A, Giordano A, Paltrinieri S, Giudice C, Cannito V, Lauzi S. Comparison of the performance of laboratory tests in the diagnosis of feline infectious peritonitis. J Vet Diagn Investig Off Publ Am Assoc Vet Lab Diagn Inc. mayo de 2018;30(3):459-63.
19. Stranieri A, Giordano A, Bo S, Braghiroli C, Paltrinieri S. Frequency of electrophoretic changes consistent with feline infectious peritonitis in two different time periods (2004-2009 vs 2013-2014). J Feline Med Surg. agosto de 2017;19(8):880-7.
20. Sparkes AH, Gruffydd-Jones TJ, Howard PE, Harbour DA. Coronavirus serology in healthy pedigree cats. Vet Rec. 11 de julio de 1992;131(2):35-6.
21. Tasker S. Diagnosis of feline infectious peritonitis: Update on evidence supporting available tests. J Feline Med Surg. 2018;20(3):228-43.
22. Lewis KM, O’Brien RT. Abdominal ultrasonographic findings associated with feline infectious peritonitis: a retrospective review of 16 cases. J Am Anim Hosp Assoc. junio de 2010;46(3):152-60.
23. Ferreira A, Marwood R, Batchelor D, Maddox T, Mortier JR. Prevalence and clinical significance of the medullary rim sign identified on ultrasound of feline kidneys. Vet Rec. 20 de noviembre de 2019.
24. Fischer Y, Sauter-Louis C, Hartmann K. Diagnostic accuracy of the Rivalta test for feline infectious peritonitis. Vet Clin Pathol. diciembre de 2012;41(4):55867.
25. Sangl L, Felten S, Matiasek K, Dörfelt S, Bergmann M, Balzer HJ, et al. Detection of feline coronavirus RNA, spike gene mutations, and feline coronavirus antigen in macrophages in aqueous humor of cats in the diagnosis of feline infectious peritonitis. J Vet Diagn Investig Off Publ Am Assoc Vet Lab Diagn Inc. julio de 2020;32(4):527-34.
26. Porter E, Tasker S, Day MJ, Harley R, Kipar A, Siddell SG, et al. Amino acid changes in the spike protein of feline coronavirus correlate with systemic spread of virus from the intestine and not with feline infectious peritonitis. Vet Res. 25 de abril de 2014;45:49.
27. Barker EN, Stranieri A, Helps CR, Porter EL, Davidson AD, Day MJ, et al. Limitations of using feline coronavirus spike protein gene mutations to diagnose feline infectious peritonitis. Vet Res. 05 de 2017;48(1):60.
28. Felten S, Hartmann K. Diagnosis of Feline Infectious Peritonitis: A Review of the Current Literature. Viruses. 15 de noviembre de 2019;11(11).
29. Dunbar D, Kwok W, Graham E, Armitage A, Irvine R, Johnston P, et al. Diagnosis of non-effusive feline infectious peritonitis by reverse transcriptase quantitative PCR from mesenteric lymph node fine-needle aspirates. J Feline Med Surg. octubre de 2019;21(10):910-21.
30. Murphy BG, Perron M, Murakami E, Bauer K, Park Y, Eckstrand C, et al. The nucleoside analog GS-441524 strongly inhibits feline infectious peritonitis (FIP) virus in tissue culture and experimental cat infection studies. Vet Microbiol. junio de 2018;219:226-33.
31. Pedersen NC, Perron M, Bannasch M, Montgomery E, Murakami E, Liepnieks M, et al. Efficacy and safety of the nucleoside analog GS-441524 for treatment of cats with naturally occurring feline infectious peritonitis. J Feline Med Surg. abril de 2019;21(4):271-81.
32. Jones S, Novicoff W, Nadeau J, Evans S. Unlicensed GS-441524-Like Antiviral Therapy Can Be Effective for at-Home Treatment of Feline Infectious Peritonitis. Animals. agosto de 2021;11(8):2257.
33. Antiviral treatment using the adenosine nucleoside analogue GS-441524 in cats with clinically diagnosed neurological feline infectious peritonitis - PubMed [Internet]. [citado 23 de febrero de 2021]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32441826/.
34. 2020 - Dr Pedersen GS-441524 Winter Update [Internet]. Sock it to fip. [citado 25 de febrero de 2021]. Disponible en: https://sockfip.org/2020-drpedersen-gs-441524-winter/
35. Pedersen NC, Kim Y, Liu H, Galasiti Kankanamalage AC, Eckstrand C, Groutas WC, et al. Efficacy of a 3C-like protease inhibitor in treating various forms of acquired feline infectious peritonitis. J Feline Med Surg. abril de 2018;20(4):378-92.
36. Miscellaneous Questions and Answers regarding FIP 2020 [Internet]. Sock it to fip. [citado 25 de febrero de 2021]. Disponible en: https://sockfip.org/ miscellaneous-questions-and-answers-regarding-fip-2020/

