뇌전증 치료제의
현재와 미래
중앙대학교


뇌전증 치료제의
중앙대학교

1. 서론
2. 3. 4. 5.
2.1. 질환 소개
2.2. 진단 및 치료
3.1. 라코사미드
3.2. 페람파넬
3.3. 에슬리카바제핀
3.4. 브리바라세탐
3.5. 세노바메이트
및 이슈
4.1. 약제별 시장 동향
4.2. 기업 분석
저자
중앙대학교 약학대학 제약산업연구학회 API
김주연, 류세하, 백승원, 소은수, 소채민
신지혜, 안수연, 유지연, 이승연, 이지원
이현진, 장인성, 조영인, 차윤아, 황승훔
지도교수
중앙대학교 약학대학 제약산업 및 사회약학 연구실
이종혁
대표
회장: 김주연(kjy57103@naver.com)
부회장: 신지혜(shinjh0506@naver.com)
이승연(seungyean103@naver.com)
뇌전증은 뇌졸중, 편두통, 알츠하이머병에 이어 전 세계적으로 네 번째로 흔한 신경계 질환으 로, 인구 1,000명당 약 4~10명에서 유병하는 것으로 보고된다. 단순히 반복적인 발작만을 특징 으로 하는 것이 아니라, 많은 환자들이 신경발달 지연, 인지 기능 저하, 정서적 장애와 같은 다양 한 신경정신학적 문제를 동반한다. 이러한 복합적인 임상 양상은 환자의 정상적인 교육, 사회생 활, 직업 유지 및 독립적인 삶을 어렵게 만들며, 삶의 질 저하를 초래한다.
더욱 심각한 사실은, 환자의 약 30%가 기존 항뇌전증제제(*ASM)에 반응하지 않는 약물 난치
성 뇌전증(drug-resistant epilepsy, DRE)으로 진행된다는 점이다. 이러한 높은 유병률과 난
치성 경향은 뇌전증이 삶의 질을 떨어뜨리는 단순한 만성 질환을 넘어 사망 위험 증가, 그리고 의
료·사회적 부담이 큰 질환임을 시사한다.
기존 항경련제들은 증상 완화에는 효과적일 수 있으나, 질병의 근본적 진행 억제나 완치, 장기적
삶의 질 향상에는 한계가 있다는 지적이 있다. 또한, 약물 난치성 뇌전증(DRE)은 현재 항경련제 에 반응하지 않는 경향이 있으므로 치료 옵션이 제한된 환자들, 특히 기존 약물로 통제되지 않는 환자들을 위한 전략이 절실히 필요한 상황이다.
특히 세노바메이트(cenobamate), 라코사미드(lacosamide), 페람파넬(perampanel), 브리 바라세탐(brivaracetam), 에슬리카바제핀(eslicarbazepine)은 서로 다른 기전을 가진 3세대 약물 또는 최근 승인된 항경련제로, 기존 1·2세대 약물보다 효능과 내약성, 다양성 측면에서 개 선된 특징을 갖고 있다.
현재 이 5가지 약물은 난치성 뇌전증(Drug-Resistant Epilepsy, DRE)의 국소발작 치료에 보조요법으로 임상적 유효성이 입증된 약물이다. 특히 세노바메이트는 발작 완전 억제율 및 치료 유지율 측면에서 두드러진 효과를 보여, DRE 환자 관리에서 주요 치료 옵션으로 떠오르고 있다. 또한 이들 약물은 각각의 작용 기전과
먼저 각 약물의 승인 시기와 허가 전략을 비교·분석함으로써 국내외 규제 환경과 시장 접근 전략 을 파악해보았고, 관련 논문을 직접 검토하며 임상시험의 전개 과정을 파악하고 데이터 해석 능 력을 심화할 수 있었다. 더불어 약물의 상업적 성패와 직결되는 급여 정책을 공부하면서 국내를 포함한 글로벌 시장에서 의약품의 최적의 접근 전략을 도출해보았다. 국내외 인허가 환경에 대한
일련의 고찰 과정을 통해 신약 개발 및 상업화 생태계를 종합적으로 이해하고 향후 제약산업을 선
도할 수 있는 리더로 성장하기 위한 중요한 토대를 마련해보고자 하였다.
정지은. (2025). 약물치료학 6개정 제3권. 한국임상약학회. 뇌전증(p1273~1307). 신일북스
Ghosh, S., Sinha, J. K., Ghosh, S., Sharma, H., Bhaskar, R., & Narayanan, K. B. (2023). A Comprehensive Review of Emerging Trends and Innovative Therapies in Epilepsy Management. Brain sciences, 13(9), 1305.
Lattanzi, S., Trinka, E., Zaccara, G., Striano, P., Russo, E., Del Giovane, C., Silvestrini, M., & Brigo, F. (2022). Third-Generation Antiseizure Medications for Adjunctive Treatment of Focal-Onset Seizures in Adults: A Systematic Review and Network Meta-analysis. Drugs, 82(2), 199–218.
Shankar, R., Marston, X. L., Danielson, V., Do Rego, B., Lasagne, R., Williams, O., & Groves, L. (2024). Real-world evidence of epidemiology, patient characteristics, and mortality in people with drug-resistant epilepsy in the United Kingdom, 2011-2021. Journal of neurology, 271(5), 2473–2483.
백승원 gswbaek100@gmail.com
유지연 smileclara03@gmail.com
이지원 ezy7829@gmail.com
이현진 junah2004@naver.com
장인성 janginsung2000@gmail.com
뇌전증(epilepsy)은 뇌신경세포의 전기적 활동에 이상이 생겨 반복적인 발작을 초래하는 질환 이다. 과거에는 간질이라고 불렸으나, 간질이라는 용어가 주는 부정적인 인식으로 인해 뇌전증으 로 용어가 변경되었다. 뇌전증은 신경세포의 일시적이고 불규칙적인 이상흥분현상에 의하여 발 생하는 모든 증상을 뜻하며, 다양한 원인에 의해 발생한다.
국제뇌전증퇴치연맹(International League Against Epilepsy, ILAE)는 2014년 개정 정의 에서 뇌전증을 다음과 같이
수 있다.
첫째, 24시간 이상의 간격을 둔 비유발성발작이 2회 이상 있는 경우.
둘째, 비유발성 발작이 한 번 있으며 향후 10년내 비유발성 발작의 재발 가능성이 일반적인 발
작의 재발률보다 높은 경우(일반적으로 60% 이상).
셋째, 뇌전증 증후군으로 진단된 경우이다.
이 정의는 뇌전증을 단순히 발작의 반복으로 보는 기존 개념에서 벗어나 질병으로서의 뇌전증 (epilepsy as a disease entity)을 강조한 것이다.
뇌전증의 분류
뇌전증은 전세계 인구의 약 1%가 겪는 흔한 만성 신경계 질환으로 발작횟수,
등에 따라 다양한 형태가 있다.
발작의 종류를 구분해보려 한다. 뇌전증의
뇌전증으로 진단되
는 것은 아니다. 뇌전증과 발작을 혼용해서 쓰는 경우가 많지만 좀 더 정확히 구분하자면, 발작은 과도한 떨림 등의 이상 “증상”을 의미하며
발작은 크게 유발성 발작과 비유발성 발작으로 구분할 수 있다. 이름에서부터 알 수 있듯이 유 발성 발작은 특정 자극이나 유발 요인에 의해 발생하는 발작이다. 갑작스러운 뇌손상이나 뇌기능 장애에 기인하는 증상으로 간주되기 때문에 재발해도 뇌전증이라 하지 않는다. 다음은 뇌전증이
아닌 발작의 예시이다.
-물질대사 및 전해질 이상; 저나트륨혈증, 저혈당증, 저칼슘혈증, 요독증, 갑상샘 기능 항진증 등
-종괴 병변 - 뇌암, 뇌출혈 등
-약물 금단 및 불응
-고혈압응급증
-중독증상; 주로 코카인, 리튬,lidocaine, 수은 및 납 중독, 일산화탄소 중독
-감염; 패혈성 쇼크, 뇌수막염, 뇌농양
-허혈 - 뇌졸중
-외상 등으로 인한 뇌압 상승
-알콜성 뇌전증
비유발성 발작은 급성의 원인 없이 일어나는 발작으로, 우리가 흔히 뇌전증이라 하면 비유발성 발작을 의미한다. 비유발성 발작은 어디에서 시작되느냐에 따라 국소발생발작과 전신발생발작, 그리고 발생미상발작으로 구분할 수 있다. 국소발생(focal-onset)발작은 크게 의식소실을 동반 하는 경우과 그렇지 않은 경우로 구분할 수 있으며, 전신(generalized-onset)발작은 의식소실 을 동반한다.
발작의 종류는 너무나 다양해서 이 파트에서는 발작 증상을 기술하는 용어들만 간단히 소개하려 한다. 크게 운동 증상과 비운동 증상으로 구분할 수 있으며, 뇌의 어느 부분에 이상이 생기냐에 따라 임상 증상이 다르다. 대표적으로 운동 경로에 이상이 생기면 팔, 어깨, 얼굴 또는 다리 등의 경련이 나타난다. 두려움, 우울증과 같은 감각증상은 측두엽의 이상과 관련 있다.
다음은 운동 증상과 관련된 용어이다.
• 자동증 (automatisms): 의도가 확실하지 않은 반복적 행동으로 입맛을 다시기도 하고 물건을 만지작거리기도 함
• 무긴장 (atonic): 근육의 긴장 상태가 갑자기 소실되는 발작으로, 머리 또는 사지가 축 쳐지가나 쓰러지게 됨.
• 간대 (clonic): 팔, 목, 얼굴의 규칙적인 경련
• 강직 (tonic): 근육이 갑자기 뻣뻣함.
• 근간대 (myoclonic): 갑작스런 근육 수축을 나타내며 보통 팔의 수축이 일어남.
• 뇌전증성 연죽 (epileptic spasm): 짧고 갑작스런 몸의 연축과 이에 동반되는 1-2초간의 목과 몸통, 팔다리의 근강직 으로 이러한 연축은 근간대발작보다는 길고 강직 발작보다는 짧은 형태임.
• 과운동 (hyperkinetic): 휘젓고 몸부림치는 동작 또는다리 페달링 동작
• 자율신경 (autonomic): 위장관 또는 복부의 전조증상, 구역감, 가스 찬 느낌, 배가 따뜻한 느낌
• 행동정지 (behavior arrest)
• 인지 (cognitive): 의식저하,주변을 인지하고 반응하는 능력의 저하
• 감정 (emotional): 공포감 등
• 감각 (sensory): 윙 울리는 소리 같은 환청, 불쾌한 냄새를 느끼는 환각
발작의 분류는 위의 용어들을 조합해서 표현하는 경우가 많다. 예를 들어 전신성 강직간대발작
이면 발작의 시작이 대뇌 피질 전반에 걸쳐서 나타났으며(전신성), 증상으로는 근육이 갑자기 뻣
뻣해지면서(강직), 팔, 목, 얼굴의 규칙적인 경련(간대)이 일어나는 발작인 것이다. 이보다 좀 더 자세한 설명은 뒤의 “발작 유형별 임상증상” 파트에서 다룰 예정이다.
용어 정리
이번 학회지에서 많이 쓰이는 용어를 정리해보려 한다. 2017년 국제 뇌전증기구(ILAE)에서 는 기존에 혼용되어서 사용되는 용어를 변경하여서 정의를 명확히 했다. 다음은 변경된 용어이 다.
부분/국소(partial)발작 => 국소(focal)발작
단순부분발작 => 국소발생 의식유지 발작
복합부분발작 => 국소발생 의식소실 발작
이차성 전신발작 => 국소발생 양측성 강직간대발작
이번 학회지에서는 허가를
다. 부분발작과 국소발작은 혼용해서 사용했지만
의 용어를 사용했다.
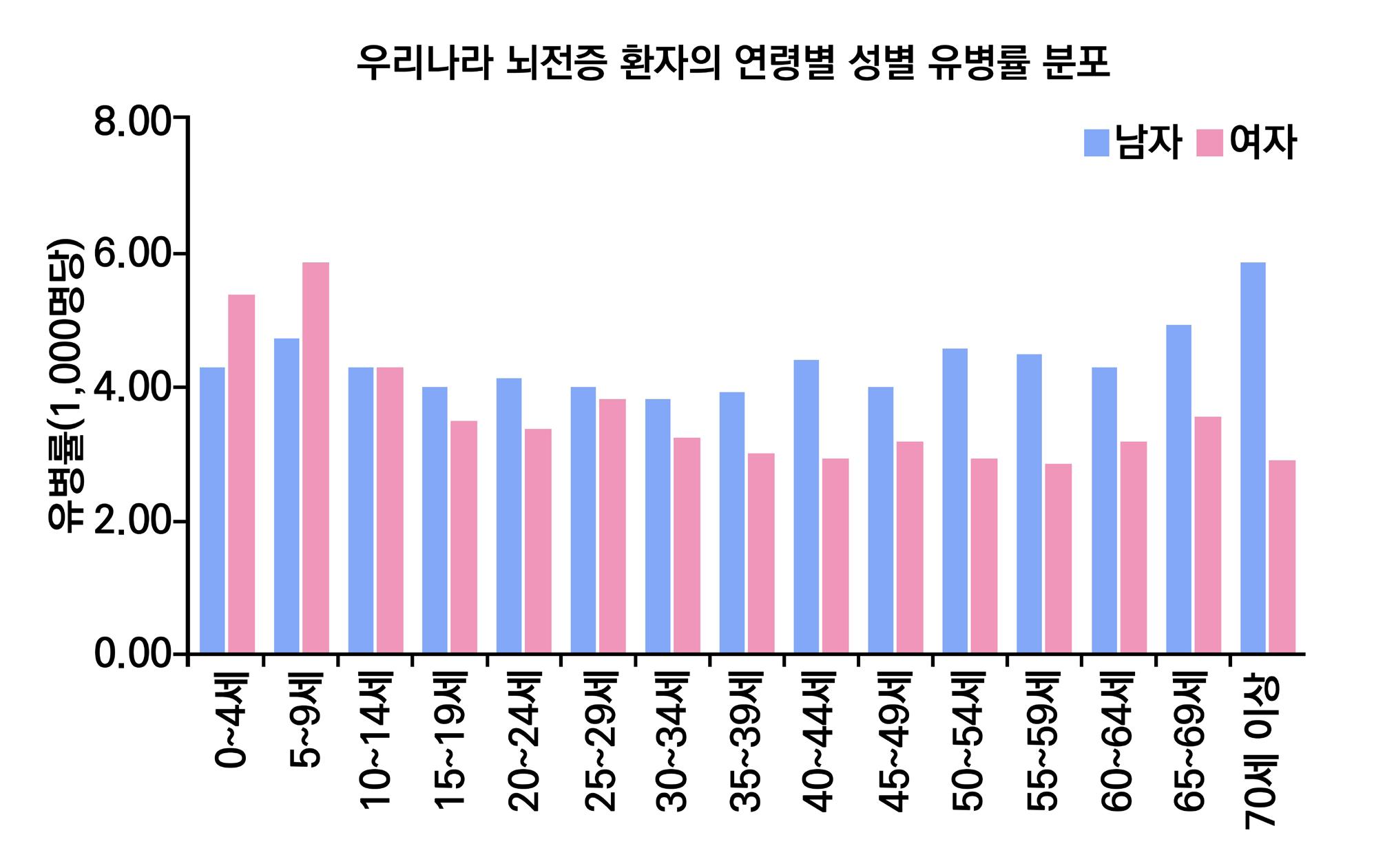
1. 뇌전증의 국내 유병률
2009년부터 2017년까지 우리나라에서의 뇌전증 유병률 연구 결과, 2009년 유병률은 1,000 명당 3.4명(약 0.34%)에서 2017년 1,000명당 4.8명(약 0.48%)로 증가하는 추세를 보이고 있다. 이러한 현상은 의학의 발달로 평균
났다. 우리나라의 경우
를 제외한 모든 연령대에서 남성이
5,179만
고 있다. 1990년에서 2021년 사이에 전체 뇌전증 유병률은 10.8% 증가하였고, 주로 이차성
뇌전증 증가로 인한 영향이 크다. 지역 간 유병률은 최대 4배 이상의 차이를 보이고 있으며 고소
득 국가의 뇌전증 유병률은 상대적으로 낮은 편이지만 여전히 0.6% 이상 수준이다. 연령에 따
른 유병률 변화의 경우, 전체적으로 J자형 곡선을 그리는 양상이다. 중년기의 유병률이 상대적으 로 낮은 것으로 나타난다. 15~19세 사이에는 특발성 뇌전증의 최고치가 관찰되며 50~54세 이 후 전반적으로 뇌전증의 유병률이 급격하게 증가한다. 글로벌 유병률이 경우 전체 뇌전증을 기준
으로 성별의 큰 차이는 나타나지 않는다. 다음 장의 그래프는 뇌전증의 글로벌 유병률을 요약적 으로 나타낸다.
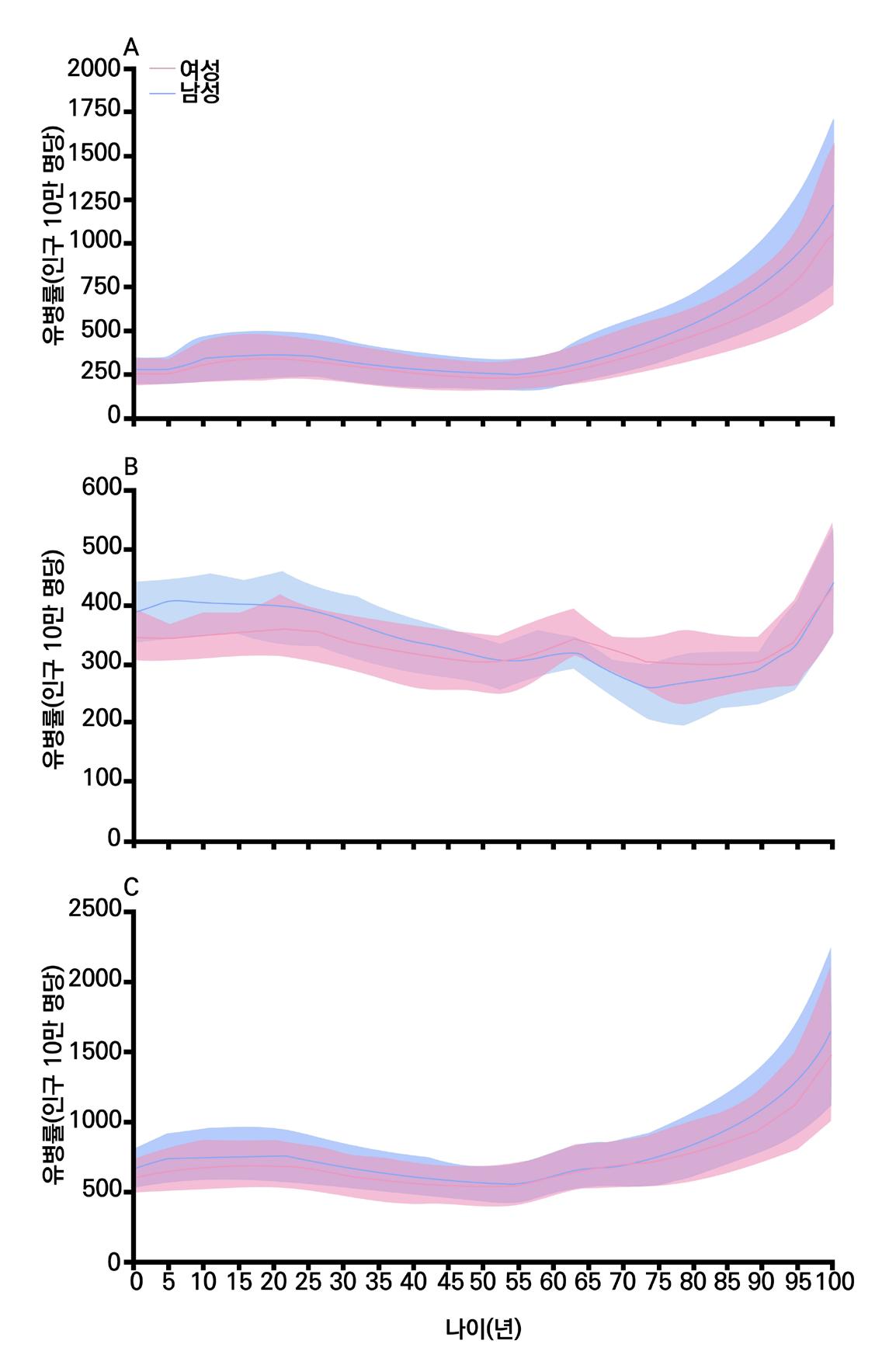
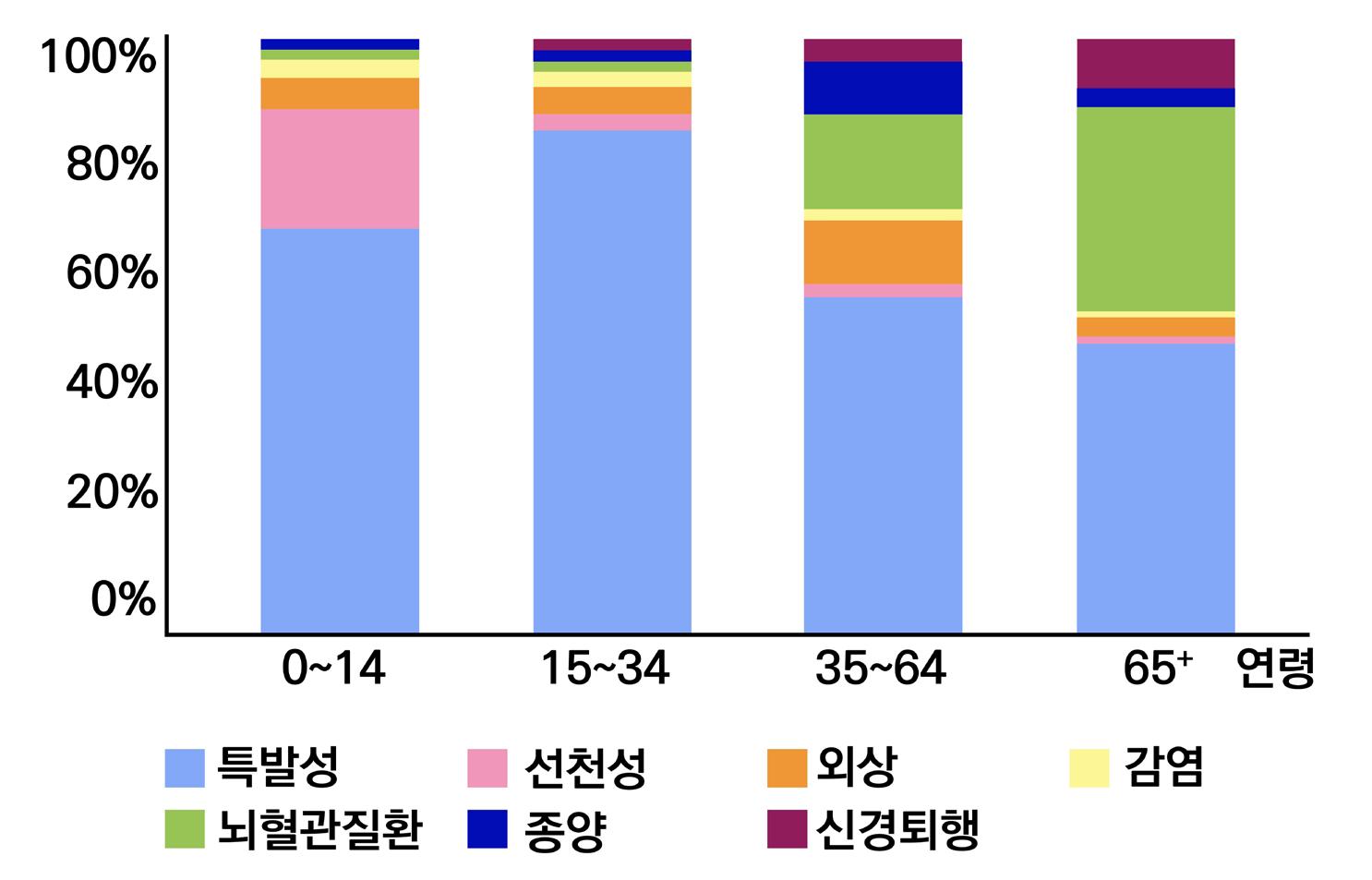
[그림 2] 2021년 기준 연령 및 성별에 따른
A.특발성/B.이차성/C.전체 뇌전증의 전 세계 유병률 추이
뇌전증의 원인과 주요 위험 요인
뇌전증은 여러 가지 원인에 의해 발생하며, 연령별로 주요 원인이 조금 다르다. 실제 환자의 약
절반은 아직 원인의 파악이 안되었으며, 다양한 질병에서부터 뇌 손상, 뇌 발달 문제에 이르기까 지 신경세포의 정상적인 활동을 방해하는 모든 것은 발작을 유발하는 원인이 될 수 있다.
연령별 발작 내에서도 뇌전증의 원인은 크게 6가지로 분류 가능하다. 이는 구조적 이상, 대사성, 유전성, 감염성,
더욱 자세한 원인 규명이 기대된다. 구조적 원인은 후천적인 질환(뇌손상이나 뇌졸중)으로 인해 서 뇌전증이 발생하는 것을 의미한다. 대사성 원인은 현재까지 규명된 뇌전증을 발생하는 대사장 애가 있는 경우에 구분된다. 유전성 원인인은 아직 완전히 규명된 것은 아니며, 통상적으로 이온 통로를 구성하는 단백질의 유전자 이상으로 인한 뇌전증의 발생이 해당된다. 일부 유형은 가족
내에서 다수 발생하며 개인에게 발생하는 돌연변이도 유전적 요인을 초래할 수 있다. 수백 개의
유전자가 뇌전증에 관여할 가능성이 언급되고 있으며 이외에도 중추신경계의 감염이나 면역성의
원인도 유전성 원인에 해당된다.
뇌전증의 발생원인을 연령별로 나누어보면 다음과 같다. 우선 연령의 기준은 출생부터 80세까
지 크게 5가지 구간으로 나누어 정의하고 있다. 출생에서 6개월까지는 분만 전후의 손상(신생아
가사 뇌출혈), 뇌의 발달이상(신경세포 이주장애, 저산소성 뇌손상 대사이상), 선천성 기형, 중추 신경계 급성 감염이 그 원인으로 해당된다. 다음으로 6개월에서 24개월까지는 급성 열성 경련, 중추신경계의 급성 감염, 분만 전후의 손상, 뇌의 발달이상이 그 원인이다. 2~6세는 중추신경계 의 급성 감염, 분만 전후의 손상, 뇌의 발달이상, 특발성, 뇌종양이 원인이며, 6~16세의 경우 특 발성, 뇌종양, 중추신경계의 급성감염, 분만 전후의 손상, 뇌의 발달 이상이 해당된다. 마지막으 로 16~80세까지 성인의 경우, 뇌외상, 중추신경계의 감염, 뇌종양, 뇌혈관 질환이 그 원인에 해 당한다.
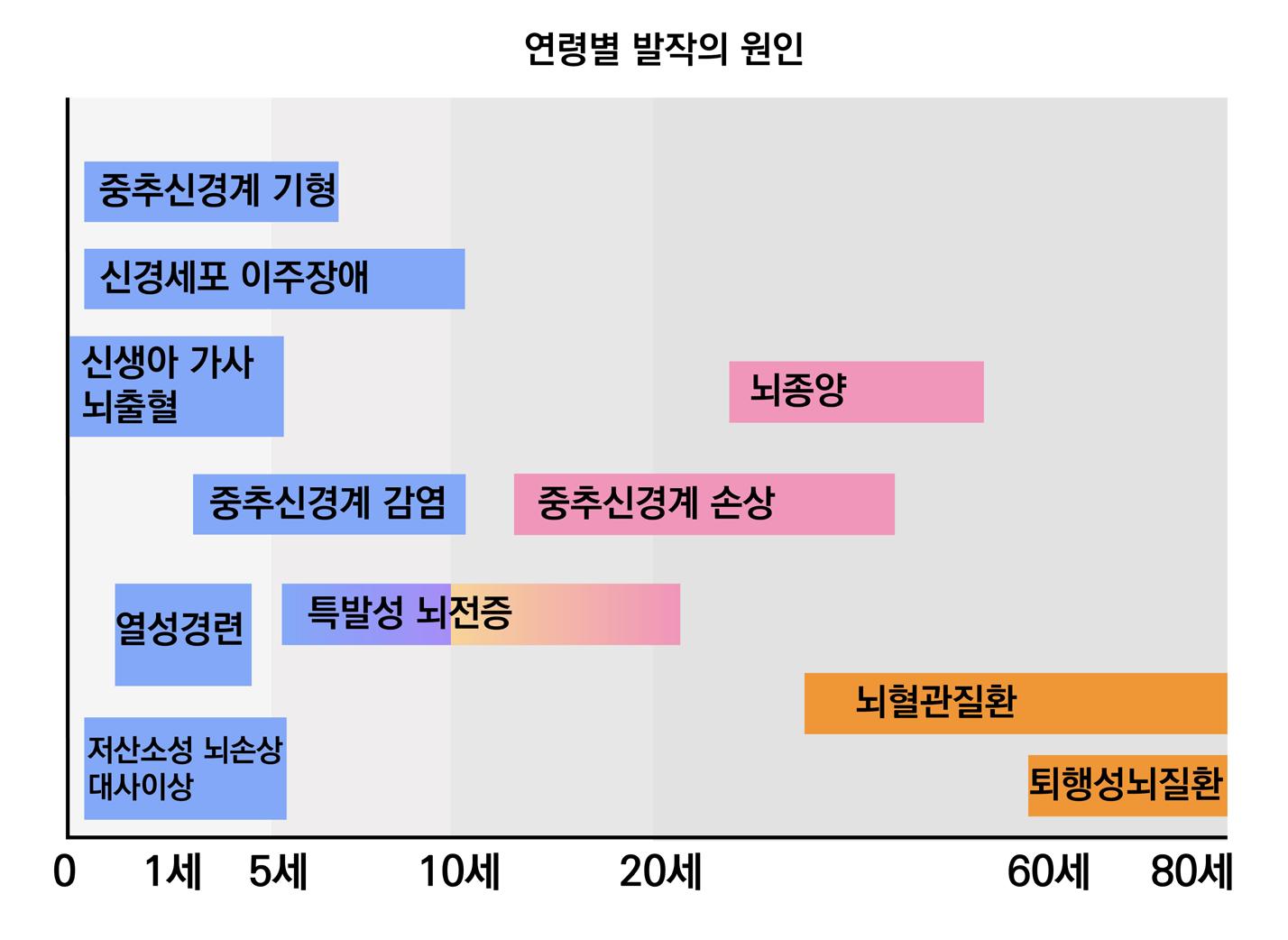
[그림 3] 연령별 발작의 원인
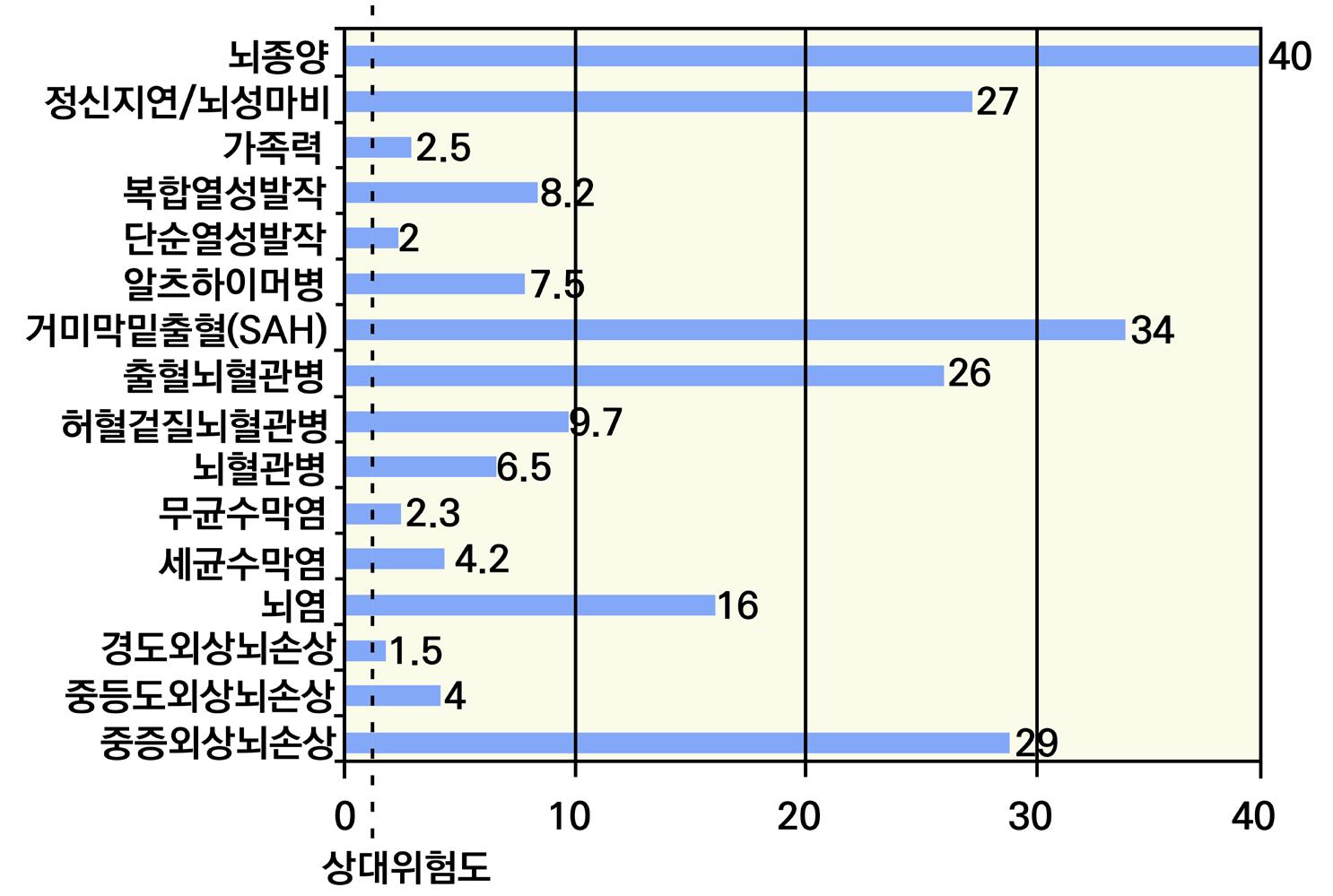
특히 대표적으로 뇌전증을 유발할 수 있는 질환에는 뇌종양, 뇌 손상, 알코올 중독 또는 금단, 알 츠하이머병, 뇌에 산소가 부족한 상태(뇌졸중, 심장마비 등), 동정맥 기형 또는 뇌출혈, 뇌 염증 또는 부종, 뇌의 감염(수막염, HIV 관련 감염, 바이러스성 뇌염), 뇌성마비 및 기타 발달 장애 등 이 있다. [그림 4] 뇌손상별 뇌전증 위험도
원인이 등장한다.
뇌전증의 병태 생리학적 기전은 크게 세 가지 구획으로 나누어 설명할 수 있다.
첫번째로 알아야 할 것은 발작의 발생 기전이다. 발작은 뇌의 전기적인 신호 전달의 폭주로 인
해 발생하는 신체적, 정신적, 감정적 이상을 포함하는 증상으로, 뇌전증은 발작이라는 증상이 반
복되는 질환이다.
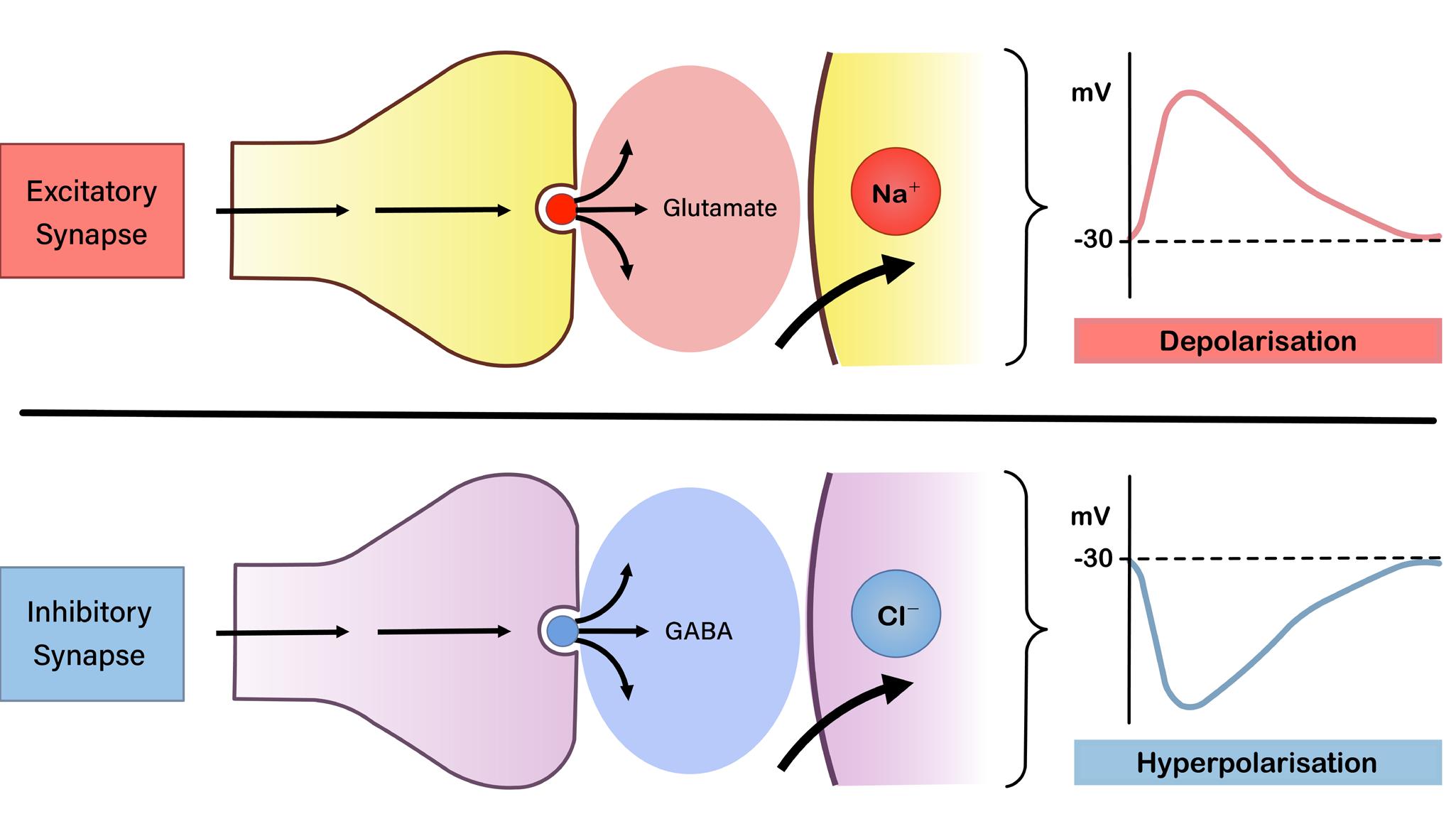
6] 흥분성과 억제성 시냅스의 모식도
인간의 중추신경계에서 시냅스는 크게 흥분성과 억제성으로 나뉘며, 이들간의 상호작용이 적절 할 때 신경망은 전기적 항상성을 유지할 수 있다. 발작은 대부분 시냅스 단위에서의 흥분성 및 억 제성
때 발생한다. 흥분성 시냅스의 주요한 신경전달물질은 glutamate로,
반면, 억제성 시냅스의 주요한 신경전달물질은 GABA이다. 이는 GABA 수용체를 통해 염화이 온의 세포 내 유입을 촉진하여 과분극을 유도하며, 결과적으로 뉴런의 흥분성을 억제하는 작용을 한다. 따라서 GABA 합성의 감소, 수용체 기능의 저하, 염화 이온 유입 감소는 억제 기능을 약화 시킬 수 있고, 이는 흥분성 신호가 상대적으로 강화되도록 한다.
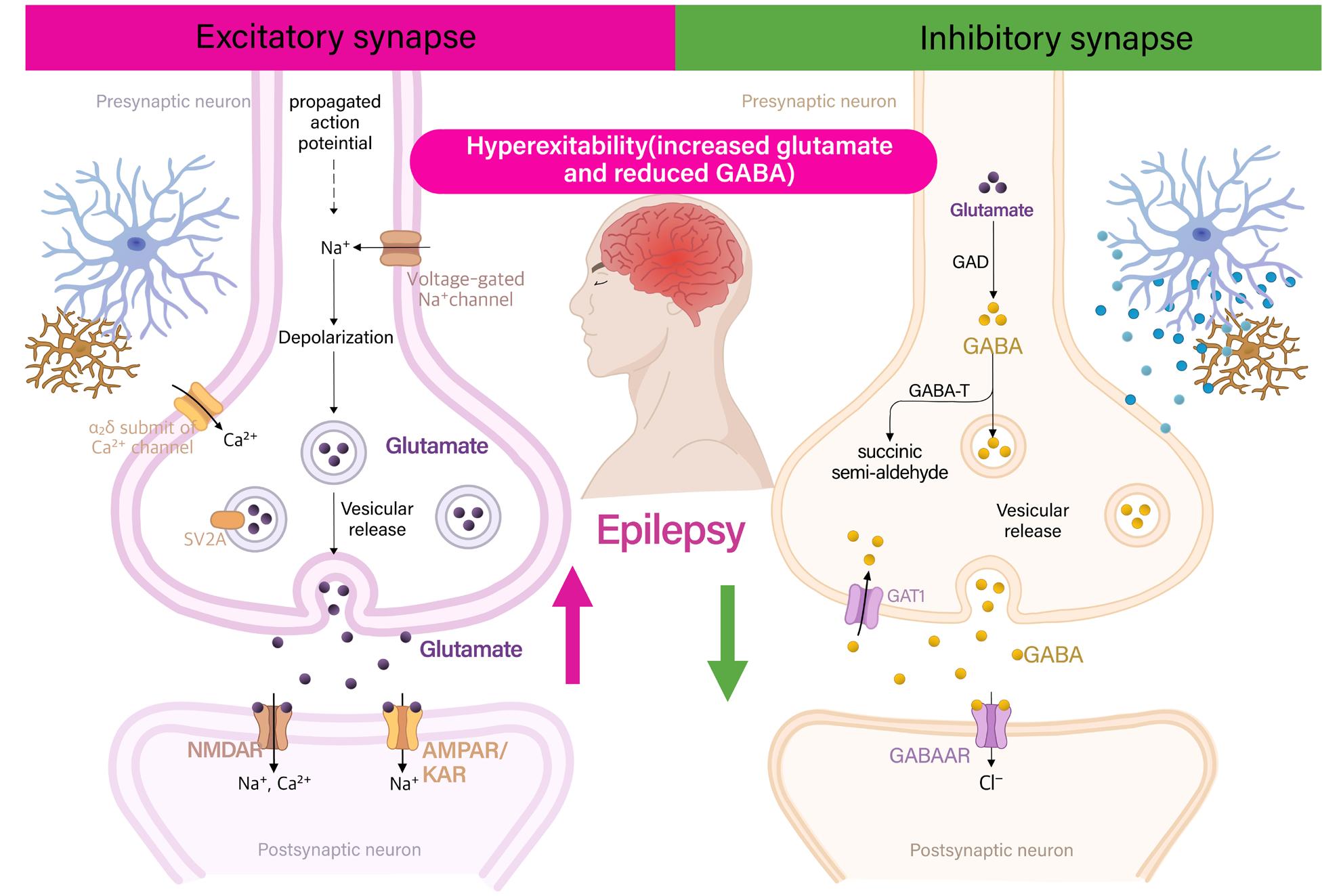
[그림 7] 흥분성과 억제성 시냅스의 활성화 요소
흥분성 시냅스의 과다활성의 유형은 다음과 같다.
• voltage gated Na+ channel의 장기 개방
• high voltage activated Ca2+ channel의 장기 개방
• glutamate의 vascular release 증가
• NMDA 수용체 또는 AMPA 수용체의 과다활성
억제성 시냅스의 과소활성의 유형의 유형은 다음과 같다.
• GABA의 합성 감소
• GABA를 분해하는 GABA-T (GABA transaminase)의 과활성으로 인한 GABA 분해 증가
• GABA를 재흡수하여 시냅스 틈에서 제거하는 GAT1 (GABA transporter 1)의 과활성
• GABA 수용체의 이상으로 인한 염화 이온 유입 감소
결과적으로, 글루탐산성 흥분 작용의 항진 또는 GABA성 억제 작용의 저하는 신경회로 내 흥
분성-억제성 균형을 붕괴시키고, 이는 발작 발생의 기초가 된다.
위에서 언급된 비정상적인 신경회로 작용을 일으키는 발생 원인은 2017 ILAE 뇌전증 분류 체
계에 따라 구조성, 유전성, 감염성, 대사성, 면역성, 원인불명의 6가지로 분류된다. 특정 환자는
두가지 이상의 원인으로 중복 진단을 받을 수 있다.
• 구조성 : neuroimaging에서 발견된 뇌의 구조적 이상이 발작 원인이라고 추정하는 경우
• 유전성 : 유전자 또는 유전자 복제 수 변이에 의해 규명할 수 있는, 혹은 추정되는 발작의 유전적 요인이 있는 경우
• 감염성 : 급성 중추신경계 감염이 뇌전증의 원인인 경우
• 대사성 : 발작이 주요한 증상인 규명 혹은 추정된 대사성 질환이 뇌전증의 원인이 되는 경우
• 면역성 : 발작이 주요한 증상인 규명 혹은 추정된 면역성 질환이 뇌전증의 원인이 되는 경우
마지막으로 알아야할 개념은 발작이라는 증상을 뇌전증으로 이어지도록 하는 발작 전파 네트워 크인 epileptogenesis이다. 이는 정상 뇌가 만성적인 자발성 발작을 유발할 수 있는 뇌로 전환 되는 과정을 이르는 용어로, 정상적인 회로가 초기 뇌손상으로 인한 비정상적인 신경 회로의 형
성와 동기화 되면서 자발적으로 발작을 생성하는 전파 네트워크가 형성되는 과정을 통칭한다. 흥
분성 시냅스의 과다활성이나 억제성 시냅스의 기능 저하 등이 국소적인 병변에 국한되지 않고 뇌 의 전반에 퍼질 수 있도록 하는 피질 간 연결세포 및 회로에는 다음과 같은 것들이 있다.
• 시냅스들을 연결해주는 다리 역할인 별아교세포(astrocyte)
• 뇌의 염증 반응을 조절하고 흥분성 축삭 회로 생성에 관여하는 미세아교세포(microglia)
• 양측의 피질을 연결해 대칭 및 전신성 발작이 유도될 수 있게 하는 뇌량(corpus callosum)
뇌전증의 만성적인 발작은 이러한 연결을 통한 대규모 뉴런의 병리적 동기화(synchronization)
가 핵심적인 기반이다.
뇌는 영역과 위치에 따라 고유 기능이 모두 다르기 때문에 뇌전증도 침범된 부위에 따라 다양한 임상 증상을 보인다. 예를 들어, 팔의 움직임을 조절하는 뇌 영역이 침범되면 한쪽 팔을 떠는 증
상이 생길 수 있다.
1981년 국제뇌전증기구(International League Against Epilepsy: ILAE)에서 임상증상과
뇌파소견을 토대로 뇌전증 발작을 분류하였으며, 현재까지도 널리 사용되고 있다. 발작의 시작
부위에 따라 크게 국소발작과 전신발작, 그리고 그 이외의 발작으로 구분된다. 국소발작은 대뇌 겉질의 일부분에서 시작되는 신경세포의 과흥분성 발작을 의미한다. 전신발작은 대뇌양쪽반구의
광범위한 부분에서 발작이 시작된다. 전조(aura,
전조와 국소발작(focal-onset seizure, 부분발작)
동반하기
를 경험한다. 전조는 기술하기 어려운
느낌, 감각, 생각, 행동의 변화로 나타나고, 한 환자 에서 뇌전증 발작 시 항상 비슷하게 나타난다. 전조의 증상은 다양하지만, 그 지속시간은 매우 짧 으며(5~30초 이내) 전조가 발생한 후 의식을 잃는 발작으로 진행하는 경우도 있지만 전조 없이 바로 팔다리를 떨거나 의식을 잃기도 한다. 비교적 흔한 전조에는 신체의 특정 부위에서 느껴지 는 저림이나 통증 등의 감각이상, 가슴이 답답하다거나 속에서 뭔가 치밀어 오르는 듯한 증상, 공 포감, 환청, 환시, 환각, 처음 일어나는 일인데도 마치 과거에 경험했던 일인 것 같은 기시감, 과 거에 경험하여 잘 알고 있는 내용인데도 갑자기 생소하게 느껴지는 미시감 등이 있다.
국소발작은 발작동안 주위의 환경과 나 자신을 스스로 인지할 수 있는지(의식유지 여부)와 몸이 어떤 움직임을 보이는지에 따라 분류할 수 있다.
1. 국소발생 의식유지 발작(focal aware seizure 또는 단순부분발작; simple partial seizure)
대뇌의 일부분에서 시작되어 대뇌 전반으로 퍼지지 않으며 의식이 유지되는 것이 특징이다. 발
병 부위에 따라 운동, 감각, 정신증상 등 다양한 형태가 있다. 한 쪽 손이나 팔을 까딱까딱하거나 입꼬리가 당기는 형태의 단순부분운동발작 (simple focal motor seizure), 한 쪽의 얼굴, 팔, 다리 등에 이상 감각이 나타나는 단순부분감각발작 (simple focal sensory seizure), 속에서
무언가 치밀어 올라오거나, 가슴이 두근거리고 모공이 곤두서고 땀이 나는 등의 증상을 보이는
자율신경계증상, 또는 이전의 기억이 떠오르거나 낯선 물건이나 장소가 친숙하게 느껴지는 증상
(데쟈뷰 현상) 등의 정신 증상이 나타날 수 있다.
2. 국소발생 의식소실 발작(focal impaired awareness seizure 또는
complex partial seizure)
복합부분발작의 특징은 의식의 장애가 있다는 점이다. 의식장애와 더불어 의도가 확실하지 않은 반복적 행동(자동증; automatism)이 나타날 수 있다. 흔히 초점 없는 눈으로 멍하니 한 곳을
다보면서 입맛을 쩝쩝 다시거나, 손을
이 관찰될 수 있다. 환자는 자신이 이러한 행동을 했다는 사실을 기억하지 못한다.
모습
3. 국소발작에서 기인하는 이차성 전신발작 (partial seizure with secondary generalization 또는 국소발생 양측성 강직간대발작)
발작 초기에는 국소 발작의 형태를 보이지만, 신경세포의 과활동성이 대뇌 전반적으로 퍼지면서
전신 발작이 나타나게 된다. 전신이 강직되고 얼굴이 파랗게 되는 증상(청색증)이 나타나다가 이 후 팔다리를 규칙적으로 떠는 발작이 나타나는 형태로 증상이 진행된다.
*양측성(bilateral)은 국소발생과 전신발생 발작을 구분하기 위한 용어로 사용된다.
1. 전신강직간대발작(대발작; generalized tonic-clonic seizure, grand mal) 전신발작 도중에
넘어가는 두 단계로
나오고 발작 중에 소변이나 대변을 보기도 한다. 발작 후에는 대개 깊은 수면이 뒤따르고 일시적
인 의식 장애가 나타나기도 하며, 일정 기간 동안의 기억 소실이 동반된다.
2. 결신발작 (소발작; absence seizure, petit mal)
소발작은 주로 4-12세 소아에서 발생한다. 갑자기 하던 행동을 멈추고 멍하게 앞이나 위를 바
라보는 모습을 보이고, 간혹 고개를 푹 수그리는 모습을 보이기도 한다. 이 발작은 대개 5~10초
이내에 종료되며, 길어도 수십 초를 넘기지 않는 경우가 일반적이다. 이후 의식을 회복한 뒤에는
자신이 발작을 했다는 사실을 인지하지 못한 채 발작 직전에 하던 행동이나 상황으로 복귀한다. 간혹 눈꺼풀이나 입 주위가 경미하게 떨리는 간대발작(clonic seizure)이나 입술을 핥고
지작거리는 자동증이 동반될 수도 있다. 숨을 크게 몰아 쉴 때 나타나기 쉽다.
3. 근간대발작(근육간대경련발작; myoclonic seizure)
빠르고 순간적인 근육의
한쪽
몸통에 한 번 또는 연달아 반복되는 것
이 특징이다. 깜짝 놀라는 듯한 불규칙적인 근육 수축이 나타나는데, 흔히 식사 중에 깜짝 놀라
며 숟가락을 떨어뜨리는 형태로 잘 나타난다. 주로 잠에서 깬 직후에 발생하거나 수면이 부족할 때 발생하며, 피로감, 정신적인 스트레스, 광 자극 등에 의해 심해지기도 한다. 청소년기에 종종 발병하는 청소년근육간대경련발작(juvenile myoclonic epilepsy)의 특징 중 하나이기도 하다.
4. 무긴장발작(atonic seizure)
순간적인 의식 소실과 함께 전신의 근육에서 힘이 빠지면서 넘어지는 형태이다. 넘어지면서 흔
히 머리를 땅이나 가구에 부딪혀서 머리, 안면, 치아 등을 다치는 경우가 많다. 소아기에 나타나 는 레녹스-가스토 증후군(Lennox-Gastaut syndrome)에서 주로 볼 수 있으며, 이 경우 예후 가 좋지 않은 편이다.
10분 이상 지속된다. 발작 중 정신(인식 상 태 포함)
발작 후 증상에는 발작의 형태, 뇌의 발생 부위가 영향을 준다. 발작이 멈추면 환자들은 두통, 근 육통, 이상한 감각, 혼란 및 극심한 피로를 느낄 수 있는데, 이러한 여파를 발작 후 상태라고 부른 다. 대부분 바로 회복되나 일부 환자는 회복하는데 수분에서 수 시간이 걸리기도 한다.
발작 후 의식, 감각, 감정, 생각의 변화에는 느린 반응, 혼동, 기억 상실, 말하고 쓰기 어려움, 멍 한 느낌, 어지럼증, 우울감, 놀란 상태, 불안감, 무서움, 좌절, 부끄러움, 당황함 등이 있다. 발작
후 신체 변화로는 두통, 근육통, 피로, 수면, 구역질, 구토 등이 동반될 수 있으며 발작 중에 신체
손상으로 피멍, 외상, 골절 등이 발생할 수 있다.
대부분의 환자는 발작 동안 무슨 일이 있었는지 기억하지 못하는 ‘발작 후 기억상실’을 경험한 다. 또한, 뇌전증이 있으면 정상인에 비해 우울증·불안장애와 같은 정신증상이 나타날 확률이
은데, 실제로 뇌전증 환자 5명 중 1명이 정신증상을 앓는 것으로 알려졌다. 뇌의 구조적 병변을
비롯해 항뇌전증약이나 수술로 인한 인지기능 장애가 발생하기도 한다.
뇌전증의 자연경과는 첫 번째 발작이 발생한 이후의 기간에 따라 달라지는데, 첫 번째 발작이 발 생한 이후 시간이 지남에 따라 재발률이 감소하는 것으로 알려져 있다. 약 절반 정도의 재발은 6 개월 이내에 발생하며, 재발
투여하면 첫 번
째 발작 후 2년 동안의 재발 빈도를 낮출 수 있으며, 이에 따라 증상의 완화 및 완치가 가능하다. 이러한 뇌전증 약물치료에 따른 예후는 예측하기 어려운데, 이는 뇌전증 중 50~60%가 이유나 기전이 불명인
증후군도 원인과 임상적 특성이 다양하기 때문이다. 지금까지 알려진 바로는 약 80%만이 약물치료에 효과를 나타내며, 약 20% 정도에서는 약물치료에 반응하지 않고 발작이 지속되는 난치성 뇌전증이 나타난다.
한편, 난치성 뇌전증은 ‘약물 난치성 뇌전증’으로 재정의할 수 있다. 항뇌전증약을 두 가지 이상 사용했음에도 무발작 상태에 도달하지 못한 환자를 ‘약물 난치성 뇌전증’ 환자로 분류한다. 하지
만 실질적으로 2가지의 약제를 복용하는 환자에 대하여 증상의 경감을 확인하기 어렵기 때문에 편의상 약물을 세 가지 이상 복용하고 있다면 약물 난치성 뇌전증 환자로 분류한다. 아직 약물 난
치성 뇌전증의 기전은 명확하지 않지만, 최초 뇌전증 발병 및 진단 나이와 연관이 있으며 첫 증
상 발발 시기가 이를수록, 치료 전 발작 횟수가 많을수록 약물 난치성 뇌전증으로 발전할 가능성 이 높다는 연구결과가 존재한다. 또한 뇌전증 증후군의 종류에 따라 약물치료효과가 달라지기도 하는데, 대표적으로 2-6세 사이의 소아에서 나타나는 레녹스가스토 증후군과 성인에서
발작 중, 발작 후 회복기간, 발작 사이 기간에 따라 발생하는 양상이 달라진다. 발작 중에는 불 안장애와 정신증이 우세하게 나타나며, 발작 후 회복기간에는 우울증이 자살충동과 함께 나타난 다. 발작 사이 기간에는 우울증과 정신증이 우세하게 나타나며, 특히 약물 난치성 뇌전증의 경우
우울증과 정신증이 나타날 확률이 높은 것으로 알려져 있다.
뇌전증의 합병증으로 나타나는 정신질환들은 뇌전증 발병 전부터 존재하며 뇌전증의 발병 요인
으로 작용할 수 있으며, 뇌전증의 증상 발현 도중에 발병할 수도 있다. 뇌전증과 정신질환 동시 치
료를 위해 항뇌전증약을 정신질환약들과 동시 처방할 때 카바마제핀이나 페니토인 등 1세대 항뇌
전증약들은 CYP450이나 UGT 효소의 활성 증가를 유도할 수 있기 때문에 항뇌전증의 약동학적
요소들을을 고려해야 한다. 추가적으로 치료 약물의 부작용으로 인해 정신질환 증상이 나타나기
도 하는데, 레베티라세탐의 경우 공격성이나 정신증을 유발할 수 있으며, 조니사마이드의 경우에 는 우울증, 정신증 등을 유발할 수 있다. 여러가지 요인들로 인해 뇌전증과 함께 나타난 정신 질
환 등은 복약 순응도에 영향을 미치거나 사고 확률 및 자살률을 높이는 요인으로 작용하기 때문 에 뇌전증과 동반된 정신신질환들을 관찰하고 알맞게 치료하는 것이 중요하다.
뇌전증으로 인한 가장 극단적인 증상은 뇌전증 돌연사이다. 이 증상은 SUDEP; Sudden Unexpected Death in Epilepsy 로도 불리며, 건강상태를 유지하던 뇌전증 환자가 돌연 사망하는
것을 말한다. 이는 적절히 치료되지 않은 뇌전증환자가 사망하는 주요 요인 중 하나로, 발작증세 와 밀접한 연관이 있는 것으로 알려져 있다. 뇌전증 돌연사로 인해 1년에 뇌전증 환자 1000명당 1명 이상이 사망한다. 이러한 뇌전증 돌연사의 기전으로 추측되는 것들 중 하나는 호흡정지인데, 뇌전증 환자의 발작이 일어날 때 무호흡증이 일어날 수 있다. 발작에 따른 무호흡증이 지속되면 심장과 뇌에 도달하는 산소의 양이 감소하며 사망에 이를 수 있으며, 무호흡증 이외에도 경련으로 인해 기도가 막혀 호흡정지가 일어나 질식사 할 수 있다. 심혈관계 또한 돌연사의 기전으로 작용 할 수 있는데, 발작 시 심장 리듬의 변화나 심장마비가 일어나 사망의 원인이 될 수 있다. 추가적 으로, 주요 생명유지 기관 장애는 발작으로 인한 영향으로 기관 자체가 손상을 입어 나타날 수도 있지만, 뇌전증으로 인해 생명유지 기관을 조절하는 뇌의 기능이 손상을 입어 나타날 수도
-뇌전증의 정의 및 분류
한국임상약학회. 2025. 약물치료학 6개정 제3권. 정지은. 뇌전증(p1273~1307). 신일북스
-뇌전증의 역학 및 위험 요인
질병관리청 국가건강정보포털. 뇌전증. Retrieved from https://health.kdca.go.kr/healthinfo/biz/health/ gnrlzHealthInfo/gnrlzHealthInfo/gnrlzHealthInfoView.do?cntnts_sn=5961
Fiest, K. M., Sauro, K. M., Wiebe, S., Patten, S. B., Kwon, C. S., Dykeman, J., Pringsheim, T., Lorenzetti, D. L., & Jetté, N. (2017). Prevalence and incidence of epilepsy: A systematic review and meta-analysis of international studies. Neurology, 88(3), 296–303. https://doi.org/10.1212/ WNL.0000000000003509
GBD Epilepsy Collaborators (2025). Global, regional, and national burden of epilepsy, 1990-2021: a systematic analysis for the Global Burden of Disease Study 2021. The Lancet. Public health, 10(3), e203–e227. https://doi.org/10.1016/S2468-2667(24)00302-5
Jeon, J. Y., Lee, H., Shin, J. Y., Moon, H. J., Lee, S. Y., Kim, J. M., & Epidemiology Committee of Korean Epilepsy Society (2021). Increasing Trends in the Incidence and Prevalence of Epilepsy in Korea. Journal of clinical neurology (Seoul, Korea), 17(3), 393–399. https://doi.org/10.3988/ jcn.2021.17.3.393
National institute od neurological disoreders and stroke. Epilepsy and Seizures. https://www.ninds. nih.gov/health-information/disorders/epilepsy-and-seizures
-뇌전증의 병태생리
정지은. (2025). 약물치료학 6개정 제3권. 한국임상약학회. 뇌전증(p1273~1307). 신일북스
질병관리청 국가건강정보포털. (2022-07-18). 뇌전증 [온라인 자료]. Retrieved from https://health. kdca.go.kr/healthinfo/biz/health/gnrlzHealthInfo/gnrlzHealthInfo/gnrlzHealthInfoView.do?cntnts_ sn=5961
Boleti, A. P. d. A., Cardoso, P. H. d. O., Frihling, B. E. F., de Moraes, L. F. R. N., Nunes, E. A. C., Mukoyama, L. T. H., Carvalho, C. M. E., Macedo, M. L. R., & Migliolo, L. (2024). Pathophysiology to risk factor and therapeutics to treatment strategies on epilepsy. Brain Sciences, 14(1), 71. https:// doi.org/10.3390/brainsci14010071
Jefferys, J. G. (2014). How does epileptic activity spread? Epilepsy Currents, 14(5), 289–290. https://doi.org/10.5698/1535-7597-14.5.289
Vera-González, A. (2022). Pathophysiological mechanisms underlying the etiologies of seizures and epilepsy. In S. J. Czuczwar (Ed.), Epilepsy [Internet]. Brisbane (AU): Exon Publications. Chapter 1. Available from https://www.ncbi.nlm.nih.gov/books/NBK580618/ https://doi.org/10.36255/exon-publications-epilepsy-pathophysiology
Wirrell, E., Tinuper, P., Perucca, E., & Moshé, S. L. (2022). Introduction to the epilepsy syndrome papers. Epilepsia, 63(7), 1330–1332. https://doi.org/10.1111/epi.17262
-발작 유형별 임상증상
김성철. (20??). 뇌전증의 모든 것(1). Retrieved from https://common.health.kr/shared/healthkr/pharmre view/%EB%87%8C%EC%A0%84%EC%A6%9D%EC%9D%98%20%EB%AA%A8%EB%93%A0%20 %EA%B2%83(1).pdf
대한뇌전증학회. (2025). 뇌전증 무엇이 궁금하십니까?. Retrieved from https://www.kes.or.kr/file/ info/2025_info_new.pdf
대한소아신경학회. (202?). 뇌전증. Retrieved from https://www.cns.or.kr/bbs/disease/ list?category=A&number=30#
서울대학교병원. (2022.05.20). 뇌전증 환자의 우울 불안, 체내 염증 반응과 관련 있다. 병원 뉴스. Retrieved from https://www.snuh.org/board/B003/view.do?viewType=true&bbs_no=5877#
서울아산병원. (20??). 뇌전증일반정보. Retrieved from https://www.amc.seoul.kr/asan/depts/ epilepsy/K/bbs.do?menuId=1401
질병관리청 국가건강정보포털. (2022.07.18). 뇌전증 [온라인 자료]. Retrieved from https://health.kdca.go.kr/ healthinfo/biz/health/gnrlzHealthInfo/gnrlzHealthInfo/gnrlzHealthInfoView.do?cntnts_sn=5961
Shin, Y. W. (2021). Epilepsy and Cognitive Impairment. Epilia: Epilepsy and Community, 3(1), 16-20.
MSD 매뉴얼 일반인용. (2024.01.04). 발작 장애. Retrieved from https://www.msdmanuals.com/ko/ home/
-뇌전증의 만성화와 합병증
김상은. (2021.09.14). 뇌전증 환자 30% ‘약물 난치성’ 소견…사회적 관심 필요. 약업신문. Retrieved from http://m.yakup.com/news/index.html?mode=view&nid=261106
서울대학교병원. 뇌전증. Retrieved from https://www.snuh.org/health/nMedInfo/nView.do?category=DIS&medid=AA000198
Epilepsy foundation. SUDEP. Retrieved from https://www.epilepsy.com/complications-risks/earlydeath-sudep
Kedare, J. S., & Baliga, S. P. (2022). Management of Psychiatric Disorders in Patients of Epilepsy. Indian journal of psychiatry, 64(Suppl 2), S319–S329. https://doi.org/10.4103/indianjpsychiatry. indianjpsychiatry_17_22
Roy, P. L., Ronquillo, L. H., Ladino, L. D., & Tellez-Zenteno, J. F. (2019). Risk factors associated with drug resistant focal epilepsy in adults: A case control study. Seizure, 73, 46–50. https://doi. org/10.1016/j.seizure.2019.10.020
김주연 kjy57103@naver.com
소채민 coa316550@gmail.com
안수연 sooyeonan0721@gmail.com
차윤아 yunacha423@gmail.com API
1. 뇌전증 진단 방법 및 최신 검사법
1) 진단 개요
뇌전증 진단 방법으로는 문진 및 병력청취, 뇌파검사, 뇌 영상 검사, 유전자검사가 있다. 그 중
에서도 가장 기초가 되는 것은 문진 및 병력청취이다. 발작의 빈도, 양상, 발현 시기, 유발 요인
을 파악하고 의식 소실, 자동증, 발작 후 혼란, 회복 시간 등의 특성을 확인할 수 있다. 이는 환 자 본인과 목격자의 진술이 매우 중요하다. 뇌전증의 진단 방법 중에서 가장 중요한 검사법은 뇌 파검사(EEG, electroencephalography)이다. 이외에도 뇌 영상 검사가 있으며, MRI, CT, PET, SPECT 등이 해당된다. 자기공명영상(MRI, Magnetic Resonance Imaging)을 우선적 으로 사용하며, 일부 특수한 뇌전증의 경우 양전자방출 단층촬영(PET), 단일광자방출 단층촬영 (SPECT)을 시행하여 뇌전증을 진단한다. 보조적으로 소아기 및 가족력 있을 때 주로 사용하는 유전자검사 및 생체표지자가 있다.
2) 증상에 의한 진단
(1) 문진 및 병력청취
뇌전증의 발작은 대부분 주변 상황과 무관하게 갑작스럽게 발생하며, 수 분 내로 서서히 회복된 다. 의료진이 발작 장면을 직접 관찰하는 경우는 드물기 때문에, 외래나 응급실에서 회복된 환자
를 통해 간접적인 정보를 얻는 경우가 많다. 발작 유무는 뇌전증 진단에 필수적이므로 문진과 병 력 청취가 뇌전증 진단의 가장 중요한 단계이다. 환자가 발작 시 기억이 불분명한 경우가 많지만, 전조 증상이나 주관적인 느낌이라도 전달 받는 것이 중요하다. 목격자가 존재하는 경우, 함께 내 원하거나 연락을 통해 당시 상황을 듣는 것 또한 중요하다. 의료진은 뇌전증 진단을 위해 발작 초 기의 전조 증상, 의식 소실 여부, 의사소통 가능 여부, 입맛을 다시거나 손으로 만지작거리는 자 동증, 시선이나 고개가 한쪽으로 돌아갔는지 등을 중점적으로 확인한다.
(2) 신체 및 신경학적 진찰 뇌전증이 의심되는 환자는
통해 다른
동반되어 있는지, 그리고 이러한 질환 이 발작의 원인과 관련이 있을 가능성을 평가해야 한다. 또한, 신경학적 진찰을 통해 감각, 운동,
반사 등의 신경 기능에 결손이 있는지 확인하고, 해당 이상이 발작과 연관되어 있는지를 살펴본 다. 진찰 과정에서는 실신, 일과성 허혈증, 심인성 발작 등 발작과 유사한 증상을 보이는 다른 질 환도 감별해야 한다. 실신은 혈압 저하 등으로 뇌에 일시적으로 혈류가 부족해 발생하는 의식 소 실 현상이다. 일과성 허혈증은 뇌로 공급되는 혈액의 흐름이 일시적으로 막혔다가 다시 이어져 순 간적으로 뇌가 쇼크 상태에 빠지는 현상이며, 심인성 발작은 심리적 이유로 발생하는 두근거림, 떨림, 호흡곤란 등이 동반되는 일시적인 발작증세를 의미한다.
3) 검사에 의한 진단
(1) 뇌파검사
① 뇌파검사(EEG, electroencephalography)
뇌파검사는 뇌의 어떤 부위에서 뇌전증파가 발생하는지를 확인하는 검사로서 뇌의 기능적 이상
을 파악한다. 뇌전증은 생리학적으로 대뇌피질세포의 전기적 과활성 상태이다. 따라서 두피에 붙
인 뇌파 전극을 통하여 간접적으로 뇌세포의 전기적 활동을 기록하는 것은 뇌전증 여부뿐만 아니 라 뇌전증 발작의 시작 위치, 그리고 뇌전증의 분류를
데 큰 도움을 준다. 대뇌피질에 서 자연적으로 발생하는 전기현상을 증폭하여 기록하는 방법으로 주파수와 크기 및 모양을 관찰 하여 뇌파를 판독한다. - 검사 방법
뇌파검사 시 환자는 침대에 누워서 20개 정도의 전극을 머리에 부착한 후, 이 전극을 뇌파기계 에 연결하여 뇌파를 기록한다. 하지만 뇌전증 환자라고 해서 항상 뇌전증파가 나오는 것은 아니 기 때문에 짧은 검사시간(30~40분) 동안 뇌전증파를 유도하기 위한 자극법이 사용되기도 한다.
대표적인 유발 방법은 다음과 같다.
• 수면박탈 뇌파검사 : 검사 전날 잠을 자지 않고 수면 부족 상태에서 검사
• 과호흡 유도 : 검사 중 깊고 빠른 호흡을 하게 함
• 광자극 검사 : 특정 주파수의 빛을 깜빡이며 자극
• 수면 중 뇌파 검사 : 환자를 수면 유도 후 검사 - 검사 시 주의사항
따라서 뇌전증이 의심되는 환자에서는 3회 정도 뇌파 검사를 반복하는 것이 일반적이다. 또한, 여러 차례 뇌파검사를 실시했음음에도 불구하고 약 20%정도는 뇌전증파를 기록하지 못한다. 이 외에도 뇌전증의 증상이 전혀 없고 가족력도 없는 정상인의 약 1~2%에서 뇌전증파와 비슷한 모
양의 뇌파가 관찰되는 경우가 있다. 특히 소아에서 이러한 뇌파가 더 자주 관찰되어 판독이 어렵 다. 뇌전증파가 드물게 나타나 이상소견이 없거나 뇌전증의 수술적 치료를 위해 뇌전증 시작 부
위를 국소화해야 할 필요가 있을 경우 비디오뇌파검사를 시행한다.
② 비디오-뇌파 검사(Video-EEG)
비디오-뇌파검사는 뇌전증 발작의 정확한 형태와 시작 부위를 파악하기 위한 정밀 검사이다. 이
검사는 뇌전증 진단뿐만 아니라, 수술 여부를 결정하거나 적절한 치료법을 선택하는 데 중요한
정보를 제공한다. 이를 위해 특수하게 설비된 소규모 병동에 입원하며, 24시간 내내 환자를 관
찰하는 전문적 간호사와 의료기사가 있다. 발작 시 녹화된 비디오와 뇌파기록을 분석하여 뇌전증
발작의 형태를 진단하고, 뇌전증 발작이 시작되는 위치를 분석한다. 환자의 경련 발생이 얼마나
빨리 관찰되느냐에 따라 짧게는 2일에서 길게는 2주동안 입원하게 된다. 항뇌전증제를 복용하고
있는 경우에는 용량을 줄이거나 약물 복용을 중단한 상태에서 발작을 기록하고, 필요에 따라서는
수면 박탈이나 운동 등 증상을 유도하기 위한 시도를 하게 된다.
(2) 영상검사
① 자기공명영상(MRI, Magnetic Resonance Imaging)
뇌전증의 진단 과정에서 뇌 영상검사, 특히 MRI는 EEG(뇌파검사)와 함께 가장 핵심적인 검사 로 간주된다. MRI는 뇌전증의 원인을 파악하는 데 매우 중요한 역할을 하며, 주로 구조적 병변 유무를 확인하는 데 사용된다. MRI를 통해 발견할 수 있는 병리적 변화에는 측두엽뇌전증의 주요 원인인 해마경화, 해면혈관종, 동정맥기형 등 혈관성 병변, 뇌연화증, 뇌피질 발달기형, 뇌종양, 기생충 감염, 뇌 염증 등이 있다. MRI에서 병리적 이상이 발견될 확률은 초기 진단을 받은 환자 에서는 약 10~30%이며, 약물 치료에 반응하지 않는 난치성 뇌전증 환자에서는 약 60%까지 증 가하는 것으로 보고되어 있다. 초기 환자에서 발견 확률이 낮은 이유는, MRI가 주로 증후성(구조 적 원인에 의한) 뇌전증을 확인하는 목적으로 시행되기 때문이며, 특발성(원인이 명확하지 않은) 또는 잠재적 뇌전증은 영상 상에서 이상이 보이지 않을 수 있다. 따라서 뇌전증 환자라면 최소 1 회 이상 MRI를 촬영하는 것이 권장되며, 보통은 증후성 원인을 배제하거나 확인하기 위한 용도 로 활용된다. 다만, 임상적으로 확실한 양성 부분 뇌전증 및 특발성 전신 뇌전증과 같이 MRI 시
행이 진단에 큰 영향을 미치지 않는 경우에는 생략되기도 한다.
② 양전자방출 단층촬영(PET, Positron Emission Tomography)
사람의 뇌는 포도당만을 주요 에너지원으로 사용하기 때문에, 뇌의 포도당 대사 상태를 측정하 면 각 부위의 기능적 활동 여부를 알 수 있다. PET 검사는 방사성 동위원소를 포도당에 결합시
켜 체내로 주입하여 뇌에서 포도당 대사가 얼마나 잘 이루어지고 있는지를 평가하는 검사이다.
이때 뇌전증의 원인 부위는 일반적으로 포도당 대사가 저하되어 있는 양상을 보인다. MRI 검사
에서 뚜렷한 이상이 발견되지 않더라도, PET 검사를 통해 뇌전증 병변의 위치를 어느 정도 추정
할 수 있다.
③ 단일광자방출 단층촬영(SPECT, Single-Photon Emission Computed Tomography) SPECT 검사는 뇌의 혈류 상태를 확인하는 핵의학 영상검사로, 뇌전증의 원인 부위를 찾는 데 활용된다. 일반적으로 뇌전증 발작이 발생하면 발작을 유발하는 뇌 부위의 혈류가 일시적으로 증
가하는데, SPECT는 이러한 변화를 포착해 병소를
많은 부위가 붉은색으로 나타나며, 이를
수 있다.
반면, 발작이 없는 시기에는 뇌전증 병소의 혈류와 대사 활동이 오히려 감소된 양상으로 보인다.
따라서 발작이 있는 동안 촬영을 시행하면 병소의 위치를 보다 민감하게 파악할 수 있다. 하지만 뇌혈류의 정상 분포가 사람마다 다르기 때문에 영상 판독이 쉽지 않아, SPECT는 특히 측두엽외
뇌전증의 경우 병소 진단률이 50~60% 수준에 머물며 민감도가 높지 않다. 이러한 이유로 뇌전
증 환자의 일반적인 진단 과정에서는 SPECT의 활용도가 상대적으로 낮고, 주로 뇌전증 수술 전
평가나 특수한 상황에서만 시행된다.
(3) 신경심리학적 검사
① 신경심리검사
신경심리검사는 환자의 지능, 사고력, 언어 능력 등 종합적인 인지 기능과 함께 정서 상태를 평
가하는 검사로, 뇌전증 수술 전 평가에 중요한 역할을 한다. 이 검사를 통해 전두엽, 측두엽, 두 정엽, 후두엽 등 각 뇌 부위의 기능을 파악할 수 있으며, 환자가 겪고 있는 우울감이나 불안감 등 의 정서적 문제도 정확하게 파악할 수 있다. 이러한 정보를 바탕으로 기억력이나 지능 저하 여부 를 평가함으로써, 발작을 유발하는 뇌 부위의 위치를 추정하고 수술 후 기억력 변화 가능성을 예 측하여 수술 후 발생할 수 있는 후유증을 예방하는 데에도 유용하다.
② 와다 검사(Wada Test)
와다 검사는 뇌전증 수술 전 평가를 위해 시행되는 검사로, 약 2박 3일간 입원하여 진행된다. 이 검사는 좌우 뇌를 각각 일시적으로 마취시킨 상태에서 언어 기능과 기억력을 평가함으로써, 언어
와 기억을 담당하는 뇌 부위가 어느 쪽 반구에 위치해 있는지를 확인하는 것이 목적이다. 시술은
혈관 조영술을 이용해 뇌의 주요 동맥에 약물을 주입하여 한쪽 뇌의 기능을 잠시 차단한 뒤, 언어
이해 및 표현, 기억력 유지 여부를 살펴보는 방식으로 진행된다. 수술 후 언어 장애나 기억력 저
하와 같은 인지 기능 손상을 미리 예측하고 예방하기 위해 매우 중요한 검사이며, 경우에 따라 뇌
전증 병소의 위치를 보다 정밀하게 파악하는 데에도 도움이 된다.
(4) 유전자검사 및 생체표지자
뇌전증 진단에 있어
데 활용된다. 특히 소아 뇌전증 증후군에서는 차세대염기서열분석법(NGS, Next Generation Sequencing)을 이용한 유전자 패널 검사가 널리 사용된다. NGS는 수십에서 수백 개의 유전 자를 동시에 분석하는 기술로, DNA를 작은 조각으로 나눈 뒤 특정 염기서열을 가진 올리고뉴 클레오티드를 부착해 라이브러리를 제작하고, 이를 장비로 읽어 데이터를 생성한 후 알고리즘으 로 분석하는 과정을 포함한다. 이 방법은 기존 검사에 비해 시간과 비용 면에서 효율적이며, 대
량의 유전체 정보를 신속하게 얻을 수 있다. 최근 세브란스 주최 연구에서는 원인이 명확하지 않 은 뇌전증 환자 957명을 대상으로 진단용 엑손 시퀀싱과 NGS 패널 검사를 시행하였다. 그 결과 약 32%에서 뇌전증 관련 유전자의 이상이 발견되었으며, 흔히 변이가 나타나는 11개 유전자 중 하나 이상의 변이가 확인된 환자는 47%에 달했다. 진단율은 환자의 증후군 유형과 나이에 따라
차이를 보였다. 특히 생후 1년 이내에 시작되는 희귀 난치성 뇌전증인 드라벳 증후군 환자에서
는 SCN1A 유전자 변이가 진단의 주요 표지로 작용했다. 이처럼 유전자 검사는 뇌전증의 원인을
밝히고, 뇌전증의 진단율을 높이며, 맞춤형 치료 계획을 수립하는 데 중요한 역할을 하고 있다.
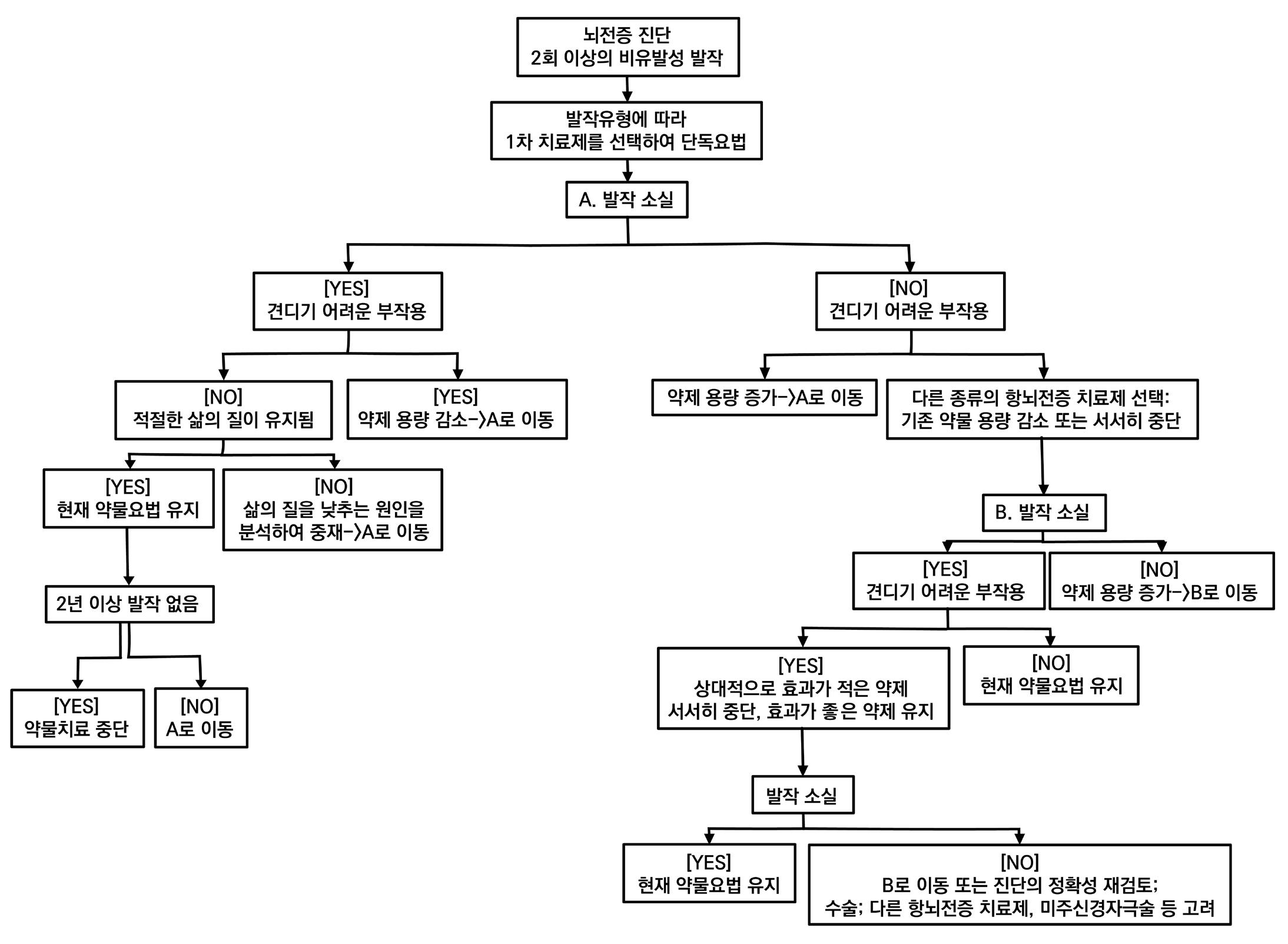
1. 발작 유형별 1차 치료제 선택 기준
1차 치료제는 특정 질병에 대해 가장 우선적으로 사용되는 약물로, 적절한 약물을 선택할 시 치
료 효과가 증가하고 부작용이 감소된다는 장점이 있다. 특히 항뇌전증에서 약물 치료 실패의 주
된 원인은 부작용이므로 적절한 1차 치료제 선택이 중요한 과제가 될 것이다. 뇌전증의 1차 치
료제는 ILAE(국제), KES(한국), NICE(영국), AES(미국) 등의 다양한 기관에서 제시하고 있다.
우선 뇌전증은 비유발성 뇌전증발작이 반복적으로 일어나는 만성적인 상태를 의미한다. 여기서
비유발성 뇌전증발작(비유발 발작)이란, 뇌전증을 일으킬 수 있는 급성 병인이 없이 생기는 발작 을 의미한다. 이러한 뇌전증은 임상양상과 뇌파소견에 따라 국소발작(partial epilepsy)와 전신 발작(generalized epilepsy)로 분류하게 된다.
뇌전증 관련 각 기관에서는 각자의 가이드라인을 통해 첫 비유발 발작 증상, 즉 처음으로 뇌전증 증상이 나타났을 때의 일차적 단독요법 및 부가치료 약물을 제시하고 있다. 각 기관 모두 ‘국소발
작‘ 또는 ’전신발작’으로 발작의 유형을 구분하였고, 특히 ILAE와 AES(AAN)에서는 등급에 따 라 약물을 추가로 분류하였다. ILAE에서는 ‘초기 단독요법으로서의 효능’이, AES에서는 ’약물 의 효과성과 유해성‘이 그 기준이다.
뇌전증 분류 KES (2015) ILAE (2013) AAN (2004) AAN (2018 update) NICE (2022)
(성인)
1차 추천: -Carbamazepine -Oxcarbazepine -Lamotrigine
부가 치료: -Levetiracetam -Valproate
(성인)
Level A
-Carbamazepine
-Phenobarbital
-Phenytoin
-Levetiracetam
-Zonisamide
Level B
-Valproate
Level C
-Gabapentin
-Lamotrigine
-Oxcarbazepine -Topiramate -Vigabatrin
Level D
-Clonazepam -Primidone
(노인)
Level A
-Lamotrigine -Gabapentin
국소발작
Level C
-Carbamazepine
Level D
-Valproate
-Levetiracetam
-Topiramate
(소아)
Level A
-Oxcarbazepine
Level C
-Carbamazepine
-Phenobarbital
-Phenytoin
-Valproate
-Topiracetam -Vigabatrin
Level D
-Lamotrigine -Zonisamide -Clobazam
(성인 및 노인)
Level A
-Carbamazepine
-Phenytoin -Valproate -Gabapentin -Lamotrigine
-Oxcarbazepine
-Topiramate
Level U
-Levetiracetam
-Zonisamide
(성인 및 노인)
Level B
-Lamotrigine: 60
세 이상 성인에서
Carbamazepine-IR
보다 효과 및 안전
성 우수
Level C
-Gabapentin: 60
세 이상 성인에서
Carbamazepine-IR
보다 효과 및 안전
성 우수
-Zonisamide: CarbamazepineCR보다 효과 우수
-Vigabatrin: Carbamazepine-IR
보다 효과 낮고, 독성
증가로 1차약으로 추 천하지 않음
-Pregabalin: Lamotrigine에 비해 효과 낮음
Level U
-Gabapentin, Oxcarbazepine, Topiramate: Carbamazepine을
대체하는 것에 대한 근 거 불충분
-Topiramate: 응급 처치시 Phenytoin을 대체하는 것에 대한 근 거 불충분 -Clobazam, Vigabatrin, Felbamate: 근거 불 충분, 양질의 연구결 과 필요 (소아) -Topiramate: 400mg/일이 50mg/일보다 효과적 이나 추천하지 않음
(성인 및 노인, 소아)
1차 단독요법: -Lamotrigine -Levetiracetam
1차 단독요법 실패시
2차 단독요법: -Carbamazepine -Oxcarbazepine -Zonisamide
2차 단독요법 실패시
3차 단독요법: -Lacosamide
단독요법 실패시 부가 치료제: -Carbamazepine -Lacosamide -Lamotrigine -Levetiracetam -Oxcarbazepine -Topiramate -Zonisamide
1차 부가치료 실패시
2차 부가치료제: -Brivaracetam -Cenobamate -Eslicarbazepine, Perampanel. Pregabalin.
Valproate (가임기 여성 제외)
2차 부가치료 실패시
3차 부가치료제: -Phenobarbital -Phenytoin -Tiagabine -Vigabatrin
전신발 작
전신 강 직간대 발작
(성인)
1차 추천: -Valproate -Lamotrigine -Carbamazepine
(성인)
Level A: 없음
Level B: 없음
Level C
-Carbamazepine -Lamotrigine
-Oxcarbazepine -Phenobarbital -Phenytoin -Primidone -Topiramate -Valproate
Level D -Gabapentin -Vigabatrin
(소아)
Level A: 없음
Level B: 없음
Level C -Carbamazepine
-Phenobarbital -Phenytoin
-Topiramate -Valproate
Level D -Oxcarbazepine
(소아)
1차 추천: -Ethosuximide -Valproate -Lamotrigine
부가 치료: -1차 약물 중 2가 지 병용
소발작
(소아)
Level A -Ethosuximide -Valproate(소아)
Level A -Ethosuximide -Valproate
Level C -Lamotrigine
(성인)
-Lamotrigine, Topiramate: Valproate와 효과 비교 근거 불충분
(소아) -Lamotrigine: Ethosuximide, Valproate에 비해 효과적이지 않음. 그러나 주의결핍은 Valproate에서 더 흔하게 발생
(성인 및 소아) 1차 단독요법: -Valproate ( 단, 가임기 여성 은 Lamotrigine, Levetiracetam)
Valproate 치료실 패시 2차 단독요법: -Lamotrigine -Levetiracetam
단독요법실패시 부 가 치료제: -Clobazam, Lamotrigine, Levetiracetam, Valproate(가 임기여성제외), Perampanel, Topiramate
1차 부가치료 실패 시 2차 부가치료제: -Brivaracetam, Lasomamide, Phenobarbital, Primidone, Zonisamide
소아)
1차 치료제: -Ethosuximide
1차 치료실패시 2 차 단독요법: -Valproate (가임 기 여성제외)
2차 단독요법 실패 시 3차 단독요법 또 는 부가치료제: -Lamotrigine -Levetiracetam
다른 발작 유형을 동반한 소발작의 경 우 1차 치료제 -Valproate (단, 가임기 여성 은 Lamotrigine, Levetiracetam)
근간대 발작
1차 추천: -Valproate -Levetiracetam -Topiramate
무긴장 발작
1차 추천: -Valproate
부가 치료: -Lamotrigine
1차 추천: -Valproate
부가 치료: Lamotrigine
1차 치료제: -Valproate ( 단, 가임기 여성은 Levetiracetam)
1차 치료실패시 2 차 단독 또는 부가 요법: -Levetiracetam
3차 단독 또는 부 가요법: -Brivaracetam, Clobazam, Clonazepam, Lamotrigine(때 떄로, 근간대발작 악화가능성 있음), Phenobarbital, Topiramate, Zonisamide
1차 치료제: -Valproate (단, 가임기 여성은 Lamotrigine)
1차 치료 실패시 2 차단독 또는 부가 요법: -Lamotrigine
3차 단독 또는 부 가요법: -Clobazam, Rufinamide, Topiramate
뇌전증 분류
전신발작 부가요법
소발작 부가요법
KES (2021) AAN (2004) AAN (2018 update)
(성인)
Gabapentine, Lamotrigine, Levetira cetam, Oxcarbazepine, Topiramate, Zonisamide, Clobazam, Eslicarbazepine, Lacosamide, Perampanel, Pregabalin, Rufinamide, Vigabatrin, Cenobamate, Brivaracetam
(소아)
Lamotrigine, Levetiracetam, Oxcarbazepine, Topiramate, Zonisamide
(성인)
Lamotrigine, Levetiracetam( 서방정), Oxcarbazepine, Topiramate, Eslicarbazepine
(성인 및 소아) -Levetiracetam, Topiramate
(소아) -Lamotrigine
-레녹스-가스토: Lamotrigine, Topiramate, Rufinamide, Canabidiol
-드라베 증후군: Canabidiol
(성인)
Level A -Gabapentin, Lamotrigine, -Levetiracetam, Oxcarbazepine, -Topiramate, Zonisamide
(소아)
Level A -Gabapentin, Lamotrigine -Oxcarbazepine, Topiramate
(성인)
Level A
-Perampanel, Pregabalin: 효과
적임 -Rufinamide, Vigabatrin: 효과
적이나 이점 적으므 로 1차 선택 배제
Level B -Topiramate XR, Eslicarbazepine, Lacosamide
Level C -Oxcarbazepine XR, Clobazam
(소아)
Level B -Levetiracetam, Oxcarbazepine -Zonisamide
(성인)
Level A -Oxcarbazepine, Topiramate
Level B -Lamotrigine
(성인)
Level C -Eslicarbazepine
(성인 및 소아)
Level B -Lamotrigine, Levetiracetam
ILAE 2013 Levels of Evidence : 초기 단독요법으로서의
Level A: Established as efficacious or effective as initial monotherapy
Level B: probably efficacious or effective as initial monotherapy
Level C: possibly efficacious or effective as initial monotherapy
Level D: potentially efficacious or effective as initial monotherapy
AAN: 2004, 2018 Levels of Evidence : 약물의 효과성과
Level A: established as effective, ineffective or harmful for the given condition in the specified population
Level B: probably effective, ineffective or harmful for the given condition in the specified population
Level C: possibly effective, ineffective or harmful for the given condition in the specified population
Level U: data Inadequate or conflicting
Level A : 초기 단독요법으로서 효과적인 것으로 입증 됨
Level B : 초기 단독요법으로서 효과적일 것으로 예상 됨
Level C : 초기 단독요법으로서 효과적일 수 있음
Level D : 초기 단독요법으로서 효과적일 가능성이 있 음
Level A : 특정 집단에서 주어진 조건에 대해 효과적이 거나 효과적이지 않거나 해로운 것으로 입증됨
Level B : 특정 집단에서 주어진 조건에 대해 효과적이 거나 효과적이지 않거나 해로울 것으로 예상됨
Level C : 특정 집단에서 주어진 조건에 대해 효과적이 거나 효과적이지 않거나 해로울 수 있음
Level D : 데이터가 불충분하거나 상충됨
뇌전증 진단 시 환자의 발작 유형 및 뇌전증 증후군의 종류, 동반질환, 나이와 성별을 고려한 이
상반응 프로파일, 약물상호작용, 복용방법의 용이성과 비욜, 빠른 치료효과 도달의 필요성, 사
회적 활동 등을 추가로
적절한 약물을 사용하여야 할 것이다.
1) 성별에 따른 치료 전략의 수립 : 여성
여성의 경우 생리주기, 피임, 임신, 수유, 폐경기 등 생리적 특수성을 보이며, 여성 뇌전증 환자
에서는 생식 기능의 감소와 다낭난소증후군 발병률의 증가가 추가적으로 나타나기 때문에 더욱
다양한 부분을 고려해야 할 필요가 있다. 본 학회지에서는 생리적 특수성에 따라 월경, 피임, 임
신, 폐경기로 분류하여 뇌전증 치료 시 주의해야 할 점을 작성하였다.
(1) 월경
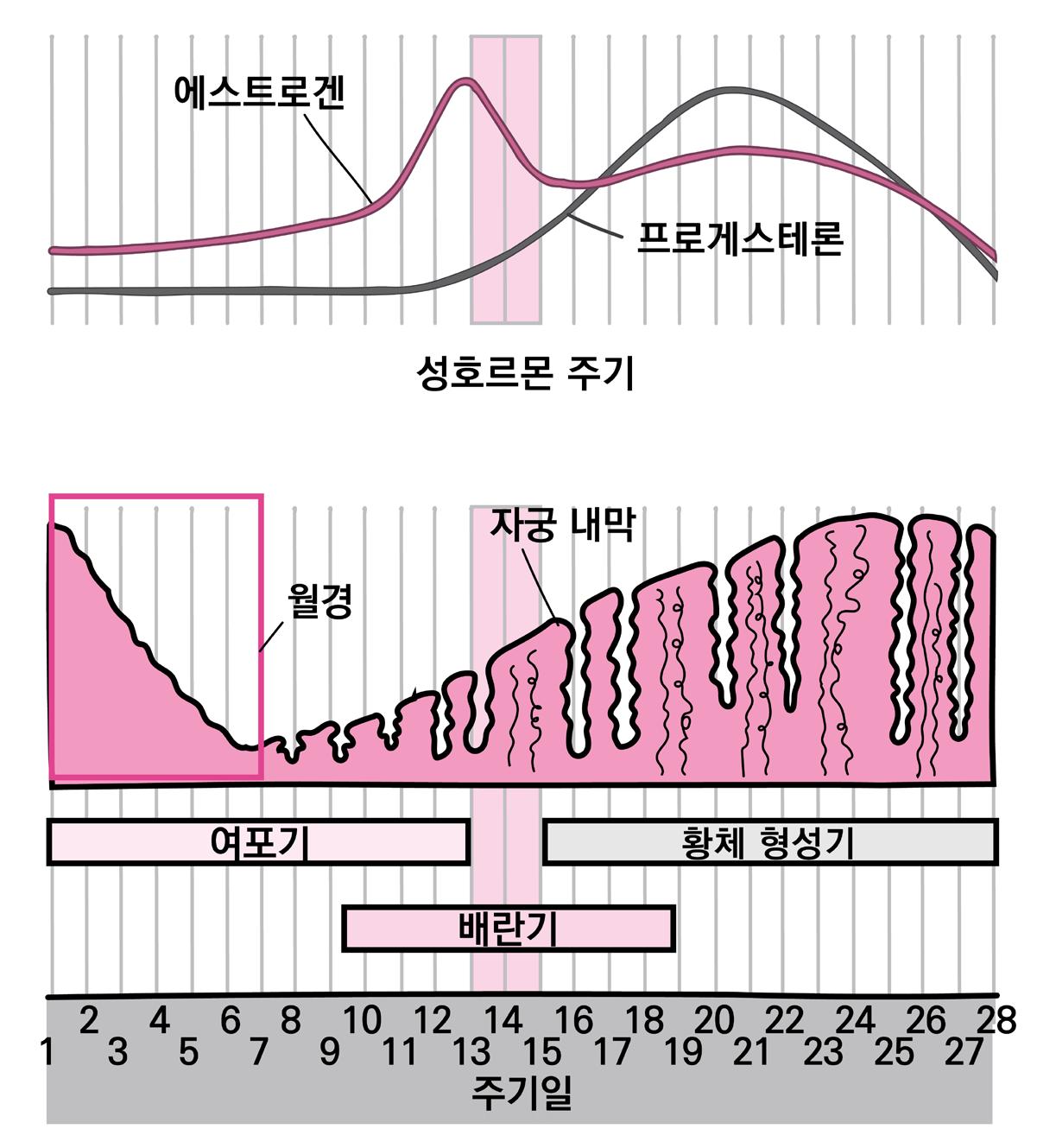
Estradiol은 NMDAR과 cystosolic neuronal estrogen receptor를 매개로 하여 신경세포
의 흥분성을 증가시키고, Progesterone은 GABA와 adenosine의 작용과 nicotine ACh R을
매개로 하여 신경세포의 흥분성을 저하시킨다. 월경과 관련하여서는 주기에 따라 혈중 Estradiol
및 Progesterone의 비율이 변화하게 되며, 항뇌전증약 농도가 감소하는 경향도 관찰된다. 이러 한 경향으로 인해 여성 뇌전증 환자의 10% 이상에서 ‘월경성 뇌전증’ (월경 주기에 따라 발작 빈
도가 증가하는 현상)이 나타나게된다.
현재 월경성 뇌전증에 대해 확실하게 효과가 입증된 치료제는 없지만 황체기에 Progesterone
이나 그 대사체, 혹은 Estrogen antagonist를 투여하는 등의 호르몬 요법과 Acetazolamide
나 Clobazam을 투여하는 등의 비호르몬 요법을 치료법으로 고려해볼 수 있다. Acetazolamide
가 탄산무수화효소 억제제로 작용함으로써 뇌의 pH와 이온 조성을 변화시켜 신경세포의 흥분성
을 감소시킬 수 있고, Clobazam은 GABA 수용체에 작용하여 Cl-이온통로 개폐 빈도 증가에 영
향을 미쳐 신경세포 억제를 촉진할 수 있다.
약물 불응성 월결성 뇌전증일 경우에는 Gonadotropin releasing hormone analogue를 투
여할 수 있지만, 한 연구에 의해 초기 3주간 발작 빈도가 증가된 후 발작 빈도 감소 효과가 나타
남이 관찰되어 주의가 필요하다.
(2) 피임
피임약을 복용 중일 때에는 피임약의 주성분인 Estrogen, Progestin의 대사를 증가시키는 효
소 유도 항뇌전증약(Carbamazepine, Oxcarbazepine, Phenytoin, Phenobarbital, Primidone 등)을 병용할 경우 피임약 혈중 농도가 50% 이상 감소될 가능성이 있다. 따라서 약물 상
호작용이 없는 항뇌전증약을 우선 복용해야 하며, 고용량 Estrogen(50-100ug)을 포함하는 경 구 피임약을 복용하거나 차단식 피임법, 자궁내 장치를 사용하는 등 권장되는 방법으로 피임하
는 것이 좋다. 특히 Lamotrigine은 복합 호르몬 경구피임약과 병용할 경우 피임 효과가 감소되
는 것은 물론 Lamotrigine의 혈중 농도 또한 감소되기 때문에 발작이 악화될 가능성이 있어 주 의가 필요한 약물이다.
(3) 임신
임신 중에는 약물 통태학적 예측이 힘들고 약물 복약순응도가 떨어질 경우 발작이 증가할 수 있
다. 따라서 혈중 약물 농도를 상시 모니터링해야 하며, 태아에게 영향을 끼치는 약물이 일부 존재 하기 때문에 이러한 약물 사용 시 특히 주의가 요구된다. Valporic acid(태아기형 위험), Phenytoin 및 Carbamazepine(구순열 위험), Phenobarbital(심장기형 및 인지기능 이상 초래의 위험)의 약물은 사용을 조심해야 하며, 임신 가능성이 있는 여성의 경우 최기형성 예방을 위해 엽산 보조제를 복용하고 임신 마지막 달에는 신생아 출 혈 장애 예방을 위해 Vitamin K를 투여받아야 한다.
(4) 폐경
폐경기 전후에는 급격한
요에 따라 호르몬
다. 단, Lamotrigine의 경우 약물의 혈중 농도가 20-30% 감소할 수 있기 때문에 혈장 농도 및
용량에 대한 고려가 필요하다.
2) 나이에 따른 치료 전략의 수립 : 노인 및 소아
노인 및 소아에서는
수립에 주의가 필요하다. 노인의
변화하는 경향이
[표 5] 노인에서의 약동학적 변화 노화 관련 약동학적
혈청 단백결합 감소, 지방친화약물의 분포용적 증가, 약물대 사경로의 효율 저하, 약물의 신청소율 저하, 제거반감기의 연 장, 간용적 감소 및 혈류 감소 등이 나타날 수 있음
Phenytoin, Valproate : 모두 단백 결합의 경향이 높으므로
용량 조절과 함께 사용할 것
Lamotrigine : 주로 간에서 대사되므로 청소율이 감소된 노 인에서는 용량 줄여 사용할 것
뇌전증 치료제의 경우 부작용으로 저나트륨혈증이 나타나는 경우가 다수이므로 이뇨제 복용 시 주의가 필요함
Carbamazepine : Erythromycin, Fluoxetine 등 CYP3A4 저해제 같이 복용 시 혈중 농도 증가
Topiramate : Carbamazepine, Phenytoin에 의해 대사 촉진
Gabapentin : 약물 상호작용이 거의 없는 약물이지만 신장 에서 배설되므로 신기능 감소 시 용량 줄여 사용할 것
청소년의 경우
뇌전증 치료에 있어 목표는 발작의 관리, 치료 부작용의 최소화, 삶의 질 유지 및 향상을 들 수
있다. 적절한 치료제를 사용하여 발작 횟수와 부작용 발생 간 균형을 맞추는 것이 필요하다. 첫
비유발 발작이 발견된 경우 뇌전증 여부의 정확한 진단, 발작의 재발 가능성 및 위험 정도와 장기
적 예후에 미칠 수 있는 영향을 정확히 고려해 손익을 따지고, 발작이 재발할 경우 환자가 겪게 될
정신사회적 및 법률적 문제들을 고려해 약물 치료 시작 여부를 결정하여야 한다.
초기 치료 실패 시 치료를 조절할 수 있으며, 1가지 약물을 최대용량으로 투여함에도
절되지 않는 경우 진단의 정확성, 약 선택의 적절성 등을 점검한 후 병용요법 또는 교체를 통한 단독요법 중 한 가지를 선택하여 진행할 수 있다.
병용요법을 선택한 경우 발작의 빠른 조절을 유도할
작용을 고려해야 한다. 교체를 통한 단독요법을 선택할 경우 두 번째 약을 추가하여 유지용량까
지 증량한 후 첫 번째 약을 점진적으로 줄여 중단하여야 한다.
치료 이후 증상이 만족스럽게 조절되면 뇌전증 치료제의 중단을 고려할 수 있다. 증상 조절이 적 절하게 되었다고 보는 기간은 나이에 따라 구분할 수 있는데, 소아의 경우 2년, 성인의 경우 3년 동안 뇌전증 발작이 나타나지 않으면 투여 중지를 고려하게 된다.
투여 중지 고려 시에는 사회 활동 및 운전 등의 문제가 생길 수 있으므로 충분한 심사숙고가 필 요하며, 뇌전증 재발의 가능성이 소아에서 30%, 성인에서 40-50% 정도 존재하므로 이에 대 한 주의도 필요하다. 만약 뇌전증이 재발하였다면 치료제를 다시 투여하면 90%의 경우에서 조 절이 가능하다.
뇌전증 치료제 투여 중지 후에도 수년간 증상이 나타나지 않으면 뇌전증 완치를 판정받게 된다.
한다.

(Phenobarbital)이다. 이는 1912년에
1962년 ‘Kefauver-Harris Amendment’가 제정되기 전이므로
물 예외조항에 따라 합법적으로 유통될 수 있었다. 이후 도입된 페니토인(Phenytoin), 발프로 산(Valproate) 등도
예방과 같은 부가적 효과도 보 였다.
그러나 이러한 약물들은 심각한 부작용과 복잡한 약동학적 특성으로 인해 한계를 드러냈다. 대 표적으로 진정, 인지기능 저하, 골다공증 유발
Carbamazepine 1974.07. 국소발작, 전신발작(소 발작 제외)의 단독 및 부가요법
Clonazepam 1976.06.
Clonazepam
Phenytoin 1963.11.
Valporate 1978.02.
10세 이상 국소발작
및 다양한 종류의 전 신발작에 단독 또는
부가요법
10세 이상
Sodiumchannel 길항 복시, 졸음, 오심, 진정, 구역, 구토 양극성장애, 삼차
악화 위험
Sodiumchannel 길항
실조, 복시, 졸음, 진정, 빈혈
이러한 약물들은 내약성이 개선되어 장기 복용 시 환자 순응도를 높였으며, 복잡한 병용약물 조 합에서도 비교적 안전하게 사용될 수 있었다. 또한 삶의 질 향상에 기여함으로써, 단순히 발작을 억제하는 수준을 넘어 환자의
주었다.
[표 7] 2세대 뇌전증 치료제
약제이름 FDA 승인일
Felbamate 1993.07.
14세 이상 국소발작
단독 또는 부가요법
2~14세 국소발작 및 레녹스가스토 증후 군 부가요법
Gabapentin 1993.12.
Lamotrigine 1994.12.
3세 이상 국소발작의 부가요법
glutamate 수용 체 차단
신기능 저하자 사 용주의
거식증, 구역, 구토, 불면, 두 통 간기능 저하자 금기
여성 및 혈구감소 증 병력 시 비가역
적 치명적 재생불 량성 빈혈 위험
2주 내로 작용 발 현
정확한 기전x (Calcium channe의 α2δ subunit에 작용)
2세 이상 국소발작, 근간대발작, 레녹스 가스토 증후군 부가 요법
16세 이상 국소발작 단독요법
4세 이상 국소발작
Levetiracetam 1999.11.
Oxcarbazepine 2000.01.
12세 이상 청소년 간 대발작
6세 이상 전신발작 부가요법
4세 이상 국소 발작 단독 및 부가요법 2-4세 국소발작의 부가요법
2세 이상 국소발
작, 전신 근간대발 작의 단독요법 및 부
Topiramate 1996.12.
가요법
2세 이상의 레녹스
가스토 증후군 부가
요법
Zonisamide 2000.03.
성인 국소발작의 부
가요법
Sodiumchannel 길항
졸음, 진정, 말 초부종, 체중 증가
GABA 유사체 but GABA 수용체에 작용x 대상포진 후 신경통 동반자에 유용 약물상호작용 적음
2주 내로 작용 발 현
복시, 졸음, 진 정, 두통, 불면
양극성 장애 동반 환자에 유용 피부발진 위험성으 로 서서히 증량함
정확한 기전x (SV2A에 작용)
졸음, 어지러 움, 우울, 흥분 성행동
Sodiumchannel 길항
졸음, 두통, 어 지러움, 구역, 구토
타 항경련제와 약 물상호작용x 우울, 불안증상 악화
양극성 장애 동반 환자에게 유용 저나트륨혈증이 빈 번하므로 주의 및 모니터링이 필요
Sodiumchannel 길항
복시, 어지러움, 졸음, 핍뇨, 체 중감소 편두통, 비만 동반 환자에게 유용 인지기능저하 환자 는 금기
신기능에 따른 용 량조절 필요
2주 내로 작용 발
Sodiumchannel 및 calciumchannel 길항
어지로움, 졸음, 대사성 산증, 핍
뇨, 체중감소, 신장결석
현
진전(tremor) 동반 환자에게 유용
설파제 알레르기 환 자는 금기
3세대 치료제는 기존 약물에 불응하는 환자군(난치성 뇌전증: 전체 환자의 약 20~30%)을
대상으로 새로운 치료 가능성을 제시하고 있다. 페람파넬(Perampanel), 라코사미드(Lacosamide), 브리바라세탐(Brivaracetam) 등은 단순한 증상 억제를 넘어, 작용기전의 다변화와 내
약성 강화, 약물상호작용 최소화 등 다방면에서 진보된 특성을 지닌다.
라코사미드는 느린 나트륨채널 비활성화를 촉진하며 기존 나트륨채널 차단제와는 다른 방식으 로 신경 과흥분을 억제한다. 페람파넬은 비경쟁적 AMPA 수용체 길항제로, 흥분성 신경전달을
차단하는 새로운 기전을 가지고 있다. 또한 이들 약물은 SV2A 단백질과의 결합력을 더욱 강화하 여, 기존 치료제로는 조절되지 않던 난치성 뇌전증 치료에 효과를 보이고 있다.
임상적으로는 인지기능 저하 및 진정 효과가 적어 장기 사용의 가능성이 높으며, 일부는 신경보 호(Neuroprotection) 효과까지 기대되고 있다. 더불어, 약물대사에 대한 영향이 적어 약물 간
상호작용을 최소화할 수 있어, 복합치료에 적합한 형태로 평가받고 있다. 다만 비용 면에서는 기 존 제네릭 제제보다 높은 편이며, 일부 약물은 유사한 효과에도 불구하고 1차 치료제로 채택되기
어려운 현실적인 제약도 존재한다.
[표 8] 3세대 뇌전증 치료제
약제이름 FDA 승인일 주요 적응증 작용기전
Brivaracetam 2016.02.
Clobazam 2011.10.
4세 이상 국소발작
의 단독요법 및 부가 요법 (주사제는 16 세 이상 사용가능)
2세이상 레녹스가스 토 증후군 부가요법
Eslicarbazepine 2013.11.
Lacosamide 2008.10.
4세 이상 국소 발작 의 단독 또는 부가 요법
선택적 SV2A 단백 억제
GABA 매 개성 Cl 유 입 증강
Sodiumchannel 길항
4세 이상 국소발작 의 단독요법 및 부가
요법 (주사제는 16 세 이상 사용가능)
Sodiumchannel 길항
졸음, 피곤, 불안, 과격 행동, 구토, 호중구 감소
기면, 진 정, 변비, 발 열, 침흘림, 발진
간기능 저하 시 용량조절 이 필요
약물남용 환자에게 주의 필요 중추신경계 억제제 병용 시 호흡곤란이 초래
어지러움, 두통, 피곤, 운동실조, 시야흐림, 저 나트륨혈증, QT연장 Carbamazepine 유사체 로, 휴지기 channel에는 5-15배 친화력이 낮고 이 상 활성의 뉴런에 선택적 억제 나타냄
심각한 간기능 장애 환 자 금기
운동실조, 어지러움, 두통, 구역, QT연장 약물상호작용 적은 장점 심전도에 영향주는 병용 약물 투여 피해야 함
Perampanel 2012.10.
4세 이상 국소발 작 단독요법
12세 이상 강직간대발작 부가 요법
Pregabalin 2004.12.
Rufinamide 2008.11.
Vigabatrin 2009.08.
Cenobamate 2019.11.
4세 이상 국소발 작의 부가요법
1세 이상 레녹스 가스토 증후군 부 가요법
AMPA glutamate 수용체 길항
정확한 기전x (Calcium channe 의 α2δ subunit에 작용)
Sodiumchannel 길 항
10세 이상의 불응 성 국소발작의 부 가요법 영아연축의 단독 요법 GABA 대사 억제
성인 국소발작 부 가요법
지속성 나트 륨 전류 억제 GABAA 수
용체 억제
성 신경전달 강화
어지러움, 피곤, 낙상, 두통, 체중 증가, 과잉 행동
복시, 시야 흐림, 어지 러움, 구갈, 기면
공격성 행동장애 및 관련 정신질환자, 간질환, 신질 환자 사용 금지 장기간 사용 시 체중 증가
2주 내로 작용 발현 당뇨병성 신경병증, 대상 포진후 신경통 등 신경통 동반 환자에게 유용 Gabapentin보다 약물의 흡수 및 효과가 일정
졸음, 어지 러움, 운동 실조, 구역, 발진 중증 간기능 저하자 금기 QT 간격 짧아질 수 있음 에 주의
시야결손, 졸음, 구역, 복통, 피 로, 흥분
졸림, 어지 러움, 두통, 균형감각 이상
2~3주 내로 작용 발현 시야결손의 위험을 상회 할 이점이 있는 영아연축 환자에게 사용
약물저항성 국소성 뇌전 증에 대한 추가요법으로 도 사용될 수 있음
3세대 뇌전증 치료제는 단순히 기존 약물의 개선형이 아니라, 신경과학적 발전과 신약 개발의
패러다임의 전환을 이끈 약물이다. 특히 난치성 뇌전증 환자에게 새로운 치료 옵션을 제공하며, 일부 약물은 발작 억제를 넘어서 신경세포 손상 자체를 줄이는 신경보호 효과 가능성까지 제기되 고 있다. 이는 뇌전증이 단순히 발작의 반복이 아닌, 장기적으로 신경계 구조와 기능에 영향을 줄
수 있다는 점에서 중요하다.
또한 3세대 약물은 다제 병용 치료 전략 수립에도 유리하며, 향후 맞춤형 유전자 치료, 면역학
적 치료 등 차세대 뇌전증 치료제 개발의 기초가 되고 있다. 기존 치료제로 조절되지 않는 환자군
을 위한 보조 치료제로서도 활용되며, 향후에는 표준치료 전략에 포함될 잠재력이 높다. 하지만 3세대 치료제는 아직 몇 가지 임상적 한계를 지닌다. 우선 1~2세대 약물에 비해 장기
안전성에 대한 누적 데이터가 부족하고, 고가의 약가 및 보험기준 미비로 인해 실제 임상 적용에
는 제한이 있다. 2세대 약물인 레비티라세탐의 경우 제네릭이 존재하여 가격이 저렴하며, 3세대 약물인 브리바라세탐은 레비티라세탐과 효과는 비슷하나 약가는 고가이다. 일부 약물에서는 여
전히 부작용이 관찰되어(예: 페람파넬의 공격성, 라코사미드의 어지럼증), 많은 약물들이 1차 단
독요법으로 승인되지 않고 제한된 용도인 보조요법으로 승인되고 있다.
3세대 치료제는 특히 난치성 뇌전증 환자에서의 역할이 강조된다. 일반적으로 전체 뇌전증 환
자의 20~30%는 적절한 약물을 복용한 후에도 발작이 완전히 조절되지 않는 난치성 경과를 보 인다. 이러한 환자에게 3세대 약물은 기존 치료제에 반응하지 않는 상황에서 보조적 혹은 대체적
치료 전략으로 중요한 역할을 수행하며, 맞춤형 치료 접근을 가능하게 한다.
결국 3세대 치료제는 완전한 치료법이라기보다는, 기존 기전의 한계를 극복하기 위한 과도기
적 위치에 놓여 있으며, 향후 4세대 이상 약물의 개발 방향을 예측하고 준비하는 데 있어 핵심적
인 의의를 가진다.
**난치성 뇌전증
난치성 뇌전증(refractory epilepsy)은 적절한 항뇌전증제를 복용했음에도 불구하고 발작이 완전히 조절되지 않는 상태를 의미한다. 일반적으로 1~2년간 표준 용량의 약물을 지속적으로 투
여한 후에도 발작이 지속되거나, 2~3개월에 1회 이상의 의식 소실을 동반하는 발작이 반복되는 경우 난치성으로 분류된다. 전체 뇌전증 환자의 약 20~30%가 이러한 난치성 경과를 보이는 것 으로 알려져 있으며, 이들은 기존 치료 전략에 잘 반응하지 않기 때문에 새로운 기전의 약물이나
병용요법, 맞춤형 치료 접근이 요구된다.
뇌전증의 비약물 치료는 주로 약물로 조절되지 않는 난치성 뇌전증(drug-resistant epilepsy, DRE) 환자에게 적용되는 치료법이다. 전체 뇌전증 환자의 약 30~40%는 항뇌전증약에 충분히
반응하지 않아 발작이 지속되며, 이로 인해 삶의 질 저하, 사고 위험, 인지기능 저하, 우울증 등 의 2차적 문제가 발생할 수 있다. 난치성 뇌전증 환자에게 비약물 치료를 시행하면 뇌전증의 증 상을 호전시킬 수 있다. 비약물 치료법에는 크게 3가지 방법이 있으며, 외과적 치료, 신경조절 치
료, 케톤 식이 요법이 이에 해당한다.
장점이 있다. 뇌전증의 분류 및
수술의 형태에 따라 수술 후
절제술, 국소적 뇌피질 절제 술, 대뇌반구 절제술, 뇌전증 발생병변 제거술 등으로 분류된다.
1)측두엽 절제술: 난치성 뇌전증에 대한 수술 중 가장 많이 시행되는 방법으로 뇌전증 조절률 이 높다.
2)뇌전증 발생병변 제거술: 양성 뇌종양이나 뇌혈관 기형이 발견되는 경우에 시행한다.
3)국소적 뇌피질 절제술: 뇌전증 발생부위가 절제 가능한 뇌부위인 경우 시행한다.
4)뇌전증로 차단술: 뇌전증파가 급속히 양쪽 대뇌반구로 퍼져, 빈번하고 급작스런 전신성경련
이 문제가 되는 경우에 시행한다.
5)대뇌반구 절제술: 소아기에 간혹 발생하는 대뇌반구 전체를 침범하는 특수한 병소의 경우 시 행한다.
하여 비정상적인 신경 회로의 흥분을 억제하고, 뇌 기능을 조절함으로써 발작 빈도를 유의미하 게 줄일 수 있다.
1) 미주신경자극술(Vagus Nerve Stimulation, VNS)
제10번 뇌신경인 미주신경은 정상적으로 뇌의 여러 넓은 영역과 연결되어 있어, 특수한 전기자 극시 뇌전증 발작을 억제하는 효과가 있다. 수술을 통해 전기자극발생기와 미주신경자극전극을 체내에 삽입하고, 지속적으로 미주신경을 절절히 자극해 뇌전증 발작의 횟수와 정도를 줄일 수 있다. 수술은 비교적 간단하여 환자에게 부담이 적고, 자극과 관련된 합병증은 외부에서 자극 강
도를 조절함으로써 없앨 수 있다. 완전한 발작 소실은 어렵고 약물과 병행하여 외과적 수술이 어 려운 환자에게 적용한다. 한국에서는 DBS나 RNS보다 보편적으로 사용되는 방법이다.
2)심부뇌자극술(Deep Brain Stimulation, DBS)
이상운동질환의 원인이 되는 뇌 기저부의 이상부분에 전극을 삽입하고 이를 통하여 전기자극을
주어 이상 신경회로를 조절하는 방법으로 주로 파킨슨병 치료에 사용되며, 난치성 뇌전증 치료에
도 효과를 연구 중이다. 현재까지 주로 사용되는 목표부위는 시상하핵과 내측담창구이며, 이전에
이상운동질환에 주로 사용되던 수술적 치료법인 뇌기저핵파괴술에 비해 치료강도의 미세조절을
조절할 수 있어 개인별로 환경 변화에 따라 정밀한 치료를 할 수 있는 장점이 있다.
3) 반응성신경자극술(Responsive Neurostimulation, RNS)
두개골 내 발작 초점에 직접 삽입된 전극을 통해 발작을 실시간으로 감지하고 전기자극을 주어 발작을 예방하거나 중단하는 장치이다. 이 방식은 ‘폐쇄 루프(closed-loop)’ 방식으로 작동하 며 이는 기기가 뇌 활동을 지속적으로 감지하고, 특정한 발작 전기 신호 패턴이 감지될 때만 자 극을 제공하는 시스템을 의미한다. 이 시스템은 개인의 발작 발생 전에 특징적으로 나타나는 뇌 파 활동을 기반으로 한다. RNS는 뇌 조직을 절제할 필요가 없고 필요 시 기기를 제거할 수 있어 가역적이며, VNS와 DBS와는 달리 발작 초점 부위의 뇌파를 실시간으로 모니터링할 수 있다는 장점이 있다.
항경련제 치료로 효과가 부족하거나 항경련제의 이상반응이 심한 환자의 경우, 케톤식이요법
을 시행할 수 있다. 케톤식이요법은 저탄수화물, 고지방 식이를 통해 체내의 탄수화물을 고갈시 켜 케톤증을 유발시키는 것이다. 뇌전증에 대한 효과가 어떠한 기전으로 인한 것인지는 확실하지
않으나 케톤식이요법을 하는 환자에게서 미토콘드리아 생합성, 산화적 인산화, GABA 수치 상
승, 신경 흥분성 감소, 시냅스 기능 안정화 등이 관찰되었다. 케톤식이는 소아뇌전증환자 특히 드
라벳 증후군, 레녹스-가스토증후군을 가진 일부 환자에서 효과적일 수 있으나, 소아의 발육지연 과 고콜레스테롤혈증의 위험을 초래할 수 있으므로 영양균형을 위해 전문가의 지도가 필요하다.
참고문헌
-뇌전증 진단 방법 및 최신 검사법
명지병원 이병인 뇌전증센터. (2023). 주요질환소개 [뇌전증]. Retrieved from https://mjh.or.kr/epilepsy/health/ class/epilepsy.do
삼성서울병원 뇌신경센터. (2015). 검사정보 [뇌전증]. Retrieved from http://www.samsunghospital.com/ dept/main/index.do?DP_CODE=NREHNS&MENU_ID=002015017
서울대학교병원. (2025). 뇌전증 [N의학정보]. Retrieved from https://www.snuh.org/health/nMedInfo/ nView.do?category=DIS&medid=AA000198
서울아산병원 뇌전증클리닉. (2014). 진료안내[검사종류]. Retrieved from https://epilepsy.amc.seoul.kr/asan/ depts/epilepsy/K/content.do?menuId=1411
식품의약품안전처 첨단바이오제품과. (2020.01.07). NGS (Next Generation Sequencing) 기반 유전자검사의 이해 (입문용, 심화용) [연구보고서]. Retrieved from https://www.nifds.go.kr/brd/m_18/view.do?seq=12495
연세대학교 의과대학. (2024.06.14). 한국인 뇌전증 유발 유전자 단서 찾았다. 세브란스병원. Retrieved from https://medicine.yonsei.ac.kr/news/press/report.do?mode=view&articleNo=122063&article.offset=0& articleLimit=12&srSearchVal=%EB%87%8C%EC%A0%84%EC%A6%9D
한국뇌전증학회. (2013). 일반인공간 [뇌전증의 진단]. Retrieved from https://www.kes.or.kr/sub04/ sub01_02.html
Fisher, R. S., Acevedo, C., Arzimanoglou, A., Bogacz, A., Cross, J. H., Elger, C. E., ... & Wiebe, S. (2014). ILAE official report: a practical clinical definition of epilepsy. Epilepsia, 55(4), 475-482.
Kim, S. H., Seo, J., Kwon, S. S., Teng, L. Y., Won, D., Shin, S., ... & Kang, H. C. (2024). Common genes and recurrent causative variants in 957 Asian patients with pediatric epilepsy. Epilepsia, 65(3), 766-778.
-뇌전증 치료 가이드라인 관리자. (2013.05.28.). 뇌전증 약물의 전반적인 이해. 후생뉴스. Retrieved from https://www.whosaeng. com/62518
김지언. (2017). 2017년도 제36차 춘계학술대회. 대한신경과학회. Epilepsy(pp. 92-95). 대한신경과학회
문혜진, (2017). 2017년도 제36차 춘계학술대회. 대한신경과학회. Therapeutic strategy of catamenial epilepsy(pp. 235-237). 대한신경과학회
세브란스. (2023.11.21.). 드라베 증후군. Retrieved from https://sev.severance.healthcare/health/lifecare/ children/health-raise.do?mode=view&articleNo=120046&title=드라베+증후군+%5B소아신경과%5D 서울대학교병원. 뇌전증. Retrieved from http://www.snuh.org/health/nMedInfo/nView. do?category=DIS&medid=AA000198
신동진, 손영민, 정기영, 구용서, 김대영, 서종근, 김지영, 송홍기. (2021). 약물난치성 뇌전증 환자의 약물 치료 권고사 항: 2021 대한신경과학회 진료지침 뇌전증 분과 소위원회. J Korean Neurol Assoc, 39(4), 255-269.
의약화학 편찬위원회. (2023). 의약화학 제7판. 신일서적 한국임상약학회. (2021). 약물치료학(제5개정판). 신일북스
한국임상약학회. (2024). 약물치료학 제6개정. 신일북스
-세대별 뇌전증 치료제
서울아산병원. 어떤 경우에 난치성 뇌전증으로 판단하나요?. Retrieved from https://epilepsy.amc.seoul.kr/ asan/depts/epilepsy/K/bbsDetail.do?menuId=1412&contentId=72585
세브란스 건강정보. (2023.02.01). 뇌전증 [Epilepsy]. Retrieved from https://sev.severance.healthcare/ health/encyclopedia/disease/body_board.do?mode=view&articleNo=67051&title=%EB%87%8C%E C%A0%84%EC%A6%9D+%5BEpilepsy%5D
한국임상약학회. (2021). 약물치료학(5판). 신일북스
-비약물 치료 (난치성 뇌전증 대상)
대한뇌전증학회. 뇌전증 수술의 종류. Retreived from https://www.kes.or.kr/sub04/sub05_02.html
서울대학교병원 파킨슨센터. 뇌심부자극술_소개. Retrieved from https://www.snumdc.org/surgicaltreatment/dbs/dbs-introduction/
한국임상약학회. (2021). 약물치료학(5판). 신일북스
ILAE(International League Against Epilepsy) Retrieved from https://www.ilae.org/patient-care
Rao, V. R., & Rolston, J. D. (2023). Unearthing the mechanisms of responsive neurostimulation for epilepsy. Communications Medicine, 3(1), 166.
Touma, L., Dansereau, B., Chan, A. Y., Jetté, N., Kwon, C. S., Braun, K. P., ... & Keezer, M. R. (2022). Neurostimulation in people with drug‐resistant epilepsy: systematic review and meta‐analysis from the ILAE surgical therapies commission. Epilepsia, 63(6), 1314-1329.
빔팻(vimpat, lacosamide)은 UCB 제약에서 개발한 항경련제로, 16세 이상의 간질 환자에 서 2차성 전신발작을 동반하거나 동반하지 않는 부분 발작 간질 (partial-onset seizures)에 대
한 보조 요법으로 사용되는 약물이다.
유럽 EMA의 2008년 09월 23일 최초허가를 필두로 미국 FDA 2008년 10월 29일 허가 승인, 국내 식약처 2010년 08월 26일 허가 승인 되어 전세계적으로 사용되고 있는 항경련제이다. 한
편, 기존 항경련제 약물의 작용기전과 다른 작용기전을 가지고 있어 전세계 항경련제 1위 품목
을 유지하고 있는 국외 상황과는 대조적으로, 국내에서는 한국 UCB제약에서 2008년 06월 14
일 빔팻정이 품목허가를
이는 보험 약가와 제네
릭 약물의 개발 등의 시장 상황에 따른 현상으로, 세계 1위 품목이 한국시장에서 제네릭으로 인
해 자진 철수한 이례적인 현상으로 평가받고 있다. 이에 대해서는 추후 급여 부분에서 보다 자세
히 후술할 예정이다.
빔팻의 작용기전 및 약리학적 특징
빔팻의 작용기전은 아직 완전히 밝혀지지 않았지만, 이중 기전(dual mechanism of acting)
을 통해 항경련 효과를 나타내는 것으로 보고되고 있다.
첫 번째 작용기전은, 나트륨 통로의 slow activation 조절을 통한 항경련 효과이다. FDA label clinical pharmacology의 mechanism에 기재되어 있는 것에 의하면, 빔팻정의 작용기전은 완
전히 밝혀지지 않았으나 in vitro electro physiology study를 통해 전압 개폐성 나트륨 채널 (흥분성 세포)의 slow activation을 선택적으로 촉진하며 과흥분성 신경막 안정화를 통한 발작
억제를 유발함을 밝혀졌다. 이는 기존 항경련제 약물(phenytoin, carbamazepine 등)의 fast activation 조절을 통한 항경련 효과와는 달리 slow activation의 선택적 조절을 통한 기전이기 에 약물로서의 가치를 높게 평가받고 있다.
두 번째로 제시된 작용기전은, CRMP-2 단백질와의 상호작용을 통한 항경련 효과이다. 뇌전
증은 비정상적인 신경 연결 및 신경돌기 재배열의 발생이 특징적으로 나타나는 질환이며 빔팻은 CRMP-2의 억제를 통해 이러한 병리적 변화에 개입하고 있는 것으로 추정된다. CRMP-2은
성장하는 신경계에서 많이 발현하는 단백질로, 신경세포의 분화, 축삭 성장, 재배열을 중재하는
단백질로 알려져 있다. 빔팻의 경우 CRMP-2 단백질의 인산화를 억제함으로써 hippocampal neuronal loss(해마신경세포 손실)를 줄이고 mossy fiber sprouting (이끼섬유 발아)를 억
제함으로써 Ca2+ channel CaV2.2를 통한 Ca2+ 유입 감소 및 신경세포 항상성 유지를 유발 한다. 다만, 두 번째 작용기전은 FDA label이 아닌, 임상 논문이나 FDA의 office of clinical pharmacology review에 기재되어 있는데 CRMP-2와의 상호작용을 통한 빔팻의 항경련 효과 가 임상적으로 입증된 작용기전이 아닌, In vitro 수준의 간접 증거로만 제시되고 있기 때문이다.
허가 적응증 및 타임라인
1) 한국 내 라코사미드의 적응증 허가사항

[그림 11] 한국 내 라코사미드 적응증 허가사항 변경 타임라인
라코사미드(lacosamide) 제제의 오리지널 의약품은 UCB에서 생산하는 빔팻(Vimpat, lacosamide)으로, 한국에서는 2010년 8월에 식약처의 허가를 받아 2011년부터 시판되었다.
그러나 2018년 6월, 한국 UCB가 빔팻에 대한 식약처의 품목허가를 자진 취하하여 과거 허가
사항 및 품목허가 자진 취하 전까지의 허가사항의 변화를 확인할 수 없는 상태이다. 이러한 오리 지널 의약품의 자진 취하에 관한 내용은 급여 파트에서 더욱 자세히 다룰 예정이며, 본 허가 파 트에서는 2016년 6월에 허가를 받은 라코사미드의 국내 퍼스트 제네릭인 빔스크 정을 기준으로 허가사항을 파악하려 한다.
-빔스크정 적응증: 16세 이상의 뇌전증 환자에서 2차성 전신발작을 동반하거나 동반하지 않는 부분발작 치료의 부가요법으로 2016년에 허가받았으며 이후 허가사항에 대한 변경은 없었다.
[표 9] 한국 내 라코사미드 제제 제네릭 목록
제품명 용량 및 제형 허가 상태 최초 허가일자 제조사
빔스크정 50 mg, 100 mg, 150 mg, 200 mg 허가
빔스크주 주사제 - 경구투여 가 일시적으로 불가 능한 환자에만 투여 허가
라코정 50 mg, 100 mg, 150 mg, 200 mg 허가
네오팻정 50 mg, 100 mg, 150 mg, 200 mg 허가
라코팻정 50 mg, 100 mg 허가
라코팻시럽 시럽제 - 정제와 허 가사항 동일 허가
라사로틴 50 mg, 100 mg 허가
빔프로정 50 mg, 100 mg, 150 mg, 200 mg 유효기간 만료 (2024년 4월 29 일)
2016.08.31. (퍼스트 제네릭) 에스케이케미칼㈜
2019.03.29. 에스케이케미칼㈜
2016.09.29. 명인제약㈜
2016.11.31. 환인제약㈜
2017.01.23. 현대약품㈜
2020.01.22. 현대약품㈜
2017.06.13. 고려제약㈜
2019.04.29. 대웅바이오㈜
빔프로정은 라코사미드 정제 의약품 중에서도 가장 최근인 2019년 4월 29일에 허가를 받았으 나, 5년 뒤인 2024년 4월 29일에 품목허가가 갱신되지 않아 허가 유효기간이 만료되어 현재는
시판되지 않는 상태이다. 빔스크주는 2019년 3월 29일에 주사제로 허가받았으나, 경구투여가 불가능한 환자군에 대해서만 처방 가능한 제약이 있다. 반면에 2020년 1월 22일에 시럽제로 허 가받은 라코팻시럽의 경우 이러한 제약 없이 정제와 동일하게 16세 이상의 부분발작 치료의 부
가요법으로 처방할 수 있다.

[그림 12] 미국 내 라코사미드 허가사항 변경 타임라인 -적응증: 라코사미드는 2008년, 미국 FDA로부터 17세 이상의 부분발작 환자 치료의 부가요 법으로 최초허가를 받았다. 2014년에는 동일 환자군 대상 치료의 단독요법으로도 허가를 받았
으며, 2017년에 4세이상의 부분발작 환자 대상 치료의 단독요법 및 부가요법으로 모두 처방 가
능하도록 허가사항이 추가되었다. 2020년에는 4세 이상의 전신강직간대발작 환자를 대상으로 하는 부가요법으로 처방이 가능하도록 적응증이 추가되었다. 추가된 환자군에 대한 처방 용량은 기존에 허가된 부분발작 환자에 대한 처방 용량과 동일한 용량으로 처방한다. 이후 2021년에 생 후 1달 이후의 부분발작 환자 치료의 단독요법과 부가요법으로 처방이 가능하도록 환자군 연령 대가 확장되었다.
4) 유럽 내 라코사미드 허가사항

[그림 13] 유럽 내 라코사미드 허가사항 변경 타임라인
-적응증: 라코사미드는 2008년, 유럽 EMA로부터 16세 이상의 부분발작 환자 치료의 부가요
법으로 최초허가를 받았다. 2016년에는 동일 환자군 대상 치료의 단독요법으로도 허가를 받았 으며, 2017년에 4세이상의 부분발작 환자 대상 치료의 단독요법 및 부가요법으로 모두 처방 가
능하도록 허가사항이 추가되었다. 2020년에는 4세 이상의 전신강직간대발작 환자를 대상으로
하는 부가요법으로 처방이 가능하도록 적응증이 추가되었다. 추가된 환자군에 대한 처방 용량은 기존에 허가된 부분발작 환자에 대한 처방 용량과 동일한 용량으로 처방한다. 이후 2022년에 2
세 이상의 부분발작 환자 치료의 단독요법과 부가요법으로 처방이 가능하도록 환자군 연령대가 확장되었다. 5) 한국, 미국, 유럽의
[표 10] 한국, 미국, 유럽 내 라코사미드
KR 한국 성인 ≥16세 50mg BID (100mg/day)
US 미국 성인 ≥17세
GR 영국 성인 및 ≥50kg
단독: 100mg BID 병용: 50mg BID
단독: 50 or 100 mg BID
병용: 50mg BID
*BID는 1일 2회 투약을 의미함
1주 후 100mg BID (200mg/day) → 이 후 매주 50mg BID
증량 가능 200mg BID (400mg/ day)
매주 50mg BID (100mg/day) 증량
매주 50mg BID (100mg/day) 증량
단독: 150-200mg BID
병용: 100-200mg BID (최대 400mg/day)
단독: 최대 300mg BID (600mg/day)
병용: 최대 200mg BID (400mg/day)
단독/병용 모두 허가
단독/병용 모두 허가 단독 최대 용량 미국, 한국보다 높음
*한국, 미국, 영국 모두 라코사미드 제형으로 정제, 시럽제, 주사제가 허가되어 있으며 세부적인 용법은 제형별로 상이함
*영국과 미국에서는 16세 이하 유아에서도 라코사미드의 처방이 가능하며, 미국과 영국 모두 이후 체중에 따른 소아 투약 용 량 가이드라인이 정해져 있다. 반면 한국에서는 소아 라코사미드 처방이 금지되어 있기 때문에 투약 용량 가이드라인이 없다.
≥50kg 50mg BID (100mg/day)
50kg~30kg 1mg/kg BID (2mg/kg/day)
30kg~6kg 1mg/kg BID (2mg/kg/day)
<6kg 1mg/kg BID (2mg/kg/day)
50mg씩 BID (100mg/day) 매
1mg/kg씩 BID (2mg/kg/day) 매 주 증량
1mg/kg씩 BID (2mg/kg/day) 매 주 증량
1mg/kg씩 BID (2mg/kg/day) 매 주
단독요법: 150-200mg BID (300400mg/day)
병용요법: 100-200mg BID (200400mg/day)
2-4mg/kg BID (4-8mg/kg/day)
3-6mg/kg BID (6-12mg/kg/day)
3.75-7.5mg/kg BID (7.5-15mg/kg/ day)
50kg~40kg (단독요법) 1mg/kg BID (2mg/kg/day)
40kg~10kg (단독요법) 1mg/kg BID (2mg/kg/day)
50kg~30kg (병용요법) 1mg/kg BID (2mg/kg/day)
30kg~20kg (병용요법) 1mg/kg BID (2mg/kg/day)
20kg~10kg (병용요법) 1mg/kg BID (2mg/kg/day)
1mg/kg씩 BID (2mg/ kg/day) 매주
BID 5mg/kg (10mg/kg/day)
1mg/kg씩 BID (2mg/ kg/day) 매주 증량 BID 6mg/kg (12mg/kg/day)
1mg/kg씩 BID (2mg/ kg/day) 매주 증량 BID 4mg/kg (8mg/kg/day)
1mg/kg씩 BID (2mg/ kg/day) 매주 증량 BID 5mg/kg (10mg/kg/day)
1mg/kg씩 BID (2mg/ kg/day) 매주 증량 BID 6mg/kg (12mg/kg/day)
1)
2) 라코사미드 뿐만
환이 심화되거나 새로이 발생하여
3) 임상시험에서 라코사미드
상 환자에 있어서 신중히 사용하여야 한다.
4) 라코사미드 및 타 항뇌전증약 투여시 호산구증가증, 간염, 신장염, 림프절병증, 심근염 등 이 복합적으로 나타나는 다기관 과민 반응(DRESS: Drug Reaction with Eosinophilia and Systemic Symptoms)이 보고되었다. 라코사미드 투여 시 다기관 과민 반응이 의심된다면 투 여를 중단하고 대체 치료를 진행한다
5) 라코사미드를 신장애 환자,
빔팻 임상분석
통해 유효성과 안전성을
이적 상황을 고려하여 본 임상 분석에서는 FDA label에 기재된 임상시험을 기준으로 임상 분석 을 펼쳐 나갈 것이다.
본 임상분석에서 임상 분석을 펼치기 전 outcome과 efficacy의 차이에 먼저 언급되어야 할 필요성에 의해 이를 먼저 언급하고자 한다. 임상 분석을 진행한 논문에서는 primary efficacy, secondary efficacy에 대해 논하였고 outcome에 대한 언급은 나와있지 않았다. 그렇지만, clinical trials에 등재 되어있는 임상의 경우 efficacy 자체를 primary outcome으로 기재하였 으며 secondary outcome을 safety로 분류되어 있다. 따라서 본 임상분석에서도 이를 근거로 primary outcome을 efficacy, secondary outcome을 safety로 크게 분류 후 efficacy를 primary efficacy, secondary efficacy로 세분화하여 임상 분석을 진행할 것이다.
FDA 허가보고서 study 1
Efficacy and Safety of Oral Lacosamide as Adjunctive Therapy in Adults with Partial-Onset Seizures
본 임상은 최소 2종 이상의 항뇌전증제(antiepileptic drugs, AEDs) 치료에도 조절되지 않 는 18~65세의 부분발작 환자를 대상으로 lacosamide 200mg/day (100mg bid), 400mg/ day (200mg bid), 600mg/day (300mg bid)의 부가요법의 유효성과 안전성을 평가하고, 병 용 AED의 혈중 농도 변화를 확인하기 위한 다기관, 무작위배정, 이중맹검, 위약 대조, 용량반응 시험이다.
임상 대상 환자는 최소 2종 이상의 항뇌전증제(antiepileptic drugs, AEDs) 치료에도 불구하
고 발작이 조절되지 않는 18~65세의 부분발작 환자(partial-onset seizure)이며, 기저선 평가
기준 동안 평균적으로 최소 4회 이상의 부분 발작을 경험한 환자이다. 본 임상은 초기 8주를 기
저선 기간, 이후 6주간 라코사미드 강제 증량기, 이후 12주 동안 유지기로 설정하여 총 26주간
진행되었다. 임상 종료 후 환자는 라코사미드 감량 및 오픈라벨로 전환하는 절차를 거쳤다. 환자
는 유지기간 동안 매일 2회 (bid) 형태로 위약 혹은 정해진 약물량을 투여받았다.
1차 평가 변수(효능) 중 1차 효능의 경우 유지기간 중 발작 빈도 변화와 50% 반응자 비율 (baseline 대비 발작빈도가 50% 이상 감소한 환자 비율) 이며 2차 효능의 주요 지표는 발작 완
전소실 환자, 무발작일 비율 변화이다.
1차 효능의 결과 중 유지기(28일 기준) 중 발작 빈도 변화의 경우 ITT 분석에서 위약투여군의 경우 10% 감소, lacosamide 200mg/day의 경우 26% 감소 (p=0.1010) 하였으며 lacosamide 400mg/day의 경우 39% 감소 (p=0.0023), lacosamide 600mg/day의 경우 40% 감소 (p=0.0084) 비율을 보여주었다. Pet protocol group의 경우 lacosamide 200mg/day 21.5% 감소 (p=0.0112), lacosamide 400mg/day 39.3% (p<0.001), 600mg/day군 31.6% (p=0.002)를 보여주었다.
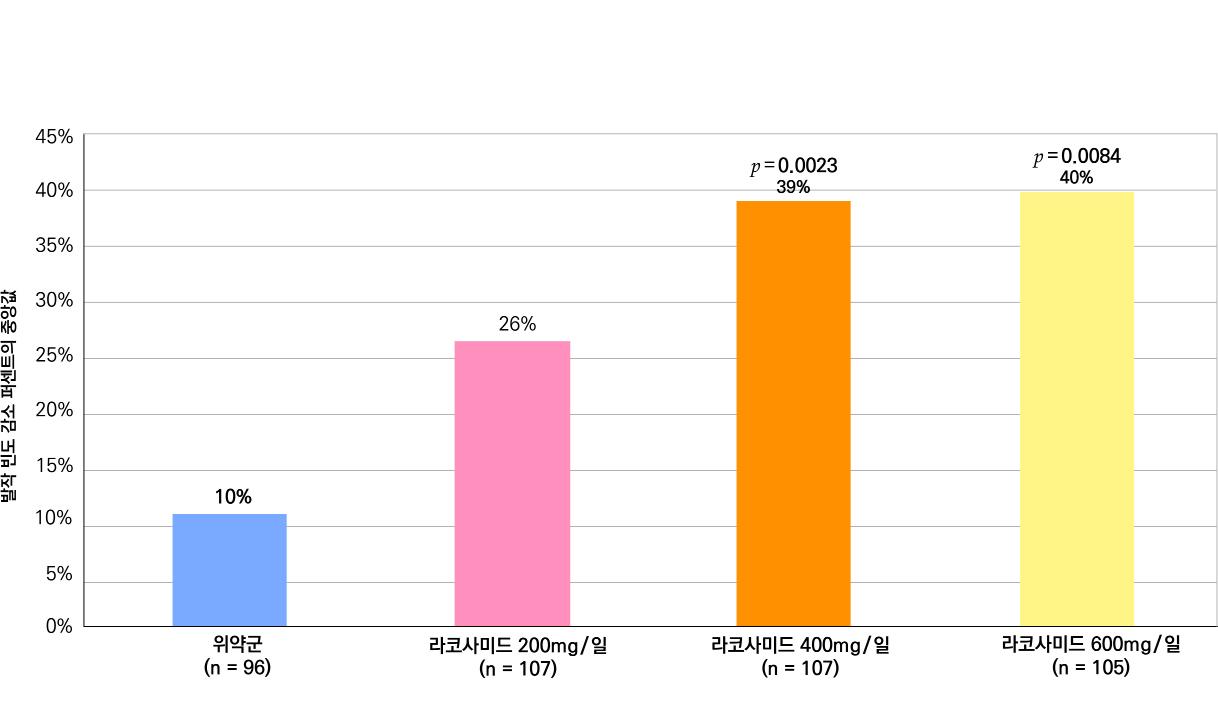
[그림 14] 유지기 동안 발작 빈도 변화 (ITT 군)
또다른 1차 효능의 결과인 50% 반응자 비율의 경우 ITT 분석에서 위약투여군의 경우 21.9% 감소, lacosamide 200mg/day의 경우 32.7% 감소 (p=0.0899) 하였으며 lacosamide 400mg/day의 경우 41.1% 감소 (p=0.0038), lacosamide 600mg/day의 경우 38.1% 감 소 (p=0.0141) 비율을 보여주었다. per protocol group의 경우 lacosamide 200mg/day 38.1% 감소 (p=0.0214), lacosamide 400mg/day 49.4% (p=0.0002), 600mg/day군 49.2% (p=0.004)를 보여주었다.
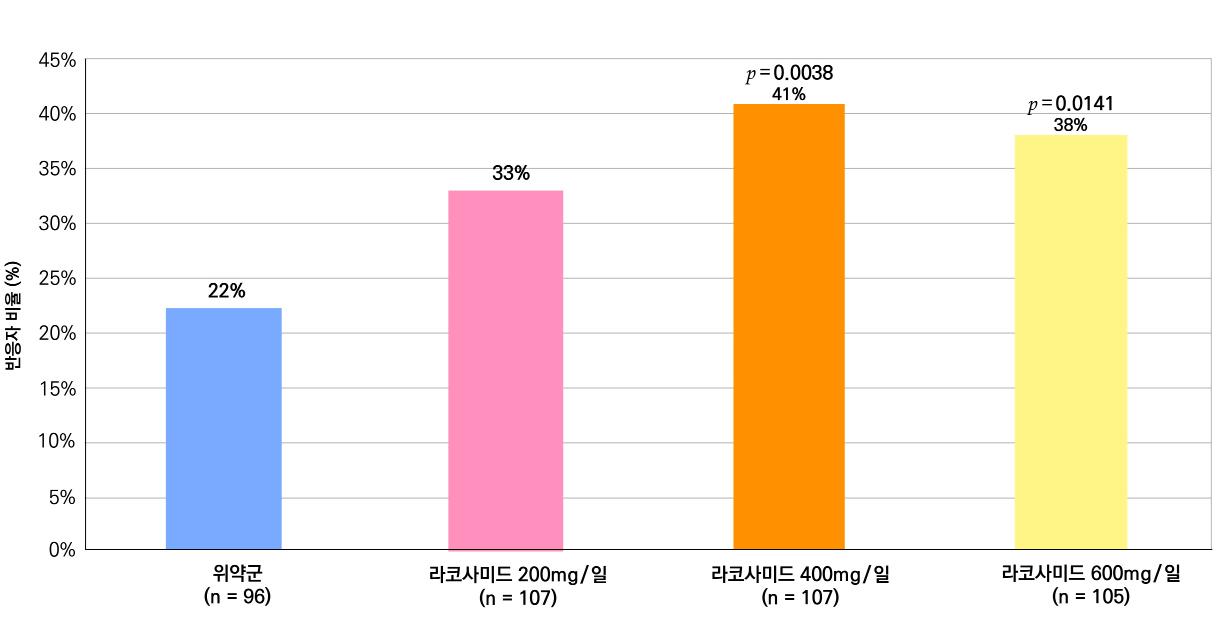
[그림 15] 유지기 동안 50% 반응자 비율 (ITT군)
2차 효능의 주요 지표 중 무발작일 비율의 경우 위약군의 경우 3%의 증가율을 보이며 lacosamide 200mg/day의 경우 6%의 증가율을 보였다. lacosamide 400mg/day의 경우 12%
증가율을 보였으며 ( p = 0.0036 ), lacosamide 600mg/day의 경우 12% 증가율을 보였다. ( p = 0.0004 ) 12주 유지기간 동안 발작 완전 소실 환자의 경우 총 7명으로 위약군에서는 발 생하지 않았고 lacosamide 200mg/day 1명, lacosamide 400mg/day 5명, lacosamide 600mg/day 1명의 발생을 보였다.
2차 평가 변수(안전성)의 주요 지표는 이상반응으로 인한 치료 중단률, 중대한 이상반응 발생 률 및 ECG 심전도 평가이다.
이상 반응으로 인한 치료 중단률의 경우 위약 투여군의 경우 5%, lacosamide 200mg/day 11%, lacosamide 400mg/day 19%, lacosamide 600mg/day 30% 의 치료 중단률을 보 였다. 중대한 이상반응 발생률의 경우 위약 투여군의 경우 6.6% (6명), lacosamide 200mg/ day 4.2% (4명), lacosamide 400mg/day 8.5% (8명),
lacosamide 600mg/day 4.3% (4명) 의 발생률을 보였다. ECG 심전도 평가의 경우 baseline 대비 유지기까지의 심박수, QTs 간격, QRS 시간 변화 등은 보이지 않았으나 심혈관 영향
에서 lacosamide 투여군에서 PR 간격의 소폭 증가 추세를 확인할 수 있었다. 다만, 이러한 소 폭 증가 추세는 임상적으로 중대한 문제를 야기하지 않았다.
본 임상에서는 최소 2종 이상의 항뇌전증제 치료로 조절되지 않는 부분 발작 환자를 대상으로
lacosamide 200mg/day, 400mg/day, 600mg/day 처방할 때의 lacosamide의 유효성 및
안전성을 확인할 수 있었다. 1차 결과(효능) 중 1차 효능에서 400mg/day, 600mg/day에서 위약투여군에 비해 발작 빈도 및 50% 반응자 비율 모두 유의미하게 개선하였음을 보여주었으나
200mg/day에서는 유의성을 확인할 수 없었다. 2차 효능에서도 무발작일 비율에서 400mg/ day, 600mg/day 투여군이 위약 투여군에 비해 유의미하게 증가하여 유효성 보여주었으나
200mg/day는 유읨성을 확인할 수 없었다. 발작 완전 소실 환자의 경우 lacosamide 투여군에
서만 확인할 수 있었다. 2차 평가변수(안전성)에서 이상반응 발생률의 경우 모든 lacosamide
투여군에서 위약 투여군보다 높았으며 이상반응으로 인한 치료 중단률의 경우 용량에 따라 증가
하는 추세를 보여주었다. 한편, 중대한 이상반응 발생률의 경우 전체적으로 낮았으며 군간 유의
미한 차이를 보여주지 않았다. 심혈관 관계에서는, PR 관계의 소폭 증가가 확인되었으나 임상적 중요성을 보여주진 않았다.
결론적으로, lacosamide는 400mg/day 및 600mg/day의 투여군에서 기존 항간질제로 조
절되지 않던 부분 발작 환자에 대해서 유의미한 치료 용량으로 기능할 수 있으며, 안전성 측면에 서도 양호함을 보였다. 다만, 200mg/day의 용량에 대해서는 임상적 유의성을 확인할 수 없었 다.
FDA 허가보고서 study 2 ( NCT00136019 )
Lacosamide as adjunctive therapy for partial-onset seizures: A randomized controlled trial
본 임상은 기존 항뇌전증제(antiepileptic drugs, AEDs) 치료에도 불구하고 발작이 조절 이 되지 않는 16~70세의 부분발작(partial-onset seizure) 환자를 대상으로, lacosamide 400mg/day (200mg bid) 또는 600mg/day (300mg bid) 를 부가요법으로 투여했을 때의 유효성과 안전성을 평가하기 위한 다기관, 무작위배정, 이중맹검, 위약 대조, 3상 임상시험이다.
임상 대상 환자는 기존 항뇌전증제(antiepileptic drugs, AEDs) 치료에도 불구하고 발작이 조
절이 되지 않는 16~70세의 부분발작(partial-onset seizure) 환자이며, 단순·복합 부분 발작
또는 이차 전신 강직-간대성 발작을 가지고 있는 환자이다. 본 임상은 초기 6주를 라코사미드 강
제 증량기, 이후 12주를 라코사미드 유지기로 설정하여 이후 라코사미드 감량기간 2주 및 추적 관찰 기간 8주를 포함하여 총 28주간 진행되었다. 임상 종료 후 환자는 라코사미드 감량 및 오 픈라벨로 전환하는 절차를 거쳤다. 환자는 유지기간 동안 매일 2회 (bid) 형태로 위약 혹은 정해
진 약물량을 투여받았다.
1차 평가 변수(효능) 중 1차 효능의 경우 유지기간 중 발작 빈도 변화와 50% 반응자 비율 (baseline 대비 발작빈도가 50% 이상 감소한 환자 비율) 이며 2차 효능의 주요 지표는 발작 완
전소실 환자, 무발작일 비율 변화이다.
1차 효능의 결과 중 유지기간(28일 기준) 중 발작 빈도 변화의 경우 ITT 분석에서 lacosamide 400mg/day군 37.3%, 600mg/day군 37.8%, 위약군 20.8%였으며, 위약 대비 감 소율은 lacosamide 400mg/day의 경우 21.6%(p=0.008), lacosamide 600mg/day의 경 우 24.6%(p=0.006)였다. per protocol group의 경우 lacosamide 400mg/day군 39.6%, 600mg/day군 50.0%, 위약군 21.7%였으며, 위약 대비 감소율은 lacosamide 400mg/day 의 경우 20.6%(p=0.008), lacosamide 600mg/day의 경우 33.0%(p=0.006)였다.
또다른 1차 효능의 결과인 50% 반응자 비율의 경우 ITT 분석에서 lacosamide 400mg/day
의 경우 38.3%, lacosamide 600mg/day의 경우 41.2%로 위약군의 18.3%와 비교할 때 두 용량 모두 유의미한 개선을 보였다. ( p <0.001 )
2차 효능의 주요 지표 중 무발작일 비율의 경우 lacosamide 400mg/day의 경우 5.3% 증 가율을 보였으며 (p=0.013), lacosamide 600mg/day의 경우 8.2% 증가율을 보였다. ( p < 0.001 ) 12주 유지기간 동안 발작 완전 소실 환자의 경우 총 9명으로 위약군에서는 발생하지 않
았고 lacosamide 400mg/day에서 160명 중 4명 (2.5%), lacosamide 600mg/day에서 62명 중 5명 (8.1%) 의 발생을 보였다.
2차 평가 변수(안전성)의 주요 지표는 이상반응으로 인한 치료 중단률, 중대한 이상반응 발생
률 및 ECG 심전도 평가이다.
이상 반응으로 인한 치료 중단률의 경우 전체 환자의 16.5%가 이상반응으로 인해 임상을 중단 했는데 lacosamide 투여군의 경우 강제 증량기 동안 20.3% (n=61), 유지기 동안 0.4% (n=1)
에서의 임상 중단이 발생했다. 중대한 이상반응 발생률의 경우 lacosamide 400mg/day의 경 우 5.9%, lacosamide 600mg/day의 경우 3.1%, 위약군의 경우 2.9%의 발생률을 보였다.
ECG 심전도 평가의 경우 baseline 대비 유지기까지의 심박수, QTs 간격, QRS 시간 변화 등 은 보이지 않았으나 PR 간격에서 lacosamide 군에서 소폭 증가한 추세를 확인할 수 있었다.
본 임상에서는 기존 항뇌전증제의 치료로 조절되지 않는 부분발작 및 이차 전신 강직-간대성 발 작을 가지는 환자를 대상으로 lacosamide 400mg/day, 600mg/day 처방시 임상적으로 유 의미한 치료 효과를 보일 수 있음을 확인하였다. 1차 결과(효능) 중 1차 효능에서 lacosamide 400mg/day, lacosamide 600mg/day 투여군에서 위약 투여군에 비해 발작 빈도 변화 및
50% 반응자 비율 모두 유의미하게 감소시켰다. 또한 2차 효능에서도 무발작일 비율에서도 유의
미한 개선을 보여주었으며 발작 완전 소실 환자의 경우 lacosamide 투여군에서만 발생하였다.
2차 평가변수(안전성)의 경우 위약군과 lacosamide 투여군에서의 큰 차이가 발생하지 않았으 나, PR 간격에서 소폭 증가한 추세를 확인할 수 있었다. 다만, 이로 인한 임상적 의미가 있는 현
상이 발생되지 않았다.
결론적으로, lacosamide는 400mg/day 및 600mg/day의 투여군에서 기존 항간질제로 조
절되지 않던 부분 발작 환자 및 이차 전신 강직-간대성 발작 환자에 대해서 치료 옵션으로 기능
할 수 있으며, 안전성 측면에서도 양호함을 보였다.
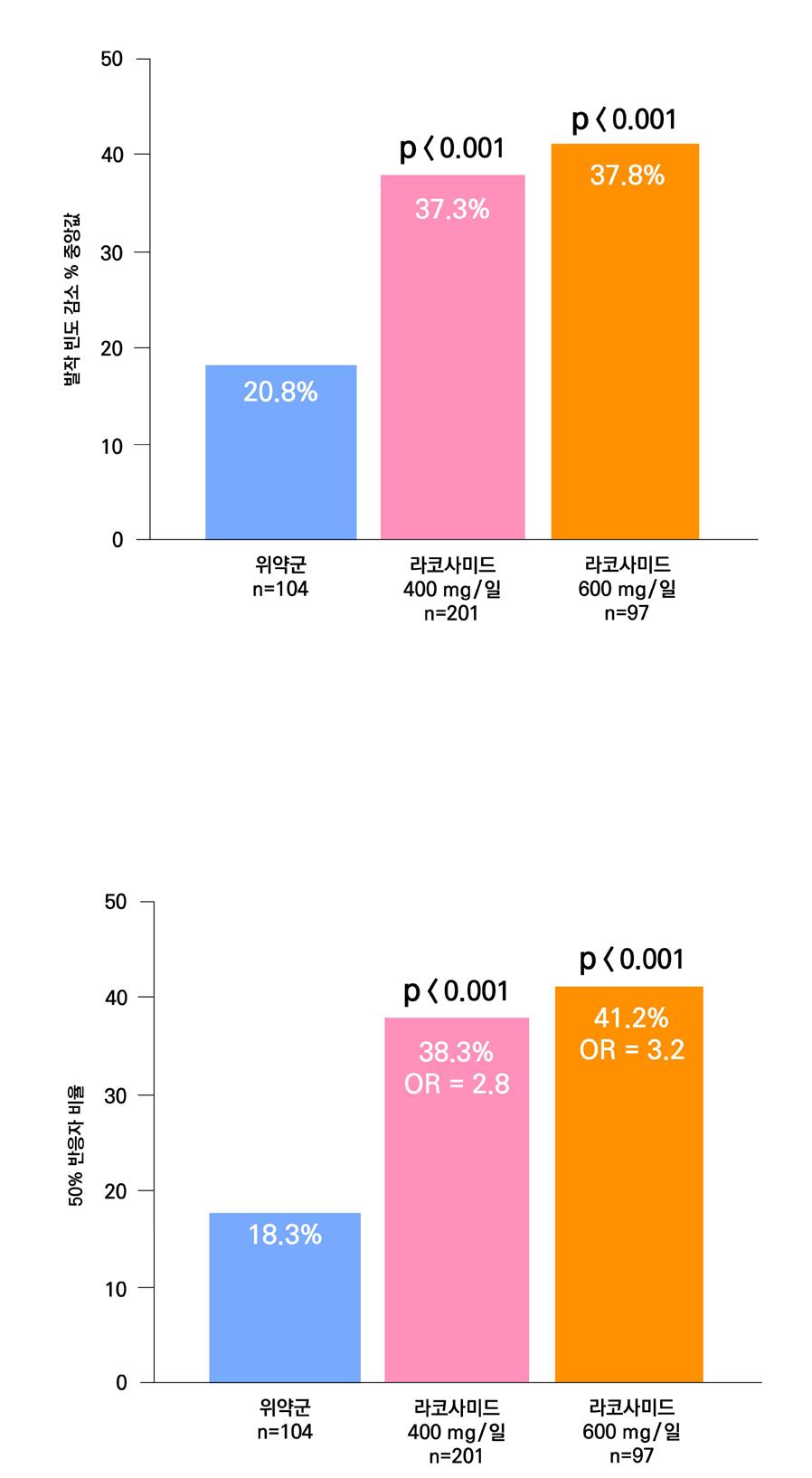
[그림 16] 유지기 동안 발작 진도 변화 (ITT군), 유지기 동안 50% 반응자 비율
A Multicenter, Double-blind, Randomized, Placebo-controlled, Parallel Group Trial to Investigate the Efficacy and Safety of SPM 927 (200mg/ Day and 400mg/ Day) as Adjunctive Therapy in Subjects With Partial Seizures With or Without Secondary Generalization
본 임상은 1~3종 이상의 항뇌전증제(antiepileptic drugs, AEDs) 치료에도 조절되지 않는 16~70세의 부분발작 환자를 대상으로 lacosamide 200mg/day (100mg bid), 400mg/day (200mg bid) 치료 요법 용량의 유효성과 안전성을 평가하기 위한 다기관, 무작위배정, 이중맹 검, 위약 대조, 평행군 임상 시험이다.
임상 대상 환자는 2년 이상 부분 발작 진단을 받고 1~3종의 항뇌전증제(antiepileptic drugs, AEDs) 치료에도 불구하고 발작이 조절되지 않는 16~70세 부분발작 환자(partial-onset seizure)이며, 기저선 평가기준 동안 평균적으로 최소 4회 이상의 부분 발작을 경험하며 21일 이상 무발작 기간이 없는 환자이다. 본 임상은 초기 8주를 기저선 기간, 이후 4주를 라코사미드 강제 증량기로 선정하였다. 강제 증량기 이후 12주 동안 유지기로 설정하여 총 24주간 진행되었다. 임
상 종료 후 환자는 라코사미드 감량 및 오픈라벨(SP774)로 전환하는 절차를 거쳤다. 환자는 유
지기간 동안 매일 2회 (bid) 형태로 위약 혹은 정해진 약물량을 투여 받았다.
1차 평가 변수(효능) 중 1차 효능의 경우 유지기간 중 발작 빈도 변화와 50% 반응자 비율 (baseline 대비 발작빈도가 50% 이상 감소한 환자 비율) 이며 2차 효능의 주요 지표는 발작 완
전소실 환자, 무발작일 비율 변화이다.
1차 효능의 결과 중 유지기간(28일 기준) 중 발작 빈도 변화의 경우 ITT 분석에서 lacosamide 200mg/day 35.3% (p=0.02), 400mg/day 36.4% (p=0.04), 위약 투여군 20.5% 감소율을 보였다. per protocol group의 경우 lacosamide 200mg/day 35.3% (p=0.04), 400mg/day 44.9% (p=0.01), 위약 투여군 25.4%를 보여주었다.
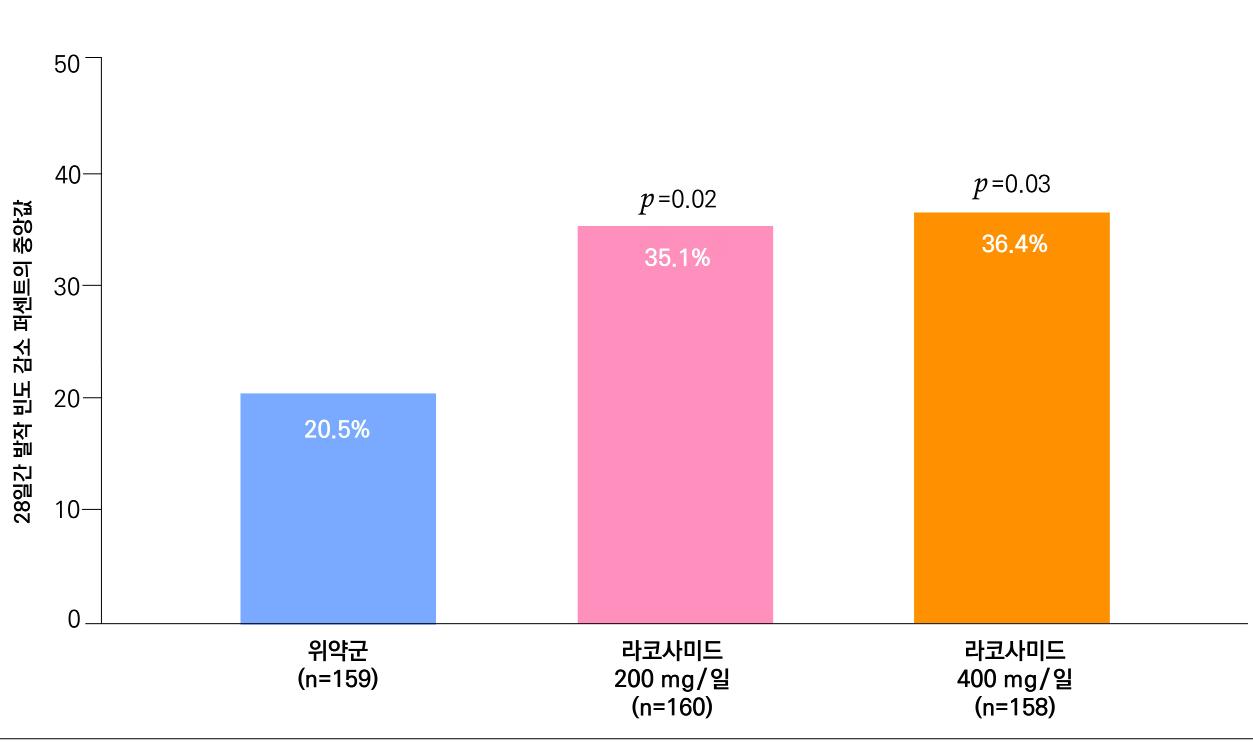
[그림 17] 유지기 동안 발작 빈도 변화 ( ITT군 )
또 다른 1차 효능의 결과인 50% 반응자 비율의 경우 ITT 분석에서 lacosamide 200mg/day
의 경우 35.0% 감소율을 (p=0.07), lacosamide 400mg/day의 경우 40.5% (p=0.01) 감
소율을 보여주면서 위약군의 25.8% 감소율과 비교할 때 두 용량 모두 유의미한 개선을 보였
다. per protocol group의 경우 lacosamide 200mg/day 35.0% (p=0.19), 400mg/day 46.3% (p<0.01), 위약 투여군 27.5% 감소율을 보여주었다.
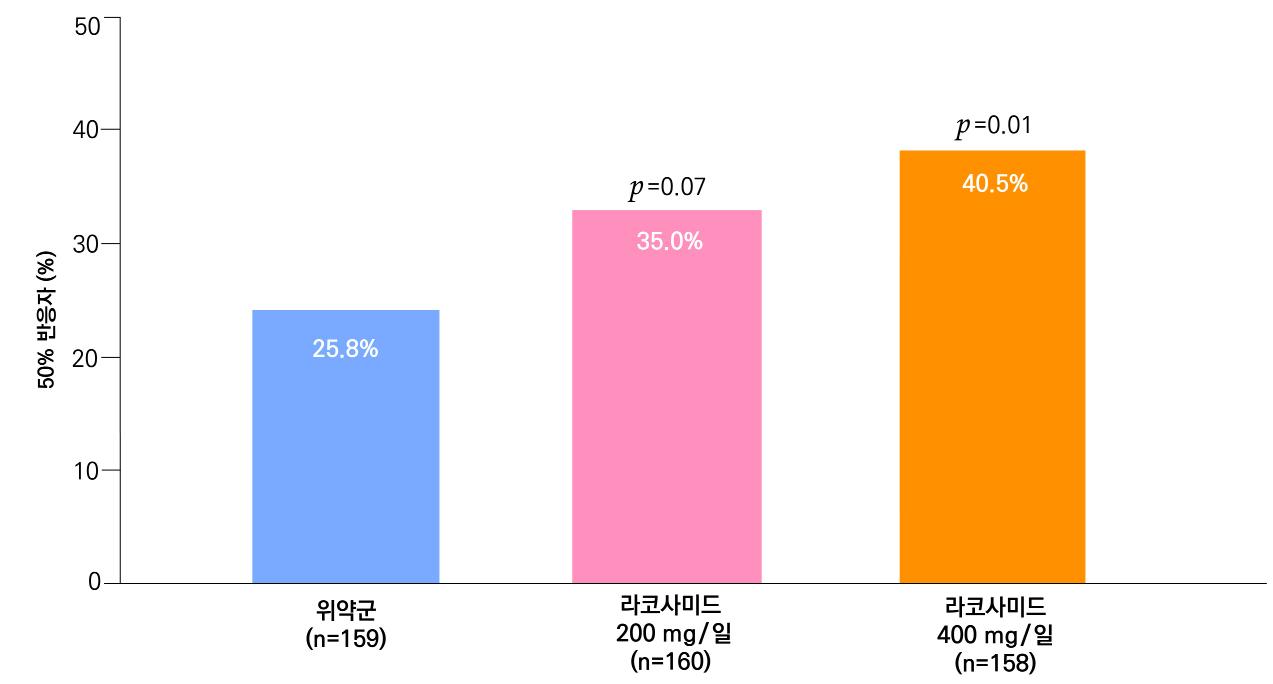
[그림 18] 유지기 동안 50% 반응자 비율 ( ITT군 )
2차 효능의 주요 지표 중 무발작일 비율의 경우 lacosamide 400mg/day 에서 위약대비 5%
증가율을 보여주었으며 그 외 투여군에서는 유의미한 변화를 보여주지 않았다. (p=0.01) 12주
유지기간 동안 발작 완전 소실 환자의 경우 총 11명으로 위약 투여군 3명 (2.1%), lacosamide 200mg/day 5명 (3.6%), lacosamide 400mg/day 3명 (2.4%) 의 발생 분포를 보여주었다. 2차 평가 변수(안전성)의 주요 지표는 이상반응으로 인한 치료 중단률, 중대한 이상반응 발생
률 및 ECG 심전도 평가이다.
이상 반응으로 인한 치료 중단률의 경우 위약 투여군의 경우 4.9% (8명). lacosamide 200mg/ day 6.1% (10명), lacosamide 400mg/day 15.1% (24명) 의 분포를 보여주었다. 다만, lacosamide 200mg/day에서 발생한 10명 중 4명은 유지기 시작 전 발생하였다. 중대한 이
상반응 발생률의 경우 전반적으로 낮은 수준을 보여주었는데 lacosamide 200mg/day의 경우 8.0% lacosamide 400mg/day의 경우 9.4%, 위약 투여군 3.7%의 분포를 보여주었다. ECG
심전도 평가의 경우 baseline 대비 유지기까지의 심박수, QTs 간격, QRS 시간 변화 등에서 유 의미한 변화가 보이지 않았으나 PR 간격에서 lacosamide 군에서 소폭 증가한 추세를 확인할
수 있었다. 하지만, 이는 임상적으로 중대한 문제와 연관성을 보여주지 않았다.
본 임상에서는 1~3종 이상의 항뇌전증제 치료에도 조절되지 않는 부분 발작 환자를 대상으로 lacosamide 200mg/day, 400mg/day의 치료적 유의성을 확인하였다. 1차 결과(효능) 중 1
차 효능에서 lacosamide 200mg/day, lacosamide 400mg/day 투여군 중 400mg/day
에서만 위약 투여군에 비해 발작 빈도 변화 및 50% 반응자 비율을 유의미하게 감소 시켰으며 200mg/day에서의 감소폭은 확인되었으나 유의성을 확보하지 못했다. 또한 2차 효능에서 무발
작일의 비율에서 lacosamide 400mg/day 에서만 유의미한 증가를 확인하였다. 한편, 12주 유
지기 동안 완전 발작 소실 환자수의 경우 세 군의 유의미한 차이를 확인할 수 없었다. 2차 평가변 수(안전성)의 경우 lacosamide 400mg/day에서 이상반응으로 인한 치료 중단률이 제일 높다
는 점 이외에 세 군에서 유의미한 차이를 확인하지 못하였다. 한편, PR 간격에서 용량에 따라 소 폭 증가하는 추세를 확인할 수 있었는데 임상적으로 중대한 문제를 야기하지 않았다. 결론적으로, lacosamide는 400mg/day 투여군에서 기존 항간질제로 조절되지 않던 부분 발 작 환자 대상으로 사용할 수 있는 치료 옵션으로 기능할 수 있으며, 안전성 측면에서도 양호함을 보였다.
라코사미드의
1) 빔스크정의 보험 등재
지난 2017년 2월, 국내에서 처음으로 라코사미드 기반 뇌전증 치료제가 보험 급여를 받았다.
당시 일부 언론에서는 이를 ’제네릭의 반란‘이라고 표현했는데, 해당 급여 건에 이러한 이름이 붙
은 이유는 오리지널 의약품인 한국UCB제약의 빔팻정(Vimpat, Lacosamide)과 다른 제네릭
의약품을 제치고, 제네릭 제품이 최초로 급여 등재되었기 때문이다.
국내 최초 등재된 라코사미드 기반 의약품은 SK케미칼의 빔스크정(Vimsk Tab, Lacosamide) 으로, 등재 용량은 50mg, 100mg, 150mg, 200mg 용량이다. 이후 전체 또는 일부 용량에 대 한 다섯 차례의 약가 인하를 거쳐 현재 용량별 약가는 50mg 230원, 100mg 369원, 150mg 463원, 200mg 537원으로 책정되어 있는 상태이다.
[표 13] 빔스크정의 국내 허가 타임라인
2016. 08. 31. 허가
2016. 12. 15. 약제급여평가위원회 심의일
2017. 02. 01. 급여 최초 등재
2017. 06. 01.
2018. 04. 01.
2020. 01. 01.
전체적 약가 인하 (보험급여 정책 영향)
전체적 약가 인하 (보험급여 정책 영향)
전체적 약가 인하 (실거래가에 따른 상한금액 조정) → 이후 2020. 03. 20. 재평가( 고시)
50mg 435원/1정
100mg 696원/1정
150mg 871원/1정
200mg 1016원/1정
50mg 305원/1정
100mg 488원/1정
150mg 609원/1정
200mg 711원/1정
50mg 233원/1정
100mg 373원/1정
150mg 466원/1정
200mg 544원/1정
50mg 232원/1정
100mg 372원/1정
150mg 465원/1정
200mg 542원/1정
(표 이어서)
2022. 01. 01.
2024. 07. 01.
50mg, 150mg, 200mg 약가 인 하 (실거래가에 따른 상한금액 조정)
전체적 약가 인하 (실거래가에 따른 상한금액 조정)
50mg 231원/1정
100mg 372원/1정
150mg 464원/1정
200mg 540원/1정
50mg 230원/1정
100mg 369원/1정
150mg 463원/1정
200mg 537원/1정
빔스크정의 경우, 오리지널 의약품인 빔팻정과
투여경로, 함량, 제형이 동일한 ‘제네릭‘임 에도 불구하고, 최초 허가된 의약품보다 먼저, 최초의 보험 급여를 획득했으므로 최초 등재되는 신약과 동일하게 취급되어 등재 시 약가 협상이 가능했다. 그러나 빔스크정은 당시 제네릭이 다 수 발매되고 있던 상황에서 ’약가협상생략’ 방식을 선택하였고, 이를 통해 대체 약제 가중평균 금
액의 90%를 약가로 지정받으면서도 최대한 빠른 시장 진입을 목표하였다는 것을 알 수 있다. 빔
스크정은 이렇게 급여를 기반으로 최초 시장에 진입한 후 위 표와 같이 다섯 차례의 약가 인하를 경험하였다.
먼저 2017년 6월과 2018년 4월의 인하는 국내 보험급여 정책에 따른 조정이다. 국내 보험급 여 정책에 따르면, 오리지널 의약품의 최초 등재 이후 첫 제네릭이 등재될 경우 기존 오리지널 의
약품은 종전가격 대비 70% 수준까지 인하되며, 이후 1년 내 4개 이상의 제네릭이 등재되고 해당 기간(1년, 가산 기간)이 지나면 최초 등재 가격의 53.55%로 상한가격이 인하되게 되어 있다. 빔스크정의 경우 역시 이 급여 제도의 적용을 받는다는 것을 인식하되, 앞서 언급된 바와 같이 빔스크정이 최초 등재되는 오리지널 의약품과 동일하게 취급된 점을 고려해 주어야 한다. 즉 해당 의약품의 급여 등재가 등재된 2017년 2월 이후, 2017년 4월부터 환인제약의 네오팻정(Neopat Tab, Lacosamide) (4개 함량), 명인제약의 라코정(Laco Tab, Lacosamide) (2개 함량), 한 국콜마의 빔코사정(Vimcosa, Lacosamide) (2개 함량), 현대약품의 라코팻정(Lacopat Tab, Lacosamide) (2개 함량) 등이 약제 급여목록에 등재되었고, 이에 따라 2017년 6월 약가가 종 전 가격 대비 70% 수준으로 인하되었으며, 1년 후인 2018년 4월 가산 기간이 종료되어 종전 가 격의 53.55%로 비용이 재조정된 것이다.
보험급여 정책에 따른 2건의 조정 이외의 세 차례 약가 인하는 실거래가에 따른 상한금액 조정으 로 인한 것이다. 이는 2년 주기로 실시되는 실거래가 조사에 기반하며, 이때 말하는 실거래가 조 사는 요양기관의 요양 급여비용 명세서를 바탕으로 품목별 가중평균 가격 산출 후 이를 기준상한 금액과 비교하여 가중평균 가격이 더 낮으면 해당 약제의 상한금액을 가중평균가격으로 인하하는 제도(인하율은 기준상한금액의 10% 이내로 함)이다. 이는 약가와 시장에서 실제 거래되는 평균
가격 사이의 거리감을 줄여 보험재정의 효율성과 약제비 적정성을 확보하기 위해 시행되며, 여기
서 말하는 가중평균가격은 요양기관이 청구한 약제 총액의 합을 청구량의 총합으로 나눈 가격이 고 기준상한금액은 약제 실거래가 조사 대상 기간의 종료일 당시의 약제 상한금액이다. 즉 나머지 세 차례의 약가 조정은 이러한 급여정책 관련은 아니지만, 실거래가 조사를 통해 확인한 비용적 간극을 줄여 보험재정의 효율성과
제네릭인 빔스크정이 급여 등재로 시장 진입하였던 반면, 최초 허가된 라코사미드 오리지널 의 약품 ‘빔팻정‘은 시장 진입 이후에도 연이은 급여 등재 실패로 ‘자진 철수‘라는 결과를 맞이하였 다. 즉 ’상대적 경쟁력 하락’으로, 빔팻정은 국내 첫 허가를 통해 시장 초반 인지도와 점유율을 확 보하였으나, 비급여 판매와 특허 종료 후 잇따른 제네릭 제품의 급여 등재 및 시판으로 상대적 경
쟁력이 하락하고 매출 감소로 이어진 것이다.
그렇다면 빔팻정이 오리지널 의약품임에도 보험 등재가 어려웠던 이유는 무엇일까? 하나를 꼽
아보자면 바로 비용효과성이다. 국내 급여 정책에 따르면, 급여 평가 시 대체약제 대비 효과성을 우선 검토하며, 효과가 우월할 경우 경제성 평가를 거쳐 고가로 급여가 가능하다. 그러나 우월하 지 않은 비열등약제일 경우, 대체약제 가중평균가(WAP) 이하를 수용해야 하며, 일정 조건을 만 족하면 약가 협상이 면제된다.
한국UCB제약은 빔팻정에 대해 2011년과 2013년 총 3차례, 빔팻시럽(Vimpat syrup, Lacosamide)에 대해 2013년 총 1차례 약제급여평가를 진행했으나, 모두 비열등약제로 판단 되었다. 이에 따라 대체 약제 가중평균가 이하를 수용해야 했으나, 제약사는 효과 대비 가격이 불 합리하다고 판단하여 수용하지 않았다. 결과적으로 비급여로 결정되었으며, 이후 빔스크정의 급 여 등재와 다수 제네릭 제품의 시장 진입으로 빔팻정 매출은 급격히 하락하였다.
실제로 2017년 빔스크정 등재 이후, 빔팻정의 매출은 약 65% 감소하였다. 빔팻정은 전 세계
뇌전증 치료제 시장에서 1위 품목으로 연 매출 약 7억6천만 달러를 기록하고, 처방 변경에 민감 한 중추신경계 약물이라는 특성을 가지고 있음에도 불구하고, 오리지널 의약품의 비급여와 다수
제네릭의 급여 등재 간 차이가 매출에 큰 영향을 미쳤다. 50mg 1정 기준 빔팻 약가가 2000원
정도였던 반면 빔스크정 출시 당시 보험 상한가가 435원이었던 점, 심지어 추가 인하로 현재 약
가가 230원인 점을 고려해 보면 그 차이와 그로부터 오는 환자의 비용적 부담을 직감할 수 있다.
이러한 상황을 배경으로 빔팻정은 2018년 5월 14일, 결국 품목허가를 자진 취하하며 국내 시장 에서 철수하였다.
4) 기타 제네릭의 보험 등재 현황
현재 보험에 등재되어 있는 라코사미드 기반 제네릭 의약품은 총 5가지이다. 일부 제품은 급여
상한가가
(17.04.01.)
(24.07.01.)
(17.04.01.) 359원 (20.01.01.)
358원 (22.01.01.)
356원 (24.07.01.)
466원 (17.04.01.)
465원 (22.01.01.)
544원 (17.04.01.)
540원 (20.01.01.)
464원 (24.07.01.) 네오팻정(200mg)
539원 (22.01.01.)
537원 (24.07.01.)
259원 (17.09.01.)
233원 (18.04.01.)
227원 (20.01.01.)
224원 (22.01.01.)
220원 (24.07.01.)
414원 (17.09.01.)
373원 (18.04.01.)
367원 (22.01.01.)
362원 (24.07.01.)
라코정(50mg)
라코정(100mg)
라코정(150mg)
라코정(200mg)
라코팻정(50mg)
라코팻정(100mg)
빔스크정(50mg)
명인제약(주) 228원
461원
빔스크정(100mg)
에스케이케미칼(주)
빔스크정(150mg) 463원
빔스크정(200mg)
[취하된 약]
빔코사정 50mg : 17.04. 등재 후 22.02. 삭제
빔코사정 100mg : 17.04. 등재 후 22.02. 삭제
빔프로정 50mg : 19.08. 등재 후 22.05. 삭제
빔프로정 100mg : 19.08. 등재 후 22.05. 삭제
빔프로정 150mg : 19.08. 등재 후 22.11. 삭제
빔프로정 200mg : 19.08. 등재 후 22.05. 삭제
537원
259원 (17.04.01.)
233원 (18.04.01.)
232원 (20.01.01.)
230원 (22.01.01.)
228원 (24.07.01.)
414원 (17.04.01.)
373원 (18.04.01.)
371원 (20.01.01.)
368원 (20.01.01.)
364원 (24.07.01.)
466원 (17.09.01.)
465원 (20.01.01.)
463원 (22.01.01.)
461원 (24.07.01.)
544원 (17.09.01.)
541원 (20.01.01.)
538원 (22.01.01.)
536원 (24.07.01.)
(17.04.01.)
(18.04.01.)
(20.01.01.)
(17.04.01.)
(18.04.01.)
435원 (17.02.01.)
305원 (17.06.01.)
233원 (18.04.01.)
232원 (20.01.01.)
231원 (22.01.01.)
230원 (24.07.01.)
696원 (17.02.01.)
488원 (17.06.01.)
373원 (18.04.01.)
372원 (20.01.01.)
371원 (22.01.01.)
369원 (24.07.01.)
871원 (17.02.01.)
609원 (17.06.01.)
466원 (18.04.01.)
465원 (20.01.01.)
464원 (22.01.01.)
463원 (24.07.01.)
1016원 (17.02.01.)
711원 (17.06.01.)
544원 (18.04.01.)
542원 (20.01.01.)
540원 (22.01.01.)
537원 (24.07.01.)
한편 위 표를 보면 현재 급여된 품목은 모두 정제임을 확인할 수 있다. 반면 전술된 허가 파트를
보면 빔스크주(Lacosamide, 주사제)와 라코팻시럽(Lacosamide, 시럽제)이 허가된 상태임을 볼 수 있다. 즉 국내 많은 제네릭이 잇따라 보험 급여에 등재된 상황에서 빔스크주와 라코팻시럽
두 제네릭이 보험 급여에 실패하였다는 것인데, 왜 이러한 결과가 나타났는지는 정확한 근거를 찾 을 수 없었다. 몇 가지 추정 할 수 있는 원인을 함께 작성해보면 다음과 같다.
먼저 제약사 측면에서 약가 협상 미진행 또는 실패되었을 가능성이 있다. 앞서 빔팻정의 급여
등재 실패 전례가 있어 제약사 자체에서 급여 신청을 하지 않았거나 빔팻정과 같이 약가 협상이
되지 않았을 가능성이 있다.
둘째로는 제형 특성과 비용-효과성을
적용 대상이 제한적이고 시장 규모가 작아 비용
제조 단가가 높은 경우가 많기에 건강보험
밀렸을 가능성도 고려해 볼 수 있다.
5) 라코사미드의 시장 점유율 및 일부 제네릭이
뇌전증은 경련이 반복적으로 발생하는 질환으로, 약물치료를 통해 발작 빈도를 안정적으로 조절 하는 것이 기본 치료이다. 이에 따라 항뇌전증제의 경우 환자를 대상으로 높은 빈도로 사용될 수
밖에 없다. 그중 라코사미드는 승인 이후에도 다른 성분의 항뇌전증제가 연이어 등장했음에도 불 구하고, 출시 이후 연평균 매출액 증가율 약 31.6%(09~21년도 12년의 연평균성장률(CAGR))
로 시장점유율을 꾸준히 확대해 왔다. 이러한 성장은 근본적으로 유효성과 안전성에 기반하며,
실제 임상 3상 연구에서는 기존 약물로 발작 조절이 되지 않는 환자에서 50% 이상 발작이 감소 한 비율이 위약군과 후속 약물 대비 유의미하게 개선된 것이 확인되기도 하였다.
시장 분석 결과, 향후 라코사미드 시장은 더욱 확대될 것으로 예측된다. 지난 2023년 라코사미 드의 전체 매출은 이미 58억 달러를 기록했으며, 2024년부터 2031년까지 4.7%의 연평균성장 률(CAGR)로 79억 달러까지 성장할 것으로 전망된다. 이는 뇌전증 및 신경계 질환의 유병률 증 가, 의료 인프라 확장,
[표 15] 제네릭의 국내 허가 취하 사례 제품명
빔코사정 (50mg, 100mg) 제뉴원사이언스
빔프로정 (50mg, 100mg, 150mg, 200mg)
빔코사정은 국내에서 Lacosamide 제네릭으로는 첫 번째 허가 이탈 사례로 기록된다. UCB의
빔팻정이 국내 시장에서 비급여 판매로 인해 가격 경쟁력이 낮아지고 시장에서 밀려났던 사례와
달리, 제네릭인 빔코사정은 2016년 Vimpat의 세 번째 제네릭으로 허가를 받아 급여 등재 후 출
시되었다. 그러나 2018년 원외 처방액이 3,000만 원 수준에 그치고 이후에도 처방이 거의 발생
하지 않았고, 결국 2021년 허가를 자진 취하하게 되었다. 이 사례는 당시 존재했던 ‘국내 시장의
제네릭 급여 출시에 따른 수요 급증 기대’와는 상반된 결과를 보여준다.
한편 허가 자진 취하된 또다른 의약품인 빔프로정은 SK케미칼에 위탁 제조하는 방식으로 2019
년 허가를 받아 생동성 시험을 생략함으로써 개발 시 2~4억 원 정도의 비용을 절감한 의약품이었 다. 또한, 2019년 출시 당시 시장 1위 의약품이었던 빔스크정을 위협할 제품으로 언급되기도 했
는데, 이는 자사인 대웅바이오가 이미 CNS 약물 ‘글리아타민‘으로 원외 처방액 767억 원을 달 성하는 등 관련 영업망을 적극 활용할 것으로 예상되었기 때문이다. 그러나 실제 빔프로정은 허 가 이후 5년이 지난 2024년 ‘의약품 품목허가 갱신제도’에 의해 의약품 허가가 취하되며 국내 시
장에서 철수하였다. 이는 2019년부터 대웅제약이 수익성 강화를 위해 펼치던 일명 ‘의약품 허가 자진 취하‘ 전략과 연관이 있다.
의약품 품목허가 갱신제도에 따르면 원료의약품과 수출용의약품을 제외한, 모든 허가된 의약품
은 5년마다 허가 혹은 신고를 갱신하여 유효성과 안전성을 입증하여야 한다. 대웅바이오는 이 제
도를 활용하여 2019년 1월 1일~4월 23일 기준 48개의 의약품에 대해 자진 취하하며 10대 제
약사 중 자진 취하 건수 1위 제약사에 자리 하였다. 즉 수익성 없는 약의 자진 퇴출로부터 수익 성 향상 전략을 펼친 것이다. 빔프로정의 자진 취하 사례도 이러한 전략이 적용된 것으로 예상되 며, 이를 통해 당시 높은 경쟁력을 갖춘 제네릭도 시장에서 일정 비율을 점유하기가 어려웠음을
예상해 볼 수 있다.
그렇다면 효능과 안전성이 높은 라코사미드, 심지어 가격과 영업망 등 다양한 측면에서 높은 경 쟁력을 챙긴 두 제네릭 의약품은 왜 허가를 자진 취하하게 된 것일지 그 이면을 살펴볼 필요가 있 다.
먼저 뇌전증 치료제는 환자의 생명과 직결되고 처방 변경에 민감하기 때문에 오리지널 제품에
대한 선호도가 높다는 측면을 살펴보아야 한다. 국내에서는 비교적 선호되는 오리지널 의약품인
Vimpat의 처방 경험조차 저조했다는 결과, 그리고 이와 함께 특허 직후 다양한 제네릭 출시로 상대적 경쟁력 약화가 이어지면서 처방이 저조하게 기록되게 된 것이다. 이는 시장 철수라는 결
론으로 이어지는 데 첫 다리를 놓은 요인일 것이다.
그 다음으로 영향을 끼친 것은 Vimpat 특허 만료와 함께 우후죽순으로 출시된 제네릭으로 인한
경쟁률 상승을 생각해 볼 수 있다. 2017년 Vimpat의 국내 특허 만료 당시 5개 회사에서 총 25 개의 라코사미드 제제가 출시되었다. 이들 회사는 명인제약, 현대약품, 환인제약, 한국콜마 등 이
미 CNS 분야에서 강한 영업력 및 경쟁력을 가진 회사들로, 시장 진입 후 경쟁이 치열해졌다.결 과적으로 일부 제네릭은 처방액이 거의 0원에 달하는 상황이 나타나기도 하였다.
이러한 현상은 글로벌 시장에서도 유사하게 확인되었다. 2021년 UCB제약의 빔팻정은 미국에 서 12억 7,000만달러, 전 세계에서 17억 4,000만 달러 매출을 기록했으나, 특허 만료로 인도 의 아우로빈도파마와 자이더스카딜라 등이 2015년과 2019년에 FDA로부터 제네릭 잠정 허가
를 받았고, 2022년 빔팻정의 특허 만료 후 시장에 제네릭이 출시되면서 특허 만료로 손해가 가 장 큰 글로벌 의약품 상위 3위 품목에 포함되기도 하였다.
한국에서는 오리지널 제품인 빔팻정이 철수된 것과 달리, 현재는 정제 50mg, 100mg, 150mg, 200mg뿐만 아니라 10mg/ml, 15mg/ml 시럽제와 10mg/ml IV 제제에 대해서도 보험 급 여가 적용되고 있는 것으로 확인된다. 이들 의약품의 급여 사항은 아래와 같이 정리할 수
Lacosamide 100mg
Vimpat
Lacosamide 150mg
Vimpat syrup
Lacosamide 200mg
Lacosamide 10mg/ml 추가 등재 2018년 1월
adjunctive therapy in the treatment of partial-onset seizures with or without secondary generalization in patients with epilepsy aged 16 years and older
변경 시 adjunctive therapy in the treatment of partial-onset seizures with or without secondary generalization in adolescents and children from 4 years of age with epilepsy
등재 시 adjunctive therapy in the treatment of partial-onset seizures with or without secondary generalization in adolescents and children from 4 years of age with epilepsy
Lacosamide 15mg/ml 최초 등재 2009년 1월 adjunctive therapy in the treatment of partial-onset seizures with or without secondary generalization in patients with epilepsy aged 16 years and older
(표 이어서)
Vimpat solution for IV Lacosamide 10mg/ml
최초 등재 2009년 1월
변경 2018년 1월
최초 등재 시 adjunctive therapy in the treatment of partial-onset seizures with or without secondary generalization in patients with epilepsy aged 16 years and older
변경 시 adjunctive therapy in the treatment of partial-onset seizures with or without secondary generalization in adolescents and children from 4 years of age with epilepsy
영국의 Lacosamide 급여 현황은 크게 2009년 1월 최초 등재 시와 2018년 1월 등재 사항 변 경 시로 나누어 살펴볼 수 있다. 영국에서는 MHRA에서 허가를 받은 후, NICE에서 임상적 효
과와 비용효과성을 평가하는 HTA(Health Technology Assessment) 결과를 기반으로 급여
적합성을 판단한다. 영국은 기본적으로 급여를 하되, 급여가 적절하지 않다고 판단되는 의약품은
제외하는 Negative list 제도를 적용하고 있기 때문에 NICE에서 급여 적합성을 인정받으면 자 동으로 급여가 적용된다.
이후 NHS England 및 지역 NHS Trust에서 HTA 결과와 예산 상황을 고려하여 급여 적용 범
위와 조건을 세부적으로 결정하며, 이는 NHS Drug Tariff와 각 지역 Formulary에 등재된다.
이에 따라 의료기관에서 처방 및 보험급여가 이루어진다. 즉, 한국과는 다른 영국은 지역별로 적 용되는 적응증과 조건이 상이할 수 있다. 본 학회지에서는 대표적으로 Scotland 지역에서 등재 된 사항을 중심으로 서술하였다.
NICE에서 2022년 공개한 ‘Epilepsies in children, young people and adults’ 문서를 통 해, 영국 내 급여 사항에 따른 경제성 평가 결과를 분석할 수 있었다. 해당 문서에 따른 주요 결 과는 아래와 같다.
[표 17] 영국 내 급여 사항에 따른 경제성 평가 결과
치료요법 FOS (부분발작)
Mono therapy
Add-on therapy
경제성 : Lamotrigine, Levetiracetam > Zonisamide *Lacosamide는 경제성 없음으로 판단
Lacosamide의 효과 및 경제성 근거를 인 정, Lacosamide 포함 주요 약제군 1차 급 여 권고
GTC (전신강직간대발작)
경제성 : Lamotrigine, Valproate 최우수 *Lacosamide는 QALY 최소, 비용 최대로 경제성 없음으로 판단
Lacosamide가 1차 급여 권고 약물로 포함, 그러나 효과 및 경제성 측면에서 Levetiracetam, Topiramate보다 열위에 있다고 판단 (cost-effective 확률 10.9%)
NICE의 평가에 따르면, Lacosamide는 FOS(Focal Onset Seizures) 및 GTC(Generalized Tonic-Clonic) 모두에서 Mono therapy(단독요법)로서의 경제성이 낮아 급여 가능성이 매우 낮았다. 반면, Add-on therapy(부가요법)로 사용될 경우 두 적응증 모두에서 급여 포함 가능성 이 인정되었다. 다만 GTC의 경우 상대적으로 낮은 비용효과성으로 평가되어, 해당 적응증에서
는 보조적 역할에 주로 활용될 수 있을 것으로 판단된다. 이러한 NICE의 판단에 따라, Lacosamide 급여 적용은 주로 부가요법에 집중되며, 단독요법으로의 확장은 경제성 부족으로 인해 가능성이 작을 것으로 판단된다.
2) 미국 : Express Scripts 사 기준을 중심으로
미국에서도 Lacosamide의 보험 급여 적용은 한국과 상이하며, 영국과도 다른 절차를 따른 다. 미국 건강보험은 크게 민간 건강보험과 공공 건강보험으로 구분되며, 민간 건강보험은 직장 건강보험과 개인 보험 등 다양하게 구성되는 반면 공공 건강보험은 65세 이상 노인과 저소득층
을 대상으로 하는 Medicare와 Medicaid 2가지만이 존재한다. 이와 함께 PBM(Prescription Benefit Manager)이라는 중개업체가 보험사와 제약사 사이에서 약가 협상, 처방약 선정, 유통
과정 등을 조율하며, PBM의 결정에 따라 보험사의 급여 등재 여부가 달라지므로 보험사별로 급 여 사항이 상이할 수 있다. 본 학회지에서는 2024~2025년 기준 약 23%의 시장점유율을 가진
미국 2대 PBM 중 하나인 ‘Express Scripts’ 사의 보험 급여 등재 현황을 중심으로 서술하였다.
*미국 내 시장점유율 1위에 해당하는 PBM인 CVS Caremark 사의 경우 미국 이외의 국가에 정보 공개를 하지 않음
PBM에서는 의약품을 Tier 1~5로 분류하고, 낮은 티어일수록 우선 처방을 권고한다. 포뮬러
리에 등재되지 못한 의약품은 비급여로 환자에게 제공된다. Express Scripts 사에서 공개한 ‘2024 Formulary’에 따르면, Lacosamide는 가장 낮은 copayment 및 co-insurance를 나 타내는 의약품인 Tier 1에 배치되었고, 동일한 성분에 대하여 우선 처방이 권고되고 있다.
[표 18] PBM의 의약품 분류
구분 (Tier) 포함 약물 참고 사항
Tier 1
Tier 2
Tier 3
이 단계에는 일반적으로 처방되는 다수의 제네 릭 의약품이 포함되며, 그 밖의 저가 의약품도 포함될 수 있다.
이 단계에는 선호되는 오리지날 의약품과 일부 제네릭 의약품이 포함된다.
이 단계에는 비선호 오리지날 의약품과 일부 제
네릭 의약품이 포함된다.
가장 낮은 본인부담금을 위해 1단계 의약품을 사용하는 것이 좋다.
이 단계의 의약품은 비선호 의약품에 비해 일반 적으로 더 낮은 본인부담금을 가진다.
다수의 비선호 의약품에는 1단계 또는 2단계 의약품으로 대체 가능한 저가 대체제가 존재한 다. 저가의 제네릭 또는 선호 브랜드 의약품으 로 변경이 가능한지 의사와 상의하는 것이 좋 다.
라코사미드가 Tier 1에 등재됨에 따라, 환자 입장에서는 경제적 부담이 낮아지고 처방 접근성이 향상되며 장기 복용과 치료 지속 가능성이 커졌다. 이러한 변화는 장기적 치료가 중요하고 처방
의약품 변경에 민감한 항뇌전증제 시장에서 환자의 선택 유인을 높이는 요인으로 작용할 것이다.
Beydoun, A., D’Souza, J., Hebert, D., & Doty, P. (2009). Lacosamide: Pharmacology, mechanisms of action and pooled efficacy and safety data in partial-onset seizures. Expert Review of Neurotherapeutics, 9(1), 33–42.Retrieved from https://doi.org/10.1586/14737175.9.1.33
DrugBank Online. (n.d.). Lacosamide – DB06218. Canadian Institutes of Health Research. Retrieved July 8, 2025, Retrieved from https://go.drugbank.com/drugs/DB06218
U.S. Food and Drug Administration. (2021, November). Vimpat (lacosamide) [Prescribing information].Retrieved from https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/022 253s049,022254s039,022255s031lbl.pdf
U.S. Food and Drug Administration. (2023). Clinical pharmacology and biopharmaceutics review(s): Motpoly XR (lacosamide). Retrieved from https://www.fda.gov/media/170702/ download -허가
어윤호. (2010.08.17). 한국UCB제약, 항뇌전증제 ‘빔팻’ 국내 허가. 메디컬투데이. Retrieved from https:// mdtoday.co.kr/news/view/179586467237523
의약품안전나라. (2016.08.31). 빔스크정100밀리그램(라코사미드). Retrieved from https://nedrug.mfds. go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=201605344aupdate
천승연. (2018.06.14). ‘진화하는 제네릭의 승부수’ 오리지널을 밀어내다. 데일리팜. Retrieved from https:// www.dailypharm.com/News/240749
EMA. (2024.03.25). Vimpat : EPAR - Product Information, Retrieved from https://www.ema.europa. eu/en/medicines/human/EPAR/vimpat#product-details
FDA. (2023.10.31). Approval Date(s) and History, Letters, Labels, Reviews for NDA 022253, Retrieved from https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview. process&ApplNo=022253
-임상
FDA 1
Ben-Menachem, E., Biton, V., Jatuzis, D., Abou-Khalil, B., Doty, P., & Rudd, G. D. (2007). Efficacy and safety of oral lacosamide as adjunctive therapy in adults with partial-onset seizures (Vol. 48, Issue 7, pp. 1308-1317). Epilepsia. https://pubmed.ncbi.nlm.nih.gov/17635557/
FDA 2
Halász, P., Kälviäinen, R., Mazurkiewicz-Beldzińska, M., Rosenow, F., Doty, P., Hebert, D., & Sullivan, T. (2010). Efficacy and safety of oral lacosamide as adjunctive therapy in adults with partial-onset seizures. Epilepsia, 51(6), 958–967. https://pubmed.ncbi.nlm.nih.gov/20132285/
U.S. National Library of Medicine. (n.d.). A study of oral lacosamide (SPD 422) as adjunctive therapy in adults with partial seizures (NCT00136019). ClinicalTrials.gov. https://clinicaltrials.gov/study/ NCT00136019
FDA 3
Sake, J.-K., Hebert, D., Isojärvi, J., Doty, P., De Backer, M., Davies, K., … Zackheim, J. (2010). A pooled analysis of lacosamide clinical trial data grouped by mechanism of action of concomitant antiepileptic drugs. CNS Drugs, 24(12), 1055-1068. https://pubmed.ncbi.nlm.nih.gov/21090839/
U.S. National Library of Medicine. (n.d.). Efficacy and safety of oral lacosamide as adjunctive therapy in adults with partial-onset seizures (NCT00220415). ClinicalTrials.gov. https://clinicaltrials.gov/ study/NCT00220415
-급여
건강보험심사평가원. 급여이력정보. Retrieved from https://www.hira.or.kr/ra/medi/getHistoryList. do?pgmid=HIRAA030035020000&WT.gnb=의약품통합정보
건강보험심사평가원. 약제기준정보. Retrieved from https://www.hira.or.kr/bbsDummy. do?pgmid=HIRAA030014040000
건강보험심사평가원. 약제급여목록표. Retrieved from https://www.hira.or.kr/bbsDummyKR. do?pgmid=HIRAA030014050000
김명선. (2019.04.23.). 의약품 허가 자진취하 ‘압도적 1위’ 대웅제약에 무슨 일이. 비즈한국. Retrieved from https://www.bizhankook.com/bk/article/17633
박재경. (2022). 에스케이바이오팜(326030). 하나금융투자. Retrieved from https://www.hanaw.com/ download/research/FileServer/WEB/industry/enterprise/2022/03/20/SKbp_220321.pdf
약제의 결정 및 조정 기준(보건복지부고시 제2025-137호) 제8조 제2항 제13호 [별표 6]
이순호. (2019.05.01.). ‘빔팻’ 빠진 라코사미드 시장 대웅도 가세. 헬스코리아뉴스. Retrieved from https:// www.hkn24.com/news/articleView.html?idxno=304962
이순호. (2021.06.30.). ‘빔팻’ 떠난 라코사미드 시장 제네릭도 탈출. 헬스코리아뉴스. Retrieved from https:// www.hkn24.com/news/articleView.html?idxno=319744&utm
이우진. (2017.06.15.). 뇌전증 치료제 시장 군침… 빔팻 제네릭 ‘선수’ 출격 준비. 약사공론. Retrieved from https://www.kpanews.co.kr/article/show.asp?category=D&idx=184584&utm
이혜경. (2018.06.08.). 격년제 실거래가 인하, 내달부터 1년간 청구량 조사. 데일리팜. Retrieved from https:// dailypharmkorea.com/Users/News/NewsView.html?ID=240582&utm
정종호. (2022.03.12.). 2022년 특허만료로 가장 손해가 큰 상위 10위권 글로벌 품목은?. 헬스오. Retrieved from https://www.healtho.co.kr/news/view.php?idx=135052
최은택. (2017.05.24.). 뇌전증약 빔스크정, 등재 4개월 만에 약가 30% ↓. 데일리팜. Retrieved from https:// www.dailypharm.com/Users/News/NewsView.html?ID=226700
Express Scripts Medicare(PDP). (2023.08.). Express Scripts Medicare(PDP) 2024 Formulary (List of Covered Drugs). Express Scripts Medicare(PDP). Retrieved from https://www.express-scripts.com/ pdf/egwp/F0PA3P4A.pdf
guideline NG217, N. I. C. E. (2022). Epilepsies in children, young people and adults: diagnosis and management. Methods.
SHBP, Express Scripts. Transition of prescription drug coverage. Express Scripts. Retrieved from https://www.express-scripts.com/art/open_enrollment/Transition_GASHBPRX46529.pdf
류세하 shryu5037@naver.com
신지혜 shinjh0506@naver.com
이현진 junah2004@naver.com
페람파넬 (Perampanel)
페람파넬(Perampanel)은 Eisai에서 개발한 3세대 항경련제이다. 2012년 7월, Fycompa라
는 상품명으로 EMA에서 허가하였고, 같은 해 10월 미국 FDA에서도 허가하였다. 국내에서는 3년이 지난 2015년 7월에 허가하였다. 현재는 만 4세 이상의 환자의 부분발작에 대한 단독 및
부가요법, 만 7세 이상의 환자의 일차성 전신 강직-간대발작의 부가요법을 국내 적응증으로 가 지고 있다.
제형으로는 2, 4, 6, 8, 10, 12mg 필름코팅정, 0.5mg/ml 현탁액의 두 가지가 존재한다. 치
료 시작 시 1일 2mg으로 시작하여 최소 2주 간격으로 1일 2mg씩 증량하는 용량조절기를 거쳐
유지용량인 4-8mg까지 증량할 수 있다. 단독요법으로 사용 시에는 최대 1일 8mg까지 증량할 수 있고, 부가요법으로
차별화된 기전
항뇌전증제 군에서 페람파넬이 갖는
가진다
는 것이다. 기존의 치료제들은 대부분 Na+ 채널 차단, Ca²+ 조절, GABA 작용제로서 항경련 작 용을 나타내었다. 그러나 페람파넬의 경우 비경쟁적 AMPA type glutamate 수용체 길항제라
는 독립적인 기전을 가져 시냅스 후 뉴런의 AMPA 수용체 이온통로의 세포 바깥쪽 알로스테릭 부위에 결합하여 이온통로의 개방을 억제한다. 이로 인해 시냅스 후 뉴런의 탈분극이 억제되고 경련을 예방할 수 있게 된다. 이렇듯 해당 치료제는 차별화된 기전을 통해 기존의 약물들에 반응 하지 않는 난치성 뇌전증의 치료에 새로운 가능성을 제시할 수 있었다. 임상시험 역시
동향
현재 부분발작 환자와 일차성 전신 강직-간대발작 환자에서 페람파넬 주사제형의 안정성 평가
를 위한 임상시험이 계획되어 있다. 이를 통해 주사제형의 추가를 계획하고 있음을 알 수 있다. 또
한 심정지 이후의 간질 중첩증 예방을 위한 임상시험 역시 피험자를 모집 중이다. 심정지 후 저산
소성 뇌손상으로 인해 뇌병증이 흔히 발생할 수 있는데, 이로 인한 뇌전증들에 대한 적응증 확대
를 위해 임상을 계획 중임을 알 수 있다. 뇌전증에는 다양한 발작 종류가 있기 때문에 꾸준히 적
응증 확대를 위해 노력할 것으로 예상된다.
파이콤파(FycompaⓇ, 성분명 Perampanel)은 일본의 제약사 Eisai에서 개발한 3세대 항경 련제이다. 기존 항경련제들이 주로 Na + 채널 차단, Ca 2+ 조절, 또는 GABA 작용을 통해 효과
를 나타내는 것과 달리, 파이콤파는 비경쟁적 AMPA type glutamate 수용체
적인 기전을 가진다. 이는
허가 적응증 및 타임라인
1. 적응증 파이콤파는 2015년 7월 10일 국내에 허가된 뇌전증
가 시에는 12세 이상의 간질 환자에서 이차성 전신발작을 동반하거나
(partial-onset seizure)에 부가요법으로
확 대되었으며, 현재 국내에서는 ▲만 4세 이상 뇌전증 환자의 이차성 전신발작을 동반하거나 동반 하지 않는 부분발작의 치료에 단독요법 ▲만 4세 이상 뇌전증 환자의 이차성 전신발작을 동반하 거나 동반하지 않는 부분발작에 부가요법 ▲만 7세 이상의 특발성 전신성 뇌전증 환자의 일차성 전신강직-간대발작 (primary generalized tonic-clonic seizure)에 부가요법으로 허가되어 있다. 한편, 영국에서는 부분발작 치료에 대한 단독요법은 허가 받지 못하였다. 미국은 적응증 범위가 유사하나, 일차성 전신강직-간대발작은 12세 이상 환자에 한해 사용이 가능하다.
2.허가 타임라인
파이콤파가 국가별로 허가 사항이 어떻게 변화해왔는지 살펴보겠다. 국가별 허가 타임라인을
정리한 표는 다음과 같다.
[표 19] 파이콤파의 한국, 미국, 영국 허가 타임라인 정리
허가 일자 내용
2015.07.10 최초 허가: 만 12세 이상의 간질 환자에서 이차성 전신발작을 동반하거나 동반하지 않는 부분발작에 부가요법
한국
적응증 확대 - 만 4세 이상의 뇌전증 환자에서 이차성 전신발작을 동반하거나 동반하지 않는 부분발작에 단독요법 - 만 4세 이상의 뇌전증 환자에서 이차성 전신발작을 동반하거나 동반하지않는 부분발작에 부가요법 - 만 7세 이상의 특발성 뇌전증 환자의 일차성 전신 강직간대발작에 부가요법 미국
2020.05.19
영국
2012.10.22 최초 허가: 부분발작 보조 치료: 12세 이상 성인을 대상으로 경구 제형 최초 승인
2015.01.22 적응증 확대 : 12세 이상 성인을 대상으로 원발성 전신 강직-간대발작에 대한 보조요법
2016.03.02
Oral suspension 제형 허가
2017.07.27 적응증 확대: 12세 이상 성인 부분발작 단독 요법
2018.09.28 연령 확대: 4세 이상의 소아에서 부분 발작에 대한 보조 및 단독 요법
2012.07.23 최초 허가: 12세 이상 성인 및 청소년을 대상으로 이차성 전신발작 여부와 관계 없이 부분 발작 보조 치료에 사용 가능
2015.05.21
2020.09.17
적응증 확대: 원발성 전신 강직-간대 발작 보조 치료 적응증이 12세 이상 성인 및 청소년으로 추가
- 연령 확대: 부분 발작 보조 치료 대상 연령이 4~11세로 확대 - 연령 확대: 원발성 전신 강직-간대 발작 보조 치료 대상 연령이 7~11세로 확대
제형
파이콤파는 양면이 볼록한 원형의 필름코팅정과 현탁액, 두 가지 제형으로 제공된다. 필름코팅
정은 2mg, 4mg, 6mg, 8mg, 10mg, 12mg 단위로 허가되었으며, 현탁액은 0.5mg/mL의
농도로 340mL 병 단위로 허가되어 있다.
용법 및 용량
1. 복용법
파이콤파는 음식 섭취와 무관하게 1일 1회, 취침 전에 투여한다. 필름코팅 정제는 씹거나 분할
하지 않고 충분한 물과 함께 통째로 삼킨다.
2. 국내/미국
국내 및 미국 허가 문서에 따르면 페람파넬의 용법·용량은 다음과 같다.
• 부분발작 단독요법: 1일 2 mg으로 시작하며, 임상반응 및 내약성에 따라 4–8 mg/일로
증량한다. 필요 시 최대 8 mg/일까지 증량 가능하다.
• 부분발작 부가요법: 1일 2 mg으로 시작하며, 임상반응 및 내약성에 따라 4–8 mg/일로 증량한다. 필요 시 최대 12 mg/일까지 허용된다.
• 일차성 전신 강직-간대발작 부가요법: 1일 2 mg으로 시작하며, 임상반응 및 내약성에 따라 8 mg/일까지 증량한다. 필요 시 최대 12 mg/일까지 증량할 수 있다.
용량 증량은 일반적으로 1일 2 mg 단위로 최소 2주 이상의 간격을 두고 시행한다.
3. 영국
영국에서는 12세 이상 성인 및 청소년의 경우 1일 2 mg으로 시작하여 1주 간격으로 2 mg씩 증량하며, 유지 용량은 4–8 mg/일, 최대 12 mg/일이다. 특히, 소아(4–11세)의 경우 체중에 따라 용량이 달라지는 점이 특징적이다. 체중 30 kg 이상은 성인과 동일하게 적용하나, 30 kg 미만에서는 시작 용량을 1 mg/일로 하고 1주 간격으로 1 mg씩 증량한다. 세부적으로 20-30 kg에서는 최대 8 mg/일, 20 kg 미만에서는 최대 6 mg/일로 제한된다. 이러한 체중 기반 용량 조절은 소아 환자의 안전성과 내약성을 고려한 영국 허가 사항의 특징적인 부분이다. PGTC 환자 역시 동일한 방식으로 용량을 조절하며, 증량 시 반드시 1주 이상의 간격을 둔다.
페람파넬은 중추신경계에 작용하는 약물로서 다음과 같은 주요 주의사항이 보고되어 있다.
1. 자살 충동 및 공격적 행동
치료 과정에서 자살 생각, 자해 행동, 분노 및 공격적 행동이 나타날 수 있으므로 환자의 정신 상 태를 정기적으로 모니터링해야 한다.
2. 호산구 증가증 및 전신 이상 반응 (DRESS)
원인 불명의 발열, 발진, 림프절 종대 등 전신 증상이 나타날 경우 DRESS를 의심할 수 있으며, DRESS 증상과 유사한 다른 병인이 배제되면 즉시 약물 투여를 중단한다.
3. 약물 상호작용 페람파넬은 주로 CYP3A4를 통해 대사된다. 따라서 CYP3A4를 유도하거나 억제하는 약물을
병용할 경우 환자의 임상 반응과 내약성을 면밀히 모니터링해야 한다.
특히, CYP3A를 유도하는 항뇌전증약(예: 페니토인, 카르바마제핀, 옥스카르바제핀 등)과 병용
시 각별한 주의가 필요하다. 이러한 약물을 복용 중인 환자의 경우, 용량 조절은 반드시 최소 1주
간격으로 1일 2 mg 단위씩 시행해야 한다.
4. 특수 환자군
간기능 장애 환자의 경우 Child-Pugh A 또는 B에서는 최대 용량을 8 mg으로 제한하며, 증량 은 최소 2주 간격으로 시행해야 한다. 중증 간질환 환자, 중등도 이상의 신부전 환자 및 혈액투석 환자에서는 투여가 권장되지 않는다.
5. 신경계 이상 및 낙상 위험
어지럼증, 졸림, 운동 실조 등의 이상 반응이 나타날 수 있어, 특히 고령 환자에서 낙상 위험이 증가한다. 따라서 운전이나 기계 조작 시 주의가 필요하다.
페람파넬의 임상 분석
페람파넬의 적응증 허가에 핵심적인 근거를 제공한 3건의 임상 3상 시험을 중심으로 약물의 임 상적 유효성과 안전성을 평가하고자 한다. 첫 번째 임상인 NCT00699972는 12세
법으로서의 유효성을 입증한 pivotal trial로, 페람파넬의 최초 적응증 허가(부분발작)에 근거 를 제공하였다. 두 번째 임상인 NCT01393743은 전신 강직-간대발작(primary generalized tonic-clonic seizure, PGTCS)을 적응증으로 추가하기 위한 연구로, 일반화된 발작에 대한 페 람파넬의 효과를 검증한 최초의 대규모 무작위 임상시험이다. 마지막으로 NCT02849626은 4
세 이상 소아를 포함한 부분발작 환자군을 대상으로 페람파넬의 유효성과 안전성을 평가함으로
써, 소아 적응증 확대의 핵심 근거가 된 임상이다.
이처럼 세 임상시험은 각각 성인, 전신발작, 소아라는 서로 다른 임상적 맥락에서 수행되었으 며, 페람파넬의
근거를 제공하였다. 따라서 본 학회지에서는 이 세
2. 연구 디자인
① 본 임상은 다기관, 무작위배정, 이중 맹검, 위약대조의 3상 임상시험으로, 미국, 캐나다, 아
르헨티나 등 총 68개 기관에서 시행되었다. 모든 환자는 약물투여 전 6주간의 베이스라인 관찰
기간을 거친 후, 6주간 용량 증량기(titration) 및 13주간의 유지기(maintenance)를 포함한 총
19주간의 이중 맹검 치료를 받았다. 이후 4주간의 follow-up 혹은 연장임상으로 전환되었다.
② 시험대상자 및 투약군
대상자는 만 12세 이상, ILAE(1981) 기준에 따라 이차성 전신화 여부와 관계없이 부분발작으
로 진단되었고, 기존에 2가지 이상의 AED 복용 중임에도 5회 이상의 발작이 발생한 환자였다.
총 388명이 무작위 배정되었으며, 이 중 387명이 ITT 분석에 포함되었다. ITT(Intention-ToTreat) 분석은 무작위로 배정된 모든 환자를 실제 치료 이행 여부와 관계없이 최초 배정군 기준 으로 분석하는 방법이다.
총 388명이 무작위 배정되어 위약군(n=121), perampanel 8 mg군(n=133), 12 mg군 (n=134)으로 할당되었으며, 이 중 387명이 발작 빈도 데이터를 제공하여 ITT(intention-totreat) 분석에 포함되었다. 12 mg군 중 1명은 약물 투여를 하루 받았으나 발작 일지를 제출하지 않아 ITT 분석에서 제외되었다.
- Placebo
- Perampanel 8 mg/day: 2mg부터 주 2mg씩 증량하여 6주 후 8mg 유지
- Perampanel 12 mg/day: 2mg부터 주 2mg씩 증량하여 6주 후 12mg 유지
③ 평가변수
본 연구의 1차 평가변수는 이중 맹검 기간 동안의 28일당 발작 빈도 중앙값(median) 변화율
로, 무작위 배정된 전체 환자를 포함한 ITT 분석 집단에서 평가되었다.
유럽의약품청(European Medicines Agency) 등록 요건에 따라 설정된 공동 1차 평가변수
는 유지기(13주) 동안 발작 빈도가 기준 대비 50% 이상 감소한 환자의 비율(Responder rate)
이었다.
2차 평가변수로는 복합 부분발작 및 이차성 전신화 발작의 빈도 변화, 임상적 전반적 상태 개선 도(CGI) 및 환자 자가 평가(PGIC), 그리고 삶의 질 변화(QOLIE-31-P)가 포함되었다.
3. 연구 결과
① 1차 평가변수 결과 및 해석
본 연구의 1차 평가변수인 이중눈가림 기간 동안의 28일당 발작 빈도 중앙값 변화율을 ITT 분석
군 기준으로 평가한 결과, 위약군은 -21.0%, 페람파넬 8 mg군은 -26.3%(p = 0.0261), 12 mg군은 -34.5%(p = 0.0158)로 나타났다. 이는 두 용량 모두에서 위약군 대비 통계적으로 유
의한 발작 빈도 감소 효과를 보였음을 의미한다. 특히, 용량이 증가함에 따라 발작 빈도 감소 폭
이 커지는 용량-반응 관계(dose-response relationship)도 확인되었으며(p = 0.0262), 이
는 페람파넬의 용량 의존적 항발작 효과를 뒷받침한다.
② 2차 평가변수 결과 및 해석
유럽 의약품청(European Medicines Agency)의 등록을 위한 공동 1차 평가변수였던 유지기 (13주) 동안 ≥50% 발작 빈도 감소율(Responder rate)은, 위약군 26.4%, 8 mg군 37.6%(p = 0.0760), 12 mg군 36.1%(p = 0.0914)로 나타났으며, 수치적으로는 개선되었지만 통계적 유의성에는 도달하지 못했다. 그러나 반응률의 절대 차이는 약 10% 이상으로, 임상적 관점에서 는 의미 있는 개선 효과로 해석될 수 있다.
[그림 19] 발작 빈도 중간값 및 50% 발작 빈도 감소율 (1차 평가 변수)
더불어 ≥75% 발작 감소율에서는 8 mg군 18.8%, 12 mg군 17.3%, 위약군 5.0%로 유의 한 차이를 보였으며(p = 0.001 for both), 고반응 환자군에서의 효과성은 뚜렷하게 나타났다. 또한, 치료 전후 환자 및 의사의 전반적 상태 평가인 CGIC, PGIC에서도 8 mg군은 위약군 대비 유의한 개선(p = 0.0122)이 관찰되었으며, 삶의 질(QOLIE-31) 지표에서는 세 군 간 유의한 차 이는 없었지만 전반적으로 안정적인 경향을 유지하였다.
[표 20] 주요 평가 변수 결과 요약
③ 부작용
총 388명 중 388명이 치료를 시작하였고, 전체 중 82.5%가 치료를 완료하였으며, 17.5%는 중단하였다. 그중 부작용으로 인한 중단은 10.3%였다. 치료와 관련된 이상반응(Treatmentemergent adverse events, TEAEs)은 페람파넬 투여군에서 더 흔히 발생했으며, 8 mg군 88.0%, 12 mg군 91.8%, 위약군 82.6%로 보고되었다.
가장 흔한 이상반응은 어지러움, 졸림, 과민성, 두통, 낙상, 운동실조 등이었으며, 특히 12 mg 군에서 부작용으로 인한 중단율이 19.4%로 높게 나타났다. 그에 반해 8 mg군과 위약군의 중 단율은 각각 6.8%, 6.6%로 유사하였다. 전반적으로 이상반응의 대부분은 경증에서 중등도였 고, 용량 증량기인 치료 초에 더 많이 발생하였으며, 이후 유지기에는 감소하는 경향을 보였다.
4. 결론
NCT00699972는 기존 항뇌전증제로 조절되지 않는 12세 이상 부분발작 환자에서, 페람파넬 의 보조요법으로서의 유효성과 안전성을 평가하기 위해 수행되었다. 연구 결과, 페람파넬 8 mg 및 12 mg/day는 발작 빈도를 유의하게 감소시키며, 특히 용량 의존적인 효과를 확인할 수 있었 다. 본 연구는 AMPA 수용체를 표적으로 한 새로운 기전의 항뇌전증제가 실제 임상에서 유효하 다는 근거를 제시한 최초의 대규모 무작위 시험이라는 데 의의가 있다. 이를 통해 페람파넬은
NCT01393743
ized
1. 연구 목적
페람파넬은 최초 허가 당시 뇌전증의 많은 하위 유형들 중 부분발작만을 적응증으로 가졌다. 그 러나 시장 점유율 확대를 위해서는 적응증 확대가 필수적이었다. 이에 따라 전신 강직-간대발작
을 적응증으로 추가하기 위해 진행된 임상이 NCT01393743이다. Eisai는 이번 임상을 통해 페
람파넬을 전신 강직-간대발작 환자에게 매일 1회 부가요법으로 사용하였을 때 우수한 치료 효과 가 나타나고, 안전성을 보장하는 데 목적이 있었다.
2. 연구 디자인 163명의 환자를 대상으로 이중 맹검, 무작위배정, 다기관, 실험군-플라시보 대조군 대조 실험
을 통해 페람파넬이 전신 강직-간대발작에 대한 치료효과를 나타냄을 보이고자 하였다. 특히 이
번 임상의 경우 다른 뇌전증 치료제 임상과는 달리 최대 3개의 뇌전증 치료제를 병용하고 있음에
도 PGTC 발작이 지속되는 환자들을 대상으로 진행되었다. 이를 통해 난치성 뇌전증의 치료 가
능성 역시 알아보았다.
플라시보군은 81명으로 매일 1회 17주간 위약을 경구 투여하였고, 페람파넬군은 82명으로
매일 1회 첫 주차 2mg에서 매주 2mg씩 증량하여 유지용량인 8mg을 유지하였다. 플라시보군 과 페람파넬군은 1:1의 비율로 배정되었으며 용량 조절기간을 4주, 유지기간을 13주로 하여 경 구 투여하였다.
NCT01393743에서 1차 평가 변수로 사용한 것은 총 두 가지로, PGTC 빈도의 중간값 백분 율 변화와 유지 기간 동안 PGTC 50% 반응률을 통해 페람파넬의 PGTC 부가요법에서의 치료 효과를 살펴보고자 하였다. 또한 많은 2차 평가 변수 중 주의 깊게 살펴봐야 하는 것은 치료 시 작 후 발생한 이상반응 및 중대한 이상반응이 나타난 환자의 수이다. 이를 통해 안전성과 내약성 을 증명하고자 하였다.
3. 연구 결과
① 1차 평가 변수 결과 및 해석
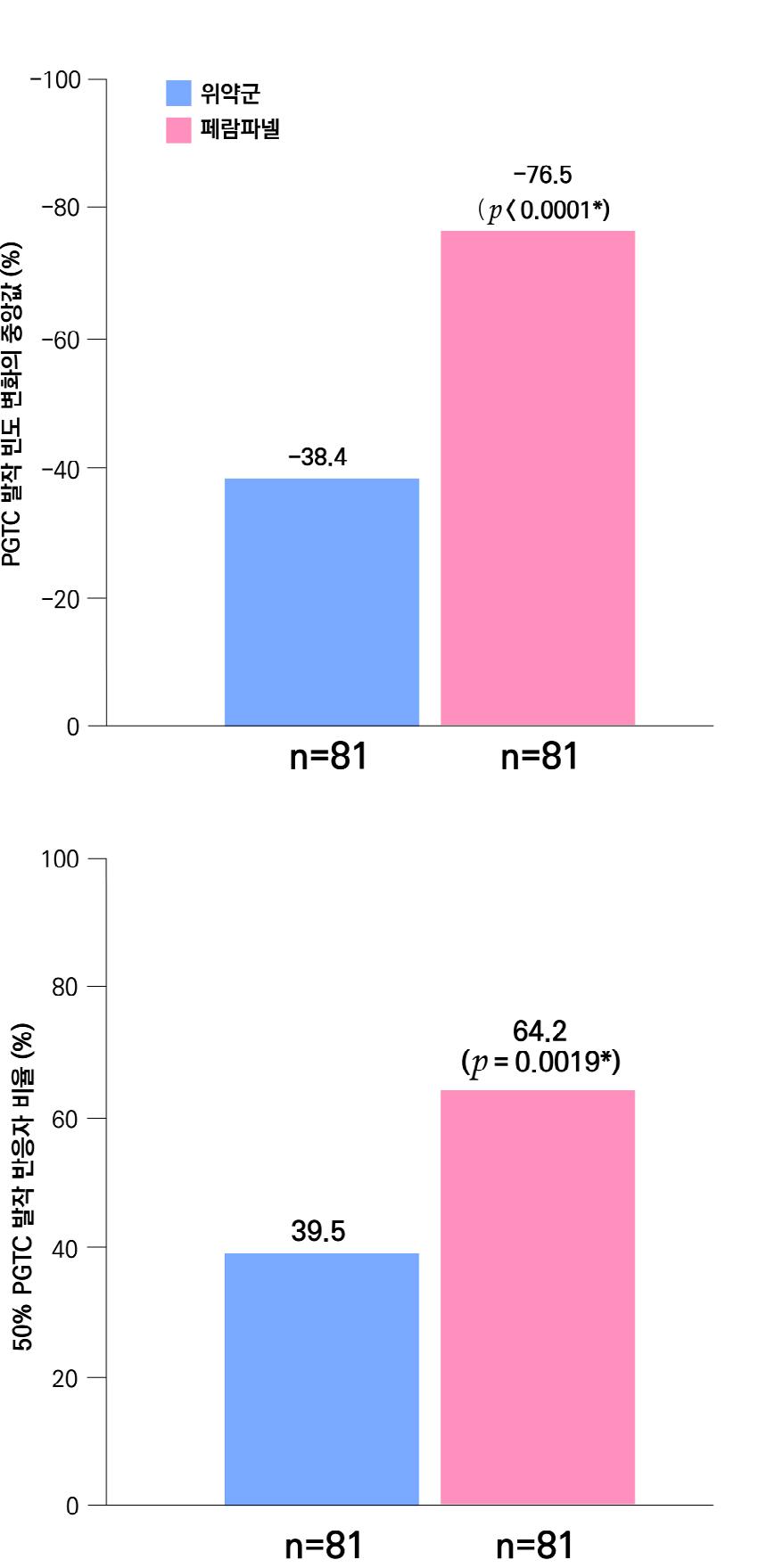
[그림 20] PTGC 발작 빈도 중간값 및 50% 반응률
[그림 20]은 PGTC 발작 빈도의 중간값 변화와 유지 기간 동안 PGTC 50% 반응률을 나타낸 것 이다. 무작위 배정 이전 기간 동안의 PGTC 빈도를 28일 기준으로 환산하여 나타낸 중간값은 플 라시보군에서 2.5, 페람파넬군에서 2.6으로 거의 동일한 수준을 보였다. 그러나 무작위 배정을 거쳐 위약과 페람파넬을 투여받음에 따라 PGTC 빈도에 차이가 발생했다. 전체 분석기간을 28 일 기준으로 환산하여 중간값을 나타내면, 플라시보군에서는 1.6, 페람파넬군에서는 0.7으로 페 람파넬군에서 확연하게 많이 감소하였음을 알 수 있다. 이를 앞선 값과 비교하면 플라시보군에서
는 PGTC 빈도가 38.4% 감소하였고, 페람파넬군에서는 76.5% 감소하였다. 또한 유지기간 동 안 개인별 발작횟수가 50% 이상 감소한 환자의 비율 역시 플라시보군은 39.5%, 페람파넬군은 64.2%로 뛰어난 치료 효과를 나타냈다. 이 중 12.3%의 플라시보군 환자는 한 번의 PGTC 발 작도 겪지 않았고, 30.9%의 페람파넬군 환자 역시 PGTC 발작을 겪지 않았다. 또한 4.9%의 플 라시보군 환자와 23.5%의 페람파넬군 환자는 모든 유형의 발작을 겪지 않았다. 이를 통해 페람
파넬은 단순히 발작 빈도만을 감소시키는 것이 아니라 일부 환자에서는 발작의 완전한 예방 효과
까지 나타낼 수 있음을 보였다. ② 2차 평가 변수 결과 및 해석 [표 21] 치료 시작 후 발생한 이상 반응
과 피로감은 페람파넬의 허가 사항에도 기재되어 있는 부작용으로서 페람파넬으로 인해 발생할 수 있는 이상반응이다.
살 시도 역시 허가 사항에도 기재되어 있는 부작용 중 하나로서 많은 항뇌전증제에서 나타나는 부작용이다.
4. 결론
기존 연구는 최대 2개의 뇌전증 치료제를 병용하고 있는 환자를 대상으로 진행되었다. 그러나
NCT01393743는 최대 3개의 뇌전증 치료제를 병용하고 있음에도 불구하고 PGTC 발작이 지
속되는 환자를 대상으로 진행되었기 때문에 기존 연구에 비해 더욱 난치성 뇌전증을 앓고 있는 환자를 포함했을 가능성이 크다. 또한 기존에 뇌전증 치료제로서 많이 사용되었던 Lamotrigine
연구에서는 117명 중 39명이 정상 뇌파(EEG) 소견을 보였으며, 13명은 IGE에서 흔하지 않은
발작 유형을 가졌다. Topiramate 연구에서도 마찬가지로 80명 중 흔하지 않은 발작 유형 환자
가 25명이 포함되었다. 그러나 NCT01393743는 더욱 엄격한 환자 기준을 적용하였기 때문에
연구의 정확도를 높일 수 있었다.
이렇게 정확도를 높인 연구에서 페람파넬군이 플라시보군보다 모든 평가지표에서 통계적으로
유의미한 치료 효과를 나타내었고, 안전성 측면에서도 치료 효과를 상회하는 중대한 부작용이 없
었기 때문에 페람파넬이 PGTC를 적응증으로 추가할 수 있었다.
하지만 연구기간이 17주로 비교적 짧았기 때문에 장기사용에서의 유효성, 안전성은 여전히 검 증이 필요한 상태였다. 이를 위해 Eisai는 NCT01393743이 끝난 이후에도 원하는 환자에 한하
여 추가적으로 임상을 이어가 장기 사용에 대한 유효성, 안전성을 증명하였다.
Open-label study to investigate the safety and efficacy of adjunctive perampanel in pediatric patients (4 to <12 years) with inadequately controlled focal seizures or generalized tonic-clonic seizures
NCT 02849626은 국소 발작 Focal seizure (with or without FBTCS) 또는 전신강직간대 발작 GTCS 의 증세를 보이는 연령 4세 이상, 12세 미만의 소아 환자를 대상으로 페람파넬 (perampanel) 경구 현탁액을 하루 1회 보조 요법으로 투여했을 때의 안전성, 내약성, 약물동태학 및
약리학적 작용을 평가하기 위해 진행되었다. 해당 임상은 EMA에서 페람파넬의 소아 대상 사용 의 허가의 근거가 되었다는 점에서 다른 많은 연구와 중요한 차별점을 가지고 있다고 볼 수 있다.
2. 연구 디자인
① 해당 연구는 국제적인 global 다기관 multicenter 시행의 공개된 open-label 단일군 single-arm 연구이며, 임상 3상에 해당한다. open-label 연구란 임상 시험에서 참가자와 연 구자 모두 어떤 치료가 제공되는지 알고 있는 연구 유형이다. 이는 무작위 대조 시험이 선행된 연 구, 즉 약물의 효과 자체는 입증이 된 후에 새로운 참가자에게서 안전성 데이터를 수집하기 위해 적용할 수 있다. 특히 눈가림이 실행 가능하지 않거나, 혹은 윤리적으로 적절하지 않을 경우에 흔 히 적용한다.
단일군 single-arm 이란 모든 참가자에게 동일한 치료를 제공하며, 위약군이 없는 임상 시험 의 설계를 말한다. 이는 위약의 투여가 비윤리적이라고 판단될 경우, 이미 약효가 입증된 약의 적 응증 또는 연령 확장을 목적으로 연구하는 경우, 혹은 드문 질환을 대상으로 하여 대규모 대조군 설정이 어려운 경우에 다소 드물게 임상 3상에서 활용한다.
이러한 개방된 환경에서 임상을 진행한 이유를 살펴보자면, 먼저 study 311은 완전히 새로운
는 충분한 유효하다고 볼 수 있겠지만, 그럼에도 불구하고 이와 같은 임상 설계는 다음과 같은 근본적인 한계가 존재하기 때문에 이에 유의하여 상업적 사용에 적용할 필요가 있다.
- 위약군의 부재로 인한 효과의 불확실성
- 눈가림의 부재로 인한 관찰자 및 대상자의 편향 발생 (예시 : 플라시보)
- 일반적인 객관성 있는 통계 비교의 어려움
Study 311은 하나의 Core Study (4주간 관찰기간 > 11주간 용량 증량기 > 12주간 유지기 > 4주간 follow-up)과 두 단계의 Extension phase A, B로 구성되었다. Extension phase A (29주간 유지기 > 4주간 follow-up) 는 Extension phase B를 진행하지 않은 대상자에 한해 기존 연구의 모든 국가에서 진행하였으며, 이 단계에서는 모든 참가자자들이 Core phase에서
기존에 처방받은 것과 같은 용량만큼의 perampanel을 복용하였다. Extension phase B는 일
본 및 EAP (Extended Access Program)을 허가하지 않는 국가에 한해 참가자가 12세가 될
때까지, 혹은 perampanel을 소아에게 상업적으로 제공하는 것이 허가되기 이전까지 진행되었
다. 해당 연구에서 4세 이상, 7세 미만인 환자의 수는 46명, 7세 이상 12세 미만인 참가자의 수
는 134명이었다.
*EAP: 아직 허가되지 않은 신약을 생명이 위독하거나 치료법이 없는 환자에게 제공하는 제도로, 임상시험 단계에 있는 의
약품을 치료 목적으로 사용할 수 있게 한다.
② 임상 참가자 및 투약군
[표 22] 임상 참가자 및 투약군
③ 평가변수
perampanel 0.5mg/mL
Core study에서 perampanel 0.5mg/ mL 경구 현탁제를 매일 최소 8mg, 최대 12mg 또는 최소 12mg, 최대 16mg 복 용함.
Extension phase A 단계를 진행 한 대상자는 Core phase의 optimal perampanel dose를 유지하여 추가로 29주, 총 52주간 perampanel을 복용함.
Core study와 Extension phase A를 모두 통과하고, EAP를 인정하지 않는 국가의 대상자에 한해 대상자가 12세 에 도달하거나 perampanel 의 상업적 사용이 가능 해진 시기까지 optimal perampanel dose를 유지하 여 복용함. 단 도중에 안전/행정상의 이유로 중단한 대상자가 존 재함.
해당 임상에는 네 가지 1차 평가변수가 존재한다. 이는 다음과 같으며, 이 네가지 평가변수에 대
하여 결과를 살펴보고 해석을 진행하였다. 1차 평가변수는 약물을 주입함으로써 참가자에게 생
기는 신체 반응을 주로 측정하여 안전성을 나타내는 지표가 되었다. - 이 연구의 전체 참가자 중에서 치료 유발 이상 반응 (AE) 및 치료 유발 중대한 이상반응 (SAE)
를 겪은 사람의 비율 : Core phase 및 extension phase 평가 - 이 연구의 전체 참가자 중에서 치료가 유발한 뚜렷한 이상 수준의 검사실 수치 (혈액검사 등)를
받은 사람의 비율 : Core phase 및 extension phase 평가 - 이 연구의 전체 참가자 중에서 비정상적인 활력 징후 (vital sign values) 수치를 받은 사람의
비율 : Core phase 및 extension phase 평가
* 비정상 수치의 기준 : 수축기 혈압이 기저치 대비 20 또는 40mmHg 이상 증감 /
주로 안전성을 평가하기 위해 마련된 1차 평가변수 외에도 perampanel의 치료 효용성 efficacy를 측정하기 위한 지표가 존재하였다. 이 경우 비교군이 없는 single-arm study의 부족 함을 보충하기 위해 pooled analysis를 활용하였는데, 이는 여러 개의 개별 연구에서 얻은 데이 터를 모아 분석에 함께 활용하는 방식으로 해당 임상인 study 311은 study 304, 305, 306, 232 , 332의 데이터를 결과 분석에 함께 사용하였다. 분석 데이터는 다음과 같다.
- baseline 대비 28일 당 발작 빈도수의 감소율
- 치료 전 대비 발작 빈도가 50% 이상 감소한 참가자의 비율
- baseline 대비 28일 동안의 부분발작 FS 빈도의 중앙값 감소율
- Clinical Global Impression of Change (CGIC) 지수
* CGIC : 주치의가 치료 후에 환자의 전반적인 임상 상태 변화를 7점의 척도 (Very much improved / Much improved / Minimally improved / No change / Minimally worse / Much worse / Very much worse) 로 나타낸 것
3. 연구 결과 ① 1차 평가변수 결과 및 해석
- TEAE를 겪은 환자군은 전체의 90%였으며, TESAE를 겪은 환자군은 전체의 20%였다. AE
보고율은 다소 높지만 대부분 경증에서 중등도의 증세였으며, SAE가 드물고 약물과의 인과관계 가 높다고 판단하기 어려워 perampanel은 전반적으로 활용 가능한 수준의 안전성을 가진 약물 이라고 할 수 있다.
- 칼륨, 나트륨, ALT 효소, 칼슘, GGT 효소, 헤모글로빈, 백혈구의 검사실 수치가 정상 범주를 넘어선 참가자 비율은 0.6% 이상, 2.8% 이하로 상당히 적었다. 단 호중구 검사실 수치가 비정 상이었던 참가자 비율은 9.1%로 다른 수치에 비해 높은 값을 기록하였다. 대부분의 항목에서 일
부 참가자에게 일시적인 검사 수치 이상만 존재하였으며, 임상적으로 치료를 중단해야 할 만큼의
독성은 나타나지 않았음을 의미한다. - Vital sign values 부분에서 가장 비정상 수치 참가자의 비율이 높았던 항목은 48.0%의 이
완기 혈압 10mmHg 증가이며, 가장 낮았던 항목은 0.6%의 수축기 혈압 20mmHg 감소이다.
이는 대부분의 참가자가 경미하거나 일시적인 변화만을 겪었으며, perampanel이 심혈관계의
안전성에 유의미한 영향을 줄 가능성이 낮다는 것을 의미한다. - 심전도 수치에 이상을 보인 참가자의 비율이 가장 높았던 항목의 수치는 8.0%, 가장 낮았던 항목의 수치는 0%로 이는 심장 안전성이 전반적으로 양호함을 의미한다.
② 2차 평가변수 결과 및 해석 [표 23] baseline 대비 28일 당 발작 빈도수의 감소율 / 치료 전 대비 발작 빈도가 50% 이상 감소한 환자의 비율 -28일 당 발작 빈도수의 감소율은 pooled analysis 값과 비교하였을 때 전반적으로 유사하거 나 더 높은 값을 보였다. 이를 통해 perampanel이 연구 참가자들의 발작 빈도수를 낮추는 것에 효과가 있었다는 것을 판단할 수 있다. - 치료 전 대비 발작 빈도가 50% 이상 감소한 환자의 비율 역시 pooled anaylsis 값과 비교 하였을 때 전반적으로 유사하거나 더 높은 값을 보였다. 이를 통해 perampanel 치료를 통해 발
작 빈도수가 유의미하게 감소한 연구 참가자자들의 비율이 높았음을 알 수 있다. 이에 더해 발작 이 완전히 없어졌다는 seizure-free가 보고된 환자자의 비율은 FS, FBTCS, GTCS 증상에서 각각 12%, 19%, 55%였다.
[표 24] baseline 대비 28일 동안의 부분발작 빈도의 중앙값 감소율 - baseline 대비 부분발작 빈도의 중앙값의 감소율 역시 pooled analysis 값과 비교하였을 때 전반적으로 유사하였다. 이때 pooled analysis에서 2세 이상 7세 미만의 값이 75%로 상대적으
- CGIC 군별 분포는 비교 대상인 연구가 없었으며, 69%의 환자들이 개선되었다는 평가를 받
았음을 보아 perampanel이 치료 효과가 있었다는 것을 추정할 수 있다.
③ 부작용
종합적으로 전체 중 89%의 환자들이 TEAE, 67%의 환자들이 perampanel과 연관된 TEAE
를 경험하였고 4세에서 7세의 환자군이 7세에서 12세의 환자군보다 treatment-related TEAE
를 경험한 비율이 각각 83%와 65%로 약 20% 정도 더 높았다. 10% 이상의 환자들이 경험한
가장 흔한 TEAE는 졸림(26%), 감기(19%), 어지러움/짜증/발열(각각13%), 구토(11%) 등이
있었다.
④ 해당 연구의 한계점
해당 연구는 몇 가지 주요한 한계를 가지는데, 먼저 open-label이며 single-arm study 라
는 점이다. 또한 연구 대상자의 인종이 대부분이 일본인과 코카서스인으로, 인종의 다양성 면에 서 부족하다. 이에 더해 4세 이상, 7세 미만인 대상자는 46명, 7세 이상, 12세 미만인 대상자는 134명이고 GTCS 대상자는 31명으로 군별 편차가 존재한다. 따라서 이러한 한계점에 유의하여 해석할 필요가 있다.
4. 결론
본 임상에 따르면 페람파넬 경구 현탁제를 하루 1회 보조 요법으로 투여하는 것은 4세 이상 12 세 미만의 소아 환자에게 전반적으로 양호한 내약성과 안전성, 유효성을 보였다. 연구 결과 perampanel의 약효는 4세~7세와 7세~12세의 군의 나이 차이에 영향을 받지 않았으며, EIASD의
병용 여부와 무관하다고 판단되었고 소아의 인지 기능에도 악영향을 끼치지 않는다.
해당 연구는 기존에 알려져 있는 perampanel의 안전성과 유효성 결과와 일치하는 결과를 보여
주어, 기존의 청소년 및 성인 대상으로만 처방될 수 있던 perampanel의 적응증을 소아까지 확대 하는 근거자료가 되었다는 점에서 중요하다. 또한 소아의 처방에 유리한 경구 현탁제 제형과 소아
적응증 확대가 맞물려, 소아환자의 복약 순응도와 약물 접근성을 동시에 높였다는 의의를 가진다.
한국 급여
파이콤파는 국내에서 2015년 7월 10일 처음으로 허가를 받았고 이후 적응증 확대가 이루어졌 으나, 건강보험 급여 적용은 허가 범위와 다소 차이가 있다. 파이콤파의 국내 급여, 허가-급여 불일치 문제와 제네릭 의약품인 페리콤파, 페라넬의 급여 현황을 종합적으로 고찰하고자 한다.
1. 국내 허가사항 및 급여 기준
1) 국내 허가사항(식품의약품안전처)
• 2015년 허가:
보조요법: 만 12세 이상 간질 환자의 부분발작 (이차성 전신발작 여부 무관)
• 2020년 적응증 확대:
단독요법: 만 4세 이상 부분발작
보조요법: 만 4세 이상 부분발작 및 만 7세 이상 원발성 전신 강직-간대발작(PGTC)
2) 국내 급여기준(건강보험심사평가원)
• 급여 적용 연령: 만 12세 이상
• 급여 인정 적응증: 부분발작의 단독 및 보조요법, PGTC의 보조요법
즉, 만 4~11세 소아는 처방 가능하지만 보험 급여를 받을 수 없고 전액 본인부담(비급여)이다.
2. 국내 급여 가격 현황 (4mg 기준)
파이콤파(페람파넬)는 2015년 12월 1일 처음으로 건강보험 급여가 적용되었으며, 당시 상한 가는 1,595원이었다. 이후 사용량 증가와 약가 조정으로 가격이 점진적으로 인하되어 1587원 까지 인하되었다.
2023년 10월 14일, 국내에 최초 제네릭 의약품이 등재되면서 오리지널 의약품의 상한가는 1,111원으로 조정되었는데, 이는 특허만료 전 오리지널 약가의 70% 수준이다. 제네릭 의약품 은 이에 비례하여 59.5%인 944원으로 책정되었다.
일반적으로 최초 제네릭이 등재되면, 특허만료 1년까지는 오리지널은 70%, 제네릭은 59.5% 수준의 약가가 유지된다. 이후 1년이 경과하면 오리지널과 제네릭 모두 특허만료 전 약가의 53.55%로 일괄 인하되는 것이 원칙이다. 그러나 페람파넬의 경우 예외적으로 2024년 10월 14
일부터 2026년 10월 13일까지 동일 가격(오리지널 1,111원, 제네릭 944원)이 유지되었다. 이 는 제네릭 등재 회사 수가 3개 미만일 경우, 약가 가산 기간이 최대 3년까지 연장될 수 있다는 제
도적 특례가 적용된 결과이다. 따라서 2026년 10월 14일부터는 오리지널과 제네릭 모두 특허
만료 전 오리지널 약가의 53.55%인 850원으로 일괄 인하될 예정이다.
[표 26] 오리지널 및 제네릭 급여 이력 2015.12.01 (파이콤파 최초 급여)
필름코팅정 4mg (페람파넬)_(4.2mg/1정) 한국에자이 (주) 급여
2023.10.14 - 2024.10.13
급여 구분 상한가 (원)
파이콤파 필름코팅정 4mg (페람파넬)_(4.2mg/1정) 한국에자이 (주) 급여 1111
페라넬정 4mg (페람파넬(미분화))_(4mg/1정) 환인제약 (주) 급여
페리콤파정 4mg (페람파넬(미분화))_(4mg/1정) 명인제약 (주) 급여
2024.10.14 - 2026.10.13 업체명 급여 구분 상한가 (원)
파이콤파 필름코팅정 4mg (페람파넬)_(4.2mg/1정) 한국에자이 (주) 급여 1111
페라넬정 4mg (페람파넬(미분화))_(4mg/1정) 환인제약 (주) 급여 944
페리콤파정 4mg (페람파넬(미분화))_(4mg/1정) 명인제약 (주) 급여 944 2026.10.14부터
업체명 급여 구분 상한가 (원)
파이콤파 필름코팅정 4mg (페람파넬)_(4.2mg/1정) 한국에자이 (주) 급여 850
페라넬정 4mg (페람파넬(미분화))_(4mg/1정) 환인제약 (주) 급여 850
페리콤파정 4mg (페람파넬(미분화))_(4mg/1정) 명인제약 (주) 급여 850
3. 결론
파이콤파는
자리 잡았다. 현재 국내에서 는 만 4세 이상으로
영국 급여
페람파넬은 전신 강직-간대발작의 부가요법으로 사용되는 1차 선택약제, 부분발작의 부분발작의 부가요법으로 사용되는 2차 선택약제, 특발성 전신발작의 부가요법으로 사용되는 2차 선택약제
및 특발성 전신발작에 대해 7세 미만의 어린이에게 오프 라벨로서 사용되는 약제이다.
페람파넬의 영국 약가 기준이 되는 NHS Drug Tariff는 다음과 같다.
[표 27] NHS Drug Tariff
전신 강직-간대발작의 부가요법에 대한 경제성 평가 결과 페람파넬은 총 비용 약 £13,787, QALY 약 6.83으로 나타났다. £20,000/QALY 기준에서 cost - effective 순위는 6개 약제 중 5위로 비용효과성 측면에서 하위권이지만, 일부 상황에서 여전히 사용 가능한 선택지로 평가되 었다. 또한 부분발작의 부가요법에 대한 경제성 평가 결과 총 비용 약 £12,977, QALY 약 6.82 로 나타났다. £20,000/QALY 기준에서 cost - effective 순위는 17개 약제 중 12위로 부분발 작의 부가요법에서 2차 선택약제로 권고되었다.
-총론
Korea Pharmaceutical Information Center. Perampanel drug information. [Internet]. Accessed May 27, 2025. Retrieved from https://www.health.kr/searchDrug/result_drug.asp?drug_cd=2015071300009
U.S. National Library of Medicine. (2017). A Efficacy and Safety Study of Adjunctive Perampanel in Primary Generalized Tonic Clonic Seizures. Retrieved from https://www.clinicaltrials.gov/study/NCT 01393743?cond=perampanel&page=8&rank=71
U.S. Food and Drug Administration. (2023). Fycompa (perampanel) [prescribing information]. FDA. Retrieved from https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/202834Orig1s019lbl. pdf
U.S. National Library of Medicine. (2024). Perampanel for Status Epilepticus Prophylaxis Post-Cardiac Arrest (PROSPER). Retrieved from https://www.clinicaltrials.gov/study/NCT06401707?cond=perampanel&page=1&rank=5
U.S. National Library of Medicine. (2025). A Study to Evaluate the Safety of Fycompa Injection in Participants With Partial-Onset Seizures or Primary Generalized Tonic- Clonic Seizures. Retrieved from https://www.clinicaltrials.gov/study/NCT06657378?cond=perampanel&page=1&rank=2
-허가
약학정보원. (2025, September 7). 파이콤파필름코팅정 2 mg Fycompa Film Coated Tab. 2 mg [의약품 상세 정보]. Retrieved from https://www.health.kr/searchDrug/result_drug.asp?drug_cd=2015071300005
European Medicines Agency. (2012.07.23). Fycompa (perampanel) [Authorisation details]. EMA. Retrieved from https://www.ema.europa.eu/en/medicines/human/EPAR/fycompa
-임상
study 1
ClinicalTrials.gov. (2017). Adjunctive Perampanel for Refractory Partial-Onset Seizures [Clinical trial record]. Retrieved from https://clinicaltrials.gov/study/NCT00699972
study 2
ClinicalTrials.gov. (2017). A Efficacy and Safety Study of Adjunctive Perampanel in Primary Generalized Tonic-Clonic Seizures [Clinical trial record]. Retrieved from https://www.clinicaltrials.gov/study/NCT 01393743?cond=perampanel&page=8&rank=71
French JA, Krauss GL, Wechsler RT, Wang XF, DiVentura B, Brandt C, Trinka E, O’Brien TJ, Laurenza A, Patten A, Bibbiani F. Perampanel for tonic-clonic seizures in idiopathic generalized epilepsy A randomized trial. Neurology. 2015 Sep 15;85(11):950-7. doi: 10.1212/WNL.0000000000001930.
study 3
Fogarasi, A., Flamini, R., Milh, M., Phillips, S., Yoshitomi, S., Patten, A., Takase, T., Laurenza, A., & Ngo, L. Y. (2020). Open-label study to investigate the safety and efficacy of adjunctive perampanel in pediatric patients (4 to <12 years) with inadequately controlled focal seizures or generalized tonicclonic seizures. Epilepsia, 61(1), 125–137. https://doi.org/10.1111/epi.16413
페람파넬 약제 요양급여의
결과. Retrieved from https://www.hira.or.kr/ bbsDummy.do?pgmid=HIRAA030014040000&brdScnBltNo=4&brdBltNo=46584#none
National Institute for Health and Care Excellence. (2022, April). Epilepsies in children, young people and adults: Supplement 3: Cost effectiveness of antiseizure therapies for people with focal and generalised tonic-clonic seizures (NICE guideline NG217, Health economics) [Report]. Retrieved from https://www.ncbi.nlm.nih.gov/books/NBK586312/bin/niceng217er3_bm4.pdf
3.3 에슬리카바제핀
smileclara03@gmail.com
ezy7829@gmail.com
yunacha423@gmail.com
1.에슬리카바제핀 소개
에슬리카바제핀(Eslicarbazepine acetate, 이하 ESL)은 포르투갈 제약회사 Bial에서 개발한
항경련제로, 1999년에 처음 소개되어 2009년에 유럽에서 사용 승인된 약이다. 미국 FDA에서
는 2013년에 승인을 받았고, 우리나라는 2020년 말부터 도입되어 사용되고 있다.
ESL의 적응증은 미국, 유럽, 한국 간에 약간의 차이가 있다. 미국에서는 압티옴(Aptiom)이라 는 상품명으로, 4세 이상 환자의 부분발작 치료에 대한 단독요법 및 보조요법으로 FDA 승인을 받았다. 반면 유럽과 한국에서는 제비닉스(Zebinix)라는 이름으로 판매되며, 각각 EMA와 식품 의약품안전처로부터 다음 두 가지 적응증에 대해 허가를 받았다. 첫째는 새로 뇌전증으로 진단 된 성인에서 2차성 전신발작을 동반하거나 동반하지 않은 부분발작 치료의 단독요법이며, 둘째 는 만 6세 이상의 소아, 청소년 및 성인에서 2차성 전신발작을 동반하거나 동반하지 않은 부분발
작 치료의 보조요법이다.
2. 화학적 특징
ESL은 기존에 뇌전증의 표준 치료제로 사용되어 왔던 carbamazepine 및 oxcarbazepine과
구조적인 차이를 보인다. Carbamazepine, oxcarbazepine, ESL은 모두 5-carboxamide 치환기를 가진 dibenzazepine핵을 공통으로 가지고 있다. 하지만 2세대 뇌전증 치료제인 oxcarbazepine과 3세대 뇌전증 치료제인 ESL은 carbamazepine과 -10,11번 위치에서 구조적 인 차이를 보인다. 이러한 분자 구조의 차이는 약물 대사의 차이로 이어져 독성 유발 대사체였던 carbamazepine-10, 11-epoxide의 생성을 줄여준다. 이에 따라 oxcarbazepine과 ESL은 1세대 약물인 carbamazepine의 부작용을 개선시킨 뇌전증 치료제로 주목받게 되었다.
Carbamazepine Oxcarbazepine Eslicarbazepine acetate
[그림 21] 에슬리카바제핀의 화학적 구조
그렇다면 2세대 oxcarbazepine과 3세대 eslicarbazepine의 차이는 무엇일까? 바로 활성 대사체의 이성질체 비율이다. Oxcarbazepine과 ESL은 모두 활성대사체인 licarbazepine의 prodrug으로, ketoreduction을 포함한 일련의 과정을 거쳐 licarbazepine이라는 주대사체를 생성해 항경련 작용을 일으킨다. 이때 Oxcarbazepine은 S 이성질체와 R 이성질체가 4:1 비 율로 생성되는 반면, ESL은 거의 전량이 주요 활성을 나타내는 S 이성질체로 전환되기 때문에 부작용이 완화됐을 뿐만 아니라, 효과 예측가능성과 내약성이 더 우수한 것으로 평가되고 있다.
3. 작용기전
ESL은 전압의존성 나트륨 통로(voltage-gated sodium channel, VGSC)에 선택적으로 작
용하는 약물이다. 특히 VGSC의 slow inactivation을 주된 기전으로 하는데, 정확한 작용 메커 니즘이 밝혀지지는 않았지만 불활성 sodium channel의 site2에 결합하여 급속도로 흥분되는 신경세포를 선택적으로 표적하여 발작을 억제한다고 추정된다. 이때 나트륨 통로에 대한 선택성
과 친화성에서 carbamazepine이나 oxcarbazepine에 비해 그 효과가 우월하다고 한다.
나아가 ESL은 carbamazepine에서 자주 발생하는 지속적인 Na+전류의 모순적 상향 조절이
없다는 장점도 가지고 있다. 나트륨 이온의 내향 전류에 영향을 주지 않기 때문에 반복적인 신경
활성에 대해서도 억제 효과가 지속되는 것이다. 이에 따라 carbamazepine에 대한 약물불응성
을 극복할 수 있을 것으로 기대되는 약물이다.
에슬리카바제핀 아세테이트(eslicarbazepine acetate, 이하 ESL)는 포르투갈의 대형 제약 사인 Bial에서 개발한 3세대 항뇌전증약이다. 총론에서 살펴보았듯이, ESL은 전압의존성 나트
륨 채널(VGSC)의 비활성화 상태를 안정화시켜서 항경련 효과를 나타낸다. 같은 계열의 항경련
제인 Carbamazepine이나 oxcarbazepine에 비해 부작용은 적고, 생체이용률 예측성과 내약
성이 우수하여 그 임상적 기대가 크다. 현재 한국과 영국에서는 zebinix(제비닉스), 미국에서는 aptiom(압티옴)이라는 상품명으로
적응증(2025년 8월 기준)이다.
[표 28] 에슬리카바제핀 적응증 최초허가일자 적응증(2025년 8월 기준)
한국 2020.11.10 -처음 뇌전증으로 진단된 성인에서 2차성 전신발작을 동반하거나 동반하지 않 은 부분발작 치료의 단독요법 -만 6세 이상의 소아, 청소년 및 성인에서 2차성 전신발작을 동반하거나 동반 하지 않은 부분발작 치료의 부가요법
미국 2013.11.08 성인 및 4세 이상 뇌전증 환자의 부분발작치료 (부가요법 및 단독요법)
EMA 2009.04.21 한국과동일
ESL은 2009년 4월에 유럽의약품청(EMA, European Medicines Agency)에서 최초로 허
가되었고, 이후 2013년 11월에 미국, 2020년 11월에 한국에서 허가를 받았다. 현재 한국과 EMA는 동일한 적응증을 보유하고 있으며, 성인 및 만 6세 이상의 소아에서 2차성 전신발작을 동반하거나 동반하지 않은 부분발작의 단독요법 및 부가요법으로 사용이 허가되었다. 반면 미국 에서는
부가요법
2013.11.08 성인 및 4세 이상 뇌전증 환자의 부분발작치료 (부가요법 및 단독요법)
2015.08.27 성인의 부분발작치료의 단독요법으로 적응증 확대 2019.03.15 4세 이상의 부분
eslicarbazepine)는
설계되었다. 허가된 용량은 국가마다 약간의 차이가
한국과 미국에서는 200mg, 400mg, 600mg, 800mg 4가지 용량으로 시판되고 있는 반면, 영국에서는 200mg, 800mg의 2가지
용량만 판매되고 있다.
영국을 포함한 유럽 일부 국가에서는 정제 복용이 어려운 소아를 위해 50mg/ml 농도의 경구
현탁액(oral suspension) 제형으로도 판매되고 있다. 현재 한국과 미국에서 이 제형은 허가되 지 않았다. 제형
용법 및 용량
ESL은 음식과 관계없이 복용할 수 있다. 비슷한 화학구조와 작용기전을 가지는 옥스카르바제 핀을 사용하는 경우 이 약을 부가요법으로 사용하지 않도록 한다. 아래는 에슬리카바제핀의 용법 및 용량을 정리한 표이다. 성인과 소아의 용법이 다르며, 신장 애가 있는 환자의 경우에도
신기능에 이상이 없는 한 고령자(>만 65세)에서 용량 조절은 필요하지 않다. 고령자에 대한
1,600 mg 단독요법의 치료 경험이 매우 제한적이므로, 사용이 권장되지 않는다.
경증 내지 중등증 간장애 환자에서는 용량 조절이 필요하지 않다. 중증 간장애 환자에서는 ESL 의 약동학이 평가되지 않았으며 이에 따라 이러한 환자에서 사용이 권장되지 않는다.
[표 30] 에슬리카바제핀의 용법 및 용량
성인 400mg qd
소아(>만 6세)
단, 체중≥60kg인 소아는
신장애 환자 (CLCR 30-60 ml/min)
1주 또는 2주에 200mg씩, 800mg qd까지 증량 (400-> 600-> 800mg qd)
10 mg/kg/day 1주 또는 2주에 10 mg/kg/ day씩 최대 30 mg/kg/day
성인: 200mg qd 또는 400mg qod 2주 후 400mg qd
800mg qd
부가요법 시, 최대 1,200mg qd 단독요법 시, 최대 1600mg qd
30 mg/kg/day 최대 1,200mg qd
400mg qd
가능 >만 6세 소아: 5 mg/kg qd 또는
qd : 1일 1회 qod : 2일 1회 CLCR : 크레아티닌 청소율(creatinine clearance)
[표 31] Apitom once daily dosage schedule for pediatric patients 4 to 17 years of age
안전성 및 주의사항
1. 자살충동과 자살행동
다른 항뇌전증제와 마찬가지로 ESL을 복용한 환자에서 자살충동 및 자살행동을 보이는 위험성 이 증가할 수 있다. 따라서 이에 대한 모니터링이 필요하다.
2. 중대한 피부반응
생명을 위협하거나 치명적일 수 있는 스티븐스-존슨 증후군(SJS)/ 독성표피괴사용해(TEN) 및
호산구 증가와 전신증상을 동반한 약물반응(DRESS)을 포함한 중증피부이상반응(SCARS)이 외
국의 시판 후 사용에서 보고되었다. 환자는 피부 반응에 대한 증상 및 징후에 대하여 교육받아야
하며 피부 반응에 대해 모니터링해야 한다.
3. 저나트륨혈증
ESL은 전압의존성 나트륨 채널(VGSC)을 억제하기 때문에 저나트륨혈증이 나타날 수 있다. 이 약을 투여받은 환자의 1.5%에서 저나트륨혈증이 나타났다. 대부분의 경우 무증상이지만, 발작
악화, 혼돈, 의식 감소와 같은 임상 증상을 수반할 수 있다. 따라서 ESL 치료 전후로 혈청 나트
륨 수치를 모니터링 해야한다. 특히 혈청 나트륨 농도에 영향을 줄 수 있는 신장애가 있는 경우
더 주의해야한다.
4. 투여 주의 대상:
이 약에 과민반응이 있는 환자, 2도 또는 3도 방실차단 환자에게는 투약하지 않는다. 또한 임 부 및 수유부, PR 간격 연장과 관련 있는 약물을 투여중인 환자에게는 이 약을 신중히 투여하도 록 한다.
에슬리카바마제핀 아세테이트(eslicarbazepine acetate, 이하 ESL)는 2009년 최초 허가받 은 이후 계속해서 적응증 및 사용 범위를 확장해오고 있다. 이와 관련된 주요 임상을 살펴보려 한 다.
에슬리카바제핀의 최초허가 시 주요 근거를 제공한 임상은 여러 개이다: 임상시험 BIA2093-301, -302, -303, -304. 이들은 비슷하게 진행되었으며, 이 임상들을 통해 ESL 은 성인 부분발작치료의 부가요법으로 최초 허가를 받을 수 있었다. 이번 학회지에서는 BIA-2093-301(NCT00957684) 임상만 자세히 볼 것이다. 임상시험 NCT01527513, NCT00988156 (BIA 2093-208, 305)은 처방연령군을 소아로 확대하는 과정에서 주요 근거 를 제공했다. 두 임상을 메타분석한 논문을 바탕으로 알아볼 것이다. 마지막으로 살펴볼 임상은
NCT01162460(BIA-2093-311)이다. 이 임상시험을 근거로 ESL은 성인 부분발작의 단독요
법 치료제로 적응증 확대를 할 수 있었다.
이 외에 시판 후 임상시험도 여러 개 진행되었다. NCT01422720 (BIA-2093-401)는 고령자 에서 ESL의 안전성을 평가한 임상4상 시험이었다. 이 임상 결과를 통해 신장 기능이 정상인 고
령자에서 용량 조절은 필요하지 않음이 입증되었다. 이 임상은 표에서만 간략히 나타낼 예정이다.
NCT00957684 (BIA-2093-301)
Efficacy and Safety of Eslicarbazepine Acetate (BIA 2-093) as Adjunctive Therapy for Refractory Partial Seizures in a Double-blind, Randomised, Placebo-controlled, Parallel-group, Multicentre Clinical Trial.
[study design]
본 임상시험은 난치성 부분발작의 보조치료로서 에슬리카바제핀(eslicarbazepine, 개발 코드
명 BIA 2 093)의 유효성과 안정성을 평가하기 위해 설계된 제3상 임상시험이다. 본 시험은 이
중맹검, 무작위배정, 위약대조, 다기관 방식으로 진행되었다.
시험군은 ESL 400mg 투여군, 800mg 투여군, 1200mg 투여군의 총 3개 그룹으로 나뉘어서
1일 1회 경구투여했다. 대조군은 위약을 마찬가지로 1일 1회 경구투여했다.
이 임상은 베이스라인 기간(8주), 적정기간(2주), 유지기간(12주), 점검기간(4주)으로 총 26주 동안 진행되었다. 약의 유효성 및 안전성은 약의 투여기간인 적정기간 2주와 유지기간 12주를 합 친 총 14주의 기간에서 평가되었다.
[participation]
다음의 조건을 만족할 경우 연구에 등록될 수 있었다. 18세 이상의 성인이며, 선별검사 전 최소 12개월동안 부분발작을 진단받은 사람. 선별검사 전 최소 2개월 동안 1~3가지의 항뇌전증약( 단, oxcarbazepine, felbamate는 제외)을 안정된 용량으로 복용한 사람. 무작위 배정 전 8주
베이스라인 기간의 각 4주 기간에 최소 4회 부분발작을 경험한 사람. 다음과 같은 경우에는 연구에서 제외되었다. 운동 증상이 없는 단순 부분 발작만을 가진 경우, 원발성 전신성 뇌전증 환자. 정신분열병 또는 자살 시도 병력이 있는 경우. 카르바마제핀, 옥스
카르바제핀 또는 이와 화학적으로 관련된 물질에 과민반응 병력이 있는 경우. 선별검사 전 1개월 이내에 옥스카르바제핀 또는 펠바메이트를 투여받은 경우.
선별검사를 통해 연구에 등록된 503명 중 395명이 무작위 배정되어 시험 약물을 투여받았다.
이 중 위약군은 100명, ESL 400mg 군은 96명, ESL 800mg 군은 101명, ESL 1200mg 군 은 98명이었다. ESL 400mg 군 1명과 ESL 1200mg 군 1명은 베이스라인 측정정 이후 효능
평가 자료가 없어 ITT(intention-to-treat) 분석에서 제외되었다. 네 치료군은 연령, 성별, 인 종, 유병기간 등의 인구통계학적 및 배경 특성에서 유사하였다.
[Outcome]
ITT집단에서, 14주간의 이중맹검 치료 기간동안 표준화된 발작빈도는 ESL 800mg(LS 평균 7.1, p < 0.001) 및 ESL 1200mg(LS 평균 7.4, p < 0.001) 투여군에서 위약군(LS 평균 10.9)
보다 유의하게 낮았다. ESL 400mg 군과 위약군 사이의 차이는 통계적으로 유의하지 않았다. PP집단에서도 마찬가지의 결과를 얻을 수
임상 용어 정리
ITT : intention-to-treat population
평균 : 공분산분석(ANCOVA)이나 분산분석(ANOVA) 같은 통계 모델을 사용해서, 공변
반응률(발작 빈도 ≥50% 감소)은 ESL 800mg (40.0%, p < 0.001) 및 ESL 1200mg (37.1%, p < 0.01) 군에서 위약군(13.0%)보다 유의하게 높았다. 마찬가지로, 발작 빈도의 중
앙값 상대 감소율은 ESL 800mg (32.6%, p < 0.001) 및 ESL 1200mg (32.8%, p < 0.001)
군에서 ESL 400mg (18.7%)과 위약군(0.8%)보다 더 높았다
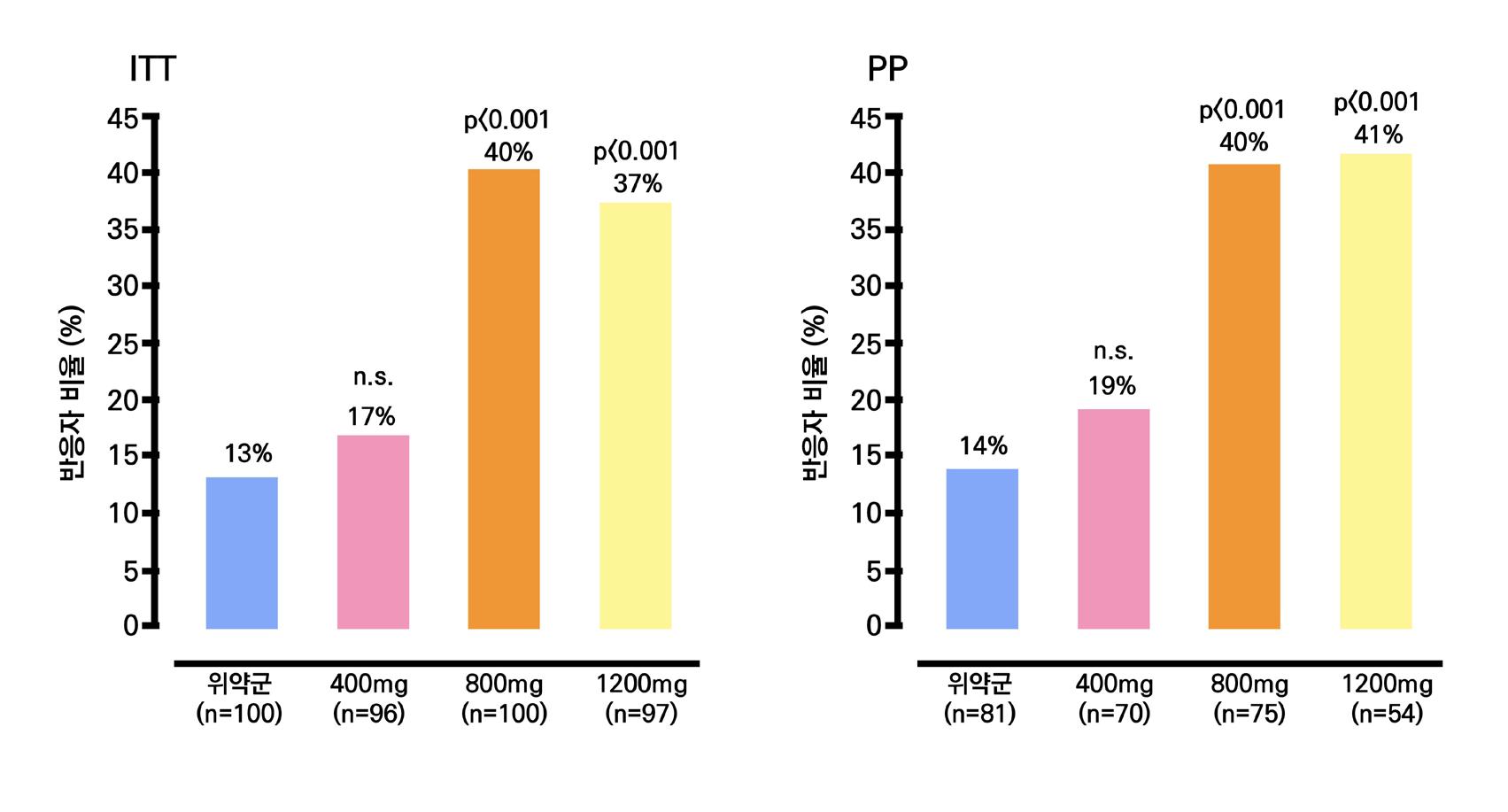
[그림 22] ITT집단, PP집단에서 14주 치료기간동안 반응률 (반응률=발작 빈도 50%이상 감소한 환자의 비율)
[Adverse Events]
치료 관련 이상반응(Treatment Emergent Adverse Event, 이하 TEAE)의 전체 발생률은 일반적으로 ESL 용량이 증가함에 따라 높아졌다. (위약군 68.0%, ESL 400mg 군 78.1%, ESL 800mg 군 83.2%, ESL 1200mg 군 79.6%).
가장 흔한 TEAE는 어지럼증, 졸림, 두통, 메스꺼움, 복시, 조정장애, 구토, 시야흐림, 피로였으 며, 대부분은 경증 또는 중등도였다. 정신질환 관련 TEAE 발생률은 매우 낮았으며, 반복적으로 나타난 증상은 우울(ESL 1200mg: 3명), 초조(ESL 800mg: 1명; ESL 1200mg: 2명), 무감 동(ESL 400mg: 1명; ESL 1200mg: 2명)이었다. 자살 사례는 보고되지 않았다. ESL 투여군 에서 4명이 저나트륨혈증으로 TEAE 보고되었으나, 위약군에서는 보고되지 않았다. 이 중 3명은
카르바마제핀을 병용 중이었다.
중대한 TEAE 발생률은 전반적으로 낮았다. (위약군 0%, ESL 400mg 군 4.2%, ESL 800mg 군 5.9%, ESL 1200mg 군 2.0%) 연구 기간 동안 사망은 없었다.
[Conclusion]
이 3상 임상시험 결과, ESL 800mg 및 1200mg 1일 1회 투여는 1~3종의 병용 항뇌전증약 (AED) 치료에 반응하지 않는 난치성 부분 발작 환자에서 부가요법으로 효과적이며, 내약성도 우 수함을 보여주었다. 이러한 임상 결과를
최 초 허가를 받을 수 있었다.
Efficacy
소아를 대상으로 적응증 확대가 이루어지는 과정에서
임상은 2가지이다. 2013년에 진행된 임상 2상인 NCT01527513(BIA 2 093-208)과 이후 2017년 진행된 임상 3상인 NCT00988156(BIA 2 093-305)의 결과를 메타 분석함으로써 소아에 대한 유효성과 안전성이 입증되어 처방 연령군이 확대되었다.
NCT01527513(BIA 2 093-208)
[Study Design]
본 연구는 1~2가지 AED 치료에 불응성인 소아 및 청소년(6~16세)의 난치성 부분 발작에 대 한 보조요법으로 에슬리카바제핀 아세테이트(Eslicarbazepine acetate, 이하 ESL)가 인지에
미치는 영향을 평가하기 위해 설계된 제2상 임상 시험이다. 이중맹검, 무작위배정, 위약대조 방 식으로 진행되었다.
[Procedure]
Study 305와 동일
[Participation]
6~16세 소아 및 청소년은 다음 조건을 충족할 경우 연구에 포함될 수 있었다. 스크리닝 방문에 앞서 최소 12개월 전에 뇌전증 진단을 받았으며, 1~2가지 AED 치료에도 불구하고 4주간 최소 2회 이상의 국소 발작을 경험했다. 또한 뇌전증 이외에는 전반적으로 건강하며 IQ(Intelligence Quotient)가 70 이상인 환자를 대상으로 했다.
다음과 같은 환자는 제외되었다. 운동 증상이 없는 국소발생 의식유지 발작만 있는 경우, 원발 성 전신 발작에 해당하는 경우, 진행성 뇌질환이나 정신병적 발작 원인을 가지는 경우, 30분 이
내에 3회 이상 cluster 발작을 하는 경우, ADHD가 있는 경우, creatinine clearance (CRCL)
<60 mL/min인 경우, Lennox-Gastaut 증후군이나 West 증후군이 있는 경우, 이전에 ESL
투여 경험이 있는 경우 임상시험에 참여할 수 없었다.
이 시험에는 총 123명의 환자가 참여했으며, 이 중 40명은 위약 투여군, 83명은 ESL 투여군
에 배정되었다.
[Primary & Secondary Outcome]
1차 유효성 평가 변수로서 복합 주의력 척도의 변화와 2차 유효성 평가 변수로서 발작 빈도의
상대적 감소 및 50% 반응자 비율 등을 평가하였다. 1차 평가 변수에서 ESL 군이 위약군 대비
통계적 유의한 차이가 없었다. 2차 평가 변수인 표준발작 빈도 감소의 경우, Baseline 이후 상
대적 변화값은 위약 투여군에서 -13.84%, ESL 투여군에서 -34.82%로 ESL 투여군에서 치 료 효과가 더 크게 나타났으며, 통계적으로 유의하였다. 유지기간 동안 반응자 비율은 위약 투여
군이 25.0%, ESL 투여군이 50.0%였으며, 적정+유지기간 동안 반응자 비율은 위약 투여군이 27.5%, ESL 투여군이 48.2%로, 유지기간 및 적정+유지기간 동안 ESL에서 반응자 비율이 더 높았으며 통계적으로 유의하였다. 이중 눈가림 기간 종료 시 측정한 인지평가 시험에서 위약 투
여군과 ESL 투여군간 유의한 차이는 없었다.
[Adverse Events]
*Study 305 참고 (논문 상에서 Study 305와 함께 분석 진행)
NCT00988156(BIA 2 093-305)
[Study Design]
본 연구는 1~2가지 AED 치료에 불응성인 소아 및 청소년(2~16세)의 난치성 부분 발작에 대 한 보조요법으로서 ESL의 유효성과 안전성을 평가하기 위해 설계된 제3상 임상 시험이다. 이중
맹검, 무작위배정, 위약대조, 평행연구 방식으로 진행되었다. (분석에는 4~17세만 포함되었다.)
[Procedure]
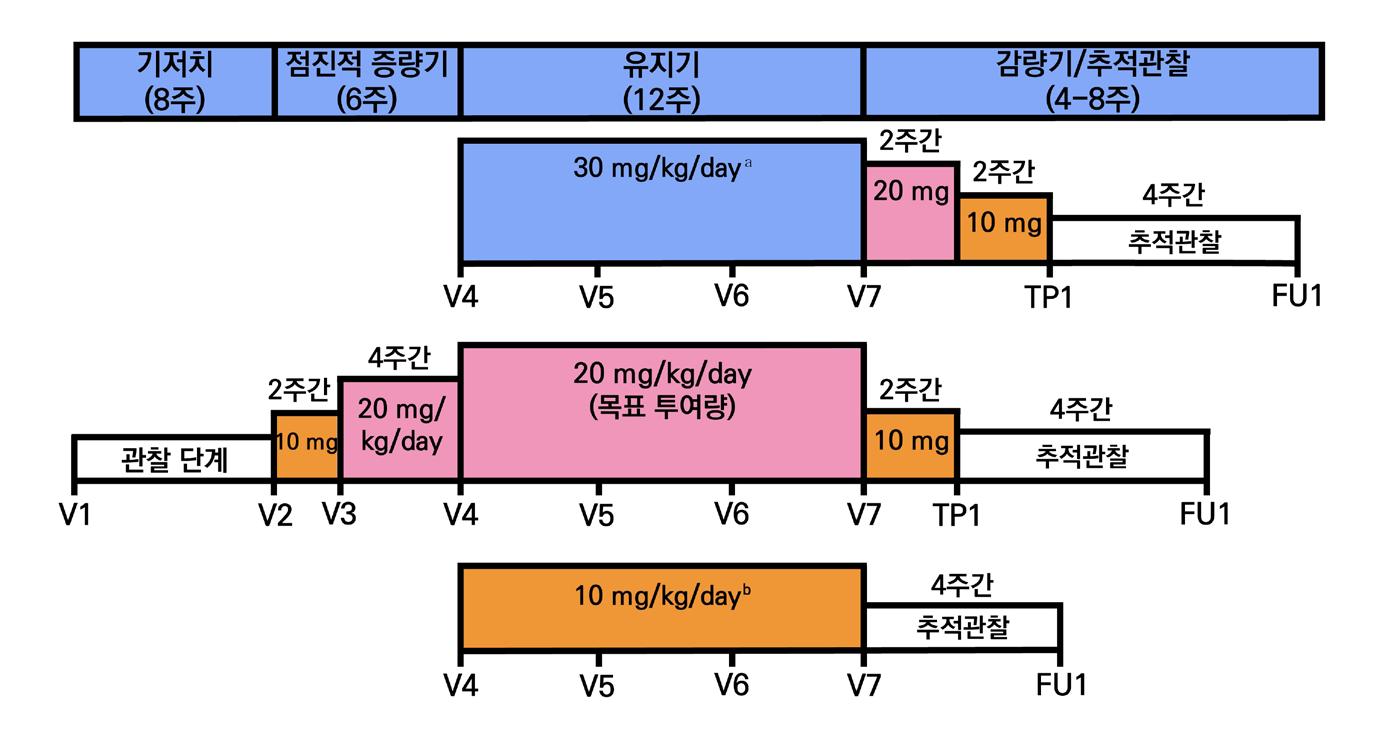
[그림 23] Participant Arm & Intervention
임상 시험 단계를 거치며 ESL 용량은 체중에 따라 점진적으로 증량되었으며, 목표 용량은 20mg/kg/day(최대 1200mg/day)였다. 내약성은 허용 가능한 것으로 간주되었으나 치료 효
과가 불충분했던 환자들에 대해서는 30mg/kg/day로 증량되었으며, 견딜 수 없는 부작용이 나 타난 환자들에 대해서는 10mg/kg/day로 감량되었다.
[Participation]
2~16세 소아 및 청소년은 다음 조건을 충족할 경우 연구에 포함될 수 있었다. 스크리닝 방문에 앞서 최소 6개월 전에 뇌전증 진단을
다음과 같은 환자는 제외되었다. 원발성 전신 발작에 해당하는 경우, 진행성 신경질환이나 정신
병적 발작 원인을 가지는 경우, 30분 이내에 3회 이상 cluster 발작을 하는 경우, 비뇌전증성 발 작에 해당하는 경우, Lennox-Gastaut 증후군이나 West 증후군이 있는 경우, 이전에 ESL 투
여 경험이 있는 경우 임상시험에 참여할 수 없었다.
이 시험에는 총 239명의 환자가 참여했으며, 이 중 120명은 위약 투여군, 119명은 ESL 투여
군에 배정되었다.
[Primary Outcome]
유효성 평가 변수는 반응자 비율(12주 유지기간 동안 베이스라인 대비 4주당 발작 빈도의 50%
이상 감소한 대상자)과 12주 유지기간 동안 베이스라인 대비 4주당 발작빈도 상대적 감소이다.
위 두 가지 1차 유효성 평가변수 모두에서 위약과 ESL군간 통계적 유의성은 없었다. 반응자 비율
은 ESL 투여군(30.6%)과 위약 투여군(31.0%)에서 차이가 없었으며, 표준발작빈도(LS mean)
의 상대적 감소는 위약 투여군(-8.6%)보다 ESL 투여군(-18.1%)에서 더 컸으나 통계적 유의
성 없었다. (p=0.2490)
[Adverse Events]
논문 상에서 Study 208과 Study 305의 Adverse Events 분석이 함께 진행되었다.
전반적인 이상반응(TEAE) 발생률은 ESL 투여군이 67.8%, 위약 투여군이 65.6%였다. 대부 분 경증 또는 중등증 이상반응이었으며, 중증 TEAE 발생률은 ESL 투여군이 8.9%, 위약 투여 군이 6.3%였다. 자주 보고된 이상반응으로는 두통, 졸림, 구토, 복시, 어지럼, 오심 등이었으며 발작 관련 이상반응은 상대적으로 드물게 발생했다. 11~21kg, 7~11세 군에서 ESL 투여군의 TEAE 발생률이 위약 투여군보다 약간 높았으나, 환자 수가 적어 명확한 분석이 어려웠다.
중대한 이상반응(SAE) 발생률은 ESL 투여군이 9.9%, 위약 투여군이 5.0%였다. 사망은 2건 발생했는데, ESL 투여군에서 발작 후 후유증으로 1건, 위약 투여군에서 질식으로 1건 발생했다. SAE로는 주로 뇌전증 관련 및 호흡기 감염이 발생하였다.
중도 탈락을 초래한 TEAE는 ESL 투여군이 5.9%, 위약 투여군이 2.5%였으며 주로 어린 연 령대에서 발생률이 높았다.
특수 관심 이상반응으로는 알레르기 및 피부 이상, 저나트륨혈증, 갑상선기능저하증, 혈구 감 소증, 인지·정신과적 증상 등이 드물게 있었으며, 발작악화는 ESL 투여군에서 8.9%, 위약 투여 군에서 6.3% 발생하였다.
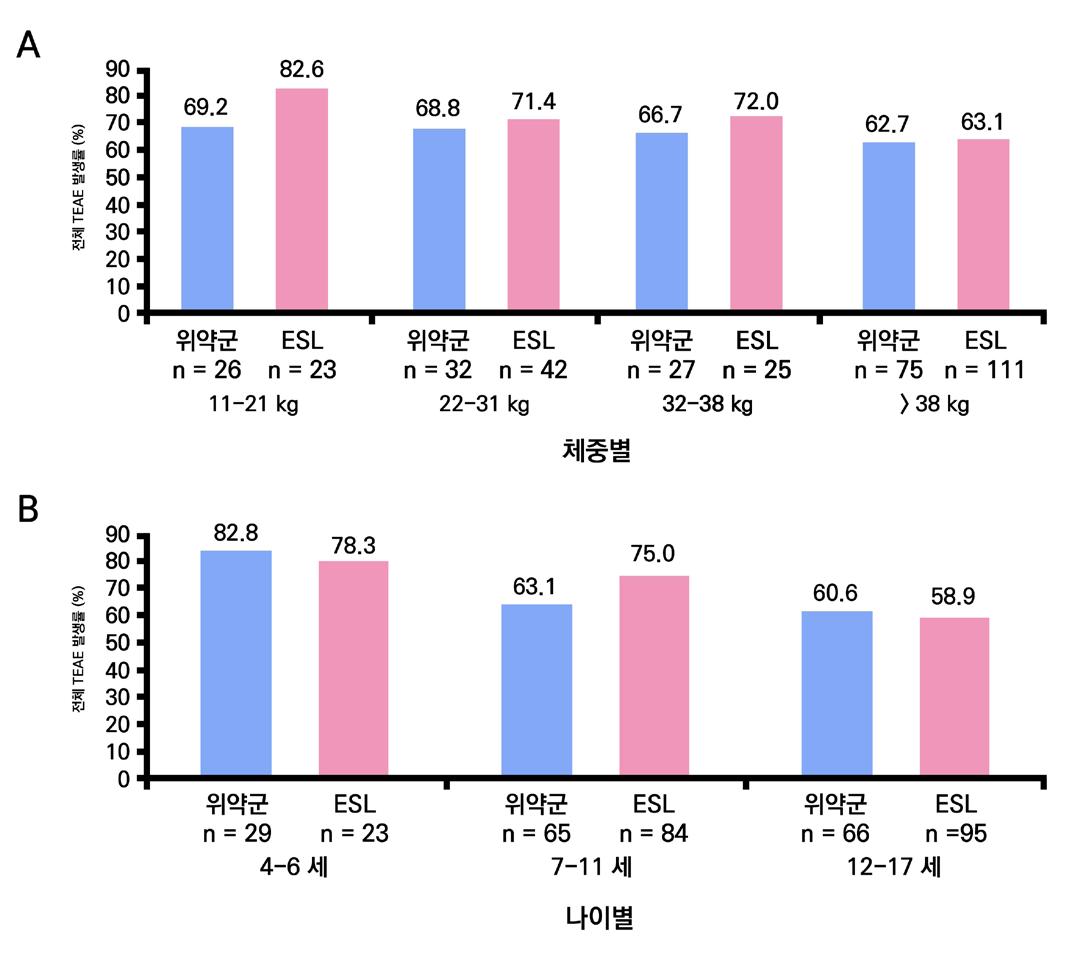
[그림 24_왼쪽] 연령별 SAE 발생률과 중도 탈락을 초래한 TEAE 발생률
[그림 24_오른쪽] 체중 및 연령별 TEAE 발생률
[Conclusion]
Study 305만으로 결과를 해석하는 경우, 두 가지 1차 유효성 평가변수에서 모두 위약과 ESL 군간 통계적 유의성이 없다. 그러나 Study 305를 Study 208과 함께 메타분석을 진행하는 경 우, 표준발작빈도의 절대 및 상대적 감소는 위약과 비교하여 ESL 치료군에서 더 높게 나타났으
며, 통계적으로 유의하다는 결론을 내릴 수 있다. 따라서, Study 305와 Study 208의 메타 분석
을 통해 난치성 국소발작을 앓고 있는 소아 및 청소년(6~16세)을 대상으로 부가요법으로서 ESL 의 유효성과 안전성이 입증되었음을 추측해 볼 수 있다.
*추가적으로, 미국에서는 4~6세의 소아를 대상으로 한 ESL 투여 또한 허가를 받았으나, 해당 임상 시험(NCT03108729)과 관련된 자세한 정보를 찾는데 어려움이 있었다.
Efficacy and Safety of Eslicarbazepine Acetate as Monotherapy for Patients With Newly Diagnosed Partial-onset Seizures
[study design]
본 연구는 국소 발작 조절에 있어 에슬리카바제핀 아세테이트(Eslicarbazepine acetate, 이하
ESL)의 효과, 편리한 내약성을 고려하여 국소 발작을 경험하는 새롭게 진단된 뇌전증 환자에게 1
차 치료제로서의 가능성을 입증하기 위해 설계된 제3상 임상 시험이다. 이 연구는 단일요법 치료 로서의 효과와 안전성을 입증하고, 표준 치료제인 카르바마제핀 서방형(이하 CBZ-CR)에 대해
비열등성을 입증하는 것을 목표로 하며, 사중맹검, 무작위 배정, 평행연구 방식으로 진행되었다.
[Procedures]
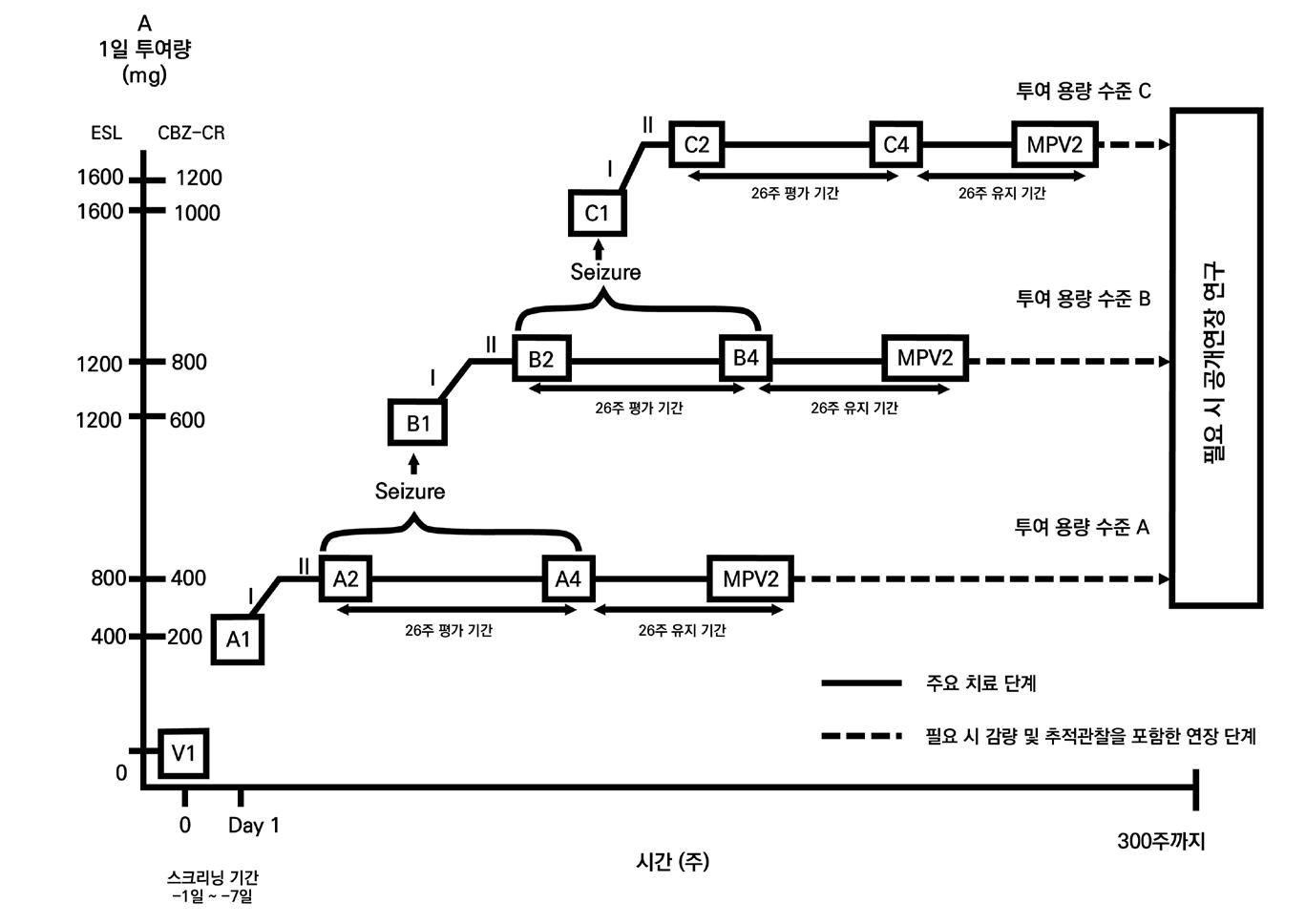
[그림 25] NCT 0116240의 임상 연구 설계
V1: 스크리닝(1~7일전)
A1, B1, C1: 1주간의 초기용량 적정기간 시작
I, II: 각 선별 군의 적정기간(I: 용량증가, II: 안정화기간)
용량그룹(Dose Levels)
1. Dose Level A: 저용량군(ESL 800mg / CBZ-CR 400mg까지)
A1 → A2 → A4 → MPV2
2. Dose Level B: 중간용량군(ESL 1200mg / CBZ-CR 600mg까지)
B1 (발작 발생시 승급) → B2 → B4 → MPV2
3. Dose Level C: 고용량군(ESL 1600mg / CBZ-CR 1200mg까지)
C1 (B군에서 발작 발생시 승급) → C2 → C4 → MPV2
이 연구는 각 치료에 대해 사전에 정의된 3개의 목표 용량으로 구성된 단계적(stepwise) 설
계를 활용하였다. 무작위 배정된 환자들은 ESL 400mg 1일 1회 또는 Carbamazepine-CR 200mg 1일 1회 중 하나를 투여받았고, 이후 첫 번째 목표 용량 수준으로 증량되었다.
26주 평가 기간 동안 발작이 없었던 환자들은 유지 기간과 이후의 연장 단계로 진입하였다. 만
약 평가 기간 중 발작이 발생한 경우, 해당 환자의 용량은 발작 발생 후 7일 이내에 용량 수준 B
로 증량되었으며(ESL 1200mg 1일 1회 또는 CBZ-CR 400mg 1일 2회), 두 번째 평가 기간
이 시작되었다.
수준 B 평가 기간 동안 추가 발작이 발생한 경우, 환자의 용량은 다시 수준 C로 증량되었고(ESL 1600mg 1일 1회 또는 CBZ-CR 600mg 1일 2회), 세 번째 평가 기간이 시작되었다.
용량 수준 C의 평가 기간 중 또는 유지 기간 및 연장 단계 중 어느 용량에서든 발작이 발생한 환자들은 연구에서 중도 탈락되었다. 3단계 용량 수준을 고려할 때, 각 환자당 최대 시험 기간
은 121주였다. 환자들은 매일의 발작 발생 횟수, 날짜, 발생 시간, 지속 시간을 전자 발작 일지 에 기록하였다.
[Participation]
18세 이상 성인으로 새롭게 진단된 뇌전증 환자는 다음 조건을 충족할 경우 연구에 포함될 수 있었다. 스크리닝 방문 이전 12개월 이내에 최소 2회의 명확히 문서화된 국소 발작을 경험하고, 최근 3개월 이내에 최소 1회의 발작을 경험했다. 또한 이전 12개월 이내에 뇌파검사(EEG) 및 뇌
CT 또는 MRI를 받아 진행성 신경 병변을 배제한 환자를 대상으로 했다.
다음과 같은 환자는 제외되었다. 특정 발작 병력 또는 뇌전증 지속상태 병력자인 경우, 항뇌전 증약(AED) 장기사용 이력자, ESL/CBZ복용자, 특정 약물(MAOI 등) 복용자인 경우, 심각한 정 신질환을 가지고 있거나 자살위험이 있는 경우, 중대한 질환(심장, 신장, 간, 내분비등)이 있는 경 우, 임신한 상태이거나 수유중인 경우에 임상시험에 참여할 수 없었다.
이 시험에는 총 929명의 환자가 참여했으며, 이 중 815명이 무작위 배정을 통해 두 치료군에 나뉘었다. ESL 투여군에는 401명이, CBZ-CR 투여군에는 414명이 배정되었다. CBZ-CR 투
여군에서는 2명이 실제 치료를 받지 않아 제외되었고, 최종적으로 안전성 평가 및 전체 분석 인구 (FAS)는 각각 401명(ESL)과 412명(CBZ-CR)으로 구성되었다. ESL 투여군에서는 총 117명 이 중도 탈락하였고, CBZ-CR 투여군에서는 총 105명이 중도 탈락하였으며 두 군 모두에서 부 작용이 가장 큰 탈락 원인이었다. 계획된 치료 프로토콜을 그대로 따른 환자 수는 ESL 투여군에 서 388명, CBZ-CR 투여군에서 397명이었고 최종적으로 평가 기간을 완료한 환자 수는 ESL 투여군 284명, CBZ-CR 투여군 307명이었다.
[Primary Outcome]
본 시험의 1차 평가변수는 Per protocol set(치료 지침을 충실히 따른 환자 집단) 내 최종 평가 된 용량 수준에서 26주 동안의 발작 완전 소실 환자의 비율이다. ESL 투여군의 71.1%, CBZCR 투여군의 75.6%가 마지막 평가 용량에서 발작이 소실되었으며 비열등성이 입증되었다(차이 = -4.28%, 95% 신뢰구간 -10.30% ~ 1.74%).
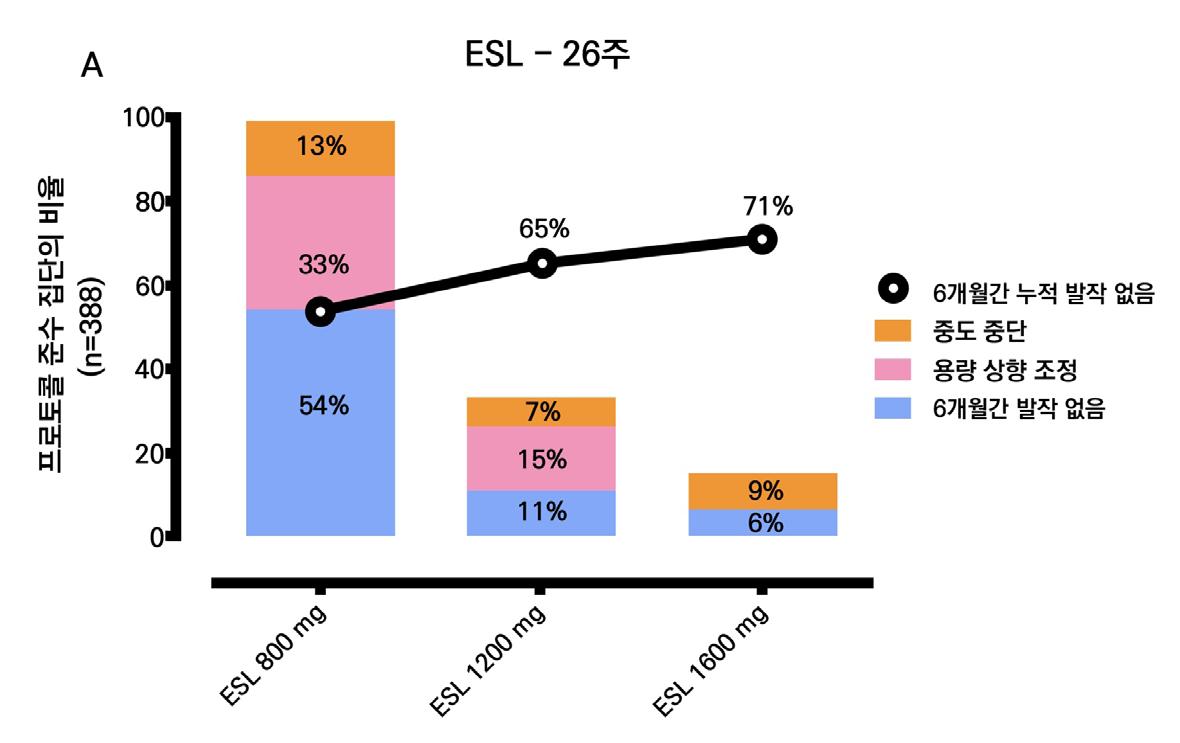
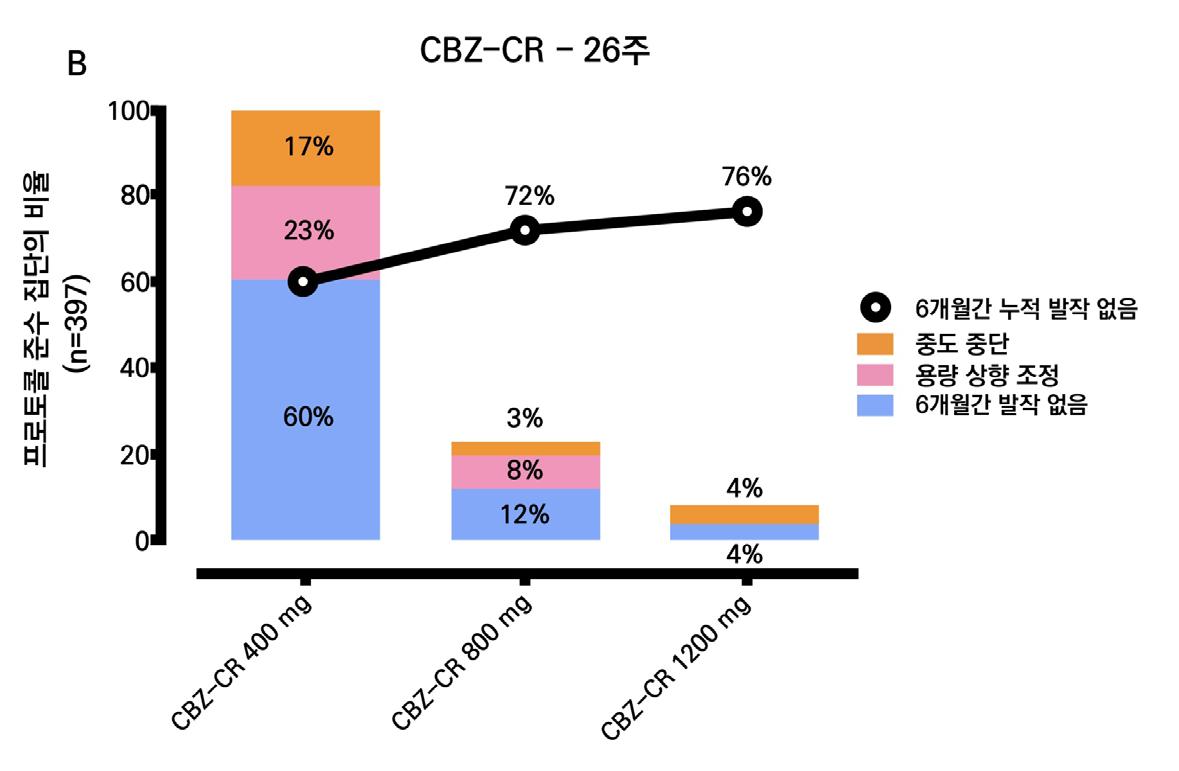
[그림 26] Per protocol 집단에서 26주 동안 각각의 용량 수준에서 ESL과 CBZ-CR 치료군
의 무발작, 중단, 그리고 증량 환자의 전체 비율
[Secondary Outcome]
먼저 Per protocol set 내 최종 평가된 용량 수준에서 52주 동안 발작이 없었던(완전 발작 소 실) 환자의 비율을 측정하였다. ESL은 CBZ-CR에 비해 비열등성이 입증되었으며, ESL 투여 군의 64.7%, CBZ-CR 투여군의 70.3%가 발작이 소실되었다(차이 = -5.46%, 95% 신뢰구 간 = -11.88% ~ 0.97%).
다음 2차 평가변수로 Per protocol set 내 26주 동안의 치료실패율(첫 발작 확률)을 측정하였
다. ESL 투여군 12%, CBZ-CR 투여군 6%(차이= -5.8%, 95% 신뢰구간 하한선 = -9.9%)
으로 ESL 투여군에서 높았으나, 사후 분석에서는 각각 7%와 3%로 차이가 줄어들었으며 두 분
석 모두 비열등성 기준 이내였다.
Full analysis set(무작위 배정된 전체 환자 집단 기준)에서 52주 최종 용량에서의 치료유지 율도 2차 평가변수로 사용되었다. 치료를 중단한 비율은 ESL 투여군 26%, CBZ-CR 투여군 21%(차이= -4.7%, 95% 신뢰구간 하한선=-10.8%)이었고, 가장 낮은 용량(dose level A)
에서 치료를 유지한 환자들의 지속률은 ESL 투여군이 CBZ-CR 투여군보다 높았으며, 1년 후 중단 비율은 각각 14%, 16%(차이=+1.8%, 95% 신뢰구간 하한선=-4.3%)였다.
그 외에 기본 발작 유형에 따른 발작 억제율은 두 치료군 간에 유사하게 나타났다. 삶의 질(QOLIE-31) 점수 개선도 또한 유지기 및 최종 방문 시점에서 두 군 간에 차이가 없었다.
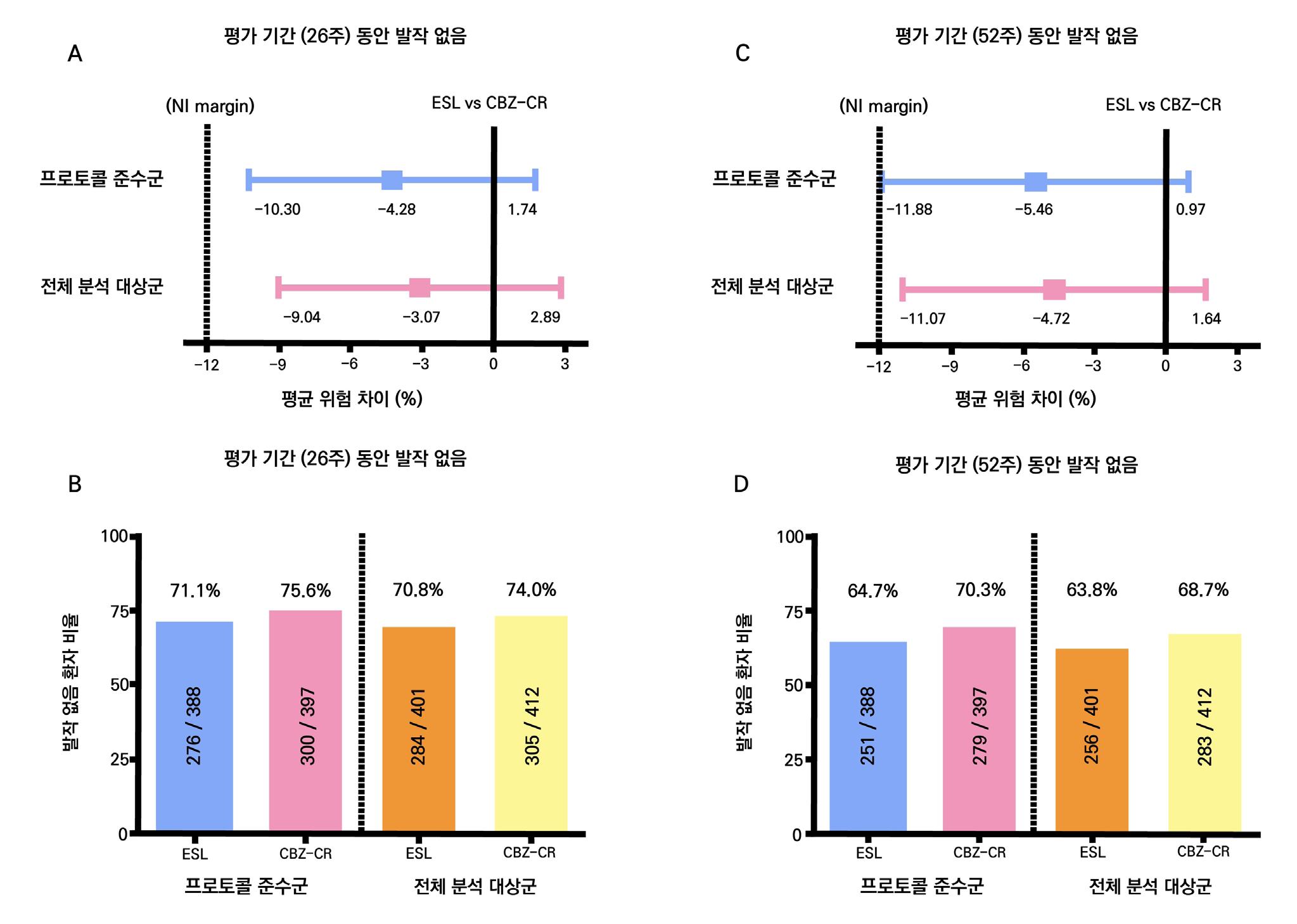
[그림 27] A,B: 26주동안의 무발작 비율, C,D: 52주동안의 무발작 비율
무작위로 ESL 또는 CBZ-CR에 배정된 per protocol 및 full analysis 집단에서, (a) 26주 및 (c) 52주 동안, 그리고 (b 및 d) 마지막 평가된 용량에서의 무발작률 비율에 대해, 양측 95% 신 뢰구간을 가진 조정된 치료 차이를 제시하였다. 비열등성 한계는 -12%로 설정되었으며, 즉 신 뢰구간의 하한이 -12% 이상일 경우 ESL은 CBZ-CR에 대해 비열등하다고 가정하였다.
[Adverse events]
이상반응 발생률은 ESL 투여군 76.3%, CBZ-CR 투여군 79.6%로 비슷했으며, 대부분 경 증이었다. 가장 흔한 이상반응은 어지러움, 두통, 졸림, 피로, 메스꺼움, GGT(감마글루타밀 전
이효소) 증가 등이었다. 중대한 이상반응의 비율도 유사했으며, ESL 투여군에서는 뇌전증이, CBZ-CR군에서는 실신, 경련, 충수염, 심방세동, 두부외상, 서혜부 탈장, 국소발작, 폐색전증 등
이 보고되었다.
사망 사례는 총 4건이었으며, ESL 투여군에서는 다형성 교모세포종과 심정지, CBZ-CR 투 여군에서는 자살과 폐선암이 원인이었다. 이 중 자살 한 건만 치료 관련 가능성이 있는 것으로 확
인되어 자살의 위험성은 비교적 낮은 것으로 간주되었다.
부작용으로 인한 치료 중단률은 ESL 투여군이 더 낮았으며(14.0% vs 18.4%), ESL 투여군
에서는 피로와 주의력 장애가, CBZ-CR 투여군에서는 알레르기 피부염, 두통, 경련, GGT 증가, 과민반응 등이 주요 원인이었다.
대부분의 환자들은 혈중 나트륨 농도가 130mEq/L 이상이었으며, 125mEq/L 이하의 저나트
륨혈증은 ESL 투여군에서 1.5%, CBZ-CR 투여군에서 0.7% 발생하였다. 단, 저나트륨혈증으
로 인해 치료를 중단한 환자는 CBZ-CR 투여군에서 1명뿐이었다. 혈액학, 응고, 갑상선 기능, 골 전환 표지자에 있어 의미 있는 변화나 그룹 간 차이는 관찰되지 않았다.
CBZ-CR 투여군은 ESL 투여군에 비해 GGT 증가 비율이 높았으며(25.7% vs 10.2%), 기 준치의 2배 이상 증가한 비율도 CBZ-CR 투여군에서 더 높았다(18.7% vs 7.3%). 총 빌리루 빈 수치는 시간이 지남에 따라 감소했지만, 대부분의 환자에서 정상 범위를 유지하였다.
백혈구 감소증은 ESL 투여군에서 4건, CBZ-CR 투여군에서 8건이 있었으며, 이 중 CBZCR 투여군 2명은 이로 인해 치료를 중단하였다. ESL 투여군에서 백혈구 감소로 치료 중단한 사 례는 없었다.
[Conclusion]
이 3상 임상시험은 하루 한 번 복용(QD)하는 Eslicarbazepine acetate가 하루 두 번 복용 (BID)하는 Carbamazepine-CR에 대해 발작 억제율에서 비열등함을 입증하였다. 이 효과는 1
년의 치료 기간 동안 유지되었으며, 2차 평가변수들과 민감도 분석 결과도 본 연구의 신뢰도를 뒷받침하였다. 비교 약물로 선정된 Carbamazepine-CR은 새롭게 진단된 뇌전증 환자에게 사
용되는 대표적인 단일요법이며, 투여 용량은 기존 임상시험에서 사용된 용량을 기준으로 삼았다.
에슬리카바제핀 아세테이트는 과거 부가요법에서 낮은 용량의 효과가 미미했던 점을 고려하여, 본 연구에서는 최고 용량을 1600mg으로 설정하였다. 환자들은 낮은 초기 용량에서 시작하여, 시간이 지남에 따라 서서히 증량되었으며, 치료 지속률은 전반적으로 유사했으나, 가장 낮은 용 량에서의 지속률은 에슬리카바제핀 투여군에서 더 높았다. 이는 카르바마제핀 투여군에서 이상 반응이나 효과 부족으로 인한 높은 중단 비율 때문이었다. 비열등성 단일요법 시험은 실제 임상 환경을 반영하기 위해 설계되었으며, 보수적인 기준(12% 비열등성 경계)을 적용했음에도, 발작 억제율 차이의 95% 신뢰구간 하한이 -10.3%로 기준 이내였으며, ILAE가 제시하는 15% 경
계 내에도 포함되었다.
결론적으로, 이 대규모 3상 임상시험은 새롭게 진단된 초점 발작 성인 뇌전증 환자에서 QD Eslicarbazepine acetate(800–1600 mg)가 BID Carbamazepine-CR(200–600 mg)에
비해 비열등하며, 안전성과 내약성 측면에서도 우수함을 보여주었다. 하루 한 번 복용이라는 복 약 편의성까지 고려할 때, 에슬리카르바제핀 아세테이트는 새롭게 진단된 뇌전증 환자를 위한 적 절한 단일요법 치료 옵션으로 평가된다.
[표 33] 에슬리카바제핀 임상 요약
시험명 시험 목적 디자인
성인의 난치성
NCT00957684 (BIA-2093-301)
NCT00988156 (BIA-2093-305)
부분발작의 보 조치료로 ESL 의 유효성 평가
NCT01162460 (BIA-2093-311)
소아 및 청소년 의 난치성 부분 발작의 보조치
료로 ESL의 유 효성 및 안전성 평가
3상, 이중맹검, 무작위배정, 평 행군, 다기관
난치성 부분발 작 성인(18세 이상) 환자
NCT01422720 (BIA-2093-401)
새로 진단된 부 분발작의 단
독요법제로서 ESL의 유효성 및 안전성 평가
3상, 이중맹검, 무작위배정, 평 행군, 국제적, 다기관
-위약 QD -ESL 400mg QD -ESL 800mg QD -ESL 1200mg QD
난치성 부분 발작의 소아 (2-16세) 환자 -위약
-6주 적정기간 ;목표: ESL 20mg/kg/day
-12주 유지기간 ;최대 ESL 30mg/kg/day
14주 치료 기간 동안, 4주당 발 작 빈도
14주 치료 기간 동안 발작 빈도 의 상대 감소
12주 유지 기간 동안 Baseline 대비 4주당 발 작 빈도의 변 화, 해당 빈도가 50%이상 감소 한 환자의 비율
고령자 부분 뇌 전증의 부가 요법으로서의
ESL의 안전성 과 내약성 평가
3상, 4중맹검, 무작위배정, 활 성대조시험
4상, 다기관, 공 개, 비대조, 단 일군시험
18세 이상 성 인, 새롭게 진단 된 뇌전증 환자.
-ESL 투여군 (QD) ;800mg, 1200mg, 1600mg
-CBZ-CR 투 여군 (BID) ;200mg, 400mg, 600mg
고령자 부분발 작 뇌정증 환자
-ESL 400~1200mg QD
26주 평가 기간 동안 발작이 없 었던 대상자의 비율
부작용 여부
한국 급여
우리나라에서 제비닉스정(에슬리카르바제핀 아세테이트, eslicarbazepine acetate)은 200, 400, 600, 800mg의 4가지 용량에 대해서 허가를 받았지만, 이중 급여가 적용되는 것은 200, 800mg의 두 가지이다. 200mg과 800mg 각각에 대해 396원과 1,386원의 상한가가 설정되 어 있다. 비급여 시 연간 투약 비용은 약 30만 원 정도이지만 급여를 통해 연간 환자 부담금이 약
9만 원으로 대폭 경감되었다.
2021년 제6차 약제급여평가위원회 평가 결과를 살펴보면, 제비닉스정은 “대체약제 대비 효과 가 열등하다고 보기 어려우나 소요 비용이 고가로, 비용효과성이 불분명하여 비급여 함.”, “단, 제약사가 대체약제의 가중평균가로 환산된 금액 이하를 수용할 경우 급여의 적정성이 있”다고 기 재되어 있다. 현재 제비닉스정에 대해 이미 급여가 이루어지고 있는 것으로 미루어 보아, 제약사 가 해당 금액을 수용했음을 추측해 볼 수 있다.
또한, 평가 내용을 통해 진료상 필수 여부에 있어서는 “진료상 반드시 필요하다고 판단되는 약
제에 해당한다고 보기 어려움.”이라고 명시되어 있지만, 임상적 유용성 측면에서 “부작용이 적
고, 효소 유도 작용이 낮아 안전하게 사용할 수 있는 약제로, 반감기가 길어 1일 1회 복용이 가능 하여, 약물 순응도가 낮을 수 있는 인지기능 저하가 있는 환자나 병식이 부족한 환자에게 장점을
가질 수 있는 약제”로 평가받았음을 확인할 수 있었다. (1일 소요 비용은 대체 약제인 carbamazepine, oxcarbazepine, lamotrigine, valproate, levetiracetam, topiramate, lacosamide, zonisamide, vigabatrin, perampanel과 비교해 고가이며 신청 약가 기준으로는 재
정소요금액이 증가할 것으로 예상되나, 대체약제 가중평균가로 환산된 금액을 기준으로 하면 대
체약제의 대체로 인한 재정증분은 없다고 기재되어 있다.)
에슬리카바제핀은 A7 국가들 중 6개국(미국, 프랑스, 독일, 이탈리아, 영국, 스위스)의 약가집
에 수재되어 있으며, 조정평균가는 각각 200mg은 1만 399원, 800mg은 1만 445원이다. (이 때, 조정평균가란 A7 국가를 포함한 주요국 보험 등재 가격을 환율, 시장 상황 등을 반영해 산 출한 국제 평균가로,
참고로, 2021년 제5차 급여기준 소위원회에서 결정된 경구용 항뇌전증약의 급여 인정 세부 기 준은 다음과 같다. 일반적으로 두 번째 뇌전증 발작 후 한 가지 약물로 시작해야 하며, 뇌파의 이 상소견이나 비정상적인 신경학적 소견, 심각한 뇌손상 등의 위험인자가 있는 경우에는 첫 발작이
라도 약물 투여를 인정한다. 단독약물의 최고 용량에 발작이 충분히 조절되지 않거나, 부작용으 로 증량이 어려울 때 작용 기전이 다른 약제의 병용을 고려하며, 난치성 뇌전증 등에는 최대 4종
이내 병용투여를 인정하고 4종 초과 시 투여소견서를 첨부하여야 한다. 일반적으로 2~5년간 발
작이 발생하지 않은 경우 약물 중단을 고려하며, 위와 같은 인정 기준 이외에는 약값 전액을 환 자가 부담해야 한다.
에슬리카바제핀은 Zebinix(제비닉스)라는 이름으로 영국에서 판매되고 있다. 허가 파트에서 살
펴 보았듯이 영국에서 에슬리카바제핀은 성인 국소발작 치료의 단독요법, 그리고 성인과 6세 이 상 소아의 국소발작 치료의 부가요법으로 허가를
영국에서는 국내와 다르게 현탁액 제 형으로도 판매되고
음과 같다.
[표 34] 에슬리카바제핀의 제형에 따른 NHS drug tariff
다
영국 Drug Tariff(Drug Tariff for England and Wales)는 NHS에서 처방조제비를 지역 약 국 등에 지급할
있다. 이 중에서 조 제약 가격은 Part VIIIA에서 대부분 결정되며, 다시 Category A/B/C/M 등으로 구분된다. 이
중에서 B는 현재 거의 사용되고 있지 않다고 한다. 다음은 B를 제외한 카테고리 A,C,M을 구분 하는 기준을 요약한 표이다.
실제 시장 구매가 기반, 정부가 재조정 제네릭 경쟁도 높음
기준 시장에 제네릭 다수 존재 할 때 브랜드 의존도가 높을 때 NHS가 지출 조절할 때
수 있다. Category A에
약은 제네릭 경쟁을 가격에 반영한다. Category C는 제네릭이 없거나 시장이 특수할 때 적
용된다. 이렇게 하면 브랜드 가격을 인정하지만, 남용을 막는 기준이 될 수 있다. Category M은 정부가 직접 가격을 조정해 약국의 과도한 마진을 방지한다.
이러한 기준에 따르면, eslicarbazepine 800mg은 여러 제네릭 제형이 나오고, eslicarbazepine 200mg 정제와 현탁액은 bial 회사의 제비닉스 브랜드 가격이 그대로 적용됨을 알 수 있다.
에슬리카바제핀은 국소발작의 단독 또는 부가요법으로 모두 허가를 받았다. 하지만 2022년에
나온 NICE guideline(NG217)에 따르면, 에슬리카바제핀은 국소발작치료의 단독요법으로는 추천되지 않으며, 부가요법 중에서도 2차 치료제로 추천되고 있다. 이렇게 후순위로 추천되는 이 유는 경제성 평가 결과 에슬리카마제핀이 다른 약에 비해 효과 대비 비싸기 때문인 것으로 생각 된다. 다음은 국소발작의 부가요법으로 사용되는 약들의 경제성 평가 결과 중 일부만 나타낸 표 이다.
[표 36] base-cases results for add-on therapy in people with focal seizures assuming £20,000 per QALY threshold ordered by ranking (1 indicates preferred option)
*INMB : 점증적 순 재정 편익 (Incremental Net Monetary Benefit) ; 새로운 치료법이 기존의 대안에 비해 얼마나 비용
위의 표를 보면 에슬리카바제핀은 부가요법
지표
효과 대비 가장 비싼 약이다. 이번 학회
지에서 보는 3세대 뇌전증 치료제인 Brivaracetam, Perampanel, Lacosamide, Eslicarbazepine Acetate 등의 경제성 평가 결과도 확인할 수 있다. 기준인 cabamazepine과 비교 해볼 때 3세대 약들이 효과 대비 비싼 약물임을 확인할 수 있다. 따라서 이러한 3세대 약물은 기 존의 1,2세대 약을 써보고 그래도 효과가 없는 난치성 뇌전증에서 쓰일 것이라는 것을 유추해볼 수 있다.
Almeida, L., & Soares-da-Silva, P. (2007). Eslicarbazepine acetate (BIA 2-093). Neurotherapeutics, 4(1), 88–96.
Drugs.com. (1996–2025). Aptiom: Uses, dosage, side effects & warnings [Updated November 25, 2024; Cited July 8, 2025]. Retrieved from https://www.drugs.com/aptiom.html
European Medicines Agency. (2009). Zebinix (eslicarbazepine acetate) [EPAR – European public assessment report]. EMA. Retrieved from https://www.ema.europa.eu/en/medicines/human/ EPAR/zebinix
Hainzl, D., & Parhofer, K. G. (2013). A review of eslicarbazepine acetate for the adjunctive treatment of partial-onset seizures. Therapeutic Advances in Neurological Disorders, 6(6), 329–336.
Ministry of Food and Drug Safety. (2020). 제비닉스정 (에슬리카르바제핀아세테이트) [의약품 상세정 보]. 식품의약품안전처. Retrieved from https://www.health.kr/searchDrug/result_drug.asp?drug_ cd=2020111100009
International Journal of Pharmaceutical Compounding. (2018). Formulation and stability study of eslicarbazepine acetate oral suspensions for extemporaneous compounding. International Journal of Pharmaceutical Compounding, 22(1). PMID: 30384342.
Patsalos, P. N. (2013). The clinical pharmacology profile of eslicarbazepine acetate. Expert Opinion on Drug Metabolism & Toxicology, 9(1), 123–133.
U.S. Food and Drug Administration. (2025). Drugs@FDA: FDA-approved drugs [Database]. FDA. Retrieved from https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch. process
-허가
김영우. (2020.11.11) 뇌전증치료신약’제비닉스정’ 4품목식약처허가. 메디소비자뉴스. Retrieved from http:// www.medisobizanews.com/news/articleView.html?idxno=74092
약학정보원. (2020.11.10). 제비닉스정 200mg. Retrieved from https://www.health.kr/searchDrug/ result_drug.asp?drug_cd=2020111100009
의약품품목허가보고서. (2018.11.29). 제비닉스정200밀리그램.
Drugs@FDA. Aptiom. Retrieved from https://www.accessdata.fda.gov/scripts/cder/daf/index. cfm?event=BasicSearch.process
EMA. Zebinix. Retrieved from https://www.ema.europa.eu/en/medicines/human/EPAR/zebinix
Kim, D. H., Kim, Y. S., Kwon, O. Y., & Yang, T. W. (2023). Efficacy and Safety of Eslicarbazepine Acetate: A Single-Center Experience. Epilia: Epilepsy and Community, 5(2), 75-80.
-임상
의약품품목허가보고서. (2018.11.29). 제비닉스정200밀리그램.
Ben-Menachem, E., Gabbai, A. A., Hufnagel, A., Maia, J., Almeida, L., & Soares-da-Silva, P. (2010). Eslicarbazepine acetate as adjunctive therapy in adult patients with partial epilepsy. Epilepsy Research, 89(2–3), 278–285. https://doi.org/10.1016/j.eplepsyres.2010.01.014
clinicaltrials.gov. (2009.08.11) Study of Efficacy and Safety of Eslicarbazepine Acetate in Adult Subjects With Partial-Onset Seizures (BIA-2093-301) (NCT00957684) Retrieved from https:// clinicaltrials.gov/study/NCT00957684?term=BIA-2093-301&rank=1
ClinicalTrials.gov.(2014.10.24). Effects of Eslicarbazepine Acetate (Esl, Bia 2-093) on Cognitive Function in Children With Partial Onset Seizures. Retrieved from https://clinicaltrials.gov/study/ NCT01527513
ClinicalTrials.gov. (2016.09.29).Efficacy and Safety of Eslicarbazepine Acetate as Monotherapy for Patients With Newly Diagnosed Partial-onset Seizures. Retrieved from https://clinicaltrials.gov/ study/NCT01162460
ClinicalTrials.gov.(2018.01.16). A Pediatric Drug Study to Determine the Long-term Safety and Tolerability in Children and Adolescents (4-17 Years in Age) Taking the Drug. Retrieved from https:// clinicaltrials.gov/study/NCT03108729
ClinicalTrials.gov.(2018.11.13). Eslicarbazepine Acetate (BIA 2 093) as Therapy for Refractory Partial Seizures in Children. Retrieved from https://clinicaltrials.gov/study/NCT00988156
EU Clinical Trials Register. (2014.03.31). BIA-2093-208 Eslicarbazepine acetate. Retrieved fromhttps://www.clinicaltrialsregister.eu/ctr-search/rest/download/result/attachme nt/2008-005606-39/2/11560
Mintz, M., Pina-Garza, J. E., Wolf, S. M., McGoldrick, P. E., Józwiak, S., Grinnell, T., ... & Blum, D. (2020). Safety and tolerability of adjunctive eslicarbazepine acetate in pediatric patients (aged 4-17 years) with focal seizures. Journal of Child Neurology, 35(4), 265-273.
Trinka, E., Ben-Menachem, E., Kowacs, P. A., Elger, C., Keller, B., Löffler, K., Rocha, J. F., & Soares-da-Silva, P. (2018). Efficacy and safety of eslicarbazepine acetate versus controlled-release carbamazepine monotherapy in newly diagnosed epilepsy: A phase III double-blind, randomized, parallel-group, multicenter study. Epilepsia, 59(2), 479–491. https://doi.org/10.1111/epi.13993
-급여
건강보험심사평가원. 급여이력정보
김정주. (2021.11.25). 제비닉스 800mg 1386원 등재…와킥스 5mg은 979원. 데일리팜. Retrieved fromhttps:// www.dailypharm.com/Users/News/NewsView.html?ID=282688&dpsearch=%BD%C9%BB%E7
약학정보원. (2020.11.10). 제비닉스정 200mg Retrieved from https://www.health.kr/searchDrug/ result_drug.asp?drug_cd=2020111100009
이석훈. (2021.11.25). 환인제약 제비닉스정 등 2개 품목 신규 건강보험 적용. 팜뉴스. Retrieved from https:// www.pharmnews.com/news/articleView.html?idxno=109180
National Institute for Health and Care Excellence (NICE). (2022.05.04). Asthma: diagnosis and monitoring (NG217). NICE. Retrieved from https://www.nice.org.uk/guidance/ng217
National Institute for Health and Care Excellence (NICE). (2022.05.04). Supporting documentation 6: Clinical guideline full text (NG217). NICE. Retrieved from https://www.nice.org.uk/guidance/ng217/ documents/supporting-documentation-6
NHS Business Services Authority (NHSBSA). (2025.11.24). Drug Tariff. Retrieved November 24, 2025, from https://www.drugtariff.nhsbsa.nhs.uk/
3.4 브리바라세탐
eunsooso3472@gmail.com
seungyean103@naver.com
브리바라세탐(Brivaracetam)의 기본 정보
브리비액트(brivaracetam)는 UCB 제약에서 개발한 항경련제로, 국내에서는 브리비액트정이
라는 제품명으로 허가되어 있다. 정제는 10mg, 25mg, 50mg, 100mg의 용량으로 구성되어 있으며, 경구용 액제 및 주사용 액제 형태(각 10mg/ml)도 함께 출시되어 다양한 투약 경로를
제공한다. 제형은 필름코팅정제를 기본으로 하며, 환자의 복용 편의성과 복약 순응도를 고려하 여 설계되었다.
브리바라세탐의 적응증은 16세 이상의 환자를 대상으로 하는 부분 발작 치료의 부가요법이다. 기존 항경련제를 단독 또는 병용 투여함에도 불구하고 조절되지 않는 2차성 전신 발작을 동반하 거나 동반하지 않는 부분 발작 환자에서 추가적으로 투여하여 발작
있다.
작용기전 측면에서
높은 선택적 친화성 을 나타내는 것으로 알려져 있다. 이 SV2A 단백질은 시냅스 소포의 신경전달물질 분비에 관여
하는 핵심 구조로, 브리바라세탐은 해당 단백질과 결합함으로써 항경련 활성을 발휘한다. 이는 기존의 항경련제와는 차별화된 작용 기전으로, 발작 억제 효과를 보다 선택적으로 나타낼 수 있
는 근거가 된다.
약동학적 측면에서는 경구 투여 후 신속하고 완전한 흡수를 나타내며, 10~600mg 용량 구간에 서 선형적인 약물 동태를 보인다.
제형에 관계없이 고지방 식이 후에도 흡수 속도에는 약간의 변화가 있으나 흡수율에는 큰 영향 을 주지 않는다. 분포는 혈장단백질에 약하게 결합하며, 높은 지질친화성을 바탕으로 혈뇌장벽을 잘 통과하여 중추신경계에 효과적으로 도달한다. 대사는 주로 간에서 아마이드기의 가수분해를 통해 이루어지며, 대사산물은 카르복시산 형태로 변환된다. 주요 대사산물인 프로필기 유도체는 모두 약리학적으로 비활성이다. 최종적으로 대사산물은 주로 신장을 통해 배설되며, 복용 후 72 시간 이내에 전체 투여량의 95% 이상이 배설된다.
Synaptic Vesicle Protein 2A (SV2A) 단백질의 발현과 항경련제 반응성과의 연관성에 대해
다룬 Contreras-García 등의 연구(Synaptic Vesicle Protein 2A Expression in Glutamatergic Terminals Is Associated with the Response to Levetiracetam Treatment, Int J Mol Sci, 2020)를 참고했을 때, 브리바라세탐은 SV2A에 대한 선택적 친화성과
기반으로 항경련 효과를 나타내는 것으로 보고되었다.
SV2A는 모든 시냅스 말단 소포의 세포막에 존재하는 단백질로, 글루타메이트성 시냅스에서 특 히 활발하게 발현된다. 이는 시냅스 전 말단에서 신경전달물질이 소포를 통해 방출되는 과정, 즉
소포의 형성, 저장, 이동, 융합에 이르는 시냅스 소포
관여하는 것으로 알려져 있다. 특히
SV2A는 소포 융합 후 방출되는 시냅토태그민(Synaptotagmin)의 발현과 이동을 조절하며, 이 는 칼슘 유입에 반응하여 소포 내 전달물질이 시냅스 간극으로 분비되는 데 중요한 역할을 한다.
레비티라세탐을 포함한 라세탐
탐은 기존 2세대 라세탐인 레비티라세탐에 비해 SV2A에 대해 약 15~30배 높은
을 가지며, 구조적으로도 더 작은 분자량과 높은 지질친화성으로 인해 뇌 내 침투율이 향상된 것
이 특징이다.
또한 SV2A와 글루타메이트 수송체(VGLUT)의 공발현 비율은 브리바라세탐에 반응하는 환자
군에서 더 높게 관찰되며, 이는 SV2A가 효과적으로 발현되는 신경 말단에서 약물이 강하게 작 용함을 시사한다. 반면, 반응이 부족한 환자에서는 이 공발현 비율이 낮아 약효가 제한될 수 있
음을 설명한다.
이러한 기전적 특징은 브리바라세탐이 단순한 증상 조절을 넘어 보다 정밀하고 표적 기반의 발 작 억제 전략으로 기능함을 뒷받침한다.
실제로 난치성 간질 환자에게 필로카핀과 같은 발작 유발 물질을 투여하면 해마 부위의 SV2A
발현이 감소하며, 이와 같은 병태모델에서 브리바라세탐과 같은 SV2A 타깃 약물이 효과적으로 작용할 수 있는 기반이 마련된다. 반대로, 급성 발작 이후 대조군에서 SV2A 발현이 일시적으로
증가하는 양상도 보고되었으며, 이는 신경세포의 보상적 반응일 가능성이 있다.
유전학적 관점에서도 SV2A는 뇌전증과 밀접한 연관을 가진다. SV2A 유전자에 missense 돌
연변이가 존재할 경우, 발작 감수성이 증가하고 난치성 발작이 유발되는 사례가 보고되었다. 또
한, SV2A가 결핍된 동물 모델에서는 성장 지연, 뇌전증, 발작 빈도 증가 등이 동반되며, 이는 해
당 단백질이 정상적인 시냅스 기능 유지에 필수적임을 뒷받침한다. SV2A 이형 접합 마우스 역시
발작 유발 물질에 노출되었을 때 더 쉽게 뇌전증을 유발한다는 실험 결과가 있다.
이러한 연구 결과들은 뇌전증의 병태생리에서 SV2A 단백질이 단순한 바이오마커를 넘어, 발작
발생의 민감도와 예후를 결정짓는 주요 조절자로 기능할 수 있음을 시사한다. 따라서 SV2A의 발
현 조절이 간질 치료의 새로운 타깃으로 주목되며, SV2A를 기반으로 하는 약물의 선택성과 기전
적 타당성은 더욱 중요하게 평가되고 있다.
[그림
28]
브리비액트 허가 타임라인
한국에서는 브리비액트(brivaracetam)가 2019년 3월 4일, 경구용 액제(oral solution)와 정 제(tablet, 10mg, 25mg, 50mg, 100mg) 제형으로 최초 허가되었다.
미국에서는 브리비액트가 2016년 2월 18일, 성인(≥16세) 부가요법(adjunctive therapy)으
로 최초 승인되었다. 이후 2017년 9월 14일 단독요법으로 허가 범위가 확대되었으며, 2018년 5월 10일에는 4세 이상 소아, 2021년 8월 27일에는 생후 1개월 이상까지 적응증 나이가 확장
되었다.
유럽(EMA)에서는 브리비액트가 2016년 1월 14일, 부분발작(partial-onset seizure) 치 료제로 최초 승인되었다. 이어 2018년 7월에 4세 이상 소아로 적응증이 확대되었으며, 영국
MHRA는 2022년 6월에 2–4세 소아 대상 부가요법 적응증 라벨 확장까지 승인하였다.
1) 한국 (1)허가 기준
2차성 전신발작이 동반되거나 동반되 지 않은
(2) 복용용량
국내 허가 기준에 따르면, 브리비액트는 1일 2회 복용하며, 초회 권장 용량은 1회 25mg 또는 50mg이다. 임상 반응과 내약성에 따라 1일 50mg(1일 2회, 1회 25mg)에서 최대 200mg(1 일 2회, 1회 100 mg) 범위에서 증감할 수 있다. 정제는 물과 함께 그대로 복용하며, 액제는 물 에 희석하거나 위관을 통해 투여할 수 있다.
특수 환자군에 대해서는, 고령자(65세 이상) 및 신장애 환자에서 별도의 용량 조절이 필요하지 않으나, 말기 신부전 투석 환자에게는 권장되지 않는다. 간 장애 환자의 경우 노출이 증가하므로, 초회 권장 용량은 1일 50mg(1일 2회, 1회 25mg)이며, 최대 투여 용량은 1일 150mg(1일 2 회, 1회 75mg)으로 제한된다.
2) 미국
(1) 허가 기준
미국 FDA는 브리비액트를 생후 1개월 이상의 모든 연령대 환자에서 부분 발작 치료에 사용할 수 있도록 허가하였다. 특히 단독요법과 병용요법 모두 허가되어 있어, 치료 선택의 유연성이 크
며, 유소아를 포함한 다양한 연령층에서의 적용이 가능하다. 이로 인해 미국 내에서는 소아 및 영
유아 뇌전증 환자에게도 비교적 이른 시기부터 치료 개입이 가능하다는 장점이 있다.
(2) 복용 용량
미국 FDA 허가 기준에 따르면, 성인(16세 이상)에서는 브리비액트를 1일 2회, 1회 50mg( 총 100 mg/day)으로 시작하며, 임상 반응과 내약성에 따라 최대 200mg/day(1일 2회, 1회 100 mg)까지 증량할 수 있다. 소아 환자의 경우 체중에 따라 용량을 조절한다. 체중 50kg 이상 에서는 성인과 동일하게 25–50mg을 1일 2회 투여하며, 유지 용량은 25–100mg 1일 2회이 다. 20–50kg 환자는 0.5–1mg/kg을 1일 2회로 시작하여 0.5–2 mg/kg 1일 2회로 유지하며, 11–20kg 환자는 0.5–1.25mg/kg 1일 2회에서 0.5–2.5mg/kg 1일 2회로 조절한다. 11kg 이하 환자에서는 0.75–1.5mg/kg 1일 2회로 시작하여, 최대 0.75–3 mg/kg 1일 2회까지 유 지할 수 있다.
성인과 소아의 용량에 차이가 있고, 소아는 체중 기준으로 조절
• 성인(16세 이상): 50mg 1일 2회 (100mg/day) → 최대 200mg/day
• 소아
[표 37] 소아의 브리비액트 복용량 (미국)
Body Weight
50kg≤ X
20kg≤ X ≤ 50kg
11kg≤ X ≤ 20kg
X≤ 11kg
3) 영국
(1) 허가 기준
twice daily
0.5-1mg twice daily
0.5-1.25mg/kg twice daily
twice daily
0.5-2mg/kg twice daily
0.5-2.5mg/kg twice daily
0.75-1.5mg/kg twice daily 0.75-3mg/kg twice daily
발작에 대한 부가요법으로 승인하였다. 단독요법은 허가되어 있지 않으며, 다른 항뇌전증제와의
병용을 통한 치료에 한정된다. EMA의 허가는 발작의 병태생리와 작용기전에 대한 근거를 기반
으로 하며, 소아 환자에서도 임상적 유효성과 안전성이 확보되었음을 전제로 연령이 확대되었다.
(2) 복용 용량
유럽 의약품청(EMA) 및 영국 의약품규제청(MHRA)에 따르면, 성인 및 체중 50kg 이상 소
아·청소년에서는 브리비액트를 1일 2회, 1회 50mg(총 100mg/day)으로 시작하며, 유지 용 량은 100mg/day(1일 2회, 1회 50mg)이고, 환자의 반응에 따라 50–200mg/day 범위 내에 서 조절할 수 있다. 그 이하 체중을 갖는 소아 및 청소년은 체중 기반으로 용량이 결정된다. 체중 20–50kg 소아 환자에서는 1mg/kg/day (최대 2mg/kg/day)로 시작하여, 2mg/kg/day로 유지하며, 1–4mg/kg/day 범위 내에서 조절이 가능하다. 체중 10–20kg 소아 환자는 1mg/ kg/day (최대 2.5mg/kg/day)로 시작하여, 2.5mg/kg/day로 유지하며, 1–5mg/kg/day 범위 내에서 조절할 수 있다. 체중 11kg 이하 소아 환자에서는 0.75–1.5mg/kg 1일 2회(총 1.5–3mg/kg/day)로 시작하여, 0.75–3mg/kg 1일 2회(총 1.5–6mg/kg/day)까지 유지할 수 있다.
Age and Body Weight
Adults (16 years and older)
Pediatric patients weighing 50kg or more
Pediatric patients weighing 20kg to less than 50kg
Pediatric patients weighing 11kg to less than 20kg
Pediatric patients weighing less than 11kg
Initial
50mg twice dailly (100mg per day)
25mg to 50mg twice daily (50mg to 100mg per day)
0.5mg/kg to 1mg/kg twice daily (1mg/kg to 2mg/kg per day)
0.5mg/kg to 1.25mg/kg twice daily (1mg/kg to 2.5mg/kg per day)
0.75mg/kg to 1.5mg/kg twice daily (1.5mg/kg to 3mg/kg per day)
25mg to 100mg twice daily (50mg to 200mg per day)
25mg to 100mg twice daily (50mg to 200mg per day)
0.5mg/kg to 2mg/kg twice daily (1mg/kg to 4mg/kg per day)
0.5mg/kg to 2.5mg/kg twice daily (1mg/kg to 5mg/kg per day)
0.75mg/kg to 3mg/kg twice daily (1.5mg/kg to 6mg/kg per day)
-경구 정제: 10 mg, 25 mg, 50 mg, 75 mg, 100 mg
-경구 액제: 10 mg/mL
-정맥 주사용 주사제: 50 mg/5 mL
미국과 영국에서는 정제와 액제, 주사제 세 가지 형태 모두
어 상황에 맞는 제형을 선택하여 사용할 수 있다. 하지만 한국의 경우, 2019년 3월 4일에 정제
와 액제가 동시에 허가되었다는 기록은 있으나, 주사 제형에 대한 승인 정보는 확인되지 않는다.
식품의약품안전처의 브리비액트에 대한 보고에 따르면 부분발작 성인 환자에 대한 여러 위약 대
조 부가요법 시험에서 이 약을 투여한 환자의 68.3%가 이상사례를 경험하였다.
이 약 투여 시 가장 빈번하게 보고된 약물이상반응(>10%)은 다음과 같았다. 가장 먼저 졸음 (14.3%) 및 어지러움(11.0%)이다. 이는 일반적으로 경증 내지 중증이었다. 졸음과 피로는 용
량 증가에 따라 높은 발생률이 보고되었다. 치료 후 처음 7일 동안 보고된 이상반응의 유형은 전
체 치료기간 동안 보고된 것과 비슷하였다.
이상반응으로 인한 투여 중단율은 무작위로 이 약 50 mg/day, 100 mg/day 및 200 mg/day
투여된 환자에서 각각 6.0%, 7.4% 및 6.8%였고 위약 환자에서 3.5%였다. 투여중단을 발생시
킨 가장 빈번하게 발생한 약물이상반응은 어지러움이었다. 즉, 브리비액트는 위약군과 비교했을
때 전반적인 이상반응 발생률에서
1) 부작용 및 이상행동
(1) 자살 충동 및 자살 행동
판단된다.
브리비액트를 포함한 항뇌전증약물로 치료를 받는 환자에게서 자살 충동 및 자살 행동이 보고된 바 있다. 이는 한국, 미국, 영국에 모두 공통적인 주의사항으로 언급되었으며 특히 미국의 경우에 는 정신과적 부작용으로 공격적 행동, 불안, 감정 기복 증가, 우울증 증가, 환각, 망상 등에 대한 항목을 추가적으로 언급하고 있다.
(2) 신경정신과적 이상 반응
브리비액트는 졸음, 피로, 어지러움, 협조운동장애 1 등의 중추신경계 이상 반응을 발생시킨다. 이는 대부분 약 투여 초기에 빈번히 발생하지만, 치료 기간 중 어느 때라도 발생할 수 있다. 따라 서 해당 약을 복용하는 환자는 운전 및 기계 조작 시 주의가 요구된다.
(3) 투약 중단
브리비액트를 포함한 항뇌전증치료제의 갑작스러운 중단은 발작 빈도 증가 및 뇌전증 중첩증을
유발할 가능성이 존재한다. 따라서 점진적으로 용량을 줄이며 중단하는 것이 권장된다.
(4) 과민반응
브리비액트 투여 환자에게서 기관지경련 및 혈관부종 등의 과민반응이 발생할 수 있음을 경고
하며, 이는 미국에서만 언급되고 있다. 한국이나 영국에서는 따로 추가적으로 언급된 바는 없다.
이렇게 총 4가지의 이상반응에 대해서 한국, 영국, 미국의 국가에서 주의를 요하고 있다.
2) 투여 환자군에 대한 주의
(1) 간 장애
간 장애 환자에 대해서 브리비액트의 투여에 관한 임상 자료가 제한적이며, 용량 조절이 권장되
고 있다. 특히 영국에서는 하루에 두 번 나눠서 복용하는 것을 추천하고 있다.
(2) 젖당 불내성 환자
브리비액트의 정제는 유당을 함유하고 있다. 따라서 젖당 불내성, 유당분해효소 결핍증, 포도
당-갈락토오스 흡수장애 등의 유전적인 문제가 있는 환자에게는 투여하면 안된다.
(3) 브리비액트의 주성분이나 다른 피롤리돈 유도체 또는 다른 구성 성분에 과민반응이 있는 환
자에게 투여하는 것에 주의를 요한다.
(4) 16세 미만의 소아
한국의 경우 16세 미만의 소아에서 안전성와 유효성은 아직 확립되지 않아 투여를 허가하지 않 고 있다. 하지만 미국과 영국의 경우 1개월 이상의 소아에서 브리비액트의 안전성 프로파일은 성 인과 일치했지만, 임상시험 데이터가 제한적이므로 2세 미만의 신생아에게는 브리비액트 사용을 권장하지 않고 있다.
(5) 임부, 수유부 및 가임 여성에 대한 투여
브리비액트의
1) 연구 목적
본 임상시험의 목적은 부가요법으로서 브리비액트(brivaracetam)의 효과와 안전성을 평가하 는 것이다. 이를 위해 국소 발작을 가진 난치성 부분발작 환자를 대상으로, 브리비액트를 5, 20, 50 mg/일 (1일 2회 분할투여) 용량에서 부가요법으로 투여하여 유효성과 내약성을 확인하였다.
2) 연구 디자인
본 연구는 다국가, 다기관, 무작위, 4중 맹검 1, 위약 대조, 평행군, 용량 탐색, 임상 2b상 시험이
다. 1~2종의 병용 항뇌전증제(AEDs)를 복용함에도 불구하고, 4주간의 기저치 기간동안 4회 이 상의 부분발작을 경험한 16세에서 65세 사이의 난치성 부분발작 환자를 대상으로 한 임상시험 이다. 뇌전증 환자 연구는 총 세 단계로 구성되었다. 첫 4주간의 기저치 기간 동안에는 발작 빈도 를 평가하였다. 다음 7주간의 치료 기간동안 피험자는 무작위 배정에 따라 네 개의 군(placebo, brivaracetam[BRV] 5 mg/일, 20 mg/일, 50 mg/일)으로 나뉘었다. BRV는 1일 2회 분할 투여 방식으로 동일한 용량을 아침과 저녁에 나누어 복용하였으며, 증량이나 감량은 허용되지 않 았다. 마지막으로 치료 종료 후 피험자는 2주간의 약물 중단기를 거쳤으며 이때 안전성 평가를 받 거나 후속 임상시험에 참여하였다.
[그림
29] 시험 대상자 흐름도
BRV5 = brivaracetam 5mg/day, BRV20 = brivaracetam 20mg/day, BRV50 = brivaracetam 50mg/day
총 265명이 본 임상시험에 스크리닝으로 참여하였다. 이 중 55명은 기준 미충족 또는 동의 철 회 등의 이유로 무작위 배정 이전에 제외되었다. 최종적으로 210명이 무작위 배정을 받았으며, 이들 중 2명은 시험약 복용 전 추적 관찰에서 이탈하여, ITT 집단1에는 총 208명이 포함되었다. ITT 집단은 위약군 54명, 브리비액트5 mg/일 투여군 50명, 브리비액트20 mg/일 투여군 52 명, 브리비액트50 mg/일 투여군 52명으로 구성되었다. 최종적으로 치료를 완료한 환자는 위약 군 49명, BRV5군 46명, BRV20군 51명, BRV50군 51명이었다.
1 ITT 집단(Intention-To-Treat population) =임상시험에서
[표 40] 임상시험 대상자 군별 분류 및 투약 계획
분류 투약 계획
그룹 1 (N=54) 위약 대조군 위약 정제 1일 2회
그룹 2 (N=50) 실험군
그룹 3 (N=52) 실험군
그룹 4 (N=52) 실험군
(2) 평가변수
1차 평가변수
• 7주 간의 치료기간 동안
2차 평가변수
Brivaracetam 5 mg/일 (2.5 mg씩 1일 2회)
Brivaracetam 20 mg/일 (10 mg씩 1일 2회)
Brivaracetam 50 mg/일 (25 mg씩 1일 2회)
• 발작 빈도의 변화 (절대/백분율 변화, 부분발작/전체발작으로 구분)
• 7주 치료 기간 동안 발작이 완전히 없는 피험자의 비율
• 4주 기간 동안 발작이 없는 날의 수
(3) 평가 방식
유효성 평가는 환자가 작성한 일일 기록지에 근거하여 이루어졌다. 발작 일지는 매 방문 시 연 구자가 검토하였다. 내약성 및 안전성 평가는 일반적인 질문들 이후 수집되었으며, 연구자가 이
상 반응의 양상, 강도, 그리고 시험 약과의 인과관계를 평가하였다. 또한 혈액화학검사 및 혈액학
검사, 항뇌전증제와 브리비액트의 혈중 농도, 요검사 등을 포함한 실험실 검사, 신체 및 신경학적 검사, 활력징후, 체중이 평가되었다.
3) 결과
총 208명의 환자가 ITT 집단에 포함되었고, 이 중 197명이 연구를 완료하였다. 위약 대비 주
간 부분 발작 빈도 감소율은 BRV5군 9.8%, BRV20군 14.9%, BRV50군 22.1%였으며, 기저 치 대비 중앙값 감소율은 위약군 21.7%에 비해 BRV5군 29.9%, BRV20군 42.6%, BRV50 군 53.1%로 나타났다. ≥50% 반응률은 위약군 16.7%에 비해 BRV5군 32.0%, BRV20군 44.2%, BRV50군 55.8%였으며, 발작 완전 소실률은 각각 1.9%, 8.0%, 7.7%, 7.7%로 관 찰되었다. BRV는 용량이 높을수록 효과가 좋았고, 이상 반응은 주로 경증에서 중등도였으며 발 생률은 위약군과 유사했으며, 이상 반응으로 인한 중도 탈락은 드물었다.
(1) 1차 평가변수
경우 복합부분발작으로 구분된다.
1차 평가변수는 7주간의 치료기간 동안 7일 기준 부분발작의 발생 빈도이며, 해당 결과는 중앙 값과 중간값의 50%가 퍼져있는 범위인 사분위 범위 (IQR, Inter-Quartile Range)로 제시되 었다. BRV5 군은 위약 대비 발작 빈도 감소에 대한 우월성 검정에서 ANCOVA1 분석을 통해 평 가되었으며, p값은 0.240이었다. 통계적 유의성을 판단하는 기준인 p<0.05에 미치지 못하였으
므로, 해당 용량이 위약보다 발작 빈도를 유의하게 감소시킨다고 보기 어렵다. 이 군의 위약 대
비 발작 빈도 감소율은 9.8%였으며, 95% 신뢰구간은 –7.2%에서 +24.0%였다. 이 신뢰구간
은 치료 효과가 없을 수 있는 0%를 포함하고 있으므로 통계적으로 유의하지 않다고 판단된다.
즉 BRV 5군은 위약보다 발작을 줄이는 효과가 있긴 하지만, 통계적으로 유의하지 않으므로 이 용량은 유효성이 입증되지 못했다. BRV 20군의 경우, p값은 0.062로 역시 유의수준 미만에 도
달하지 못하였으며, 감소율은 14.9%, 95% 신뢰구간은 –0.8%에서 +28.2%였다. 이 역시 효 과가 없음을 시사하는 0%를 포함하므로 통계적으로 유의하지 않다. 따라서 20 mg/day 용량
역시 유효성이 입증되지 못하였다. 반면, BRV 50군은 위약 대비 유의한 발작 빈도 감소 효과를 보였다. 우월성 검정 결과 p값은 0.004로 통계적으로 유의하였으며, 감소율은 22.1%, 95% 신 뢰구간은 +7.6%에서 +34.3%로, 효과가 없음을 나타내는 0%를 포함하지 않아 유의성을 갖는 다. 이와 같은 결과는 브리비액트의 용량이 증가함에 따라 발작 빈도가 감소하는 경향이 존재함 을 시사한다. 특히 25 mg을 하루 2회 투여하는 50 mg/day 용량에서 통계적으로 유의한 유효 성이 확인되었으며, 이는 본 약물의 최소 유효 용량(minimum effective dose)을 50 mg/day 로 설정하는 근거가 되었다.
1 ANCOVA= 1차 유효성 분석은 치료 기간 동안의 주간 부분발작(partial-onset seizure, POS) 빈도를 로그 변환하여, 치료군과 두 가지 층화 변수( 레베티라세탐 사용 여부, 카르바마제핀 병용 여부)를 독립변수로 포함하고, 로그 변환된 기저선 기간 POS 빈도를 연속형 공변량으로 포함한 공분산분석(analysis of covariance, ANCOVA)에 근거하여 수행되었다.
(2) 2차 평가변수
[그림 30] 주간 부분 발작 빈도의 기준선 대비 중앙값 감소율(%)
주간 부분 발작 빈도의 기준선 대비 중앙값 감소율은 위약군에서 21.7%였으며, BRV5, BRV20, BRV50 군에서는 각각 29.9%, 42.6%, 53.1%였다. 위약 대비 차이는 BRV50군(–28.7%; 95% CI –45.1, –13.6; p <0.001)과 BRV20군(–22.5%; 95% CI –39.5, –4.7; p = 0.014)
에서 유의했으나, BRV5군(–13.6%; 95% CI –31.6, 1.7; p = 0.086)에서는 유의하지 않았 다. 이러한 결과는 저용량에서는 치료 효과가 충분히 입증되지 않음을 시사하며, 최소 20mg 이
상에서 임상적으로 유효한 발작 억제 효과를 기대할 수 있음을 의미한다. 따라서 브리비액트는
부분 발작 환자에서 위약 대비 우수한 치료 효과를 가지며, 특히 50mg 용량에서 가장 뚜렷한 효
과를 나타내는 것으로 해석할 수 있다.
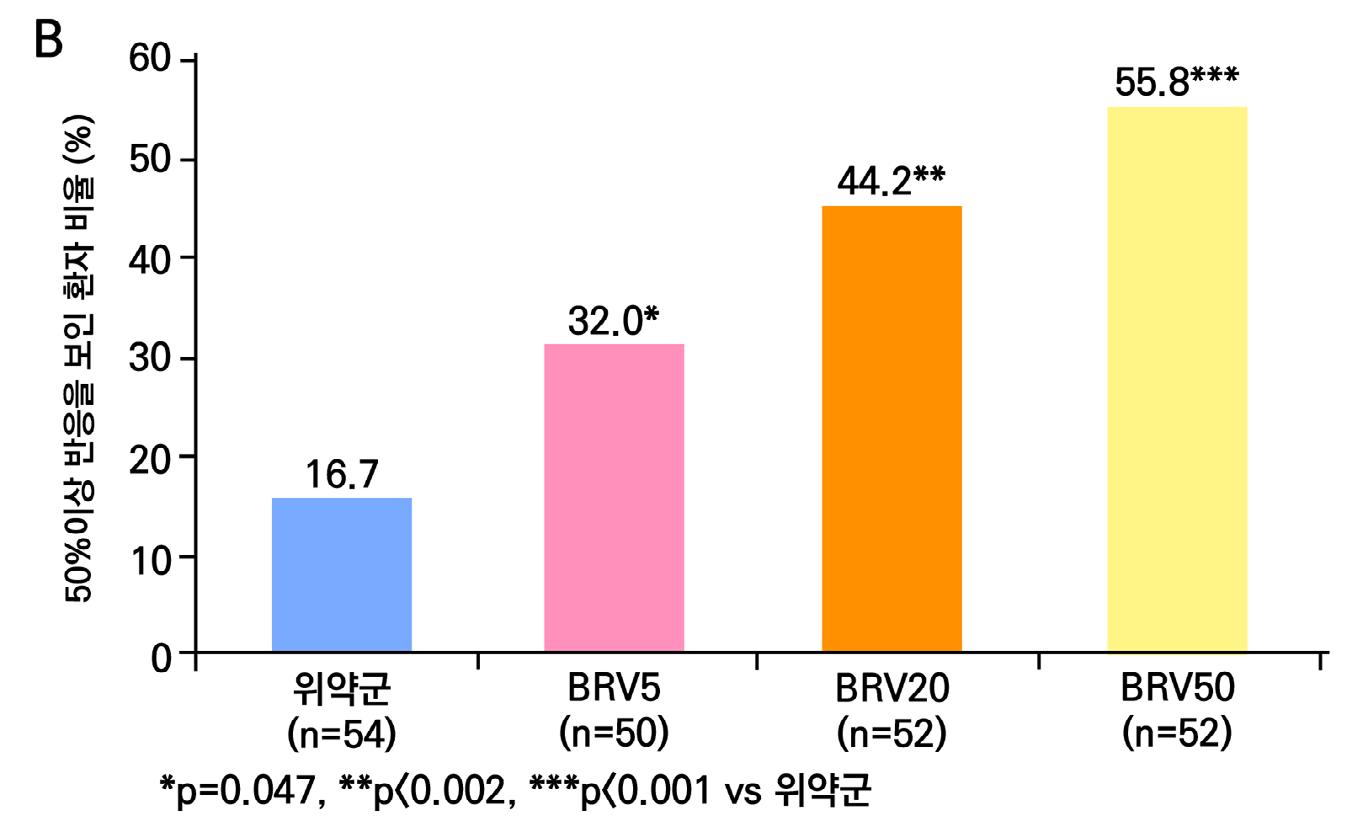
[그림 31] 50% 이상 반응률
50% 이상 반응률은 위약군에서 16.7% (9/54)였고, BRV5, BRV20, BRV50 군에서는 각 각 32.0% (16/50), 44.2% (23/52), 55.8% (29/52)로 나타나 모든 용량군에서 위약 대
비 유의한 양상을 보였다. 특히, 오즈비 분석에서 BRV5군은 OR 2.7(95% CI 1.0–7.0; p = 0.047), BRV20군은 OR 4.3(95% CI 1.7–10.8; p = 0.002), BRV50군은 OR 7.2(95% CI 2.8–18.6; p <0.001)으로, 용량이 증가할수록 반응률 개선 효과가 뚜렷하게 커지는 경향을 확 인할 수 있었다. 이러한 결과는 브리비액트가 부분 발작 환자에서 위약 대비 임상적으로 의미 있 는 치료 반응을 유도하며, 특히 고용량에서 더욱 강력한 발작 억제 효과를 나타낸다는 점을 뒷받 침한다.
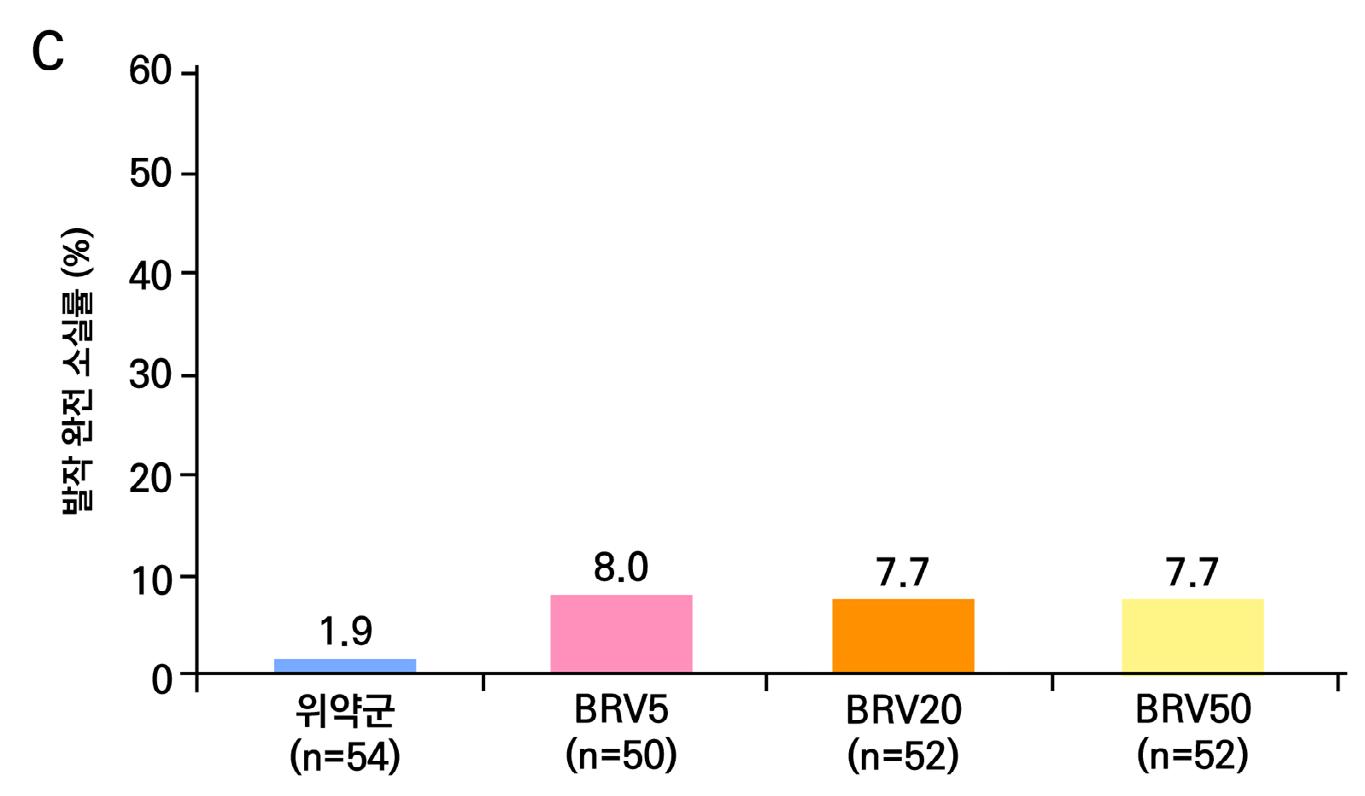
[그림 32] 발작 완전 소실률 발작 완전 소실률은 위약군에서 1명(1.9%)에 불과했으며, BRV 투여군에서는 각각 4명으로 나 타나 BRV5군 8.0%, BRV20군 7.7%, BRV50군 7.7%의 소실률을 보였다. 그러나 세 군 모 두 위약 대비 통계적으로 유의한 차이를 보이지 않았으며(p값 각각 0.193, 0.193, 0.201), 따 라서 발작 완전 소실
4) 결과 해석
본 임상시험은 브리비액트의 용량-반응 관계를 평가한 초기 연구로, 50mg/day 용량에서 발작
빈도의 유의한 감소가 관찰되었고, 통계적으로도 의미 있는 결과가 나왔다. 이 결과는 후속 주요
임상시험에서 고용량 투여를 평가하는 근거로 활용되었다. 예를 들어, NCT 00490035 (Study 1)에서는 시험 용량을 20mg/day, 50mg/day, 100mg/day로 설정하였고, NCT 01261325
(Study 3)에서는 100mg/day 및 200mg/day를 평가하였다. 현재 미국 FDA와 국내 약학 정
보원은 이 연구 결과를 반영하여 브리비액트의 권장 시작 용량을 50 mg/day로 제시하고 있다. 이처럼 본 연구는 50mg/day 용량에서 유효성이 통계적으로 입증되었음을 최초로 확인한 점에
NCT01261325
1) 연구 목적 본
를 병용 투여 중임에도 불구하고 발작이 여전히 조절되지 않는 경우에 한해 평가되었다. 연구의
주된 목적은 브리비액트를 하루 100mg 혹은 200mg 용량으로 1일 2회 분할 복용할 경우의 위
약 대비 발작 빈도 감소 효과와 안전성을 객관적으로 평가하여 브리비액트의 보조치료로서의 임
상적 유효성과 내약성을 확인하는 데 있다.
2) 연구 디자인
만 16세 이상 80세 이하의 768명의 임상 시험 환자를 대상으로 26주(8주 : 스크리닝 기간 → 12주: 무작위 치료 기간 → 4주: 약물 용량 감량 기간 → 2주: 치료 후 기간) 동안 진행한 무작
위, 이중 맹검, 위약 대조, 평행군, 임상 3상 실험이다. 시험은 8주간의 베이스라인 기간을 거친 후 12주간의 치료 기간으로 구성되었으며, 이후 장기 추적연구로 전환 가능한 디자인이었다. 모
든 환자들은 성인 국소 뇌전증 환자로, 1~2가지 항뇌전증제를 복용 중에도 발작이 조절되지 않 는 경우였다.
BRV 100mg/day 군은 50mg씩 하루 2회, BRV 200mg/day 군은 100mg씩 하루 2회 분
할 복용 방식으로 투여되었으며, 위약군도 동일한 방식의 복약 스케줄을 유지하였다. 모든 군에 서는 해당 국가에서 허가된 항뇌전증제를 병용투여할 수 있었다.
(1) 시험 대상자 총 1,045명이 스크리닝에 참여하였고, 이 중 기준을 충족한 768명의 환자가 무작위로 세 그룹 에 1:1:1 비율로 배정되었다. 각 군은 위약군(n=263), 브리비액트 100mg/day 군(n=254), 브 리비액트 200mg/day 군 (n=251)으로 구성되었다.
[표 42] BRITE 임상시험 대상자 정리
그룹 1 (N=263)
(2) 평가 변수
2 (N=254)
3 (N=251)
위약군 브리비액트 100mg/day 군 브리비액트 200mg/day 군
1차 평가 변수
• 베이스라인 대비 28일 기준
• 기준 시점 대비 50% 이상 발작 빈도 감소 반응률
2차 평가 변수
• Baseline 대비 발작 빈도 감소율
• 모든 발작에 대한 완전 발작 소실률
(3) 평가 방식
① 약동학 측정
BRV 혈중 농도 측정을 위해 2, 4, 8, 12주차에 혈액 채취
② 안전성 평가
• 이상반응(AE), 혈액검사, 생체징후, 심전도(ECG)
• 환자는 방문 시 또는 수시로 이상반응을 보고 가능
3) 결과
2차 평가 변수에서도 BRV 투여군은 발작 빈도 감소율과 완전 발작 소실률에서 위약군 대비 유의 한 개선을 보였다. Baseline 대비 중간(percent reduction) 발작 빈도 감소율은 위약군 17.6% 에 비해 BRV 100mg 군 37.2%, 200mg 군 35.6%로 유의하게 우수하였다(p <0.001). 52주 기준 완전 발작 소실률은 위약군 0.8%, BRV 100mg 군 5.2% (p = 0.003), BRV 200mg 군 4.0% (p = 0.019)으로 역시 통계적으로 의미 있는 차이를 보였다.
혈중 BRV 농도 분석 결과, 100mg 군은 1.06–1.15 μg/mL, 200mg 군은 2.02–2.06 μg/ mL으로 확인되었으며, 용량 증가에 따라 혈중 농도도 약 2배 증가하였다. 이상반응은 졸림, 어 지러움, 피로감 등이 주요 항목으로 보고되었으며, 대부분 경도에서 중등도 수준이었다. BRV 200mg 군에서 치료 관련 사망 사례가 2건 보고되었으나, 연구자 평가 결과 치료와의 인과성은 낮았다. 치료 중단은 BRV 군에서 위약군보다 다소 증가하였으나, 전반적인 안전성 지표는 양호 하였다.
(1) 1차 평가변수
1차 평가변수인 “28일 기준 조정된 발작 빈도 감소율” 은 다음과 같다. 위약 대비 브리비액트 100mg 군에서 22.8% (95% CI: 13.3~31.2%), 브리비액트 100mg 군에서 23.2% (95% CI: 13.8~31.6%)로 통계적으로 유의하였다. (p < 0.001)
“기준 시점 대비 ≥50% 응답률” 역시 위약군 21.6%에 비해 브리비액트 100mg 군에서 38.9% (OR 2.39, 95% CI: 1.6–3.6), 브리비액트 200mg 군에서 37.8% (OR 2.19, 95% CI: 1.5–3.3)로 유의하게 높았다. (p < 0.001)
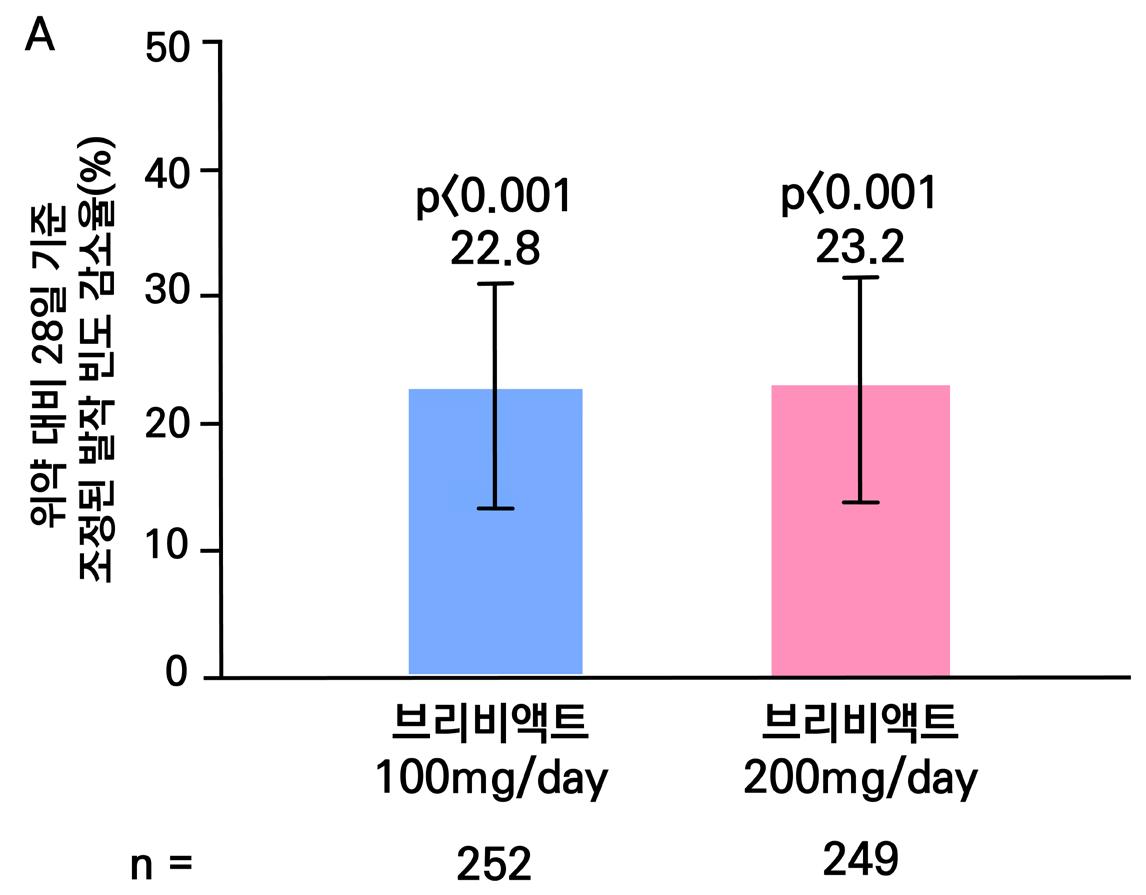
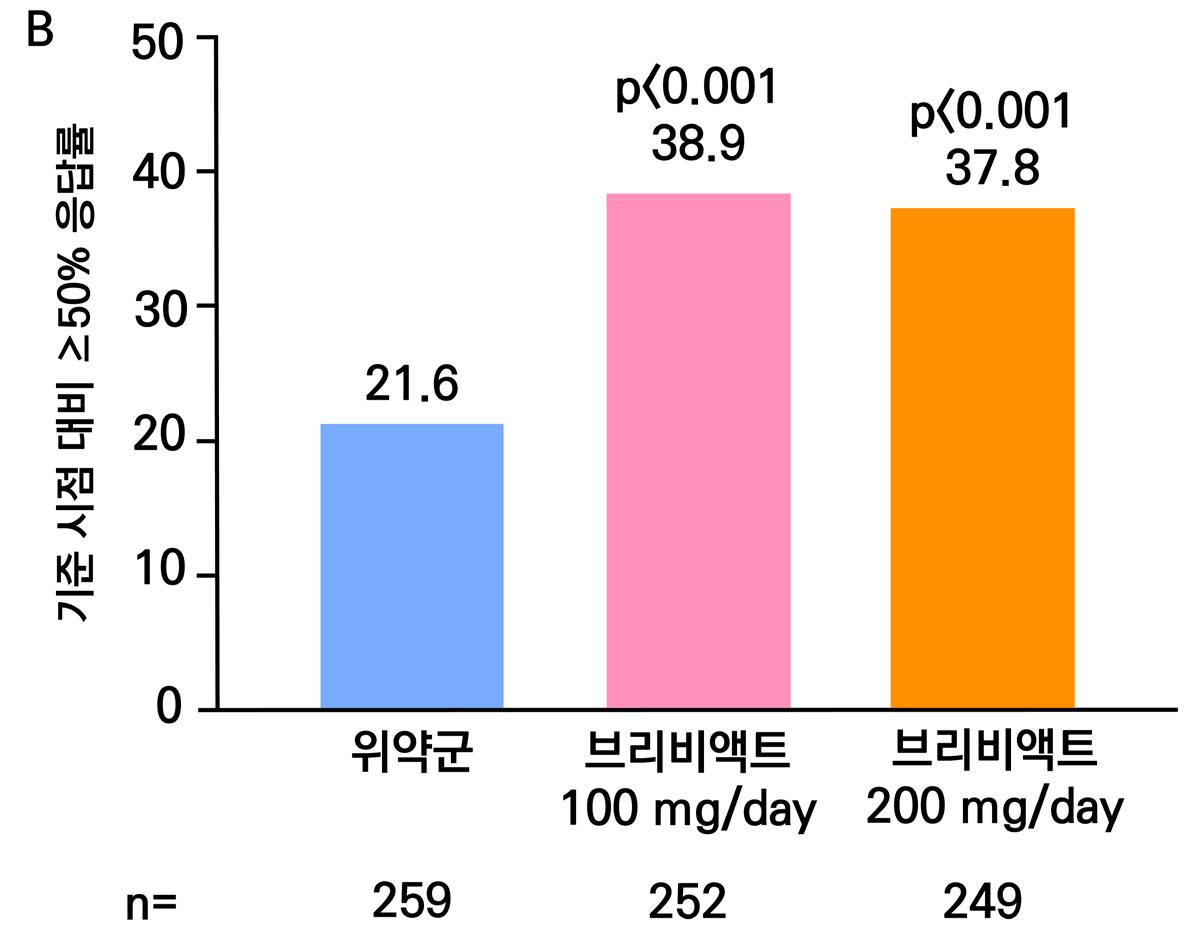
[그림 33] 1차 평가변수
A. 위약 대비 28일 기준 조정된 발작 빈도 감소율
B. 기준 시점 대비 50% 이상 발작 감소 환자 비율
(2) 2차 평가변수
2차 평가 변수에서도 브리비액트 투여군은 “발작 빈도 감소율” 과 “완전 발작 소실률”에서 위 약군 대비 유의한 개선을 보였다. “Baseline 대비 중간 발작 빈도 감소율” 은 위약군 17.6% 에 비해 브리비액트 100 mg 군 37.2%, 브리비액트 200mg 군 35.6%로 유의하게 우수하였 다(p <0.001). “52주 기준 완전 발작 소실률”은 위약군 0.8%, 브리비액트 100mg 군 5.2% (p = 0.003), 브리비액트 200mg 군 4.0% (p = 0.019)으로 역시 통계적으로 의미 있는 차이
를 보였다.
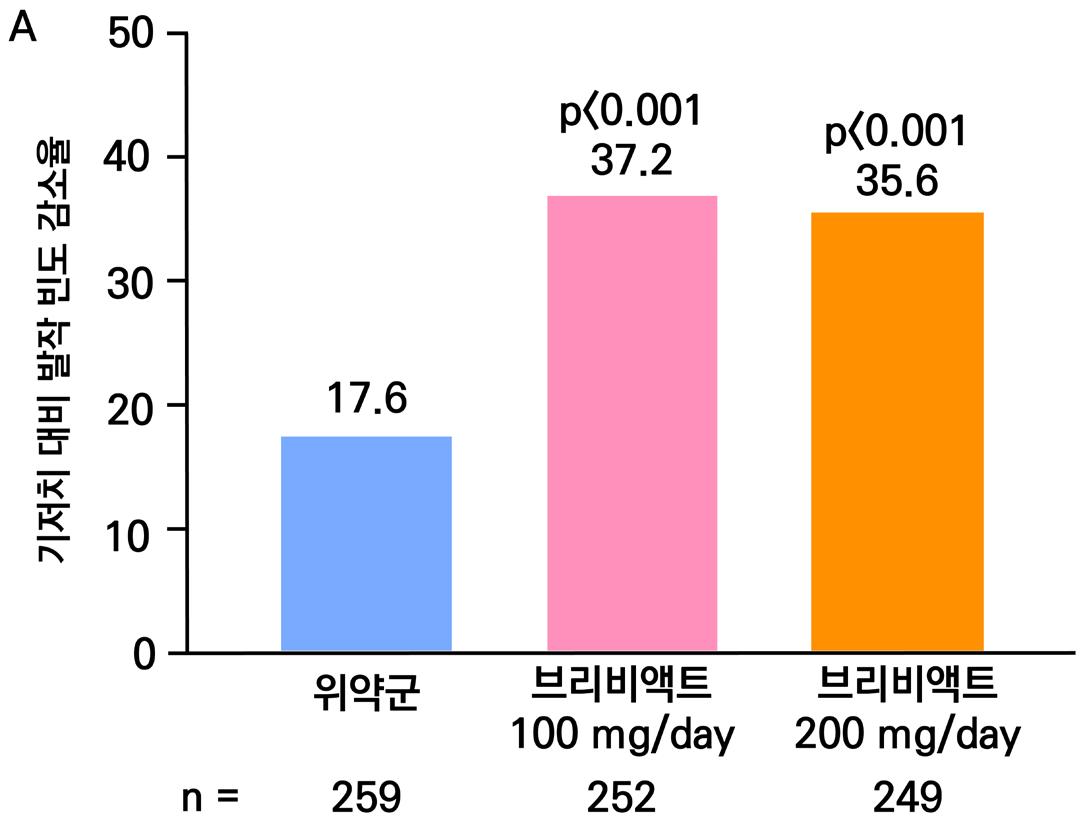
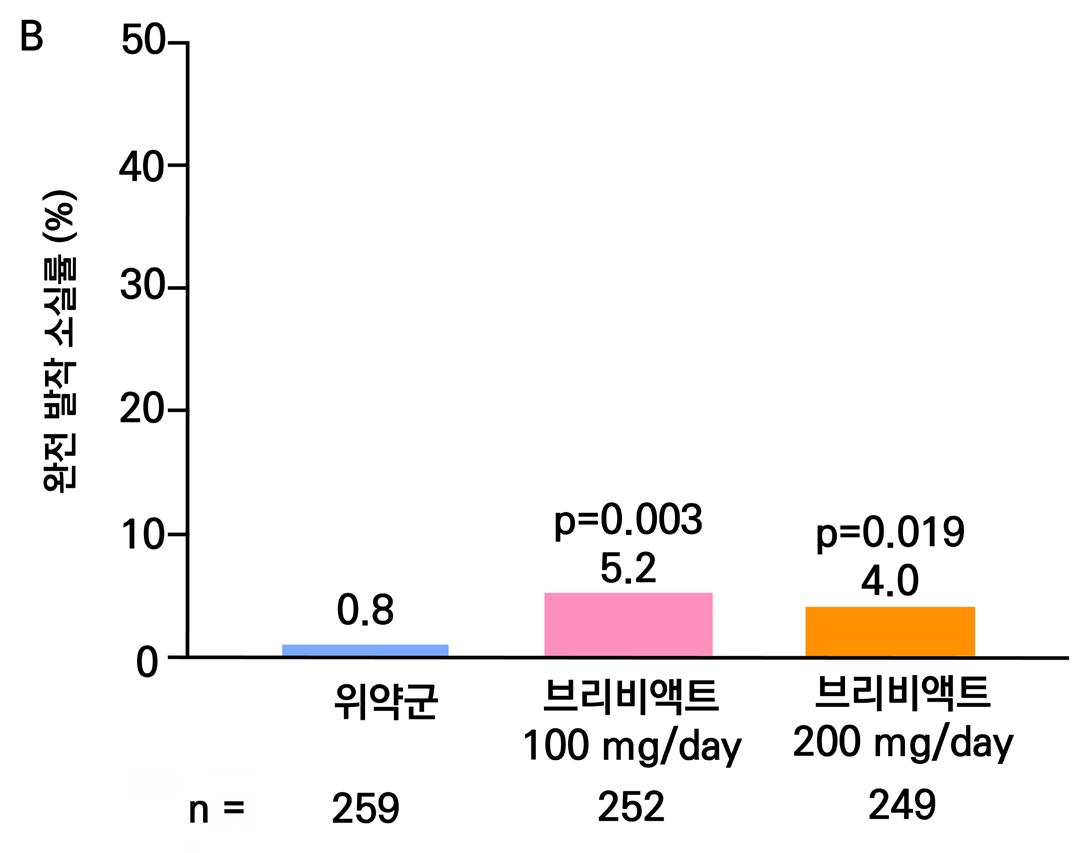
[그림 34] 2차 평가변수
A. Baseline 대비 발작빈도 감소율
B. 모든 발작에 대한 완전 발작 소실률
(3) 추가 임상 결과
혈중 BRV 농도 분석 결과 브리비액트 100mg 군은 1.06–1.15 μg/mL, 브리비액트 200mg 군은 2.02–2.06 μg/mL으로 확인되었으며, 용량 증가에 따라 혈중 농도도 약 2배 증가하였다.
이상반응은 졸림, 어지러움, 피로감 등이 주요 항목으로 보고되었으며, 대부분 경도에서 중등도 수준이었다. 브리비액트 200mg 군에서 치료 관련 사망 사례가 2건 보고되었으나 연구자 평가 결과 치료와의 인과성은 낮았다. 치료 중단은 브리비액트 군에서 위약군보다 다소 증가하였으나, 전반적인 안전성 지표는 양호하였다.
(4) 고찰
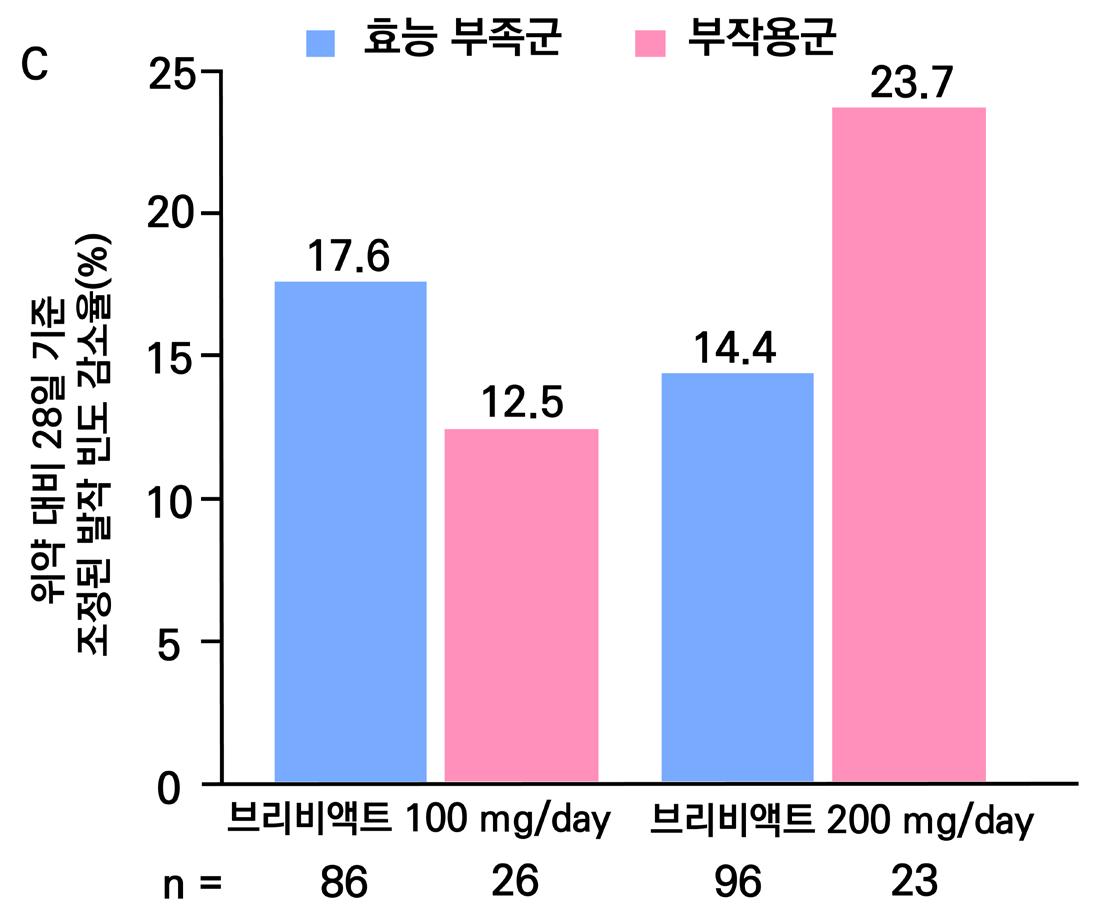
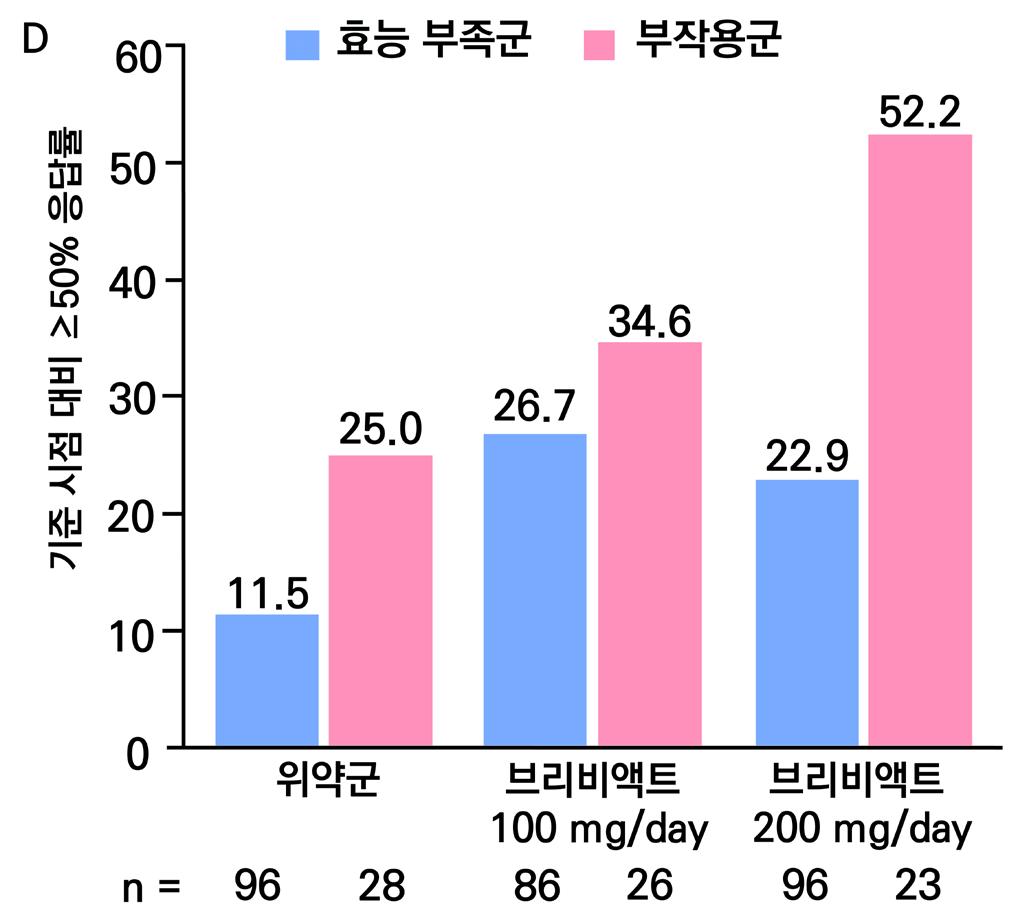
[그림 35] 케프라(levetiracetam) 실패 환자군의 브리비액트(brivaracetam) 반응률
C. LEV 중단 이유에 따른 발작 빈도 감소 효과 (%)
D. LEV 중단 이유에 따른 ≥50% 반응률 (%)
BRITE 연구의 하위분석 결과인 그림 35의 C와 D는, 이전에 케프라(levetiracetam)를 중단한
환자군을 대상으로 그 중단 이유에 따라 브리비액트의 유효성 차이를 평가한 결과이다.
케프라를 중단한 이유가 효능 부족인 환자군에서 브리비액트의 발작 빈도 감소 효과가 부작용으 로 중단한 환자군보다 전반적으로 우수하게 나타났다. 구체적으로, 브리비액트 100mg/day 투
여군에서 발작 빈도는 효능 부족군에서 17.6% 감소한 반면, 부작용군에서는 12.5% 감소하였 다. 브리비액트 200 mg/day 투여군에서는 각각 23.7%, 14.4%의 감소율을 보였다. 50% 이상 발작 반응률에서도 유사한 경향이 나타났다. 브리비액트 100 mg/day 투여군에
서는 효능 부족군의 반응률이 34.6%로, 부작용군 25.0%보다 높았다. 브리비액트 200 mg/ day 투여군에서는 효능 부족군에서의 반응률이 52.2%로 가장 높게 나타났으며, 부작용군에서
는 22.9%에 그쳤다.
이러한 결과는, LEV 치료에서 효능 부족으로 중단한 환자에게도 BRV가 효과적인 대체 치료제 로 작용할 수 있음을 시사하며, 두 약물 간 기전의 유사성에도 불구하고 치료 반응에는 개별적 차
이가 존재함을 보여주는 근거가 된다.
BRITE는 본 연구는 총 768명의 대규모 중재형 연구로, 기존 1~2개 항뇌전증제에도 발작이 조절되지 않는 성인 국소 발작 환자를 대상으로 수행되었다. 연구 결과, 브리비액트 100mg과
200mg 모두 위약 대비 발작 빈도 감소 및 ≥50% 반응률(Responder Rate)에서 통계적으로 유의미한 효과를 확인하였으며, 이는 이전의 같은 용량 고정형 제3상 연구들과 일관된 결과이다. 특히, 본 연구는 발작 완전 소실율에서도 위약 대비 유의한 차이를 보여주었으며, 이는 동일 용 량의 다른 항뇌전증제에 비해 통계적으로 의미 있는 완전 발작 소실 효과를 보인 첫번째 제3상
부가요법 연구로 평가된다.
하위분석에서는 이전에 케프라 치료 실패 경험이 있는 환자 집단에서도 브리비액트는 유의한 효 과를 보였으며, 케프라 미사용 환자와 유사한 수준의 치료 반응을 보였다. 이는 SV2A 작용기전
약제 간 상호보완적 효과 가능성을 시사한다.
다만 100mg과 200mg 간 명확한 용량-반응 관계가 관찰되지 않았으며, 이는 이전 연구에서도
보고된 바 있어 용량 증가 시 효용이 비례하지 않을 수 있다는 점을 시사한다. 이 현상은 SV2A 포화 또는 기타 미확인 기전에서 기인할 가능성이 제기되며, 향후 연구를 통해 기전 규명이 필요 하다.
안전성 측면에서는 이상반응으로 인한 중단율이 저용량 100 mg 군 8.3%, 고용량 200 mg 군 6.8%로 낮았으며, 이상반응은 졸림, 어지러움, 피로 등 경도에서 중등도 중추신경계 관련 부작 용에 국한되었다. 전체적으로 브리비액트는 초기부터 목표 용량으로 시작 가능할 정도로 내약성 이 우수한 것으로 평가되었다.
결론적으로, 본 BRITE 연구는 보조요법으로서 브리비액트 100mg 및 200mg이 부분발작 환
자에서 효과적이고 안전한 치료 옵션임을 입증하였으며, 특히 LEV 불응 환자군에서도 유효성을
보였다는 점에서 임상적 의미가 크다. 또한 LEV와 병용 없이도 성공적인 치료가 가능하다는 점
이 향후 치료전략 수립에 유용한 근거를 제공한다.
NCT00175916
1) 연구 목적
본 임상은 뇌전증 환자(부분 발작(초점성), 전신 발작)에서 브리비액트의 장기 안전성, 내약성, 그리고 효능을 입증하기 위해 진행되었다. 이 연구는 공개(비맹검), 다기관, 단일군, 장기 추적 임 상시험이다.
2) 연구 디자인
대상자는 이전 브리비액트 임상시험에 참여했거나 투여 받은 만 16세 이상의 성인이었다. 이들
은 이전 임상시험에서 권장된 용량으로 투여를 시작하였고, 치료 기간 중 용량은 환자의 안전성 과 효과에 따라 50mg/day 단위로 증감하였다. 브리비액트 투여 중단 시에는 감량 기간을 두었
으며, 투여 중단 후 2~4주 시점의 결과를 포함해 최종 평가가 이루어졌다. 평가 기간은 환자별 참
여 기간에 따라 달랐고, 최장 14년(165개월)이었다.
본 임상은 무작위 대조군이 없는 단일군 개방형 시험으로, 통계적 가설 검정은 수행되지 않았다.
모든 데이터는 기술 통계(descriptive statistics)만 제공되었으며, 이에 따라 데이터 해석 과정
에서 선택 편향 가능성이 존재한다. 기술 통계는 데이터의 분포와 요약치를 제시하여 치료 효과
와 안전성의 전반적 경향을 파악하는 데 유용하지만, 인과관계 확인에는 제한적이다. 다만, 본 연 구의 근간이 된 주요 2상 및 3상 이중맹검 임상시험에서 브리비액트의 유효성은 이미 통계적으 로 입증된 바 있다.
(1) 평가변수
1차 평가 변수 :
① 치료 안전성 및 내약성 평가
• 치료 관련 발생 부작용(TEAE 1) 발생률 및 심각성
• 중대한 *TEAE 발생률
• 투여 중단 사유로 인한 치료 중단률(TEAE 관련 중단)
② 임상적 안전성 평가
• 임상적 검사(혈액검사, 생체징후, 심전도 등) 변화
• 행동 장애 관련 부작용 발생(예: 불안, 공격성, 자살사고)
• 사망률 및 사망 원인
2차 평가 변수 : ① 효능 지표
• 28일 단위 초점성 발작 빈도 변화율(%)
• 50% 이상 발작 빈도 감소 환자 비율(50% responder rate)
• 지속적 발작 자유 상태 유지율(6개월 및 12개월 이상)
② 전신 발작 환자 평가 지표 1
• QOLIE-31-P (Patient Weighted Quality of Life in Epilepsy InventoryForm 31)
• EQ-5D 설문 결과 변화
3) 결과 1차 평가 변수에 대한 결과로는 전체 환자의 84.4%(720/853명)가 최소 1회 이상 TEAE 경
험했으며, 이 중 약물 관련 TAEA는 52.9%(451명), 발작, 두통, 간질 악화 등의 중대한 TAEA 는 29.1%(248명)이었다. TAEA 관련하여 투여가 중단된 케이스는 11.1%(95명)이었다. 이를
통해 장기 투여 시에도 브리비액트 단기 임상과 유사한 안전성 및 내약성을 유지한다는 결론이 산출되었다.
2차 평가 변수에서는 발작 억제 효과가 확인되었다. 초점성 발작 환자군에서 발작 빈도는 기준
선 대비 중앙값 43.1% 감소했으며, 절반 이상의 환자에서 발작 빈도가 50% 이상 줄어들었다. 또한 6개월 발작 자유율은 22.2%, 12개월 발작 자유율은 15.8%였다. 전신 발작 환자군(30명)
에서도 유사한 경향을 보여, 발작일수 중앙값이 43.2% 감소하고 50% 반응률이 43.3%로 나타 났다. 삶의 질 평가는 전반적으로 안정적이거나 소폭 개선되는 양상이었다.
그림 36, 그림 37 및 그림 38에 제시된 바와 같이, 브리비액트의 장기 투여는 발작과 관련된 평
가지표의 전반적인 개선을 나타냈다. 특히, 치료 기간이 길어질수록 해당 지표의 개선 효과가 점
진적으로 증가하는 경향이 관찰되었다. 이때 언급된 효능 집단은 본 임상시험에서 효과 평가에 포함된 환자군을 의미한다. 환자군의 특성은 최소 1회 시험약을 복용하고 발작 빈도 기록 등 유 효성 평가에 필요한 적절한 데이터를 소유한 것이다. 전체 집단은 임상시험에 투여된 모든 환자 (안전성 평가 대상)이며, 전체
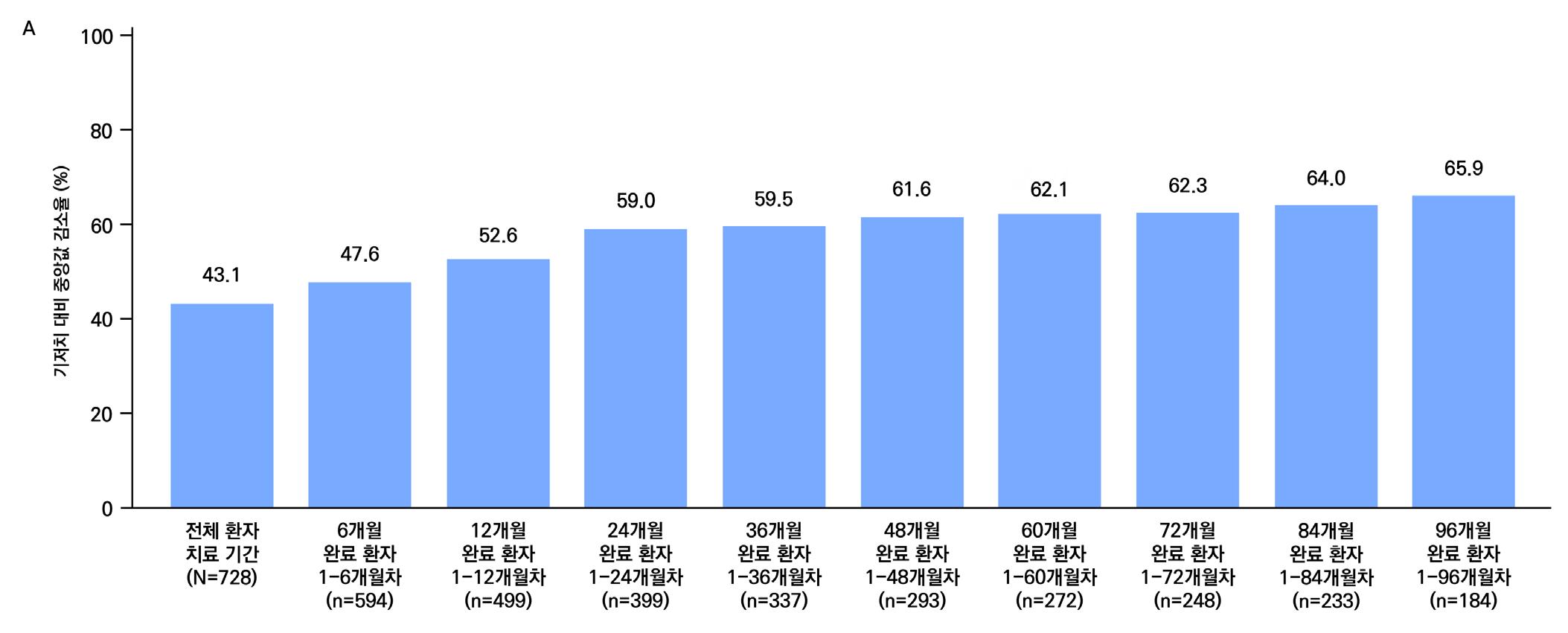
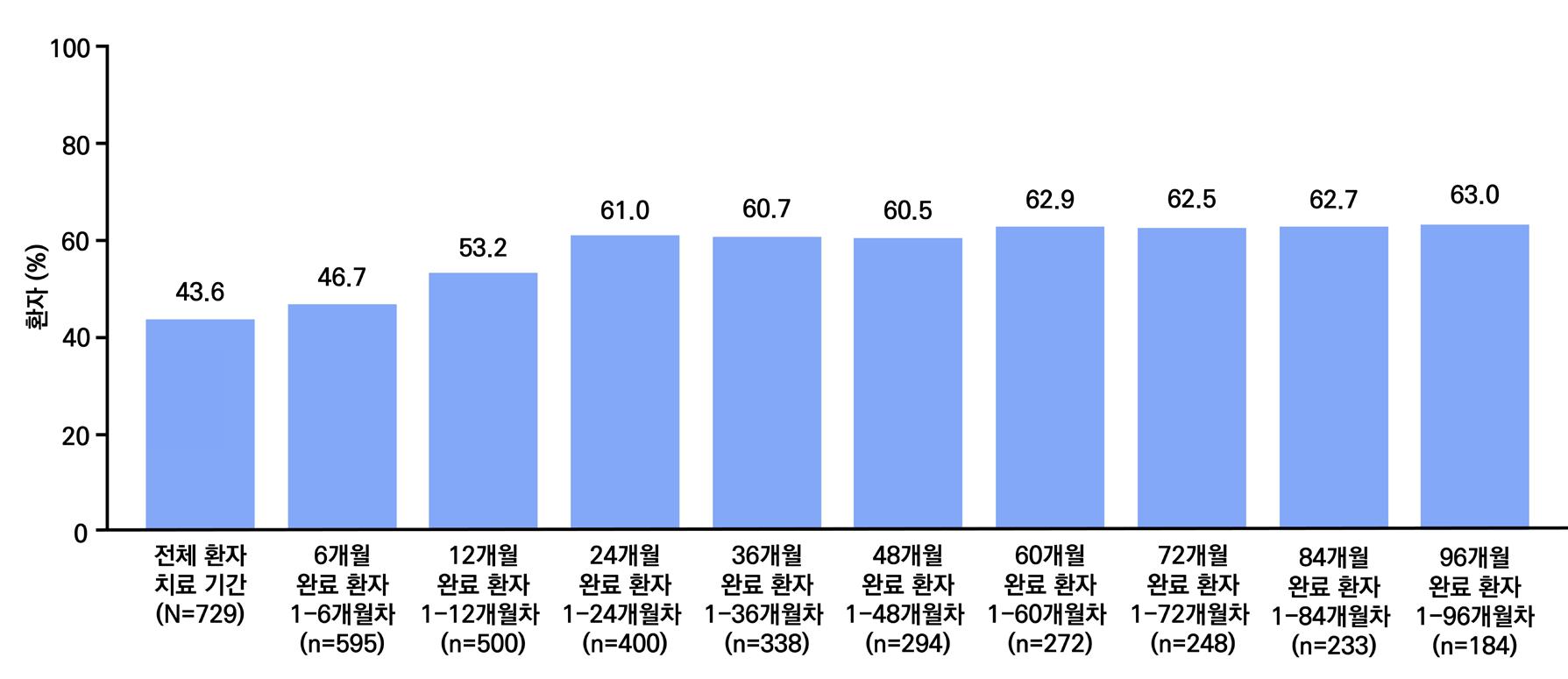
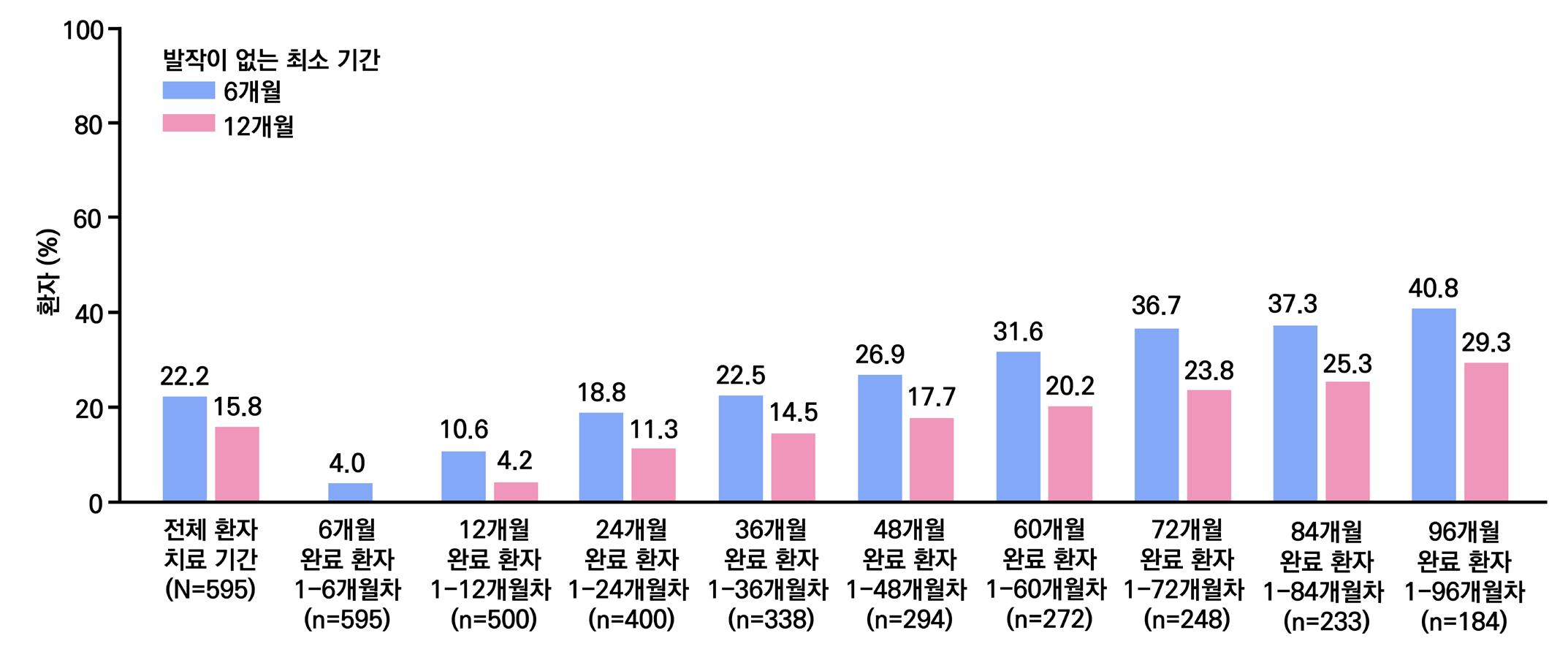
4) 결과 해석
본 임상은 브리비액트가 초점성 발작, 전신 발작 환자에서 최대 14년까지 장기간 투여해도 안
전성과 내약성 프로파일이 양호함을 시사한다. 발작 빈도 감소 효과는 장기 치료 기간 동안 유지
되며, 일부 환자군에서는 개선 효과가 누적되거나 안정적으로 유지된다. 행동 관련 부작용 발생
률은 낮고, 기존 임상 데이터와 유사한 수준을 보인다. 따라서 브리비액트는 무작위 대조군이 없
는 디자인과 선택 편향 가능성을 감안 시, 장기 안전성 및 유지 효과에 대한 실제 임상 근거로 중
요한 의미를 가지며 난치성 환자군에서도 효과와 안전성 면에서 유의미한 장기 치료 옵션이라는 결론을 시사한다.
브리비액트 한국 급여
브리비액트는 2019년 3월 4일 식품의약품안전처로부터 국내 허가를 받았으나, 현재까지 급여
등재는 이루어지지 않았다. 약가 협상이 지연되면서 건강보험 적용이 이루어지지 않았고, 특히 건강보험심사평가원과 한국 UCB제약 간의 약가 협상 결렬로 인해 국내 의료현장에서 도입이 지
연되는 상황이 이어졌다. 한국 UBC제약은 5종 이상의 항뇌전증제를 사용하고도 발작이 지속되는 환자를 대상으로 한 후 속 치료제로 브리비액트의 급여권 진입을 시도하였다. 임상 하위분석 결과를 근거로 제시하였으 나, 급여소위원회는 효과를 입증할
약가를 맞출 것을 요구하였다.
현재 국내 뇌전증 치료제의 급여 체계를 살펴보면, 후속 치료제에 대한 별도의 기준이 존재하지
않는다. 또한 현재 급여 기준이 적용된 10종의 성분 모두 일괄적으로 동일한 급여 기준이 적용되 고 있다. 이는 뇌전증을 비롯한 신경계 질환의 발병 원인과 약물의 작용 기전이 다양하여, 기존
치료제와의 직접 비교 임상을 통해 우월성을 입증하기 어렵기 때문이다. 따라서 신약이 급여권에
진입할 경우 기존 치료제 수준으로 약가를 맞춰야 하는 것이 현행 구조이다.
급여소위원회가 제시한 브리비액트의 가중평균가는 50mg 기준 1일 2회 투여 시 약 2000원
수준으로, 이는 전 세계 최저가인 1일 2정 3500원에 한참 못 미치는 금액이다. 이러한 가격 격
차로 인해 브리비액트의 급여 등재는 성사되지 못하였다.
브리비액트의 특허는 2026년 2월 21일 만료될 예정이며, 이에 따라 여러 제약사가 제네릭 출
시를 준비하고 있다. 환인제약은 ‘WIG-2022’에 대해 2025년 5월 2일자로 생동성 시험을 진행 한 것으로 보고되었으며, 명인제약의 ‘부리팜정’은 2025년 4분기 허가 이후 내년 2월 특허 만료 시점에 맞추어 발매가 예정되어 있다. 특허 만료 후 제네릭 의약품의 상용화가 성공할 경우, 항경
련제 시장 내에서 새로운 경쟁 구도가 형성될 것으로 전망된다.
NG217 가이드라인 내 브리비액트의 언급
영국에서 브리비액트는 2016년 1월 13일 EMA 승인을 받아 16세 이상 부 분 발작 환자에게 최초 허가되었다. 이후 브리비액트는 독립적인 TA(Technology
Appraisal) 1 평가를 받지 않았으나 2, NICE NG217 가이드라인에 간접적으로 포함 되었다. 해당 가이드라인에서는 브리비액트를 ‘전신 강직-간대 발작의 2차 보조 치료 제’, ‘국소 발작의 2차 보조 치료제’, ‘근간대성 발작의 2차 보조 치료제’로 언급하고 있다.
비록 NICE TA가 없더라도 NG 가이드라인3에 약제가 간접적으로 포함될 경우 급여 적용은 가 능하다. NHS에서는 가이드라인 권고사항과 각 지역 NHS 위원회(Clinical Commissioning Group, CCG) 또는 Integrated Care Board(ICB)의 자율적 판단에 따라 급여가 진행된다. 각
단체는 예산 상황과 임상적 필요성에 따라 처방 범위, 적응증, 사용 지침, 예산 한도 등을 설정하 며, 이로 인해 지역별 급여 적용 범위와 접근성에는 일부 차이가 발생한다.
2) NHS drug tariff에서 브리비액트의 언급
앞서 급여 제도를 살펴본 바와 같이, NHS Drug Tariff를 통해서는 의약품 비용에 대한 NHS
와 약국 간의 정산 단가를 확인할 수 있다. NHS Drug Tariff는 NHS가 약국 등 공급자에게 의
약품 비용을 환급하기 위해 제시하는 공식 가격 목록으로, DHSC(Department of Health and Social Care) 4와 NHS Business Services Authority에 의해 발행된다.
Drug Tariff에 명시된 가격은 문서로 공식화된 전국 단일 가격이며, 이는 앞서 설명한 급여 제
도의 지역별 유연성과는 대조적인 특징을 지닌다. 브리비액트는 2024년 9월부터 NHS Drug Tariff에 포함되었으며, 가장 최근 자료는 2025년 4월 버전에서 확인된다. 해당 자료는 정기적 으로 갱신되며, 브리비액트는 최초 등재 이후 환급 가격의 변동은 보고되지 않았다.
1 TA(Technology Appraisal, 기술 평가)는 신약이나
2
의사결정을 지향한다. 또한 모든 약제를 중앙기관에서 TA 평가하는 데에는 시간과 비용적 한계가 존재하기 때문에, 일부 약제에 대해서는 지역 의료진과 위원 회의 전문적 판단에 맡겨 효율성을 높이고 있다. 이 밖에도
환급 가격은 다음 표와 같다. Category C는 특정
Briviact® for brivaracetam)의
[표 43] Brivaracetam 제제의 환급 단가 현황
-총론
의약품안전나라. (2019.03.04) 브리비액트정25밀리그램(브리바라세탐) Retrieved from https://nedrug. mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=201901308aupdateTs2025-04-25%20 18:30:37.0b
Contreras-García, I. J., Gómez-Lira, G., Phillips-Farfán, B. V., Pichardo-Macías, L. A., García-Cruz, M. E., Chávez-Pacheco, J. L., & Mendoza-Torreblanca, J. G. (2021). Synaptic Vesicle Protein 2A Expression in Glutamatergic Terminals Is Associated with the Response to Levetiracetam Treatment. Brain Sciences, 11(5), 531.
-허가
의약품안전나라. (2019.01.30). 브리비액트액(브리바라세탐). Retrieved from https://nedrug.mfds. go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=201901306aupdateTs2025-03-05%20 17:22:15.575464b
European Medicines Agency. Briviact (brivaracetam) [EPAR product information].EMA. Retrieved from Briviact (in Italy: Nubriveo) | European Medicines Agency (EMA)
-임상
study1 (임상 2상)
Clinical trials. 2018. A Dose-ranging Study With Brivaracetam in Patients From 16 to 65 Years With Refractory Partial Onset Seizures. retrieved from https://clinicaltrials.gov/study/NCT00175825?cond =NCT00175825&rank=1
French, J. A., Costantini, C., Brodsky, A., & von Rosenstiel, P. (2010). Adjunctive brivaracetam for refractory partial-onset seizures: A randomized, controlled trial. Neurology, 75(6), 519–525. Retrieved https://doi.org/10.1212/WNL.0b013e3181ec7f7f
study2 (임상 3상)
Clinical trials. 2014. Brivaracetam Efficacy and Safety Study in Subjects With Partial Onset Seizures (BRITE) retrieved from Study Details | NCT01261325 | Brivaracetam Efficacy and Safety Study in Subjects With Partial Onset Seizures | ClinicalTrials.gov
BRITE
Klein, P., Schiemann, J., Sperling, M. R., Whitesides, J., Liang, W., Stalvey, T., Brandt, C., & Kwan, P. (2015). A randomized, double-blind, placebo-controlled, multicenter, parallel-group study to evaluate the efficacy and safety of adjunctive brivaracetam in adult patients with uncontrolled partial-onset seizures. Epilepsia, 56(12), 1890–1898. https://doi.org/10.1111/epi.13212
study3 (임상 4상)
Ben-Menachem, E., Baulac, M., Hong, S. B., Cleveland, J. M., Reichel, C., Schulz, A. L., Wagener, G., & Brandt, C. (2021). Safety, tolerability, and efficacy of brivaracetam as adjunctive therapy in patients with focal seizures, generalized onset seizures, or Unverricht-Lundborg disease: An open-label, long-term follow-up trial. Epilepsy research, 170, 106526. https://doi.org/10.1016/j. eplepsyres.2020.106526
Clinical trials. 2021. Follow-up Trial to Evaluate Long-term Safety and Efficacy of Brivaracetam in Subjects Suffering From Epilepsy) retrieved from https://clinicaltrials.gov/study/NCT00175916
-급여
김한상. (2014). HIRA_정책동향 8권 6호. 영국 NHS의 지불과정(pp. 81-88). 건강보험심사평가원 심사평가정보
센터
이충만. (2025.03.25). 뇌전증 치료제 ‘브리비액트’ 공백에 제네릭 개발 ‘본격화’. 헬스코리아뉴스. Retrieved from https://m.healthcaren.com/news/news_article_yong.jsp?mn_idx=547884
최원석. (2020.05.20). 멀어지는 뇌전증 신약 ‘급여’…’해법’없을까?. 의협신문. Retrieved from https://www. doctorsnews.co.kr/news/articleView.html?idxno=134666
NHS Business Services Authority. (2025). Drug Tariff (April 2025 ed.). NHS Business Services Authority
3.5 세노바메이트
김주연 kjy57103@naver.com 안수연 sooyeonan0721@gmail.com
youngin20010927@gmail.com
개발 배경 및 의의
세노바메이트(Cenobamate)는 최근 개발된 항경련제로 성인 부분발작의 치료에 새로운 가능 성을 제시하고 있다. SK바이오팜이 개발한 이 약물은 미국 FDA로부터 2019년 11월에 승인받 아 ‘엑스코프리(XCOPRI)’라는 이름으로 출시되었고, 2021년 3월에는 유럽연합에서도 ‘온투즈 리(ONTOZRY)’라는 상품명으로 허가를 받았다. 현재 한국에서는 2020년부터 3상 임상시험이 진행 중이며, 2025년 이후 출시가 목표다. 이 약물은 단독요법뿐 아니라 기존
세노바메이트는
첫째, 전압의존성 나트
륨 채널(VGSCs)을 억제하여 신경세포의 과도한 흥분성을 줄이고 발작 발생을 억제한다. 특히 비
활성화 상태의 나트륨 채널을 안정화하는 방식으로 작용한다. 둘째, GABA-A 수용체의 양성 알 로스테릭 조절자로서 GABA의 억제성 신경전달을 강화해 신경세포 과흥분성을 억제한다. 세노
바메이트는 carbamate 계열의 구조를 가지며, GABA-A 수용체에서는 벤조디아제핀 계열 약
물과는 다른 결합 부위를 통해 작용하여 기존 약물과 차별화된 효과를 나타낸다.
세노바메이트의 이중 작용기전은 항경련 효과를 향상시키는 것으로 평가된다. 나트륨 채널 억 제는 발작의 발생을 줄이고, GABA-A 수용체 조절은 신경계의 흥분을 안정화시키는 데 기여한 다. 두 메커니즘이 병합됨으로써 기존 항경련제에 반응하지 않는 난치성 부분발작 환자에게서도 치료 효과를 나타낼 수 있다. 이러한 특성은 다른 항경련제와 병용 시 상호보완적 효과를 기대할 수 있는 기반이 된다. 작용기전
세노바메이트의 임상 적용 및 향후 전망
세노바메이트(Cenobamate)는 기존 항경련제에 충분히 반응하지 않는 환자에서 단독요법과 병용요법 모두에 사용될 수 있다. 세노바메이트의 초기 권장 용량은 12.5mg/day로 시작해, 이
후 2주 간격으로 점진적 증량을 통해 최대 400mg/day까지 도달할 수 있다.이는 DRESS 증후
군(Drug Reaction with Eosinophilia and Systemic Symptoms)과 같은 심각한 과민반응
발생 위험을 최소화하기 위한 전략이다. DRESS 증후군은 피부 발진, 발열, 호산구 증가 및 간·
신장·폐 등의 장기 손상을 유발할 수 있으며, 드물지만 치명적인 결과로 이어질 수 있어 의료진 의 철저한 관찰이 요구된다.
임상 연구에서는 세노바메이트가 난치성
전반적으로 양호한 내약성을 보였다는 결과가 보고되었다. 특히 이 약물은 다른 항경련제와 병
용 시 상호 보완적인
글로벌 시장에서는 적응증 확장과 장기
전략의 한 축으로 고려될 수 있다.
진행 중이다. 이 연구들
이 완료되면 세노바메이트의 적용 범위가 확대될 수 있으며, 다른 신경계 질환 치료에도 활용 가
능성이 논의되고 있다. 국내에서는 3상 임상시험이 마무리된 후 도입될 예정으로, 뇌전증 환자의 치료 접근성을 개선하고 치료 옵션을 넓힐 수 있을 것으로 기대된다. 향후 국내외 실사용 데이터 와 추가 임상 연구를 통해 세노바메이트의 장기적 안전성과 효과가 확인되면, 실제 치료 현장에 서의 활용도는 더욱 증가할 것으로 보인다.
세노바메이트의 상품명은 두 가지로 분류된다. 유럽에서는 온투즈리(Ontozry)라고 불리는 반 면, 미국에서는 엑스코프리(Xcopri)라고 불린다.
적응증 및 타임라인
1.적응증
온투즈리는 2종류 이상의 항뇌전증제를 사용했음에도 적절하게 조절되지 않는 뇌전증 성인 환 자에서 이차적 전신 발작 여부와 관계
국소 발작을 동반한 뇌전증의 보조치료제이다.
2. 허가 타임라인
온투즈리는 2021년 03월 26일 유럽 의약품청(EMA)으로부터 허가를 받았다. 엑스코프리는
2019년 11월 21일 미국 FDA로부터 허가를 받았다. 이후 efficacy 변화, indication 확대 등 유의미한 추가 허가는 없었다.
용법 및 용량
온투즈리는 12.5 mg, 25 mg, 50 mg, 100 mg, 150 mg, 200 mg의 총 6가지 용량으로
제공된다. 이 중 12.5 mg은 정제(Tablet)이며, 나머지 용량은 모두 필름코팅정(Film-coated tablet)이다. 치료 시작 후 첫 2주간은 12.5 mg/day를, 이후 2주간은 25 mg/day를 투여하
여 총 4주의 치료 시작 기간을 거친다. 이후 5주차부터는 50 mg/day로 증량하며, 2주 간격으
로 50 mg씩 총 2회 증량하는 6주간의 용량 조절 기간을 거친다. 11주차부터는 권장 목표 용량
인 200 mg/day에 도달하며, 이후 유지 치료로 200 mg/day를 지속 투여한다. 임상 반응에 따
라 발작 조절이 불충분한 환자의 경우, 온투즈리의 용량을 2주 간격으로 50 mg씩 증량하여 최
대 400 mg/day까지 조절할 수 있다.
환자가 약물 복용을 잊었을 경우, 다음 예정된 복용 시간까지 12시간 이상 남아 있다면 가능한 한 빨리 1회 용량을
65세 이상의 고령자에 대한 임상시험은 충분한 수의 대상자가 포함되지 않아, 젊은 환자군과의 반응 차이를 명확히 판단하기 어렵다. 일반적으로 항뇌전증제를 복용 중인 고령 환자에서는 피로, 보행 장애, 낙상, 운동실조, 균형 장애, 어지러움, 졸림 등의 이상반응 발생 빈도가 높다고 보고된
바 있다. 이에 따라 고령자에서는 간기능 및 신기능 저하, 동반 질환, 다제 병용 등의 요인을 고
려하여 용량 선택 시 신중을 기해야 하며, 보통 용량 범위의 하한에서 시작하는 것이 바람직하다. 신기능이 저하된 환자의 경우 주의하여 투약해야 하며, 투여 목표 용량의 감량을 고려할 수 있
다. 이는 경증에서 중등도(크레아티닌 청소율 30~90mL/min) 및 중증(크레아티닌 청소율 <30 mL/min) 신기능 장애 환자 모두에 해당된다. 이들 환자에서의 최대 권장 용량은 300 mg/day 이다. 말기 신질환 환자 또는 혈액투석 중인 환자에서 온투즈리를 투약해서는 안 된다. 간질환이 있는 환자에서는 약물에 대한 체내 노출이 증가한다. 초기 투여 용량의 조정은 필요하
지 않으나, 최대 목표 용량은 최대 50%까지 감량이 필요할 수 있다. 경증 및 중등도 간기능 장
애 환자에서의 최대 권장 용량은 200 mg/day이며, 중증 간기능 장애 환자에게는 사용이 권장
되지 않는다.
소아에 대한 안전성과 유효성은 확립되어 있지 않으며, 0개월부터 18세까지의 소아에 대한 자
료는 현재까지 제공된 바 없다.
온투즈리는 보통 1일 1회, 일정한 시간에 경구로 투여하는 것이 권장된다. 식사와 관계없이 복용 할 수 있으며, 정제는 충분한 양의 물과 함께 복용해야 한다. 본 제제는 분할선이 없어 정제를 정 확하게 분할할 수 없으며, 분할 시 용량의 정확성이 보장되지 않는다. 정제는 통째로 복용하거나 분쇄하여 복용할 수 있다. 분쇄한 정제는 물에 혼합하여 경구 투여하거나 비위튜브(nasogastric tube, NG tube)을 통해 투여할 수 있다.
비위튜브를 통한 분쇄한 정제의 투여 방법은 다음과 같다.
1) 처방된 용량에 따라 적절한 수의 정제를 분쇄한다.
2) 적절한 용기의 내부에 분쇄된 정제와 25 mL의 물을 넣는다.
3) 완전히 혼합하여 현탁액을 만든다.
4) 입자 잔여물이 용기 내에 남지 않도록 주의하여, 현탁액을 카테터 전용 주사기를 이용해 비 위튜브에 주입한다.
5) 같은 주사기에 10 mL의 물을 다시 채운 후 부드럽게 흔들어 남은 약물을 회수하고 주입한다.
6) 주사기 내에 입자가 남아 있는지 육안으로 확인하고, 입자가 남아 있을 경우 5번 과정을 반 복한다.
엑스코프리는 총 6가지 용량(12.5mg, 25mg, 50mg, 100mg, 150mg, 200mg)에 대해 허 가를 받았으며, 정제(tablet)으로 제공되어 경구 투여된다.
1) 기본 용량: 권장 초기 용량은 12.5mg을 1일 1회 복용하는 것이다. 권장 유지 용량은 1일 1 회 200mg이며, 최대 용량은 1일 1회 400mg이다.
2) 간 손상 환자: 경증 또는 중등도의 간 손상 환자의 경우, 최대 권장 용량은 1일 1회 200mg 이다.
3) 복용 방법: 정제는 물과 함께 통째로 삼키거나, 분쇄하여 복용할 수 있다. 분쇄된 정제 (crushed tablet)는 물과 혼합하여 경구 현탁액으로 복용하거나, 코위관(nasogastric tube)을
통해 투여한다. 이때 코위관이란 코-식도-위까지 관을 삽입할 때 사용하는 기구로, 위에 넣는 짧
은 튜브 길이는 약 127㎝이다. Levin 튜브가 대표적으로 사용되므로 L-tube라고도 한다. 이렇 게 코위관을 사용한 분쇄된 정제 복용 방법은 2024년 4월에 새롭게 추가된 용법이다. 이전에는
음식과 관계없이 언제든 복용 가능하며, 정제를 씹거나 부수지 않고 통째로 삼키도록 권장되었다.
온투즈리와 엑스코프리의 사용상의 주의사항은 다음과 같다.
1. 자살 사고 및 행동 항뇌전증제 복용 환자에서 자살 사고 및 자살 행동이 보고된 바 있다. 항뇌전증제의 위약 대조
임상시험에 대한 메타분석에서도 자살 사고 및 행동의 위험이 소폭 증가하는 것으로 나타났다. 이러한 위험 증가의 기전은 명확히 밝혀지지 않았으므로, 투약 중 환자에게 자살 사고 또는 행동
의 징후가 나타나는지 주의 깊게 관찰해야 하며, 필요 시 적절한 조치를 취해야 한다. 또한 환자
및 보호자에게 자살 사고나 행동이 나타날 경우 즉시 의료진에 알릴 것을 사전에 교육해야 한다.
2. 호산구증가증 및 전신 증상을 동반한 약물반응(Drug reaction with eosinophilia and systemic symptoms, DRESS)
세노바메이트를 고용량으로 시작하거나 급속하게 증량(1주 간격 또는 그보다 짧은 간격)할 경
우, 생명을 위협하거나 치명적일 수 있는 호산구증가증 및 전신 증상을 동반한 약물반응(DRESS) 이 보고된 바 있다. 한편, 1,340명의 뇌전증 환자를 대상으로 한 공개표지 안전성 연구에서는 세
노바메이트를 12.5 mg/day에서 시작하고 2주 간격으로 점증했을 때, DRESS 사례는 보고되
지 않았다.
세노바메이트를 처방할 때에는 DRESS의 증상 및 징후에 대해 환자에게 사전 설명을 하고, 피
부 이상 반응에 대해 면밀히 모니터링해야 한다. DRESS는 일반적으로 발열, 다장기 침범과 연 관된 발진, 림프절병증, 간기능 이상, 호산구 증가증 등의 증상을 포함하나, 이에 국한되지 않는 다. 특히 발진이 동반되지 않더라도 초기 과민반응 증상으로 발열이나 림프절병증이 나타날 수
있으므로 주의가 필요하다. DRESS가 의심되는 임상 증상이 발생하는 경우, 세노바메이트는 즉 시 중단해야 하며, 필요 시 대체 치료를 고려해야 한다.
3. QT 간격 단축
세노바메이트는 용량 의존적으로 QTcF 간격을 단축시키는 것으로 관찰되었다. QTcF가 340 msec 미만으로 단축된 사례는 보고되지 않았다. 임상시험에서는 세노바메이트와 다른 항 뇌전증제를 병용했을 때 추가적인 QT 단축 효과는 확인되지 않았다. 다만, QT 간격을 단축시키 는 것으로 알려진
. 4. 약물 상호작용 및 기타 상호작용
세노바메이트는 주로 포도당산 결합에 의해 광범위하게 대사되며, 산화 대사는 상대적으로 적 은 비중을 차지한다. 세노바메이트는 CYP3A4 및 CYP2B6에 의해 주로 대사되는 약물의 혈중
농도를 감소시킬 수 있으며, 반면 CYP2C19에 의해 주로 대사되는 약물의 혈중 농도를 증가시 킬 수 있다. 세노바메이트의 투여 시작, 중단 또는 용량 변경 시 효소 활성의 새로운 안정 상태
에 도달하기까지 약 2주가 소요될 수 있다. 약력학적 상호작용 면에서는 중추신경계 억제제와의
병용 시 주의가 필요하다. 세노바메이트를 알코올, 바비투르산염(Barbiturates), 벤조디아제핀 (Benzodiazepines) 계열
위험이 증가할 수 있다. 따라서
(Phenytoin)
페노바비탈 (Phenobarbital)
클로바잠 (Clobazam)
라모트리진 (Lamotrigine)
(Carbamazepine)
반응에 따라 페니토 인 용량 조절 가능
세노바메이트 용량 조절 불필요 세노바메 이트 증량 시 페노바비탈 농도 모니터링 필요하며, 개별 반응에 따라 페노바비탈
용량 조절 가능
세노바메이트 용량 조절 불필요 클로바잠
활성대사체(N-desmethylclobazam)
농도 증가 가능성 있어 클로바잠 용량 조 절 필요할 수 있음
개별 반응에 따라 세노바메이트 용량 증 량 필요할 수 있음(200~400 mg/day)
불필요
(Pharmacokinetic Effect)
200 mg/day과 병용 시, 세노바메이트 Cmax -27%, AUC -28% 감소, 페니토인 Cmax 67%, AUC 84% 증가
세노바메이트 200 mg/day과 병용 시 세노바메이트 노출 변화 없음, 페노바비 탈 Cmax 34%, AUC 37% 증가
클로바잠 활성대사체 농도 증가 클로바잠 병용 시 세노바메이트 노출 24% 증가 예상
세노바메이트 병용 시 라모트리진 농 도 용량 의존적으로 감소(세노바메이트 100, 200, 400 mg/day에 대해 각각 -21%, -35%, -52%).
세노바메이트 노출 영향 없음
세노바메이트 노출 영향 없음 카바마제핀 Cmax 23%, AUC 24% 감 소 발프로산 (Valproic acid)
및 발프로산 모두 용량 조
불필요 두 약물 모두 노출 변화 없음
경구피임약 (CYP3A4) 비호르몬 피임법 병행 권고
CYP3A4 기질 용량 증량 고려
CYP2B6 기질 용량 증량 고려
CYP2C19 기질 용량 감량 고려
OAT3 기질 노출 증가 주의
5. 생식능, 임신 및 수유 1) 가임기 여성 및 피임
영향 (Effect on PK parameters)
↓ 혈중 농도
세노바메이트 200 mg/day 투여 시 미 다졸람(Midazolam) AUC 72% 감소
피임 효과 저하 가능
↓ 혈중 농도
미다졸람 AUC가 100 mg에서 27%, 200 mg에서 72% 감소
↓ 혈중 농도
부프로피온(Bupropion) Cmax 23%,
AUC 39% 감소
↑ 혈중 농도
오메프라졸(Omeprazole) Cmax 83%,
AUC 107% 증가
부작용 증가 가능
↑ 혈중 농도
세노바메이트는 OAT3 억제
→ baricitinib, empagliflozin 등 노출
증가 가능
세노바메이트는 피임을 하지 않는 가임기 여성에게 권장되지 않는다. 세노바메이트는 CYP3A4
유도 작용으로 경구피임약의 혈중 농도를 감소시킬 수 있으므로, 경구피임약을 복용 중인 여성은
치료 기간 동안 및 치료 종료 후 최소 4주간 비호르몬성 피임법을 추가하거나 대체해야 한다. 안
전한 임신 예방을 위해 치료 전 피임 상담이 필수적이다.
2) 임신
뇌전증 환자에서 항뇌전증제를 사용하는 경우, 일반 인구의 선천기형 발생률(약 3%)에 비해
2~3배 높은 기형 발생률이 보고되어 있다. 특히 다제 병용요법에서는 그 위험이 더 높게 나타난
다. 그러나 이러한 위험이 약물에 의한 것인지 또는 뇌전증이라는 기저 질환에 의한 것인지는 명 확히 밝혀지지 않았다. 항뇌전증제 중단은 발작 조절 실패로 이어져 산모와 태아 모두에 해를 끼 칠 수 있으므로 신중한 판단이 필요하다. 세노바메이트의 경우, 임산부에 대한 적절한 임상 자료 는 없으며, 동물 실험에서 세노바메이트가 태반을 통과하고, 임상 노출 이하의 용량에서도 생식
독성이 관찰된 바 있다. 따라서 임신 중에는 임상적으로 꼭 필요한 경우에만 세노바메이트의 사
용이 고려되어야 한다.
3) 수유
세노바메이트 또는 그 대사체가 사람의 모유로 분비되는지는 알려져 있지 않다. 그러나 동물 연 구에서 모유 중 세노바메이트가 검출되었으며, 이로 인해 수유 영아에게 노출될 가능성을 배제할
수 없다. 이에 따라 치료 기간 중에는 수유를 중단할 것이 권장된다. 모유 수유 여부는 약물의 필
요성과 잠재적 위험성을 고려하여 개별적으로 결정해야 한다.
4) 생식능
세노바메이트의
6. 운전 및 기계 조작 능력에 대한 영향
러움, 피로,
계 조작 능력이 저하될
이상사례
클로바잠(Clobazam)과 병용 시 부작용 발생이 더 빈번하였다. 치료 중단을 가장 많이 초래한 부작용은 빈도 순으로 운동실조(세노바메이트 1.6% vs 위약 0.5%), 어지러움(1.6% vs 0.5%), 졸림(1.4% vs 0.5%), 안구진탕(0.7% vs 0%), 현기증(0.7% vs 0%), 복시(0.5% vs 0%)였다. 이러한 이상사례는 용량 의존적으로 발생하며, 점진적인 용량 증 량 계획을 엄격히 준수해야 한다.
다음은 임상시험에서 보고된 이상사례를 계통별 및 빈도별로 정리한 표이다. 이상사례의 빈도는 매우 흔함(10명 중 1명 이상), 흔함(100명 중 1명 이상 10명 미만), 드묾(1,000명 중 1명 이상 100명 미만), 희귀(1만 명 중 1명 이상 1,000명 미만)으로 구분된다. 각 빈도군 내에서 이상사 례는 심각도에 따라 내림차순으로 나열되어 있다.
[표 46] 임상시험에서 보고된 이상사례
계통 분류 빈도 이상사례
면역계 장애 드묾 과민반응
정신장애 흔함 혼돈 상태, 과민성 드묾 자살사고
신경계 장애 매우 흔함 졸림, 운동 및 보행 장애, 두통 흔함 구음장애, 안구진탕, 실어증, 기억장애
안구 장애 흔함 복시, 시야 흐림
위장 장애 흔함 변비, 설사, 구역, 구토, 구강 건조
흔함 발진 희귀 호산구 증가 및 전신 증상을 동반한 약물 반응(DRESS) 검사 이상 흔함 간 효소 증가
-졸림 : 졸림, 피로, 진정, 과다수면을 포함한다.
-운동 및 보행 장애 : 어지러움, 현기증, 균형 장애, 운동실조, 보행 장애 및 비정상적 협응을 포 함한다.
-과민반응 : 과민반응, 약물 과민반응, 눈꺼풀 부종을 포함한다.
-발진 : 발진, 홍반성 발진, 전신 발진, 반상 발진, 반상구진성 발진, 홍역양 발진, 구진성 발진, 가려운 발진을 포함한다.
-간 효소 증가 : 알라닌 아미노전달효소(Alanine aminotransferase) 증가, 아스파테이트 아
미노전달효소(Aspartate aminotransferase) 증가, 간 효소 증가, 간 기능 이상, 트랜스아미나 제(Transaminases) 증가를 포함한다.
NCT01866111
A Double-Blind, Randomized, Placebo-Controlled, Phase 2 Trial of YKP3089 as Adjunctive Therapy in Subjects With Partial Onset Seizures– NCT01866111
[Study Design]
본 임상시험은 기존의 항경련제 치료에 반응하지 않는 국소발작 환자를 대상으로, 세노바메이트 (Cenobamate, 개발 초기 코드명 YKP3089)의 유효성과 안전성을 평가하기 위해 설계된 제2 상 임상이다. 본 시험은 다기관, 무작위 배정, 위약 대조, 사중맹검 방식으로 진행되었다. 특히, quadruple-blind 설계는 피험자, 임상 연구자, 약물 관리자, 결과 평가자까지 모두 시험약의 정 보를 알 수 없도록 설계함으로써, 연구의 객관성과 신뢰도를 극대화한 점이 특징이다 .
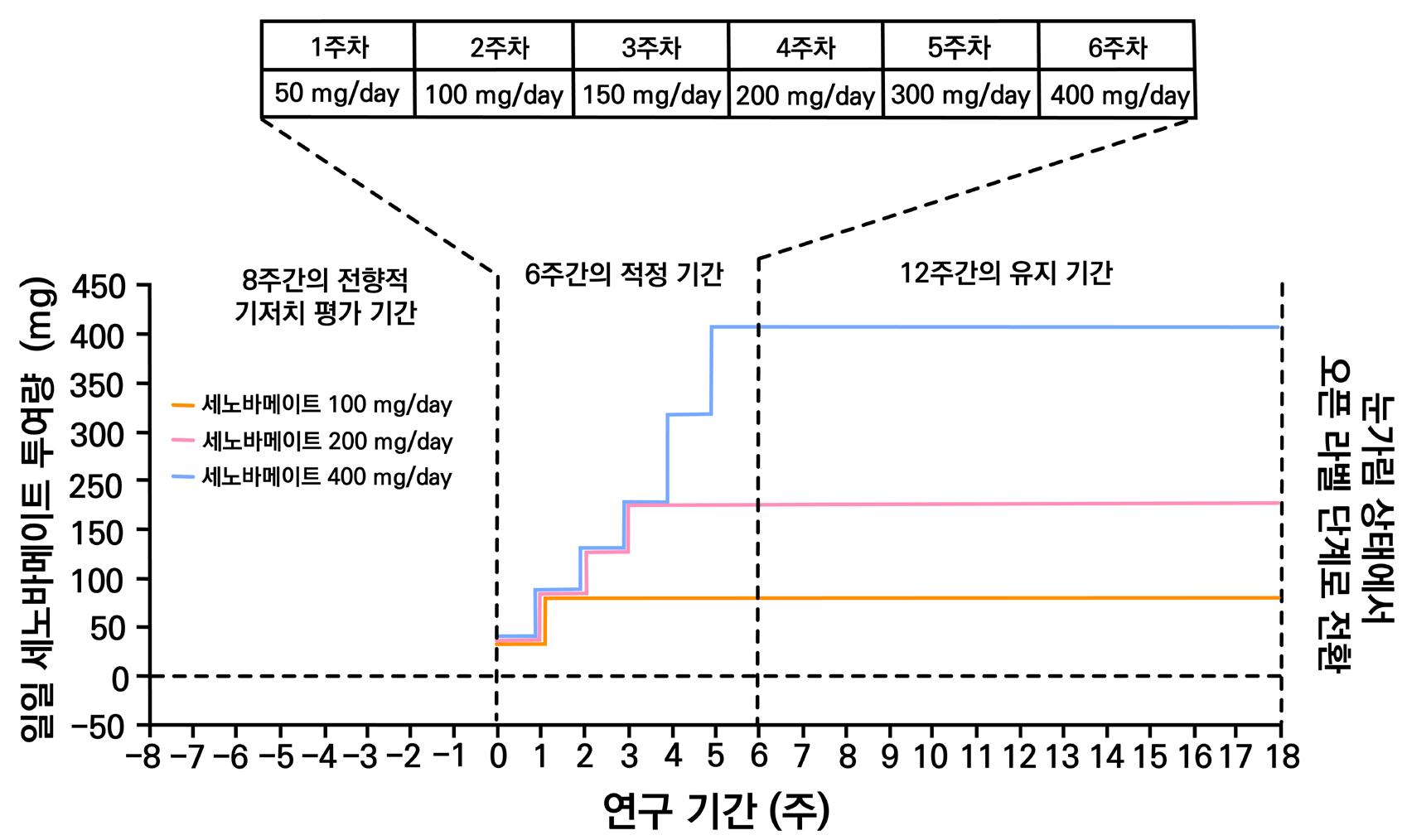
[그림 39] NCT01866111의 연구 디자인
시험군은 세노바메이트를 100mg, 200mg, 400mg 세 가지 용량으로 하루 한 번 경구 투여받 았으며, 대조군은 위약을 동일한 방식으로 투여받았다. 총 18주간의 이중맹검 치료 기간이 설정 되었고, 이 전에 8주간의 관찰 기간을 통해 환자의 발작 빈도와 안정적인 AED 치료 이력을 확인 하였다. 연구는 미국을 포함한 총 67개 지역에서 수행되었으며, 약물 용량에 따른 용량-반응 관 계를 명확히 분석할 수 있도록 설계된 dose-response trial이었다.
[Participation Criteria]
참여자는 총 434명으로 구성되었으며, 각 군의 피험자 수는 다음과 같다: Placebo 108명, 세 노바메이트 100mg 108명, 200mg 110명, 400mg 111명. 각 군의 나이, 성별, 질환 기간, 병용약물 수 등 주요 인구통계학적 특성은 유사하였다.
포함 기준 (Inclusion Criteria)
• ILAE 기준에 따라 부분발작으로 진단된 최소 40kg 이상의 18세 이상 70세 이하의 환자
• 임상병력과 국소화 관련 뇌전증과 일치하는 뇌파(EEG)를 통해 진단이 확정되어야 함. 이때, 다른 진단 기준(임상 병력 등)을 충족하는 경우, 정상 뇌전증 뇌파도 허용됨.
• 최근 2년 이내에 최소 1회의 AED 치료를 받았음에도 불구하고 조절되지 않는 부분발작이
있는 경우
• 현재 안정적으로 항뇌전증제 치료요법을 받고 있어야 함.
• Baseline 8주 동안 최소 8회의 부분발작을 경험해야 함. (운동 증상을 수반한 단순부분
발작, 복합부분발작, 25이 이상의 발작없는 간격이 없는 이차성 전신발작) 이때, 피험자는 baseline period 중 연속된 2개의 4주 구간동안 각각 최소 3회의 이러한 부분발작을 경험
해야 함.
제외 기준 (Exclusion Criteria)
• 심인성 또는 비간질성 발작 병력이 있는 경우
• 비운동성 단순 부분 발작 또는 원발성 전신성 발작만 있는 경우
• 레녹스-가스토 증후군 병력
• 연구 결과 해석에 혼란을 줄 수 있는 활성 CNS 감염, 탈수초성 질환, 퇴행성 신경 질환 또는
연구 진행 중 진행성 질환으로 간주되는 모든 CNS 질환이 있는 경우
• 지난 2년 이내에 알코올 중독, 약물 남용 또는 약물 중독 병력
• visit 1 후 3개월 이내에 간질 상태 병력
• 지난 6개월 동안 C-SSRS(기준/선별 버전) 사고 섹션의 질문 1 또는 2에 “예”라고 답하거 나 지난 2년 동안 자살 행동 질문 중 하나에 “예”라고 답한 경우
• 평생 1회 이상의 자살 시도
• 선별 검사 후 30일 이내(또는 현지 규정에 따라 그 이상)에 임상시험용
련된 다른 임상시험에 참여한 경우
• 이전에 YKP3089에 노출된 적이 있는 경우
• 시험자의 의견에 따라 피험자의
임상적으로 중요한 정신과 질환, 심리적 또는 행동 문제
본 임상시험의 1차 평가변수는 baseline 대비 28일당 부분발작 빈도의 백분율 변화율이다. 구
체적으로는 운동증상을 수반한 단순 부분 발작, 복합 부분 발작, 이차성 전신 발작을 포함한 발작
빈도를 기준으로 하였다. 평가 시점은 이중맹검 기간 전체(18주)이며, 각 치료군에서 평균 28일 간의 발작 빈도를 계산한 뒤 baseline과 비교하여 변화율을 산출하였다.
이중맹검 18주 기간 동안의 분석 결과, placebo군은 발작 빈도의 중앙값이 24.0%p 감소하
였으며(전체 범위 –91% ~ +198%), 세노바메이트(Cenobamate) 투여군에서는 용량이 높을
수록 발작 빈도 감소 효과가 크게 나타났다. 100mg/day 군은 –35.5%(–100% ~ +206%), 200mg/day 군은 –55.0%(–100% ~ +191%), 400mg/day 군은 –55.0%(–100% ~ +167%)로, 200mg 이상 고용량에서는 발작 빈도가 명확히 감소하였다.
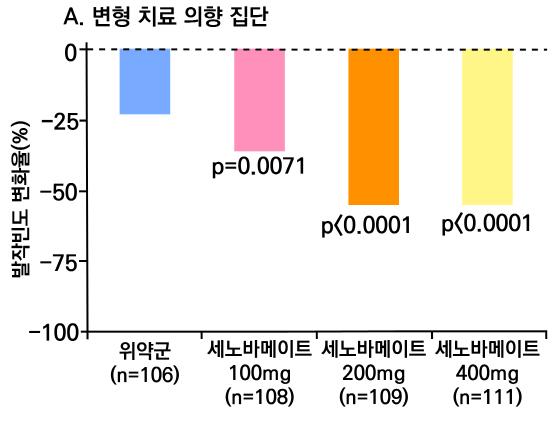
[그림 40A] mITT population에서의 28일당 발작빈도 변화율 (18주 전체 기간 기준)
보다 엄격한 분석군인 mITT-M population(12주 유지 기간 기준) 분석에서도 유사한 경향이 확인되었다. Placebo군은 –27.0%(IQR –51.0% ~ –8.0%)였으며, 세노바메이트 100mg/ day 군은 –41.5%(IQR –65.0% ~ –11.0%)로 나타났으나 p-value = 0.0537로 통계적 유 의성은 borderline 수준이었다. 반면, 200mg/day 군은 –56.5%(IQR –78.0% ~ –25.0%), 400mg/day 군은 –63.0%(IQR –97.0% ~ –28.0%)로 각각 p-value < 0.0001로 유의미한 차이를 보였다. 이러한 결과는 세노바메이트의 용량 의존적 효과를 시사하며, 특히 200mg 이상 투여 시 placebo 대비 뚜렷한 발작 억제 효과가 있음을 입증하였다.
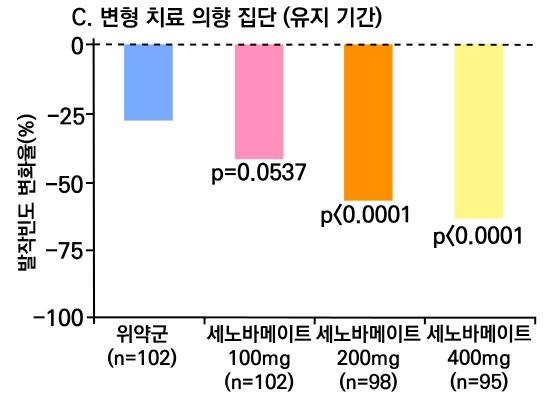
[그림 40C] mITT-M population에서의 발작 빈도 변화율 (12주 유지 기간 기준)
요약하면, 세노바메이트는 이중맹검 치료기간 동안 baseline 대비 28일 발작 빈도를 유의하게
감소시켰으며, 특히 200mg 이상 고용량에서는 통계적으로도 강력한 유의성을 보여 치료 효과
의 확실성을 입증하였다. 100mg/day 용량에서도 어느 정도 효과는 있었으나 통계적 유의성 측
면에서는 경계선에 위치해 있었다. 따라서 세노바메이트는 고용량에서 보다 안정적이고 확실한
치료 효과를 기대할 수 있는 약물로 해석된다.
[Secondary Outcome]
2차 평가변수는 50% Responder Rate, 즉 치료 전 대비 부분 발작 빈도가 50% 이상 감소한
환자의 비율로 정의된다. 이는 이중맹검 치료기간 동안의 부분 발작 빈도 감소율을 기준으로 산 출되었으며, 분석 기간은 18주였다.
전체 치료군 중 placebo군은 106명 중 23명(21.7%)에서만 50% 이상 발작 감소 반응을 보였 다. 반면, 세노바메이트 투여군에서는 용량에 따라 반응률이 유의하게 증가하였다. 100mg/day 군에서는 44명(40.7%), 200mg/day 군에서는 63명(57.8%), 400mg/day 군에서는 67명 (60.4%)이 50% 이상 발작 빈도 감소를 보였다.
mITT-M population을 기준으로 한 유지 기간(12주) 분석에서도 placebo군은 25%의 반응 률을 보인 반면, 세노바메이트 100mg/day, 200mg/day, 400mg/day는 각각 40%, 56%, 64%의 반응률을 나타냈다. 특히 고용량군(200/400mg/day)은 p-value < 0.0001로 통계적 으로 매우 유의한 효과를 입증하였다. 100mg/day 용량 역시 placebo 대비 효과는 있었으나, OR 1.97 (95% CI: 1.08–3.56), p = 0.0365로 상대적으로 유의성이 낮은 borderline 수준 이었다. 이로 인해 100mg은 효과는 있으나 치료 반응의 확실성을 보장하기엔 제한이 있는 용량 으로 해석된다.
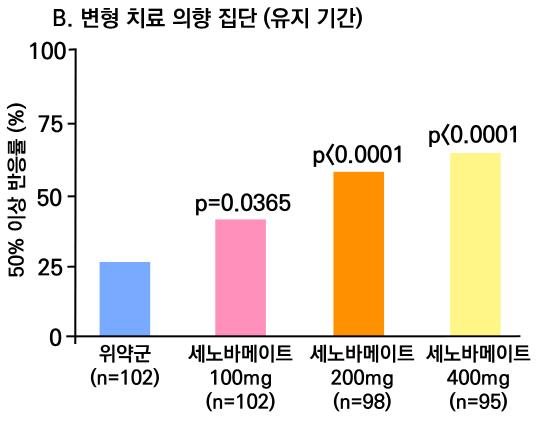
[그림 40B] mITT-M population에서의 50% 이상 반응률 (12주 유지 기간 기준)
또한 전체 이중맹검 기간(18주 기준)의 분석에서도 유사한 경향이 관찰되었다. mITT population 분석에 따르면 100mg/day에서 42%(p = 0.0032), 200mg/day에서 55%(p < 0.0001), 400mg/day에서 63%(p < 0.0001)의 환자가 50% 이상의 발작 빈도 감소를 경험 하였다. 용량이 증가할수록 반응률 또한 증가하며, placebo군(25%) 대비 모든 세노바메이트 용
량군에서 통계적으로 유의미한 차이가 나타났다.
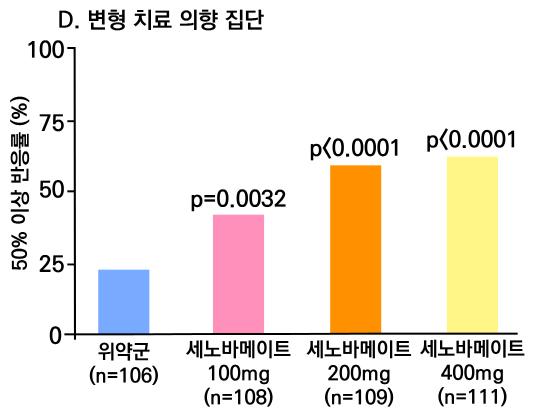
[그림 40D] mITT population에서의 50% 이상 반응률 (18주
감소뿐 아니라, 임상적으로 의미 있는 수준의 반응을 보인 환자의 비율에서도 세노바메이트의 우수한 효능을 입증한 결과이다.
[고강도 반응률 (≥75%, ≥90%, 100% 발작 감소 비율)]
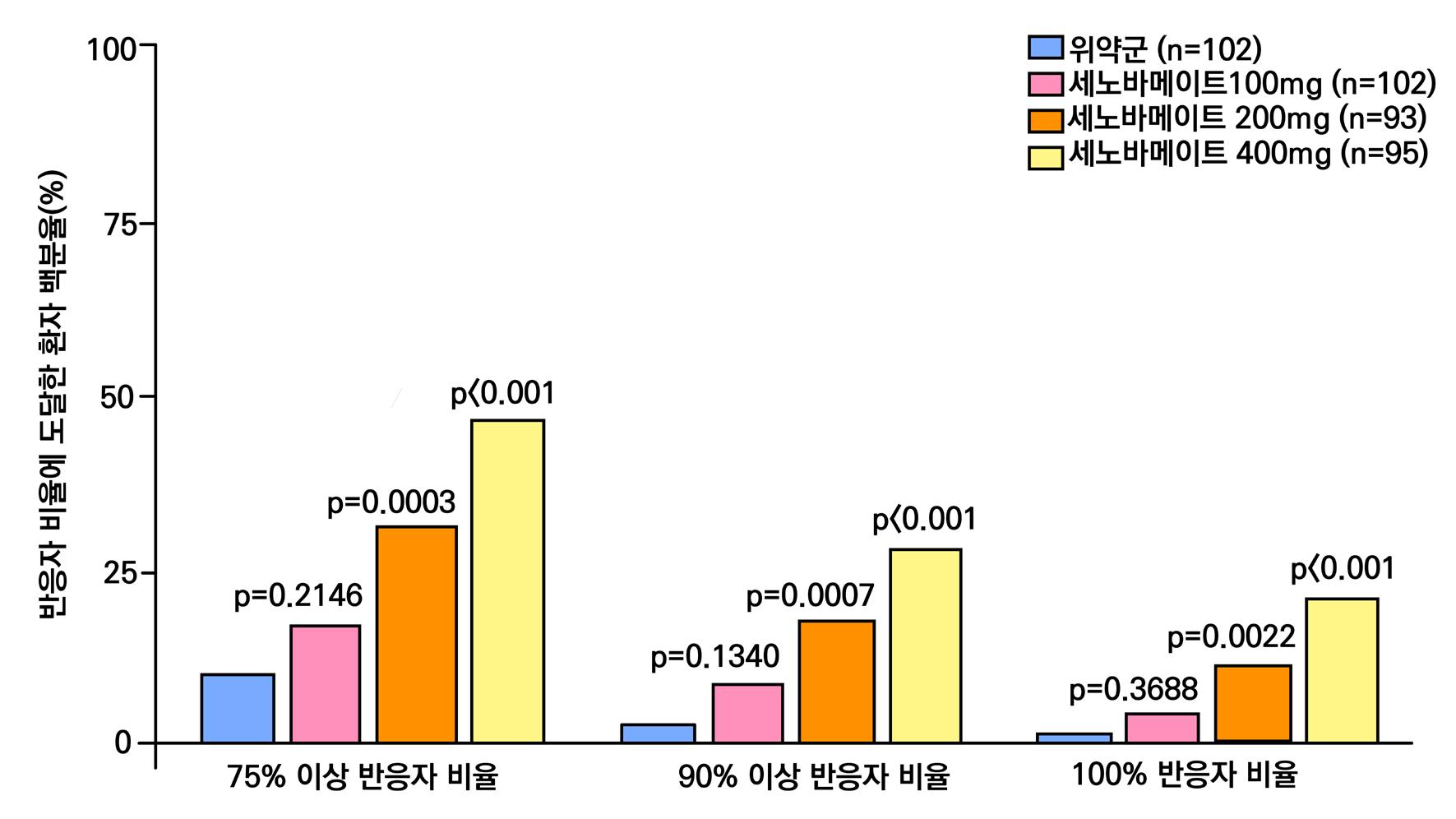
[그림 41] 고강도 반응률
공식적인 1차 및 2차 평가변수 외에도, 임상시험에서는 고강도 반응률에 해당하는 ≥75%, ≥90%, 100%의 발작 빈도 감소 비율을 달성한 환자 비율을 분석하였다. 이는 ClinicalTrials.
gov에는 등록되지 않았던 보조적 결과지표이나, 약물의 강력한 항경련 효능을 뒷받침하는 중요 한 근거로 제시되었다.
Placebo군에서는 각각 10%, 3%, 1%의 환자가 발작 빈도 감소율 75%, 90%, 100% 이상을 달성하였다. 반면, 세노바메이트 투여군에서는 용량이 증가할수록 반응률이 유의하게 증가하였 다. 100mg/day군은 75% 이상 감소 비율이 17%, 90% 이상 9%, 완전 발작 소실은 4%였으며, 통계적으로 유의한 차이는 없었다. 하지만 200mg/day 투여군에서는 각각 31%(p=0.0003), 17%(p=0.0007), 11%(p=0.0022)의 환자에서 반응이 나타났고, 400mg/day 투여군에서는 46%(p<0.0001), 28%(p<0.0001), 그리고 무려 21%(p<0.0001)의 환자가 완전 발작 소실
상태를 보였다.
이는 기존 항경련제들에서 보기 어려운 수준의 효과로, 특히 400mg/day 투여 시 5명 중 1명 에서
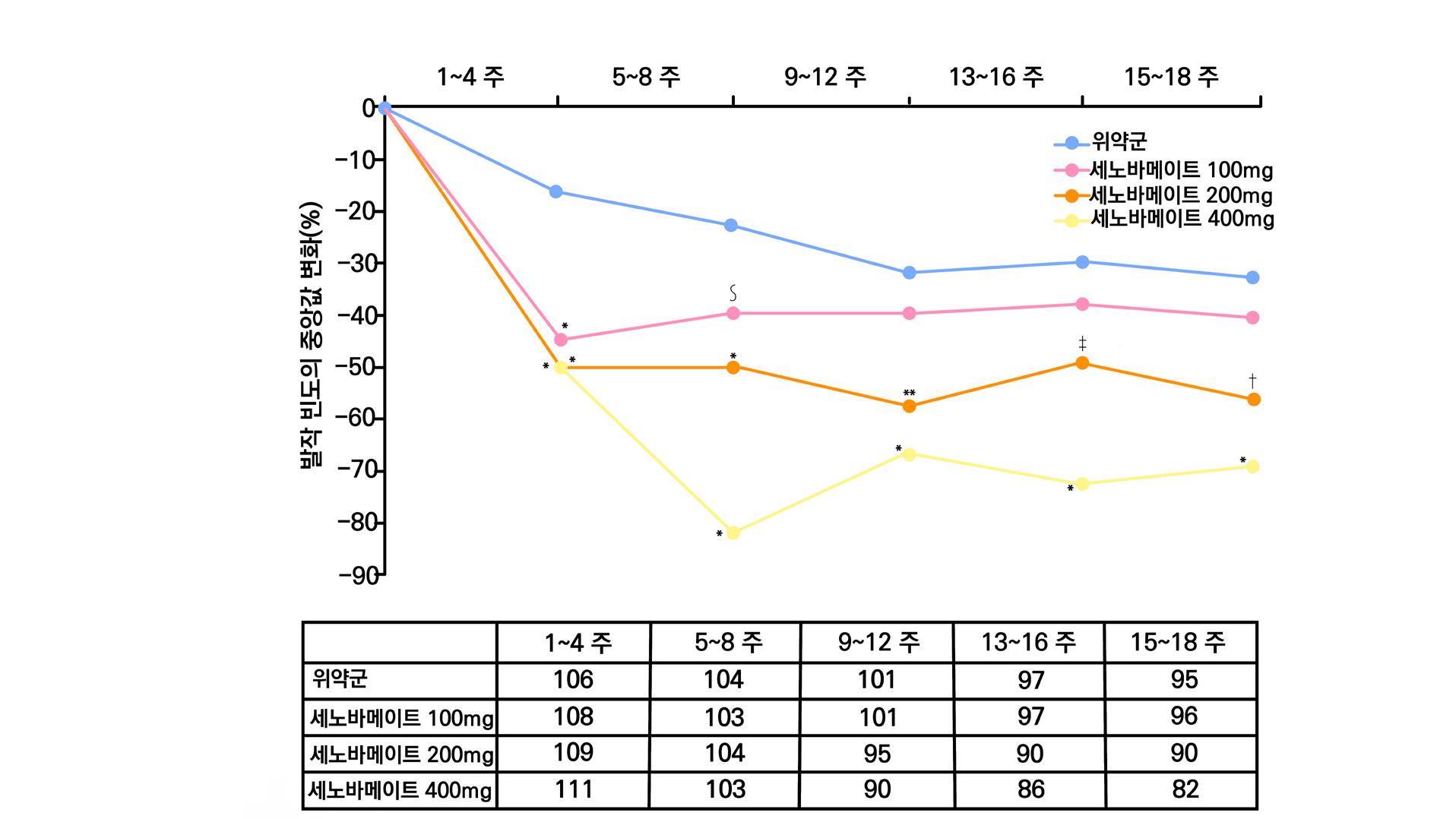
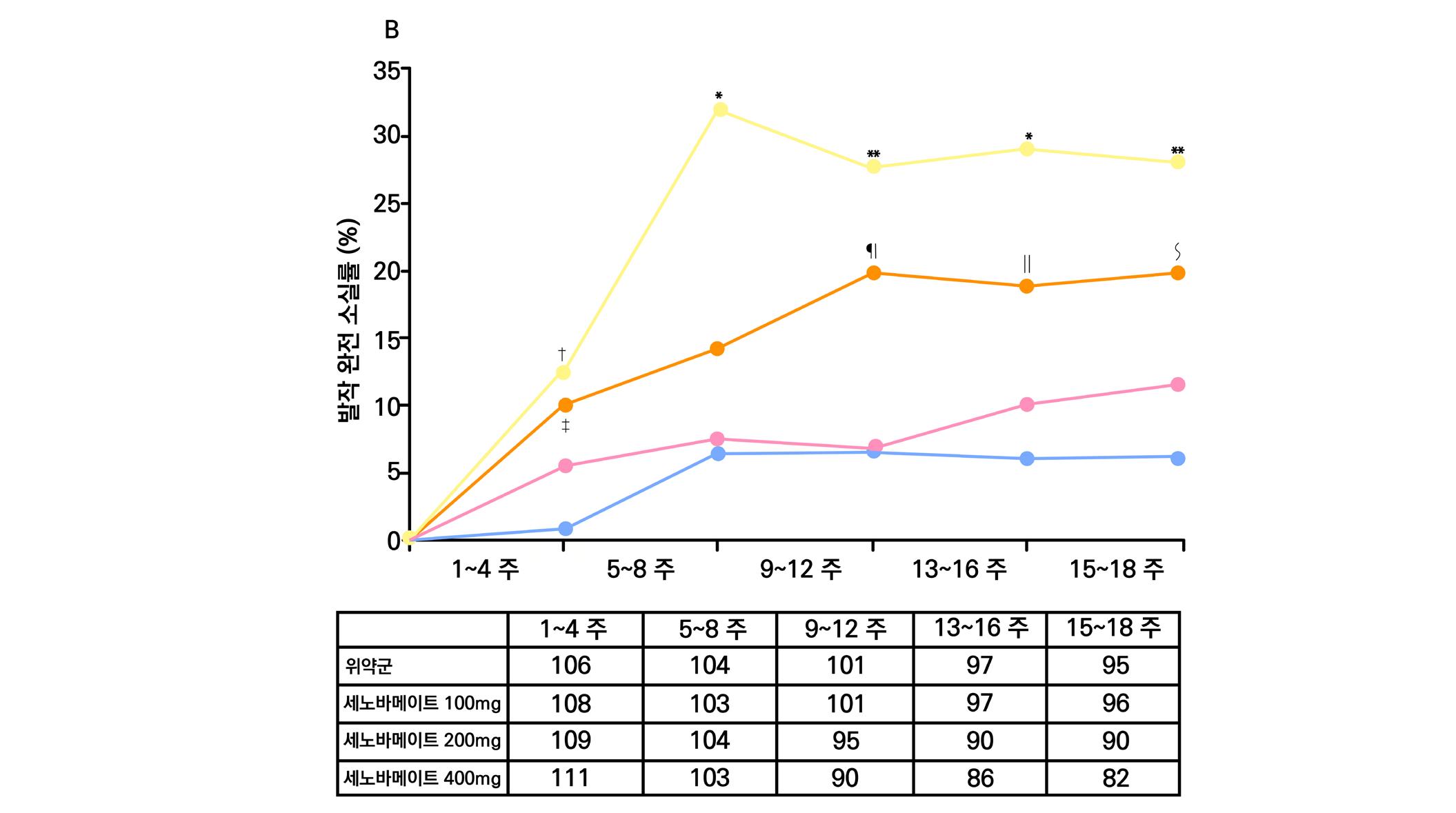
본 분석에서는 유지기간 동안의 시간 경과에 따른 발작 빈도 변화와 발작 소실의 추이를 4주 단
위로 추적하여 평가하였다. 이는 기존의 단일 시점 비교 분석을 보완하며, 세노바메이트의 장기 적인 효과 지속성 및 용량-시간 효과 관계를 파악하는 데 중요한 지표로 작용한다.
[그림 42]에서는 4주 단위별 평균 발작 빈도의 변화율을 나타낸다. 200mg 및 400mg 투여군 에서는 4주 시점부터 지속적이고 점진적인 발작 감소가 관찰되었으며, 5주차 이후부터는 뚜렷한
차이가 나타났다. 특히 400mg/day군에서는 8~18주 기간까지 발작 빈도가 최대 80~90%까지
감소하여 가장 우수한 효과를 보였다. 이러한 경향은 세노바메이트의 용량이 높을수록 효과가 강
하고 지속됨을 다시 한 번 보여준다.
[그림 43]는 발작 소실률의 변화를 보여준다. 200mg/day 및 400mg/day 투여군에서는 치
료 초반부터 발작 소실이 관찰되었으며, 15~18주 구간에서는 400mg/day 투여 시 30% 이상
의 환자가 완전 발작 소실 상태에 도달하였다. 반면, placebo군은 모든 시점에서 발작 소실률이
0~5%에 그쳐, 세노바메이트군과의 뚜렷한 차이를 보였다.
특히 고용량 투여군은 시간 경과에 따라 완전 발작 소실을 경험하는 환자 비율이 점진적으로 증 가하는 용량-시간 반응 관계를 보여주었으며, 이는 세노바메이트의 장기적이고 누적적인 항경련
효과를 입증하는 근거가 된다. 마찬가지로, 해당 결과는 clinicaltrials.gov에 명시되지 않은 보
조적인 결과이지만, 임상적으로 의미 있는 추가 정보이다.
[Adverse Events]
세노바메이트의 이상반응은 대체로 용량 의존적으로 나타났으며, 특히 400mg/day 투여군에서
가장 높은 빈도를 보였다. 치료 관련 이상반응은 placebo군에서 43%, 세노바메이트 100mg/ day군에서 57%, 200mg/day군에서 65%, 400mg/day군에서 83%로 확인되었고, 중대한 이상반응은 각각 6%, 10%, 4%, 7%로 보고되었다.
주요 이상반응은 대부분 중추신경계 증상으로, 어지러움, 졸림, 두통, 균형 장애 등이 주를 이루
었으며, 대부분 경도에서 중등도 수준이었다. 특히 졸림은 400mg/day군에서 37%로 가장 높 은 비율을 기록했다.
또한, 드물지만 주의가 필요한 이상반응으로는 DRESS 증후군을 포함한 과민반응이 있다. 이 는 보통 투여 초기 빠른 증량 시에 발생하며, 느린 용량 적정 프로토콜을 적용함으로써 예방 가 능하다. 현재 세노바메이트의 장기 안전성에 대해서는 open-label 연구를 통해 추가 관찰이 진 행 중이다.
[추가 연구 결과: OLE 및 사후분석]
기존 이중맹검 임상이 종료된 후, 세노바메이트의 장기적 유효성과 안전성을 평가하기 위해 OLE(Open-Label Extension) 연구가 최대 48개월간 진행되었다. 그 결과, 43~48개월 시
점에서 중앙값 기준 발작 빈도는 76.1% 감소하였고, 완전 발작 소실을 경험한 환자 비율도 유 의미했다. 전체 기간 기준으로는 10.2%, 해당 구간 관찰자 기준으로는 16.4%가 완전 발작 소
실을 경험하였다. 또한 발작 빈도가 90% 이상 감소한 환자는 24.3% (전체 기준), 39.1% ( 관찰자 기준)로 나타났으며, 지속적인 발작 억제 효과가 장기적으로도 유지됨을 보여주었다. 12/24/36/48개월 시점에서도 각각 83%, 71%, 65%, 62%의 환자가 유지되었으며, 이는 일 부 환자에서 지속적인 완전 발작 소실이 가능함을 시사한다.
또한, 사후분석(Post-hoc analysis)을 통해 병용 항뇌전증제 개수, 기저 발작 빈도, 질병 지 속 기간에 따른 치료 효과 차이를 분석하였다. 그 결과, 병용 약물 수가 적을수록 효과가 두드러
졌으며, 특히 1개 약물과 병용한 400mg/day 투여군에서는 중앙값 기준 86%의 발작 감소율이 관찰되었다. 또한 발작 빈도 및 질병 지속 기간이
효과가 높았으며, 최대 25.0%의 환 자에서 완전 발작 소실이 나타났다. 위약군에서의 완전 발작 소실 비율은 0~2.2% 수준에 불과 했다. 이는 환자의 기저 특성에 따라 세노바메이트의 치료 효과가 달라질 수 있으며, 고용량이 더
유리할 수 있음을 시사한다.
[결론 및 의의]
세노바메이트는 기존 항뇌전증제 1~3종을 병용함에도 부분발작이 조절되지 않는 난치성 뇌전 증 환자에게서 의미 있는 발작 빈도 감소를 입증하였다. 특히 100, 200, 400mg/day 투여군 모두에서 유효성이 입증되었으며, 200mg 및 400mg 용량에서는 발작 소실 비율도 유의하게 높게 나타났다.
이상반응은 용량 의존적이며 대부분 경도~중등도 수준이지만, 400mg/day군에서는 그 빈도와 중증도가 증가하는 양상이었다. 또한 DRESS 증후군와 같은 심각한 과민반응이 드물게 발생했 으나, 느린 증량 프로토콜로 이를 예방할 수 있음이 확인되었다. 이러한 결과는 세노바메이트가 약물 난치성 부분발작 환자에게 새로운 치료 옵션으로서 임상적 가치를 지닌 약물임을 시사하며, 향후 실임상 적용에 있어서도 용량 설정과 증량 속도 조절이 중 요한 고려사항임을 강조한다.
NCT01397968
Efficacy and Safety of YKP3089 in Subjects With Treatment Resistant Partial Onset Seizures
[Study Design]
본 연구는 치료 저항성 국소 발작 환자를 대상으로 세노바메이트(Cenobamate, 개발 초기 코
드명 YKP3089)의 유효성과 안전성을 평가한 임상시험이다.
본 시험은
대상으로 수행되었으며 무작위 배정, 삼중 맹검, 위약 대조 방식으로 설계되었다. 또한, 본 시험 종료 후에는
진행되었다.
평가하는 open-label 연장 연
[Participation]
해당 임상시험의 참가 자격은 남녀 모두 가능하며, 연령은 18세부터 65세까지로 제한되었다.
건강한 지원자는 허용되지 않았으며, 2011년 07월 06일부터 2013년 06월 15일까지 미국, 폴
란드, 한국, 인도, 총 4개 국가에 위치한 38개 기관에서 실시되었다. 포함 기준 및 제외 기준은 다음과 같다.
포함 기준 (Inclusion Criteria)
1.
2.
3. 월 3회 이상 다음 중 하나 이상의 발작을 경험하며, 연속 21일 이상 발작이 없는 기간이 없
는 사람 :
- 운동성 단순 부분 발작 (Simple Partial Seizures with Motor Component)
- 복합 부분 발작 (Complex Partial Seizures)
- 이차성 전신 발작 (Secondarily Generalized Seizures)
4. 현재 안정적인 항뇌전증제(AED) 치료를 받고 있는 사람 :
- 1~3가지 AED를 최소 12주 이상 안정적인 용량으로 복용 중이어야 함
- 미주신경자극(VNS)은 AED로 간주되지 않지만, 기본 상태 유지가 최소 4주 이상 유지되어
야 함
- 뇌전증, 불안 장애, 수면 장애로 인하여 벤조디아제핀(Benzodiazepines)을 주 1회 이상 복
용하는 경우, 이는 1개의 AED로 간주됨. 따라서 추가로 최대 2가지 승인된 AED만 허용됨
제외 기준 (Exclusion Criteria)
1. 과거 2년 이내 알코올 중독, 약물 남용 또는 약물 중독의 병력이 있는 사람
2. 과거 1년 이내 뇌전증 지속증(Status Epilepticus)을 경험한 사람
3. 항뇌전증제(AED)에 대한 심한 알레르기 반응을 보인 이력이 있는 사람:
- AED에 2회 이상 알레르기 반응을 경험한 경우
- AED에 대한 심각한 과민 반응을 한 번이라도 경험한 경우
4. 펠바메이트(Felbamate) 복용자 중 18개월 이상 지속적으로 복용하지 않은 사람
5. 페니토인(Phenytoin), 페노바비탈(Phenobarbitone) 또는 이들의 대사산물을 복용 중인 사람
6. 최근 6개월 이내 자살 계획이나 자살 의도를 가지고 있거나 활성화된 자살 사고가 있는 사람
7. 최근 2년 이내 자살 시도 병력이 있는 사람, 단 1회 이하의 자살 시도만 해당
8. 최근 6개월 이내 주요 우울 삽화(Major Depressive Episode) 진단 기준을 충족하는 사람
9. 발작 시 응급용 벤조디아제핀(Intermittent Rescue Benzodiazepines)을 한 달 동안 1회 이상 사용한 사람 (1~2회 복용이 24시간 내 이루어진 경우, 이를 1회 사용으로 간주)
본 연구는 총 285명의 피험자를 선별하였으며, 포함 기준 및 제외 기준 등에 따라 63명이 제외
되어 최종적으로 222명이 임상시험에 참여하였으며 participant flow는 그림 1과 같다. 시험
군은 세노바메이트 200mg을 1일 1회 경구 투여하였고, 대조군은 동일한 용량의 위약을 투여받 았다. 치료군 113명 중 11명이 중도 탈락하여 102명(90.3%)이 시험을 완료하였으며, 대조군 109명 중 10명이 중도 탈락하여 99명(90.8%)이 완료하였다.
[그림 44] Participant flow
치료군과 대조군 간의 나이, 성별, 인종, 민족, 지역 등 baseline 특성은 유사하였다. 단, 임상 시험에 영향을 줄 수 있는 차이점으로는 세노바메이트 투여군의 월평균 발작 횟수가 7.5회로, 위 약군의 5.5회보다 평균적으로 약 2회 높은 수준이었다.
본 시험의 1차 평가변수는 발작 빈도 감소 정도이며 2차 평가변수는 50% 이상 발작이 감소한 환자의 비율이다.
(1) Primary Outcome
1차 평가변수는 ITT(Intention-To-Treat) 집단을 대상으로 12주간 28일 주기로 측정한 발작
빈도의 중앙값 감소율로, 약물의 치료 효과를 가장 중요하게 판단하는 지표표이다. 그림 2에 따르 면, 세노바메이트 투여군에서는 발작 빈도 중앙값이 55.6% 감소하였으며, 위약군에서는 21.5% 감소하였다. 세노바메이트의 발작 빈도 감소 효과는 위약에 비해 유의미하게 높은 것으로 나타났 다. (p < 0.0001) 그림 3은 동일한 12주 기간 동안 매달 측정한
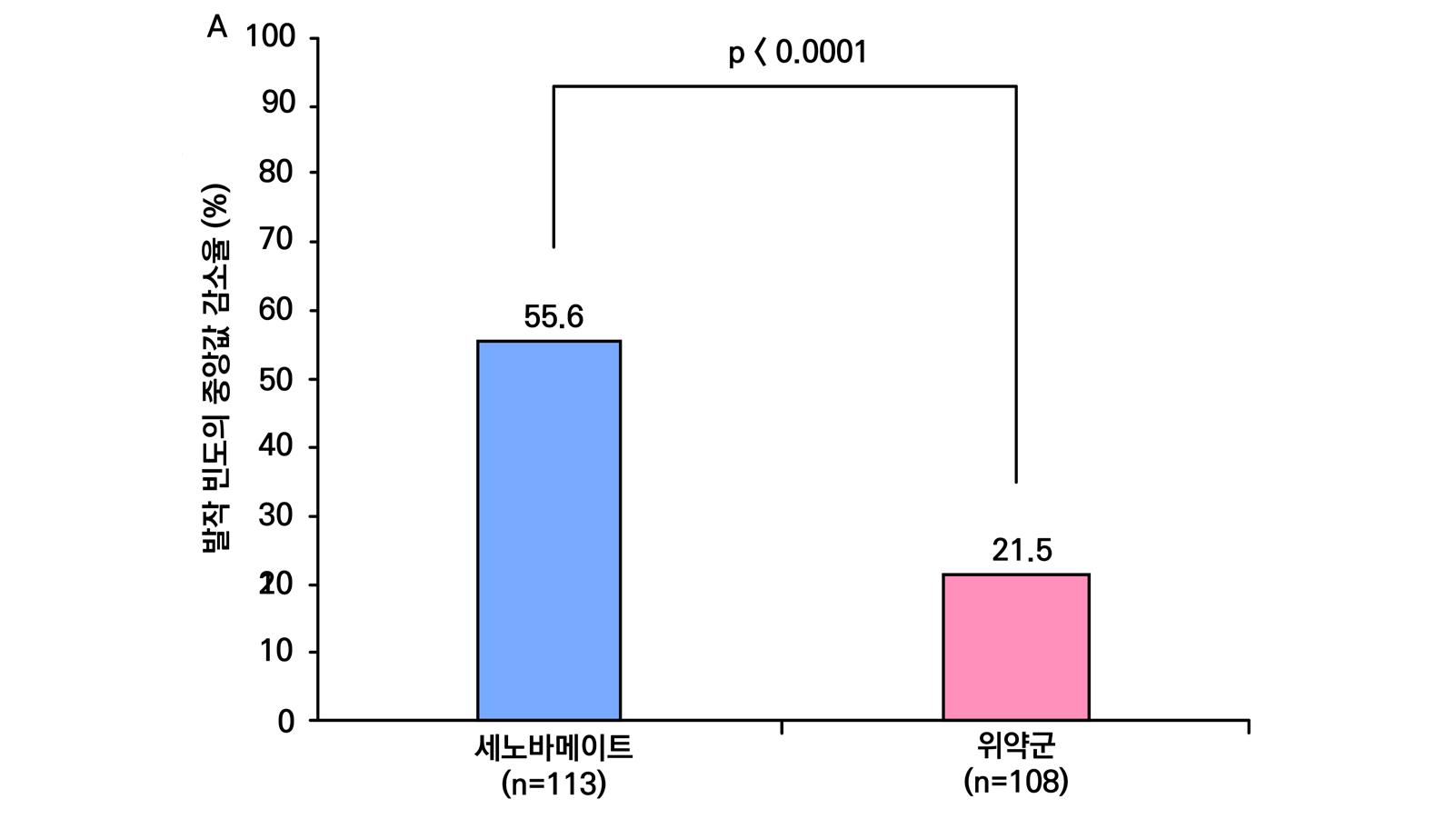
45] 12주 치료 기간 동안의 발작 빈도 중앙값 감소율 [그림 46] 12주 치료 기간
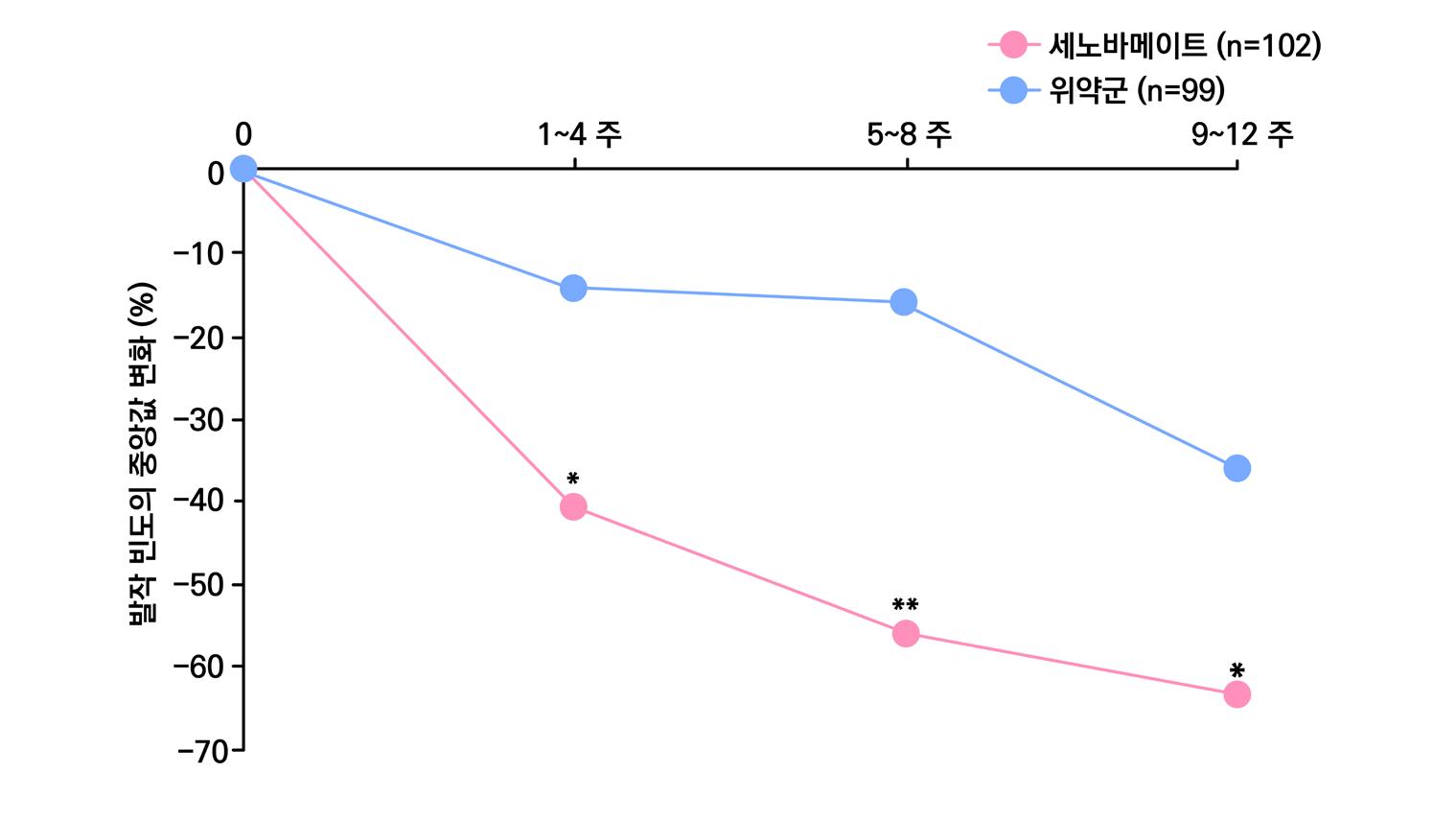
(2) Secondary Outcome
본 연구의 2차 평가변수는 기저치 대비 12주 치료 기간 동안 단순 운동성 국소 발작, 복합 국소 발작, 이차성 전신 강직 간대발작의 28일 발작 빈도가 50% 이상 감소한 환자의 비율이다. [그림
47]은 각 발작 유형별 분석 결과로, 좌측부터 단순 운동성 국소 발작 환자의 76.3%, 의식 장애 를 동반한 복합 국소 발작 환자의 55.6%, 이차성 전신 강직 간대발작 환자의 77.0%에서 50%
이상의 발작 빈도가 감소하였다. 이러한 세 유형 모두에서 p-value가 0.05 미만으로 세노바메
이트는 위약 대비 통계적으로 유의한 차이를 보인다. [그림 48]의 50% 이상 발작 감소를 보인 환 자 비율은 세노바메이트 투여군에서 50.4%, 위약군에서 22.2%였으며, 군 간 차이는 28.2%p
로 유의한 차이를 보인다. (p < 0.0001)
[그림 47] 발작 유형별 12주간 발작 빈도 중앙값 감소율 비교
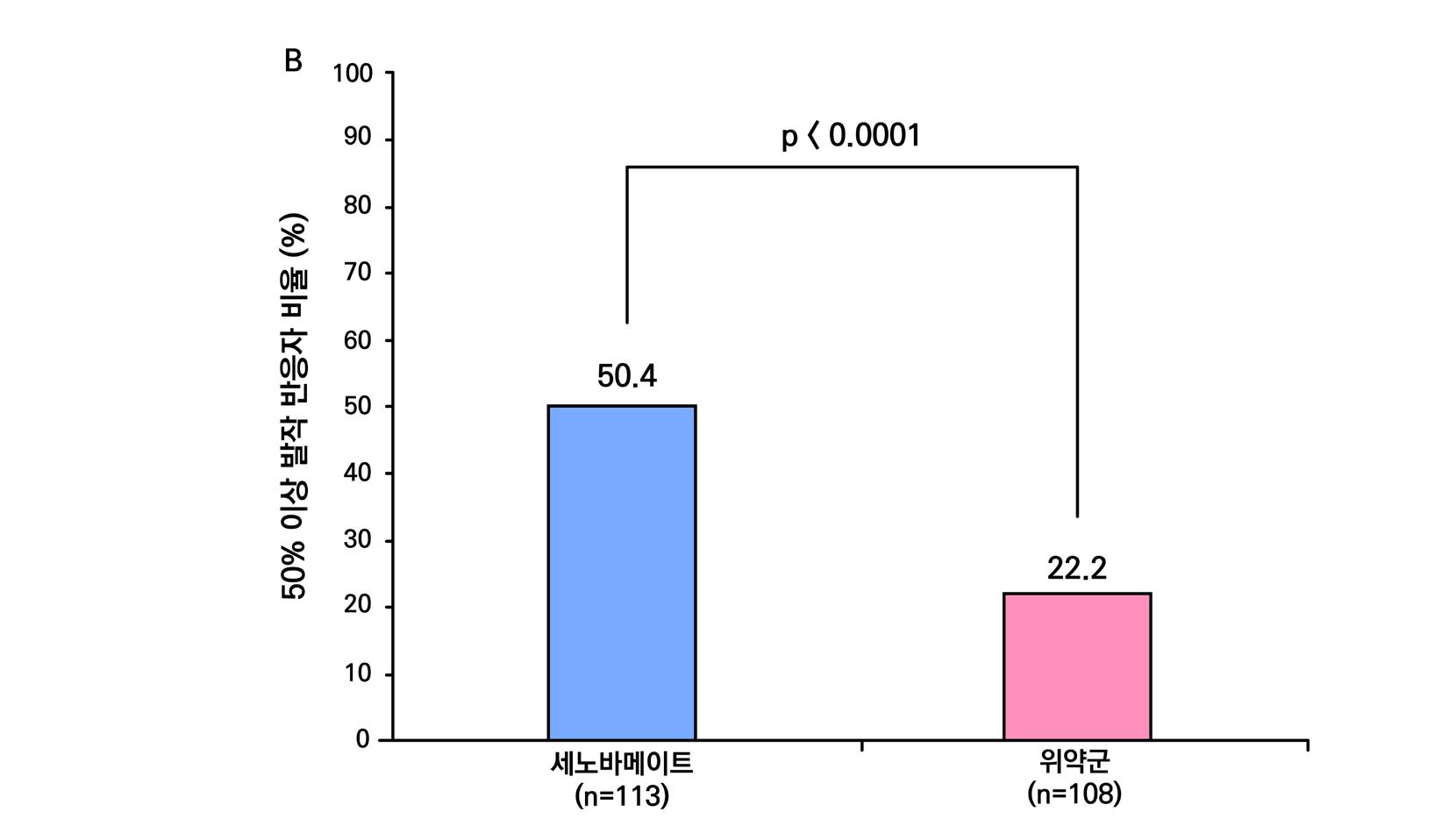
[그림 48] 50% 이상의 발작 빈도 감소를 보인 환자 비율
이외의 추가 분석에서는 [그림 49]에 제시된 바와 같이, 발작 빈도가 75% 이상 또는 90% 이 상 감소한 환자 및 완전 발작 소실에 도달한 환자의 비율이 보고되었다. 해당 지표들에 대한 pvalue는 모두 0.05 미만으로 통계적으로 유의하였으며, 세노바메이트 투여군은 위약군에 비해 교차비(Odds ratio)가 2배에서 최대 6배까지 높게 나타나, 세노바메이트의 치료 효과가 다시 한 번 입증되었다.
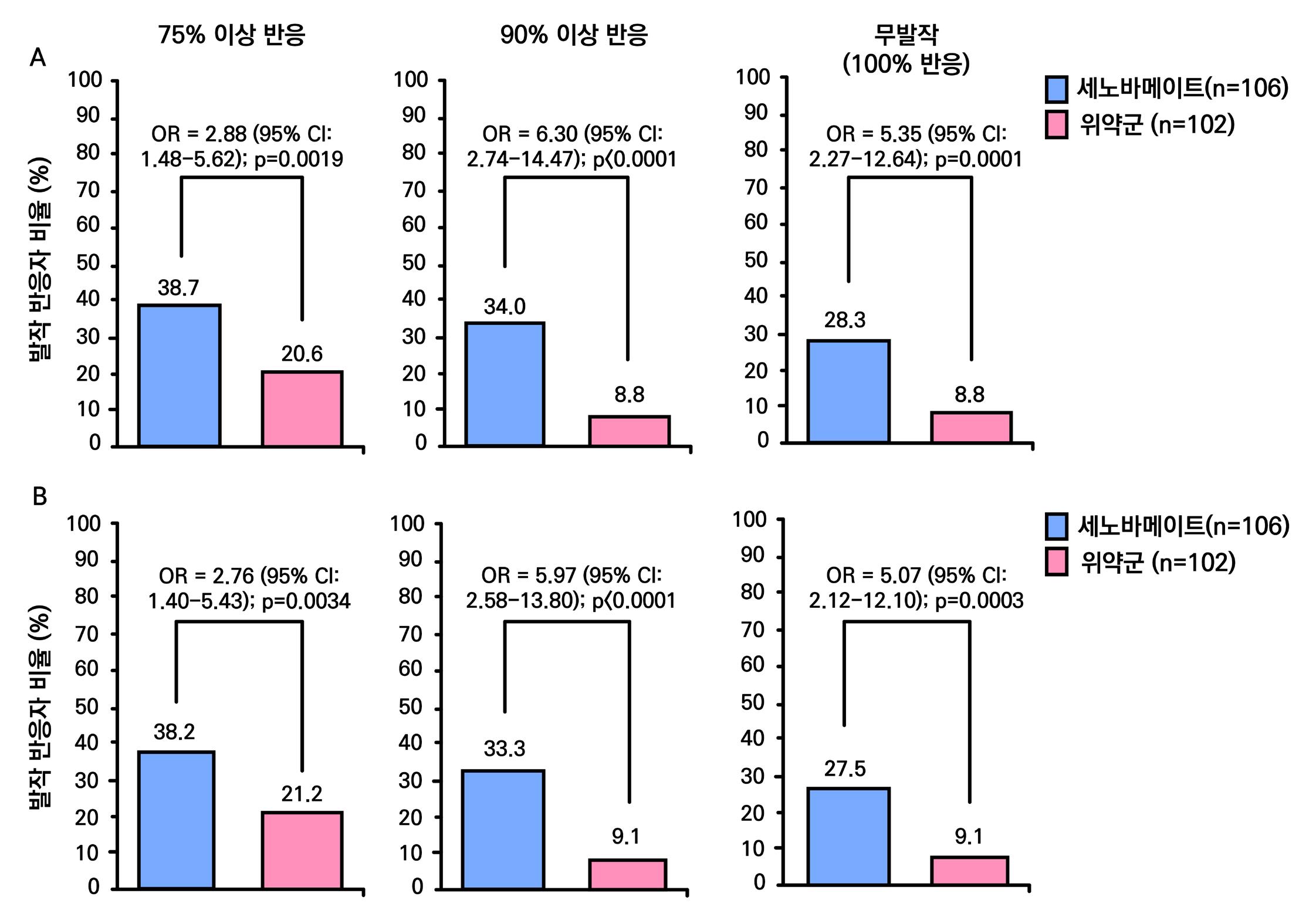
[그림 49] 세노바메이트의 발작 빈도 감소 효과 : 위약군 대비 반응률 (≥75%, ≥90%, 100%) 비교
[Adverse Events]
본 연구 기간 동안 사망 사례는 보고되지 않았으며, 심각한 이상사례는 세노바메이트군에서 3 명, 위약군에서 4명에서 각각 관찰되었다. 세노바메이트군에서는 약물 과민반응, 요로 감염, 뇌 전증 지속증이 각 한 명씩 보고되었으며, 위약군에서는 관상동맥 조영술상 이상 소견 없음, 경 련이 각각 1명, 뇌전증 지속증이 2명 보고되었다. 심각하지 않은 이상사례는 세노바메이트군의 76.11%, 위약군의 63.3%에서 보고되었으며, 이 중 발생률 5% 이상의 이상사례는 위장관 질
환, 전신 증상, 신경계 이상, 감염, 정신질환 등으로 분류되었다. 세노바메이트군에서는 위약군 대비 소화기 증상 및 피로, 졸림, 어지러움 등 신경계 관련 이상반
응이 더 자주 보고되었으며, 이 중 메스꺼움, 피로, 졸림, 어지러움, 두통은 10% 이상의 환자에 서 발생하였다.
더 많이 보고되었다. 본 임상시험은 기존 항경련제 치료에도
수행되었으며, 세노바메이트 200mg 투여군에서
인되었다. 또한, 대부분의 약물 이상사례는 경증 내지
수준으로 나타났으며, DRESS 증 후군은 보고되지 않았다. 따라서, 세노바메이트는
안전성 측면에서도 임상적으로 충분한 근거를 확보한 약물로 평가된다.
Efficacy of Cenobamate for Uncontrolled Focal Seizures: Post-hoc Analysis of a Phase 3, Multicenter, Open-label Study
[ Study Design ]
본 연구는 치료 저항성 국소 발작 환자를 대상으로 세노바메이트(Cenobamate, 개발 초기 코 드명 YKP3089)의 안전성, 내약성 및
평가하기 위한 제3상, 다기관, 공 개 라벨 임상시험이다. 이 임상시험은 세노바메이트를 1~3개의 항경련제(ASMs)를 복용하고 있 음에도 발이 조절되지 않는 성인 환자를 대상으로 진행되었다.
연구 설계는 12주간의 용량 적정 기간(titration phase)과 이후 유지 기간(maintenance phase)으로 구성된다. 용량 적정 기간 동안 세노바메이트는 2주 간격으로 증량되어 목표 용량인 200mg/일로 투여되었고, 이후 유지 기간에는
나아가 이 연구의 주요 효능 결과는 사후 분석(post-hoc analysis)을 통해 얻어졌다. 사후 분
석은 임상시험 설계 단계에서 미리 계획되지 않은 추가 분석을 의미하며, 새로운 가설을 탐색하 거나 데이터에서 예상치 못한 패턴을 발견하기 위해 수행되는 연구 방식이다. 이는 연구 결과를
보강하고 약물의 잠재적 효과에 대한 추가적인 정보를 제공할 수 있다는 장점을 가진다.
[ Participation ]
본 임상시험의 참가 자격은 남녀 모두 가능하고, 연령은 18세부터 65세까지로 제한되었으며 건 강한 지원자는 허용되지 않았다. 치료 저항성 국소 발작을 가진 성인 환자 총 255명이 등록되었 으며, 스크리닝 단계에서 15명이 제외되어 240명이 최종적으로 효능 평가에 포함되었다. 미국
내 10개 기관에서 실시되었고, 연구 시작 시점에서 대상 환자들의 28일 기준 월평균 발작 횟수( 중앙값)는 2.8회(평균 18.1회)였으며, 데이터 종료 시점까지 240명 중 177명(73.8%)이 세노
바메이트 치료를 지속하고 있었다. 참가자 포함
기준, Baseline characteristics, 그리고 Participant flow는 아래의 [표 43], [표 44], [표 45]와 같다.
[표 47] NCT02535091 임상의 Participant criteria
포함기준(Inclusion criteria)
1. 남녀 모두 참여 가능하며, 서면 동의서에 서명하는 시 점 기준으로 만 18세 이상 70세 이하이어야 한다.
2. 체중이 30kg 이상이어야 한다.
3. 연구에 참여하기 전에, ICH GCP 가이드라인에 따 라 피험자 본인 또는 법적 보호자가 서면 동의서에 서명 해야 한다.
4. 국제간질연맹(ILAE) 기준에 따라 부분 간질(partial epilepsy)으로 진단된 환자여야 한다. 이때 진단은 “임 상 병력과 국소 관련 간질과 일치하는 뇌파검사(EEG)” 를 통해 이루어져야 한다.
5. 최근 약 2년 이내에 최소 1개 이상의 항간질제(AED) 로 치료를 받았음에도 불구하고 발작이 조절되지 않아 추가 치료가 필요한 환자여야 한다.
6. 현재 안정적인 항간질 치료요법을 받고 있어야 하며, 기준일 이전 최소 3주 이상 1~3개의 항간질제를 안정적 으로 복용하고 있어야 한다.
7. 과거 10년 이내에 뇌전증의 진행성 원인을 배제하기 위해 CT 또는 MRI 촬영을 완료했어야 한다.
8. 전화 연락이 가능한 환자여야 한다.
9. 임신 가능성이 있는 여성 환자는 적절한 피임 방법을 사용해야 한다.
제외기준(Exclusion criteria)
1. 약물에 의한 중증 과민반응(스티븐스-존슨 증후군, 독성표피괴사용해증, 호산구 증가 및 전신 증상 동반 약 물반응 등) 또는 입원이 필요한 약물 유발 발진 이력이 있는 경우
2. 약물에 의한 발진이나 과민반응 이력이 있는 경우
3. 1촌 이내 가족(부모, 자녀, 형제자매)에게 중증 약물 유발 피부 부작용 이력이 있는 경우
4. 심각한 전신 질환(간 기능 부전, 신장 기능 부전, 악 성 종양 등)이 있거나, 생존 예후가 3개월 미만인 질병 이 있는 경우
5. 페니토인(Phenytoin)을 복용 중인 환자는 페노바르 비탈(Phenobarbital)이나 프리미돈(Primidone)을 함 께 복용할 수 없고, 반대로 페노바르비탈을 복용 중이면 페니토인 또는 프리미돈 복용 금지
6. 페니토인 또는 페노바르비탈 외의 다른 항간질제를 복용하는 환자도 추가로 페니토인, 페노바르비탈, 프리 미돈을 복용하면 안 됨
7. 페니토인 또는 페노바르비탈 독성 증거가 임상적으로 있는 경우
8. 비간질성 발작이나 정신성 발작 이력이 있는 경우
9. 운동 증상이 없는 단순 부분 발작만 있거나, 일차성 전신성 간질을 가진 경우
10. 첫 방문 후 8개월 이내 간질 수술 예정이 있는 경
11. 임신 중이거나 수유 중인 여성
12. 중대한 정신과 질환, 심리적 또는 행동 문제가 있어 연구 참여에 방해가 된다고 연구자가 판단하는 경우
13. 항정신병 약물 복용 이력으로 확인된 정신병적 장애 또는 불안정한 기분장애가 있거나, 최근 6개월 내 주요
우울삽화 이력이 있는 경우
14. 최근 2년 이내 알코올 중독, 약물 남용, 약물 중독 이력이 있는 경우
15. 펠바메이트(Felbamate)를 18개월 미만 복용한 환 자
16. 최근 1년 이내 비가바트린(vigabatrin) 또는 에조 가빈(ezogabine) 사용 이력이 있는 경우 (과거 에조가 빈 사용자는 망막 색소병증과 유사한 안저 이상 소견이 없어야 함)
17. 절대 호중구 수(ANC)가 1500/μL 미만
18. B형 간염, C형 간염, HIV 검사 양성 이력이 있는 경우
19. 선천성 짧은 QT 증후군을 가진 환자
20. YKP3089(세노바메이트) 복용 경험이 있는 경우
[표 48] NCT02535091 임상의 Participant Baseline characteristics
환자 수 240명(post hoc study 포함)
연령 평균 41.8세 (range: 18-70세)
성별 남성 56.3%(135명) 여성 43.8%(105명)
체중 최소 30kg 이상 (Inclusion 기준)
인종 백인 84.6%, 흑인 8.8%, 히스패닉 5.0%, 아시아인 1.7%
간질 유형 국제간질연맹(ILAE) 기준 focal (partial-onset) epilepsy 진단
기저 발작 빈도 중앙값 2.8회/29일 평균 18.1회/28일 범위 0.2-562.3회
병용 ASM 88%가 2-3개 ASM 복용 (Top 3: Lacosamide 40.8%, Levetiracetam 37.1%, Lamotrigine 27.5%)
기저 영상 검사 최근 10년 이내 CT/MRI로 진단한 진행성 뇌 질환 배제
EEG 간질 진단은 병력+국소성 간질을 시사하는 EEG
기타 기준 전화 연락 가능해야 하며, 가임기 여성은 피임 필수
Arm/Group Title YKP3089 and Phenytoin YKP3089 and Phenobarbital YKP3089 and Other AEDs
Arm/Group Description
Reason Not Completed
Subjects taking phenytoin and cenobamate.
Subjects taking phenobarbital and cenobamate.
Subjects taking AEDs other than phenobarbital and phenytoin and taking cenobamate.
[ Intervention ]
장기 안전성 및 약동학을 평가하기 위해 진행된 NCT02535091 연구는 다국 가, 다기관, 개방형(open-label) 임상 3상 시험으로, 성인 환자의 조절되지 않는 부분발작을 대 상으로 하였다.
1) 투여 및 증량 방식 -초기 투여는 12.5 mg/day에서 시작하여 2주 간격으로 단계적 증량을 시행하였다. (12.5 → 25 → 50 → 100 → 150 → 200 mg/day)
-목표 용량은 200 mg/day였으며, 이후 환자의 내약성과 임상적 반응에 따라 400 mg/day
까지 증량이 허용되었다. (50 mg/day 단위, 2주 간격)
-감량은 연구자의 임상적 판단 하에 최소 50 mg/day까지 가능하였다.
-Cenobamate는 단독요법(monotherapy)으로는 허용되지 않았으며, 모든 환자는 기존 항 뇌전증약(ASMs) 1~3제를 안정적으로 복용하는 상태에서 보조요법(adjunctive therapy)으로 투여되었다.
2)치료 단계
선별 기간(Screening period): 최대 21일. 환자의 적격성 평가와 기저 발작 빈도 확인을 위한 기간으로, 안정적인 항뇌전증약(ASMs) 용량이 유지되었는지 검증하였다.
적정 기간(Titration phase): Cenobamate를 12.5 mg/day에서 시작하여 2주 간격으로
200 mg/day까지 12주 동안 단계적으로 증량하였다. 이 단계는 약물의 내약성 평가 및 초기 발
작 억제 효과를 확인하는 목적을 가진다.
유지 기간(Maintenance phase): 목표 용량(200 mg/day)에 도달한 이후, 환자의 임상 반응
에 따라 최대 400 mg/day까지 증량 가능하였다. 장기간 발작 억제 효과와 안전성을 관찰하는
핵심 단계이며, 최대 43개월까지 추적하였다.
추적 관찰: 치료 중단 시에는 점진적 감량(tapering)을 통해 중단하였으며, 이후 일정 기간 동
안 이상 반응 및 발작 재발 여부를 추적 관찰하였다.
3)환자 방문 및 안전성 관리
초기 16주 동안은 2주 간격으로 내원하였고, 이후에는 1~3개월 간격으로 방문하였다. 용량 적
정 과정에서 피부 발진, 과민반응(DRESS) 위험을 최소화하기 위해 저용량 시작 및 점진적 증량 이 도입되었다.
이와 같은 점진적 증량(intervention strategy)은 단기 위약-대조 연구에서 입증된 효능을 장
기적으로 검증하는 동시에, 안전성 확보를 위한 핵심 설계 요소였다. 실제로 C021 연구의 사후
분석 결과, 환자 상당수가 초기 적정 단계에서부터 발작 빈도의 유의한 감소를 경험하였으며, 장
기 유지 치료에서 높은 비율의 ≥50% 발작 감소 및 완전 발작 소실(100% seizure freedom)
사례가 보고되었다.
[표 50] NCT02535091 임상의 Intervention 요약 table
대상환자 기존에 1-3개의 Antiseizure Medication(ASM) 복용 중에도 조절되지 않는 부분발작 환 자(보조요법)
Intervention Cenobamate PO, 2주 간격으로 점진적 증량
Titration 12.5mg/day for 2 weeks 25mg/day for 2 weeks 50mg/day for 2 weeks 100mg/day for 2 weeks 150mg/day for 2 weeks 200mg/day for 2 weeks
Target Dose 200mg/day
Maintenance Phase 200mg/day 도달 후, 필요 시 50mg 단위로 증량하여 최대 400mg/day까지 가능
용량 조정 허용 Cenobamate와 병용 ASM 모두 용량 조정 가능
[Outcomes]
본 임상시험의 1차 목표는 장기간의 안전성 및 내약성 평가였으나, 사후 분석(post-hoc analysis)을 통해 효능 데이터가 보고되었다. 주요 효능 평가 지표는 발작 빈도 감소율과 발작 소실률 (seizure freedom rate)이었다.
** Main Efficacy Outcomes
• ≥50% 발작 감소 반응률: 전체 치료 기간 동안 50% 이상 발작이 감소한 환자의 비율은 71.7%(240명 중 172명)로 나타났다.
• ≥90% 발작 감소 반응률: 유지 기간 동안(중앙값 29.5개월) 90% 이상 발작이 감소한 환자 의 비율은 40.2%(214명 중 86명)였다.
• 100% 발작 소실 반응률: 유지 기간 동안 100% 발작 소실을 달성한 환자의 비율은 13.1%(214 명 중 28명)였다. 또한, 87명의 환자(36.3%)는 12개월 이상 연속으로 발작이 완전히 소실되 는 경험을 했다.
[표 51] NCT02535091 임상의 Main Efficacy Outcomes 요약 table
Treatment-Emergent Adverse Events (TEAs)
Serious Adverse Events (SAEs)
Drug-Related TEAE
Drug-Related SAE
Discontinuation Due to AEs
Death
[Pharmacokinetics]
Cenobamate 복용 후 발생한 모든 이상반응 총
89.6% 발생 (214/239명)
중대한 이상반응(ex. 입원 필요, 생명 위협 등)-
20.8%(50/240명)
약물과 관련 있는 이상반응-56.9% (136/239명)
약물 관련 중대한 이상반응 -4.6% (11/240명)
이상반응으로 인한 Cenobamate 치료 중단률 -11.2% (27/240명)
0.8%(2/240명)
세노바메이트는 용량에 비례하는 선형적인 약동학적 특성(linear pharmacokinetics)을 보였다.
• Cmax (최대 혈중 농도): 용량 증가에 비례하여 증가(dose-proportional increase)했다.
• Tmax (최대 농도 도달 시간): 약물 투여 후 4시간에서 8시간 사이에 도달했다.
• AUC (약물 노출량): Cmax와 마찬가지로 용량에 비례하여 선형적으로 증가했다.
• Half-life (t½, 반감기): 약 50시간에서 60시간으로 나타나, 1일 1회 복용(once-daily dosing)에 적합한 것으로 평가되었다.
• Steady-State Achievement: 장기 복용에도 특별한 축적 없이 안정적인 혈중 농도(steadystate)가 유지되는 것으로 확인되었다.
[표 52] NCT02535091 임상의 Pharmakokinetics 요약 table
Cmax 용량에 비례하여 증가 (dose-proportional increase)
Tmax 약 4-8시간 사이에 도달
AUC (Area Under the Curve) 용량에 비례하여 선형적으로 증가
Half-life (t1/2) 약 50-60시간
Dose-normalized PK 장기 복용에도 특별한 축적 없음 (steady-state에서 안정적 유지)
Steady-State Achievement 50-400mg/day 구간에서 선형적 관계 유지 (linear PK)
[Adverse Events]
이 연구는 장기간의
피로 (Fatigue): 34.6%
어지러움 (Dizziness): 32.1%
졸림 (Somnolence): 29.6%
이러한 이상사례는 다른 임상시험에서 보고된 것과
양상을 보였다. 특히 DRESS 증
후군(호산구증가증 및 전신증상을 동반한 약물 반응)과 같은 심각한 과민 반응을 최소화하기 위
해 낮은 초기 용량(12.5mg)과 느린 용량 적정 속도가 적용되었으며, 이는 위험을 줄이는 데 효
과적인 것으로 나타났다.
영국 급여
세노바메이트는 NICE에서 2021년 12월 15일에 성인 국소발작 치료를 위한 보조요법으로 급
여 승인되었다.
[권고 및 치료 적용 기준]
세노바메이트는 이차 전신화 발작 여부와 무관하게, 최소 두 가지 이상의 항경련제로 적절한 조 절이 이루어지지 않은 약물 난치성
용이 권고된다.
다만, 본 약물은
1. 최소 1가지 이상의 1차 추가 치료제가 발작
2. 다른 1차 추가 치료제들이 금기이거나 내약성이 부족한 경우
3. 뇌전증 치료에 전문성을 가진 의료인의 판단 하에 치료를 시작한 경우
사용이 권장된다.
본 권고는 본 가이드라인 발표 이전에 영국 NHS(National Health Service) 내에서 세노바메
이트 치료를 이미 시작한 환자에 대해서는 적용되지 않는다. 해당 환자들은 본 권고 외의 기준에
따라 치료를 지속할 수 있으며, 이는 환자 및 담당 의료진이 치료 중단을 고려하기 전까지 기존의
재정 지원 체계 하에서 유지된다.
[Price]
14정에서 28정으로 구성된 용량 조절 팩은 12.5mg에서 200mg까지 다양한 용량으로 제공되 며, 팩 당 가격은 £85.54~£165.62이다.
[표 53] 세노바메이트의 용량별 가격 (원화 환산 기준 : £1=1,850원)
[Cost Effectiveness]
(1) 자원 사용
임상 전문가로부터 추정된 자원 사용량은 실제 치료 비용을 과대평가했을 가능성이 있다. 회사
는 약물 내성 간질 환자에 대한 영국 내 자원 사용 관련 데이터가 존재하지 않으며, 자체적으로
데이터를 수집하지도 않았다고 밝혔다. 기본 분석에서는 28일 동안의 약물 투여, 정기 모니터링, 뇌전증 관리에 대한 비용을 포함했지만, 이는 대부분 임상의의 의견에 크게 의존한 것으로 판단 된다. 이를 기반으로 ERG는 회사가 추정한 28일 간의 건강 관리 비용이 기존에 발표된 모델보 다 높다고 평가하였다. 또한, Jacoby의 연구결과는 1993년에 수집한 것으로 현재 뇌전증의 치 료 방식이 많이 바뀐 만큼 유효성이 의심된다. 이러한 이유로 위원회는 자원 사용 추정치가 과대
평가되었기 때문에 회사와 Jacoby 추정치의 중간 수준일 것으로 보고 있다.
(2) 비용 효과성 추정 다음은 비용 효과성을 추정했을 때 위원회가 ERG의 기준 사례로부터의 선호하는 가정이다.
1. C013 및 C017 임상시험의 치료 기간 동안 수정된 무작위 배정 집단(modified intent-totreat, mITT) 자료를 활용하여 ERG의 위약 보정된 공동 종합 네트워크 메타분석 사용
2. 3가지 반응 수준을 기반으로 한 건강 상태 모델 사용
3. 전이 확률을 ERG 기준 사례와 동일한 방식으로 모델링
4. 6주기 이후 세노바메이트와 모든 비교 약물들의 중단률이 동일
5. 환자의 건강 관련 삶의 질을 평가하기 위한 유용성 값 자료는 사용 가능한 두 출처 모두를 반 영하여 분석
6. 간병인의 불편(disutility)은 ERG 기준 사례와 같이 분석에서 제외
위원회에서는 ERG의 기준 사례가 회사의 선호 가정 대부분을 포함하고 있다고 판단했다. 하지
만 ERG 기준 사례는 자원 사용에 대해서도 회사 측의 기본 가정과 동일한 가정을 사용하였다. 이에 대해 위원회는 비용-효과성 결과에 자원 사용이 중한 영향을 미치는 요소라고 판단하였으 며, 임상 전문가의 의견과 Jacoby 연구의 자원 사용 데이터를 이용한 범위를 고려하는 것을 선 호했다.
(3) NHS 자원의 비용-효과적 사용 위원회의 세노바메이트의 비용-효과성에 대한 평가 방법은 다음과 같다.
1. 3세대 항뇌전증제와 비교
2. Jacoby 연구를 기반으로 한 자원 사용 가정 적용
첫째, 브리바라세탐 아세테이트(Brivaracetam acetate), 에슬리카바제핀 아세테이트(Eslicarbazepine acetate), 라코사미드(Lacosamide), 페람파넬(Perampanel) 등의 다른 3세 대 약물들과 비교하여 고려하는 것이다. 브리바라세탐 대비 £51,967, 에슬리카바제핀 대비
£21,080, 라코사미드 대비 £33,619, 페람파넬 대비 £28,296의 비용이 절감되었으며, 각각 1 인당 생애 주기 동안 QALY는 각각 1.047, 0.598, 0.776, 0.703 증가하였다. 해당 접근에서
세노바메이트의 장기 복용에 대한 근거가 제한적이고 이상 반응 프로파일에 대한 불확실성 및 일
부 비교 약물의 분석 누락이 존재함에도 불구하고, 세노바메이트는 비교된 약제 대비 더 높은 효
과와 더 낮은 비용을 나타내는 약물로 평가되었다. 즉, 세노바메이트는 다른 3세대 항뇌전증제에
비해 우월한 치료제로 판단되었다.
둘째, 자원 사용에 대한 가정은 Jacoby 연구를 기반으로 하여 적용되었다. 이 경우 세노바메 이트는 임상적으로 더 효과적이나, 비용은 더 많이 소요되는 치료제로 분석되었으며, 이때 산출
된 ICER은 £20,522/QALY로 나타났다. 이는 환율 £1=1,850원을 기준으로 환산할 경우, 약 3,800만원/QALY에 해당한다.
위원회는 Jacoby 연구에서 제시된 자원 사용 추정치가 실제 임상시험에서의 비용을 과소평가
했을 가능성이 높다고 판단하였다. 또한, ICER 분석에는 간병인의 삶의 질 향상과 같은 추가적인 잠재적 이점들이 반영되지 않았다고 판단하였다. 이러한 요소들을 종합적으로 고려한 결과, 위원 회는 임상적 근거의 불확실성과 비교 약물과의 제한적인 비교 분석에도 불구하고, 세노바메이트 가 약물 내성 뇌전증 치료에 있어 NHS 자원의 비용-효과적 사용에 부합한다고 결론지었다. 아 울러, 일부 임상 전문가들은 세노바메이트가 향후 임상시험을 통해 효과성과 안전성이 추가로 입 증된다면 보다 이른 치료 단계에서도 사용될 수 있다는 의견을 제시하였다. 그러나 현재 시점에 서는 이를 뒷받침할 수 있는 충분한 근거가 부족하다고 판단되었다.
이에 따라 위원회는 세노바메이트의 급여 적용 기준을 다음과 같이 명시했다.
1. 최소 한 가지 이상의 추가 치료제로도 발작이 조절되지 않은 경우에 한하여, 추가 치료 요법 으로 사용
2. 치료는 뇌전증 전문 센터에서 시작되어야 함
-총론
Latimer, D. R., Edinoff, A. N., Ruff, R. D., Rooney, K. C., Penny, K. M., Patel, S. B., … Kaye, A. D. (2021). Cenobamate, a sodium channel inhibitor and positive allosteric modulator of GABAA ion channels, for partial-onset seizures in adults: A comprehensive review and clinical implications. Neurology International, 13(2), 252–265. https://doi.org/10.3390/neurolint13020026
U.S. Food and Drug Administration. (2019, November 21). Approval Package: Xcopri (cenobamate) tablets for the treatment of partial-onset seizures in adult patients [NDA 212839Orig1s000]. Retrieved from https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/212839Orig1s000Approv.pdf
허경. (2024). ‘세노바메이트’ 국내 도입 지연에 대한 어느 의사의 유감. 닥터닥터. Retrieved from https://www. docdocdoc.co.kr/news/articleView.html?idxno=3018602
-허가
European Medicines Agency. Ontozry (cenobamate) [EPAR product information].EMA. Retrieved from https://www.ema.europa.eu/en/medicines/human/EPAR/ontozry
-임상
Bialer, M., Johannessen, S. I., Levy, R. H., Perucca, E., Tomson, T., & White, H. S. (2013). Progress report on new antiepileptic drugs: a summary of the Eleventh Eilat Conference (EILAT XI). Epilepsy research, 103(1), 2-30.
Chung, S. S., French, J. A., Kowalski, J., Krauss, G. L., Lee, S. K., Maciejowski, M., ... & Kamin, M. (2020). Randomized phase 2 study of adjunctive cenobamate in patients with uncontrolled focal seizures. Neurology, 94(22), e2311-e2322.
ClinicalTrials.gov. (2022.04.11). Efficacy and Safety of YKP3089 in Subjects With Treatment Resistant Partial Onset Seizures. Retrieved from https://clinicaltrials.gov/study/NCT01397968
ClinicalTrials.gov. (2025.06.24). A Double-Blind, Randomized, Placebo-Controlled, Phase 2 Trial of YKP3089 as Adjunctive Therapy in Subjects With Partial Onset Seizures. Retrieved from https:// clinicaltrials.gov/study/NCT01866111?term=NCT01866111&rank=1&tab=results
French JA, Chung SS, Krauss GL, Lee SK, Maciejowski M, Rosenfeld WE, Sperling MR, Kamin M. Long-term safety of adjunctive cenobamate in patients with uncontrolled focal seizures: Openlabel extension of a randomized clinical study. Epilepsia. 2021 Sep;62(9):2142-2150. doi: 10.1111/ epi.17007. Epub 2021 Jul 13. PMID: 34254673; PMCID: PMC8456960.
Klein, P., Aboumatar, S., Brandt, C., Dong, F., Krauss, G. L., Mizne, S., Sánchez-Álvarez, J. C., Steinhoff, B. J., & Villanueva, V. (2022). Long-term Efficacy and Safety From an Open-Label Extension of Adjunctive Cenobamate in Patients With Uncontrolled Focal Seizures. Neurology, 99(10), e989–e998. https://doi.org/10.1212/WNL.0000000000200792
Krauss, G. L., Klein, P., Brandt, C., Lee, S. K., Milanov, I., Milovanovic, M., Steinhoff, B. J., & Kamin, M. (2020). Safety and efficacy of adjunctive cenobamate (YKP3089) in patients with uncontrolled focal seizures: a multicentre, double-blind, randomised, placebo-controlled, dose-response trial. The Lancet. Neurology, 19(1), 38–48. https://doi.org/10.1016/S1474-4422(19)30399-0
Rosenfeld, W. E., Nisman, A., & Ferrari, L. (2021). Efficacy of adjunctive cenobamate based on number of concomitant antiseizure medications, seizure frequency, and epilepsy duration at baseline: A post-hoc analysis of a randomized clinical study. Epilepsy research, 172, 106592. https://doi. org/10.1016/j.eplepsyres.2021.106592
SK Life Science Inc. (2019). Protocol YKP3089C021, Amendment 5: An open-label, multicenter, safety and pharmacokinetic study of YKP3089 as adjunctive therapy in subjects with partial onset seizures [Unpublished clinical study protocol].
Sperling, M. R., et al. (2021). Efficacy of cenobamate for uncontrolled focal seizures: Post hoc analysis of a phase 3, multicenter, open-label study. Epilepsia, 62(12), 3005–3015. https://doi.org/10.1111/ epi.17091
U.S. National Library of Medicine. (2025). Study to assess long term safety, tolerability and pharmacokinetics of adjunctive YKP3089 in subjects with partial onset seizures. ClinicalTrials.gov. Retrieved from https://clinicaltrials.gov/study/NCT02535091
European Medicines Agency. (2021.03.26). Ontozry (cenobamate) [Authorisation details]. EMA. Retrieved from https://www.ema.europa.eu/en/medicines/human/EPAR/ontozry#authorisationdetails
Laskier, V., Agyei‐Kyeremateng, K. K., Eddy, A. E., Patel, D., Mulheron, S., James, S., ... & Sander, J. W. (2023). Cost‐effectiveness of cenobamate for focal seizures in people with drug‐resistant epilepsy. Epilepsia, 64(4), 843-856.
National Institute for Health and Care Excellence. (2021.12.15). Cenobamate for treating focal onset seizures in epilepsy [Technology appraisal guidance; TA753]. Retrieved from https://www.nice.org. uk/guidance/ta753
상, 운영 주체, 급여 범위, 약가 협상 구조에 있어 서로 상이한 특성을 보인다.
공보험은 전체 의료 서비스의 약 30~40%를 담당하며, 주로 미국 정부에 의해 운영된다. 대표
적인 공보험에는 메디케어(Medicare)와 메디케이드(Medicaid)가 있으며, 각각 고령자 및
애인, 저소득층을 주요 대상으로 한다. 공보험은
제공에 초점을 맞추고 있다. 공보험 수혜자의 경우, 일부 비용 분담이 발생하나 상대적으로 낮은
본인부담금 구조를 가진다.
반면, 사보험은 민간 보험사가 주도하며 전체 의료 서비스의 약 60~70%를 부담한다. 고용주 기반 보험이나 시장 기반 보험이 대표적인 형태이다. 사보험은 모든 국민이 가입 가능하며, 보험
플랜별로 보장 범위나 본인부담금이 상이하다. 사보험 시스템 하에서는 보험사가 약제의 급여 여
부 및 본인부담금 수준을 독자적으로 설정할 수 있어, 보험사 간 혹은 플랜 간 치료 접근성에 차
이가 생길 수 있다.
미국 보험 시스템의 또 다른 특징은 PBM(Pharmacy
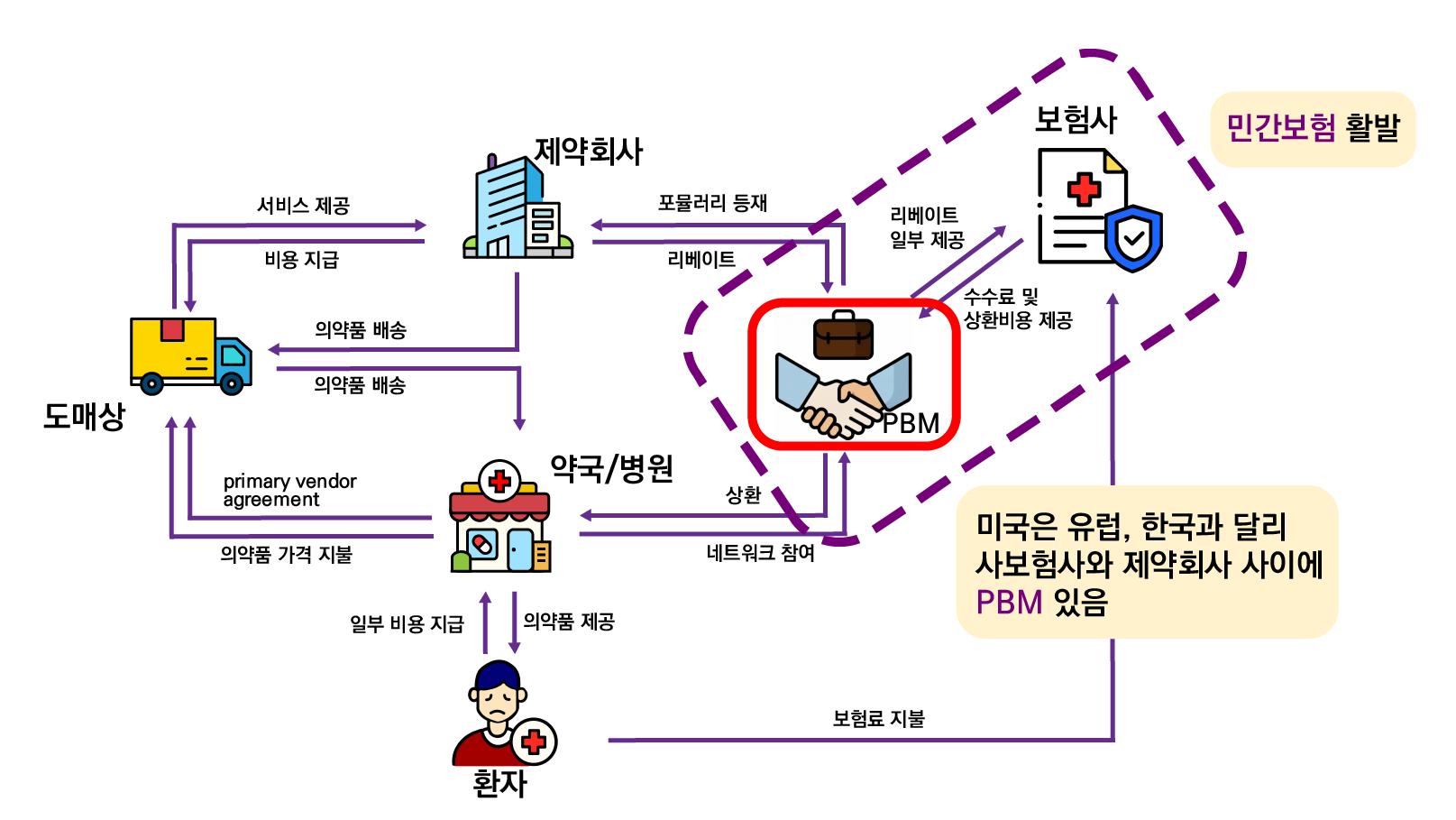
[그림 50] 미국의 보험 시스템
PBM은 포뮬러리(Formulary)를 관리하는 역할을 맡으며, 제약사로부터 리베이트를 수령하고, 그 결과에 따라 특정 약물이 포뮬러리 내 어느 위치에 배치될지를 결정한다. 포뮬러리는 통상적
으로 Tier 1부터 Tier 5까지로 분류되며, 낮은 티어에 위치할수록 우선 처방 및 낮은 본인부담
금 혜택이 주어진다. 제약사는 자사 약물이 높은 우선순위에 배치되도록 하기 위해 PBM과 리베
이트 협상을 진행하게 된다.
[표 54] PBM 포뮬러리 포뮬러리 구조 (Formulary structure) 2
Tier
Tier 4
Tier 5
미국의 약가 결정의 출발점은 WAC(Wholesale Acquisition Cost)와 ASP(Average Sales Price) 개념이다. WAC는 제약회사가 책정한 표시 가격(list price)으로, 할인이나 리베이트가 반영되기 전의 도매가이다. 반면 ASP는 도매상이 실제로 제약사에 지불하는 실질 공급 가격(net price)이며, 일반적으로 WAC의 70~80% 수준으로 설정된다. 제약사는 도매상에게 ASP 수준 으로 의약품을 공급하고, 도매상은 이를 약국이나 병의원에 유통한다
이후 환자는 병의원이나 약국에서 의약품을 구매하게 되며, 보험사가 설정한 본인부담금을 지 불한다. PBM은 제약사로부터 리베이트를 일정 수준 확보하며, 리베이트 금액은 WAC와 ASP
의 차액에 해당한다. 제약사 입장에서는 PBM과의 리베이트 협상에서 유리한 위치를 확보하기 위해, 자사 제품이 포뮬러리 내 우선순위 높은 티어(Tier 1 또는 2)에 등재되도록 전략적으로 접 근할 필요가 있다.
PBM의 포뮬러리 구조는 보통 2~5단계 티어로 구성되어 있으며, 제네릭 의약품은
에, 브랜드 의약품은 선호도나 가격에 따라 하위 티어에 배치된다. 포뮬러리에 등재되지 않거나
낮은 티어에 위치한 제품은 비급여 취급되어 환자의 비용 부담이 높아질 수 있다. 이에 따라 제
약사는 PBM과의 협상에서 리베이트 제공을 통해 자사 의약품을 상위 티어에 배치시키는 전략
을 활용하게 된다.
PBM 등재 전략은 크게 두 가지로 나뉜다. 첫째, 높은 WAC 정책은 제약사가 WAC를 의도적
으로 높게 설정하고, PBM에 큰 폭의 리베이트를 제공함으로써 높은 티어 진입을 도모하는 방식 이다. 이 전략은 시장 지배력이 강한 대형 PBM에 유효할 수 있다. 둘째, 낮은 WAC 정책은 리베 이트 규모를 줄이는 대신, 초기 WAC 자체를 낮게 설정하는 방식으로, 주로 소형 PBM 또는 가 격 민감도가 높은 보험 시장에서 적용된다. 어느 전략을 채택하느냐는 PBM의 성격, 시장 점유 율, 보험 설계자에 따라 달라지며, 제약사의 마케팅 목표 및 수익 구조에 따라 유연하게 조정된다.
미국에서는 보험 상품 간 급여 범위와 비용 구조가 다양하게 존재하기 때문에, 환자는 본인의 의
료 이용 패턴과 재정 여건에 따라 적절한 보험을 선택해야 한다. 보험 선택 시 고려되는 주요 기 준은 다음과 같다.
Premium(월 보험료) : 보험 유지에 필요한 기본 비용으로, 보험료가 낮을수록 부담은 줄지만 커버 범위가 제한될 수 있다.
Deductible(연간 본인부담금) : 보험 혜택을 받기 전 환자가 자비로 부담해야 하는 금액으로,
Deductible이 낮은 보험은 병원을 자주 방문하는 환자에게 유리하다.
Formulary(약 목록) : 보험에서 급여 대상으로 인정하는 의약품 목록으로, 복용 중인 약물이 포 뮬러리에 포함되어 있지 않다면 보험 혜택이 적용되지 않는다.
Network(계약 의료기관) : 약국, 병원, 의사가 해당 보험사의 네트워크에 포함되어 있는지 여부
를 뜻하며, 네트워크 외 의료기관에서는 보험 혜택을 거의 받을 수 없다.
Co-pay / Co-insurance (본인 부담금) : 보험사와 환자가 공동으로 부담하는 의료비 항목으
로, 각 보험 플랜 간 부담 비율이 다르기 때문에 비교가 필요하다.
미국의 약가 관리 체계에서 중심적인 역할을 수행하는 PBM(Pharmacy Benefit Manager) 시장은 현재 CVS Caremark, Express Scripts, OptumRx가 주도하고 있으며, 이들 3개 업체 가 전체 시장의 약 80%를 점유하고 있다. CVS Caremark는 모회사인 CVS Health를 기반으 로 약 34%의 가장 높은 시장 점유율을 차지하고 있으며, 그 뒤를 이어 Cigna 산하의 Express Scripts가 약 23%, UnitedHealth Group 산하의 OptumRx가 약 21%를 차지하고 있다. 이 들 상위 3개 PBM은 미국 내 대부분의 보험
브리비액트(brivaracetam) Express Scripts의 2024년 포뮬러리 기준에서 Tier 3 등급에 등
재되어 있다. Express Scripts의 Tier 기준에 따르면 Tier 3는 비선호 오리지널 약제 혹은 일부
비선호 제네릭 의약품이 포함되는 등급으로, 환자의 본인부담금이 높고, 약국이나 보험사가 처방
제한을 둘 수 있는 가능성이 크다. 브리비액트는 항뇌전증제로서 항경련제군 내 경쟁 약물들 사
이에서 우선순위가 낮게 평가되어 해당 등재 위치에 머무르고 있는 상황이다.
브리비액트가 Tier 3에 등재된 주요 배경에는 몇 가지 시장적 요인이 존재한다. 첫째, 기존에
널리 사용되고 있는 경쟁 약물인 빔펫(lacosamide), 케프라(levitiracetam) 등의 존재로 인해 상대적인 우선순위가 낮게 평가되었다. 둘째, 3세대 항뇌전증제라는 약물 특성상 가격대가 높아
마지막으로, Express Scripts 측에
리베이트 조건이 충족되지 않아 포뮬러리
심으로 전개되고 있다. UCB는 2024년 자사 제품
인하하는 리베이트 정책을 시행하여 PBM과의 협상력을 제고하고자 하였다. 이는 환자의 접근성
을 개선하기 위한 적극적인 약가 전략의 일환이다. 동시에 브리비액트트의 안정성과 효과를 입증 한 임상 데이터를 기반으로 PBM 및 보험사 측의 신뢰를 확보하고 있으며,
내 등재 위치 개선을 도모하고 있다.
브리비액트의 마케팅 전략은
설계되어 있 으며, UCB 제약사가 이를 직접 운영하고 있다. 주요 대상은 상업 보험에 가입한 자격 보유 환자 로, 해당 환자들이 약가 부담을 줄일 수 있도록 실질적인 경제적 혜택을 제공하는 구조이다.
UCB는 ‘Patient Savings Card’를 통해 환자 본인부담금(Co-pay)을 낮추는 프로그램을 운 영 중이며, 이를 통해 30일 분량의 브리비액트를 최소 $10로 구매할 수 있도록 하고 있다. 카드 발급은 온라인 등록을 통해
감 카드 등록 지원, 재정 지원 옵션 안내, 보험 청구 가이드 등 다양한 역할을 수행하고 있다. 이 러한 구성은 단순한 약물 보급을 넘어 환자 중심의 통합적 지원 체계를 구축하고자 하는 전략적 접근으로 해석된다.
브리비액트 이와 같은 마케팅 전략을 통해 고비용 치료제에 대한 접근 장벽을 낮추고, 환자의 치 료 지속률 및 제품 충성도를
선택에도 복잡한 영향을 미치게 된다. 특히 PBM의 역할은 약물 접근성과 환자 부담 수준, 제약사의 전략에 지대한 영향을 미치기 때
문에, 뇌전증 치료제와 같은 만성 질환 치료제의 급여 전략 수립 시 반드시 고려되어야 할 요소 이다.
참고문헌
신재훈/이베스트투자증권. (2018.09.03). American Healthcare. 트럼프의 pbm 죽이기, 그리고 바이오시밀러 러. Retrieved from (Microsoft Word - 180903_\275\305\300\347\310\306_American Healthcare\ (\277\317\))
Adam J. Fein, Ph.D. Dr. Fein/ Drug Channels Institute. (2024.01.09). The Big Three PBMs’ 2024 Formulary Exclusions: Biosimilar Humira Battles, CVS Health’s Weird Strategy, and the Insulin Shakeup. Retrieved from https://www.drugchannels.net/2024/01/the-big-three-pbms-2024formulary.htm
Express Scripts Medicare. (2023.08.23). Express Scripts Medicare (PDP) 2024 Formulary (List of Covered Drugs) Retrieved from https://www.express-scripts.com/pdf/egwp/F0PA3P4A.pdf?utm
Kristi Martin/ The Commonwealth Fund. (2025.05.17). What Pharmacy Benefit Managers Do, and How They Contribute to Drug Spending. Retrieved from https://www.commonwealthfund.org/ publications/explainer/2025/mar/what-pharmacy-benefit-managers-do-how-they-contributedrug-spending
Mackenzie Bean/ Becker’s Hospital review.(2025.5.31). Top PBMs by 2024 market share. Retrieved from https://www.beckershospitalreview.com/pharmacy/top-pbms-by-2024-market-share/
3.5 테즈파이어 4.1 시장 동향
이병주 lbbjjj99@gmail.com
김주연 kjy57103@naver.com
이소은 leesoeun8797@gmail.com
안수연 sooyeonan0721@gmail.com
윤시원 seaone0228@gmail.com
이승연 seungyean103@naver.com
박소윤 tediee0123@gmail.com API
글로벌 의약품 시장 현황
뇌전증 치료제 시장 현황을 이해하기 위해 글로벌 의약품 시장 현황을 먼저 살펴보면 다음과 같
다. 세계 제약시장은 2023년 1.6조 달러에서 2028년 최대 2.24조 달러까지 지속적으로 성장
할 전망이다. 2019년부터 2023년 연평균 성장률은 6% 이었으며, 2024년부터 2028년까지는
약 7%로 예상된다. 이는 제약시장이 앞으로 더욱 빠르게 성장할 것임을 의미하며 이러한 전체
제약 시장의 성장 추세는 뇌전증 치료제 시장에도 긍정적인 영향을 미칠 것이다. 기업현황은 글 로벌 제약기업 상위 50개 회사 중 미국이 34%(17개 사)를 차지하며, 세계 제약시장을 주도하 고 있다. 1-3위 제약사는 Pfizer(미국) 913억 달러, AbbVie(미국) 561억 달러, Johnson & Johnson(미국) 501억 달러로, 글로벌 제약 시장에서 미국 기업들이 상위를 차지하며 주도하고 있다. 50대 제약기업 대부분이 미국(17개), 일본(6개), 독일(5개)로 선진국에 집중되어 있으며, 중국(4개), 인도(1개) 등이 뒤를 잇는다.
[그림 51] 글로벌 제약시장 규모 (2019~2028)
전 세계 제약회사의 연구개발 투자비용은 2023년 3,060억 달러에서 지속적으로 증가하여 2028년 3,770억 달러가 될 것으로 보인다. R&D 투자 상위 10대 제약사가 전체 투자규모의 38.1%를 차지할 것으로 예측되며, AbbVie와 Merck & Co. 등의 글로벌 대형 다국적 제약회 사는 매출액의 20% 이상을 R&D에 투자하고 있다.
[그림 52] 전 세계 제약 R&D 투자비용 및 전년 동기 대비 증감률
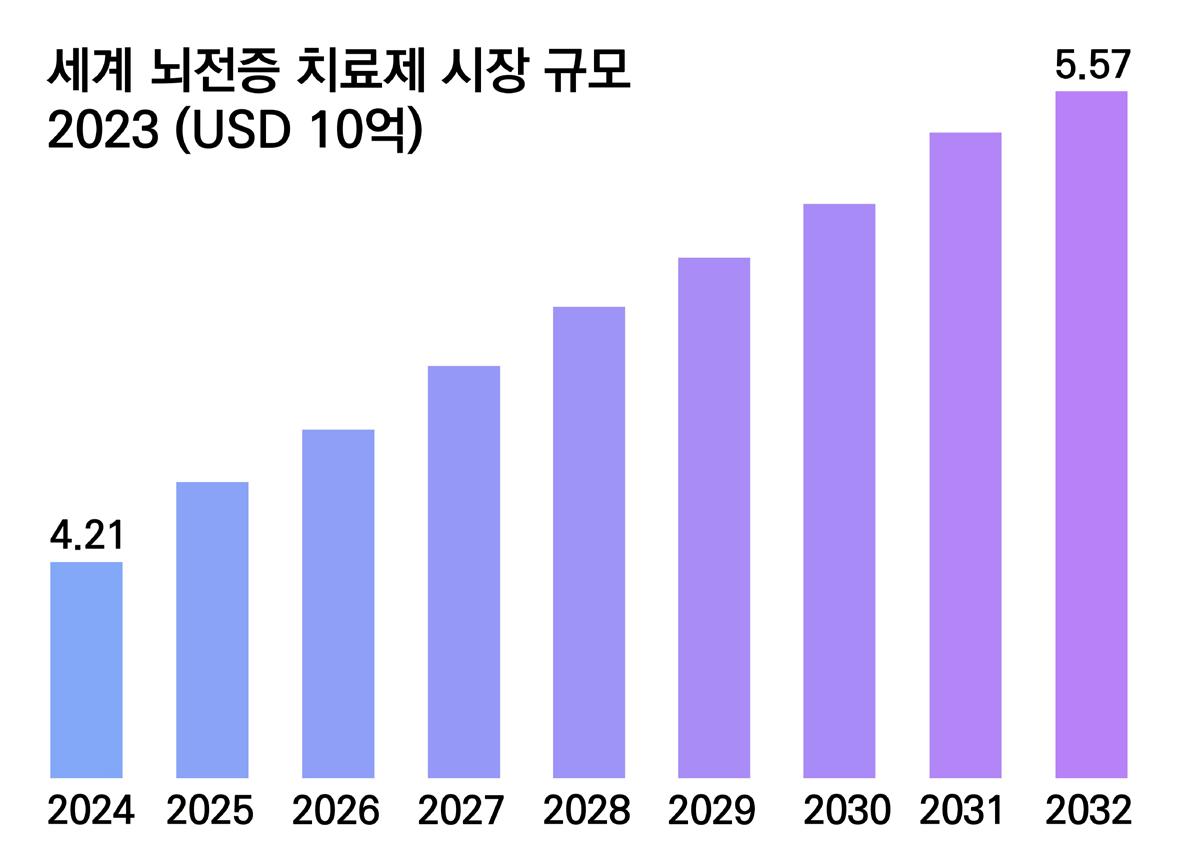
[그림 53] 세계 뇌전증 치료제 시장 규모 이와 같이, 전 세계적으로 신약 개발과 시장 확장이 활발히 이루어지고 있다. 그 중에서도 약물 난치성 뇌전증 시장은 2024년에 42만 달러에 달하였고 2024-2030년 예측 기간 동안 CAGR 3.2%로 성장하여 2030년에는 55만 달러에 달할 것으로 예측된다. CAGR (Compound Annual Growth Rate, 연평균 성장률)은 특정 기간 동안의 연간 복리 평균성장률을 의미한다. 단 순한 연평균과는 달리,
국내 뇌전증 치료제 시장은 연간 약 1300억 원에서 3400억 원 규모로 추산된다. 현재 이 시장
은 주로 다국적 제약사의 오리지널 약물들이 주도하고 있으며, 국내 제약사의 제네릭 제품들이
그 뒤를 잇는다. 연 매출 1200억원대의 대표적인 뇌전증 치료제인 프레가발린 제제와 레비티라 세탐 제제, 가바펜틴 제제의 2023년과 2024년 3분기 매출을 나타내는 자료가 이를 뒷받침한다. 리리카(프레가발린), 케프라(레비티라세탐)와 뉴론틴(가바펜틴)은 각각 Pfizer와 UCB가 개발한
오리지널 의약품이며 현재는 Viatris와 UCB에서 판매중이다. 그 외 카발린 (HK이노엔), 리리베 아 (대웅바이오), 에필라탐 (삼진제약), 큐팜 (명인제약), 네버펜틴 (대웅바이오), 가바페닌 (한미 약품)은 국내 제약사가 개발한 제네릭 의약품이다. 세 가지 제제 모두 다국적 제약사가 개발한 오 리지널 약물들의 제네릭이 시장 매출 1위를 차지하고 있으며, 상당히 큰 격차를 두고 2위부터 국
내 제약사 제네릭 제품이 위치하고 있다. 이는 국내 뇌전증 치료제 시장은 다국적 제약사 중심으 로 운영되고 있음을 나타낸다.
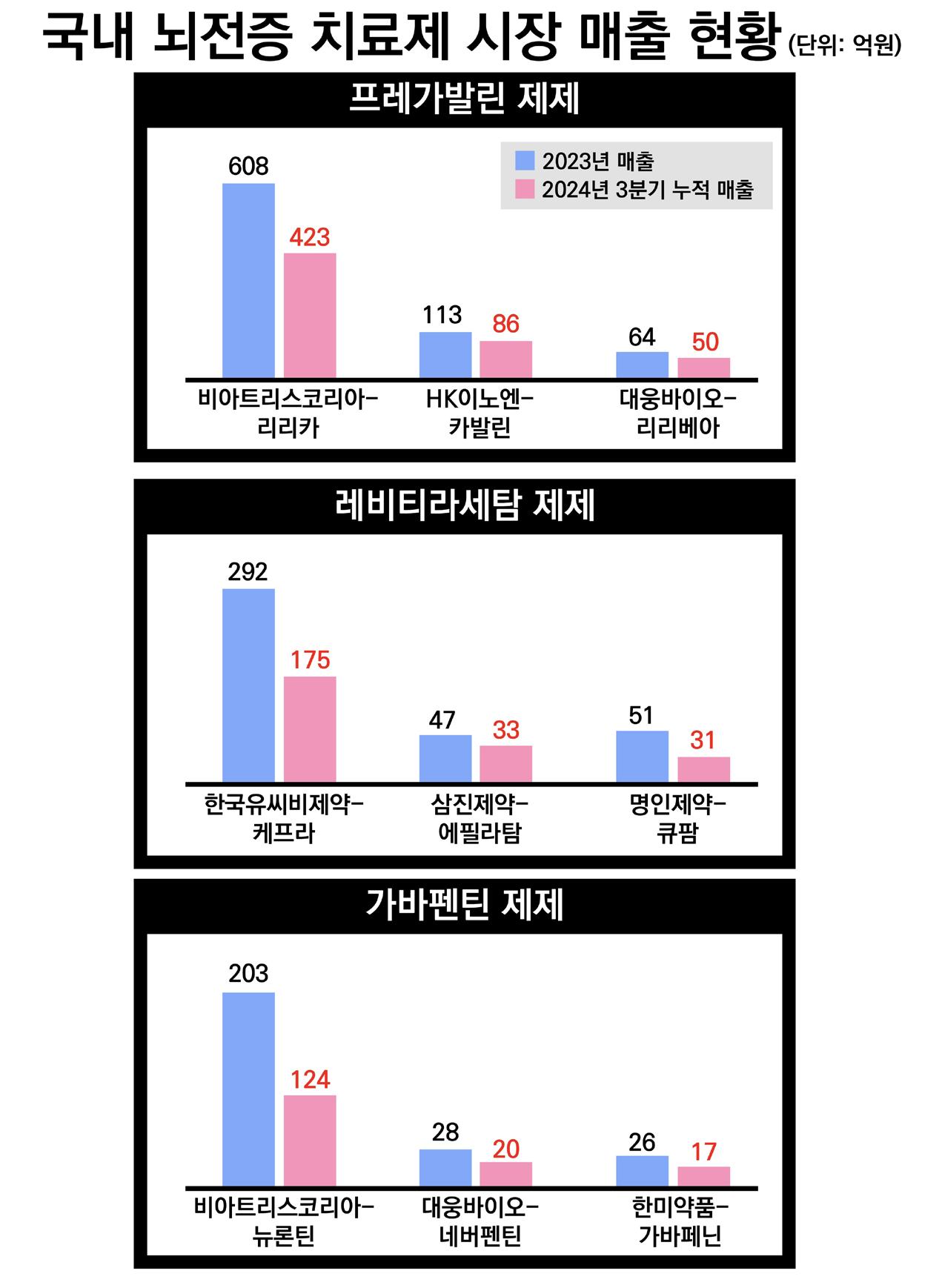
디지털 치료제는 소프트웨어 기반의 치료방법으로, 환자의 증상 관리 및 치료에 활용되는 기술
이다. 이는 뇌전증 환자의 발작 예측 및 관리에 활용될 수 있다. 미국 시장조사기관 프로스트앤설
리번(Frost and Sullivan)에 따르면, 미국의 디지털 치료제 시장 규모는 2017년 8억 9,000만
달러에서 2023년 44억 2,000만 달러로 크게 성장할 것으로 전망되었다. 또한, 유전자 편집 기
술의 발전으로 최근 유전자 편집 기술을 활용한 치료제 개발이 활발히 진행되고 있으며, 이는 뇌
전증 치료의 새로운 가능성을 열어가고 있다. 이는 뇌전증의 유전적 원인을 직접적으로 수정함으
로써 증상 완화가 아닌 근본적인 치료를 가능하게 할 것이다.
빔팻
1. 라코사미드 성분 항뇌전증제의 시장 전망
라코사미드(lacosamide)는 UCB제약에서 개발한 항뇌전증제인 빔팻(Vimpat)을 시작으로, 이차성 전신발작을 동반하거나 동반하지 않는 부분 발작 간질(partial-onset seizures) 에 대 한 부가요법 약물로 널리 사용되고 있는 항뇌전증제의 한 종류이다. 기존 항뇌전증제 약물과 다 른 작용기전을 가지고
한편,
제제가 출시되며 기존 오리지널 약의 시장 내 입지와 더불어 제네릭와의 경쟁이 심화되는 상황에 놓여있다.
라코사미드(lacosamide)의 시장은 더욱 확대될 것으로 예상된다. 2023년 58억 달러의 시장 규모를 가지고 있는 라코사미드 시장 규모는 4.7%의 CAGR의 성장세를 보이며 2031년까지 79
억 달러의 시장 규모를 가질 것으로 예상된다. 이러한 시장의 성장세를 보이는 이유로는 뇌전증
및 신경계 질환의 유병률 증가 및 의료 인프라 확장, 환자 맞춤형 치료에 대한 수요 증가 등의 영
향 등 필요 및 요구의 증가 측면이 꼽히고 있다. 특히 고령화 시대에 따른 노인 인구 증가로 신경
계 장애 및 뇌전증 유병률이 증가하는 것이 주요 원인으로 생각된다. * CAGR (연평균 성장률) : 매년 동일한 성장률을 가진다고 가정한 후, 복리 효과를 고려해 시 간이 지남에 따라 투자가 어떻게 성장했는가를 나타내는 지표 (종료값^1/n) % (시작값) -1 - 종료 값 : 기간 종료 시점의 투자가치 - 시작 값 : 기간 시작 시점의 투자가치 - n : 연도 수
2. 빔펫 한국 시장 분석 및 국내외 제네릭 출시 경향
의약품 시장에서는 오리지널 의약품의 특허 만료 이후 다수의 제네릭이 동시에 출시되는 경향이
빈번히 나타난다. 제네릭 의약품의 출시는 의약품 자체의 낮은 가격과 정책에 따른 오리지널 의 약품 가격 인하로 환자에게 경제적 부담을 완화할 수 있고, 건강보험 재정에도 기여할 수 있다는 장점이 있다. 특히 항뇌전증제, 만성질환 치료제와 같은 지속적이고 오랜 복용이 필요한 의약품 에서 이러한 경제적 부담의 완화가 중요한 역할을 할 것으로 기대할 수 있다.
하지만 오리지널 제품의 입장에서는 특허 만료가 만료됨과 동시에 시장 점유율이 크게 하락하고
높은 가격 경쟁을 맞이하게 된다. 실제 빔펫의 경우 국내 시장에서 오리지널 의약품 특허가 만료
됨에 따라 다수의 제네릭이 잇따라 출시되었고, 이들의 급여가 이어지면서 시장 점유율과 매출이 크게 하락하여 시장 자진 철수가 결정된 바 있다. 이러한 경향은 빔펫에 급여가 적용된 해외에서 도 나타난다. 미국과 유럽에서 특허가 차례로 종료된 후 제네릭 출시로 각각에서 매출이 38%, 8% 하락한 바 있다. 이는 제네릭의 출시가 오리지널 의약품 매출에 실질적이고 즉각적인 타격을 준다는 점을 보여주는 예시이다.
결국 제네릭은 의약품에 대한 환자 접근성과 비용 측면에서 이점을 제공하지만, 동시에 오리지 널 의약품의 경쟁력을 하락, 압박을 심화시켜 제약산업에서 신약 출시에 대한 기반을 약화시킬 수 있다. 또한 일부 블록버스터 제품의 제네릭은 100개 이상 출시되기도 하여, 제네릭 간 경쟁
심화도 무시할 수 없는 측면이다. 국내에서는 지난 2020년 약가제도가 개편되어 제네릭, 생동성 시험을 직접 수행하고 등록 원료 사용 시에만 오리지널가의 53.55%를 보장하고 계단형 약가제
도의 적용으로 20개 이상 제네릭이 등재된 성분일 경우 신규 등재 품목의 상한가가 기존 최저가 의 85%로 제한되었다. 이러한 점에 영향을 받아 제네릭의 신규 출시가 감소하였지만, 한편으로 는 이것이 기존 R&D 역량 기반 신약 개발 경쟁력을 보유한 대형 제약사에는 영향이 적고 해당 경쟁력이 상대적으로 부족한 소규모 제약사에게 영향이 큰 점을 고려하여 제약사 간 양극화에 대 한 우려를 표하는 입장이 존재하기도 한다.
1. 허가 관련 국가별 이슈
(1) 국내 이슈 : 국내 제네릭 허가 및 특허 분쟁 이슈
페람파넬의 오리지널 의약품인 “파이콤파”는 에자이(Eisai)사가 개발했으며, 물질특허 만료일
은 2026년 10월 14일로 예정되어 있다. 그러나 국내에서는 이미 제네릭 의약품이 출시되어 특 허 회피 및 독점 판매권(우판권)과 관련한 법적 이슈가 있었다. 주요 제네릭 제품으로는 “페리콤 파정(명인제약)”, “페라넬정(환인제약)”이 있다. 이 두 제약사는 ‘1,2-디히드로피리딘 화합물의
결정 및 그 제조방법’에 대한 파이콤파의 특허에 대해 소극적 권리범위확인심판을 청구하였고, 2020년 10월 22일 승소 판결을 받아 제네릭 출시가 가능해졌다. 명인제약과 환인제약은 제네
릭 최초 허가를 획득하며, 2023년 10월 14일부터 2024년 7월 13일까지 9개월간의 우판권을 확보했다. 이 기간 동안 두 회사만이 페람파넬 제네릭을 독점적으로 판매할 수 있다. 이러한 국
내 제네릭 허가 이슈는 오리지널 제약사와 국내 제약사 간 특허 분쟁 및 시장 진입 전략의 한 부 분을 보여준다.
(2) 미국 이슈 : 희귀의약품 지정 철회, 중복 평가 지연 이슈
2012년 12월 7일, Lennox-Gastaut Syndrome (LGS)에 대해 희귀의약품으로 지정되 었으나, 2024년 5월 1일자로 지정이 철회되었다. 지정 철회의 사유가 공식적으로 발표되지 는 않았다.파이콤파는 2012년 10월에 FDA에 의해 최초로 승인되었으나, 미국의 마약단속국 DEA(Drug Enforcement Administration)에서 검토 절차에 늦게 착수하여 발매일정 조율에 어려움을 겪은 바 있다. 미국에서는 항경련제나 수면개선제, 비만 치료제와 같이 중추신경계에
작용하는 기전을 가져 오남용의 가능성을 갖는 신약의 경우 FDA의 허가를 취득했더라도 DEA에 서 관리대상 의약품 (Controlled Substance) 급수를 부여받아 최종 분류 검토 작업을 거친 뒤 발매가 가능하다. 그러나 FDA에서 2013년 1월에 발매일정 권고에 대한 서류를 발송했음에도
불구하고 DEA에서 7개월이 지나도록 검토 절차에 착수하지 않자, 개발사인 Eisai에서는 DEA 가 “불합리하고 터무니없게” 파이콤파의 검토를 지연하여 많은 뇌전증 환자가 치료를 받지 못하 고 있다는 사유로 2013년 8월 19일, 컬럼비아 특별구 항소법원에 청원서를 제출하였다. 이 청원 은 같은 해 10월 말까지 DEA 측에서 급수 지정을 해주겠다고 약속하며 기각되었으며, 이는 결 과적으로 환자들이 항뇌전증증제를 활용할 수 있는 시점을 늦추었다는 점에서 DEA의 일정 결정 과정의 효율성에 대한 의문점을 제시하고, 더욱 신속한 분류 평가에 대한 필요성을 제시하였다.
2. 파이콤파 동향
(1) 권리 이전
2022년 12월, 파이콤파의 기존 개발사인 일본 제약사 Eisai Co.는 미국 내 파이콤파의 제품화
권리를 Catalyst Pharmaceuticals, Inc.에 1억 6천만 달러의 계약 선급금을 받고 매각하였다.
Eiasi는 미국 외 권역의 권리는 유지하고, 제조와 공급은 계속 담당하는 조건으로 권리를 이전하
였으며, 해당 매각 자금을 Eisai가 최근 주력으로 진행한 알츠하이머병 포트폴리오의 연구와 치료
제 개발 및 상업화에 사용할 것으로 발표하였다. 권리를 양도받은 Catalyst Pharmaceuticals
는 희귀질환 환자 치료제를 연구하는 바이오 제약회사로, 신경근육 및 신경계 질환 치료제 개발
에 주력하는 기업으로 파이콤파에 대한 권리를 이전 받는 목적으로 자사의 상업 제품 포트폴리오
강화, 이미 성공적으로 시장에 진입한 제품을 추가하고 뇌전증 전문 팀을 꾸려 신경과학 분야의
입지를 강화하는 것 등을 제시하였다.
(2) 매출/ 시장 규모 / 전망
Eisai에서 발표한 파이콤파의 매각 전년도인 2021년의 미국에서의 순매출은 약 1억 2500만
달러이며, Catalyst에서 발표한 매각 후인 2023년과 2024년의 미국에서의 순매출은 각각 1억
3800만 달러와 1억 3730만 달러이다. 2023년에 비해서 2024년에 0.6%의 경미한 하락세를
보이긴 했으나 파이콤파는 대체로 권리 양도 후에도 전반적으로 긍정적인 매출 흐름을 유지하고 있으며, 큰 변동은 없는 꾸준한 수익 기여제품의 자리를 유지하고 있다.
이러한 파이콤파는 2024년 매출 기준 전 세계 페람파넬 시장에서 약 27%를 차지하고 있으며, 페람파넬의 오리지널 브랜드로 많은 제네릭 약품의 등장 이후에도 시장을 주도하고 있다. Verified Market Reports에 따르면 현재 페람파넬의 시장 규모는 약 12억 달러이며, 2033년의 예 상 시장 규모는 25억 달러로 9.2%의 연평균 성장률을 가질 것으로 예측된다. 시장의 동인으로 는 뇌전증 환자수의 증가, 페람파넬의 EMA/FDA 승인 적응증의 확대, 정밀 의료에 대한 수요
증가 등을 꼽을 수 있으며, 기회 요인으로는 희귀 및 고난도 뇌전증 적응증에 대한 확장 가능성, 신흥국 의료 인프라의 성장, R&D 협업 확대를 가진다. 반면 시장 과제로는 국가별로
에슬리카바제핀
2023년, 에슬리카바제핀 아세테이트 API의 글로벌 시장은 제약 및 연구 용도에서의 수요 증
가에 힘입어 상당한 가치로 평가되었다. 전체 시장 매출에 기여한 주요 지역을 살펴보면 북미 (40%), 아시아 태평양(30%), 유럽(20%), 라틴 아메리카(5%), 중동 및 아프리카(5%)가 순서
대로 높은 매출을 차지했으며, 이 중 아시아 태평양 지역은 2023년에 가장 빠르게 성장한 지역으 로 확인되었다. 이는 제약 산업과 연구 활동의 확대에 따른 에슬리카바제핀 아세테이트 수요 증 가에 기인한다. 2023년 시장에서 제약 부문은 70%의 점유율로 가장 큰 비중을 차지했으며, 연 구 용도는 나머지 30%를 구성했다.
2. 시장 전망
에슬리카바제핀 아세테이트 API 시장 규모는 2024년에 약 2억 달러로 추정되며, 2026년부터 2033년까지 연평균 성장률(CAGR) 8.5%로 성장하여 2033년에는 4억 달러에 이를 것으로 예 상된다. 미국 국립보건원(NIH)에 따르면, 미국에서만 약 340만 명이 뇌전증을 앓고 있어 효과적 인 치료법에 대한 상당한 수요를 보여준다. 이러한 이유로, 에슬리카바제핀 아세테이트 API 시장 의 성장이 기대되며, 인식 제고, 뇌전증 발생률 증가, 그리고 고급 치료 옵션에 대한 필요성이 이
성장을 이끌고 있다. FDA를 포함한 규제 기관들은 에슬리카바제핀 아세테이트의 새로운 제형 및
조합을 점점 더 승인하고 있으며, 이는 시장 가능성을 더욱 확대시키고 있다.
에슬리카바제핀 아세테이트가 양극성 장애나 신경병성 통증과 같은 다른 신경 질환에 적용될 가
능성에 대한 지속적인 연구는 시장 확장의 새로운 길을 열어주고 있다. 이 약의 다용성에 대한 연 구가 증가하면서, 추가 치료 적응증에 대한 승인을 받을 가능성도 커지고 있으며, 이는 시장 범위 를 크게 넓히고 새로운 환자층을 유치할 수 있게 한다. 예를 들어, 당뇨성 신경병성 통증 및 대상 포진 후 신경통과 같은 신경 병증에서의 임상 결과가 제시되며 다른 치료 영역에서의 치료가능성 을 확인받았다. 전 세계 제약 시장이 계속 진화함에 따라, 에슬리카바제핀 아세테이트는 복합 치 료에서의 사용이 증가할 것으로 예상되며, 이는 다양한 의료 환경에서 환자의 치료 결과를 향상 시킬 것으로 기대된다.
또한, 특히 아시아-태평양 지역의 신흥 시장은 성장 가능성이 높은 미개척 영역을 제공한다. 인 도, 중국 등 국가들은 도시화와 생활 습관 변화에 따라 신경 질환의 유병률이 증가하고 있으며, 보건의료 지출 증가 및 제약 인프라에 대한 투자 확대가 이 지역에서 에슬리카바제핀 아세테이트
API의 도입과 수용을 촉진하고 있다.
1. 브리비액트 국내외
브리비액트(브리바라세탐)은 UCB 제약이 개발한
치료제로 2019년 3월 식품의약품 안전처의 허가를 획득하였으나, 약가 협상 결렬로 인해 급여 등재가 지연됨으로써 국내 시장 진
입이 사실상 미뤄진 상태이다. 약제급여평가위원회는 브리비액트의 임상적 유용성을 인정하였으
나, 동일 계열 약물들의 가중평균 약가 수준을 수용하는 것이 급여의 전제 조건으로 작용하면서
사실상 매우 낮은 약가가 요구되고 있다. 이러한 가격 협상의 난항으로 인해 오리지널 제품은 비 급여 상태가 지속되고 있으며, 이 공백을 틈타 최근 국내 제네릭 허가 움직임이 빠르게 확산되고
있는 상황이다.
국내에서는 대웅제약이 국내 최초 브리비액트 제네릭인 ‘브리바탑정’ 4개 용량의 허가를 획득하
였으며, 부광약품은 ‘부광브리필정’을 비롯한 제품의 허가를 준비하고 있다. 또한 환인제약을 포 함한 여러 제약사가 생물학적 동등성 시험과 허가 절차를 진행 중이다. 이들 제네릭 제품은 2026
년 2월 21일로 예정된 특허 만료 전후로 시장 진입을 준비하고 있으며, 급여 적용 시점이 오리지
널과 제네릭 간 시장 우위를 결정짓는 주요 변수가 되고 있다.
2026년 특허 만료 이후의 국내 시장 시나리오는 크게 두 가지로 나눌 수 있다. 첫째, 오리지널 의약품인 브리비액트가 가격을 양보하고 급여에 동시 진입하는 경우이다. 이 시나리오에서는 브 리비액트가
둘째, 제네릭이 먼저 급여권에 진입하는 경우이다. 이 경우에는 제네릭이 가격 경쟁력을 앞세워 시장을 주도할 가능성이 크며, 오리지널은 처방 의미가 희석되어 시장 철수 혹은 비급여 유지라 는 전략적 선택지에 직면할 수 있다. 따라서 국내에서는 UCB가 가능한 한 빠르게 약가 재협상에 합의하고 동반 급여 진입을 통해 시장 기반을 확보하는 것이 중요하다.
글로벌 시장에서도 유사한 흐름이 관찰된다. 브리비액트는 유럽, 일본을 포함한 여러 지역에서
사용 환자 수가 증가하면서 2024년 매출이 전년 대비 약 20% 이상의 성장을 기록하며 €600m
이상을 달성하였다. 그러나 미국을 비롯한 주요 시장에서의 특허 만료 시점이 임박함에 따라
2026년 이후에는 제네릭 침투가 본격화되고 가격 하락과 점유율 감소가 불가피할 것으로 전망 된다. 제네릭 출시 이후에는 약가 인하 압력과
스위칭이 가속화되면서 매출은 점진적 하향 곡선을 그릴 가능성이 크다.
이에 대응하기 위해 UCB는 글로벌 차원에서 Lifecycle Management 전략을 강화하고 있다. IV 제형, 소아 및 청소년 적응증 확대, 실사용 근거(real-world evidence) 축적 등을 통해 제품 차별성을 강조하고, 새로운 적응증 개발과 혁신적 면역·신경계 파이프라인 확충을 통해 포트폴리 오 중심축을 이동시키고 있다. 이러한 전략은 브리비액트를 현금 창출원으로 유지하는 한편, 장
기적으로는 신제품으로 성장 동력을 전환하기 위한 포석이다.
종합적으로 볼 때, 브리비액트는 2024~2025년 사이 매출 피크를 지나 2026년 이후에는 제네
릭 출시와 함께 점유율이 점차 희석되는 시장 성숙 단계로 진입할 것으로 전망된다. 국내에서는
제네릭 허가가 이미 현실화되었으므로 오리지널의 조속한 급여 진입 여부가 향후 시장 판도를 좌
우할 핵심 요인이 될 것이다. 오리지널이 빠른 급여 전환에 성공할 경우 일정 부분 점유율을 방
어할 수 있으나, 제네릭이 먼저 급여 진입에 성공하면 시장 주도권은 후발 제품으로 넘어갈 가능 성이 높다. 따라서 국내외 시장에서의 브리바라세탐은 단기적으로는 매출 성장을 지속할 수 있으 나, 중장기적으로는 가격 인하와 제네릭 경쟁으로 인해 점차 쇠퇴 곡선을 그릴 것으로 예상되므 로 매출을 방어할 전략을 세워야 한다.
1. 한국 허가 이슈
세노바메이트(Cenobamate)는 SK바이오팜이 자체 개발한 항뇌전증제로, 전압 개폐성 나트륨
채널(Voltage-gated sodium channel, VGSC)을 억제하고 GABA-A 수용체에 대한 양성 알
로스테릭 조절 작용을 동시에 나타내는 복합 기전을 지닌 약물이다. 이러한 기전의 차별성으로 기존 항뇌전증제보다 우수한 발작 억제 효과를 보이며, 글로벌 시장에서 주목받고 있다. 세노바
메이트 한국허가 이슈에서는 세노바메이트의 국내 허가 지연 원인과 함께, 이를 보완하기 위한 ‘ 치료목적 사용승인’ 제도의 활용을 중심으로 살펴보고자 한다.
(1) 한국 허가 지연의 원인
세노바메이트는 미국에서 2019년 11월 FDA 허가를 받고 2020년 5월 출시되었으며, 유럽에 서는 2021년 3월 EMA 허가를 받아 독일, 프랑스 등 주요국에 순차적으로 출시되었다. 그러나
국내 허가는 상당히 지연되었으며, 지난 2025년 2월에 이르러서야 비로소 품목허가 신청이 이 루어졌다. 이러한 지연은 크게 세 가지 이유로 설명할 수 있다.
첫째, SK바이오팜의 전략적 선택이다. 회사는 미국 시장을 우선 공략하기 위해 자체 법인 ‘SK Life Science’를 설립하고 FDA 승인 및 직접 판매에 나섰으며, 한국 시장은 상대적으로 우선순
위에서 밀려났다. 이에 따라 실제 국내 허가 신청은 SK바이오팜이 아닌 동아ST가 담당하게 되었
고, 동아ST는 2024년 1월 SK바이오팜으로부터 라이선스 인 계약을 체결한 후, 국내외 30개국 공급을 위한 완제의약품 생산 기술을 이전받은 상태이다. 이러한 일련의 과정은 자국에서 개발된
신약임에도 불구하고 국내 도입이 뒤처지는 이른바 ‘코리아 패싱’ 논란과도 맞물리며, 이후 급여
등재 과정에서도 중요한 쟁점이 되고 있다.
둘째, 국내 임상 데이터 부족이다. 세노바메이트는 한국 내 임상시험이 제한적으로 이루어졌기
때문에, 미국과 유럽에서 확보한 데이터를 기반으로 국내 허가를 추진해야 하는 상황에 놓였다. 셋째, 약가 및 급여 문제이다. 한국에서 신약이 시장에 성공하기 위해서는 건강보험 급여 적용이 핵심 변수다. 세노바메이트는 기존 뇌전증 치료제에 비해 가격이 높기 때문에 급여 등재 여부가 불투명하며, 약제급여평가위원회 심의와 심평원과의 협상이 불가피하다.
(2) 치료목적 사용승인 제도란?
국내 허가가 지연되는 가운데, 중증 또는 희귀질환 환자에게는 ‘치료목적 사용승인’ 제도를 통 해 세노바메이트의 접근성이 일부 확보되고 있다. 이는 임상시험용 의약품에 대해 식약처의 예
외적 승인을 받아, 치료 목적으로 사용할 수 있도록 하는 제도다. 일반적으로 임상시험계획 승인 (IND) 이후 의약품의 제조 또는 수입을 위한 품목허가(또는 신고)를 거친 후, 해당 제도를 통해
실제 사용이 가능하다.
해당 제도는 ‘동정적 사용(Compassionate Use)’이라고도 불리며, 사용 방식에 따라 개인별 환자와 다수 환자 단위로 나뉜다.
• 개인별 환자 대상 승인 절차는 환자의 주치의가 식약처에 직접 치료목적 사용을 신청하고, 해
당 제약사가 의약품을 공급하는 구조다. 승인까지의 기간은 평균 7일 이내로 비교적 신속하다.
• 다수 환자 대상 승인 절차는 제약사 또는 임상시험계획 승인기관이 신청 주체가 되며, 임상시 험심사위원회(IRB) 1 승인을 거쳐 공급된다. 이후 이상반응, 안전성 정보 등을 추적 및 보고하는 절차가 포함된다.
이 제도는 허가를 받지 못한 신약이라 하더라도 환자의 생명을 위협하는 상황에서 중요한 치료 수단이 될 수 있으며, 세노바메이트 역시 이 제도를 통해 일부 환자에게 제공되어 왔다.
세노바메이트는 한국 제약사의 기술력과 상업화 능력을 입증한 대표적 사례로, 향후 한국 신약 개발의 방향성을 제시하고 있다. 그러나 국내 허가 지연은 글로벌 전략, 임상 데이터, 급여 체계
등 복합적 요인에 기인하며, 제도적 보완이 요구된다. 치료목적 사용승인 제도는 이러한 간극을 메우는 중요한 수단이지만, 장기적으로는 환자의 접근성과 산업의 지속가능성을 동시에 보장할 수 있는 제도 개선이 필요하다.
※ 본 원고는 작성 당시 세노바메이트가 국내 미허가 상태였기 때문에 허가 사항을 자세히 다루지 못한 점 양해 부탁드립니다.
2025년 11월 3일, 식품의약품안전처는 성인 뇌전증 환자의 부분발작 치료에 세노바메이트(제 품명 엑스코프리정)를 승인하였으며,
개발된 제41호 국산신약으로 등재되 었다. 본 신약은
티가 SK바이오팜과의 라이선스 인 계약을 통해 국내외 30여 개국에서의 생산 및 판매권을 확
보하고 국내 품목허가를 주도하였다.
이번 허가는 국산 신약이 글로벌 임상과 기술수출을 거쳐 국내에서 다시 상용화로 이어진 사례 로, 국내 제약산업의 연구개발 자립성과 혁신 역량을 입증한 중요한 전환점으로 평가된다. 또한
세노바메이트는 기존 항뇌전증제 치료에 반응이 불충분했던 환자들에게 새로운 치료 대안을 제
공할 수 있게 되었으며, 향후 급여평가 절차, 실제임상근거(RWD) 축적, 그리고 장기 안전성 및 효과에 대한 후속 연구가 중요한 과제로 남아 있다.
2. 한국 급여 이슈
(1) 2025년 허가제도 개편과 세노바메이트 2025년 1월부터 시행된 신약 허가제도 개편의 핵심은 심사 수수료 인상, 심사 전문성 및 투명
성 강화, 전담 심사팀 도입, 심사 기간 단축이다. 기존 신약 허가 수수료는 883만 원이었으나, 개
편 이후 4억 1,000만 원으로 약 50배 인상되었다. 식약처는 수수료 인상에 따라 평균 420일이
었던 심사 기간이 295일로 단축될 것이라고 밝혔다. 이는 신약 심사의 질 향상, 치료 접근성 개 선, 제도의 신뢰도 제고 등을 기대하게 하지만, 동시에 중소 및 바이오벤처에게는 큰 진입 장벽이 되며, 국내 신약개발의 양극화 및 수입신약 차별 논란을 야기할 수 있다.
세노바메이트는 이 개편의 첫 적용 사례 중 하나로, 실제로 심사 기간의 단축 여부가 중요한 기 준점이 될 전망이다. 또한 수수료 기반이 실비 산정으로 전환되면서 제도 운영의 투명성과 행정
비용 현실화도 함께 추진되고 있다.
(2) 희귀필수의약품센터를 통한 환자접근성 제고
세노바메이트는 아직 국내 시판허가를 받기 전까지는 한국희귀필수의약품센터를 통한 ‘자가 치
료용 의약품 수입’ 방식으로 환자에게 공급되고 있다. 이 경우, 환자가 진단서와 의사 처방전, 의 약품 구입 동의서, 개인정보 이용 동의서 등을 제출하면, 센터가 유럽으로부터 세노바메이트를 수입해 전달한다. 유통 시간은 평균 8~10주가 소요되며, 알약 84개 1팩 기준으로 약가가 55만 원, 해외 운송료는 약 50만 원으로, 한 달분 약제비는 약 105만 원 수준이다.
이러한 방식은 허가 이전 단계에서 환자의 치료 접근성을 일정 부분 보완해준다는 점에서 의미 가 있지만, 여러 한계도 존재한다. 우선 고가의 비용 부담과 평균 2개월에 달하는 유통 지연으로 인해 시급한 치료가 필요한 환자에게는 실질적인 접근성 저해 요소로 작용할 수 있다. 또한 자가 치료용 수입은 정식 유통이 아니기 때문에 복약지도, 이상반응 보고 등 사후관리 체계가 미흡할
수밖에 없다. 결국 환자의 권익과 안전한 약물 사용을 보장하기 위해서는 시판허가 및 급여 등재
를 통한 제도권 진입이 필수적이며, 세노바메이트의 국내 허가 절차와 급여 진입 논의가 더욱 시
급한 이유이기도 하다.
(3) 급여 진입 전망과 약가 이슈
세노바메이트의 급여 진입에는 여러 구조적 쟁점이 존재한다. 우선, 세노바메이트는 항암제나 희귀질환 치료제가 아니므로 건강보험 요양급여에서 경제성평가 면제를 받을 수 없다. 이에 따라 경제성평가와 대체약제 가중평균가
문제는 대체약제 약가가 매우 낮은 경우, 신약임에도 불구하고 기존 약제보다 낮은 가격이 책정
될 수 있다는 점이다. 실제로 국내에서는 신약 약가가 대부분 대체약제 가중평균가의 90% 이하
로 책정되고 있다. 세노바메이트 역시 대체약제의 특허가 만료되어 제네릭이 출시된 상황에서, 신
약 혁신성이 충분히 반영되지 못하고 가격 경쟁력에서 불리해질 가능성이 있다.
해외 약가를 살펴보면 미국에서는 1정당 약 5~6만원, 유럽에서는 7,000~8,000원, 프랑스에 서는 3,500원 수준이다. 국내는 프랑스보다도 낮은 가격으로 책정될 가능성이 높은 것으로 전 망된다.
급여 진입 과정에서는 동아ST(제약사), 정부(재정관리), 의료계(처방 주체) 간의 입장 차도 뚜렷 할 것으로 예상되며, 이는 향후 협상 과정에 영향을 줄 수 있다. 다만 식약처로부터 ‘국내개발신 약’으로 허가받는 경우, 일정 수준의 제도적 혜택이 적용될 수 있다.
(4) RWE 가이드라인 논의 최근 급여 등재되는 고가 중증질환
근거만으로도 사후 조건부 등재가
루어지고 있으며, 이로 인해 급여 결정의 불확실성이 증가하고 있다. 특히 단기간, 단일군, 소수 환자 임상만으로 근거가 부족한 경우가 많고, 경제성평가가 생략되는 경우도 많다.
세노바메이트와 같은 사례에서는 등재 이후의 성과평가를 위해 RWD(Real World Data), RWE(Real World Evidence)의 활용이 필수적이다. 그러나 현실 진료 데이터는 비뚤림(bias) 의 위험이 높기 때문에, 신뢰도 높은 RWE 생성을 위한 가이드라인 마련이 시급하다는 목소리가 크다. 영국, 캐나다 등은 이미 자국 상황에 맞는 RWE 가이드라인을 운영 중이며, 한국 역시 국 내 데이터를 체계적으로 수집·활용할 수 있는 기반 마련이 필요하다.
세노바메이트는 한국 제약사의 글로벌 신약 개발 성과를 보여주는 사례이면서, 국내 제약 정책 의 현실을 반영하는 지표이기도 하다. 2025년부터 시행된 허가제도 개편의 적용 사례로서 심사
기간 단축 효과와 제도 신뢰성 강화 여부를 시험받고 있으며, 급여 진입에서는 여전히 낮은 약가
평가와 경제성평가의 경직된 구조라는 문제에 직면해 있다.
나아가 RWE 기반의 사후성과 평가 및 보완적 급여관리 체계가
이트는 단순한 신약 이상의
이어질 수 있을 것이다.
참고문헌
-뇌전증 시장 현황
Businessresearchinsights. (2025.10.13). 간질 치료 시장 규모, 점유율, 성장 및 산업 분석, 유형별 (1 세대 및 2 세대), 응용 프로그램 (병원 약국, 소매 약국 및 온라인 약국), 지역 통찰력 및 2025 년에서 2033 년까 지 예측. Retrieved from https://www.businessresearchinsights.com/ko/market-reports/epilepsytherapeutic-market-101019
이상구. (2025.01.23). 뇌전증藥 시장, ‘세노바메이트’ 출시하면 외자사 구조 바뀔까. Retrieved from https:// www.sisajournal-e.com/news/articleView.html?idxno=409005
제약산업정보포털. (2024.2). 글로벌 제약시장. Retrieved from https://www.khidi.or.kr/board?menuId=M ENU03555&siteId=SITE00024
Donga ST. (2024.11.11). 동아ST, SK바이오팜 항뇌전증 신약 ‘엑스코프리’ 국내외 30개국 독점 판매권 확 보. Retrieved from https://www.donga-st.com/html/news_detail.php?bo_table=board_news&wr_ id=475
Health Chosun. (2025.11.03). SK바이오팜 ‘엑스코프리’, 식약처 허가 획득... 국산 신약 41호 등재. Retrieved from https://m.health.chosun.com/svc/news_view.html?contid=2025110301408
The Korea Economic Daily. (202511.03). SK바이오팜 ‘엑스코프리’, 국산 41호 신약으로 허가. Retrieved from https://www.hankyung.com/article/202511039816i
-페람파넬
약업뉴스. (2014 Jan 3). 에자이 ‘파이콤파’ 美 발매 마침내 6일 착수: 마약단속국 관리대상 의약품 분류 한 동안 지연 [ 온라인 기사]. Retrieved from http://m.yakup.com/news/index.html?mode=view&nid=170724
Catalyst Pharmaceuticals. Catalyst Pharmaceuticals Acquire US Commercial Rights — FYCOMPA (perampanel) CIII [뉴스 릴리즈]. Retrieved from https://ir.catalystpharma.com/news-releases/newsrelease-details/catalyst-pharmaceuticals-acquire-us-commercial-rights-fycompar/
Eisai Co., Ltd. (2022 Dec 19). Eisai to Divest Rights for Anti-Epileptic Drug FYCOMPA® (perampanel) CIII in United States to Catalyst Pharmaceuticals [뉴스 릴리즈]. Retrieved from https://media-us.eisai. com/EISAI-TO-DIVEST-RIGHTS-FOR-ANTI-EPILEPTIC-DRUG-FYCOMPA-R-perampanel-CIII-INUNITED-STATES-TO-CATALYST-PHARMACEUTICALS
Verified Market Reports. Global Perampanel Market Size By Drug Type (Oral Tablets, Injection), By Application (Epilepsy, Seizures)… Forecast 2023-2033 [온라인 자료]. Retrieved from https://www.verifiedmarketreports.com/product/perampanel-market/
-세노바메이트
김윤미. (2022.12.07). 약이 있어도 못쓰는 환자들…미허가·고가 신약 쓸 수 있는 방법은?. 청년의사. Retrieved from https://www.docdocdoc.co.kr/news/articleViewAmp.html?idxno=3000123
김찬혁. (2025.02.25). 국내 허가 신청한 세노바메이트, 임상 현장 ‘조기 데뷔’, 청년의사. Retrieved from https:// www.docdocdoc.co.kr/news/articleViewAmp.html?idxno=3026078
김창원. (2024.01.04). 동아ST-SK바이오팜, ‘세노바메이트’ 라이선스 계약체결. medipana. Retrieved from https://www.medipana.com/medician/view.php?page=15&sch_menu=2&sch_smenu=2002&sch_ cate=B&news_idx=321282
문윤희. (2023.10.10). 임상약 치료목적 승인 기준 두고 환자-의사 ‘온도차’ 확연. 뉴스더보이스. Retrieved from https://www.newsthevoice.com/news/articleView.html?idxno=34716
송영두. (2025.02.05). 의사가 인정한 세노바메이트, 3400억 韓 시장 장악 유력… 문제는 약가. 팜이데일리. Retrieved from https://pharm.edaily.co.kr/News/Read?newsId=02302566642067568
서울대학교병원의생명연구원. IRB 소개. Retrieved from http://hrpp.snuh.org/irb/introirb/_/singlecont/ view.do
식품의약품 안전처. (2024.07). 임상시험용의약품의 치료목적 사용을 위한 가이드라인 – 민원인 안내서. Retrieved from https://www.mfds.go.kr/brd/m_1060/view.do?seq=15484&srchFr=&srchTo=&srchWord=&src hTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=1
신창민. (2025.02.20). 동아ST, SK바팜서 L/I ‘세노바메이트’ 국내 허가신청. 바이오스펙테이터. Retrieved from https://www.biospectator.com/news/view/24372
엄태선. (2021.02.05). 임상용약 치료목적 사용승인제, 올해 이렇게 바꾼다. 뉴스더보이스. Retrieved from https://www.newsthevoice.com/news/articleView.html?idxno=17720
이상구. (2025.02.21). 환자들 기다린 동아ST ‘세노바메이트’, 언제 처방 가능할까. 시사저널e. Retrieved from https://www.sisajournal-e.com/news/articleView.html?idxno=409670
이원국. (2021.01.28). [알쏭달쏭 제약용어 바로 알기] 라이선스 아웃. 헬스경향. Retrieved from https:// www.k-health.com/news/articleView.html?idxno=52109
이영재. (2025.02.20). 동아ST, 뇌전증 신약 ‘세노바메이트’ 품목허가 신청. 의협신문. Retrieved from https:// www.doctorsnews.co.kr/news/articleView.html?idxno=158490
이충만. (2025.02.07). SK바이오팜 ‘세노바메이트’, 국내 허가 전 의료현장서 먼저 검증. 헬스케어N. Retrieved from https://m.healthcaren.com/news/news_article_yong.jsp?mn_idx=544118#google_vignette
이탁순. (2025.02.06). 심평원, 약제 사후평가 근거 RWE 가이드라인 개발 추진. 데일리팜. Retrieved from https://www.dailypharm.com/Users/News/NewsView.html?ID=320176
이현주. (2025.01.07). 신약 허가심사 수수료 4억내고 ‘신속한 허가 보장받는 시대 개막’. 히트뉴스. Retrieved from http://www.hitnews.co.kr/news/articleView.html?idxno=60466
조희연. (2025.02.21). 뇌전증 신약 ‘세노바메이트’ 출시 후 급여화 속도낼까 … 12만 환자 염원. 뉴데일리 경제. Retrieved from https://biz.newdaily.co.kr/site/data/html/2025/02/21/2025022100099.html
김주연 kjy57103@naver.com
안수연 sooyeonan0721@gmail.com
이승연 seungyean103@naver.com
UCB 제약회사 (라코사미드 및 브리바라세탐)
UCB(Union Chimique Belge, UCB SA)는 벨기에 브뤼셀에 본사를 둔 글로벌 제약사로, 주
력 연구 및 사업 분야는 신경학적 질환, 면역학적 질환, 그리고 희귀질환이다. 신경학 영역에서
는 뇌전증과 파킨슨병, 면역학에서는 건선과 중증 근무력증, 자가면역질환 등이 주요 대상이며, 희귀질환 영역에서는 특정 유전질환 및 자가면역성 질환에 집중하고 있다. 대표 제품으로는 뇌전 증 치료제인 빔팻(Vimpat, Lacosamide), 케프라(Keppra Tab, Levitiracetam), 브리비액트 (Briviact Tab, Brivaracetam)를 비롯하여 알레르기 치료제인 지르텍(Zyrtec Tab, Cetirizine Dihydrochloride) 등이 있다. 이외에도 파킨슨병, 하지불안증후군을 포함한 다양한 면역/염 증, 희귀질환 치료제를 연구 개발, 시판 중이며, 한국에서는 1989년부터 지사를 설립, 운영하며 CNS 및 알레르기/호흡기, 면역 질환에서 연구 개발을 지속 중에 있다.
1) UCB 제약회사의 전략
① 내부 개발
브리비액트는 벨기에에 본사를 둔 글로벌 제약회사인 UCB(UCB Pharma)가 개발한 항뇌전증 제이다. UCB는 이 약물을 브리비액트(Briviact)라는 상품명으로 전 세계에 출시하였다.
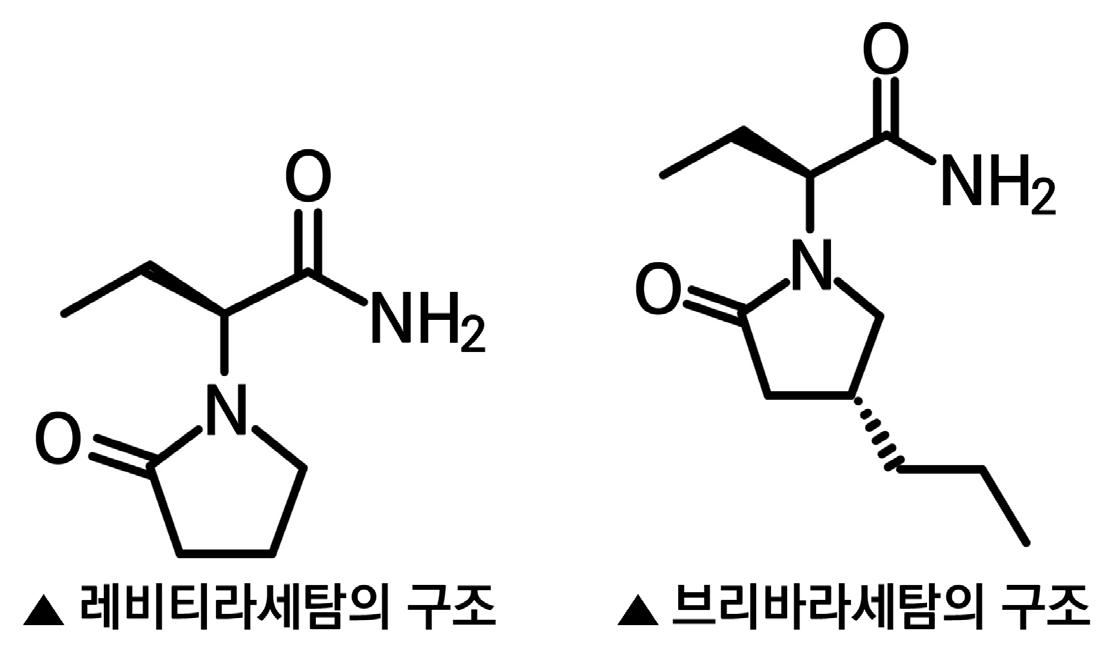
[그림 55] 레비티라세탐과 브리바라세탐의 구조
위 구조는 UCB가 더 먼저 개발한 기존 항뇌전증제인 케프라(levetiracetam)이다. 브리바라세 탐은 이 레비티라세탐의 구조를 기반으로 만들어진 신약으로 화학구조가 유사 하지만 propyl기 하나를 더해 합성되었다. 프로필기를 붙임으로써 브리바라세탐은 레비티라세탐보다 뇌의
15~30배 높은 SV2A 결합 친화도를 보였다. 즉, Keppra®(Levetiracetam, UCB)로부터 개발 한 Briviact®(Brivaracetam, UCB)는 내부 개발의 성공 사례이다.
② 선택과 집중
UCB는 기존의 오래된 오리지널 제품과 시장을 정리하고, 혁신신약에 집중함으로써 미래 성장
기반을 강화하고 있다. 2024년 11월, UCB는 아타락스(hydroxyzine)와 누트로픽(piracetam)
의 유럽 및 일부 아시아, 라틴아메리카 지역 권리를 ADVANZ PHARMA에 매각하였다. 아타락 스, 누트로픽 등은 특허가 만료된 제품이고 제네릭과의 가격 경쟁이 심한 의약품이다. 이런 제품
은 신약에 집중하는 UCB의 전략과는 멀어졌기 때문에 ADVANZ PHARMA같은 제네릭 전문
회사에 넘기고, UCB는 신약 및 희귀 질환 치료제 개발에 집중하게 되었다. 이는 높은 시장 성
장률을 가진 제품에 집중하기 위한 전략이다. 2024년 8월, UCB는 중국 내 신경학 및 알레르기
약물 사업부를 싱가포르의 CBC 그룹과 아 부다비의 무바달라(Mubadala)에 6억 8천만 달러에 매각하였다. 이 거래에는 케프라, 빔팻, 뉴프로 등의 신경학 약물과 지르텍, 씨잘 등의 알레르기
약물들이 있다. 특히 항히스타민제(지르텍, 씨잘)나 케프라 등은 이미 시장에 자리 잡은 제품으 로 시장에서 안정적인 매출 기반을 확보하고 있었지만, 이는 성숙기에 접어둔 제품군이었기 때
문에 UCB는 이들을 매각하고, 면역학 및 희귀질환 분야에 집중하는 전략으로 방향을 전환했다.
UCB 제약회사의 전략에서 두 가지 개념을 확인할 수 있었는데, 바로 선택과 집중 전략과 투자 대비 수익률(ROI)이다. 선택과 집중 전략은 성장 가능성이 낮은 제품은 정리하고, 고부가가치 신 약 및 희귀질환 분야에 자원을 집중하는 전략이다. UCB 제약은 빔젤스(Bimekizumab), 다피롤 리주맙 페골(Dapirolizumab)등 면역학, 희귀질환, 신경계 혁신 치료제 중심으로 재편 중이다. 매각된 제품은 ROI 측면에서 추가 투자 대비 수익 창출 여지가 낮은 반면, 신약은 높은 시장 성 장률과 약가 경쟁력으로 ROI 기대치가 높다. UCB는 중국에서도 면역학적 질환과 희귀질환 신 약 중심으로 진입하였으며 단기 수익성은 낮지만, 장기적으로 성장성이 높은 영역에 집중함으로 써 자본 효율성을 극대화하고 있다. 따라서 UCB는 잘 팔리더라도 성장하지 않는 약은 다른 회
사에 넘기고 장기적으로 큰 성장을 기 대할 수 있는 신약에 집중하는 전략을 사용 중인 것을 확 인할 수 있었다.
UCB는
bimekizumab (IL-17A/F) Monoclonal antibody
doxecitine and doxribtimine (nucleoside therapy)
fenfluramine (5-HT agonist)
dapirolizumab pegol (antiCD40L antibody)
STACCATO® alprazolam
bepranemab (anti-tau antibody)
glovadalen/ UCB0022 (D1 receptor positive allosteric modulators)
galvokimig/ UCB9741 (IL17A/F & IL-13)
donzakimig/ UCB1381 (IL13 & IL-22)
우선 면역 관련 약들이다. Bimekizumab의 기전은 IL-17A와 IL-17F 동시 억제이며, 적응 증은 건선성 관절염이다. 임상 시험은 현재 4상 진행 중이며 2026년 하반기에 마무리될 예정 인 약이다. Dapirolizumab pegol의 기전은 anti-CD40L 항체로서 면역 활성 T세포의 costimulation을 억제한다. 적응증은 전신성 홍반성 루푸스(SLE)이며 임상시험은 현재 3상이 1 차 완료되었고 2028년에 완료될 예정이다. Galvokimig은 IL-17A/F 및 IL-13 이중 억제 기
전을 가지며 아토피 피부염 약으로 Positive Phase 2a 임상 결과가 확보되었다. 괄호에 들어간
UCB 9741은 개발 당시 불린 코드명이다. Donzakimig(UCB 1381)은 IL-13과 IL-22 억제
하는 아토피 피부염 치료제이다. 현재 임상 2상 진행 중이며 예정 시점은 2025년 하반기이다.
다음으로 신경 관련 약들이다. 각 약들의 기전과 적응증은 다음과 같다. Bepranemab은 tau
단백질 응집을 차단하여 알츠하이머병의 진행을 늦추는 질병 조절제로 주목받고 있다. 그외
Doxecitine, rozanolixizumab, fenfluramine, glovadalen 등을 보면 UCB는 뇌전증, 파킨 슨병, 알츠하이머처럼 다양한 신경계 질환에 대해 질병 기전을 중점적으로 타깃하고 있는 것을 알 수 있다.
3) UCB 제약회사의 재무성과
2024년 기준 UCB의 총매출은 약 61.5억 유로(한화 약 9.9조 원)에 달하며, 순매출로는 56.1억 유로(한화 약 9.0조 원)를 기록했다. 주요 성장 동력으로는 자가면역성 염증 질환 치료 제 Cimzia(Certolizumab petal), 항뇌전증제 브리비액트, 염증성 피부 및 관절 질환 치료제 Bimzelx(Bimekizumab-bkzx) 등이 꼽힌다.
4) UCB 제약회사의 시장 지위 및 사업 확장 2023년 기준 7~8조원 수준에 달했던 세계 뇌전증 치료제 시장에서 미국 시장이 70~80%를 차
지했으며, 이 가운데 UCB는 약 50%의 시장 점유율을 확보하였다. UCB는 빔팻, 케프라, 브리 비액트, 네이질람(Nayzilam, Midazolam), 핀테플라(Fintepla, Fenfluramine) 총 5종의 의
약품만으로 이렇게 넓은 시장을 점유하여 2022년 1년 동안 약 24억9020만 유로(한화 약 3조 5000억 원)의 매출을 올렸다. 특히 빔팻은 2022~2023년 사이 미국과 유럽에서 차례로 특허가 만료되며 제네릭이 출시되었음에도 2024년 약 1조 5850억 원의 매출로 시장 점유율 21%를 기 록하며 항뇌전증제 매출 1위에 해당한 적 또한 있다. 또한 2022년 Zogenix 인수로 확보된 의약 품인 핀테플라는 드라베증후군 및 레녹스가스토증후군 치료제로 시판되며 2022년 1년간 7470 만 유로의 매출을 확보하였다.
이외에도 UCB는 인수 합병을 통해 파이프라인을 확장하고 있다. 2020년 Engage Therapeutics 사를 인수하여 약물 전달 기술과 Alprazolam 성분을 활용한 흡입형 항뇌전증제를 확 보하였다. 해당 의약품은 활동성 뇌전증 발작을 신속하게 중단하는 목적을 가지며, 12세 이상 뇌
전증 환자에서 반복적 및 지속적 발작의 신속 중단을 평가하는 3상 임상이 진행 중이다. 또한, 이
미 지난 임상 2b상을 통해 1mg, 2mg 용량 모두에서 2분 내 발작 중단 효과가 유의미하게 발현
됨이 확인되었다. 2022년에는 Zogenix 사를 인수하여 당시 드라베 증후군에 대한 치료제로 승
인되었던 Fintepla를 확보하였고, FDA로부터 희귀 소아기 뇌전증 레녹스-가스토 증후군(LGS)
과 관련된 발작 치료로 적응증 확대를 인정받기도 하였다.
이렇듯 UCB는 이미 오리지널 처방 선호도가 높고 처방 변경에 있어 어려움이 있는 항뇌전증
제 시장에서 오리지널 의약품을 보유하며 우위를 점하고 있음에도, 신경계, 특히 뇌전증과 면역 계 질환을 중심으로 다양한 파이프라인과 제품군을 확보해 나가며 시장 점유율을 더욱 확보할 것 으로 예상된다.
Eisai (페람파넬)
에자이(Eisai Co., Ltd.)는 1941년 일본 도쿄에서 설립된 글로벌 제약사로, 환자 중심 철학인 hhc(human health care)를 핵심 가치로 삼고 있다. 이는 환자와 가족의 삶의 질 개선을 기업 활동의 최우선 목표로 두겠다는 비전으로, 연구개발과 사업 전략, 글로벌 확장 전반에 반영되어 있다. 에자이는 단순히 의약품 공급에 국한되지 않고, 환자 중심 접근을 통해 혁신 신약을 개발하
는 제약사로 자리매김하였다.
연구개발 측면에서 에자이는 신경계와 종양을 핵심 분야로 설정하고 있다. 신경계 분야에서는 알츠하이머 치료제 에리셉트(Aricept, Donepezil)이 대표적이며, 이는 1990년대 후반 글로벌
블록버스터로 성장하여 에자이의 국제적 입지를 강화하였다. 이어 개발된 항뇌전증제 파이콤파 (Fycompa, Perampanel)는 AMPA 수용체 길항제로 난치성 뇌전증 환자 치료에 기여하며 신 경계 치료제 포트폴리오를 확장하였다. 종양 분야에서는 항암제 렌비마(Lenvima, Lenvatinib) 을 개발하여 간세포암, 갑상선암, 신세포암 등 다양한 고형암 치료에 적용하고 있으며, 병용요법 을 통한 글로벌 임상 확대를 통해 매출 성장을 견인하고 있다. 최근에는 알츠하이머 항체 치료제
레켐비(Leqembi, Lecanemab)을 미국 바이오젠(Biogen)과 공동 개발하였다. 이는 아밀로이 드 베타 단백질 축적을 표적으로 하는 질병 조절 치료제 중 하나로 평가되며, 피하 주사 제형 개 발을 통해 투여 편의성을 개선할 것으로 기대된다.
글로벌 사업 전략 측면에서 에자이는 일본 본사를 중심으로 아시아, 북미, 유럽 전역에 네트워 크를 구축하고있으며, 미국 FDA와 유럽 EMA 등 주요 규제기관과 협력하여 글로벌 임상개발 역 량을 강화하고 있다. 또한, 다국적 제약사와 전략적 제휴를 통해 파이프라인을 보완하고, 오픈 이
노베이션 모델을 활용하여 바이오벤처 및 학계와 공동 연구를 수행하고 있다. 주요 시장에서는
제품 허가와 보험 등재를 통해 환자 접근성을 확대하고, 학계와 협력하여 신약 사용 경험 및 임
상 데이터를 축적하고 있다.
2025회계연도(2024년 4월~2025년 3월) 기준, 에자이의 매출액은 약 7,894억 엔(한화 약 6 조 5,000억 원)으로 전년 대비 약 6.4% 증가하였으며, 순이익은 약 438억 엔(한화 약 3,500억
원)으로 보고되었다. 매출 성장은 렌비마와 파이콤파의 안정적 판매가 주도하였으며, 레켐비의
미국 내 채택 속도가 예상보다 더디게 진행된 관계로 단기 매출 기여도는 제한적이다.그러나, 고
령화 사회 진입에 따른 치매 치료제 수요 증가는 장기적 성장 요인으로 평가된다.
한국에서는 1980년대 한국에자이를 설립하여 파이콤파, 렌비마 등 주요 제품을 도입하고, 적응
증 확대와 보험 등재를 통해 환자 접근성을 강화하였다. 또한 학계 및 임상 현장과 협력하여 신약
사용 경험과 임상 연구 기반을 축적하며 국내 제약 환경 속 입지를 공고히 하고 있다.
에자이는 알츠하이머 치료제 레켐비를 차세대 성장 동력으로 삼고 있으며, 피하 제형 상용화 및
글로벌 승인 확대를 통해 시장 점유율 확대를 모색하고 있다. 신경계 및 종양 분야 파이프라인의
다각화와 글로벌 협력 확대는 장기 성장 기반을 강화하는 전략으로 평가된다. 다만, 제네릭 의약 품과의 경쟁, 약가 규제 강화, 높은 연구개발 비용 등은 주요 리스크로 작용한다. 따라서 혁신 신 약 확보와 글로벌 협력 생태계 강화가 에자이의 장기적 경쟁력을 좌우할 것으로 전망된다.
에슬리카바제핀 아세테이트는 대표적인 항뇌전증제로, 글로벌 시장에서는 포르투갈 제약사 BIAL이 개발을 주도해왔다. 국내에서는 환인제약이 해당 성분을 도입하고 개발하여 국내 환자 치료에 적용하고 있으며, 두 회사 모두 뇌전증을 비롯한 신경계 질환 영역에서 파이프라인을 확 장하고 있다.
BIAL은 에슬리카바제핀 아세테이트(ESL)를 핵심 자산으로 하여 뇌전증, 파킨슨병, 희귀질환 등 신경계 질환 치료제 개발에 집중하고 있다. 특히 ESL은 보조요법(adjunct), 소아·청소년 환 자용(paediatric), 단일요법(monotherapy) 등 다양한 임상 개발 전략을 통해 적응증을 확장해 왔으며, 일부 연구에서는 당뇨성 신경병증 통증과 대상포진 후 신경통 등 신경병성 통증 영역으
로도 탐색적 연구가 진행되었다. 또한 BIA 9-1067(Opicapone)과 같은 파킨슨병 치료제, BIA 28-6156(유전자 변이 기반 파킨슨병 연구) 등 차세대 파이프라인도 확보하여 중추신경계(CNS) 질환에 대한 연구 포트폴리오를 강화하고 있다.
BIAL의 파이프라인은 기존 항뇌전증제 시장에서의 입지를 더욱 공고히 하는 동시에, 고령화
및 만성질환 증가로 수요가 확대되는 신경과학 분야 전반으로의 확장을 목표로 하고 있다. 특히
ESL의 다양한 임상 데이터 축적은
기반으로 한 보조요법, 단일요법, 소아 적응증 확대는 글로벌 시장에서의 경쟁력 강화로 이어질 전망이다. 더불어 파킨
슨병 및 희귀 신경질환 파이프라인은 장기적으로 BIAL의 성장 동력을 다변화하는 요소로 작용 할 것으로 예상된다.
2) 환인제약
환인제약은 파킨슨병, 알츠하이머병, 우울증, 알코올 중독, 뇌전증 등 다양한 중추신경계 질환 을 대상으로 신약 파이프라인을 확장해왔다. 주요 과제에는 항우울제제, 알츠하이머병 치료제, ADHD 치료제 등이 포함되어 있으며, 뇌전증 치료제 WIG-2202는 뇌전증 치료제 시장 내 경쟁
력 확보를 위해 전략적으로 개발되고 있다. 그러나 최근 기사 보도에 따르면 2020~2021년 착
수한 임상과제 중 일부는 효과 부족으로 중단되거나 연구가 지연되면서 임상 파이프라인 관리의 어려움이 드러났다. 실제로 2022년부터 시작된 신약 개발 과제 중 다수가 중도에 정체 상태에
놓여 있는 것으로 나타났다. 환인제약은 국내 대표적인 정신신경계 전문 제약사로서, 축적된 R&D 경험과 포트폴리오를 바 탕으로 장기적으로 중추신경계 치료제 영역을 강화하려는 전략을 유지하고 있다. 다만 최근 임
상 실패와 연구 지연은 신약 개발 동력 확보에 도전 과제로 작용하고 있으며, 이를 극복하기 위 해 선택과 집중 전략이 요구되는 상황이다. 특히 고령화로 인한 파킨슨병 및
1) Cenobamate 개요 및 차별화 전략
세노바메이트(Cenobamate)는 SK바이오팜이 독자적으로 개발한 중추신경계(CNS) 혁신 신 약이다. 이는 성인 국소 발작(Focal Seizures) 치료를 위한 보조 요법제로 사용된다. 미국 식품
의약국(FDA)은 2019년 11월 21일 Xcopri라는 상품명으로, 유럽 의약품청(EMA)은 2021년
3월 26일 Ontozry라는 상품명으로 각각 최초로 승인했다.
세노바메이트의 가장 큰 특징은 이중 작용 기전(Dual Mechanism of Action)과 구조적 차
별화이다.
• 작용 기전: GABA-A 수용체의 양성 알로스테릭 조절제 역할과 나트륨 채널(Sodium Channel) 차단제 역할을 동시에 수행하여 강력한 항경련 효과를 발휘했다.
• 구조적 특징:
① 테트라졸(Tetrazole) 포함: CYP 효소에 대한 저항성을 높여 대사 안정성을
증가시키고 독성을 감소시켰다. 특히 간독성 위험을 회피하도록 설계되었다.
② 클로로페닐기(Chlorophenyl group) 포함: 약물의 지용성(Lipophilicity)을 증가시켜 혈액-뇌 장벽(BBB) 통과를 용이하게 하여 뇌전증 약물로서 효과를 극대화 했다.
2) SK바이오팜 기업 분석 및 파이프라인 전략
SK바이오팜은 1993년 설립된 SK그룹 계열의 제약사로, 중추신경계(CNS) 질환 치료제 개발 에 특화되었다. 신약 후보 물질 발굴부터 임상 개발, 허가, 상업화까지 전 과정을 독자적으로 수 행하는 국내 최초의 제약사로 ‘빅 바이오텍’으로의 도약을 목표로 했다.
① Cenobamate 중심 파이프라인 확장 세노바메이트는 SK바이오팜의 핵심 성장 동력이다. 성인 국소 발작 외의 적응증 및 제형 확장 을 통해 그 가치를 극대화하고 있다.
• 적응증 확장: 2025년 말 일차성 전신 강직 간대 발작(PGTC)에 대한 임상 결과를 확보하는 것 을 목표로 임상을 진행 중이다.
• 제형 확장: 소아 환자 투여를 위한 경구 현탁액(OS) 제형 개발을 진행 중이며, 2025년 중 NDA(신약 허가 신청)를 제출할 계획이다.
• 아시아 시장: 한국, 중국, 일본에서 성인 뇌전증 환자를 대상으로 임상 3상을 진행하여 유의미 한 발작 감소 효과를 확인했다. 국내에서는 2024년 1월 동아ST가 라이선스 계약을 통해 식약처
에 국내 허가 신청을 완료했다.
② 차세대 성장 동력 확보 (3대 Modality)
장기적인 성장을 위해 SK바이오팜은 저분자 화합물(Small molecule), RPT(방사성 의약품 치 료제), TPD(표적 단백질 분해 기술)의 3대 핵심 모달리티에 대한 초기 파이프라인 개발 투자를
강화하고 있다.
3) 사업 동향 및 향후 전망
① 사업 동향 및 실적
미국 시장에서의 Xcopri 처방 수(TRx)와 매출은 지속적인 성장세를 보였다.
• 2024년 4분기 기준: 처방 성장 지속으로 XCOPRI 매출이 전 분기 대비 159억 원 증가하며
역대 최대 증가 폭 (전년 대비 62% 성장)을 기록했다. 또한, 특수 영업 조직 및 인력 강화를 완 료했다.
• 2025년 1분기 기준: 월별 총 처방 수(TRx)에 일시적인 변동성이 있었으나, 이는 곧 회복되어
TRx 성장에 수렴할 것으로 전망된다.
• 시장 확대 전략: 2025년 상반기 중 DTC(Direct-To-Consumer) 광고 집행을 통해 환자 및
의료 전문가(HCP)에 대한 XCOPRI 인지도를 확대하고 성장세를 더욱 강화할 계획이다.
② 향후 전망
세노바메이트는 북미, 유럽, 아시아 시장에서의 강력한 임상적 효능과 시장 침투력을 바탕으 로 글로벌 블록버스터(Blockbuster) 신약으로 성장할 잠재력이 매우 높다. 장기적으로는 RPT
와 TPD 등 차세대 모달리티에 대한 선제적인 투자를 통해 포트폴리오를 다각화하고 지속 가능한
성장을 이룰 것으로 기대된다.
참고문헌
-라코사미드 및 브리바라세탐
한국유씨비제약. Retrieved from https://www.ucbkorea.co.kr/ UCB. Retrieved from https://www.ucb.com/
-페람파넬
한국에자이(주). Retrieved from https://www.eisaikorea.com/
Eisai Co., Ltd. Retrieved from https://www.eisai.com/
Eisai Co., Ltd. (2025.05..15). Consolidated Financial Report [IFRS] for Fiscal 2024 (Year Ended March 31, 2025). Eisai Co., Ltd. Retrieved from https://finance-frontend-pc-dist.west.edge. storage-yahoo.jp/disclosure/20250515/20250515552874.pdf
-에슬리카바제핀
환인제약. 파이프라인. Retrieved from https://www.whanin.com/_commonBase/content.php?co_ id=pipeline
Bial. Pipeline. Retrieved from https://www.bial.com/en/our-research/pipeline
Trinka, E., Rocamora, R., Chaves, J., Moreira, J., Ikedo, F., Soares-da-Silva, P., & BIA-2093-311/ EXT Investigators Study Group (2020). Long-term efficacy and safety of eslicarbazepine acetate monotherapy for adults with newly diagnosed focal epilepsy: An open-label extension study. Epilepsia, 61(10), 2129–2141. https://doi.org/10.1111/epi.16666
-세노바메이트
SK바이오팜. 파이프라인. Retrieved from https://www.skbp.com/kor/pipeline/pipeline.do
SK바이오팜. (2025.02.06). SK바이오팜, 4분기 美 매출 폭발적 성장으로 사상 최대의 연간 흑자 달성 세노바 메이트, 대한민국 혁신 신약의 새 역사 써. Retrieved from https://www.skbp.com/kor/news/view. do?boardSeq=729
European Medicines Agency. Ontozry (cenobamate) [EPAR product information].EMA. Retrieved from https://www.ema.europa.eu/en/medicines/human/EPAR/ontozry
U.S. Food and Drug Administration. (2019, November 21). XCOPRI® (cenobamate) approval letter and prescribing information. U.S. Food and Drug Administration. Retrieved from https://www.accessdata. fda.gov/drugsatfda_docs/appletter/2019/212839Orig1s000ltr.pdf
적응증 확장
뇌전증 치료제는 발작 억제를 목적으로 개발되어 왔으나, 최근에는 약물의 기전적 특성을 바탕
으로 신경계 전반의 질환으로 적응증을 확장하려는 시도가 이루어지고 있다. 나트륨 채널 차단, AMPA 수용체 길항, 시냅스 단백질 결합과 같은 다양한 작용기전은 신경병성 통증, 신경퇴행성
질환, 정신질환 등으로의 응용 가능성을 열어주고 있다. 본 주제에서는 ClinicalTrials.gov에 등
록된 임상시험을 중심으로 세노바메이트, 에슬리카바제핀, 라코사미드, 페람파넬, 브리바라세탐 의 적응증 확장 가능성을 고찰하고자 한다.
세노바메이트는 나트륨 채널 억제와 GABA_A 수용체 양성 조절 작용을 통해 부분 발작 치료 제로 승인된 약물이다. 현재 진행 중인 임상시험은 성인 및 소아 환자를 대상으로 한 용량-반
응 연구, 장기 안전성 평가, 확대 접근 프로그램 등이 있다(NCT05859854, NCT04903314, NCT04513860). SK바이오팜 임상시험 현황에 따르면, 2025년 이내로 부분 발작을 넘어 전 신발작으로 적응증 확장에 대한 임상 3상 결과를 확보할 계획이며 후술할 현탁액 제형 개발 또 한 이루어지고 있다. 또한 최근 EMA는 세노바메이트의 소아 적응증 임상시험계획을 승인하였으 며, 이에 따라 만 2세 이상 청소년 및 소아 환자까지 적응증 확대가 추진되고 있다. 해당 연구는 2034년까지 완료를 목표로 하며, 소아 환자에서의 안전성·유효성 평가와 함께 후술할 새로운 제 형 개발까지 병행될 예정이다. 세노바메이트는 전압의존성 나트륨 채널을 억제할 뿐 아니라 특히 지속적인 나트륨 전류를 강력하게 억제하는 특성이 있다. 또한 GABA_A 수용체에 대한 양성 알 로스테릭 조절 작용을 통해 억제성 신경전달을 강화한다. 이러한 이중 작용 기전은 신경세포 과 흥분을 억제하여 항경련 효과를 나타낼 뿐만 아니라, 신경망의 과도한 활성에 의해 악화되는 불 안장애나 신경병성 통증과 같은 질환에서도 치료적 가능성을 시사한다.
에슬리카바제핀은 카바마제핀 계열의 나트륨 채널 차단제로, 부분 발작 환자에서 보조요법과 단
독요법 모두에 대한 연구가 진행되었다(NCT01527513, NCT00988429, NCT00957372).
소아에서 인지 기능에 미치는 영향을 평가한 연구도 보고된 바 있다. 아직 신경병성 통증이나 양 극성 장애 등으로의 적응증 확장 연구는 본격적으로 진행되지 않았으나, 기전적 유사성을 고려하 면 삼차신경통 등에서 임상적 활용 가능성이 있다.
라코사미드는 나트륨 채널의 느린 불활성화를 촉진하는 특성을 가지고 있으며, 적응증 확장 에서 가장 활발한 연구가 진행되고 있다. SCN9A 유전자 변이에 따른 통증 환자를 대상으로 한 연구(NCT01911975), 만성 신경병증 환자 대상 장기 연구(NCT00237458), 급성 통증 환자를 위한 정맥 제제 연구(NCT06851910)가 대표적이다. 또한 특발성 전신 뇌전증 환자 (NCT02408523)에서도 임상시험이 보고되어 있어, 여러 영역에서의 임상적 확장이 두드러진 다. 라코사미드 기전 특성상 다른 나트륨 채널 차단제와 달리 느린 불활성화를 선택적으로 촉진 한다. 그러므로 정상 신경신호 전달에는 큰 영향을 주지 않으면서 병리학적 과흥분을 보이는 신 경세포 활동만 억제하는 것이 가능하여, 통증 조절 및 만성 신경질환에서 임상적 장점을 가진다.
실제로 임상 현장에서는 삼차신경통과 같은 난치성 신경병성 통증 환자에서 라코사미드의 오프
라벨 사용이 점차 늘고 있다. 스페인 통증학회의 조사에
서 오프라벨로 항뇌전증제가 사용되고 그 중 라코사미드가 비교적 높은
보고되었다. 이러한 임상적 경험은 라코사미드가
신경병성 통증 치료제로서 잠재 적 가치를 가진다는 점을 뒷받침한다.
페람파넬은 AMPA 수용체 길항제로, 기존 뇌전증 치료 외에도 신경퇴행성 및 정신질환 영역 으로 연구가 확대되고 있다. 특히, 글루타메이트 독성이 중요한 병리 기전으로 작용하는 신경퇴
행성 질환에서 치료적 가능성을 갖고있다. 근위축성 측삭경화증(ALS) 환자를 대상으로 한 연구 (NCT03020797)와 알코올 사용 장애 환자 대상 연구(NCT04502589)가 진행되었다. 또한, 현 재 발달성 뇌전증성뇌병증(DEE) 환자에서 페람파넬 사용 사례들이 보고되고 있으며, 일부 realworld 연구에서 발작 억제 효과가 관찰되었다. 이는 향후 무작위 대조 임상시험 설계의 근거가
될 수 있다. 다만 증례·관찰연구만으로는 적응증 확대를 뒷받침하기에는 근거수준이 낮으며, 추 가 연구가 필수적이다. 이러한 결과들은 글루타메이트 신경전달 억제 기전을 기반으로 신경과 정
신 영역 모두에서의 새로운 치료 전략으로 활용될 수 있음을 시사한다.
브리바라세탐은 SV2A 단백질에 선택적으로 결합하는 약물로, 레비티라세탐보다 높은 친화도 를 가진다. 특히 신경망의 과흥분을 안정화시켜 뇌전증뿐만 아니라 신경병성 통증 및 치매 관련 신경활동 조절에도 응용가능할 것으로 전망된다. 최근 연구에서는 척수 손상 환자의 신경병성 통 증 완화를 평가하는 무작위 위약 대조 연구(NCT04379011)와 알츠하이머병 환자에서 관찰되 는 해마의 과흥분성과 뇌전증적 활동에 대한 연구(NCT05899764)가 진행 중에 있다. 이로써 뇌 전증 치료제 중에서도 신경병성 통증 및 신경퇴행성 질환으로의 확장 가능성을 보여주는 대표적 인 사례로 평가된다.
임상시험 데이터를 종합하면, 항뇌전증제의 적응증 확장은 주로 신경병성 통증, 신경퇴행성 질 환, 그리고 정신질환 영역에서 활발히 진행되고 있다. 라코사미드와 브리바라세탐은 신경병성 통 증 연구에서 두각을 보이고 있으며, 페람파넬은 ALS와 알코올 사용 장애와 같은 신경·정신질환
에서 탐색적 연구가 이루어지고 있다. 세노바메이트와 에슬리카바제핀은 아직 발작 이외의 적응
증 확장 연구가 제한적이나, 기전적 가능성을 고려하면 향후 발전 가능성이 크다. 이러한 동향은
뇌전증 치료제가 단순히 발작 억제제에서 벗어나 신경계 전반의 질환을 대상으로 하는 다목적 치
료제로 진화하고 있음을 보여준다.
뇌전증은 만성적인
료 성공은 약물의 약리학적 효과뿐만
약물치료가 필요하다. 치
기존 약물의 제형을 개선하거나 새로운 제형을 개발하는 전략은 환자의 편의성과 안전성을 향상
시키는 중요한 수단으로 주목받고 있다. 본 글에서는 현재 FDA에서 승인된 뇌전증 치료제인 세
노바메이트, 에슬리카바제핀 아세테이트, 라코사미드, 페람파넬, 브리바라세탐을 중심으로 제형 개발 현황과 임상시험 동향을 살펴보았다.
세노바메이트는 현재 경구 정제로만 승인되어 있으나, 임상시험에서 경구 현탁액(Oral suspension)과 정제 간의 상대생체이용률 및 식이영향을 평가한 연구가 진행된 바 있다 (NCT04690751). 이는 연하곤란 환자나 소아 환자를 대상으로 한 제형 확장의 가능성을 보여 준다. 향후에는 구강붕해정이나 장기지속형 주사제와 같은 새로운 접근이 고려될 수 있으나, 아 직 구체적인 임상시험은 보고되지 않았다.
에슬리카바제핀 아세테이트는 1일 1회 복용이 가능한 서방형 정제로 승인되었으며, 제형 개발 측면에서 소아 환자를 위한 경구 현탁액 연구가 활발히 이루어졌다. 실제로 소아를 대상으로 한 임상에서 경구 현탁액의 효능과 안전성이 검증되었고(NCT00988156), 현탁액의 맛 선호도를 비교하는 연구까지 수행되었다(NCT02021461). 또한 소아의 약동학 및 장기 안전성을 확인하 는 과정에서도 현탁액 제형이 사용되었다(NCT02170064, NCT03108729). 이는 연령별 맞춤 형 제형 개발의 필요성과 가능성을 잘 보여준다.
라코사미드는 경구 정제, 경구 용액, 정맥주사제까지 다양한 제형으로 이미 상용화되어 있다. 특 히, 앞선 주제에서 언급했듯이 급성 통증 환자를 위한 정맥 제제 연구(NCT06851910)가 진행 되었고, 주사제로 허가되어있다. 국내에서는 SK케미칼에서 ‘빔스크 주’로 지난 2019년 출시되
었다. 그러나 ODT, 비강 스프레이, 설하정과 같은 새로운 투여경로를 다룬 임상시험은 확인되 지 않았다. 현재 등록된 연구는 기존 제형 내에서 약동학적 특성이나 안전성을 평가하는 데에 집
중되어 있다.
페람파넬은 정제와 함께 경구 현탁액 제형이 FDA 승인을 받았으며, 소아 환자를 대상으로 한
현탁액의 약동학 및 안전성 연구가 활발히 이루어졌다(NCT02849626, NCT02914314). 반감
기가 긴 약물 특성상 복합제 개발보다는 소아 및 연하곤란 환자를 위한 제형 단순화 전략이 임상 적으로 더 적합하다고 판단된다.
브리바라세탐은 경구 정제, 경구 용액, 정맥주사제로 승인되어 다양한 환자군에 투여할 수 있다.
다만 새로운 제형에 대한 임상시험은 진행되지 않았으며, 최근에는 경구 용액의 생체이용률과 식
이영향을 평가하는 연구(NCT06762743) 및 소아 환자에서의 정맥주사 제형 안전성을 확인하 는 연구(NCT03405714)가 보고되었다.
종합하면, 뇌전증 치료제의 제형 개발은 현재까지 주로 소아 환자 맞춤형 경구 현탁액을 중심으 로 진행되어 왔다. 그러나 실제 임상 상황에서 고려해야 할 환자군은 소아 외에도 연하곤란 환자,
응급 발작 환자, 그리고 복약 순응도가 낮은 만성 환자까지 다양하다. 향후 제형 개발의 방향은 구
강붕해정이나 구강필름을 통한 복용 편의성 개선, 비강 및 설하 제형을 통한 급성 발작 대응, 장 기지속형 주사제를 통한 복약 순응도 제고, 그리고 고정용량복합제를 통한 다약제 복용 부담 완
화로 확장될 가능성이 높다. 이러한 제형 혁신은 단순한 약물 전달 방식의 변화가 아니라 환자 삶 의 질을 개선하고 치료 효과를 극대화하는 중요한 전략으로 자리매김할 것이다.
중추신경계(CNS) 질환은 인류 보건의 중요한 과제로 자리 잡고 있으며, 뇌전증은 그중에서도 가장 흔한 만성 신경질환 중 하나로 환자의 삶의 질에 직접적인 영향을 미친다. 전 세계적으로 약
5천만 명 이상의 환자가 뇌전증을 가지고 있는 것으로 추산되며, 특히 약 30%의 환자는 기존 항
뇌전증제 치료에도 불구하고 발작 조절이 어려운 난치성 뇌전증에 해당한다. 이러한 점에서 뇌전
증 치료제 개발은 단순한 발작 억제를 넘어, 신경망 안정화와 뇌 기능 회복까지 포괄하는 새로운 패러다임으로 확장되고 있다.
1) 유전자 기반 치료제
최근 뇌전증 분야에서는 환자 개개인의 유전적 특성을 고려한 유전자 기반 치료제가 활발히 개
발되고 있다. Dravet 증후군은 주로 생후 첫 1년 내 발생하는 난치성 소아 발작 질환으로, 열성
발작과 다양한 형태의 강직성·간대성 발작이 특징이며,
발달 지연과 운동 기능 저하, 행동
문제를 동반할 수 있다. 이 질환의 대부분은 SCN1A 유전자 변이에 의해 발생하며, SCN1A는
뇌 신경세포에서 나트륨 채널 단백질을 생성하여 신경 흥분과 억제의 균형을 조절한다. SCN1A 변이가 존재하면 GABAergic 억제 뉴런 기능이 저하되어 발작이 쉽게 발생한다.
Zorevunersen은 ASO(Anti-Sense Oligonucleotide) 기반 치료제로, SCN1A RNA를 표
적하여 정상 단백질 생성과 신경세포 기능 회복을 유도한다. 현재 Phase 3 EMPEROR 연구 (NCT06872125)가 진행 중이며, 주요 평가 항목은 주요 운동 발작 빈도의 변화이다.
AAV9 기반 유전자 치료제 ETX101은 SCN1A 유전자를 GABA성 억제 뉴런에 전달하여 세 포 내 정상 단백질 발현을 촉진한다. 두 치료제 모두 SCN1A 변이에 따른 발작 억제와 신경 기능 회복을 목표로 개발되었으며, Dravet 증후군의 발병 기전과 환자 특성에 맞춘 표적 치료 전략의
대표적인 사례라 할 수 있다.
2) 디지털 기술과 AI 및 원격 관리 시스템
디지털 기술과 인공지능(AI)의 접목은 뇌전증 치료의 새로운 전환점을 제시하고 있다. 기존 약 물치료는 발작 억제 효과를 가져오지만, 환자 개별 특성에 따른 발작 양상 예측의
웨어러블 기기와 뇌파 기반 모니터링 기술은 환자의 일상생활에서 발작을 조기에 감지하고, 실
시간으로 뇌 활동을 추적할 수 있게 한다. 이는 의료진이 기존 진료실 중심의 제한된 정보를 넘어, 환자의 실제 생활에서 발생하는 발작 데이터를 포괄적으로 수집·분석할 수 있도록 하며, 치료 계 획의 정밀도를 높인다. 아울러 인공지능 기반 발작 예측 알고리즘은 수집된 대규모 데이터를 학
습하여 발작 발생 가능성을 사전에 경고하고, 환자와 보호자가 미리 대응할 수 있도록 돕는다. 이
러한 기술은 단순히 발작 감지에 머무르지 않고, 약물 복용 시점을 최적화하며, 환자 맞춤형 치료
전략 수립에 기여할 수 있다.
더 나아가, 디지털 치료제와 원격 관리 시스템은 약물치료의 구조적 한계를 보완하는 도구로 자
리 잡아가고 있다. 모바일 애플리케이션 기반의 인지 훈련 프로그램, 환자 자기관리 도구, 치료
순응도 관리 솔루션은 환자가 스스로 질환을 이해하고 치료 과정에 적극적으로 참여할 수 있도록 한다. 특히 원격 모니터링은 발작 기록, 약물 복용, 부작용 보고를 실시간으로 공유함으로써, 환
자와 의료진 간 상호작용을 강화하고 맞춤형 피드백을 가능하게 한다. 이는 환자의 치료 순응도
를 향상시키고, 장기적인 질환 관리에 긍정적인 영향을 미친다.
3) 신경조절 기기
뇌-컴퓨터 인터페이스(BCI)와 신경조절 기기의 발전은 난치성 뇌전증 환자에게 새로운 치료 대
안을 제공하고 있다. BCI는 뇌 신호를 직접 해석하여 외부 장치와 연결하는 기술로, 발작 발생 시 뇌파 변화를 실시간으로 분석하고, 필요 시 전기적 자극을 통해 신경망의 과흥분을 조절할 수 있는 가능성을 제시한다. 신경조절 기기 또한 뇌심부자극술, 미주신경자극술, 반응성 신경자극과 같은 형태로 발전하면서, 약물에 반응하지 않는 환자들에게 임상적으로 의미 있는 발작 감소 효 과를 보여주고 있다. 이들 기술은 약물 치료와 병용될 때 더 큰 시너지 효과를 발휘할 수 있으며, 환자 맞춤형 치료 옵션을 확장하는 데 기여한다.
종합하면, 뇌전증 및 CNS 질환 치료는 단일 약물 기전에 의존하는 전통적 접근에서 벗어나, 다 중 표적 약물, 정밀의학적 치료제, 디지털 치료제, 신경조절 기기, 인공지능 기반 관리 전략이 결 합된 통합적 패러다임으로 진화하고 있다. 앞으로의 연구는 환자 개별 특성을 고려한 맞춤형 치 료, 장기 안전성 검증, real-world 근거 축적을 통해 뇌전증 및 CNS 질환 치료 전략을 고도화해 야 한다. 이러한 변화는 단순히 발작 억제를 넘어 환자의 전인적 삶의 질 향상으로 이어질 수 있 는 새로운 치료 패러다임의 전환을 예고한다.
참고문헌
최다은. (2025.06.23). SK바이오팜, 세노바메이트 후속 전략···‘아시아 진출·적응증 확장’. 시사저널e. Retrieved from https://www.sisajournal-e.com/news/articleView.html?idxno=412777 최원석. (2025.07.08). SK바이오팜 ‘세노바메이트’ 유럽서 소아·청소년 투약 개발계획 변경 승인. PRESS9. Retrieved from https://www.press9.kr/news/articleView.html?idxno=65143
Ahuja, A., Agrawal, S., Acharya, S., Batra, N., Daiya, V., & BATRA, N. (2024). Advancements in wearable digital health technology: a review of epilepsy management. Cureus, 16(3).
Alcántara Montero A. (2022). Off-label use of lacosamide, an alternative for the treatment of neuropathic pain. Headache, 62(9), 1239–1240. https://doi.org/10.1111/head.14399
Cross, J. H., Laux, L., & Sullivan, J. (2024, September). MONARCH and ADMIRAL: open-label, phase 1/2a studies in USA and UK investigating safety, drug exposure, and clinical effect of zorevunersen (STK-001), an antisense oligonucleotide, in children and adolescents with Dravet syndrome [presentation]. In 15th European Epilepsy Congress.
Tanenhaus, A., Stowe, T., Young, A., McLaughlin, J., Aeran, R., Lin, I. W., ... & Tagliatela, S. (2022). Cell-selective adeno-associated virus-mediated SCN1A gene regulation therapy rescues mortality and seizure phenotypes in a Dravet syndrome mouse model and is well tolerated in nonhuman primates. Human Gene Therapy, 33(11-12), 579-597.
Wang, C., & Jing, W. (2025). Artificial intelligence in electroencephalography analysis for epilepsy diagnosis and management. Frontiers in Neurology, 16, 1615120.
Yamagishi, H., Osaka, H., Muramatsu, K., Kojima, K., Monden, Y., Mitani, T., Asakura, Y., Wakae, K., Nagai, K., & Tajima, T. (2024). Perampanel reduces seizure frequency in patients with developmental and epileptic encephalopathy for a long term. Scientific reports, 14(1), 30051. https://doi.org/10.1038/ s41598-024-82014-5
Zendehbad, S. A., Razavi, A. S., Tabrizi, N., & Sedaghat, Z. (2025). A systematic review of artificial intelligence techniques based on electroencephalography analysis in the diagnosis of epilepsy disorders: A clinical perspective. Epilepsy Research, 107582.
API 학회지 2025-1 Vol.5
뇌전증 치료제의 현재와 미래
발행 2025년 11월
제작 기획: 김주연, 신지혜, 안수연, 이승연, 이지원
디자인: 류세하, 소은수, 이지원, 차윤아, 이현진
소채민, 신지혜, 조영인, 장인성, 황숭흠, 유지연, 백승원
주소: 06974 서울특별시 동작구 흑석로 84 약학대학 및 R&D센터
발행처: 중앙대학교 약학대학 제약산업학회 API
E-mail: caupharmapi@gmail.com
