











1) 허가 승인에 따른 확증임상시험과 Phase4
2) Aducanumab의 환자접근성
1) Lecanemab과 다른 항체 의약품의 비교
2) Donanemab의 작용
1) 알츠하이머병 치료제 연구 동향
2) 알츠하이머병 바이오마커의 현주소
3) 알츠하이머병 진단법 연구 동향 -국내 진단법 연구 동향, 국외 진단법 연구 동향
알츠하이머병은 기억력을 포함한 인지 기능의 점진적인 악화가 특징인 질병이다 알츠하이머병은 세포 외부의 아밀로이드 베타를 포함하는 아밀로이드 플라크의 축적과, 세포 내부의 과도한 인산화 또는 비정상적인 인산화가 일어난 tau 단백질로 구성되는 신경섬유다발의 형성이 주된 병인으로 알려져 있다 이외에도 나이 및 성별, ApoE4 유전자 보유 여부, 염증 등이 알츠하이머 병에 영향을 미치는 기타 요인으로 알려져 있다 최근에는 알츠하이머병의 병인으로 tau가 주목받으면서
Ⅰ. 알츠하이머병의 병인
알츠하이머병은 치매의 한 종류로 퇴행성 뇌질환으로
인해 기억력을 포함한 인지기능을 점진적으로 악화시키는
것이 특징적이며, 이로 인해 유발되는 치매 증상은 전
세계적으로 노인 인구에서 치매 증상을 보이는 환자의
80% 이상을 차지한다[1] 보통 치매와 알츠하이머병을
혼용해서 사용하는 경우가 잦으나, 치매는 뇌에서
일어나는 인지 기능의 감소를 지칭하는 용어이며, 그
자체로 질환의 진단명을 이르는 것은 아니다
알츠하이머병은 생물학적으로 타우(tau) 함유 신경섬유
엉킴을 포함하는 아밀로이드 베타(amyloid beta, Aβ)의
존재로 정의되는 유전적, 산발적 신경 퇴행성 질환으로 정의된다[2] 발병 시에는 인지적인 증상이 먼저 일어나게
되며, 아밀로이드 축적이 동반되고, 이후 1 tau 병인(tau pathology) 및 뇌의 구조적 변화가 일어난다
알츠하이머병은 초기에는 환자들의 증상 악화가
점진적으로 일어나지만 이후 가속화되는 경향이 보인다
이로 인해 초기에 발견하고 치료하는 것이 환자의 인지
기능, 기억력 등을 보존하는 데 있어서 가장 중요하다
아포지단백(apolipoprotein E4, ApoE4)라고 부르는
인자도 알츠하이머병의 원인으로 제시된다 ApoE4 대립
유전자의 보인자는 알츠하이머의 발병 확률이 약 29%로 , 비보인자의 약 9%보다 3배 이상 높은 수치를 나타낸다
같은 ApoE4 보인자여도 흑인, 히스패닉보다는 백인, 아시아인이 알츠하이머에 걸리는 확률이 더 높은 것으로
알려져 있다 이 외에도 성별에 따라서 발병률이
달라지기도 하는데, 여성의 경우가 남성의 경우보다 약
1 5배 더 잘 발병한다[3]
2 알츠하이머병의 병인 – 아밀로이드 베타
알츠하이머병은 대부분 단일 원인이 아닌 여러 복합적
작용을 거쳐 발생하는 것으로 알려져 있으며, 현재까지도
알츠하이머병의 정확한 원인 규명을 위한 연구들이
활발히 이어지고 있다 현재 알츠하이머병의 원인을
설명하는 여러 가설들 중 가장 널리 받아들여지고 있는
2가지는 아밀로이드 베타 가설과 tau 단백질 가설이다
1) 아밀로이드 증폭 가설
Aβ는 막관통 단백질인 amyloid precursor protein (APP) 이 β-secretase, γ-secretase 에 의해 절단되어
생성되는 펩타이드로 이것이 응집 및 축적되어 플라크를
형성한다
APP 는 시냅스 형성 및 복구 , 뉴런에서의 전향성
(anterograde) 수송, 철 수출 등의 기능과 연관되어
있다[4] 해당 단백질은 단일 막관통 도메인, 세포 외
글리코실화된 N-말단과 비교적 짧은 세포질 C-말단으로
구성된다 APP는 대략 695에서 770개의 아미노산으로
구성되어 여러 동형(isoform)으로 존재하며 뇌에서 가장
풍부한 형태는 APP695이다[5]
사람의 APP는 Aβ 생성 경로 혹은 비생성 경로를 통해
처리된다(그림1) APP는 아밀로이드 비생성 경로에 따라 α-secretase, 또는 아밀로이드 생성 경로에 따라 βsecretase에 의해 절단되어 막으로 연결된 α- 또는 β-C 말단 단편(C-terminal fragment, CTF)을 생성한다 βsecretase 절단에 의해 생성된 APP의 99 아미노산 CTF(C99) 는 γ-secretase 에 의해 추가로 처리되어 최종적으로 Aβ40 및 Aβ42를 형성할 수 있는 43, 45, 46, 48, 49, 51 개 아미노산으로 구성되는 단편들을 생성한다[6]
AICD, APP intracellular domain; CTF, C-terminal fragment; sAPP, secreted amyloid precursor protein
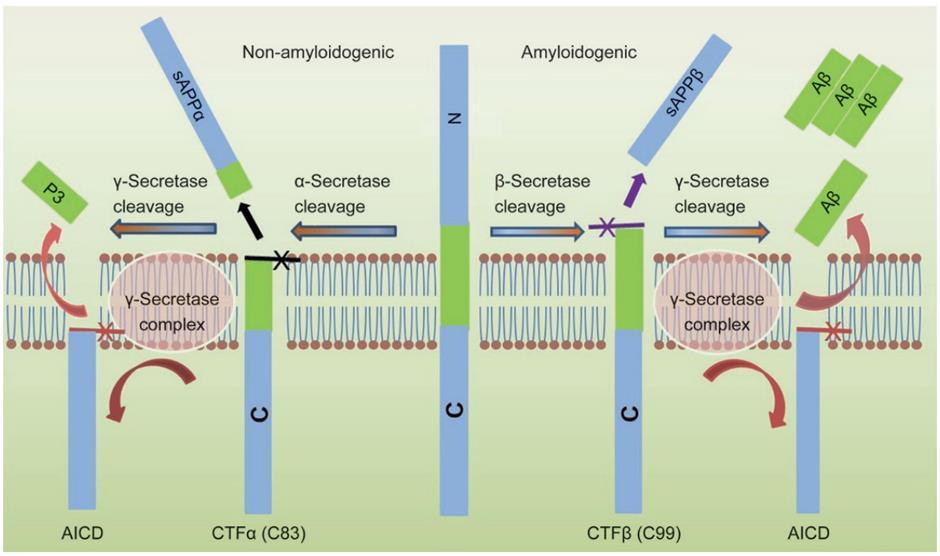
그림1. APP 단백질 절단 경로 (출처: Chen et al., 2017)
Aβ42 는 알츠하이머병 환자의 뇌에서 발견되는
아밀로이드 플라크의 대부분을 구성하며 , Aβ40 은
뇌척수액에 Aβ42보다 몇 배 더 존재하며 Aβ42보다
응집이 느리다는 특징을 가진다
또한, γ-secretase에 의해 C99이 절단되면서 APP
세포내 도메인 (APP intracellular domain, AICD) 이
유리된다 AICD는 핵으로 전위되어 세포 사멸 유전자
발현을 유도하는 등의 조절을 할 수 있다
캐스페이즈(caspase)에 의한 APP/C99 절단이 신경독성
펩티드(C31)를 생성한다는 것도 이와 연관지어 이해할 수
있다[7] β-구역 APP 절단 효소(β-secretase enzyme, BACE) 는 뉴런에 풍부하게 존재하며 , 뇌에서
아밀로이드를 생성하는 방향의 APP 처리를 촉진하고
뉴런 손상 및 생존 저해를 야기할 수 있다
유전적 요인에 의해 발병하는 조기 발현형 가족성
알츠하이머병(early-onset familial Alzheimer’s disease, EOFAD)은 위와 같은 APP나 secretase를 부호화하는
유전자의 돌연변이에 의해 발생한다 그 중에서도 γsecretase 복합체를 구성하는 presenilin-1, presenilin2를 암호화하는 유전자의 돌연변이가 EOFAD의 주요한 원인으로 여겨진다[8] 이러한 돌연변이는 Aβ를 과잉
생성, 축적시키며 알츠하이머병을 일으킨다
앞서 살펴본 아밀로이드 증폭 가설에서와 같이 Aβ
펩타이드가 섬유 형태로 응집, 플라크 축적이 일어나며
뉴런을 파괴, 알츠하이머병에 영향을 줄 것이라는 내용의
연구가 진행되어왔다 그러나 아밀로이드 플라크
자체만으로는 알츠하이머병의 직접적인 연관은 밝힐 수
없다는 연구가 보고되기도 했다[9] 그 이후 단순히 Aβ
축적이 아닌, 특정한 종류의 Aβ가 알츠하이머병 발생에
관여한다는 아밀로이드 가설이 제시되었다
Aβ가 축적되어 형성된 2노인반(senile plaque) 에서
신경세포 퇴행을 관찰할 수 있기에 특정한 종류의 독성
Aβ가 신경세포 파괴 및 알츠하이머 발병에 기여할 것으로
추정할 수 있었다 몇 종류의 올리고머는 장기강화(longterm potentiation)를 약화하기도 한다고 알려졌다[10]
섬유를 형성하고 뉴런을 손상시키는 데 영향을 주는 Aβ의
정확한 작용 기전 및 분자생물학적 특징은 아직 잘 알려져
있지 않지만, 관련 연구가 지속되고 있다
2 알츠하이머병의 병인 – 타우 단백질 이상
Tau는 주로 신경세포의 축삭(axon)에서 발견되는
미세소관 연관 단백질 (microtubule-associated protein) 이며 , 본래 친수성의 비정형 (disordered)
단백질이지만 자가 응집성 베타 병풍(β-sheet) 구조를
형성하려는 경향이 있다 알츠하이머병의 진행과정에서
tau는 뇌의 인지기능을 담당하는 다양한 영역에서 응집된
형태로 나타난다[11][12] Tau 응집체가 알츠하이머병을
일으키는 과정을 설명하는 다양한 이론과 가설이 있다
1) 과인산화 가설
먼저, tau 단백질은 미세소관 결합 부위(microtubulebinding region, MBR)를 통해 미세소관과 결합하며, tau 의 인산화 / 탈인산화의 균형에 의해 친화도가 조절된다[13](그림2) 생리적 환경에서 tau 단백질은 접히지 않고 인산화된 형태이다
알츠하이머병 환자의 뇌에서는 tau의 인산화를 조절하는
tau 인산화효소(kinase)의 상향 조절(upregulation)

또는 탈인산화효소 (phosphatase) 의 하향
조절(downregulation)에 의해서 비슷한 나이의 건강한
사람의 뇌와 비교하여 과도하게 인산화된 형태의 tau
단백질 또는 비정상적인 위치에서 인산화된 tau 단백질이 많이 발견된다
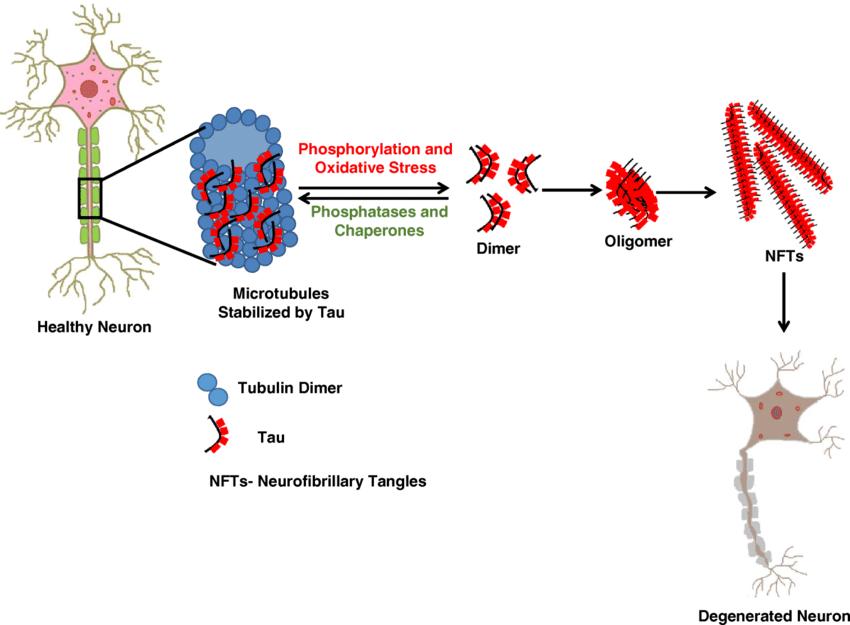
과인산화 된 tau 단백질은 미세소관으로부터 분리되며,
구조적인 변화를 통해 다른 tau 단백질들과 응집되면서
이량체에서 팔량체에 이르는 다양한 tau 다량체를 형성해
3 신경섬유다발 (neurofibrillary tangles, NFT) 을
형성한다[14](그림3) NFT는 알츠하이머병을 포함한
다양한 신경 퇴행성 질환에서 관찰되며, 이 질병에서
중요한 역할을 하는 것으로 알려져 있다
그림3. 알츠하이머병에서 타우(tau) 단백질의 병태생리 (출처: Gorantla, N.V. et al., 2018)
2 노인반(senile plaque): .알츠하이머병 환자의 뇌실질에서 관찰되는 구조로, Aβ가 축적되어 형성되는 플라크이며 강한
NFT는 신경세포 내에서 생성되지만, 신경세포가 사멸할
때 원래 세포가 있던 자리에 남아 세포 바깥에 위치한다
이는 일명 ghost tangles 로 불리며 , 알츠하이머병
환자들에서 흔히 관찰된다 또한, 비슷한 연령의 건강한
사람의 뇌와 비교했을 때, 알츠하이머병 환자의 뇌에는
세포 외 공간에 존재하는 총 tau 단백질의 양이 4~5배
정도로 더 많으며, 이들은 비정상적으로 과인산화된
형태이다[15],[16] 정상 상태에서는 주로 신경세포의
축삭에 위치하는 tau 단백질이 세포체수상돌기 (somatodendritic site)로 이동하게 된다 이러한 과정의
결과로 미세소관의 탈응집 (disintegration), 신경의
수송시스템 붕괴, 불용성 침전물의 생성 등이 발생하며
뉴런 간 연결의 파괴 또는 세포의 사멸까지 이어지게 된다
2) 엔도좀-리소좀 경로
알츠하이머병이 엔도좀-리소좀 경로(EndosomalLysosomal pathway)를 통해 일어난다는 이론도
존재한다[17] 단량체 tau와 달리 다량체(oligomer)
형태의 tau는 세포질의 단백질 분해효소에 저항성이 있기
때문에 엔도좀-리소좀 경로를 통해서만 제거될 수
있다(그림4) 이 과정에서 일어나는 지속적이고 점진적인
실패가 tau 응집 연쇄 반응의 주요 유발인자라는 이론이며, 마치 리소좀 경로에 의한 저장병과 유사하다
미토콘드리아 대사 생성물 및 다른 세포막으로부터 온
단백질들은 리소좀 경로에 진입하는데 나이가 증가할수록
이 경로에 결함이 생겨서 부분적으로 소화되거나 응집된
분해 산물이 방출되고, 리포푸신(lipofuscin) 형태로
세포질에 축적된다[18] 알츠하이머병 환자의 뇌 절편을
형광현미경으로 관찰하면 많은 신경세포 내에 리포푸신이
짙은 황색의 자가 형광을 띄는 세포 내 과립으로 다수
존재하는 것이 보인다[18] 이러한 분해산물이 tau
단백질 응집에 있어서 초기 핵 형성(nucleation)의
기질이라는 것이 현재 가장 유력한 이론이라고 할 수 있다
한편, 막 단백질인 APP와 presenilin는 엔도좀-리소좀
경로에 의한 가공과정이 필요하다 정상상태에서는 이
단백질들에서 일어나는 다양한 돌연변이가 tau 응집의
직접적인 원인이 되지는 않는다 그러나 , 나이가
증가하면서 이 경로에 결함이 증가하게 되면 이미
혼잡해진 엔도좀-리소좀 경로에 의해 처리되어야 하기
때문에 tau 단백질의 응집을 유발하는 결정적 결함이
발생하는 시기를 앞당기는 요인으로 작용한다[19]
APP, amyloid precursor protein; PS, presenilin; TREM2, triggering receptor expressed on myeloid cells 2
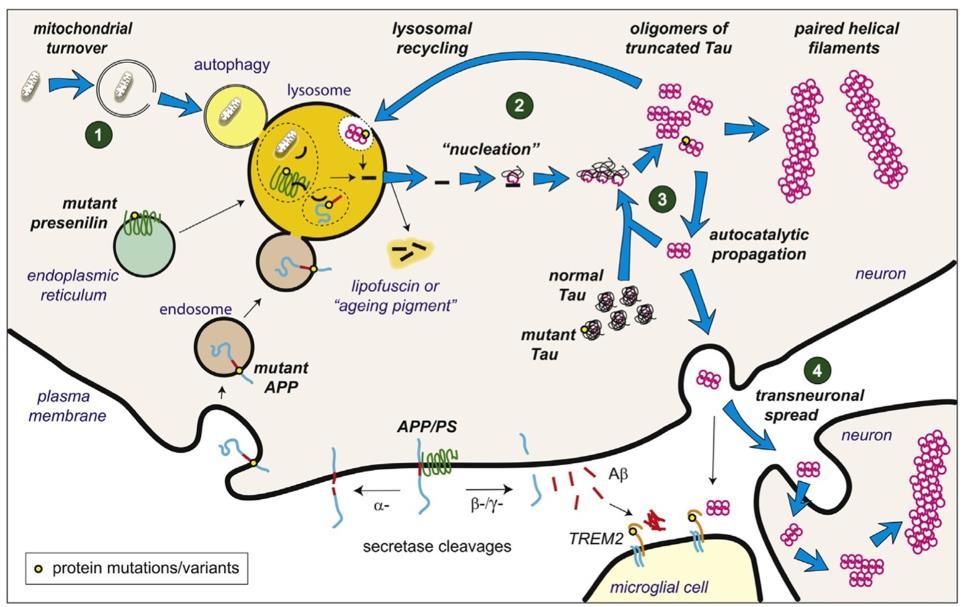
그림4.
형성과정 (출처: Wischik, C. M., 2014)
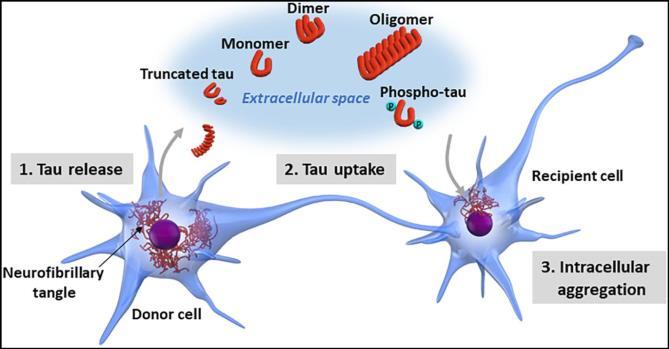
3) 인접한 뉴런 간의 비정상 tau 단백질의 전파: 프리온 유사 전파
또한, 신경세포에서 생성된 tau 응집체는 다른 인접한
뉴런으로 전파되는 특징이 있다 정확한 메커니즘은
아직까지 연구가 진행 중이지만 크게 세 단계를 거쳐
전파가 일어난다[20](그림5)
그림5. Tau 단백질이 한 뉴런에서 인접한 뉴런으로 전파되는
과정 (출처: Takeda, S., 2019)
먼저, 공여 세포(donor cell)의 세포 내에서 형성된
병리적인 형태의 tau는 신경 세포 파괴 등을 통해 세포
바깥 공간으로 배출되거나, ghost tangles로부터 tau의
유리가 일어나 세포 바깥에 위치하게 된다 이후 인접한
수용 세포(recipient cell)의 세포 표면에서 일어나는
수동확산이나 세포내이입 또는 4 세포 간
나노튜브(cellular nanotube) 등을 통해서 세포 내로
흡수된다[21] 흡수된 tau는 수용 세포의 세포 내 새로운
tau 응집체의 형성을 촉진한다 Tau의 전파는 신경세포의
네트워크에서 양방향으로 일어날 수 있는 것으로 알려져
있어 , tau 의 전파가 오로지 시냅스 전달 (synaptic transmission)을 통해서만 일어나는 것이 아님을 알 수
있다[22],[23] 최근에는 5엑소좀(exosome)이 뉴런 간에 tau를 전달하는 메커니즘에 관여할 수도 있다는 연구도 보고되었다[24]
이러한 전파는 6 프리온 유사 작용 (prion-like behavior)을 통해 일어나는 것으로 알려져 있으며, tau 단백질에서 반복되는 아미노산 서열이 이러한 성질을
부여하는 것으로 생각된다 [25] NFT 중심의 끝이
잘린(truncated) tau 조각들이 정상적인 용해가능한 tau를 섬유성 tau 다량체가 되어 뭉치도록 촉매하기 때문에 병인성 tau 단백질이 프리온과 같은 성질을 띠게
된다 그러나 , tau는 프리온과는 다르게 아직까지
인간에서 개인 간 전염성이 있는 것으로 확인되지 않았다는 점에서 프리온과는 차이점이 있다[26]
4) Tau와 Aβ와의 관계 : Fyn-tau-아밀로이드 toxic triad
Tau와 Aβ는 서로 다른 메커니즘을 통해 알츠하이머병에
작용하는 것처럼 보이지만, 둘 사이에도 상호작용이 있다
Tau 단백질과 Aβ 플라크 사이의 관계를 설명하는 이론 중
하나로 7Fyn-tau-amyloid의 toxic triad가 있다[27]
정상적인 tau는 세포 내의 분류 시스템에 의해서 주로
뉴런의 축삭(axon)에 위치하게 된다(그림6 왼쪽) 또한
tau은 C 말단 도메인을 통해 미세소관과 결합하지만, N
말단 도메인을 통해서 Fyn 인산화효소와도 결합할 수
있다[28] Tau는 Fyn 인산화효소와의 상호작용을 통해
Fyn 인산화효소를 수지상 돌기의 연접이후 치밀질
(postsynaptic density, PSD)로 이동시킨다 이동한 Fyn
인산화효소는 수지상극(dendritic spine)에서 NMDA
수용체의 subunit 2를 인산화하고 이 수용체의 PSD
단백질(PSD95)과의 상호 작용을 안정화시킨다[29] 그 결과 신경전달물질인 글루탐산 (glutamate) 에 의한
신호전달이 강화되어 Aβ 독성이 강화된다
4세포 간 나노튜브(Cellular nanotube): 한 세포에서 다른 세포로 뻗어나온 돌기(protrusion)로 세포들 사이에서 단백질이나 바이러스 등 다양한 종류의 분자를 수송하는 통로
5엑소좀(exosome): 세포 내에서 생성되어 세포 외부로 방출되는 소낭(vesicle)의 일종으로 진핵생물체에서 세포 간 정보교환을 위해 50~150nm 크기로 분비된다
6 프리온(prion): 단백질로 이루어진 감염성 입자 정상적인 구조의 단백질을 다시 접음으로써 비정상적인 구조를 가지는 단백질로 변환시키며 포유류에서 신경퇴행성 질환의 원인이 된다
7Fyn: 티로신 단백질 인산화효소 종양유전자(protein-tyrosine kinase oncogene) family에 속하는
그림6. A toxic triad in Alzheimer’s Disease (출처: C. Haass et al., 2010)
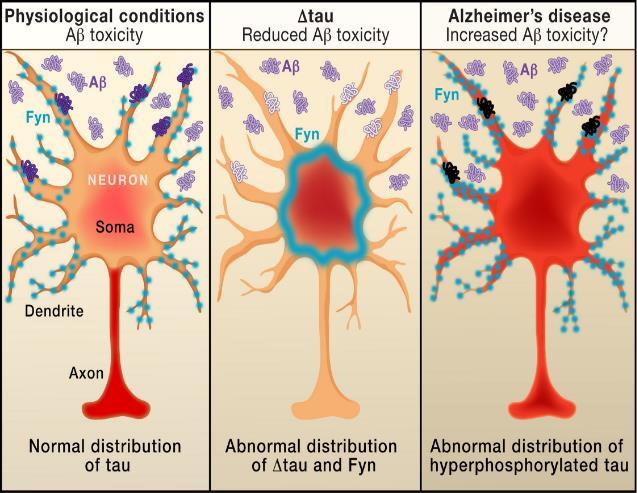
정상적인 생리환경 및 병리적 환경에서의 tau 단백질(빨간색)과 Fyn 인산화효소(파란색)의 위치를 나타낸 그림 정상적인 tau는 주로
뉴런의 축삭에 위치하지만, 뉴런의 수송 시스템이 완전히 효율적이지는 않기 때문에 일부는 세포체에 남기도 한다(왼쪽) C 말단이 없는 ∆Tau가 과발현되면 Fyn 인산화효소에는 결합하지만 미세소관에는 결합하지 않는 tau가 많이 생기고 Fyn 인산화효소가 세포체에 격리되고 수상돌기로 이동하지 못한다(중간) 알츠하이머병에서는 비정상적으로 과인산화된 tau가 축삭에서 세포체-수상돌기 구획으로 재분포된다 그 결과 tau 의존적인 Fyn 인산화효소의 수상돌기로 이동이 일어나고 신경세포에 대한 Aβ의 독성 효과가 강화된다(오른쪽)
이를 검증하기 위해 정상 tau에 존재하는 C 말단
도메인이 결실된 ∆ Tau 변이체 단백질을 형질전환
마우스 (transgenic mice) 에서 발현시켰다 ∆Tau
변이체는 Fyn 인산화효소에는 결합하지만 미세소관에는
결합할 수 없다 그 결과 Fyn 인산화효소는 수상돌기에
도달하지 못하고 세포체에 격리되며, Fyn 인산화효소에
의해 매개되는 NMDA 수용체의 인산화가 감소하여 Aβ
독성 또한 감소하였다(그림6 중간) 이러한 결과를 통해
Fyn 인산화효소의 수상돌기로의 이동은 정상 tau에
의존적이라는 것을 알 수 있다
알츠하이머병의 주요한 특징인 tau의 과인산화 또는
비정상적 인산화가 일어나면 tau는 축삭에서 세포체 수상돌기 구획 (somatodendritic compartment) 으로 재분포가 일어난다(그림6 오른쪽)[30] Tau의 재분포는 tau 의존적인 Fyn 인산화효소의 이동을 강화시켜
수상돌기로
정상적인 뇌 발달 과정에선 tau 단백질과 다른 미세소관
연관 단백질 (microtubule associated proteins) 들이
신경세포 전체에 분포하지만, 분화가 진행되면서 tau는
축삭 쪽으로 이동하게 된다 그러나, 알츠하이머병 및
다른 퇴행성 뇌질환에서는 tau 의 이동패턴이
파괴되며[30], Aβ의 독성 효과를 증가시킨다
신경세포에서 Fyn 인산화효소와 tau의 관계를 응용하여
알츠하이머병의 치료제를 개발하는 새로운 전략을 세울
수 있을 것으로 기대된다 현재까지 Fyn 인산화효소에
의한 NMDA 수용체의 인산화를 막음으로써 흥분독성에
의한 신경세포 손상을 막는 펩타이드가 개발되었다[31]
한편, Fyn-tau-amyloid triad에서 정상 tau는 주로
축삭에 위치하는데, 어떻게 Fyn 인산화효소가 수상돌기로
이동하는데 관여하는지에 대해서는 의문을 제기할 수
있다 이 과정에 다른 단백질이 관여하는 것은 아닌지
생각해볼 수 있지만, Fyn 인산화효소과 tau외에 다른
단백질이 중간에 관여하는 것인지 아직까지는 불분명한
상태로 남아있다
.
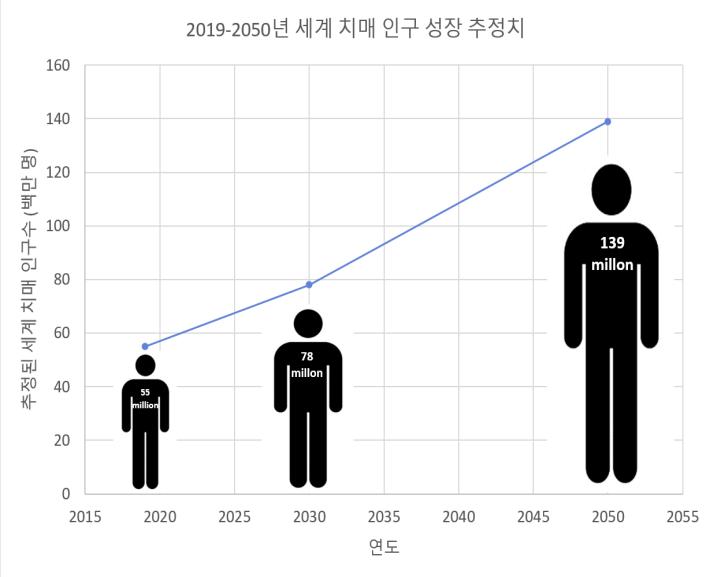
1 치매 유병인구 현황 및 전망
알츠하이머 협회 (Alzheimer’s Disease
International)에 따르면 세계 치매 환자 수는 2019년
5500만 명에서, 2050년에는 약 1억 3900만 명으로
늘어날 것으로 예측된다[32](그림7) 2050년 세계 예상
인구로 97억 명이 예측되는데, 이는 세계 인구 중 약 1%
가 치매 환자라는 수치이다[33]
한국은 2020년 기준, 전국 65세 이상의 추정 치매환자
수가 약 84만 명이었고, 이는 65세 이상 노인인구의 10 2%가 치매 환자라는 수치이다[34] 즉, 10명 중 한
명은 치매를 앓고 있다는 것이다 한국의 치매환자 증가율
또한 상당하다 ‘2016년 치매유병률조사’에서는 한국
치매 환자 수가 2024년에는 100만, 2039년에는 200 만을 넘어설 것으로 예측하였다 ‘ 2012 년
치매유병률조사’에서는 2041 년에 200 만을 넘을 것이라고 예측했지만, 이보다 2년이 앞당겨진 것이다
치매환자 증가 속도가 더 가팔라지고 있음을 알 수 있다
특히, 한국은 전세계에서 가장 빠르게 치매 환자가
늘어나는 국가가 될 것으로 전망된다 한국은 2000년에
8고령화 사회에 진입하였고, 9초고령 사회까지 26년이
걸릴 것이라고 추정된다 이는 세계에서 가장 빠른
고령화를 보이는 일본에 비해서도 10년이나 빠른
속도이다[35]
2 알츠하이머병 관련 비용
고령화로 인해 유병률이 증가하고, 진단기술 또한
발달하면서 알츠하이머병 환자 수가 증가하고 있기
때문에, 치료제에 대한 수요도 계속해서 늘어나고 있다
국내의 알츠하이머형 치매치료제 시장 규모(보험급여
청구액 기준)는 2016년을 기준으로 약 2155억원
규모이었고, 글로벌 시장규모는 2015년을 기준으로 약
31 1억불(약 3 5조원)이었다
8고령화 사회: 65세 이상의 인구가 전체 인구의 7% 이상인 사회
9초고령화 사회: 65세 이상의 인구가 전체 인구의 20% 이상인 사회
그림7. 2019-2050년의 추정된 세계 치매인구 수 (출처: WHO global status report 2021)
시장 규모는 계속해서 증가할 것으로 예상되며
전세계적으로 2024년까지 4배 이상 성장할 것이라고
예측한다[36]
환자의 돌봄과 관련한 비용을 포함한 사회적 비용 또한
상당하다 사회적 비용은 직접비용과 간접비용을
포함한다 직접비용에는 치매환자의 치료와 보호를 위해
사용되는 비용이며, 간접비용은 보호자의 노동시간 손실
등의 비용을 의미한다 보건복지부의 2011년 치매노인
실태조사에 따르면 한국의 국가치매관리비용은 2010년
약 8조 7천억 원에서 2050년 134조 5천억 원까지
늘어날 것으로 예측된다[37] 미국의 경우, 2022년
알츠하이머병 및 기타 치매에 10Medicare 와 11Medicaid
지급액 2060억 달러를 포함하여 약 3210억 달러의
비용이 투여될 것이라 예측되고 있다 치매의 완전한
치료나 예방이 가능해지지 않는 이상, 2050년에는
알츠하이머병에 1조 달러에 달하는 비용이 들 것으로
예상된다[38]
10Medicare: 미국의 노인 의료보험제도. 20년 이상 사회보장세를 납부한 65세 이상의 노인과 장애인에게 연방 정부가 의료비의 50%를 지원하는 제도
11Medicaid: 미국의 빈곤층 의료보험제도
1993년 최초의 치매약 ‘Tacrine(Cognex®)’부터 2014년
FDA 승인을 받은 ‘Namzaric®’까지 여러 종류의 치료제가
개발, 승인되어 사용되고 있으나(표1) 모두 ACEI, NMDA receptor antagonist와 같은 발병 후 나타나는 증상을
완화하는 수준에 그친다 2015 년까지 ‘ Aricept®’, ‘Exelon®’ 등 기존 오리지널 약품의 특허 만료와 저가
제네릭 의약품의 시장잠식 등으로 인해 당분간 큰
성장률은 보이지 않겠으나 , 차세대 알츠하이머병
치료제의 등장으로 시장은 지속적으로 성장할 것으로
예상된다[39]
한편, 현재 개발 중인 신약 후보물질은 근본적인 질병
완화제제를 중심으로 알츠하이머병 치료제 연구 및 임상 시험이 진행되고 있다 신경전달물질과 그 수용체 뿐만 아니라 알츠하이머병의 발병 기전과 연관되는 염증, amyloid beta, tau 등을 타겟으로 하는 여러 신약이 개발
중에 있다(그림8) 이러한 타겟들은 전임상(preclinical)
작용기전
Acetylcholinesterase Inhibitors
Cognex Tacrine
Aricept Donepezil
Exelon Rivastigmine
Razadyne Galantamine
NMDA receptor antagonists

Namenda
단계의 연구가 임상(clinical) 단계의 약물 수보다 많거나, 임상과 전임상에서 모두 많은 연구가 진행 중이다 즉, 근본적 치료제로의 연구가 최근 들어 더욱 활발히 진행되고 있음을 확인할 수 있다[40] Pharmtivation
Memantine
복합체 Namzaric Donepezil + Memantine
2017년부터 2021년까지의 국내 알츠하이머병 의약품
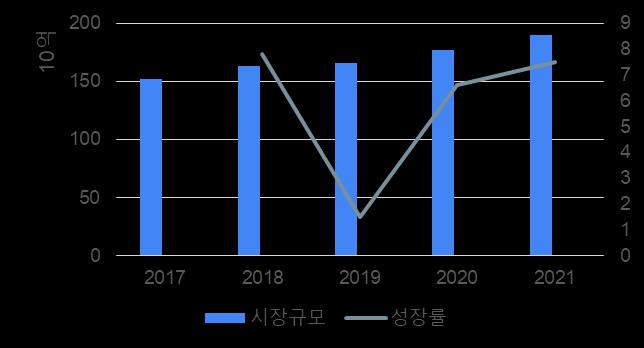
시장의 규모는 매년 성장하는 추세를 보였다 그러나,
성장률은 2019년에 매우 낮아지는 것을 확인할 수
있다 ( 그림 9) 실제로 2019 년의 의약품 시장 규모
성장률은 1 5%였지만, 다른 해에는 모두 7%에 가까운
값들을 보여준다
두 번째 이유인 도네페질 29개사 49개 품목에서 ‘혈관성
치매‘ 적응증이 삭제된 것에 대해 살펴보겠다 도네페질
경구제가 임상 재평가 결과 혈관성 치매(뇌혈관질환을 동반한 치매) 증상 개선에 유효성을 입증하지 못하여 비급여 전환되었다 제약사들은 자신들의 치료제가 가진
각 적응증에 대해 임상시험을 실시하고, 그 결과를 식약처에 제출했으나 식품의약품안전처는 도네페질제가
혈관성 치매에 대한 유효성을 입증하지 못한 것으로
평가하였다 따라서 도네페질제는 알츠하이머형 치매
증상 치료로는 계속 사용할 수 있지만, 혈관성 치매 증상
개선을 위해서는 처방될 수 없게 되었다 제약업계
관계자는 비록 하나의 적응증이 삭제된 것일 뿐이더라도
알츠하이머병 치료제 시장에서 적응증이 삭제된
그림9. 2017~2021년의 국내 AD 제약시장의 규모와 성장률 (출처: IQIVIA)
2019년에 다른 해에 비해 성장세가 작은 이유로
도네페질제의 오리지널인 ‘Aricept®’의 약가 인하와
혈관성 치매에 대한 도네페질제의 급여 삭제를 뽑을 수
있다 먼저, 사용량-약가 연동의 협상 결과로 2019년에
아리셉트 5 종류의 가격이 조정되어 약가가
인하되었다(표2)
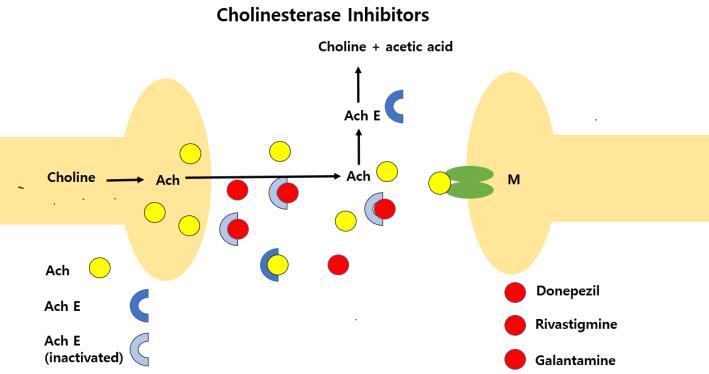
현재 시장에서 주로 사용되고 있는 알츠하이머 병 치료제의 대부분은 저분자 의약품들로, 크게 아세틸콜린 에스터레이즈 저해제(acetylcholinesterase inhibitors, ACEIs) 계열의 약인 donepezil, rivastigmine, galantamine과 NMDA 수용체 길항체 계열의 약인 memantine이 사용되고 있다
1) 아세틸콜린에스터레이즈 저해제
이 약들은 공통적으로 신경전달물질인
아세틸콜린 (acetylcholine) 을 분해하는 효소인
아세틸콜린에스터레이즈 (acetylcholinesterase, AchE) 를 저해하여 시냅스에서 신경전달 물질인
아세틸콜린의 농도를 높임으로써 니코틴성 아세틸 콜린
수용체 (nAchR) 및 무스카린성 아세틸콜린
수용체(mAchR)에 대한 아세틸콜린의 효과를 강화 및
연장시키는 작용을 함으로써 알츠하이머 병에서 인지
기능의 개선 효과를 나타내는 효과를 보인다(그림10)[41]
Memantine은 글루탐산(glutamate) 수용체의 일종인 NMDA(N-Methyl-D-Aspartate) 수용체에 반경쟁적
저해제 (uncompetitive inhibitor) 로 작용하는 통로
차단제(channel blocking antagonists)이며, 중등도에서
중증 단계의 환자들에게 사용된다 ( 그림 11)
[43] Memantine은 중추신경계에서 NMDA 수용체의
과도한 활성화는 막으면서 , 정상적인 활성은
유지하여 알츠하이머병 및 다른 신경 퇴행성 질환들에서
신경독성을 감소시킨다[44]
그림10. 아세틸콜린에스터레이즈와 이를 저해하는
아세틸콜린에스터레이즈 저해제의 메커니즘
그러나, ACEIs 계열의 약들은 장기적인 관점에서
알츠하이머병의 진행을 막거나, 근본적인 병리적 기전에
영향을 주지는 못하는 한계가 있다 또한, ACEIs들에
의해서 mAchR가 활성화 됨으로써 메스꺼움, 구토, 설사와 같은 부작용이 나타날 수 있으며, nAchR의 과도한
활성화는 진전 및 근육 경련 등의 부작용을 일으킬 수
있다[41]
한편, galantamine은 경증-중등도의 알츠하이머병에
효과를 보이는 데, donepezil 또는 rivastigmine처럼
아세틸콜린에스터레이즈 저해제로 작용할 뿐만 아니라, 니코틴 수용체의 알로스테릭 자리에 결합하는 이중 작용
기전을 갖고 있다는 차이점이 있다[42]
그림11. 흥분성 시냅스에서 NMDA 수용체 길항제의
작용기전을 나타낸 그림 (출처: Rogawski et al., 2003)
Memantine은 ketamine과 같은 다른 NMDA 수용체
길항제(antagonists)들과 마찬가지로, 높은 농도에서는
학습 및 기억에서 중요한 역할을 하는 시냅스
가소성(synaptic plasticity)을 저해하는 것으로 알려져
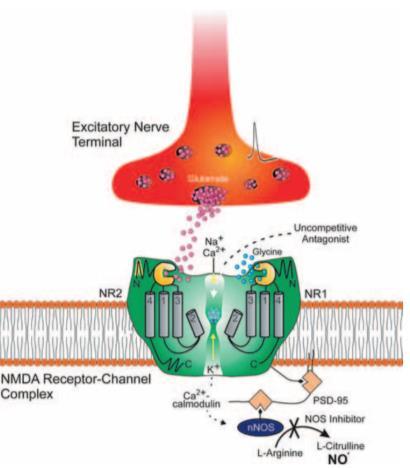
있으나[45], 임상적으로 사용되는 더 낮은 농도에서는
신경가소성을 촉진하고, 알츠하이머병의 동물 모델들에서
기억을 증진시키는 것으로 알려져 있다
알츠하이머병에서 memantine은 인지 및 행동 기능의
저하가 일어나는 속도를 일시적으로 감소시킬 뿐만
아니라, 첫 치료 개시 3개월 동안에는 개선효과도 보일
수있다 그러나 , 다른 한편으로는 memantine 은
nAchR 과의 상호작용 외에도 ACEIs 와 AchE 의
상호작용에 영향을 미침으로써 ACEIs의 치료적 활성을
방해할 가능성도 있는 것으로 알려져 있다
[1] Anand, R., Gill, K. D., & Mahdi, A. A. (2014). Therapeutics of Alzheimer's disease: Past, present and future. Neuropharmacology, 76, 27-50.
[2] David S. Knopman, Helene Amieva, Ronald C. Petersen, Gäel Chételat, David M. Holtzman, Bradely T. Hyman, Ralph A. Nixon, & David T. Jones. Alzheimer disease. HHS Public Access: 1
[3] Cummings, J. L., & Cole, G. (2002). Alzheimer disease. Jama, 287(18), 2335-2338.
[4] Chen, G. F., Xu, T. H., Yan, Y., Zhou, Y. R., Jiang, Y., Melcher, K., & Xu, H. E. (2017). Amyloid beta: structure, biology and structure-based therapeutic development. Acta Pharmacologica Sinica, 38(9), 1205-1235.
[5] Guerreiro, R. J., Gustafson, D. R., & Hardy, J. (2012). The genetic architecture of Alzheimer's disease: beyond APP, PSENs and APOE. Neurobiology of aging, 33(3), 437-456.
[6] Olsson, F., Schmidt, S., Althoff, V., Munter, L. M., Jin, S., Rosqvist, S., ... & Lundkvist, J. (2014). Characterization of intermediate steps in amyloid beta (Aβ) production under nearnative conditions. Journal of Biological Chemistry, 289(3), 1540-1550.
[7] Lu, D. C., Shahrooz, R., Shayya, R. F., Ellerby, L. M., Salvesen, G. S., Koo, E. H., & Bredesen, D. E. (2000). A second cytotoxic proteolytic peptide derived from β-amyloid precursor protein. Neurobiology of Aging, (21), 255.
[8] Sherrington, R., Rogaev, E. I., Liang, Y. A., Rogaeva, E. A., Levesque, G., Ikeda, M., ... & George-Hyslop, S. T. (1995). Cloning of a gene bearing missense mutations in early-onset familial Alzheimer's disease. Nature, 375(6534), 754-760.
[9] Terry, R. D., Masliah, E., Salmon, D. P., Butters, N., DeTeresa, R., Hill, R., ... & Katzman, R. (1991). Physical basis of cognitive alterations in Alzheimer's disease: synapse loss is the major correlate of cognitive impairment. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society, 30(4), 572-580.
[10] Walsh, D. M., Klyubin, I., Fadeeva, J. V., Cullen, W. K., Anwyl, R., Wolfe, M. S., ... & Selkoe, D. J. (2002). Naturally secreted oligomers of amyloid β protein potently inhibit hippocampal long-term potentiation in vivo. Nature, 416(6880), 535-539.
[11] Ghoshal, N., Garcıa-Sierra, F., Wuu, J., Leurgans, S., Bennett, D. A., Berry, R. W., & Binder, L. I. (2002). Tau conformational changes correspond to impairments of episodic memory in mild cognitive impairment and Alzheimer's disease. Experimental neurology, 177(2), 475-493.
[12] Mitchell, T. W., Mufson, E. J., Schneider, J. A., Cochran, E. J., Nissanov, J., Han, L. Y., ... & Arnold, S. E. (2002). Parahippocampal tau pathology in healthy aging, mild cognitive impairment, and early Alzheimer's disease. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society, 51(2), 182-189.
[13] Gustke, N., Steiner, B., Mandelkow, E. M., Biernat, J., Meyer, H. E., Goedert, M., & Mandelkow, E. (1992). The Alzheimer‐like phosphorylation of tau protein reduces microtubule binding and involves Ser‐Pro and Thr‐Pro motifs. FEBS letters, 307(2), 199-205.
[14] Gorantla, N. V., & Chinnathambi, S. (2018). Tau protein squired by molecular chaperones during Alzheimer’s disease. Journal of Molecular Neuroscience, 66(3), 356-368.
[15] Khatoon, S., Grundke‐Iqbal, I., & Iqbal, K. (1992). Brain levels of microtubule‐associated protein τ are elevated in Alzheimer's disease: A radioimmuno‐slot‐blot assay for nanograms of the protein. Journal of neurochemistry, 59(2), 750-753.
[16] Khatoon, S., Grundke-Iqbal, I., & Iqbal, K. (1994). Levels of normal and abnormally phosphorylated tau in different cellular and regional compartments of Alzheimer disease and control brains. FEBS letters, 351(1), 80-84.
[17] Wischik, C. M., Harrington, C. R., & Storey, J. M. (2014). Tau-aggregation inhibitor therapy for Alzheimer's disease. Biochemical pharmacology, 88(4), 529-539.
[18] Ihara, Y., Morishima-Kawashima, M., & Nixon, R. (2012). The ubiquitin–proteasome system and the autophagic–lysosomal system in Alzheimer disease. Cold Spring Harbor perspectives in medicine, 2(8), a006361.
[19] Guerreiro, R., Wojtas, A., Bras, J., Carrasquillo, M., Rogaeva, E., Majounie, E., ... & Hardy, J. (2013). TREM2 variants in Alzheimer's disease. New England Journal of Medicine, 368(2), 117127
[20] Takeda, S. (2019). Tau propagation as a diagnostic and therapeutic target for dementia: potentials and unanswered questions. Front Neurosci. 2019; 13: 1274.
[21] Holmes, B. B., DeVos, S. L., Kfoury, N., Li, M., Jacks, R., Yanamandra, K., ... & Diamond, M. I. (2013). Heparan sulfate proteoglycans mediate internalization and propagation of specific proteopathic seeds. Proceedings of the National Academy of Sciences, 110(33), E3138-E3147.
[22] Ahmed, Z., Cooper, J., Murray, T. K., Garn, K., McNaughton, E., Clarke, H., ... & O’Neill, M. J. (2014). A novel in vivo model of tau propagation with rapid and progressive neurofibrillary tangle pathology: the pattern of spread is determined by connectivity, not proximity. Acta neuropathologica, 127(5), 667-683.
[23] Takeda, S., Wegmann, S., Cho, H., DeVos, S. L., Commins, C., Roe, A. D., ... & Hyman, B. T. (2015). Neuronal uptake and propagation of a rare phosphorylated high-molecular-weight tau derived from Alzheimer’s disease brain. Nature communications, 6(1), 1-15.
[24] Asai, H., Ikezu, S., Tsunoda, S., Medalla, M., Luebke, J., Haydar, T., ... & Ikezu, T. (2015). Depletion of microglia and inhibition of exosome synthesis halt tau propagation. Nature neuroscience, 18(11), 1584-1593.
[25] Goedert, M., Masuda-Suzukake, M., & Falcon, B. (2017). Like prions: the propagation of aggregated tau and α-synuclein in neurodegeneration. Brain, 140(2), 266-278.
[26] Sanders, D. W., Kaufman, S. K., DeVos, S. L., Sharma, A. M., Mirbaha, H., Li, A., ... & Diamond, M. I. (2014). Distinct tau prion strains propagate in cells and mice and define different tauopathies. Neuron, 82(6), 1271-1288
[27] Haass, C., & Mandelkow, E. (2010). Fyn-tau-amyloid: a toxic triad. Cell, 142(3), 356-358.
[28] Lee, G., Newman, S. T., Gard, D. L., Band, H., & Panchamoorthy, G. (1998). Tau interacts with src-family non-receptor tyrosine kinases. Journal of cell science, 111(21), 3167-3177.
[29] Nakazawa, T., Komai, S., Tezuka, T., Hisatsune, C., Umemori, H., Semba, K., ... & Yamamoto, T. (2001). Characterization of Fyn-mediated tyrosine phosphorylation sites on GluRε2 (NR2B) subunit of the N-methyl-D-aspartate receptor. Journal of Biological Chemistry, 276(1), 693-699.
[30] Ballatore, C., Lee, V. M. Y., & Trojanowski, J. Q. (2007). Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nature reviews neuroscience, 8(9), 663-672.
[31] Aarts, M., Liu, Y., Liu, L., Besshoh, S., Arundine, M., Gurd, J. W., ... & Tymianski, M. (2002). Treatment of ischemic brain damage by perturbing NMDA receptor-PSD-95 protein interactions. Science, 298(5594), 846-850.
[32] World Health Organization. (2021). Global status report on the public health response to dementia.
[33] United Nations Department of Economic and Social Affairs, Population Division (2022). World Population Prospects 2022: Summary of Results. UN DESA/POP/2022/TR/NO. 3.
[34] 이지수, 강민지, 이옥진, 곽미영, 서지원, 고임석,(2022), 「대한민국 치매현황 2021」, 중앙치매센터
[35] https://www.nid.or.kr/info/diction_list2.aspx?gubun=0201
[36] 이영찬(2017), 「알츠하이머병 글로벌 시장 분석」, 『KHIDI 보건산업브리프』 239
[37] 2022 Alzheimer's disease facts and figures. (2022). Alzheimer's & dementia : the journal of the Alzheimer's Association, 18(4), 700–789.
[38] 정안나(2015), 「치매 분야 국가연구개발 조사분석보고서」, 『KHIDI HT R&D 이슈리포트 』 10
[39] van Bokhoven, P., de Wilde, A., Vermunt, L., Leferink, P. S., Heetveld, S., Cummings, J., ... & Vijverberg, E. G. (2021). The Alzheimer’s disease drug development landscape. Alzheimer's Research&Therapy, 13(1), 1-9.
[40] World Health Organization. (2017). Global action plan on the public health response to dementia 2017–2025.
[41] Giacobini, E. (2000). Cholinesterase inhibitor therapy stabilizes symptoms of Alzheimer disease. Alzheimer Disease & Associated Disorders, 14(1), S3-S10.
[42] Samochocki, M., Zerlin, M., Jostock, R., Groot Kormelink, P. J., Luyten, W. H. M. L., Albuquerque, E. X., & Maelicke, A. (2000). Galantamine is an allosterically potentiating ligand of the human α4/β2 nAChR. Acta Neurologica Scandinavica, 102, 68-73.
[43] Rogawski, M. A., & Wenk, G. L. (2003). The neuropharmacological basis for the use of memantine in the treatment of Alzheimer's disease. CNS drug reviews, 9(3), 275-308.
[44] Parsons, C. G., Quack, G., Bresink, I., Baran, L., Przegalinski, E., Kostowski, W., ... & Danysz, W. (1995). Comparison of the potency, kinetics and voltage-dependency of a series of uncompetitive NMDA receptor antagonists in vitro with anticonvulsive and motor impairment activity in vivo. Neuropharmacology, 34(10), 1239-1258.
[45] Rogawski, M. A. (2000). Low affinity channel blocking (uncompetitive) NMDA receptor antagonists as therapeutic agents–toward an understanding of their favorable tolerability. Amino acids, 19(1), 133-149.
현재까지 사용되고 있는 알츠하이머병 치료제는 donepezil, rivastigmine, galantamine, memantine과 같은
저분자 의약품이 대부분이다 그러나, 알츠하이머병 치료에는 일시적인 증상 완화보다 근본적으로 질병의 병리적
기전에 영향을 줄 수 있는 질병 완화제제(disease-modifying therapy, DMT)의 개발이 필요한 상황이다
Aducanumab(Aduhelm®)은 아밀로이드 베타(Amyloid beta, Aβ)에 결합하는 단일클론항체로, 뇌 속의
아밀로이드 플라크를 감소시키는 기전을 통해 알츠하이머병의 초기 단계에 작용할 수 있다 Aducanumab은 그
이전에 개발된 Aβ를 표적으로 하는 다른 항체 의약품들과 분자적인 특성, 임상 시험 디자인, 뇌혈관장벽(bloodbrain barrier, BBB) 통과 비율 등에서 차이점이 있다
이러한 특징을 갖는 aducanumab은 2021년 6월, 미국 식품의약품안전청(Food and Drug Administration, FDA)으로부터 신속심사 경로를 통해 조건부승인을 받았지만, 유효성과 안전성으로 인한 문제 등으로 FDA
자문위원회의 반대에 부딪히기도 하며 승인 과정에서 여러 논란이 존재했다 Aducanumab이 FDA에서 허가 받은
신속심사제도가 다른 국가에서는 그 특징이 어떻게 되고, 이에 따라 해당 약물의 승인 결과는 국가별로 어떠한
차이가 존재하는 지 살펴보며 허가 과정에서의 논란에 대해 자세히 살펴보고자 한다
Ⅰ. 근본적인 알츠하이머병 치료제 개발의 필요성 통해 알츠하이머병에 대한 치료적 개입은 질환이
앞서 소개한 acetylcholinesterase inhibitors(AChEIs)
계열 약물이나, memantine과 같은 N-methyl-Daspartate(NMDA) 수용체 길항제는 모두 근본적인
치료가 아닌 , 일시적으로 증상을 완화시키는
약물들이다 이러한 증상적인 치료는 뇌의 병태 생리에는
영향을 미치지 못하기 때문에 근본적인 치료가 될 수 없으며, 실제로도 알츠하이머병을 치료하는데 있어서 한정된 기간동안 치료효과가 있다는 공통적인 문제점이
있다 지난 20년간의 알츠하이머병에 대한 연구결과들을
심해지기 전인 경도인지장애 (mild cognitive impairment, MCI) 혹은 경도 치매에서 더 효과적임을
알게 되었다 그러나 앞서 소개한 약물들은 알츠하이머
병이 어느정도 진행된 후에 사용되는 약물들이라는 점
역시 한계점을 가진다 또한, 시판되고 있는 증상완화제로
치료가 시작될 경우 평생 약물을 복용해야 하므로 1인당
치료제 소비가 타 치료제에 비해 높다는 점에서도
근본적인 질병 완화제제(disease-modifying therapy, DMT) 개발의 필요성이 더 커지고 있다
결국 알츠하이머병에 대한 증상 개선제들이 이미 있지만, 여전히 알츠하이머병에서 초기 단계에 작용하면서 뇌의 병태생리에 작용할 수 있는 근본적인 치료제의 개발이
필요한 상황이라고 할 수 있다 Aducanumab 역시
이러한 배경에서 연구된 Aβ를 표적으로 하는 항체
의약품이며, aducanumab을 비롯해 현재 개발 진행 중인
다수의 약물은 증상완화보다도 질병 자체의 완화를 그
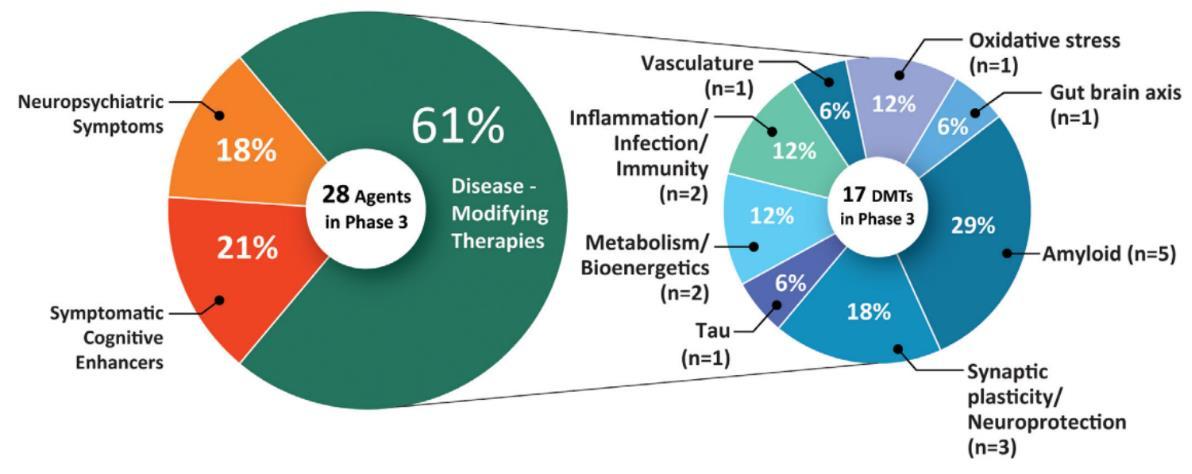
목표로 한다 2021년 치료제 개발 현황을 살펴보면, 임상
3상의 알츠하이머병 치료제의 61%, 임상 2상의 86%가
DMT에 해당한다(그림1)[1]
그러나 아직 알츠하이머병을 비롯한 퇴행성 뇌 질환은
명확하게 밝혀진 단일 질병기전이 없고, 여러 장애요인이
존재하기 때문에 근본적인 치료제 개발이 어렵다[2]
현재까지 연구된 알츠하이머 발병의 주요 가설은 Aβ의
침전, 아세틸콜린 합성 감소, tau의 과인산화 등이다 이
중 아밀로이드 가설을 바탕으로 aducanumab, donanemab, gantenerumab 등의 DMT가 개발되고 있다
Ⅱ. Aducanumab,이전의항체치료제와무엇이다른가
는 시도는 존재했으나, 항체 치료제 중 알츠하이머병
치료제로 FDA 승인을 통과한 것은 aducanumab이 처음이다 그렇다면, 다른 항체 치료제들과 비교하여 aducanumab은 어떤 점이 달랐을까? Aducanumab이
FDA승인을 통과하게 만든 요인에는 어떤 것이 있을 지 몇가지 꼽아보았다
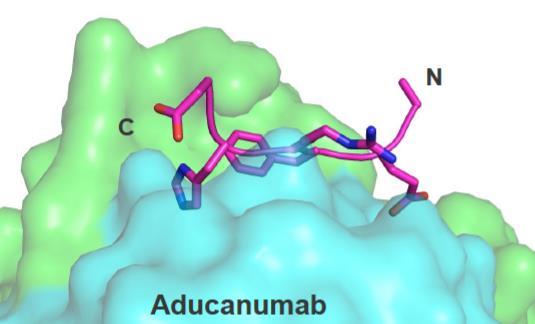
먼저, aducanumab의 결정구조를 들 수 있다 Aβ 펩타이드와 aducanumab의 결합은 매우 얕고 좁은
결합부위를 가지고 있다는 점에서 이전의 다른 항 Aβ
항체치료제와는 다르다(그림2) 이러한 좁은 결합부위는
aducanumab과 Aβ 펩타이드 사이에 아주 적은 접촉만
가능하게 하기 때문에, 다양한 Aβ 형태 중에서도
알츠하이머병과 연관된 응집된 형태의 Aβ에 대해
aducanumab이 결합 특이성을 갖도록 한다[2] 만약 aducanumab이 특이도가 낮아서 모든 형태의 Aβ에 결합
Aducanumab은 Aβ에 결합하는 단일클론 IgG1 항체로, 뇌 속의 아밀로이드 플라크를 감소시키는 작용을 한다[1]
Aducanumab 이전에도 다른 항체 치료제들을 통해 알츠하이머병의 원인인 아밀로이드 침전물을 감소시키려 그림2. Aducanumab과 Aβ가 결합한 결정구조의 모양 (출처: Arndt et al., 2018)
한다면, 고농도의 aducanumab이 뇌 속에 있는 타겟과
안전하게 상호작용 할 수 없을 것이다 Aducanumab의
높은 특이도와 친화도는 알츠하이머병의 임상적 증상으로
이어지는 병리적인 진행과정을 막아줄 기회를 제공한다
2 임상 시험 디자인에서의 진보 : When to treat?
지난 20년간 항체 개발 및 임상 시험 디자인 및 도구에서의 진보가 이루어진 점 또한 다른 점이라고 할 수
있다 앞서 진행된 연구들을 통해, Aβ를 표적으로하는
치료적 접근은 광범위한 신경 퇴행이 발생하기 이전인
질병 초기 단계에 개시될수록 성공적이라는 것이
밝혀졌다[3] 이는 바이오젠에서 시행한 aducanumab
임상 시험 프로그램의 디자인에 반영되어, 임상시험
등록단계에서 부터 PET 이미징을 진행하여 Aβ가
존재하는 것으로 진단된 환자, 즉 인지 증상의 초기 단계에
있는 환자를 대상으로 등록하도록 했다 앞선 항체 치료제
연구들이 임상시험 대상을 단순히 알츠하이머병 환자로
정의한 것과는 달리 치료에서 더 효과적일 것으로
기대되는 대상들을 선정한 것이다
3 뇌혈관 장벽(Blood-Brain Barrier, BBB) 통과
알츠하이머병에 대한 새로운 치료법이 나오지 않는 가장
큰 원인은 뇌혈관장벽 (blood-brain barrier, BBB)
때문이라고 할 수 있다
BBB 는 혈액과 중추신경계 실질조직 (CNS parenchyma) 사이에서 형성된 장벽으로 분자량이
400 500Da 이하인 작은 분자들만 통과 가능하며, 이 중에서도 수소결합을 많이 형성하는 분자들은 통과하지
못한다 고효율 스크리닝 (High-throughput screening)기법으로 개발된 저분자 약물(small molecule drug) 들의 98% 이상이 BBB 를 통과하지 못하며 , 분자량이 더 큰 생물학적 제제 또한 BBB를 통과할 특별한
전략이 없다면 거의 100%에 가깝게 통과할 수 없기 때문에 뇌에 작용하는 생물학적 제제의 개발을 어렵게 하는 요인으로 작용한다[4] BBB 통과가 어려운 이유와
aducanumab 이 이를 통과하는 메커니즘에 대해
살펴보도록 하자
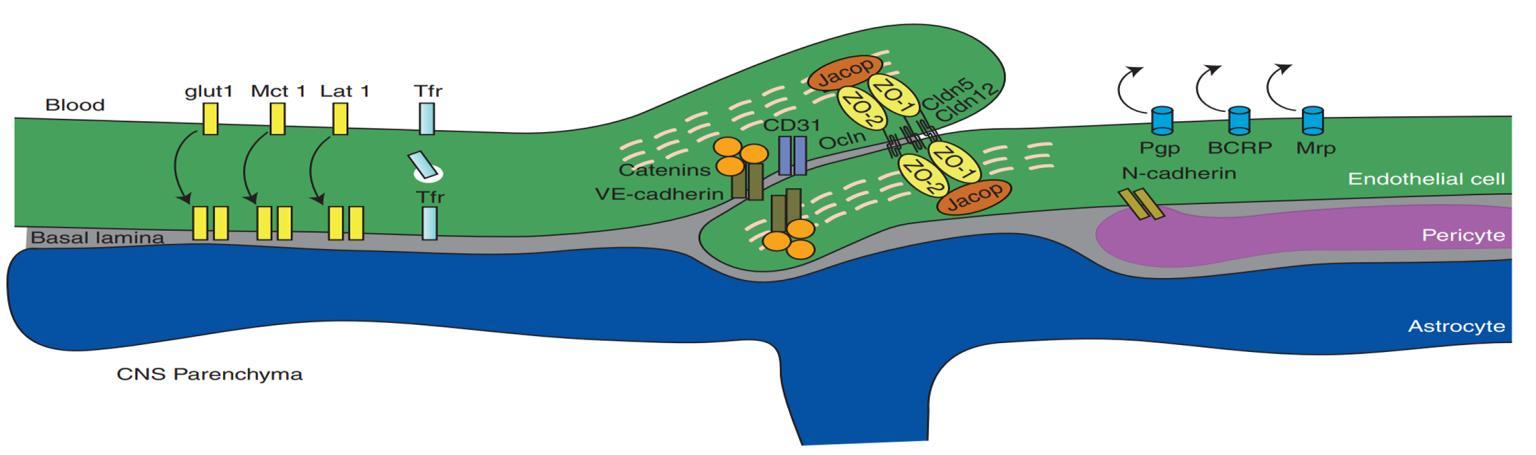
1) 뇌혈관장벽의 물리적 장벽을 구성하는 요소 3가지
BBB가 약물 통과를 어렵게 하는 이유는 이를 구성하는
3가지 정도의 물리적 장벽들이 존재하기 때문이다 첫째, 일반 말초혈관들에 비해 BBB 에서는 내피세포 (endothelial cells) 들이 잘 발달된 밀착 연접(tight junction)에 의해 단단히 결합하고 있어
이온과 분자들에 대한 강력한 장벽을 형성해 세포주위통로(paracellular pathway)를 통한 뇌혈관장벽 통과가 어렵다(그림3)[5]
Glut, Glucose Transporter, Mct, Monocarboxylate Transporter 1; Lat1,L-type Amino Acid Transporter 1; Tfr, The transferrin receptor; CD31, Clusterof Differentiation 31; Ocln, Occludin; ZO-1,2, Tight Junction protein-1,2, Cldn5.12 ;Pgp, P-glycoprotein;BCRP, breast cancer resistance protein MRP,MDRassociated protein
그림3. BBB를 구성하는 분자들을 표현한 모식도. CNS, central nervous system; VEcad, VE cadherin.
(출처: Daneman et al., 2015)
이러한 연접은 claudin, occludin, JAM 등의 막
단백질 (transmembrane proteins) 들이 구성하고
있다[6] 연접의 세기는 조직이 발견되는 위치에 따라
다르지만, 세포 배양 실험을 통해 최대 4 nm 크기의
전하를 띄지 않는 분자들이 크기 선택적인 투과성을 갖고
있으며 크기가 더 큰 분자들은 통과가 어렵다 [7],[8]
둘째 , 내피 세포 바깥에서 성상세포 (astrocytes) 가
내피세포 주변을 둘러싸고 있어, BBB의 통과를 어렵게
한다[5] 성상세포는 BBB의 형성과정과 기능에 중요한
작용을 하는 아교 세포 (glial cell) 의 한 종류이며 , 성상세포의 돌기는 신경세포의 돌기 또는 혈관 구조를
감싸고 있다[9] 셋째, 내피세포 표면에 발현된 수송
단백질 (transport protein) 들이 BBB 에 진입했던
약물들을 다시 배출하기도 한다
중추신경계의 내피세포에는 뇌와 혈액 간의 이온 및
분자의 수송을 위한 수송단백질들이 발현된다 이러한
단백질 중에는 약물의 배출을 촉진하는 Mdr1, BCRP(breast cancer resistance protein), MRPs(multidrug resistance protein) 등의 유출
수송체가 존재하며[5], 이들은 주로 내피세포의 정단부에
위치하여 다양한 소수성 약물에 대한 장벽을 형성한다
특히, 이 중 Mdr1은 ‘P-glycoprotein’이라고도 불리며
Mdr1의 발현과 약물 저항성에 대한 연구가 많이 알려져
있다 즉 BBB는 뇌세포의 정상대사에 필요한 물질을
공급하고, 독성물질과 병원체들로부터는 뇌를 보호하는
기능을 하지만 약물 전달 측면에서는 오히려 CNS로
향하는 약물의 통과를 감소시켜 신경질환 치료 약물과
항체의 전달을 어렵게 하는 문제가 있다[5]
2) Aducanumab의 뇌혈관장벽 통과 메커니즘 : 약물에 의해 유도된 BBB 변성(disruption)
Aducanumab이 이전에 개발된 항체 치료제들과 다른
차이점 중 하나가 BBB를 통과하는 메커니즘이 있다는
것이다 Aducanumab 이전에 개발된 항체 치료제들은
임상시험에서 실패한 경우가 많았다 그 이유는 뇌의 BBB
구조를 통과하는지의 여부가 중요하게 다루어지지 않아
정맥 주사 후 실제 BBB를 통과하여 뇌 속으로 진입하는
항체의 비율이 매우 낮기 때문이다 [10]
Aducanumab 역시 다른 항체 치료제들처럼 항체가 BBB를 통과하는 특별한 메커니즘을 고려하여 개발되지는
않았으나, 약물에 의해 유도된 BBB 변성(disruption)을
통해 약물이 뇌 속으로 진입할 수 있다[10] 이 사실은
aducanumab의 임상 2상 시험에서 뇌 아밀로이드의
감소 정도와 aducanumab의 중요한 부작용 중 하나인
1ARIA의 발생이 선형적인 상관관계가 있음을 통해서 알
수 있다[11] 결과적으로는 aducanumab이 BBB 구조의
일부를 파괴하여 뇌 속으로의 진입을 용이하게 만들기
때문에 다른 항체 의약품과 비교하였을 때 정맥주사 후
CSF에서 발견되는 항체의 양이 많은 것이라고 볼 수 있는
것이다
3) Aducanumab의 잠재적 한계점과 항체 치료제의 미래
중요한 성공 요인 중 하나로 볼 수 있는 BBB 통과가 aducanumab 의 주된 부작용인 ARIA 의 발생과 상관관계가 있다는 점은 여전히 해결해야할 과제로
보인다 ARIA 부작용을 일으키지 않는 항 Aβ 항체는
특별한 BBB 통과전략이 없다면 뇌의 아밀로이드
플라크를 감소시키지 못한다[12] 하지만 약물에 의해
유발되는 BBB 변성에 의해 BBB를 통과한다면, 약물의
안정성을 판단하는 지표인 치료계수 (therapeutic index)가 작아 ARIA 발생 등의 약물 부작용의 발생빈도가 높을 것으로 예상해볼 수 있을 것이다
최근 로슈에서는 이전에 실패했던 항체 치료제인
gantenerumab을 이중항체 전략으로 개량하여 BBB 통과 비율을 높인 후보물질을 만들어 임상시험을 다시
진행하고 있다 이 약물은 수송체 매개 세포통과 (transporter-mediated transport) 를 통해
BBB를 통과하는 전략을 갖고 있으며, 고용량에서도
알츠하이머병 환자들에서 aducanumab보다 적은 ARIAE 부작용을 발생시키는 것으로 보고되고 있다[13]
Aducanumab의 BBB 통과 메커니즘은 부작용과도
관계가 있는 만큼, 심각한 부작용을 일으키지 않으면서도
1ARIA: 베타 아밀로이드를 표적으로 하는 해당 항체 계열약에 대표적 중증 이상반응(amyloid-related imaging abnormalities)
항체 치료제가 BBB를 통과할 수 있도록 하는 메커니즘을
가진 신약을 개발하는 것이 앞으로의 알츠하이머병
치료를 위한 항체 치료제의 미래로 보인다
Ⅲ. Aducanumab의조건부승인, 무엇이문제인가
Aducanumab은 FDA에서 최초로 승인된 알츠하이머병
치료제다 단순히 증상을 완화하는 것이 아닌 근본적인
질병의 원인을 치료한다는 점에서 해당 약물이 혁신적인
것은 분명하나, aducanumab이 FDA의 허가를 얻어내는
과정에서 여러 논란이 존재했다 Aducanumab 은
미국에서 FDA 의 신속심사 과정을 통해 조건부
승인되었고 현재 임상적 유익성을 확인하는 단계에 있다
이에 반해, 유럽과 한국에서는 유효성 및 안전성에 관련된
문제 등으로 허가받지 못한 상황이다 본 파트에서는
aducanumab이 승인받은 경로가 포함되는 신속심사
제도는 국가별로 어떻게 다른지, 이로 인한 승인 여부의
차이는 어떻게 되는지 분석해보고자 한다 따라서 크게
허가 현황과 국가별 신속심사제도에 대해 살펴보며 허가
관련 논란에 대한 분석을 진행해 보려고 한다
1 허가 현황
Aducanumab은 미국과 유럽에서 허가 심사를 받았지만
그 결과는 상이했다 미국의 허가 당국인 FDA 의
자문위원회에서 11명 중 8명의 심사위원이 승인에
반대했고 2명의 심사위원은 ‘불확실’이라는 결정을
내렸다[14] 반대한 심사위원들은 aducanumab의
유효성이 불분명하다는 점과 부작용이 존재한다는 이유를
들었다 하지만 이러한 자문위원회의 반대에도 불구하고
FDA는 2021년 6월 7일에 신속심사 제도를 통해 aducanumab의 허가를 승인하였다 신속심사 제도의
조건에 따라, 시판 후 임상 4상을 통해 aducanumab의
유효성을 증명해야 약물의 허가가 확실시된다 이에 반해, 유럽에서는 2021년 12월, 유럽의 허가 당국 EMA의
소속위원회인 CHMP에서 aducanumab 의 승인에 반대입장이 우세하여 허가 신청을 거절하였는데, 거절한 사유로는 유효성과 안전성의 이슈가 있었다 유효성 이슈로는 뇌의 Aβ 감소가 알츠하이머병의 임상적
개선으로 이어지는지에 대한 연관성이 확립되지 못한
점과, 임상시험인 Study 301과 302의 상충하는 주요
연구 결과로 인해 aducanumab의 유효성이 임상시험을
통해서 확실히 입증되지 못했다는 점들을 들었다
안전성의 이슈로는 부종 및 출혈을 암시하는 이상 반응인
ARIA등의 무시할 수 없는 수준의 부작용의 발생과 이상 반응의 모니터링 및 관리의 어려움을 들었다[15] 이러한
결정에 대해 바이오젠 측은 현재 EMA에 재검토를
요청하였지만, 이후 이에 대한 판매 허가 신청을 철회한 상태이다
이렇듯 약물의 허가 승인을 받지 못한 유럽과는 달리
자문위원회의 반대를 무릅쓴 FDA의 이례적인 승인
결정이 미국의 허가 과정 등에 관련된 여러 가지 논란을
빚었다 그러면 이제부터 국가별 신속 심사 프로그램의
어떠한 차이가 승인 여부의 차이를 초래했는지 살펴보자
2 각 국가별 신속 프로그램의 차이
신속 프로그램은 심각하고 위험한 질병을 치료할 수 있는 의약품을 최대한 빠르게 환자들이 사용할 수 있도록
제공하기 위해 만들어진 프로그램으로, 의학적 미충족을
해결하거나 전염병 사태에서 신속하게 공급되어야 하는
등 사회적 요구가 큰 의약품에 대해 적용된다[16] 본
파트에서는 국가별 신속 프로그램에 해당하는 제도들의
특징을 구체적으로 살펴보고 , 그 중에서도
aducanumab이 허가된 경로인 신속 심사(Accelerated Approval) 제도의 국가별 차이점을 구체적으로
알아보고자 한다
1) 미국의 신속 프로그램
미국의 일반적인 의약품의 승인 절차는 다음 그림과 같다(그림4) 제조사는 허가 신청서를 제출하기 전에, 첫 번째로 임상시험계획 승인신청(Investigational New Drug Application, IND) 을 제출하는 임상시험
신청단계를 거치며 이후 임상시험을 통해 신약의
안전성과 유효성을 확인하게 된다[17] 이때, 일반적인
신약의 경우 임상적 평가변수(clinical endpoint)를
그림4. 미국의 신약 허가 승인 절차 (출처: APEC 규제조화센터, 미국 의약품 허가제도)
이용하여 임상시험의 결과 분석을 진행하게 된다 임상
1상에서는 약물의 약동학(Pharmacokinetics) 을, 2상에서는 약의 용량과 부작용을, 3상에서는 통계적으로
유의미한 데이터를 확보함으로써 여러 번에 걸쳐 약의 안전성과 유효성을 검토하게 된다 임상시험을 통해
신약에 대한 데이터를 확보한 후에는
신약허가신청서(New Drug Application, NDA)를
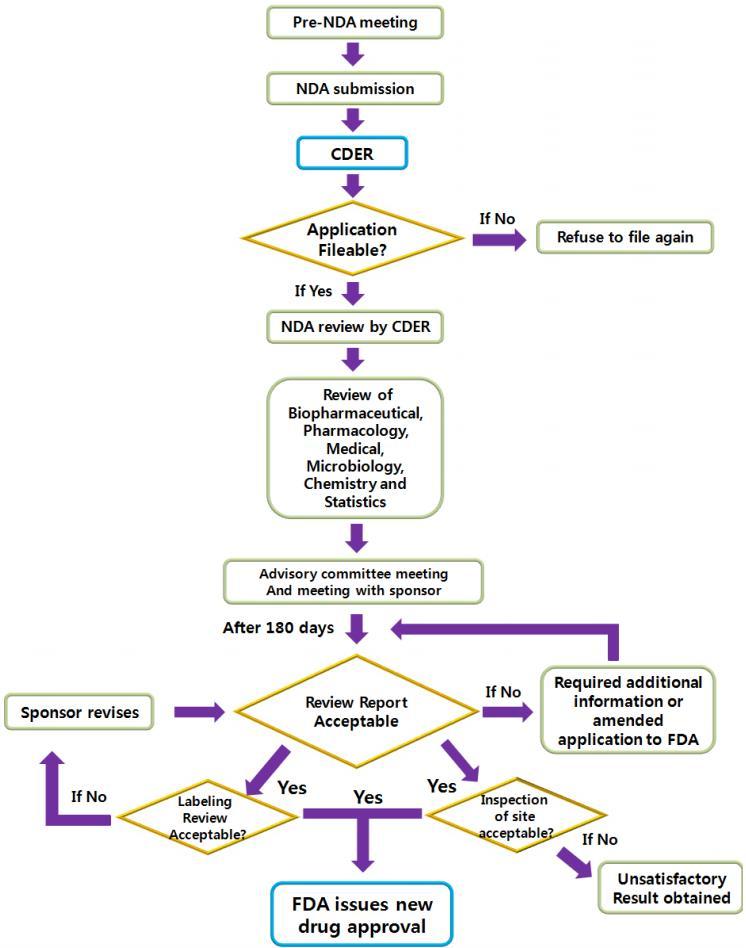
제출하여 심사가 진행되는데, 이에 앞서 사전회의(preNDA meeting)를 통해 Center for Drug Evaluation and Research(CDER)에서 60일간 NDA의 심사 가능
여부를 결정하고 [ 18 ], 완전하다고 판단될 시에
식품의약품청 심사팀에서 NDA를 바탕으로 의약품의
안전성 및 유효성 여부를 평가하게 된다[19] 이때 추가
정보가 필요하다고 판단되면, 심사팀은 의뢰자에 추가
정보를 요구할 수 있다 이렇게 안전성과 유효성에 대한
입증이 완료되면, 표시 기재 사항에 충분한 정보가
포함되었는지 여부를 심사하고, 의약품 제조 시설에 대한
실태 조사를 수행하여 통과되면 의약품의 시판 허가
승인이 최종적으로 완료된다 신속 프로그램도 약물의
허가 승인 절차 자체는 일반적인 신약 허가 과정과
유사하지만, 이 프로그램의 대상으로 지정된 신약들의
개발 및 허가 속도가 일반적으로 더 빠르게 진행된다 미국
FDA의 신속 프로그램은 앞서 설명한 것과 같이 심각하고
위험한 질병을 치료할 수 있는 의약품을 최대한 빠른 시일
내에 환자들이 사용할 수 있도록 제공하기 위해 만들어진
프로그램으로 , 이에 속하는 제도는 총 4 가지가
존재한다(표1) 신속 프로그램은 공통적으로 신약허가
심사 기간을 단축하며, 중대한 질환의 치료의약품이 그
주요한 대상이 된다 하지만 제도별로 세부적인 특징이
구분되어 ‘중대한 질환을 치료할 수 있는 의약품을 최대한
빠른 시일 내에 환자들에게 제공한다’라는 목표를 이루기
위해 그 대상과 필요에 따라 다양한 제도가 사용된다(표1)
그럼 제도별 구체적인 특징에 대해서 알아보자
먼저, 신약 개발 과정에서 허가 당국 FDA의 여러 방면에서의 지원을 제공하여 신약 개발의 가속화를
가능케 하는 제도로 패스트 트랙 (Fast track) 과
혁신의약품 지정(Breakthrough therapy)이 있으며, 각
제도의 구체적인 내용은 다음과 같다 패스트 트랙(fast track)은 ‘의학적 미충족(unmet medical needs)을
해결하는 신약’의 개발을 가속하기 위한 지원 제도이다
여기서 ‘의학적 미충족을 해결한다’는 것은, 기존 치료법이
없는 질병에 대한 약물이거나 신약이 기존 치료제보다
임상적으로 유의미한 개선을 나타낸다는 것을 의미한다
이 경로로 신약허가 승인을 받고자 할 경우 승인 과정에서
전임상자료만으로 신청이 가능하고, FDA와 높은 빈도로
커뮤니케이션을 할 수 있어 신약의 신속한 개발이
가능해진다[20] 추가로, 패스트트랙의 대상 신약의 경우
다수가 허가 신청 시 우선심사(Priority Review)의
대상으로 지정되어 빠른 허가 승인 절차를 밟게
된다[21] 혁신의약품 지정(Breakthrough therapy)은
예비 임상시험 결과에서 기존의 치료법과 비교하여
상당한 개선을 보이는 신약의 개발 및 심사 절차를
대상
패스트트랙 (Fast Track)
- 중대한 질환의 치료, 진단, 예방을 위한 신약
- 의학적 미충족을 해결하는
신약
- 감염병 치료를
위해 지정된 의약품
혁신의약품 지정 (Breakthrough therapy)
- 중대한 질환의 치료, 진단, 예방을 위한 신약 - 예비 임상 결과에서 기존
치료법에 비해 안전성 및 유효성의 유의미 한 개선이 입증된 의약품
신속심사 (Accelerated approval) 우선심사 (Priority Review)
- 생명을 위협하거나
중대한 질환의 치료를 위한
신약
- 대리평가변수를 기반으로
의학적 미충족을 해결 하는
품목
- 중대한 질환의 치료, 진단, 예방을 위한 신약
- 의학적 미충족을 해결하는
신약
- 감염병 치료를
위해 지정된 의약품
특징
- 비임상자료를 근거로 신청 가능
- FDA와 높은 빈도의 커뮤니케이션 가능
- 조건 충족시 신속심사나
우선심사의 대상으로 지정
가능
- 예비 임상자료 제출 필요
- FDA와의 높은 빈도의 커뮤니케이션 가능
- 디테일한 신약개발 지침 제공
- Senior manager 전담 마크
- 대리평가변수를 사용하여
임상시험 진행 - 시판 후 치료적 확증
임상시험 제출하지
못하면 허가 취소
- NDA 기간 6개월로
단축
- FDA 심사팀이
신청자의 요청이 없어도
품목에 따라 우선심사로
지정할 수 있음
표1. 미국의 신속 프로그램의 제도별 특징 (출처: 식품의약품안전평가원, 해외 주요국 신속심사 사례집)
가속하기 위한 제도이다 여기서 예비 임상시험 결과란
임상 1상 또는 2상의 결과를 의미하며, 유효성 및 안전성의 유의미한 개선을 보여주어야 한다 이 제도의
특징으로는 예비 임상자료의 제출이 필요하며 , 패스트트랙과 비슷하게 기존 신약품 개발 및 심사
절차에서보다 FDA와의 빈도 높은 커뮤니케이션과 더
상세한 신약 개발 지침을 받을 수 있다는 점 등이 있다[22] 패스트트랙이나 혁신의약품 지정 제도는 모두
그 대상이 되기 위해서는 품목허가 신청과는별도로제도자체 에대한지정신청이 필요하다[21]
다음으로, 임상시험 신청부터 허가 승인까지의 허가 과정
자체를 단축해주는 제도로 신속심사와 우선심사가 있으며
그 구체적인 내용은 다음과 같다 여기서 신약의
신속심사 (Accelerated approval) 는 aducanumab 이
조건부 승인을 받은 허가경로이다 이는 의학적 미충족을
해결하는 품목의 허가를 받을 때 아직 임상 효능이
명확하게 입증되지 않았어도 임상 효능을 예측할 수 있는
대리평가변수 (surrogate endpoint) 에서의 결과를
토대로 승인을 결정하는 제도이다 허가 과정에서 임상
효능이 확실하게 입증되지 않았기 때문에, 시판 후 임상
4상 및 치료적 확증 임상시험을 통해 이에 대한 확실한
증명이 필요하다 이러한 증명이 진행되지 못했을 경우,
FDA는 승인을 취소할 수 있다[22]
마지막으로 우선심사(Priority review)는 중대한 질환에
대한 치료제 중 안전성 및 유효성의 측면에서 상당한
개선을 입증한 의약품에 대해 품목허가 기간을 6개월
이내로 하여 신속한 허가심사를 진행하는 경로이다 이는
일반적인 신약의 품목허가 심사 기간이 10개월인 것에
비해 단축된 것이다 우선심사의 경우 일반적으로
품목허가 신청 시 우선심사 지정 요청서를 제출하지만,
신청자의 요청이 없어도 우선심사의 대상이라고 판단될
경우 품목에 따라 그 대상으로 지정될 수 있다[21] 예를 들어, 패스트트랙으로 지정받은 신약의 경우 우선심사
지정 요청서를 따로 제출하지 않아도 우선심사 지정 검토
대상이 되어 최종적으로 우선심사의 대상이 될 확률이
높다
그림5. 미국 신속 프로그램의 연도별 현황 (출처: 식품의약품안전평가원, 해외 주요국 신속심사 사례집)
모든 제도들에서 신속 프로그램의 대상 품목들이
지속적으로 증가하는 추세에 있으며 그 중에서도 특히
신속심사의 대상 품목 수가 최근 들어 급격하게
증가하였다 2020년 현황을 보면 신속심사를 통한 약물의

허가가 가장 많이 이루어졌음을 볼 수 있으며 , aducanumab도 이러한 예시 중 하나이다
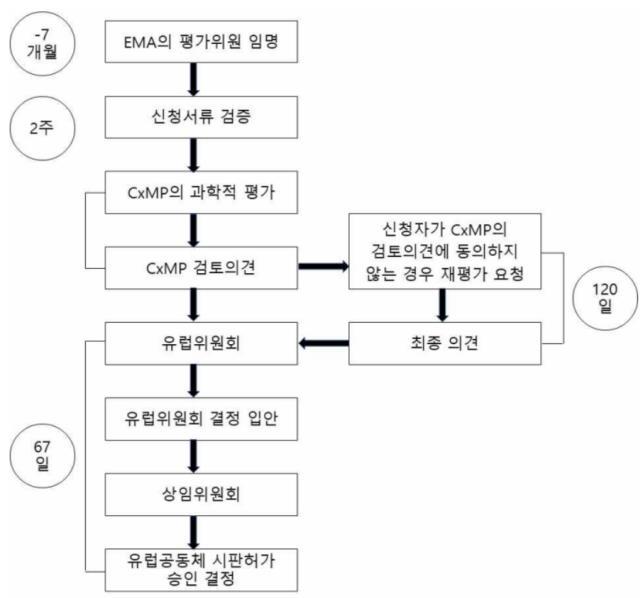
제약회사가 신약 허가 승인을 받고자 한다면, 유럽연합 각
회원국에 개별적으로 임상시험계획 승인신청을 하거나
유럽 연합에 승인 신청을 해야 한다 유럽의 허가 당국인
EMA에는 제품 허가에 대한 심의를 담당하는 7개의
위원회가 있는데 이 중 2CHMP는 통합절차에 따라 제출된
의약품의 판매허가신청서를 평가하고 3PRAC은 의약품의
위험성을 평가하고 안전성을 모니터링하는 위원회이다
이 두 위원회가 신청서를 평가하는 것을 공동으로
주도하게 된다 4 Advanced therapy medicinal product에 대해서는 Committee for Advanced Therapies(CAT)의 멤버가 평가를 주도하게 된다
통합절차는 유럽연합에서 허가를 받는 것으로 모든
유럽연합 회원국에 허가가 적용된다 이후 통합절차에
따른 신약허가신청 절차에서 의약품의 판매허가신청서를
제출하기 18개월에서 7개월 전에 근거 사항이 동반된
자격 요청서를 제출하여 통합절차 심사 대상에 적합한지
검증하게 된다 의약품의 판매허가신청서를 제출하기
7 개월 전에 신청자는 EMA 에 사전신청요청서와
판매허가신청서 제출예정일을 이메일로 보내야 한다
의약품의 판매허가신청서 제출하기 6~7개월 전에 열리는
유럽의 일반적인 신약 허가 절차는 다음과 같다(그림6)
그림6. 유럽의 신약 허가 승인 절차
(출처: 식품의약품안전처, 의약품 수출입 지원을 위한 의약품 허가 심사 체계 연구-유럽)
2Committee for Medicinal Products for Human Use(CHMP): 통합절차에 따라 제출된 의약품의 판매허가신청서를 평가하는 EMA 위원회
3Committee for Medicinal Products Pharmacoviligance Risk Assessment Committee (PRAC): 의약품의
사전미팅(pre-submission meetings)에서는 신청자가
EMA로부터 절차 및 규제에 관한 요구사항에 부합할 수
있도록 하여 평가 과정의 속도를 빠르게 할 수 있다
판매허가신청서를 제출하기 2~3개월 전에 EMA에 제출
날짜를 확실하고 정하고, 만약 날짜에 변동사항이 있다면
그 사실을 알려야 한다 신청자는 eCTD로 eSubmission
gateway나 Web Client를 통해 신청서를 제출한다
CHMP는 통합 허가 절차로 제출된 것을 바탕으로 판매
허가 신청서에 대해 평가를 진행하는데 이는 PRAC의
위험관리계획(RMP)과 ATMP 로부터 얻은 자료를
고려하며 이는 210일이 소요된다 CHMP는 의약품의
허가 여부에 대해 과학적 견해를 피력하며 EMA는
European Commission 의 견해 요약문을 발표한다
European Commission 는 통합 절차의 허가 주체이고
EMA 의 추천을 기반으로 법적 결정을 한다
European Commission의 최종 결정은 CHMP 의견 수령
67일 이내에 이루어진다 결과는 Community Register of medicinal products for human use에 공개되고
EMA는 유럽공공평가보고서를 발행한다 거절될 경우
EMA 는 Q&A 문서와 평가 보고서를 포함한 거절
유럽공공평가보고서를 출판한다
유럽에서도 미국과 비슷한 관련 제도들이 마련되어
있지만 , 각 제도에 적용되는 주요대상은 조금씩
다르다(표2)
먼저, 유럽에서도 신약의 개발을 가속하기 위한 제도가
마련되어 있는데, PRIME(PRIority MEdicines) 제도가
바로 그것이다 PRIME 제도는 의학적 미충족을 해결하는
신약의 개발을 가속화 하기 위한 제도로 미국의 ‘패스트
트랙’이나 ‘혁신 의약품 지정’과 유사한 제도라고 볼 수
있다
프라임제도(PRIME) 조건부허가(CMA) 예외적허가(MAEC) 신속심사 (AA)
- 의학적 미충족을 해결할 수
있는 경우
- 의학적 미충족을 해결할
가능성이 있는 경우
- 다음을 적응증으로 하는
의약품
1) 심각한 쇠약성 혹은
생명을 위협하는 질병
2) 공중보건에 위협이 되는
질병 대유행
- 해당 질환이 드물게 발생하여
신청자가 종합적 자료를
제출할 것으로 합리적으로
기대할 수 없는 경우 - 현재의 과학적 지식 수준으로
- 공중보건에 이익이 되는
경우
- 새로운 치료법을
도입하거나 기존
치료법을 개선해 의학적
대상
3) 희귀질환 - 유익성, 위해성 조사 긍정적 결과를 제출할 수
있는 경우
종합적 정보를 제공할 수 없는
경우
- 일반적으로 받아들여지는
의료 윤리에 위배되는 경우
미충족을 해결하는 경우
- 질병의 예방, 진단
방식이 기존보다 상당히
입증하는
- 의약품 개발 단계에서
허가 심사 기간 150일로 단축(기존: 210일)
시판 후 치료적 확증임상시험 결과를 요구하지 않음
허가 심사 기간 150일로
단축(기존: 210일)
표2. 유럽의 신속 프로그램의 제도별 특징 (출처: 해외 주요국 신속심사 사례집, 식품의약품안전평가원)
신약이 PRIME 제도의 대상으로 지정되면, CHMP는
의약품의 개발을 지원하기 위해 과학적 조언을 제공하는
등의 다양한 측면에서의 지원을 진행하게 된다[24]
혁신적인 기술을 사용한 여러 의약품들이 PRIME 제도를
통해 허가되었다 Aducanumab 또한 PRIME 제도의
대상으로 지정되었지만, 시판 허가가 취소되면서 지정
또한 철회되었다[25]
다음으로, 신약의 허가 과정을 단축해주는 제도로
조건부허가(Conditional marketing authorization),
예외적 허가(Marketing authorization under exceptional circumstances), 그리고
신속심사 (Accelerated assessment) 가 있다
조건부허가는 의학적 미충족을 해결하는 품목의 허가를
받을 때, 시판 후 치료적 확증 임상시험을 진행하는
조건으로 신약의 조기 허가를 가능하게 하는 제도이다
따라서 이는 미국의 신속심사 제도와 상당히 유사함을
확인할 수 있다[26] 예외적 허가는 조건부허가와 달리
시판 후 치료적 확증 임상시험을 요구하지 않는 제도로, 희귀질환과 같이 치료적 확증 임상시험을 진행하기
어려운 경우 주로 적용된다 이에 따라 유효성 및 안전성
이슈가 발생할 수 있으므로, 예외적 허가를 통해 시판
허가된 제품은 허가당국의 주기적인 모니터링이
요구된다[27] 신속심사는 허가 승인 과정 자체를
단축한다는 점에서 미국의 우선심사(Priority review)와 비슷하다고 볼 수 있다 구체적으로, 신속심사의 대상으로
지정되면 허가심사 기간은 기존의 210일에서 150일로
단축된다 신약이 대상으로 지정되기 위해서는 의학적
미충족을 해결해야 하며, 치료적 혁신 관점에서 중요한
의미가 있다고 판단되어야 한다 이에 대한 판단은
CHMP가 개별적으로 하게 된다[28] 유럽의 신속 프로그램의 연도별 현황을 살펴보면 다음과 같다(그림7)
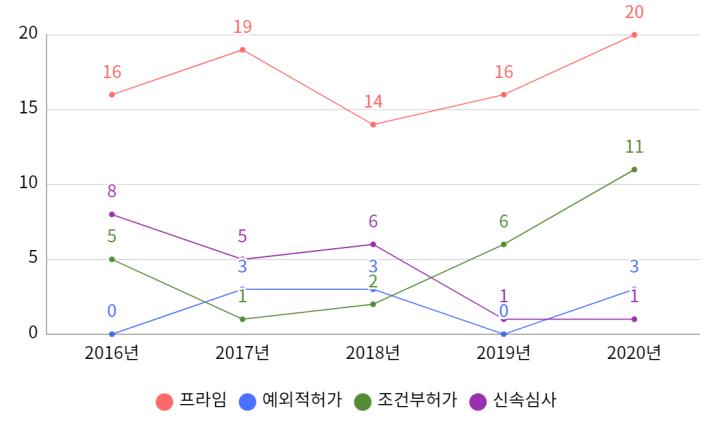
유럽은 전반적으로 신속 프로그램의 대상으로 지정되기 위한 기준이 미국보다 까다롭기 때문에 허가된 품목 수가 확연히 적고 대부분은 프라임 제도로 허가가
이루어졌음을 확인할 수 있다 또 , 조건부허가와 프라임
증가함을 알 수 있다
그림7. 유럽의 신속 프로그램의 연도별 현황 (출처: 식품의약품안전평가원, 해외 주요국 신속심사 사례집)
3) 한국의 신속 프로그램
한국에서 일반적인 신약의 허가가 이루어지는 과정은 다음과 같다(그림8) 신약의 시판허가 승인 과정은 제약회사가 IND 승인신청을 의약품 심사조정과에 접수함에 따라 시작되고 , 이후 30 일 동안 임상시험심사위원회 (Institutional Review Board, IRB)와 식약처의 승인이 동시에 진행된다 다음으로는 NDA를 제출하게 되는데 신약허가 신청 시의 자료는 국제공통기술문서 양식(Common Technical Document, CTD)으로 작성한다 이후 과정은 접수, 예비심사, 심사, 허가 그리고 송부 단계를 거쳐 이루어지게 된다 많은 부분이 의약품심사조정과에서 진행된다 검토 기간은 drug master file(DMF) 미포함 심사의 경우 90일, DMF
포함 심사의 경우 120일이 소요된다 갱신은 5년마다 진행되며 허가 후에는 약물 감시, 재심사, 재평가, 위험관리계획(risk management plan)를 통해 관리하게
된다[29] 한국의 신속 프로그램의 제도별 특징은 다음과
같다(표3) 조건부허가는 미국의 신속심사와 거의 동일한
제도로, 의학적 미충족을 해결하는 품목에 대해 임상
2상까지의 자료를 바탕으로 허가된다[21] 미국의
신속심사에서와 같이 임상 2 상까지의 자료에서
대리평가변수에 대한 유효성을 시판 후 증명해야 한다
그림8. 한국의 신약 허가 승인 절차 (출처: 식품의약품안전처, 의약품 품목허가심사 절차의 이해)
조건부허가 제도는 약사법 제35조를 근거조항으로 두고 있다 다음으로, 우선심사는 용어에서 확인할 수 있듯이, 미국의
우선심사(PR)와 거의 동일하며 의학적 미충족을 해결하거나
혁신형 제약기업이 개발한 신약이 그 대상이 된다
근거조항: 약사법 제 35조)
- 다음 3가지 조건을 충족하는 의약품
1) 적응증에 대해 의학적 미충족을 해결하는 의약품

이는 미국의 우선심사에서와 같이 허가 심사 기간 자체를 단축하는 제도로, 기존의 허가 심사 기간(120일)이 90일로 단축되어 빠른 시판 허가가 이루어질 수 있다 또한 우선심사는 약사법 제35조의 4, 제40조의 2를 그
근거조항: 약사법 제 35조의 4, 제 40조의 2)
- 심각한 중증질환이나 희귀질환을 치료하기 위해 사용되는
의약품
대상
2) 적응증이 생명을 위협하거나 중대한 질병인 의약품
3) 임상적 유익성을 예측할 수 있는 대리평가변수에
대한 효과를 증명할 수 있는 의약품
- 혁신형 제약기업이 개발한 신약 중 보건복지부장관의
지정요청이 있는 의약품
특징
- 대리평가변수를 사용하여 임상시험 진행
- 시판 후 치료적 확증 임상시험 제출하지 못하면 허가 취소
- 품목허가 심사 기간 단축 (120일 >90 일)
- 허가 심사 기간이 일반 의약품에 비해 훨씬 단축되어 빠른 시판허가 가능
표3. 한국의 신속 프로그램의 제도별 특징 (출처: 식품의약품안전평가원, 해외 주요국 신속심사 사례집)
근거 조항으로 두고 있다 각국의 신속프로그램을 유사한
것끼리 묶어 정리하면 다음과 같다(표4) 이처럼 미국,
유럽, 한국의 허가 당국은 의학적 미충족을 해결하는
신약에 대해 여러 종류의 ‘신속프로그램’을 마련하여
신약의 개발과 허가 과정을 단축해 환자들에게 최대한
빠르게 신약이 공급하는 데 기여하고 있다
3 허가 관련 논란
그럼, aducanumab 허가에 대해 미국과 유럽에서
상이한 결과가 나온 이유를 앞에서 설명한 신속
프로그램과 관련지어 크게 2가지로 분석해보자
먼저, FDA는 자문위원회의 반대에 부딪히면서까지
aducanumab에 대한 허가 승인을 하였다 FDA의 이러한
승인은 aducanumab 자체의 유효성만 본
결정이라기보다는 앞으로의 치매 의약품 시장의 장기적
성장 가능성을 고려한 일종의 투자라고도 볼 수 있으며, 현재 개발되고 있는 치매 의약품에 대한 개발을 장려하기 위한 일종의 인센티브로 보인다 또한, 실제 치매의
진행기간보다 많이 짧은 임상시험의 한계를 극복할 수
있다는 이유도 들고 있다 즉, aducanumab에 대한
논란이 존재하기는 하지만 , 이러한 위험성보다는
의약품을 시장에 내놓음으로써 얻어지는 이득이 더
크다고 판단한 것이다 이에 반해 EMA의 경우에는, aducanumab 의 유효성 및 안전성이 확실히
확보되어야만 허가해준다는 입장을 고수하여 허가 승인을
다음은 신속심사(AA) 제도 대상에 대한 기준 차이이다
Aducanumab는 미국에서 신속 심사 제도를 통해 허가
승인을 받았는데, 이와 비슷한 제도는 유럽 및 한국에서의
조건부허가라고 볼 수 있다 이 제도들은 모두 공통적으로
전체적인 임상 자료를 요구하는 것이 아닌
대리평가변수를 이용하거나 특정 조건을 만족한 임상
자료를 요구하여 허가 과정이 이루어질 수 있도록 하고
있으며 이후 임상적 유익성이 증명되지 못할 경우 허가가
취소된다 하지만 여기서 각 제도들로 지정되기 위한
기준들에 차이가 발생하여 aducanumab이 미국에서는
신속심사 제도를 통해 승인받았고, 유럽 및 한국에서는
이와 비슷한 제도인 조건부허가를 통해 승인받지
못하였음을 추론할 수 있었다
구체적으로, 미국은 생명을 위협하거나 중대한 질환에
대한 치료제 중 대리평가변수를 기반으로 의학적
미충족을 해결하는 품목에 대하여 신속심사의 대상으로 지정하고 있는데 반해, 유럽에서는 이보다 더 나아가 유익성, 위해성 조사에 대한 긍정적 결과가 있어야 하며, 광범위한 임상 자료에 대한 제출이 가능해야 조건부허가의 대상으로 지정될 수 있다 ( 표 5)
Aducanumab 의 적응증인 알츠하이머병은 노인성 질환의 70% 이상을 차지하지만 이에 대한 근본적인 치료제는 거의 존재하지 않는 미충족 수요가 큰 질환이다
신속심사 (FDA)
대상 - 생명을 위협하거나 중대한 질환 치료제에
대하여 대리평가변수를 기반으로 의학적 미충족을 해결
하는 품목
특징
- 대리평가변수를 사용하여 임상시험 진행
- 시판 후 치료적 확증 임상시험 제출하지 못하면 허가 취소
표
조건부허가 (EMA)
- 다음을 적응증으로 하는 의약품
1)심각한 쇠약성 혹은 생명을 위협하는 질병
2)공중보건에 위협이 되는 질병 대유행 (WHO, EU 집행위원회 지정)
3) 희귀질환 - 전체적인 임상 자료를 제출하지 않고, 다음의 모든 사항을 충족시킴
1) 유익성, 위해성 조사 긍정적 결과
2) 광범위한 임상자료 제출 가능
3) 의학적 미충족 해결
4) 공중 보건에 대한 즉각적인 공급에 따른 혜택이 미제출
자료에서 기인한 위험성보다 큰 경우
- 생명을 위협하는 질환, 공중보건상 위급한 상황, 희귀질환 치료제에 대해 허가 후 치료적 확증 임상시험 제출을 조건적 허가
5. 미국의 신속심사와 유럽의 조건부허가 제도의 비교 (출처: 식품의약품안전평가원, 해외 주요국 신속심사 사례집)
Aducanumab은 알츠하이머병을 발생시키는 원인인
아밀로이드 플라크 자체를 감소시키는 것이 임상시험에서
확인되었으므로 대리평가변수를 기반으로 의학적
미충족을 해결하는 품목이라고 볼 수 있다 따라서 이러한
근거에 따라 FDA는 aducanumab을 신속심사 대상으로
지정할 수 있었던 것으로 보인다 이에 반해 유럽에서는
유익성, 위해성 조사에서 긍정적인 결과를 나타내야
하는데, aducanumab의 경우 ARIA와 같은 부작용을
나타내며, 통계적으로 유의미한 유효성도 3상 임상시험
중 Study 302(EMERGE) 에서만 나타났기 때문에 긍정적인 결과를 나타냈다고 보기 어렵다 따라서
aducanumab의 경우, 아예 조건부 허가의 대상으로
지정되지 못했으며 , 이에 따라 허가 승인 자체가 반려되었다고 보인다
4 Summary
Aducanumab은 미국 FDA에서 장기적 성장 가능성을
보았고 신속 허가 제도의 대상에 부합하였기 때문에 허가
승인을 받았지만 유럽에서는 유효성이 확정적으로
입증되지 않았고 ARIA등의 부작용의 위험을 높게 보아서
허가 신청을 반대하였다 신속심사로 지정된 대상
품목수를 확인해 본 결과, 실제로 지정 단계에서부터
미국에서보다 유럽에서 훨씬 적은 수의 품목이 통과된
것을 볼 수 있었다 이에 따라 지정 기준의 차이가 허가
승인 여부의 차이를 유발하였다고 추론할 수 있었다
추가적으로, 한국 식약처에서 또한 유효성 및 안전성에
대한 불확실성을 토대로 aducanumab의 허가 승인을
거절하였음을 볼 수 있었다
[1] Benefit, A. C. Aduhelm (aducanumab-avwa).
[2] Arndt, J. W., Qian, F., Smith, B. A., Quan, C., Kilambi, K. P., Bush, M. W., ... & Weinreb, P. H. (2018). Structural and kinetic basis for the selectivity of aducanumab for aggregated forms of amyloid-β. Scientific reports, 8(1), 1-16.
[3] McKhann, G. M., Knopman, D. S., Chertkow, H., Hyman, B. T., Jack Jr, C. R., Kawas, C. H., ... & Phelps, C. H. (2011). The diagnosis of dementia due to Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimer's & dementia, 7(3), 263-269.
[4] Pardridge, W. M. (2015). Targeted delivery of protein and gene medicines through the blood–brain barrier. Clinical Pharmacology & Therapeutics, 97(4), 347-361.
[5] Daneman, R., & Prat, A. (2015). The blood–brain barrier. Cold Spring Harbor perspectives in biology, 7(1), a020412.
[6] Furuse, M. (2010). Molecular basis of the core structure of tight junctions. Cold Spring Harbor perspectives in biology, 2(1), a002907.
[7] Van Itallie, C. M., & Anderson, J. M. (2006). Claudins and epithelial paracellular transport. Annu. Rev. Physiol., 68, 403-429.
[8] Van Itallie, C. M., Holmes, J., Bridges, A., Gookin, J. L., Coccaro, M. R., Proctor, W., ... & Anderson, J. M. (2008). The density of small tight junction pores varies among cell types and is increased by expression of claudin-2. Journal of cell science, 121(3), 298-305.
[9] Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., & Begley, D. J. (2010). Structure and function of the blood–brain barrier. Neurobiology of disease, 37(1), 13-25.
[10] Pardridge, W. M. (2017). Delivery of biologics across the blood–brain barrier with molecular Trojan horse technology. BioDrugs, 31(6), 503-519.
[11] Sevigny, J., Chiao, P., Bussière, T., Weinreb, P. H., Williams, L., Maier, M., ... & Sandrock, A. (2016). The antibody aducanumab reduces Aβ plaques in Alzheimer’s disease. Nature, 537(7618), 50-56.
[12] Pardridge, W. M. (2019). Alzheimer’s disease: Future drug development and the bloodbrain barrier. Expert Opinion on Investigational Drugs, 28(7), 569-572.
[13] Logovinsky, V., Satlin, A., Lai, R., Swanson, C., Kaplow, J., Osswald, G., ... & Lannfelt, L. (2016). Safety and tolerability of BAN2401-a clinical study in Alzheimer’s disease with a protofibril selective Aβ antibody. Alzheimer's research & therapy, 8(1), 1-10.
[14] https://www.nytimes.com/2020/11/06/health/aducanumab-alzheimers-drug-fdapanel.html
[15] https://www.dementianews.co.kr/news/articleView.html?idxno=4703
[16] Darrow, J. J., Avorn, J., & Kesselheim, A. S. (2014). New FDA breakthrough-drug category implications for patients. New England Journal of Medicine, 370(13), 1252-1258.
[17] https://www.fda.gov/drugs/development-approval-process-drugs/how-drugs-aredeveloped-and-approved
[18] https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?fr=312.47
[19] https://www.fda.gov/drugs/information-consumers-and-patients-drugs/fdas-drug-reviewprocess-ensuring-drugs-are-safe-and-effective
[20] US Food and Drug Administration. (2021). Expedited programs for serious conditions-drugs and biologics; 2014.
[21] 식품의약품안전평가원. (2021). 해외 주요국 신속심사 사례집
[22] Ryan, R. (2013). The need for speed: comparing and contrasting expedited drug development programs in the US.
[23] https://www.ema.europa.eu/en/human-regulatory/marketing-authorisation/obtaining-eumarketing-authorisation-step-step
[24] European Medicines Agency. (2018). Enhanced early dialogue to facilitate accelerated assessment of PRIority Medicines (PRIME)(EMA/CHMP/57760/2015, Rev. 1).
[25] https://www.europeanpharmaceuticalreview.com/news/41426/biogen-aducanumabprime/
[26] European Medicines Agency. (2016). Guideline on the scientific application and the practical arrangements necessary to implement Commission Regulation (EC) No 507/2006 on the conditional marketing authorisation for medicinal products for human use falling within the scope of Regulation (EC) No 726/2004.
[27] Arnardottir, A. H., Haaijer‐Ruskamp, F. M., Straus, S. M., Eichler, H. G., de Graeff, P. A., & Mol, P. G. (2011). Additional safety risk to exceptionally approved drugs in Europe?. British journal of clinical pharmacology, 72(3), 490-499.
[28] 박실비아. (2017). 미국과 EU의 의약품 신속 개발 및 허가 프로그램의 동향과 쟁점 약 학 회 지, 61(3), 147-157.
[29] 식품의약품안전처 (2017). 의약품 품목허가심사 절차의 이해
Aducanumab(Aduhelm®)의 약효와 조건부 승인에 관하여 논란이 계속되고 있다 우리는 aducanumab에 대한

논란을 정확히 이해하고, 그 원인에 대해 분석하여 이후의 다른 임상연구의 이해에 작은 도움이 되기 위해 aducanumab의 임상결과를 자세히 알아보고자 한다 먼저, 임상에 대한 이해를 돕기 위해 임상에서 사용하는
용어들이나 통계원칙, 분석법 등에 대한 배경지식을 공부하고, 이후 타임라인을 통해 aducanumab 임상시험의
진행 순서와 주요 사건에 대한 전반적인 흐름을 살펴볼 것이다 다음으로, aducanumab의 핵심 임상시험 3가지인 Study 103, Study 302, Study 301의 임상시험 각각을 자세히 살펴본다 특히, 동일한 디자인으로 설계된 Study 302, Study 301이 상반된 결과를 보여 aducanumab의 효과에 의문이 제기되었기 때문에, 두 임상시험을
비교하며 이러한 결과가 도출된 이유에 대해 고찰한다 또한 aducanumab 임상시험 전반에서 드러나는 문제점을
분석하며 약효와 관련된 논란을 이해한다 본문에 서술된 임상시험의 디자인 및 결과는 [FDA Aducanumab Medical Review]를 바탕으로 조사하였다[1]
Ⅰ. Introduction
Ⅰ-ⅰ. 배경지식(background)
1 바이오마커(biomarker)
치매에는 진단, 특히 조기진단이 매우 중요하지만
임상적인 정보만 가지고 정확한 조기진단과 질병을
모니터링하는 것은 아직 어려운 일이다 때문에 치매
진단에 있어서 바이오마커의 중요성이 커지고 있다
바이오마커란, 단백질이나 DNA, RNA, 대사물질 등의
생체 물질로 정상 또는 병리적인 상태, 약물에 대한 반응
정도 등을 객관적인 기준에서 측정할 수 있는 표지자이다
치매에서 바이오마커의 역할은 크게 세 가지로 나눌 수
있다 먼저 바이오마커는 생체 내의 병태 생리학과 관련된
객관적이고 유용한 정보를 제공한다 두 번째로, 치료
측면에서 알츠하이머병(Alzheimer’s disease, AD)
환자를 대상으로 질병 완화 제제(disease modifying therapy, DMT)의 접근성을 높일 수 있다 마지막으로, 질병 초기단계에서 정확한 조기진단이 가능하게 한다
특히 경도인지장애(mild cognitive impairment, MCI)
환자는 인지적 퇴화가 일어나지 않았지만 이미
비가역적인 뉴런의 저하가 진행되었을 가능성이 있어, 조기진단을 통해 알츠하이머병으로의 진행을 막을 수
있는 대상으로 치료가 더욱 효과적으로 작용할 수 있다
현재 임상에서 활용되고 있는 AD 진단 바이오마커의
종류는 크게 PET 이미징과 뇌척수액(cerebrospinal fluid, CSF)으로 나뉘며, PET 또는 CSF로부터 측정된 p-tau, 신경퇴행정도 (neurodegeneration), 아밀로이드
베타(Aβ)42/Aβ40 비율 등을 종합적으로 분석해 진단에
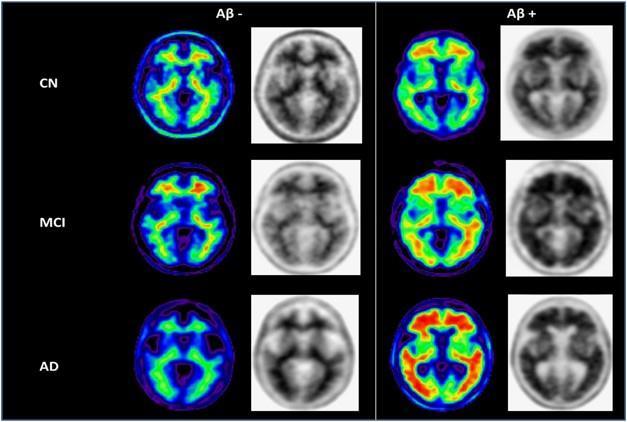
사용한다(그림1)[2] 바이오마커를 활용한 진단은 설문지
검사보다 정확한 진단이 가능하기 때문에 환자에게
적극적인 치료를 가능하게 한다 그러나 PET와 CSF는
비용이 많이 드는 편이고, 검사 과정의 침습적인 측면
때문에 접근성에 한계점이 있다 따라서 최근 연구에서는
혈액 검사 등 보다 비침습적인 진단법을 개발하기 위해
AD의 새로운 바이오마커를 찾아내려는 노력이 계속되고
있다 환자에게 PET나 CSF 검사를 시행하기 전 일차적
선별 검사의 역할을 할 수 있고 정확도가 높은
바이오마커라면 추가적인 검사 없이 AD 진행 정도를
측정할 수 있을 것이다
그림1. Aβ PET 이미징을 이용한 AD의 진단 (출처: Doraiswamy, P. et al., 2014)
임상시험에서는 바이오마커를 기준으로 하여 환자가
병리학적으로 AD인지 아닌지를 높은 확률로 판별할 수
있다 또한 약력학적(pharmacodynamics, PD) 마커로 활용하면 표적 결합(target engagement) 정도와
질병 완화 효과(disease modifying effect)를 확인할 수
있어 혈중 바이오마커 농도 측정을 통해 투여하는 약물의
용량을 조절할 수 있다 또한 임상시험의 대리
평가변수로서 활용이 가능해 임상시험을 효율적으로
운용할 수 있다
2 평가변수(Endpoint)
1) 정의
임상시험에서 평가변수(endpoint)는 해당 시험의 성과를
평가하는 데 직접적인 기준이 되는 변수다 평가변수는
다음과 같이 분류할 수 있다
(a) 임상적 평가변수(Clinical endpoint)
임상시험의 성과를 판단하는 기준으로, 임상시험에서
목표로 하는 질병, 증상, 징후 또는 이상 발생을 나타내는
결과 척도를 말한다 즉 , 반드시 약물이 질병에
직접적으로 효과가 있다는 것을 알 수 있는 변수다 해당
임상시험의 목적에 따라 임상적 평가변수가 결정된다
(b) 대리 평가변수(Surrogate endpoint)
임상적 유익성을 예측할 수 있는 실험실적 측정, 방사선
이미지, 신체적 증후 등과 같은 변수를 의미한다 약물의
효능을 입증하는 데 오랜 시간이 걸리거나 임상적
평가변수를 설정하는 것이 어려운 경우, 신속 승인을
목적으로 임상시험에서 임상적 평가변수를 대체하여
사용한다 특정 질병에 대해 어떤 바이오마커가 임상적
결과를 일관되고 정확하게 예측할 수 있다는 과학적
근거가 있다면 임상시험에서 대리 평가변수로 사용될 수
있다[3] 단, 대리 평가변수를 사용하여 임상시험을
진행할 때, 시판 후 확증시험(confirmatory trial) 결과를
제출하지 못하면 허가가 취소될 수 있다
임상시험을 설계할 때 임상적 평가변수와 대리
평가변수를 적절히 선정하여 평가변수 간 우선순위를
정하고, 이에 따라서 결과를 분석한다 1차 유효성
평가변수(primary endpoint)는 임상시험의 가장 중요한
목적을 나타내는 변수로, 주로 약물이 질병의 개선에
직접적인 영향이 있는지를 평가하는 변수다 이는
임상시험의 성패를 결정하는 가장 중요한 변수라고 할 수
있다 2차 유효성 평가변수(secondary endpoint)는 primary endpoint에 추가로 알고 싶은 변수에 대한
효과측정 변수이다 일반적인 신약의 경우 , 임상
1 상에서는 약의 약동학적 결과 (pharmacokinetics, PK)를, 2상에서는 약의 용량 및 부작용을, 3상에서는 통계적으로 유의미한 데이터를 평가변수로 확보하여 여러
차례에 걸쳐 안전성과 유효성을 검토한다
2) 본 연구에서 사용한 임상적 평가변수
본 연구에서 사용한 임상적 평가변수는 인지기능과
관련된 설문지이며, 환자가 작성한 설문지를 의사가
평가하여 그 점수를 통해 임상적으로 진단한다 본
연구에서는 치매의 중증도를 평가하기 위해서 다양한
임상적 평가변수를 사용하였다 임상 3 상 시험을
기준으로 1 차 유효성 평가변수로는 CDR-SB 를
사용하였고, 2차 유효성 평가변수로는 MMSE, ADASCog 13, ADCS-ADL-MCI 를 , 3 차 유효성
평가변수 (tertiary endpoint) 로는 NPI-10 을
사용하였다(표1)
(a) CDR-SB(Clinical Dementia Rating-Sum of Boxes)
CDR(Clinical Dementia Rating)은 치매에서 감퇴하는
인지 및 사회 기능을 평가하는 검사이며, 기억력, 지남력, 판단력 및 문제해결력, 일상생활 및 취미활동, 사회활동, 개인위생 관리 총 6개 영역을 평가한다 각 영역(box)은
0~3점으로 환산되고, 점수가 높을수록 중증도가 높다
6개 영역의 점수를 합산한 점수가 CDR-SB(Clinical Dementia Rating-Sum of Boxes) 이다 [4] 치매의
중증도를 세분화하여 중증도 변화에 가장 민감한 검사로, 의사가 환자와 보호자 각각 장시간의 면담을 진행하여
점수를 결정하기 때문에 신뢰도가 높아 AD 진단에서 가장
보편적으로 사용된다 CDR-SB는 aducanumab 3상
실험에서 1차 유효성 평가지수로 사용되었다
(b) MMSE(Mini Mental State Examination)
인지기능에 대한 평가로 상대적으로 간단한 검사이다
환자가 자가 작성한 짧은 설문지를 토대로 점수를
평가한다 작성 소요 시간이 10분 내외로 간단하기 때문에
일상적으로 활용할 수 있지만 정확도는 떨어지는 편이다
(c) ADAS-Cog 13(Alzheimer’s Disease Assessment
Scale-Cognitive subscale 13)
알츠하이머병 환자가 대상인 인지기능에 대한 평가방 법이다 기억력, 언어능력, 시공간 구성능력
CDR-SB, Clinical Dementia Rating-Sum of Boxes; MMSE, Mini Mental State Examination; ADAS-Cog 13, Alzheimer’s Disease Assessment Scale-Cognitive subscale 13; ADCS-ADL-MCI, Alzheimer’s Disease Cooperative Study ADL Scale for Mild Cognitive Impairment; NPI-10, Neuropsychiatric Inventory-10;
등 인지 영역 13개 항목에 대한 평가로 구성되어 있다 행동 및 운동 영역에 관한 평가는 포함하지 않으며, 점수가 높을수록 인지 기능 손상도 크다[5]
(d) ADCS-ADL-MCI (Alzheimer’s Disease
Cooperative Study ADL Scale for Mild Cognitive Impairment)
ADCS-ADL-MCI는 MCI환자를 대상으로 하는 평가로, 알츠하이머 환자의 일상 생활 수행 능력(activities of daily living, ADL)을 평가한다 인간의 아주 기본적인 일상생활 능력들로 구성되며, 기본적인 육체 기능에 관한
신체적 일상 생활 능력 (physical ADL, P-ADL)부터
복잡한 도구적 일상생활 능력(Instrumental-ADL, IADL)으로 세분화된다 중증도에 따라 검사 항목이 다르며, 지난 4주 동안 환자의 각 항목에 대한 시도 여부와 생활능력을 확인한다[6]
(e) NPI-10 (Neuropsychiatric Inventory-10)
치매 환자에서 주로 발생하는 행동장애에 대한 검사이다
NPI-10은 다른 진단법과는 다르게, 환자의 행동을 잘
알고 있는 보호자 또는 간병인과 면담을 시행하여 10가지
행동장애에 대해 평가한다 발병 후 환자의 행동 변화
양상을 파악하는 목적이므로 행동 자체에 대한 평가는
하지 않는다[7] 본 연구의 3차 유효성 평가변수로
활용되었다
다음은 본 연구에서 사용한 clinical endpoint를 진단
목적에 따라 분류한 것이다(그림2)
인지 MMSE ADAS-Cog
CDR-SB
3 자료 분석 시 고려사항
임상시험의 자료의 통계분석 방법은 연구 시작 전 설계 및
계획 단계에서 임상시험계획서 또는 별도의
통계분석계획서(statistical analysis plan, SAP)에 사전에
자세히 기술되어야 한다 통계분석 계획에는 임상시험의
통계학적 분석에 필요한 세부 사항으로써 주 분석
대상군이 되는 집단, 평가변수에 대한 자료 분석법, 분석
과정에서 예상되는 문제점을 해결하는 방법 등이 포함된다
1) 분석 대상군(Analysis Set)
분석 대상군은 편향(bias)을 최소화하고, 제1종 오류를
증가시키지 않는 방향으로 설정되어야 한다 임상 시험에
따라 그 특성을 잘 반영할 수 있는 분석 대상군으로
결정된다 일반적으로 모든 분석 대상자군(full analysis set)과 계획서 순응 임상시험대상자군(per protocol set)이 이용된다
(a) 모든 분석 대상자군(Full Analysis Set, FAS)
모든 분석 대상자군(full analysis set)에서는 ‘배정된
대로 분석’ (intention-to-treat, ITT) 원칙이 적용된다
ITT 원칙이란 무작위 배정 (randomization) 된 모든 피험자를 실제 처리와 상관없이 처음 배정된 치료군으로
간주해서 분석해야 한다는 것이다 무작위 배정된 이후, 환자가 임상시험을 철회(withdrawal)하더라도 환자에
대한 평가가 계속 이루어져서 분석에 포함된다 최초의
무작위 배정된 상태를 그대로 유지하는 것은 편향의
발생을 최소화하지만, 통계적으로 보수적인 분석법이기
때문에 두 치료군 사이에 치료 효과의 차이를 증명하기
어렵다는 문제가 있다
FAS 의 경우 기본적으로 ITT 원칙을 적용하되 ,
선정기준을 만족시키지 못하는 일부 피험자를 분석에서
제외한다 약물을 한 번도 투여받지 않은 경우, 주요한
행동 NPI-10
그림2. 진단 목적에 따라 분류한 Endpoint
선정기준을 위반한 경우 등이 그 예이다 현실적으로 ITT 원칙에 따라 완전하게 분석군을 유지하기는 어렵기
때문에, 편향을 발생시키지 않는 선에서의 FAS 분석은
합리적일 수 있다 일반적으로 , 우월성
평가시험(superiority trial)에서 주 분석대상군이 된다
(b) 계획서 순응 임상시험대상자군 (per protocol set, PPS)
계획서 순응 임상시험대상자군 (per protocol set)
분석은 무작위 배정된 모든 피험자 중 임상시험계획서에
따라 임상을 완료한 집단을 대상으로 한다 PPS는 ①미리
정한 최소기간 이상의 치료를 완료한 경우, ②1차 유효성 평가변수의 측정치를 이용할 수 있는 경우 , ③임상시험계획서의 주요 기준을 위반하지 않은 경우를
모두 충족시켜야 한다 PPS는 임상시험이 계획에 따라 이행되었을 때 예상되는 치료효과가 잘 반영되어
나타난다는 장점이 있다 그러나 FAS 분석에 비해 편향이
개입될 가능성이 높은데, 이는 PPS에서 치료에 대한
순응도가 높은 모범 환자들이 상대적으로 많이 포함될 수
있기 때문이다 동등성 평가시험(equivalence trial) 또는
비열등성 평가시험 (non-inferiority trial) 에서 주 분석대상자군으로 사용될 수 있다
어떤 분석 대상자군을 사용하는 지에 관계없이 일관된
임상 결과가 나오는 것이 가장 바람직하다 따라서
확증임상(confirmatory trial)에서는 FAS, PP를 모두 분석할 것을 권장한다[8]
2) 자료 분석법
본 연구에서 사용한 자료 분석법은 공분산분석(Analysis of Covariance, ANCOVA)과 반복측정 혼합모형(Mixed Models for Repeated Measures, MMRM)이다
ANCOVA와 MMRM은 3개 이상의 집단의
방법이다 둘의 차이점은 결측치 (missing data) 를
처리하는 과정이다 ANCOVA는 치료 중단 이후의
데이터는 손실된 데이터로 처리하여 , 2LOCF(last observation carried forward) 등의 방법으로 결측치를
처리하지만[11], MMRM은 3결측치가 표본집단에서
랜덤으로 발생한 것(missing at random, MAR) 으로
가정하고, 표본의 경향을 따른다는 전제 하에 결측치를
다른 값으로 대체하는 단계를 거치지 않고 기존의
데이터를 그대로 이용하는 방식이다[12] MMRM은
ANCOVA보다 결측치로 인한 편향을 더욱 줄일 수 있고, 결측치를 자연스럽게 처리하는 방식이기 때문에 결측치
발생 시 가장 보편적으로 사용하는 방법이다[13]
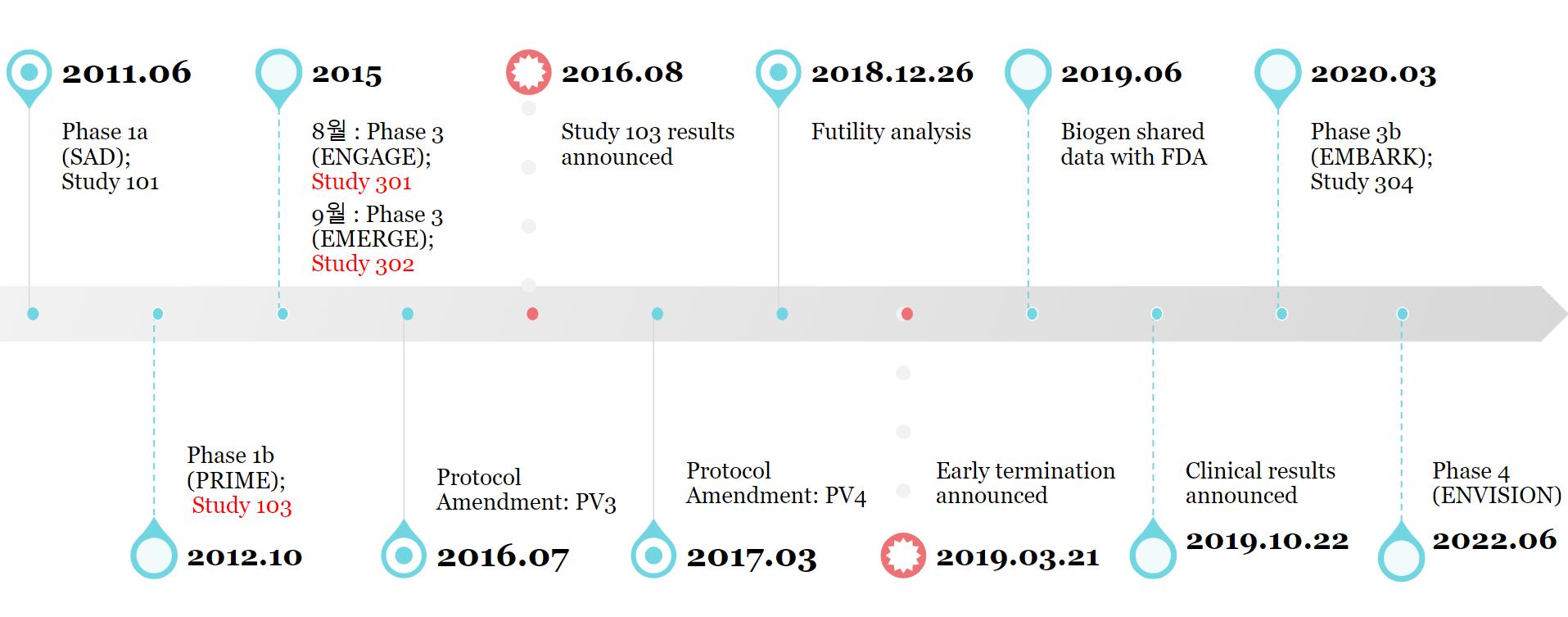
Aducanumab에 대해 시행되었던 임상시험 및 주요한 사건을 시간순으로 정리해보았다(그림3) 2011년 6월, 임상 1상 시험인 Study 101이 시작되었다 Study 101은 안전성, 내약성, PK의 확인을 목적으로 하였고, 투여
용량은 0 3mg/kg에서 6mg/kg까지 적정(titration)으로
약물을 투여하면서 진행하였다 2012년 10월, 임상 1b상
시험인 Study 103(PRIME) 을 시작하였다 Study 101에서 확인한 안전성, 내약성, PK에 더불어 PD까지
확인하는 것을 목적으로 하였다 1, 3, 6, 10mg/kg
투여군을 각각 병행 설계(parallel group design)로
진행하였다
2015년에는 aducanumab 임상 3상이 시작되었고, 동일하게 설계된 두 개의 3상 시험이 서로 다른 환자들을
대상으로 동시에 진행되었다 2015년 8월과 9월, Study 301(ENGAGE)과 Study 302(EMERGE)가 각각
시작되었다 두 임상 시험의 목적은 aducanumab의
효능과 안전성을 관찰하는 것으로, 총 3285명의 환자를
대상으로 진행했다
1공변량: 독립변수에 포함되지는 않지만, 종속변수에는 영향을 미쳐 독립변수와 종속변수의 관계분석에서 정확도를 감소시킬 수 있는 외생변수(extraneous variable)이다[9].
2LOCF: 결측치 발생 시, 가장 마지막에 관측된 데이터로 결측값을 대체하여 데이터를 채우는 방법이다[10].
3MAR: Missing at random 의 줄임말로, 결측된 데이터가 독립변수나 종속변수와는 무관한 경우를 의미한다
그림3. Aducanumab의 임상시험과 주요사건을 나타낸
그 중 실험의 결과에 중대한 영향을 끼쳤을 가능성이
있는 두 가지의 프로토콜 변경이 있었다 첫 번째의
프로토콜 변경은 2016년 7월 수정된 Protocol Version
3(PV3)으로 , ARIA에 대한 관리 기준을 완화하여 MRI
상으로 ARIA가 관찰되더라도 증상이 나타나지 않은 경우
임상을 계속할 수 있도록 하였다 이에 따라 임상을
중단하지 않고 목표량을 모두 투여받은 환자들이 늘게
되었다 두 번째 프로토콜 변경은 2017년 3월에 수정된
Protocol Version 4(PV4)이다 PV4는 2016년 8월
발표된 Study 103의 결과를 바탕으로 변경된 내용으로, 기존에 ApoE ε4 보인자 고용량 투여군의 투약량은
6mg/kg이었으나, Study 103에서 10mg/kg의 안전성과
임상적인 효과가 입증되면서 10mg/kg으로 투여하는
것으로 프로토콜이 변경되었고, 이에 따라 임상시험이 진행되었다
2018년 12월, 전체 피실험군의 약 50%가 총 20회의
계획된 치료를 모두 완료한 시점에서 본 연구에 대한
4무용성 평가(futility analysis)가 진행되었다 무용성
평가 결과 본 연구에서 aducanumab이 유의미한 효과를
보이지 않아 임상을 조기에 중단할 것이 권고되었고, 2019년 3월 임상이 최종 중단되었다[14]
바이오젠은 2019년 6월 FDA에 임상 결과를 제출하였고, 이후 추가적인 사후분석(post hoc)을 시행하여 같은 해 10월 최종 임상 결과를 발표하였다 Aducanumab의
유효성에 대한 논란에도 불구하고 바이오젠은 FDA에
우선검토(priority review)를 신청했으며, 2021년 6월
FDA는 aducanumab의 시판을 조건부 승인했다 FDA는
임상 4상인 시판 후 확증 시험을 통해 효과를 추가로
입증할 것을 요구했고, 2022년 6월 4상 시험이 시작되어
진행 중이다
Ⅱ. Study 103, 302, 301
Aducanumab과 관련된 논란들을 정확히 이해하기 위해, aducanumab 의 여러 임상시험 중 핵심 임상시험
3가지인 Study 103, Study 302, Study 301을 자세히 알아보고자 한다 이들 중 , 안전성 (safety) 과 내약성 (tolerability) 을 확인하기 위한 Study 103(PRIME)을 먼저 살펴볼 것이다 Study 103에서 사용하고 있는 평가변수, 중간 분석, 그리고 하위그룹 분석(subgroup analysis) 등의 임상 디자인을 살펴보고, 이후 Study 103의 결과를 분석하여 본 시험이 가지는
의미와 한계점들을 분석해보자
Ⅱ -ⅰ. Study 103
1. 연구 디자인
Study 103 은 다기관 (multicenter), 무작위
배정(randomized), 이중 눈가림(double-blind), 위약
대조군 (placebo-controlled), 시간차 (staggered), 병행 (parallel-group) 설계이며 , 환자군은 인지기능
저하는 존재하지만 일상생활 유지에는 큰 문제가 없어
치매로 진단하기 어려운 상태인 ‘전단계(prodromal)’나
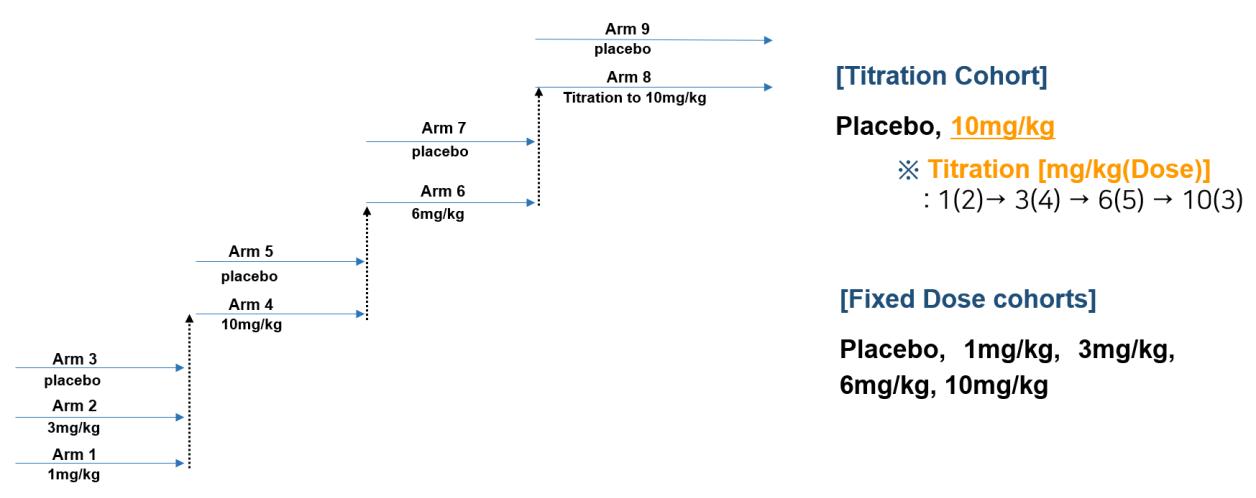
‘경증(mild)’ 단계의 환자로 구성되었다 [15] Arms
1~7 은 고정된 용량으로 투여되는 (fixed dose)
코호트이며 , Arm 8 는 1mg/kg 부터 10mg/kg 까지
점진적으로 증가하는 적정투여 (titration)
코호트이다(그림4) 위약군(placebo)과 약물 투여군의
인원 비율은 3:1이 되도록 배정되었다
Study 103은 용량 외에도 ApoE ε4 보인자(carrier)
유무에 따른 계층화를 진행하였으며, Arms 1-7에 대한
피험자는 ApoE 상태에 대해서 각 군에서의 ApoE ε4
보인자 (carreirs) 와 비보인자 (non-carriers) 비율을
1:2에서 2:1 사이로 할당하였고, Arms 8-9에서는 모든
피험자가 ApoE ε4 보인자 상태가 되도록 배정하였다
약물을 투여하기 전, 약 8주 동안 필요조건을 만족하는지
와 ApoE 유전형에 대한 조사, 그리고 신경학적/ 물리적
시험을 진행하는 심사 기간(screening period)을 거치고, 이후에 조건을 만족하는 환자군을 대상으로 약물투여가
시작된다 약물 투여는 52주 동안 진행되며, 피험자들은
거의 4주마다 한 번씩 정맥 주입(IV infusion)을 진행하여
총 14번의 약물 또는 위약을 투여 받는다 또한, 26주와
54주에는 약효를 측정하기 위해 amyloid PET 촬영과 CDR-SB 검사를 진행한다 이후에는 안전성 확인을 위해
18주간의 추적(follow-up) 기간을 거친다 70주에는
amyloid PET 촬영과 CDR-SB, MMSE 검사를 진행하여
안전성을 확인한다(그림5)
이후 aducanumab의 반응 지속성을 확인하고자 하는
목적으로 진행되는 장기간 연장연구 (Long Term Extension, LTE) 단계가 진행이 되며, 추적기간 이후
추가적으로 4 25 년 (222 주 ) 동안 진행하여 약효의
지속성을 확인한다 LTE 기간 동안에는 첫 3년 동안에는
매 4주마다 한 번씩, 총 42번의 추가적인 aducanumab
투여를 받는다
그림4. Study 103 도식(출처: FDA Aducanumab Medical Review)
그림5. Study 103 디자인 개략도
1) 환자 선정 및 제외 기준
Study 103의 선정기준은 amyloid PET scan검사에서의
양성을 조건으로, 나이는 50세부터 90세 이하이며 환자의
인지와 관련된 정보를 제공할 수 있는 보호자가 있어야
한다 또한, 전단계(prodromal) 환자의 경우 MMSE는
24점 이상, CDR global score는 0 5이어야 하고, 경증
환자의 경우 MMSE 점수는 20-26점, CDR global score 는 0 5 또는 1 점의 기준을 만족해야 한다
제외기준은 이전에 알츠하이머병 관련 치료를 받았거나, 정신질환과 같은 알츠하이머병 이외의 인지기능에 영향을
주는 질환의 유무, 그리고 출혈 장애 유무 등이 있다
2) 용량 조정
Study 103 의 용량 조정은 아밀로이드베타 표적
치료제를 사용하는 환자들에게 특징적으로 관찰되는
‘5ARIA (amyloid-related imaging abnormalities)’

부작용인 ARIA-E이나 ARIA-H 발생과 심각도를 기준으로
판단한다 다음은 임상적 증상의 유무나 심각도, 그리고
MRI 진단을 통한 ARIA의 방사선 사진 상의 심각도 등을 통해 용량을 감소할 것인지 중단할 것인지 등을 판단하는
규칙을 나타낸 것이다(표2)
표2. Study 103 ARIA-E 관련 용량 조절/중단 규칙 (출처: FDA Aducanumab Medical Review)
평가변수 본 시험은 안전성과 내약성을 보는 1차 유효성 평가변수, 약물의 약효(efficacy)를 보는 2차 유효성 평가변수, 그리고, 질병의 진행정도와 관련된 것을 검사하는 탐색적
평가변수 (Exploratory endpoint), 이렇게 총 3 개의
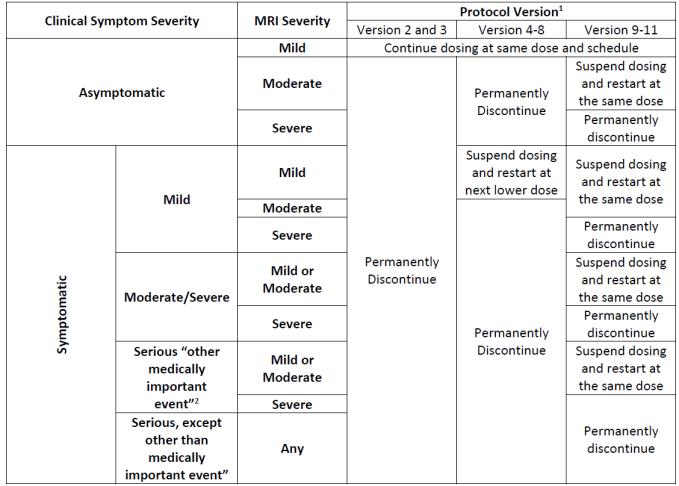
평가변수를 통해 aducanumab의 효과를 평가하였다
다음은 평가변수 각각에 대한 목적 및 판단기준을 자세히
기술한 것이다(표3)
3)Primary
Safety and Tolerability
- 부작용 및 심각한 부작용 발생률
- 임상적인 진단검사 결과
- 활력 징후
- 신경학적/물리적 검사 결과
- 심전도 결과
변화, 비선형 혼합 효과 접근방식(Nonlinear mixed effect approach) 을 통한 약물의 약동학적 결과 , 기준치(baseline)와 비교한 혈중에서의 항-aducanumab
항체의 발생률(incidence)을 통해 판단한다
마지막으로 , 탐색적 평가변수는 aducanumab 의
알츠하이머병 임상증상의 진행정도에 대한 영향을
평가하는 것으로, 54주에서의 amyloid 양의 변화, 그리고
Secondary
- ARIA 관련 뇌 MRI 촬영
Efficacy
- aducanumab의 약동학적 결과
- 26주에 PET로 측정한 amyloid양의 변화량
- 항-aducanumab 항체의 발생률 변화
AD의 임상적 진행정도에 대한 영향
- 54주에서의 amyloid 양의 변화량
4) 중간 분석(interim analysis)
6중간분석(interim analysis)은 특정 시점에서 안전성 및
유효성에 대해 치료군 간의 차이를 비교할 목적으로
실시하는 분석이다 본 시험에서는 총 3번의 중간분석이
진행되었고, 그 대상은 다음과 같다; 1) Arms 1-5 군에서 26주 방문을 완료한 피험자들, 2) Arms 1-7 군에서 26주
Exploratory
- CDR-SB와 MMSE 점수의 변화
표3. Study 103의 평가변수 별 목적 및 내용
먼저, 1차 유효성 평가변수는 부작용(adverse event) 및
심각한 부작용(serious adverse event)의 발생률, 그리고
임상적인 진단검사(lab test) 결과들, 활력징후(vital sign, V/S), 신경학적/물리적 검사 결과, 심전도 결과(ECG data), 그리고 ARIA-E/ARIA-H를 포함한 MRI 결과가
포함되며 , 이들을 통해 aducanumab 의 안전성과
내약성을 판단한다 1차 유효성 평가변수는 본 시험의
가장 주요한 목적인 안전성과 내약성을 판단하는 기준이
되는 것이기 때문에 가장 중요하다
두 번째로, 2차 유효성 평가변수는 약효를 확인하는
평가변수이다 26주에 PET를 통해 측정한 Aβ 양의
방문을 완료한 피험자들, 3) Arms 1-5 군에서 54주 방문을 완료한 피험자들 5) 하위그룹 분석(subgroup analysis)
본 시험에서는 PET SUVR에 대한 하위그룹 분석은 ApoE
ε4 보인자 여부(보인자 혹은 비보인자), 전단계 혹은 경증
알츠하이머병, 그리고 7표준화 섭취계수율(Standardized Uptake Value Ratio, SUVR) 분석에 대해 수행되었으며, 임상적 종말점에 대한 하위그룹 분석은 수행되지 않았다
2 Study Results
1) Patient disposition
Study 103에는 최종적으로 총 197명이 참가하였고, 196명은 최소 1번 이상의 투여를 받았으며, 1명은 시험 대상에서 제외되는 조건인 고혈압 관련 문제로
철회(withdrawal)되었다
CDR-SB와 MMSE 검사를 통해 판단한다 6
대해 치료군 간의 차이를 비교할 목적으로 실시하는 분석이다[17].
7표준화 섭취계수율(composite SUVR): composite SUVR 측정 시 뇌의 전두엽(frontal), 정두엽(parietal), 측엽(lateral), 측두엽(temporal), 감각운동(sensorimotor), 후각 피질(occipital cortices), 전방 및 후방 띠이랑(anterior/posterior cingulate) 영역을 합성한 영역에서 소뇌(cerebellum)가 질병 상태와 관계없이 섭취계수율이
일정한 것으로 알려져 있기 때문에 참조영역(reference region)으로 사용되었다[18].
Pharmtivation 41
Aducanumab 투여군 각각의 인원은 약 30명 정도이며,
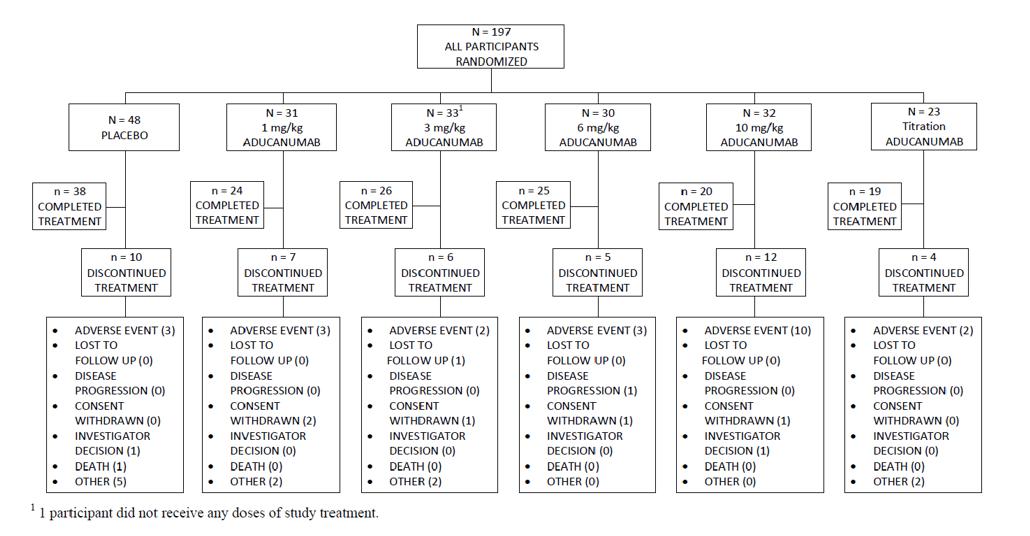
위약군은 48명, 적정(titration) 투여군은 23명으로 구성
되어있다(그림6) 투여군에서의 대부분의 중단이유는
부작용 발생으로 인한 것이고, 특히 다른 군들에 비해
10mg/kg 투여군에서 가장 많은 부작용이 발생한 것을
확인할 수 있었다 다른 군들은 2-3명정도가 부작용
발생으로 인한 중단이 발생한 반면, 10mg/kg 투여군에서
10명이나 부작용으로 인한 중단이 발생한 현상은 주의
깊게 봐야 할 부분이다
2) 인구학적 특성

인구학적 특성은 ITT 인구를 기준으로 , 성별은
남여비율은 1:1 이며, 평균 나이는 72 8세, 국가는 미국만
참여하였고, 인종은 백인이 97%로 가장 많은 비율을
차지하는 것으로 나타났다(그림7) 또한, 민족성은
히스패닉계 (8hispanic) 보다 비히스패닉계 (nonhispanic) 이 98% 의 비율을 차지하여 아프리카계
미국인 (african-american), 히스패닉 / 라틴계
(hispanic/latino)에 대한 대표성이 부족하였다
병용 약물
본 시험의 질병학적 특성은 aducanumab 투여군의
대부분은 전단계(prodromal)와 경증 알츠하이머병(mild AD) 가 약 4:6 의 비율로 구성되어 있으며 , 다른
알츠하이머병 치료제와의 동시 치료 비율은 약물 투여군
모두 50%가 넘는 비율을 보였다 또한, ApoE ε4 status의 경우, 10mg/kg 투여군은 100% ApoE ε4
보인자 상태이며, 위약군을 비롯한 다른 투여군은
61~71%의 보인자 상태로 구성되었다 CDR-SB 점수의
경우, aducanumab 투여군은 3 14~3 50 정도의 점수로
평균 3점대를 보이며, 위약군은 이보다 낮은 2 69점을
보였다
병용 약물의 경우, 평균 66%의 환자가 다른 알츠하이머
약물을 병용하고 있었으며, 병용 약물 중, cholinesterase inhibitor를 병용한 환자가 평균 63%로 가장 많았으며, memantine을 병용한 환자는 평균 20%이다
4) 효능 결과 – 임상적 평가변수
본 실험의 약효결과를 임상적 평가변수를 통해 분석한
결과이다 분석법은 ANCOVA와 MMRM을 사용하였다 각각의 결과를 자세히 살펴보자
(a) ANCOVA
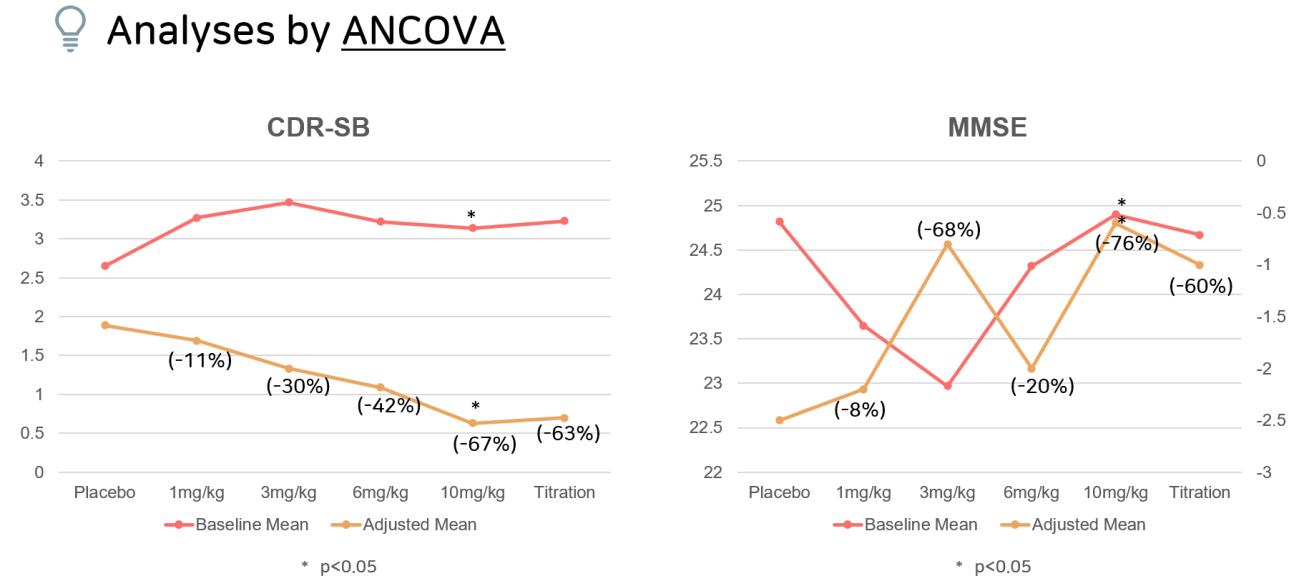
CDR-SB (점수와 알츠하이머 임상증상이 비례) 결과는 투여 용량이 증가할수록 CDR-SB 점수가 감소함을 볼 수 있었고, 위약군과 비교 시 10mg/kg 투여군이 가장 효과가 좋은 것을 볼 수 있었으며(-67%), 10mg/kg과
titration 투여군에서 p-value가 각각 0 0246, 0 0432로 p-value가 유의미함을 의미하는 0 05보다 작기 때문에 두 군에서만 통계적으로 유의미한 값을 보였다(95% CI, -0 251에서 1 511; p<0 05)(표4) MMSE(점수와 알츠하이머 임상증상이 반비례) 에서도 10mg/kg
투여군이 위약군 대비 가장 좋은 효과를 보였으며(-76%), p-value도 0 0356으로 유의미한 값이 나왔다(95% CI, -2 01 에서 0 92; p<0 05)( 표 5) 특히 , 10mg/kg
투여군에서 CDR-SB와 MMSE 모두 p-value가 0 05보다
작은 통계적으로 유의미한 결과가 나왔다 보정된
평균값(adjust mean)을 기준으로 용량에 따른 경향성은
CDR-SB는 약물의 투여 정도에 따라 경향성이 뚜렷하지만, MMSE는 경향성이 뚜렷하게 보이지 않는데(그림8), MMSE가 CDR-SB보다 조금 더 부정확한 검사법이기
때문에 나온 결과로 추측된다
(b) MMRM
대체적인 결괏값은 ANCOVA와의 분석과 거의 비슷한
양상을 보였으며 , ANCOVA 와의 분석과 동일하게
MMSE보다 CDR-SB가 농도에 따른 경향성이 뚜렷한
것을 확인할 수 있었다(그림9) 다만, ANCOVA와는 조금
다르게, CDR-SB(95% CI,-0 041에서 1 633; p<0 05)
와 MMSE(95% CI,-1 94에서 0 88; p<0 05) 두 개의
결과에서 10mg/kg 투여 환자 집단에서만 p-value가
0 05 보다 작은 , 즉 통계적으로 유의미한 결과가
나왔다(표6, 표7)
Baseline mean(빨간 선), 투여 전 환자 집단의 알츠하이머 평균 수치; Adjusted mean(노란 선), 투여 54주 후의 환자 집단의 평균 수치를 나타낸 것; 괄호 안의 숫자, placebo 집단과의 차이를 퍼센트로 나타낸 것
그림9. Study 103의 임상적 평가변수 – MMRM 분석결과, CDR-SB 와 MMSE
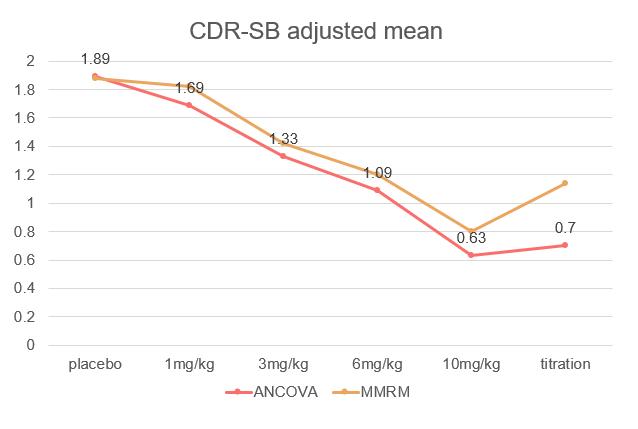
(c) ANCOVA & MMRM 결과 정리
ANCOVA 와 MMRM의 결과를 정리하면 다음과 같다
두 분석방법 모두 aducanumab 투여 후 CDR-SB 점수가
감소하였고, 용량에 비례하게 점수가 감소하는 양상을
보였다(그림10) 10mg/kg을 투여한 환자 집단에서
ANCOVA 와 MMRM모두 p-value값이 0 05보다 낮은
통계적으로 유의미한 수치를 나타냄을 확인할 수 있었다
5) 효능 결과- 약력학적(pharmacodynamic) 평가변수
다음은, 약력학적 평가변수를 통한 약효 분석결과이다
약력학적 약효분석은 시간에 따라 각 투여농도 별 뇌
아밀로이드 신호의 변화량을 26주와 54주에 PET로
측정하여 Composite SUVR로 정량화한 것으로 판단한다
다음은 Aβ PET Composite SUVR 결과를 나타낸
자료이다(그림11) 54주의 결과를 보면 aducanumab
그림10. Study 103의 임상적 평가변수 –ANCOVA와 MMRM 분석결과, CDR-SB
그림11. Study 103의 Aβ PET Composite SUVR의 기준치로부터의 변화(change from baseline in Aβ PET Composite SUVR)를 나타낸 그래프

(출처: FDA Aducanumab Medical Review)

투여군에서는 전반적으로 Aβ의 양이 상당히 감소하였고, 약물의 용량 증가 시 Aβ의 양이 감소하는 용량 의존적인(dose-dependent) 양상을 보였다 이를 통해 aducanumab이 Aβ의 양이 감소하는 것과 인과관계가
있다고 볼 수 있었다 특히 적정(titration) 투여군의 경우, 26주에는 2 9mg/kg, 54주에는 5 3mg/kg을 투여하여
26주의 3mg, 54주의 6mg 투여군과 비교해보면 용량과
효과의 비례관계가 뚜렷한 것을 확인할 수 있었다
6) 반응 유지 기간
다음은 aducanumab의 지속력을 알아보고자 4 25년 간
진행한 LTE follow-up에 대한 결과이다
먼저, Aβ 양 감소와 관련된 LTE 결과는 다음과 같다
222주의 결과를 보면, 1mg/kg과 3mg/kg 투여군은
위약군 대비 Aβ 양이 증가하였고, 6mg/kg과 10mg/kg,
그리고 titration 투여군은 위약군 대비 Aβ의 양이
감소하였다 또한, aducanumab의 용량에 비례하게
Aβ 가 감소하는 용량 의존적인 양상은 6mg/kg, 10mg/kg, titration 투여군에서 관찰되었다 (그림12)
두 번째로, 임상증상 지연과 관련된 결과는 다음과 같다
222 주의 결과를 보면 , CDR-SB 와 MMSE 모두
3mg/kg과 10mg/kg, 그리고 titration투여군은 위약군
대비 임상증상이 지연된 것을 확인할 수 있었으며, 특히 10mg/kg는 임상 증상 지연에 대한 확실한 효과가
있었음을 볼 수 있었다 다만, 1mg/kg과 6mg/kg
투여군은 위약군에 비해 오히려 증상이 악화되었고, 용량에 비례하게 임상증상이 지연되는 용량 의존적인
양상은 뚜렷하지 않았다 (그림13)
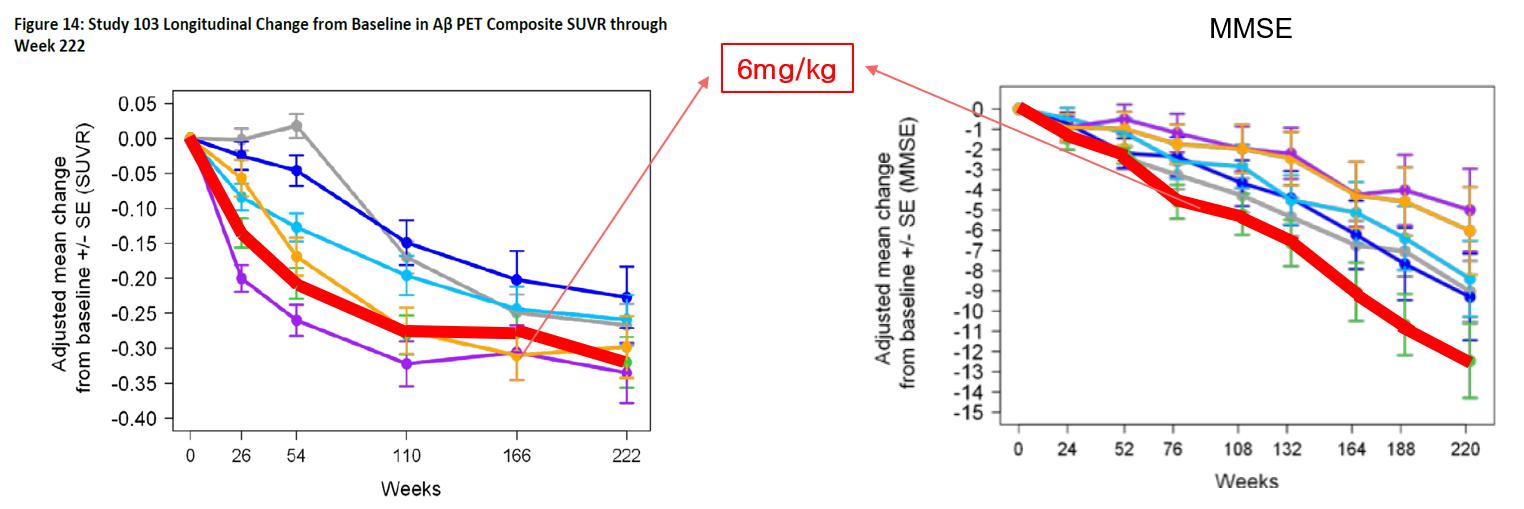
여기서, 우리는 6mg/kg 투여군의 결과를 주목하였다
222주에서의 6mg/kg 투여군(빨간색) 결과를 보면, Aβ는
위약군(회색)보다 감소하였지만, CDR-SB과 MMSE의
경우 위약군보다 악화되었다(그림14) 이것은 Aβ가
감소하면 인지기능이 개선된다는 기본적인 전제조건에
어긋나는 양상이다 따라서, 해당 용량에 대한 추가적인
시험이 필요하다고 생각된다
3 Study 103의 한계점
마지막으로, Study 103에 대한 한계점을 살펴보고자
한다 먼저, 본 임상시험은 임상 1상으로 175명이라는
적은 환자수를 대상으로 한 시험이다 따라서, 결과를
일반화하는 것은 한계가 있다 또한, 비교적 적은 환자
수로 임상시험을 진행했기 때문에 9다중성(multiplicity)
의 한계점이 있다 만일, 한 개의 1차 유효성 평가지수에
대해, 평가변수와 관련된 단 하나의 귀무가설을 언급하고
중간분석은 없이 두 처리군을 비교하는 임상시험의 경우, 제 1종 오류를 보정할 필요가 없다[21] 하지만, 본
실험은 중간 분석을 진행하는 시험이기 때문에 다중성을
보정할 필요가 있다 이를 적절하게 보정하지 않으면
그림12. Study 103의 222주까지의 Aβ PET Composite SUVR의

기준치로부터의 종단적인 변화(longitudinal change)를 나타낸
그래프
(출처: FDA Aducanumab Medical Review)
부적절한 결론이 나올 가능성이 커지고 약물 효과에 대해
입증되지 않은 주장을 할 수 있다 또한, 다중성이
존재하는 결과에서 연구자가 선호하는 결과를 선택하게
되면 시험 약물의 허가에
그림13. Study 103의 222주까지의 CDR-SB와 MMSE의 기준치로부터의 종단적인 변화(Longitudinal Change)를 나타낸 그래프 (출처: FDA Aducanumab Medical Review)
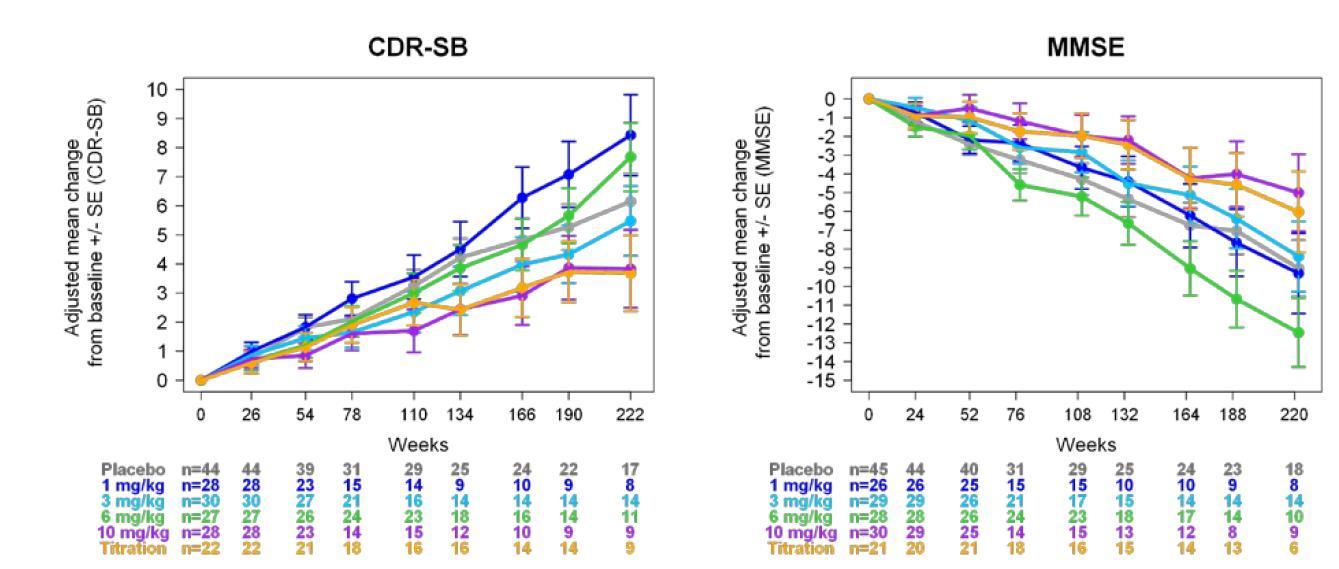
그림14. Study 103의 6mg/kg의 종단적인 Aβ PET Composite SUVR결과와 MMSE의 결과 를 나타낸 그래프 (출처: FDA Aducanumab Medical Review)
하지만 본 실험에서는 다중성에 대해 고려를 하지 않은
한계점이 있다 두 번째로, PET SUVR에 대한 분석이 모든
인원이 참가한 것이 아니라, 일부의 인원만 참여한 점을
눈여겨보아야 한다 PET 분석에 모든 인원이 참가한 것이 아니라, 아주 소수의 인원만 참여했기 때문에, 결과에
대한 일반화가 가능한 것인지 생각해 볼 필요가 있다
마지막으로, 6mg/kg에 대한 결과에서 Aβ 감소와 인지기능 개선의 연관성이 보이지 않는 결과가 나왔기에, 이에 대한 추가적인 임상시험이나 연구를 통해 Aβ 감소와
인지기능 개선의 인과관계에 대한 보다 명확한 근거가 필요할 것으로 생각된다
Ⅱ -ⅱ. Study 302
1 연구 디자인
Study 302 는 Study 301 과 동일한 디자인으로
설계 되었으며 , 다기관 (multIcenter), 무작위
배정 (randomized), 이중 눈가림 (double-blind), 병행군 (parallel-group), 3 상 임상시험 (Phase3 study)이다 검증을 위해 전 세계 181개 기관에서
진행되었으며(그림15), 환자는 장소와 ApoE 4유전자
보인자 (carrier) 여부에 따라 분류 , 무작위
배정되었다 환자들과 환자들을 돕는 스태프들은 모두
약물 투여 여부 및 용량 등에 대해
눈가림 (blind) 처리되었지만 , ARIA 의 발생 등에
의해 의도치 않은 눈가림해제(unblinding)가 일어날
가능성을 완전히 배제할 수는 없었다
Study 302는 8주간의 심사 기간(screening period), 78 주 간의 눈가림 치료기간 (blinded treatment period), final dose 이후 18주간 안전성 추가조사
기간(safety follow-up period)을 거쳤다
평가변수도 Study 301과 동일하게 구성되었으며, 1차
유효성 평가 변수(primary endpoint)로 CDR-SB, 2차 유효성 평가 변수 (secondary endpoint) 로 MMSE, ADAS-Cog 13, ADCS-ADL-MCI 검사가 이루어졌다
약력학적 유효성 평가변수 (pharmacodynamic endpoint) 로 Flobetapir PET 의 SUVR 효능분석 , 아밀로이드 베타나 tau 단백질의 CSF에서의 농도, tau PET 분석, 뇌 용적의 변화 분석 등이 이루어졌다
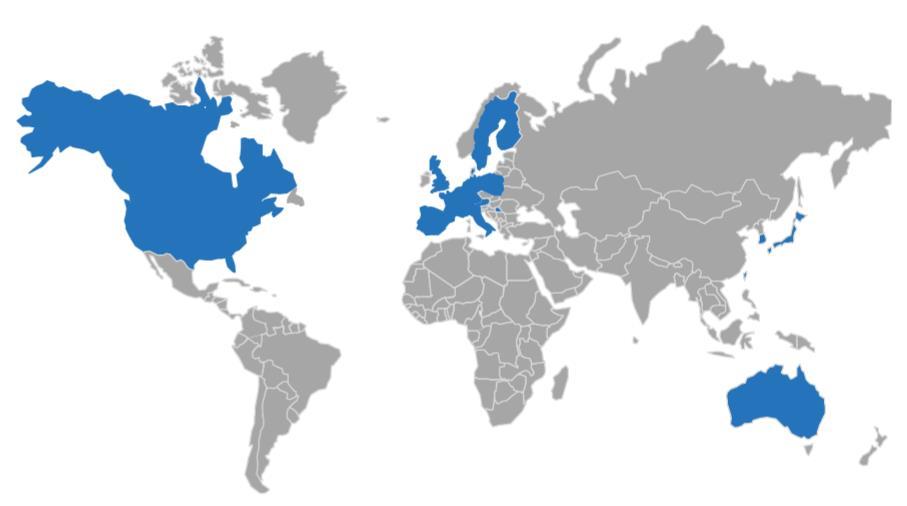
그림15. Aducanumab 임상 시험에 참여한 국가들 오스트레일리아, 호주, 벨기에, 캐나다, 덴마크, 핀란드, 프랑스, 독일, 이탈리아,
미국 등 [22].
(출처: Haeberlein et al., 2019)
Study 103과 Study 301,302에서 임상 시험 대상자의
참여를 위한 기준 중 초기 MMSE 점수에 차이가 있는
것을 확인할 수 있다 Study 103에서는 초기 MMSE

점수를 20 30 점으로 하였으나 , Study 301 및
302에서는 초기 MMSE 점수를 24~30점으로 좁혔다
임상시험 참여자의 초기 MMSE 점수에 차이를 둔 이유는
임상시험 참여자의 초기 점수 범위를 좁힘으로써
임상시험 결과에서 나타날 수 있는 가변성(variability)을
줄이기 위해서라고 볼 수 있다(표8)
또한, Study 103에서 얻은 aducanumab의 효과가 용량
의존적이라는 실험결과로부터, Study 301과 302에서는
임상시험을 저용량군과 고용량군으로 나눈 것이 다르다고
할 수 있다
8. Study 103과 301, 302의 연구 디자인 차이점
2) 유효성 평가변수
Study 103
Primary endpoint Safety and Tolerability
Secondary endpoint F-florbetapir PET (Week 26에서 측정된 amyloid signal 변화)
CDR-SB
- MMSE
- ADAS-Cog 13
- ADCS-ADL-MCI
Tertiary endpoint - NPI-10
Exploratory endpoint Week 54에서 amyloid signal, CDR-SB와 MMSE baseline 변화 -
- Amyloid signal as measured by 18F-florbeta PET and SUVR
Key Pharmacodynamic endpoint -
- CSF levels of Aβ 1-42, Aβ 1-40, p-tau, t-tau
- Tau PET - Brain volume
표9. Study 301과 301, 302의 유효성 평가변수
무용성 평가(futility interim analysis)는 개발중인
의약품이 치료제로 가치가 있는지를 따져 임상시험
지속여부를 판단하는 중간 분석이다 심각한 부작용이
발견되거나, 효과가 너무 낮아 신약으로의 가능성이 낮은 물질은 개발을 조기 중단하기 위하여 실시한다
중간 분석은 눈가림 해제 이후 임상 시험에 관여하지 않는
외부 기관에서 시행한다 외부 전문가로 구성된
자문기구인 independent data monitoring committee(IDMC)가 사전에 명시된 기준을 바탕으로
중간평가를 진행한다
중간 분석은 신약의 효과가 충분하지 않다고 보일 시
임상시험의 조기 종료를 위해 시행된다 신약이 유용성이
있는지의 판단은 조건부 검정력(conditional power)을
바탕으로 한다 조건부 검정력은 중간에 얻은 데이터로 계산한 최대 효능이 미래의 측정되지 않은 효과와 같다고
효과가 없는 것으로 본다
Aducanumab study는 치료 시작 후 78주차가 지난
참여자를 대상으로 무용성 평가 를 진행하였다
결과적으로 뇌에 축적된 아밀로이드 감소 효과는 있지만
인지 개선 효과가 크지 않다고 판단되어 임상이
중단되었다
그러나 무용성 평가가 끝나고 임상시험이 중단되기 전
3개월 간 치료를 마친 318명의 데이터를 포함한 더 큰
데이터 셋을 분석한 결과 , 임상적 효과가 있다고
발표되었고, Study 302의 고용량 투여군이 통계적으로
유의미한 결과를 보였다
2015년 8월에 Study 301(ENGAGE)을, 9월에 Study
302(EMERGE) 를 시작하였다 2016 년 7 월에는
Protocol Version(PV) 3으로 프로토콜이 수정되었다
이전까지는 ARIA의 부작용을 경험하면 일시적으로
중단했는데, PV 3로 수정된 후 ARIA를 경험한 후에도
다시 aducanumab을 투여하도록 바뀌었다
2017년 3월에는 2016년 8월에 나온 Study 103의
결과를 바탕으로 PV 4로 프로토콜을 수정하였다(표10)
프로토콜 수정 Study 103 Study 301 & 302
Study 103의 결과로 10mg/kg 이하의 투여 군에서
통계학적으로 유의미한 효과가 나타나지 않았고 , 10mg/kg 투여했을 때 부작용 크지 않다는 점이
도출되었다 이러한 결과를 바탕으로 APOE ε4 보인자의
고용량의 투여량을 기존 6mg/kg에서 10mg/kg으로
증가시키는 PV4로 수정되었다(그림17) Study 301에서
PV4 로의 수정이 Study 302 보다 한 달 더 늦게
시작되었다
Dose level & duration 변경
Titration regimen (in arm 8)
1mg/kg to 6mg/kg 1mg/kg to 10mg/kg
ARIA 발생 관련 용량(dose) 수정
Dose level & duration 변경
PV3 (2016.07.21)
ARIA 발생 관련 용량(dose) 수정
PV4 (2017.03.24)
Apo E 고용량 10mg/kg 변경
PV6 (2018.06.28)
표본 크기 변경: 450 535명
표10 Study 103과 301, 302의 프로토콜 수정 비교
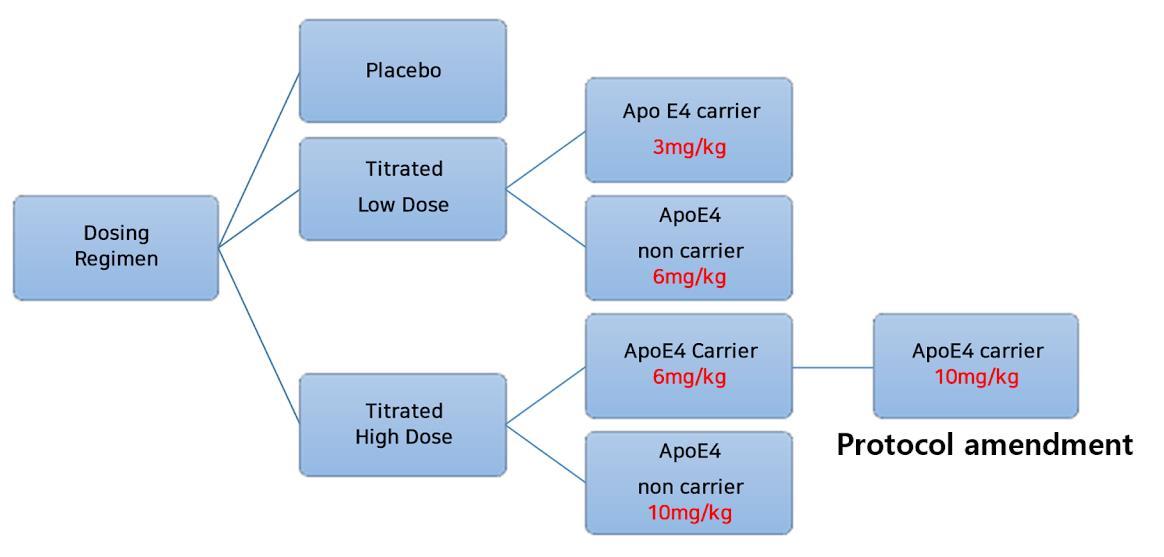
그림17 Study 301, 302의 하위 집단 별 aducanumab 용량을 나타낸 도표
Study 301과 Study 302에서 사용된 aducanumab
투여 요법 변화를 그래프로 확인할 수 있다(그림18)
저용량군에서 ApoE ε4 보인자의 aducanumab 투여
용량을 1mg/kg으로 시작하여 8주 차부터 3mg/kg으로
증가시켰다 고용량군에서는 ApoE ε4 보인 자의
aducanumab 투여 용량은 PV4 프로토콜 수정 이전에는 1mg/kg으로 시작하여 8주 차에 3mg/kg으로 증가시킨
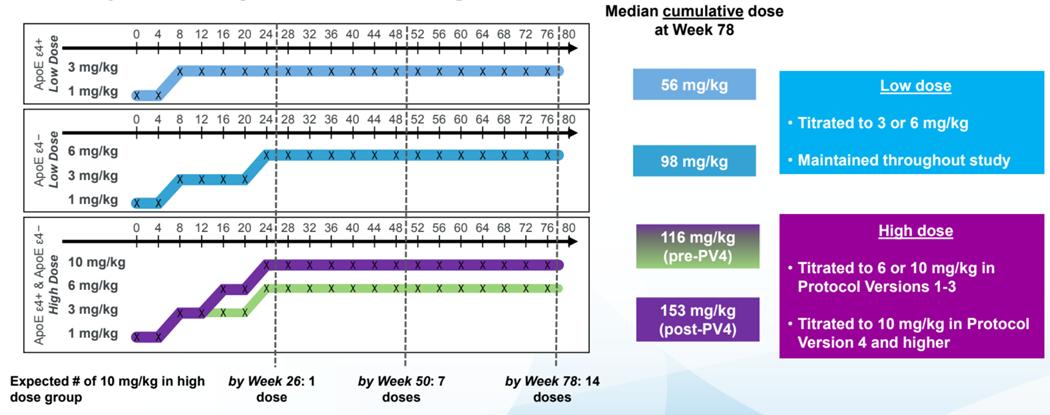
후, 24주 차에 6mg/kg으로 증가시켰다 PV4 프로토콜
수정 이후에는 ApoE ε4 보인자의 aducanumab 최종
투여 용량을 6mg/kg에서 10mg/kg으로 증가시키면서, 16 주 차에 6mg/kg 으로 증가시킨 후 24 주 차에 10mg/kg으로 증가시키도록 변경되었다 한편, ApoE ε4
비보인자는 저용량군에서 1mg/kg으로 시작하여 6주
차에 3mg/kg으로 증가시킨 후 24주 차에 6mg/kg으로
증가시켰다 ApoE ε4 비보인자의 고용량군에서의 투여
요법은 PV4 이후의 보인자와 동일하였다
Study 301과 Study 302에는 PV4 도입 시기 차이로
인한 총 투여량 차이가 있었다 Study 301보다 Study
302에서 프로토콜 수정이 한 달 먼저 도입되었기 때문에
10mg/kg를 권고된 전체 14번의 용량으로 투여받은 환자
비율이 Study 301 에서 22 3%, Study 302 에서 28 8%로 Study 302에서 더 높았다
3 연구 결과
Study 302 요약
• Study 302는 고용량군에서 1차 및 2차 목표를 충족
했다
• Study 302의 저용량군에서는 고용량군에 비해서는
적은 약효가 나타났고, 이를 통해서 aducanumab이
용량 의존적인 관계가 있는 것을 알 수 있다
Study 302(ENGAGE) 참여 전 적합성 평가를 위해서
심사 기간에 참여한 사람은 총 6757 명이었고, 그 중
기준에 적합하지 않거나 amyloid PET Scan에서 amyloid
플라크가 관찰되지 않는 등의 이유로, 5144명을 제외한
1643 명의 환자들이 눈가림 치료기간 ( blinded treatment period)에 참여했다 환자들은 위약군과
치료군에 1:1:1 (위약 : 저용량 : 고용량 = 548: 543:
547)비율로 무작위 배정되었고, ITT population은 총
1638명이다(표11)
그림18 Study 301, 302의 aducanumab 투여 요법 (출처: Haeberlein et al., 2019)
실험 중단 중 가장 많은
비중을 차지한 원인은 부작용의 발생이었으며 , aducanumab을 고용량으로 투여받은 고용량군에서 가장
많이 나타났다 ( 표 12) 표에는 세부 중단원인으로
부작용으로 인한 중단만을 나타냈다
2) 인구학적 특성
Study 302의 각 용량군 에 배정된 환자들의 주요 인구
통계학적 특성은 아래 표와 같다(표13) 성별(sex)과
나이는 위약군과 저용량, 고용량 에서 모두 비슷하였고 각
용량군에서 남성 : 여성 = 1 : 1의 비율이었고, 전체
평균은 약 70 6세 정도이다 인종의 경우, 각 용량군의
약 76% 정도가 백인으로 가장 많았고, 그 다음이 아시아
인으로 각 arm의 8%정도에 해당했다 전체 환자 중
39 8 %가 미국에서 등록된 환자였으며, 아프리카계

미국인 (african-american), 히스패닉 / 라틴계 (hispanic/latino)에 대한
그림19. Study 302 환자 특성
Study 301과 302의 ITT군 기준, 임상 대상자의
경도인지장애 및 알츠하이머병
전단계(prodromal) 환자와 경증 환자의 비율은 두
시험에서 거의 비슷하였다(표14) 또한, 임상 중 허용된
알츠하이머 병용 약물을 복용한 대상자의 비율도 큰 차이
없었다 기존에 투여하던 약물을 연구 시작 전에 중단한
경우의 비율도 마찬가지로 나타났다 결과적으로 Study
301과 302의 결과 차이가 임상 대상자의 기존 AD 진행
정도나 병용 약물에 의한 것으로 보기는 어려웠다 Study
의 경우, Study 301 및 Study 302와의 초기 질병 분포는 달랐지만 Study 103의 각 치료군 간의
다만, 연구 진행 시점에 따라 임상 대상자의 초기 질병
단계 구성에 차이가 발생한 점을 각 임상 결과 분석에서
무시할 수 없다 Study 302의 연구 시기 별 초기
임상단계(baseline disease stage)를 나타내면 아래
그래프와 같다(그림20) 시기 별 임상 대상자의 초기 임상
단계가 균일하지 않음에 따라 pre-PV4 군과 postPV4군에서 구성원의 초기 AD 중증도에 차이가 나타났다
이에 따라 pre-PV4와 post-PV4 하위 집단 및 전체
위약군 간의 비교 등을 진행할 때 환자의 초기 상태 차이가
결과에
Medical Review)
4) 치료 순응도, 병용 약물
(a) 치료 순응도 (Treatment compliance)
Study 302에서 치료 기간 치료에 대한 환자들의
순응도 (compliance) 는 96 2% 로 높았다 그러나 , ARIA로 인한 프로토콜에 정의된 용량 변경, 프로토콜의
변경 및 연구 종료는 몇몇 환자들이 목표 용량보다 적은
용량을 받았음을 의미한다
예를 들어, ApoE ε4 보인자 환자군의 경우, PV4의
변경으로 고용량군의 투여 용량이 변경되었다 따라서, ApoE ε4 비보인자 환자군에 비해 ApoE ε4
보인자 환자군의 경우 10mg/kg을 모두 투여받은 환자와
한 번이라도 10mg/kg을 투여받은 환자 모두 비율이 낮은
것을 확인할 수 있다(표15)
Patients Apo E ε4 carriers Apo E ε4 non-carriers
Received all 14 doses of aducanumab
표15. Study 302에서 10 mg/kg를 투여받은 비율 (출처: FDA Aducanumab Medical Review)
(b) 병용약물
Study 302 에서는 환자 중 14% 가 연구 기간 중
알츠하이머병 병용 약물을 변경하였다 병용 약물 변경
환자들의 수는 각 치료군 간 비슷하였다(표16)
한편, Study 301 및 302 모두 알츠하이머병 관련 병용
약물 사용 유무에 따라 하위군을 나누어도 결과상 큰 차이점이 보이지 않았다(표17) 따라서, aducanumab의
효과에 알츠하이머병 병용 약물의 사용이 영향을 주지
않는 것으로 보인다
표17. Study 301, 302에서 기준값으로부터 AD 병용약물
변경이 있었던 환자의 수 및 비율(%)
(출처: FDA Aducanumab Statistical Review)
아래의 표는 Study 302(overall), Study 302 고용량,
Study 301에서 PV4 시행 전후의 알츠하이머병 병용
약물 사용을 시작한 환자들의 비율을 각각 나타낸
것이다(표18) 이를 통해 PV4 시행 이후 알츠하이머병
병용 약물을 시작한 환자의 비율이 약간씩 증가하였음을
알 수 있다 따라서, 알츠하이머병 병용 약물의 영향은
PV4 의 영향 분석을 어렵게 하는 교란 요인으로
작용한다고 생각된다
: FDA Aducanumab Medical Review)
표18. Study 301, 302에서 AD 병용약물을 사용하기 시작한
비율(%) (출처: FDA Aducanumab Statistical Review)
5) 효능 결과(Efficacy results)
(a) 효능결과 – 1차 유효성 평가 변수(CDR-SB)
Study 302에서 78주 차에 1차 유효성 평가 변수인
CDR-SB의 기준선으로부터의 변화량을 분석한 결과를 다음과 같은 표로 나타냈다(표19) 이 분석을 위해
MMRM 분석법이 사용되었으며, 기준선으로부터의 양의
값의 변화는 증상의 임상적 악화를 의미한다 초기 CDRSB 값은 위약군에서 548명, 저용량군에서 543명, 고용량군에서 547명을 대상으로 측정하였다 78주 차에
기준선으로부터 변화한 CDR-SB 값은 위약군, 저용량군, 고용량군에서 각각 288명, 290명, 299명을 대상으로 측정하였다(표19)
저용량군에서는 -0 26(95%CI, -0 569에서 0 041; p>0 05)의 차이를, 고용량군에서는 -0 39(95%CI,0 694에서 -0 0865; p<0 05)만큼의 차이를 보였다
즉, 78주 차에 CDR-SB의 기준선으로부터의 퍼센트
변화는 위약군과 비교하여 고용량 치료군에서 –22%
감소하는 결과를 보여 위약군과 비교하여 고용량
치료군에서 유의미한 효과를 확인할 수 있었다(p=0 0120)
한편 저용량군에서는 -15% 의 차이를 보여
고용량군에서보다 작은 효과가 나타났고, 통계적으로
유의미하지 않은 결과가 나왔다(p=0 0901)
그러나 자료 해석 시 주의할 점은 퍼센트 감소에 대한 강조가 가변적인 플라시보 효과 (placebo effect)를 가릴 수 있다는 것이다 또한, 분석 스케일로
단순한 CDR-SB 값을 사용하는 것보다 log(CDRSB)를 사용하는 것이 더 적절하며, 퍼센트 감소에
연구가 진행되는 동안 방문주차(analysis visits)에 따라 CDR-SB의 기준값으로부터의 보정 평균 변화량을 나타낸
그래프에서는 78 주에서만 CDR-SB 변화량에 대해 aducanumab 고용량군에서만 유의미한 변화가 나타났고, 그 이전인 26주 및 50주에서는 유의미한 차이가 나타나지
않았다(그림21)
그림21. Study 302(EMERGE)에서 CDR-SB의 기준값으로부터의 종단적 변화를 나타낸 그래프
: Haeberlein et al., 2019)
(b) 효능 결과 – 2차 유효성 평가 변수
Study 302에서 2차 유효성 평가 변수로 MMSE, ADASCog 13 그리고 ADCS-ADL- MCI가 사용되었다 각각의
결과를 살펴보자
먼저 , 초기 MMSE 값은 실험자를 대상으로
측정하여 임상실험에 참여한 모든 위약군, 저용량군, 고용량군에서 각각 548명, 543명, 547 명을 대상으로
측정하였고, 78주 차에 기준선으로부터 변화한 MMSE
값을 위약군, 저용량군, 고용량군에서 각각 288명, 293명, 299명을 대상으로 측정하였다(표20)
저용량군에서는 위약군과 -0 1(95% CI, -0 65에서 0 48; p>0 05) 차이로 유의미한 차이가 없었고, 고용량군은
위약군과 0 6(95%CI, 0 00에서 1 13; p<0 05)만큼의
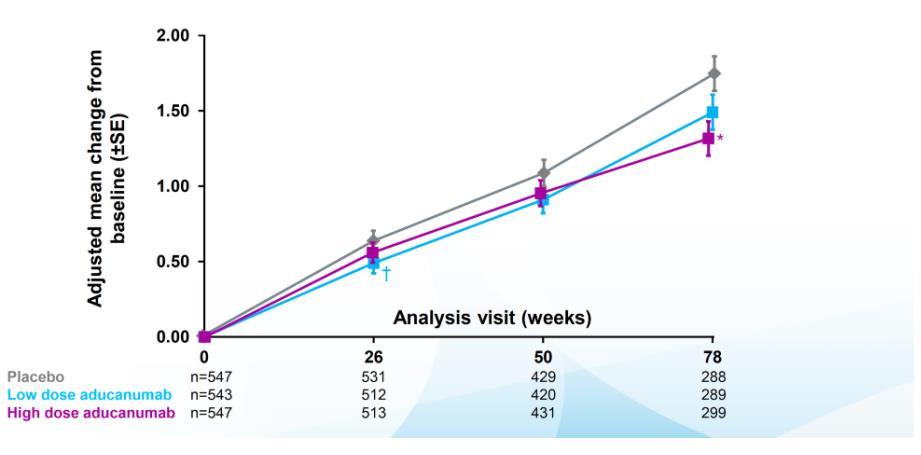
차이가 있었다 즉, -18%의 차이를 보여 고용량군에서는
유의미한 효능을 보이는 것을 알 수 있다
연구가 진행되는 동안 방문주차에 따라 MMSE 의
기준값으로부터의 보정 평균 변화량을 나타낸
그래프에서는 50주 및 78주에 측정한 MMSE변화량에
대해 고용량군에서 유의미한 변화가 있었음을 확인할 수
있다(그림22)
다음으로 초기 ADAS-Cog 13 값은 위약군, 저용량군,
각각 545명, 524명, 546명을 대상으로
측정했고 78주 차에 위약군, 저용량군, 고용량군에서 각각
287명, 289명, 293명을 대상으로 측정하였다(표21)
ADAS-Cog 13 값의 위약군과의 차이를 고용량군과
저용량군을 각각 비교하였을 때 , 저용량군에서는
-0 70(95% CI, -1 76에서 0 36; p > 0 05), 즉 -14%의

차이를 보였다 고용량군에서는 -1 40(95% CI, -2 46에서 0 34; p<0 05), 즉 -27%의 차이를 보였다 결과적으로
Study 302에서 aducanumab은 ADAS-Cog 13 분석의
고용량군에서 유의미한 효능이 나타난 것으로 보이며, 이는 study 302의 1차 유효성 평가 변수의 경향성과도 일치했다
그림22. Study 302(EMERGE)에서 MMSE의
기준값으로부터의 종단적 변화를 나타낸 그래프 (출처: Haeberlein et al., 2019)
초기 ADCS-ADL-MCI 값은 위약군 , 저용량군 , 고용량군에서 각각 545명, 540명, 545명을 대상으로
측정했고, 78주 차에 위약군, 저용량군, 고용량군에서
각각 283 명 , 286 명 , 295 명을 대상으로
측정하였다(표22)
78주 차에 ADCS-A이-MCI 값의 기준선으로부터의 보정
평균 변화량은 위약군에서 -4 3 (95% CI, -5 02에서3 53), 저용량군에서 -3 5 (95% CI, -4 29에서 -2 79; p>0 05), 고용량군에서 -2 5 (95% CI, -3 27에서 -1 79; p<0 05)였다
78주 차에 ADCS-ADL-MCI 값의 위약군과의 차이를
저용량군과 고용량군에서 각각 비교하였을 때 ,
저용량군은 0 7(95% CI; -0 27에서 1 73; p>0 05)이고
고용량군은 1 7(95%CI; 0 75에서 2 74; p<0 05)였다
위약군과의 퍼센트 차이(% difference vs placebo)는
저용량군에서는 -16%, 고용량군에서는 -40%
였다(표22)
즉 , ADAS-Cog13 과 ADCS-ADL- MCI 은
고용량과 저용량에서
dependent)
표22. Study 302의 임상적 평가 변수 – ADCS-ADL- MCI (출처: FDA Aducanumab Medical Review)
(c) 효능 결과 – 약력학적 유효성 평가 변수
효능 결과 분석을 위한 약력학적 유효성 평가변수로는
뇌척수액(cerebrospinal fluid, CSF)에 존재하는 Aβ1-42
와 Aβ1-40 농도의 기준값으로부터의 변화 , 181 번
위치에서 인산화된 tau(p-tau), 전체 tau(t-tau)가 Study
302에 참여한 환자들의 일부에서 측정되었다
먼저, 뇌의 Aβ 신호의 변화는 SUVR로 측정되었으며
측정결과는 MMRM 모델로 분석하여 치료군, 방문(visit), treatment group-by-visit interaction, 초기 나이, 초기
MMSE 값, ApoE ε4 유전자 보유 여부, 초기 SUVR 값
등에 의한 영향을 통제하였다 Amyloid PET는 0주 차와 26주 차, 78주 차에 측정하여 초기값으로부터의 Aβ PET
composite SUVR의 변화를 나타냈다
결과적으로 study 302의 Aβ PET composite SUVR
변화는 78주에 위약군과 비교한 보정 평균 변화량이
저용량군에서 -0 179(p<0 0001), 고용량군에서0 278(p<0 0001)로 유의미한 감소를 보였다(그림23)
한편, 26주에 측정된 Aβ PET composite SUVR 값의
변화는 저용량군에서 -0 075(p<0 0001), 고용량군에서 -0 082(p<0 0001)로 유사한 값으로 나타났다(표23)
그림23. Study 302에서 측정한 Aβ PET Composite SUVR의 기준값으로부터의 변화 (출처: FDA Aducanumab Medical Review)
302(EMERGE)
표23. Study 302 Aβ 18F-florbetapir PET의 SUVR 분석 (출처: FDA Aducanumab Medical Review)
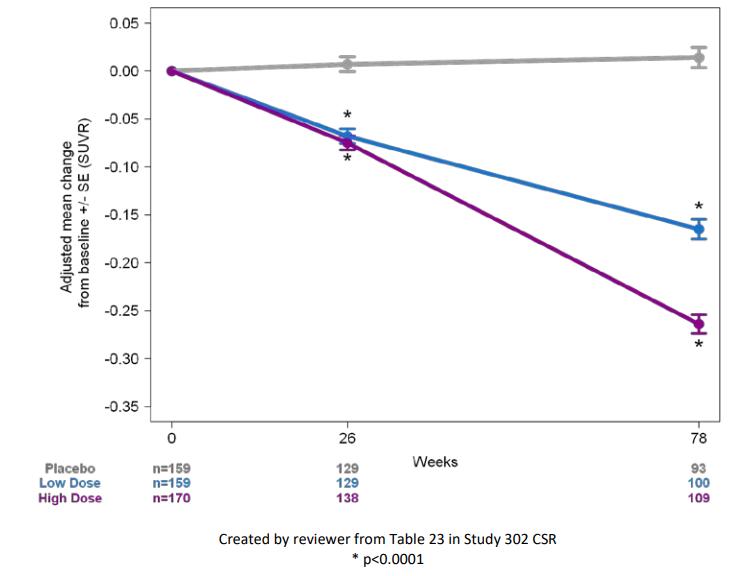
이러한 결과는 8주~24주까지 적정(titration) 기간에는
두 그룹이 유사한 용량이 투여된 것이 원인으로 생각된다
전체적인 그래프 개형을 통해 SUVR 변화량과
aducanumab의 투여에는 시간 및 용량 의존적인 관계가
있음을 확인할 수 있다(그림23)
한편, 78주 차에 ApoE ε4 유전자 보유 여부에 따라 고용량군의 대조군과의 차이를 비교한 경우, 각각
ApoE ε4 보인자군에서는 -0 260(95% CI, -0 2915에서 -0 2280), ApoE ε4 비보인자군에서는 -0 298(95% CI, -0 3490 에서 -0 2469) 값을 나타냈다 ApoE ε4 비보인자군에서 더 큰 감소가 나타났는데, 이러한 결과는 aducanumab 투여 용량이 더 컸다는 사실과 일치한다(표24)
302(EMERGE) High Dose Group
ApoE ε4 carriers ApoE ε4 non-carriers
Reduction -0.260 -0.298
95% CI (-.02915, -0.2280) (-0.3490, -0.2469)
표24. Study 302 고용량군의 ApoE ε4 유전자 보유 여부에 따른 SUVR 변화량의 차이 (출처: FDA Aducanumab Medical Review)
다음 그래프는 aducanumab 치료를 받고 78주에 CSF에
존재하는 Aβ1-42 와 Aβ1-40 농도의 기준값으로부터의
변화를 측정하여 나타낸 것이다(그림24) CSF Aβ1-42 의
농도는 용량 의존적인 증가가 관찰되었지만, CSF Aβ1-40
의 경우 뚜렷한 경향성이 나타나지 않았다 CSF Aβ1-42
농도의 변화는 CSF로의 Aβ1-42의 유입이 증가하였거나, CSF로부터의 청소율이 감소했기 때문에 나타난 것으로
생각된다
그림24. Study 302 78주에서 CSF Aβ1-42(위) 과 Aβ1-40(아래) 의 기준값으로부터의 변화 (출처: FDA Aducanumab Medical Review)
다음은 aducanumab 치료를 받고 78 주에 CSF 에
존재하는 알츠하이머병의 tau 병태생리 및 신경퇴화의
마커인 p-tau 및 t-tau 농도의 기준값으로부터의 변화를 측정하여 나타낸 것이다(그림25) p-tau 및 t-tau에서는
모두 aducanumab 의 용량에 의존적인 감소 가
나타났다(그림25) 한편, 각 용량군에서 aducanumab
치료를 받은 환자들 간에도 결과에 상당한 차이가 있었다
그림25. Study 302 78주에서 CSF p-tau(위) 와 t-tau (아래) 기준값으로부터의 변화
(출처: FDA Aducanumab Medical Review)
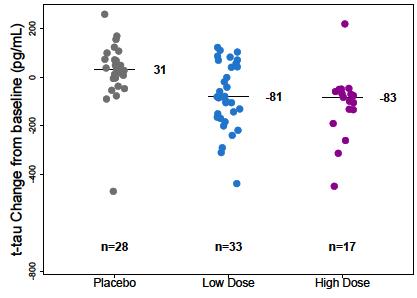

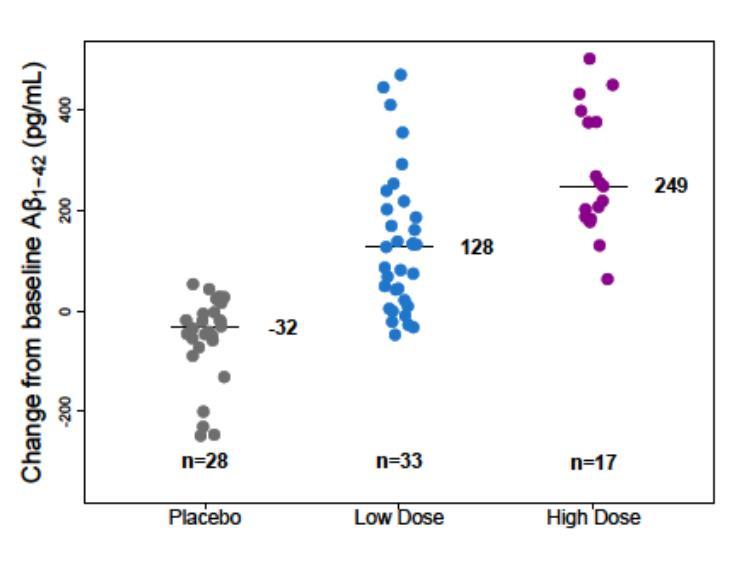
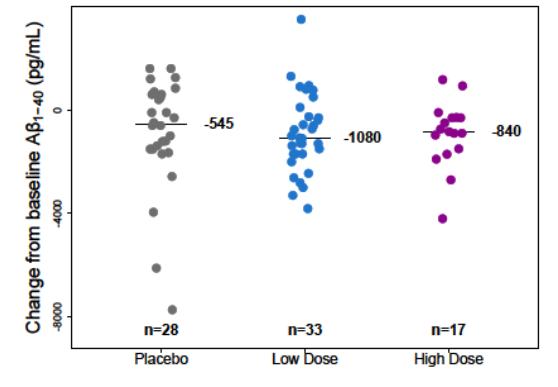
Ⅱ-ⅲ. Study 301
바이오젠은 aducanumab의 알츠하이머병 환자에 대한
효능 (efficacy) 과 안정성 (safety) 을 평가하기 위해
동일하게 디자인된 임상 3 상 시험인 Study
301(EMERGE)과 Study 302(ENGAGE)를 진행하였다
동일하게 설계되었지만, Study 302는 고용량에서 임상적
유의성을 보였지만, Study 301의 경우에는 임상적
유의성을 나타내지 못하였다 임상시험에서 상반된
결과가 나온 것과 관련하여, aducanumab의 효능에 대한
많은 논란이 발생하였다 따라서 Study 301의 디자인에
대하여 간략하게 살펴본 후, 논란이 된 Study 301의 임상
결과를 살펴보고자 한다
1 연구 디자인
Study 301 의 디자인은 Study 302 와 동일하다
다기관(multicenter), 무작위 배정(randomized), 이중
눈가림(double-blind), 위약 대조(placebo-controlled), 병행군 (parallel-group), 3 상 임상시험 (phase 3 study)이며, 환자군은 초기 알츠하이머병 환자로, MCI 환자군과 전단계(prodromal) 환자군으로 구성되었다
3 상 임상시험의 경우 , 환자는 위약군 , 저용량군 , 고용량군의 세 가지 군에 배정되며, 위약군 : 저용량군 : 고 용량군에 1:1:1로 무작위 배정된다 또한, 층화 무작위
배정법 (stratified randomization) 에 따라 환자를
분류하는데, 환자의 위치와 ApoE ε4 보인자의 여부에
의해 결정되었다 Study 301의 ApoE ε4 보인자 여부에 따른 고용량군 , 저용량군의 투여량을 포함한
투여요법 (dosing regimen) 은 Study 302 과 같다 (그림17), (그림18)
(safety follow-up period)으로 구성이 되고, 이를 완료한
환자는 장기 연장연구(long-term extension period)에
참여할 선택권이 주어진다
무용성 평가(futility analysis) 시행일인 2018년 12월
26일까지 Study 301 참여 환자의 57%가 78주차 방문
완료 기회(opportunity to complete)를 얻었다
2 연구 결과
다음은 Study 301의 환자 분포를 나타낸 표이다(표25)
심사 기간 (screening period) 에 참여한 사람은 총
6,173 명이었고 , 그중 시험 기준에 맞지 않아
무작위화되지 않은 사람은 4,520명, 무작위화 되어
눈가림 치료 기간(blinded treatment period)에 참여한
환자는 1,653 명이다 위약군과 치료군 ( 고용량과
저용량)에 1:1:1 비율로 무작위화되었고, ITT 인구집단은
총 1647명이다 심사 기간(screening period) 단계에서
눈가림 치료 기간 (blinded treatment period) 으로
넘어가지 못한 주요 이유는 10CDR global score, MMSE score, RBANS score가 포함 기준에 부합하지 않거나 (67%), 양성의 Amyloid PET scan 이 없는 (12%)
것이었다
환자 분포는 Study 301과 Study 302가 유사하지만, Study 301이 Study 302에 비해 상대적으로 더 적은
인원이 실험을 중단하였다 11 그 이유는 Study 301이
Study 302 보다 일찍 시작하여 , study 종료
시점(2019 03 21)에 분석한 실험의 OTC
위약-통제 기간(placebo - controlled)은 8주의 심사
기간(screening period), 78주의 눈가림 치료 기간 (blinded treatment period), 18주의 안전 추적기간
표25 Study 301 환자 분포 (출처: FDA Aducanumab Medical Review)
2) 인구학적 특성


Study 301의 인구 통계학적 특성 분석은 ITT 군으로
분석하였다(그림26) 이를 살펴보면, 치료군 간의 분포가
잘 되었다 성별은 각 군에서 남성 : 여성 = 1 : 1의
비율이었고, 나이는 위약군과 저용량군, 고용량군 모두
비슷하였다 스터디를 참가한 사람의 평균 연령은
70 1세이다 인종(race)의 경우, 각 치료군의 70%
이상이 백인으로 가장 많았고, 그다음이 아시아인으로 각
치료군의 10% 정도에 해당했다 전체 환자 중 46 3%가 미국에서 등록된 환자였으며, 아프리카계 미국인(africanamerican), 히스패닉/라틴계 (hispanic/latino)에 대한 대표성이 부족하였다
그림26. Study 301 인구학적 특성 (출처: FDA Aducanumab Medical Review)
3) 초기 질병 특성
질병 특성(disease characteristic)에 대한 분석 역시
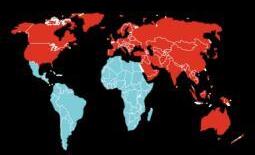
인구 통계학적 분석과 같게 ITT 인구집단으로 분석하였다
질병 특성도 위약군 및 치료군 간에 균형이 잘 잡혀 있으며, Study 302와 유사하다
연구 디자인에서도 언급하였듯, 임상 단계를 보면
알츠하이머병 초기 단계에 있는 환자 집단을 반영하는
것을 볼 수 있다 MCI 환자는 전체 인구 중 80%를
차지하고, 전 단계(prodromal) 환자는 20%를 차지한다
이는 실험의 유효성 평가 변수인 CDR-SB, MMSE, ADAS-Cog 13, ADCS-ADL-MCI 의 기준값들을
관찰하면 , 실험에 참여한 환자들이 초기 단계의
알츠하이머병임을 알 수 있다 ApoE ε4 보인자 여부를
살펴보면, 약 70%의 환자가 ApoE ε4 보인자였다
56 4%의 환자가 다른 알츠하이머 약물을 병용하고
있었으며, 병용 약물 중, cholinesterase inhibitor를 병용한 환자가 46 3%로 가장 많았고, cholinesterase inhibitor와 memantine을 함께 병용한 환자가 7 4%, memantine만 병용한 환자가 2 7%였다 환자의 13%는
투여받던 알츠하이머 약물을 연구에 참여하기 전에 중단하였다
다음은 Study 103과 3상 임상시험(Study 301, Study 302)의 질병 특성을 비교한 것이다(표26) Study 301과 Study 302 의 경우 , 값이 유사하기 때문에 , 3 상
임상시험의 값은 Study 301의 값으로만 비교하였다
알츠하이머 치매임을
나타내는 지표이다 Study 103과 Study 301의 무작위화
된 환자들의 CDR-SB의 기준값을 비교하여 보면, Study 103의 평균값이 3 17로 더 높았다 또한 이는 MMSE
점수를 비교하여도 알 수 있다 MMSE는 점수가 낮을수록
중증의 알츠하이머 치매임을 나타내는 지표이다 MMSE
점수 구간별 환자 비율을 살펴보면, 3상 임상시험에 비해 Study 103이 MMSE 점수가 낮은 구간에 많은 환자가
분포하였다는 것을 알 수 있다 Study 103에 중증의
알츠하이머 치매 환자가 많았기 때문에, 다른 알츠하이머
치매 치료 약물을 병용한 환자의 비율 역시 Study 301(56 4%) 에서보다 Study 103(66%) 에서 더
높았다고 추정할 수 있다
4) 치료 순응도(Treatment Compliance) 및 병용 약물 (Concomitant Medications)
임상 시험에 대한 환자의 치료 순응도(compliance)는
높았다 하지만 프로토콜 수정으로 인하여 ARIA 발생
시 투여 용량이 변경되었고, 임상시험이 예정된 기간을 다
채우지 못하고 조기 종료하였기 때문에 실험에
참여한 환자 중 일부는 목표했던 용량보다 더 적은 용량을
투여받았다
PV3(protocol version 3)에서 PV4 (protocol version 4)로의 변경으로 인해 ApoE ε4 보인자 환자군의 경우, 고용량군의 투여 용량이 6mg/kg에서 10mg/kg으로
변경되었다 이는 ApoE ε4 비보인자 환자군과 동일한
용량이다 임상실험 중간에 ApoE ε4 보인자 환자군의
고용량군의 투여량이 6mg/kg 에서 10mg/kg 으로
변화하였기 때문에, 처음부터 10mg/kg을 투여한 ApoE
ε4 비보인자 환자군에 비해 ApoE ε4 보인자 환자군의
경우 10mg/kg을 모두 투여받은 환자와 한 번이라도
10mg/kg을 투여받은 환자 모두 비율이 낮은 것을 확인할
수 있다(표27)
Study 301 (ENGAGE) Apo E ε4 carriers Apo E ε4 non-carriers
표27 Study 301 10mg/kg 투여 환자 비율 (출처: FDA Aducanumab Medical Review)
그리고 11 7% 에 해당하는 사람이 연구 기간 중
알츠하이머 병용 약물을 변경했다 Study 301의 각각의
군에서의 알츠하이머병 병용약물 변경 비율에 대해
나타낸 표를 보면, 각각의 군에서 알츠하이머 병용약물
변경 환자의 수와 비율은 유사한 것을 알 수 있다(표28)
Study 301 (ENGAGE) Placebo
표28 Study 301 병용약물 변경 환자 수와 비율 (출처: FDA Aducanumab Medical Review)
5) 효능 결과 – 1차 유효성 평가 변수
다음은 78주 차에 CDR-SB의 기준값으로부터의 변화를
비교한 결과이다(표29) 위약군과 고용량군을 비교하면, 위약군이 더 좋은 효능을 나타낸 것을 알 수 있었다(2%)
하지만 p-value 값이 0 8330으로 , 0 05 이상이기
때문에 이는 통계적으로 유의미하다고 볼 수 없다(95% CI, -0 262에서 0 326; p>0 05)
저용량군과 위약군의 비교 결과는, 수치적으로는
저용량군이 유의미한 효능을 보였다(-12%) 하지만, 저용량군의 p-value 값은 0 2250으로 , 0 05 이상이기 때문에 이 역시 통계적으로 유의미하다고 볼 수 없다
(95% CI, -0 469에서 0 110; p>0 05) 즉, 1차 유효성
평가 변수의 통곗값으로 보아 study 301은 부정적인 연구 (negative study)라는 것을 알 수 있다
3상 임상시험의 1차 유효성 평가 변수인 CDR-SB의 경우, 눈가림 치료 기간 중 26, 50, 78주 차에 측정한다
보라색은 고용량군, 파란색은 저용량군, 회색은 위약군의
결괏값이다(그림27) 측정 기간 중 기준값으로부터의
CDR-SB값의 수치적 변화를 비교하였을 때, 고용량군은
위약군보다 좋지 못한 효과를 나타냄을 알 수 있고,
저용량군은 효과가 있는 것을 확인할 수 있다
그림27. Study 301(ENGAGE)에서 CDR-SB의 기준값으로부터의 종단적 변화를 나타낸 그래프[21]. (출처: Haeberlein et al., 2019)
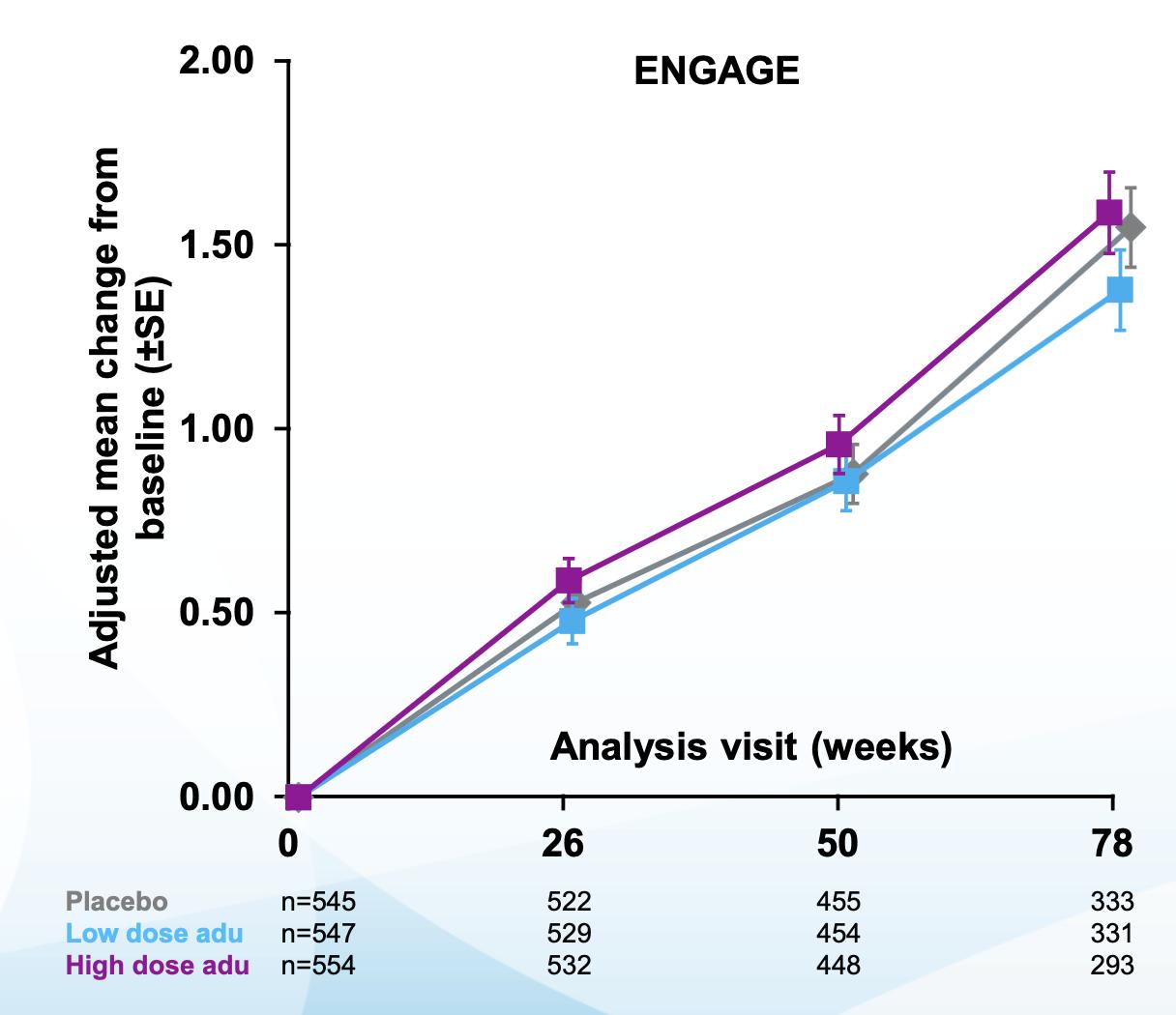
6) 효능 결과 – 2차 유효성 평가 변수
Study 301에서 사용한 각각의 2차 유효성 평가 변수의
결과를 표로 정리하였다 3상 임상시험에서 2차 유효성
평가 변수로 사용한 지표는 MMSE, ADAS-Cog 13
그리고 ADCS-ADL-MCI 이다 3상 임상시험의 2차
유효성 평가 변수 역시 1차 유효성 평가 변수와 같이, 눈가림 치료 기간 중 26, 50, 78주 차에 측정한다
먼저 MMSE 결과는 다음과 같다(표30) 저용량군과 위약군과 비교한 결과는 수치적으로는 저용량군이 유의미한 효능을 보인 것으로 나타났다(-6%) 하지만, 저용량군의 p-value 값은 0 4795로 , 0 05 이상이기
때문에 이는 통계적으로 유의미하다고 볼 수 없다 (95% CI, -0 35에서 0 74; p>0 05)
고용량군에서는 1차 유효성 평가 변수와 유사하게
수치적으로는 위약군의 효과가 더 좋게 결과가 나온 것을
알 수 있다(3%) 하지만, 고용량군의 p-value 값은 0 8106으로 , 0 05 이상이기 때문에 이는 통계적으로
유의미하다고 볼 수 없다 (95% CI, -0 62에서 0 49; p>0 05)
다음은 눈가림 치료 기간 동안 측정한 MMSE 결과의
평균값을 나타낸 것이다(그림28) 보라색 그래프는
고용량군 , 파란색은 저용량군 , 회색은 위약군의
결괏값이다 측정 기간 동안, 고용량군은 위약군보다 좋지
못한 효과를 나타냈다 저용량군의 경우 26주 차에는
위약군보다 효과가 없었지만, 50주 차와 78주 차에는
위약군에 비하여 효과가 있는 것을 확인할 수 있다
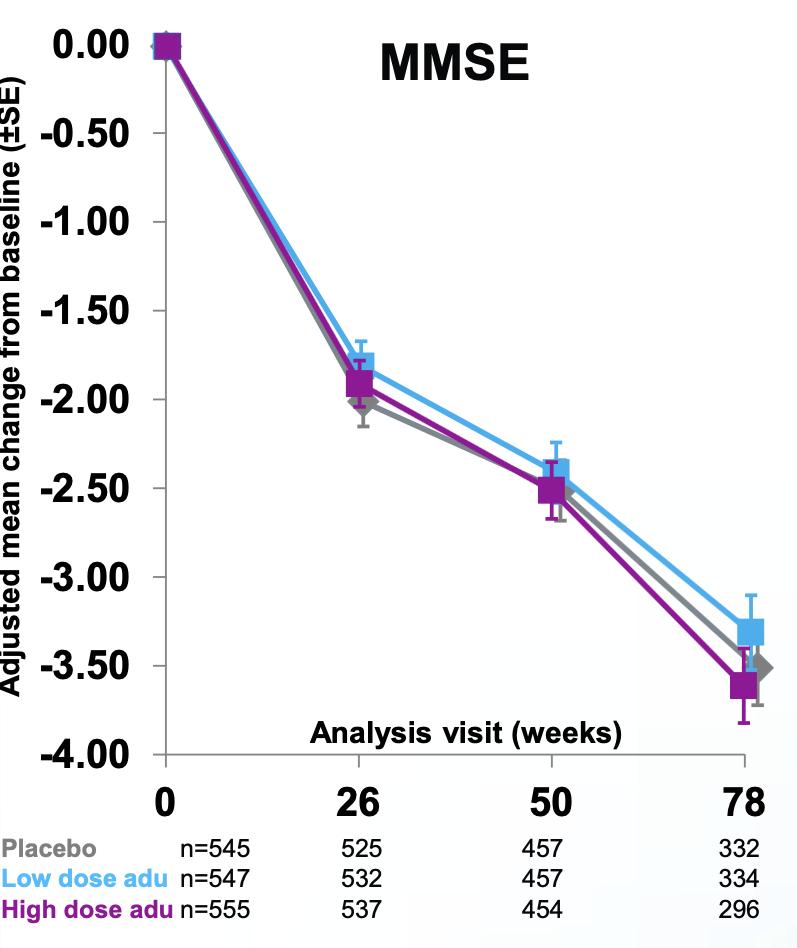
ADAS-Cog 13과 ADCSADL- MCI의 결과는 다음과
같다(표31)(표32) ADAS-Cog 13의 경우, 위약군과
고용량군 , 저용량군을 각각 비교하였을 때 , 모두 수치적으로는 치료군이 유의미한 효능을 보인 것으로
나타났다(-11%) ADCS-ADL-MCI는 위약군과 고용량군, 저용량군을 각각 비교하였을 때, 모두 수치적으로는
치료군이 유의미한 효능을 보인 것으로 나타났다(-18%)
즉, ADAS-Cog 13과 ADCS-ADL-MCI 모두 치료군에서
효과가 있었다 하지만, 고용량군과 저용량군의 효과가
거의 동일하기 때문에 용량 의존적(dose dependent)인
효과가 나타나지 않았고, 1차 유효성 평가 변수의
경향성과도 맞지 않았다
다음은 눈가림 치료 기간 동안 측정한 ADAS-Cog 13과
ADCS-ADL-MCI 결과의 평균값을 나타낸 것이다(그림 29) 보라색 그래프는 고용량군, 파란색은 저용량군, 회색은 위약군의 결괏값이다
ADAS-Cog 13의 경우, 26주에는 고용량군이 위약군에
비해 효과를 나타낸다고 볼 수 없었지만, 이후 50주와 78주에는 위약군에 비해 효과가 있음을 알 수 있다 반면, 저용량군은 모든 측정 시점에서 위약군보다 좋은 효과가
있음을 알 수 있다 또한 앞서 언급하였듯, 저용량군과
고용량군의 78주에서의 결괏값은 거의 비슷하다
ADCS-ADL-MCI의 경우, 26주에는 모든 군이 유사한
결괏값을 보였지만, 이후에는 위약군보다 고용량군과
저용량군이 효과가 더
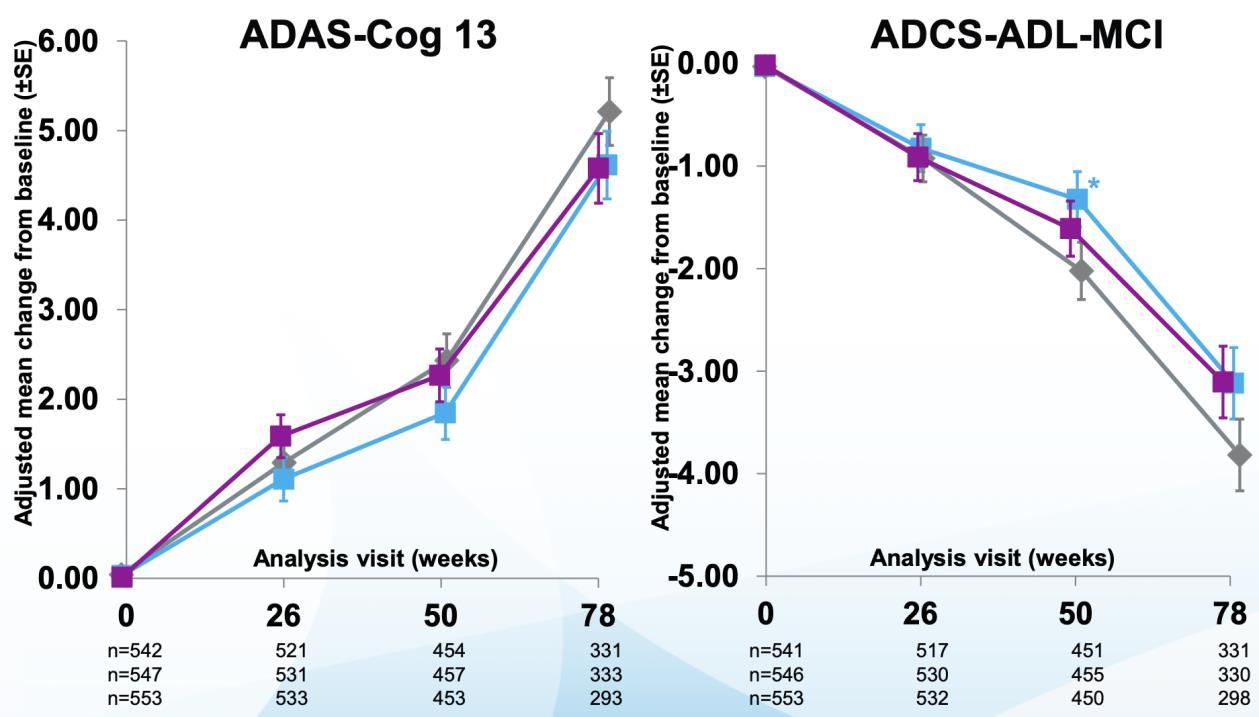
7) 효능 결과 – 약력학적 유효성 평가 변수
뇌의 Aβ 신호의 변화는 SUVR로 측정되었으며 측정
결과는 MMRM 모델로 분석하였다 그 결과 위약군에
비해 치료군에서 유의미한 감소세를 보이는 것을 알 수
있다 (그림30)
Amyloid PET의 경우, 0주, 26주, 78주 차에 측정한다
아래의 자료의 26주 차의 결과를 보면 저용량군은 -0 065, 고용량군은 -0 066으로 비슷한 정도의 Aβ 감소를
나타내는 것을 볼 수 있다 이러한 결과가 나온 이유는
적정기간 (titration period) 때문일 수 있다
8 주 24 주까지는 적정 (titration) 으로 목표 용량에
도달하기 때문에, 임상 초기에는 고용량군과 저용량군
간의 총투여량의 차이가 크지 않다 따라서 유사한 결과가
나오는 것은 합리적인 추론이라 보인다
그림30 Study 301 SUVR로 측정한 뇌의 Aβ 신호 결과 (출처: FDA Aducanumab Medical Review)
Study 301의 Aβ PET composite SUVR 변화의 78주
차의 결과를 보면, 고용량군(-0 232)이 저용량군 (0 167)보다 더 많은 Aβ가 감소하였다 따라서 뇌의 Aβ
신호 결과를 통하여 시간 의존적인 관계와 용량 의존적인
관계가 모두 나타남을 확인할 수 있다(표33) 또한 이
결괏값은 p < 0 0001이기 때문에 통계적으로 유의하다고
할 수 있다
301 (ENGAGE) Week 26 (p-value) Week 78 (p-value)
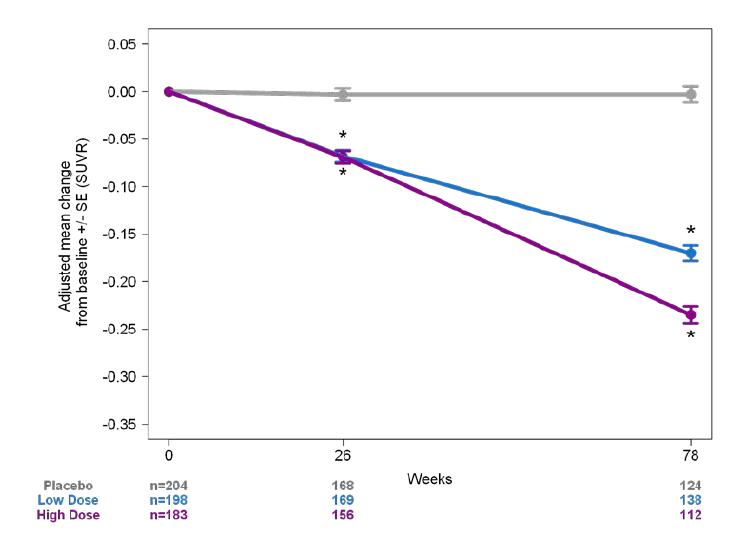
dose -0.065 (p<0.0001) -0.167 (p<0.0001) High dose -0.066 (p<0.0001) -0.232 (p<0.0001)
표33 Study 301 SUVR로 측정한 뇌의 Aβ 신호 결과 (출처: FDA Aducanumab Medical Review)
다음은 ApoE ε4 유무에 따른 Aβ 감소 결과를 비교한
결과이다(표34) ApoE ε4 비보인자군에서 투여 용량이
더 크므로 Aβ가 더 많이 감소할 것으로 기대하였으나,
ApoE ε4 유무에 대한 차이는 두드러지지 않았다
Study 301 (ENGAGE)
ApoE ε4 carrier ApoE ε4 non-carrier
Reduction -0.231 -0.234
표34. Study 301 ApoE ε4 유무에 따른 SUVR로 측정한 뇌의 Aβ 신호 결과 (출처: FDA Aducanumab Medical Review)
앞선 유효성 평가 변수들의 결과를 모두 비교하여 보았을
때, 기준값 대비 78주 차의 CDR-SB의 변화와 기준값
대비 78주 차의 SUVR의 변화 사이에는 상관관계가
관찰되지 않았다 1차 유효성 평가 변수인 CDR-SB의
경우 , 치료군과 위약군의 기준값부터의 변화를
비교하였을 때 약물이 효능이 있다고 말할 수 없었다
하지만, 약력학적 유효성 평가 변수의 결과는 시간 의존적
및 용량 의존적인 Aβ 감소를 나타낸다
즉 인지기능의 변화를 나타내는 CDR-SB의 결과와 Aβ
양의 변화를 나타내는 SUVR로 측정한 뇌의 Aβ 신호
결과의 양상은 일치하지 않는다 이를 통하여, 인지기능의
변화와 Aβ 감소의 상관관계가 없음을 알 수 있다
CSF는 78주에만 검사를 진행했다 아래의 결과는
기준값으로부터 Aβ1-42 와 Aβ1-40 의 변화를 측정하여
나타낸 것이다(그림31) CSF에 존재하는 Aβ1-42와 Aβ1-40
의 양을 측정해보면, CSF Aβ1-42의 경우 용량 의존적
증가가 관찰되었다 CSF Aβ1-40 은 다른 군과
비교해보았을 때, 고용량군에서 중앙값 변화(median change)가 관찰되지 않았다
다음은 CSF에 존재하는 tau의 양을 검사하여 그 양이
기준값과 비교하여 얼마나 달라졌는지를 나타낸
것이다(그림32) p-tau와 t-tau 모두 Study 302에서의

결과와 유사하게 Study 301에서도 용량 의존적인 감소
경향을 보였다
그림31. Study 301 Aβ1-42(위) and Aβ1-40 (아래)의
기준선으로부터의 변화 (출처: FDA Aducanumab Medical Review)
그림32. Study 301 p-tau(위) and t-tau(아래)의
기준값으로부터의 변화
(출처: FDA Aducanumab Medical Review)
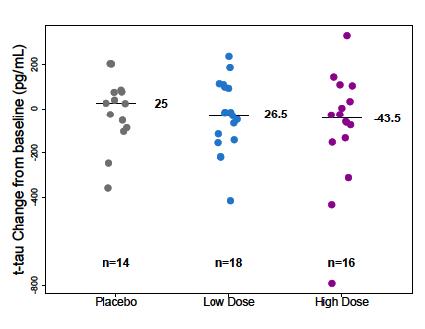
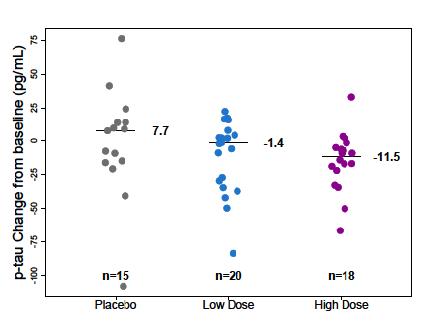
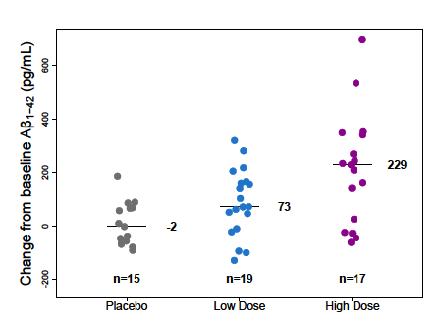
Tau PET 측정은 26, 78주 차에 진행되었다 Tau PET
관찰이 임상시험에서 상대적으로 늦게 도입되었기 때문에
부분 모집단(subpopulation)은 10mg/kg을 투여받을
기회가 있는 고용량군 환자가 더 많이 포함되었다 또한
tau PET 결과 분석의 경우, 표본 수가 너무 작기 때문에
Study 301, Study 302 통합 분석(pooled analysis)을
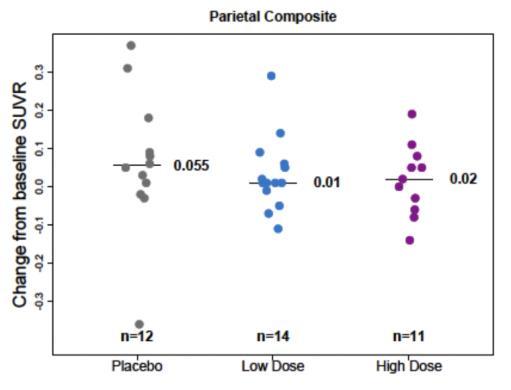
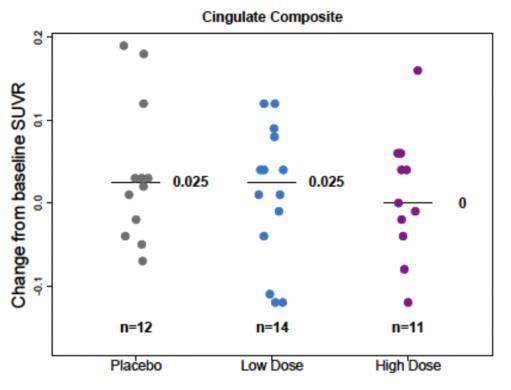
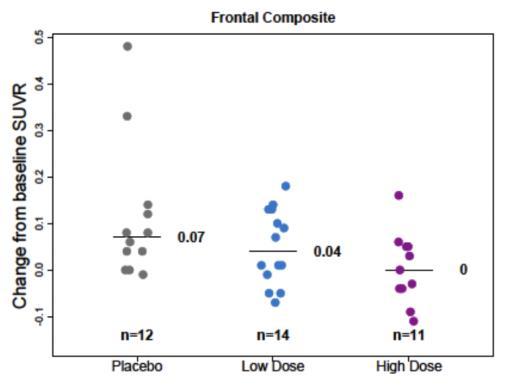
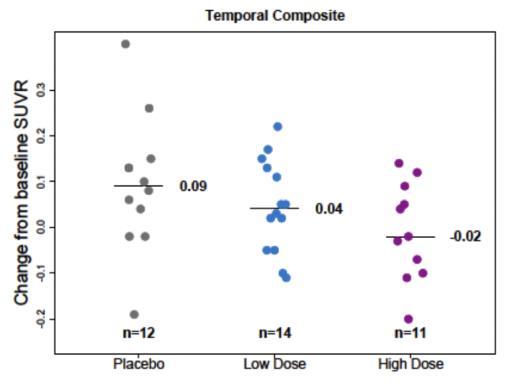

진행하였다
Tau PET를 관찰한 결과, 크게 용량 의존적 tau 감소가
관찰된 영역, 용량 의존적인 감소는 아니지만 tau의
감소가 관찰되어 유효한 치료 경향성을 보이는 영역, 마지막으로 tau의 감소가 나타나지 않는 영역으로 구분할 수 있다 그림
용량 의존적인 tau 감소가 관찰된 영역은 총 3가지 영역으로 , 내측 측두엽 (medial temporal), 측두엽(temporal), 전두엽(frontal)이었다(그림33) 용량
의존적 감소는 아니지만, tau의 감소가 관찰되어 유효한
치료 경향성을 보이는 영역은 대상 피질(cingulate), 두정엽 (parietal)이었으며, tau의 감소가 나타나지 않는
영역은 후두엽(occipital)이었다(그림34)

용량 의존적 tau 감소가 관찰된 영역의 경우, 모두 기억
및 사고가 주요한 기능인 영역인 반면, 유효한 치료
경향성을 보이는 영역의 경우, 주요한 기능이 기억 및
인지와 관련된 부분은 아니지만, 기억과 관련이 있는
영역이었다 Tau의 감소가 관찰되지 않은 후두엽은
기억과 관련이 없는 영역이었다
살펴본 바와 같이 Study 301과 Study 302는
동일한 디자인의 임상시험임에도 불구하고, 그 결과에
차이가 있다 12ICER(Institute for Clinical and Economic Review)의 ‘Aducanumab for Alzheimer's
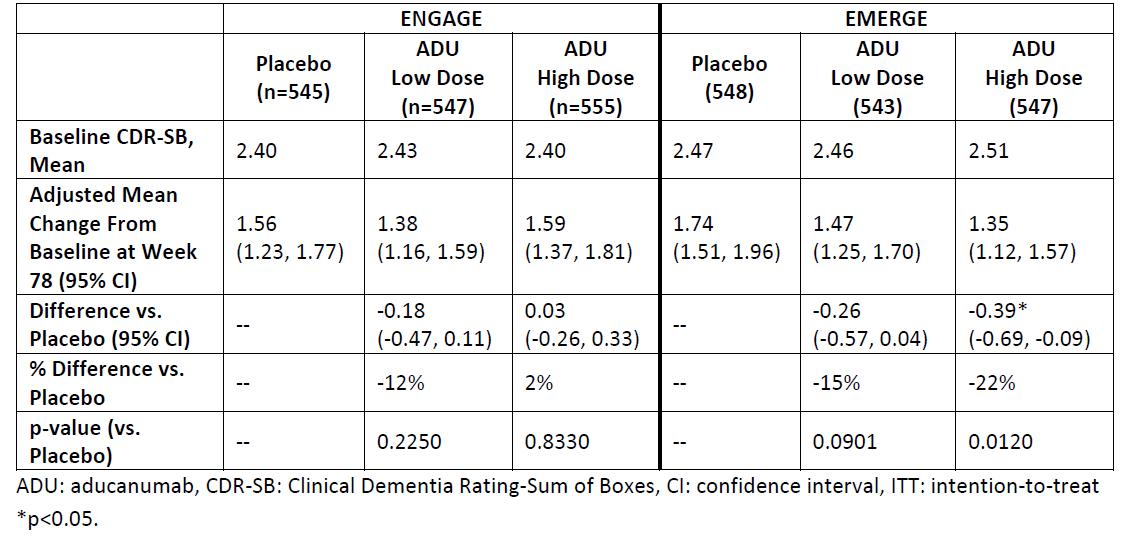
Disease: Effectiveness and Value’ 보고서에서 분석한
aducanumab의 임상적 유효성과 FDA Aducanumab
Medical Review에서 분석한 ‘Safety review’를 바탕으로
Study 301과 302의 결과가 어떻게 같고, 어떻게 다른지
살펴보고자 한다
1 Study 301, 302에서의 aducanumab의 유효성[23]
1) CDR-SB
ICER 보고서에서 분석한 aducanumab의 임상적
유효성을 살펴보자 먼저 Study 301, Study 302에서 1차
유효성 평가 변수인 CDR-SB 결과값을 살펴보면 다음과
같다(표35) 두 임상시험의 결과는 일치하지 않는데, 먼저
Study 301에서는 고용량 치료군과 저용량 치료군
모두에서 치료 효과가 관찰되지 않았다 Study
302에서는 고용량 치료군은 통계적으로 유의미한 차이가
나타났지만 (p< 0 05 ) 저용량 치료군은
통계적으로 유의미하지 않았다(p>0 05) 또한 통계적
유의성이 있는 고용량 투여군의 결과도 임상적으로
유의미한 최소한의 차이인 1-2점보다 낮았다
Study 301과 Study 302를 종합하여 메타분석한 통합
연구(pooled study) 결과, 고용량 투여군과 저용량
투여군에서 CDR-SB의 위약군과의 차이 값은 각각 -0 18, -0 21로 비슷했다 ( 그림35) 또한 고용량 투여군의
치료효과는 통계적으로 유의미하지 않았는데(95% CI0 50, 0 24), 이는 Study 301의 고용량 투여군 CDR-SB
결괏값의 영향이라고 생각해볼 수 있다 Study 301에서
고용량 투여군의 CDR-SB 값은 위약군보다 높아진 0 03으로 , 위약군에서 더 긍정적인 결과가 나왔지만,
통계적 유의성은 없었다(95% CI -0 26, 0 32) 이
결괏값으로 인해 Study 302와 종합해도 통계적으로
유의미하지 않은 결과가 나온 것이라 생각되었다
추가적으로 16주에 PV4에 동의한 환자군에 대해
메타분석을 한 결과, 고용량 투여군과 저용량 투여군
모두에서 모두 통계적으로 유의미했으며(각각 95% CI0 88, -0 13/ -0 76, -0 01) 배정된대로 분석(intentionto-treat analysis, ITT analysis)에서보다 더 나은 효과를 보였다(그림36)
(Meta-analysis of Difference in CDR-SB versus Placebo) (
Aducanumab for Alzheimer’s Disease: Effectiveness and Value, ICER 2021)
(Meta-analysis of Difference in CDR-SB versus Placebo in Post-PV4 Population)

(출처: Aducanumab for Alzheimer’s Disease: Effectiveness and Value, ICER 2021)
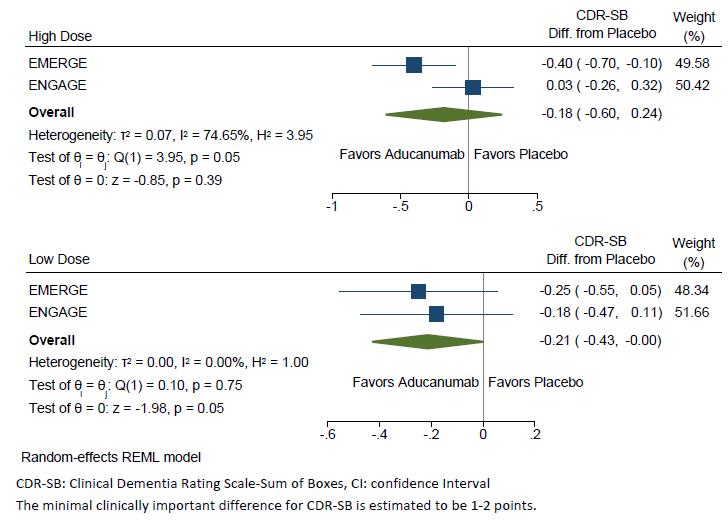
배정된대로 집단(intend-to-treat population)은 1번
이상의 투여를 받은 모든 무작위 피험자이며, PV4에서는
고용량 투여군의 ApoE ε4 보인자의 투여량이
6mg/kg에서 10mg/kg로 수정되었다 즉, PV4 이후의
집단(post-PV4 population)은 배정된대로 집단보다
aducanumab을 고용량, 그리고 장기적으로 투여받은
사람이 더 많기 때문에 배정된대로 집단보다 더 나은
효과를 보인 것이라 생각된다
2) PET composite SUVR 다음으로 유효성을 확인하는 또 다른 방법으로
바이오마커인 PET composite SUVR 변화를 살펴보았다 (그림37) 뇌의 아밀로이드 변화를 PET composite SUVR로 측정한 결과, Study 301과 Study
302 모두에서 aducanumab 투여 시 시간과 용량에
비례하여 SUVR의 평균변화량이 감소하는 시간 의존적, 용량 의존적인 결과가 나타났다 용량 적정 (dose titration)으로 인해 치료군 전체에서 용량이 비슷한
26주차에서 두 임상시험의 저용량 투여군과 고용량
투여군 모두 비슷한 결과를 보였으며, 78주차에서는
아밀로이드 플라크의 감소가 더 명확히 나타났다
FDA Aducanumab Medical Review 의 ‘ Safety review’에서는 Study 103, Study 301, Study 302에
대해 적어도 한번 aducanumab을 투여받은 무작위
배정된 모든 환자들을 안전성 집단 (safety population)으로 하여 위약대조군(placebo-controlled, PC)기간과 장기 연장 연구(long-term extension, LTE)
기간으로 나누어 분석했다 여기서 LTE 기간은 PC기간
이후의 추적 시험으로 장기간 동안 안전성, 유효성, 내약성을 평가한다 중등도 , 중증의 치매 환자는
임상시험에서 제외되었기 때문에 이 환자군에서의 안전성
결과는 알 수 없다
안전성 집단과 이상반응(adverse event)의 분류 및
정의는 다음 페이지에 나타내었다(표36, 표37) 안전성
집단의 인구학적 특징을 살펴보면, 나이는 임상시험 참여
환자의 평균 나이보다 실제 알츠하이머병 환자의 평균
나이가 더 많았다 Aducanumab 10mg/kg 투여군은
위약군과 특징이 유사했으며 아프리카 계 미국인과
히스패닉의 경우 비교적 임상시험에 적게 참여한 것을
확인할 수 있다
그림37. Study 301, Study 302에서 Aβ PET Composite SUVR의 기준값으로부터의 변화
(출처: Aducanumab for Alzheimer’s Disease: Effectiveness and Value, ICER 2021)
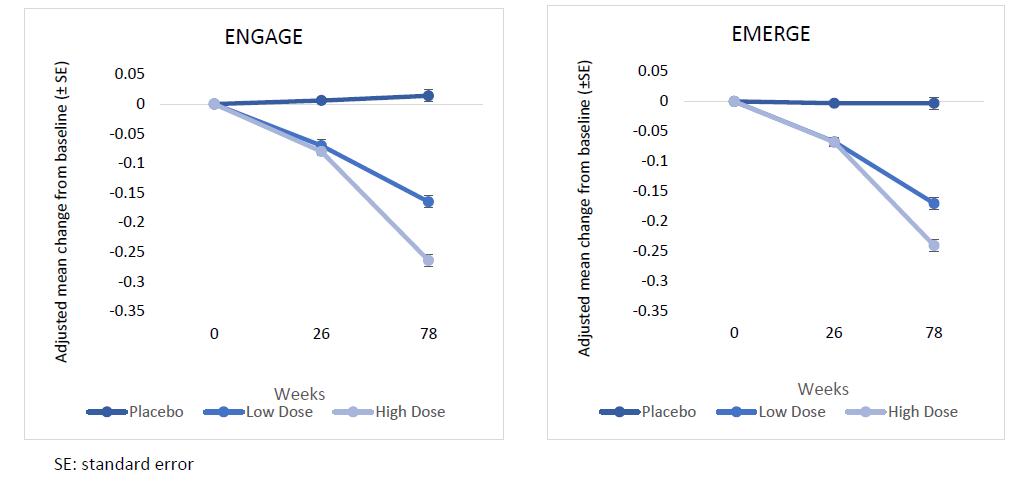
Study
Dose (Safety Population)
Placebo Aducanumab-Treated Group
301 540
ADU 3mg/kg: 391
ADU 6mg/kg: 158
ADU 10mg/kg: 558
ADU 3mg/kg: 369
안전성 분석 결과, ‘사망’의 경우 aducanumab 투여군과
위약군 간의 유의미한 사망률 차이는 보이지 않았으며 이
결과로 aducanumab과 환자의 사망과의 연관성을
확정지을 수는 없다고 보고 있다(표38)
302 547
Pooled Studies
301&302
ADU: aducanumab
ADU 6mg/kg: 175
ADU 10mg/kg: 547
ADU 3mg/kg: 760
1087
ADU 6mg/kg: 333
ADU 10mg/kg: 1105
(Placebo-controlled period, phase 3 studies)
(출처: FDA Aducanumab Medical Review)
AE (Adverse Event)
• 치료와 반드시 인과 관계가 있는 것은
아닌 의약품을 투여받은 환자 또는 임상
조사 대상에서 발생한 모든 부당한 의료
사고
• 복용량에 관계없이 사망에 이르게 한
표38. Study 103, 301, 302의 Placebo-Controlled Periods에서의 사망 발생률
(출처: FDA Aducanumab Medical Review)
다음으로 복용량에 관계없이 피험자를 즉각적인 사망
위험에 처하게 한 모든 의료사고인 중대한
이상반응(serious adverse event, SAE)에 대한 결과를
살펴보자 Aducanumab 투여군과 위약군을 비교했을 때
Study 103을 제외하고 전체적인 중대한 이상반응
발생률의 유의미한 차이는 보이지 않았다(표39)
SAE (Serious Adverse Event)
의료사고
• 피험자를 즉각적인 사망 위험에 처하게
한 모든 의료사고
TEAE (Treatment Emergent Adverse Event)
• 치료 중 또는 치료 후의 발병/악화 표37 이상반응의 분류 및 정의 (출처: FDA Aducanumab Medical Review)
ADU: aducanumab
(0.5)
표39. Pooled study(301&302)에서 가장 많이 보고된 SAE (출처: FDA Aducanumab Medical Review)
Aducanumab 투여 환자군에서 이상반응 (adverse effect, AE)으로 인해 치료 중단이 된 비율은 Pooled study(Study 301, 302)에서 9%이다 치료 중단의 원인이 된 유해효과로는 아밀로이드 연관 영상이상미세출혈 (ARIA-microhemorrhages), 혈철소 침착 (hemosiderin in deposits), 표재철침착증(superficial siderosis) 순으로 그 빈도수가
높았고 , 치료유발 이상반응 (treatment emergent adverse event, TEAE)은 표재철침착증, 아밀로이드 연관
영상이상 - 미세출혈 , ARIA-E) 순으로 그 빈도수가
높았다(표40)
TEAE; treatment emergent adverse event , ADU; aducanumab, ARIA;
표40. Placebo-Controlled Period 동안 ADU 10mg/kg
투여군과 Placebo군의 TEAE별 발생률 비교 (출처: FDA Aducanumab Medical Review)
TEAE는 임상시험 시작 이후에 부작용을 갖게 되거나 그
증상이 악화되는 경우를 의미한다 전반적으로 대부분의
TEAE 는 경증 또는 중등도 였으며 15%가 중증에
해당했다 AE 의 중등도는 경증, 중등증, 중증으로
정의되며 그 중 중증의 기준은 심한 불쾌감을 일으키는
경우, 일상 생활이 불가능하거나 일상에 중대한 영향을
일으키는 경우, 그 중증도가 임상시험 참여의 중단을
유발하는 경우, 증상에 대한 치료가 제공되거나 입원하는
경우 등을 의미한다(표41)
중증의 TEAE를 경험하는 사람의 발생률은 위약군에 비해
aducanumab 10mg/kg 군이 더 높았다(표42) Study
301과 302의 통합연구(pooled study)의 PC, LTE 기간
모두에서 10mg/kg aducanumab을 처리한 군의 경우
ARIA-E, ARIA-H, 표재철침착증이 가장 빈번한 중증의
TEAE이다 또한 통합연구의 PC 기간에 보고된 TEAE는 ARIA-E, 두통 , 표재철침착증 , 낙상 순으로 빈도가
높았다 ( 표 43) 낙상은 고관절 골절의 위험인자로 , 알츠하이머병에서의 고관절 골절은 사망률 증가와
관련있다 또 , 통합연구의 PC와 LTE 기간을 종합하여 aducanumab 10mg/kg 투여군과 이보다 적은 용량의
군을 비교했을 때 적어도 하나의 TEAE를 경험하는
발생률은 비슷했다
이상반응 증증도 정의 경증 (Mild)
• 피험자에게 뚜렷하지 않거나 피험자를 불편하게 하지 않는 증상
• 어떠한 수행이나 기능에 영향을 미치지 않는 증상
• 피험자를 불편하게 만들 정도로 심각한 증상
• 일상 활동의 수행에 영향을 미치는 증상
• 일반적으로 증상완화를 위해 약 처방이 필요하지 않으나 피험자의 성격에 따라 처방될 수 있는 증상 중등증 (Moderate)
• 피험자가 시험을 중단할 수 있는 증상
• 증상에 대한 치료가 필요할 수 있는 증상 중증 (Severe)
• 심한 불쾌감을 일으키는 증상
• 피험자의 일상생활을 무력화시키거나 중대한 영향을 미치는 증상
• 증증도가 임상시험의 치료 중단을 일으킬 수 있음
• 증상 치료 또는/그리고 피험자의 입원이 가능함
표41 이상반응 중증도의 정의 (출처: FDA Aducanumab Medical Review)
표42. Pooled study(Study 301+302) PC 기간에서 가장
Ⅲ-ⅱ. Study 301 vs. 302 :
연구 설계, 하지만 다른 결과?
Aducanumab의 임상 3상인 Study 301(ENGAGE)과
302(EMERGE)는 동일한 연구 설계로 진행되었음에도
불구하고, 1차 유효성 평가변수인 CDR-SB로 그 효능을
측정한 결과 study 301은 부정적인 결과를, Study 302는
긍정적인 결과를 나타낸 것을 볼 수 있었다(표44)
Study 301은 고용량 투여군, 저용량 투여군에서 모두
통계적으로 무의미한 차이가 관찰되어 (p>0 05)
치료효과를 관찰할 수 없었고, Study 302는 고용량
투여군에서 통계적으로 유의미한 차이가
관찰되었다(표44) 즉, study 301은 aducanumab의
효능에 대해 부정적인 결과를, 302는 상대적으로
긍정적인 결과를 나타낸 것이다 이처럼 거의 동일하게
진행된 두 study의 결과가 다르게 나타난 것에
표43. Pooled study(Study 301+302) PC 기간에서 가장
Study 301, 302의 결과 차이에 대한 첫번째 가설은
‘용량 가설’로, Study 301의 참여자가 충분한 투여 용량을
투여 받지 못해 더 부정적인 결과가 나온 것이라는
가설이다 임상시험 과정 중, 몇번의 프로토콜 수정이
있었는데, 그 중 PV4(Protocol Version 4)에 대한 수정의
도입 시점이 302에서 한달 먼저 도입되었다 따라서
충분한 투여 용량인 10mg/kg의 권고된 14번의 전체

용량을 투여 받은 환자의 비율이 302에서는 28 8%, 301에서는 22 3%로 302에서가 더 높았다
용량 가설은 이렇게 301에서 프로토콜 수정이 늦게
도입되어 충분한 투여 용량을 투여 받은 환자 수가 더 적어
더 부정적인 결과가 나왔다는 가설이다 이러한 가설을
검증하기 위해 다음과 같은 분석이 진행되었다
1) 용량 가설을 검증하기 위한 분석: 사후 분석(post-hoc analysis)
바이오젠은 이러한 가설을 확인하기 위해 이에 대한
사후 분석을 진행하였다 사후 분석은 용량 가설을
증명하기 위한 분석을 뜻하며, 각 임상 시험에서의
투여용량을 똑같이 맞추어 분석함으로써 투여용량의
차이에 의한 영향을 배제한 것이다 여기서 투여용량을
똑같이 맞추는 것은 성향 점수 매칭(propensity score matching) 방식으로 진행되었다 이는 구체적으로 각
연구 대상이 갖고 있는 성향을 점수화한 성향 점수를
이용하여 301과 302의 점수, 즉 여기서는 투여 용량이
비슷한 대상을 매칭하여 두 군 간의 불균형을 맞추는
방식이다 용량 가설이 맞다면, 성향 점수 매칭을 통해 두 study 에서 투여된 용량을 비슷하게 맞췄을 때 CDR-SB
값이 두 study 에서 동일해야 한다 이러한 가설을
바탕으로 사후 분석을 진행했으며, 임상시험 참여자들을
각각 총 누적 투여 용량에 따라, 그리고 투여 횟수에 따라
계층화하여 분석을 진행하였다
먼저, 총 누적 투여 용량에 따라 환자들을 계층화하여
분석하였다 총 투여 받은 약의 용량이 100mg/kg
미만일때, 100-150mg/kg일 때, 그리고 150mg/kg
이상일 때로 나눠서 분석이 진행되었다(그림38) 총 누적
투여 용량이 150mg/kg 이상일 때는 301과 302에서
비교적 비슷한 CDR-SB 값이 나타난 것을 볼 수 있지만,
그 외의 투여용량에서는 약의 유효성을 나타내는 지표인
CDR-SB값이 두 study에서 확연히 차이남을 볼 수 있다
그림38 총 누적 투여 용량에 따른 post-hoc analysis (출처: Aducanumab for Alzheimer’s Disease: Effectiveness and Value, ICER 2021)
특히, 100-150mg/kg 투여군에서는 결과의 경향성마저
다른 것을 그래프에서 볼 수 있다 구체적으로, 총 누적
투여용량이 100-150mg/kg인 군에서, Study 301에서는
aducanumab 투여시에 위약군에서보다 CDR-SB 값이
커 부정적인 결과가 나왔지만 , Study 302 에서는 aducanumab 투여시에 위약군에서보다 CDR-SB값이
작아 긍정적인 결과가 나온 것을 볼 수 있다 용량
가설에서 주장하는 바와 같이 Study 301과 302에서 결과
차이가 투여용량의 차이에서 기인한 것이라면 용량을
똑같이 맞추고 분석을 진행했을 때에는 모든 군에서
301과 302에서 비슷한 결과가 나와야 하는데, 그렇지
않은 결과가 나온 것을 확인할 수 있다
다음으로, 10mg/kg를 투여 받은 횟수에 따라 환자들을
계층화하여 사후 분석하였다(그림39) 그래프에서 볼 수
있는 것처럼, 10mg/kg를 투여 받은 횟수가 0-5회일 때, 6-12 회일 때 , 13 회 이상일 때로 나눠서 분석을
진행하였는데, 13회 이상일 때를 제외하면 Study 301과
302에서 상반된 CDR-SB 결과가 나타남을 볼 수 있다
정리하면, 두 사후 분석 결과 모두에서 투여용량을 같이
맞추어 301과 302를 비교해도 결과의 경향성이 다르게
나오므로 , 이를 바탕으로 301에서 충분한 용량을
투여받지 못하여 부정적인 결과가 나왔다는 용량 가설은
근거가 충분하지 않다는 것으로 결론지을 수 있다
2) 용량 가설의 검증을 위한 추가 분석
용량 가설에 대한 추가적인 분석 또한 진행되었는데, 이는 PV4 이후 집단과 배정된대로 집단에서의 CDR-SB를
비교한 분석이다 PV4는 Study 103의 결과를 바탕으로
고용량 투여군 중 ApoE ε4 보인자의 약물 투여량을
6mg/kg에서 10mg/kg으로 증량한 것이다 즉, PV4로
투여 용량이 증가한 군은 APOE ε4 보인자군 뿐이다 용량
가설은 충분한 투여 용량을 받은 환자수가 많을수록 약의
효능이 높게 측정된다는 가설이기에, 가설이 맞다면
APOE ε4 보인자군에서만 PV4 이후 CDR-SB 점수가
감소해야 한다 하지만 결과에서는 301 에서
보인자군에서는 차이가 없었고 오히려 위약군에서는
CDR-SB 가 PV4 이후에 감소했으며 , 302 에서는
보인자군에서 오히려 PV4 이후에 CDR-SB 가
증가했다(표45) 이처럼 추가적인 분석에서도 용량
가설을 기각할 수 있는 근거들이 등장하며 프로토콜의
수정 시점 차이가 두 study의 결과 차이를 불러일으켰다는
가설은 기각되었다
APOE ε4 carrier group Placebo group
301 차이 X Post PV4에서 CDR-SB 감소
302 Post PV4에서 CDR-SB 증가 Post PV4에서 CDR-SB 감소
표45 pre-PV4 에서의 CDR-SB 결과
(출처: Aducanumab for Alzheimer’s Disease: Effectiveness and Value, ICER 2021)
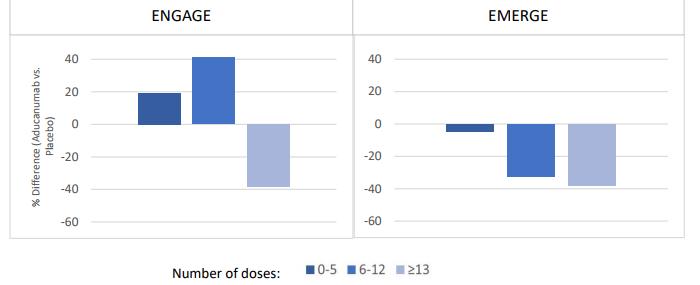
2 ARIA 부작용 관련 눈가림해제[22]
가설 중 하나는 바로 ARIA 부작용 관련 눈가림해제(unblinding)이다 ARIA는 aducanumab의
가장 흔한 부작용 중 하나이다 임상시험에서는 투여군과
위약군이 자신이 어떤 군에 속해있는지 모르는
‘눈가림(blinding)’이 되어야 하는데, ARIA가 부작용으로
발생하게 되면 환자는 자신이 aducanumab 투여군임을
인지할 수 있게 되어 눈가림해제가 발생하게 되고, 이는
편향된 결과를 초래할 수 있다 이러한 ARIA 관련
눈가림해제로 두 study간의 결과 차이가 초래되었다는
가설도 제시되었지만, ARIA 발생률은 301과 302에서
거의 비슷하고, ARIA 발생 후 결과를 배제한 분석도 초기
분석결과와 거의 동일한 경향성을 띄기 때문에 이러한
가설 또한 301과 302간의 결과 차이와 큰 연관성이
없다는 결론을 내릴 수 있다(표46)
참가자들을 뜻하며, 고용량 투여군에서 그 수가 다른
투여군에서보다 많다 301에서 더 부정적인 결과가 나온
것이 rapid progressor의 존재 때문이라는 가설 하에, 이를 증명하기 위해 rapid progressor를 제거하고 Study
301에서의 결과를 분석해보았다 이 결과, CDR-SB
점수를 위약군과 비교한 수치가 확연히 감소하였음을
4 국가 이슈 배정된대로 분석(ITT analysis) 자료에 따른 인구학적
변수를 살펴보면 미국, 벨기에, 캐나다, 프랑스, 일본 등 13개국, 181개의 연구기관에서 참여자를 모집하였고
그중 39 8%는 미국이었으며 남성 : 여성의 비율은 795 :
843이었다 이때, Study 301과 Study 302의 결과에서

차이가 나타나는 이유로 등록국가의 비율 차이를
생각해볼 수 있다 일본, 독일은 PV4 전후로 참여자 수가
증가하여 일본의 경우 2%에서 12%로 증가했지만, 폴란드의 경우 PV4 전후로 19%에서 4%로 참여자
비율이 감소했다(그림40) 또한, 등록비율 뿐만 아니라 국가 간에 aducanumab 치료 효과에 있어서 통계적으로
유의미한 차이가 존재하기 때문에 결과 분석에서
일관성이 부족하다는 결론을 내릴 수 있다
표46. Study 301, 302에서의 CDR-SB 결괏값 (출처: Aducanumab for Alzheimer’s Disease: Effectiveness and Value, ICER 2021)
3 Rapid progressors[22]
용량 가설외에도 여러가지 요인들이 Study 301과 302의
결과차이를 유발했다고 제시되었는데, 그 중 하나가 rapid progressor의 존재이다 Rapid progressor는 78주 동안 CDR-SB가 8점 가량 증가하여 빠르게 증세가 악화된
두 번째로 매개변수를 어떻게 같은 그룹으로 묶는지가
결과 차이에 큰 영향을 미쳤을 것으로 생각된다 예를 들면, 인종에서 아프리카계
또한, 13숲 그림(forest plot)에서 국가별로 CDR-SB의

영향이 다른 것을 알 수 있다(그림41) 미국 이외의
국가의 참여자들은 ‘유럽/캐나다’와 ‘아시아’ 두 그룹으로만
구분되었는데, 아래 숲 그림을 보면 캐나다와 유럽으로
분류된 국가 간에도 CDR-SB 변화량에서 상당한 가변성을
보이기 때문에 임상 결과를 분석하는 데 있어서 이들을
같은 그룹으로 묶는 게 적절했는지 의문을 제기할 수 있다
PV4를 기점으로 한 APOE+ 고용량 투여군에서 최대
용량의 변화(6mg/kg → 10mg/kg) 효과는 서로 다른
인구 분포에 영향을 받았을 수 있다 국가 및 인구 분포는
분명 결과에 영향을 줄 수 있는 요인으로, PV4 전후의
인구 통계에서 생기는 변화는 임상에서의 결과 변화가
용량 변화에서 기인한 것이라는 명확한 결론을 내릴 수
없게 한다
5 초기 질병 특성(Baseline disease characteristic)에
Study 301과 302의 ITT군 기준, 임상시험 참가자 중
MCI, 전단계 AD 환자, 그리고 경증 AD 환자의 비율은 두 study에서 거의 비슷하게 나타났다(표47) 따라서 Study
301과 302의 결과 차이가 임상 대상자의 기존 AD 진행 정도나 병용 약물에 의한 것으로 보기는 어렵다 다만, 연구 진행 시점에 따라 임상 대상자의 초기 질병의 구성에
차이가 발생한 점을 각 Study 결과 분석에서 무시할 수
없다 Study 302의 연구 시기 별 초기 질병의 임상적
그림41. 78주에서 국가별 및 다른 하위그룹에서 CDR-SB
변화를 나타낸 숲 그림(forest plot)
(출처: FDA Aducanumab Statistical Review)
Study 301과 302에 참여한 국가들과 그 비율의 차이에
따른 문제도 존재한다 Study 301과 302 중 한쪽에만
등록된 국가들도 존재한다(표48) 오스트레일리아를
포함한 6개 국가는 Study 301, 벨기에를 포함한 6개
국가는 Study 302에만 등록되었다 또한, Study 301과
302 모두에 참여한 국가에서도 해당 국가 인구의 비율이
두 임상시험에서 다르게 나타나기에 이에 의한 영향도
무시할 수 없다 미국의 경우 Study 301에서는 전체의
46 4%, Study 302에서는 39 6%에 해당하였다 이러한
차이는 Study 301과 302의 비교 및 결과 분석에 혼란을
주는 요인이었다
임상 대상자 국가 분포의 차이는 PV4 이전 그룹과 PV4
이후 그룹에서도 확인할 수 있었다 PV4 이후 임상
단계를 나타내면 다음 페이지의 그림과 같다(그림42)
시기별 임상 대상자의 초기 질병의 임상적 단계가
균일하지 않음에 따라 PV4 이전 구성원과 PV4 이후
구성원의 초기 알츠하이머병 중증도에 차이가 나타났다

그림42 Study 302 진행 시기에 따른 초기 질병 단계에서의 무작위 배정의 확률, 경증 알츠하이머병(1) vs. 전단계(0) (출처: FDA statistical review)
병용 약물 복용 대상자의 비율도 PV4 시행을 전후로
차이가 있었다 Study 301과 302에서 병용 약물 복용
대상자의 비율은 PV4 이전에 비해 PV4 이후에서 더
늘어났음을 알 수 있다(표49)
이에 따라 PV4 이전과 PV4 이후 하위군 및 전체 위약군
간의 비교 등을 진행할 경우 환자의 초기 상태 차이가
결과에 영향을 줄 가능성이 존재한다
따라서 시기별로 aducanumab 의 효과가 다르게
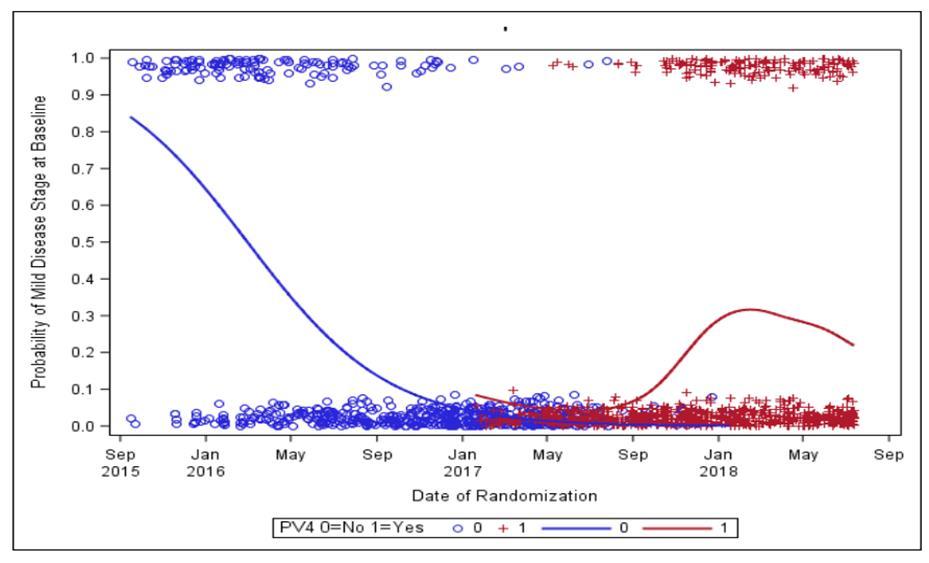
나타났을 때, 그 차이가 PV4 시행 때문인지 병용 약물
복용자의 비율이 증가해서인지 알 수 없다 즉, 이러한
차이들이 PV4의 영향을 분석하기 어렵게 만드는 교란
요인으로 작용하게 된다
표49 임상시험 시작 시기에서 투여군 별 병용약물 사용 비율 (출처: FDA Aducanumab Statistical Review)
1 프로토콜 수정과 관련된 논란
바이오젠에서 진행한 aducanumab의 임상 시험이
진행되는 도중에 프로토콜에 몇 차례 변경이 있었다 그중
Protocol amendment version 4(PV4)의 경우 용량과
관련된 중요한 변경 사항으로 , ApoE 보인자에서
고용량을 6mg/kg에서 10mg/kg으로 증가시켰고 이는
결과에 영향을 미쳤을 가능성이 있다 특히 Study
302에서는 PV4 이전의 ARIA 부작용 발생률이 ApoE
비보인자 대비 ApoE 보인자에서 1 4배 높았지만, PV4
이후에는 2 3 배 높았다 따라서 , PV4 이후에
용량관리 (dose managing) 로 인한 눈가림
해제(unblinding)가 더 많이 일어났을 가능성이 있으며, ApoE 보인자 하위군에서 ARIA 부작용이 처음
발생하기까지 걸린 시간이 PV4 이후에 더 짧아지는 등의
영향도 있었다 더욱이 임상 시험 도중 변경된 프로토콜의
적용 시점이 지역별로 다르므로 효과를 분명히 알기가
어렵다
Aducanumab 임상시험에서는 Study 103의 결과로
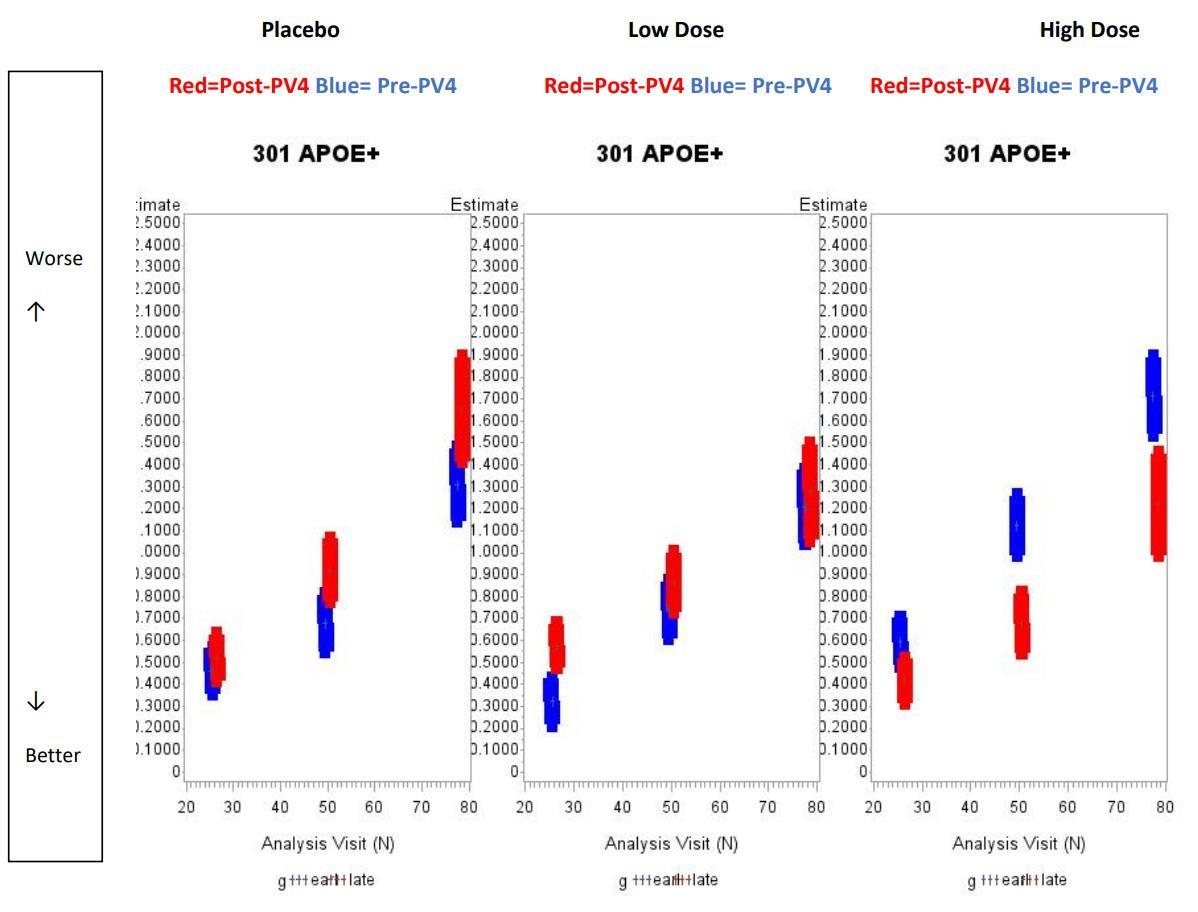
3 상 임상시험이 진행되는 도중 프로토콜 변경이
이루어졌다 만약 1상, 2상 임상시험이 완전히 끝난 후에
그 결과를 반영하여 3 상 임상시험을 처음부터
진행했더라면 프로토콜의 변경을 줄여 더 정확한 결과를
얻는 것이 가능했을 것으로 생각된다
Study 301에서 ApoE 보인자인 환자들을 위약군, 저용량군 , 고용량군에서의 CDR-SB 변화를
분석하였다 ( 그림 43) 고용량군의 최대 투여량을
6mg/kg에서 10mg/kg으로 증가시킨 PV4를 기준으로
하여 전(PV4 이전, 파란색)과 후(PV4 이후, 붉은색)의
78주 차 CDR-SB 결과를 각 용량군에 대하여 표시하였다
고용량군에서 PV4 이전에서 PV4 이후보다 좋은 결과를
얻을 수 있었으며(그림43 오른쪽), 위약군은 PV4 이후의
78주 차 결과가 악화되었다(그림43 왼쪽)
그림43. Study 301에서 ApoE 보인자에서의 위약군, 저용량 투여군, 고용량 투여군의 PV4이전 및 PV4 이후의 CDR-SB 결괏값 (출처: FDA Aducanumab Statistical Review)
위약군의 PV4이전과 PV4 이후의 결과가 일치하지
않는다는 점과 앞서 다룬 PV4 전후 결과 분석에 영향을
주는 요인들에 관한 고찰을 통해 보면 위 자료만을 토대로
최대 투여량 증가의 효과를 단정지을 수 없다 그럼에도
고용량군의 결과만을 놓고 본다면 최대 투여량을
증가시킨 PV4 이후에서 개선된 효과가 나타난 것으로
해석할 여지가 있다
다만, 위 결과 비교를 통해 PV4 이후 위약군에서의
악화가 최종 CDR-SB 결과를 해석할 때 실제보다
aducanumab이 더 효과가 있는 것으로 비춰질 수 있음을
확인하고 이 사항에 유의하며 Study 301 분석을
진행하였다
아래 그림에서 study 302의 PV4 이전과 이후의 CDR-SB
값의 변화를 위약군, 저용량군, 고용량군에서 각각
나타내었다(그림44) PV4 전후로 변화한 것은 ApoE
보인자에서 고용량군의 용량을 최대 6mg/kg 에서
10mg/kg으로 바꾼 것이었지만, 다른 용량에서도 PV4
이후 CDR-SB 값에 변화가 나타나는 것을 확인할 수
있었다(그림44)
Study 302의 ApoE 유전자 보인자(ApoE+) 집단에서의
임상 시험 결과에서 CDR-SB 의 변화를 PV4
이전 ( 파란색 ) 과 PV4 이후 ( 붉은색 ) 로 나누어
비교해보았다
먼저 Study 302의 위약군에서 PV4 이전에 비해 PV4
이후에서 CDR-SB의 평균값이 크게 증가하여 PV4 이후에
오히려 결과가 나빠진 것을 볼 수 있다(그림44 왼쪽)
고용량군에서도 PV4 이후에 CDR-SB 평균값이
증가하였다(그림44 오른쪽) 반면에 PV4 수정으로 인한
aducanumab 용량의 변화가 없었던 저용량군에서는

오히려 결과가 약간 좋아졌다(그림44 중간) PV4 이후에
저용량군에서 고용량군보다 수치적으로 더 좋은 결과가
나타나는 것은 PV4 이후에 나타나는 변화는 PV4 이후
고용량군에서만 용량을 증가시켰다는 사실로부터 기대할
수 있는 경향과는 반대된다
그림44. Study 302에서 ApoE 보인자에서의 위약군, 저용량 투여군, 고용량 투여군의 PV4이전 및 PV4 이후의 CDR-SB 결괏값 (출처: FDA Aducanumab Statistical Review)
2 Study 103과 302의 다른 경향성
Study 103과 임상 3상 시험 중 긍정적인 결과를 나타낸
Study 302에서 ApoE ε4 보인자 여부에 따른 경향성이
다르게 나타났다 Study 103 에서는 aducanumab
10mg/kg 효과가 ApoE ε4 비보인자에서 더 크게
나타났었지만 , 이러한 경향성이 Study 302 에서는
재현되지 않았다
Aducanumab 10mg/kg 투여군과 통합 위약군(pooled placebo)의 CDR-SB 변화를 비교한 결과에서 Study 302 에서는 ApoE ε4 보인자군에서의 효과가
비보인자군에서의 효과보다 크게 나타났다(표50)
Study 302에서 동일한 용량 투여군의 동일한 평가
변수(endpoint)에 대해서는 ApoE ε4 보인자가 ApoE ε4
비보인자에 비해 더 좋은 효과가 나타났다(그림45)
한편 Study 103은 14staggered arm design에 의해서
디자인되었는데, 10mg/kg의 위약군을 포함한 모든
위약군들이 동시에 배정되지 않았다 따라서 , 바이오젠의 Study 103의 결과에 대한 분석이 전체적인
무작위 배정 (randomization)에 의해서 뒷받침되지
표50. 54주차에 10mg/kg과 통합 위약군의 APOE ε4
보인자군과 APOE ε4 비보인자군의 CDR-SB 차이
(출처: FDA Statistical review)

그림45. Study 302의 주요 Endpoints인 ADCS-ADL-MCI, ADAS-Cog 13, MMSE, CDR-SB에 대한 치료효과를
ApoE 유전자에 따라 분석한 숲 그림(forest plot) (출처: FDA Aducanumab Statistical Review)
[1] Krudys, K. (2021). BLA 761178 clinical review: aducanumab in Alzheimer's. 2020.
[2] 한국과학기술기획평가원. (2019). 알츠하이머 진단 치료 기술
[3] Strimbu, K., & Tavel, J. A. (2010). What are biomarkers?. Current Opinion in HIV and AIDS, 5(6), 463.
[4] Duara, R., Loewenstein, D. A., Greig‐Custo, M. T., Raj, A., Barker, W., Potter, E., ... & Potter, H. (2010). Diagnosis and staging of mild cognitive impairment, using a modification of the clinical dementia rating scale: the mCDR. International Journal of Geriatric Psychiatry: A journal of the psychiatry of late life and allied sciences, 25(3), 282-289.
[5] Carotenuto, A., Rea, R., Traini, E., Ricci, G., Fasanaro, A. M., & Amenta, F. (2018). Cognitive assessment of patients with Alzheimer's disease by telemedicine: pilot study. JMIR mental health, 5(2), e8097.
[6] Kahle-Wrobleski, K., Coley, N., Lepage, B., Cantet, C., Vellas, B., & Andrieu, S. (2014). Understanding the complexities of functional ability in Alzheimer’s disease: more than just basic and instrumental factors. Current Alzheimer Research, 11(4), 357-366.
[7] Connor, D. J., Sabbagh, M. N., & Cummings, J. L. (2008). Comment on administration and scoring of the Neuropsychiatric Inventory in clinical trials. Alzheimer's & Dementia, 4(6), 390394.
[8] 식품의약품안전처. (2016). 의약품 임상시험 통계 가이드라인
[9] Khammar, A., Yarahmadi, M., & Madadizadeh, F. (2020). What Is Analysis of Covariance (ANCOVA) and How to Correctly Report Its Results in Medical Research?. Iranian journal of public health, 49(5), 1016–1017.
[10] 신혜원, 이준영, & 안형진. (2011). 대응 짝 비열등성 임상시험에서 모의실험을 통한 ITT 군과 PP 군의 비교 보건정보통계학회지, 36(2), 217-228.
[11] Siddiqui, O., Hung, H. M., & O'Neill, R. (2009). MMRM vs. LOCF: a comprehensive comparison based on simulation study and 25 NDA datasets. Journal of biopharmaceutical statistics, 19(2), 227–246.
[12] 김윤선. (2010). 임상시험 결측 자료 분석법 비교
[13] Schuler A. (2022). Mixed Models for Repeated Measures Should Include Time-by-Covariate Interactions to Assure Power Gains and Robustness Against Dropout Bias Relative to CompleteCase ANCOVA. Therapeutic innovation & regulatory science, 56(1), 145–154.
[14] Massie, T. (2021). BLA 761178 statistical review: aducanumab in Alzheimer's. 2020.
[15] 오응석, & 이애영. (2016). 경도인지장애 대한신경과학회지, 34(3), 167-175.
[16] Arndt, J. W., Qian, F., Smith, B. A., Quan, C., Kilambi, K. P., Bush, M. W., ... & Weinreb, P. H. (2018). Structural and kinetic basis for the selectivity of aducanumab for aggregated forms of amyloid-β. Scientific reports, 8(1), 1-16.
[17] 식약처. (2015). 임상시험의 통계 원칙
[18] Landau, S. M., Fero, A., Baker, S. L., Koeppe, R., Mintun, M., Chen, K., ... & Jagust, W. J. (2015). Measurement of longitudinal β-amyloid change with 18F-florbetapir PET and standardized uptake value ratios. Journal of Nuclear Medicine, 56(4), 567-574.
[19] https://terms.naver.com/entry.naver?docId=931358&cid=43667&categoryId=43667
[20] 식품의약품안전처. (2019). 체외진단용 의료기기의 임상적 성능시험(통계) 민원인 안내서
[21] 식품의약품안전청. (2009). 임상시험에 있어 다중성에 대하여 고려할 점
[22] Haeberlein, S. B., Von Hehn, C., Tian, Y., Chalkias, S., Muralidharan, K. K., Chen, T., ... & Nisenbaum, L. (2019). EMERGE and ENGAGE topline results: two phase 3 studies to evaluate aducanumab in patients with early Alzheimer’s disease. San Diego: 12th Clinical Trials on Alzheimer's Disease, 1-25.
[23] Lin, G. A., Whittington, M. D., Synnott, P. G., McKenna, A., Campbell, J., Pearson, S. D., & Rind, D. M. (2021). Aducanumab for Alzheimer’s disease: effectiveness and value; final evidence report and meeting summary. Institute for Clinical and Economic Review.
앞서 살펴본 것처럼, aducanumab(aduhelm®)은 임상 3상 시험인 Study 301과 302에서 그 유효성과 안전성에
대한 데이터가 확실히 입증되지 못하였다 이에 따라, 현재 추가적인 임상 3상 시험인 Study 304(EMBARK)와
임상 4상 시험인 ENVISION이 진행중이다 본 파트에서는 각 임상시험이 어떠한 측면에서 임상 3상 시험의 한계를
극복할 수 있는지, 또 어떠한 목적으로 시행되었는지 등을 살펴보고자 한다
그리고, Study 304와 임상 4상 시험과 같은 추가적인 임상시험에서 긍정적인 결과가 나와 실제 시장에
시판된다고 해도, aducanumab이 실질적으로 알츠하이머병 환자들에게 도움이 되기 위해서는 그들에게 부담이
되지 않는 가격으로 제공되어야 한다 본 파트에서는 이러한 ‘환자 접근성(patient accessibility)’ 측면에서
aducanumab을 분석해보기 위해 현재 급여 현황과, 약물의 효과 대비 현재 약가가 얼마나 경제적인지를 고려하는
비용효과성 분석을 살펴보고자 한다
이렇게 본 파트에서는 aducanumab의 현재에 대해 알아봄으로써 본 약물이 비용효과적인 가격으로 환자들에게
제공되기 위해서는 보험 급여와 약가 측면에서 어떠한 개선이 필요한지에 대해 고찰해보자
Ⅰ. 허가 승인에 따른 확증임상시험과 Phase 4
앞선 내용처럼, 임상 3상의 결과는 aducanumab의
유효성과 안전성을 입증할 수 있는 확실한 데이터를
제공하지 못하였다 이에 따라 , 미국 식품의약품
안전청(Food and Drug Administration, FDA)는 임상

4상을 통해 약물의 유효성 및 안전성을 확실히 입증할
것을 전제로 약물에 대한 조건부 승인을 허가하였다 본 파트에서는 Study 301,302이 중단된 이후 이 두 임상시험의 결과를 보완하기 위해 시작되어 현재까지
진행 중인 임상 시험인 Study 304(EMBARK)와 임상 4상
시험 (ENVISION) 에 대해 간단히 살펴봄으로써 ,
aducanumab의 현 개발상황에 대해 알아보고자 한다 두
임상시험에 대한 정보는 바이오젠 발표 자료[1]와 미국
국립 보건원(National Institutes of Health, NIH)에서
운영하는 임상시험 등록사이트[2]를 활용하여 알아보았다
1 Study 304 : EMBARK
현재 진행되고 있는 임상 3 상 시험인 Study 304(EMBARK)는 Study 301(ENGAGE)과 Study 302(EMERGE)에서 발생한 논란을 중단시키기 위해 추가적으로 진행한 실험이다(그림1).
그림1. Aducanumab 임상 시험의 전체적인 timeline (출처: Castrillo-Viguera et al., 2021)
그럼, 이제부터 Study 304의 구체적인 내용에 대해
알아보자
Study 304의 피실험자는 다음과 같은 조건을 만족해야
한다 이들은 Study 301와 302에서 실험을 진행했었던
인원들 중에서도 피실험자들의 인지 능력 정보를
전달해주는 간병인 (care partner) 이 있어야 하며 , 알츠하이머병 이외의 질환(근래 1년간 뇌졸중이나
의식불명, 임상 이후의 발작 현상 등)이 없어야 한다
Study 304의 1차 유효성 평가 변수는 aducanumab을
10mg/kg 투여하였을 때 약물의 장기적 안정성과
내약성을 평가할 수 있는 파라미터들을 이용하였다
이러한 파라미터들은 구체적으로 amyloid-related imaging abnormalities(ARIA)와 같은 약물 부작용
발생률, 피실험자의 혈청 중 aducanumab에 대한 항체
생성 여부 등을 포함한다 탐색적 평가변수로는 인지, 신경정신적 상태 및 기능의 변화를 측정할 수 있는
파라미터들을 사용하여 aducanumab의 장기간의 효과를
평가하였다 이러한 탐색적 평가변수를 평가하는 도구로는 CDR-SB, MMSE, 1MOCA score, 2HEOR등이 사용되었으며, 앞에서 설명되지 않은 MOCA와 HEOR의 특징은 다음과 같다(표1) 바이오마커 평가변수로는 PET
또는 MRI와 같은 영상기술로 확인하거나, 체액 중의
바이오마커 농도를 관찰함으로써 aducanumab의 장기간 효과를 평가하였다 임상시험 프로토콜에 기술된 각 평가변수의 측정 진행시점은 다음과 같았다(그림2)
Aducanumab의 안전성에 대해서는 통계적 분석이
이루어졌는데, 여기서 분석 대상인 안전성 집단(safety population)은 Study 304에서 적어도 한 번 이상 약물을
투여받은 환자들이다 통계적 분석에서는 대표적
부작용인 ARIA 의 발생여부 , aducanumab 에 대한
환자의 면역원성을 확인하기 위한 항체 생성 여부 등을
분석한다 또한, 탐색적 효능의 측정은 Study 304에서
aducanumab의 투여군 대상이면서 PET 또는 CSF 중의
바이오마커 측정을 시행한 일부 환자를 대상으로 하며, 재투여한 연구 (Study 304) 와 그 선행연구 (Study 301&302)와의 아밀로이드 PET, CSF 바이오마커의 baseline 변화를 분석하여 진행되었다
본 임상시험의 결과는 aducanumab 의 안정성을


장기적인 관점에서 평가할 수 있고, 치료 효과의 지속성에
대한 이해를 향상시킬 수 있다 또한, 앞선 임상시험에서
투여를 진행하지 않았던 경증 알츠하이머병(mild AD)
이상의 단계에 있는 환자들에 대한 약물의 효과와, 바이오마커와 임상 시험 결과의 상관관계를 제시할 수
있을 것으로
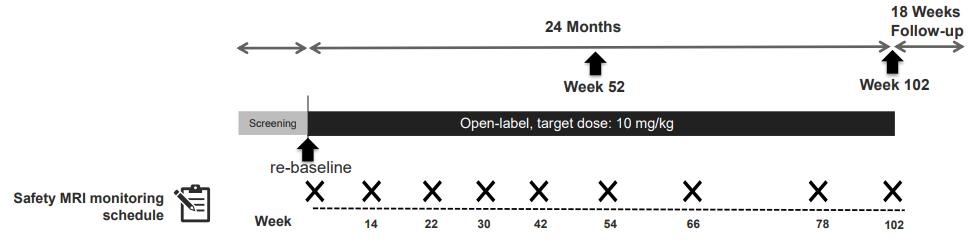

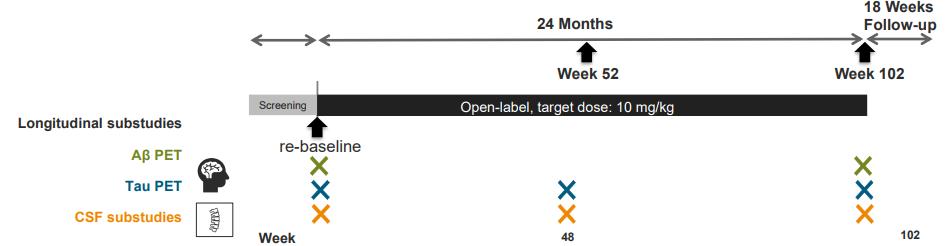
앞선 설명처럼 , FDA 는 2021 년 6 월에 가속

승인 (accelerated approval) 절차에 따라
aducanumab을 조건부 승인하고, 보다 확실한 약물의
임상적인 효과 검증을 위해 새로운 무작위 대조 임상
시험을 요구하였다 이에 따라 바이오젠은 2022년 3월에
임상 4상(ENVISION)에 대한 프로토콜을 발표하였고,
같은 해 5월에 이에 참여할 환자에 대한 스크리닝을
진행하였다
임상 3상까지는 중재 연구(interventional Study)로
많은 조건이 통제된 임상 시험인 반면, 임상 4상은 관찰
연구 (observational Study) 로 참가자에게 특정
치료군으로의 할당 없이 치료 내용을 미리 전달하고 진행
및 관찰하는 방식으로 진행하였다 피실험자들의 투여
용량 또한 10mg/kg으로 고정된 단일군 시험(single arm Study)로 디자인되었다 임상 3상 시험에서의 인구
분포를 분석했을 때 아프리카계 미국인 (africanamerican), 히스패닉/라틴계(hispanic/latino)의 비중이
전체에서 5%이하로 매우 낮아 대표성이 부족하다는
한계를 보였기 때문에, 이를 극복하기 위해 4상에서는
이들의 비율을 18% 이상 포함하겠다는 목표로 실험
대상을 모집하였다 본 임상 시험은 총 6000명의
피시험자가 참여하는 코호트 연구이며, 실질적인 연구
시작일은 2021년 11월 8일이고 예정된 연구 종료일은
2026년 10월 1일이다 피실험자는 AD를 진단 받은
환자이거나 연구와 관계없이 의사의 결정에 따라 AD에
대한 처방을 받은 적이 있는 환자여야 한다 앞선
3 상까지의 실험에 참여하고 있는 사람이거나
aducanumab을 이미 투여 받은 적이 있는 경우 본 임상
시험의 피실험자로 참여할 수 없다
임상 4상에서는 1차 유효성 평가변수의 측정에 사용되는
진단 방법이 이전 임상들보다 훨씬 다양하게 진행된다
2차 유효성 평가변수로는 참여자의 부작용 발생률 및
투여 대상에 대한 통계 분석을 진행하였다 본 임상시험은
약물이 실제 임상적 효과를 갖는지에 대한 연구이므로, 대리 평가변수에 대한 평가는 이루어지지 않았다
두 임상시험 모두 현재 진행 중이므로 그 결과에 따라 aducanumab의 허가 여부가 확실하게 결정될 것으로
보인다 Study 304는 장기간에 걸친 안전성 및 유효성을
측정 가능케 함으로써 기존 임상시험이 알츠하이머병의
진행 시간에 비해 훨씬 단기간에 걸쳐 진행되었다는
한계점을 어느정도 보완할 수 있을 것이다 또 4상은 많은
수의 환자들에서 실제 상황과 비슷하게 디자인되어
상대적으로 많은 조건이 제한되어 있던 앞선
임상시험들에서 확인할 수 없었던 유효성 및 안전성에
대한 정보를 제공할 것이다
최신 뉴스 업데이트
Aducanumab은 최근 이러한 추가적인 임상시험
시행에도 불구하고 바이오젠에서 약물에 대한 투자를
본격적으로 축소하고 있다 이는 EU에서의 허가 승인
거부와 , Centers for Medicare & Medicaid Services(CMS) 에서 aducanumab 에 대한
보험급여를 CMS가 승인한 임상시험 참여자로
제한하는 등의 부정적인 결과가 잇따르면서 내려진
결정으로 보인다
추가적으로, 바이오젠은 aducanumab에 대한
지원을 일부 철회하는 대신 유사 기전 약물인
lecanemab의 연구개발에 대한 투자를 가속화하고
있다 여러 문제와 제한점이 따르고 있는
aducanumab에 대한 경제적인 지원을 유사 기전
약물인 lecanemab에 투자하고 있는 것으로 보인다
Ⅱ. Aducanumab의 환자접근성
약물의 환자 접근성(patient accessibility)은 약물의
유효성과 안전성 못지않게 중요한 요인이다 아무리 좋은
효과를 지니고 안전한 약이라고 해도, 비급여 항목이거나,
그 자체로 환자가 지불하기에 지나치게 높은 가격이면
환자가 접근하기에 어려움을 느껴 실질적인 도움이 되지
못하기 때문이다 실제로 현재 aducanumab은 유효성과
안전성에 관련된 문제 외에도 지나치게 비싼 약가로
논란을 빚고 있다 이번 페이지에서는 aducanumab의
현재 급여 현황과 논란에는 어떤 것이 있는지, 그리고 현재
설정된 약가는 합리적인지에 대한 논의를 다룸으로써
aducanumab의 ‘환자 접근성’에 초점을 맞춰 관련 문제를
다루어 보려고 한다
1 급여 현황 및 논란
미국의 공공 의료보험은 메디케어(Medicare)로 , 병원
보험 (Part A), 의료보험 (Part B), 메디케어
어드밴티지(Part C)그리고 처방약 비용적용(Part D) 총
4 개의 파트로 나누어진다 이 중 aducanumab 이
포함되어 있는 Part B(의료보험)에 대해 먼저 알아보자
Part B의 대상자는 65세 이상의 시니어 또는 장애가 있는
일부 젊은 사람이고, 월 보험료(Premium)는 2021년
기준 평균 $148 5이며 환자부담금(deductible)은
$233/y이다 발생하는 의료비용에 대하여 환자 부담금을
제한 비용을 환자와 메디케어가 20:80의 비율로 지불하게
된다(표2)[3] 이때 환자가 지불하는 20%의 금액에는
최대치가 없는데 이를 ‘ no cap on out-of-pocket
spending’이라고 한다[4] 우선 병원은 제조사로부터
도매가(wholesale acquisition cost, WAC)인

$28,000(약가 인하된 2022년 1월 기준)을 지불하여
aducanumab을 구입하고, 환자와 메디케어는 20:80의 비율로 도매가의 103 % 의 가격을 병원에게
지불한다(그림4)[5] 이처럼 메디케어 Part B의 경우 환자
지불 금액에 상한선이 없기 때문에, 즉 ‘ no cap on outof-pocket spending’ 방식을 적용하고 있기 때문에
aducanumab을 구매하는 환자는 연간 aducanumab
투약 비용으로만 $5,000 이상을 지출하게 된다
Medicare Part B 가입자의 50% 이상의 연간 소득이
$30,000 이하라는 점을 고려하면 aducanumab 의
약가가 인하되었다고 하더라도 여전히 많은 환자에게
금전적으로 부담이 되는 것을 알 수 있다[6]
내용
대상자 - 65세 이상의 시니어 또는 장애가 있는 일부 젊은 사람
월 보험료 - $148.5 (2021년 기준)
환자 부담금
- 연 $233 - 이를 초과하여 발생하는 의료비용에 대해서는 환자가 20% 부담 - No cap on out-of-pocket spending
방식
표2. Medicare Part B 특징
WAC; Wholesale Acquisition Cost
그림4. Aducanumab 환자 부담금 (출처: Franklin et al., 2021)
1) 보험료 인상 문제
또한 aducanumab이 현재의 약가로 보험적용이 된다면
이는 Medicare Part B 월 보험료 인상 문제를 야기할
것이다 2017년 기준, 메디케어 가입자 중 약 200만명이
알츠하이머병 처방약을 복용하였는데, 고령화가 진행됨에
따라 알츠하이머병 처방약을 복용하는 인구는 이보다 더
증가했을 것으로 보인다 연간 aducanumab 투여 비용을
$56,000(2021 년 기준 ) 이라하고 , 투여 대상을
보수적으로 잡아 100만명만 투여 받는다고 가정했을
때에도 메디케어의 연간 지출 비용은 $570억인데, 이는
2019 년 Part B 약물의 총지출 비용인 $370 억을
상회하는 액수이다 [7] 따라서 메디케어는
aducanumab의 보험 적용으로 인한 추가 지출을 예상해
2022년 Part B 월 보험료를 월 $148 5에서 $170 1로
인상할 것을 2021년 11월에 발표하였다[8]
aducanumab에 대해 보험을 적용 받을 수 있다는 문제가
발생한다 Part B 인상 발표 1달 후인 2021년 12월, 바이
오젠은 2022년 1월 기점으로 aducanumab의 약가를 연
간 $56,000에서 $28,000로 인하하겠다는 발표를 하였
다[9] 미국 보건복지부(Health and Human Services, HHS)에서는 2022년 5월, 인하된 aducanumab의 약가
를 고려해 2022년에 인상되었던 Part B 월보험료를
2023년부터 인하할 것을 검토 중에 있다고 한다

메디케어 Part B 가입자의 연간 소득을 고려할 때 인하 전
후의 약가는 금전적으로 부담이 되는 액수라는 것을 확인
할 수 있었다 Aducanumab 보험 대상자를 보수적으로
계산했을 때 인하 전 약가로 인한 지출 예상 비용은 Part B
drug의 총지출 비용을 상회해 2022년의 Part B 월 보험
그림5. Part B 가입자 연간 소득
(출처: Wyatt Koma et al., 2020)
2) Part B 가입자와 혜택 대상 범위의 불일치
하지만 Part B 월 보험료를 인상할 경우, Part B 가입자
전원이 인상된 보험료를 지불하지만 CMS 또는 NIH가
인증한 무작위배정 비교임상시험 (Randomized Controlled Trial, RCT) 에 참여한 환자만이
료를 인상하는 혼란을 초래했다 또한 Part B 가입자 전원
이 인상된 보험료를 지불하는 데에 반해 특정 임상시험에
참여한 제한된 인원들만 aducanumab 보험 대상자로서
혜택을 받는다는 문제점이 발생했다 Aducanumab의 약
가는 메디케어 월 보험료와 관련해서 많은 혼란을 초래했
고 이러한 문제점들을 해결하기 위해 다양한 노력이 기울
여지고 있다
그림6. Part B 보험료와 aducanumab의 약가 인하 타임라인
어떠한 약물의 가격이 합리적이고 경제적인지 고려할
때는, 그 약물의 ‘비용효과성’에 대해 다룰 필요가 있다
여기서 비용효과성이란, ‘동일한 효과를 얻는 데에 얼마의
비용이 쓰이는가’를 의미한다 이에 대한 분석을 통해 같은
효과라도 적은 비용이 드는 약물이 무엇인지를 파악할 수
있다 따라서 aducanumab 의 현재 약가가 과연
합리적인지, 이에 따른 환자 접근성은 어떠한지를
판단하기 위해서는 비용효과성 분석을 진행할 필요가
있다
본 파트에서는 미국의 비영리단체인 Institution for Clinical and Economic Review(ICER) 에서
aducanumab 비용효과성 분석을 진행한 결과와 , aducanumab과 그 유사 기전 약물인 donanemab과의
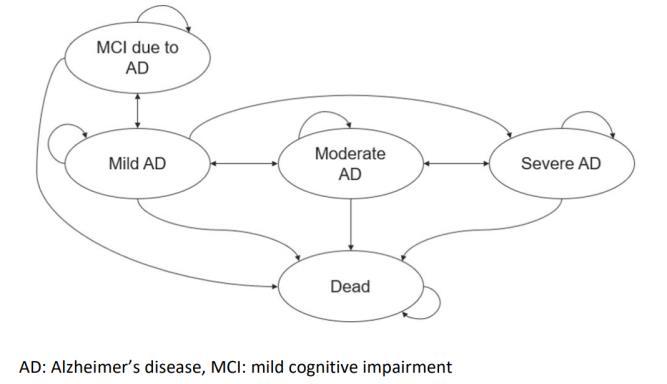
비용효과성 비교 분석을 진행한 논문 결과를 살펴봄으로써 aducanumab의 현재 가격이 합리적인지에
대한 의문을 해결하고자 한다
1) ICER 에서 진행한 aducanumab 의 비용효과성
분석[10]
본 파트에서는 ICER에서 진행한 비용효과성 분석 진행
방법과 결과, 그리고 이에 대한 분석을 차례로 설명하고자
한다 여기서 ICER라는 미국의 비영리기관은 다양한
요인들을 분석하고 계산하여 환자들이 합리적인 가격으로
치료를 받는 것을 목적으로 의약품의 비용효과성 분석을
진행하는 기관이다
ICER에서는 마르코프 모델(Markov model)을 사용하여
지지적 치료(supportive care)를 단독으로 진행했을 때와
지지적 치료를 aducanumab와 병용했을 때의 결과를
비교하였다 여기서 지지적 치료란 기존의 알츠하이머병
치료방식을 의미하며, 이는 aducanumab과 같은
질병완화제제의 사용을 포함하지 않는다 또 분석에서
사용된 마르코프 모델은 ‘추후 상태의 예측이 현재의
상태나 과거의 상태에 의존하지 않는다’는 가정 하에
설정된 모델이다 이 모델은 고혈압, 당뇨, 정신질환과
같이 분석 기간이 길고, 일정한 건강 상태가 반복적으로
발생하는 질환을 대상으로 경제성 평가를 할 때 주로
사용한다 마르코프 상태라고 부르는 질병의 각 단계들은
배타적이기 때문에 질병의 여러 단계를 동시에 겪을 수
없다 또 모델의 분석 대상은 질병이 악화되는 것이
일반적이나, 증상이 호전되는 경우도 있기 때문에 보통
양방향의 화살표를 사용해 상태 간 이행을 나타낸다
마르코프 상태는 알츠하이머병(Alzheimer’s Disease, AD)의 중증도 악화 순서에 따라 5단계; 알츠하이머병으로
인한 경도인지장애 (MCI due to AD), 경증
알츠하이머병 (mild AD), 중등도 알츠하이머병 (moderate AD), 중증 알츠하이머병 (severe AD), 사망(death)으로 나눠진다[11] 각 상태는 이웃한 단계와 양방향 화살표로 연결되어 있지만 대다수의 경우 호전될 가능성은 극히 낮으며, 각 상태에서 바로 사망할 수 있다는 점을 고려해 ‘사망’ 단계와 단방향 화살표로 연결된 것을 아래 모식도에서 확인할 수 있다(그림7)[12]
그림7. 마르코프 모델로 나타낸 알츠하이머병 (출처: Synnott, P. G et al.,2021)
모델에서의 주기는 1 년으로 , 다른 aducanumab
비용효과성 분석 자료에서 사용한 경제성 평가 모델과
동일하게 설정되었고, 모델의 결과를 quality-adjusted life years gained(QALY), equal-value of life years gained(evLYG) 등으로 설정해 점증적비용효과비 (Incremental Cost Effectiveness ratio, ICER)를 계산해
비용효과성을 분석했다
여기서 질보정 수명(QALY)은 삶의 양적인 측면과 질적인
측면을 통합한 지표로써 ‘utility value X life year’로
계산되고 질 가중치(utility value)는 0에서 1 사이의 값을
가진다 예를 들어 질 가중치가 0 9의 편두통을 10년간
앓았다면 이때의 QALY 는 9 년이 된다 다음으로 , 점증적비용효과비(ICER)는 비용의 증가량(incremental cost)을QALYs의 증가량(incremental QALYs)으로 나눈
것으로 정의된다 ICER는 비교 대안에 비해 증가한 효과
한 단위당 어느 정도의 비용이 추가 소요되는지 나타내는
지표이다 [13] 이때 효과에 대한 지표로 QALYs, evLYs(나이, 장애, 질병 등에 관계없이 연장된 수명을
가장 건강한 상태로 동등하게 간주하고 평가하는 지표)
등을 사용할 수 있다 마르코프 모델을 이용해 분석한
환자들의 초기 상태는 알츠하이머병으로 인한
경도인지장애 55%, 경증 알츠하이머병 45% 였으며,
전체의 92%는 요양환경, 즉 병원과 같은 의료 환경이
아닌 환경에 있던 알츠하이머병 초기 환자들이다 이렇게
구성된 환자들을 대상으로 지지적 치료를 단독으로
진행했을 때와 지지적 치료를 aducanumab과 병용했을
때의 결과를 비교했으며, 이때 다음과 같이 3가지 가정이
전제되었다 첫번째 가정은 aducanumab의 효능을
Study 301과 302 두 임상시험의 평균값으로 가정한 것, 두번째 가정은 경증 알츠하이머병에서 aducanumab의 효능은 그 ‘알츠하이머병으로 인한 경도인지장애’
단계에서의 효능의 절반이라고 가정한 것, 마지막 가정은 중증 알츠하이머병 단계부터는 약물을 투여해도 효능이
없으며 이때부터는 약물 투여를 중단한다는 것이다(표3)
ICER는 마르코프 모델을 이용한 분석 시 두 가지 관점, 보건의료체계적 관점 (health care system perspective)과 조정된 사회학적 관점(modified societal perspective)을 사용하였다 보건의료체계적 관점은 직접적인 치료 가격과 환자의 건강 증진을 고려한
관점이고, 조정된 사회학적 관점은 여기서 더 나아가 환자를 돌보는 데 드는 시간과 비용, 간병인의 삶의 질, 간병인의 직접적 의료 비용 또한 포함하는 좀 더 넓은
다시 말해, 보건의료체계적 관점은 약물 사용이 환자에 미치는 직접적인 영향을 고려한 관점이라면, 조정된 사회학적 관점은 환자에 미치는 영향 외에도 간병인에게 미치는 영향까지 전체적으로 고려한 관점이다[14]
내용
분석대상 알츠하이머병으로 인한 경도인지장애 55%, 경증 알츠하이머병 45%
가정 1 Aducanumab의 효능 = Study 301과 302의 결과값의 평균
가정 2 ‘경증 알츠하이머병’ 단계에서의 효능 = (‘경도인지장애’ 단계에서의 효능) * 0.5
가정 3 ‘중증 알츠하이머병’ 단계부터의 효능 = 0
분석 시 사용된 관점
1.보건의료체계적 관점
2.조정된 사회학적 관점
(b) Results
이렇게 설계된 마르코프 모델을 기반으로 도출된 결과를 다음과 같은 4 가지 측면에서 aducanumab 의
비용효과성을 평가하였다
먼저, base-case result는 다음과 같다(표4) 여기서
base-case result 란 aducanumab 을 투여했을 때
QALYs, evLYs와 같은 결괏값이 어떻게 변화하였는지
분석한 결과를 의미한다 다음에서 볼 수 있는 것처럼,
전체적으로 aducanumab을 투여했을 때가 지지적
치료만을 진행했을 때 비해 QALYs 와 evLYs 가
증가하였으므로, aducanumab 투여가 전반적으로 초기
알츠하이머병 환자의 수명을 증가시킨 것을 확인할 수
있었다(표4) 알츠하이머병은 간병인의 삶에도 미치는
영향이 크기 때문에 , 총 비용 (total cost) 은
지지적치료만을 진행했을 때와 aducanumab을 투여했을
때 모두에서 간병인에 미치는 영향까지 고려하는 조정된
ADU: aducanumab, QALY: Quality-adjusted life years gained, evLYG:equal-value of life years gained
표4.Base case result (출처: Synnott, P. G et al., 2021)
Base-case result의 결괏값을 바탕으로, <표4>의
비용의 증가량을 QALY의 증가량 또는 evLYs 증가량으로
나누어 구한 aducanumab 의 ICER 값은 다음과
같았다(표5) ICER는 앞의 설명처럼 QALY와 같은 단위값
1을 증가시키는 데에 필요한 비용을 의미하는데 , (표5)에서 볼 수 있듯이 aducanumab의 투여 비용을
$50,000으로 가정하여 계산하였을 때의 ICER 값은
$1,000,000/QALY 를 초과해 통상적인 기준치인
QALY: Quality-adjusted life years gained evLYG:equal-value of life years
두 번째로, threshold analysis는 aducanumab의 연간 투여 비용이 어느 정도여야 특정 ICER 값을 달성할 수
있는지를 알아보기 위해 진행된 분석이다 보통 어떠한 약물이 비용효과적인지 판단할 때는 , ICER 값이 $100,000~$150,000/QALY 가 되기 위한 가격의
범위를 뜻하는 health benefit price benchmarks(HBPB)를 참고한다 아래 표에서 볼 수 있는 것처럼 , 보건의료체계적 관점에서는 HBPB 가
$2,560~$4,850, 조정된 사회학적 관점에서는 HBPB가
$3,390 $5,750으로 , 바이오젠이 초기에 제시한 연간
투여 비용인 $50,000와 큰 차이를 나타냄을 확인할 수
있었다(표6)
세 번째로 , 현재 aducanumab 에 대한 증거가
불충분하고, aducanumab의 치료 이점에 대한 다양한
Quality-adjusted life years
입력값으로 인해 비용효과성의 변동 폭이 클 수 있다 이로
인한 결과의 불확실성을 고려하기 위해 aducanumab에
대한 시나리오 분석(scenario analysis)이 진행되었다
구체적으로 시나리오 분석에서는 낙관적인
시나리오 (optimistic treatment benefit scenario) 와
보수적인 시나리오(conservative treatment benefit scenario)에 대해 분석함으로써 다양한 상황을 고려했다
낙관적인 시나리오 분석에서는 aducanumab의 효과를
Study 302의 HR로 간주한다 즉, 결과가 좋지 않았던
Study 301의 결과를 302의 결과와 섞지 않기 때문에
aducanumab 의 치료 효과를 최대한 낙관적으로
바라보고 분석한 것이다 또 , 임상시험은 경도인지장애와
경증 알츠하이머병 상태의 환자들을 대상으로 진행되었기
때문에 경도인지장애에서 경증 알츠하이머병 단계로의
이행시 적용되는 HR에 대한 임상자료는 있지만, 경증에서
중등도 단계로의 이행 시 적용되는 HR에 대해서는
임상자료가 없다 이렇게 임상자료 없는 데이터에 대해
낙관적인 시나리오에서는 경증에서 중등도로 이행 시
적용되는 HR을 경도인지장애에서 경증 알츠하이머병
단계로의 이행 시 적용되는 HR과 같다고 가정하였다
이에 반해 보수적 관점의 시나리오에서는 Study 301과
302의 결과를 모두 반영하여 aducanumab의 효능을
설정했으며 , 경증 AD 이후 단계에 대해서는
aducanumab의 질병 진행 감소 효과가 없다고 가정했다
이렇게 두 가지 시나리오로 분석한 결과, 낙관적인
시나리오가 보수적인 시나리오보다 QALY당 소요되는
비용, 즉 ICER 값이 더 작은 것을 확인할 수 있다(표8)
또한 현재 aducanumab의 연간 투여 가격인 $50,000은
가장 긍정적인 상황을 가정한 낙관적인 시나리오에서도
비용효과성 기준(threshold)에 훨씬 미치지 못하여, 비용효과적이기 위해서는 가격 인하가 확실히 필요함을
알 수 있다
(
: Synnott, P. G et al., 2021)
마지막은 aducanumab 약가에 따른 재정영향(budget impact, BI)에 대한 분석으로, 특정 가격에서 재정영향
기준치(BI threshold)를 초과하지 않으면서 치료받을 수
있는 환자의 최대 비율을 살펴보는 것이 그 목적이다
여기서 특정 가격이란, 현재의 aducanumab 가격, 또는
특정 ICER 값 ($50,000~$150,000/QALY) 을
만족시키기 위한 aducanumab 의 가격을 모두 포함한다[17]
이 분석에서 재정영향 기준치를 1년 당 819만 달러로
설정했으며, 분석 결과는 다음과 같다(표9) (표9)에서
aducanumab의 연간 투여 비용 1년에 $50,000이라고
가정할 때 치료받을 수 있는 환자 수가 3%라는 것은, 약
28만명의 치료 대상 환자 중 3%만이 재정영향 기준치인 819만 달러를 넘기지 않고 5년 내에 치료받을 수 있다는
9. 특정 ICER 값을 달성하기 위한 연간 가격 (출처: Synnott, P. G et al., 2021)
15만 달러/QALY 라면 약 25%의 환자가 치료받을 수
있고, ICER 값이 $100,000/QALY라면 41%의 환자가, $50,000/QALY라면 모든 환자가 재정영향 기준치를
넘기지 않고 5년 내에 치료를 받을 수 있다 이로부터
ICER 값 (1 QALY 당 소요되는 추가 가격)이 줄어들면
치료받을 수 있는 환자의 비율이 증가함을 알 수 있다 이
결과를 그래프로 나타내면 다음과 같다(그림8)
보다 꽤 높은 가격임을 볼 수 있다 이에 따라 인하된
가격의 aducanumab도 비용효과성이 낮음을 확인할 수
있었다(그림8)
(c) Summary
위와 같이 분석이 진행되었지만, 비용효과성 분석 시
임상시험에서 부족한 데이터들로 인해 세운 여러 가지
가정들로 인해 이번 분석에 대해서는 여러 불확실성이
존재한다 대표적으로, aducanumab의 유효성에 대해
Study 301과 302에서 다른 결과를 제시하고 있어 본
분석에서는 두 임상 시험 결과의 평균값, 또는 긍정적인
결과를 나타낸 Study 302의 결과값만을 사용하여 분석을
진행했지만 , 이것이 실제 aducanumab 의 효능과
비슷한지는 알 수 없다 이러한 여러 한계들에도 불구하고, 비용효과성 분석을 진행했을 때 현재 비용은
비용효과적인 비용과는 큰 차이가 있기 때문에, 본 분석을
그림8.Aducanumab 투여의 budget impact (출처: Synnott, P. G et al., 2021)
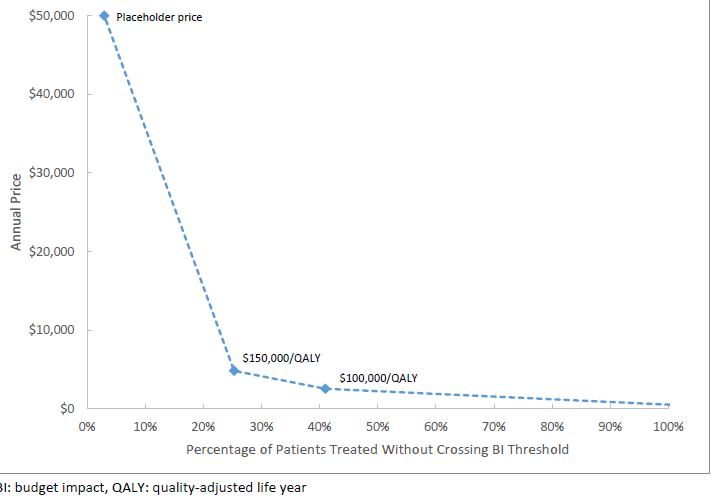
위 그래프에서 볼 수 있는 것처럼 aducanumab의
약가가 지금과 같이 $50,000로 유지될 경우, 재정 영향
기준치를 초과하지 않고는 5년 내에 28만 명 중 3%밖에
치료할 수 없는 것을 확인할 수 있다 따라서 현재 aducanumab의 약가는 환자 접근성이 매우 낮음을 알 수 있다 또한 바이오젠은 최근 처음에 제시한 가격인
$56,000에서 가격을 약 $28,000로 가격을 인하했지만, $28,000도 ICER 기준치를 만족시키기 위한 가격
통해 ‘aducanumab의 현재 가격은 비용효과적이지 않다’라는 결론은 타당하다고 보인다
2) 유사기전 약물의 비용효과성 비교[18]
ICER 자료의 비용효과성 분석을 통해 aducanumab이
비용효과적이지 않다는 것을 알 수 있었지만, 비슷한
기전의 약물인 donanemab과 비용효과성을 한 번 더
비교한다면 aducanumab의 비용효과성을 더욱 확실히
판단할 수 있어 본 논문(Ross EL, Weinberg MS, Arnold SE Cost-effectiveness of Aducanumab and Donanemab for Early Alzheimer Disease in the US
2022)에 대한 review를 진행하였고 그 결과는 다음과
같다
본 논문에서는 시간에 따라 알츠하이머병의 중증도가
변하는 상태 - 전이 모델 (state-transition model) 을
이용해 비용효과성을 예측했다(그림9) 모델의 사이클은
1달로, 사이클이 끝날 때마다 환자는 일정 확률(rn*H)로
AD clinical stage가 악화하도록 설정되었다 여기서 rn 은
다음 단계로 전이될 확률을, H는 HR을 뜻하며, 각 단계에
따른 rn 과 H는 다음과 같다(표10) 그리고 환자들은
clinical stage에 따라 MCI, mild AD, moderate AD, severe AD로 분류되며 12사이클, 즉 1년이 지날 때마다
환자들의 연령은 한 살씩 증가하고 해당 연령에 맞게
health care cost, societal cost, utility, mortality HR
등의 값이 재설정된다
단계
Ratio, AD; Alzheimer’s disease
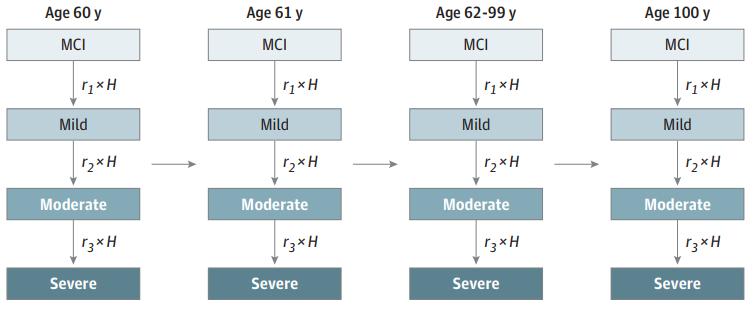
모델에서 사용된 기본 환자 정보는 다음과 같았다
환자들의 평균 연령은 75세, 시작 단계에서 65%가
경도인지장애(MCI), 35%가 경증 알츠하이머병(mild AD)이었고, 치료 비용은 치료제 비용과 background care cost로 나뉘며 여기서 background care cost는
치료제 비용 외에 소요되는 비용으로 질병이 악화할수록
증가하는 특징을 갖는다 그리고 약물의 연간 투여 비용의
경우 , aducanumab 은 용량 적정으로 10mg 에
도달하기에 첫해에는 $20,500, 그 이후로는 연간
(b)
연간 $150,000/QALY를 달성하기 위한 가격, 즉
가치기반가격(value-based price)은 donanemab에서
더 큰 것을 확인할 수 있었다 어떠한 약물의 약가가
가치기반가격 이하라면 1 QALY를 증가시키는 데에
$150,000보다 낮거나 같은 가격이 요구되기 때문에
비용효과적인 가격이라고 볼 수 있다 하지만 현재 aducanumab 과 donanemab 의 약가는 모두
가치기반가격보다 크므로 두 약물 모두 비용효과성이지
않은 것을 확인할 수 있었다 따라서 aducanumab과 donanemab 모두 현재 가격인 연간 $25,000는
비용효과적이지 않다 이 두 약물이 비용효과적이기
위해서는 조정된 사회학적 관점으로 분석했을 때
로 감소해야 함을
볼 수 있다 정리하면, 이 결과는 ICER의 비용효과성 분석 결과와 거의 유사하여 aducanumab의 현재 가격은
비용효과적이지 않음을 다시 한번 확인할 수 있었다 또 aducanumab은 비용효과적인 가격(조정된 사회학적
관점에서 분석한 가치기반가격 ) 과의 차이가
donanemab 에서보다 크므로 , aducanumab 은
유사기전의 약물인 donanemab 에 비해서도
비용효과적인 가격과는 거리가 더 큼을 확인할 수 있었다
다음은 각 치료효과 정도에 따른 가치기반가격 분석
결과이다 여기서 약물의 치료효과 정도는 HR, 즉
위약군의 HR 대비 투약군의 HR로 표현되었다 HR이 1인
경우 위약군과 투약군의 위험도가 같으며, 1보다 작을
경우 투약군이 위약군에 비해 위험도가 낮은 것이다 다음
그래프는 HR로 표현된 여러 치료효과 정도에 따른
aducanumab 과 donanemab 의 가치기반가격을
ICER: Incremental Cost Effectiveness ratio QALY: Quality-adjusted life years gained 표11. 본 분석의 base-case result (출처: Ross et al., 2022)
가치기반가격을 나타낸 그래프이다(그림10) 질병 진행
HR이 증가한다는 것은 해당 약물의 치료효과가 낮다는
것을 의미하고 , 치료효과가 낮으면 해당 약물의 비용효과성 또한 감소한다 따라서, 질병 진행 HR이
증가함에 따라 가치기반가격이 감소함을 확인할 수 있다
Aducanumab의 경우, HR이 0 5보다 작은 값을 가져야, 즉 더 좋은 치료효과를 보여야 가치기반가격이 연간
$25,000 이상이 되고, HR이 0 1로 치료효과가 매우 큰
경우에도 가치기반가격이 연간 $50,000 미만인 것을
확인할 수 있다 따라서 현재 비용인 연간 $25,000는
약물의 치료효과가 높을 때 비용효과적인 것이다
Donanemab은 HR이 0 7을 넘으면 가치기반가격이 연간
$25,000가 되고, HR이 0 5를 초과하면 연간 $50,000
이상이 된다 즉 0 7보다 낮은 HR에서는, 동일한
치료효과에서 donanemab 이 aducanumab 보다

가치기반가격이 높아 donanemab에서 비용효과적인
가격과 현재 약가와의 차이가 더 작음을 확인할 수 있다
비용효과성 분석 결과 donanemab이 비용효과적인
비용과 현재 약가와의 차이가 더 작다는 결론이
도출되었지만 이를 무조건적으로 수용하기에는 무리가
있다 이는 비용효과성 분석에 사용한 donanemab의
효능 자료는 임상 2상 데이터를 기반으로 했기 때문이다
임상 3 상을 통해 더 많은 수의 표본이 확보되어
donanemab의 효능이 확실히 검증되기 전까지는 임상
2상 기반 효능 데이터는 예비 자료로 판단되어야 한다 또
다른 문제점은 임상시험 디자인 차이가 약물의 본질적인
약리학적 차이보다 비용효과성 분석 결과에 더 큰 영향을
끼쳤다는 것이다 첫번째로 donanemab 의 경우
aducanumab보다 더 많은 신경 퇴행 관련 바이오마커를
사용했다 긍정적인 아밀로이드 PET 결과만을
바이오마커로 사용한 aducanumab의 실험 프로토콜과
달리, donanemab을 투여받은 환자는 아밀로이드와
타우를 모두 바이오마커로 사용하여 더욱 정밀한 측정이
가능했다 둘째로, aducanumab은 MRI로 모니터링을
진행했지만 , donanemab 은 아밀로이드 PET 를
진행 HR에 따른 aducanumab과 donanemab의 가치기반가격 (출처: Ross et al., 2022)
확인하는 등 더욱 정밀하게 검사를 진행했다 마지막으로, aducanumab은 부작용이 나타나지 않는 한 계획된
기간동안 계속 투여된 반면 donanemab은 아밀로이드가
충분히 제거되었다고 판단되면 투여가 중지되었다 특히
마지막 투여기간의 차이가 비용효과성 결과에 큰 영향을
끼쳤다 aducanumab은 질병 진행 정도를 90% 이상
감소시켜도 평생 복용해야 하므로 연간 약가 $50,000의
투여 비용은 비용 효과적이지 않다 하지만
donanemab의 경우, 질병 진행 정도를 50% 수준으로만
감소시켜도 연간 $50,000 의 투여비용은 비용 효과적이라고 평가된다 왜냐하면 평생 복용하는 것이 아니라 상태가 호전되면 투여를 중단할 수 있어 추가적인
비용이 발생하지 않기 때문이다
이처럼 비록 부족한 부분이 있으나 aducanumab과
donanemab의 비용효과성 분석 결과는 앞으로 출시될
알츠하이머 치료제의 비용 효과성 분석의 길잡이로서의
역할을 할 수 있다 현재 개발 중인 항체 약물들 중 하나인
lecanemab은 현재 임상 3상이 진행 중이고 임상
2상에서 상태가 호전되어도 중단 없이 투여한 결과,
질병의 진행을 26~56% 감소시켰다 임상 3상에서 이러한
효능이 입증되면 lecanemab 의 가치기반가격은 연
$10,000~$25,000로 예상되고, 만약 상태가 호전될 경우
투여가 중단되는 방식으로도 치료가 가능하다면
가치기반가격은 증가한 연 $15,000 $60,000로 예상된다
분석을 통해 현재 aducanumab과 donanemab의
가격은 초기 알츠하이머병 환자들에게 모두
비용효과적이지 않으며, aducanumab의 가격은 1년 당
$3,000 이하일 때 비용효과적이다 Donanemab의 경우
3상 임상시험에서 허가가 날 경우, 1년 당 $20,000의
비용에도 비용효과적이라는 결정을 내릴 수 있다 이 두
값은 조정된 사회학적 관점에서 분석한 가치기반가격에
기인한 값이다 하지만 두 약물의 유효성 측정 과정에서
임상시험 프로토콜의 차이로 인해 donanemab이 더
긍정적인 결과를 낼 수 있는 요인들이 많았기 때문에, 이러한 한계를 고려하여 두 약물의 비용효과성 분석을
비판적으로 수용할 필요가 있어 보인다
[1] Castrillo-Viguera, C., Chalkias, S., Burkett, P., Wu, S., Chen, H., Harrison, K., ... & Haeberlein, S. B. (2021). EMBARK: a Phase 3b, open-label, single-arm, safety Study to evaluate the longterm safety and efficacy of aducanumab in eligible participants with Alzheimer’s disease (2448).
[2] https://clinicaltrials.gov/
[3] https://www.medicare.gov/basics/costs/medicare-costs
[4] San-Juan-Rodriguez, A., Gellad, W. F., Shrank, W. H., Good, C. B., & Hernandez, I. (2021). A decade of increases in Medicare Part B pharmaceutical spending: what are the drivers?. Journal of managed care & specialty pharmacy, 27(5), 565-573.
[5] Franklin, M. (2021). ICER report on Alzheimer’s disease: implications from a patient perspective. Journal of Managed Care & Specialty Pharmacy, 27(11), 1618-1620.
[6] https://www.kff.org/medicare/issue-brief/medicare-beneficiaries-financial-security-beforethe-coronavirus-pandemic/
[7] https://www.kff.org/medicare/issue-brief/relatively-few-drugs-account-for-a-large-share-ofmedicare-prescription-drug-spending/
[8] Franklin M. (2021). ICER report on Alzheimer's disease: implications from a patient perspective. Journal of managed care & specialty pharmacy, 27(11), 1618–1620.
https://doi.org/10.18553/jmcp.2021.27.11.1618
[9] https://investors.biogen.com/news-releases/news-release-details/biogen-announcesreduced-price-aduhelmr-improve-access-patients
[10] Synnott, P. G., Whittington, M. D., Lin, G. A., Rind, D. M., & Pearson, S. D. (2021). The effectiveness and value of aducanumab for Alzheimer’s disease: A summary from the Institute for Clinical and Economic Review’s California Technology Assessment Forum. Journal of Managed Care & Specialty Pharmacy, 27(11), 1613-1617.
[11] 2021 Alzheimer's disease facts and figures. (2021). Alzheimer's & dementia : the journal of the Alzheimer's Association, 17(3), 327–406. https://doi.org/10.1002/alz.12328
[12] Green, C., Handels, R., Gustavsson, A., Wimo, A., Winblad, B., Sköldunger, A., & Jönsson, L. (2019). Assessing cost-effectiveness of early intervention in Alzheimer's disease: An open-source modeling framework. Alzheimer's & Dementia, 15(10), 1309-1321.
[13] Prieto, L., & Sacristán, J. A. (2003). Problems and solutions in calculating quality-adjusted life years (QALYs). Health and quality of life outcomes, 1(1), 1-8.
[14] Mesterton, J., Wimo, A., Langworth, S., Winblad, B., & Jonsson, L. (2010). Cross sectional observational Study on the societal costs of Alzheimer's disease. Current Alzheimer Research, 7(4), 358-367.
[15] Landeiro, F., Mughal, S., Walsh, K., Nye, E., Morton, J., Williams, H., ... & Gray, A. M. (2020). Health-related quality of life in people with predementia Alzheimer’s disease, mild cognitive impairment or dementia measured with preference-based instruments: a systematic literature review. Alzheimer's research & therapy, 12(1), 1-14.
[16] https://acl.gov/ltc/costs-and-who-pays/costs-of-care
[17] Bloudek, L. M., Nguyen, V., Grueger, J., & Sullivan, S. D. (2021). Are drugs priced in accordance with value? A comparison of value-based and net prices using Institute for Clinical and Economic Review reports. Value in Health, 24(6), 789-794.
[18] Ross, E. L., Weinberg, M. S., & Arnold, S. E. (2022). Cost-effectiveness of Aducanumab and Donanemab for Early Alzheimer Disease in the US. JAMA neurology, 79(5), 478-487.
바이오젠의 알츠하이머 치료제 aducanumab(Aduhelm®)이 상업적으로 실패하면서 투자자들은 에자이와 바이오젠이 공동 개발한 lecanemab에 기대를 걸었다 FDA는 지난해 6월에 lecanemab을 혁신치료제로
지정했고, 지난해 12월에는 lecanemab을 패스트 트랙으로 지정했다 최근에는 lecanemab의 임상 3상 시험인 CLARITY의 톱라인 데이터에서 긍정적인 결과가 발표되었다 구체적인 데이터는 올해 11월에 공개될 예정이지만, 이 결과가 다른 아밀로이드 베타 방식 치료제 개발에도 긍정적인 영향을 끼칠 것으로 예상된다 한편, 일라이 릴리에서 개발한 donanemab은 lecanemab과 같은 단일 클론 항체 의약품이며, pyroglutamate Aβ에서 형성된
플라크의 중심부에 특이적으로 발현되는 항원을 인식하여 작용한다 Donanemab의 임상 3상 시험인
TRAILBLAZER-ALZ 3, TRAILBLAZER-ALZ 4 study가 진행 중이며, 인지기능 개선을 확인할 수 있는 확증 임상
결과는 2023년 중으로 발표될 예정이다 이 외에 현재 개발 중인 다른 알츠하이머병에 대한 항체치료제의
사례로는 로슈에서 gantenerumab에 이중항체 기술을 적용한 것이 있으며, tau 단백질을 표적으로 하는 tau
특이적 항체 치료제인 gosuranemab, tau 응집 억제제인 TRx0237등이 있다
Ⅰ. Lecanemab과 다른 항체 의약품의 비교
Lecanemab 은 마우스 mab158 의 IgG1 인간화
항체이며 수용성 아밀로이드 베타(amyloid beta, Aβ)

원시섬유 (protofibril) 에 선택적으로 결합한다 [1]
Lecanemab, aducanumab, gantenerumab의 다양한
형태의 Aβ에 대한 결합 친화도를 비교하기 위해 세 가지
항체 의약품의 결합 특이성을 그림으로 나타냈다(그림1)
그림에서 더 진한 색으로 표시된 곳일 수록 각 항체
의약품이 더 강하게 결합함을 의미한다
그림1. Lecanemab, aducanumab, gantenerumab의
결합 특이성 (출처: ALZFORUM)

Lecanemab 은 작은 크기의 단량체 (monomer) 나
올리고머(oligomer)에는 결합하지 않고 6-mer 에서 12mer 정도의 중간 크기의 원시섬유에 강하게 결합한다[3]
Aducanumab, gantenerumab과 lecanemab의 결합
친화도를 비교해보면, 75-300kD 크기의 Aβ에 대한
lecanemab 의 친화력은 aducanumab 보다 100 배 , gantenerumab보다 10배 크다 이보다 큰 크기의 300-
500kD Aβ에 대해서는 lecanemab이 aducanuamb보다
친화력이 25배 높다(표1)
이 항체의약품들의 타겟이 다르기 때문에 작용기전도
다를 것이다 Aducanumab은 불용성의 Aβ 섬유(fibril)을
코팅하여 표면에서 새로운 플라크(plaque)의 형성을 위한
핵형성(nucleation)을 막는 방식으로 작용한다 반면에, lecanemab은 원시섬유를 타켓으로 하여 결합하며, 뇌에서 원시섬유(protofibril)와 섬유(fibril) 간의 농도 평형을 이동시키기 때문에 이미 형성된 불용성의 Aβ 원시섬유를 녹이는 작용을 하는 것으로 예상된다
또한 알츠하이머병 경도에서 중등도 환자를 대상으로
lecanemab의 안정성과 내성을 조사한 임상시험에서
ARIA -E/H 의 발생률이 대조군과 유사했다 즉 , lecanemab은 다른 항체 알츠하이머 치료제들보다 ARIA
부작용 발생이 적었다 ARIA 부작용이 발생하는 이유는
aducanumab과 gantenerumab 같은 불용성 섬유에
친화력이 높은 항체들이 혈관 벽에 침착된 섬유에 결합해 혈관 벽에 염증반응을 일으키기 때문으로 예상된다
따라서, lecanemab의 ARIA 부작용 발생이 적은 이유는 lecanemab이 불용성 섬유보다 가용성인 원시섬유에 더 강하게 결합하는 것이 원인이라고 예상할 수 있다
또 다른 점은 다음과 같다 Aducanumab은 침전된 Aβ를
인지하는 자연 항체에서, gantenerumab은 fibril을
인지하는 자연 항체에서 유도된 항체 의약품이다 반면
lecanemab은 인공 Aβ 원시섬유에 결합하도록 만들어진
항체라는 점에서 앞의 두 항체 치료제와 다르다[2]
한편, 최근 lecanemab의 임상 3상 시험 CLARITY에서
1톱라인 데이터가 성공적인 결과를 보였다 1차 유효성
평가 변수(primary endpoint)인 CDR-SB가 위약군 대비 27% 감소하였고, ADAS-cog-14 등의 2차 유효성 평가
변수(secondary endpoint)에서도 효과를 보였다 ARIA
부작용 발생률도 예상 범위 이내였다 이는 lecanemab이
알츠하이머 증상의 완화에 있어 의미 있는 결과를
보였음을 의미한다 바이오젠과 에자이는 실험이
완료되는 2023년 3월까지 승인을 신청할 계획이며, 이번
결과에 따라 추후 Aβ 방식 치료제 개발에도 긍정적인
영향을 끼칠 것으로 예상된다
Ⅱ. Donanemab의 작용기전
Donanemab 도 lecanemab 과 같은 단일클론항체
방식의 약물이며 마우스 mE8-IgG2a에서 얻은 IgG1
인간화 항체이다 부작용으로는 ARIA-H가 우세한 경향을
보인다 관전 포인트는 같은 표적 항체 약임에도 타겟
부위에는 차이를 보인다는 대목이다
Donanemab의 작용기전을 자세히 이해하기 위해 pyroglutamate peptide가 생성되는 과정을 알아보자
표1. Lecanemab, aducanumab, gantenerumab의 Aβ에 대한 결합 친화도 비교
다음 그림은 AD 발병에 연관된 N-terminal pyroglutamate peptide 가 생성되는 단계를
보여준다(그림2)[4]
그림2. 알츠하이머병에서 Pyroglutamate peptides의 생성과정 (출처: Bayer, T.A., 2022)
- 아밀로이드 전구체 단백질(amyloid precursor protein, APP)에서 전체 길이 Aβ 를 형성할 때 BACE1 또는 meprin-β의 작용에 의해 Aβ peptide의 Met(-1)위치와
Asp(+1)위치 사이가 잘려 전체 길이 Aβ의 N 말단이 형성되고 신경세포에서 분비된다
- 이후 meprin-β 또는 aminopeptidase A가 N말단의 Asp(+1)과 Ala(+2) 아미노산 사이도 잘라 Aβ 2-X 를 형성할 수 있다 DPP4 또는 meprin-β는 Ala(+2)와
Glu(+3) 사이를 잘라 Aβ 3-X를 만든다
- 다음으로는 glutamyl cyclase(QC)가 작용하여 절단된
N 말단의 세 번째 위치의 glutamate(E) 가 pyroglutamate(pE)로 변형된다
- IsoQC는 QC의 동종효소로 주로 chemokine ligand
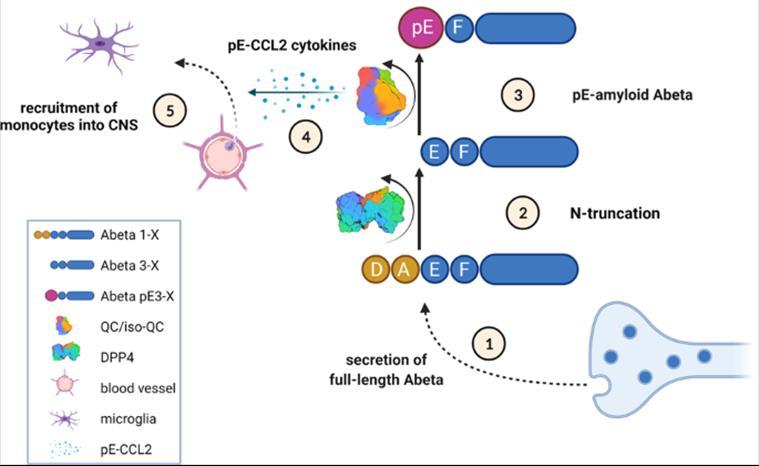
2(CCL2)를 변형하여 pE-CCL2를 합성한다
- pE-CCL2는 중추신경계로 단핵구의 침투를 촉진하는
작용을 한다 뇌를 침투한 단핵구는 미세아교
세포(microglia) 기능에 영향을 미친다 미세아교 세포는
Aβ를 없애는 작용도 하지만 과도한 염증반응을 일으켜
AD를 악화시키는 이중적 작용을 한다
다음 그림은 pyroglutamate Aβ cascade를 대상으로
하는 알츠하이머병 치료적 개입을 보여준다(그림3)
먼저 APP 절단 효소(β-secretase enzyme, BACE) 또는
meprin-β를 억제하거나, DPP-4를 억제하여 Aβ 1-X에서
첫 두 개의 N 말단 아미노산을 잘라 Aβ 3-X가 생성되는
과정을 억제할 수 있다 또한 glutamyl cyclase(QC)의
활성을 저해하여 Aβ 3-X가 Aβ pE3-X 단량체로 전환되는
과정을 억제할 수 있다
다음으로는 항체를 이용하여 아밀로이드 응집체의
독성을 중화하는 방법이 있다 먼저 Aβ pE3-X 단량체가
형성될 때 β-hairpin 유사 구조를 갖게 되는데, 이 구조를
TAPAS 백신에 의한 단일 클론 항체가 중화할 수 있다
다음으로 수용성 올리고머에서 불용성 섬유까지 다양한
형태에 작용하는 pan-AβpE-X 항체가 있다
그림3. 알츠하이머병 치료의 타겟으로서의 Pyroglutamate Aβ (출처: Bayer, T.A., 2022)
일라이 릴리 (Eli Lilly) 에서 개발한 donanemab 은
플라크(plaque)의 중심부에 특이적으로 발현되는 항원을
인식하여 작용한다 Aβ 에 결합해 응집체 형성을 차단하는
개념에서는 선발주자인 aducanumab 과 유사한
작용기전을 가지지만, 아밀로이드 플라크에서 응집된 Aβ
단백질의 pyroglutamate 형태인 Aβ(p3-42)를 타겟으로
한다는 점에서 차이가 있다
이전에 개발된 대부분의 Aβ 치료제는 다양한 수용성 또는
불용성 형태의 Aβ에 결합했으나, 축적된 아밀로이드
플라크에는 낮은 친화도를 가졌다 단순히 새로운
플라크의 침전을 막거나, 이미 존재하는 플라크의 성장을
막는 것이 아닌 donanemab처럼 축적된 플라크를
표적으로 할 수 있어야 이미 뇌에 존재하는 아밀로이드
축적(amyloid burden)을 제거할 수 있다는 개념이다[5]
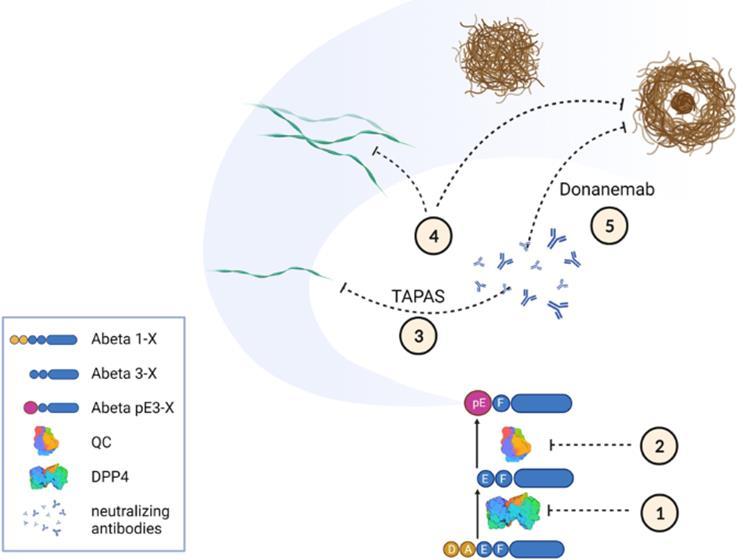
또한, 이전에 개발된 플라크에 결합하는 항체들은 뇌에서
미세출혈 부작용을 일으키기 때문에 폐기되었지만, donanemab 은 mouse 에서 미세출혈을 일으키지 않으면서 플라크를 제거할 수 있는 것으로 보고 되었다[5]
한편, 2021년 6월 FDA는 예비 임상 증거를 바탕으로
개발 및 연구 속도를 빠르게 하기 위해 donanemab을
혁신적 치료제로 지정하였다 환자의 40%에서 6개월
내에 Aβ 플라크가 제거됨을 확인했으며 이를 기반으로
aducanumab을 대조군으로 한 플라크 제거 임상을
시작했다 그 결과 임상 2상 1차 평가에서 인지기능 저하 32%를 개선했으며, 작년 12월 donanemab의 임상
규모를 늘려 3상 2건을 새로 시작했다
새로 시작된 donanemab의 임상 3상은 TRAILBLAZERALZ 3, TRAILBLAZER-ALZ 4 study이다 Study 3은
증상이 없는 알츠하이머병 환자를 대상으로 하는 예방
임상이며 study 4는 aducanumab을 대조약으로 Aβ
플라크 제거 정도를 비교하는 임상이다 Donanemab은
올해 안으로 가속승인 신청이 진행될 예정이며, 인지기능
개선을 확인할 수 있는 확증 임상 결과는 2023년 중으로
발표될 예정이다 만약 donanemab이 승인이 될 경우
2026년까지 6조 원의 매출이 예상될 만큼, 확실한 효과를
보증하는 알츠하이머 치료제에 대한 수요가 크다는 것을
알 수 있다
최근 로슈 (Roche) 에서는 gantenerumab 에 뇌
셔틀(brain shuttle) 기술을 적용한 새로운 신약 후보인
RO7126209를 개발하여 임상시험을 진행하고 있다
기존에 개발되던 항 아밀로이드 항체(anti-amyloid antibodies) 의약품들은 단일클론 항체 의약품으로
분자량이 크기 때문에 뇌혈관장벽(blood-brain barrier, BBB)구조의 파괴(BBB disruption)가 일어나지 않으면
BBB를 거의 통과할 수 없었다 기존 항 아밀로이드
항체들의 뇌 분포 용적이 뇌 혈류량과 비슷하다[6]는
사실을 통해서 BBB를 거의 통과하지 못한다는 것을
확인할 수 있다
로슈의 gantenerumab 또한 Aβ 섬유를 표적으로 하는
인간 IgG1 항체로 처음에는 특별한 BBB 통과 전략 없이
개발되어 3상 임상 시험에서 실패했으나, BBB 통과를
위해 이중 항체(bispecific antibody, BSA) 엔지니어링
기술을 적용해 gantenerumab의 BBB 통과 비율 및
뇌에서의 농도를 높임으로써 효과를 개선하였다
1. 이중 항체(Bispecific antibody)란?

이중 항체란 두 가지 서로 다른 타겟에 결합할 수 있는
능력이 있는 항체로, 자연적인 항체는 하나의 항원에
결합할 수 있는 반면에 이중 항체는 서로 다른 항원에
결합하거나 동일한 항원의 서로 다른 항원 결합
부위(epitope)에 결합할 수 있다
현재 이중항체는 주로 두 가지 다른 항체 또는 항체의
절편을 화학적 교차결합(chemical cross-linking)을 통해
연결하거나, 하이브리도마 세포(hybridoma cell)처럼
항체를 생성하는 두 세포를 융합하여 하나의 세포에서
항체를 구성하는 2 가지 형태의 중쇄 및 경쇄를
생성하도록 하는 방식을 통해 제작되고 있다 이때,
항체를 디자인하는 방식에 따라 100가지 이상의 다양한
형태로 개발이 가능하기 때문에 목적에 따라 원하는
형태를 채용하여 항체의 원자가(valency), 배열, 크기, 유연성(flexibility), 약물 동력학적 특성 등을 조절하여
기존 항체 의약품을 개선한 다양한 변화를 시도할 수
있다는 것이 장점이다(그림4)[7] 이러한 장점으로 인해
차세대 항체 치료제를 개발하는 전략으로 주목받고
있으며 트로이 목마 (Trojan horse) 기술 또는 뇌 셔틀(brain shuttle) 기술이라는 이름으로도 불리고 있다
사용되는 이중 항체의 구조 (출처: Kontermann et al., 2015)
2. 뇌 혈관 장벽과 Gantenerumab
BBB에는 인슐린, 트랜스페린(transferrin), 렙틴(leptin), 인슐린 유사 성장인자(Insulin-like growth factors, IGFs)
같은 내인성 펩타이드들의 수송을 위해 세포 표면에서
발현되는 수용체 매개 수송시스템이 있다 [8]
RO7126209는 Aβ fibril에 결합하는 치료용 항체인
gantenerumab과 BBB 통과를 위해 BBB에 발현되는
수용체에 결합하는 항체를 유전적으로 융합해
만들어졌다(그림5)[9]
그림5. BBB에 발현되는 수용체에 결합하는 단일클론 항체
중쇄의 카르복실기 말단에 single chain Fv anti-Abeta 항체를
융합해 만든 이중항체의 구조 (출처: Pardridge et al., 2020)
이 이중항체는 인간 인슐린 수용체(human insulin receptor,HIR)에 대한 단일 클론 항체인 HIRMAb 또는 마우스 트랜스 페린 수용체(transferrin receptor,TfR)에
대한 단일 클론 항체인 TfRMab의 카르복실기 말단에
알츠하이머병에서 타겟이 되는 Aβ 섬유에 대한 치료용
항체의 Single chain Fv(ScFV)를 융합해 만들어졌다[9]
TfRMab 또는 HIRMab에서 유래한 도메인은 BBB에

발현되는 수용체에 결합하여 이 항체를 수용체 매개
endocytosis 방식으로 통과시킨다 (그림6)[9] 이후, gantenerumab에서 유래한 도메인이 뇌 속의 Aβ 섬유에
결합하여 작용하게 되는 것이다 RO7126209는 BBB를
통과하는 이중항체 중 최초로 임상시험에 진입했다는
데에 의의가 있다
한편, 국내 연구 개발사 및 제약회사에서도 이러한
이중항체를 이용한 신약을 개발하려는 시도가 증가하는
추세이다 유한양행, 한미약품, 종근당, 에이비엘바이오, 앱클론, 와이바이오로직스 등이 이중항체 기술을 이용한
의약품을 개발 중이다 그림6. 이중항체 기술을 통해 BBB를 통과하는 Gantenerumab (출처: Roche)
로슈의 Brain shuttle 기술을 통해 Gantenerumab이 트랜스페린 수용체(TfR1)에 결합한 후, BBB를 통과하여 Aβ에 결합한다
Ⅳ. Tau 단백질 표적
현재 개발 중인 tau 표적 치료제들은 tau 단백질이
질환을 일으키는 여러 가지 모델의 각 단계에 작용하여
이를 차단하는 메커니즘으로 작동하며 다양한 전략의
치료제들이 연구되고 있다 1) siRNA 또는 miRNA를
이용하여 tau 단백질의 발현을 감소시키거나 2) tau의
과도한 인산화를 억제하기 위해 tau kinase를 억제하거나
tau phosphatase를 활성화할 수 있으며 3) tau에
특이적인 항체 약물의 개발로 tau의 응집 및 전파를
억제하거나 또는 4) 프로테아좀(proteasome) 자극제
혹은 자가 포식 자극제 등을 개발해 tau 청소율을 높여
tau 단백질의 축적을 피하는 방법 5) 가장 임상 연구가 많이 진행된 tau 응집 억제제를 이용하는 방법 등이 있다
뇌에서 tau 응집체의 침착은 알츠하이머병, 피질 기저
변성 및 진행성 핵상 마비(progressive supranuclear palsy, PSP)와 같은 tau 병증이라고 하는 여러 신경퇴행성
질환의 병리학적 특징이다 병적 tau 응집체의 세포 간
확산이 질병 진행과 주된 관련이 있다고 생각되기 때문에
면역 요법이 tau 병증에 대한 치료법으로 많이 고려되고
있으며 그중 바이오젠에 의해 인수되어 현재
알츠하이머병 치료제로 개발되고 있는 gosuranemab을
간략히 다루고자 한다
1 Tau 특이적 항체 약물 : Gosuranemab
Gosuranemab은 tau 단백질의 N 말단을 표적으로 하는
humanized 단일클론 항체로 tau 단량체
(monomer)뿐만 아니라, tau 섬유, 불용성 tau(insoluble tau) 모두에 높은 결합력을 나타낸다 인간 tau 단백질의
15-22 번 잔기에 결합하며 gosuranemab 의 Fab 와
결합할 때의 tau 펩타이드 전자밀도 지도에서 각 잔기의
표면 접근 가능성을 통해 tau의 15-22번 잔기가 결합 표면에서 가장 중요한 역할을 하는 것을 알 수
있다(그림7)[10]
그림7. Tau와 결합한 IPN002 Fab의 결정 구조
(A) 위에서 본 binding paratope의 표면 부위
(B) Omit 전자 밀도 지도로 구현한 IPN002 Fab와 결합했을
때의 tau 펩타이드 형태 각 잔기의 접근가능성을 퍼센트로
나타내고 있다 (출처: Sopko, R et al , 2020)
처음 gosuranemab이 tau를 표적으로 한 항체의약품으로
개발될 때 희망적이었던 이유는 gosuranemab의 tau와의
결합 특성 때문이었다 Gosuranemab Fab가 인간 tau
isoform 0N4R과 결합할 때의 친화력 및 kinetics를
나타내는 sensorgram을 통해 결합과 해리 상수를 측정한
결과 gosuranemab과 tau가 1:1 kinetic 결합 모델을
형성하는 것을 알 수 있었다(그림8 A)[11] 또한, tau를
표적으로 한 여러 가지 단일클론 항체의 tau-binding
ELISA를 수행한 결과 tau 단량체와 결합하는 항체의 적정
곡선에서, gosuranemab의 결합 친화성이 가장 뛰어난
것으로 나타났다(그림8 B)[11]
그림8. Gosuranemab이 tau에 결합할 때의 특징
(A)0N4R과 결합할 때의 sensorgram (B)ELISA 그래픽 결과 (출처: Sopko, R. et al., 2020)

Gosuranemab을 사용한 병리학적 인간 뇌 균질물 및
형질전환 마우스 간질액(Interstitial fluid,ISF)을 연구한
결과 tau 바이오센서 세포에서 감소한 tau 응집을 초래한
결과가 나왔다 Gosuranemab과 AD-tau의 사전 배양은
마우스의 1차 피질 뉴런에서 tau 응집을 유의미하게
억제했으며 또한 PSP 및 알츠하이머 환자의
뇌척수액(cerebrospinal fluid, CSF) 및 처리된 형질전환
마우스의 ISF 및 CSF에서 결합하지 않은 N-말단 tau를
유의미하게 감소시켰다 이러한 결과는 일부 임상 시험
투여 코호트의 CSF에서 관찰된 >90% 표적 참여와
일치하여 AD 에 대한 잠재적인 치료로서
gosuranemab의 평가를 뒷받침했고 gosuranemab의
임상 2상인 TANGO test는 2018년 5월부터 진행되어
공식적으로 2021년 8월 30일에 위약-대조군 연구 단계가
종료되었다[12]
그림9. Gosuranemab 처리군과 위약군에서의 시간에 따른
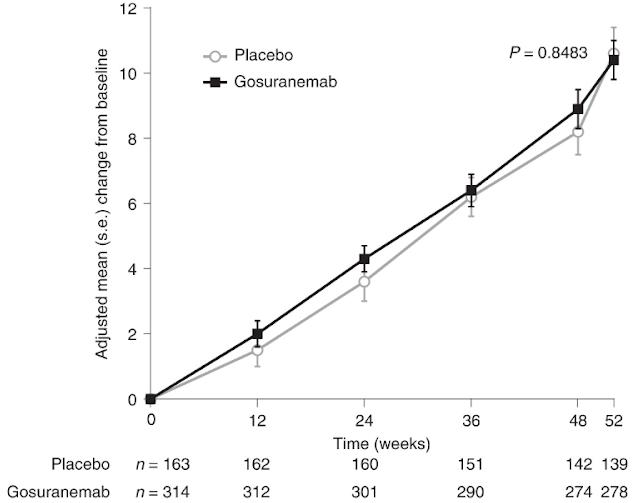
점수 변화 (출처: Tien Dam et al., 2021)
이것은 알츠하이머로 인한 경증인지장애가 있는 환자를 대상으로 gosuranemab의 안전성과 내약성, 유효성 시험하기 위해 수행되었으며 무작위 배정(randomized), 이중 눈가림(double-blind), 위약대조군(placebocontrolled), 병행군 (parallel -group) 설계로
진행되었으나, 다른 tau 타겟 단일클론항체 약품과 마찬가지로 gosuranemab 또한 임상에서 위약군의 결과
임상에서 위약군의 결과와 유의미한 차이를 나타내지
못해 결국 중단되었다 이처럼 면역
요법(immunotherapy) 뿐만 아니라 다양한 메커니즘을
표적으로 하는 다양한 tau 단백질 관련 치료제들이 실제
임상에서 부작용을 일으키지는 않지만 , 유효성이
부족하여 대부분 임상 2상에서 개발이 중단되고 있는
상황이다[13]
2 Tau 응집 억제제[14],[15],[16]
그림10. TRx0237의 분자구조
현재 tau 단백질을 표적으로 하는 알츠하이머 치료제 중
가장 임상 연구가 많이 진행된 메커니즘은 tau 응집
억제제(tau aggregation inhibitor)를 사용하는 방법이다
1세대 tau 응집 억제제에는 Methylthionium이 있으며,
2세대 tau 응집 억제제에는 저분자 의약품에 속하는
TRx0237이 있다
TRx0237은 메틸렌 블루(methylene blue) 유도체에
속하며, 모체인 메틸렌 블루는 원래 말라리아 치료제로
사용되었으나 1996년에 이 유도체가 시험관 내에서
이들은 tau 단량체의 미세소관 결합 부위(microtubule binding region, MBR) 영역에 결합해 tau 단량체끼리의
중합이 일어나는 것을 억제해 알츠하이머병에서 독성을
나타내는 tau 응집체를 형성하는 과정을 억제한다는 것이
알려졌다
현재는 TRx0237에 대한 임상시험인 LUCIDITY가
588명의 알츠하이머병 환자들을 대상으로 12개월간의
이중 눈가림(double-blind), 위약대조군 연구(placebocontrolled study)로 진행 중이며, 이 임상시험은 2023년
6월에 완료될 예정이다
[1] Shi, M., Chu, F., Zhu, F., & Zhu, J. (2022). Impact of Anti-amyloid-β Monoclonal Antibodies on the Pathology and Clinical Profile of Alzheimer’s Disease: A Focus on Aducanumab and Lecanemab. Frontiers in Aging Neuroscience, 14.
[2] https://www.alzforum.org/news/conference-coverage/lecanemab-sweeps-toxic-avprotofibrils-catches-eyes-trialists
[3] Lannfelt, L., Johannesson, M., Nygren, P., Söderberg, L., & Möller, C. (2021, July). Binding profiles to different amyloid-beta species of lecanemab (BAN2401) and other antibodies in phase 3 clinical development for Alzheimer’s disease. In 2021 Alzheimer's Association International Conference. ALZ.
[4] Bayer, T. A. (2022). Pyroglutamate Aβ cascade as drug target in Alzheimer’s disease. Molecular Psychiatry, 27(4), 1880-1885.
[5] De Mattos, R. B., Lu, J., Tang, Y., Racke, M. M., DeLong, C. A., Tzaferis, J. A., ... & Hutton, M. L. (2012). A plaque-specific antibody clears existing β-amyloid plaques in Alzheimer's disease mice. Neuron, 76(5), 908-920.
[6] Boado, R. J., Zhang, Y., Zhang, Y., Xia, C. F., & Pardridge, W. M. (2007). Fusion antibody for Alzheimer's disease with bidirectional transport across the blood brain barrier and Aβ fibril disaggregation. Bioconjugate chemistry, 18(2), 447-455.
[7] Kontermann, R. E., & Brinkmann, U. (2015). Bispecific antibodies. Drug discovery today, 20(7), 838-847.
[8] Pardridge, W. M. (2020). Blood-brain barrier and delivery of protein and gene therapeutics to brain. Frontiers in aging neuroscience, 11, 373.
[9] Pardridge, W. M. (2020). Treatment of Alzheimer’s disease and blood–brain barrier drug delivery. Pharmaceuticals, 13(11), 394.
[10] Wischik, C. M., Harrington, C. R., & Storey, J. M. (2014). Tau-aggregation inhibitor therapy for Alzheimer's disease. Biochemical pharmacology, 88(4), 529-539.
[11] Sopko, R., Golonzhka, O., Arndt, J., Quan, C., Czerkowicz, J., Cameron, A., ... & Hering, H. (2020). Characterization of tau binding by gosuranemab. Neurobiology of Disease, 146, 105120.
[12] Racine, A. M., Rajagovindan, R., Collins, J. A., Kong, J., Li, Y., O'Gorman, J., ... & Shulman, M. (2021). Baseline biomarker (tau PET) characteristics from TANGO: A phase 2 trial of gosuranemab (BIIB092) in early Alzheimer's disease. Alzheimer's & Dementia, 17, e054952.
[13] Dam, T., Boxer, A. L., Golbe, L. I., Höglinger, G. U., Morris, H. R., Litvan, I., ... & Haeberlein, S. B. (2021). Safety and efficacy of anti-tau monoclonal antibody gosuranemab in progressive supranuclear palsy: a phase 2, randomized, placebo-controlled trial. Nature medicine, 27(8), 1451-1457.
[14] Melis, V., Magbagbeolu, M., Rickard, J. E., Horsley, D., Davidson, K., Harrington, K. A., ... & Riedel, G. (2015). Effects of oxidized and reduced forms of methylthioninium in two transgenic mouse tauopathy models. Behavioural Pharmacology, 26(4), 353.
[15] Wischik, C. M., Staff, R. T., Wischik, D. J., Bentham, P., Murray, A. D., Storey, J., ... & Harrington, C. R. (2015). Tau aggregation inhibitor therapy: an exploratory phase 2 study in mild or moderate Alzheimer's disease. Journal of Alzheimer's Disease, 44(2), 705-720.
[16] Baddeley, T. C., McCaffrey, J., Storey, J. M., Cheung, J. K., Melis, V., Horsley, D., ... & Wischik, C. M. (2015). Complex disposition of methylthioninium redox forms determines efficacy in tau aggregation inhibitor therapy for Alzheimer’s disease. Journal of Pharmacology and Experimental Therapeutics, 352(1), 110-118.
현재 알츠하이머병에서 임상적으로 가장 많이 사용되는 것은 증상 완화 치료(symptomatic therapy)지만, 근본적인 질병 완화제제(disease modifying therapy, DMT)인 aducanumab(Aduhelm®)이 등장하면서 치료
스펙트럼이 넓어지고 있다 그러나 ‘아밀로이드 베타의 양을 감소시키는 것이 알츠하이머병 증상을 완화시킨다’는
아밀로이드 베타 가설 자체에 대한 반론이 제기되면서, aducanumab과 같이 아밀로이드 베타를 표적으로 하는
약물의 작용 기전과 그 유효성에도 논란이 이어지고 있다 따라서 우리는 논란의 배경을 이해하고, 새로운 표적
물질을 기반으로 한 치료제 개발 동향을 살펴볼 것이다
조기 진단을 위한 새로운 바이오마커와 진단법에 대한 연구도 계속되고 있다 알츠하이머병은 질병의 특성 상
조기진단이 매우 중요하지만, 현재 사용되는 진단법은 초기 단계에 대한 진단의 정확성이 떨어지고 접근성이 낮은
점 또한 한계로 작용한다 우리는 국내 뿐 아니라 국외에서 진행하고 있는 바이오마커와 진단법에 대한 연구 현황을
살펴보며, 향후 알츠하이머병의 연구가 어떤 방향으로 나아가야 할지 생각해보고자 한다

Ⅰ. 알츠하이머병 치료제 연구 동향
최근 알츠하이머병 치료의 핵심 가설 중 하나인 ‘아밀로이드 베타(amyloid beta, Aβ) 가설’이 논문 조작
논란에 휩싸였다 아밀로이드 베타 가설이 거짓이라면, 아밀로이드 베타 가설에 기반하여 Aβ42를 표적으로 하는
aducanumab 및 아밀로이드를 표적으로 하는 lecanemab, donanemab 등의 유사 신약의 개발에
문제가 있는 것은 아닐까?
?
문제가 되고 있는 것은 2006년에 네이처(Nature)지에 게재된 미네소타 대학(University of Minnesota)의 실뱅 레스네(Sylvain Lesne) 박사의 논문이다 해당 논문은
‘뇌의 특정 아밀로이드 베타 단백질 집합이 기억력을
손상시킨다(A specific amyloid-β protein assembly in the brain impairs memory)’라는 제목으로 치매 질환을
대표하는 레퍼런스 논문으로 인정받아 왔다
 1) 논란이 되고 있는 논문은 무엇인가
1) 논란이 되고 있는 논문은 무엇인가
이 논문은 이전에 알려지지 않았던 올리고머 아밀로이드
베타 스타 56(Aβ*56) 단백질을 분리하여 어린 쥐에게 주
입했을 때, 쥐들이 간단한, 이미 알고 있던 정보를 회상하
는 능력이 감소했다는 내용을 담고 있다 예를 들어, 수중
미로 실험에서 쥐들은 숨겨진 플랫폼(hidden platform)
위에 올라가야 미로를 탈출할 수 있는데 이 위치를 기억하
는 능력이 크게 감소했다[1]
해당 논문은 당시 아밀로이드 및 독성 올리고머 가설이 의
심받기 시작할 때 발표되었는데, 이러한 실험결과가 치매
발병 원인이 Aβ*56 에 있다는 중요한 근거가 되었다 그
후, 이 논문은 학계에서 약 2,300건 인용될 정도로 많이
이미지에 부적절하게 복제된 이미지가 있다고 주장했다
이미지 상의 몇몇 밴드가 비정상적일 정도로 유사성을
나타내고 있다는 것이다 다음의 과정을 통해 이미지
분석을 시행하였다 먼저 , 두 세트의 밴드를 같은
조건에서 비교하기 위해 명암비 (contrast level) 를
일치시켰다 그 후 배경색을 검정으로 바꾸고, 밴드에
색을 입힌 후 정교하게 크기와 방향을 맞추었다 이후, 색을 입힌 밴드를 합쳐 동일한 이미지 영역을 노란색으로
나타나도록 하였다
논문에 의혹을 제기한 것은 미국 밴더빌트 대학 (Vanderbilt University) 의대의 신경과학자 매튜 슈러그
(Matthew Schrag)로 , 국제적 학술지 사이언스(Science)
지를 통해 레스네 박사의 논문의 조작 가능성을 주장했다
[2] 그는 FDA의 aducanumab 승인에 부정적인 입장을

취해온 바 있다
매튜 슈러그 교수는 해당 논문에서 알츠하이머병의 진행
에 있어 Aβ*56의 역할을 부풀리기 위해 이미지를 조작했
을 가능성을 지적했다 이에 사이언스는 자체적으로 이미
지 분석가 및 알츠하이머병 연구자를 조직하여 6개월 간
조사를 진행했고, 2022년 7월 21일, 분석 결과 레스네 박
사의 여러 편의 논문에 포함된 수백 개의 이미지에 의문점
이 존재한다고 발표했다
3) 해당 논문의 논란이 되고 있는 부분은 어떤 것인가? :
논문에 실린 웨스턴 블롯(Western Blot) 이미지를
분석하는 과정이다(그림1) 붉은 점선 박스 안에 있는
밴드의 굵기는 Aβ*56 단백질의 발현 수준을 나타내며, 마우스(mouse)의 나이가 증가하면서 증상과 함께 Aβ* 56 발현이 증가하는 패턴을 보였다 슈러그 교수는 이
그림1. 해당 논문의 웨스턴 블롯 결과 사진에서 복제가 의심되는
밴드를 분석하는 과정 (그래픽 출처: C. Bickel/Science, 데이터 출처: Lesne, S. et al., 2006)
이미지 분석 2) 이미지 조작 의혹 제기합쳐진 두 밴드 간의 유사성을 분석하기 위해 상관
계수(correlation coefficient)값을 계산하였다 그 결과, 동일한 이미지들은 히트맵(Heat map)에서 45° 각도의 직선으로 나타났으며 상관관계는 1이었고, 밴드들은

0 98 의 상관관계를 보였다 ( 그림 2) 이는 우연히 나타났다고 보기 매우 어려운 수치이다
4) 이번 논란이 현재 치매 치료 연구에 중요한 영향을
미칠까?: 전문가들의 의견
그렇다면, 이번 논란이 현재까지 알츠하이머병의 중요한
발병 원인으로 여겨졌던 아밀로이드 가설 및 현재 연구 중
인 aducanumab 등의 치매 치료제 연구에 중요한 영향을
미칠까? 국내외 전문가들은 이번 논문 조작 논란이 현재
치매치료 연구에는 큰 영향을 미치지 않는다는 의견을 내
놓았다
먼저, 해당 논문에서 다루고 있는 Aβ*56은 56kDa 크기
의 아밀로이드 베타 올리고머(Aβ oligomer)로 Aβ42의
십이량체 단백질이다 이는 아밀로이드 베타 올리고머의
그림2. 웨스턴 블롯에서 유사해 보이는 밴드들을 분석한 결과 (출처: Piller, C., 2022. Blots on a field? Science(NewYork,NY), 377(6604))
같은 과정으로 웨스턴 블롯에서 유사하지 않은 두 밴드를
분석하였다(그림3) 병합된 이미지에서 두 밴드의 서로
다른 부분은 각각 빨간색과 초록색으로 나타났는데, 이는
자연적으로 발생된 두 밴드를 비교할 때 나타나는
모습이다 두 밴드 간에도 어느 정도의 상관관계가 있지만, 복제된 두 이미지에 비해서는 훨씬 낮은 상관관계가
나타났다 히트맵에서도 직선 모양이 아닌, 마치 곤충의
날개 모양과 같은 더 흐리고 넓은 형태로 관찰되어 복제가
의심되는 이미지를 분석했을 때와는 큰 차이가 있다는
것을 확인할 수 있다
그림3. 웨스턴 블롯에서 유사하지 않은 두 밴드를 분석한 결과 (출처: Piller, C., 2022). Blots on a field?. Science(New York,NY), 377(6604))
한 종류일 뿐이며, 알츠하이머병에서 현재 개발 중인 아밀
로이드 베타를 타겟으로 하는 신약들은 Aβ*56이 아닌
Aβ42를 표적으로 하고 있기 때문에 그 연관성이 낮다는 의견이다
또한, 현재 아밀로이드 베타 가설이 가설 단계에 머무르는 이유는 아직까지 이를 기반으로 한 치료제가 나오지 않았
기 때문이지, 아밀로이드 베타와 치매의 진행에 관한 연구
가 부족하기 때문이 아니다 해당 논문이 발표된 이후에도
많은 연구를 통해서 아밀로이드 베타와 치매에 관한 연구
들이 진행되어 왔다
끝으로, 최근 개발 중인 알츠하이머병 치료제들은 아밀로
이드 베타 단백질만을 단독으로 표적으로 하는 경우는 거
의 없으며, 아밀로이드 베타 이외에도 다양한 작용기전에
대한 연구가 이루어져 이들을 대상으로 하고 있기 때문에
큰 영향을 받지 않을 것이라는 주장도 있다[3]
새로운
뇌의 성상세포(astrocyte)와 미세아교세포(microglial cell)는 중추신경계의 항상성 유지 및 면역 반응에
기여한다 특히 미세아교세포는 뇌 내 대식세포 역할을
수행하며 외부 물질을 인식 제거하고 여러 신경 물질을
분비하여 항상성 유지에 크게 기여한다 그러나
지질다당류 (lipopolysaccharide) 나 바이러스 외부
단백질인 gp120, 아밀로이드 베타 관련 단백질 등에 의해
미세아교세포가 과활성되면 과도한 산화 스트레스와
신경염증 반응을 야기한다 이는 신경세포 손상을 유발해
알츠하이머병을 비롯한 퇴행성 신경 질환을 일으킬 수
있다 [4] 알츠하이머병 치료제의 새로운 타겟으로
신경아교세포와 관련된 다양한 대사와 물질에 관한
연구가 이루어지고 있다
현재 알츠하이머병 치료제 개발을 위한 미세아교세포
관련 연구는 전장 유전체 연관 분석(genome-wide association study, GWAS)을 통해 활발히 진행되고
있다 GWAS 는 모든 유전체 위치에 대해서
알츠하이머병과 같이 관심 있는 형질에 연관성을 가진
후보 유전자 위치를 탐색하는 방법으로, 특정 환자와
건강한 대조군의 유전자를 분석한 후 환자군에서 더 많이
나타나는 1 단일염기 다형성 (single nucleotide
polymorphism, SNP)을 찾아낸다 아래 소개하는 치료제
표적인 키뉴레닌(Kynurenine) 대사 경로와 CD33 및
TREM2 외에도 미세아교세포의 포식 작용에 관여하는
toll 유사 수용체(toll-like receptor), CD14 등 다양한 microglial target이 GWAS를 통해 연구되었다[5]
현재 항우울제 등으로 사용되는 세로토닌 재흡수
억제제를 제외하고는 키뉴레닌 경로 자체를 표적으로 한
시판 약물은 존재하지 않는 상황이다
키뉴레닌 경로는 트립토판이 인돌 2,3-이산소화효소 (indole-2,3-dioxygenase, IDO) 또는 트립토판 2,3이산소화효소 (tryptophan-2,3-dioxygenase, TDO) 에
의해 N-폼일키뉴레닌(N-formylkynurenine)으로 대사된
후, 빠르게 L-키뉴레닌으로 전환되는 것이 첫 단계다 이후
키뉴레닌의 대사는 뇌에서 중추신경계 질환에 기여하는
다양한 신경 활성 물질을 생성한다 생성물은 세포의
종류에 따라 다르게 나타난다 성상세포는 키뉴레닌
아미노전이효소 (kynurenine aminotransferase, KAT) 를 발현하여 뇌의 신경 보호 대사물질인

키뉴렌산(kynurenic acid, KYNA)의 주요 공급원이 되며,
미세아교세포는 키뉴레닌 3-일산소화효소(kynurenine 3-monooxygenase, KMO)를 발현하여 키뉴레닌이 3하이드록시키뉴레닌 (3-hydroxykynurenine, 3-HK),
퀴놀린산(quinolinic acid, Quin)과 같은 신경독성 물질로
전환되도록 촉진한다(그림4)
키뉴레닌 (Kynurenine, KYN) 대사 경로 는 트립토판(Tryptophan, Trp)의 대사 경로 중 하나로, 알츠하이머병을 비롯한 여러 가지 질병과 연관되어 있다
IDO, indole-2,3-dioxygenase; TDO, tryptophan-2,3-dioxygenase; KAT, kynurenine aminotransferase; KYNA, kynurenic acid; KMO, kynurenine 3monooxygenase; 3-HK, 3-hydroxykynurenine; Quin, quinolinic acid
4. 트립토판 키뉴레닌 대사 경로 (출처: Biber et al., 2019)
알츠하이머병 환자의 경우 해마, 미세아교세포, 성상세포, 뉴런 모두에서 IDO 발현이 증가한다 플라크나 신경섬유
엉킴 근처에서 quin의 증가도 공통적으로 확인된다[6]
이는 quin 이 알파 - 시누클레인(α-synuclein) 응집을
촉진하여 tau 과인산화(tau hyperphosphorylation)를
유도할 수 있다는 연구 결과와 일치한다[7]
다만, KMO를 비롯한 신경독성 KYN 효소의 중추신경계
억제 약물의 가용성이 해결되야 할 문제로 남아있다
말초에서 KMO를 표적으로 한다면 KYN이 증가하게 되며, KYN이 뇌로 수송되어 KYNA 등으로 전환될 수 있기
때문이다 이는 오히려 중추신경계에서 신경 손상을
증가시키는 결과를 초래할 수 있다 특히 알츠하이머병
환자의 경우 KYN이 신경독성물질로 보다 쉽게 전환되기
때문에, 높은 중추신경계 침투성을 가진 효소 억제제
개발이 추가 연구과제로 남아있다 여전히
알츠하이머병의 발병 및 진행에 있어 KYN 대사 물질의
역할에 대한 이해가 부족하다는 점 또한 한계로 보인다
알츠하이머병 환자들의 경우, 대뇌 피질에서 CD33의
발현과 아밀로이드 병증 사이에 양의 상관관계를
확인하였다 CD33의 기능과 미세아교세포에서 Aβ 플라크 섭식 능력은 반비례 관계에 있으며 , 미세아교세포의 CD33 발현 증가가 아밀로이드 병증을
촉진한다[9]
한편 , TREM2(Triggering Receptor Expressed on Myeloid Cells 2) 라는 수용체는 미세아교세포의 식세포
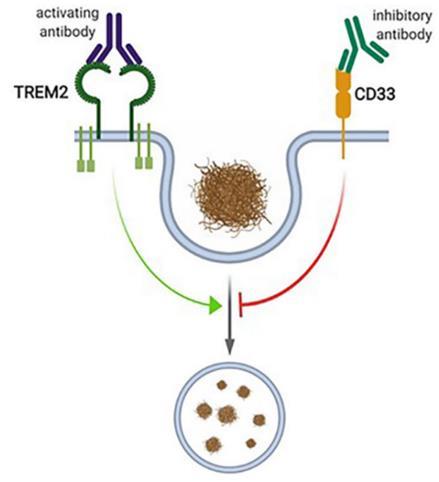
작용 조절에 CD33 과 반대되는 작용을 한다
미세아교세포에서 TREM2와 그 희귀 돌연변이의 발현이
알츠하이머병의 발병률과 대응되는 것도 확인되었다[10]
현재는 TREM2에는 활성화시키는 항체를, CD33에는
억제성 항체를 사용하는 개입 방법이 알츠하이머병을
치료 및 완화하는 방법으로 제안되고 있다(그림5)
CD33은 골수세포와 뇌의 미세아교세포에서 발현되는
억제성 면역 수용체로 시알산에 결합하는 세포표면의
렉틴 단백질이다(sialic acid-binding immunoglobulinlike lectins, siglec) 리간드가 결합하고 Src
인산화효소 (Src kinase) 가 티로신 (tyrosine) 을
인산화하면 CD33 수용체가 활성화된다 이후 SHP ½(SH2-containing tyrosine phosphatase) 를
불러들이며, 이에 따라 신호 전달 경로의 탈인산화 및 억제가 이루어진다
2011년에 진행된 GWAS 연구에서 특정 자리에 생기는
SNP 중 알츠하이머병을 예방하는 CD33 대립유전자의
존재가 밝혀졌다 CD33m(rs12459419T, D2CD33)이라 불리는, 리간드와 결합하는 부분이 절단된
형태의 기능을 상실한 CD33 이 발현되면
미세아교세포에서 전반적인 CD33 기능 저하가 일어난다[8]
그림5. TREM2와 CD33의 식세포 작용 조절 (출처: Biber et al., 2019)
알츠하이머병 치료제 표적으로서 CD33와 TREM2의
가능성이 충분히 제시되었지만 여전히 넘어야 할 산들이
많다
CD33의 연구는 다음와 같은 문제로 난항을 겪고 있다
먼저, CD33에 대한 리간드를 찾기 어렵다 CD33 결합에
관여하는 결합 당사슬(glycan binding)은 다른 결합에
2) CD33 & TREM2비해 상대적으로 친화도가 낮으며, 충분한 친화도를
위해서는 다가성(multivalency)이 필요하다 CD33와
결합하는 특정 시알산이 발견되었지만, 이와 결합된
당단백질은 확인된 바 없다 또한, CD33은 종 간 차이가
크다 사람의 CD33 신호전달은 두 가지 세포 내
도메인 (intracellular domain) 으로 구성되는 반면 , 마우스에는 그 중 하나인 ITIM 유사 도메인(ITIM-like domain)만 존재한다 이러한 종 간 차이로 인해 적절한
동물 모델의 선정도 쉽지 않다 CD33 연구에 사용할
리간드 및 분석 도구가 부족하다는 점 또한 문제다 실험
결과를 분석할 도구의 부족으로 CD33의 기능적 저해제
개발이 더디어지고 있는 것이다
TREM2 도 크게 세 가지의 치료제 개발 방향성이
제시되고 있지만 모두 추가적인 연구가 필요한 상황이다
- TREM2 기능의 직접적 증진을 통한 식세포 작용 조절은
현재 연구 수준에서는 실질적으로 매우 어렵다
- 세포 표면에서 TREM2를 안정화시키거나 단백질
분해 절단 및 방출을 차단하는 항체를 사용하는 것도
하나의 방법이다 다만, 이러한 항체를 발견하는 것이
어렵고, 여전히 해당 연구가 진척되지 않은 상태이다
- TREM2 전사 조절 인자(regulatory factor)의 변화를
통해 TREM2 기능을 조절할 수 있을 것이다 단, 원치
않은 부가적 효과는 차단하는 특이적인 조절이나 신호
메커니즘이 보고되지 않았기에 TREM2 자체에 관한
연구가 더욱 진행되어야 할 것으로 보인다
또한, 실제로 알츠하이머병의 발병 위험을 증가시키는
TREM2 돌연변이를 가진 환자는 매우 소수라는 점에서
해당 약물 개발의 효용성에 관해서도 재고해 볼 필요가
있다
국내 제약사의 알츠하이머병 치료제 개발
국내 제약사인 젬백스앤카엘(이하 젬백스)에서
‘GV1001’으로 알츠하이머병 치료제를 개발 중에 있다
젬백스는 GV1001이 알츠하이머병에서 치료제로
작용하는 기전으로 다음 3가지를 꼽는다
1) 아밀로이드 베타의 축적 억제
2) Tau 과인산화 억제
3) 신경 보호 효과
GV1001은 다양한 작용을 갖는 아미노산 16개로
구성된 펩타이드이다 인간 텔로머레이스 역전사효소
(human telomerase reverse transcriptase, hTERT) 의 extra-telomeric 기능을 모방하는
방식으로 다양한 작용을 하는 것으로 보인다
hTERT의 extra-telomeric 기능에는 세포 증식 유도, 세포자살 억제, 미토콘드리아 안정화, 항노화, 항산화
효과 등이 있다 또한 아밀로이드 베타에 의한
활성산소의 생성과 염증반응을 억제하는 효과도
갖는다 즉, 지금까지의 알츠하이머병 치료제와는
다르게 다양한 작용기전을 갖는 신개념 치료제인
것이다
젬백스에서 제출한 GV1001의 알츠하이머병에 대한
효능에 관한 보고서를 참고하여 비임상 실험 결과를
정리하였다(표1)[11] 시험관 내 연구(in vitro)에서, GV1001 은 생존인자 (Ki67, PI3K 등 ) 의 발현을
증가시키고 사멸인자(Bax, GSK-3β 등)의 발현을
억제하여 아밀로이드 베타에 의한 뇌세포의 사멸과
활성산소 생성을 억제하고 신경 줄기세포의 증식을
촉진시켰다 생체 내 연구(in vivo)에서는 GV1001이
아밀로이드 베타 와 tau 의 축적을 막고
텔로머레이스의 활성을 증가시켜
안정화하는 효과가 있음을 확인하였다
신경세포를
In vitro (세포 모델)
Aβ Aβ + GV1001
뇌세포 사멸 증가
사멸 저해; 생존인자 발현 증가 & 사멸인자 발현 억제
활성산소 생성 증가 감소
신경세포로 분화
Aducanumab 의 임상시험에서는 CDR-SB, MMSE, ADAS-Cog 와 같은 설문지를 유효성 평가 변수로
활용하였다 하지만 이러한 설문지를 바탕으로 한 인지
기능의 평가는 검사자의 주관적 소견이 개입될 수 있기
때문에 보다 객관적으로 알츠하이머병의 진행 및 인지
기능 저하 정도를 판단할 수 있는 바이오마커
줄기세포 분화
감소 & 성상세포로 분화 증가
신경세포로의 분화를 증가시킴
In vivo (AD mouse 모델) 대조군 양성대조군 실험군 saline donepezil GV1001
기억, 학습 평가 (2수동회피실험)(25초)
향상 (103초) 향상 (130초)
Aβ, Tau - 감소 감소
활성 성상세포50% 이상 감소 50% 이상 감소
텔로머레이스 - 활성 증가 활성 증가 표1. GV1001의 비임상 실험 결과
비임상 시험으로 얻은 결과를 바탕으로 임상 2상을
진행하고 있다 ‘GV1001’은 현재 국내 임상 2상을 진행
중이고, 2022년 1월에 식약처에서 국내 임상 3상 시험을
승인 받았다 또한 2019년 5월 FDA 승인을 받아 미국
임상 2상 시험을 진행할 예정이다
젬백스는 알츠하이머병이 복잡하고 다양한 기전으로
발병되기 때문에 다양한 병리 기전에 작용하는
‘GV1001’이 알츠하이머병 치료제로서 성공 가능성이
높다고 평가하고 있다
(biomarker)의 필요성이 대두되고 있다 뿐만 아니라, 특이도 및 정밀도가 높은 바이오마커는 생체 내
병태생리와 관련된 객관적이고 유용한 정보를 제공할 수
있고 질병 초기 단계에서 정확한 조기진단을 할 수 있게
해주는데 , 초기 단계에서의 치료가 중요한
알츠하이머병의 경우 특히 그 중요도가 높다고 할 수 있다
현재까지 개발된 알츠하이머병 바이오마커의 종류와 그
특징 및 한계에 대해서 알아보고자 한다
1 현재 개발된 바이오마커에는 무엇이 있는가?
알츠하이머병 환자에서는 아밀로이드 플라크의 축적, tau 단백질의 과인산화 및 신경 손상이 특징적으로
일어난다 현재까지 개발된 바이오마커는 이러한
알츠하이머병의 병태생리를 이용하므로 , 어떠한
병태생리기전을 이용하느냐에 따라 A(아밀로이드 베타 플라크 , amyloid beta plaque), T(tau 병리 , tau pathology), N( 신경변성 , neurodegeneration) 으로
나눌 수 있으며 이를 ATN 분류체계라고 한다 이와 같은
병태생리 기전을 확인할 수 있는 바이오마커는 PET와 같은 영상기술로 확인하는 방법, 뇌척수액 그리고 혈중의
바이오마커 농도로 확인하는 방법 순으로 발전해
왔다(그림6)[12] 여기서 이상적인 알츠하이머병의
바이오마커는, 알츠하이머병 증상의 본격적인 시작 전에
진단을 가능케하여 그 치료 효과를 증대시키고, 덜
침습적이며, 경제적이어야 하고, 다수의
그림6. 알츠하이머병 바이오마커 개발의 역사 (출처: Mankhong et al., 2022)
1) 신경 영상(Neuroimaging)
알츠하이머병의 연구와 진단에 사용되는
이미징(imaging) 기술은 크게 구조적 이미징(structural imaging), 기능적 이미징(functional imaging), 그리고
분자적 이미징 (molecular imaging) 으로 나눌 수
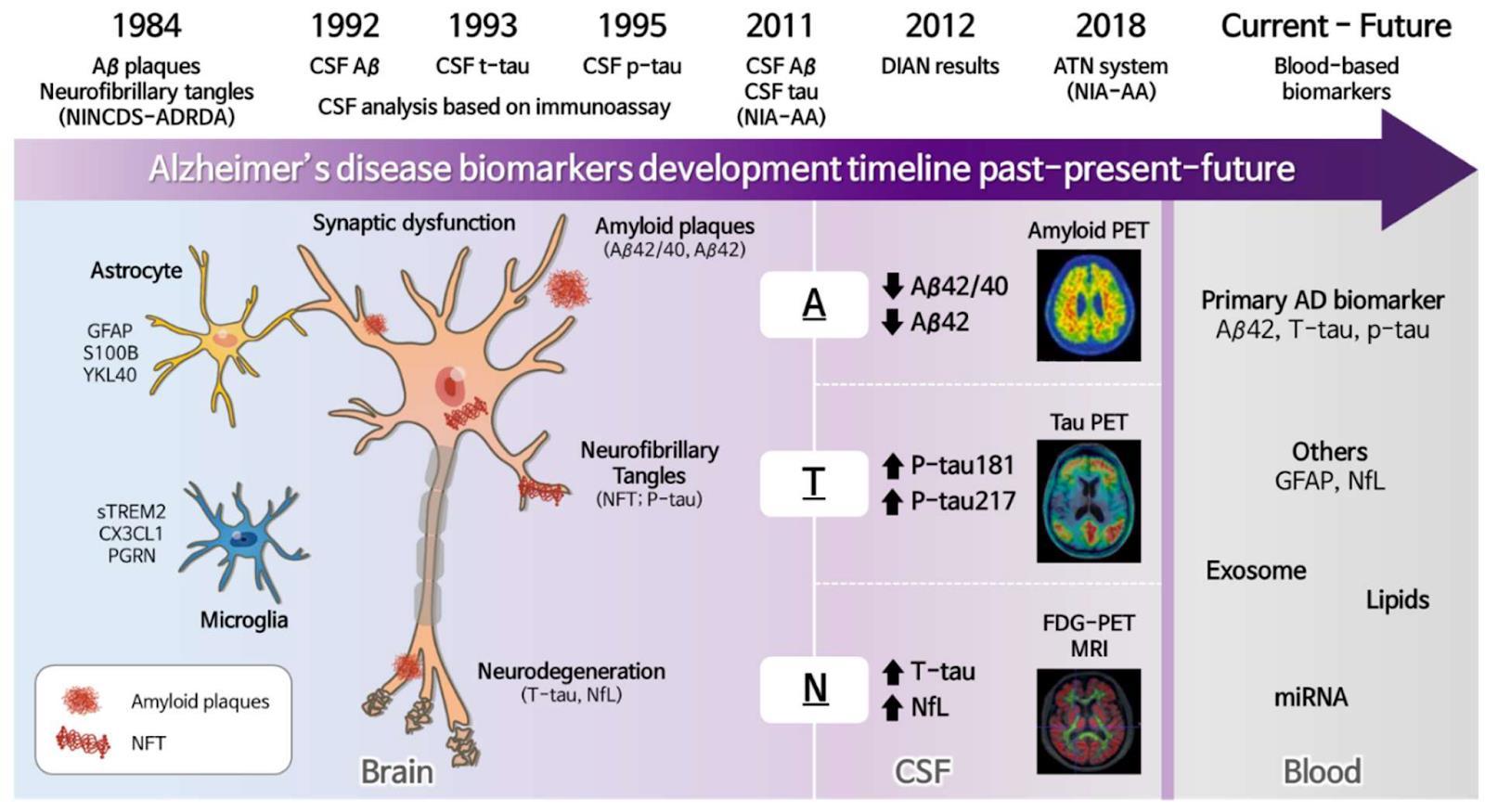
있다[14]
구조적 이미징(Structural imaging)은 MRI(Magnetic resonance imaging)나 CT(Computed tomography)
등을 일컫는 이미징 기술로, 뇌 조직의 모양, 위치, 부피
등에 대한 정보를 제공한다 알츠하이머병 환자의 경우
해마 및 내측 측두엽의 위축이 발견된다 따라서 구조적
이미징을 통해 뇌 내 특정 부위의 위축을 관찰하면
알츠하이머병의 진단에 활용할 수 있다
기능적 이미징(functional imaging)은 뇌세포가 당 또는
산소를 얼마나 활발히 사용하는지를 보여줌으로써 뇌
내의 어떤 지역이 어떻게 작동하고 있는지를 보여주며,
이에 포함되는 기술로는 PET(Positron emission tomography)나 fMRI(functional MRI) 등이 있다 이는
뇌 내의 당 대사나 산소 이용도를 시각적으로
확인함으로써 알츠하이머병 진단을 가능케 한다
마지막으로 분자적 이미징(molecular imaging)은 특정
분자에 대한 표지자를 이용해 알츠하이머병에서 나타나는
뇌 내의 아밀로이드 플라크, 인산화된 tau 단백질, 신경손상 등을 측정하는 기술이며, 이때 표지자와의
결합을 주로 PET 와 같은 영상기술로 관찰한다
아밀로이드 플라크와 같이 알츠하이머병에서 나타나는
특징적인 구조를 시각적으로 바로 관찰할 수 있어 최근
주목받고 있다 다음은 PET 이미징을 활용하여 정상인과
알츠하이머병 환자의 뇌를 촬영한 결과이다(그림7)[15]
그림7. 정상인과 알츠하이머병 환자의 PET imaging 결과 (출처: Thientunyakit, T. et al., 2022)
하지만 이러한 영상 기술 중 정확도가 가장 높은 PET는
비용이 상대적으로 높아 환자 접근성이 낮기 때문에
다양한 환자들을 대상으로 상용화될 수 없다는 단점이
존재한다 이러한 한계를 극복하기 위해 체액에 존재하는
바이오마커에 대한 연구가 진행되고 있다
뇌척수액 장벽(blood-CSF barrier)이 분자 및 단백질의
수송을 제한하기 때문에 CSF는 질병의 스크리닝과
모니터링에 도움을 주는 신경 퇴행성 장애 표지자를
검출하는 데 유용하다 알츠하이머병에 대한 CSF
바이오마커로는 Aβ, tau, 미세신경섬유 경쇄 (Neurofilament light chain, NfL),
2) 체액을 이용한 바이오마커 - 뇌척수액과 혈액을 중심으로
앞선 설명처럼, 알츠하이머병 환자에서는 아밀로이드
플라크의 축적, tau 단백질의 과인산화, 신경 손상 등이 특징적으로 일어난다 체액을 이용한 바이오마커는
이러한 알츠하이머병 특이적 지표를 이용한다(그림8)
(1) 뇌척수액 바이오마커 (CSF biomarker)[16]

뇌척수액(cerebrospinal fluid, CSF)은 뇌에서 생성되어
뇌와 척수를 순환하는 액체로, 뇌의 생화학적 변화를 반영하는
뉴로그라닌 (neurogranin), 용해성 TREM2(soluble TREM2, sTREM2) 등이 있다
알츠하이머병 환자에서는 아밀로이드 플라크의 형성으로
Aβ가 뇌 내에 축적되기 때문에 CSF나 혈청(plasma)
수준에서는 Aβ가 오히려 감소하게 되는데, Aβ의 여러
동형(isoform) 중에서도 Aβ42가 특징적으로 감소한다
하지만 Aβ42만을 바이오마커로 이용하게 되면 개인별
절대적인 양의 차이 존재에 따라 오차가 생길 수 있다
이러한 개인별 편차를 보정하기 위해 알츠하이머병
유무와 상관없이 그 농도가 거의 일정하게 유지되는
Aβ40 값과 비교하여 Aβ42/Aβ40 비율 (Aβ42/Aβ40
ratio)을 바이오마커로 활용한다 또한 Aβ 펩타이드의
그림8. 알츠하이머병 환자에서의 바이오마커의 주요 CSF 및 혈중 농도 변화 및 관련된 병리학적 기전 (출처: Teunissen et al., 2022)
다른 절단된 형태인 Aβ37, Aβ38, Aβ39 등은 진단에 있어
추가적인 정보를 제공할 수 있는데, Aβ42/Aβ38 비율은
알츠하이머병 예측에 있어 Aβ42/Aβ40 비율과 비슷한
정확도를 보인다 하지만 Aβ 바이오마커는 개인 간의 차이
등의 한계로 인해 일상적인 임상 현장에서의 사용은 아직
초기 단계에 있다
Tau 단백질은 정상적인 상태에서는 신경 섬유의
미세소관에 결합하여 미세소관을 안정화시킨다 하지만
알츠하이머병의 경우 인산화효소 (kinase) 와
인산가수분해효소(phosphatase)의 불균형으로 tau
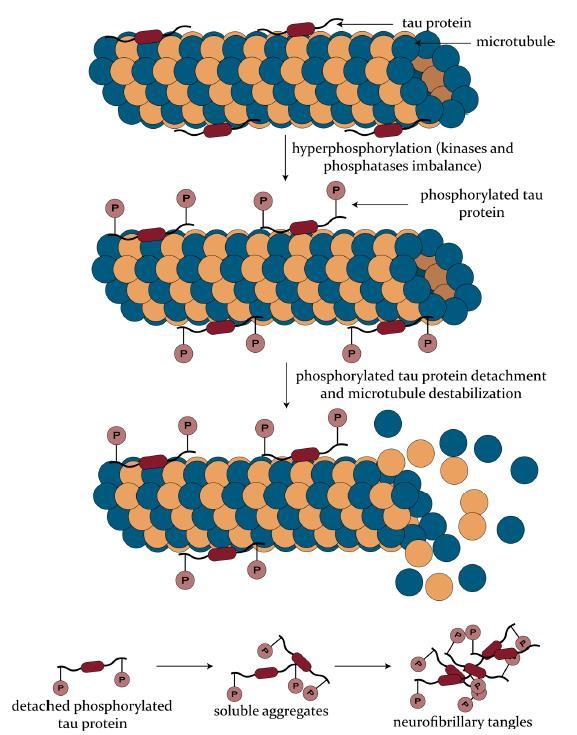
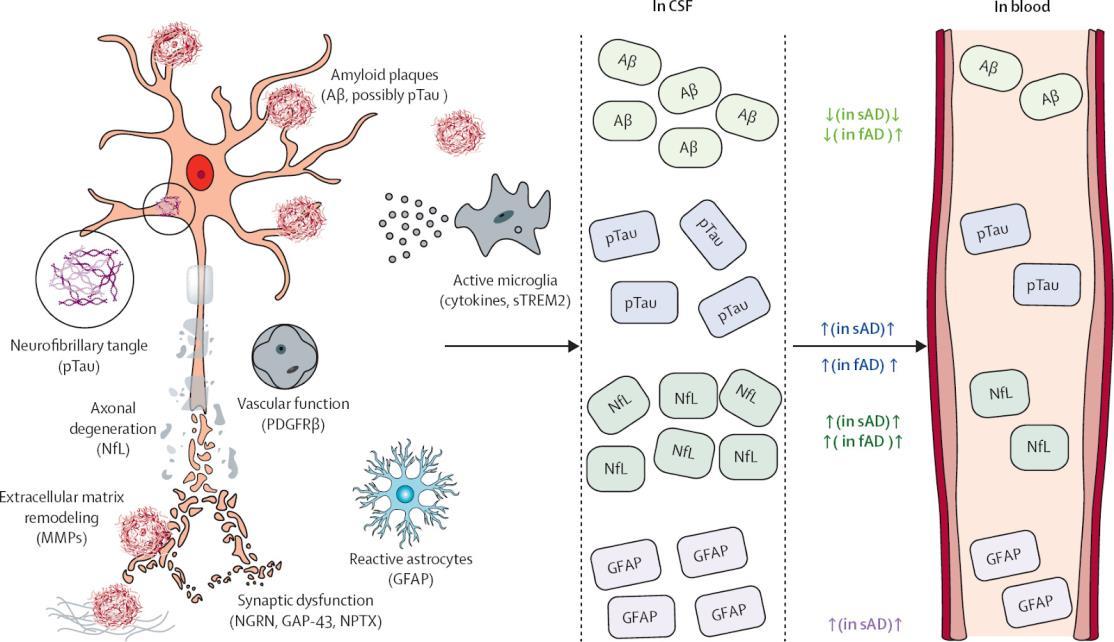
단백질에 과인산화가 발생하고, 이에 따라 과인산화된
tau 단백질 , 즉 P-tau(phosphorylated tau) 는
미세소관에서 떨어진다(그림9) 따라서 알츠하이머병
환자의 CSF 에서는 P-tau 단백질이 증가한다
알츠하이머병 환자에서 T-tau(total tau) 농도는
200 300% 증가하지만, 뇌졸중이나 크로이츠펠트
Aβ와 tau 단백질 이외에, 최근 몇 년 동안 신경 손상과
관련된 NfL, 시냅스의 기능장애나 손실과 관련된
뉴로그라닌, 신경염증과 관련된 sTREM2 등과 같은
알츠하이머병의 병리학적 기전과 관련된 새로운
바이오마커가 등장했다
미세신경섬유 경쇄(Neurofilament light chain, NfL)는
신경섬유의 중심을 구성하며 중추신경계 내에서
축삭돌기를 둘러싸는 미엘린 구조에 필수적인 삼중
단백질이다 뇌척수액 내에서의 NfL의 존재는 축삭
손상에 특이적이기 때문에 NfL 농도 상승은 신경퇴행성
장애, 특히 알츠하이머병 환자에서 널리 보고된다
뉴로그라닌(neurogranin)은 뇌에 존재하는 시냅스 후
단백질로 칼모듈린, 칼슘 신호 전달, 기억 형성의 주요
조절자이다 부검 연구 결과 알츠하이머병 환자의 뇌에서
뉴로그라닌 수치는 감소했고 CSF에서는 뉴로그라닌
수치가 증가했으며 , 이를 통해 뉴로그라닌과
알츠하이머병 간의 상관관계의 가능성을 보였다 또한
뉴로그라닌은 경도인지장애(mild cognitive impairment, MCI)단계에서도 초기의 병리학적 변화를 감지하고
알츠하이머병과 관련된 인지 저하를 예측 및 모니터링할
수 있다는 점에서 전증상 (pre-symptomatic)
바이오마커로서의 역할을 기대할 수 있다
용해성 TREM2(soluble TREM2, sTREM2)는 CSF에서
측정 가능한 미세아교세포의 활성 지표로 , 미세아교세포의 역학(dynamics)을 조절하고 이후의
아밀로이드 플라크 형성 및 시냅스 가소성에 관여한다
따라서 CSF에서 sTREM2의 증가는 알츠하이머병의
병리에 대한 보호 반응과 관련되어 있으며, 잠재적인 바이오마커 역할을 할 수 있다
(2) 혈액 내 바이오마커(Plasma biomarker)
CSF 바이오마커의 가장 큰 한계는 뇌척수액을 검출하기
위해 요추천자(lumbar puncture)를 이용한 침습적인
방법으로 검사가 진행되어야 한다는 사실이다 따라서
환자 접근성이 떨어진다는 단점이 있다 이에 따라 최근
연구에는 혈액 내 바이오마커(plasma biomarker)들을
발굴하려는 노력이 계속되고 있다 연구되고 있는 혈액 내
바이오마커에는 Aβ, tau, NfL 등이 있다
Aβ 바이오마커의 경우, 알츠하이머병 환자에서 감소하는
혈청 Aβ42/Aβ40 비율을 사용하는 것이 많이 연구되어
있다 앞에서의 설명과 같이, 알츠하이머병 환자의 CSF나
혈청에서의 Aβ는 아밀로이드 플라크의 형성으로 그
농도가 감소하게 된다 하지만, CSF 수준에 비해 혈액
수준에서의 Aβ42/Aβ40 비율은 그 감소량이 확실하지
않아 측정 시 나타날 수 있는 실험적 오차에 의해 많이
영향을 받을 수 있다는 단점이 있다 구체적으로, Aβ42/Aβ40 비율은 알츠하이머병 환자의 CSF
수준에서는 약 40-60% 정도 감소하는 데에 반해, 혈액
수준에서는 약 10-20% 밖에 감소하지 않는다 따라서
바이오마커로 혈청 Aβ42/Aβ40 비율을 단독으로
사용하는 것은 정확성이 떨어질 수 있다 이를 보완하기
위해 tau, NfL 등의 다른 바이오마커와 병용하는 것이
권고된다
혈청 중의 증가된 과인산화된 tau 단백질(P-tau)을
바이오마커로 활용할 수 있다 CSF 수준에서와 같이, 알츠하이머병 환자에서는 혈청 수준에서도 과인산화된
tau 단백질이 미세소관에서 떨어져 혈청 중 농도가
증가하게 된다 그 중에서도 특히 P-tau 181, 217, 231이 증가하기 때문에 이들을 주된 바이오마커로
활용한다 P-tau는 치매의 감별진단, 경도인지장애
환자에서의 인지 감소 예측에서 높은 정확도를 보이는
것을 확인할 수 있었다 또한 인지적 퇴화가 일어나지 않은
환자에서 알츠하이머병으로 인한 치매 또는 인지 감소를
예측하는 데에도 높은 정확도를 나타냈다 P-tau는 혈청
바이오마커 중 알츠하이머병의 전 진행 단계에 걸쳐
사용할 수 있는 가장 중요한 바이오마커인
것이다(그림10)[17]
신경 세포 손상 시 CSF 및 혈액 수준에서 그 값이
증가하는 NfL을 알츠하이머병의 바이오마커로 활용할
수도 있다 하지만 이는 알츠하이머병뿐 아니라 근위축성
측색 경화증(amyotrophic lateral sclerosis, ALS)과 같은
다른 신경퇴행성 질환에서도 증가하기 때문에 , 알츠하이머병을 감별 진단하는 데에 활용하기보다는
환자가 알츠하이머병임이 확실시 되었을 때 질병 진행 시 신경 퇴행 정도를 측정하는 방법으로 활용될 수 있다
이러한 혈중 바이오마커들은 침습적이지 않다는 면에서
CSF보다 환자 접근성이 높지만, 이에 대한 연구가 아직
많이 없어 임상적으로 사용되기 위해서는 검증이 필요한
단계에 있다 또 , 검출하고자 하는 단백질 바이오마커들이
혈중에 높은 농도로 존재하지 않고 , 혈중
프로테아제 (protease) 존재 등으로 인해 CSF

바이오마커에 비해 검출이 어렵다는 단점이 존재한다[18]
그림10. 알츠하이머병의 각 단계에서 활용될 수 있는 혈중 바이오마커 (출처: Leuzy, A. et al., 2022)
앞에서 언급한 바이오마커를 비교한 표이다(표2) 지금까지 알츠하이머병에 대해 다양한 바이오마커가 개발되었지만, 아밀로이드 베타 이외의 바이오마커는 아직 임상에서 적용하는 단계에 도달하지는 못했다 이에 따라 연구단계에서
아밀로이드 관련 바이오마커보다 그 정확성과 활용도가 더 높을 것으로 밝혀진 tau 단백질 관련 바이오마커가 임상적으로
활용될 수 있도록 그에 맞춘 진단법 및 관련 연구가 필요할 것으로 생각된다 더불어, 새로운 바이오마커가 알츠하이머병의 진단에 활용되기 위해서는 각각이 극복해야 할 한계가 존재함을 확인할 수 있었다 따라서 보다 정확한 알츠하이머병의 조기 진단으로 치료 효과를 높이고, 개발 중인 약물의 효과를 정확히 판단하기 위해서 바이오마커 분야에서 활발한 연구 및
혈액 내 바이오마커
- 침습적 방법으로
- 알츠하이머병에서 농도
감소(약 40~60%)
- Aβ42/Aβ40 ratio,
Aβ42/Aβ38 ratio 사용
- 알츠하이머병에 대한
감별 능력 높음
- 알츠하이머병에서
농도 증가
- 질병의 진행정도를
잘 반영
- NfL 농도 측정 - 신경퇴행성 질환 (ex. 알츠하이머병)
에서 농도 증가 - 알츠하이머병과 다른
신경퇴행성 질환의 감별
진단 어려움
- 진행된 연구 수
적어 신뢰도 낮음
- 낮은 단백질
농도로 인한
검출의 어려움
- 알츠하이머병에서 농도
감소 (약 10~20%)
- 감소율 확실하지 않아
실험적 오차로 인한
위양성 판정 가능
- 알츠하이머병에서
농도 증가
- P-tau 181, 217, 231
사용
- 혈액 내 바이오마커 중
활용도 가장 높음
표2. 알츠하이머병에 대한 바이오마커
참고
▶ 바이오마커로 활용되는 miRNA
최근에는, 앞서 설명된 단백질 바이오마커 외에도 혈중을 순환하는 miRNA에 대한 연구 또한 활발히 진행되고 있다
miRNA(microRNA)는 전사 후 유전자 발현에 관여하는 21-25개의 뉴클레오타이드로 이루어진 rRNA로 , 리포솜이나 지질단백질(lipoprotein)과 같이 miRNA의 분해를 막는 단백질과 함께 혈액을 순환한다고 알려져 있다 이러한 miRNA 중 알츠하이머병을 95%의 정확도로 감별, 진단할 수 있는 7개의 miRNA (hsa-let-7d-5p, hsa-let7g-5p, hsa-miR-15b-5p, hsa-miR-142-3p, hsa-miR-191-5p, hsa-miR-301a-3p, hsa-miR-545-3p)가 밝혀져
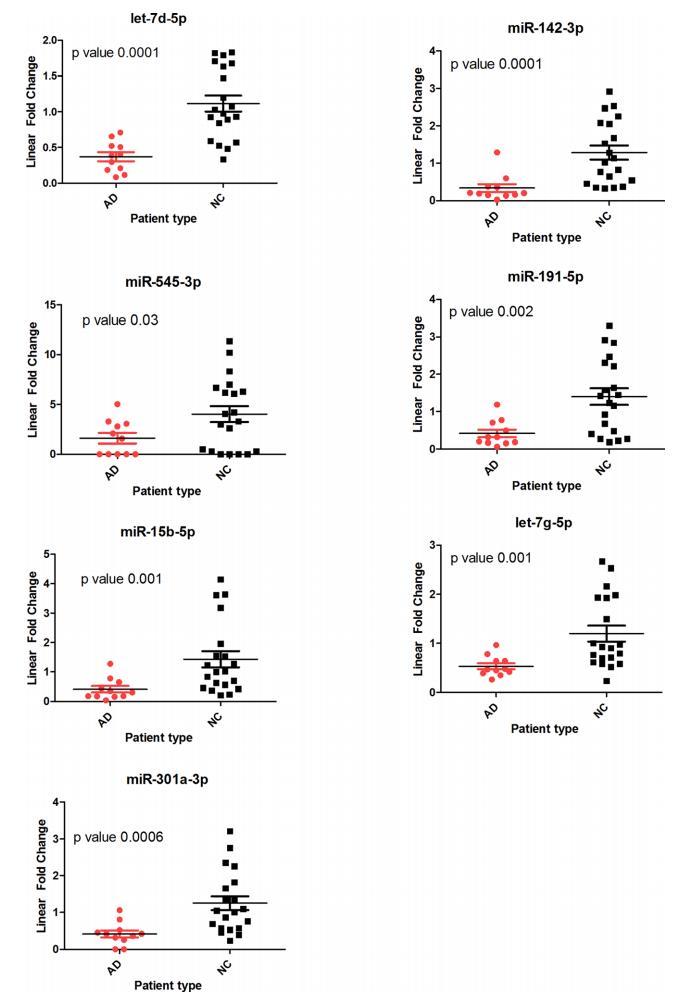
있다 종류에 따라 정도의 차이가 있지만 이들은 대체적으로 알츠하이머병 환자에게서 약 2-3배 정도 하향
조절(down-regulation) 되어 있음이 밝혀졌다(그림11)[19] 이러한 바이오마커들은 침습적이지 않으며, 조기
진단이 가능하여 알츠하이머병에 대한 치료 효과를 높일 수 있다 하지만 miRNA 바이오마커들에 대한 진단법 관련
연구는 아직 초기 단계에 있어 적용되기까지는 더 많은 연구가 필요할 것으로 보인다
그림11. 알츠하이머병 환자와 정상인에서의 miRNA 발현량 차이 (출처: Kumar P et al., 2013)
Ⅲ. 알츠하이머병 진단법 연구 동향
기존의 진단법이 가진 한계로 알츠하이머병(Alzheimer’s Disease, AD)에 대한 새로운 진단법 개발의 필요성이
대두되면서 세계적으로 관련 시장 선점을 위한 연구가
활발하게 진행중이다 각국의 연구진은 아밀로이드 베타
PET-CT가 가진 단점을 보완하고, 진단 과정의 편리성을
장점으로 내세운 기술 개발과 사용처 확보에 집중하고
있다 다양한 바이오마커 (Biomarker) 와 IT 기술을
활용하여 개발되고 있는 국내외 최신 진단 기술을 간단히 살펴보자
에서 자세하게 볼 수 있다 이때, 포획항체와 검출항체가
결합하는 항원인식부위(epitope)가 동일하도록 설정하면, 단량체와는 달리 동일한 항원인식부위가 많이 존재하는
올리고머만 검출할 수 있다 피플바이오는 MDS 기술을
발전시켜 미량의 단백질을 증폭하여 타겟이 되는
단백질을 측정하는 SI-MDS(Spiking and Incubation MDS), 여러 검출항체를 한 번에 넣어 여러 타겟 단백질과
결합하도록 하여 여러가지 질병을 진단할 수 있는 3DMDS 등을 개발하였다
피플바이오의 알츠하이머 진단 키트 'inBlood OAβ
테스트(OAβ 테스트)’는 소량의 혈액으로 간편하게 검사를
진행할 수 있다는 장점이 있고, 높은 정확성을 보인다
1 국내 진단법 연구 동향
1) 혈액 진단법
(a) inBlood OAβ 테스트 키트
국내 기업 중 혈장 바이오마커를 이용한 AD 진단 키트
개발의 선두 주자는 피플바이오다 혈액에서
올리고머화된 아밀로이드베타(Oligomeric Amyoid-β, OAβ)는 뇌에서 축적되는 아밀로이드베타 플라크에 대한
표지자로, AD의 바이오마커로 사용될 수 있음이 입증된
바 있다[20] 알츠하이머병에서는 아밀로이드 단량체가
결합하여 올리고머를 이루는데, 올리고머릭 아밀로이드
베타는 여러 독성을 유발한다 또한 이는 중증도와 높은
상관관계를 보인다
이 진단키트는 소량의 채혈로 아밀로이드베타의
올리고머화 정도를 측정하여 알츠하이머병을
진단한다(그림12) 본 진단법에는 새롭게 개발한 MDS
(Multimer Detection System)라는 기술을 이용한다 이
기술은 샌드위치 ELISA (Enzyme - linked immunosorbent assay) 를 응용하여 실험판에
포획항체(capturing antibody)를 코팅시킨 후, 샘플을
넣어 검출항체 (detecting antibody) 와 결합시키고
올리고머를 검출한다 이 기술의 원리 및 과정은
https://www youtube com/watch?v=yQkUeuLGTP4
현재 진단에 소요되는 시간은 약 2일이며, 테스트 1회당
10만 원 정도로 다른 진단 기술 대비 저렴하다
피플바이오는 2018년 inBlood OAβ 테스트 키트에 대한
식약처의 허가를 받아 해당 목적의 제품 중 세계 최초로
상용화되었다 또한 올해 안으로 전국 병의원 어디서나
알츠하이머병 혈액검사를 받을 수 있는 체계를 구축할
예정이다 피플바이오는 2021년 11월 싱가포르의 All
Eights사와 약 20억 원 규모의 알츠하이머병 검진키트
공급 계약을 맺는 등 글로벌 시장에서도 상용화하는
것을 목표로 하고 있다
그림12. 피플바이오에서 개발한 inBlood OAβ 테스트 키트 (출처: 피플바이오 홈페이지)
(b) QPLEXTM Alz plus assay

메디프론디비티 역시 혈액을 통한 진단법 개발을
진행중인 회사 중 하나다 메디프론디비티(Medifron)와
퀀타매트릭스(Quanta Matrix)가 공동개발한 QPLEXTM
Alz plus assay는 혈장에 존재하는 여러 알츠하이머병
관련 바이오마커를 정량화하여 진단한다(그림13)
인지장애 단계 이전에 뇌의 아밀로이드 베타 축적량을
측정할 수 있는 검사이기 때문에, 알츠하이머병의 조기
예측에 널리 활용될 수 있다 QPLEXTM Alz plus assay는
알츠하이머병 관련 바이오마커 4가지를 측정하고, 독자적인 예측 알고리즘인 범용 자동화 장(QMIA)을 통해 알츠하이머병의 위험도를 예측한다
QPLEXTM Alz plus 분석은 여러 종류의 바이오마커를 동시에 감지하기 때문에 하나의 바이오마커를 이용하여 진단하는 것보다 정확도가 높으며, 혈액시료를 사용하기
때문에 비침습적이다 또한 기존의 검사법인 아밀로이드
PET에 비해 저렴해 환자의 의료비 부담이 적다는 장점이
있다 QPLEXTM Alz plus 는 알츠하이머병을 조기
진단하는 키트로 2020년 8월에 식약처 품목허가 승인을
받았다
그림13. 메디프론디비티와 퀀타매트릭스가 공동개발한
진단 키트 (출처: 메디프론 홈페이지)
(c) 다양한 혈액 바이오마커의 개발
경상대학교 김명옥 교수 연구팀의 ‘형광 나노입자
이미징을 이용한 알츠하이머병의 새로운 조기 진단
키트’가 국제적 과학 저널인 네이쳐(Nature)의 자매지
특히, 이 연구에서는 개인별 맞춤 진단이 가능하도록
마이크로RNA(microRNA, miRNA) 8종 및 항체 13종, 총 21종의 바이오마커 개발을 통해 진단의 정확도를
높였는데, 대표적인 AD의 바이오 마커인 OAβ 혹은
tau 뿐만 아니라 miRNA 와 다른 염증 마커들을
마이크로어레이 ( microarray ) 를 이용한

스크리닝(screening)을 통해 선별하였다 선별된 타겟
항원이나 miRNA가 항체 또는 miRNA의 상보적인 서열에
결합하면 형광체가 형광을 발색하게 되고, 그 발색 정도에
따라 치매 진행 단계를 진단할 수 있다 이 진단법에는
기존의 ELISA 와 FISH(Fluorescence in situ
Hybridization) 기술, 그리고 소광체와 형광체의 거리
의존적인 FRET(Fluorescence Resonance Energy Transfer)가 모두 사용되었다 여러 바이오마커 수치를
형광 발색을 통해 동시에 확인하기 때문에 더욱 정확한
진단을 제공한다[21]
다음은 분자비콘 NANP 센서를 사용하여 샘플로부터
다양한 바이오마커를 분석한 결과이다(그림14) Tau 및
Aβ1-42 올리고머는 알츠하이머병의 중증도에 따라
증가한다 이외에 miR-106b와 miR-153 또한 유의한
발현 양상을 보여 알츠하이머병의 진행을 확인하는 조기
진단 마커로 활용될 수 있음이 확인되었다 miR-124b, miR-34a, miR-153 에서도 유의미한 결과를 보여 바이오마커로써 활용 가능성이 있음을 시사한다
NLRP3, NLR family pyrin domain containg 3; NFkB, Nuclear factor kappa light chain enhancer of activated B cells
국제적으로 인정받았다 그림 14. 연구팀에서 개발한 혈액 바이오마커를 이용한 진단 키트의 형광 발색 결과 (출처: Park, J.S. et al., 2019)
Scientific Reports 에 2019 년 9 월 게재되면서
연구팀은 현재 치매의 조기 진단이 어렵고, 질병의 진행
정도를 객관적인 지표로 나타내기 어려워 정성적으로
표현할 수밖에 없다는 실정을 인식하고 진행된 연구라고
밝혔다 본 기술은 기존의 진단법이 가진 침습적 방법의
한계를 극복하고 다양한 바이오마커를 개발하여 진단의
정확도와 민감도를 높였다는 데 의의가 있다
과학기술정보통신부 ‘뇌과학원천기술개발사업’의 지원을
받은 본 연구에서 개발된 치매 조기진단 키트는 2018년
7월 민간 기업 (주)피토스(현 Axceso Biopharma)에
이전되어 시장 진출을 추진하고 있다 다음은 Axcesco
Biopharma의 2021년 9월 기준 파이프라인이다(그림

15) 표의 가장 아래 부분에 해당하는 Medical Device가
앞서 설명한 알츠하이머병 진단 키트로, 2021년 9월 기준
전임상단계(non-clinial) 진행 중에 있다
치료의 작용기전은 과학적 근거에 기반해야
하며, 소프트웨어 의료기기(Software as a Medical Devices, SaMD)로서 하드웨어의 도움 없이 독립적인
형태의 소프트웨어만으로 기능할 수 있어야
한다[24] 치매 치료제의 개발이 난항을 겪으면서 치매

분야에도 디지털 치료제가 도입되고 있다
국내 스타트업인 이모코그 (Emocog) 의
코그테라 (Cogthera) 는 경도인지장애 (MCI) 단계의
환자들을 진단하고 예방하는 것을 목표로 개발되고 있는
모바일 어플리케이션 형태의 소프트웨어
의료기기이다(그림16) 코그테라는 주기적으로 사용자의
인지 기능을 관찰하고, 맞춤형 인지훈련을 제공한다 음성
대화 기반의 인터페이스로 경도인지장애 환자들의 이용에
어려움이 없도록 하였고, 자동 생성된 컨텐츠를 통해
환자의 인지 능력을 측정한다 나아가 개인에게 적합한
난이도의 인지 능력 개선을 위한 훈련을 제공하여 치매의
그림15. Axcesco Biopharma 파이프라인 (출처 : Axcesco Biopharma 홈페이지)
2) 치매관리의 디지털화
세계적인 고령화와 국가적인 의료비 증가에 따라 의료 시스템의 디지털화가 중요하다는 인식이 확산되고 있다 이러한 흐름 속에서 IT와 의료 및 제약 기술이 융합된
디지털 치료제(Digital Therapeutics, DTx)가 헬스케어 기술 시장에서 화제이다 디지털 치료제는 의학적 장애나 질병을 예방, 관리, 치료하기 위해 환자에게 치료를
제공하는 소프트웨어 의료기기를 말한다
예방 및 치료의 기능도 갖추고 있다 그림16 이모코그에서 개발 중인 치매 디지털 치료제 ‘코그테라’ (출처: https://www.folin.co/article/1892)
코그테라는 식약처로부터 인지치료 소프트웨어 의료기기 품목으로 허가받아 임상을 신청 중에 있으며, 신청이 승인된다면 올해 안에 국내 임상시험을 진행할 계획이다 이모코그 측은 2024년 코그테라를 국내에서 상용화하는 것을 목표로 개발하고 있으며 , 나아가
2026년에는 해외 진출도 염두에 두고 있다고 밝혔다
3) 후각 바이오마커를 이용한 5분 간편 진단법
AD 환자의 인지기능 저하에 따른 초기 증상으로 후각
기능의 감소가 나타난다는 연구 결과에 입각하여, 후각
기능을 바이오마커로 활용한 진단법이 최근 국내외에서
활발히 연구중이다 국내에서는 광주과학기술원(GIST)
김재관 교수와 조선대학교 이건호 교수 연구팀은 3기능적
근적외선 분광법 (functional near-infrared spectroscopy, fNIRS) 을 이용하여 간단한 후각
자극만으로 5분 이내에 치매를 진단할 수 있는 기술을
개발했다
본 연구는 후각 자극 시 뇌 전전두엽에서 변화하는
헤모글로빈의 값에 따라 방출되는 근적외선 신호를
fNIRS 로 측정한다 fNIRS 는 PET나 MRI 에 비해
비침습적이고 직관적인 결과를 제공한다 또한 fNIRS
그래프가 다른 두 그래프보다 더 넓은 선 아래 영역을
보여주는데, 이는 fNIRS가 MCI 진단에서 가장 높은
민감도와 특이도를 나타냄을 의미한다 ( 그림 17)
임상시험 결과 새로운 진단기법이 뇌 MRI 또는
아밀로이드 PET나 CT보다 우수한 진단 능력을 갖추고
있으며, MMSE, SNSB와 같은 기존 치매 검사와도 유사한
진단 정확도를 지니고 있음을 확인했다[23] 특히 이
진단법은 소요시간이 약 5분 내외로 매우 짧고 비용도
상대적으로 낮다는 점에서 경쟁력이 있다
본 연구 결과는 2022년 3월 ‘Alzheimer’s Research & Therapy’에 온라인 게재되었다 해당 기술을 활용한 진단
키트는 광주과학기술원의 스타트업엔서와 협업하여
제품화를 목표로 개발이 진행되고 있다
그림17. fNIRS(빨간색), 아밀로이드 PET-CT(초록색), MRI(파란색)가 정상인과 경도인지장애(MCI) 환자를 구분하는 능력에 대한 민감도와 특이도 비교 그래프 (출처: Kim, J. et al., 2022)
3fNIRS(functional near-infared spectroscopy): 기능적 근적외선 분광법 근적외선 파장(650~100nm)을 조사하여 뇌 조직으로부터
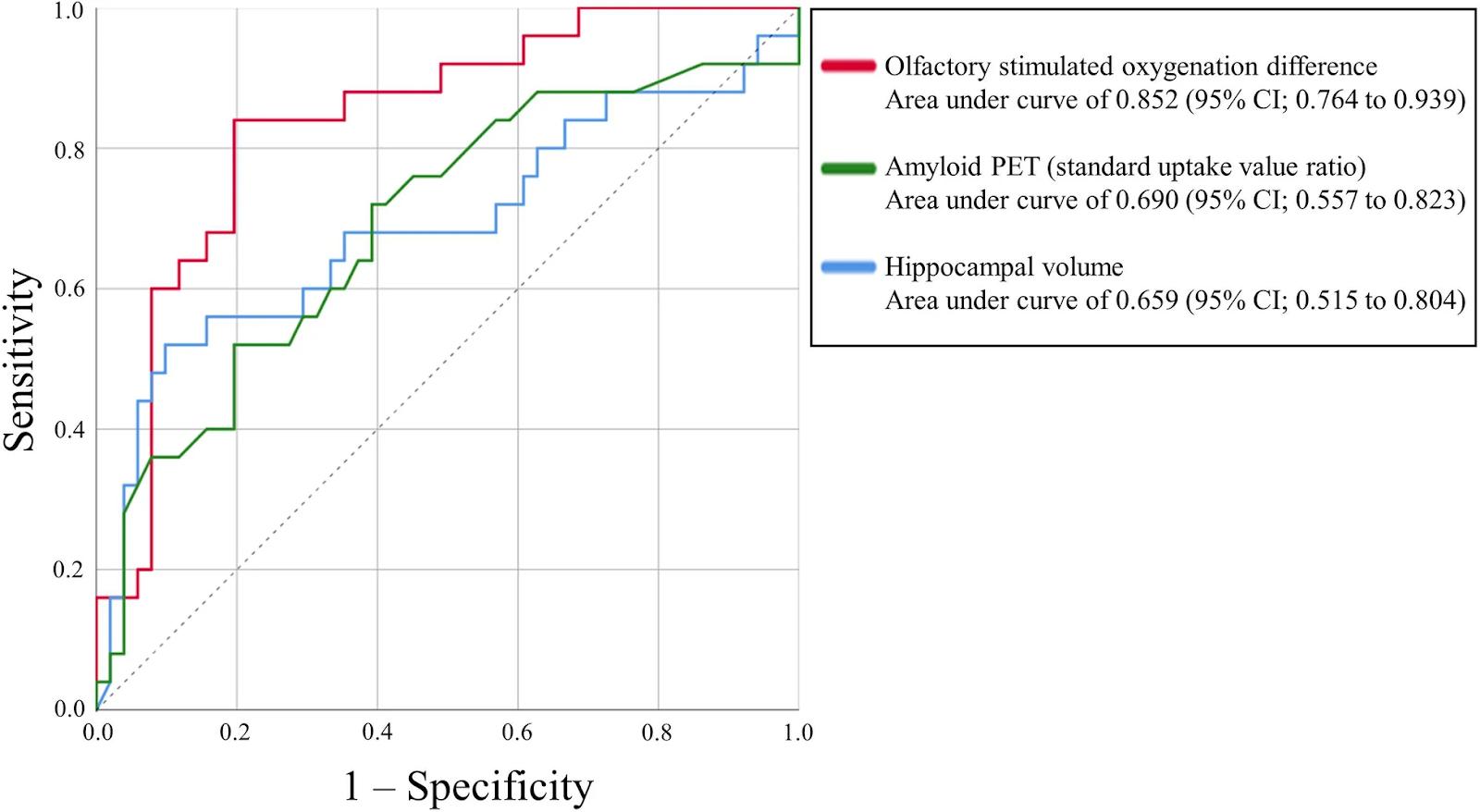
산란된 빛을 검출한다 그 흡광도에 따라 대뇌의 산소포화도와 혈류량을 산출하여 인지 기능을 측정할 수 있다[22].
Pharmtivation 136
4) 결론
편리하고 저렴한 진단법에 대한 수요에 따라 치매 진단
시장의 성장은 계속될 전망이다 시장조사업체
리서치앤마켓(Research and markets)에 따르면, 글로벌
치매 진단시장은 2021년 47억 1,000만 달러에서
2022 년 50 억 8,000 만 달러로 7 9% 의 연평균
성장률 (Compound annual growth rate, CAGR) 로
성장할 것으로 예상되며 2026년에는 69억 4,000만
달러에 이를 것으로 예상된다[25] 한국기술기획평가원에
의하면, 국내 치매 진단 시장은 2012년 9900억원에서
2050년에는 3조 5,000억원으로 2012년 대비 약 3 5배
성장할 전망이다[26] 치매 치료제의 잇따른 실패와 조기
진단의 긍정적인 예후에 관련 시장에 진입하려는
업체들이 늘고 있는 것이다
현재 시중에 개발된 알츠하이머 진단 키트는 전 세계적으로도 그 수가 절대적으로 적기 때문에, 향후 국내
제약바이오 기업들에게는 시장을 어떻게 개척해 나갈지가
큰 과제로 보인다 관건은 기존의 검사법을 대신할 수
있는가에 달렸다 기존 진단 방식의 분명한 한계에도
불구하고 후발주자로서 임상 현장에 이미 자리잡은
기술을 대체하는 일은 쉽지 않을 것이다 성숙한 기술을
바탕으로 뛰어난 바이오마커를 개발하는 데 성공한다면
치매 진단 시장을 선도할 수 있을 것이라 생각된다
2 국외 진단법 연구 동향
조기진단이 중요한 만큼 국외에서도 알츠하이머병
진단법에 대해 여러 연구가 진행중이다 그 중, 가장 많이
개발되고 있는 기술은 혈액진단법이다 따라서 , 본문에서는 혈액진단기술에 대해 활발히 연구를 진행하고
있거나 개발에 성공하여 현재 시판 중인 4 개의
국가(이탈리아, 미국, 일본, 대만)의 혈액 진단법에 대해
살펴보자
1) 이탈리아 - 질량분석을 통한 U-p53AZ 검출기술
이탈리아 회사 디아뎀(Diadem)은 1ml 미만의 혈액을
채취하여 p53의 변이체인 U-p53AZ를 검출하는 방법인
‘ AlzoSure Predict’ 라는 체외 진단용 의료기기 를

개발하였다(그림18) U-p53AZ는 암을 억제하는 p53
단백질의 변이체로, 비정상적인 아밀로이드 형성과 산화
스트레스에 영향을 미치는 동시에 알츠하이머병의
발병과도 밀접한 관련성을 가지는 것으로 밝혀졌다
‘AlzoSure Predict’의 메커니즘은 혈액을 체취하고 Up53AZ에 특이적으로 결합하는 항체를 처리한 후 LCMS(Liquid Chromatography Mass Spectrometry)를
통해 U-p53 단백질을 검출해내는 방법이다
U-p53AZ 는 아밀로이드 베타나 tau 단백질과 같은 바이오마커에 비해 알츠하이머병 진행 초기부터 진단이 가능한 바이오마커이며, 최근 연구 결과에서는 임상 증상
그림
식별 전에 경증 인지장애 환자식별을 6년 일찍 예측했고, 알츠하이머병의 진행 여부를 95% 의 정확도로
보고했다고 한다[27]
다음은 알츠하이머 환자와 정상인을 구별하기 위한 Up53AZ 및 아밀로이드 베타 PET의 성능을 비교하는
4ROC곡선이다(그림 19) 이 곡선은 민감도와 특이도를
보여주는데, 두 방면에서 모두 뛰어나다는 것을 알 수
있다 [28] 현재 뚜렷한 치료제가 존재하지 않고
5대증요법만 진행되는 현재 시점에서 알츠하이머의 조기
예측이 가능하다는 큰 장점과 더불어, 정확도 또한
높으면서 간단하고 효율적인 검사법이다 또한 , 촬영기기가 필요한 PET 방법이나 환자에게 부담이 가는 뇌척수액 검사에 비해 소량의 혈액만으로 진단이 가능하다는 것 또한 큰 장점이다
‘AlzoSure Predict’는 2022년 3월 유럽연합 (EU)과 영국에서 시판 허가를 받았으며, FDA도 2022년 1월에
혁신의료기기로 지정하였다
AUC, Area Under the ROC Curve
그림19. U-p53AZ과 Aβ-PET의 ROC 곡선 (출처: Piccirella S. et al., 2022)
2) 미국 – Aβ 42/Aβ 40 및 tau 단백질 양 측정

: SIMOA(Single molecule assay), PrecivityAD 와 P-tau MAA(Multi-Analyte Assay)
알츠하이머병의 임상적 진행과 더불어 혈중 p-tau181과
p-tau217 의 농도가 상승하고 Aβ42/Aβ40 비율이
감소한다는 연구결과를 기반으로[29], 간단한 혈액검사를
통해 이러한 단백질들의 농도변화를 파악하여
알츠하이머병을 더욱 간편하게 진단하고자 하는 연구가
진행중이다 특히 p-tau181 과 p-tau217 는 PET
결과만큼 정확하며 , 다른 바이오마커들보다
알츠하이머병의 조기진단에 가장 유리하기 때문에 ptau181 과 p-tau217 를 통한 진단은 큰 강점을
가진다[30]
미국의 퀸터릭스 ( Quanterix) 회사는 자동화된
초민감(ultrasensitive) 6ELISA 기술인 SIMOA(Single molecule assay) 를 이용하여 혈액 내 Aβ42/Aβ40
비율이나 tau 단백질의 양을 측정하는 새로운 자동 측정
플랫폼을 개발하였다 제약회사 일라이 릴리(Eli Lilly and Company) 는 Quanterix 의 기술을 이용하여
알츠하이머병의 새로운 초기진단법을 개발하고자 하고
있다 SIMOA의 기술은 말 그대로 단일분자(single molecule)를 탐지하는 기술로서 , 방법은 다음과 같다(그림20)
그림20. SIMOA 메커니즘 (출처: https://www.raybiotech.com/learningcenter/elisa-immunopcr-simoa/ )
4ROC 곡선: Receiver Operating Characteristic Curve의 줄임말로, x축은 민감도(sensitivity), y축은 특이도(specificity)로 구성된 곡선이다
5대증요법: 수병의 진행을 지연시키거나 증상을 완화시키는 방법이다 6ELISA: Enzyme-Linked ImmunoSorbent Assay
SIMOA 기술은 타겟과 결합한 비드 ( bead) 가
구멍(well)에 배치되는 과정에서, well 당 하나의 bead만
포함되기 때문에 형광을 나타내는 well의 수가 곧 타겟
단백질의 양을 의미하여 단일 분자를 탐지할 수 있다는
장점이 있다
하지만 이 방법은 타겟 단백질에 반응하는 항체의 종류에
의해 제한이 된다는 단점이 있고, 진단장비가 고가이며,
SIMOA의 경우 tau와 Aβ 이외에도 여러 항원들을
진단하기 때문에 알츠하이머병 진단의 특화성이
떨어진다는 단점이 있다 [32] 미국의 식품
의약품청(FDA)은 2021년에 p-Tau 181 혈액 검사를
혁신기기로 지정하였다
또한, 혈액 진단키트 전문 개발사인 C2N에서는 나이와
Aβ42/Aβ40 비율, 그리고 7ApoE 유전자형(genotype)을
융합하여 알츠하이머병을 진단하는 방법인
‘PrecivityAD’법을 개발하였다 방법은 다음과 같다 먼저, 혈액을 채취하여 질량분석법과 고성능
액체크로마토그래피를 통해 Aβ 42 /Aβ 40 비율을 정량화하고, ApoE의 존재를 통해 ApoE 유전자형을
판별한다 이를 통해 구한 Aβ42/Aβ40 비율과 ApoE
유전자형 결과, 그리고 환자의 나이를 아밀로이드
확률점수(Amyloid Probability Score, APS) 로
환산하는데[33], 점수가 높을수록 뇌의 아밀로이드
침착가능성이 높은 것을 의미하며 이를 통해
알츠하이머병 환자의 진단이 가능하다 ‘PrecivityAD’
기술은 2020년 12월에 시장 공급에 나섰고, 2022년
현재 시판 중이다 C2N는 또한 고분해능 질량 분석법을
이용해 tau217 및 tau181의 인산화 형태와 관련된
4 가지 분석 물질을 정량화하는 방법인 p - tau
MAA(Multi-Analyte Assay)를 개발했으며[34], 2022년
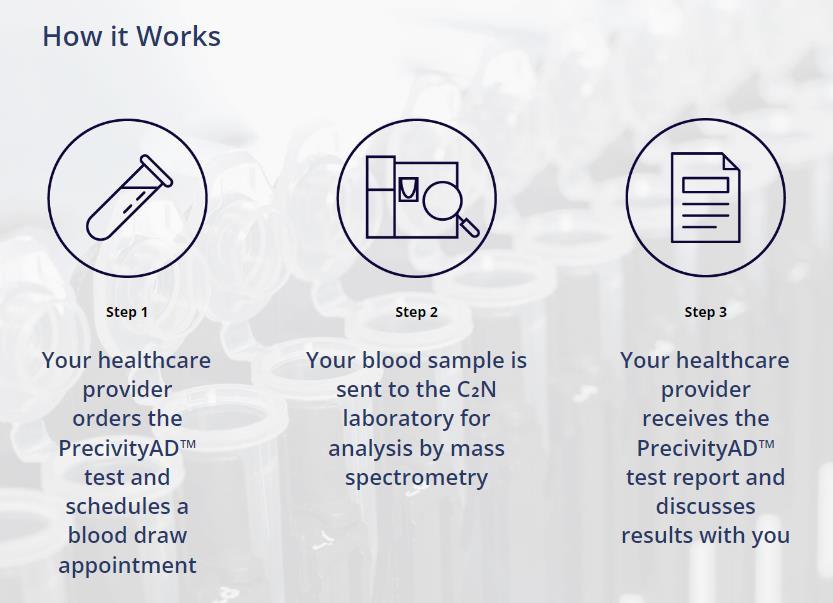
9월 기준으로는 시판은 되지 않고 임상연구 목적으로만
이루어지고 있다 또한, C2N은 현재 ‘PrecivityAD’의 Aβ
42/40 비율과 p-tau217 비율을 결합한 혈액검사를 개발
중이며, 2022년 7월 알츠하이머병 협회 국제 회의에서
해당 기술은 90% 정도의 높은 정확도와 정량적
아밀로이드 PET와 비교 시 0 96의 높은 AUC값을
보였다고 밝혔다(그림21)[36]
C2N의 방법들은 Aβ42/Aβ40 비율 뿐 아니라, Apo E나
p-tau와 같은 다른 바이오마커들을 융합하여 진단하기
때문에 정확도가 높다 특히 ‘PrecivityAD’의 경우
Aβ42/Aβ4를 정량하는 과정에서 동위원소를 투여하는데, 이것은 혈액뇌관문(Blood Brain Barrier)를 통과하여
뇌로 들어갈 수 있기 때문에 뇌의 Aβ양을 정확히 정량할
수 있다는 큰 장점이 있다[32] 하지만, 질량분석기를
사용하기 때문에 다른 혈액진단법에 비해 비용이 더 많이
들고, 시간이 오래 걸린다는 단점이 있다
그림21. PrecivityAD 과정 개략도 (출처: PrecivityAD 홈페이지)
3) 일본–혈액 전처리와 질량분석법을 통한 혈액 내
Aβ42/Aβ40 비율 진단 : Amyloid MSTM
일본의 시마즈(Shimadzu)는 질량분석법을을 통한 혈액
내 Aβ42/Aβ40 비율 진단하는 방법인 아밀로이드 질량
분석 ( Amyloid Mass Spectrometry, Amyloid MS) 기술을 개발했다 Amyloid MS 기술은 C2N의
Precivity AD와 유사하게 면역침강법과 질량분석을
이용하여 Aβ42/Aβ40 비율을 구하지만 , Aβ 관련
펩타이드의 양을 보다 정확하게 검출하기 위해 혈액에
다양한 전처리를 진행하여(그림22) 검출하고자 하는 Aβ
관련 펩타이드만을 높은 정확도로 추출한다[37] 해당
방법은 고가의 질량분석기를 사용하기 때문에 일반적인
혈액검사법에 비해 가격이 높으며, 시간이 오래 걸린다는
단점이 있다 Amyloid MS service는 2022년인 현재
시판 중이다
그림22. Amyloid MSTM 진행 과정 (출처: https://www.shimadzu.com/research_and_developm ent/technology_branding/neurotech/amyloidms.html)
4) 대만 - IMR(Immuno Magnetic Reduction)을 통한
Aβ 정량
대만의 맥규 (MagQu) 에서는 독자적으로 개발한
IMR(Immuno Magnetic Reduction) 기술을 통해 Aβ
1-42 을 검출해내는 혈액 진단 키트를 개발했다
IMR기술은 다음과 같다(그림23) 약 50nm의 직경을
가진 Fe3O4 자성 입자의 표면에 항원과 결합하는 항체를
접합하고, 항체가 결합된 입자는 외부 자기장의 자극 존재
시 시약과의 자기 상호작용을 통해 자기장과 함께
진동한다 진동하는 정도는 교류 자화율 (ac susceptibility χac )이라는 수치로 계산된다 만일, 항체에
타겟분자가 결합하면 클러스터를 형성하여 진동이
줄어들게 되고, 감소한 χac의 정도를 통해 Aβ와 tau의
양을 정량화할 수 있다[38] IMR기술은 단 한 종류의
탐침을 사용하여 비특이적인 결합은 낮으면서, 높은 표면-
부피비를 가지고 있어 항체와 분자 사이의 결합 면적이
크기 때문에 민감도가 높다 또한, χac의 변화를 통해
생체분자의 농도를 비교적 정확하게 정량할 수 있다는 장점이 있다 하지만 고가의 기기가 필요하고, 자기장을
이용하기 때문에 단백질의 변성에 영향을 줄 수 있다는 위험이 있다
그림23. IMR(Immuno Magnetic Reduction) assay (출처: MagQu 홈페이지)

다음은 앞서 기술하였던 한국, 이탈리아, 미국, 일본, 대만의 알츠하이머병 진단법에 대하여 비교한 표로써, 제품명과 사용기술 및 표적물질, 비용, 그리고 상용화 단계를 중심으로 정리하였다(표 3)
한국 PeopleBio 이탈리아 Diadem 미국 Quanterix 미국 C2N 일본 Shimadzu 대만 MagQu
제품 inBlood Oaβ Test AlzoSure Predict Simoa® Technology PrecivityAD / P-tau MAA Amyloid MS Aβ 1-42 IMR Reagent
사용 기술(장비) / 표적 물질
SI-MDS, Spiking&Incubation Multimer Detection System; LC-MS, LIquid Chromatography Mass Spectrometer; IP-MS, Immunoprecipitation Mass spectrometry;
3 요약 국내와 국외의 개발동향을 통해 혈액이나 신경, 디지털기기 등을 이용하는 비침습적 진단법이 활발하게 개발 중임을 볼 수 있었고, 아밀로이드 베타 외의 새로운 바이오마커에 대한 여러 연구도 진행 중이었다 알츠하이머병에서의 진단은 질병을 진단하는 것을 넘어, 질병의 조기 진단을 통해 알츠하이머병의 치료효과를 극대화할 수 있기 때문에 매우 중요한 의미를 가진다 조기진단이 매우 중요한 질병인 만큼, 앞으로의 알츠하이머병의 진단법 시장도 더욱 커질 것을 예상할 수 있으며, 진단법 개발과 더불어 알츠하이머병 치료제 개발을 위한 여러 제약사들의 노력으로 알츠하이머병의 정복에 한걸음 다가가기를 바란다
[1] Lesné, S., Koh, M. T., Kotilinek, L., Kayed, R., Glabe, C. G., Yang, A., ... & Ashe, K. H. (2006). A specific amyloid-β protein assembly in the brain impairs memory. Nature, 440(7082), 352-357.
[2] Piller, C. (2022). Blots on a field?. Science(NewYork,NY), 377(6604), 358-363.
https://www.science.org/content/article/potential-fabrication-research-images-threatens-keytheory-alzheimers-disease
[3] https://biz.chosun.com/it-science/bio-science/2022/08/02/XHKH75UFJVAE7IBQCLFWGYMS ME/
[4] Arimoto, T., & Bing, G. (2003). Up-regulation of inducible nitric oxide synthase in the substantia nigra by lipopolysaccharide causes microglial activation and neurodegeneration. Neurobiology of disease, 12(1), 35-45.
[5] Biber, K., Bhattacharya, A., Campbell, B. M., Piro, J. R., Rohe, M., Staal, R. G., ... & Möller, T. (2019). Microglial drug targets in AD: opportunities and challenges in drug discovery and development. Frontiers in Pharmacology, 10, 840.
[6] Bonda, D. J., Mailankot, M., Stone, J. G., Garrett, M. R., Staniszewska, M., Castellani, R. J., ... & Smith, M. A. (2010). Indoleamine 2, 3-dioxygenase and 3-hydroxykynurenine modifications are found in the neuropathology of Alzheimer's disease. Redox Report, 15(4), 161-168.
[7] Guillemin, G. J., Smythe, G. A., Veas, L. A., Takikawa, O., & Brew, B. J. (2003). Aβ1-42 induces production of quinolinic acid by human macrophages and microglia. Neuroreport, 14(18), 2311-2315.
[8] Bradshaw, E. M., Chibnik, L. B., Keenan, B. T., Ottoboni, L., Raj, T., Tang, A., ... & De Jager, P. L. (2013). CD33 Alzheimer's disease locus: altered monocyte function and amyloid biology. Nature neuroscience, 16(7), 848-850.
[9] Griciuc, A., Serrano-Pozo, A., Parrado, A. R., Lesinski, A. N., Asselin, C. N., Mullin, K., ... & Tanzi, R. E. (2013). Alzheimer’s disease risk gene CD33 inhibits microglial uptake of amyloid beta. Neuron, 78(4), 631-643.
[10] Pimenova, A. A., Raj, T., & Goate, A. M. (2018). Untangling genetic risk for Alzheimer’s disease. Biological psychiatry, 83(4), 300-310.
[11] 범부처전주기신약개발사업단. (2018). 텔로머라제
[12] Mankhong, S., Kim, S., Lee, S., Kwak, H. B., Park, D. H., Joa, K. L., & Kang, J. H. (2022). Development of Alzheimer’s Disease Biomarkers: From CSF-to Blood-Based Biomarkers. Biomedicines, 10(4), 850.
[13] Swarbrick, S., Wragg, N., Ghosh, S., & Stolzing, A. (2019). Systematic review of miRNA as biomarkers in Alzheimer’s disease. Molecular neurobiology, 56(9), 6156-6167.
[14] https://www.alz.org/alzheimers-dementia/research_progress/earlierdiagnosis#:~:text=Imaging%20technologies%20used%20in%20Alzheimer's%20research&text =Structural%20techniques%20include%20magnetic%20resonance,cells%20use%20sugar%2 0or%20oxygen.
[15] Thientunyakit, T., Shiratori, S., Ishii, K., & Gelovani, J. G. (2022). Molecular PET Imaging in Alzheimer’s Disease. Journal of Medical and Biological Engineering, 1-17.
[16] Bălașa, A. F., Chircov, C., & Grumezescu, A. M. (2020). Body Fluid Biomarkers for Alzheimer’s Disease An Up-To-Date Overview. Biomedicines, 8(10), 421.
[17] Leuzy, A., Mattsson‐Carlgren, N., Palmqvist, S., Janelidze, S., Dage, J. L., & Hansson, O. (2022). Blood‐based biomarkers for Alzheimer's disease. EMBO Molecular Medicine, 14(1), e14408.
[18] Villa, C., Lavitrano, M., Salvatore, E., & Combi, R. (2020). Molecular and imaging biomarkers in Alzheimer’s disease: a focus on recent insights. Journal of Personalized Medicine, 10(3), 61.
[19] Kumar P, Dezso Z, MacKenzie C, Oestreicher J, Agoulnik S, Byrne M, Bernier F, Yanagimachi M, Aoshima K, Oda Y. Circulating miRNA biomarkers for Alzheimer's disease. PLoS One. 2013 Jul 29;8(7):e69807.
[20] Babapour Mofrad, R., Scheltens, P., Kim, S., Kang, S., Youn, Y. C., An, S. S. A., ... & Teunissen, C. E. (2021). Plasma amyloid-β oligomerization assay as a pre-screening test for amyloid status. Alzheimer's Research & Therapy, 13(1), 1-10.
[21] Park, J. S., Kim, S. T., Kim, S. Y., Jo, M. G., Choi, M. J., & Kim, M. O. (2019). A novel kit for early diagnosis of Alzheimer’s disease using a fluorescent nanoparticle imaging. Scientific Reports, 9(1), 1-12.
[22] Herold, F., Wiegel, P., Scholkmann, F., & Müller, N. G. (2018). Applications of functional near-infrared spectroscopy (fNIRS) neuroimaging in exercise–cognition science: a systematic, methodology-focused review. Journal of clinical medicine, 7(12), 466.
[23] Kim, J., Yon, D. K., Choi, K. Y., Lee, J. J., Kim, N., Lee, K. H., & Kim, J. G. (2022). Novel diagnostic tools for identifying cognitive impairment using olfactory-stimulated functional nearinfrared spectroscopy: patient-level, single-group, diagnostic trial. Alzheimer's Research & Therapy, 14(1), 1-10.
[24] 식약처. (2020). 디지털치료기기 허가 심사 가이드라인(민원인 안내서).
[25] https://www.researchandmarkets.com/reports/5553667/alzheimers-disease-treatmentglobal-market
[26] 한국과학기술기획평가원. (2019) 치매극복 연구개발사업’
[27] https://www.diademdx.com/AlzosurePredict
[28] Piccirella, S., Van Neste, L., Fowler, C., Masters, C. L., Fripp, J., Doecke, J. D., ... & Kinnon, P. (2022). A Conformational variant of P53 (U-P53AZ) as blood-based biomarker for the prediction of the onset of symptomatic Alzheimer’s disease. The Journal of Prevention of Alzheimer's Disease, 1-11.
[29] Brickman, A. M., Manly, J. J., Honig, L. S., Sanchez, D., Reyes‐Dumeyer, D., Lantigua, R. A., ... & Mayeux, R. (2021). Plasma p‐tau181, p‐tau217, and other blood‐based Alzheimer's disease biomarkers in a multi‐ethnic, community study. Alzheimer's & Dementia, 17(8), 13531364.
[30] Milà-Alomà, M., Ashton, N.J., Shekari, M. et al. Plasma p-tau231 and p-tau217 as state markers of amyloid-β pathology in preclinical Alzheimer’s disease. Nat Med 28, 1797–1801 (2022).
[31] https://terms.naver.com/entry.naver?docId=499996&cid=60408&categoryId=55558
[32] 보건복지부. (2019). 올리고머화
[33] https://c2n.com/
[34] https://precivityad.com/news/ctyxl9j8rbpsn1nlwd2lhammfktqu3
[35] Kim, J., Basak, J. M., & Holtzman, D. M. (2009). The role of apolipoprotein E in Alzheimer's disease. Neuron, 63(3), 287–303. https://doi.org/10.1016/j.neuron.2009.06.026
[36] Kirmess, K. M., Meyer, M. R., Holubasch, M. S., Knapik, S. S., Hu, Y., Jackson, E. N., ... & Contois, J. H. (2021). The PrecivityAD™ test: Accurate and reliable LC-MS/MS assays for quantifying plasma amyloid beta 40 and 42 and apolipoprotein E proteotype for the assessment of brain amyloidosis. Clinica Chimica Acta, 519, 267-275.
[37]https://www.shimadzu.com/research_and_development/technology_branding/neurotech/a myloidms.html
[38] https://www.magqu.com/node/15
현재까지 알츠하이머병 치료제 시장에서 주로 판매되고 있는 의약품들은 donepezil, rivastigmine 등 치매 증상을
완화하는 치료제들이다 Aducanumab은 알츠하이머병의 원인으로 알려진 아밀로이드 베타(amyloid beta, Aβ)를 제거하는 근본적인 질병 완화제제 (disease modifying therapy, DMT) 로 개발된 항체의약품이며 해당 계열 의약품으로서는 처음으로 FDA에서 조건부 승인을 받으면서 매우 큰 기대를 받았다 FDA에서 aducanumab을 승인할 때
에는 알츠하이머병 치료에서 단순히 증상을 완화하는 치료제가 아닌 질병의 근본적인 원인을 해결하는 치료제가 새로운 선 택지가 생길 수 있다는 점도 고려되었다

그러나 Aducanumab의 임상 3상 시험에서는 동일하게 설계된 임상시험인 Study 302(EMERGE)와 Study 301(ENGAGE)에서 결과가 다르게 나타나 효능에 대한 논란이 있었다 Study 302에서 aducanumab 고용량 치료군에서는 위약군에 비해 통계적으로 유의미한 차이가 나타났지만, 저용량 치료군에서는 통계적으로 유의미한 차이가 나타나지 않았다 반면에 Study 301에서는 aducanumab 고용량 치료군과 저용량 치료군에서 모두 유의미한 치료 효과가 관찰되지 않았다 Aducanumab의 효능에 대한 연구는 Study 302에서는 긍정적으로 나타났지만, Study 301에서는 부정적으로 나타났다 이번 신약 개발 사례 연구에서는 Study 302의 긍정적인 결과를 근거로 FDA에서 aducanumab을 승인한 것에 통계적인 오류 등은 없는지 여러 측면에서 살펴보았다
또한, aducanumab의 안전성에 관한 논란을 aducanumab의 주된 부작용인 아밀로이드 연관 뇌영상 이상(amyloidrelated imaging abnormalities, ARIA) 발생을 중심으로 본문에서 분석해 보았다 알츠하이머병 환자 전체 집단의 평균 나이가

2019년에 발표한 EvaluatePharma의 제약산업 동향 보고서에 따르면 2021년 aducanumab의 기대 매출액은 2 7억
달러, 2022년 7 6억 달러로 예상되었다[1] 하지만 실제 매출액은 예상에 훨씬 미치지 못하였다 2021년 총매출액은 30만
달러, 2022년 9월까지의 매출액은 450만 달러로 예상 매출액에 전혀 못 미치는 수준이다[2][3] 바이오젠에서는 aducanumab의 시장 진입이 늦어진 점과 보험 적용 여부에 대해 아쉬움을 표하였고, 2022년 1분기 실적 발표 이후 aducanumab의 상용화 인프라를 최소화하고 후속 약물인 lecanemab 개발에 집중하겠다고 발표하였다 이로써 aducanumab의 상용화는 사실상 기대하기 어려울 것으로 여겨진다
Tau 치료제 이러한 상황에서 본 학회는 앞으로의 알츠하이머 치료제 개발 패러다임의 변화 방향성을 세 가지로 예상하였다 먼저, tau 단백질 관련 항체 치료제의 개발이 증가할 것으로 생각한다 현재까지는 주로 아밀로이드 베타 단백질과 관련한 연구가 더 많았으며, 치료제 개발에서도 aducanumab과 같은 항체 치료제들이 많이 개발되고 있지만 실제 임상에서 큰 성과를 보이지 못하는 상황이다 따라서 알츠하이머병의 발병 원인으로 아밀로이드 베타 다음으로 유력한 원인인 tau 단백질을 표적으로 하는 치료제에 관한 연구가 활발히 이루어질 것으로 기대된다 한편, 아밀로이드 베타나 tau 단백질의 침전이 유력한 발병 기전으로 생각되고는 있으나 아직까지 알츠하이머병의 발병 원인과 기전이 명확하게 밝혀지지는 않았기 때문에 더 나은 치료제를 개발을 위해서는 알츠하이머병 자체에 관한 연구를 통해 질병의 생물학적 기전 및 원인을
더욱 자세하게 파악하는 것이 필요할 것이다 이에 따라 이번 사례 연구에서는 미세아교세포를 중심으로 알츠하이머병의 기전을 밝힌 연구들에 대해 다루었다 이 외에도 알츠하이머병 발병 메커니즘을 추가로 규명한다면, 더욱 특이적이고
효능을 높인 치료제의 개발이 이루어질 것으로 생각한다
병용 요법 앞으로의 알츠하이머병 치료제의 사용은 기존의 donepezil, galantamine, rivastigmine 등 콜린에스터레이스
저해제 계열의 약과 DMT 계열 의약품의 병용 또는 아밀로이드 베타 단백질을 표적으로 하는 DMT와 tau 단백질 등의 다른 발병 메커니즘을 표적으로 하는 DMT의 병용이 이루어질 것으로 생각한다 알츠하이머병 환자를 대상으로 하는 2/3상 임상 시험인 Tau NexGEN 연구에서 아밀로이드 베타를 표적으로 하는 항체 치료제인 lecanemab과, tau 표적 치료제
후보물질인 E2814의 병용 혜택을 평가한다 알츠하이머병의 발병에 관여하는 아밀로이드 베타 플라크와 tau 단백질을
동시에 표적으로 하는 병용 요법이 시너지 효과를 보일 것으로 기대되고 있다
기술 알츠하이머병 치료제 시장에서도 이중항체 기술을 이용한 약물이 등장할 것으로 예상된다 이중항체 기술은
이미 혈우병 치료제인 Emicizumab(Hemlibra®)과 급성림프모구백혈병 치료제인 Blinatumomab(Blincyto®) 등 FDA의 허가를 받아 성공적으로 시판 중인 사례가 있으며, 알츠하이머병 치료제 시장에서도 로슈에서 gantenerumab에 이중항체
기술을 적용한 신약을 개발하여 임상 시험을 진행 중이다 기존의 단일클론항체 약물들은 주로 혈액-뇌 장벽(blood brain barrier, BBB) 통과에 대한 고려 없이 개발되었기 때문에 그 효과가 작거나, 효과가 있는 경우에는 ARIA-E/ARIA-H 등의 부작용이 나타났다 반면에 이중항체 전략을 이용한 치료제들은 개발
한편, 이중항체는 다양한 구조로 개발이 가능하므로 뇌 셔틀(brain shuttle) 기술 이외에도 알츠하이머병과 관련된 원인 물질을 표적으로 하는 더욱 효과적인 항체 치료제들을 개발할 수 있을 것으로 기대된다 이번 사례연구에서는 이중항체의
예로 gantenerumab에 뇌 셔틀 기술을 적용한 사례를 살펴보았다 Gantenerumab의 이중항체는 BBB에서 발현되는
수용체에 대한 항체와 Aβ 섬유(fibril)에 대한 항체를 융합한 대칭형 항체이다 다양한 플랫폼이 개발되고 있는 이중항체에는
크게 IgG-like와 non-IgG-like 형태가 있다 전자는 보통 항체와 유사한 구조를 갖고 대칭적 이중항체와 비대칭적
이중항체로 나뉜다 후자는 Fc 부분이 없어 비교적 간단한 구조이다 이 중 비대칭적 IgG-like 이중항체와 non-IgG-like
이중항체는 양쪽 팔에서 다른 항원을 인식한다 비대칭적 이중항체는 중쇄에 돌연변이를 유도하는 방식으로, non-IgG-like
이중항체는 항원 인식부위를 직접 연결시켜 만들어진다 따라서 어떤 항체를 연결시키는지에 따라 다양한 조합을 만들 수 있고, 그에 따른 다양한 응용 가능성이 있다 앞으로는 비대칭적 형태로 작용하는 이중항체를 이용한 알츠하이머병 치료제 개발 가능성에 대해서도 다양하게 고려해볼 수 있을 것으로 생각한다 또한, aducanumab이나 lecanemab 또한
gantenerumab처럼 이중항체 기술을 적용한 새로운 항체를 개발을 시도한다면 현재보다 낮은 농도에서도 사용이 가능할
것으로 기대되어 안전성과 효능이 개선될
Ⅱ. 신속프로그램 관련 최신 현황
, 20년 8월 신속승인(accelerated approval) 경로 하에 우선 심사(priority review)의 대상으로 지정되어 임상 4상을 통해 효능을 입증할 것을 조건으로 시판 허가되었다 또한 허가 심사 기간이 단축되어 빠른 개발과 허가가 가능했다 하지만 최근 바이오젠은 aducanumab보다 부작용이 적고 임상적 효능에서도 보다 긍정적인 결과가 나오는 lecanemab의 개발에 더 집중하고 있다 Lecanemab은 aducanumab과 비슷한 기전의 항체 약물이기에 21년 6월 혁신치료제로 지정되었으며, 22년 6월 신속승인 경로 하에 우선심사의 지정 대상 검토를 시작하였다[4] 이 검토 결과는 23년 1월까지 승인 여부가 결정된다 이처럼 신속프로그램의 대상으로 지정받게 되면 개발 과정에서 허가당국의 지원을 받을 수 있을 뿐 아니라, 허가 과정에서도 그 기간이 단축될 수 있어 승인 결과가 나오면 lecanemab의 개발이 더욱 가속화될 가능성이 커질 것으로
보인다 그 외의 항체 치료제의 신속프로그램 관련 현황을 알아본 결과는 다음과 같다 먼저 일라이 릴리의 donanemab의
경우 lecanemab과 같이 21년 6월 혁신치료제로 지정되었고, 22년 7월 신속 승인 경로 하에 우선심사 검토가 시작된
상태이다[5] 그리고 로슈의 gantenerumab의 경우 FDA로부터 혁신치료제 지정을 받은 상태이다[6] 이처럼 아밀로이드
베타에 대한 항체 치료제는 모두 의학적 미충족을 해결하는 신약으로 인정되어 대부분 신속프로그램의 대상이 된 것을 확인할 수 있다 그만큼 부작용이 적고 임상적 유효성이 높은 알츠하이머병 치료제에 대한 의료적 수요가 높은 것을 확인할 수 있었다
국내 신속프로그램의 한계 각 국의 신속프로그램에 대한 조사를 진행하는 과정에서 한국의 신속프로그램의 경우 미국이나 유럽보다 그 제도수가 충분치 않고, 신속프로그램을 통해 개발 과정에서 지원을 받은 의약품의 허가율 또한 미국, 유럽과 달리 50%를 밑돌고 있는 상황이다[7] 그뿐만 아니라, 신속심사제도를 통해 허가를 받았다고 하더라도 건강보험 급여까지 이어지는 경우는 극히 드물다 먼저 제도수가 충분치 않은 것은 한국은 신속프로그램 자체가 실시되기 시작한지
얼마 되지 않았고, 미국 FDA의 신속프로그램을 참고하여 우리나라 허가, 급여 제도 등의 실정에 맞게 신속프로그램을
도입하기 위해서는 시간이 필요할 것으로 예측된다 또 , 신속프로그램을 통해 지원받은 의약품의 허가율이 낮았는데 개발
단계에서는 혁신 의약품으로 평가됐지만 실제 의료현장에서는 혁신성을 인정받지 못한 경우가 많았다[7] 따라서 ‘의료적
미충족 수요를 해결한다’는 신속프로그램의 목표를 달성하기 위해서는 도입되지 않은 제도들에 대한 연구와 우리나라의
실정에 맞는 신속한 적용, 그리고 지정 대상에 대한 명확한 기준 확립 등이 해결해야 할 과제로 보인다
Ⅲ. 본 연구의 한계 및 개선점
본 연구의 한계점 본 연구에 사용된 1차 유효성 평가변수(endpoint) 중 CDR-SB에 대한 한계점이 존재한다 CDRSB(Clinical Dementia Rating-Sum of Boxes)는 임상 현장에서 가장 널리 사용되는 치매 진단 검사 중 하나이다 치매로
인해 감퇴하는 인지 기능을 6개의 영역으로 세분화하여 검사하고, 경도인지장애(mild cognitive impairment, MCI)부터 중증 치매까지 광범위한 진단이 가능하여 aducanumab 임상시험에서 1차 유효성 평가 변수(primary endpoint)로
사용되었다 그러나, aducanumab의 유효성을 평가하는 기준으로서 분명한 한계도 존재한다 어떤 부분이 문제로 작용할
수 있는지, 또 향후 어떻게 보완하면 좋을지 생각해 보았다
먼저, MCI 단계의 환자에 대해 CDR-SB의 민감도가 떨어진다는 연구가 다수 보고되고 있다 그 원인으로는 MCI로 진단될
수 있는 인지 상태의 범위가 너무 광범위하다는 점이 지적된다 실제로, 한 연구에서는 경미한 인지 저하를 보이는 환자에서 CDR-SB를 이용하여 치매를 진단할 때, 6영역 중 2영역 이상에서 이상을 보일 때에만 MCI 진단을 내릴 경우 치매에 대해 보다 정확한 진단이 가능하다고 주장했다[8] 그러나, CDR-SB 검사에서 제시하는 MCI의 진단은 단순히 영역별 점수를 합산한 값을 기준으로 한다 특히, 피험자의 대부분이 MCI에 해당하는 aducanumab 임상시험의 경우(Study 302 기준
피험자 군의 81 6%가 MCI), MCI의 개념과 그 범위를 명확히 제시할 필요가 있어 보인다
CDR-SB 검사의 평가 방식 자체에 대한 한계도 있다 CDR-SB를 비롯하여 본 연구에서 유효성 평가 변수로 사용된 인지
기능 검사는 ‘주관적 평가’ 중 자기 보고형(self-report) 방식으로, 대상자 본인이 인지 능력과 관련된 문항에 대해 스스로 판단하여 응답하는 형태로 구성된다 객관적 평가와 달리, 주관적 평가는 임상 현장에서 실시하지 않아도 되고 일상기능에
대한 측면을 반영할 수 있다는 장점이 있다 그러나, 피검사자의 기억에 의존도가 높고 대상자 본인의 감정과 인지 및 언어적인 수준의 영향이 크기 때문에 객관성이 떨어질 수 있다[9] 특히, 알츠하이머병의 특성상 중등도 이상의 인지 기능 저하로 인하여 답변의 일관성이 떨어지고 판단의 객관성을 확보하기 힘든 대상자는 타당도와 신뢰도 검증 결과를 왜곡할 수 있다[10] 따라서 평가방식과 평가항목 등에 대한 보완이 필요할 것으로 생각된다 IQCODE(Informant Questionnaire on Cognitive Decline in the Elderly)와 같은 정보제공자 보고형(informant-report) 평가를 활용하여 일상생활의 인지언어적 양상이나 장기간의 변화에 대한 보호자의 의견을 반영하고, 전문가에 의한 직접적인 ‘객관적 평가’ 방식도 활용하면
결과의 정확도 향상에 도움이 될 것으로 생각한다
또한, aducanumab의 효과로 나타난 CDR-SB 점수 상의 개선이 실제 알츠하이머병 환자와 보호자의 삶에 얼마나 영향을
줄지는 미지수이다 임상적으로 그 유효성이 있다고 판단된 Study 302에서조차 위약군(placebo group)과의 차이가0 39로 미미했다 경증의 환자에게서는 유효하게 증상의 개선이 나타날 수 있는 점수 차이지만, 중등도 이상의 환자의 경우
삶의 질이 나아질 정도로 의미 있는 효과가 나타날 수 있을지는 의문이다
마지막으로, 약력학적 유효성 평가 변수(pharmacodynamic endpoint)로 사용된 18F-florbetapir PET 표준 섭취계수율(SUVR)과 CDR-SB 사이의 연관성에 대한 의문이 남는다 Aducanumab 임상시험에서 Study 301의 경우 CDR-SB에서 치료군과 위약군 사이에 유의미한 차이를 보이지 않았지만, 약력학적 유효성 평가 변수는 시간 의존적 및 용량
의존적인 Aβ 감소를 나타냈다 즉, 인지 기능의 변화와 Aβ 감소의 상관관계가 설명되지 않는다 이는 본문의 part 6에서
언급한 아밀로이드 베타 가설에 대한 논란의 연장선이기도 하다 더 나은 알츠하이머병 치료제의 개발을 위해서는 치료
효과를 평가할 수 있는 명확한 바이오마커에 대한 연구가 필요해 보인다
개선점 이번 사례 연구에서 조사한 자료들의 통계적 방법이 연구가 진행된 상황과 조건을 고려했을 때 적절한 통계적 방법이었는지 평가했다면, 더 비판적인 분석이 가능했을 것이다 특히나 사후분석에서 데이터를 조정했을 때 처음의 결과와는 다른 결론이 났었는데 구체적으로 어떤 사후분석 방법을 사용했는지 어떠한 데이터를 중점적으로 보고 어떠한 데이터를 생략을 했는지, 그리고 생략을 해도 되는 의미가 크지 않은 데이터인지를 비판적으로 바라보았으면 조금 더 중립적으로 데이터를 다룰 수 있었을 것 같다 이뿐만 아니라, aducanumab이 최신 약제이기에 비용효과성 분석이 진행된 논문이 몇 개 없어 중점적으로 살펴본 논문 수가 적었다는 한계가 있었다 특히 aducanumab과 donanemab의 비용효과성을 비교한 논문의 경우 donanemab이 아직 시판 허가가 되지 않아 약가가 설정되지 않은 약물이기에 여러 가지
가정을 전제로 비용효과성 분석을 진행하였다 이러한 가정들을 바탕으로 분석이 진행되었기 때문에 분석의 정확성이 떨어졌을 수 있다 따라서 추후 조사에서는 통계적 기법에 대한 이해를 바탕으로 데이터를 분석하고, 다양한 관점의
자료들을 수집하여 논문 작성자의 의견을 보다 비판적으로 수용하면 본 조사의 한계를 극복할 수 있을 것으로 보인다
바이오젠은 22년 9월 28일, 일본 에자이(Esai)와 공동 개발 중인 lecanemab의 임상 3상 시험(CLARITY AD)에서
긍정적인 결과를 얻었다는 내용을 발표하였다 정확한 발표는 22년 11월 29일 알츠하이머병 임상시험(Clinical Trials on Alzheimer's Disease, CTAD) 에서 공개될 예정이지만 결과를 간략히 살펴보면, lecanemab은 aducanumab보다 BBB
투과성이 높아 치료 효율이 더 높고, 임상 3상에서 1차 평가변수와 모든 주요 2차 평가변수에 있어서 통계적으로 유의미한
결과를 보였다고 한다[11] 특히, lecanemab(ARIA-H의 발생 비율: 투약군의 약 0 7%)은 aducanumab(ARIA-H
발생비율: 투약군의 약 14%)에 비해 뇌출혈을 포함한 염증 부작용이 적은 결과를 보였다고 한다[12] BBB를 통과하여
치료 효율을 높임과 동시에 ARIA에 대한 부작용을 낮춘 것은 눈여겨볼 결과이며, 학회지가 완성되는 시점에서 이런 자료가 공개되어 lecanemab의 자세한 임상 결과를 이번 학회지에서는 다루지 못하여 아쉬웠다 향후에 lecanemab의 임상 3상의
결과를 aducanumab의 임상 3상 결과와 함께 비교 분석해 본다면 의미 있는 결과를 얻을 수 있을 것으로 생각한다
[1] Ryan Waters, L. U. (2019). EvaluatePharma World Preview 2019.
[2] 2021 매출 출처: Biogen. (2022. 04. 21). Annual Report 2021. Retrieved from https://investors.biogen.com/static-files/316c17ed-0bff-458c-9204-5d38e65e3526
[3] 2022 매출 출처: Biogen. (2022. 10. 25). Biogen Reports Third Quarter 2022 Results. Retrieved from https://investors.biogen.com/static-files/6dbb5555-ed48-4739-a3dc-d6e833b02a07
[4] https://www.biopharmadive.com/news/fda-under-fire-for-aduhelm-approval-starts-reviewof-another-alzheimers/626649/
[5] https://investor.lilly.com/news-releases/news-release-details/lillys-donanemab-receives-usfdas-breakthrough-therapy
[6]https://www.alzforum.org/therapeutics/gantenerumab#:~:text=In%20October%202021%2 C%20the%20FDA,2021%2C%20Washington%20University%20in%20St
[7] http://www.monews.co.kr/news/articleView.html?idxno=314992
[8] Woolf, C., Slavin, M. J., Draper, B., Thomassen, F., Kochan, N. A., Reppermund, S., Crawford, J. D., Trollor, J. N., Brodaty, H., & Sachdev, P. S. (2016). Can the Clinical Dementia Rating Scale Identify Mild Cognitive Impairment and Predict Cognitive and Functional Decline?. Dementia and geriatric cognitive disorders, 41(5-6), 292–302. https://doi.org/10.1159/000447057
[9] 이미숙 and 김보선. (2021). 노년기 인지-언어 능력에 대한 정보제공자 보고형 평가척도(ISCOLE): 신뢰도, 타당도, 객관적 평가와의 상관성을 중심으로 특수교육재활과학연구, 60(1), 265-288.
[10] Lee, J., Kim, H., Seo, Y. K., Kang, H. W., Kang, W.-C., & Jung, I. C. (2018). A Research to Evaluate the Reliability and Validity of Pattern Identifications Tool for Cognitive Disorder: A Clinical Study Protocol. Journal of Oriental Neuropsychiatry, 29(4), 255–266.
https://doi.org/10.7231/JON.2018.29.4.255
[11] https://www.prnewswire.com/news-releases/lecanemab-confirmatory-phase-3-clarity-adstudy-met-primary-endpoint-showing-highly-statistically-significant-reduction-of-clinical-declinein-large-global-clinical-study-of-1-795-participants-with-early-alzheimers-disease301634888.html
[12] https://www.hankyung.com/it/article/202210317029i
김소중
Team R&D 팀장
Aducanumab이라는 약을 주제로 신약 개발과정에서 R&D, 임상, 허가 급여 분야에 대해 폭 넓게 공부해 볼 수 있었습니다
FDA 승인 논란의 구체적인 내용을 알기 위해 임상 3상의 통계 자료를 처음부터 끝까지 분석하면서 임상시험 디자인 비교와
결과 비교 등 다양한 경험을 해본 좋은 기회였습니다 BBB 통과 메커니즘과 이중항체 신약 개발에 대해서도 알아보며 현재
알츠하이머병 치료제의 한계와 앞으로의 개발 방향에 대해 능동적으로 생각해볼 수 있어서 좋은 시간이었습니다
박승연
Aducanumab 에 대해 공부하면서 현재 사용되고 있거나 연구되고 있는 치매 치료제에 대해 공부하면서 아직까지 치매의
원인에 대해 잘 알지 못하고 있다는 사실을 알게 되었습니다 아직도 파악되지 않은 질병들이 많고 연구의 필요성을 느끼게
되었습니다 또한 aducanumab 임상에 관한 논문을 자세히 공부하면서 임상 디자인 및 프로토콜, 결과 해석 등 다양한
내용을 접할 수 있어 임상에 관한 시각을 키울 수 있어 좋은 시간이었습니다
이번 아두카누맙 파이프라인 스터디에 R&D 팀으로 참여해 연구개발부터 임상, 허가제도와 급여문제까지 직접 수많은
논문을 읽고 분석하다 보니 학계의 분위기나 트렌드가 치료제의 연구방향에 중대한 영향을 미친다는 것을 체감할 수 있었습니다 이처럼 주체적으로 연구의 동향을 파악하고 흐름을 추적할 수 있는 시각을 갖게 된 것이 Pharmtivation을 통해 얻게 된 가장 큰 자산 중 하나이자 앞으로도 꾸준히 우리가 나아가야 할 방향이라고 생각합니다
알츠하이머병과 aducanumab에 관한 공부를 하며 단순히 지식을 얻는 것 이상의 경험을 할 수 있었습니다 주어진 정보를 있는 대로 받아들이지 않고 다양한 해석과 의견을 참고하며 주체적인 결론을 내리고자 긴 시간 고민하기도 했습니다 그
과정에서 그동안 학교에서 배웠던 파편화된 지식을 정리하고 연구의 맥락을 살필 수 있었으며, 제 부족한 점도 절실히 느낄 수 있었습니다 앞으로 약학도로서 공부하고 고민해야 할 것들이 무엇인지 조금이나마
활동을 통하여 각각의 임상 단계에서 정확히 어떤 일을 하는지를 공부할 수 있었던 기회라고 생각합니다 Aducanumab뿐만 아니라 추후에 다른 의약품에 대해서도 이러한 탐구를 진행하는 기회를 가지고 싶습니다 통계 처리 과정에서도 발생할 수 있는 여러 가지 문제점이나 이를 해결하는 방안을 배운 것 같습니다
Team Clinical Study 팀장
박신영 하나의 약제에 대해 R&D, 임상, 그리고 허가급여라는 다양한 측면에서 공부한 것은, 학교에서 배우는 지식을 적용해보는
것을 너머 약학이라는 학문을 보다 넓고 유기적으로 바라보는 시야로 바라볼 수 있게 해준 소중한 경험이었습니다 배웠던
지식을 적용하여 임상결과를 직접 해석해보고, 근본적인 것부터 논리에 오류는 없는지 비판적으로 판단하는 과정에서
주체성과 능동성을 기를 수 있었습니다 또한, 임상 결과에 대한 논란이 있었음에도 FDA가 승인을 해준 것, 그리고 급여
측면에 대해 공부를 하면서 신약이 승인되는 것이 단순히 임상에 대한 성공과 실패를 가르는 것이 아닌, 다른 약제 뿐 아니라
해당 약물이 속해 있는 시장 자체에도 큰 영향을 미치는 매우 종합적이고 입체적인 일임을 배울 수 있었습니다 그리고
다양한 분야에 대한 필요성을 느끼고 학습의 원동력을 부여해주었던 매우 의미 있는 활동이었습니다
기존에는 의약품의 개발에 있어서, 임상시험 결과의 중요성만 생각했었습니다 하지만, 이번 활동을 통해 임상의 전반적인
과정을 살펴보며, 임상시험은 여러 요소를 고려해 디자인하는 것도 중요하고, 진행 과정에서 이를 수정 없이 잘 지키는 것 역시 결과 해석에 영향을 줄 수 있기 때문에 중요함을 알게 되었습니다 또한 결과 해석 시, 통계 처리 방법 및 분석자가 생각하는 자료의 중요도의 차이에 따라 임상의 성공여부가 결정됨을 보고 , 다각도에서 자료를 해석하는 것의 중요성을
느끼게 되었습니다
임상시험에 대해 공부하면서 동일한 연구 결과도 분석하는 시각에 따라 그 결과가 다르게 해석되는 양상을 확인하면서
다양한 관점에서 자료를 이해하는 경험을 하였습니다 실제로 임상시험 결과를 단순히 숫자 그 자체로 받아들이기 보다는
자료의 유의성을 고려하여 적절한 분석법을 이용했을 때 비로소 정확한 해석이 이루어진다는 것을 배웠습니다 연구자로서
통계 분야에 대한 공부의 필요성을 다시 한 번 느낄 수 있었던 뜻 깊은 시간이었습니다
김세현
첫 스터디 및 학회 활동인 만큼 용어 숙지와 메커니즘 이해에 어려움을 겪었지만, 임상시험 팀의 일원으로서 임상 실험의
과정을 탐구하고 실제로 신약이 상용화되기까지 필요한 요건들을 알아볼 수 있었습니다 또한, 아직 원인조차 알려지지
않은 알츠하이머의 위험성을 상기하고 예측되는 원인, 진단 키트, 혈액 진단법 등 질병의 다양한 방면을 알아보며 신약
개발의 필요성을 느끼고 이것을 알리는 학회지 활동의 의의를 깨달아 이 점에서 동기부여 받았습니다
이예린
Team Approval & Reimbursement 팀장
Pharmtivation을 통해 개발부터 허가까지 전 과정을 살펴보며 하나의 신약이 만들어지는 과정을 자세히 살펴볼 수 있었고, 여태껏 수업에서 배운 지식들이 현실세계에서는 어떻게 적용되는지 살펴볼 수 있어 좋은 기회였습니다 허가 및 급여
측면에서 약물을 조사해보는 것에 그치지 않고, 동일한 약물을 임상이나 개발과 같은 측면에서 조사한 다른 팀과 내용을
나눠보는 과정에서 다양한 인사이트를 얻을 수 있었습니다 또한 자료를 직접 찾아보는 과정에서 능동적으로 사고할 수
있는 힘을 기른 것 같아 개인적으로도 성장할 수 있었습니다
Aducanumab은 알츠하이머병의 증상 완화가 아닌 질병을 조절하는 치료제가 없던 상황에서 첫 FDA 승인을 받음과 동시에 논란도 많았던 약제이기에 매우 흥미로운 사례연구 주제였습니다 이번 연구를 통해 해당 약제가 개발이 된
배경부터 허가 및 급여까지 신약 개발의 전 과정을 보는 안목을 기를 수 있었고, 무엇보다 문헌 자료를 있는 그대로
받아들이는 것이 아니라 ‘왜’ 이러한 결과가 나왔는지 고민하는 과정에서, 그 궁금증과 의문점에 대해 학회원들과 함께
의논하며 스스로 연구할 내용을 찾아갔던 경험은 비판적인 사고와 더불어 주체성을 기를 수 있었던 소중한 경험이었습니다
알츠하이머 치료제인 아두카누맙을 주제로 임상시험부터 허가까지 신약 개발의 전 과정에 대해 공부하며 약학 지식을
실무에 적용시킬 수 있는 좋은 기회였습니다 또한 신약개발에서 적절한 허가 전략을 세우는 방법에 대해 고민하고, 임상
데이터 결과 해석에 논리적인 흠결이 없는지 등을 직접 판단하며 비판적 사고를 기를 수 있는 값진 경험이 되었습니다
하나의 약이 개발되어 허가되는 과정에 대해서 자세히 공부할 수 있는 좋은 기회였습니다 또한 같은 자료로 판단하더라도
무엇에 중점을 두느냐에 따라 허가 여부가 달라질 수 있다는 것이 인상적이었습니다 Pharmtivation을 통해 논문을
읽으면서 어떤 것이 신뢰할 만한 정보인지 판단하는 연습을 하게 되었는데 앞으로 다른 논문들을 읽게 되어도 그대로
수용하는 것이 아니라, 사실과 주장을 구분하면서 비판적으로 보는 자세를 유지하고 싶습니다
김재민 약의 개발 단계부터 허가, 약가 책정 및 조정, 허가 이후의 추가적 단계들까지 전반적인 과정을 배울 수 있었습니다 실제
임상 결과들을 접하면서 수동적인 태도로 결과를 받아들이는 것이 아니라 통계의 한계점(통계적 방법, 임상시험이 진행된
환경과 조건 등)과 분석의 목적에 맞게끔 사후분석을 조정해서 결과가 차이가 날 수 있다는 점들을 유의하면서 비판적으로
바라보아야 한다는 점을 깨달았습니다
Copyright 2022. Pharmtivation. All rights reserved.

