중앙대학교 약학대학 제약산업 연구 학회 API

저자
중앙대학교 약학대학 제약산업연구학회 API
김수정, 박세희, 김소연, 김지윤, 김현지, 손채린
윤시원, 김주연, 신지혜, 이승연, 이지원
임서연, 황숭흠, 박소윤
지도교수
중앙대학교 약학대학 제약산업 및 사회약학 연구실
이종혁
대표
회장: 김수정(sooz1221@gmail.com)
부회장: 박세희(shp990529@gmail.com)

중앙대학교 약학대학 제약산업 연구 학회 API

저자
중앙대학교 약학대학 제약산업연구학회 API
김수정, 박세희, 김소연, 김지윤, 김현지, 손채린
윤시원, 김주연, 신지혜, 이승연, 이지원
임서연, 황숭흠, 박소윤
지도교수
중앙대학교 약학대학 제약산업 및 사회약학 연구실
이종혁
대표
회장: 김수정(sooz1221@gmail.com)
부회장: 박세희(shp990529@gmail.com)
2.1. 총론
2.2. 진단 및 중증도 평가
2.3. 치료 가이드라인
3.1. 총론
3.2. 졸레어
3.3. 누칼라·싱케어·파센라
3.4. 듀피젠트
3.5. 테즈파이어
이슈
4.1. 바이오시밀러
4.2. 듀피젠트 특집
5.1. 치료제 매출 분석
5.2. 회사별 호흡기 질환 파이프라인
5.3. 발전 방향
천식은 전 세계적으로 수백만 명이 앓고 있는 만성 호흡기 질환으로, 특히 중증 천식은 환자의 일상 생활을 크게 제한하고, 건강 관련 삶의 질을 심각하게 저하시켜 효과적인 치료 방법에 대한
논의가 끊임없이 지속되어 왔다. 중증 천식 환자들은 전통적으로 고용량의 경구 스테로이드제제 를 사용해 왔지만, 이들 약물의 장기 사용은 심각한 부작용을 초래할 수 있으며, 일부 환자에서는 스테로이드에 대한 의존성에도 불구하고 천식 증상이 충분히 조절되지 않는 임상적 한계가 존재 한다. 효과적인 천식 관리와 치료 방법에 대한 다양한 논의 끝에 중증 천식 환자를 대상으로 한 치료 전략은 기존의 전통적인 경구 스테로이드제제에서
이러한
이와
인 관심이 높아지면서 더욱 가속화되고 있다.
호흡기 질환에 대한 전반적
경구 스테로이드제제는 염증을 억제하고 천식 증상을 완화하는 데 있어 오랫동안 표준 치료로
사용되어 왔다. 그러나 장기적인 스테로이드 사용은 골다공증, 고혈압, 당뇨병, 백내장, 면역억 제 등 심각한 부작용의 위험을 증가시킨다. 더불어, 고용량 스테로이드 치료에도 불구하고 천식 증상이 잘 조절되지 않는 환자들에게는 다른 치료 대안이 절실히 필요하다. 이러한 임상적 요구 에 대응하여, 최근에는 특정 환자 집단에서 생물학적 제제가 새로운 치료 옵션으로 떠오르고 있
으며, 이들 약물은 천식의 기전적 특성을 타겟으로 하여 더욱 정밀한 치료를 가능하게 한다.
생물학적 제제는 천식의 기저에 있는 면역학적 경로를 직접적으로 조절함으로써, 전통적인 치 료제와는 다른 기전을 통해 증상을 개선한다. 특히, 중증 호산구성 천식이나 스테로이드 의존성 천식 환자들에게서 생물학적 제제는 매우 유효한 치료 옵션으로 자리잡고 있다. 예를 들어, 누칼 라, 싱케어, 파센라와 같은 항-IL-5 생물학적 제제들은 호산구 매개 염증을 억제하여 천식 악화 빈도를 유의미하게 감소시키며, FEV1과 같은 폐 기능 지표의 개선을 유도한다. 이러한 임상적 유효성은 여러 대규모 무작위 임상시험에서 입증되었으며, 이는 기존의 스테로이드 기반 치료와 는 차별화된 생물학적 제제의 강점을 부각시킨다.
이와 더불어, 생물학적 제제의 장기적인 사용에 따른 경제적 부담을 완화하기 위해, 이들 치료
제에 대한 급여 등재 논의도 활발히 진행되고 있다. 이미 일부 생물학적 제제는 급여 등재가 이루
어졌지만, 아직 급여 등재가 이루어지지 않은 치료제들이 많으며, 이들의 급여 등재는 환자들에 게 생물학적 제제에 대한 접근성을 확대하고, 치료 비용 부담을 줄이는 데 중요한 역할을 할 것 이다. 급여 등재는 환자들이 보다 효과적이고 안전한 치료를 받을 수 있도록 지원하며, 궁극적으
로는 전체적인 건강관리 체계 내에서 천식 관리의 질을 향상시키는 데 기여할 것이다.
따라서 본 학회지에서는 중증 천식 치료제의 허가 과정과 임상적 근거, 그리고 급여 등재와 관
련된 최신 동향을 심도 있게 분석하고자 한다. 이를 통해 중증 천식 환자들이 보다 효과적이고 안
전한 치료를 받을 수 있도록
함을 목표로 하고 있다. 더불어, 생물학적 제제의
향후 천식 치료의 표준을 재정립하고, 더 나아가 환자
데 기여하는 것을 목표로 한다.
김성호. (2024.05.23). 중증천식은 ‘중증질환’…겪어보지 못하면 이해 못 해. 헬스경향. Retrieved from https://www.k-health.com/news/articleView.html?idxno=66911
김수연. (2024). “한국 중증 천식 갈 길 멀었다...모든 생물학적제제 급여로 맞춤형 치료 환경 갖춰야”. 팜뉴스. Retrieved from https://www.pharmnews.com/news/articleView.html?idxno=236611
김윤미. (2023.09.22). 생물의약품, 스테로이드 의존성 중증 천식 환자에 해법. 청년의사. Retrieved from https://www.docdocdoc.co.kr/news/articleView.html?idxno=2025359
윤병기. (2024.05.03). 코로나19 사실상 종식되니 급증하는 ‘천식’. 후생신보. Retrieved from https://www. whosaeng.com/152028
이영재. (2024.07.17). 중증 천식 치료 패러다임 생물학적 제제 중심 전환. 의협신문. Retrieved from https:// www.doctorsnews.co.kr/news/articleView.html?idxno=155614
2.1 총론
2.2 진단 & 중증도 평가
2.3 치료 가이드라인
이승연 itcsrh1310@gmail.com
신지혜 shinjihye603@gmail.com
이지원 ezy7829@gmail.com
황숭흠 heumi1005@gmail.com
천식은 만성 기도 염증을 특징으로 다양한 임상 양상을 보이는 질환이다. 가변적인 호기 기류
제한과 함께 시간에 따라 중증도가 변하는 호흡기 증상(천명, 호흡곤란, 가슴 답답함, 기침 등)
의 병력이 있는 것으로 정의된다. 하나 또는 여러 개의 증상들이 우세할 수 있으며 가변적인
나타날 수 있다.
이러한 천식의 정의는 천식 치료(ICS를 포함하는
중증 천식에 대한 명확한 정의는 없으나, 일반적으로 중증 천식은 고용량 흡입스테로이드( ICS, inhaled corticosteroid) 및 그 이상의 조절제를 쓰고도 조절이 잘되지 않는 천식으로 정의 한 다.
2024 GINA 가이드라인에서는, 최적화된 4-5단계의 치료 1(고용량 ICS-LABA)에 대한 높은 순응도와 천식 유발 인자의 조절에도
천식은 나라에 따라 1-29% 인구에 영향을 미치는 일반적이고 만성적인 호흡기 질환이다. 천
식은 만성 기도 염증과 기도 과민성 반응을 주요 특징으로 하지만, 이러한 특징들이 천식 진단을
하는 데 필수적인 것은 아니다. 기도 과민성 반응이란 정상인에게는 해가 적은 자극에 대해 기도
수축이 일어나는 것으로 이로 인해 가변적인 호기 제한과 간헐적인 증상이 나타난다.
가변적인 호기 기류 제한 및 호흡기 증상(천명, 호흡곤란, 가슴 답답함, 기침 등)은 주로 운동,
알레르겐 및 자극성 물질에의 노출, 기후
지만
천식의 증상 및 호기
호흡기 바이러스 감염에 의해서 촉발된다. 하
지 않을 수 있으며 치료에 따라 완화될 수 있다. 하지만 반대로 환자들은 갑작스러운 악화를 경
험할 수 있고 이는 생명을 위협하고 환자와 사회에 심각한 부담을 지워줄 수 있다. 천식으로 인 한 사망의 대부분은 중저소득 국가들에서 일어난다.
천식의 주요 증상은 호흡곤란, 기침, 천명이다. 하지만 이 증상들은 다른 질병에 의해서도 생길 수 있으므로 철저한 병력 청취와 신체 진찰을 통해 환자가 호소하는 증상이 전형적인 천식에 의
한 것인지 아니면 천식 이외의 질환이나 동반 질환에 의한 것인지 확인이 필요하다.천식
상에 대한 천식 이외의 고려할 상태 혹은 질환은 다음 과 같다.
[ 표 1] 천식의 주요 증상과 가능 질환
증상 가능한 질환
호흡곤란
기침
천명
만성폐쇄성폐질환, 비만, 심혈관질환, 컨디션 저하
성대기능부전, 상기도기침증후군, 위식도역류질환, 기관지확장증, ACE억제제 복용
비만, 만성폐쇄성폐질환, 기관-기관지연화증, 성대기능부전
임상 천식 표현형(clinical asthma phenotypes)은 인류통계학과 천식의 임상적 특징을 기 반으로 천식의 표현형을 분류한 것이다. 일부 중증 천식 환자에서는 표현형에 따른 치료가 가능 하지만, 대부분의 임상 천식 표현형은 특정한 질병 진행 과정이나 치료제 반응성과 상관관계가
있지는 않다. 그러나 천식의 병태생리학적인 과정들을 반영하는 생물학적 지표는 조절이 어려운
천식과 중증 천식의 치료 및 평가에 있어서 도움이 된다.
2]
천식 표현형
천식 알레르기성 천식은 가장 쉽게 발견되는 천식 표현형이다. 유년기부터 시작해 습 진, 알레르기성 비염, 음식 또는 약제 알레르기 질환에 대한 과거력이나 가족력을 동반한다. 천식 치료 전 유도 객담 검사에서 호산구성 기도 염증이 주로 확인되 며, 알레르기성 천식 표현형을 가진 환자는 흡입 스테로이드 치료에 잘 반응한다.
비알레르기성 천식
기침성 천식 및 기침이 우세한 천식
비알레르기성 천식은 알레르기와 연관되지 않은 기전의 천식으로, 유도 객담검사 에서 이 표현형의 환자들은 호중구성, “호산구성”, 또는 비과립백혈구성일 수 있 으며 흡입 스테로이드 치료에 잘 반응하지 않는다.
기침성 천식은 일부 어린아이나 성인에서 기침이 유일한 천식의 증상인 천식을 의 미한다. 가변적인 호기성 기류제한이 기관지 유발 검사에서 나타나지 않을 수 있 다. 일부 환자들은 이후 천명과 기관지 확장제 반응성이 나타날 수 있다. 흡입 스 테로이드가 포함된 치료가 효과적이다.
성인 발병 천식은 일부 성인, 특히 여성에서 성인기에 처음으로 발병하는 천식 으로 대부분 비알레르기 천식이다. 고용량의 흡입스테로이드가 필요하거나 상대 적으로 스테로이드 치료에 반응하지 않으며 직업성 천식과의 감별이 필요하다. 지속적 기류제한을 동반한 천식 지속적 기류제한을 동반한 천식은 기도 리모델링으로 인한 기류제한이 지속되거 나 불완전한 가역성을
성인 발병(후기 발병) 천식
유도 객담 검사란?
유도 객담검사를 시행하는 목적은 천식 및 기타 호흡기 질환에서 기도 염증의 특징을 확인하기 위한 것 이며, 유도 객담검사는 기도 염증을 측정하는 직접적이고 상대적으로 비침습적이며 재현성이 높은 방법 이다 객담이 자연적으로 생성될 수 없는 하부 기도에서 적절한 검체를 수집하기 위하여 등장성 혹은 고
장성 용액을 흡입하도록 하여 객담 유도를 하게 된다 특히 유도 객담 내 호산구 수는 천식의 매우 유용한 지표 중 하나이며, 천식의 표현형이나 치료 반응의 예측에도 도움을 주고 있다 일반 정상인의 객담 내 호산구 세포 분율을 3% 미만으로, 호산구가 3% 이 상일 때 증가하여 있다고 볼 수 있다
1) 천식 증상은 복합적이며 가변적이다.
대부분의 환자는 기침과 호흡곤란이 동반되며
2) 환자에 따라 다른 양상의 발작이 반복된다.
심한 천식 발작은
수
1) 천명 숨을 들이쉬고 내쉴 때 쌕쌕거리는 숨소리가 난다. 심하지 않은 천명은 청진기로 청진해
들린다.
2) 기침
주로 한번 시작하면 끊임없이
3)
4) 호흡곤란
빨대를 입에 물고 숨을 쉬는 것처럼 숨쉬기가 매우 힘들어지기도 하며, 심할 경우에는 전혀 숨
을 쉬지 못할 정도가 되어 의식을 잃고 응급실로 실려 갈 수 있다. 한편, 천식의 호흡곤란은 숨을
들이쉴 때보다 내 쉴 때 더 힘이 드는 경우가 많다.
5) 가래
좁아진 기관지에 염증이 동반되어 점막 표면에 분비물이 많아지며 그것이 바깥으로 배출된 것 이 가래이다. 가래는 좁아진 기관지를 막아서 기침을 발생시키며 호흡곤란을 더 악화시킨다.

[ 그림 1] 천식의 주요 증상
빠른 호흡, 호기의 지연, 빠른 심박수, 건성 수포음 등 이 나타날 수 있다. 심각한 경우에는 산소
부족으로 인한 청색증이 나타나기도 한다. 또한 팔다리의 무감각을 느끼거나 손바닥에 땀이 나 기 시작하며 의식을 잃을 정도의 흉통으로 이어지기도 한다.
증상 체크리스트
- 기침이나 쌕쌕거리는 숨소리가 나고 쉽게 없어지지 않으며, 자주 반복된다.
- 차가운 날 이나 바람이 많이 부는 날 가슴이 답답하고, 쌕쌕거림이 나타나고 기침이 난다.
- 감기를 앓고 나서 한 달 이상 기침이 자꾸 난다.
- 밤에 잠을 자다가 심한 기침이나 숨이 차서 깬 적이 있다.
- 담배 연기, 매연 등을 맡고 가슴이 답답해지거나 숨이 차고 기침이 심하게 난 적이 있다.
- 감기약을 먹고 나서 숨이 가빠져서 고통스러웠던 적이 있다.
천식의 발병기전은 표현형에 따라 다양하며 복잡하다. 앞서 천식의 정의 단락에서 살펴보았듯 이 원인에 따라 알레르기성 천식, 비알레르기성 천식으로 구분하기도 하고, 증상이나 발병원인
에 따라 기침성 천식, 성인 발병 천식, 비만이 동반된 천식, 직업성 천식 등으로 구분하기도 한다.
이 부분에서는 알레르기 천식과 호산구성 천식을 중심으로 천식의 발병기전을 알아보고자 한다. [ 그림 2] 천식의 발병에 관여하는 면역세포와 사이토카인

알레르기성 천식은 IgE에 의해 매개되는 것으로 알려졌으며, 이는 우리 몸이 집먼지진드기, 바 퀴벌레, 동물 비듬, 곰팡이 등과 같은 항원에 노출되었을 때 생성된다. IgE가 생성되면 기도 점 막에 있는 비만세포의 Fc Receptor에 결합하고, 비만세포의 세포 과립에 저장되어 있던 다양한 매개체들이 유리된다. 유리된 histamine, tryptase, leukotriene C4, D4 및 prostaglandin D2는 급성 기관지 수축, 점액분비 증가, 혈관 투과성 증가, 혈관확장 등을 일으키며 천식의 초 기 반응이 나타난다.
후기 천식 반응은 초기 천식 반응 3~6시간 후 지속적인 기관지 수축으로 일어날 수 있으며, 이
는 기관지 염증성 증가와 기도 점막 내 염증 세포 유입과 관련 있다. Th2 림프구에서 생성되는
사이토카인, 특히 IL-4, 5 및 13이 후기 천식 반응의 주원인으로 추정된다. 이들 사이토카인은 호산구를 유인하여 활성화하고, B 림프구를 자극하여 IgE를 생성시키며, 기도 상피세포를 자극 하여 점액을 생성시킨다.
호산구에서 나오는 TGF-β는 기도의 구조적 변화를 일으킨다. 그 결과 기도의 탄력성을 잃게
되는 기도개형(airway remodeling)이 나타날 수 있다. 기도개형은 질환의 중증도와 연관이
있으며 비가역적 기도협착을 가져오기도 한다. 호염구나 호산구에서 분비된 씨스테닐 류코트리 엔은 기도 평활근을 수축시키고 혈관 투과성을 높이며, 염증세포들을 유인한다. 또한 점액이 과 다분비하여 섬유화가 되도록 한다. 결과적으로 씨스테닐 류코트리엔은 강력한 기도 수축을 유 발한다.
이외에도 천식의 반응에는 다양한 매개체가 작용하며, 각 매개체에 대한 자세한 설명은 다음 의 [ 표 3]를 통해 정리해보았다.
천식의 주요 세포 매개 물질
주로 기도상피세포에서 발현되며 염증세포들을 기도로 동원하는데 중요하다
케모카인 (chemokine)
씨스테닐 류코트리엔 (cysteinyl leukotriene)
CCL11(eotaxin)은 선택적으로 호산구를, CCL17와 CCL22는 Th2세포를 동원시 킨다
사이토카인 (cytokine)
히스타민 (histamine)
산화질소 (nitric oxide, NO)
비만세포와 호산구에서 분비되는 강력한 기도 수축, 전염증성 매개체이다 약제에 의해 억제되었을 때 폐기증 및 천식 증상 호전을 보이는 유일한 매개체이다
천식의 염증반응을 관장하고 중증도를 결정한다 - IL-1β, TNF-α : 염증반응을 증폭시킨다 - GM-CSF : 기도 내 호산구의 생존기간을 늘린다. - Th2세포 유래 시토카인; - IL-5 : 호산구의 분화 및 생존에 필요 - IL-4 : Th2세포의 분화 및 IgE 발현에 중요 - IL-13 : IgE 발현에 필요
비만세포에서 분비되며 기도수축 및 염증반응에 기여한다. 항히스타민제는 효과가 제한적이고 부작용이나 내성 발현 때문에 천식의 치료에 역할이 크지 않다.
기도상피세포의 유도산화질소신타아제(iNOS)에 의해 생성된 강력한 혈관 확장 물 질이다.
프로스타클란딘 D2 (prostaglandin D2) 비만세포에서 유래된 기도수축 물질이며 Th2세포의 동원에 역할을 한다
최근 혈중 호산구 수치가 높은 천식 환자들을 대상으로 “호산구성 천식”이라는 표현형이 새로 정의되었다. 호산구성 천식이란 알레르기성 천식과 발병기전이 유사하지만, 특히 호산구 수치가
높은 경우를 말한다.
알레르기성 천식과 호산구성 천식에서 모두 호산구 유래 사이토카인에 의한 염증 작용이 나타
날 수 있다.알레르기성 천식은 비만세포나 호염구에서 나오는 히스타민, 프로스타글란딘 등에
의한 염증 작용이 특징적이다. 반면 호산구성 천식은 Th2 유래 사이토카인에 의해 활성화되는 혈중 호산구 수치가 특히 높은 것이 특징적이다. 알레르기성과 호산구성 천식은 특징적으로 활
성화되는 염증세포는 다르지만 두 경우 모두 다양한 사이토카인에 의해 기도 과민성, 기도 수축, 기도 염증, 기도 개형 등의 공통적인 증상이 나타나게 된다. 이로 인해 아직 임상에서는 알레르 기성과 호산구성 천식을 혼용해서 쓰는 경우가 많다. 천식의 표현형에 따라 치료 방법이 달라지
므로 전문가들 사이의 합의가 필요한 것으로 보인다.

2022 천식 진료지침에 따르면, 전 세계적으로 2025년에는 천식환자가 4억 명에 이를 것으 로 예상되며 생활습관의 서구화 및 도시화로 천식 유병률의 증가 추세는 앞으로도 계속될 것으 로 예상된다.
천식 국내 유병률은 최근 업데이트된 2024년 4월의 질병관리청 통계 자료를 보면 19세 이 상 성인 기준 3.0±0.3% 이다. 또한, 천식 국내 유병률은 국민건강영양조사에 따르면 1998년
1.2%에서 2010년 3.1%까지 지속해서 증가하다 10여 년 동안 3% 전후의 수치를 유지하는 것으로 나타났다. 연령대별 유병률을 살펴보면, 70세 이상에서는 전반적으로 6~8% 전후를 유 지하고 있고, 비교적 젊은 성인층인 19~49세에서는 1998년부터 2017년까지 꾸준히 증가하 는 경향을 보인다. [ 그림 4] 국내 천식 진단의 연도별 추이



한편, 국내 천식 사망률은 대한천식알레르기학회에 따르면 인구 10만 명당 천식 연관 사망률 (AAD)은 2003년 16.2명에서 2015년 28명으로, 인구 10만 명당 천식 기여 사망률(ACTD)은
2003년 4.8명에서 2015년 13.8명으로, 천식 인구 10만 명당 중증 천식 연관 사망률은 2003
년 1917건에서 2015년 2650건으로 각각 증가하였다. 즉 천식으로 인한 사망률이 10년 사이 에 3배 증가한 상황에 놓여있는 것으로 조사된 것이다. 또한 해당 학회에 따르면 우리나라의 천
식 사망률은 천식 인구 10만 명당 연령표준화 사망률이 4.2명으로 OECD 국가 중 2위에 해당
하는 수준이다. 물론, 이러한 수치는 비OECD 국가에 비하면 매우 낮은 수준이나, 의료 수준이
비슷한 주요 선진국의 수치와 비교할 때 사망률이 높아 국내 천식 사망률에 대한 유의성이 높다
고 볼 수 있다.
이러한 천식으로 인한 사망 대부분은 불충분한 치료와 급성 악화 시 치료가 늦어져 발생하기
때문에, 효과적으로 천식을 치료하고 관리하여 사망을 예방하는 것의 중요성이 더욱 대두되고 있다.
천식은 사회 경제적으로 중요성을 띄고 있는 질병이다. 일례로 2017년 건강보험공단 추계 상 천식에 대해 3479억 원의 총 진료비용이 소요되었 다. 이는 천식 의료비용이 치 료와 약물 등에
소요되는 직접 의료비용과 천식으로 인한 생산성 저하 등의 간접 의료 비용으로 구분된다는 점
에서 천식으로 인한 경제적 비용의 손실은 그 이상임을 짐작할 수 있다.
이러한 사회 경제적인 부담은 중증 천식 환자에서 더욱 악화된다. 국가 건강보험 청구 자료로 분석한 연구에 따르면, 국내 중증천식 유병률은 6.1~10%로 보고되고 있다. 이는 세계천식기구 (Global Initiative for Asthma, GINA)에서 제시하는 6.1% 보다도 높은 수치이다. 또한 이러 한 국내 중증 천식 환자의 숫자는 지속해서 증가하는 추세를 보이고 있다. 2002년 전체 천식 환 자 중 중증천식의 유병률은 3.5%로 조사되었는데, 2015년 6.1%를 기록하였으며 현재는 최대 10%까지 이를 것으로 추정된다. 뿐만 아니라 사망률에서도 중증 천식의 누적 사망률은 일반적
인 천식과 비교하였을 때 1.5배 이상 더 높은 것으로 보고되었다.
이와 같이 높은 중증 천식의 위험성과 더불어 중증 천식의 질병 부담은 비중증 천식에 비해 상
당히 높다. 이는 중증천식의 위험성과 밀접한 관련이 있는데, 중증 천식 환자는 비중증천식 환자 보다 약물의 사용이 많으며, 외래나 응급실 방문 역시도 잦은 편이기 때문이다. 특히 천식 악화
로 인한 입원 역시 빈번하다. 또한 경구 스테로이드 사용의 비중이 높아, 이에 따른 약물 부작용 으로 추가되는 의료 비용도 간과할 수 없다.
대한천식알레르기학회에 따르면 중증 천식 환자의 병원 방문 횟수는 비중증 환자보다 약 3배 많으며, 그에 따른 약제비용도 10배 이상 높다. 실제로 중증 천식 환자의 약제비는 월 100만 원 이상에 달하는 수준으로 조사되었으며, 중증 천식은 전체 천식 의료 비용의 50~60%를 차지하 는 것으로 보인다. 나아가 중증 천식 환자의 직업 중단율은 44.4%, 직업 중단 기간도 평균 약 7 년 정도이며 그에 따른 국내
또한 우리는 중증 천식 환자가 겪는 열악한 삶의 질에 대해서도 주목할 필요가 있다. 중증 천 식 환자들은 심각한 기침과 가래 등의 호흡기 증상으로 거의 모든 일상생활에 제약이 있어 상당
한 불편감을 안고 생활한다. 이와 더불어 천식 악화에 대한 불안감이나 생명 위협에 대한 공포
감, 우울감 등 막대한 정신적 고통을 겪는 것으로 조사되었다. 중증 천식 환자의 삶의 질에 관한
PRISM(Precision medicine intervention in severe asthma) 연구에 따르면, 중증 천식
환자의 삶의 질은 암 환자보다도 낮은 수준으로 조사되었다. 해당 연구에서 조사한 중증 천식 환
자의 삶의 질 환산 점수는 0.803으로, 이는 주요 만성질환 중 가장 낮은 수치였으며, 0.861인 암 환자보다도 좋지 않은 수준이었다.
결론적으로 전체 천식에서 중증 천식이 차지하는 비율은 5~10%로 다소 적은 수치로 치부될 수 있지만, 환자 개개인이 겪어야 하는 질병 부담과 사회경제적으로 발생하는 부담을
을 때, 중증 천식의 치료
천식은 특징적인 증상 패턴과 가변적인 호기성 기류 제한에 기반하여 진단하며, 이때 한 가지
이상의 검사가 필요할 수 있다. 이러한 검사 중 가장 흔히 사용하는 폐활량측정법(spirometry)
은 많은 의료 전문가들에게 접근성이 낮다. 만약 폐활량측정법을 이용할 수 없다면, 증상에만 기
반하여 진단을 내리기보다 최고호기유속(PEF) 을 이용해 호기성 기류 제한도 확인해야 한다. 또
한, 흡입 코르티코스테로이드(ICS, inhaled corticosteroid) 치료를 시작하기 전에 천식 진단 을 문서화하는 것이 요구되는데 이는 천식 조절이 개선되면 진단 확인이 어렵기 때문이다.이는 천식 증상이 개선되면 진단을 확인하는 것이 종종 더 어렵기 때문이다. 이미 ICS 치료를 받고
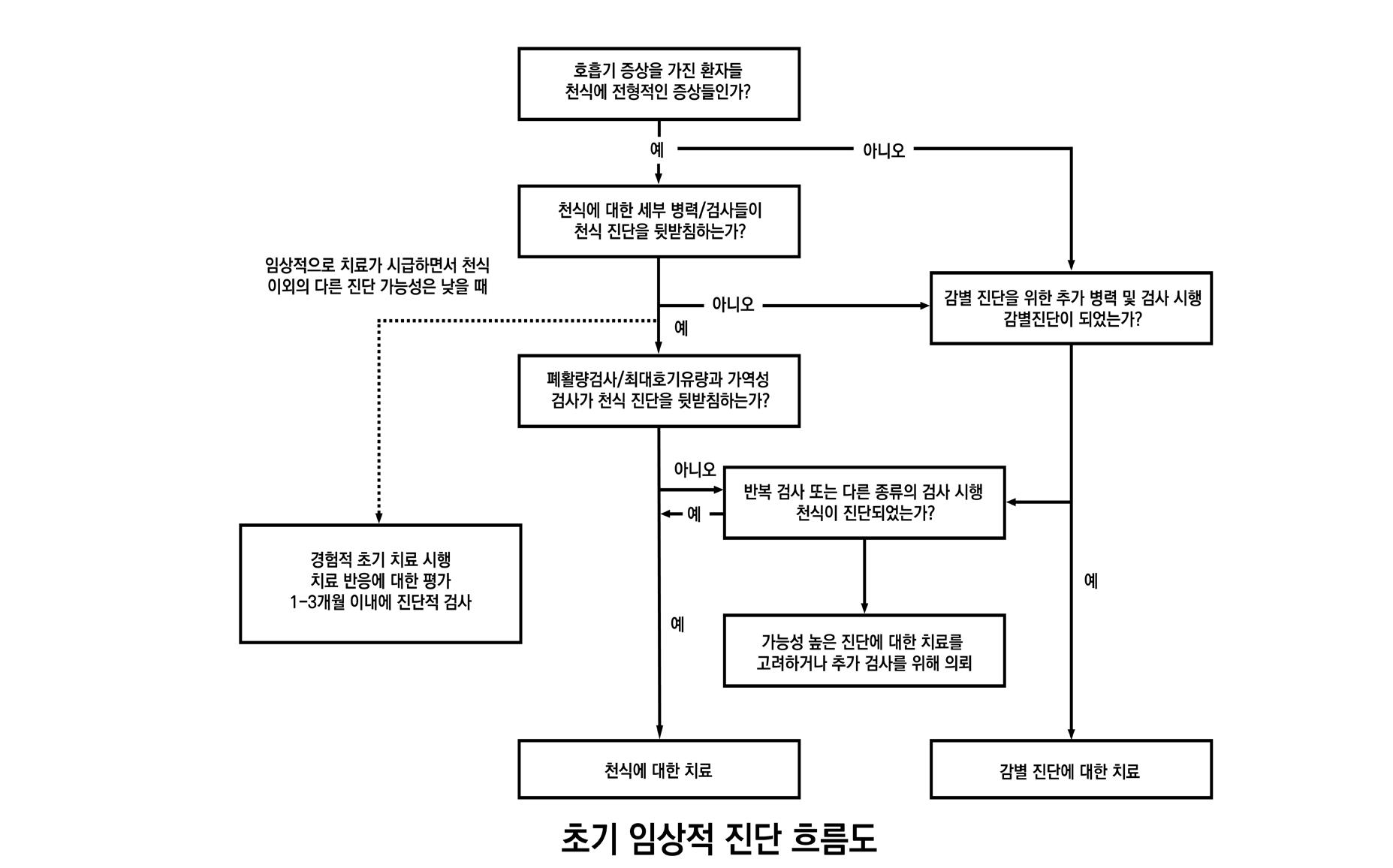
증상에 의한 진단
천식의 진단은 호흡기 증상의 특징적인 패턴을 확인하는 데 기반을 둔다. 다음과 같은 증상을
보이는 경우 천식을 의심할 수 있다.
- 천명
- 호흡곤란
- 가슴답답함
- 기침
이러한 호흡기 증상은 천식 이외의 질환에 의해서도 발생할 수 있으므로 증상의 패턴을 확인하
는 것이 중요하다. 다음의 [ 표4]에서 천식 진단 기준이
표 4] 천식의 진단 기준 - 반복적인
호흡기 증상의 병력 임상 양상 진단적 특징
천명, 호흡곤란, 가슴답답함, 기침 (문화와 연령의 차이에 따라 표현은 다를 수 있음) 두 가지 이상의 호흡기 증상 (성인에서 다른 호흡기 증상 없이 기침만 있는 경우 천식은 드묾)
- 시간에 따른 변화를 보이며 다양한 강도로 나타남 - 야간 또는 기상 직후 악화되는 장상
- 운동, 웃음, 알레르겐, 찬 공기 등에 의해 유발되는 증상 - 바이러스 감염에 의해 유발 또는 악화
천식 환자의 진찰 소견은 정상인 경우가 많으며 다른 질환에 의해서도 위의 증상이 나타날 수 있다는 것을 고려해야 한다. 천식의 가장 흔한 이상 소견은 천명음이지만 들리지 않는 경우도 많 으며 크게 심호흡하는 경우에만 들리기도 한다. 매우 심한 천식의 급성 악화 시 공기의 흐름이 너무
다음과 같은 증상에서는 다른 질병의 가능성을 고려해야 한다.
- 다른 증상이 동반되지 않은 기침
- 객담을 동반하는 만성 기침
- 어지러움, 현기증 또는 손발 저림이 동반되는 호흡곤란
- 흉통
- 흡기음이 크게 들리는 운동유발 호흡곤란
천식 진단은 증상과 더불어 호기 시 가변적인 기류제한을 증명함을 통해서 이루어질 수 있다. 호기 시 가변적인 기류제한은 짧은 시간 안에 정상보다 심하게 변화하는 기류 제한으로 천식 진 단의 핵심이 된다.
가변적인 호기 기류제한을 증명하기 위해 가장 흔히 사용되는 방법은 폐활량측정법 (spirometry) 이다. 이 방법에서는 1초간 강제호기량 (FEV1), 강제폐활량 (FVC), 최고호기유속 (PEF) 등의 수치를 참고한다. 특히 폐활량측정법에 대한 접근성이 떨어질 때, GINA 2024에서는 PEF 를 이용하는 것을 권고하고 있다. PEF는 폐활량측정법에 비해 신뢰도가 떨어지므로, PEF를 측 정할 때는 매번 동일한 측정기를 사용하고 측정된 세 가지 판독값 중 가장 높은 값만을 사용해 야 한다.
천식에서는 FEV1 이나 PEF가 감소함을 확인할 수 있다. 그러나 이는 다른 폐질환에서도 나 타나므로 천식을 진단하기 위해서는 FEV1/FVC의 비율이 감소된 ‘폐쇄 이상’을
명시되어 있다.
2022 천식 진료 지침에 따르면 전형적인 천식 증상이 있는 환자에서 다음과 같은 폐기능의 과
도한 변동성이 확인된 경우 천식으로 진단할 수 있다.
- 기관지확장제 투여 후 또는 질병조절제 사용 후 폐기능의 증가
- 운동 후 또는 기관지유발검사 후 폐기능 저하
- 병원 방문 시마다 또는 최소 1-2주 동안 집에서 모니터링을 하였을 때 정상 범위를 벗 어난
폐기능의 변화
PEF의 경우 2022 천식 진료지침에 따라 일중변동률을 계산하여 하루 2회 측정치의 차이를 일일 평균치에
검사 중 최고치로
20% 이상이면
할
변
가능하다.
기류 제한 FEV1이 낮을 때 최소 한번 이상 FEV1/FVC (<0.75-0.8) 감소 확인 그리고
심한 폐기능 변동 (아래 검사 중 하나 이상)
기관지확장제에 의한 가역반응 양성
폐기능 변동이 심할수록, 자주 나타날수록 진단적 가치가 높음 초기검사에서 음성일 때, 증상이 있을 때 혹은 이른 아침에 검사를 시행할 수 있음
Salbutamol 200-400 mcg (or 동량의 다른 흡입속효성베타작용제(SABA)) 흡입 10-15분 후 FEV1 의 증가>12% 이면서 >200ml ( >15%이면서 >400ml 증가한 경우 더 신뢰) 검사 전 SABA 최소 4시간, 하루 2번 사용하는 흡입지속성베타작용제(LABA) 사용 시 24시간 이상 혹은 하루 1번 사용하는 LABA 사용 시 36시간 이상 중단
2주 이상 과도한 최대호기유량의 변동 평균 일중 최대호기유량 변동 > 10% (일일 2회 측정)
4주 이상 항염증 치료 후 폐기능 호전
유발검사 양성
4주 치료 후 FEV1 증가가 > 12%이면서 > 200ml, 또는 최대호기유량 > 20% 증가 (단 호흡기 감염이 없는 경우에)
후 FEV1 감소가 > 10%이면서 > 200ml 기관지유발검사 양성
흡입 후 FEV1 감소 ≥ 20%
고장성 생리식염수 혹은 만니톨 흡입 후 FEV1 감소 ≥ 15%
측정한 폐기능검사에서 FEV1 변동 > 12%이면서 > 200 ml (단 호흡기 감염이 없는 경우에)
기류제한을 증명하기 위한 다른 방법에는 기관지유발검사, 알레르기 검사, 호기산화질소 측정 검사, 영상 검사 등이 있다. 기관지유발검사는 메타콜린, 히스타민 등을 이용하는 검사로 특이도
가 낮다. 알레르기 검사는 혈청 특이 IgE 항체의 측정으로 아토피 여부를 판정하는 원리이며, 아
토피가 있으면 천식일 가능성이 높기 때문에 진단에 이용될 수 있다. 그러나 모든 천식의 표현형
에서 나타나지 않을 수 있다는 단점이 있다. 호기산화질소는 호산구 염증을 특징으로 하는 천식
에서 더 높게 나타나며 객담과 혈액의 호산구와 연관된다. 영상 검사는 치료가 어려운 성인 천식
에서 동반 질환이나 대체 진단의 가능성을 조사할 때 이용된다.
이미 ICS 치료를 받고 있는 환자를 진단하는 방법은 환자의 증상과 폐기능에 따라 달라진다. 환자의 상황에 따라 질병조절제의 용량을 낮추거나 중단할
에서 확인할 수 있다.
[ 표 6] 천식을 확진하기 위해 치료 단계를 낮추는 방법 평가
- 천식 조절과 폐기능을 포함하여 환자의 현재 상태를 확인한다. 환자가 천식 악화의 위험인자가 있는 경우 철저한 관리없이 단계를 낮추지 않는다.
- 호흡기 감염, 휴가, 임신 등이 아닌 적당한 때를 골라야 한다.
- 환자가 천식 악화를 인식하고 대처할 수 있도록 서면화된 천식 행동지침을 제공한다. 천식이 악화된다면 이전 약제로 돌아갈 수 있는 충분한 약이 있는지 확인한다. 조정
- 환자에게 흡입스테로이드(ICS)를 25-50% 줄이거나 흡입지속성베타작용제(LABA), 항류코트리엔제(LTRA)와 같은 추가 조절제를 끊어 본다.
- 2-4주 후에 방문일을 정해준다. 반응점검
- 2-4주 후에 천식 조절의 평가와 폐기능 검사를 재시행한다.
- 증상이 악화되거나 가변적인 기류제한이 있는 경우 천식으로 확진하고 이전에 효과적이었던 가장 낮은 단계로 조절제 를 높인다.
- 증상 악화가 없고 가변적인 기류제한이
소아 천식 진단
5세 이하의 소아에서는 천식 이외에도 천명과 기침을 유발하는 질환이 흔하기 때문에 천식 진
단이 쉽지 않다. 그리고 일반적으로 폐기능 검사를 시행하기 어렵다. 그러므로 이러한 경우 임상 적 진단을 통해 천식을 진단한다.
반복적인 천명이 있으면서,
- 부모 중 최소한 1명이 천식의 진단을 받은 경우
- 알레르겐 특이 IgE 양성
- 본인의 아토피피부염 과거력이나 동반력
- 높은 혈청 총 IgE 수치
- 호흡기 감염을 동반하지 않은 천명
- 기관지확장제나 전신 스테로이드에 의한 천명이나 호흡곤란이 호전된 경우
위와 같은 경우에는 천식일 가능성이 높다.
6세 이상의 소아의 경우 성인과 천식 진단 방법이 동일하다. 소아 천식 진단에서는 다른 질환 유무에 대한 평가가 매우 중요하다.
천식의 감별진단은 연령에 따라 나눌 수 있다. 먼저 성인의 경우 아래와 같은 질병과 감별진단
을 고려해야 한다.
[표 7] 성인 천식의 감별진단
연령대 감별진단 증상
만성 상기도기침증후군
기도 내 이물질
기관지확장증
6-11세
원발섬모운동이상증
선천심장병
기관지폐형성이상
낭성섬유증
재채기, 코가려움, 코막힘, 헛기침
갑작스러운 증상 발생, 일측성 천명
객담을 동반한 기침, 반복적인 감염
반복적인 감염, 객담을 동반함 기침, 비부비동염
심잡음
조산, 출생 후부터 증상
과도한 기침과 객담, 소화기 증상
12-39세
40세 이상
만성 상기도기침증후군
기도 내 이물질
기도 내 이물질
선천심장병
성대기능부전
과호흡, 호흡기능장애
기관지확장증
낭성섬유증
알파1 항트립신 결핍증
성대기능부전
과호흡, 호흡기능장애
만성폐쇄성폐질환
기관지확장증
심부전
약물관련 기침
폐실질 질환
폐색전증
중심기도폐쇄
모든 연령 결핵
재채기, 코가려움, 코막힘, 헛기침
갑작스러운 증상 발생, 일측성 천명
심잡음
호흡곤란, 흡기 시 천명(협착음)
어지러움, 이상감각, 한숨
객담을 동반한 기침, 반복적인 감염
과도한 기침과 객담
호흡곤란, 조기 폐기종 발병의 가족력
호흡곤란, 흡기 시 천명(협착음)
어지러움, 이상감각, 한숨
기침, 가래, 노작성 호흡곤란, 흡연/ 유해물질 노출
객담을 동반한 기침, 반복적인 감염
노작성 호흡곤란, 야간 증상
안지오텐신변환효소 억제제 복용
노작성 호흡곤란, 마른 기침, 곤봉지
갑작스러운 호흡곤란, 흉통
호흡곤란, 기관지확장제에 무반응
만성 기침, 객혈, 호흡곤란, 피로, 발열(야간), 발한, 식욕감퇴, 체중감소
소아 천식의 경우, 바이러스성 세기관지염, 반복적인 호흡기 바이러스 감염, 만성상기도기침 증후군, 기관-기관지 연화증, 기관지폐형성이상, 기도 내 이물질, 위식도역류 등과 감별진단해 야 한다.
천식 조절 여부는 환자의 치료 경과, 중증도 등을 판단하는 중요한 지표이다. 이에 ‘천식 조절’ 의 평가 기준을 명확히 하는 것이 필요하다. 천식 조절은 ‘현재 증상 조절’과 ‘미래의 위험’으로 평가한다.
즉, 천식의 증상적 완화뿐만 아니라 급성 천식 악화 등의 미래 위험성도 적을 때 ‘잘 조절되는 천식’이라 평가한다. 천식 증상 조절 평가와 미래의 위험 평가에 대해 차례대로 알아보도록 한다.
천명, 가슴 답답함, 호흡 곤란 등 천식 증상은 환자의 일상생활에 큰 부담을 줄 수 있으며 잘 조절되지 않을 경우 천식 악화의 위험성을 높인다. 이에 천식 증상이 잘 조절되는지 평가하는 것
은 ‘천식 조절’의 중요한 평가 지표이며, 병원 방문 등 기회가 있을 때마다 수시로 평가하는 것
이 권장된다.
[ 표 8] 천식 증상 조절 평가 천식 증상 조절
지난 4주간 환자가 경험한 증상 있음 없음 조절 부분 조절 조절 안 됨
일주일에 2번을 초과하는 주간 증상 모두 없음 1-2개 3-4개
천식으로 인한 야간 증상
일주일에 2번을 초과하는 증상완화제 사용
천식으로 인한 활동 제한
천식 증상 조절 정도는 4주간의 증상을 4가지 항목 (증상 주간 빈도, 밤에 깨는 등의 야간 증
상, 증상 완화제 사용 빈도, 활동 제한)에 대해 평가한다. [ 표 8]의 각 항목에 대해 증상 유무를 조사하고, 4가지 항목 모두 증상이 없으면 ‘조절’, 1-2개 증상이 있으면 ‘부분 조절’, 3-4개 증 상이 있으면 ‘조절 안 됨’으로 평가한다.
이외 천식 조절 상태를 평가하는 도구로, 천식 조절설문 (ACQ, Asthma Control Questionnaire), 천식 조절검사 (ACT, Asthma Control Test)가 있다.
[ 표 9] ACQ와 ACT
초기 ACQ는 ACQ-5로, 천식 증상 5가지에 대해 평가하는 검사였지만 ACQ-6, ACQ-7이 추 가되었다. ACQ-6는 ACQ-5에 증상완화제 사용 여부를 판단하는 문항을, ACQ-7는 ACQ-6
에 기관지 확장제 사용 전 FEV1에 대한 문항을 추가한 것이다. ACQ 검사 결과 점수가 0.75 미
만인 경우 ‘잘 조절되는 천식’, 1.5 이상인 경우 ‘잘 조절되지 않는 천식’이라 평가한다.
ACT
ACT 검사 결과 20-25인 경우 ‘잘 조절되는 천식’, 15 이하인 경우 ‘잘 조절되지 않는 천식’이 라 평가한다. ACT는 4-11세를 위한 c-ACT (Childhood ACT)가 별도로 존재하며 19 이상인 경우 ‘잘 조절되지 않는 천식’이라 평가한다.
ACQ, ACT, c-ACT의 구체적인 검사 항목을 비교한 내용은 다음 [표 10]과 같다.
야간에 잠에서 깸
(환자, 부모)
증상 완화제 사용
천식 자가 진단
(환자) 기침 + (환자)
비교 항목은 야간 증상, 심각한 야간 증상, 일상생활 제한, 숨가쁨, 천명음, 증상완화제 사용, 천식 조절 자가 평가, 기침, 주간 천식 증상으로, 각 검사 항목에 해당하는 경우 + 로 나타냈다.
특히 c-ACT의 경우 평가자 주체가 아이인지 부모인지 또한 나타냈다.
위험 평가
미래 위험 평가는 급성 천식 악화, 고정 기류 제한, 약물 부작용 위험의 미래 위험성에 대해 평 가한다. 이는 천식을 진단할 때 시행하며 이후 특히 급성 악화를 경험한 환자에 주기적으로 시 행한다.
1) 급성 천식 악화 급성 천식 악화는 심한 경우 사망을 초래할 수
조정 가능한 급성 천식 악화의 위험인자
∙ 약물 : 흡입 속효성 β2 항진제(SABA) 다량 사용 (월 1통 초과 사용할 때 사망 위험 증가), 흡입 스테로이드의 부적절한 사용이나 처방받지 않음,
약물 순응도 감소, 흡입기 사용법 미숙
∙ 동반 질환 : 비만, 만성 비부비동염, 위-식도 역류 질환, 식품 알레르기, 임신
∙ 환경 노출 : 흡연, 감작 항원, 대기오염
∙ 주변 환경 : 주요 정신적 또는 사회경제적 문제
∙ 폐기능 : 낮은 FEV1 (특히 예측치의 60% 미만), 높은 기관지확장제 반응성 (high bronchodilator response)
∙ 2형 염증 지표 상승 : 혈액 호산구수, 호기산화질소 (흡입 스테로이드 사용 중인 성인 알레르기 천식 환자)
증상이 잘 조절되더라도 이 중 한가지라도 해당사항이 있으면 미래의 나쁜 예후 위험이 있음 그 외 급성 천식 악화의 독립적 주요 위험인자
천식으로 기관삽입이나 중환자실 치료
천식 증상이 잘 조절되더라도 ‘조정 가능한 위험인자’, ‘그 외 독립적 주요 위험인자’ 중 해당 사 항이 있다면 급성 천식 악화의 미래 위험이 있다고 평가할 수 있다. 조정 가능한 급성 천식 악화 위험인자로는 크게 약물, 동반 질환, 환경 노출, 주변 환경, 폐기능, 2형 염증 지표 상승이 있다. 구체적 예시로는, 흡 입 속효성 β2 항진제( SABA) 다량 사용, 비만, 만성 비부비동염, 흡연, 불 안, 우울증, 낮은 FEV1 등이 있다. 그 외 독립적 주요 위험인자로는 천식으로 기관삽관, 중환자 실 치료 과거력 그리고 지난 12개월간 1회 이상 중증 천식 악화가 해당한다.
2) 고정 기류 제한
천식 환자는 폐 기능 저하가 빨라 지속적인 기류 제한으로 인한 호흡 곤란의 위험성이 크기 때 문에 미래 기류 제한 가능성을 평가하는 것이 중요하다. 이에 병력, 약물, 흡연 등의 기류 제한
위험인자를 조사하여 미래 위험성을 평가한다.
고정 기류 제한의 위험인자
∙ 병력 : 조산, 저체중출생아 또는 급격한 유아기 체중 증가, 만성 점액 과다분비
∙ 약물 : 흡입 스테로이드 미사용
∙ 환경 노출 : 흡연, 유해 화학물, 직업 노출
∙ 검사 : 낮은 초기 FEV1, 객담 또는 혈중 호산구 증가
3) 약물부작용
천식 환자는 대부분 장기간 약물 복용을 하므로 약물 부작용에 대한 미래 위험성 평가가 필요 하다. 스테로이드제 등이 약물부작용 위험인자가 될 수 있으며 특히 스테로이드제를 고용량, 장 기간 흡입할 경우 부작용 위험이 증가한다. 대부분 환자가 복용하는 ICS의 경우 전신 부작용으 로는 피부가 얇아지거나 멍이 들 수 있으며, 국소 부작용으로는 아구창, 목소리 변성 등이 나타 날 수 있다.
약물 부작용의 위험인자 ∙ 경구 : 경구 스테로이드 잦은 사용, 장기간 고용량 흡입 스테로이드 사용, P450 억제제 복용 ∙ 국소 : 고용량 흡입 스테로이드, 잘못된 흡입기 사용
천식 조절 평가에서 폐기능검사
폐기능검사는 결과만으로 천식 조절 정도를 평가할 수 없지만 다양한 평가 항목에서 중요한 지표로 고려된다. 가령 ‘천식 증상 조절 평가’에서 ACQ-7 검사에서 폐기능검사 자료가 필요하 며, ‘미래 위험 평가’에서 급성 천식 악화와 고정 기류 제한의 위험인자로 낮은 폐기능이 고려된
다. 이에 천식 치료 시작 시 FEV1을 측정하고 질병조절제 치료 3~6개월 후 폐기능을 측정하며 모니터링해야 한다.
천식 중증도 평가
적절한 천식 치료를 위해서는 중증도에 따라 환자 천식 상태를 분류하는 것이 중요하다. 천식은
크게 경증 천식, 중등증 천식, 중증 천식으로 분류되어 정의된다.
천식 중증도 평가
∙ 경증 (mild) 천식 : 1~2단계 치료로 잘 조절되는 천식
∙ 중등증 (moderate) 천식 : 3~4단계 치료로 잘 조절되는 천식
∙ 중증 (severe) 천식 : 고용량 ICS-LABA 치료가 필요한 천식 또는 고용량 ICS-LABA 치료에도 조절되지 않는 천식
천식의 중증도는 천식의 ‘조절’에 초점을 두어 정의된다. 경증 천식은 1~2단계 치료로 잘 조 절되는 천식, 중등증 천식은 3~4단계 치료로 잘 조절되는 천식이다. 그리고 중증 천식은 고용량 ICS-LABA 치료가 필요한 천식 혹은 고용량 ICS-LABA 치료에도 조절되지 않는 천식으로 즉, 5단계 치료가 필요한 천식으로 정의된다. 단계가 증가할수록 고강도 치료를 의미하며 각 단계별 자세한 내용은 치료 가이드라인 파트(p.54~) 에서 다룬다.
단, 중증도 평가는 천식이 잘 조절되어 최소 유효 용량을 찾기 위해 step down 한 경우, 천식 이 최대 용량에도 몇 달간 잘 조절되지 않은 경우에는 사용할 수 없음에 유의해야 한다.
하지만 때에 따라 중증도 평가가 학문적으로 정의된 바와 다르게 사용되는 경우가 있다. 가령 community에서는 일반적으로 중증 천식은 조절과 무관하게 증상이 자주 나타나는 것을, 경증
천식은 증상이 매일 나타나거나 빠르게 완화되는 경우로 사용한다. 또, 역학 조사에서는 천식 조 절 단계와 무관하게 진단된 치료에 의해서만 천식을 분류하기도 하며, 다른 가이드라인은 ICS 치료 시작 전의 기준인 SABA 빈도, 증상 등으로 분류하기도 한다.
중증 천식 평가 시 주의점
천식 중증도 평가에 따르면 4단계 치료에도 불구하고 조절되지 않는 천식의 경우 중증 천식으 로 정의된다. 실제 약물에 불응하여 조절되지 않은 천식의 경우 중증 천식으로 정의해야 하지만 흡입기 사용법 미숙 등 다른 원인에 의한 것인지 구분할 필요가 있다. 후자의 경우 중증 천식으로
정의하기보단 천식이 조절되지 않은 원인을 분석하고 해결하여 천식을 개선해야 하기 때문이다.
이에 중증 천식 진단을 내리기 전에 다음과 같은 사항들을 확인해 볼 필요가 있다.
중증 천식 진단 전 확인 사항
∙ 흡입기 사용법 미숙
∙ 낮은 약물 순응도
∙ 유도성 후두 폐쇄, 심부전, 체력 부족 등으로 인한 부정확한 천식 진단
∙ 비부비동염, 위-식도 역류 질환 , 비만, 폐쇄성 수면 무호흡증 등의 복합 질환
∙ 가정, 직장에서 감작성, 자극성 물질에 지속적 노출
천식 치료 약제
천식 치료의 목표는 천식 조절 상태에 도달하고, 증상완화제가 필요 없을 정도로 조절상태를 잘 유지하여 환자들의 정상적인 일상생활을 유지하는 것이다. 이때, 천식에 의한 사망, 급성 악
화, 지속적인 기류 제한, 약물 부작용을 최소화하는 것이 중요하다.
천식 치료 약제는 질병조절제, 증상완화제, 기타 추가약물로 구분할 수 있다. 우선 질병조절
제는 천식 증상 조절을 위해 규칙적으로 사용하는 약물을 의미한다. 장기간 매일 꾸준히 사용하
여야 하는 약제로, 항염증 효과가 있는 것이 특징이다. 질병조절제의 사용은 기도 염증, 천식 증
상, 급성 악화, 폐 기능 저하 위험을 감소시킨다. 증상완화제는 천식 증상이 발생하였을 때 증상
경감을 위하여 필요시에 사용하는 약물이다. 신속하게 기도를 확장시켜 천식의 증상을 완화하 며, 이는 모든 천식 환자에게 제공된다. 다음으로 기타 추가약물은 고용량의 질병조절제를 사용 함에도 불구하고 증상이 지속되거나 급성 악화가 있을 때 추가하는 치료제이다. 기타 추가약물
로는 지속성 항콜린제, Theophylline, 그리고 본 학회지에서 다루게 될 생물학적 제제가 있다.
1) 흡입 스테로이드(ICS, Inhaled corticosteroids)
지속성 천식을 치료하는 가장 효과적인 항염증 약제이다. 단기적으로는 기도 염증을 감소하고 기도 과민증을 호전시키며 폐 기능을 개선한다. 궁극적으로는 천식증상을 감소시키고 삶의 질을
개선하며 천식 사망률을 감소시킨다. 그 기전은 광범위한 항염증 효과에 의한 것으로, 부분적으 로 염증성 사이토카인의 생성을 억제하고 기도에서 림프구, 호산구, 비만세포의 침윤을 억제한
다. 이는 기관지 과민성을 감소시키고 기관 점막 내부의 충혈된 혈관을 수축시키며 β 수용체 효 능약의 효과를 강화시킨다. 그럼에도 천식 완치는 불가하며, ICS 를 중단하면 환자들은 천식 증 상의 악화를 겪는다. 또한, 용량을 높여서 사용할수록 효용 대비 부작용 위험이 증가하므로 용량 의 증가보다는 타 질병조절 약제의 추가가 적절할 수 있다.
ICS의 대표적인 국소 부작용은 구강 칸디다증, 목소리 변형, 상기도 자극에 의한 간헐적 기
침이 있다. 이러한 국소 부작용이 적은 약제로는 Ciclesonide가 있는데, 이는 prodrug로 흡 입하므로 폐 도달한 이후에 활성화된다. 전신 부작용으로는 폐에서 약물이 흡수된 이후에 나타 나는 부작용으로, 부신 억제, 멍, 골밀도 감소, 백내장, 녹내장, 결핵 등이 있다. Ciclesonide, Budesonide, Fluticasone은 용량대비 전신 부작용이 상대적으로 적은 약제이다. 소아에서 는 ICS 가 가장 효과적인 질병조절제이나, 고용량 사용 시 성장 속도가 저하될 수 있다.
2) 흡입 스테로이드(ICS) + 흡입 지속성 β2 작용제(LABA, Long Acting Beta2 Agonist)
ICS에 추가로 LABA를 사용할 수 있다. LABA의 작용 기전은 Adrenoreceptor 중 기관지 평활근과 혈관 평활근에 주로 존재하는 β2 수용체를 활성화해 기관지 평활근을 이완시킨다. LABA의 투여로 기대할 수 있는 효과는 천식 증상 및 야간 증상 감소, 폐 기능 호전, 천식의 악 화 빈도 감소이다. 이렇게 복합제로 약물 투여 시 대부분의 환자에서 질병 조절이 더 빨리 되며
흡입 스테로이드의 사용 용량을 감소시킬 수 있다. 증상 조절이 되면, 가능한 LABA 사용은 중 단하고 흡입 스테로이드만으로 질병 조절을 유지하는 것이 권고된다. 대표적인 부작용으로는 심 혈관 자극, 골격근 진전, 저칼륨 혈증이 있다.
ICS + LABA의 대표적인 조합은 Budesonide + Formoterol, Beclomethasone + Formoterol, Fluticasone + Salmeterol이 있다.
3) 류코트리엔 조절제
류코트리엔이란, Arachidonic acid에 5-lipoxygenase가 작용하여 생성되는 염증 매개 물질 이다. 기도의 호산구, 비만세포, 대식세포 등 다양한 염증세포에서 합성된다. 천식에서 나타나는
다양한 증상에 영향을 주는 것은 LTC4, LTD4로, 이들은 기관지 수축, 기관지 반응성 증가, 점 막 부종, 점액 과다 분비 등을 유도한다. 류코트리엔 수용체 길항제는 약간의 기관지 확장 효과가 있으며, 기침 등의 천식 증상 감소, 폐 기능 호전, 기도 염증 감소 효과를 갖는다. 대표 약물로는 Montelukast, Pranlukast가 있다. 류코트리엔 조절제를 단독 사용 시에는 흡입 스테로이드보 다 효과가 명백하게 적으나, 일부 흡입 스테로이드 부작용이 심하거나 사용할 수 없는 환자에서 초기에 사용한다. ICS에 류코트리엔을 추가하여 사용할 수 있으며, 이 경우 ICS에 LABA를 추 가하여 사용할 때보다 열등한 효과를 보인다.
부작용으로는 두통, 어지러움, 피로감 등 가벼운 중추신경계 부작용이 드물게 발생하는 것을 제외하고는 거의 없다. 다만, Montelukast의 경우 FDA에서 심각한 정신건강 부작용을 경고 하였다.
증상완화제는 천식의 급성 악화 시에 기도 폐쇄를 완화하기 위한 목적으로 사용한다. 운동유발 천식 환자에서 운동 전 처치로서 일차적으로 사용한다. 주기적으로 사용하는 약물이 아니라, 증 상이 있을 때 필요에 따라 사용하는 약물로 이 약제의 이틀 이상의 지속적인 사용은 천식 조절이
제대로 이루어지지 않음을 의미한다.
1) 흡입 속효성 β2 작용제(SABA, Short Acting Beta2 Agonist)
대표적인 약물로는 Salbutamol, Terbutaline, Fenoterol, Levalbuterol, Pirbuterol 등이 있다. 부작용으로는 진전, 빈맥 등이 있으며 장기간 과용량 사용 시 오히려 천식 관련 사망 위험
도를 증가시킨다. 단독치료 역시 같은 맥락에서 권유되지 않는다.
2) 저용량 흡입 스테로이드(ICS) + Formoterol
성인 및 청소년의 경증 천식에서 필요 시에 저용량으로 사용된다. SABA의 단독 사용보다 천
식 악화를 감소시킨다. 최근에는 저용량 ICS와 Formoterol의 조합을 SABA보다 선호한다.
기타 약물
1) 전신스테로이드
꾸준한 질병조절제의 사용에도 불구하고 증상 조절이 되지 않는 경우에 경구 저용량 스테로이
드를 단기 투여하기도 한다. 멍, 골다공증, 고혈압, 당뇨, 백내장, 녹내장, 비만, 근력 약화 등 부
작용 위험이 크므로 장기간 사용은 하지 않는다.
2) Macrolide 계열 항생제
ICS + LABA의 사용에도 불구하고 증상이 지속될 경우, Azithromycin과 같은 Macrolide 계열 항생제가 사용된다. 이들은 항염증 작용을 통하여 호산구성 및 비호산구성 천식의 악화를 감소시켜 삶의 질 향상을 기대할 수 있다. 다만 부작용 위험이 크므로 장기간 사용은 하지 않는 다. 대표적인 부작용으로는 설사, 이독성, 부정맥, 항생제 내성 등이 있다.
3) 크산틴계 약물
ICS나 ICS + LABA로 천식이 조절되지 않는 성인 환자에서 제한적으로 추가할 수 있는 약물 이다. 기관지 경련을 저해할 수 있으며, 저용량에서 항염증 작용이 있으나 ICS와 LABA보다는 천식의 증상 개선 측면에서 효능이 낮다. Therapeutic range가 좁고, 약물 상호작용이 많아 서 사용 시 주의가 필요하다. Theophylline, Aminophylline이 천식의 질병 조절에 사용된다.
4) 흡입 속효성 항콜린제(LAMA, Long Acting Muscarinic Antagonist)
Ipratropium bromide와 같은 흡입 속효성 항콜린제(LAMA)는 기관지를 확장하는 역할을 한다. 항콜린제는 부교감신경 말단에서 분비되는 Acetylcholine이 무스카린 수용체와 결합하 는 것을 경쟁적으로 방해한다. Acetylcholine에 의한 기도 평활근 수축과 점액 분비 증가를 차
단하는 역할을 하여 기관지 확장 효과가 있다. ICS, ICS + LABA 투여에도 불구하고 증상이 조
절되지 않고 기도 폐쇄가 지속되는 환자에서 LAMA를 추가하며, 이를 통해 폐 기능을 개선하고
증상 완화제의 사용을 줄일 수 있다. 장기 사용에 대한 효과는 아직 미지수이나, LABA 투여에
의한 빈맥, 부정맥, 떨림 등의 부작용을 경험하는 환자에서 대체 가능한 기관지 확장제이다. 부
작용으로는 구강건조증, 변비, 녹내장 등이 있다.
5) 생물학적 제제
생물학적 제제는 기존의 천식 치료제로 충분히 조절되지 않는 환자들에게 새로운 치료 옵션으
로 제시된다. 이들은 천식의 주요 병리 기전인 염증 반응을 표적으로 하며, 중증 천식 환자의 경 구용 코르티코스테로이드(OCS) 사용을 줄일 수 있어 부작용 감소 측면에서 임상적 이점을 가진
다. 생물학적 제제는 기도 염증을 유발하고, 점액의 과다분비, 기도 과민반응 등을 초래하는 염 증 매개체나 수용체를 타겟으로 한다. 이를 통하여 염증을 근본적으로 억제하고 기도 과민성을 완화한다. 이때, 환자의 표현형을 고려하여 약제를 선정하게 된다. 현재 사용 가능한 생물학적 제 제는 알레르기성 천식환자에게 사용되는 IgE를 타겟으로 하는 졸레어(Xolair, Omalizumab), 호산구성 천식환자에게 사용되는 IL-5를 타겟으로 하는 누칼라(Nucala, Mepolizumab), 싱 케어(Cinqair, Reslizumab), 파센라(Fasenra, Benralizumab), IL-4 및 IL-13 경로를 타겟 으로 하는 듀피젠트(Dupixent, Dupilumab), TSLP를 타겟으로 하는 테즈파이어(Tezspire, Tezepelumab)가 있다.
천식의 증상조절 및 악화 감소를 위해서 초기 조절제 치료가 선택된다. 천식 환자에게 저용량 흡입 스테로이드(ICS, inhaled corticosteroid)를 조기 투여하는 경우, 증상이 2~4년간 지속
되었던 환자에 투입하는 것보다 폐 기능이 향상되었다. 그러므로 ICS를 근간으로 하는 규칙적인
조절제 치료는 천식 진단 후 가능한 한 즉시 시작해야 한다. 이때, 주기적인 치료 반응 평가 및
조정이 필요하며, 이를 통해 단계별로 치료제를 감량하거나 증량하여 증상 조절과 급성 악화, 약
제 부작용 최소화한다. 천식이 2~3개월 동안 조절이 잘 되는 경우, 최소 용량을 찾기 위해 치료
단계를 내린다. 그러나 2~3개월의 조절제 치료에도 증상이 완화되지 않거나 급성악화가 나타날
수 있다. 이러한 경우에는 치료 단계를 올리기
흡입이 잘 이루어지고 있는지, 순응도가 낮 은지, 위험인자에 노출되고 있는지, 진단이 잘 이루어졌는지 확인이 필요하다.
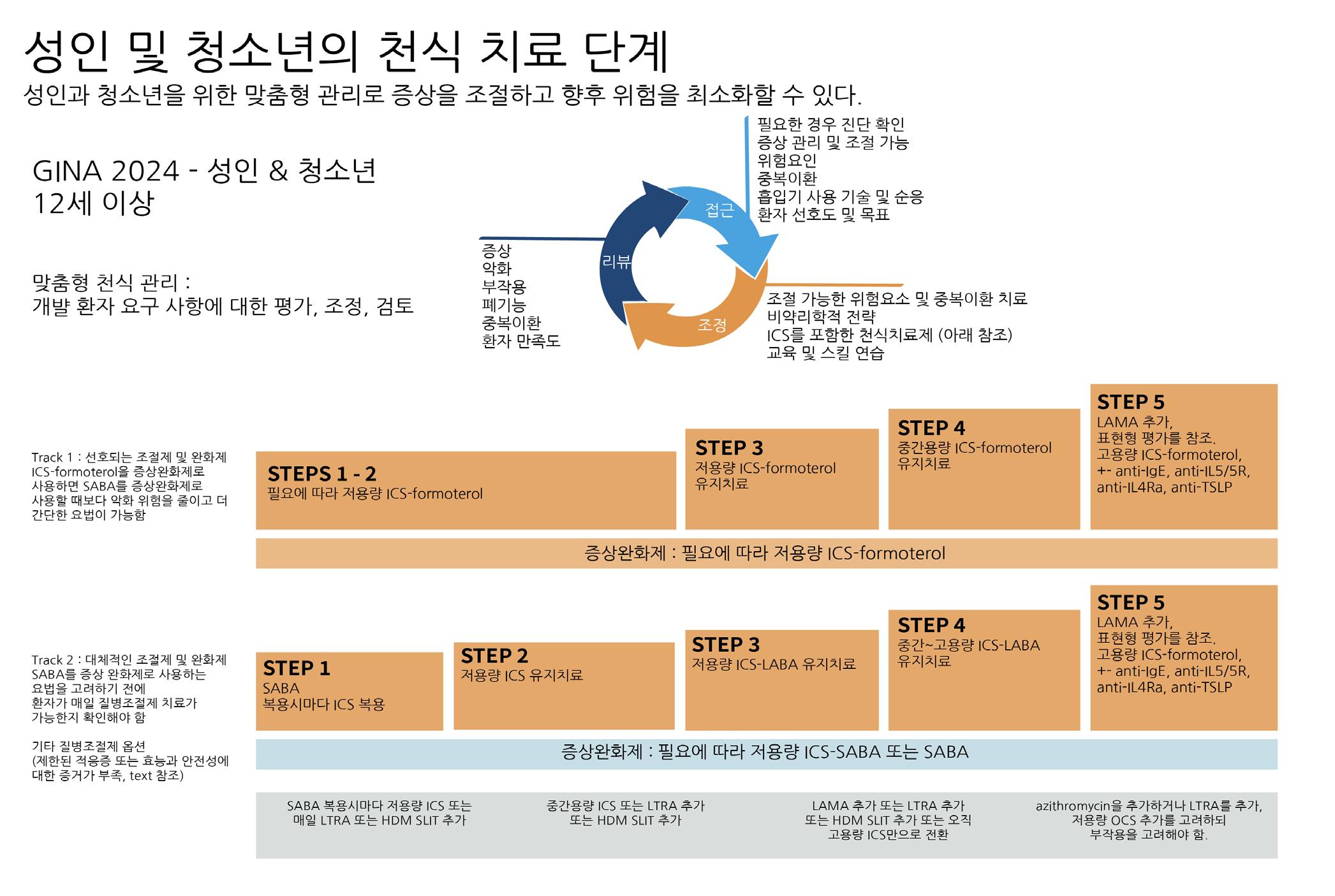
성인 및 청소년 (12세 이상)
1) 1단계: 천식 증상의 횟수가 한 달에 2회 미만이며 악화 위험인자가 없는 경우
가장 권장되는 치료(Track 1)는 필요시에 저용량 ICS + Formoterol을 사용하는 것이며, 대
안(Track 2)으로는 흡입 속효성 β2 작용제( SABA, short acting beta2 agonist) 와 저용량 ICS 치료가 있다. 이때, SABA 를 단독으로 사용하는 것은 권장되지 않는데, 천식 증상을 빠르
게 경감시킬 수는 있으나 천식 관련 사망 위험이 증가하고 폐 기능이 감소할 수 있기 때문이다.
2) 2단계: 증상이 월 2회 이상이나, 주 4~5일 미만
가장 권장되는 치료(Track 1)는 필요시에 저용량 ICS + Formoterol을 사용하는 것이며, 대 안(Track 2)으로는 규칙적 저용량 ICS와 필요시 SABA 치료가 있다. ICS를 사용할 수 없는 경
우에는 항류코트리엔제(LTRA, Leukotriene receptor antagonist)를 사용할 수 있다. 서방 형 테오필린이나 크로몰린제를 사용하는 것은 권장되지 않는데, 이는 천식 조절 효과가 약하고 부작용이 흔하기 때문이다.
3) 3단계: 거의 매일 증상이 있거나, 주 1회 이상 야간 증상 가장 권장되는 치료(Track 1)는 저용량 ICS + Formoterol을 사용하는 것이며, 대안(Track 2)으로는 저용량 ICS와 SABA를 유지 치료로 사용하며 필요시에 SABA를 사용하는 방법이 있다. 조절되지 않는 경우, ICS를 중간 용량으로 증량할 수 있으나, 흡입 지속성 β2 작용제 (LABA, long acting beta2 agonist)를 추가하는 것보다는 효과가 작고, 다른 방법으로 저용 량 ICS에 LTRA 또는 저용량 서방형 테오필린을 함께
4) 4단계: 증상이 매일 1회 이상 있, 주 1회 이상 야간 증상이 동반되며 폐 기능 저하
가장 권장되는 치료(Track 1)는 중간용량 ICS + Formoterol을 사용하는 것이며 대안(Track 2)으로는 중간용량/고용량 ICS와 LABA를 유지치료로 사용하면서 필요시에 SABA를 사용하 는 방법이 있다. 1안과 2안을 모두 시도하였음에도 천식 악화를 경험하는 환자에는 흡입 지속성
항콜린제 추가를 고려할 수 있으며, 설하면역치료 또한 고려할 수 있다. 중간 또는 고용량 ICS
에 추가될 수 있는 약제로는 LTRA, 서방형 테오필린이 있으며, 이들은 LABA보다 효과가 작다.
5) 5단계: 4단계에서 천식조절이
4단계 치료에도 천식 조절이 이루어지지 않으면, 3~6개월간 고용량 ICS + LABA 치료를 시도 해볼 수 있다. 이러한 시도에도 천식이 조절되지 않으면 추가해 볼 수 있는 것으로는 흡입 지속
성 항콜린제, Azithromycin가 있고, 최후의 수단으로 저용량 경구 스테로이드(OCS)가 있다. 그러나 OCS의 장기 사용은 심각한 부작용을 초래할 수 있어, 이를 줄이기 위하여 생물학적 제
제의 중요성이 더욱 주목받고 있다. 생물학적 제제는 특정 염증 경로를 표적으로 하여 천식의 근
본적인 원인을 억제함으로써, OCS의 사용을 최소화하거나 완전히 배제할 가능성을 제공한다.
GINA 가이드라인에서도 5단계 치료에서의 생물학적 제제의 사용을 적극 권장하고 있다. 현재
사용 가능한 생물학적 제제는 I항 IgE 치료, 항 IL-5/5R 치료, 항 IL-4Rα 치료 등이 있으며, 각각의 약물은 특정 천식 환자군에 적합하도록 설계되었다. 생물학적 제제의 선택은 환자의 표
현형에 따라 달라지며, 이는 치료 효과를 극대화하기 위해 중요한 요소로 작용한다.
1) 1 단계 : 증상이 월 2 회 미만이며 악화 위험이 낮은 경우
가장 권장되는 치료(Track 1)는 필요 시 저용량 ICS와 함께 사용되는 Formoterol이다. 대안 (Track 2)으로는 저용량 ICS와 SABA 병용 요법을 사용할 수 있다. 단, SABA 단독 사용은 권 장되지 않으며, 이는 천식 악화의 위험을 높이고 폐 기능 감소를 초래할 수 있다.
2) 2단계: 증상이 월 2회 이상이나, 주 4~5일 미만인 경우 가장 권장되는 치료(Track 1)는 필요시 저용량 ICS와 Formoterol을 사용하는 것이다. 대안 (Track 2)으로는 매일 저용량 ICS와 필요시 SABA를 사용하는 방법이 있다. 또한, ICS를 사용 할 수 없을 때는 LTRA가 대안이 될 수 있으며 서방형 테오필린이나 크로몰린제는 효과가 미미
하고 부작용이 흔하므로 사용하지 않는 것이 좋다.
3) 3단계: 거의 매일 증상이 있거나, 주 1회 이상 야간 증상이 있는 경우
가장 권장되는 치료(Track 1)는 저용량 ICS와 Formoterol을 규칙적으로 사용하는 방법이다. 대안(Track 2)으로는 저용량 ICS와 LABA를 유지 치료로 사용하며 필요시 SABA를 추가하는 방법이 있다. 만약 조절되지 않는다면, 중간용량 ICS로 증량하거나, 저용량 ICS에 LTRA를 추 가할 수 있으며 ICS 증량 후에도 조절이 어렵다면, 설하면역치료를 고려할 수 있다.
4) 4단계: 증상이 매일 1회 이상 있으며, 주 1회 이상 야간 증상이 동반되고 폐기능
저하가 있는 경우
가장 권장되는 치료(Track 1)는 중간용량 ICS와 Formoterol을 사용하는 것이다. 대안(Track 2)으로는 중간용량/고용량 ICS와 LABA를 병용하며 필요시 SABA를 사용하는 방법이 있다.
두 방법 모두 효과가 부족한 경우, 흡입 지속성 항콜린제(LAMA, long acting muscarinic antagonist)를 추가할 수 있으며, 설하면역치료도 고려할 수 있다. 이때, LTRA나 저용량 서방 형 테오필린을 보조적으로 사용할 수 있으나 효과는 LABA보다 적다.
5) 5단계: 단계 치료에도 천식 조절이 어려운 중증 천식 고용량 ICS와 LABA를 3~6개월간 시도한 후에도 조절되지 않으면, 추가로 LAMA 또는 Azithromycin을 고려할 수 있다. 마지막으로, 저용량 경구 스테로이드(OCS)를 사용할 수 있 지만, 부작용이 크므로 생물학적 제제의 사용이 권장된다. GINA 가이드라인에서는 5단계 치료
에서 생물학적 제제의 사용을 적극적으로 권장하며, 현재 항 IgE, 항 IL-5/5R, 항 IL-4Rα 치 료가 가능하고, 각 제제는 환자의 표현형에 맞추어 선택하여야 한다.
약어 정리하기
흡입 스테로이드 : ICS, inhaled corticosteroid
흡입 속효성 β2 작용제 : SABA, short acting beta2 agonist
흡입 지속성 β2 작용제 : LABA, long acting beta2 agonist
흡입 속효성 항콜린제 : SAMA, short acting muscarinic antagonist
흡입 지속성 항콜린제 : LAMA, long acting muscarinic antagonist
항류코트리엔제 : LTRA, leukotriene receptor antagonist
건강보험심사평가원. (2019). 최근 5년간 천식질환자 진료경향 분석. 건강보험심사평가원.
김민혜, 외. (2017). 유도객담검사의 시행과 해석: 전문가 의견서. Retrieved from https://synapse.koreamed.org/ upload/synapsedata/pdfdata/0206aard/aard-5-307.pdf
김상헌. (2012). 중증 천식의 임상적, 병태생리적 특징. 대한내과학회지, 83(4), 424-429.
대한결핵 및 호흡기학회. (2022). 5차 개정 천식 치료지침. 대한결핵 및 호흡기학회. 대한천식알레르기학회. (2021). 한국 천식진료지침 2021. 대한천식알레르기학회.
문윤희. (2023.05.15). 중증 호산구성 천식, 치료제 접근성 문제 개선돼야. 뉴스더보이스헬스케어. Retrieved from https://www.newsthevoice.com/news/articleView.html?idxno=32623
서울아산병원. 천식. 서울아산병원. Retrieved from https://www.amc.seoul.kr/asan/healthinfo/disease/ diseaseDetail.do?contentId=31811
신유섭. (2018.1.20). 천식, 새로운 치료와 전망. 메디포뉴스. Retrieved from https://www.medifonews.com/news/ article.html?no=134932
한국약학교육협의회 약리학분과회. (2024). 약리학 (pp. 361-362). 신일서적.
Brand, P. L., Mäkelä, M. J., Szefler, S. J., Frischer, T., & Price, D. (2015). Monitoring asthma in childhood: symptoms, exacerbations and quality of life. European Respiratory Review, 24(136), 187-193.
Global Initiative for Asthma (GINA). (2023). Global Strategy for Asthma Management and Prevention (pp. 3345). Retrieved from https://ginasthma.org
Global Initiative for Asthma (GINA). (2023). Global Strategy for Asthma Management and Prevention (pp.77). Retrieved from https://ginasthma.org
Global Initiative for Asthma (GINA). (2024). Global Strategy for Asthma Management and Prevention (pp. 2335). Retrieved from https://ginasthma.org
National Asthma Council Australia. Asthma pathophysiology. Severe Asthma Toolkit. Retrieved from https:// toolkit.severeasthma.org.au/management/asthma-pathophysiology/
Oppenheimer, J., Bleeker, E. R., Busse, W. W., et al. (2022). Allergic and eosinophilic asthma in the era of biomarkers and biologics: Similarities, differences and misconceptions. Annals of Allergy, Asthma & Immunology, 129(2), 169-180.
Papaioannou, A. I., Diamant, Z., Bakakos, P., & Loukides, S. (2018). Towards precision medicine in severe asthma: Treatment algorithms based on treatable traits. Respiratory Medicine, 142, 15-22.
Voorend-van Bergen, S., Brackel, H., Caudri, D., de Jongste, J., & Pijnenburg, M. (2013). Assessment of asthma control by children and parents. European Respiratory Journal, 41(1), 233-234.
Yoo, K. H., et. al. (2016). Burden of Respiratory Disease in Korea: An Observational Study on Allergic Rhinitis, Asthma, COPD, and Rhinosinusitis. Allergy, asthma & immunology research, 8(6), 527–534. https://doi. org/10.4168/aair.2016.8.6.527
3.1 총론
3.2 졸레어 3.3 누칼라·싱케어·파센라
3.4 듀피젠트
3.5 테즈파이어
sooz1221@gmail.com
shp990529@gmail.com
중증 천식은 염증 형태에 따라 2형 염증성 천식과 비2형 염증성 천식으로 분류할 수 있으며 이
를 기반으로 추가 치료제를 선택한다. GINA 가이드라인에 따르면 고용량 흡입 스테로이드( ICS)
를 사용하거나 경구 스테로이드(OCS)를 매일 복용함에도 아래 4가지 중 한가지라도 확인이 된
다면, 2형 염증성 천식의 가능성이 있다.
- 호산구가 혈중 ≥ 150cells/mcl, 객담 ≥ 2%
- 호기산화질소(FeNO) ≥ 20ppb
- 임상적으로 알레르기 항원에 의해 유발되는 천식
- 유지요법으로 경구 스테로이드를 사용하는 경우
1) 2형 염증성 천식
2형 염증성 천식은 천식 환자의 50~70%에서 나타나는 천식으로, IgE 의존성 반응에 의한 알
레르기성 천식과 비알레르기 호산구성 천식이 이에 포함된다. 호산구, Th2 세포, B 세포, group 2 innate lymphoid cells (ILC2), 그리고 호염기구 등이 2형 염증에 관여한다.
대체로 2형 염증성 천식 환자들은 ICS 에 좋은 반응을 보인다. 심한 2형 염증성 천식을 앓고 있는 환자들의 경우, ICS 로 는 조절되지 않는 천식 증상과 폐 기능의 저하를 경험하며 장기간의 OCS 치료로 생긴 합병증으로 인해 전반적인 삶의 질이 낮다. 2형 염증성 천식은 제2형 염증 반응의 주요 사이토카인인 IL-4, IL-5, IL-13이 천식을 발현 시킨다는 연구 결과가 밝혀지며 등장한 새로운 개념이다. 그 전까지 천식은 정확한 유발 원인이 파악되지 않아 알레르기
2형 염증성 천식은 Th2 세포와 ILC2 세포에 의해 발병된다. 먼저 Th2 세포에 의한 천식의 발 병 과정을 살펴보면, 알레르기원이나 자극성 물질 등 외부 항원에 기도가 노출되면 수지상 세 포는 naive T helper 세포인 Th0 세포를 자극하여 이들이 Th2 세포로 분화되는 과정을 촉진 한다. 활성화된 Th2 세포는 앞서 제2형 염증 반응의 주요 사이토카인으로 소개된 IL-4, IL-5, IL-13을 대량으로 방출한다.
또 다른 기전으로 ILC2 세포에 의한 천식의 경우, 기도의 상피 세포(airway epithelial cells, AECs)가 세포 표면의 PRR(pattern recognition receptor)을 통하여 알러젠 등의 자극성 물 질을 인식하며 시작한다. 이러한 자극에 대한 반응으로 상피세포는 alarmin 이라고 불리는 사 이토카인을 방출하며, 이를 통해 2형 염증 반응을 유도한다. Alarmin은 상피에서 유래하는 염
증 반응의 매개체로서, thymic stromal lymphopoietin(TSLP), IL-25, IL-33을 포함하며, 이들은 group 2 innate lymphoid cells(ILC2s)을 활성화하는 역할을 한다. 특히 기도에 많이
분포하는 ILC2는 활성화된 후, 제2형 염증 반응에서 특징적인 IL-5와 IL-13를 생성 및 방출하
여 기도에서의 제2형 염증 반응을 증가시킨다. 한 연구에 따르면 ILC2s는 활성화된 Th2 세포
보다 10배 이상의 IL-5와 IL-13을 생산한다고 알려진다.
2) 비 2 형 염증성 천식
비 2형 염증성 천식은 Th1, Th17 세포의 활성화와 호중구성, 무과립성, 또는 중복형을 보이
며 일반적으로 ICS 치료에 잘 반응하지 않는다. 비만, 흡연, 늦게 발병된 천식, 또는 직업성 천
식이 이에 속하는 경우가 많다.
2형 염증성 천식의 발병에 대표적인 세 가지 사이토카인의 역할은 다음과 같이 정리할 수 있다.
제2형 염증성 천식과 관련하여 IL-4와 IL-13은 기도의 염증 반응과 airway remodeling에 관여한다.
IL-4의 주된 역할은 naive T cell이 Th2 세포로 분화되는 과정을 촉진하여 제2형 염증 반응
의 시작을 돕는 것이다. 이렇게 IL-4가 Th2 세포의 활성화를 돕는 데에는 IL-4가 조절 T 세포
를 억제하는 역할을 동시에 할 수 있다는 점 역시 작용한다. 또한 IL-4는 혈관 상피에 VCAM1(vascular cell adhesion molecule)의 발현을 증가시킴으로써 호산구, 호염구, T 림프구 등
의 각종 백혈구가 천식 환자의 기관지 조직 내로 이동하는 과정을 돕기도 한다.
IL-13은 기도의 과민 반응과 기관지의 구조적 변화를 촉진하는 역할을 주로 한다. 우선 IL-13
은 기도 상피 세포간 tight junction에 중요한 단백질 성분인 caludin-18.1을 하향 조절하여
기도 상피 장벽이 물리적으로 단단하게 유지될 수 없게 한다. 또한 앞서 제2형 염증성 천식 환자
에서 나타나는 특징 중 하나로 호기산화질소(fractional exhaled nitric oxide, FeNO)의 양이 정상 수치보다 높은 것을 소개하였는데, IL-13은 기관지 상피에서 iducible isoform of nitric oxide synthase(Inos)의 발현을 촉진하여 기도에서의 산화질소를 증가시키기도 한다. 더불어 기관지의 구조적 변화 측면에서 IL-13은 기관지 평활근 세포의 비대와 증식을 촉진하며, 기관
지 내에서 섬유아세포의 증식과 콜라겐 생성 역시도 촉진하여 airway remodeling 과정의 핵 심 사이토카인으로 작용한다.
IL-4와 IL-13이 공통적인 역할을 담당하기도 하는데, 첫째로 IL-4와 IL-13은 B 세포의 면 역글로불린 class switching을 유도하여 B 세포로부터 IgE가 생성되도록 한다. 생성된 IgE가 비만세포와 호염구 표면의 FceRI 수용체에 결합한 후 이러한 상태의 IgE에 결합하게 되면, 비 만세포와 호염구로부터 다시 많은 양의 IL-4와 IL-13이 분비되어 2형 기도 염증 반응을 더욱 증폭시킨다. 두 번째 공통 역할은 두 사이토카인이 기관지 상피에서 호산구 화학주성 단백질인 eotaxin의 합성을 활성화하여 기관지에 호산구가 밀집되도록 하여 기도에서 염증 반응을 유도 한다는 점이다.
IL-5는 IL-13과 유사하게 염증에서의 airway remodeling을 일으킨다. IL-5는 주로 호산구 전구 세포에 작용하여 성장과 분화를 자극하여 더 많은 호산구가 오래 생존하게 하기 때문에 천 식 환자의 호산구 수와 밀접한 연관이 있다. 또한 염증 부위에서의 과립 방출을 촉진하여 제2형
염증반응의 강한 원동력이 된다. 주로 호산구가 주요한 역할을 하는 면역반응의 후기 단계에 관
여한다. 이뿐만 아니라 알레르기 상황에서 히스타 방출과 류코트리엔 C4 생성을 통해 호염구를
더욱 활성시키는 역할도 한다. IL-5 수치가 증가하면 염증이 있는 기도로 호산구가 모여들어 천
식을 더욱 악화시킨다. 기도에 호산구가 축적되면 BMP, TGF-α/β 등의 섬유성 성장인자, 그
외 IL-2, IL-4, IL-5, IL-10, IL-12, IL-13 등의 사이토카인, CCL5 and CCL11 등의 케
모카인이 분비된다. 이 물질들은 상피세포층을 근본적으로 손상시키고 점액 생성을 증가시키며
airway remodeling을 일으켜 전반적으로 천식을 악화시킨다.

[그림 9] 중증천식 생물학적 제제의 작용 기전
1) IgE 타겟 : 졸레어(Xolair, Omalizumab)
졸레어는 재조합 DNA 기반의 인간화 IgG1 κ 단일클론항체로, 혈액 내 free IgE에 높은 선택
성으로 결합한다. 이때 IgE의 Fc 부분에 결합함으로써 IgE가 비만세포나 호염구 표면의 IgE 수
용체인 FcεRI에 결합하는 것을 막는 역할을 한다. 또한 졸레어의 투여로
IL-4와 IL-13에 의해 B 세포로부터 생성된 IgE는 비만세포와 호염구 표면의 수용체에 결합한
다. 이후, 이들 세포가 알러젠을 비롯한 외부 항원에 민감히 반응하면 흔히 알레르기라고 부르는
제1형 과민 반응이 일어난다. IgE로 활성화된 비만세포와 호염구는 탈과립화 후 히스타민, 류코
트리엔 등 화학 물질을 방출하여 초기 알레르기 반응을 유발한다. 이러한 반응이 지속될 시 알레 르기 반응의 초반 과정에서 방출된 IL-4, IL-5, IL-13 등의 사이토카인뿐만 아니라 다양한 케
모카인도 증가하며, 이들 물질은 기도 염증 부위로 호산구, 호중구, 호염구를 비롯하여 T 세포, 대식세포 등 여러 염증 세포를 불러모은다. 이 과정을 후기 알레르기 반응이라고 하며, 이때 점 액이 과도하게 분비되며, 기도의 염증 반응이 본격적으로 발생하고, airway remodeling 과정
까지 일어나는 것이다.
위와 같이 IgE와 이를 매개로 하는 기도에서의 염증 반응을 종합적으로 보았을 때, 졸레어는
IgE를 억제함으로써 혈액 및 조직의 호산구뿐만 아니라 2형 염증반응의 대표 사이토카인인 IL4, IL-5, IL-13도 감소시킨다.
2) IL-5 타겟 : 누 칼라 (Nucala, Mepolizumab) · 싱케어( Cinqair, Reslizumab) · 파센라(Fasenra, B enralizumab)
누칼라는 인간화 IgG1 κ 단일클론항체이며 싱케어는 인간화 IgG4 K 단일클론항체이다. 지금 까지 알려진 두 약제의 작용기전은 동일한데, IL-5와 결합하여 호산구 표면에 발현된 IL-5 수 용체의 α사슬에 IL-5가 결합하는 것을 경쟁적으로 길항한다. IL-5의 신호전달을 차단해 혈액 과 조직의 호산구 과잉표현을 줄여서 호산구성 염증을 감소시키며 B 림프구의 증식을 막는다.
파센라는 인간화 IgG1 κ 단일클론항체로서 IL-5R의 α사슬에 높은 친화도와 특이성으로 결 합하여 IL-5의 활성을 중화시킨다. 파센라는 누칼라, 싱케어와 같이 단순히 IL-5의 신호전달을 차단하는 기전 외에도, 호산구의 세포자멸사를 유도하여 호산구성 염증반응을 감소시키는 기전 을 가지고 있다. 파센라는 Fc 도메인에
구성 염증반응을 감소시킨다.
3) IL-4, IL-13 타겟 : 듀피젠트(Dupixent, Dupilumab)
듀피젠트는 IgG4 인간 단일클론항체로 IL-4와 IL-13의 신호전달체계를 억제하는 역할을 하 는 생물학적 제제이다. 듀피젠트는 IL-4 수용체의 α 소단위체에 선택적으로 결합하는데, 이 α 소단위체는 IL-4 신호전달에 관여하는 Type 1 수용체와 IL-4, IL-13 신호전달에 관여하는
Type 2 수용체를 구성한다. 따라서 듀피젠트는 단일 타겟에 결합함으로써 IL-4와 IL-13의 작
용을 모두 억제할 수 있는 약제이다. IL-4와 IL-13이 천식의 발병에 구체적으로 어떤 역할을 하 는가에 대해서는 앞서 서술한 본문 72페이지를 참고하 길 바란다.
4) TSLP 타겟 : 테즈파이어(Tezspire, Tezepelumab)
테즈파이어는 IgG2λ 기반의 단일클론항체 의약품으로 TSLP(thymic stromal lymphopoietin)에 직접 결합하여 이것이 TSLP 수용체와 상호작용하는 것을 억제한다. 이를 통해 다양한 염증성 사이토카인과 세포의 활성화를 막을 수 있다.
앞서 소개된 5개의 생물학적 제제는 IgE를 비롯한 IL-4, 5, 13와 같은 제2형 염증성 반응에 서 증가하는 물질들을 타겟으로 한다. 그렇기 때문에 알레르기성 천식, 호산구성 천식과 같은 2
형 염증성 천식 환자에 사용 시 효과적이다. 그러나 모든 중증 천식 환자에서 제2형 염증성 반 응이 일어나는 것은 아니다. 비2형 염증성 천식 환자의 경우 2형 염증성 천식과 전혀 다른 양상 을 보이는데, Th2 세포가 아닌 Th1 및 Th17 세포의 활성화가 특이적이며, 호산구가 아닌 호중 구가 증가하는 것이 특징적이다. 따라서 비2형 염증성 천식 환자까지 모두 포함하여 중증 천식 환자에서 광범위하게 사용되려면, 보다 상위 단계의 기도 염증 반응에 관여하는 물질을 타겟으 로 하는 생물학적 제제가 필요하다. 그러한 필요성에 적합한 물질이 바로 테즈파이어가 타겟으 로 하는 TSLP이다.
TSLP는 앞서 소개된 것처럼 alarmin의 일종이다. 흉선, 폐, 피부 등에 있는 상피세포가 알러 젠, 바이러스, 박테리아 등의 외부 항원 자극에 대하여 반응할 때 발현된다. 최근 연구에 따르면 천식에 관여하는 수지상세포, 비만세포, 호염구 등에서도 TSLP가 생성된다고 한다.
TSLP는 다른 alarmin과 같이 ILC2s를 활성화하여 IL-5와 IL-13의 증가를 통해 제2형 염증 성 반응을 촉진한다. 더불어 다른 alarmin인 IL-2와 IL-33과 구분되는 특징이 있다면, TSLP
는 수지상세포의 성숙 또한 촉진한다는 점이다. TSLP의 분비를 통해 성숙된 수지상세포는 naive CD4+ T cell이 제2형 염증 반응을 매개하는 Th2 cell로 분화할 수 있도록 한다.
위와 같은 2형 염증성 반응뿐만 아니라 TSLP는 비 2형 염증 반응에서도 중요한 역할을 한다. TSLP는 수지상 세포를 활성화한 후 naive T cell이 Th17 세포 쪽으로 분화하도록 돕는다. 또 한 TSLP는 기도 평활근 세포의 이동과 섬유아세포의 콜라겐 생성을 촉진하여 천식 환자에서 대 표적으로 발생하는 airway remodelling을 일으키기도 한다. 이렇게 TSLP는 천식의 염증

중증 천식 치료제 중 생물학적 제제의 제형은 바이알, 프리필드시린지, 프리필드펜, 오토인젝 터로 분류된다. 의료인에 의해서만 투여 가능한 제형인 바이알과 자가 투여가 가능한 나머지 제 형으로 크게 나눌 수 있다.
바이알 제형
먼저 바이알 제형의 경우, 환자가 직접 투여 가능한 경우도 있으나 천식의 생물학적 제제 중 국
내에서 바이알 제형으로 허가받은 졸레어, 누칼라, 싱케어는 모두 의료인에 의해서만 투여할 수 있다. 분말이 들어있는 유리 용기 (바이알) 에 주사용수를 주입하여 분말을 모두 용해한 후 다시 주사기 내에 주입하는 과정을 거쳐 투여하게 된다. 이러한 점에서 바이알 제형은 자가투여가 어
려워 규칙적인 투여가 필요한 환자에서는 편의성을 떨어뜨린다는 단점을 가지고 있다. 이외에도 주사제가 유리나 고무 파편 등에 의하여 오염될 수 있으며, 정확한 용량의 투여가 어렵다는 문 제점이 있다.
자가투여 제형
자가투여가 가능하도록 개발된 제형은 프리필드시린지, 프리필드펜, 오토인젝터이다. 이러한
제형들에서는 약제 자체에 1회분의 약물이 들어있어 별도의 조제 과정이 필요하지 않다. 따라 서 기존의 바이알 제형 대비 편의성이 높아 지속적인 관리가 필요한 환자에게 효과적이며 치료
순응도를 개선할 수 있다. 또한 투여 과정 중 오염 위험이 바이알 대비 적고, 조제 상의 오류가
거의 없어 정확한 용량 투여가 가능하다는 장점이 있다. 이는 바이알 제형과 다르게 약물의 양
이 정량 충전되기 때문에 과도하게 채워지는 것을 방지할 수 있고, 투여 시 버려지는 약물이 거
의 없기 때문이다.
프리필드시린지 (PFS, Pre-filled Syringe)
프리필드시린지는 환자가 약물 투여 시, 주사 바늘의 덮개를 벗겨 낸 후 사용한다. 그러나 일
반 주사와 똑같은 외형을 가지고 있어 환자가 주사 바늘에 공포를 느끼는 경우 사용이 어렵고 찔 림 사고가 발생할 수 있다는 단점이 있다. 특히, 류마티스 관절염 환자의 경우 손가락 관절 통증 을 느끼기 때문에 프리필드시린지를 통한 자가투여가 어려워 찔림 사고나 투약 오류가 자주 발 생한다.
프리필드펜 (PFP, Pre-filled Pen) & 오토인젝터 (AI, Autoinjector)
프리필드펜과 오토인젝터는 주사바늘을 제품 내부에 숨겨두어 투여 중 또는 후에 보이지 않아 바늘을 두려워하는 환자도 이용할 수 있다. 또한 점검 창을 통해 약물의 주입이 완료된 것을 환 자가 가시적으로 확인할 수 있다. 프리필드시린지와 비교하였을 때, 바늘의 안전 덮개가 견고하 게 덮여 있어 주사 바늘의 훼손 우려가 적다. 이러한
프리필드펜과 오토인젝터 제형의 차이는 작동 방법에 있다. 육안으로 보았을 때는 외형이 거의 유사하지만 제형을 주입하는 방법이 조금 다르다. 두 제형 모두 주사부위에 수직으로 향하게 한
후 약액을 투여해야 한다는 점은 공통적이다. 프리필드펜의 경우 환자가 주사부위의 피부에 프
리필드펜을 꽉 누른 뒤 딸각 소리와 함께 주입이 시작되며, 약물이 투여되는 동안 일정한 압력을 주어 프리필드펜을 누르고 있어야 한다. 반면, 오토인젝터 제형은 작동버튼의 잠금장치를 해제 한 후 작동버튼을 누르기만 하면 주사바늘이 튀어나와 약물이 자동으로 주사된다. 따라서 환자
가 약물이 완전히 주사될 때까지 직접 누르고 있을 필요가 없다.
약제 총정리
12] 중증천식 생물학적 제제 비교
(Cinqair, Reslizumab)
특발성 두드러기 (청소년, 성인)
(Cinqair, Reslizumab)
Ab anti IL-5 Receptor Ab anti IL-4 & IL-13 Ab anti TSLP Ab
천식 중증 호산구성 천식 (성인)
중등도-중증 아토피피부염 (소아, 청소년, 성인)
중증 천식 (청소년, 성인)
비용종 동반 만성 비부비동염 (성인)
결절성 가려움 발진 (성인)
중증 천식 (청소년, 성인)
김상일. (2024.05.07). 중증 천식 ‘제2형 염증’ 여부 확인해야 하는 이유는?. 의학신문. Retrieved from http://www. bosa.co.kr/news/articleView.html?idxno=2221777
식품의약품안전처 의약품안전나라. (2024). 파센라프리필드시린지주30밀리그램(벤라리주맙), 12. 전문가를 위한 정보. Retrieved from https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=201903766a updateTs2024-07-26
전세미. (2019.11.14). “‘제 2형 염증 천식’ 등장…‘표적 치료’ 가능해졌다”. 약업닷컴. Retrieved from http://m. yakup.com/news/index.html?mode=view&cat=&nid=237359
홍숙. (2020.12.01). 천식환자가 ‘제2형 염증’ 확인해야 하는 이유. 히트뉴스. Retrieved from http://www.hitnews. co.kr/news/articleView.html?idxno=31360
Emson, C., Diver, S., Chachi, L., Megally, A., Small, C., Downie, J., Parnes, J. R., Bowen, K., Colice, G., & Brightling, C. E. (2020). CASCADE: a phase 2, randomized, double-blind, placebo-controlled, parallelgroup trial to evaluate the effect of tezepelumab on airway inflammation in patients with uncontrolled asthma. Respiratory research, 21(1), 265. https://doi.org/10.1186/s12931-020-01513-x
Kuruvilla, M. E., Lee, F. E., & Lee, G. B. (2019). Understanding Asthma Phenotypes, Endotypes, and Mechanisms of Disease. Clinical reviews in allergy & immunology, 56(2), 219–233. https://doi. org/10.1007/s12016-018-8712-1
Lambrecht, B. N., Hammad, H., & Fahy, J. V. (2019). The Cytokines of Asthma. Immunity, 50(4), 975–991. https://doi.org/10.1016/j.immuni.2019.03.018
Menzella, F., Biava, M., Bagnasco, D., Galeone, C., Simonazzi, A., Ruggiero, P., & Facciolongo, N. (2019). Efficacy and steroid-sparing effect of benralizumab: has it an advantage over its competitors?. Drugs in context, 8, 212580. https://doi.org/10.7573/dic.212580
Menzies-Gow, A., Wechsler, M. E., & Brightling, C. E. (2020). Unmet need in severe, uncontrolled asthma: can anti-TSLP therapy with tezepelumab provide a valuable new treatment option?. Respiratory research, 21(1), 268. https://doi.org/10.1186/s12931-020-01505-x
Pelaia, C., Crimi, C., Vatrella, A., Tinello, C., Terracciano, R., & Pelaia, G. (2020). Molecular Targets for Biological Therapies of Severe Asthma. Frontiers in immunology, 11, 603312. https://doi.org/10.3389/ fimmu.2020.603312
Pelaia, C., Heffler, E., Crimi, C., Maglio, A., Vatrella, A., Pelaia, G., & Canonica, G. W. (2022). Interleukins 4 and 13 in Asthma: Key Pathophysiologic Cytokines and Druggable Molecular Targets. Frontiers in pharmacology, 13, 851940. https://doi.org/10.3389/fphar.2022.851940
Rola AbuJabal, Rakhee K. Ramakrishnan, Khuloud Bajbouj, Qutayba Hamid. (2024). Role of IL-5 in asthma and airway remodelling. Clinical & Experimental AllergyVolume 54, Issue 8, 529-639. https:// doi.org/10.1111/cea.14489
Steinke, J. W., & Borish, L. (2001). Th2 cytokines and asthma. Interleukin-4: its role in the pathogenesis of asthma, and targeting it for asthma treatment with interleukin-4 receptor antagonists. Respiratory research, 2(2), 66–70. https://doi.org/10.1186/rr40
박세희 shp990529@gmail.com 황숭흠 heumi1005@gmail.com
kjy57103@gmail.com
허가 한국 허가
졸레어는 중증 천식 치료제 중 최초로 허가받은 생물학적 제제로, Ig-E에 의해 매개된 알레르
기성 천식 환자들에게만 허가되었다. FDA에서 2003년 6월, EMA에서 2005년 10월, 국내에 서는 2007년 5월 시판 허가를 받았다. 국내 최초 허가 시 졸레어는 12세 이상의 아래와 같은
조건을 만족하는 성인과 청소년 알레르기성 천식 환자에서 천식 조절을 개선하기 위한 추가 요 법제로 승인되었다.
- 통년성 대기 알러젠에 대하여 in vitro 반응 혹은 피부 반응 양성을 보이며 - 빈번한 주간 증상이나 야간에 깨어나는 증상이 나타날 뿐만 아니라 폐기능이 저하 ( FEV1 < 80% ) 되어 있고
- 고용량의 흡입용 코르티코스테로이드( ICS) 및 장기 지속형 흡입용 β 2 작용제( LABA ) 투여 에도 불구하고 중증 천식 증상의 악화가 여러 번 기록된 중증의 지속성 알레르기성 천식
국내 최초 허가 7년 후인 2014년, 졸레어는 6~12세 미만의 소아 알레르기성 천식 환자로 적
용 대상이 확대되었다. 이러한 소아 환자의 경우 12세 이상 성인 및 청소년 환자와 달리, 폐기 능 저하 조건을 충족하지 않아도 졸레어 투여가 가능하다. 졸레어의 소아 환자에 대한 적응증은 아래와 같이 정 리할 수 있다. - 통년성 대기 알러젠에 대하여 in vitro 반응 혹은 피부 반응 양성을 보이며 - 빈번한 주간 증상이나 야간에 깨어나는 증상이 나타나고 - 고용량의 흡입용 코르티코스테로이드( ICS) 및 장기 지속형 흡입용 β 2 작용제( LABA ) 투여 에도 불구하고 중증 천식 증상의 악화가 여러 번 기록된 중증의 지속성 알레르기성 천식
이후 2017년 성인 및 청소년 만성 특발성 두드러기(Chronic Spontaneous Urticaria, CSU), 2021년 성인 비용종을 동반한 만성 비부비동염(Chronic Rhinosinusitis with Nasal Polyps, CRSwNP)에 대하여 추가적으로 적응증을 확대하였다.
FEV1 < 80% 란?
폐활량계(spirometer)를 사용하여 환자가 숨을 들이쉰 후 날숨을 불어 보게 하여 이로부터 여러 측정 값을 얻는 것을 단순 폐 기능 검사(simple spirometry)라고 한다. 폐 기능
아래와 같다.
- 강제 호기량(FVC, Forced vital capacity) : 환자가 최대로 숨을 들이쉬게 한 다음 최대의
숨을 끝까지 내쉬게 했을 때 내쉰 양을 뜻한다. - 1초간 강제 호기량(FEV1, forced expired volume in one second) : 환자가 숨을 최대로 들이 쉰 다음 노력을 다해 내쉴 때 첫 1초간 내쉰 양을 의미한다. 첫 1초간 환자가 얼마나 빨리 숨을 내쉴 수 있는가를 보는 지표이다. FEV1은 키, 나이, 성별 및 인종 등을 고려하여 계산된 예측 표준 값에 대하여 spirometer로 측정된 값의 비율로 계산된다. 예측 표준 값에 대한 측정값의 비율이 80% 이상일 때 정 상으로 간주한다. - FEV1/FVC 비율 : 보통 정상인은 강제 호기량의 70% 이상을 첫 1초에 내쉴 수 있다. 즉, 보통 정 상 성인에서 FEV1/FVC 비율의 값은 0.75~0.8 이상이 되며, 어린이는 0.9 이상이다. 반면에 FEV1/ FVC 비율 값이 0.7 미만일 경우, 이는 환자가 숨을 내쉬는 데 장애가 있음을 시사한다. 따라서 FEV1/ FVC는 기관지폐쇄 여부를 확인하는 유용한 지표가 된다.
다음 표를 통해 졸레어의 한국 / 미국 / 영국에서의 적응증과 최초 허가일자를 정리하도록 한
다. 한국과 영국에서 졸레어의 허가 적응증은 완벽하게 같다. 다만 미국은 크게 두 가지 다른 부
분을 찾을 수 있다. 첫째로 천식 적응증에서 차이점을 찾아볼 수 있는데, 한국과 영국에서는 세
부적으로 만족하여야 할 세 가지 조건이 있으며, 그 조건 내용도 성인 및 청소년
룹으로 나뉘어 연령에 따라 차이가
졸레어는 하나 이상의 식품
표 14] 졸레어 한국/미국/영국 적응증 정리
한국
중증 지속성 알레르기성 천식
- 청소년(12세~) 및 성인 - 소아(6세~12세)
* 세부 사항은 위의 본문 (P.~)을 참고
18세 이상의 성인
기존 치료(비강용 코르티 코스테로이드)에 적절하 게 조절 되지 않는 비용종
을 동반한 만성 비부비동
염의 추가 유지 치료
12세 이상의 청소년 및 성인
H1항히스타민제 요법에 불응인
만성 특발성 두드러기 환
자의 증상을 조절하기 위 한 추가 요법제 X
미국
중등증-중증 지속성 천식
- 소아(6세~), 청소년, 성인
통년성 대기 알러젠에 대
하여 시험관 내 반응 또
는 피부 반응 양성을 보이
며, 흡입용 코르티코스테
로이드의 투여에도 증상
의 조절이 되지 않는 환자
* 한국, 영국과 달리 성 인 및 청소년, 소아에서
의 적응증 세부 조건 구
분이 없음
한국과 동일
한국과 동일
1세 이상 소아, 청소년, 성인
IgE 매개 식품 알레르기 가 있는 환자에서 하나 이 상의 식품에 우발적으로 노출되었을 때 발생할 수 있는 아나필락시스를 포 함한 Type 1 알레르기 반응을 감소시키기 위한 치료제
한국에서 졸레어는 2006년 11월 국내에서 희귀의약품으로 지정된 이후, 2007년 5월 30일
졸레어주사 제형이 최초 허가 승인되었다. FDA에서는 2003년 6월 20일, EMA에서는 2005 년 10월 25일 졸레어 주사 제형이 각각 최초 허가를 받았다. 졸레어의 한국과 미국에서의 허가
타임라인은 아래와 같다. [표 15] 한국·미국 졸레어 허가
06.20
졸레어주사
12세 이상
중등증-중증 천식
허가
05.30
졸레어주사
12세 이상
알레르기성
06.26
PFS 150mg
CSU
추가
05.27
PFS 150mg 제형 추가
적응증 확대
졸레어주사
CSU
적응증 추가
PFS : Prefilled syringe
PFP : Prefilled pen
AI : Autoinjector
졸레어주사
이상 중등증-중증
적응증 확대
PFS 75mg, PFS 150mg 제
04.16
졸레어주사 PFS 150mg PFS 75mg
CRSwNP
적응증 추가
03.07
PFS 300mg
제형 추가
한국과 미국, 영국에서 졸레어의 허가된 제형과 용량은 아래 표를 통해 알아보도록 한다.
[ 표 16] 한국 졸레어 허가 제형 및 용량
졸레어 주사¹ O
졸레어 프리필드시린지
[ 표 17] 미국 졸레어 허가 제형 및 용량
졸레어 주사
졸레어 프리필드시린지
150mg lyophilized powder in a single-dose vial for reconstitution
75mg/0.5ml, 150mg/ml, 300mg/2ml
졸레어 오토인젝터 75mg/0.5ml, 150mg/ml, 300mg/2ml
[표 18] 영국 졸레어 허가 제형 및 용량
졸레어 주사
졸레어 프리필드시린지
75 mg powder and solvent for solution for injection, 150 mg powder and solvent for solution for injection
75mg/0.5ml, 150mg/ml, 300mg/2ml
졸레어 프리필드펜 75mg/0.5ml, 150mg/ml, 300mg/2ml
앞서 언급한 2007년 국내 최초의 허가, 2014년 소아 알레르기성 천식으로의 적응증 확대는 졸레어 주사 제형에 대한 것으로, 졸레어 프리필드 시린지 제형의 국내 최초 허가는 2016년 5 월 졸레어 프리필드시린지 150mg으로 시작되었다. 졸레어 프리필드 시린지 150mg의 경우 2016년 5월 최초 허가 시에 성인,
이후 2017년 6월 CSU에 대해 적응증을 확대하였으며, 이때 동시에 졸레어 프리필드 시린지
75mg가 성인, 청소년, 소아 알레르기성 천식과 CSU에 대해 최초 허가되었다. 마지막으로 졸레
어 프리필드 시린지 300mg가 올해 초 허가 승인을 받아 국내에서 졸레어 프리필드 시린지 제형
은 75mg, 150mg, 300mg 총 세 가지 용량으로 선택지를 넓혔다. 다만 6~12세 미만의 소아 알레르기성 천식 환자는 프리필드 시린지 300mg은 투여 불가하며, 프리필드 75mg와 150mg
만이 국내 소아 환자에서 사용 가능하다.
국내의 졸레어 자가투여 제형으로는 졸레어 프리필드시린지만 허가되어 있는 반면, 미국과 영
국은 프리필드시린지뿐만 아니라 프리필드 오토인젝터, 프리필드 펜을 각각 자가투여 제형으로 추가 승인하였다. 미국과
[ 표 17], [ 표 18]을 통해 정리하도 록 한다.
한국에서 졸레어 프리필드시린지 300mg은 12세 미만의 소아 환자에서는 투여할 수 없다. 따
라서 6~11세 소아 알레르기성 천식 환자에서는 75mg, 150mg의 졸레어프리필드시린지만 사 용 가능하다.
또한 미국에서 프리필드 오토인젝터 제형은 용량에 관계없이 11세 이하의 소아 환자에서는 사 용 불가하다.
마지막으로 영국에서는 용량에 따라 승인된 적응증에 차이가 있다. 제형에 상관없이 75mg 용 량은 천식과 CRSwNP에 대해서 허가되었으며, 150mg과 300mg의 졸레어는 두 질환뿐만 아
니라 CSU에서도 사용 가능하다. 또한 졸레어 프리필드시린지 300mg과 모든 용량의 프리필드
펜 제형은 11세 이하의 소아 환자에서는 사용 불가하다.
용법 및 용량
졸레어의 적절한 투여 용량과 빈도는 반드시 치료 시작 전 측정하는 IgE의 기저치(IU/ml)와 체
중(kg)에 의해 결정된다. 이에 따라 용량 결정을 위해서 모든 환자는 투여 시작 전 시판되고 있
는 혈청 총 IgE 정량법에 의해 IgE 수치를 측정하여야 한다. 치료 시작 전의 환자의 개별 IgE 기
저치에 따라, 1회 75~600mg을 매 2주 간격 또는 매 4주 간격으로 피하 투여한다. 투여 간격
에 따른 투여 용량은 다음 첨부하는 [표 19]를 참고하도록 한다. IgE의 기저치나 체중(kg)이 [ 표
19] 용량 의 한도 밖에 있을 경우, 이 약을 투여하여서는 안된다. 해당 표의 투여 용량에 따라 매
투여 시 졸레어 75~600mg을 총 1~4회에 나누어 주사할 수 있다. 즉, 예를 들어 환자의 IgE 기
저치와 체중에 의해 결정된 1회 투여 용량이 만약 375mg이라면, 국내 기준으로는 졸레어 프리
필드 시린지 75mg과 300mg을 각각 1회씩, 총 2회 주사를 맞아야 하는 것이다. 유사하게 만
약 525mg을 1회 투여하여야 하는 환자라면, 75mg, 150mg, 300mg의 모든 용량의 졸레어 프리필드 시린지를 각 1회씩 투여받아 총 주사 횟수는 3회가 되는 식이다. 이렇게 환자에 따라
투여 용량에 도달하기 위하여 2회 이상의 주사가 필요한 경우, 주사 부위는 반드시 두 곳 이상으
로 나누어져 투여되어야 한다.
만약 투여 전 측정한 IgE 수치가 일정 기준보다 낮은 환자의 경우, 졸레어로 인한 유익성을 경
험할 가능성이 적을 수 있다. 이에 따라 IgE 수치가 76 IU/ml보다 낮은 성인 및 청소년 환자,
200 IU/ml보다 낮은 6~12세 미만의 소아 환자라면 투여 전 통년성 알러젠에 대하여 명백한 시
험관 내 반응을 나타냄을 확인하여야 한다.
졸레어는 피하주사를 통하여 주사되어야 하는 약으로, 그 외에 정맥 내 투여나 근육 주사를 통 한 투여는 삼가하여야 한다.
프리필드시린지 75mg, 150mg은 알레르기성 천식을 앓고 있는 소아 환자에서도 사용될 수 있 으나, 300mg의 경우 12세 미만의 환자에서는 투여 불가능한 점 역시 주의하여야 한다.
알레르기성 천식 환자에서 졸레어 투여 후 환자의 반응을 평가하기 위해서는 최소 12주 이상 의 치료가 지속되어야 한다. 또한 졸레어 투여 후 16주째, 치료의 유효성을 평가한 후 치료의 지 속을 결정한다.
>
>
>
>
> 11001200
> 12001300
안전성 및 주의사항
1) 아나필락시스
아나필락시스 현상은 국내 허가 보고서뿐만 아니라 FDA label의 black box warning에서도 경고하고 있는 사항이다. FDA의 label에 따르면 허가 이전의 임상 시험에서는 약 0.1% 정도의
환자군에서 아나필락시스 현상이 관찰되었으며, 시판 후 조사 결과에 의하면 졸레어를 투여받은
환자의 약 0.2% 정도에서 아나필락시스가 발생하였다. 기관지 경련, 저혈압, 실신, 두드러기, 인후 또는 혀의 혈관 부종 등의 양상으로 그 증상이 나타난다. 아나필락시스는 졸레어의 첫 투여 후 바로 발생하기도 하지만, 지속적 투여 1년 후에도 발생한 경우가 있어 특히 주의하여 관찰이 필요하다. 이에 따라 첫 투여는 의료진들에 의해 투여가 시작되어야 하며, 졸레어 투여 후 적절 한 기간 동안 환자에게서 아나필락시스가 발생하는지 자세히 보아야 한다. 그러므로 자가투여가 가능한 프리필드시린지 제형이라고 하더라도, 아나필락시스 이력이 없는 환자에 한해서 4번째 투여부터 비의료인에 의한 투여가 가능하다.
2) 약물 이상 반응
이외에 환자에게서 졸레어 투여 후 나타날 수 있는 흔한 약물 이상 반응으로는 두통과 주사부
위 통증, 홍반 및 가려움증, 부어오름을 포함하는 주사부위 반응이었다. 특히 소아 환자에서 흔 히 나타나는 약물 이상 반응은 두통, 발열과 상복부 통증이었다. 이러한 반응은 대부분 경증 혹
은 중등증으로 별도의 의료적 조치가 필요한 사항은 아니다.
3) 약물 중단 시 주의사항 졸레어가 고용량의 스테로이드에도 증상의 개선을 보이지 않는 중증의 알레르기 천식 환자의 치료에 사용되는 약제임은 분명하지만, 졸레어의 투여 시작 후 전신 혹은 흡입용 코르티코스테 로이드를 갑자기 중단하는 것은 권장되지 않는다. 코르티코스테로이드의 감량은 반드시 의료진 의 감독 아래에서 서서히 진행되어야 한다.
졸레어(Xolair, omalizumab)는 중증 알레르기 천식 및 알레르기 관련 질환에 사용되는 생물
학적 제제로 체내 항체 중 IgE를 표적으로 하는 중증 천식 치료제로 최초 허가되었다는 특징을
가지고 있다. 졸레어는 다양한 임상시험을 통해
허가보고서에 기재된 천식 임상시험을
분석을 펼쳐 나갈 것이다.
Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma
본 임상은 질병 통제가 제대로 이루어지지 않는 중등도 이상의 알레르기 천식 환자에서 omalizumab 치료의 유효성과 안전성을 평가한, 무작위 배정, 이중맹검, 3상 위약 대조 임상시험이 다.
임상 대상 환자는 중간에서 높은 ICS 치료에도 불구하고 증상이 있는 12세에서 75세 사이의 알레르기 천식 환자이다. 이들은 28주 동안 omalizumab 혹은 위약을 2주 225mg, 300mg, 375mg 혹은 4주 150mg, 300mg 피하투여 받았으며 투여 용량과 빈도는 체중과 혈청 IgE에 따라 결정되었다. 본 연구에서는 ICS로 BDP (inhaled beclomethasone dipropionate )를 사용하였으며, 기간에 따라 용량의 차이를 두었다. 28주 중 초반 16주를 BDP의 용량을 고정하 는 스테로이드 고정 단계, 이후 12주를 스테로이드 감소 단계로 선정하였다. 스테로이드 감소 단 계인 12주는 다시 8주와 4주로 나누어 첫 8주는 BDP 최적 용량을 찾기 위해 2주마다 25%씩 감소시켰으며 나중 4주는 최적 BDP로 유지하였다.
1차 평가 변수 는 스테로이드 고정 단계 및 스테로이드 감소 단계에서 환자당 평균 천식 악화
1차 결과인 환자당 평균 천식 악화 횟수에서의 천식 악화는 경구 또는 정맥 코르티코스테로이
드로 치료하거나 피실험자 기준 흡입 BDP 용량을 두배 이상으로 치료해야 할 만큼 충분히 심각 한 상황으로 간주하였다. 이때, 스테로이드 고정 단계에서 omalizumab 투여군은 0.28회, 위
약 투여군은 0.54회를 경험하였다. (p=0.006) 스테로이드 감소 단계에서는 omalizumab 투
여군은 0.39회, 위약 투여군은 0.66회를 경험하였다. (p=0.003)
2차 결과 중 주요 지표는 최소 1회 이상 천식 악화 경험 환자 수이다. 최소 1회 이상 천식 악 화 경험 환자 수의 경우 스테로이드 고정 단계에서 omalizumab 투여군 14.6%, 위약 투여군 23.3%의 결과값이 산출되었으며 (p=0.009), 스테로이드 감소 단계에서 omalizumab 투여군 21.3%, 위약 투여군 32.3%의 결과값이 산출되었다. (p=0.004)
본 임상에서는 중증도 이상의 ICS 의존성 알레르기 천식 환자 중 질병 통제가 제대로 이루어 지지 않는 환자들에게 omalizumab이 효과적이고 안전하다는 것을 확인할 수 있었다. 1차 결 과였던 피실험자 당 평균 악화 횟수에서도 스테로이드 고정 단계, 스테로이드 감소 단계 모두 omalizumab이 위약에 비해 치료적으로 효과가 있음을 보여주었으며, 특히 스테로이드 고정 단 계 동안 omalizumab에 의한 천식 악화율 감소가 스테로이드 감소 단계에서도 효과가 유지되었 음을 입증했다. 또한 2차 결과였던 천식 악화 경험 환자 수, 일일 천식 증상 점수, 구조 약물 사용
횟수 모두 omalizumab이 위약에 비해 유의미한 감소를 보여주었고, 폐 기능에서도 임상적으 로 유의미한 개선이 관찰되었다. 연구 종료 후의 평가에서도 피실험자, 의사 모두 omalizumab
선호를 보여주었다. 이는 ICS 치료에서의 omalizumab의 유효성 및 안전성을 확인할 수 있는 것으로 해석할 수 있다.
결론적으로, omalizumab은 ICS 부작용을 견딜 수 없거나 권장 치료 요법을 준수하는 데 문 제를 가지고 있는 중등도 이상의 알레르기 천식 환자들에게 추가적인 치료 옵션으로 유용하게 사용될 수 있다.
2. NCT00314574
(Xolair)
본 임상은 중증도 알레르기 천식 환자에서 고용량의 ICS 및 LABA (지속성 베타 작용제) 요 법에 omalizumab을 추가할 때 안전성과 유효성을 탐구한 무작위 배정, 이중맹검, 3상 위약 대 조 임상시험이다.
임상 대상 환자는 천식 추가 조절 요법 유무와 관계없이 고용량 ICS 및 LABA로 적절하게 조
절되지 않는 12세에서 75세 사이의 환자이다. 이들은 48주 동안 2주 혹은 4주마다 피하투여 로 omalizumab 혹은 위약을 투여받았으며, 투여 용량과 빈도는 체중과 혈청 IgE에 따라 결정 되었다.
1차 평가 변수는 48주 치료 기간 동안 천식 악화율이며, 2차 평가 변수는 천식 증상 점수 변화, 구조 약물 사용 횟수 변화, 천식 삶의 질 설문 점수 변화이다. 1차 결과인 48주 치료 기간 동안 천식 악화율에서 천식 악화는 3일 이상 전신 코르티코스테로이드를 사용한 치료가 필요한 천식 증상의 악화로 정의하였으며, 장기간 경구 코르티코스테로이드를 복용하는 환자는 oral prednisone의 일일 복용 용량이 20mg 이상인 경우로 정의하였다. 그에 대한 결과값으로 omalizumab의 투여군은 피실험자 당 0.66회(n=427), 위약 투여군은 피실험자 당 0.88회(n=421) 의 천식 악화율이 산출되었다. (p=0.008)

2차 결과 중 주요 평가지표는 천식 증상 점수 평가와 천식 삶의 질 설문 점수 변화이다.
천식 증상 점수의 경우 TASS ( total asthma symptom scores )로, 야간 천식 점수 (0~4 점), 아침 천식 증상(yes = 0, no = 1), 주간 천식 점수(0~4점)를 통해 총 0~9점 척도로 평가된 다. 점수가 더 높을수록 더 나쁜 증상을 대변하는 것으로 파악할 수 있다. omalizumab 투여군의 경우 -1.61(n=426), 위약 투여군의 경우 -1.36(n=417)의 결과값이 도출되었다. (p=0.038)
천식 삶의 질 설문 점수의 경우 삶의 질 질문지인 AQLQ ( asthma quality of life questionnaire )를 이용하여 평가하였다. AQLQ는 4개의 영역( activity limitations, symptoms, emotional function, environmental stimuli )에 대하여 각각 8개의 항목을 가져 1~7점 ( 1 : severe impairment, 7 : no impairment )의 척도로 32개의 항목을 평균화한 점수를 도출 하였다. 점수가 높을수록 치료 효과가 높다고 간주할 수 있다. AQLQ 설문지 점수의 변화를 보 았을 때 omalizumab 투여군의 경우 1.16(n=426), 위약 투여군의 경우 0.96(n=417)의 결과 값이 도출되었다. (p=0.005)

[ 그림 12] 구조 약물 사용횟수 및 TASS 점수 변화 추이

[ 그림 13] AQLQ 점수 변화 추이
본 임상에서는 고용량 ICS 및 LABA의 사용에도 불구하고 중등도 이상의 알레르기 천식이 적
절하게 조절되지 않는 환자에 대해 omalizumab을 추가할 시 임상적으로 의미 있는 치료 효과
를 낼 수 있으며, 나아가 천식 환자들의 삶의 질까지 향상할 수 있음을 확인하였다. 48주간의 치
료 기간 동안 omalizumab이 위약 투여에 비해 유의미하게 천식 악화율이 낮았으며, TASS 및
구조 약물의 사용횟수 변화에서도 omalizumab 투여군이 위약 투여군에 비해 더 높은 감소를
보였다. 천식 관련 삶의 질에서도 omalizumab이 위약에 비해 더 높은 삶의 질을 보여주었다.
결론적으로 omalizumab은 기존의 고용량 ICS 및 LABA 요법 치료에도 증상이 지속되
는 중증 천식 환자에게 추가적으로 사용할 수 있는 치료 옵션이 분명하며, 이들 환자군에서 omalizumab은 유의미한 치료 효과뿐만 아니라 삶의 질까지 높일 수 있는 대안이 될 수 있다.
3. NCT00079937
Efficacy and Safety of Omalizumab in Children (6 - < 12 Years) With Moderatesevere, Inadequately Controlled Allergic Asthma
본 임상은 ICS로 적절하게 조절되지 않는 중등도 이상의 알레르기 천식 환자 중 6~12세 소아 환자에 대해 omalizumab을 처방하였을 때의 유효성과 안전성을 탐구하기 위한 무작위 배정, 사중 맹검, 3상 위약 대조 임상시험이다. 임상 대상 환자는 중간 용량 이상의 ICS로 조절되지 않는 중증도 및 중증의 지속성 알레르기성 천식을 가진 6세에서 12세 미만의 소아이다. 이들은 52주 동안 2주 혹은 4주마다 피하투여로 omalizumab 혹은 위약을 투여받았으며,
또한 ICS 용량을 기간에 따라 차이를 두었는데 52주 중 초반 24주를 스테로이드 고정 단계, 이후 28주를 스테로이드 조정 단계로 선정하였다. 스테로이드 조정 단계란, 환자가 스테로이드 감소에 대한 엄격한 기준을 충족시켰을 때 용량을 하향할 수 있는 단계로 8주에 한 번 이하 스테 로이드 용량을 25~50%가량 감소하였다. 52주 치료 기간 이후에는 추가적인 16주 동안의 후 속 조사를 진행하였다.
1차 평가 변수는 24주의 스테로이드 고정 단계 기간 동안 심각한 천식 악화율과 최소 1번 이 상 부작용을 겪은 환자 비율이며, 2차 평가 변수는 스테로이드 고정 단계의 마지막 4주 동안의
야행성 천식 증상 점수 변화, 52주 치료 기간 중 심각한 천식 악화 비율, 스테로이드 고정 단계
중 마지막 4주 동안의 구조 약물 일일 평균 흡입 횟수 변화, 소아 천식 삶의 질 설문지 PAQLQ ( Pediatric Asthma Quality of Life Questionnaire ) 점수 변화이다.
1차 결과인 스테로이드 고정 기간 중 심각한 천식 악화 비율에서 천식 악화는 기준 ICS 용 량의 2배 이상 혹은 최소 3일 동안 전신 구조 약물을 사용한 치료가 필요한 경우로 간주하였 다. 초반 24주 동안 omalizumab 투여군의 경우 환자당 0.45(n=384), 위약 투여군의 경우 0.64(n=192)의 천식 악화율을 보였다. (p=0.007)
또 다른 1차 결과인 최소 1번 이상의 부작용을 겪은 참가자의 비율의 경우 omalizumab 투여 군은 90.3%(n=421), 위약 투여군은 93.7%(n=207)의 결과값을 보였다. 다만, p value를 고
려하였을 때 omalizumab 투여군과 위약 투여군의 비율 차이가 임상적으로 유의미하지 않다.
2차 결과 중 주요 지표는 52주 치료 기간 중 심각한 천식 악화율과 구조 약물 사용횟수 변화 이다.
52주 치료 기간 중 심각한 천식 악화 비율은 이전 1차 평가와 같은 천식 악화 정의를 사용하 였으며, omalizumab 투여군의 경우 0.78(n=384), 위약 투여군의 경우 1.36(n=192)의 결괏 값이 도출되었다. (p<0.001)
구조 약물 일일 평균 흡입 횟수는 야행성 천식 점수와 함께 스테로이드 고정 단계 24주 중 마 지막 4주 동안의 구조 약물 일일 평균 횟수를 세어 그 변화를 관찰하였다. omalizumab 투여
군의 경우 -1.3(n=381), 위약 투여군의 경우 -1.0(n=191)의 변화를 보여주었다. (p<0.047)
본 임상에서는 중간 용량 이상의 ICS로 조절되지 않는 중등도 이상의 알레르기성 천식 소아
환자를 대상으로 omalizumab을 추가 처방할 시 임상적으로 유의미한 치료 효과를 보일 수 있
음을 확인하였다. 1차 결과에서 스테로이드 고정 단계에서 omalizumab 투여군은 위약 투여
군에 비해 천식 악화율을 31% 감소 시켰으며, 2차 결과에서는 치료 기간동안 천식 악화율을 43% 감소시켰다. 또한 최소 1회 이상의 부작용을 겪은 환자의 비율에서도 omalizumab 투여
군과 위약 투여군의 차이가 임상적으로 유의미하지 않아 부작용 관련한 문제에서 둘의 차이가 크지 않음을 보여주었다. 한편, 대부분의 2차 결과에서는 omalizumab 투여군과 위약 투여군 의 차이를 확인할 수 없었는데, 야행성 증상 점수, 구조 약물 흡입 횟수, PAQLQ 점수 변화에서 omalizumab 투여군이 전체적으로 위약 투여군에 비해 긍정적인 수치를 보였으나 통계적으로 유의미하지 않았다.
결론적으로, omalizumab은 ICS로 조절되지 않는 중등도 이상의 알레르기성 천식 어린이 환 자(6세~12세)를 대상으로 추가적인 치료 옵션으로 기능할 수 있으며, 이는 스테로이드 고정 단

계뿐만 아니라 스테로이드 조절 단계에서도 유의미한 치료 효과를 보여줄 수 있음을 의미한다. [ 그림 14] (A) 스테로이드 고정 기간 천식 악화율 (B) : 치료기간 천식 악화율

4. 허가보고서 천식 시험 5
Treatment of childhood asthma with anti-immunoglobulin E antibody (omalizumab)
본 시험은 최소 1년 이상 중등도 이상의 알레르기성 천식을 겪는 청소년 및 성인, 어린이를 대
상으로 천식 및 예정치 않은 외래 방문, 응급실 치료 및 천식 악화에 대한 omalizumab의 영향
을 평가하기 위해 탐구한 무작위 배정, 이중맹검, 3상 위약 대조 시험이다.
한편 본 시험을 소개하는 참고 논문에서 1차 평가 변수 및 2차 평가 변수의 구분이 쉽지 않았
기에, 본 임상 분석에서는 주요 평가 지표 위주로 살펴볼 것이다. 또한 해당 임상은 국내 허가 보 고서에 소아 중증 천식 환자 대상 관련 자료로 활용되었기에 소아 환자의 자료를 위주로 분석할 것이다.
임상 대상 환자는 최소 1년 이상 중등도 이상의 알레르기성 천식을 겪는 6~12세 소아 334명 이다. 이들은 28주 동안 omalizumab 혹은 위약을 2주 혹은 4주마다 피하투여 받았으며 투여 용량과 빈도는 체중과 혈청 IgE에 따라 결정되었다. 본 실험에서 ICS는 BDP(inhaled beclomethasone dipropionate)를 사용하였으며 기간에 따라 용량의 차이를 두었다. 28주 중 초 반 16주를 스테로이드 고정 단계, 이후 12주를 스테로이드 감소 단계로 선정하였다. 스테로이 드 감소 단계인 12주는 다시 8주와 4주로 나누어 첫 8주는 BDP 최적 용량을 찾기 위해 2주에 걸쳐 25%씩 감소시켰으며 나중 4주는 최적 BDP로 유지하였다. 28주간의 연구 기간 이후, 총 연구 기간이 1년이 되도록 추가 24주를 연장 단계로 선정하여 최적 BDP를 유지하며 연구를 진 행하였다. 본 시험의 연장 단계에서는 청소년 및 성인의 경우 이전과 동일하게 blind test로 진
행하였으나, 소아에서는 open-label therapy로 모든 환자에게 omalizumab을 투여하였다.
주요 평가 지표는 예상치 않은 외래진료, 응급실 방문, 입원을 포함한 심각한 천식 악화율, 천식 악화율, 평균 결석 일수가 있다.
주요 평가 지표 중 첫 번째로, 천식 악화율의 경우 omalizumab 투여군이 위약 투여군에 비해 더 낮았으며, 소아의 스테로이드 감소 단계에서 특히 두드러지게 관찰되었는데 이는 [그림 6] 에 서 보다 자세하게 확인할 수 있다.


[ 그림 15] 스테로이드 고정 단계 및 스테로이드 감소 단계에서의 천식 악화율
심각한 천식 악화율의 경우 예상치 못한 외래 방문, 응급실 방문, 입원 세 가지 측면에서 측정 되었으며, omalizumab 투여군의 100명당 발생률을 위약 투여군의 100명당 발생률로 나눈 rate ratio를 통해 비교하였다. 예상치 못한 외래 방문의 경우 0.48 (p<0.01), 응급실 방문의 경 우 0.29 (p<0.06)의 비율이 나왔으며 입원의 경우 omalizumab 투여군에서 발생치 않아 rate ratio 및 p value 가 정의되지 않았다.
본 시험에서는 중등도 이상의 알레르기성 천식을 겪는 소아(6~12세) 환자를 대상으로 omalizumab의 유효성 및 안전성을 확인할 수 있었다. 천식 악화율의 경우 스테로이드 고정 단계, 스테로이드 감소 단계 모두 omalizumab이 치료 효과를 가지고 있음을 보여주었으며, 특히 ICS 용량이 감소했음에도 악화발생률에 미치는 영향이 유효함을 확인할 수 있었다. 또한 omalizumab은 예기치 못한 외래 진료 등을 포함한 심각한 천식 악화율을 낮추는 데에도 기여 하였다. 이를 통해 omalizumab이 ICS 치료가 필요한 알레르기성 천식 소아 환자에 대해 ICS 용량을 낮추면서 천식 악화의 빈도를 발생률을 낮출 수 있음을 확인할 수 있었다. 또한 심각한 천식 악화율의 감소는 결석 가능성을 줄이고, 환자가 보다 정상적인 활동을 이어갈
5. NCT00252135
EXCELS ( Evaluating Clinical Effectiveness and Long-Term Safety in Patients With Moderate to Severe Asthma )
본 임상은 기존의 RCT study ( Random controlled trials, 무작위 대조군 연구 )와는 달리
오말리주맙의 long-term safety를 평가한 임상으로 시판 후 5년간의 발암 가능성 및 심혈관 (CV), 뇌혈관(CBV) 질병과의 잠재적 연관성에 대해 조사한 다기관 연구, 전향적 연구, 4상 관
찰 코호트 임상시험이다.
임상 대상 환자는 12세 이상의 중등도 이상 천식 환자 중 5년의 연구에 동의한 환자이다. 주요
평가 지표는 심각한 천식 악화율, 비흑색종 피부암 (NMSC)을 포함한 악성 종양 발생률, 심혈관 (CV)/뇌혈관(CBV) 관련 질환 발병률, 동맥 혈전 색전증(ATE) 발병률이다.
심각한 천식 악화율은 omalizumab 투여군 50.3%, 비omalizumab 투여군 23.0%이다. 악 성 종양 발생률은 모든 악성 종양 발생률과 NMSC를 제외한 악성 종양 발생률로 나누어 측정하
였는데, 교란 요인과 위험인자를 조정한 cos proportional hazards modeling에서의 hazard ratio로 측정하였다. 이를 통해 표현한 모든 악성 종양 발생률의 hazard ratio는 1.09(95% Cl, 0.87-1.38)이고, NMSC를 제외한 악성 종양 발생률은 1.15(95% Cl, 0.83-1.59)이다.
심혈관(CV)/뇌혈관(CBV) 관련 질환 발병률의 경우 omalizumab 투여군이 1000명당 13.4 명, 비omalizumab 투여군이 1000명당 8.1명의 발병률을 보여주었다. ATE 발병률의 경우, omalizumab 투여군은 1000명당 6.66명, 비omalizumab 투여군은 1000명당 4.64명의 발 병률을 보였으며 hazard ratio의 경우 1.32(95% Cl, 0.91-1.91)를 보여주었다.
기존 RCT 연구가 보통 16주에서 60주 사이의 상대적으로 짧은 치료 기간을 대상으로 진행
되며, 기존의 real-life observational study도 1~2년 동안 진행된다는 점에서, 본 임상은 5 년간 추적 조사를 통해 omalizumab의 장기 안전성을 확인했다는 점에서 큰 의의를 가지고 있 다. 또한 FDA label, EMAD의 EPAR 자료 등에서 발암 가능성, CV/CBV 관련 부작용 관련 문제에 대한 근거로 활용되기도 하였다.
omalizumab의
반면 CV/CBV 관련 질환 발병률과 ATE 발병률 결과의 경우, omalizumab 투여군이 비 omalizumab 투여군에 비해 높은 것으로 나타났다. 이는 두 그룹 간의 천식 심각도 차이로 인
한 오류를 제거하지 못한 결과이기는 하지만, omalizumab의 투여가 관련 질환의 위험을 일부 증가시킬 수 있음을 의미한다.
결론적으로 omalizumab은 장기 안전성의 측면에서 악성 종양 발생 위험성을 높인다고
할 수는 없지만, 심혈관 및 뇌혈관 관련 질병, 동맥 혈전 색전증의 발병률을 높이는 데에는 직간 접적인 영향을 미칠 수 있다.
6. 추가임상분석 중증천식
INNOVATE ( Efficacy and Safety of Omalizumab in Patients With Severe Persistent Asthma ) NCT00046748
본 임상은 고용량 ICS 및 LABA 용법으로도 조절되지 않는 중증 지속형 알레르기 천식 환자
에서 omalizumab 치료의 유효성을 평가한, 무작위 배정, 이중맹검, 3상 위약 대조 임상시험이 다. 임상 대상 환자는 고용량의 ICS 및 LABA 용법으로도 질병 통제가 적절하게 이루어지지 않 는, 12세에서 75세 사이의 중증 지속형 알레르기 천식 환자이다. 이들은 선별 방문 및 8주간의 run-in 단계 이후 28주간의 투여기간 동안 omalizumab 혹은 위약을 2주 혹은 4주마다 피하 투여받았으며 투여 용량과 빈도는 체중과 혈청 IgE에 따라 결정되었다. 1차 평가 변수는 임상적 으로 유의미한 천식 악화율이며, 2차 평가 변수는 중증 악화율, 응급 방문율, 천식 삶의 질 설문 지 평가 (AQLQ)이다.
1차 결과인 임상적으로 유의미한 천식 악화율에서 천식 악화는 전신 코르티코스테로이드 치료 가 필요한 천식 악화로 정의되었다. 28주간의 치료 기간 동안 고용량 ICS 및 LABA 치료에 추 가로 omalizumab를 병용투여한 군의 경우 0.68, 위약을 병용투여한 군의 경우 0.91의 천식 악화율을 보였다. (p=0.042)
1차 결과인 임상적으로 유의미한 천식 악화율에서 천식 악화는 전신 코르티코스테로이드 치료 가 필요한 천식 악화로 정의되었다. 28주간의 치료 기간 동안 고용량 ICS 및 LABA 치료에 추 가로 omalizumab를 병용투여한 군의 경우 0.68, 위약을 병용투여한 군의 경우 0.91의 천식
악화율을 보였다. (p=0.042)

[ 그림 16] (a) 천식 악화율 (b) 중증 악화율
본 임상에서는 고용량의 ICS 및 LABA 용법에도 불구하고 적절하게 조절되지 않는 중증 알레
르기 천식 환자를 대상으로 위약에 비해 omalizumab의 병용투여가 임상적인 치료 효과가 있 음을 보여주었다. 28주 치료 기간동안 1차 결과에서 omalizumab 투여군이 위약 투여군에 비
해 천식 악화율을 26% 감소시켰으며, 2차 결과에서는 중증 악화율을 50%를 감소시켰다. 이 외의 응급 방문율, AQLQ 결과지표에서 모두 위약 투여군에 비해 유의미한 개선을 보여주었다.
이러한 임상 결과는 omalizumab의 보험 적용에 큰 영향을 미쳤다는 점에서 의의를 띄고 있 다. 기존 국내 중증 알레르기성 천식에는 보험이 적용된 생물학적 제제가 전무하여 기존 ICS 및
LABA 요법으로 뚜렷한 치료 효과를 보지 못하는 경우, 치료를 위해 새로운 치료적 옵션인 생 물학적 제제를 사용하는 데 큰 어려움을 겪었다. 이때, 급여 등재를 위해서는 새로운 치료 옵션 에 대한 높은 요구도와 의학적 근거를 필요로 하는데, 여기에서 의학적 근거에 대한 결과로 INNOVATE 임상 결과가 사용되었다. 위약 투여군에 비해 omalizumab 투여군이 임상적으로 치 료적 효과를 보았음을 증명하는 INNOVATE 임상 결과가 omalizumab의
결론적으로, omalizumab은 고용량 ICS 및 LABA 요법으로 치료되지 않은 중증 알레르기 성 천식 환자(12세~75세)를 대상으로 추가적인 치료적 옵션으로 활용될 수 있으며, 이러한 임
상 결과는 급여 등재 과정에서 중요한 의학적 근거로 활용되어 중증 알레르기성 천식에서 최초 로 생물학적 제제가 급여 인정을 받는 결과를 이끌었다.
[표 20] 졸레어 임상 총 정리
연구명 연구 목적 연구 디자인
Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma
중등도 이상의 알
레르기 천식 환자
A Study of Omalizumab (Xolair) in Subjects With Moderate to Severe Persistent Asthma (EXTRA)
중등도 알레르기
천식 환자의 고용
량 ICS 및 LABA
요법에서 omalizumab 추가 치료
의 유효성과 안전 성 평가
군, 위약 투여군 무작위 배정 - 기간 : 28주
스테로이드 고정단계 16주 + 스테로이드 감소 단계 12주 (8
주 감소 단계 + 4주 최적 ICS
용량 유지 단계)
에서 omalizumab 치료의 유효성 과 안전성을 평가 - 대상 : 12~75세 중증도 이 상의 알레르기 천식 환자 - 배정 : omalizumab 투여
- 2주 225mg, 300mg, 375mg 혹은 4주 150mg, 300mg 피하주사
용량과 빈도는 체중과 혈청 IgE에 따라 결정
- 대상 : 12~75세 고용량 ICS
및 LABA로 적절하게 조절되
지 않는 중증등도 알레르기 천
식 환자
- 배정 : omalizumab 투여
군, 위약 투여군 무작위 배정 - 기간 : 48주 - 2주 혹은 4주 피하주사
용량과 빈도는 체중과 혈청
IgE에 따라 결정
일차 평가 변수 : 환자당 평균 천식 악화 횟수 - 스테로이드 고정 단계 (p=0.006) omalizumab : 0.28회 | 위약 : 0.54회 - 스테로이드 감소 단계 (p=0.003) omalizumab : 0.39회 | 위약 : 0.66회
이차 평가 변수 : 천식 악화 경험 환자수, 일일 천 식 증상 점수, 구조약물 사용횟수, 폐기능 검사 (FEV1, PEF), 치료효과 글로벌 평가 - 천식 악화 환자수, 증상점수, 구조약물 사용횟수 모두 omalizumab 투여군이 위약군에 비해 유의 미한 감소를 보여줌 - 폐기능 검사에서 omalizumab 투여군이 FEV1, PEF이 유의미한 개선을 보여주었으며, 글로벌 평 가에서 피실험자와 의사 모두 omalizumab에 대 한 선호를 보여줌
일차 평가 변수 : 환자당 천식 악화율 omalizumab : 0.66회 | 위약 : 0.88회 (p=0.008)
이차 평가 변수 : 천식 증상 점수 TASS, 구조약물 사용횟수, 천식 삶의 질 설문점수 AQLQ - TASS, 구조약물 사용횟수는 omalizumab 투 여군이 위약군에 비해 유의미한 감소를 보임 - AQLQ 점수는 omalizumab 투여군이 위약군에 비해 유의미한 증가 변화를 보임
연구명 연구 목적 연구 디자인 주요 결과
Efficacy and Safety of Omalizumab in Children (6 - < 12 Years) With Moderatesevere, Inadequately Controlled Allergic Asthma
ICS로 적절하게 조
절되지 않는 중등
도 이상의 알레르 기 천식 어린이 환
자에 대한 omalizumab의 유효성
과 안전성 평가
- 대상 : ICS로 조절되지 않는
중증도 이상의 알레르기 천식
을 가진 6세에서 12세 미만의
소아 환자 - 배정 : omalizumab 투여 군, 위약 투여군 무작위 배정 - 기간 : 52주 + 16주 후속 조사
스테로이드 고정단계 24주 + 스테로이드 조정단계 28주 + 후속 16주 - 2주 혹은 4주 피하주사
용량과 빈도는 체중과 혈청
IgE에 따라 결정
일차 평가 변수 : 스테로이드 고정 단계 중 심각한 천식 악화율, 최소 1번 이상 부작용 경험 환자비율 - 스테로이드 고정 단계 중 심각한 천식 악화율 omalizumab : 0.45회 | 위약 : 0.64 (p=0.007) omalizumab 투여군이 위약 투여군보다 천식 악 화율을 31% 감소시킴 - 1회 이상 부작용 경험 환자비율 omalizumab : 90.3% | 위약 : 93.7%
두 군의 차이는 임상적으로 유의하지 않아 유사하 다고 판단할 수 있음
이차 평가 변수 : 스테로이드 고정단계 중 야행성 천식 증상 점수 및 구조약물 일일 평균 흡입 횟수, 심각한 천식 악화율, 소아 천식 삶의 질 설문점수 PAQLQ - 심각한 천식 악화율의 경우 omalizumab 투여군이 위약 투여군보다 43% 감소시켰음 (p<0.001) - 이외의 다른 이차 평가 변수의 경우 omalizumab 투여군이 위약 투여군에 비해 긍정적인 수 치를 보였으나 통계적 유의성을 확보하지 못했음
Treatment of childhood asthma with antiimmunoglobulin E antibody (omalizumab)
최소 1년 이상 중
등도 이상 알레르
기 천식 어린이 환
자에 대한 예정치
못한 외래방문, 응
급실 치료 및 천
식 악화에 대한 omalizumab 치
료의 유효성과 안 전성 평가
- 대상 : 최소 1년 이상 중등 도 이상 알레르기 천식을 겪는
알레르기 천식을 가진 6세에서
12세 미만의 소아 환자
- 배정 : omalizumab 투여
군, 위약 투여군 무작위 배정
- 기간 : 28주 + 24주 연장
단계
스테로이드 고정단계 16주 + 스테로이드 감소단계 12주 (8
주 감소단계 + 4주 최적 ICS
용량 유지단계) + 연장단계 16 주 (open-label therapy 전 환)
- 2주 혹은 4주 피하주사
용량과 빈도는 체중과 혈청
IgE에 따라 결정
주요 평가 변수 : 심각한 천식 악화율, 치료 효과 글로벌 평가, 평균 결석 일수, 천식 악화율 - 심각한 천식 악화율 omalizumab투여군/위약 투여군)
예상치 못한 외래 방문 : 0.48 (p<0.01)
응급실 방문 : 0.29 (p<0.06) 입원 : omalizumab 투여군에서 발생치 않아 값 없음 - 평균 결석 일수 omalizumab : 0.65일 | 위약 : 1.21일 - 천식 악화율의 경우 omalizumab 투여군이 위 약 투여군에 비해 낮으며 소아의 스테로이드 감소 단계에서 특히 두드러짐 - 치료 효과 글로벌 평가의 경우 피실험자와 조사 자 모두 omalizumab에 대한 선호를 보여줌
연구명 연구 목적 연구 디자인 주요 결과
EXCELS ( Evaluating Clinical Effectiveness and Long-Term Safety in Patients With Moderate to Severe Asthma )
기존 RCT study 및 real-life observational study와 달리
시판 후 5년 간 omalizumab으
로 인한 발암 가능
성 및 심혈관(CV)/ 뇌혈관(CBV) 관련
질환과의 잠재적
연관성 평가 - 대상 : 12세 이상 중등도 이 상 알레르기 천식 환자 중 5년 의 연구에 동의한 환자 - 배정 : omalizumab 투여 군, 위약 투여군 무작위 배정 - 기간 : 5년 - 2주 혹은 4주 피하주사
용량과 빈도는 체중과 혈청
IgE에 따라 결정
주요 평가 변수 : 심각한 천식 악화율, 악성 종양 발생률, CV/CBV 질환 발병률, ATE 발병률 - 심각한 천식 악화율 omalizumab : 50.3% | 비omalizumab : 23.0% - 악성 종양 발생률 ( hazard ratio 이용 ) 모든 악성 종양발생률:1.09(95%Cl, 0.87-1.38) NMSC 제외 악성 종양발생률:1.15(95%Cl, 0.83-1.59) omalizumab의 처방이 유의미하게 악성 종양 발 생 위험성을 높이는 것에 영향을 미친다고 할 수 없 음 - CV/CBV 질환 발병률 ( 1000명당 발병 인원 ) omalizumab : 13.4명 | 비omalizumab : 8.1 명 - ATE 발병률 ( 1000명당 발병 인원 ) omalizumab : 6.66명 | 비omalizumab : 4.64 명
hazard ratio = 1.32(95%Cl, 0.91-1.91) omalizumab의 처방이 CV/CBV, ATE 질환의 발 병률을 높이는데 직간접적인 영향을 미친다고 판 단 가능 * hazard ratio = hazard in treatment arm / hazard in control arm ( 연구 기간 내내 일정 시 간 간격에서 두 집단의 사건이 발생할 확률의 비 )
INNOVATE
( Efficacy and Safety of Omalizumab in Patients With Severe Persistent Asthma)
고용량 ICS 및
LABA 요법으로
적절하게 조절되지
않는 중증 지속형
알레르기 천식 환
자에 대한 omalizumab의 유효성 과 안전성 평가
- 대상 : 고용량 ICS 및 LABA
요법으로 적절하게 조절되
지 않는 12세에서 75세 사이
의 중증 지속형 알레르기 천
식 환자 - 배정 : omalizumab 투여
군, 위약 투여군 무작위 배정 - 기간 : 28주 - 2주 혹은 4주 피하주사
용량과 빈도는 체중과 혈청
IgE에 따라 결정
일차 평가 변수: 환자당 천식 악화율 omalizumab : 0.68 | 위약 : 0.91 (p=0.042)) omalizumab 투여군이 위약 투여군보다 천식 악 화률을 26% 감소시킴
이차 평가 변수 : 중증 악화률, 응급 방문률, 천식 삶의 질 설문점수 AQLQ
- 중증 악화률의 경우 omalizumab 투여군이 위
약 투여군에 비해 50% 감소시켰음 (p=0.002)
- 응급 방문률의 경우 omalizumab 투여군이 위 약 투여군에 비해 44% 감소 시켰음 (p=0.038) - AQLQ의 경우 omalizumab 투여군이 위약 투 여군에 비해 유의미한 증가를 보였으며, 임상적 유 의미한 발전을 한 환자 비율에서도 우위를 보임. ( activity, emotion, symptom, environment 4개의 영역 모두 유의미한 개선 )
졸레어(Xolair, Omalizumab)의 알레르기성 천식 적응증에 대한 국내 급여 기준은 아래 [표
21] 과 같다. 이때 중증 천식 환자에 사용하는 생물학적 제제(졸레어, 누칼라, 싱케어, 파센라) 간
병용투여는 급여 인정하지 않으니 주의하여야 한다. 또한, 중증 호산구성 천식 환자에 사용하는
생물학적 제제(누칼라, 싱케어, 파센라)에서 졸레어로의 교체투여 역시 인정하지 않는다.
[표 21] 졸레어의 알레르기성 천식 한국 및 영국 급여 기준
성인 및 청소년(만 12세 이상):
알레르기성 중증 지속성 천식 환자 중 고용량의 흡
입용 코르티코스테로이드-장기지속형 흡입용 베타2
작용제 (ICS-LABA)와 장기 지속형 무스카린 길항
제(LAMA)의 투여에도 불구하고 적절하게 조절이 되
지 않는 경우로서 다음의 조건을 모두 만족하는 경우
1. 치료시작 전 IgE의 수치가 76IU/mL 이상
2. 통년성 대기 알러젠에 대하여 시험관 내(in vitro)
소아, 청소년, 성인:
severe persistent allergic IgE-mediated asthma
Optimized therapy*에 add-on하여 사용
기준
반응 또는 피부 반응 양성
3. FEV1 값이 예상 정상치의 80% 미만
4. 치료 시작 전 12개월 이내에 전신 코르티코스테
로이드가 요구되는 천식 급성 악화가 2회 이상 발생 한 경우
소아(만 6~12세):
상기 성인 및 청소년에게서의 내용과 같으나, 소아의
경우 3번 조건을 제외한 1번, 2번, 4번 조건을 만족 해야 함
1.최초 투여 후 16주째 반응평가※를 하여 전반적인
천식조절을 확인한 환자에 대한 소견서 제출 시 향후
지속투여를 인정함.
2.이후 지속적으로 3∼6개월마다 반응 평가하여 투여
지속 여부를 판단하도록 함.
※ 반응평가 : 최대호기유속(peak expiratory flow),
주간 및 야간증상, 구원치료제 (rescue medication)
사용, 폐활량검사(spirometry), 증상악화 (exacerbations) 등
단, 지속적이거나 빈번한 OCS 필요한 사람 & 제조사가 PAS에서 합의된 할인으로 제공할 때
*optimized therapy - ICS (high-dose) - LABA - LTRA - theophylline - OCS
급여등재절차 및 약가변화
졸레어는 2007년 5월 허가 이후 11년이 넘도록 비용 효과성을 인정받지 못한 최장수 미등재
신약이었다. 급여의 문턱을 넘기까지 오랜 기간이 걸렸던 졸레어의 국내 급여 등재 절차는 다음 과 같다. 2016년 제12차 약제급여평가위원회에서 경제성평가 분석 결과 비용 효과적이지 않으
므로 비급여 하였다. 기존 표준치료법과 비교 시 천식악화율 및 천식 관련 삶의 질 향상은 유의
미하나, 비용 효과성이 명확하게 소명되지 않았다.
2년 뒤인 2018년 제12차 약제급여평가위원회에서는 대체요법 대비 천식 증상악화 발생빈도
감소 등 임상적 유용성 개선이 인정되었다. 경제성평가 결과 비용-효과비가 수용 가능하므로 급
여 적정성 있다고 판단하였다. (근거 임상: INNOVATE, EXTRA) 이렇게 심평원 약평위에서 비
용 효과성을 인정받았으나, 건강보험공단과의 비용 효과성을 협상에서 노바티스 측이 자진 철 회하였다. 이는 코리아패싱 논란을 불러일으켰는데, 단일 보험자인 건강보험공단을 통하여 급
여가 등재되는 우리나라의 투명한 비용 효과성을 제도를 타 국가가 참조하기 좋기 때문이다. 특 히 중국 시장의 한국 약가 참조가 큰 변수로 작용하였다. 2019년 중국에서 졸레어의 급여가 등 재된 이후, 졸레어의 보험급여 등재는 재도전 되었다. 2020년 제 3차 약제급여평가위원회에서
다시 한 번 급여 적정성이 있음을 평가받았고, 그 결과 2020년 7월 1일 자로 졸레어주사가 급
여 적용을 개시하였다. 이후 2021년 졸레어 프리필드시린지 75mg과 150mg이 차례대로 급
여 등재되었다. 제형과 용량별로 급여 등재 시점에 차이를 둔 것은 노바티스의 공급 가능 시기
에 따라 결정되었다.
졸레어의 국내 약가 변화 및 약가 인하 사유는 아래 [표 22]를 참고 바란다.
[ 표 22] 졸레어의 국내
다음으로는 영국에서 졸레어의 급여에 대해 살펴보고자 한다. 한국과 영국에서의 최초 급여 등 재일 및 약가 비교는 아래 [표 23]를 통해 정리한다.
[표 23] 졸레어의 한국과 영국 최초 급여 등재일 비교 한국 영국
현재 약가 (Omalizumab 150mg vial 기준)
최초 급여 등재일
27만 305원
2020.07.01 (졸레어주사)
2021.01.01 (졸레어 PFS 75)
2021.10.01 (졸레어 PFS 150)
256.15파운드 (약 37만 400원)
2013.04.24
현재 영국에서 졸레어는 150mg vial이 £256.15 (한화 약 37만 4000원), 75mg vial
이 £128.07 (한화 약 18만 7000원)로 등재되어 있다. 한국에서 졸레어프리필드시린지주 150mg이 27만원대, 75mg이 14만원대인 것에 비하여 높은 가격으로 책정되어 있다. 또한, 영국의 졸레어 급여등재일은 2013년 4월로, 2020년 급여 적용을 개시한 한국보다 7년 빠르다.
영국의 약가 제도를 살펴보자면 DHSC(보건사회복지부)에서 NHS(영국 국영 의료서비스) 등 재 의약품의 약가 및 급여 여부를 결정한다. 기본적으로 제약사가 자율적으로 가격을 신청하는 free-pricing 방식으로 제약사가 신청한 가격을 DHSC에서 승인하는 형태이다. 약가 결정과 급여 여부는 별도로 분리되지 않으며, NHS에서 처방되는 약제의 대부분은 100% 보험급여 된 다. 즉, 품목허가가 이루어지면 NICE(국립보건임상연구소)의 평가를 거쳐 약가 목록에 자동으 로 등재(negative list)된다. 이때 NICE는 NHS에 약제의 임상적 효과성, 비용-효과성에 대해 근거에 기반한 기술적 자문을 제공한다. 국내는 의약품 선별등재제도(positive list)로, 비용효 과성에 대한 경제성 평가와 약가 협상을 거쳐 치료적 및 경제적 가치가 우수한 의약품만 선별적 으로 보험을 적용한다는 것에서 영국과 차이가 있다.
졸레어의 임상적 효능을 평가한 5개의 질문은 다음과 같다.
∙ Efficacy of Omalizumab
∙ Long-term efficacy of Omalizumab
∙ Corticosteroid-sparing effect of Omalizumab
∙ Safety of Omalizumab
∙ Adverse effect of oral corticosteroids
이때 efficacy는 exacerbation, 입원 횟수, asthma control questionnaire 점수, FEV1 수치와 관련된 것이었으며, key adverse event는 아나필락시스, 동맥혈전증, 암이었다. 이 과
정에서 검토한 임상은 EXALT, INNOVATE, SOLAR를 포함한 11개였다.
영국에서 졸레어의 급여 등재 시 경제성평가는 Manufacturer’s economic model과 Assessment Group’s economic model을 통하여 이루어졌다. 경제성 평가 과정에서 이러 한 모형을 구축하는 이유는 임상 연구에서 관찰된 기간보다 외삽하여 장기간 효과를 관찰하여야 하며, 중간 임상 지표를 최종성과에 연결해야 하기 때문이다. 졸레어에 대해서는 Markov model 로 평가가 이루어졌다. 이때, Assessment group은 두 모델 모두 ICER값이 £30,000/ QALY gained 이하가 될 가능성을 거의 0이라고 평가했다. 아래 표는 Assessment Group’s economic model 결과이다.
[표 24] 졸레어 경제성평가 (Assessment group’s economic model, 영국)
성인
이어서 평가위원회는 추가로 세 개의 group을 가정하여 모델을 구축하고 ICER 값을 분석할 것을 요청하였다.
-Group 1 : oral corticosteroids maintenance + hospitalized in the year before treatment
-Group 2 : oral corticosteroids maintenance
-Group 3 : oral corticosteroids maintenance or oral corticosteroids frequent use
이러한 추가분석 결과 또한 ICER값이 £30,000/QALY gained 이상이었다.
이후 Manufacturer 측에서 추가 분석을 진행하였다. Asthma-related mortality rate을 15%로 증가시키고, Children의 비율을 2.2%, 4.75%, 7.3%로 나누어 각각의 ICER 값을 계산하여 결과를 도출하였다. 이때, Manufacturer 측에서 사전에 PAS에 대하여 동의하였다.
[표 25] 졸레어 경제성 평가 (추가 분석, 영국)
Children 비율 2.2% 4.75% 7.3%
Group 2
Group 3
£23,626/QALY gained
£23,011/QALY gained
£23,817/QALY gained
£23,203/QALY gained
£24,008/QALY gained
£23,395/QALY gained
결론적으로 평가위원회는 6~11세 children proportion in the overall population eligible for omalizumab을 4.75%로 계산하였고, PAS 를 적용하였다. 그 결과 경구용 코르티코스테
로이드로 유지요법 중이거나 빈번하게 투여받는 성인, 청소년, 아동을 합친 모집단에서 얻은 가
장 합리적인 ICER값은 £23,200/QALY gained였다. 이를 통해 졸레어는 비로소 영국에서 급
여 등재될 수 있었다.
** PAS란?
영국에는 PAS(Patient Access Scheme, 환자 접근성 향상 제도)가 존재한다. PAS는 의약 품의 비용-효과성을 향상시키고 혁신적 의약품에 대한 환자의 접근을 제고하도록 회사에서 제
안하고, 보건부와 회사가 합의하도록 설계한다. 제약사는 다양한 형태의 PAS를 선택할 수 있고, 가장 간단한 형태로는 오리지널 가격에서 할인을 하는 방식이 있으며 보건부가 이에 동의해야 한다 PAS는 단순할인유형(Simple discount schemes)과 복잡계획(Complex scheme)으 로 구분된다.단순할인유형의 경우 등재가격보다 낮은 가격이나 할인율을 적용하여 고정 가격을 보장받는다. 이는 상환 방식이 가장 단순하여 계약유형 중 가장 많은 비중을 차지한다. 복잡계약 의 경우 사용량상한(Dose Cap), 조건부무상제공(Free Stock), 단일고정가격제(Single Fixed Price) 등 다양하게 분류되며 이는 제약사와 NHS 양쪽에 부담을 줄 수 있기 때문에 예외적인 상황에서만 사용한다. 졸레어의 PAS에 따라 약가가 인하되었으며 discount size는 기밀이다.
3. 급여전략
국내 졸레어의 급여 과정에서 살펴볼만한 급여 전략 관련 이슈는 크게 두 가지 정도로 정리할 수 있다. 첫 번째는 위험분담제도(RSA)에 대한 것으로, 2009년에 졸레어의 RSA적용방안이 검 토된 적 있으나 결과적으로 불발되었다. 노바티스 측에서는 16주까지 환자에게 졸레어 투약 후 임상적 효과가 있는 환자에 한하여 약물투여지속 및 건강보험적용(약가보상)을 개시하는 방안을
제안하였다. 그러나, 당시 졸레어가 필요한 국내 잠재환자군은 100명 내외였으며 노바티스는 보험상한가로 월평균 투약비용 120만원, 병당 46만원대를 제시했다. RSA의 경우 당시 현행법
령상 근거 미비 및 타 법령에 저촉될 소지가 있다고 판단되어 기각되었다.
다음으로는 중증 천식과 산정 특례에 대해 살펴보고자 한다. 중증천식환자는 산정특례 대상이
아닌데, 대한천식알레르기학회 차원에서도 적용 요구를 꾸준하게 했으나, 몇 가지 이유로 대상 이 되지 못하고 있다. 첫 번째는 스테로이드로 증상이 조절될 수 있기 때문이다. 두 번째로는 중 증천식은 겉으로는 증상이 없는 것으로 보인다. 따라서 아토피 피부염과 같이 눈에 보이는 질환 에 비하여 심각성이 부각되지 않는다. 세 번째로는 타 질환에 비해 성인층 환자가 더 많다는 점 이다. 중증 천식은 아토피피부염과 같이 어린이 환자가 많은 질환에 비해서 스테로이드 부작용 에 대한 경각심이 덜하기 때문에, 중증 천식을 산정 특례 질환으로 적용하는 것에 대한 논의가 긍 정적으로 마무리되지 않았다.
허가
의약품 안전나라. (2007.05.30). 졸레어주사(오말리주맙). Retrieved from https://nedrug.mfds.go.kr/pbp/ CCBBB01/getItemDetailCache?cacheSeq=200706212aupdateTs2024-08-19%2022:03:16.886614b
의약품 안전나라. (2016.05.27). 졸레어프리필드시린지주150(오말리주맙). Retrieved from https://nedrug. mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=201602975aupdateTs2024-08-19%20 22:08:34.392923b
의약품 안전나라. (2017.06.26). 졸레어프리필드시린지주75(오말리주맙). Retrieved from https://nedrug. mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=201704778aupdateTs2024-08-19%20 22:07:04.240647b
의약품 안전나라. (2024.03.07).
졸레어프리필드시린지주300(오말리주맙). Retrieved from https://nedrug. mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202400492aupdateTs2024-08-30%20 15:45:20.315141b
European Medicines Agency. Medicines. Retrieved from https://www.ema.europa.eu/en/ medicines/human/EPAR/xolair
FDA. Drug Databases. Drugs@FDA. Retrieved from https://www.accessdata.fda.gov/scripts/cder/ daf/index.cfm?event=BasicSearch.process
Makwana, S., Basu, B., Makasana, Y., & Dharamsi, A. (2011). Prefilled syringes: An innovation in parenteral packaging. International journal of pharmaceutical investigation, 1(4), 200–206. https:// doi.org/10.4103/2230-973X.93004
Roszkiewicz, J., Swacha, Z., & Smolewska, E. (2020). Prefilled pen versus prefilled syringe: a pilot study evaluating two different methods of methotrexate subcutaneous injection in patients with JIA. Pediatric rheumatology online journal, 18(1), 64. https://doi.org/10.1186/s12969-020-004554 - 임상
Busse W, Corren J, Lanier BQ, McAlary M, Fowler-Taylor A, Cioppa GD, van As A, Gupta N. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001 Aug;108(2):184-90. doi: 10.1067/mai.2001.117880.
Busse WW, Szefler SJ, Haselkorn T, Iqbal A, Ortiz B, Lanier BQ, Chipps BE. Possible Protective Effect of Omalizumab on Lung Function Decline in Patients Experiencing Asthma Exacerbations. J Allergy Clin Immunol Pract. 2021 Mar;9(3):1201-1211. doi: 10.1016/j.jaip.2020.10.027. Epub 2020 Oct 24.
Corren J, Casale T, Deniz Y, Ashby M. Omalizumab, a recombinant humanized anti-IgE antibody, reduces asthma-related emergency room visits and hospitalizations in patients with allergic asthma. J Allergy Clin Immunol. 2003 Jan;111(1):87-90. doi: 10.1067/mai.2003.49.
Hanania NA, Alpan O, Hamilos DL, Condemi JJ, Reyes-Rivera I, Zhu J, Rosen KE, Eisner MD, Wong DA, Busse W. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial. Ann Intern Med. 2011 May 3;154(9):573-82. doi: 10.7326/0003-4819-154-9201105030-00002. Erratum in: Ann Intern Med. 2019 Oct 1;171(7):528. doi: 10.7326/L19-0549.
Iribarren C, Rahmaoui A, Long AA, Szefler SJ, Bradley MS, Carrigan G, Eisner MD, Chen H, Omachi TA, Farkouh ME, Rothman KJ. Cardiovascular and cerebrovascular events among patients receiving omalizumab: Results from EXCELS, a prospective cohort study in moderate to severe asthma. J Allergy Clin Immunol. 2017 May;139(5):1489-1495.e5. doi: 10.1016/j.jaci.2016.07.038. Epub 2016 Sep 14.
Lanier B, Bridges T, Kulus M, Taylor AF, Berhane I, Vidaurre CF. Omalizumab for the treatment of exacerbations in children with inadequately controlled allergic (IgE-mediated) asthma. J Allergy Clin Immunol. 2009 Dec;124(6):1210-6. doi: 10.1016/j.jaci.2009.09.021.
Long A, Rahmaoui A, Rothman KJ, Guinan E, Eisner M, Bradley MS, Iribarren C, Chen H, Carrigan G, Rosén K, Szefler SJ. Incidence of malignancy in patients with moderate-to-severe asthma treated with or without omalizumab. J Allergy Clin Immunol. 2014 Sep;134(3):560-567.e4. doi: 10.1016/j. jaci.2014.02.007. Epub 2014 Mar 27.
Milgrom H, Berger W, Nayak A, Gupta N, Pollard S, McAlary M, Taylor AF, Rohane P. Treatment of childhood asthma with anti-immunoglobulin E antibody (omalizumab). Pediatrics. 2001 Aug;108(2):E36. doi: 10.1542/peds.108.2.e36.
건강보험심사평가원. (2016.12.22). 2016년 제12차 약제급여평가위원회. Retrieved from https://www.hira. or.kr/bbsDummy.do?pgmid=HIRAA030014040000&brdScnBltNo=4&brdBltNo=46645&pageIndex=1 &pageIndex2=1#none
건강보험심사평가원. (2019.02.11). 2018년 제12차 약제급여평가위원회. Retrieved from https://www.hira. or.kr/bbsDummy.do?pgmid=HIRAA030014040000&brdScnBltNo=4&brdBltNo=46799&pageIndex=1 &pageIndex2=1
건강보험심사평가원. (2020.07.15.). 2020년 제3차 약제급여평가위원회. Retrieved from https://www.hira. or.kr/bbsDummy.do?pgmid=HIRAA030014040000&brdScnBltNo=4&brdBltNo=46857&pageIndex=1 &pageIndex2=1
건강보험심사평가원. (2020.06.30). 고시 제2020-133호 요양급여의 적용기준 및 방법에 관한 세부사항 안내. Retrieved from https://www.hira.or.kr/bbsDummy.do?pgmid=HIRAA020002000100&brdScnBltNo= 4&brdBltNo=8036#none
건강보험심사평가원. (2023.10.31). 고시 제2023-197호 요양급여 적용기준 및 방법에 관한 세부사항 안내. Retrieved from https://www.hira.or.kr/bbsDummy.do?pgmid=HIRAA020002000100&brdScnBltNo= 4&brdBltNo=10523
건강보험심사평가원. (2024.05.01). 약제급여목록 및 급여상한금액표. Retrieved from https://www.hira. or.kr/bbsDummy.do?pgmid=HIRAA030014050000https://biz.kpis.or.kr/kpis_biz/index.jsp&brdScnB ltNo=4&brdBltNo=1678&pageIndex=1&pageIndex2=1
건강보험심사평가원. (2019). 의약품 및 의료기기 생애주기별 국내외 급여 관리 제도 비교. Retrieved from https://repository.hira.or.kr/bitstream/2019. oak/3054/2/%EC%9D%98%EC%95%BD%ED%92%88%20%EB%B0%8F%20%EC%9D %98%EB%A3%8C%EA%B8%B0%EA%B8%B0%20%EC%83%9D%EC%95%A0%EC% A3%BC%EA%B8%B0%EB%B3%84%20%EA%B5%AD%EB%82%B4%EC%99%B8%20 %EA%B8%89%EC%97%AC%20%EA%B4%80%EB%A6%AC%EC%A0%9C%EB%8F%84%20 %EB%B9%84%EA%B5%90.pdf
김정주. (2020.06.26). ‘코리아패싱’ 논란 졸레어급여… 7월엔 1제품만. 데일리팜. Retrieved from https:// www.dailypharm.com/Users/News/NewsView.html?ID=265976 문윤희. (2023.06.26). “더딘 중증천식 치료제 급여, 안타까움 넘어 부끄러움 느껴야”. news The Voice. Retrieved from https://www.newsthevoice.com/news/articleView.html?idxno=33248
병원신문. (2023.06.26). 중증천식 치료 접근성 향상 위해 위험분담제(RSA) 활용 제안. 병원신문. Retrieved from https://www.khanews.com/news/articleView.html?idxno=224920
어윤호, 김진구. (2019.08.28). 약가 ‘코리아패싱’ 현실화… 제약계가 생각해 볼 문제들. 데일리팜. Retrieved from https://www.dailypharm.com/Users/News/NewsView.html?ID=256146
이원국. (2023.08.24). 중증천식은 ‘중증질환’... 겪어보지 못하면 이해 못 해. 헬스경향. Retrieved from https://www.k-health.com/news/articleView.html?idxno=66911
정윤식. (2020.06.26). ‘졸레어주사’ 건강보험 적용… 상한금액 27만 1700원. MEDICAL Observer. Retrieved from http://www.monews.co.kr/news/articleView.html?idxno=211709
최은택. (2009.08.20). ‘졸레어주’, 리스크-쉐어링 적용 일단 불발. 데일리팜. Retrieved from https:// www.dailypharm.com/Users/News/NewsView.html?ID=115617&dpsearch=%C1%B9%B7%B 9%BE%EE
최은택. (2018.09.21). 중증 천식치료제 졸레어주, 11년만에 보험급여 통과. HIT NEWS. Retrieved from http://www.hitnews.co.kr/news/articleView.html?idxno=2721
NICE. (2013). Omalizumab for treating severe persistent allergic asthma. Retrieved from https://www.nice.org.uk/guidance/ta278
3.3 누칼라·싱케어· 파센라
김수정 sooz1221@gmail.com
윤시원 seaone0228@gmail.com
임서연 imoojoorighthere@gmail.com
김소연 ksyeonssy@gmail.com
손채린 chaerin087@gmail.com
신지혜 shinjihye603@gmail.com
이지원 ezy7829@gmail.com
이번 장에서는 누칼라(Nucala, Mepolizumab), 싱케어(Cinqair, Reslizumab), 파센라 (Fasenra, Benralizumab) 3가지 약제의 허가에 대해 살펴보도록 한다.
호산구는 여러 염증촉진성 매개체 및 과립 단백질의 주요 원천으로 중증 천식의 발병 기전에서
중요한 구성 요소이다. IL-5는 이러한 호산구의 분화, 증식 및 생존에 중요한 역할을 하는 Th2
유래 사이토카인이다. IL-5 또는 그 수용체에 대한 항체는 중증 호산구 천식 치료제로 사용된 다. 우리나라에서는 현재까지 18세 이상 성인에서 누칼라, 싱케어, 파센라 이렇게 3가지 약물
이 허가되었다.
누칼라는 GSK에서 개발한 IgG1/к 동종형, 싱케어는 한독테바가 개발한 IgG4/к 동종형으로
두 약제 모두 인간화 항 IL-5 단일클론항체이다. 이들은 IL-5와 직접 결합하여 IL-5의 작용을 차단한다. 결과적으로 순환 및 조직 호산구를 감소시키며, 이는 호산구성 천식 환자에서 중요한 치료 메커니즘이다.
파센라는 아스트라제네카에서 개발한 IgG1/к 동종형의 인간화 탈푸코실화(humanized afucosylated), 항 IL-5Rα 단클론 항체이다. 위의 두 약제와는 달리 파센라는 인간 호산구 및 호 염구 표면의 IL-5 수용체에 결합하여 작용한다. Fc 도메인에 푸코실 잔기가 존재하지 않기 때문 에, 파센라는 자연살해(NK) 세포와 같은 면역 효과기 세포 상의 FcɣRIII 수용체에 높은 친화도 를 가진다. 파센라는 NK 세포의 항체 의존적 세포매개 세포독성(ADCC)을
[그림 17] IL-5 inhibitor의 작용

우선 세 약제의 한국 허가부터 살펴보자. 한국에서 누칼라, 싱케어, 파센라는 모두 성인에서 기
존 치료법으로 적절하게 조절되지 않는 중증 호산구성 천식 치료의 추가 유지 요법으로 허가받
았다. 이들은 급성 기관지 경련 또는 급성 악화 치료에 사용할 수 없다. 허가된 적응증은 호산구
수치에서 차이가 있다. 누칼라는 치료 시작 시 혈중 호산구 수가 150cells/㎕ 이상이거나 치료
시작 전 12개월 이내에 혈중 호산구 수가 300cells/㎕ 이상인 경우에 사용한다. 싱케어는 치료
시작 시 혈중 호산구 수가 400cells/㎕ 이상인 환자를 대상으로 사용한다.
미국허가
다음으로 각 약제의 미국 허가를 살펴보도록 한다.
누칼라는 2015년 11월 4일 중증 호산구성 천식 치료제로 미국 FDA에서 최초로 승인 받았다.
이후 오토인젝터와 프리필드시린지 제형의 변화로 인해 또 한 번 허가를 받았다. 이는 호흡기 관
련 생물학적 제제 중 최초로 오토인젝터가 허가되었다. 가정 내 투여가 가능해졌다는 점에서 의 미있는 일이었다. 2022년 1월에는 6-11세의 소아 호산구성 천식 환자들에게도 누칼라 투여가 허가되며 더 많은 연령층이 투여받을 수 있게 되었다. 이 외에도 호산구 관련 질환에 대한 누칼 라의 유효성과 안전성이 지속적으로 입증되면서 호산구성 육아종증 다발혈관염 (eosinophilic granulomatosis with polyangiitis (EGPA)), 과다호산구증(hypereosinophilic syndrome (HES)), 비용종 동반 만성 비부비동염(chronic rhinosinusitis with nasal polyps (CRSwNP).) 등 미국에서 누칼라의 적응증 확대가 여러 차례 이루어졌다.
싱케어는 2016년 03월 23일에 미국 FDA에서 허가 받았으며 적응증은 한국 허가와 같다. 아
직 소아 및 청소년 환자에 대한 임상결과가 충분히 확립되지 않았기 때문에 소아나 청소년에게
는 사용되지 않는다.
파센라는 2017년 11월 14일 12세 이상의 중증 호산구성 천식환자들을 대상으로 미국에서
첫 승인을 받았고, 2019년 10월에 오토인젝터 제형 변화로 인한 추가적인 허가를 받았다. 최근 에는 6세-11세의 소아 환자들 대상의 임상 시험에서 안전성이 확보되어 2024년 5월에 연령층 확대가 이루어졌다.
[그림 18] 한국 허가 타임라인

[그림 19] 미국 허가 타임라인

위 그림 은 누칼라, 싱케어, 파센라 허가 타임라인이다.
3. 용법 및 용량, 제형
누칼라는 한국에서 주사 바이알 제형으로 허가받았다. 중증 호산구성 천식 환자를 대상으로 해
당 약물은 피하 주사 (Subcutaneous, SC)의 방식으로 투여되며, 성인 및 12세 이상 청소년의 경우 4주마다 100mg을 투여한다. 투여 부위는 상박의 외측, 복부, 대퇴부 전면 등이며, 같은
부위에 반복해서 주사하지 않는다. 미국에서 누칼라는 중증 호산구성 천식, 호산구 육아종증 다
발혈관염 치료(EGPA), 호산구증가증(HES), 비용종 동반 만성 비부비동염(CRSwNP)의 치료
제로 미국 식품의약국(FDA)의 승인을 받았다. 각 적응증별 권장 용량은 상이하다.
먼저, 중증 호산구성 천식 치료를 위한 누칼라의 권장 용량은 성인과 12세 이상 환자에서 4주
마다 100mg을 피하 주사로 투여하는 것이다. 6-11세의 소아 환자는 4주마다 40mg을 피하 주사로 투여하는 것이 권장된다. 피하 주사는 상박, 복부, 대퇴부 등에 주사하며, 환자 스스로 자 가 주사하거나 의료 전문가가 주사할 수 있다. 자가 주사를 위해 누칼라는 프리필드시린지(prefilled syringe)나 자동 주사기(auto-injector) 형태로 제공된다.
이외에도 호산구증가증(HES)과 호산구 육아종증 다발혈관염 치료(EGPA)를 위해서는 성인 및 12세 이상의 청소년에게 4주마다 100mg 주사제 3개를 연속 투여하여 총 300mg을 피하 주사한다. 비용종 동반 만성 비부비동염(CRSwNP)의 경우, 성인에서 4주마다 100mg을 피하 주사한다.
[표26] 미국에서 누칼라의 적응증에 따른 용법과 용량
적응증 중증 호산구성 천식 - 호산구 육아종증 다발혈관염 - 호산구증가증 비용종 동반 만성 비부 비동염 주사방법 피하 주사 (Subcutaneous, SC)
대상 성인 및 12세 이상 청소년 6-11세의 소아 성인 및 12세 이상의 청소년 성인
용량 4주마다 100mg 4주마다 40mg 4주마다 100mg 주 사제 3개를 연속 투여 하여 총 300mg 4주마다 100mg
싱케어는 국내 및 미국에서 모두 동일한 용법 및 용량으로 환자에게 투여한다. 싱케어 제형은
주사 바이알로, 병원에서 전문 의료진에 의해 4주마다 한 번씩 정맥 주사로 투여된다. 체중에 따
라 3mg/kg의 용량으로 투여되기 때문에 각 환자의 체중에 맞춰 정확한 용량을 계산해야 한다.
각 주사 시간은 약 20~50분 정도 소요된다.
파센라 제형은 투명 내지 유백색인, 무색 내지 황색 액체가 프리필드시린지에 충전된 주사제이 다. 프리필드시린지(1mL) 중 벤라리주맙의 함량은 30mg이다. 처음 3회는 4주 간격으로 피하
주사하고, 이후에는 8주 간격으로 피하주사한다. 이 약은 상완, 허벅지 또는 복부에 투여한다. 미국에서는 파센라 제형이 총 3가지이다. (10 mg/0.5 mL solution in a single-dose prefilled syringe, 30 mg/mL solution in a single-dose prefilled syringe, 30 mg/mL solution in a single-dose autoinjector FASENRA PEN.) 파센라는 국내와 다르게 소아 에게 사용 가능하며 성인과 소아의 용법이 다르다. 12세 이상의 청소년 및 성인의 경우에는 파
센라 30mg을 4주 간격으로 3회 피하주사, 이후에는 8주 간격으로 피하주사한다. 6-11세 소
아의 경우에는 몸무게에 따라 용량이 달라진다. 35kg 이하의 경우에는 벤라리주맙 10mg을 4
주 간격으로 3회 피하주사, 이후에는 8주 간격으로 피하주사한다. 35kg 이상의 경우에는 성인
과 용법 및 용량이 동일하다.
누칼라, 싱케어, 파센라의 주의사항을 살펴보도록 한다. 다음은 세 약제의 주의사항이다.
1) 급성 천식 증상 또는 악화 질환
급성 천식 증상 또는 급성 악화의 치료에 사용해서는 안 된다. 누칼라, 싱케어, 파센라는 급성 기관지 경련 또는 천식 지속 상태의 치료에 사용하지 않는다. 치료 시작 후, 천식이 조절되지 않 거나 악화되는 경우 의사와 상의해야 한다.
2) 과민 반응
누칼라와 파센라는 투여 후 과민 반응(예: 아나필락시스, 혈관 부종, 기관지 경련, 저혈압, 두 드러기, 발진)을 포함한 급성 및 지연성 전신반응이 발생할 수 있다. 임상에서 이러한 반응은 대 체로 투여 후 수 시간 이내에 발생했으며, 일부의 경우 발현이 지연되기도 했다. 과민 반응 발생 시 투여를 중단해야 한다.
싱케어는 아나필락시스와 같은 심각한 알레르기 반응을 일으킬 수 있으므로, 주사 후 환자를 일 정 시간 동안 관찰해야 한다. 누칼라, 파센라와 달리 싱케어는 과민반응이 빠르게 나타난다. 임
상 연구에서 투여 완료 후 20분 이내에 아나필락시스 부작용이 관찰되었다. 만약 아나필락시스
를 포함하는 중대한 전신반응이 발생하면 즉시 투여를 중단하고 적절한 의학적 치료를 시행해야 하며, 싱케어의 사용을 영구적으로 중단해야 한다.
3) 코르티코스테로이드 용량 감소 누칼라와 파센라를 이용한 천식 치료는 전신 또는 흡입 코르티코스테로이드의 사용량을 줄일 수 있다. 이때, 코르티코스테로이드 투여를 갑자기 중단하면 안 되며, 의사의 감독 하에 서서히 감량해야 한다. 전신 금단 증상 또는 전신 코르티코스테로이드 요법으로 억제되었던 증상이 발 현할 수 있기 때문이다.
4) 기생충 (연충) 감염 기생충(연충) 감염 환자는 누칼라, 싱케어, 파센라 투여시 주의해야 한다. 기생충 감염이 발생하 면 호산구가 세포독성 물질을 분비하여 기생충을 직접적으로 죽이는 역할을 한다. 그러나 호산구
의 성숙, 생존 및 활성에 작용하는 사이토카인 IL-5를 타깃으로 하는 약물은 천식 악화의 위험 인자인 혈액 내 호산구수 증가를 억제한다. 이로 인해, 기생충 감염 환자는 기생충 감염에 대한
면역학적 반응을 일으키지 못하게 된다. 따라서, 기생충 감염 환자는 약들을 투여하기 전에 기생
충 감염증을 치료해야 한다. 만약, 환자가 위 약들로 치료하는 동안 감염되었고 항 기생충 치료
에 반응하지 않을 경우, 이 약의 일시적인 투여 중단을 고려해야 한다.
5) 악성 종양
싱케어는 악생 종양 발생 가능성이 있다. 위약대조 임상시험에서 악성 종양이 보고된 환자는 싱케어를 투여받은 환자군 1028명 중 6명, 위약 투여군 730명 중에서는 2명이었다. 또한, 장 기 임상연구에서는 싱케어 투여 환자군 1051명 중 15명의 환자가 악성 신생물 발생을 보고했 다. 싱케어와 악성 종양 간의 인과 관계는 추가적인 연구가 필요하다.
위의 주의사항 외의 다른 주의사항으로 세 약제 모두 임부와 수유부에 대한 안전성이 확립되지
않아 사용 시 신중을 기해야 한다.
[ 표 27]
누칼라, 싱케어, 파센라 정리
누칼라(Nucala, mepolizumab)
싱케어(Cinqair, Reslizumab) 파센라(Fasenra, benralizumab )
제약사 GSK 한독테바 아스트라제네카
작용기전 anti IL-5 Ab anti IL-5 Ab anti IL-5 Receptor Ab
-중증 호산구성 천식 (성인, 6세 이상)
적응증
<미국의 추가 적응증> -호산구성 육아종증 다발혈 관염 -비용종 동반 만성 비부비동 염(성인) -과다호산구증(성인, 12세 이상)
중증 호산구성 천식 (성인) 중증 호산구성 천식 (6세 이상)
* ACQ-5 와 ACQ-7 의 차이 ACQ-5 와 ACQ-7 의 차이
ACQ-5와 ACQ-7은 둘 다 천식 조절 설문지(ACQ)의 버전으로, 천식 증상의 조절 정도를 측정하는 데 사용되지 만, 항목 수와 평가 범위에서 차이가 있다. ACQ-5는 다섯 개의 질문으로 구성되며, 주로 천식의 주요 증상인 숨가 쁨, 야간에 깨는 횟수, 활동 제한, 쌕쌕거림, 그리고 일일 구급 흡입기 사용에 초점을 맞춘다 천식 증상 조절과 일 상 생활에 미치는 영향을 평가하는 데 초점을 두고 있고, 다섯 개의 질문 각각이 7점 척도로 점수화되며, 점수가 낮 을수록 천식 조절이 잘 되고 있음을 나타낸다 최종 점수는 다섯 항목의 평균으로 계산된다
FEV1과 FVC의 임상적 해석 방법
FEV1(1초간 노력성 호기량)와 FVC(노력성 폐활량)는 폐 기능을 평가하는 중요한 지표로, 호흡기 질환의 진단 과 관리를 위해 자주 사용된다. FEV1은 환자가 최대한 빨리 그리고 강하게 내쉬는 동안 첫 1초 동안 배출된 공기 의 양을 측정한 것이다. 이 지표는 기도의 폐쇄 정도를 반영하며, 기도가 좁아질수록 FEV1이 감소한다. 일반적으 로 예상 FEV1의 80% 이상일 때 정상으로 간주되며, 60%에서 79% 사이일 때 경도 감소, 40%에서 59% 사이 일 때 중등도 감소, 40% 미만일 때 중증 감소로 해석된다 따라서 천식 환자에서 FEV1의 감소는 기도 폐쇄를 나
타내며, 치료에 따른 개선 여부를 평가하는 데 사용된다
이와 달리, FVC는 최대 흡입 후 가능한 최대 속도로 완전히 내쉴 때 배출되는 공기의 총량을 측정한 것이다. 이
는 폐의 총 용량을 반영하며, 제한성 폐질환(예: 폐섬유증)에서는 FVC가 감소한다. 일반적으로 예상 FVC의 80%
이상일 때 정상으로 간주되며, 80% 미만일 때는 제한성 폐질환을 시사할 수 있다.
이러한 지표들은 천식의 진단과 치료 계획 수립에 중요한 역할을 하며, 의사는 환자의 임상적 증상과 함께 이 지 표들을 종합하여 질환의 상태와 진행을 평가한다.
*** CAEs와 ICS-formoterol의 임상적 해석 방법
CAEs는 임상적으로 중요한 천식 악화를 의미하며, 주로 치료가 필요한 증상의 급격한 악화를 지칭한다. 이는 천 식 증상이 급격히 악화되어 구급 약물 사용이 증가하거나 스테로이드 치료가 필요해지는 경우, 응급실 방문이나 입 원이 필요한 경우, 또는 폐기능이 급격히 악화되는 경우 등을 포함한다. 임상시험에서 CAEs의 빈도가 감소한다는 것은 해당 치료제가 천식의 급성 악화를 효과적으로 예방하고 관리하는 데 도움이 된다는 것을 의미하며, 이는 천식 관리의 중요한 목표 중 하나이다. ICS-formoterol 용량 감소는 천식 치료에 사용되는 흡입 스테로이드(ICS)와 formoterol의 조합을 더 낮은 용량 으로 사용하면서도 천식 증상이 잘 조절된다는 것을 나타낸다. 이는 천식 관리가 효과적으로 이루어지고 있음을 시 사하며, 약물의 부작용 위험을 줄이고 환자의 삶의 질을 개선하는 데 기여할 수 있다. 임상적으로, ICS-formoterol 용량을 성공적으로 줄이면서도 천식이 잘 조절된다는 것은 해당 치료제가 효과적이라는 중요한 지표로 여겨진다. 따라서, CAEs와 ICS-formoterol 용량 감소는 천식 치료제의 임상시험에서 치료 효과와 안전성을 평가하는 핵 심 지표로, 각각 천식 악화 예방과 장기적인 천식 관리의 성공을 나타낸다고 볼 수 있다.
연구 목적 - 연구 디자인 - 결과 - 결론/의의
중증 호산구성 천식은 호산구의 과도한 증가로 인한 염증성 질환으로, 기존 치료제에 반응하지
않는 경우가 많다. 최근에는 IL-5를 표적으로 하는 생물학적 제제들이 이러한 환자들에게 새로
운 치료 옵션으로 떠오르고 있다. 본 분석에서는 IL-5 inhibitor 생물학적 제제인 메폴리주맙( 누칼라), 레슬리주맙(싱케어), 벤랄리주맙(파센라)의 임상시험 결과를 비교하고 그 효능과 안전
성을 평가해 보려 한다.
메폴리주맙(누칼라)은 DREAM 연구, MENSA 연구, SIRIUS 연구를 통해 그 효능이 입증되 었다.
DREAM 연구는 중증 호산구성 천식 환자에서 메폴리주맙의 다양한 용량이 천식 악화율을 감
소시키는 효과를 평가한 다기관 무작위 배정 이중 맹검 위약 대조 시험이다. 이 연구에서는 616
명의 환자를 1:1:1:1 비율로 무작위 배정하여, 75mg, 250mg, 750mg 메폴리주맙 또는 위약
을 4주마다 피하 주사했다. 연구 결과, 75mg에서 48%, 250mg에서 39%, 750mg에서 52%
의 천식 악화 비율 감소를 보였으며, FEV1에서도 유의미한 개선이 나타났다. 특히 750mg 투
여군에서 최대 0.23L의 개선을 보였다. 부작용 발생 빈도는 위약군과 유사했으며, 두통, 비인 두염, 주사 관련 반응이 빈번하게 보고되었다. 이 연구는 다양한 용량에서 천식 악화율을 효과 적으로 감소시키고, 메폴리주맙이 중증 호산구성 천식 환자들에게 새로운 치료 옵션으로 자리 잡을 수 있음을 보여주었다.
[그림 20] (A) 시간에 따른 악화의 누적 수 및 (B) 악화 횟수 분포. : 1차 평가 변수


MENSA 연구는 중증 호산구성 천식 환자에서 메폴리주맙을 추가 요법으 로 사용했을 때의 효과를 평가했다. 이 연구는 576명의 환자를 1:1:1 비율로 무작위 배정하여, 75mg 또는 100mg 메폴리주맙을 4주마다 피하 주사 또는 100mg 정맥 주사 했다. 연구 결과, 피하 주사군에서 53%, 정맥 주사군에서 47%의 천식 악화 비율 감소를 확인하였으며, FEV1에 서 피하 주사군 0.22L, 정맥 주사군 0.20L의 개선이 나타났다. 경미한 부작용 위주로 보고되었
으며, 주사 부위 반응, 두통, 상기도 감염이 빈번하게 나타났다. 이 연구는 메폴리주맙의 다양한
투여 방법이 모두 유효함을 보여주고, 환자의 상태에 따라 피하 주사와 정맥 주사를 선택할 수 있
는 유연성을 제공한다.
SIRIUS 연구는 중증 호산구성 천식 환자에서 경구 스테로이드(OCS) 용량을 줄이기 위해 메폴
리주맙의 효과를 평가했다. 이 연구는 135명의 환자를 1:1 비율로 무작위 배정하여, 100mg 메
폴리주맙 또는 위약을 4주마다 피하 주사했다. 연구 결과, 메폴리주맙 투여군에서 OCS 용량이 유의하게 감소하였으며(50% 이상 감소 환자 비율이 54%), 천식 악화 비율도 감소했다. 부작용
발생 빈도는 위약군과 유사했으며, 두통, 주사 부위 반응, 상기도 감염이 빈번하게 보고되었다. 이
연구는 스테로이드 사용을 줄이면서도 천식 조절이 가능함을 입증하여, 장기 스테로이드 사용의
부작용을 줄일 수 있는 가능성을 제시했다.
[그림 21] (A) 경구 스테로이드 용량의 변화 (B) 시간에 따른 악화의 누적 수 (C) 1차 평가 변수



레슬리주맙(싱케어)은 NCT01508936, NCT02452190, NCT01287039 및 NCT01285323
연구를 통해 평가되었다.
NCT01508936 연구에서는 18세 이상의 중등도에서 중증 천식 성인 환자 대상으로 3.0 mg/ kg 레슬리주맙이 호산구 ≥400 cells/μL인 환자에서 FEV1과 ACQ-7 점수를 유의미하게 개
선함을 확인했다. FEV1은 위약군 대비 0.272L 개선되었고, ACQ-7 점수는 -0.858의 개선을 보였다. 부작용 발생 빈도는 위약군과 유사했으며, 주로 천식 악화, 두통, 비인두염이 보고되었 다. 이 연구는 고용량의 레슬리주맙이 중증 호산구성 천식 환자에게 효과적임을 보여주며, 특히 혈중 호산구 수치가 높은 환자들에게 유리한 치료 옵션이 될 수 있음을 시사했다.
[그림 22] 위약과 레슬리주맙의 호산구 수치에 따른 FEV1의 변화

NCT02452190 연구는 조절되지 않는 천식과 혈액 호산구 수치가 높은 성인 및 12세 이상 청 소년을 대상으로 레슬리주맙의 효능을 평가했다. 이전의 NCT01508936 연구에서 임상적 효과 를 갖는 것으로 입증된 레슬리주맙의 용량이 다소 높았기 때문에, 상대적으로 적은 용량을 투여 시 유의미한 효과가 있는지 확인을 하기 위해 이루어진 연구이다. 이 연구는 468명의 환자를 무
작위 이중 맹검 위약 대조 시험으로, 110mg 레슬리주맙 또는 위약을 4주마다 피하 주사했다. 연구 결과, 피하 주사 레슬리주맙이 악화 빈도를 감소시키지 못했으며, FEV1에서도 위약군과 유의미한 차이를 보이지 않았다. 이 연구는 피하 주사 110mg 용량이 충분한 효과를 발휘하지 못했음을 시사하며, 더 높은 용량의 필요성을 제기했다. 부작용 발생 빈도는 위약군과 유사했다.
[그림 23]
NCT01287039 및 NCT01285323 연구는 흡입 코르티코스테로이드 기반 치료로 적절하게
조절되지 않고 혈중 호산구 수치가 ≥400 cells/μL인 천식 환자를 대상으로 레슬리주맙의 효
능 및 안전성을 평가했다. 두 연구는 각각 489명, 476명의 환자를 무작위 이중 맹검 위약 대조
병행군 연구로, 3.0 mg/kg 레슬리주맙 또는 위약을 4주마다 정맥 주사했다. 연구 결과, 두 연 구 모두에서 악화 빈도가 유의미하게 감소하였으며, FEV1은 위약군 대비 0.2L 개선되었다. 부
작용 발생 빈도는 위약군과 유사했다. 이 연구는 고용량 레슬리주맙이 효과적임을 재확인하며, 12세 이상 청소년을 포함한 넓은 연령대에서의 사용 가능성을 평가했다.
벤랄리주맙(파센라)은 CALIMA 연구, SIROCCO 연구, SHAMAL 연구, ZONDA 연구, TATE 연구를 통해 평가되었다.
CALIMA 연구는 중등도에서 고용량 ICS와 LABA로도 조절되지 않는 중증 천식 환자를 대상
으로 벤랄리주맙의 유효성을 평가했다. 이 연구는 1306명의 환자를 무작위 배정 이중 맹검 위약
대조 3상 연구로, 30mg 벤랄리주맙을 4주 또는 8주 간격으로 피하 주사했다.
[ 그림 24 ]


SHAMAL 연구는 벤랄리주맙으로 증상이 잘 조절되는 중증 호산구성 천식 환자에서 흡입 스테 로이드 용량 감소를 평가했다. 이 연구는 168명의 환자를 대상으로 한 제4상 임상시험으로, 무
작위 배정, 공개 라벨(open label), 활성 대조 연구로, 30mg 벤랄리주맙 또는 현재 치료를 4
주 간격으로 피하 주사했다. 연구 결과, ICS-formoterol 용량을 성공적으로 감소시켰으며, 4 주 투여군의 92%가 ICS-formoterol 용량을 줄였고, 이 중 60% 이상이 단순 항염증 완화제만
으로도 천식 조절을 유지했다. 또한, ICS 용량을 크게 줄였음에도 불구하고 치료 감량군의 87%
이상이 48주차까 악화를 보이지 않았다. 일부 환자에서는 ICS를 필요 시만 사용했을 때 FEV1
이 감소하는 경향이 있었고, 치료 감량군 전체에서 FEV1 변화와 FeNO 농도 변화 간에 소규모
이지만 유의미한 상관관계가 발견되었다. 부작용 발생 빈도는 위약군과 유사했으며, 빈번한 이
상 반응은 두통, 비인두염, 상기도 감염이었다. 전국 및 국제 치료 지침에서는 낮은 ICS 용량에 반응하지 않는 중증 천식 환자에게 고용량 ICS 로 치료를 강화할 것을 권장한다. 그러나 고용량 ICS의 장기 사용은 부작용 위험이 증가할 수 있 다는 우려가 있으며, GINA 가이드라인에서는 생물학적 제제에 긍정적으로 반응하는 중증 천식
환자에게 ICS 용량을 줄이도록 권장하고 있다. SHAMAL 연구는 이러한 권장 사항을 지지하는 가장 포괄적인 연구로, 벤랄리주맙이 고용량 스테로이드에 대한 노출을 최소화하고 장기적 사용
에 따른 부작용을 줄일 수 있다는 것을 증명하였다.
25]

ZONDA 연구는 고용량 흡입형 코르티코스테로이드(ICS)와 지속성 β2 효능제(LABA), 그리 고 장기적인 경구용 코르티코스테로이드(OCS) 병용요법으로도 천식이 조절되지 않는 중증 천 식 환자를 대상으로 벤랄리주맙(Benralizumab)의 유효성과 안전성을 평가했다.
이 다기관, 무작위배정, 이중맹검, 위약 대조 3상 임상시험에는 220명의 환자가 참여했으며, 14주차(W14) 방문 시 OCS 1일 용량의 평균이 6차 방문(베이스라인)과 비교해 50% 이상 감
소한 환자의 비율을 1차 평가변수로 설정했다. 연구 결과, 벤랄리주맙 30mg을 4주 또는 8주 간 격으로 투여한 두 군 모두에서 통계적으로 유의하며 임상적으로 의미 있는 OCS 용량의 감소가 나타났다. 두 투여군 모두 OCS 용량의 중간값이 75% 감소한 반면, 위약군은 25% 감소에 그 쳤다. 또한, PK/PD 분석 결과, 12주차(W12)에서 거의 완전한 호산구 고갈이 확인되었고, 이 는 28주차(W28)까지 유지되었다. 벤랄리주맙은 두 가지 투여군 모두에서 예상치 못한 안전성 문제 없이 양호한 내약성을 보였으며, 장기 안전성 평가에서도 호산구 감소가 유지되었음을 확 인했다. 이 연구는 벤랄리주맙이 중증 천식 환자의 OCS 용량을 유의미하게 줄일 수 있음을 입
증하며, 4주 또는 8주 간격으로 유연하게 투여할 수 있는 치료 옵션을 제시했다.
벤랄리주맙(파센라)의 소아 환자(6~11세) 사용은 성인과 청소년을 대상으로 한 적절하고 잘 설
계된 시험의 증거와 추가적인 소아 약물동력학, 약력학, 안전성 데이터를 바탕으로 지지된다. 이
연령대의 효과는 SIROCCO, CALIMA, ZONDA 시험에서 성인과 청소년에서 확인된 유효성
을 근거로 소아 환자에게도 적용된다. TATE 연구에서 6세에서 11세 사이의 소아 환자 28명(평
균 연령 9세, 6-8세 11명, 9-11세 17명, 여성 32%, 백인 29%, 아시아인 32%, 흑인 29%)
을 대상으로 진행되었으며, 35kg 이상의 환자에게 투여된 30mg의 벤랄리주맙은 성인과 청소
년의 동일한 용량에서 나타난 것과 유사하거나 더 높은 약물 노출을 보였다. 또한, 약물동력학적
반응도 성인 및 청소년과 유사했다.
메폴리주맙, 레슬리주맙, 벤랄리주맙 모두 중증 호산구성 천식 치료에서 유의미한 효과를 보이
며, 천식 악화 비율을 감소시키고 FEV1을 개선하는 데 효과적이다. 각 제제는 비교적 유사한 안
전성 프로파일을 보이나, 투여 방법과 일부 임상 결과에서 차이를 보인다. 따라서 환자의 상태
와 필요에 따라 적절한 생물학적 제제를 선택하는 것이 중요하다. 향후 각 제제의 장기적 사용에 따른 안전성 및 효능을 지속적으로 모니터링하고, 개별 환자에 맞춘 치료 전략을 개발하는 것이 필요하다. 또한, 생물학적 제제의 높은 비용을 고려하여 비용 대비 효율성을 평가하고, 환자에게
최적의 경제적 부담을 제공할 수 있는 방안을 모색해야 한다. 다양한 투여 방법과 간격을 통해 환 자의 편의성을 높이고, 치료 순응도를 향상시킬 수 있는 방안을 마련하며, 새로운 생물학적 제제
개발을 통해 더 효과적이고 안전한 치료 옵션을 제공할 필요가 있다.
[표 29] 누칼라, 싱케어, 파센라 임상 정리 제제 임상명 연구 디자인
1:1:1:1 비
율 무작위 배
정, 75mg, 250mg, 750mg 메폴리
주맙 또는 위약
을 4주마다 피 하 주사 연간 천식 악화율
FEV1, ACQ-5, AQLQ
75mg에서 48%, 250mg 에서 39%, 750mg에서 52%의 천식
악화 비율 감 소, FEV1에서
유의미한 개선, 특히 750mg 투여군에서 최 대 0.23L 개선
심각한 부 작용 발생 빈도는 위
약군과 유 사. 빈번 한 이상 반 응은 두통, 비인두염, 주사 관련 반응
다양한 용량
에서 천식 악 화율을 효과
적으로 감소 시켰으며, 안
전성 프로파
일이 양호함.
메폴리주맙 은 중증 호산 구성 천식 환 자들에게 새 로운 치료 옵 션으로 자리 잡을 수 있음
피하 주사군에
메폴리주맙 (누칼라)
1:1:1 비율
로 무작위 배
정, 75mg 또는 100mg 메폴리
주맙을 4주마
다 피하 주사 또
는 100mg 정 맥 주사
1:1 비율 무
작위 배정, 100mg 메폴리
주맙 또는 위약 을 4주마다 피 하 주사
연간 천식 악화율
FEV1, ACQ-5, AQLQ
OCS 용량 감소 비율 천식 악화 비율, FEV1, ACQ-5
서 53%, 정
맥 주사군에 서 47%의 천 식 악화 비율 감소, FEV1에 서 피하 주사군 0.22L, 정맥 주사군 0.20L 개선 경미한 부 작용 위주 로 보고, 빈번한 이 상 반응은
메폴리주맙 의 다양한 투
여 방법이 모 두 유효함을
보여주며, 환 자의 상태에
주사 부위 반응, 두 통, 상기도 감염
심각한 부 작용 발생
메폴리주맙 투
여군에서 OCS
용량 유의하게 감소(50% 이 상 감소 환자 비율이 54%)
빈도는 위
약군과 유 사. 빈번 한 이상 반
응은 두통, 주사 부위
반응, 상기 도 감염
따라 피하 주 사와 정맥 주 사를 선택할 수 있는 유연 성을 제공
스테로이드
사용을 줄이
면서도 천식
조절이 가능 함을 입증하 여, 장기 스 테로이드 사
용의 부작용 을 줄일 수
있는 가능성 을 제시
무작위 이중 맹 검 위약 대조 시 험, 3.0 mg/kg
레슬리주맙 또
는 위약을 4주
마다 정맥 주사
NCT02452190 무작위 이중 맹 검 위약 대조 시 험, 110mg 레
또는 위약을 4주마다 피하 주사
무작위 이중 맹
NCT01287039&
NCT01285323
검 위약 대조 병 행군 연구, 3.0 mg/kg 레슬리 주맙 또는 위약
임상 천식 악화 (CAEs) 빈도
호산구 ≥400 cells/μL인 환
자에서 FEV1, ACQ-7 점수
유의미한 개
선, FEV1: 위
약 +0.002L, 레슬리주맙 +0.272L, ACQ-7: 위
약 -0.386, 레슬리주맙 -0.858
FEV1, AQLQ 피하 주사 레 슬리주맙이 악 화 빈도를 감소 시키지 못함, FEV1에서 위
을 4주마다 정 맥 주사 임상 천식 악화 (CAEs) 빈도 FEV1, AQLQ
고용량의 레
슬리주맙이
부작용 빈 도는 위약 군과 유사. 주로 천식 악화, 두 통, 비인 두염
약군과 유의미 한 차이 없음 부작용 빈 도는 위약 군과 유사 피하 주사 110mg 용 량이 충분한 효과를 발휘 하지 못했음 을 시사, 더 높은 용량의 필요성 제기
고용량 레슬
리주맙이 효
악화 빈도 유 의미한 감소, FEV1: 위약 군 대비 0.2L 개선
부작용 빈 도는 위약 군과 유사
과적임을 재
확인하며, 청소년을 포
함한 넓은
연령대에서 의 사용 가
능성을 평가
벤랄리주맙 (파센라)
무작위 배정 이
중 맹검 위약 대 조 3상 연구, 30mg 벤랄리
주맙을 4주 또
는 8주 간격으 로 피하 주사
연간 천식 악 화율
FEV1, ACQ-5, AQLQ
4주 간격 투여
군에서 연간 악
화율 0.60(위
약군 0.93), 8 주 간격 투여
군에서 연간 악
화율 0.66(위
약군 0.93),
FEV1에서 유
의미한 개선
부작용 빈 도는 위약 군과 유사. 주로 비인 두염, 천식 악화
벤랄리주맙 의 유효성과
안전성을 입
증하며, 4주 또는 8주 간 격의 유연한 투여 일정 제공
무작위 배정 이 중 맹검 위약 대 조 3상 연구, 30mg 벤랄리 주맙을 4주 또 는 8주 간격으 로 피하 주사 연간 천식 악 화율
FEV1, ACQ-5, AQLQ 4주 간격 투 여군에서 연간 악화율 45% 감소, 8주 간 격 투여군에 서 연간 악화 율 51% 감소, FEV1에서 유 의미한 개선 부작용 빈 도는 위약 군과 유사. 주로 비인 두염, 상기 도 감염
ICS-formoterol 용
무작위 배정 공 개 라벨 연구, 30mg 벤랄리 주맙 또는 현
재 치료를 4주 간격으로 피하 주사
ICSformoterol 용 량 감소 비율
천식 악화 비율, FEV1, ACQ-5
량을 성공적으 로 감소시킴, 4주 투여군의
92%가 ICSformoterol
용량을 줄였으 며, 이 중 60%
이상이 단순 항
염증 완화제만
으로도 천식 조 절을 유지
부작용 빈 도는 위약 군과 유사. 빈번한 이 상 반응은 두통, 비인 두염, 상기 도 감염
환
벤랄리주맙
이 스테로이 드 의존성을
감소시키고,
장기적 사용 에 따른 부
작용을 줄일
수 있는 가
능성을 제시
국내에서 IL-5 억제제 계열 중증 천식 생물학적제제의 급여 등재는 다음과 같이 이루어졌다.
세 약제 중 누칼라(Nucala, Mepolizumab)와 싱케어(Cinqair, Reslizumab)가 2023년 11
월 성인 중증 호산구성 천식에 대해 동시 급여 등재되었고, 잇따라 파센라(Fasenra, Benralizumab)가 2024년 7월 성인 중증 호산구성
급여 목록에 올랐다. 이로써 중증 호산구
성 천식 환자에게 더욱 넓은 치료 선택지가 제공 가능해졌다.
영국에서는 중증 호산구성 천식 치료제로서 싱케어는 2017년 10월, 파센라는
상이하며 아래의 표와 같다. 치료 시작 시 혈중 호산구가 400 cells/㎕이상이며 치료 시 작 전 12개월 이내에 OCS가 요구되는 급성악화가 3번 이상 발생하였다면 세 약제를 모두 급 여 받을 수 있는 조건에 해당된다. 천식의 지표를
영국의 급여 기준과 평가방법은 한국과 유사하다. 다만, 세 약제를 모두 사용할 수 있는 환자의
경우 가장 낮은 가격의 치료제를 사용하기를 추가적으로 권고하고 있다.
[ 표 31] 누칼라, 싱케어, 파센라의 급여기준
누칼라
1. 투여대상 ○성인 중증 호산구성 천식 환자 중 고용량의 흡
입용 코르티코스테로이드-장기지속형 흡입용 베 타2 작용제 (ICS-LABA)와 장기지속형 무스카린
길항제(LAMA)의 투여에도 불구하고 적절하게
조절이 되지 않는 경우로서 다음 1), 2) 조건 중 하나에 해당하는 경우
※ ICS-LABA: Inhaled CorticoSteroidsLong Acting Beta-2 Agonist LAMA: Long Acting Muscarinic Antagonist
- 다 음1) 치료 시작 전 12개월 이내에 혈중 호산구 수치 가 300 cells/㎕ 이상이면서
- 치료 시작 전 12개월 이내에 전신 코르티코스 테로이드가 요구되는 천식 급성악화가 4번 이상 발생하였거나, 치료 시작 6개월 전부터 prednisolone 5mg/day 와 동등한 수준 이상의 경구
용 코르티코스테로이드를 지속적으로 투여한 경 우 2) 치료 시작 전 12개월 이내에 혈중 호산구 수치 가 400 cells/㎕ 이상이면서 - 치료 시작 전 12개월 이내에 전신
Mepolizumab, as an add-on therapy, is recommended as an option for treating severe refractory eosinophilic asthma, only if: it is used for adults who have agreed to and followed the optimised standard treatment plan and
the blood eosinophil count has been recorded as 300 cells per microlitre or more and the person has had at least 4 exacerbations needing systemic corticosteroids in the previous 12 months, or has had continuous oral corticosteroids of at least the equivalent of prednisolone 5 mg per day over the previous 6 months or
the blood eosinophil count has been recorded as 400 cells per microlitre or more and the person has had at least 3 exacerbations needing systemic corticosteroids in the previous 12 months (so they are also eligible for either benralizumab or reslizumab).
Mepolizumab is recommended only if the company provides it according to the commercial arrangement.
1. 투여대상 ○성인 중증 호산구성 천식 환자 중 고 용량의 흡입용 코르티코스테로이드-장 기지속형 흡입용 베타2 작용제 (ICSLABA)와 장기지속형 무스카린 길항제 (LAMA)의 투여에도 불구하고 적절하 게 조절이 되지 않는 경우로서 다음의 조건을 모두 만족하는 경우
※ ICS-LABA: Inhaled CorticoSteroids-Long Acting Beta-2 Agonist
LAMA: Long Acting Muscarinic Antagonist - 다 음 -
1) 치료 시작 시 혈중 호산구 400 cells/㎕ 이상 2) 치료 시작 전 12개월 이내에 전신 코르티코스테로이드가 요구되는 천식 급성악화가 3번 이상 발생한 경우
1. 투여대상
○ 성인 중증 호산구성 천식 환자 중 고 용량의 흡입용 코르티코스테로이드-장 기지속형 흡입용 베타2 작용제 (ICSLABA)와 장기지속형 무스카린 길항제 (LAMA)의 투여에도 불구하고 적절하 게 조절이 되지 않는 경우로서 다음 1), 2) 조건 중 하나에 해당하는 경우
※ ICS-LABA: Inhaled CorticoSteroids-Long Acting Beta-2 Agonist
LAMA: Long Acting Muscarinic Antagonist
Reslizumab, as an add-on therapy, is recommended as an option for the treatment of severe eosinophilic asthma that is inadequately controlled in adults despite maintenance therapy with high-dose inhaled corticosteroids plus another drug, only if:
the blood eosinophil count has been recorded as 400 cells per microlitre or more
the person has had 3 or more severe asthma exacerbations needing systemic corticosteroids in the past 12 months and
the company provides reslizumab with the discount agreed in the patient access scheme.
Benralizumab, as an add-on therapy, is recommended as an option for treating severe eosinophilic asthma that is inadequately controlled in adults despite maintenance therapy with high-dose inhaled corticosteroids and long-acting betaagonists, only if: the person has agreed to and followed the optimised standard treatment plan and the blood eosinophil count has been recorded as 300 cells per microlitre
- 다 음 -
1) 치료 시작 전 12개월 이내에 혈중
호산구 수치가 300 cells/㎕ 이상이 면서
- 치료 시작 전 12개월 이내에 전신 코
르티코스테로이드가 요구되는 천식 급
성악화가 4번 이상 발생하였거나, 치
료 시작 6개월 전부터 prednisolone
5mg/day 와 동등한 수준 이상의 경구 용 코르티코스테로이드를 지속적으로 투여한 경우
2) 치료 시작 전 12개월 이내에 혈중 호산구 수치가 400 cells/㎕ 이상이 면서 - 치료 시작 전 12개월 이내에 전신
or more and the person has had 4 or more exacerbations needing systemic corticosteroids in the previous 12 months, or has had continuous oral corticosteroids of at least the equivalent of prednisolone 5 mg per day over the previous 6 months (that is, the person is eligible for mepolizumab) or
the blood eosinophil count has been recorded as 400 cells per microlitre or more with 3 or more exacerbations needing systemic corticosteroids in the past 12 months (that is, the person is eligible for reslizumab).
Benralizumab is recommended only if the company provides it according to the commercial arrangement.
급여기준
2. 평가방법
○ 동 약제 투여 전과 투여 후 매 1년마다 평가 하여 다음 중 한 가지 이상을 만족하면서, 전반 적인 천식조절을 확인한 환자에 대한 투여 소견 서 제출 시 지속 투여를 인정함.
(단, 임상증상 등을 고려하여 효과가 불충분 하다고 판단되는 경우에는 1년 이내이더라도 치 료효과를 평가할 수 있음.) - 다 음 -
1) 천식 급성악화의 빈도가 치료 시작 전 대비 50% 이상 감소
2) 지속적인 경구용 코르티코스테로이드 치료 가 필요한 환자의 경우 천식증상 조절을 개선하 거나 유지하면서 경구용 코르티코스테로이드 용 량을 치료 시작 전 대비 50% 이상 감소
3. 중증 천식 환자에 사용하는 생물학적 제제 (omalizumab, mepolizumab, reslizumab, benralizumab)간 병용투여는 급여 인정하지 아니함.
4. 교체투여 가. 중증 호산구성 천식 환자에 사용하는 생 물학적 제제(mepolizumab, reslizumab, benralizumab)간 교체투여 및 동 약제에서 omalizumab으로의 교체투여는 인정하지 아니 함.
나. omalizumab 주사제 투여 후 동 약제로의 교체투여는 다음의 조건을 모두 만족하면서 투여 소견서 첨부 시 사례별로 급여 인정함. - 다 음 -
1) omalizumab 주사제를 3-6개월 이상 사
용하였음에도 효과가 불충분하거나 부작용으로 투약을
2)
If mepolizumab, benralizumab or reslizumab are equally suitable, start treatment with the least expensive option (taking into account drug and administration costs).
At 12 months:
stop mepolizumab(reslizumab, benralizumab) if the asthma has not responded adequately or
continue mepolizumab(reslizumab, benralizumab) if the asthma has responded adequately and assess response each year.
An adequate response is defined as:
a clinically meaningful reduction in the number of severe exacerbations needing systemic corticosteroids or
a clinically significant reduction in continuous oral corticosteroid use while maintaining or improving asthma control.
[표 32] 한국 급여 등재 절차 및 약가
[표33] 영국 급여 등재 절차 및 약가
므로 비급여하였다. 고용량 ICS/LABA복합제 + OCS요법을 대체 요법으로 선정하였고 기존
치료법 대비 천식 악화 빈도 감소, 전신 스테로이드 사용량 감소 등에서 유의한 개선을 보였으
나 대체약제 대비 4주 소요비용이 고가로 평가되었다. 2023년 제10차 약제급여평가위원회에
서 ICS/LABA 복합제와 LAMA 또는 OCS 병용요법을 대체요법으로 선정하였고 비교약제 대 비 천식 악화 빈도 등을 감소시켜 임상적 유용성 개선이 인정되며, 제약사가 제시한 위험분담안 을 적용한 경제성평가 결과 비용효과비가 수용 가능하므로 급여의 적정성이 있다고 평가되었다.
2023년 11월 1일, 약가 협상을 마치고 144mg 1병에 1,280,000의 상한금액으로 급여 등재 되었다.
싱케어는 2023년 제7차 약제급여평가위원회에서 경제성평가 결과, 비교약제인 ICS/LABA 복합제와 LAMA 또는 경구용 스테로이드 병용요법 대비 4주 소요비용이 고가로 평가되었으나, 천식 악화 빈도 등을 감소시켜 임상적 유용성 개선이 인정되며, 비용-효과비가 수용 가능하여 급 여의 적정성이 있다고 평가되었다. 누칼라와 동시에 2023년 11월 급여 등재되었다.
파센라는 2024년 제3차 약제급여평가위원회에서 동일한 생물학적제제인 누칼라와 싱케어가 대체약제로 비교되었다.
대체약제로 비교되었다. 파센라와 대체약제 간에 천식 악화 빈도 감소 등 효과의 차이가 있다고
보기 어려우나, 8주 소요비용은 파센라가 대체약제에 비해 저렴하여 비용효과적이므로 급여의
적정성이 있다고 평가되었다. 선발 약제 중 누칼라가 위험분담제를 적용받았으므로 파센라도 같
은 유형의 위험분담제가 적용되었고 대체약제와 점유율을 비교해 약가를 협상하였다.
4. 급여 등재 전략
한국 급여 등재 전략
세 약제는 한국 급여 등재 이전 여러차례의 실패를 겪었다. 출시 이후 여러
실패한 싱케어는 2023년 7월 약제급여평가위원회에서 네번째 도전 만에 급여 적정성을 인정받 았다. 싱케어는 중증 천식 치료제임에도 불구하고 일반 경제성 평가 트랙를 통해 급여 등재를 신 청했다. 약평위의 평가 결과 자료에 따르면 싱케어는 임상적 유용성 개선과 급여의 적정성이 있 음에도 불구하고 경제성평가 분석 시 효용 및 사망률 추정에 따른 비용효과비에 불확실성이 있 는것으로 판단되어 유사 천식치료제의 비용 등을 고려해 약가 협상이 필요한 상황이었다. 이 때
유사치료제는 당시 치료적 위치가 비슷하며 보험 급여가 되고 있던 치료제였던 졸레어이다. 같
은 생물학적제제이지만 치료 기전과 급여 대상이 다름에도 불구하고 정부는 졸레어를 비교 대
상으로 삼았고, 졸레어의 약가를 감안하여 공단과 협상을 해야했기 때문에 싱케어의 약가 협상
이 길어졌던 것으로 보인다.
그 사이, 누칼라는 2023년 9월 약평위에서 급여 적정성을 인정받았다. 누칼라는 싱케어와 달
리 환급형, 총액제한형의 위험분담제를 적용 받아 급여 등재 절차를 밟았다. 누칼라를 비롯한 중 증 호산구성 천식 치료제는 희귀의약품으로 지정되었지만 희귀질환치료제로는 분류되지 않아 기존에는 위험분담제의 대상이 되지 않았고 이러한 이유로 그동안 급여권에서 소외되고 있었다. 하지만 2023년 보건복지부가 신약의 혁신가치 적정보상안을 발표하며 위험분담제의 적용 대상 이
먼저 등재된 약제가 일반등재 절차를 통해 실제가로 등재되었다면 후발약제가 위험분담제를 적 용받는데 불리하다. 이러한 선례가 없었기 때문에 누칼라는 싱케어가 급여 적정성을 인정받는 동
안 더욱 급여 등재를 서두른것으로 보인다.
또한 누칼라는 2017년 비급여 심의를 받은 당시와 비교해 임상적 유용성 데이터를 더욱 확보 하였다. 이러한 노력 덕분에 2023년 9월 누칼라는 급여 적정성을 인정받을 수 있었다. 이후 누
칼라는 기등재된 졸레어와 협상 중인 싱케어의 약가를 고려하여 약가협상을 마쳤고 2023년 11 월 싱케어와 동시에 급여 목록에 올랐다.
파센라는 2024년 3월 약평위에서 급여 적정성을 인정받았다. 이미 급여되고 있는 생물학적제
제인 누칼라와 싱케어를 대체요법으로 삼아 비용효과성이 평가되었다. 파센라의 8주 소요 비용 이 대체약제 대비 저가로 평가되었다. 파센라는 누칼라와 치료적 위치가 동등하면서 비용효과적
인 후발약제로서, 선발약제인 누칼라와 동일한 유형인 환급형과 총액제한형의 위험분담제가 적
용되며 2024년 7월 정식으로 급여 목록에 올랐다.
영국 급여 등재 전략
가장 먼저 급여된 싱케어는 best supportive care와의 비교를 통해 비용 효용성을 입증했
다. study 3082와 study 3083의 결과를 토대로 싱케어와 플라시보 투여 시의 천식 악화 확 률을 비교했다. 이 때 악화 전의 확률을 어떻게 계산하는지가 싱케어가 비용 효용성을 입증하는 데에 중요한 영향을 미쳤다. 지난 12개월 동안 악화가 3회 이상 발생한 사람에 대한 ICER는 £29,870/QALY였다. 싱케어 사용 시 경구 코르티코스테로이드가 절약되는 점까지 반영하면 ICER는 더 낮아질 수 있으므로 위원회는 싱케어의 비용 효용성을 인정했다. 싱케어는 Patient Access Scheme(PAS)의 단순할인 유형을 통해 할인된 가격으로 급여된다.
NICE 평가위원회는 파센라가 중증 호산구성 천식 환자에게 새로운 선택지를 제공해주면서도 기존에 급여되는 싱케어보다 투여방법이 쉽고 투여 간격이 길어 편리할 수 있다고 평가했다. 싱
케어는 세 그룹의 환자에서 비용 효용성이 평가되었다. 먼저, 누칼라를 투여할 수 있는 환자군( 경구 코르티코스테로이드를 복용 중이거나 악화가 4회 이상 발생하고 호산구 수가 마이크로리 터당 300개 이상인 사람)에게 파센라와 누칼라의 PAS를 반영해서 구한 ICER는 £20,000/
QALY 미만이었고 두 선택지 모두 비용 효용성이라고 판단하여 둘 중 더 저렴한 약제를 사용하
라고 권고했다. 싱케어를 투여할 수 있는 환자군(호산구 수가 마이크로리터당 400개 이상이며 악화가 최소 3회 발생한 사람)에게도 파센라의 투여 방법과 투여 간격의 이점을 고려했을때 마 찬가지로 파센라의 비용 효용성을 인정했다. 하지만, 표준치료가 유일한 환자군(호산구 수가 마
이크로리터당 300~399개이고 정확히 3번 악화되었으며 경구 코르티코스테로이드를 복용하지
않는 사람)에게는 ICER가 최대 £45,406/QALY이므로 비용 효용성이 없다고 평가되었다. 따
라서 현재 누칼라 또는 싱케어가 권장되는 집단에서 파센라가 비용 효율적이라는 결론을 내린 후 파센라의 급여를 인정하였다.
GSK는 누칼라의 비용 효용성 입증을 위해서 관리 및 모니터링 비용과 경구 코르티코이드 사 용이 있다는 가정하에 누칼라, 싱케어, 파센라의 1년 소요 비용을 비교했다. 동등한 효과를 가
정했을때 누칼라는 호산구 수가 마이크로리터당 400개 이상이고 연간 최소 3회의 중증 악화가
있는 사람에게 사용했을 경우에 싱케어, 파센라에 비해 더 증가된 비용 절감 효과를 보였다. 이
러한 비용 비교에 근거해서 누칼라는 PAS의 단순할인 유형을 통해 할인된 가격으로 등재 목록
에 올랐다.
- 허가
대한천식알레르기학회. (2022). 2022 천식치료지침. 대한천식알레르기학회.
윤누리. (2022.6. 17.). 천식 치료의 최신지견. 약학정보원.
- 임상
[누칼라]
Pavord, I. D., Korn, S., Howarth, P., Bleecker, E. R., Buhl, R., Keene, O. N., Ortega, H., & Chanez, P. (2012). Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet (London, England), 380(9842), 651–659. https://doi.org/10.1016/ S0140-6736(12)60988-X
[싱케어]
Lim, H. F., & Nair, P. (2015). Efficacy and safety of reslizumab in patients with moderate to severe eosinophilic asthma. Expert review of respiratory medicine, 9(2), 135-142. Corren, J., Weinstein, S., Janka, L., Zangrilli, J., & Garin, M. (2016). Phase 3 study of reslizumab in patients with poorly controlled asthma: effects across a broad range of eosinophil counts. Chest, 150(4), 799-810.
Bernstein, J. A., Virchow, J. C., Murphy, K., Maspero, J. F., Jacobs, J., Adir, Y., Humbert, M., Castro, M., Marsteller, D. A., McElhattan, J., Hickey, L., Garin, M., Vanlandingham, R., & Brusselle, G. (2020). Effect of fixed-dose subcutaneous reslizumab on asthma exacerbations in patients with severe uncontrolled asthma and corticosteroid sparing in patients with oral corticosteroid-dependent asthma: results from two phase 3, randomised, double-blind, placebo-controlled trials. The Lancet. Respiratory medicine, 8(5), 461–474. https://doi.org/10.1016/S2213-2600(19)30372-8 Effect of fixed-dose subcutaneous reslizumab on asthma exacerbations in patients with severe uncontrolled asthma and corticosteroid sparing in patients with oral corticosteroid-dependent asthma: results from two phase 3, randomised, double-blind, placebo-controlled trials Bernstein, Jonathan A et al.
The Lancet Respiratory Medicine, Volume 8, Issue 5, 461 - 474 clinicaltrials.(2021.11.09).A Study to Evaluate the Efficacy and Safety of Reslizumab (3.0 mg/kg) in the Reduction of Clinical Asthma Exacerbations in Patients (12-75 Years of Age) With Eosinophilic Asthma.Retrieved from https://clinicaltrials.gov/study/NCT01287039 FDA. Drug databases. Drugs@FDA.Retrieved from https://www.accessdata.fda.gov/drugsatfda_ docs/label/2016/761033lbl.pdf
Bjermer, L., Lemiere, C., Maspero, J., Weiss, S., Zangrilli, J., & Germinaro, M. (2016). Reslizumab for Inadequately Controlled Asthma With Elevated Blood Eosinophil Levels: A Randomized Phase 3 Study. Chest, 150(4), 789–798. https://doi.org/10.1016/j.chest.2016.03.032
Castro, M., Zangrilli, J., Wechsler, M. E., Bateman, E. D., Brusselle, G. G., Bardin, P., Murphy, K., Maspero, J. F., O’Brien, C., & Korn, S. (2015). Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3trials. The Lancet. Respiratory medicine, 3(5), 355–366. https://doi.org/10.1016/S2213-2600(15)00042-9 clinicaltrials.(2021.11.09).A Study to Evaluate the Efficacy and Safety of Reslizumab in Patients With Eosinophilic Asthma.Retrieved from https://clinicaltrials.gov/study/NCT01285323
[파센라]
FitzGerald, J. M., Bleecker, E. R., Nair, P., Korn, S., Ohta, K., Lommatzsch, M., ... & Goldman, M(2016). Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. The Lancet, 388(10056), 2128-2141.
Bleecker, E. R., FitzGerald, J. M., Chanez, P., Papi, A., Weinstein, S. F., Barker, P., ... & Goldman, M. (2016). Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with highdosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. The Lancet, 388(10056), 2115-2127.
- 급여
박서영. (2023.07.07). 중증천식 치료제 싱케어, 급여 적정성 인정. 메디칼타임즈. Retrieved from http:// www.monews.co.kr/news/articleView.html?idxno=324554
건강보험심사평가원. (2023). 약제 요양급여의 적정성 평가 결과 reslizumab 100mg/10ml(싱케어주(레슬리 주맙), 한독테바(주)).
박찬영. (2023.08.25). 한독테바 천식치료제 ‘싱케어주’ 약가협상 돌입. 메디소비자뉴스. Retrieved from https://www.medisobizanews.com/news/articleView.html?idxno=109721 건강보험심사평가원. (2024.07.01). 보험인정기준. 고시. mepolizumab 주사제(품명: 누칼라주). Retrieved from https://www.hira.or.kr/rc/insu/insuadtcrtr/InsuAdtCrtrList.do?pgmid=HIRAA030069000400
건강보험심사평가원. (2024.07.01). 보험인정기준. 고시. Reslizumab 주사제(품명: 싱케어주). Retrieved from https://www.hira.or.kr/rc/insu/insuadtcrtr/InsuAdtCrtrList.do?pgmid=HIRAA030069000400
건강보험심사평가원. (2024.07.01). 보험인정기준. 고시. Benralizumab주사제(품명: 파센라프리필드시 린지주30밀리그램). Retrieved from https://www.hira.or.kr/rc/insu/insuadtcrtr/InsuAdtCrtrList. do?pgmid=HIRAA030069000400
건강보험심사평가원. (2023). 약제 요양급여의 적정성 평가결과: 누칼라주(메폴리주맙, 유전자재조합). 건강보 험심사평가원. Retrieved from https://www.hira.or.kr/bbsDummy.do?pgmid=HIRAA030014040000 건강보험심사평가원. (2023). 약제 요양급여의 적정성 평가결과: 싱케어주(레슬리주맙). 건강보험심사평가원. Retrieved from https://www.hira.or.kr/bbsDummy.do?pgmid=HIRAA030014040000
건강보험심사평가원. (2024). 약제 요양급여의 적정성 평가결과: 파센라프리필드시린지30밀리 그램(벤라리주맙). 건강보험심사평가원. Retrieved from https://www.hira.or.kr/bbsDummy. do?pgmid=HIRAA030014040000
National Institute for Health and Care Excellence (NICE). (2021). Committee papers: Fasenra for treating severe eosinophilic asthma. NICE. Retrieved from https://www.nice.org.uk/guidance/ ta671/documents/committee-papers
이종혁, 방준석. (2018). An overview of the risk-sharing management in Korean National Health Insurance, focused on the effect of the patient access and insurance finance. Korean Journal of Clinical Pharmacy, 28(2), 124-130. https://doi.org/10.24304/kjcp.2018.28.2.124
이탁순. (2024.07.01). 중증 천식신약 3종, 어떻게 1년만에 등재 성공했나. Retrieved from https://www. dailypharm.com/Users/News/NewsView.html?ID=313136&REFERER=NP
박소윤 tediee0123@gmail.com
itcsrh1310@gmail.com
듀피젠트(Dupixent, Dupilumab)는 아토피 피부염, 천식, 비용종을 동반한 만성 비부비동염, 결절성 가려움 발진 등 여러 적응증을 동시에 가진 약제임이 특징이다. 천식에서의 듀피젠트는 중증 천식 환자의 추가 유지 치료제로 허가된 항체 의약품으로, 2형 염증을 동반한 중증 천식 환
자의 추가 유지 치료에 사용된다. 듀피젠트는 한국에서 성인(만 18세 이상) 및 청소년(만 12세~
만 17세)을 대상으로 기존 치료에 적절하게 조절되지 않는 중증 천식이나, 다음 중 하나에 해당 하는 제2형 염증성 천식의 추가 유지 치료로 허가되었다. 그러나 급성 기관지 경련 또는 상태의 완화를 목적으로는 사용되지 않는다.
1) 중증 호산구성 천식(혈중 호산구 ≥150/㎕ 또는 호기 산화질소(FeNO) ≥25ppb)
2) 경구 코르티코스테로이드 의존성의 중증 천식
듀피젠트 역시 주사제로, 프리필드주와 프리필드펜의 두 가지 제형이 있다. 천식의 경우 프리필
드주와 프리필드펜 모두 성인(만 18세 이상) 및 청소년(만 12~17세)에게 투여 가능하다. 2024
년 FDA 가이드라인에 따르면 프리필드펜은 만 2세 이상의 성인 및 소아 환자에게, 프리필드시
린지는 생후 6개월 된 소아와 성인 환자에게 투약할 수 있다고 정의되어 있다.
타임라인
국내 허가 현황
듀피젠트 프리필드주와 프리필드펜의 두 제형의 허가 절차는 독립적으로 이루어졌다. 듀피젠 트 프리필드주 (200mg, 300mg)는 2018년 3월 30일 한국에서 아토피피부염 치료제로 최초 허가를 받았다. 그리고 2년이 지난 2020년 4월 1일, 한국에서 듀피젠트 프리필드주(200mg, 300mg)의 적응증이 천식으로 확대되며 허가되었다. 듀피젠트 프리필드펜의 경우, 2년 후인 2022년 5월 19일에 300mg과 200mg이 동시 허가 되었다.
[ 표 34 ] 듀피젠트 국내 적응증과 허가 타임라인 적응증 허가 타임라인
기존 치료에 적절하게 조절되지 않는 중증 천식으
로 다음 중 하나에 해당하는 제2형 염증성 천식의
추가 유지 치료
1) 중증 호산구성 천식(혈중 호산구 ≥150/㎕ 또
는 호기 산화질소(FeNO) ≥25ppb)
한국
2) 경구 코르티코스테로이드(OCS) 의존성의 중 증 천식
사용 제한 사항 : 급성 기관지 경련 또는 상태 완
화를 위한 것이 아님
국외 허가현황
성인(18세-)
청소년(12-17세)
2018.03.30
듀피젠트 프리필드주
아토피피부염 허가
2020.04.01
듀피젠트 프리필드주 천식 허가
2020.05.19
듀피젠트 프리필드펜 (200mg, 300mg)
허가
미국(FDA)의 최초 허가일 2017년 3월 28일, 천식으로 적응증이 확장되며 추가된 변경허가일 이 2018년 10월 19일이었다. 유럽 (EMA)의 최초 허가일은 그보다 조금 늦은 2017년 9월 26 일, 변경허가일이 2019년 1월 3일임을 알 수 있다. EMA의 허가사항은 FDA와 같다.
[ 표 35 ] 듀피젠트 FDA 적응증과 허가 타임라인
적응증 허가 타임라인
2017. 03. 28
듀피젠트 프리필드주 300mg 허가 (성인 아토피)
2018.10.19
FDA
기존 치료에 적절하게 조절되지 않는 중증 천식으 로 다음 중 하나에 해당하는 제2형 염증성 천식의
추가 유지 치료
1)중증 호산구성 천식(혈중 호산구 ≥150/㎕ 또는 호기 산화질소(FeNO) ≥2 ppb)
2)OCS 의존성의 중증 천식
사용 제한 사항 : 급성 기관지 경련 또는 상태 완 화를 위한 것이 아님
성인(18세-) 청소년(12-17세)
소아 (6세-11세)
듀피젠트 프리필드주 200mg, 300mg 허가 (12세 이상 중증 천식)
2020.06.18
듀피젠트 프리필드펜 300mg 허가 (12세 이상 중증 천식)
2021.06.14
듀피젠트 프리필드펜 200mg 허가 (12세 이상 중증천식)
2021.10.20
듀피젠트 프리필드펜/주 (6-11세의 중증 천식 환자)
국내
청소년 및 성인
듀피젠트는 복부나 허벅지, 팔뚝의 피하지방에 주사하는 피하주사의 방식으로 투여되며, 투여
용량은 환자의 연령대나 몸무게에 따라 달라진다.
[표 37] 듀피젠트 용법 용량 (청소년 및 성인, 국내)
몸무게 초회용량 유지용량
15kg 이상 30kg 미만
30kg 이상 60kg 미만
600mg (300mg 2회 투여) 300mg (4주 간격)
400mg (200mg 2회 투여) 200mg (2주 간격)
60kg 이상 600mg (300mg 2회 투여) 300mg (2주 간격)
성인 환자(만 18세 이상)와 청소년(만 12-만 17세)의 경우, 처음 투여 시의 초회용량으로
400mg (200mg을 다른 투여부위로 연속 2회 투여)을 투여 후 유지 용량으로 200mg을 2주
간격으로 피하 투여하는 방법과 처음 투여 시의 초회 용량으로 600mg (300mg을 다른 투여 부 위로 연속 2회 투여)을 투여 후, 유지용량인 300mg을 2주 간격으로 피하 투여하는 방법이 있
다. 특히 천식 환자가 경구 코르티코스테로이드 의존성이 있거나 중증도에서 중증 아토피 피부
염을 동반하고 있는 경우, 초회 용량으로 600mg, 유지 용량으로 300mg을 2주 간격으로 피 하 투여해야 한다.
국외
청소년및성인
[표 38] 듀피젠트 용법 용량 (청소년 및 성인, 국 외 )
몸무게
초회용량 유지용량
15kg 이상 30kg 미만 600mg (300mg 2회 투여) 300mg (4주 간격)
30kg 이상 60kg 미만
60kg 이상
400mg (200mg 2회 투여)
600mg (300mg 2회 투여)
소아 한국 에서 듀피젠트는 천식과 관련하여
200mg (2주 간격)
300mg (2주 간격)
한국에서도 적응증 확대를 위해 제약사 측에서 허가 변경을 신청할 가능성이 높은 것으로 보인 다. 소아 환자에 대한 듀피젠트의 용법 및 용량은 다음과 같다. 성인, 청소년과는 다르게 초회 용
량과 유지용량의 구분이 없다는 특징이 있다.
미국
[표 39] 듀피젠트 용법 및 용량 (소아, 미국)
몸무게 용량
15kg 이상 30kg 미만 4주 간격 300mg 30kg 이상 1주 간격 200mg
유럽
[표 40] 듀피젠트 용법 및 용량 (소아, 유럽)
몸무게 초회용량 유지용량
15kg 이상 30kg 미만 4주 간격 300mg
30kg 이상 60kg 미만 1주 간격 200mg 4주 간격 300mg
60kg 이상 1주 간격 200mg
안전성 및 주의사항
[안전성]
듀피젠트의 경우, 가장 흔한 이상 반응은 주사 부위 반응, 구인두염, 호산구 증가증이 있다. 이 세 가지 반응 모두 듀피젠트의 안전성 시험 도중 단독 투여군에서 1% 이상의 발현 빈도를 보이 며 위약군보다 높은 비율로 발생하였다. 주사 부위의 반응은 홍반, 부종, 가려움증, 통증 및 염증 을 모두 포함하였고, 초회 주사 시 흔하게 보고되는 반응이다. 호산구 증가증의 경우 심각한 호 산구 수치의 기준에 해당하는 환자는
2020년 유럽 호흡기학회 연례학술대회(ERS)의 라이브 세션에서 발표된 바에 따르면, 듀피젠 트는 12세 이상의 청소년 및 성인 중증 천식 환자를 대상으로 한 3년의 장기 임상 데이터를 확보 했다. 이 장기 임상시험에는 LIBERTY에 참여한 2,200명 이상의 환자가 참여했으며, 장기 관찰 데이터 역시 이전 임상에서의 이상 반응 발생빈도와 유사했다. 가장 흔한 이상 반응 역시 비인두 염과 주사 부위 반응 (각각 18-26%와 2-23%)으로 이전에 알려진 바와 같았다.
2024년 8월, 사노피는 국내 중증 천식 환자를 대상으로 진행된 듀피젠트의 TRAVERSE(3상) 연구의 한국인 하위 분석 결과를 공개했다. 하위 분석은 연구에 참여한 2,282명의 환자 중 74
명의 국내 환자를 대상으로 진행되었으며, 최대 96주간의 장기 임상 데이터를 얻을 수 있었다.
데이터 중 안전성 측면에서는 기존의 임상과 일관된 결과를 유지하였으며, 가장 흔한 이상 반응
역시 이전과 같았다(상부 호흡기 감염, 비인두염, 주사 부위 통증).
[주의 사항]
1. 과민반응
임상시험에서 듀피젠트를 투여받은 환자의 1% 미만에서 혈관 부종, 전신성 두드러기, 발진, 결 절성 홍반, 혈청병 등의 과민반응이 관찰되었다. 임상적으로 유의한 과민반응이 발생한 경우, 즉 시 투여를 중단하고 적절한 치료를 시작해야 한다.
2. 결막염 및 각막염
주로 아토피 피부염 환자에게서 관찰되는 이상 사례이다.
3. 호산구성 상태
천식 환자들에게서 호산구성 폐렴이나 호산구성 육아종증 다발혈관염의 특징을 보이는 전신성 호산구증이 관찰되었다. 이 증상은 OCS 감량과 관련이 있으며, 전신성 코르티코스테로이드 치 료를 해야 한다. 그러나 이 약과 혈관염 간의 인과는 확립되지 않았다.
4. 급성 천식 또는 질병 악화 급성 천식이나 급성 악화에 투여하면 안 되며, 급성 기관지 경련이나 천식 발작 환자에게도 투 여를 금한다. 듀피젠트 투여 이후 천식이 조절되지 않거나 천식 악화가 관찰되면, 전문가의 자 문을 구한다.
5. 코르티코스테로이드 용량의 감량
듀피젠트의 치료 시작과 함께 전신, 국소, 흡입 코르티코스테로이드의 투여를 중단해서는 안 된
다. 코르티코스테로이드의 감량은 의사의 감독하에 이루어져야 하며, 감량에 따라 전신성 금단
증상이나 전신성 코르티코스테로이드 치료에 의해 억제되었던 증상이 출현할 수 있다.
6. 천식이 동반된 환자 천식이 동반된 아토피피부염 환자나 비용종을 동반한 만성 비부비동염 환자는 임의로 천식 치 료를 중단하지 않는다.
7. 기생충 감염 기생충에 감염된 환자는 임상시험 대상에서 제외되었다. 기생충 감염의 면역반응과 듀피젠트와
의 영향은 밝혀진 바 없다. 이 약의 투여 전 기생충에 감염된 환자는 우선적으로 치료하고, 약의
투여 기간 중에 기생충에 감염되었을 경우, 치료될 때까지 약의 투여를 중단한다.
이 외에도 듀피젠트를 사용하면 안되는 경우는 아래와 같다 :
생백신을 투여할 예정인 경우
임신 중 (태아에 미치는 영향이 알려지지 않음)
모유 수유 중 (모유에 미치는 영향이 알려지지 않음)
듀피젠트(Dupixent, dupilumab)의 임상 시험은 모두 중등증, 중증 만성 천식 환자를 대
상으로 이루어졌다. GINA 지침에 따라 중증 악화의 비율, 응급실 입원 치료 및 응급 치료 이
력, 혈중 호산구 수에 따라 중등증, 중증 천식으로 확진되었으며 중증 천식 환자를 대상으로 한
DRI12544(임상 2상), QUEST(임상 3상), VENTURE(임상 3상)를 통해 듀피젠트의 천식
료제로서의 유효성 및 안전성을 평가해 FDA 허가를 받았다.
DRI12544(임상 2상)는 듀피젠트의 최적 투여 기간
시험, QUEST(임상 3상)는 듀피젠트
의 안전성 및 유효성을 평가하고 듀피젠트 투여 환자군을 설정하는 데 기여한 시험, VENTURE( 임상 3상)는 경구 스테로이드를 복용 중인
환자에게서 듀피젠트의 효능을 검증하는 시험이었다. 그리고 DRI12544(임상 2상), QUEST(임상 3상), VENTURE(임상 3상)에 참여 한 환자들을 대상으로 장기 임상시험인 TRAVERESE를 진행해 듀피젠트의 장기 안전성 및 유 효성을 평가했다.
듀피젠트는 만 18세 이상의 성인 중증 천식 환자를 대상으로 한 표준 치료(SOC) 병용 임상 시 험인 DRI12544(임상 2b상), 만 12세 이상의 청소년 및 성인을 대상으로 한 표준 치료(SOC)
병용 임상 시험인 QUEST(임상 3상)를 통해 듀피젠트의 최적 용량 및 투여 기간을 설정하였다.
그리고 기존에 경구 스테로이드를 복용 중인 중증 천식 환자에게서의 듀피젠트의 효능을 검증하 는 VENTURE(임상 3상) 시험을 진행하였다. 총 3개의 임상 시험을 통해 지난해 악화 병력이
있고, 혈중 EOS ≥ 150 cells/μl 또는 FeNO ≥ 25ppb에 해당하거나, 혹은 전신스테로이드
1) DRI12544(임상 2상) (NCT01854047)
DRI12544(임상 2상) (NCT01854047) : An Evaluation of Dupilumab in Patients With Moderate to Severe Uncontrolled Asthma
① 연구 목적
DRI12544 임상시험은 만 18세 이상의 중등도에서 중증 천식 환자를 대상으로 한 듀피젠트 평
가를 통해 듀피젠트 의 투여 용량 범위를 설정하기 위해 진행되었다. 이 시험의 1차 목표는 조절
되지 않는 중등도에서 중증 천식을 앓고 있는 임상 시험 참여자에게서의 듀피젠트 의 효능을 평
가하는 것이고, 2차 목표는 ‘안전성 및 내약성’ 그리고 ‘ 듀피젠트 의 전신 노출로 인한 항 듀피젠
트 항체’에 주목하여 중등도에서 중증 천식 환자에서 가장 효과적인 듀피젠트 용량과 요법을 평
가하는 것이었다.
② 연구 디자인
만 18세 이상의 776명의 임상 시험 환자를 대상으로 46주(2-3주 : 스크리닝 기간 → 24주 : 무작위 치료 기간 → 16주 : 치료 후 기간) 동안 진행한 무작위, 이중 맹검, 위약 대조, 평행군 실 험이다. GINA 2009 지침에 따라 12개월 이상 동안 조절되지 않는 중등도에서 중증의 천식 진
단을 받은 사람 1들을 대상으로 임상 시험을 진행했다. 모든 환자들은 표준 치료(SOC) 2로 중간
용량 또는 고용량 ICS와 LABA를 투여받았다.
[시험 대상자]
환자는 24주 동안 2주마다 또는 4주마다 피하 듀피젠트 200mg 또는 300mg 또는 위약을 투
여받도록 무작위(1:1:1:1:1:1) 배정되었다.
[표 41] DRI12544 임상시험 대상자 정리
그룹 1 (N=150)
1일차 : 듀피젠트 600mg 피하주사
2주차-22주차 :듀피젠트 300mg +SOC q2w
그룹 2 (N=157)
1일차 : 듀피젠트 400mg 피하주사
2주차-22주차 :듀피젠트 200mg +SOC q2w
그룹 3 (N=154)
1일차 : 듀피젠트 600mg 피하주사
2주차-22주차 :듀피젠트 300mg +SOC q4w
그룹 4 (N=157)
1일차 : 듀피젠트 400mg 피하주사
2주차-22주차 :듀피젠트 200mg +SOC q4w
그룹 5 (N=158)
1일차 : 위약 피하 주사
2주차-22주차 :위약+SOC q4w
[평가 변수]
1차 평가 변수 : - 베이스라인 혈중 호산구수가 300 cells/μl 이상인 시험대상자에서 12주차 FEV1 (1초 강제
호기량)(L)의 베이스라인 대비 평균 변화
2차 평가 변수 :
- 전체 환자군에서 24주 위약 대조 치료 동안 연간 중증 천식 악화 사건 1 발생률
- 천식조절설문(ACQ5) 및 천식 환자 삶의 질 설문 표준 버전(AQLQ(S)) 점수를 보고한 시험
대상자에서 반응자 비율
③ 결과
[표 42] DRI12544 임상시험 결과정리
베이스라인 혈중 EOS≥300 cells/μl인 환자
베이스라인
(1차 평가
변수)
기관지
변화
(0.11, 0.40) p<0.001
CI)
(2차 평가
변수)
연간
(0.11, 0.76) p<0.001
(0.06, 0.36) p<0.001
1차 평가 변수인 “EOS≥300 cells/μl인 시험 대상자에서 12주차 FEV1의 베이스라인 대
비 평균 변화” 해석 결과는 다음과 같다. 이 약 200mg 또는 300mg을 2주 간격으로 투여받은
베이스라인 혈중 EOS≥300 cells/μl인 시험 대상자는 위약과 비교해 기관지 확장제 사용 전
FEV1의 유의한 증가가 관찰되었고, 천식 악화율이 유의하게 감소하였다. 그리고 추가적인 자 료 해석 결과 EOS<300 cells/μl인 시험 대상자 에서도 유사한 결과가 관찰되었다. 위약과 비 교했을 때 듀피젠트에서 가장 흔한 부작용은 상기도 감염(33-41% 대 35%)과 주사 부위 반응 (13-26% 대 13%)이었다.
④ 결과 해석
DRI12544 임상시험의 1차 평가 변수는 EOS≥300cells/μl인 환자들을 대상으로 평가하는
것이었지만, 자료 해석 결과 듀피젠트는 기준선 호산구 수에 상관없이 조절되지 않는 중등도 및 중증 천식 환자에서 폐 기능을 증가시키고 중증 악화를 감소시켰다. 또한, 4주에 한 번 투여보 다 2주에 한 번 투여하는 것이 더 효과적으로 보였으며 200mg과 300mg 용량 사이에 큰 차이 가 있지는 않았다. 그리고 위약 대비 부작용에 대해서 안전한 경향을 보였다. 따라서 듀피젠트는
ICS와 LABA 요법으로 구성된 표준 요법 단독 치료에 비해 조절되지 않는 중증 천식 환자의 삶
을 개선할 수 있다.
2) QUEST (임상 3상) (NCT02414854)
QUEST (임상 3상) (NCT02414854) : An Evaluation of Dupilumab in Patients With persistent asthma
① 연구 목적
QUEST
② 연구 디자인
만 12세 이상의 1902명(청소년 107명과 성인 시험대상자 1,795명)의 임상 시험 환자를 대
상으로 67-69주(3-5주 : 스크리닝 기간 → 52주 : 무작위 치료 기간 → 12주 : 치료 후 기간)
동안 진행한 무작위, 이중 맹검, 위약 대조, 평행군 실험이다. GINA 2014 지침에 따라 12개월
이상 동안 천식 진단을 받은 사람 1들을 대상으로 임상 시험을 진행했다. 모든 환자는 표준 치료
(SOC) 2로 중간 용량에서 고용량의 ICS와 1개 또는 2개의 다른 천식 조절제를 투여받았다. 베
이스라인 혈중 EOS≥1500 cells/μl인 시험 대상자는 제외되었다.
[시험 대상자]
환자는 24주 동안 2주마다 또는 4주마다 피하 듀피젠트 200mg 또는 300mg 또는 200mg
또는 300mg 위약을 투여받도록 무작위(2:2:1:1) 배정되었다.
[표 43] QUEST 임상시험 대상자 정리
그룹 1 (N=633)
1일차 : 듀피젠트 600mg 피하주사
2주차-50주차 :듀피젠트 300mg +SOC q2w
[평가 변수]
그룹 2 (N=631) 그룹 3 (N=321) 그룹 4 (N=317)
1일차 : 듀피젠트 400mg 피하주사
2주차-50주차 :듀피젠트 200mg +SOC q2w
1일차 : 위약 600mg 피하주사
2주차-50주차 :위약 300mg +SOC q2w
1일차 : 위약 400mg 피하주사
2주차-50주차 :위약200mg +SOC q2w
1차 평가 변수 : -전체 시험 대상자에서 12주차 기관지 확장제 사용 전(pre-bronchodilator) FEV1의
베이스라인 대비 평균 변화 -전체 시험
2차 평가변수 : -서로 다른 호산구 베이스라인을 가진 환자들에서 12주차 FEV1의 베이스라인 대비 평균 변화
1. 전년도에 천식 악화로 인한 입원 치료 또는 전신 OCS 치료를 경험한 경우
2. SOC : 중간용량 및 고용량 ICS+1-2개의 천식 조절제/ salbutamol/albuterol 또는 levosalbutamol/levalbuterol을 완 화 약물
-서로 다른 호산구 베이스라인을 가진 환자들에서 52주차 치료 기간 동안의 중증 천식 악화 사건 발생률
-천식 조절 설문(ACQ5) 및 천식 환자 삶의 질 설문 표준 버전(AQLQ(S)) 점수를 보고한 시험
대상자에서 반응자 비율 -FeNO≥25ppb, IgE ≥30IU/mL, EOS ≥ 300cells/μl 인 환자 들에서 52주차 치료 기간 동안의 천식 악화 사건 발생율 -FeNO≥25ppb, IgE ≥30IU/mL, EOS ≥ 300cells/μl 인 환자들에서12주차 FEV1의 베이스라인 대비 평균 변화
③ 결과
[ 1차 평가 변수]
[표 44] QUEST 임상시험 1차 평가 변수
임상시험 대상자
(1차 평가변 수)
기관지 확장 제 사용 전 FEV1 변화
(1차 평가변 수)
연간 중증
0.13 (0.08, 0.18) p<0.001 0.14 (0.08, 0.19) p<0.001
0.61)
1.16)
0.53)
1.05)
(0.43, 0.68) p<0.001
(0.41, 0.66) p<0.001
기준으로 12주차의 기관지 확장제
FEV1을 측정했을 때 듀피젠트 300mg을 q2w 복용한 집단(n=633)은 베이스라인 대비 평 균 340ml 개선이 있었고 플라시보 집단 (n=321)은 210ml의 개선이 있었다. (LSM 차이 : 130ml /95%, CL:80,180ml) 듀피젠트 200mg을 q2w 복용한 집단(n=631)은 베이스라인 대비 평균 320ml 개선이 있었고 플라시보 집단 (n=317)은 180ml의 개선이 있었다. (LSM 차 이 : 140ml /95%, CLl:80,190ml)
- 1차 평가 변수인 “전체 시험 대상자에서 52주차 치료 기간 동안의 천식 악화 사건 발생률”은
다음과 같다. 듀피젠트 300mg을 q2w 복용한 집단(n=633)은 평균 연간 0.52번의 중증 천식
악화 사건을 경험했고 이에 비해 플라시보 집단 (n=321)은 평균 연간 0.97번의 중증 천식 악화
사건을 경험했다. 듀피젠트 200mg을 q2w 복용한 집단 또한 비슷한 결과를 확인할 수 있었다. 즉, 이 약 200 mg 또는 300 mg을 2주 간격으로 투여받은 전체 시험 대상자는 위약과 비교해
기관지 확장제 사용 전 FEV1의 유의한 증가가 관찰되었고, 천식 악화율이 유의하게 감소하였다.
[ 중요 2차 평가 변수] - 서로 다른 호산구 베이스라인을 가진 환자들에서 12주차 FEV1의 베이스라인 대비 평균 변화
[그림 26,27] 서로 다른 호산구, FeNO 베이스라인을 가진 환자에서 위약대비 듀피젠트의 12
주차 FEV1의 베이스라인 대비 평균 변화
[그림 26] 듀피젠트와 위약 300mg을 q2w로 피하투여

[그림 27] dupilumab과 위약 200mg을 q2w로 피하투여

듀피젠트 300mg을 q2w 간격으로 투여한 환자에 주목했을 때 EOS<150cells/μl, 150cells/
μl ≤ EOS < 300 cells/μl인 환자군의 경우 통계상 위약 대비 듀피젠트 의 효과가 우월했다고
말할 수 없었다. 또한, FeNO < 25ppb인 환자군의 경우에도 통계상 위약 대비 듀피젠트 의 효 과가 우월했다고 말할 수 없었다.
듀피젠트 200mg을 q2w 간격으로 투여한 환자에 주목했을 때 EOS<150cells/μl인 환자군
의 경우 통계상 위약 대비 듀피젠트가 우월했다고 확실히 말할 수 없었으며 듀피젠트 300mg을
q2w 간격으로 투여한 환자와 마찬가지로 FeNO < 25ppb인 환자군의 경우 위약 대비 듀피젠 트 의 효과가 우월했다고 말할 수 없었다.
두 실험군에서 나온 결과를 종합해보면, 위약 대비 듀피젠트는 150cells/μl ≤ EOS 또는 25ppb ≤ FeNO 인 환자군에서 베이스라인 대비 12주차 FEV1 증가 효과가 있음을 알 수 있었
다. ([그림 28] 참고) 또한, 150cells/μl ≤ EOS인 환자들의 경우 EOS 수준이 높을수록 FEV1 증가율이 높아지는 것으로 나타났다. ([그림 29] 참고)
[그림 28 ] FeNO≥25ppb, EOS ≥150 cells/μl인 환자들에게서 위약 대비 dupilumab의 12주차 FEV1 베이스라인 대비 평균 변화

[그림 29 ] 150cells/μl ≤ EOS인 환자들에서 FEV1 증가 정도 -서로 다른 호산구 베이스라인을 가진 환자들에서 52주차

발생률
[그림 30] 베이스라인 혈중 호산구수(cells/μl)에 따른 연간 중증 악화 사건 발생률의 상대 위 험도

듀피젠트
150cells/μl ≤ EOS 이면서 25ppb ≤ FeNO 인 환자군에서 듀피젠트와 위약의 중증 악화 사건 발생률의 차이를 비교해 보니, 악화 사건 감소에 있어서 듀피젠트가 위약 대비 효과가 탁월
함을 확인할 수 있었다. ([그림 31] 참고) 또한, 듀피젠트를 투여한 150cells/μl ≤ EOS인 환
자들의 경우 EOS 수준이 높을수록 중증 천식 악화율이 감소하는 것으로 나타났다. ([그림 32] 참고)
[그림 31 ] FeNO≥25ppb, EOS ≥ 150 cells/μl인 환자들에게서 위약대비 dupilumab의
중증 천식 악화율

[ 그림 32 ] 1 50cells/μl ≤ EOS인 환자들에서 중증 천식 악화율 감소 정도

④ 결과 해석
QUEST 는 조절되지 않는 2형 염증성 중증 천식 환자에서 듀피젠트의 유효성을 판단한 최초
의 임상 3상 시험이었고, 위약 대비로 설계된 시험이었다. 조절되지 않는 중증 천식 환자들의
경우 심각한 중증 천식 악화, 폐기능의 급속한 저하 그리고 삶의 질 저하 등의 고통을 받으며 살 아가는데 기존 치료제로는 이러한
FeNO 수치, EOS 수치
트는 FeNO≥25ppb, EOS ≥ 150 cells/μl 인
어 듀피젠트 투여
3) VENTURE (임상 3상) (NCT02528214)
VENTURE (임상 3상) (NCT02528214)) Evaluation of Dupilumab in Patients With Severe Steroid Dependent Asthma
① 연구 목적
VENTURE 연구에서는 ICS(흡입 스테로이드)와 추가 조절제의 주기적인 사용 외에도 매일
OCS(경구 스테로이드) 투여가 필요한 만 12세 이상 중증 천식 시험 대상자에서 듀피젠트의 효 능을 검증하였다. 이때 듀피젠트 투여 시 OCS 감량이 가능할 경우 효능이 있다고 판단하였다. OCS 감량을 중증 천식 임상
② 연구 디자인
만 12세 이상의 210명의 임상 시험 환자를 대상으로 46주(3-8주:스크리닝 기간 → 24주 : 무
작위 치료 기간 → 12주 : 치료 후 기간)동안 진행한 무작위, 이중맹검, 위약 대조, 평행군 시험
이다. 표준 치료(SOC) 1로 고용량 ICS와 1-2개의 추가 조절제를 사용하고 있음에도 불구하고 추가로 매일 OCS를 필요로 하는 중증 천식 환자를 대상으로 임상 시험을 진행했다. 임상 시험
자를 모집할 때 제 2형 염증성 천식의 바이오마커인 FeNO, IgE 수치에 따라 제한을 두지 않았
지만 EOS >1500 cells/μL 인 환자들은 제외되었다.
[시험 대상자]
시험 대상자는 스크리닝 기간 동안 OCS용량을 최적화하고, 24주 동안 초회 용량 dupilumab 600mg 또는 위약 600mg을 투여받은 뒤 2주마다 두필루맙 300mg 또는 위약 300mg을 투
여받도록 무작위(1:1) 배정되었다. 시험 대상자는 시험 기간동안 기존 천식 치료제를 투여받음 과 동시에 천식 조절이 유지되는 경우 4-20주차 동안 OCS 용량을 4주마다 감소시켰다.
[표 45] VENTURE 임상시험 대상자 정리
그룹 1 (N=103) 그룹 2 (N=107)
1일차 : 듀피젠트 600mg 피하주사
2주차-24주차 :듀피젠트 300mg +SOC+OCS q2w
[ 평가변수]
1일차 : 위약 600mg 피하주사
2주차-24주차 :위약 200mg +SOC +OCS q2w
1차 평가 변수 : - 전체 시험 대상자에서 천식 조절이 유지되는 동안 베이스라인 용량 대비 24주차에서 OCS 용량의 감소 백분율
2차 평가변수 : - 베이스라인
1. SOC : 고용량 ICS+1-2개의 천식 조절제+OCS(prednisone or prednisolone)/ salbutamol/albuterol 또는 levosalbutamol/levalbuterol을 완화 약물
③ 결과
[1차 평가변수]
[그림 33] 듀피젠트와 위약 섭취 환자에서 시간에 따른 OCS 감량 비율(OCS 감량값 : 전체 시
험대상자의 LSM 1 이용)
[그림 34] EOS 수치에 따른 OCS 감량에서의 위약대비 듀피젠트 의 효과

1. *lsm : least square mean
[그림 33]을 참고하면 1차 평가 변수인 천식 조절이 유지되는 동안 베이스라인 대비 24주차
최종 OCS 용량의 감소 백분율은 다음과 같다. 듀피젠트를 투여받은 시험 대상자는 베이스라인 대비 70%(중앙값 100%)감소를 경험했고 (95% CL: 0.60, 0.80), 위약을 투여받은 시험대상
자는 베이스라인 대비 42%(중앙값 50%) 감소를 경험했다. (95% CL: 0.33, 0.51)
다른 평가변수인 OCS 용량의 50% 이상 감소는 듀피젠트의 경우 82명(80%), 위약의 경우
57명(53%)에서 관찰되었다.
[그림 34]를 참고하면, 결론적으로 OCS 감량에 대해서 듀피젠트는 특히 EOS ≥150cells/μl
인 시험 대상자에서 위약 대비 효과가 있음을 확인할 수 있었다.
[중요 2차 평가 변수]
베이스라인 대비 24주차 기관지 확장제 사용 전 FEV1의 경우 듀피젠트 환자군은 230ml 증가, 위약군은 10ml 증가로 듀피젠트 환자군에서 220ml의 개선을 보였다. (95% CL: 0.09~0.34 L)
중증천식 악화율은 다음과 같다. 24주 임상 시험에서 연간 중증 천식 악화율은 dupilumab을
투여받은 환자는 0.65, 위약군을 투여받은 환자는 1.60이었으며, 듀피젠트는 위약 대비 59%
의 중증 악화 감소율을 보였다.
[부작용]
주사부위 반응은 듀피젠트가 위약보다 조금 더 많이 발생했으며( 9% 대 4%) 일시적인 혈액 호
산구증 또한 위약보다 듀피젠트에서 더 많이 관찰되었다. (14% 대 1%)
④ 결과 해석
OCS 의존적 중증 천식 환자에서 듀피젠트는 OCS 사용량을 위약 대비 현저하게 감소시켰고 특히 150cells/μl ≤ EOS환자에서 듀피젠트의 효과가 두드러졌다. 또한, 듀피젠트는 OCS 없 이 추후 중증 천식 악화율 감소와 폐기능 개선을 할 수 있는 가능성을 높임을 증명했다. 듀피젠 트 투여시 일시적인 혈액 호산구증이 발생한 것을 확인할 수 있었는데, 이는 7명 중 1명꼴로 발 생했다.
TRAVERSE (NCT02134028) (임상 3상) Open-label Extension Study to Evaluate the Long-term Safety and Tolerability of Dupilumab in Patients With Asthma Who Participated in a Previous Dupilumab Asthma Clinical Study
① 연구 목적
TRAVERSE 연구는 듀피젠트에 대한 이전 임상시험에 참여했던 중등도에서 중증 천식 성인
및 청소년 환자(DRI12544(임상 2상), QUEST(임상 3상) 참여 환자), 경구 코르티코스테로이 드 의존성 천식 성인 환자 (VENTURE(임상 3상) 참여 환자)를 대상으로 듀피젠트의 장기 유효
성을 평가하는 임상시험이었다. 특히 듀피젠트의 전신 노출, 그로 인한 항 듀피젠트 항체, 제 2 형 염증성 천식 바이오마커를 중심으로 듀피젠트의 장기 유효성을 평가하는 데 초점을 두었다.
② 연구 디자인
DRI12544, QUEST, VENTURE에 참여했던 만 12세 이상의 2282명의 임상 시험 환자를 대상으로 최대 96주 동안 1 진행한 무작위, open label trial 2, 위약 대조, 평행군 임상시험이다.
참가자들은 기존 임상 시험에 참가했을 때 유지했던 중간용량 혹은 고용량 ICS, 이차 조절제인
OCS (VENTURE 임상 시험에 참여했던 경우), 3차 조절제(LABA, LTRA, methylxanthine)
에 대한 정보를 가지고 있었고 이를 표준 치료(SOC)로 하여 듀피젠트와 함께 복용했다. 듀피젠 트 외 다른 치료를 경험했거나 필요로 하는 환자들은 제외되었다.
[시험 대상자]
48주 동안 듀피젠트 + SOC 300mg q2w (n=2282), 그 중 일부는 96주 동안 듀피젠트 + SOC 300mg q2w (n=1906) 임상시험에 참여하였다.
[평가 변수]
1차 평가 변수 : - 96주차까지 TEAE(treatment emergent adverse event) 3를 경험한 환자의 비율
1. amendment 04(치료 기간을 줄이기 위해 발행된 개정안) 승인 전 환자들은 96주 동안, 승인 후 환자들은 48주 동안 참여
2. open-label trial : 임상시험 대상자와 조사자 모두 시험대상자에게 배정된 약물을 아는 임상시험. open-label trial은 서로 다른
주요 2차 평가 변수 :
-연간 FEV1 및 중증 악화율
-50% 이상 OCS 감량을 경험했거나 OCS를 완전히 중단한 환자의 비율
③ 결과
[주요 평가 변수]
-기관지 확장제 사용 전(pre-bronchodilator) FEV1의 베이스라인 대비 평균 변화 및 폐기
능 개선
이전 QUEST 임상시험에서 듀피젠트를 투여받고 베이스라인 FEV1 수치가 1.78L였던 임상
시험 대상자는 (n=447) TRAVERSE 임상시험 96주차에서 310mL의 FEV1 개선을 경험했다.
이전 QUEST에서 위약을 투여받고 베이스라인 FEV1 수치가 1.75L였던 임상시험 대상자는 (n=219)은 TRAVERSE 임상시험 96주차에서 330mL FEV1 개선을 경험했다.
이전 QUEST 임상시험에서 듀피젠트를 투여받고 EOS ≥300 cells/μL, 베이스라인 FEV1 수치가 1.84L였던 임상시험 대상자는 (n=92) TRAVERSE 임상시험 96주차에서 450mL의
FEV1 개선을 경험했으며 QUEST에서 위약을 투여받고 EOS ≥300 cells/μL, 베이스라인 FEV1 수치가 1.89L 였던 임상시험 대상자는(n=50) 440mL의 FEV1 개선을 경험했다.
-중증 천식 악화율
DRI12544와 QUEST에서 듀피젠트 300 mg Q2W + SOC를 투여받은 임상시험 대상자들 (n=2062) 중 97%는 3년동안의 TRAVERSE 임상시험 기간 동안 중증 천식 악화로 인한 입원 또는 응급실 방문을 하지 않았고 74%는 3년동안 0회의 천식 악화를 경험했다. DRI12544에 참 여한 환자들 (n=396) 중 79.5%는 48-96주의 TRAVERSE 시험 기간 동안 0회의 중증 악화를 경험했다. QUEST 시험에서 52주 동안 듀피젠트 200 mg/300 mg Q2W + SOC (n=816) 를 투여받고 TRAVERSE에서 96주 동안 듀피젠트 300 mg Q2W + SOC를 투여받은 환자들 의 89%는 3년 동안 0회의 중증 천식 악화를 경험했고 QUEST 시험 참여 환자중 EOS ≥300 cells/μL이면서 듀피젠트를 투여받은 group(n=215) 중 70%는 3년동안의 TRAVERSE 시험 기간 동안 0회의 중증 악화를 경험했다. - OCS 감량 VENTURE에 참여한 임상시험 환자들 중 79%가 OCS 복용을 중단했고 89%는 96주차에 OCS 감량을 성공했다.
④ 결과 해석
148주까지의 open label extension 진행 결과, DRI12544, QUEST, VENTURE 임상시 험에서 듀피젠트를 복용하고 이후 TRAVERSE 시험에서 3년 동안 듀피젠트에 노출된 환자들
은 폐기능 개선, 중증 악화율 감소, 천식 조절, 천식 설문지 응답 비율에 있어서 그 효과가 지속 됨을 경험했다. 기존 시험들에서 위약을 투여받고 이후 TRAVERSE에서 3년동안 듀피젠트에
노출된 중증 천식 환자들 또한 폐기능 개선, 중증 악화율 감소, 천식 조절, 천식 설문지 응답 비
율에 대해 비슷한 결과를 경험했다. 듀피젠트의 유효성은 3년동안 조절되지 않는 제 2형 염증성 중증 천식 환자에게서 지속되었고 안전성 역시 증명되었다. 즉, 듀피젠트는 만 12세 이상의 청 소년 및 성인 중증 천식
만, 국내의 경우
못했다. 소아를 대상으 로 하는 중증 천식 적응증
임상시험인 EXCURSION이 있다. 이를 기반으로 FDA와 EMA는 소아 중증 천식 환자에게서 도 듀피젠트를 허가했고, 효과가
루어질 가능성이 높다.
1) VOYAGE (NCT02948959) (임상 3상)
VOYAGE (NCT02948959) (임상 3상) (Dupilumab in Children with Uncontrolled Moderate-to-Severe Asthma)
② 연구 디자인
만 6세-11세 중등도 및 중증 천식 환자 408명을 대상으로 52주 (스크리닝 기간 3-5주 → 임상시험 기간 52주 → 치료 후 기간 12주) 동안 진행한 무작위, 이중맹검, 위약 대조, 평행 군 임 상 3상 시험이다. GINA 지침에 따라 12개월 이상 천식을 진단 받은 소아 환자를 대상 으로 임상시험을 진행했다. 모든 환자들은 표준 치료(SOC)로 중간용량의 ICS+ 이차 조절제
(LABA,LAMA,LTRA) 혹은 고용량의 ICS 혹은 고용량의 ICS+ 이차 조절제를 투여받았다.
16kg 미만 환자, 폐기능을 손상시킬 수 있는 만성 폐질환 환자, 극심한 천식 악화 경험이 있는 환자는 제외되었다.
[시험 대상자] 환자는 52주 동안 2주마다 피하 듀피젠트 또는 위약을 투여받도록 무작위(2:1) 배정되었다.
30kg 초과의 소아 환자들은 200mg의 듀피젠트 혹은 위약을 q2w로 피하 투여, 30kg 이하의
소아 환자들은 100mg의 듀피젠트 혹은 위약을 q2w로 피하 투여 혹은 300mg의 약을 q4w 로 피하 투여받았다.
[표 46] VOYAGE 임상시험 대상자 정리
그룹 1 (N=273)
2주차-52주차 :듀피젠트 200mg +SOC q2w (30kg 초과) or
듀피젠트 100mg +SOC q2w (30kg 이하)
[ 평가 변수]
그룹 2 (N=135)
2주차-52주차 :위약 200mg +SOC q2w (30kg 초과) or 위약 100mg +SOC q2w (30kg 이하)
1차 평가 변수 : - 전체 시험 대상자에서 52주차
2차 평가 변수 : - 전체 시험 대상자에서
- 24주차 천식 조절 설문(ACQ-7-IA) 1 점수 1. ACQ-7-IA : Asthma Control Questionnaire 7 Interviewer-Administered
③ 결과
[주요 평가변수]
[그림 35] 52주차 동안의 중증 천식 악화율, 베이스라인 대비 12주차 FEV1 변화, 베이스라인
대비 24주차 ACQ-7-1A 점수 변화에 있어서 위약대비 듀피젠트 의 효과

VOYAGE는 전체 임상시험 참여 환자군을 2형 중증 천식 환자군, EOS ≥ 300 cells/μl인 환자군, EOS ≥ 150 cells/μl인 환자군, FeNO ≥ 20 ppb인 환자군으로 나누어 시험 결과 를 분석했다. 주요 1,2차 평가 변수인 52주차 치료 기간 동안의 중증 천식 악화율, 베이스라인 대비 12주차 FEV1 변화, 베이스라인 대비 24주차 ACQ-7-1A 점수 변화에 대해 95% 신뢰 구간(p<0.001)을 이용해 통계 분석 한 결과 모든 항목과 모든 환자군에서 듀피젠트가 위약대 비 효과가 있음이 확인되었다.
④ 결과 해석
VOYAGE 진행 결과, 듀피젠트에 노출된 소아 환자들은 폐기능 개선, 중증 악화율 감소, 천식
조절에 있어서 그 효과가 위약 대비 뛰어남을 경험했다. 즉, 듀피젠트는 만 6세-11세까지의 중
등도에서 중증 천식을 앓고 있는 소아 환자에게서 유효하고 안전하다.
2) EXCURSION (NCT03560466) (임상 3상) 중증천식
EXCURSION (NCT03560466) (임상 3상) Assessment of the Safety and Efficacy of Dupilumab in Children With Asthma
① 연구 목적
VOYAGE에 참여한 만 6세-11세 조절되지 않는 중등도 중증 천식 환자들에서 듀피젠트의 안
전성 및 유효성을 평가하는 장기간 진행된 임상시험
② 연구 디자인
이전에 VOYAGE에 참여한 만 6세-11세 중등도 및 중증 천식 환자 365명(90%)을 대상으로
52주 동안 진행한 OLE 1 임상 3상 시험이다. GINA 지침에 따라 12개월 이상 천식을 진단 받
은 소아 환자를 대상으로 임상시험을 진행했다. 모든 환자들은 표준 치료(SOC)로 중간 용량의
ICS+ 이차 조절제 (LABA,LAMA,LTRA) 혹은 고용량의 ICS 혹은 고용량의 ICS+ 이차 조절제 를 투여받았다. 16kg 미만 환자, 폐기능을 손상시킬 수 있는 만성 폐질환 환자, 극심한 천식 악 화 경험이 있는 환자는 제외되었다.
[시험 대상자]
EXCURSION에 참여한 모든 환자는 52주 동안 2주마다 피하 듀피젠트를 투여받았다. 30kg 초과의 소아 환자들은 200mg의 듀피젠트 혹은 위약을 q2w로 피하 투여, 30kg 이하의 소아 환자들은 100mg의 듀피젠트 혹은 위약을 q2w로 피하 투여 혹은 300mg의 약을 q4w로 피 하투여 받았다.
1. open label extension
[평가변수]
1차 평가변수 :
- 52주차까지 TEAE 1를 경험한 환자의 수 및 비율
주요 2차 평가변수 :
- 연간 중증 천식 악화율
- VOYAGE 시험 당시의 기관지 확장제 사용 전(pre-bronchodilator) FEV1 베이스라인 대
비 52주차 평균 변화
③ 결과
[주요 평가변수]
-기관지 확장제 사용 전 FEV1의 베이스라인 대비
및 폐기능 개선
VOYAGE에서 52주 동안 위약에 노출되었다가 EXCURSION에서 듀피젠트 노출로 바뀐 환자 의 경우 듀피젠트 피하투여 2주만에 급격한 FEV1 개선이 이루어졌다. VOYAGE에서는 위약, EXCURSION에서는 듀피젠트 에 노출된 임상시험 대상자(n=106)는 52주차에 베이스라인 대 비 9.4%의 FEV1 개선이 있었고 VOYAGE에서 듀피젠트 , EXCURSION에서도 듀피젠트 에 노 출된 임상시험대상자(n=209)는 52주차에 베이스라인 대비 12.6%의 개선이 있었다.
[그림 36] VOYAGE와 EXCURSION에 참여한 환자들의 베이스라인 대비 FEV1 증가율

-중증 천식 악화율
VOYAGE에서 듀피젠트에 노출되고 이후 EXCURSION에서도 듀피젠트에 노출된 제 2형 염 증성 중증 천식 소아 환자의 경우 VOYAGE 임상시험 전 베이스라인 대비 중증 악화율이 95% 감소했다. (연간 중증 악화율이 2.56에서 0.118로 감소) VOYAGE에서 위약에 노출되고 이후 EXCURSION에서는 듀피젠트에 노출된 제 2형 염증성 중증 천식 소아 환자의 경우 VOYAGE 임상시험 전 베이스라인 대비 중증 악화율이 94% 감소했다. (연간 중증 악화율이 2.16에서 0.124로 감소) EXCURSION에 참여한 만 6-11세 소아 중증 천식 환자 중 91%는 2년동안 0 회의 중증 악화를 경험하지 않았다.
-OCS 감량
이전 VOYAGE 시험에서 1회의 중증 악화를 경험했던 임상시험대상자(n=77) 중 81%는 EXCURSION 시험에 참여한 2년 동안 전신 코르티코스테로이드(SCS)를 전혀 복용하지 않았 다.
④ 결과 해석
VOYAGE에서 확인된 제 2형 염증성 소아 중증 천식 환자에서의 듀피젠트의 유효성 및 안전
성은 52주차 시험인 EXCURSION에서도 그 효과가 지속됨을 확인할 수 있었다. 특히 듀피젠 트를 장기간 복용했을 때 2형 염증 바이오마커인 EOS, FeNO 그리고 혈중 IgE 수치가 적절하 게 잘 조절되었다. 즉,듀피젠트는 제 2형 염증성 소아 중증 천식 환자에게서 위약대비 장기적으 로 유효하다.
의약품안전나라. (2022.05.19). 듀피젠트프리필드펜300밀리그램(두필루맙, 유전자재조합). Retrieved from https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202202110aupdate Ts2024-08-06%2009:08:13.468b
FDA. Drug Databases. Drugs@FDA. Retrieved from https://www.accessdata.fda.gov/drugsatfda_ docs/label/2024/761055s057lbl.pdf
European Medicines Agency. Medicines. Retrieved from https://www.ema.europa.eu/en/ medicines/human/EPAR/dupixent#authorisation-details
drugs.com. (2024.01.29). Dupixent FDA Approval History. Retrieved from https://www.drugs.com/ history/dupixent.htmlPfizer. (2022). Tofacitinib in Rheumatoid Arthritis. Retrieved from https:// webfiles.digitalpfizer.com/0a4985a9-bea2-41ff-a70f-e44367247643/index.html#/
의약품안전나라. (2022.05.19). 듀피젠트프리필드펜300밀리그램(두필루맙, 유전자재조합). Retrieved from https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202202110aup dateTs2024-08-06%2009:08:13.468b
전세미. (2020.09.10). 듀피젠트, 중등도-중증 천식 대상 3년 데이터 공개, 글로벌 3상 임상 과 동일한 수준의 안전성 확인. 약업신문. Retrieved from http://m.yakup.com/news/index. html?mode=view&nid=248864
김찬혁. (2024.08.09). 사노피 ‘듀피젠트’, 96주 장기 천식 치료 효과 입증. 청년의사. Retrived from http://m.yakup.com/news/index.html?mode=view&nid=248864
Wenzel, S., Castro, M., Corren, J., Maspero, J., Wang, L., Zhang, B., ... & Teper, A. (2016). Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium-to-high-dose inhaled corticosteroids plus a long-acting β2 agonist: a randomised double-blind placebo-controlled pivotal phase 2b dose-ranging trial. The Lancet, 388(10039), 31-44.
Busse, W. W., Maspero, J. F., Rabe, K. F., Papi, A., Wenzel, S. E., Ford, L. B., ... & Teper, A. (2018). Liberty Asthma QUEST: phase 3 randomized, double-blind, placebo-controlled, parallel-group study to evaluate dupilumab efficacy/safety in patients with uncontrolled, moderate-to-severe asthma. Advances in therapy, 35, 737-748.
Castro, M., Corren, J., Pavord, I. D., Maspero, J., Wenzel, S., Rabe, K. F., ... & Teper, A. (2018). Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. New England journal of medicine, 378(26), 2486-2496.
Rabe, K. F., Nair, P., Brusselle, G., Maspero, J. F., Castro, M., Sher, L., ... & Teper, A. (2018). Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. New England journal of medicine, 378(26), 2475-2485.
Wechsler, M. E., Ford, L. B., Maspero, J. F., Pavord, I. D., Papi, A., Bourdin, A., ... & Hardin, M. (2022). Long-term safety and efficacy of dupilumab in patients with moderate-to-severe asthma (TRAVERSE): an open-label extension study. The Lancet Respiratory Medicine, 10(1), 11-25.
Bacharier, L. B., Maspero, J. F., Katelaris, C. H., Fiocchi, A. G., Gagnon, R., de Mir, I., ... & Hardin, M. (2021). Dupilumab in children with uncontrolled moderate-to-severe asthma. New England Journal of Medicine, 385(24), 2230-2240.
Bacharier, L., Maspero, J., Katelaris, C., Fiocchi, A., Gagnon, R., De Mir-Messa, I., ... & Robinson, L. (2022). LONG-TERM SAFETY AND EFFICACY OF DUPILUMAB IN CHILDREN WITH ASTHMA: LIBERTY ASTHMA EXCURSION. Annals of Allergy, Asthma & Immunology, 129(5), S44.
Drugs@FDA: FDA-Approved Drugs (24.09.12). DUPIXENT. Retrieved from https://www.accessdata. fda.gov/drugsatfda_docs/label/2024/761055s059lbl.pdf
의약품안전나라. (2022.05.19). 듀피젠트프리필드펜300밀리그램(두필루맙, 유전자재조합). Retrieved from https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202202110aupdate Ts2024-08-06%2009:08:13.468b
손형민 (2023.10.16). ‘소아 천식 치료 개선’...아토피신약 ‘듀피젠트’의 진화 Retrieved from https://www.dailypharm.com/Users/News/NewsView.html?ID=304816
3.5 테즈파이어
허가 적응증 및 타임라인
1) 허가 적응증
테즈파이어는 최초의 항 TSLP 단클론항체로, 기도의 염증 유발을 차단하는 원리로 천식 증상 을 개선시킨다. 치료제로서 테즈파이어는 환자의 바이오마커 결과에 제한받지 않으며 중증 천식
환자의 추가 유지 치료에 이용되는 생물학적 제제 (biologic) 이다. 국내에서는 테즈파이어의 허 가 적응증을 기존 치료에 적절하게 조절되지 않는 12세 이상의 중증 천식 환자의 추가 유지 요
법으로명시하고 있다. 국외 허가 적응증을 살펴보면 미국, 영국, 유럽 모두 국내와 같은 적응증
에서 허가를 받았다. 즉, 테즈파이어는 성인 또는 12세 이상의 청소년 중증 천식 환자에게 적용
되는 Add-on 유지 요법으로 사용되는 약제이다.
따라서, 기존 치료로 이용되는 고용량의 ICS와 추가 치료법에도 조절이 불가한 천식을 가진 경
우 테즈파이어를 치료제로 이용할 수 있다. 주의할 점은 테즈파이어는 급성 기관지 경련(acute bronchospasm) 과 천식 지속 상태(status asthmaticus)에는 사용할 수 없다는 점이다.
2) 타임라인
테즈파이어는 2021년 12월 17일에 FDA에 의해 미국에서 허가를 받은 뒤, 2022년 09월 19일에 EMA에 의해 유럽에서 허가를 받았다. 2023년 6월 9일에 MHRA에 의해 영국에서 또 한 허가가 승인되었다. 이후 2023년 12월 21일에 국내에서 식품의약품안전처에 의해 테즈파 이어가 허가를 받았다.
미국에서의 허가 타임라인을 자세히 살펴보면 다음과 같다. -2021.12.17 최초 허가 승인(Original approval): 바이알, 프리필드시린지 제형 허가 -2023.02.01 효능-임상 데이터를 통한 제조 변화: 프리필드 펜 제형 추가 허가 -2023.05.26 라벨링-패키지 인서트
유럽과 영국에서의 허가 타임라인은 다음과 같이 정리할 수 있다.
2022.09.19 유럽에서 허가 승인
2023.06.09 영국에서 허가 승인
국내에서는 프리필드시린지 제형과 프리필드 펜 제형이 동시에 최초 허가 시 승인되었다.
모두 210mg, 4주마다 피 하주사로 동일하다. 테즈파이어의 경우, 바이알, 프리필드시린지, 프리필드 펜으로 3가지
이 존재한다.
1) 국내 국내에서는 테즈파이어를 성인 및 청소년(12세 이상)을 대상으로 약 210mg을 4주마다 피하 주사한다. 투여가 누락된 경우에는 가능한 빨리 해당 용량을 투여하며, 이후 환자는 일반적인 투
여일에 투여를 재개할 수 있다. 이미 다음 투여 시기가 된 경우에는 예정된 대로 투여한다.
2) 국외 국외에서 허가받은 테즈파이어의 용법 및 용량 또한 국내와 동일하다. 자세히 살펴보면 먼저
미국의 경우, 마찬가지로 210mg을 4주마다 피하주사한다. 이때 제형 종류에 따른 용법 및 용 량에는 차이 없이 모두 210mg/1.91mL의 용량으로 투여한다.
영국과 유럽의 경우 또한 성인 및 12세 이상의 청소년을 대상으로 4주마다 1회 피하주사하도
록 되어 있다.
안전성 및 주의사항
테즈파이어는 구성 성분인 테제펠루맙과 첨가제에 과민증을 가지고 있는 환자에게는 투여가 불가하다. 치료 시작 후 천식이 조절되지 않거나 악화되는 경우 의사와 상담해야 하며, 치료 시 작 후 코르티코스테로이드를 갑자기 중단해서는 안 된다. 일반적으로 급성 천식 악화 치료에는 사용하지 않으며 발진 등의 과민 반응이 발생할 수 있다.
또한 중대한 감염, 심장 사건, 기생충 감염 등의 부작용이 나타날 수 있다. TSLP의 차단에 의해
감염의 위험이 증가할 수 있고, 감염이 발생한 경우 치료될 때까지 Tezepelumab 치료를 중단
해야 한다. 장기 임상시험에서 중대한 심장 이상반응의 수치적 불균형이 관찰되었으나 인과 관
계는 확인되지 않았다. TSLP가 일부 연충 감염에 대한 면역학적 반응에 관여할 수 있기 때문에
기생충 감염 또한 주의해야 한다. 운전 및 기계 조작 능력에 대한 영향은 거의 없다. 한편, 공식 적인 약물 상호작용은 없으며 병용 투여되는 천식 약물과 임상적 영향성을 가지지 않는다.투여 환자는 약독화된 생백신 사용은 피해야 한다.
임산부에게는 권장되지 않고 수유부의 경우 위험 가능성이 있으므로 유익성을 고려한 후 사용 을 결정해야 한다. 적응증에서 확인한 바와 같이, 테즈파이어는 12세 미만의 소아 치료에는 허 가가 승인되지 않았다. 해당 연령층에서 이 약의 안전성 및 유효성이 확립되지 않았기 때문이 다. 65세 이상의 고령자와 간장애, 신장애 환자의 경우 용량 조절이 불필요하다.과량 투여 시
280mg까지는 임상시험에서 독성의 증거는 없으며, 적절히 모니터링하며 지지 요법으로 치료 한다.
테즈파이어(Tezpire, Tezepelumab)는 PATHWAY와 NAVIGATOR를 통해 조절되지 않 는 중증 천식 환자에 대해 효과와 안전성을 입증하였으며, SOURCE로 테즈파이어의 OCS
sparing effect를 연구하였다. 이후 NAVIGATOR와 SOURCE 참가자들을 대상으로 진행한
DESTINATION을 통해 장기적인 안정성과 효과 또한 입증하였다. 언급한 4가지 임상 연구에 대해 자세히 분석해 보았다.
Study to Evaluate the Efficacy and Safety of *MEDI9929(AMG 157) in Adult Subjects With Inadequately Controlled, Severe Asthma
*MEDI9929(AMG 157) : 테즈파이어 alternative name
본 연구는 조절되지 않는 중증 천식 성인 환자의 천식 악화에 대해 테제펠루맙 3가지 용량 (70mg, 210mg, 280mg)의 효과, 안전성 평가를 목적으로 시행되었으며, 무작위 배정, 이중
맹검, 평행군, 위약 대조, 2상 임상 시험으로 설계되었다. 2013년 12월부터 2017년 3월까지
미국, 슬로바키아, 일본, 남아프리카 등 12개국에서 중간 용량 혹은 고용량의 흡입용 코르티코
스테로이드와 지속성 베타 2 항진제를 처방받은 18~75세 중증 천식 환자 550명을 대상으로 진 행했다. 단, 급성 기관지 경련, 성대 기능 장애 등을 진단받았거나 타생물의약품 치료에 아나필
락시스 병력이 있는 경우 제외했다.
참가자들은 4가지 그룹(위약, 테제펠루맙 70mg, 테제펠루맙 210mg, 테제펠루맙 280mg)
으로 무작위 배정되어 해당 약물을 52주간 피하주사 했다. 위약, 테제펠루맙 280mg은 2주마
다 피하주사 하였고, 테제펠루맙 70mg, 테제펠루맙 210mg은 1일 차부터 48주 차까지 4주마
다 약물을, 2주 차부터 50주 차까지 4주마다 위약을 피하주사 했다.
1차 평가 변수는 52주간 AER로, 결과는 [ 표 47] 과 같다. 각 테제펠루맙 AER값을 위약 AER 로 나누어 계산한 rate ratio를 통해 테제펠루맙 3가지 용량 모두 유의미하게 위약보다 AER이 작다는 것이 입증되었다. (p < 0.001)
[표 47] PATHWAY 1차 평가 결과
테제펠루맙
비
2차 평가 변수는 AER의 감소이며, 이는 혈중 호산구 수(호산구성, 비 호산구성), Th2 상태(높 음, 낮음), FENO(높음, 낮음), 알러지 여부(알러지성, 비알러지성) 등에 따라 나누어 AER을 평 가하였고 결과는 [ 표 48] 과 같다. 혈중 호산구 수, FENO 상태, 알러지 여부와 무관하게 위약 대
비 AER 감소가 유의미하게 나타났으며, Th2 상태 또한 위약 대비 AER 감소 경향성을
[표 48] PATHWAY 2차 평가 결과
PATHWAY 결과, 테제펠루맙은 18~75세 조절되지 않는 중증 천식 환자 치료에 대해 70, 210, 280mg 3가지 용량 모두에서 효과와 안전성을 입증했다. 호산구, Th2, FENO 등을 포함 한 염증성 생체 표지자의 기저 수준, 알러지성 여부 등과 무관하게 AER이 유의미하게 감소하였 으며 감염 등 여러 부작용 발생률 또한 위약 대비 높지 않았기 때문이다. 이를 통해 임상 3상 연
Study to Evaluate Tezepelumab in Adults & Adolescents With Severe Uncontrolled Asthma
본 연구는 임상 2상 PATHWAY에 더해 조절되지 않는 중증 천식 치료에 대한 테제펠루맙의 효
과, 안전성에 대해 임상 3상 연구 결과를 얻기 위해 시행되었으며, 무작위 배정, 이중 맹검, 평행
군, 위약 대조, 3상 임상 시험으로 설계되었다. 2017년 11월부터 2020년 11월까지 미국, 한
국, 독일 등 289개 지역에서 적어도 12개월 중간 용량 혹은 고용량의 흡입용 코르티코스테로이
드를 처방받은 12~80세 중증 천식 환자 1,061명을 대상으로 진행하였다. 단, 암 병력, 감염 병 력, 흡연자 등은 제외하였다. 참가자들은 2가지 그룹(위약, 테제펠루맙 210mg)으로 무작위 배
정되어 해당 약물을 52주간 4주마다 피하주사 했다.
1차 평가 변수는 52주간 AAER이며, 참가자 전체에 대한 결과와 기저 호산구 수 300cells/ uL 이상 참가자에 대한 결과로 나누어 [ 표 49] 에 나타냈다. 테제펠루맙의 AAER값을 위약 AAER로 나눈 rate ratio를 통해 참가자 전체, 기저 호산구 수 300cells/uL 이상 참가자 모두 유의미하게 위약보다 AAER이 작다는 것이 입증되었다. (p < 0.001)
[표 49] NAVIGATOR 1차 평가 결과
기저 호산구 수 300cells/uL 이상
2차 평가 변수는 FEV1 변화, ACQ-6 변화, AQLQ(S)+12 변화, ASD 점수 변화이다. 52주 간 FEV1 변화는 위약 0.10, Tezepelumab 0.23으로 나타났다. (차이 ; 0.13 ; p<0.001) 또 한 위약과 테제펠루맙은 각각 ACQ-6 변화에서 -1.20, -1.53을 (차이 ; -0.33 ; p<0.001), AQLQ(S)+12 변화에서 1.414, 1.48을 (차이 ; 0.33 ; p<0.001), ASD 변화에서 -0.70, -0.59을 나타냈다. (차이 ; -0.11 ; p=0.004) 이를 통해 FEV1, ACQ-6 등 다양한 지표에서 테제펠루맙이 위약보다 중증 천식 치료에서 유의미하게 효과가 있음을 나타냈다.

[ 그림 37] NAVIGATOR 1차 평가 결과
NAVIGATOR 결과, 테제펠루맙 210mg은 12~80세 조절되지 않는 중증 천식 환자 치료에 유 의미하게 효과와 안전성을 입증했다. 1차 평가 변수였던 AAER의 유의미한 감소는 물론 2차 평
가 변수였던 FEV1 변화, ACQ-6 변화, AQLQ(S)+12 변화, ASD 변화를 통해 테제펠루맙의
위약 대비 효과를 볼 수 있었고 여러 부작용 발생률 또한 위약 대비 높지 않았기 때문이다.
본 연구에서는 PATHWAY 참가자 조건인 18~75세에 12세 이상 청소년, 75세 이상 노인을 추가하여 테제펠루맙의 접근성을 높였다는 측면에서 의의가 있다. 또한 항 TSLP 단클론항체라 는 기존 치료제와 차별화된 새로운 작용 기전의 가능성을 제시한 만큼 중증 천식 환자들에게 중 요한 선택지로 작용할 것이라 예상된다.
Study to Evaluate the Efficacy and Safety of Tezepelumab in Reducing Oral Corticosteroid Use in Adults With Oral Corticosteroid Dependent Asthma
본 연구는 경구 코르티코스테로이드(OCS)를 처방받은 성인 천식 환자의 경구 코르티코스테
로이드 사용 감소 효과(OCS-sparing effect)에 있어 테제펠루맙의 효능, 안전성 평가를 위해 시행됐으며, 무작위 배정, 이중 맹검, 평행군, 위약 대조, 3상 임상 시험으로 설계되었다. 2018
년 3월부터 2020년 9월까지 미국, 한국, 튀르키예 등 60개 지역에서 중간 용량 혹은 고용량의 흡입용 코르티코스테로이드를 처방받았으며 12개월 동안 천식 악화가 최소 1회 발생한 18~80
세 중증 천식 환자 150명을 대상으로 진행했다. 단, 타 폐질환, 암 병력, 감염 병력, 흡연자 등 은 제외하였다.
본 연구는 테제펠루맙 치료 전 8주간 참가자별 OCS 최적화 단계를 가졌다. 이때 최적화 단계
는 2주마다 OCS 감량 여부를 판단하여 천식 조절이 유지되는 OCS 최소 용량을 결정함으로써 치료 기저선을 설정하는 단계이다. 이후 참가자들은 2가지 그룹(위약, 테제펠루맙 210mg)으
로 무작위 배정되며 해당 약물을 48주 치료 기간동안 4주마다 피하주사 했다. 이때 치료기간은
유도 단계, OCS 감량 단계, 유지 단계로 구성된다. 유도 단계는 총 4주로, 최적화 단계에서 결
정된 OCS 기저 용량을 유지한다. OCS 감량 단계는 총 36주로, 4주마다 감소 용량을 결정하
며, OCS 용량이 10mg/일 이상일 경우 5mg씩, 10mg/일 이하일 경우 2.5mg씩 감소하게 된 다. 마지막 유지 단계는 총 8주로, OCS 감량 단계가 끝날 때 달성된 OCS 용량을 계속해서 복 용한다.

[그림 38] SOURCE 연구 디자인
1차 평가 변수는 치료 기간 48주간 일일 OCS 용량의 감소율이며 결과는 [ 표 50] 과 같다. 결 과 해석을 위해 odds ratio로 나타낸 결과 1.28 (95% ; 0.69~2.35 ; P=0.434)였다. 95%
신뢰구간이 1을 포함하며 P value가 0.05 이상이므로 Tezepelumab이 위약에 비해 유의미하 게 OCS를 감량했다고 볼 수 없다.
[표 50] SOURCE 1차 평가 결과
SOURCE는 부작용이 큰 OCS의 용량을 감소시켜 중증 OCS
삶의 질(HRQoL)을 크게 개선하는 잠재력을 가진다는
특히 이전
메폴리주맙, 벤랄리주맙, 두필루맙의 OCS-sparing effect 연구와 유사한 설계지만 이전 연구 (24~40주)보다 긴 기간(48주)을 연구하여 OCS 용량을 0mg까지 줄일 수 있다는 점에서 이전
연구의 한계점을 보완한 바 있다.
하지만 1차 평가 결과상 Tezepelumab은 유의미하게 OCS sparing effect를 나타낸다고 볼
수 없었다. 성과 잠재력이 크므로 연구 설계를 보완하여 추가적인 연구가 후속되는 것이 중요하 다고 생각된다.
Extension Study to Evaluate the Safety and Tolerability of Tezepelumab in Adults and Adolescents With Severe, Uncontrolled Asthma
본 연구는 테제펠루맙의 장기적 안전성, 효능 평가를 위해 시행됐으며, 무작위 배정, 이중 맹 검, 평행군, 위약 대조, 3상 임상 시험으로 설계되었다. NAVIGATOR, SOURCE 연구를 완 료 한 12~80세 환자들을 대상으로 2019년 1월부터 2022년 5월까지 진행되었다.
선행 연구에서 테제펠루맙 210mg Q4W을 무작위 배정받았던 환자는 52주(1년)간 테제펠루 맙 치료를 유지하며, 위약을 무작위 배정받았던 환자는 52주간 테제펠루맙 210mg Q4W와 위
약 중 다시 1:1로 무작위 배정된다. 이에 NEVIGATOR와 SOURCE에서 테제펠루맙 : 위약 비 율이 1:1이었지만 DESTINATION에서는 3:1이 된다. 선행 연구 후 재지정된 약물을 52주간 4 주마다 피하주사했다.
1차 평가 변수는 AEs(adverse events), SAEs(Serious adverse events)의 조정된 발생 률로 결과는 [표 51] 과 같다. 일차 목표가 장기적 안전성에 대한 평가이므로 타 임상 연구와 다
르게 AEs가 1차 평가 변수로 선정되었다.
조정된 발생률은 AE 있는 대상자 수를 모든 대상자의 총 위험 시간으로 나눈 후 100을 곱한 값
으로 정의된다. 이때 총 위험 시간은 IP(Investigational Product) 첫 투여일과 최솟값 (IP 마
지막 투여일 +33일, 사망일, 연구 종료일, 타 생물학적 제제 시작 전날) 사이의 시간을 말한다. NAVIGATOR, SOURCE 각각의 테제펠루맙 투여군과 위약을 비교했을 때 AE, SAE 모두 감 소하는 경향성을 보였다. 다만, 테제펠루맙군에서는 11명의 사망자를, 위약군에서는 5명의 사 망자가 나타났지만, 테제펠루맙과 인과관계가 간주된 사망자가 없어 본
제하였다.
[표 51] DESTINATION 1차 평가 결과
[ 그림 39] DESTINATION 1차 평가 결과
2차 평가 변수는 AAER로, 테제펠루맙의 장기적 효과를 평가하는 기준으로 선정되었다. 결과
는 [표 52] 와 같다. NAVIGATOR와 SOURCE의 rate ratio가 모두 1 이하의 값이며 95% 신
뢰구간이 1을 포함하지 않은 것을 통해 테제펠루맙이
낮음을 알 수 있다.
[표 52] DESTINATION 2차 평가 결과
DESTNATION은 임상 3상 연구인 NAVIGATOR와 SOURCE 참여자들을 대상으로 1년간 추
가 연구를 통해 선행 연구 기간 포함 총 104주(2년)간 테제펠루맙의 안전성, 효과를 장기적 측 면에서 평가하는 데에 의의가 있다. 연구 결과상 AEs와 AAER 모두 위약보다 감소하였기에 테 제펠루맙의 장기적 사용에 대한 가능성을 입증하였다.
테즈파이어는 기존 중증 천식 치료제와 차별화된 작용 기전을 가진 만큼 임상 시험 결과가 보 다 중요한 의미를 갖는다. 테즈파이어는 임상 2상 PATHWAY와 임상 3상 NAVIGATOR 그리고
장기 프로젝트였던 DESTINATION을 통해 12세 이상 중증 천식 환자 치료에 대한 장기적 효과 와 안전성을 충분히 입증하였다. 특히 PATHWAY에서 호산구, Th2, FENO 등의 염증성 생체 표지자 기저 수준, 알러지성 여부와 무관하게 효과가 나타난 점, NEVIGATOR에서 12세 이상 청소년을 포함하여 효과가 나타난 점을 고려했을
[표 53] 테즈파이어 임상 정리
연구명 연구 개요 연구 디자인 주요 결과 안전성
- 대상: 중증 천식 환자
- 배정: 1:1:1:1 비율 무
작위 배정
- 용량: 70mg, 210mg, 280mg
PATHWAY
NAVIGATOR
중증 천식 환자의 천식
악화에 대한 MEDI9929
의 3가지 용량 수준의 효 과 평가
1) 위약, 테제펠루맙 280 mg : 2주마다 피하주사
2) 테제펠루맙 70 mg, 210 mg : 4주마다 약
물 (1일차~48주차), 4주
마다 위약 (2주차~ 50주 차) 피하주사
일차 평가 변수: 연간 천
식 악화 비율 (AER) - 75mg: 38% 감소 - 250mg: 29% 감소 - 750mg: 34% 감소
이차 평가 변수: AER 감 소 (혈중 호산구 수, Th2 상태, FENO 상태, 알러 지 여부 등 - 혈중 호산구 수, Th2 상태 등 무관하게 테제 펠루맙 투여군에서 AER 유의미한 감소
부작용: 테제펠루맙 투여 군과 위약군 간에 부작용 발생 빈도 유사
빈번한 이상 반응: 감염, 두통
SOURCE
중증 천식 환자 치료에
대한 테제펠루맙의 효과 및 안전성 평가 - 대상: 중증 천식 환자 - 배정: 1:1 비율로 무작
위 배정 - 용량: 위약 혹은 210mg 테제펠루맙을 4 주마다 피하 주사
일차 평가 변수: 연간 천 식 악화 비율 (AER) - 전체 : 44% 감소 - 기저 호산구 수 300cells/uL이상 : 59% 감소
이차 평가 변수: FEV1, AQLQ, ACQ, ASD 점 수 - 각 항목에 대해 테제 펠루맙 투여군에서 AER 유의미한 감소
부작용: 테제펠루맙 투여 군과 위약군 간에 부작용
발생 빈도 유사 빈번한 이상 반응: 면역 계 반응, 감염
중증 천식 환자에서 경 구 스테로이드(OCS) 용
량을 줄이기 위해 테제 펠루맙의 효과 및 안전
성 평가
- 대상: 중증 천식 환자 - 배정: 1:1 비율로 무작 위 배정 - 용량: 위약 혹은 210mg 테제펠루맙을 4 주마다 피하 주사
일차 평가 변수: 48주 동 안 OCS 투여 감소량 - 유의미한 결과 없음 (p=0.434)
부작용: 테제펠루맙 투여 군과 위약군 간에 부작용 발생 빈도 유사
연구명 연구 개요 연구 디자인 주요 결과 안전성
- 대상: NAVIGATOR, SOURCE 참
가자
중증 천식 환자에서 테
DESTINATION
제펠루맙의 장기적 안
전성 및 효과 평가
- 배정: 3:1 (=테제펠
루맙 : 위약)
- 용량: 위약 혹은
210mg 테제펠루맙을
4주마다 피하 주사
일차 평가 변수: AEs, SAEs
- 테제펠루맙 투여군
에서 유의미한 개선
이차 평가 변수: 연간
천식 악화 비율
- 테제펠루맙 투여군
에서 유의미한 개선
부작용: 테제펠루맙 투
여군과 위약군 간에 부
작용 발생 빈도 유사
-허가
의약품안전나라. (2023.12.21). 테즈파이어오토인젝터주(테제펠루맙). Retrieved from https://nedrug. mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202303399aupdateTs2024-07-31%20 16:49:28.0b
US FDA. (2021.12.17). TEZSPIRE. Retrieved from https://www.accessdata.fda.gov/scripts/cder/ daf/index.cfm?event=BasicSearch.process
EMA (2022.09.19). Tezspire. Retrieved from https://www.ema.europa.eu/en/medicines/human/ EPAR/tezspire
-임상
NIH. (2018.12.04). Study to Evaluate the Efficacy and Safety of MEDI9929 (AMG 157) in Adult Subjects With Inadequately Controlled, Severe Asthma. Retrieved from https://clinicaltrials.gov/study/NCT02054130
Corren, J., Ambrose, C. S., Sałapa, K., Roseti, S. L., Griffiths, J. M., Parnes, J. R., & Colice, G. (2021). Efficacy of tezepelumab in patients with severe, uncontrolled asthma and perennial allergy. The Journal of Allergy and Clinical Immunology: In Practice, 9(12), 4334-4342.
NIH. (2021.11.26). Study to Evaluate Tezepelumab in Adults & Adolescents With Severe Uncontrolled Asthma (NAVIGATOR). Retrieved from https://clinicaltrials.gov/study/NCT03347279
Menzies-Gow, A., Corren, J., Bourdin, A., Chupp, G., Israel, E., Wechsler, M. E., ... & Colice, G. (2021). Tezepelumab in adults and adolescents with severe, uncontrolled asthma. New England Journal of Medicine, 384(19), 1800-1809.
NIH. (2021.12.09). Study to Evaluate the Efficacy and Safety of Tezepelumab in Reducing Oral Corticosteroid Use in Adults With Oral Corticosteroid Dependent Asthma (SOURCE). Retrieved from https://clinicaltrials.gov/study/NCT03406078
Wechsler, M. E., Colice, G., Griffiths, J. M., Almqvist, G., Skärby, T., Piechowiak, T., ... & Garcia Gil, E. (2020). SOURCE: a phase 3, multicentre, randomized, double-blind, placebo-controlled, parallel group trial to evaluate the efficacy and safety of tezepelumab in reducing oral corticosteroid use in adults with oral corticosteroid dependent asthma. Respiratory Research, 21, 1-10.
NIH. (2023.06.06). Extension Study to Evaluate the Safety and Tolerability of Tezepelumab in Adults and Adolescents With Severe, Uncontrolled Asthma (DESTINATION). Retrieved from https://clinicaltrials.gov/study/NCT03706079
Menzies-Gow, A., Ponnarambil, S., Downie, J., Bowen, K., Hellqvist, Å., & Colice, G. (2020). DESTINATION: a phase 3, multicentre, randomized, double-blind, placebo-controlled, parallel-group trial to evaluate the long-term safety and tolerability of tezepelumab in adults and adolescents with severe, uncontrolled asthma. Respiratory Research, 21, 1-10.
Menzies-Gow, Andrew, et al. “Long-term safety and efficacy of tezepelumab in people with severe, uncontrolled asthma (DESTINATION): a randomised, placebo-controlled extension study.” The Lancet Respiratory Medicine 11.5 (2023): 425-438.
중증 천식 생물학적 제제 분야에서 앞서 다루었던 6개의 치료제 외에도 주목해야 할 치료제 시 장이 있는데 바로 바이오시밀러이다. 셀트리온의 '옴리클로'가 그 예이다. 옴리클로는 알레르
기성 천식, 만성 특발성 두드러기 치료제 졸레어(Xolair, Omalizumab) 바이오시밀러로, 최근 식품의약품안전처와 영국 의약품건강관리제품규제청(MHRA)으로부터 승인을 받았다. 이에 따
라 중증 천식 환자들이 더 많은 치료 기회를 얻었으며 의료 보험 재정도 줄일 수 있을 것이라는
기대를 주고 있다. 옴리클로를 비롯한 중증 천식 바이오시밀러에 앞서서 바이오시밀러는 무엇이
고 어떤 제도를 거쳐 시장에 판매되는지 먼저
한다.
바이오시밀러란 특허 기간이 끝난 바이오의약품을 본떠서 만든 동등생물의약품이다. 이때 바 이오의약품은 사람이나 다른 생물체에서 유래된 것을 원료 또는 재료로 제조한 의약품을 말한
다. 바이오시밀러는 동등생물의약품으로서 대조약과 매우 유사한 물리, 화학 및 생물학적 특성
이 있어야 하며 임상적 효능에서 차이가 없어야 한다. 다른 의약품과 동일하게 엄격한 품질, 안 전성 및 유효성 기준에 따라 허가된다. 또한, 유효성분이 단백질일 경우 대조약과 바이오시밀러
는 동일한 아미노산 서열과 3차 구조를 가져야 하고, 완제의약품일 경우 동일한 투여량과 투여 경로를 가져야 한다. 바이오시밀러는 오리지널 의약품과 성분 면에서 유사하지만 동일하지는 않 으며, 개발비용이 오리지널 의약품 대비 1/10 수준으로 저렴하고 의약품 가격도 오리지널 의약 품의 50~80% 수준으로 저렴한 것으로 알려져 있다. [ 그림 40] 바이오시밀러의 품목허가 절차

바이오시밀러가 품목허가를 받는 절차는 다른 의약품과 유사하다. 하지만 추가로 대조약과 유 효성과 안전성에 차이가 없다는 것을 입증하는 비교 동등성 시험 자료를 제출해야 한다. 대조약 과 높은 유사성이 입증되면 대조약의 유효성 및 안전성에 근거해서 허가받게 된다. 비교 동등성 시험에는 세 단계가 있다. 먼저 품질 비교 시험에서는 in vitro로 단백질 구조와 생물학적 활성
을 비교한다. 그다음 단계인 비임상 비교 시험에서는 생리학적 표적의 결합 및 활성/억제와 세
포에서의 생리학적 영향을 확인하는 in vitro, in vivo 시험을 진행한다. 마지막으로 임상 비교 시험에서 대조약과의 생물학적 유사성을 재확인하며, 이 과정은 이미 대조약에서 확인한 사항
을 바이오시밀러에서 다시 확인하는 불필요한 과정을 줄일 수 있다. 바이오시밀러도 재심사 대 상에 해당되어서 품목허가시 제출된 제한된 임상시험 결과만으로 유효성과 안전성을 보장 할 수
없어 허가 이후에 장시간으로 광범위 환자를 관찰하는 RMP(위해성관리계획)를 제출해야 한다.
미국 FDA에서는 2015년 첫 바이오시밀러 승인을 시작으로 매년 증가되는 제품 수 추세를 보
이며 올해 상반기에는 56개의 바이오시밀러를 승인했다. 미국뿐만 아니라 세계 각국에서 바이 오시밀러 승인이 활발히 진행되고 있다. 또한, 전 세계 바이오시밀러 시장 규모는 갈수록 커져서
2028년에 약 103조원에 이를 것이라 예측된다. 이런 성장 전망은 블록버스터급 의약품의 특허
독점권이 2028년까지 차례로 만료돼 대형 바이오시밀러가 나올 것이라는 기대에 근거했다. 특 히 우리나라의 바이오시밀러 시장은 셀트리온과 삼성바이오로직스 등을 중심으로 생산규모가 크 게 성장 중이며 대부분 원료의약품을 수출 중이다. 가장 최근 통계인 2022년 국내 바이오시밀러
수출 실적을 보면 14억 6,869만 달러로, 전년(2021년) 9억 8,161만 달러보다 무려 49.6%가 급등했다. 이처럼 국내 제약사를 중심으로 지속적인 발전이 이루어지고 있는 바이오시밀러 시장 에 큰 관심을 둘 필요가 있다. 우리는 중증 천식 치료제 졸레어의 특허 만료에 따라 경쟁이 본격
화되고 있는 졸레어 바이오시밀러에 대해서 알아보고자 한다.
졸레어의 특허 만료
생물학적 제제 중 최초로 중증 천식 치료제가 된 졸레어는 2003년 6월 FDA에서의 허가를 시
작으로 EMA에서 2005년 10월, 그리고 국내에서 2007년 5월 시판 허가를 받았다. 이에 따라
졸레어의 오리지널 약물 특허는 2017년에 이미 만료가 되었고, 물질특허는 2018년에 만료되
었다. 물질특허란 화학 및 생물학적 방법으로 제조된 유용한 신규 물질 자체에 부여되는 특허이
다. 합성의약품뿐만 아니라 바이오의약품 역시 물질 특허의 대상이고, 물질 자체가 부여받는 특 허이므로 적응증이나 환자군, 용법 용량 등에 한정되지 않음이 특징이다.
오리지널 약물 특허와 물질 특허 모두가 만료되었음에도 졸레어가 생물학적 제제 시장을 독점 할 수 있는 이유는 제형 특허 때문이었다. 졸레어는 피하주사 제형의 특허 때문에 오랜 기간 시 장을 독점할 수 있었다. 그러나 이 특허 역시 유럽에서 2024년 3월 만료되었고, 미국에서 2025 년 11월에 만료된다.
제형 특허 만료 시기가 임박함에 따라 국내외 기업들은 바이오시밀러의 개발에 박차를 가했다. 2022년 2월 17일 기준, 미국 국립보건연구원 (NIH)의 clinical trials에 의하면 졸레어의 바이 오시밀러와 관련된 임상시험은 6건이었다. 또한 졸레어의 특허 만료를 앞둔 2024년 2월 기준 바이오시밀러를 허가받았거나 임상 단계를 밟고 있는 기업은 총 11개였다.
[ 표 54] 에 따르면, 러시아 제약사인 제네리움의 제놀레어와 중국의 제약사인 타이저우 마이보 타이케의 아오마이슈는 자국 허가를 받았다. 글로벌 시장을 겨냥하는 경쟁업체는 우리나라의 셀 트리온과 네덜란드의 바이오사나파마, 이스라엘의 테바, 미국의 카시브 바이오사이언스, 인도의 글렌마크 파마슈티컬스, 대만의 파운튼 바이오파마의 6곳이 있었다. 2022년 이후 CSPC, 제 레리움, 제지앙 화하이, 시네오스 헬스의 4개의 제약사는 개발을 중단한 것으로 보이며, 자국의 허가를 노리는 중국계 제약사들과 글로벌 시장을 차지하기 위해 개발 경쟁에 참여한 타 제약사 들의 증가를 확인할 수 있다.
[표 54] 졸레어 바이오시밀러 허가, 임상 (2024년 2월)
업체 약물 개발 단계
중국 타이저우 마이보타이케 제약 (Taizhou Maibotaike Pharmaceutical)
러시아 제네리움 (Generium)
중국 싱멍 바이오테크놀로지 (Xingmeng Biotechnology)
셀트리온
아오마이슈 (Aomaishu) 중국 허가
제놀레어(Genolair)
러시아 허가
SYN-008 중국 허가 신청
네덜란드 바이오사나파마 (BiosanaPharma) AVT-23 임상 3상 시험
미국 카시브 바이오사이언스 (Kashiv Biosciences)
이스라엘 테바 (Teva)
중국 쓰촨 위안다 수양 제약 (Sichuan Yuanda Shuyang Pharmaceutical)
ADL-018 임상 3상 시험
TEV-45779 임상 3상 시험
SYB-507 임상 3상 시험
중국 저장 히성 제약 (Zhejiang Hisun Pharmaceutical) HS-632 임상 1상 시험
인도 글렌마크 파마슈티컬스 (Glenmark Pharmaceuticals)
GBR-310 임상 1상 시험
대만 파운튼 바이오파마 (Fountain Biopharma) FB-317 임상 1상 시험
[표 55] 미국 국립보건연구원 졸레어 바이오시밀러 허가, 임상 (2022년 2월 27일)
업체 약물 개발 단계
셀트리온 CT-P39 임상 3상 시험 진행 테바 TEV-45779 임상 3상 시험 진행
임상 1상 시험 종료
화하이 HS632 임상 1상 시험 진행
헬스 BP11 임상 1상 시험 진행 졸레어 바이오시밀러 임상 현황_ 2022년 2월 17일 기준, 미국 국립보건연구원 (NIH)의 clinical trials
졸레어의 바이오시밀러, 옴리클로
국내에서 퍼스트 무버의 자리를 차지한 곳은 셀트리온이었다. 셀트리온의 옴리클로프리필드시
린지주 (옴리클로)는 2024년 6월 24일 식품의약품안전처의 허가를 받았다. 옴리클로의 적응증
은 알레르기성 천식과 만성 특발성 두드러기 두 가지로, 졸레어의 적응증 중 하나인 비용종을 동 반한 만성비부비동염은 포함되지 않았다. 옴리클로와 졸레어의 상세 투여 용량에는 차이가 없으
나, 졸레어와는 다르게 바이알로 투여할 수 없다는 것이 특징적이었다.
노바티스는 졸레어의 바이오시밀러 시장에 맞서 고용량인 300mg의 프리필드시린지주를 허가 받고(국내 허가일: 2024.03.07), 특허 소송을 청구하는 등 적극적인 방어를 대책으로 내놓았 다. 2023년 6월 1일, 노바티스는 셀트리온에게 적극적 권리범위심판을 청구하였다. 특허권자 인 노바티스가 자신이 보유하고 있는 제제 특허 2건(물질 특허와 제제 특허건)을 옴리클로를 개 발한 셀트리온에게 침해당했음을 주장하며 특허심판원에 회사의 특허권이 효력을
그러나 2024년 4월 24일과 2024년 6월 28일, 특허심판원이 각각의 적극적 권리범위확인심 판(물질 특허와 제제 특허건)을 심결 각하하며 특허 분쟁은 종결되었다. 심결각하는 부적합한 심
판청구로서 그의 흠결을 보정할 수 없을 때 피청구인에게 답변서 제출의 기회를 주지 않고 심결 로써 이를 각하할 수 있다는 특허법 규정으로 기각과 구분된다. ‘CT-P39’가 아직 출시되지 않
은 상황에서 '고농도 항체 및 단백질 제형’의 특허가 3월 29일 만료되며 심판을 진행할 의미가
없다는 판단을 내린 것이다. 셀트리온의 국내 허가와 심결각하 판정이 차례로 이어지며 셀트리 온은 성공적으로 바이오 시밀러 시장에 진입했다.
노바티스와 셀트리온의 사례처럼 물질의 특허가 만료된 이후에도 계속해서 특허 분쟁이 발생 하는 이유는 의약품 특허의 특성에서 찾을 수 있다. 의약품은 일반 특허 분야와 달리 다양한 특 허를 낼 수 있다. 때문에 오리지널 의약품을 만든 제약사는 시장을 더 오래 독점하기 위해 물질
특허를 낸 이후에도 용도, 조성물, 제형, 제법 등의 특허를 후속적으로 등록하는 전략을 펼친다.
이를 에버그리닝 (evergreening)이라고 한다. 제약사의 입장에서 성공적인 오리지널 의약품은
안정적인 수익 창출원이 되기 때문에 한 제품에 최대한 많은 종류의 특허를 출원해 경쟁자들이 시장에 진입하는 시기를 늦추는 전략이다.
마치며, 올해 7월 옴리클로는 영국의 의약품건강관리제품규제청(MHRA)으로부터의 품목 허 가 승인을 받은 상태이다. 이로써 유럽, 한국에 이어 영국에서까지 졸레어의 바이오시밀러 중 ‘ 퍼스트무버’의 지위를 공고히 하게 되었다. 또한 국내의 경우 오리지널 제품과 비교하였을 때 약 28%의 저렴한 가격 (150mg 기준 19만 5079원)으로 급여가 책정되었다. 이렇듯 셀트리온은 ‘퍼스트 무버’의 지위를 통한’ 선점 효과와 저렴한 가격을 바탕으로 시장을 공략하며, 천식으로
인한 환자들에게 새로운 치료 옵션을 제공하고 있다.
권혁진.(2024.07.09). 셀트리온, 졸레어 시밀러 ‘옴리클로’ 영국 품목허가…”퍼스트무버 지위 확보”. 약업신문. Retrieved from. http://m.yakup.com/news/index.html?mode=view&nid=296619
김경교 . (2019.05.18). “엘리퀴스 봤지?” 신약 물질특허가 중요한 이유. 히트뉴스. Retrived from https:// www.hkn24.com/news/articleView.html?idxno=336222
김순호. (2024.05.07). 셀트리온, 제넨텍 특허 공세 방어 … ‘졸레어’ 시밀러 상용화 청신호. 헬스코리아. Retrieved from https://www.hkn24.com/news/articleView.html?idxno=337593
김진구. (2023.06.02). 노바티스, 셀트리온에 ‘졸레어 시밀러’ 특허소송 역공. 데일리팜. Retrieved from https://www.dailypharm.com/Users/News/NewsView.html?ID=300862
김찬혁. (2024.08.09). 사노피 ‘듀피젠트’, 96주 장기 천식 치료 효과 입증. 청년의사. Retrived from http://m. yakup.com/news/index.html?mode=view&nid=248864
대웅제약. (2022). [제약산업 용어 상식] 바이오시밀러. Retrieved from https://newsroom.daewoong.co.kr/ archives/13431
보건신문. (2024.09.23). 폐 질환과 천식 치료제 관련 새로운 연구 발표. 보건신문. http://www.bosa.co.kr/ news/articleView.html?idxno=2223457
서일. (2021.12.23). 노바티스, ‘리겔리주맙vs졸레어’ CSU 3상 “개선 실패”. 바이오스펙테이터. Retrived from http://m.biospectator.com/view/news_view.php?varAtcId=15068
식품의약품안전처. (2020). 동등생물의약품(바이오시밀러) 설명서- 의료전문가용 -.
식품의약품안전처. (2021). 동등생물의약품 평가 가이드라인.
연구개발특구진흥재단. (2021). 바이오시밀러 동향 Issue Report.
이용. (2024.09.02). 셀트리온제약, 신규 바이오시밀러 3종 국내 판매 개시. 매일 일보. Retrieved from https://www.m-i.kr/news/articleView.html?idxno=1155335
이충만. (2024.02.06). 알레르기 치료제 ‘졸레어’ 특허만료 앞두고 시밀러 경쟁 가시화. 헬스코리아. Retrived from https://www.hkn24.com/news/articleView.html?idxno=336222
의약품안전나라. (2024.03.07). 졸레어프리필드시린지주300(오말리주맙). Retrieved from https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202400492aupdate Ts2024-07-28%2022:45:26.0b
의약품안전나라. (2024.06.24).옴리클로프리필드시린지주(오말리주맙). Retrieved from. https://nedrug. mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202401521aupdateTs2024-08-04%20 08:11:27.399075b
지용준. (2022.02.17). 4조원 대어 ‘졸레어’ 시밀러 개발 각축...퍼스트무버는. 데일리팜. Retrived from https://www.dailypharm.com/Users/News/NewsView.html?ID=285387
한국바이오협회. (2023). 글로벌 바이오시밀러 시장 현황 및 매출 전망.
한국바이오협회. (2024.07.02). 미국 FDA, 2024년 상반기까지 총 56개 바이오시밀러 허가. https://www. koreabio.org/board/board.php?bo_table=report&bcate=b:0;&pg=2&idx=389
4.2 듀피젠트
작년 API의 아토피피부염 및 건선 학회지에서 듀피젠트(Dupixent, dupilumab)를 아토피피
부염 치료제 시장의 막강한 선두주자로 다룬 바 있다. 올해에도 중증 천식의 생물학적 제제로써
듀피젠트를 다시 한번 소개한다. 지난해 학회지가 나온 후부터 약 1년 동안 듀피젠트라는
있는지 보고자 한다.
먼저 지난해 12월 듀피젠트는
증 확대를 승인받았다. 결절성
질환으로, 온몸에 피부가 두꺼워지는 병변인 결절이
다. 실제로 결절성 양진은 아토피피부염이나 천식
된
관련이 크다 고 알려졌으며, 결절성 양진 환자의 절반가량은 아토피성 동반 질환을 보유한 것으로 나타난다.
따라서 듀피젠트는 제2형 염증 반응에 의한 다양한 질환을 통합적으로 타 겟 할 수 있는 유일한 생 물학적 제제로 고려되고 있는 것이다. 이러한 적응증 확대로 현재 듀피젠트는 결절성 양진 환자
치료에 승인된 유일한 생물학적 제제이다.
올해 8월부터 듀피젠트는 6개월~5세 영유아 중등증-중증 아토피피부염 환자를 대상으로 급여 가 확대 적용된다. 아토피피부염에서 영유아 환자까지 급여 확대가 된 생물학적 제제는 듀피젠 트가 처음이다.
듀피젠트의 매출 분석
최근 경쟁 치료제가 임상 현장에 도입됨에도 아토피피부염 치료제 시장에서 듀피젠트의 독주 체제는 여전한 상태인데, 이러한 급여 확대를 통해 추가적인 매출 성장 동력을 얻게 될 것으로 예 상된다. 실제로 아이큐비아 조사를 따르면 듀피젠트는 2022년 1052억 원의 매출을 기록한 뒤, 지난해 소아와 청소년 아토피피부염 급여 확대를 계기로 1432억 원의 매출을 기록하였다. 급여
확대가 듀피젠트의 매출 성장에 미치는 영향을 직접적인 수치로 확인할 수 있는 좋은 사례라고 볼 수 있다. 또한 아토피피부염의 경우 급여 적용에 있어서 치료제 간 교체투여를 허용하고 있지
않기 때문에, 듀피젠트의 급여 확대는 곧 임상 현장에서의 처방 주도권을 한층 높이는 계기가 될 것이라는 분석이 있다. 실제로 듀피젠트는 올해 초 RSA 재계약 협상 시, 앞서 언급한 것처럼 지
난해 소아 및 청소년에서의 급여 확대를 기반으로 역대급 실적을 기록하여 당분간 고속 성장을
이어갈 발판을 마련한 것으로 평가받은 바 있다. 이를 고려해보면 아토피피부염에서 급여 연령 확대를 통해, 듀피젠트는 더욱 독점적인 시장을 구축하여 또 한 번의 성장을 기대해 볼 수 있다.
국내를 넘어 전 세계적인 시장에서 듀피젠트의 매출에 대해서도 간단히 알아보았다. 2023년
듀피젠트는 전 세계 매출 원화 약 15조 원을 기록하였다. 연 매출이 100억 이상이 되었을 때 그
약제에 대하여 메가 블록버스터라고 칭한다. 즉, 듀피젠트는 지난해 새롭게 메가 블록버스터 품
목 대열에 합류하였다. 이렇게 듀피젠트는 폭발적인 매출 성장세를 보이며 사노피의 주요 성장 동력으로 꼽히고 있다.
이러한 폭발적 성장의 가장 큰 배경은 바로 듀피젠트가 경쟁 제품과 비교하였을 때 다양한 적응 증을 확보한 약제라는 점이다. 현재 국내에서 허가된 적응증으로는 아토피피부염, 중증 호산구
성 천식 또는 경구 코르티코스테로이드 의존성의 중증 천식, 비용종을 동반한 만성 비부비동염, 결절성 가려움 발진이 있다. 국내 외 다른 나라에서 추가로 승인된 적응증으로는 호산구성 식도
염이 있다. 2022년 FDA에서 허가 승인하였으며, 호산구성 식도염 역시 제2형 염증 반응으로 인해 식도의 벽이 호산구로 채워져 식도가 손상되는 만성 염증성 질환이다. 기존 약물 요법으로 는 스테로이드 치료제가 유일한 상황이었기 때문에, 듀피젠트는 호산구성 식도염 환자들의 신약 에 대한 미충족 수요를 충족시켜 주었다. 이렇게 듀피젠트는 제2형 염증성 질환 치료제 시장의 으뜸으로 자리매김하고 있다.
최근 듀피젠트는 만성 폐쇄성 폐질환(COPD)이라는 새로운 영역에서 최초의 생물학적 제제라 는 타이틀을 획득할 것으로 기대된다. 아직 COPD 환자를 위한 생물학적 제제가 없는 상황에서, 지난 2024년 7월 유럽 식품의약청(EMA)에서 듀피젠트를 호산구 증가를 동반하는 조절되지 않
는 COPD 성인 환자의 유지 치료제로 승인하였다. 또한 지난 9월, 듀피젠트는 미국 식품의약국 (FDA)으로부터 생물학적 제제로는 최초로 COPD 적응증을 승인받는 쾌거를 이루었다. 전문가
들은 듀피젠트가 COPD에 대해서 적응증을 확대할 경우, 연간 35억 달러에서 최대 200억 달러 의 매출 상승을 보일 것으로 전망하고 있다. 나아가 일각에서는 듀피젠트가 COPD 치료제 시장
역시도 장악할 것으로 보기도 한다. 유럽과 미국 허가 당국에서의 잇따른 승인을 고려하였을 때
우리나라에서도 충분히 듀피젠트의 COPD 적응증 확대를 긍정적으로 검토할 수 있을 것이다.
듀피젠트가 다음번에는 어떠한 새로운 질환에서 적응증을 확대하여 시장에서의 입지를 공고히 하며 폭발적인 성장을 이룰지 그 귀추가 주목된다.
구영회. (2023.04.15). 듀피젠트, 호산구성 식도염 기반 매출 또다시 ‘업그레이드’. 팜뉴스. Retrieved from https://www. pharmnews.com/news/articleView.html?idxno=221859
권혁진.(2024.07.09). 셀트리온, 졸레어 시밀러 ‘옴리클로’ 영국 품목허가…”퍼스트무버 지위 확보”. 약업신문. Retrieved from. http://m.yakup.com/news/index.html?mode=view&nid=296619
김경교 . (2019.05.18). “엘리퀴스 봤지?” 신약 물질특허가 중요한 이유. 히트뉴스. Retrived from https://www. hkn24.com/news/articleView.html?idxno=336222
김순호. (2024.05.07). 셀트리온, 제넨텍 특허 공세 방어 … ‘졸레어’ 시밀러 상용화 청신호. 헬스코리아. Retrieved from https://www.hkn24.com/news/articleView.html?idxno=337593
김진구. (2023.06.02). 노바티스, 셀트리온에 ‘졸레어 시밀러’ 특허소송 역공. 데일리팜. Retrieved from https:// www.dailypharm.com/Users/News/NewsView.html?ID=300862
김찬혁. (2024.02.28). 듀피젠트, 근본치료 부족하던 ‘결절성 양진’ 적응증 확보. 청년의사. Retrieved from https:// www.docdocdoc.co.kr/news/articleView.html?idxno=3014825
김찬혁. (2024.08.09). 사노피 ‘듀피젠트’, 96주 장기 천식 치료 효과 입증. 청년의사. Retrived from http://m. yakup.com/news/index.html?mode=view&nid=248864
대웅제약. (2022). [제약산업 용어 상식] 바이오시밀러. Retrieved from https://newsroom.daewoong.co.kr/ archives/13431
문성호. (2024.02.22). 듀피젠트 마침내 RSA 재계약…경쟁약 급여 진입이 변수. 메디컬타임즈. Retrieved from https://www.medicaltimes.com/Main/News/NewsView.html?ID=1157547
문성호. (2024.06.10). 뛰는 자 위에 나는 자? 듀피젠트 처방 경쟁력 커질 듯. 메디컬타임즈. Retrieved from https:// www.medicaltimes.com/Main/News/NewsView.html?ID=1159144
보건신문. (2024.09.23). 폐 질환과 천식 치료제 관련 새로운 연구 발표. 보건신문. http://www.bosa.co.kr/news/ articleView.html?idxno=2223457
서일. (2021.12.23). 노바티스, ‘리겔리주맙vs졸레어’ CSU 3상 “개선 실패”. 바이오스펙테이터. Retrived from http://m.biospectator.com/view/news_view.php?varAtcId=15068
식품의약품안전처. (2020). 동등생물의약품(바이오시밀러) 설명서- 의료전문가용 -. 식품의약품안전처. (2021). 동등생물의약품 평가 가이드라인.
연구개발특구진흥재단. (2021). 바이오시밀러 동향 Issue Report.
의약품안전나라. (2024.03.07).
졸레어프리필드시린지주300(오말리주맙). Retrieved from https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202400492aupdate Ts2024-07-28%2022:45:26.0b
의약품안전나라. (2024.06.24).옴리클로프리필드시린지주(오말리주맙). Retrieved from. https://nedrug. mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202401521aupdateTs2024-08-04%20 08:11:27.399075b
이용. (2024.09.02). 셀트리온제약, 신규 바이오시밀러 3종 국내 판매 개시. 매일 일보. Retrieved from https://www.m-i.kr/news/articleView.html?idxno=1155335
이충만. (2024.02.06). 알레르기 치료제 ‘졸레어’ 특허만료 앞두고 시밀러 경쟁 가시화. 헬스코리아. Retrived from https://www.hkn24.com/news/articleView.html?idxno=336222
주경준. (2024.02.02). 듀피젠트, 100억$↑ 메가블럭버스터 등록...올해 세번째. 뉴스더보이스헬스케어. Retrieved from https://www.newsthevoice.com/news/articleView.html?idxno=36518
지용준. (2022.02.17). 4조원 대어 ‘졸레어’ 시밀러 개발 각축...퍼스트무버는. 데일리팜. Retrived from https:// www.dailypharm.com/Users/News/NewsView.html?ID=285387
최성훈. (2024.07.18). 듀피젠트, 내달부터 영유아 아토피 치료서도 급여 적용. 메디파나. Retrieved from https:// www.medipana.com/medician/view.php?page=13&sch_menu=2&news_idx=329047
최성훈. (2024.08.05). 여전히 매서운 ‘듀피젠트’…COPD로 하반기 매출 확장 주목. 메디파나. Retrieved from https://www.medipana.com/article/view.php?news_idx=329736
한국바이오협회. (2023). 글로벌 바이오시밀러 시장 현황 및 매출 전망.
한국바이오협회. (2024.07.02). 미국 FDA, 2024년 상반기까지 총 56개 바이오시밀러 허가. https://www.koreabio. org/board/board.php?bo_table=report&bcate=b:0;&pg=2&idx=389
5.1 치료제 매출 분석
5.2 회사별 호흡기 질환 파이프라인
5.3 발전 방향
김지윤 jeeyoon78@gmail.com 김소연 ksyeonssy@gmail.com
졸레어
졸레어는 중증 천식 치료제 중 최초 허가 받은 생물학적 제제로, 알레르기성 천식, 만성 특발성
두드러기, 비용종을 동반한 만성 비부비동염의 적응증이 있는 약물이다. [그림 41]은 노바티스 (Novartis)에서 제공한 US 제외 분기별 매출 자료이다. 2023년 1분기부터 2024년 2분기까지
의 매출을 나타냈으며 점점 증가하는 추세를 볼 수 있다. 구체적으로는, 2023년 2분기에 비해 18.0% 증가하였다. 2022년 전체 매출은 USD 1,365 million이었다.

[그림 41] 졸레어 비 US 분기별 매출
로슈 제넨텍(Roche Genentech)에서 제공한 US 매출 자료에 따르면, 2022년은 USD 2,208 million, 2023년은 USD 2,208 million을 기록했다. US에서의 매출이 비US보다 약 1.5배 이상 높음을 알 수 있다. 두 매출 자료를 합산하여 전체 매출 분석을 해보았을 때 졸레어 는 2022년 USD 3,573 million, 2023년 USD 3,639 million임을 알 수 있다.
소아 및 성인의 아나필락시스
등의 알레르기 반응을 감소시키는 적응증에 대해 FDA 승인 받았다 한편 졸레어의 물질 및 제
형 특허 만료에 따라 셀트리온은 바이오시밀러 CT-P39 를 개발하여 2023 년부터 EMA, 식약 처 , FDA 에 품목 허가를 신청했으며 EMA 로부터 품목 허가를 승인받았다 .
듀피젠트는 알레르기성 천식, 아토피 피부염, 비용종을 동반한 만성 비부비동염, 결절성 가려 움 발진 등 매우 다양한 적응증이 있는 약물이다. [그림 42]는 사노피(Sanofi)에서 제공한 전체
분기별 매출 자료이다. 2023년 1분기부터 2024년 2분기까지의 매출을 나타냈으며 대체로 증 가하는 추세를 볼 수 있다. 구체적으로는, 2023년 2분기에 비해 28.9% 증가하였다. 연도별 매 출은 2022년 EUR 8,293 million, 2023년 EUR 10,715 million이다. USD로 환산하자면 (USD=EUR*1.11) 2022년 USD 9,205.23 million, 2023년 USD 11,893.65 million이 다. [그림 42] 듀 피젠트 전체 분기별 매출

듀피젠트는 2023년 8월 만성 폐쇄성 폐질환(COPD) 적응증에 대해 EMA에 품목 허가 신청을 하여 승인 권고를 받았으며, 2024년 2월 FDA에 품목 허가 신청을 하여 심사 연장을 받은 상태
테즈파이어
테즈파이어는 12세 이상 중증 천식 적응증이 있는 약물로, 2021년 12월 최초 FDA 허가 승인 을 받은 신약이다. [그림 43]은 암젠(Amgen)에서 제공한 전체 분기별 매출 자료이다. 2023년 1분기부터 2024년 2분기까지의 매출을 나타냈으며 대체로 증가하는 추세를 볼 수 있다. 구체적
으로는, 2023년 2분기에 비해 75.9% 증가하였다. 연도별 매출은 2022년 USD 170 million, 2023년 USD 567 million이다.

[그림 43] 테즈파이어 전체 분기별 매출
테즈파이어는 2022년 9월 EMA, 2023년 6월 MHRA 그리고 2023년 12월 식약처의 허가 승인을 받았다. 또한 2023년 2월 프리필드 펜 제형을 추가 허가 받아 환자가 스스로 투약이 가 능하도록 하였다. 두 요인으로 인해 2022년 매출보다 2023년 233.5% 증가했다고 분석할 수 있다. 테즈파이어는 다른 치료제들과 차별화된 기전의 약물이며, 환자 바이오마커에 무관하게 사용할 수 있다는 점에서 각광받는 신약이다. 또한 현재 COPD 적응증 확보를 위한 임상 3상을 계획 중에 있다. 이에 앞으로의 매출 상승이 기대되는 바이다.


졸레어, 듀피젠트, 테즈파이어 매출 비교






[그림 44] 졸레어, 듀피젠트, 테즈파이어 매출 비교
[그림 44]는 졸레어, 듀피젠트, 테즈파이어의 2022년, 2023년 매출을 비교한 결과이다. 세 약 모두 증가하는 양상을 보였으며 가장 큰 증가폭을 보인 것은 테즈파이어다. 이는 테즈파이어 가 잠재력이 있는 신약이며 EMA 등 추가적인 품목 허가에 의한 것으로 예상된다. 가장 높은 매
출을 나타낸 것은 듀피젠트이며 가장 많은 적응증을 가졌기 때문이라 생각된다.
누칼라
누칼라(Nucala)는 IL-5 길항제 단일클론항체로, 중증 천식 치료제이다. 비용종 동반 만성
비부비동염, 다발혈관염을 동반한 호산구성 육아종증(EGPA), 과호산구성 증후군(HES) 등의
추가 적응증을 갖고 있다.
다음의 표 와 그래프 는 2022년부터 현재까지의 매출을 분기별,
[ 표 56] 누칼라 분기별 매출

pipeline highlight
2023 H2 anticipated news flow
2023 Q1
2024 anticipated news flow
2023 H2 anticipated news flow
2023
Q2
2024 H2 anticipated news flow
Pipeline highlight
2023 H2 anticipated news flow
2023
Q3
2024 H2 anticipated news flow
Trials (Indication, Presentation) Event
Severe asthma
Nasal polyposis
Severe asthma
Nasal polyposis
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Chronic rhinosinusitis with nasal polyps
Severe asthma
Chronic rhinosinusitis with nasal polyps
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Chronic rhinosinusitis with nasal polyps
Chronic rhinosinusitis with nasal polyps
Severe asthma
Chronic rhinosinusitis with nasal polyps
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Regulatory acceptance (CN)
Regulatory submission (CN, JP)
Regulatory decision (CN)
Regulatory decision (JP)
Phase III data readout
Regulatory submission (US, EU, CN, JP)
Regulatory submission (CN, JP)
Regulatory decision (CN)
Regulatory decision (JP)
Phase III data readout
Regulatory submission (US)
Regulatory acceptance (JP)
Regulatory submission (CN)
Regulatory decision (CN)
Regulatory decision (JP)
Phase III data readout
Regulatory submission (US)
(이어서)
Trials (Indication, Presentation) Event
pipeline highlight Severe eosinophilic asthma
2023 H2 anticipated news flow
2024 H2 anticipated news flow
2023 Q4
2025 anticipated news flow
Chronic rhinosinusitis with nasal polyps
Chronic rhinosinusitis with nasal polyps
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Chronic rhinosinusitis with nasal polyps
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Chronic rhinosinusitis with nasal polyps
2024 H2 anticipated news flow
2024 Q1
2025 anticipated news flow
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Chronic rhinosinusitis with nasal polyps
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Chronic rhinosinusitis with nasal polyps
2024 H2 anticipated news flow
2024 Q2
2025 anticipated news flow
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Chronic rhinosinusitis with nasal polyps
MATINEE (chronic obstructive pulmonary disease)
MATINEE (chronic obstructive pulmonary disease)
Regulatory approval (CN)
Regulatory submission (CN)
Regulatory decision (JP)
Phase III data readout
Regulatory submission (US)
Regulatory decision (CN)
Regulatory decision (US)
Regulatory submission (CN, EU)
Regulatory decision (JP)
Phase III data readout
Regulatory submission (US)
Regulatory decision (CN)
Regulatory decision (US)
Regulatory submission (CN, EU)
Regulatory decision (JP)
Phase III data readout
Regulatory submission (US)
Regulatory decision (CN)
Regulatory decision (US)
Regulatory submission (CN, EU)
(1)2023년 1분기
2023년 1분기의 매출 성장은 중증 호산구성 천식에 대한 환자 수요와 현재 출시 중인 새로운
적응증에 대한 수요를 반영했다. 그러나 이러한 성장은 미국에서 재고 고갈과 이전 분기의 불리
한 RAR(Regulatory Asset Ratio) 조정의 영향으로 부분적 상쇄되었다.
(2)2023년 2분기
2023년 2분기 모든 지역에서의 성장은 중증 호산구성 천식에 대한 환자 수요와 지속적인 출시 가 있는 새로운 적응증에 대한 수요를 반영했다. YTD(year to date) 성장률은 23년 1분기 미 국 재고 소진과 전분기의 불리한 반품 및 리베이트(RAR) 조정의 영향으로 인해 약간 낮아졌다.
(3) 2023년 3분기 2023년 3분기의 모든 지역에서의 성장은 중증 호산구성 천식에 대한 환자 수요와 지속적인 출시가 진행중인 새로운
신규 환자 증가로 인한 미국
강세로 인해 2023년 상반기부터 분기 성장이 가속화되었다.
(4) 2023년 4분기
2023년 전체 및 4분기 동안 모든 지역에서 지속적인 강력한 성장은 중증 호산구성 천식에 대 한 높은 환자 수요와 추가로 새로운 적응증의 매출 증가 및 성장 기여를 반영했다. 2023년 4분 기 성장은 신규 환자 시작 증가와 채널 재고 구축으로 인한 미국 실적 개선으로 가속화되었다.
(5) 2024년 1분기
2024년 1분기의 매출 성장은 유럽 및 해외 지역에서의 호조에 힘입어 이루어졌으며, 이는 호 산구성 질환 치료에 대한 환자 수요 증가를 반영하였다.
(6) 2024 2분기
2024년 2분기의 매출 성장은 모든 지역에 걸쳐 전 세계적으로 강력한 성과에 의해 주도되었 으며, 이는 호산구성 질환을 해결하는 치료법에 대한 환자 수요 증가를 반영했다.
파센라(Fasenra)는 IL-5 Receptor의 α소단위에 결합하는 인간화 단일클론 항체로 중증 호
산구성 천식 치료의 추가유지요법에 사용되는 생물학적 제제이다. 다음의 표 와 그래프 는 2022년부터 현재까지의 매출을 분기별,나라별로
[표 58] 파센라 분기별 매출

아래의 표는 2023년부터 2024년 2분기까지 매출에 영향을 준 임상과 결과를 정리한 것이다.
[표 59] 파센라 매출에 영향을 준 임상과 결과
event
2023 Q1
2023 Q2
2023 Q3
2024 Q1
driver and commentary
Phase III trial read-out MIRACLE MIRACLE을 통한 연간 천식 악화율이 통계적으로 유의하게 감 소(1차 평가변수 충족)
Phase III trial read-out TATE ‘12세 이상 → 6세 이상' 안전성 및 내약성 확대 (1차 평가변수 충족)
Phase III trial discontinued FJORD FJORD의 부정적 결과로 중단
Phase III trial read-out MANDARA MANDARA 임상 3상의 긍정적 결과
presentation: ERS SHAMAL SHAMAL의 긍정적 결과 (2023년 9월)
presentation: ERS MIRACLE MIRACLE 임상 3상의 긍정적 결과 → regulatory submission(CN) (2023년 9월) → 승인 결정 예정 (2024년 하반기)
Label expansion US 12세 이상 → 6세 이상 확대 (TATE, 2024년 4월)
Publication(Respiratory Medicine) MIRACLE MIRACLE 임상 3상의 아시아 지역 긍정적 결과 (2024년 4월
(1)2023년 1분기
전 세계적으로 주요 시장에서 중증 호산구성 천식 시장의 선두자리를 계속하여 유지하고 있고,
IL-5 53에서 선두를 달리고 있다. 미국에서는 강력한 기본 수요 성장, 재고 문제로 인해 이번 분 기에서 부분적으로 상쇄되었다. 신흥시장(경제성장 및 산업화 과정에 있는 사회의 국가) 에서는 출시 가속화로 인해 큰 성장을 하였다.
(2)2023년 2분기
전 세계적으로 주요 시장에서 중증 호산구성 천식 시장 점유율 1위를 유지하고 있다. 미국에서 는 성장하는 시장에서 점유율을 유지하여 판매량이 증가하였다. 신흥시장의 경우는 저번 분기와 동일하게 대규모 성장을 유지했다. 중증천식
(3)2023년 3분기
미국은 호산구성 천식에 대한 리더십 확대 및 성장 시장에서 총 점유율 유지로 두 자리 수의 판
매량 증가로 이어졌으며 시장 가격 차이로 부분적으로 상쇄되었다. 신흥시장의 경우는 저번 분
기와 동일하고, 유럽의 경우에는 중증 호산구성 천식에 대한 시장이 확대 되었으나, 강력한 판매
량 증가로 부분적으로 가격이 상쇄되었다.
(4)2023년 4분기
미국은 성장하는 시장에서의 점유율 유지로 강력한 물량 성장으로 이어졌고, 신흥 시장의 경우
주요 시장에서의 출시 가속화에 따라 지속적으로 수요가 증가하고 있다.
(5)2024년 1분기
전 세계적으로 주요 시장에서 IL-5 클래스의
지속하고 있다. 미국에서는 성장하는 시장에서 점유율을 유지하고 있고, 신흥시장에서는 주요 시장에서의 출시 가속화에 따
른 지속적인 수요를 보이고 있다. 유럽은 중증 호산구성 천식 분야에서 시장 점유율을 확대하고 있다.
(6)2024년 2분기
전 세계 주요 시장에서 IL-5 클래스의 천식 시장 점유율을 지속하고 있다. 미국에서는 성장하
는 중증 천식 생물학적 제제 시장의 점유율을 유지하고 있고, 신흥시장에서는 주요 시장에서의
출시가 가속화되어 지속적으로 수요가 증가하고 있다.
Novartis. (2023). Novartis Q1 2023 Condensed Financial Report. Retrieved from https://www.novartis.com/investors/financial-data/quarterly-results#tabarchive-17056
Novartis. (2023). Novartis Q2 2023 Condensed Financial Report. Retrieved from https://www.novartis.com/investors/financial-data/quarterly-results#tabarchive-17056
Novartis. (2023). Novartis Q3 2023 Condensed Financial Report. Retrieved from https://www.novartis.com/investors/financial-data/quarterly-results#tabq3-2023-17051
Novartis. (2023). Novartis Q4 2023 Condensed Financial Report. Retrieved from https://www.novartis.com/investors/financial-data/quarterly-results#tabannual-resultsand-q4-2023-17046
Novartis. (2024). Novartis Q1 2024 Condensed Financial Report. Retrieved from https://www.novartis.com/investors/financial-data/quarterly-results#tabq1-2024-17041
Novartis. (2024). Novartis Q2 2024 Condensed Financial Report. Retrieved from https://www.novartis.com/investors/financial-data/quarterly-results#tabq2-2024-17036
Roche. (2023). Finance Report 2023. Retrieved from https://www.roche.com/investors/annualreport23
Roche. (2022). Finance Report 2022. Retrieved from https://www.roche.com/investors/annualreport22 이한기. (2024.02.20). 美 FDA, 졸레어 식품 알레르기 적응증 승인. 의약뉴스. Retrieved from https://www.newsmp.com/news/articleView.html?idxno=239442
-듀피젠트
Sanofi. (2023). Sanofi Q1 2023 Report: Strong Growth in Dupixent® (dupilumab) Sales and Business EPS. Retrieved from https://www.sanofi.com/en/media-room/press-releas es/2023/2023-04-27-05-30-00-2655840
Sanofi. (2023). Third quarter 2023 Results. Retrieved from https://www.sanofi.com/en/investors/financial-results-and-events/financial-results/q3results-2023
Sanofi. (2023). Sanofi Q4: Exploring Sanofi’s Q4 2023 Sales: Dupixent® (dupilumab)’s Leading Growth. Retrieved from https://www.sanofi.com/en/media-room/press-releas es/2024/2024-02-01-06-30-00-2821667
Sanofi. (2024). Sanofi Q1: Press Release: Sanofi Q1: robust 7% sales growth driven by launches, underpins full-year guidance. Retrieved from https://www.sanofi.com/en/mediaroom/press-releases/2024/2024-04-25-05-30-00-2869276
Sanofi. (2024). Sanofi Q2: strong performance with 10% sales growth; 2024 guidance upgraded. Retrieved from https://www.sanofi.com/en/media-room/press-releas es/2024/2024-07-25-05-30-00-2918503
구영회. (2024.06.04). ‘듀피젠트’ COPD 적응증 관련 미국과 유럽서 희비교차. 팜뉴스. Retrieved from https://www.pharmnews.com/news/articleView.html?idxno=245185
Nick Paul Taylor. (2023). Amgen, AstraZeneca focus on asthmatic punk rocker to show how Tezspire can unleash lust for life. Retrieved from https://www.fiercepharma.com/marketing/cdc-foundation-revamps-contagiousconversations-podcast-narrative-focused-format
Amgen. (2024). AMGEN REPORTS FIRST QUARTER 2024 FINANCIAL RESULTS. Retrieved from https://www.amgen.com/newsroom/press-releases/2024/05/amgen-reports-first-quarter2024-financial-results
Amgen. (2024). AMGEN REPORTS SECOND QUARTER 2024 FINANCIAL RESULTS. Retrieved from https://www.amgen.com/newsroom/press-releases/2024/08/amgen-reports-secondquarter-2024-financial-results
Kevin Dunleavy. (2024.05.20). Despite midstage trial miss, Amgen and AstraZeneca see promise for Tezspire in COPD. FIERCE Pharma. Retrieved from https://www.fiercepharma.com/pharma/amgen-astrazeneca-trial-demonstrates-tezspireseffectiveness-copd
5.2 회사별 호흡기 질환 파이프라인
노바티스
김주연 kjy57103@gmail.com
이승연 itcsrh1310@gmail.com
이지원 ezy7829@gmail.com
신지혜 shinjihye603@gmail.com
윤시원 seaone0228@gmail.com
[표 60] 노바티스 파이프라인 - 호흡기계 약물
성분명 임상단계 작용기전 적응증
CMK389 임상 2상
LTP001 임상 2상
Indacaterol Acetate
0.173mg + mometasone furoate
0.080mg
임상 2상 (소아에 대하여)
IL-18 inhibitor 폐 사르코이드증 아토피 피부염
SMURF1 inhibitor
특발성 폐섬유증
폐동맥 고혈압
지속성 β2 효능약(LABA) + 흡입 코르티코스테로이드 (ICS) 천식
Ligelizumab 임상 3상 IgE inhibitor food allergy
[그림 47] 노바티스 파이프라인

노바티스(Novartis)는 글로벌 제약 시장에서 강력한 입지를 가지고 있으며, 현재 노바티스에서 집중하고 있는 분야는 심혈관, 신장 및 대사 (CRM: Cardiovascular, Renal, Metabolism), 면역학 (Immunology), 신경과학 (Neuroscience), 종양학 (Oncology)이다. 호흡기계 치료 제 전략으로는 천식, 특발성 폐섬유증(IPF), 폐 사르코이드증 등 만성적이고 난치성 질환을 표
적으로 삼은 다양한 약물 파이프라인을 보유하고 있다. 이러한 전략은 회사의 혁신적인 연구개 발(R&D) 능력과 치료제 시장에서 리더십을 강화하는 데 초점을 맞추고 있다.
1. 노바티스의 호흡기계 약물 파이프라인
노바티스는 호흡기계 질환을 타겟으로 한 다양한 약물을 개발 중이며, 특히 다음과 같은 약물
들이 주목받고 있다.
1) CMK389 (폐 사르코이드증)
폐 사르코이드증은 전신 염증 질환으로, 현재 치료 옵션이 제한적이다. 노바티스의 CMK389는 이러한 치료 공백을 메우기 위해 개발되고 있는 약물로, 염증을 억제하고 폐 기능을 개선하는 것
을 목표로 한다. CMK389는 IL-18 inhibitor로, 기존 치료제의 한계를 넘어설 수 있는 잠재력
을 가지고 있다. 현재 폐 사르코이드증에서의 효능과 안전성에 대한 임상 2상(NCT04064242)
이 진행 중이며, 추가로 아토피 피부염에서의 효능과 안전성에 대한 임상(NCT04836858)이 완료되었다.
2) LTP001 (특발성 폐섬유증)
특발성 폐섬유증(IPF)은 진행성 폐질환으로, 환자의 예후가 매우 불량하다. 또한, 현재 완벽한 치료제가 없는 상황이다. LTP001은 이러한 질환을 타겟으로 한 SMURF1 inhibitor이며, 질 병의 진행을 억제하고 환자의 생존률을 개선하는 것을 목표로 한다. 이 약물은 IPF 환자에게 새 로운 희망을 제시할 수 있는 가능성을 가지고 있다. 현재 IPF에서의 효능과 안전성에 대한 임 상 2상(NCT05497284)이 진행 중이며, 폐동맥 고혈압에서의 효능과 안전성에 대한 임상 2상 (NCT05764265)이 진행 중이다.
3) Atectura (천식)
Atectura는 천식 치료제로, 기존 치료법으로 제어되지 않는 천식환자를 대상으로 개발된 combination therapy이다. Indacaterol Acetate 0.173mg과 mometasone furoate 0.080mg으로 구성된 흡입용 캡슐이다. 지속성 β2 효능약(LABA)과 흡입 코르티코스테로이 드(ICS)의 병용 요법이 적절하다고 판단되는 성인 및 만 12세이상 청소년의 1일 1회 천식 유 지치료로 허가되어 있다. 노바티스는 현재 어택트라의 소아(6-12세)에 대한 적응증 확대를 위 한 노력이 진행 중이다. 지난 2022년 완료된 PK에 관한 임상 2상(NCT04589663)에서는 Mometasone Furoate 단독과 indacaterol 병용 시에서 약동학적 특징이 유사하였다. 그리 고 현재 6-12세에서 효능과
대한 임상 2상(NCT05562466)이 진행 중이다. 어택트 라는 2027년 이후 소아로의 적응증 확대를 목표로 하고 있다.
4) Ligelizumab (IgE 억제제)
Ligelizumab은 IgE 억제제로, 졸레어(Xolair)와 유사한 기전을 가진다. 그러나 중증 천식에서
omalizumab과 placebo에 대한 우월성을 입증하지 못하였다.(NCT01716754) 다만, FcεRI 에 대한 억제는 omalizumab보다 강력하여, food allergy 치료제로 임상 3상(NCT04984876) 을 진행 중이다.
노바티스는 호흡기계
1) 환자 중심의 혁신
흡기계 질환은 전 세계적으로 환자 수가 많고, 삶의 질에 큰 영향을 미치기 때문에 이 분야에서의 혁신은 매우 중요하다. CMK389와 LTP001 같은 약물 개발은 이러한 전략을 잘 반영하고 있다.
2) 차별화된 기전과 치료 접근 노바티스는 기존 치료제의 한계를 넘어서는 차별화된 기전의 약물 개발에 주력하고 있다.
Ligelizumab과 같은 IgE 억제제는 기존의 졸레어를 능가하는 성능을 목표로 하여 개발을 시작 하였고 천식치료 효능 입증은 실패하였으나,
R&D 투자와 파트너십 강화
노바티스는 R&D에 대한 지속적 투자를 통해 호흡기계 질환에 특화된 신약을 개발하고 있다. 특히, 특발성 폐섬유증(IPF)과 폐 고혈압과 같은 희귀 호흡기 질환에 집중함으로써 시장에서의
독점적 입지를 강화하고 있다. 이러한 희귀질환 치료제는 시장에서의 경쟁이 상대적으로 적고, 환자들에게 필수적인 치료 수단을 제공해 높은 수익성을 기대할 수 있다. 희귀질환은 환자 수가
적어 제약사가 진입을 꺼릴 수 있는 영역이다. 하지만 성공적인 신약 개발 시 경쟁이 적고, 혁신
적인 치료로 환자들의 생명을 좌우할 수 있어 독보적인 위치를 확보할 수 있다. 이는 회사의 브 랜드 가치를 높이고, 장기적 수익성을 강화하는 데 중요한 역할을 한다.
노바티스의 호흡기계 질환 치료제 파이프라인은 환자 중심의 혁신, 차별화된 기전, 그리고 지속 적인 R&D 투자에 기반하고 있다. 이는 회사가 장기적으로 호흡기계 질환 치료에서 글로벌
입지를 공고히
질환 치료의 미래를 크게 변화시킬 잠재력을 가지고 있다.
1. 사노피의 호흡기계 약물 파이프라인
[표 61] 사노피의 호흡기계 약물 파이프라인
성분명 물질 기전 목표적응증 개발 단계
amlitelimab 항체 항 OX40L 항 체
중등도, 중증 천식 (moderate to severe asthma)
임상 2상 비포낭성 기관지 섬유증 (Non-cystic Fibrosis Bronchiectasis)
itepekimab 항체 항 IL33 항체 만성폐쇄성폐질환 (COPD)
rilzabrutinib 소분자
lunsekimig
BTK inhibitor (Bruton’s 티 로신 인산화 효소억제제)
항체 항 IL13/TSLP 항체
중등도, 중증 천식 (moderate to severe asthma)
중등도, 중증 천식 (moderate to severe asthma)
Dupilumab 항체 IL4/IL13 항체 제 2형 염증을 동반한 중등 도에서 중증 COPD
소아 천식
Rezurock 소분자 ROCK2 inhibitor
ROCK2 inhibitor 만성 폐 동종 이식 부전 (Chronic Lung Allograft Dysfunction)
임상 2상
NCT05421598
NCT06033833
임상 2상
NCT06280391
임상 3상
NCT04751487
NCT04701983
임상 2상
NCT05104892
임상 2상
NCT06102005
임상 3상
NCT04456673
EMA, FDA 허가
임상 3상
(장기 유효성 평가)
NCT03560466
임상 3상
NCT06082037
[ 그림 48] 사이토카인 매개 염증반응

베이포투스(니르세비맙)
사노피의 영유아 대상 호흡기 세포융합 바이러스(RSV) 예방 주사인 베이포투스(니르세비맙)가
24년도에 예상치를 훌쩍 뛰어넘는 매출을 올리며 블록버스터 기준인 연매출 10억 달러 이상을 거뜬히 넘어설 것으로 기대된다. 베이포투스는 소아 폐렴, 모세기관지염과 같은 RSV로 인한 하
기도 질환을 예방할 수 있는 예방 항체주사로, 첫 RSV 계절을 맞은 모든 영유아를 대상으로 투 여할 수 있도록 허가 받았다. 경쟁 제품인 아스트라제네카의 시나지스(Synagis)는 미숙아와 같
Rilzabrutinib
사노피가 24년 5월 BTK 억제제 릴자브루티닙 중증 천식 대상 임상 2상 시험에 성공했다. 릴
자브루티닙은 BTK 억제제로 사노피의 맞춤 공유결합 플랫폼이 적용돼 BTK를 선택적으로 억제
하며 그 외의 위험 요소를 줄일 수 있다. 릴자브루티닙이 허가를 받게 되면 첫번째 경구용 면역매 개질환 치료제가 된다. 사노피에 따르면 릴자브루티닙 투여구는 위약군에 비해 천식 증상 악화
발생률을 감소시켰으며 (저용량 투여군은 위약대비 25% 감소, 고용량 투여군은 위약대비 36%
감소) 임상적으로 유의미한 차이를 보였다. 또한 새로운 안전성과 내약성 문제도 확인되지 않았 으며 주목할 만한 부작용은 설사이다. 사노피는 현재 중등도
기존 약물
의 개량을 통해 다른 회사들의 뒤를 쫓는 후발주자가 아닌, 새로운 치료법 개발로 제약 산업을
이끄는 선도 주자가 되는 것을 목표로 사노피를 이끌고 있다. 이러한 “play to win” 전략을 바 탕으로 2022년부터 경쟁력 있는 first-in-class 약물에 선택 및 집중을 통한 파이프라인 강화, 외부와의 전략적인 파트너쉽 및 합병, 지속 가능성을 고려하는 ESG 기업이 되는 것을 중점적으 로 하며 회사 경영을 해오고 있다.
19년 9월 폴 허드슨 부임 이후 사노피는 “선택과 집중”으로 전략을 변경했다. 19년도에는 암, 혈액 질환, 희귀 질환, 신경계 질환 등 4개 영역을 R&D 집중 투자 분야로 선정해 당뇨병과 심
혈관 질환 연구를 중단하겠다는 R&D 개편안을 공개하면서 당뇨병 신약 에피글레나타이드를 한미약품에 재반환했다. 22년도에는 듀피젠트의 적응증 확대와 면역 질환, 항암제, mRNA 백 신 등의 파이프라인 강화에 집중했고 24년 4월부터 항암제 프로그램을 축소하고 면역학 질환, 백신과 같이 가능성이 높은 분야에 대한 투자를 가속화하며 전체 파이프라인 우선순위 재조정 을 진행했다.
또한 사노피는 조직 구조개편을 통해 R&D와 사업 개발에 자본을 집중적으로 투입하고 있다.
올해 10월 21일 사노피는 일반의약품 및 건강기능식품을 담당하는 헬스케어 사업부인 오펠라 (opella)의 지분을 매각하기 위한 협상을 시작했다고 밝혔다. 이는 사업 구조 조정을 통해 신약 과 백신 개발 투자를 강화하려는 전략이다. 폴 허드슨은 이번 매각으로 향후 혁신 의약품과
개발에 더 집중할 계획이라고 밝혔다.
3.2 외부와의 전략적인 파트너쉽 및 합병
사노피는 기존 듀피젠트의 바이오베터 제품인 듀피젠트 SC 개발을 위해 알테오젠과 파트너쉽
을 맺은 것으로 알려졌다. 듀피젠트는 사노피와 리제네론이 공동 개발한 IL-4, 13 신호전달 억
제제로 아토피 피부염, 천식, 만성 비부비동염 등의 적응증을 보유하고 있다. 최근에 COPD 치
료제로도 EMA와 FDA 승인을 받은 메가 블록버스터 의약품이다. 2030년 듀피젠트의 대부분
적응증에 대한 특허가 만료되어 다른 회사의 바이오시밀러 개발이 가능하게 되었다. 특허 만료
이후에도 시장 점유율을 유지하기 위해 사노피는 알테오젠의 하이브로자임 기술을 이용하여 바
이오베터인 듀피젠트 SC를 개발해 특허 만료에 대응할 계획이다. 고용량 듀피젠트 SC 제형은 투여 빈도를 줄여 병원 방문 횟수를 줄이고 환자 삶의 질을 개선하는데 큰 도움을 줄 것으로 예 상된다.
또한 사노피는 올해 초 미국 희귀질환 치료제 개발 기업 인히브릭스(Inhibrx)를 22억 달러에 인수했다. 이를 통해 희귀질환인 알파-1 항트립신 결핍증 파이프라인인 ‘INVRX-101’을 가져 갔다. 이번 인수를 통해 사노피의 희귀질환 분야 및 면역학 분야로의 집중을 다시 한번 확인할 수 있다.
이렇듯 사노피는 다른
사노피는 2022년 3월 스탠더드앤드푸어스(S&P) 글로벌 레이팅스가 발표한 ESG 평가에서 최
상위 지속가능경영 기업군에 선정됐다. 사노피의 “Play to Win” 전략은 다음과 같은 4가지 핵 심 분야를 토대로 하고 있다. 사노피의 ESG 기업을 향한 4가지 핵심 분야는 ▲교육 프로그램
등 의료 체계의 지속 가능성을 뒷받침하는 활동과 동시에 건강에 대한 글로벌 접근성과 경제성
보장 ▲가장 취약한 계층을 돕기 위한 혁신 ▲건강과 지구의 재연결을 통한 환자들의 의약품 접 근성 보장 ▲포용적인 직장 문화 구축과
1.
아스트라제네카(AstraZeneca)는 영국-스웨덴 다국적 제약 및 생명공학 회사로 1999년 영국
의 제약 회사 Zeneca와 스웨덴의 Astra AB가 합병하여 설립되었다. 주요 연구 분야로 심혈관 및 신장 대사 질환, 호흡기 및 면역 질환, 희귀 질환 치료제, 항암제, 백신과 면역 치료제가 있다.
Budesonide/Glycopyrronium/Formoterol (Breztri Aerosphere)
아스트라제네카는 호흡기 질환 분야에서 [표 58]와 같은 강력한 파이프라인을 보유하고 있다.
- Fasenra (Benralizumab)
인터루킨-5 수용체를 차단하여 염증 반응을 억제하여 중증 호산구성 천식을 치료하는 항체 치 료제이다. FDA에서 승인을 받아서 미국, 유럽, 일본 등에서 상용화되었다.
- Tezspire (Tezepelumab)
Thymic stromal lymphopoietin(TSLP)을 억제하는 작용기전으로 중증 천식치료제로 2021 년에 미국 FDA 승인을 받았다. 여러 알레르기성 및 염증성 호흡기 질환에도 적용 가능성을 연 구 중이다.
- Breztri Aerosphere (Budesonide/Glycopyrronium/Formoterol)
LABA/LAMA/ICS의 3가지 성분의 조합으로 염증을 억제하고 기관지 확장을 돕는다. 만성폐
쇄성폐질환(COPD)에 적용되며, 현재 여러 국가에서 상용화되었다.
- Tozorakimab (MEDI3506)
인터루킨-33(IL-33) 억제제, 염증성 호흡기 질환에서 면역반응을 억제하여 COPD 및 기타 호 흡기 질환을 치료한다. 현재 임상 3상 진행 중이다.
- MEDI5884
인터루킨-4 수용체를 차단하여 면역 반응을 조절하여 천식 및 COPD를 치료하는 작용기전을 가지고 있다. 아스트라제네카의 자회사 MedImmune에서 임상을 진행 중이다. 임상 2상까지 진행되었다.
한독테바는 2013년 10월 출범한 제약사로, 이스라엘 다국적 제약사인 테바와 국내 60년 전통
의 한독이 공동 투자하여 설립한 합작회사이다. 이 합작법인은 테바의 글로벌 연구 개발 역량과
한독의 마케팅, 영업 및 유통 노하우를 결합하여 한국 시장에서 혁신적인 의약품과 제네릭 약품
의 접근성을 확대하기 위해 설립되었다. 한독테바가 2013년 한국에 진출한 지 4년 만인 2017 년에 처음으로 자체개발 신약인 싱케어를 국내 시장에 출시했다.
호흡기 관련 치료제로는 천식 및 COPD 치료제 ‘듀오레스피 스피로맥스(성분명: 부데소니드/ 포르모테롤푸마르산염수화물)’가 출시되어 있다. 듀오레스피 스피로맥스는 ICS(흡입용스테로 이드)와 LABA(지속성 베타2작용제) 복합제로 부데소니드와 포르모테롤 성분으로 이루어져 있 다. 이 복합제는 세계천식기구(GINA)가 지정한 천식치료 가이드라인에서 별도의 증상완화제 없 이 천식 관리에 사용하도록 권장되고 있으며, 3단계부터 5단계 환자 유지요법 및 완화요법에 사
용해야 하는 유일한 건조분말흡입제로 권고되고 있다.
듀오레스피 스피로맥스는 효능이 확인된 성분에 환자 편의성을 크게 높인 흡입기를 접목해 복
용 순응도를 개선한 점이 특징적이다. 흡입기 스피로맥스는 테바의 고유 기술을 활용해 환자가 흡입기 사용을 위해서 뚜껑을 여는 것만으로 정확한 용량의 약물이 장착되도록 했다. 고령 환자 나 호흡이 어려운 환자에게도 일정하게 약물 전달이 가능하다.
테바 제약(Teva Pharmaceuticals)은 1901년 이스라엘에서 설립되어 제네릭 의약품과 혁신
적인 치료제를 제공하며, 현재는 세계 최대의 제네릭 제약사 중 하나로 자리 잡았다. 초기에는 화학 물질과 의약품 유통에 중점을 두었으나,
현재 테바는 “성장으로의 전환(Pivot to Growth)” 전략을 통해 두 가지 주요 목표를 가지고 있습니다. 첫째, 지속적으로 제네릭 약품 사업을 강화하며 다양한 신제품을 출시하여 안정적인
수익원을 확보하고 있습니다. 둘째, 신경계와 면역계 질환을 중심으로 혁신 의약품 연구에 집중 하고 있습니다. 특히 주요 신약 후보군으로는 ‘아우스테도(Austedo)’, ‘아조비(Ajovy)’, 그리 고 조현병 치료용 장기지속형 주사제 ‘우제디(Uzedy)’가 있다. 이러한 신약들은 테바의 매출 성 장의 핵심으로 자리 잡고 있으며, 테바는 향후 수익 확대를 위해 이들의 글로벌 시장 확장을 준 비하고 있다.
연구 부문에서는 정신 건강, 신경 질환, 면역학 및 항암 분야에서의 혁신에 중점을 두고 있으며, 최근 인공지능(AI)과 디지털 헬스 기술을
[ 그림 49 ] 테바의 진행중인 임상 단계

3. 한독테바 파이프라인
1) TEV 248
TEV 248은 흡입형 천식 치료제 후보물질로 임상3상 진행 중이다. TEV 24는 플루티카손과 알 부타몰로 구성되어 있다. TEV 24는 ICS인 플루티카손과 SABA인 알부타몰로 구성되어 즉각적
인 증상 개선과 함께 장기적인 염증 개선이 가능하다. 이 두 성분을 건조 분말 흡입기를 통해 환
자의 기도로 전달하는 원리로 이용된다. 한편, TEV 248은 천식 악화 개선 효능을 평가하는 임
상 3상을 진행 중이다. 이에 대한 결과는 2026년 2분기에 확인될 예정이다. TEV 248의 임상
운영, 진행 및 관리는 임상개발 기업 런치 테라퓨틱스(Launch Therapeutics)가 주도한다. 테
바는 이후 과정인 미국 내 제조, 허가, 상업화를 맡는다.
2) Biosimilar to Xolair 테바 제약은 졸레어의 바이오시밀러인 ‘TEV-45779’의 개발을 진행 중이다. 현재 TEV45779는 만성 특발성 두드러기(Chronic Idiopathic Urticaria, CIU) 환자를 대상으로 임상 3 상 단계에 있으며, 졸레어와의 비교 연구를 통해 효과와 안전성을 검증하고 있다. 이 연구에서는 TEV-45779와 원조 의약품인 졸레어(150mg 및 300mg)를 동일 용량으로 투여해 효능과 생
물학적 반응을 측정하고 있다.
졸레어 바이오시밀러는 기존 졸레어가 제공하는 항체 기반 치료 효과를 목표로 하며, IgE를 억
제하여 두드러기 증상을 완화하는 방식으로 작용한다. 테바는 졸레어의 바이오시밀러를 통해 알
레르기성 천식 및 두드러기 치료제 시장에서 경쟁력을 강화하고, 환자들에게 더욱 경제적인 대
안을 제공하는 것을 목표로 하고 있다.
영국에 본사를 둔 다국적 제약회사 GSK(GlaxoSmithKline)은 호흡기 치료제 시장을 이끌고
있는 선두 기업이다. 1969년, GSK는 최초로 호흡기 질환의 환자가 사용할 수 있는 흡입기를 개
발해 수백만 명의 환자에게 보다 나은 호흡 환경을 조성하였다.
GSK는 현재 호흡기 분야에서 천식 및 COPD 시장 규모를 성장시키는 것에 집중하고 있다. 이
러한 목표를 달성하기 위해서 의료진에게 환자 진단을 위한 교육 프로그램을 제공하고 학회와
함께 다양한 활동들을 하는 것에 중점을 두고 있다고 본다. 호흡기 질환은
로 작용하는 것이 더 효과적이며, 다른 기관에 약효가 미칠 경우에는 부작용이
효율이 낮은 편이다. 흡입제는 폐에 직접 작용하는 만큼 부작용이
가이드라인에
가장 기본적인 치료법으로 언급되고 있으며, 실제 진료 현장에서 가장 대중적이고 중요한 치 료법으로 다뤄지고 있다.
현재 GSK는 파이프라인 대부분이 백신과 감염질환 파이프라인에 중점을 두는 방향성을 가지고 있다. 면역학 및 인간 유전학, 첨단 기술에 집중된 R&D 전략을 통해 의약품 파이프라인을 강화 하고 있다. 다른분야의 파이프라인을 강화하는 대신, 호흡계통 파이프라인은 조금 비중이 낮은 것으로 보일 수 있으나, 호흡계통, 특히 천식과 COPD 치료제는 지속적인 연구가 꾸준히 이어지
고 있다. 주요 후보 약물로는 Depemokimab, Trelegy Ellipta, Zebulon 등이 개발중에 있다.
이중 2024년 1번째 Quarter에서 phase 3에 해당하는 depemokimab이 주요 연구 생물학 적 제제이며 SWIFT-1과 SWIFT-2 임상시험에서 긍정적 결과를 보이고 있다. 이 임상시험에 서 Depemokimab은 연간 중증 천식 악화율을 54% 감소시켰다. 그러나 일부 2차 목표 (증상 완화)에서 통계적 유의성에 도달하지 못하여 아직 완전하게 임상시험이 통과되지는 못하였다. 이 약물은 IL-5 억제제로 호산구 매개 염증을 감소시킨다. 2형 염증이 있는 중증 천식 환자에게 초장기 지속형으로 작용한다. 적응증으로는 중증 천식 및 만성 비후성 부비동염이고 현재 임상 개발 상황으로는 중증 천식 환자를 대상으로 한 3상 연구 결과는 2024~2025년 발표 예정이다. 이 약물은 기존 누칼라(Nucala)와 유사한 기전이지만, 누칼라 대비 주사 빈도를 줄이고 더 긴 작 용 지속 시간을 가지는 것이 특징이다.
즉, 현재 GSK에서 개발중인 Depemokimab은 환자 편의성을 높이는 것을 목표로 하고 있다. 특히 치료 주기가 길어 환자의 삶의 질을 개선하고 의료 시스템의 부담을 줄일 수 있는 장점이 기
대된다. G SK는 depemokimab이 환자의 질병 경과를 변화시키고 장기적인 임상적 관해를 달 성할 수 있을 것으로 기대하고 있다고 보고 주력 약물로 밀고 있다.
또한 GSK는 만성 폐쇄성 폐질환(COPD), 만성 기침, 호산구성 육아종증, 만성 비염 등의 호
흡기 질환에 대한 다양한 치료제도 개발 중에 있다. 예를 들어, camlipixant라는 P2X3 억제제
는 만성 기침 치료에 대해 기대를 모으고 있으며, 2026년 출시를 목표로 하고 있다. GSK의 대
표적인 천식치료제 Mepolizumab (Nucala)의 COPD 적응증 확대에 관해서는, 2018년 미국
FDA에서 COPD 악화 예방에 효과적이라는 증거가 부족하다는 이유로 COPD 적응증 확대를 거
부하였던 이력이 있다. 임상 3상 METREX와 METREO 연구로 COPD 악화 감소 효과의 입증
을 위해 나섰으나, METREX에서는 효과를 보였으나 후속 연구인 METREO에서는 COPD 악화
개선에 효과를 보이지 못했다. 그리고 2024년 5월자로 63%의 phase transition success rate (PTSR)은 Pre-Registration을 향한 긍정적인 신호탄으로 작용하고 있고 임상과정의 막 바지로 접어들고 있다.
다가오는 GSK 파이프라인을 분석해보면, 2024년에는 depemokimab이 SWIFT-1,2와 ANCHOR-1,2 임상 3상을 완료 짓고 2025년에 regulatory decision을 목표를 하고 있다.
Nucala의 부비동염 적응증 확대와 COPD 치료 적응증 확대도 2025년에 기대되고 있는 점이 다.
이러한 파이프라인은 GSK의 핵심 치료 분야에서의 경쟁력을 강화하며, 면역학적 기전과 새로 운 흡입 기기 기술 등을 통해 호흡기 질환 치료제를 강화할 계획이라고 전망된다.
- 노바티스
식품의약품안전처 의약품안전나라. (2020.12.24). 의약품 상세정보- 어택트라. Retrieved from https:// nedrug.mfds.go.kr/searchDrug?sort=&sortOrder=false&searchYn=true&ExcelRowdata=&page=1&s earchDivision=detail&itemName=%EC%96%B4%ED%83%9D%ED%8A%B8%EB%9D%BC&itemEn gName=&entpName=&entpEngName=&ingrName1=&ingrName2=&ingrName3=&ingrEngName=&i temSeq=&stdrCodeName=&atcCodeName=&indutyClassCode=&sClassNo=&narcoticKindCode=&ca ncelCode=&etcOtcCode=&makeMaterialGb=&searchConEe=AND&eeDocData=&searchConUd=AND &udDocData=&searchConNb=AND&nbDocData=&startPermitDate=&endPermitDate=
NIH. (2017.08.11). Efficacy and Safety of QGE031versus Placebo and Omalizumab in Patients Aged 18-75 Years With Asthma. Retrieved from https://clinicaltrials.gov/study/NCT01716754
NIH. (2023.10.13). Study to Compare the Pharmacokinetics of Mometasone Furoate Alone and in Combination With Indacaterol in Patients ≥ 6 to < 12 Years Old With Asthma. Retrieved from https://clinicaltrials.gov/study/NCT04589663
NIH. (2024.02.08). A 24-week Prospective, Open-label, Multicenter, Single-arm rPMS Study in Real-world Setting for Atectura®. Retrieved from https://clinicaltrials.gov/study/NCT05217810
NIH. (2024.03.19). Efficacy and Safety of QGE031 (Ligelizumab) in Patients With Peanut Allergy. Retrieved from https://clinicaltrials.gov/study/NCT04984876
NIH. (2024.06.20). A Study to Assess the Efficacy and Safety of CMK389 in Patients With Moderate to Severe Atopic Dermatitis. Retrieved from https://clinicaltrials.gov/study/NCT04836858
NIH. (2024.07.30). Study of Efficacy, Safety and Tolerability of CMK389 in Patients With Chronic Pulmonary Sarcoidosis. Retrieved from https://clinicaltrials.gov/study/NCT04064242
NIH. (2024.09.19). A Study to Evaluate the Efficacy and Safety of QMF149 (Indacaterol Acetate/ Mometasone Furoate) Versus Budesonide in Children From 6 to Less Than 12 Years of Age With Asthma. Retrieved from https://clinicaltrials.gov/study/NCT05562466
NIH. (2024.09.19). Extension Study of Efficacy and Safety of LTP001 in Pulmonary Arterial Hypertension Participants. Retrieved from https://clinicaltrials.gov/study/NCT05764265
NIH. (2024.09.27). To Assess the Efficacy of the Investigational Products Compared to Placebo in Participants With IPF. Retrieved from https://clinicaltrials.gov/study/NCT05497284
Novartis. (2024). 2024 Q1 results presentation and transcript. Retrieved from https://www.novartis. com/investors/financial-data/quarterly-results/2024-q1-transcript
Novartis.(2024). Novartis Pipeline. Retrieved from https://www.novartis.com/researchdevelopment/novartis-pipeline
Trischler, J., Bottoli, I., Janocha, R., Heusser, C., Jaumont, X., Lowe, P., Gautier, A., Pethe, A., Woessner, R., Zerwes, H. G., & Zielen, S. (2021). Ligelizumab treatment for severe asthma: learnings from the clinical development programme. Clinical & translational immunology, 10(3), e1255. https://doi.org/10.1002/cti2.1255
- 사노피
Wang, S.-H., & Zuo, Y.-G. (2021). Thymic stromal lymphopoietin in cutaneous immunemediated diseases. Frontiers in Immunology, 12. Retrieved from https://doi.org/10.3389/ fimmu.2021.698522
정지윤. (2024.07.31). “R&D 재조정” 사노피, 임상 5건 ‘중단’..”면역학 집중” 바이오스펙테이터
Retrieved from http://m.biospectator.com/view/news_view.php?varAtcId=22636
신창민. (2022.05.19) “마음 급해진” 사노피, 성장 돌파구 3가지 전략은? 바이오스펙테이터 Retrieved from http://m.biospectator.com/view/news_view.php?varAtcId=16097
염현아. (2024.10.22) 사노피, 헬스케어 사업부 ‘오펠라’ 매각…”신약 R&D에 집중 Retrieved from https://news.nate.com/view/20241022n15201
박도영. (2024.10.29) 사노피 영유아 RSV 백신 베이포투스, 예상치 뛰어넘는 매출 달성으로 블록버스터 코앞 Retrieved from https://www.medigatenews.com/news/1738087254
유하은 (2024.05.26) 사노피, BTK 억제제 ‘릴자브루티닙’ 중증 천식 대상 임상2상 성공 Retrieved from https://www.thebionews.net/news/articleView.html?idxno=5493
Sanofi 홈페이지 (2022) Retrieved from https://www.sanofi.com/assets/countries/south-korea/ docs/news/2022/Press-2022-03-17--1-.pdf
- 아스트라제네카
Astrazeneca medicines (2024) Retrieved from https://www.astrazeneca.com/our-therapyareas/medicines.html
한국바이오협회. (2021.05.06) 아스트라제네카 기업 동향 Retrieved from https://www.bioin.or.kr/ board.do?num=307765&cmd=view&bid=industry
한국바이오협회. (2024.05.22) 아스트라제네카의 담대한 목표: 2030년 매출 800억 달러 Retrieved from https://www.bioin.or.kr/board.do?num=324980&bid=industry&cmd=view
- 한독테바
바이오스펙테이터. (2024.04.02). 테바, VC서 1.5억弗 조달..”천식치료제 3상 개발”. 바이오스펙테이터. Retrieved from http://m.biospectator.com/view/news_view.php?varAtcId=21551
- GSK
GSK Press kit 2020-2021(2020). Retrieved from https://www.kobia.kr/member_company/ data/4/1ef0caf3e9.pdf
2024년 7월, 아스트라제네카의 파센라가 국내 건강보험 급여에 등재되었. 기존 치료제로 천 식 관리가 어려웠던 국내 환자들이 보다 합리적인 가격에 효과와 편의성이 개선된 치료제를 경 험하게 되었다. 그동안 파센라는 급여적정성평가에서 여러 번 고배를 마시며 비급여 치료제에
머물러야 했으나, 이번에 결국 급여를 받게 된 것이다. 이를 통해 중증천식치료제 보급의 필요성 은 커져가지만, 파센라와 같이 특정 치료제들이 급여를 받기까지 도달하는 기간은 오래 걸린다
는 점을 확인할 수 있다.
최근 천식 알레르기 질환의 발병률은 급격히 증가하는
국내뿐만 아니라 전세계적으로 발병률이 늘고 있으나, 그에 따른 치료제 급여 방안과 문제점들은
빠르게 해결되지 못하고 있다. 먼저, 국내 중증천식의 치료현황에 따르면, 중증 천식의 초기 진단
이 정확히 이루어지지 않을 뿐더러, 이루어지더라도 잘못된 초기 치료 방법을 취하는 등 상당히
열악한 상황임을 알 수 있다. 또한, 중증 천식에 대한 인지도가 낮기 때문에 본인이 천식 환자임
을 모르거나, 천식임을 인지하여 1차 의료기관에 방문하더라도 증상에 따른 적절한 치료제가 처
방되지 않는 경우가 많다. 예를 들어, 흡입제로도 조절이 가능한 경증 단계에서부터 무분별한 경 구 스테로이드 처방이 이루어져 단기간 사용에도 부작용이 발생하는 경우가 빈번하다. 이렇게 경 구 스테로이드 의존도가 높아지게 된 이유에는 처음 흡입제가 국내 허가되고 급여될 당시 그 기 준이 매우 까다롭다보니 1차 의료기관 측에서 흡입제보다 경구 스테로이드를 더 많이 처방하게 되었기 때문이다. 이와 같은 진료 양상이 계속 이어져 결국 환자들이 피해를 받게 되었다. 이러한 잘못된 처방의 결과, 한국이 OECD 국가 중 천식 사망률과 입원율이 압도적으로 높은 통계를 보 이게 되었다. 생물학적 제제의 신속한 급여뿐만 아니라 약가인하, 허가 적응증 범위와 급여 기준 간의 차이, 그리고 산정특례 적용의 필요성도 대두되고 있다. 중증 천식은 만성 질환이므로 치료 제를 단기간 투여하거나 사용 중 중단하면 오히려 천식의 급성 악화 위험을 증가시킨다. 따라서 치료제인 생물학적 제제를 평생
하기
환자들에게 약가 인하의 필요성은 매우 크다. 그리고 급여 기준을 더 확대하여 허가 적응증 범위와의 갭을 줄여나갈 필요성도 대두되고 있다. 이에 더 많은 임상데이터를 확보하여 더 많은 환자들이 급여대상에 포함되도록 해야한다.
현재 환자 본인부담금이 30%이고, 이는 치료비용에 대한 환자 부담이 크므로 산정특례를 적
용하여 환자부담금을 10%로 줄이는 방향으로 개선시켜 나가야 한다. 천식은 한두번의 치료로
개선되는 질환이 아니라 평생 약제를 쓰며 치료해야하는 질환이다 보니 치료비용에 대한 환자 부담이 크다. 중증천식치료제들이 급여가 되어 사용되고 있다하더라도 여전히 본인 부담이 적지 않다. 산정특례가 적용되면 현 부담률보다 1/3로 크게 낮아지기 때문에, 중증천식에서 적용이
되면 보다 많은 환자들이 부담없이 치료를 받을 수 있게 될 것이다.
기존 중증 천식치료제를 사용할 시, 손상된 폐 조직을 회복시키기 어려웠었는데, 최근에 줄기
세포 치료법을 새롭게 개발하여 난치성 천식 치료제 개발 가능성을 열어줄 핵심 인자를 입증하 게되었다. 유전자 발현을 조절하는 전사 활성화 인자2 (ATF2) 단백질이 중간엽줄기세포의 치료 효과를 결정하는 핵심 인자이고, 이 줄기세포 치료제가 기존 치료제보다 기관지 염증이 절반 수 준으로 감소하는 결과를 낳으면서 난치성 중증 치료제에 새로운 패러다임을 열고 있다. 또한, 기 존 천식치료제로는 개선되지 않는 ‘호중구성 천식’에 효과를 보이는 과염증 유도를 억제하는 면 역세포군을 발견하고 이를 이용한 치료법이 제시되면서 항천식제 시장이 빠르게 확대되고 있음 을 알 수 있다.
글로벌 항천식제 시장은 앞으로 꾸준히 크게 성장할 것으로 예상되면서, 10년 안에 그 가치가 300억 달러 이상에 이를 것으로 추정된다. 효과적인 중증천식 치료법에 대한 지속적인 수요를 반영하여 볼때,2023년부터 2030년까지 약 5~7%의 연평균 성장률(CAGR)로 성장할 것으로 예상된다. Novartis, GSK, AstraZeneca, Sanofi, Regeneron 등 다양한 제약회사들의 지 속적인 연구개발(R&D) 투자와 함께 새로운 기전의 약물 및 치료법이 출시될 가능성이 높고 현 재 더 많은 후보물질들이 개발중에 있다. 특히, 인공지능(AI)과 디지털 헬스 기술의 통합이 천식 관리에 중요한 역할을 할 것으로 보인다
김민건. (2023.12.15). “한국 중증 천식 갈 길 멀었다… 모든 생물학적제제 급여로 맞춤형 치료 환경 갖춰야” https://www.pharmnews.com/news/articleView.html?idxno=236611
병원신문. (2023.06.26). 중증천식 치료 접근성 향상 위해 위험분담제(RSA) 활용 제안. Retrieved from https://www.khanews.com/news/articleView.html?idxno=224920
양영구. (2024.07.02). 파센라, 중증 호산구성 천식 유지요법 건강보험 급여. Retrieved from http://www.monews.co.kr/news/articleView.html?idxno=332989
이탁순. (2023.10.28). 듀피젠트, 영유아 중증 아토피,천식 급여확대 청신호. Retrieved from https://www. dailypharm.com/Users/News/NewsView.html?ID=305322
이현주. (2023.08.16). ‘삶의 질 개선’ 중증 천식약 누칼라, RSA 급여 등재 ‘관심’. Retrieved from http://www.hitnews.co.kr/news/articleView.html?idxno=47447
API 학회지 2024-1 Vol.4
중증천식 치료제 :
허가·임상·급여의 통합적 접근
발행 2024년 11월
제작 기획: 김수정, 박세희, 김소연, 김현지, 손채린, 임서연
디자인: 김수정, 박세희, 김주연, 신지혜, 윤시원, 이승연, 이지원, 임서연, 박소윤
주소: 06974 서울특별시 동작구 흑석로 84 약학대학 및 R&D센터
발행처: 중앙대학교 약학대학 제약산업학회 API
E-mail: caupharmapi@gmail.com
