ESD i Norge s. 34
Endoskopisk behandling ved pankreatitt s. 08
Eksokrin pankreassvikt s. 18

ESD i Norge s. 34
Endoskopisk behandling ved pankreatitt s. 08
Eksokrin pankreassvikt s. 18
Årgang 32 Informasjon fra Norsk gastroenterologisk forening Nr. 4. - desember / 2025 gastroenterologen.no


Skyrizi er indisert til behandling av voksne pasienter med moderat til alvorlig aktiv Crohns sykdom som har respondert utilstrekkelig på, har mistet respons på, eller er intolerante overfor konvensjonell behandling eller en biologisk behandling1
Den første selektive IL-23-hemmeren
godkjent for CROHNS SYKDOM1,2
allerede et ter første dose*1

etter
induksjonsfasen** 1
som vedvarer †1
‡ Godkjent av European Medicines Agency. Behandling for ulcerøs kolitt er ikke tilgjengelig for norske pasienter.
ADVANCE dobbeltblindet RCT 12 uker induksjon, Skyrizi 600 mg n=336, PBO n=175. MOTIVATE dobbeltblindet RCT 12 uker induksjon, Skyrizi 600 mg n=191, PBO n=187. FORTIFY dobbeltblindet RCT 52 uker vedlikehold, Skyrizi 360 mg n=141, PBO n=164.
*Klinisk respons uke 4: ≥60 % reduksjon i gjennomsnittlig daglig SF og/eller ≥35 % reduksjon i gjennomsnittlig daglig AP-skår, og begge ikke dårligere enn ved baseline, og/eller klinisk remisjon (ADVANCE: SKYRIZI 600 mg 46 % vs placebo 31 % [95 % KI, 6 –23] p ≤0,01); MOTIVATE: SKYRIZI 600 mg (n=191) 45 % vs placebo 32 % [95 % KI, 4–23] p≤0,05).
**Mukosaltilheling uke 12: SES-CD såroverfate delskår 0 hos pasienter med en delskår ≥1 ved baseline (ADVANCE: SKYRIZI 600 mg 21 % vs placebo 8 % [95 % KI, 8–19] p<0,001; MOTIVATE: SKYRIZI 600 mg 14 % vs placebo 4 % [95 % KI, 4–15] p≤0,01).
† Klinisk remisjon uke 12 og uke 52 (primært endepunkt): Gjennomsnittlig daglig SF ≤2,8 og ikke dårligere enn ved baseline, og gjennomsnittlig daglig APskår ≤1 og ikke dårligere enn ved baseline (Uke 12: ADVANCE: SKYRIZI 600 mg 43 % vs. placebo 22 %, [95 % KI, 14 –30] p<0,001; MOTIVATE: SKYRIZI 600 mg 35 % vs.placebo 19 %, [95 % KI, 6–24] p≤0,01; Uke 52: FORTIFY: SKYRIZI 360 mg 52 % vs. placebo 40 %, [95 % KI, 5–25] p≤0,01).
600 mg administrert ved intravenøs infusjon ved uke 0, uke 4 og uke 8, etterfulgt av 360 mg administrert ved subkutan injeksjon ved uke 12, og deretter hver 8. uke. Det bør vurderes å seponere behandlingen hos pasienter som ikke har vist tegn på terapeutisk nytte innen uke 24.
SKYRIZI viktig sikkerhetsinformasjon1
Kontraindikasjoner Klinisk relevante, aktive infeksjoner (f.eks tuberkulose), overfølsomhet overfor innholdsstoffene (se avsnitt 4.4 SmPC).
Infeksjoner
Tuberkulose
Immunisering
Prevensjon
Graviditet
Amming
Brukes med forsiktighet ved kronisk infeksjon, historikk med tilbakevendende infeksjon eller kjente risikofaktorer for infeksjon. Behandling skal ikke startes før infeksjonen er borte eller er tilstrekkelig behandlet.
Før oppstart av behandling skal pasienter utredes for tuberkuloseinfeksjon. Pasienter skal overvåkes for tegn og symptomer på aktiv tuberkulose.
Før oppstart av behandling med SKYRIZI skal det vurderes å fullføre alle relevante immuniseringer i henhold til gjeldende immuniseringsretningslinjer. Dersom en pasient har fått levende vaksiner (virale eller bakterielle) anbefales det å vente minst 4 uker før oppstart av behandling med SKYRIZI. Pasienter behandlet med SKYRIZI skal ikke få levende vaksiner under behandling og i minst 21 uker etter behandling.
Kvinner i fertil alder skal bruke en sikker prevensjonsmetode under behandling og i minst 21 uker etter behandling.
Som et forsiktighetstiltak er det anbefalt å unngå bruk under graviditet.
Det er ukjent om risankizumab blir skilt ut i morsmelk hos menneske. Tatt i betraktning fordelene av amming for barnet og fordelene av behandling for moren, må det tas en beslutning om behandlingen med risankizumab skal avsluttes/avstås fra.
Vanligste bivirkninger: (Svært vanlige ≥1/10): Øvre luftveisinfeksjoner. (Vanlige ≥1/100 til < 1/10): tineainfeksjoner, hodepine, pruritus, utslett, eksem, fatigue, reaksjoner på injeksjonsstedet.
Alvorlige bivirkninger (sjeldne ≥1/10 000 til < 1/1 000): Anafylaktiske reaksjoner.
SKYRIZI utvalgt produktinformasjon1:
Reseptgruppe C. Pakninger og priser: 1 x 600 mg (60 mg/ml) konsentrat til infusjonsvæske kr 46 384,60. 1 x 360 mg injeksjonsvæske, oppløsning i sylinderampulle kr 46 384,60. Refusjon: Dette er et avtaleprodukt besluttet innført til behandling av Crohns sykdom av Beslutningsforum fra og med 1. november 2023. Anbudsstart 1. februar 2025, del av LIS TNF BIO anbudet for 2025.2 For mer utfyllende informasjon om indikasjoner, dosering, kontraindikasjoner, forsiktighetsregler, bivirkninger, pris og finansiering, se Felleskatalogen. Referanser: 1. SKYRIZI SmPC avsnitt 4.1, 4.2, 4.3, 4.4, 4.6, 4.8 og 5.1 sist godkjent 19.06.2025. 2. TREMFYA SmPC avsnitt 4.1 og 5.1 sist godkjent 05.2025, STELARA SmPC avsnitt 4.1 og 5.1 sist godkjent 31.03.2025, OMVOH SmPC avsnitt 4.1 og 5.1 sist godkjent 12.02.2025, ILUMETRI SmPC avsnitt 4.1 og 5.1 sist godkjent 09.08.2023. 3. https://nyemetoder.no/metoder/risankizumab-skyrizi-indikasjon-iii Lesedato 25.09.2025.





Leder
Roald Flesland Havre
Medisinsk Klinikk, Seksjon for fordøyelesessykdommer, Haukeland universitetssykehus roald.flesland.havre@helse-bergen.no
Nestleder
Tone Bergene Aabrekk, Gastromedisinsk avdeling Sykehuset i Vestfold, Tønsberg tonebergene.aabrekk@siv.no
Kasserer
Vendel Kristensen
Gastromedisinsk avdeling Oslo universitetssykehus Ullevål venkri@ous-hf.no
Sekretær
Henrik Wåhlberg
Gastromedisinsk avdeling Sykehuset Østfold, Kalnes henrik.wahlberg@so-hf.no
Styremedlemmer: Kim V. Ånonsen
Henrik Wåhlberg
Hólmfríður Helgadottir
Marijn Radersma, Tone Bergene Aabrekk Vendel Kristensen
Redaktør: Umael Khan Haukeland universitetssykehus umael@hotmail.com
Redaksjonskomité: Umael Khan umael@hotmail.com
Jolanta Lorentzen jolanta.lorentzen@siv.no
Gro Nygard Riise gro.nygard.riise@helse-bergen.no
Eivind Ness-Jensen eivind.ness-jensen@ntnu.no
NGFs hjemmeside: www.legeforeningen.no/ foreningsledd/fagmed/ norsk-gastroenterologisk-forening/ Kontakt: Hólmfríður Helgadóttir hofihelgad@gmail.com
NGF-nytts hjemmeside: www.gastroenterologen.no
Materiellfrister:
1-2026: 15.02.26
2-2026: 15.05.26
3-2026: 15.09.26
4-2026: 10.11.26
Forsidebilde: Illustrasjon: Jørgen Valeur
Layout, annonsesalg og produksjon: WebPress Tlf.: 22 76 00 00 john@webpress.no www.webpress.no
5 Redaktørens hjørne
7 Lederen
Tema: Pankreas
8 Endoskopisk behandling ved pankreatitt
14 Endoskopisk ultralyd som presisjonsverktøy ved pankreaskreft – erfaringer fra en norsk populasjonsbasert studie (NORPACT-2)
18 Eksokrin pankreassvikt – nye europeiske retningslinjer
22 Pankreatitt hos barn
24 Residiverende akutte pankreatitter – Veien til organsvikt eller mulighet enes vindu?
Nytt fra fagmiljøene
30 ERCP i Norge: Hva vet vi om kvaliteten?
34 Endoskopisk submukosal disseksjon (ESD) i Norge – status, praksis og fremtid
Faste spalter og aktuelt
28 Skråblikk: Edle etterlatenskaper
40 Gastronet: Tarmtømming før koloskopi – hvordan oppnår man et best mulig resultat
42 NGF Vintermøtet 2026
44 Abstrakter NGFs årsmøte 2026
Oversikt kongresser, møter og kurs
48 NGF lørdagssymposium -26
50 Sammendrag Nasjonalt IBD symposium 2025
52 En pankreas reise til India – Om å delta i en pankreas familie
54 Vestlandske Polyppdager
56 Det 4. nordiske møtet om Barretts øsofagus og spiserørskreft i tidlig stadium (NEENA-møtet)
60 Langvarig bruk av protonpumpehemmere og risiko for nevroendokrine neoplasmer i ventrikkel
62 Gastroøsofageal reflukssykdom og øsofageal motilitet hos pasienter med type 2-diabetes operert med gastrisk bypass eller sleevegastrektomi. 5-års resultater fra Osebergstudien (1)
64 Gjennombrudd innen cøliakiforskning
66 Lifetime Achievement Award til Lars Aabakken
Endoskopisk behandling ved pankreatitt s. 08

OLYSENSE™ CAD/AI is a cloud-based suite of AI-powered tools integrated into the Olympus ecosystem, helping detect GI diseases earlier and supporting confident clinical decisions.
CADDIE™ : Precision in Colorectal Cancer Detection
CADDIE™ uses AI to help identify high-risk, hard-to-detect colorectal lesions – seamlessly integrated with Olympus imaging for sharper insights and greater confidence.

AI-Powered Polyp Detection
+7.4% absolute increase in ADR1
AI-Powered Polyp Characterization
Real-time insight for confident GI decisions.
Early Detection of High-Risk Lesions
Act sooner. Optimize outcomes.
CADU™ & SMARTIBD™ : Advancing GI Care
CADU™ highlights dysplasia, and SMARTIBD™ assesses ulcerative colitis activity –delivering a smart second pair of eyes to help standardize GI care.
Experience the future of endoscopy with OLYSENSE™ CAD/AI –where advanced imaging meets cutting-edge cloud-based AI.
www.olympus.eu/olysense
Please contact us for information or a demonstration of the system.
1] Data on file with Odin Medical Ltd., CADDIE AI Trial - NCT04325815
2] Data on file with Odin Medical Ltd, ODIN-CADU-TCP-027.
3] Data on file with Odin Medical Ltd, ODIN-IBD-TCU-001 Validation Report V1.0.1, ODIN-IBD-TCP-023 Verification Report V1.0.1, ODIN-IBD-TCP-006 Verification Report V1.0.1, ODIN-IBD-TCP-025 Verification Report V1.0.1.
For detailed information regarding instructions for use, contraindications, warnings, and precautions, please consult the device manual.
Drengsrudbekken 12, 1383 Asker | telefon 23 00 50 50 | www.olympus-europa.com
Hovedtemaet for denne utgaven av NGF nytt er pankreas. I sin retroperitoneale beskjedenhet glemmes ofte dette organet bort. Kanskje det er historiske årsaker til dette? Legen Galen beskrev pankreas bare som en pute for andre abdominale strukturer. Nå skal det sies at Galen også var kjent som gladiatorenes lege, så det er kanskje naturlig at han så for seg at man trengte litt ekstra polstring i buken. Uansett er vår forståelse av pankreas kommet en lang vei siden da, og vi runder av 2025 med en hyllest til bukspyttkjertelen.
I dette nummeret har vi forsøkt å gi noen smakebiter på hva som skjer innenfor pankreatologi med innspill fra gastroenterologer, pediatere og gastrokirurger. Det legges frem en oppsummering av de nye retningslinjene for eksokrin pankreassvikt, samt artikler om residiverende akutte pankreatitter og pankreatitter hos barn. Endoskopisk ultralyd står sterkt, og vi presenterer artikler som omhandler EUS både ved pankreatitt og malignitet. For å gi litt avbrekk fra pankreas presenterer vi også litt stoff om ERCP og ESD, i tillegg til tradisjonstro rapport fra gastronett samt skråblikk.
Utover pankreas har vi også med referat fra de ulike fagmiljøene. Norsk gastroenterologi markerte seg spesielt godt ved årets UEGW. Lars Aabakken ble feiret med en «Lifetime achievement award», og overlege Knut Lundin ved OUS/UiO sitt innlegg om immunologisk behandling av cøliaki ble også fremhevet blant de utvalgte forelesningene. I tillegg presenterte både Eivind Ness-Jensen og Jolanta Lorentzen innlegg der. Vi gratulerer alle sammen!
Vi har fått et nytt medlem, nemlig Eivind Ness-Jensen, i NGF nytt redaksjonen. Og med den gladnyheten runder redaksjonen av for i år. En riktig god jul, så ses vi til nyåret!
På vegne av redaksjonen Umael Khan




Date January 15, 2026
Time 11:30 – 12:55
Place Live at Karolinska Huddinge & Online
This educational webinar will focus on the management of genetic cholestatic liver diseases, with particular emphasis on PFIC. The session will cover diagnostic challenges, standards of care, and clinical experience with IBAT inhibition in both pediatric and adult practice. Registered participants will receive the meeting recording after the event.
We look forward to your participation!


Read more and register here

Denne utgaven av NGF-Nytt handler mest om bukspyttkjertelen. Dette fine endo- og eksokrine organet på bakre bukvegg som få har sett, men som tar hånd om fordøyelsen av marsipan og juleribbe, men kan gi opphav til mye plager og alvorlig sykdom.
Kreft i bukspyttkjertelen er en av de mest fryktede diagnoser fordi prognosen ofte er dårlig. Behandlingen har i hovedsak vært kirurgisk reseksjon i kombinasjon med kjemoterapi, eller som hos flertallet som får diagnosen, kjemoterapi alene. Til tross for forbedringer i behandlingsmetodene, er det likevel en av krefttypene der overlevelsen ikke har endret seg så mye de siste 20-30 årene.
I relasjon til behandlingen oppstår også komplikasjoner og bivirkninger der gastroenterologisk kompetanse kommer til nytte, særlig med drenasje av postoperative væskeansamlinger og endoskopiske tiltak for å drenere nekroser. Dette fagfeltet har utviklet seg mye de siste årene, og gjennom gjentatte endoskopiske prosedyrer, får mange pasienter korrigert sekveler etter kirurgi eller akutte pankreatitter på en mer effektiv, men skånsom og tryggere måte.

Norske gastroenterologer markerer seg også internasjonalt. På UEGW i Berlin i oktober fikk Lars Aabakken den ærefulle utmerkelsen «Lifetime achievement award», for sin innsats både som forsker, formidler og arbeid i ulike fagforeninger innen gastroenterologi og endoskopi i mange land. Til UEGW sendes det inn over fire tusen abstrakts, fem av disse trekkes frem som spesielt interessante. I år var en av disse professor og overlege Knut Lundin ved OUS/UiO. Han presenterte abstraktet om meget spennende immunologisk behandling av cøliaki ved hjelp av nanopartikler.
Vi nærmer oss slutten av året, og dette året har vi etablert en ny NGF-Nytt redaksjon. Redaksjonen har fått utgitt to fine nummer, og vi takker redaksjonsmedlemmene for at de har påtatt seg dette arbeidet på vegne av foreningen. Vi ønsker alle lesere av NGF-Nytt en god jul og et godt nyttår, og jeg håper å se flest mulig av dere på NGFVintermøtet på Lillehammer som i år arrangeres 29.01–31.01.2026, som er en uke tidligere enn vanlig.
Roald Flesland Havre
Leder NGF

Gunnar Qvigstad Seksjonsoverlege, Gastrolab Avd. for fordøyelses- og leversykdommer St. Olavs Hospital, Trondheim Universitetssykehus
Behandlingen av både akutt og kronisk pankreatitt er hovedsakelig konservativ og ikke-invasiv, men endoskopisk behandling har de senere år etablert seg som en stadig viktigere del av det terapeutiske arsenalet. Jeg vil i denne oversikten belyse noen problemstillinger hvor endoskopisk behandling spiller en viktig rolle. Pasientgruppen er krevende på mange måter. Klinisk totalsituasjon og den endoskopiske behandlingen ved både akutt alvorlig pankreatitt og kronisk pankreatitt kan være komplisert og pasientene anbefales håndtert i et multidisiplinært team med erfaring i vurdering og behandling av tilstandene.
I. Akutt pankreatitt
Akutt pankreatitt er i stor grad en selvbegrensende tilstand som sjelden krever invasiv intervensjon med mindre det oppstår spesifikke, alvorlige komplikasjoner. Behandlingsmålet er å støtte pasienten gjennom den inflammatoriske fasen med fokus på tidlig adekvat rehydrering med intravenøs væske, tilstrekkelig smertelindring, ernæringsstøtte og behandling av evt. organsvikt.
Gallestenspankreatitt
Ved akutt pankreatitt er endoskopisk intervensjon ikke indisert i den tidlige fasen, med ett viktig unntak: gallesteinsindusert pankreatitt som er komplisert med kolangitt eller vedvarende «betydelig» gallegangsobstruksjon. Disse pasientene bør avlastes med ERCP i løpet av 1-3 døgn avhengig av klinikk. For andre pasienter med gallesteinsutløst pankreatitt kan intervensjon utsettes til pasienten er klinisk stabil. Et viktig og ufravikelig prinsipp er at gallestenspankreatitt skal ha forbyggende invasiv behandling før utskrivelse fra sykehus, fortrinnsvis cholecystectomi, alternativt ERCP med papillotomi.
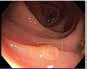
Behandling av walled off nekroser (WON) Akutt pankreatitt har et alvorlig forløp hos ca. 20 % av pasientene med utvikling av pankreatiske og/eller peripankreatiske nekroser (nekrotiserende pankreatitt) og truende multiorgan affeksjon. Disse pasientene kan ha et langtrukkent forløp med uker og måneder på sykehus. Forløpet er typisk 2-faset hvor den første uken (tidlige fase) er preget av systemisk inflammatorisk responssyndrom (SIRS) og organsvikt, etterfulgt av en sen fase (etter 1-2 uker) der komplikasjoner kan oppstå som følge av infeksjon i nekrotisk vev, kompresjon/obstruksjon av gallegang og/eller GI tractus, pseudoaneurismer, lekkasje fra pankreasgang, m.m. I den sene fase vil nekrosene gradvis innkapsles i lokulamenter kjent som
WON, og hos ca. 50 % av pasienten vil disse kreve invasiv behandling. Behandlingen av WON har gjennomgått en revolusjon de senere år hvor man nå ikke intervenerer mer enn nødvendig og så sent som mulig ut fra det kliniske bildet («step-up» strategi). Endoskopisk transmural drenasje har blitt standard behandling og første valg fremfor tradisjonell kirurgisk drenasje. Indikasjoner for endoskopisk drenasje er de samme som for kirurgisk drenasje: mistenkt infiserte nekroser (vanligste indikasjon), obstruksjon/kompresjon av GI tractus/gallegang eller manglende klinisk bedring i senforløpet («failure to thrive»). Som hovedregel må man vente til nekrosene er demarkert (synlig kapsel på CT) og man har en etablert WON, det vil si minst 3-4 uker eller senere ut i forløpet. Gode CT bilder og/eller MR bilder (helst < 1 uke gamle) er viktig for å få informasjon om størrelse og utbredelse av WON, andel nekroser i kaviteten, avstand fra ventrikkel (duodenum), pseudoaneurismer og eventuelle større blodkar (f.eks. miltkarene) i relasjon til kaviteten samt tilstedeværelse av gastriske varicer, både med tanke på risiko i relasjon til prosedyren og risiko for et mer langvarig forløp hvor det bl.a. kan bli behov for nekrosektomi. Endoskopisk drenasje bør bare gjøres dersom multidisiplinært team er tilgjengelig (endoskopør, gastrokirurg, intervensjonsradiolog og anestesiolog) både med tanke på indikasjonsstilling og håndtering av eventuelle komplikasjoner i forløpet.
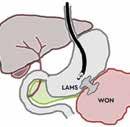
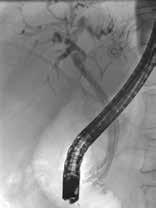
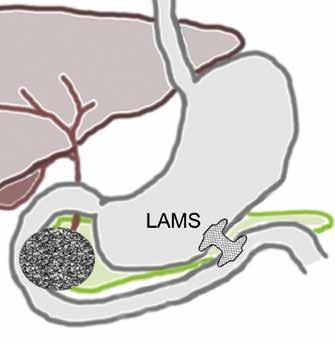
Samtidig med dreiningen mot primær endoskopisk behandling av infiserte nekroser har det blitt utviklet en helt ny type dekkede selvekspanderende metallstenter, såkalte «lumen apposing» metallstenter (LAMS). Stentene legges EUS veiledet og lager en kommunikasjon mellom ventrikkel (eventuelt tarm) og WON, en cystogastrostomi (Fig 1). Stentene har stor diameter (15-20 mm) og man oppnår på den måten god drenasje av nekrotisk materiale til ventrikkel. I tillegg får man tilgang til kaviteten med et gastroskop
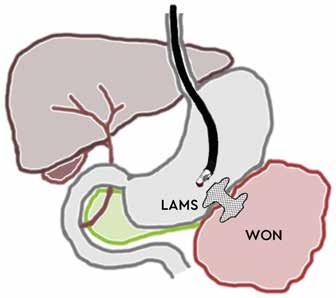
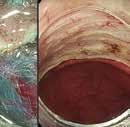
Fig 1: Illustrasjon av EUS-veiledet drenasje av WON til ventrikkel ved hjelp av «lumen apposing» selvekspanderende metall stent (LAMS).
og dermed mulighet for uthenting av nekrotisk materiale (direkte endoskopisk nekrosektomi) dersom dette skulle bli nødvendig. I motsetning til eksterne kirurgiske dren er behandling med slike stenter smertefritt for pasienten.
Endoskopisk behandling er som nevnt førstelinjebehandling og bør uansett forsøkes først dersom teknisk mulig da ekstern drenasje av væskefasen og eventuell tilførsel av luft i WON kan vanskeliggjøre senere endoskopisk behandling. Tilhelingstid er normalt 4-6 uker avhengig av størrelse, utbredelse og andel faste nekroser i kaviteten, men kan hos enkelte pasienter være betydelig lenger. Stenten (LAMS) fjernes når kaviteten er borte (Fig 2).
Pseudocyste og disconnected duct I senfasen av akutt alvorlig pankreatitt vil væskeansamlinger på grunn av ødem og lekkasje fra pankreasgang kunne kapsles inn med en fibrøs vegg i en såkalt pseudocyste. Dette er altså ikke det samme som WON som er innkapsling av nekrotisk materiale, og innholdet i en pseudocyste er tyntflytende med høyt innhold av amylase. Utviklingen av pseudocyster skjer vanligvis etter noen uker, når den akutte inflammatoriske responsen har avtatt. Mange pasienter er asymptomatiske, spesielt hvis cysten er liten, og de fleste cyster vil gå tilbake spontant. Intervensjon er kun indisert dersom cysten gir symptomer eller komplikasjoner som blødning, ruptur eller infeksjon. Symptomer skyldes ofte masseeffekt, slik som kroniske magesmerter, kvalme, oppkast eller tidlig metthetsfølelse som følge av kompresjon av nærliggende organer som duodenum eller magesekken. Pseudocyster kan dreneres EUS-veiledet til
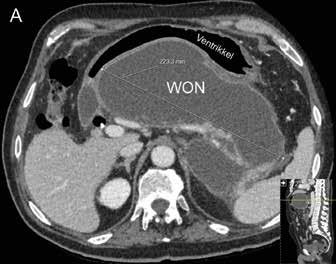
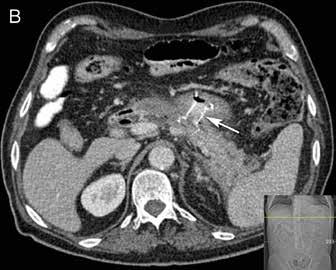
Fig 2: CT bilder fra pasient med nekrotiserende pankreatitt og behandlingstrengende WON før drenasje (A) og 4 uker etter (B) innleggelse av LAMS (pil).
ventrikkel, enten med dobbel pigtail stenter eller LAMS. Disconnected duct syndrome er definert som en komplett diskontinuitet i pankreas hovedgang, oftest i collum/corpus, og fører til et mer langvarig og komplisert forløp. Den frakoblede pankreasresten (cauda) opprettholder sin funksjon og produserer pankreassaft som ikke lenger kan dreneres gjennom pankreasgangen, men i stedet lekker ut i det peripankreatiske rommet og innkapsles som en pseudocyste eller danner fistler som kan være komplisert å behandle. I slike tilfeller kreves langvarig drenasje (> 6 mnd.) og EUS veiledet drenasje til ventrikkel er første valg. Transpapillær drenasje og «bridging» av defekten er teknisk svært vanskelig og lykkes sjelden som behandling alene. Dersom skaden ikke er for omfattende (inkomplett diskontinuitet) kan kontinuitet i pankreas
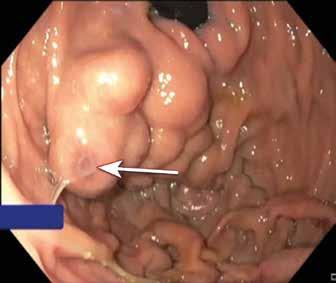
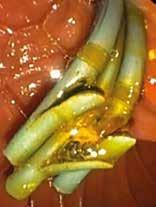
Fig 3: Gastrisk varice («fundusvarice») hos pasient med miltvenetrombose før endoskopisk liming. Blødning ble midlertidig stanset med Sengstaken sonde og blødningspunktet (fibrinplugg) på varicen er markert med pil.
hovedgang gjenopprettes med tiden, også uten at pankreasgang er stentet. Kirurgisk behandling er et alternativ dersom man ikke kommer til målet med endoskopisk intervensjon.
Vaskulære komplikasjoner
Arterielle pseudoaneurismer oppstår hos inntil 10 % av pasientene i forløpet av nekrotiserende pankreatitt som følge av at enzymatisk skade (pankreasenzymer eller infeksjon) på arterieveggen eller skade under invasive (kirurgiske, endoskopiske) inngrep. Dette fører til svekkelse og risiko for ruptur av arterieveggen. Miltarterien eller a. gastroduodenale er oftest affisert. Diagnose stilles på CT, men de kan være vanskelig å oppdage da det kan være begrenset sirkulasjon/kontrast i aneurismet, spesielt ved nylig blødning.
Pseudoaneurismer i relasjon til WON eller pseudocyster må coiles før en eventuell endoskopisk drenasje av disse da ruptur av aneurismet kan føre til massive blødninger i etterkant av den endoskopiske drenasjen.
Ved akutt pankreatitt kan kompresjon/obstruksjon og/eller de inflammatoriske forandringene skade splankniske vener, spesielt miltvenen, og føre til trombose. Risiko øker med alvorlighetsgrad av pankreatitten. Ved miltvenetrombose vil ca. halvparten danne gastriske varicer lokalisert i fundus/cardia (Fig 3). Ruptur av varicene kan føre til svært alvorlige blødninger og forekommer hos ca. 7 % av pasienter med slike varicer. Blødende gastriske varicer behandles vanligvis endoskopisk med injeksjon av vevslim (histoacryl) i varicen. Alternativ kan man injiseres en kombinasjon av coiler og lim EUS veiledet i varicene, men denne teknikken er foreløpig lite utbredt. Begge metoder krever erfaring fra både endoskopør og assistenter. Ved manglende endoskopisk ekspertise tilgjengelig kan blødningen midlertidig kontrolleres med ventrikkelballongen på en Sengstaken sonde. Endoskopisk terapi som primærprofylakse mot blødning er oftest ikke indisert.
II. Kronisk pankreatitt
Kronisk pankreatitt er en progressiv og irreversibel tilstand. Den er preget av vedvarende inflammasjon som gradvis erstatter pankreasparenkymet med fibrøst bindevev, ofte ledsaget av dannelse av konkrementer (kalknedslag) og strikturer i pankreasgangen. Livsstilsendringer med total avholdenhet fra alkohol og røykeslutt er viktig for å bremse sykdomsprogresjonen. Smerteterapi følger den tradisjonelle smertetrappen for kroniske smerter, og enzymtilskudd brukes liberalt for å hindre malabsorpsjon og symptomer som steatoré og vekttap ved eksokrin pankreasinsuffisiens. Intervensjon er primært rettet mot å lindre vedvarende symptomer, først og fremst smerter, dersom man ikke kommer til målet med konservative tiltak. Effekten av invasive tiltak er avhengig av at man kommer relativt tidlig til i forløpet. Langtkommen sykdom og spesielt opiatavhengighet > 6 mnd. gir mindre sannsynlighet for tilstrekkelig smertelindring. Avholdenhet fra alkohol og tobakk er også svært avgjørende. Pasientene har økt dødelighet, dels på grunn av komorbiditet, dels på grunn av risiko for pankreascancer.
Obstruksjon av pankreas hovedgang Årsaken til smerter ved kronisk pankreatitt er multifaktoriell men kan hos mange, spesielt i tidlig fase av tilstanden (før pasienten blir opiatavhengig), forklares helt eller delvis av økt trykk i pankreas hovedgang på grunn av obstruksjon av fløde av pankreassaft. Obstruksjonen er oftest forårsaket av strikturer og konkrementer i caput eller collum og gir dilatasjon av hovedgangen. Obstruksjon lenger oppstrøms i corpus og cauda har sjeldnere klinisk relevans. Den vanlige og minst invasive tilnærmingen er å plassere en plaststent forbi obstruksjonen i hovedgangen som trykkavlastning for å se om dette bedrer smertene. Dersom effekt kan man fortsette stentbehandling og evt. gå videre med andre invasive tiltak. ESGEs retningslinje fra 2018 foreslår endoskopisk terapi og/ eller ekstrakorporal sjokkbølge-litotripsi (ESWL) som førstevalg for smertefull, kronisk pankreatitt med obstruerende konkrement og dilatasjon av hovedgang i caput eller corpus. Imidlertid viste ESCAPE-studien fra 2020 og en senere langtids oppfølgingsstudie at tidlig (opiatavhengighet < 6 mnd.) kirurgi var bedre enn endoskopisk behandling i å gi smertelindring både på kort og lang sikt. Pasienter operert tidlig hadde også mindre reintervensjoner enn pasientene med endoskopisk behandling. Nyere retningslinjer fra ASGE (2024) anbefaler derfor tidlig MDT vurdering med tanke på kirurgi. Det er imidlertid mange faktorer som påvirker valg av terapi, inklusiv pasientens ønske, komorbiditet og alder, og all invasiv (endoskopi/kirurgi) behandling har dårligere effekt jo lenger ut i sykdomsforløpet man har kommet. Tidspunkt for intervensjon kan være like viktig som valg av prosedyre, og beslutning om valg av terapi krever ekspertise og nøye risikovurdering i hvert enkelt tilfelle. All endoskopisk intervensjon på pankreas er beheftet med komplikasjoner som post-ERCP pankreatitt, blødninger, perforasjon og infeksjon. Pasienter med kronisk pankreatitt har dessuten økt risiko for adenocarcinom i pankreas som er en viktig differensialdiagnose ved dilatasjon av pankreas hovedgang eller forverring av symptomer hos pasienter med kronisk pankreatitt.
Små konkrementer i pankreas hovedgang (< 5 mm) kan ofte fjernes endoskopisk ved at strikturer dilateres og konkrementet hentes
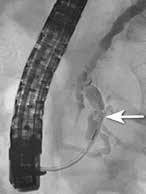
ut med konvensjonelle metoder (Fig 4). Større konkrementer er mer krevende og kan behandles med ESWL eller pankreatikoskopi og fragmentering av konkrement(ene) med sjokkbølgelitotripsi eller laser. Selv om man tilsynelatende klarer å fjerne alle konkrementer fra hovedgangen er tilbakefallsfrekvensen høy og pasientene risikerer langvarig stentbehandling (vanligvis en eller flere plaststenter) og gjentatte endoskopiske prosedyrer.
Den mest fornuftige behandlingsalgoritmen synes å være en "step-up"-tilnærming, der endoskopisk behandling forsøkes først, fulgt av kirurgi for dem som ikke oppnår tilstrekkelig smertelindring. Det er viktig at kirurgisk vurdering ikke utsettes unødvendig av gjentatte endoskopiske prosedyrer, noe som reduserer suksessraten ved kirurgi.
Obstruksjon av gallegang
Inflammasjon og fibrose i caput av pankreas kan skade gallegang og føre til benigne strikturer og kolestase. Slike strikturer kan være krevende å behandle. Det er viktig med god bildediagnostikk i forkant av terapi for å utelukke malign striktur, noe som kan være vanskelig på grunn av de inflammatoriske/fibrotiske forandringene sekundært til kronisk pankreatitt. Det er svært viktig at man ikke intervenerer endoskopisk dersom usikkerhet om malign etiologi men henviser til senter med HPB kirurg og MDT vurdering.
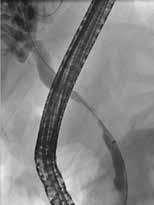
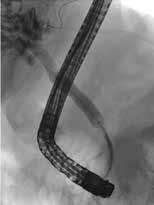
Standard behandling av benigne strikturer har vært ERCP med gjentatte dilatasjoner og innleggelse av multiple plaststenter i gallegang over en periode på ett år (Fig 5). De senere år har bruk av selvekspanderende metallstent i 6-12 mnd. blitt mer vanlig dersom forholdene teknisk ligger til rette for dette. Det er imidlertid risiko for residiv av striktur på grunn av progresjon av grunntilstanden så gjentatt endoskopisk behandling kan bli nødvendig.
Pseudocyster
Pseudocyster oppstår oftest i senfasen av akutt pankreatitt (se over) men kan også sees ved kronisk pankreatitt. Mange pseudocyster gir ingen symptomer og oppdages tilfeldig under bildediagnostiske undersøkelser. Intervensjon er som ved akutt pankreatitt kun aktuelt dersom klinikk tilsier dette: smerter, avklemming av nærliggende organer (magesekk, duodenum, gallegang) eller om cysten skulle bli infisert. EUS veiledet transmural drenasje er første valg ved behov for intervensjon.
Gastrisk utløpsobstruksjon (Gastric outlet syndrome)
Gastrisk utløpsobstruksjon med ventrikkelretensjon er svært plagsomt for pasienten og kan ha en rekke årsaker, både benigne og maligne. I dag er maligne tilstander, spesielt kreft i pankreas, den vanligste årsaken til behandlingstrengende mekanisk obstruksjon, men både akutt og kronisk pankreatitt kan føre til gastrisk utløpsobstruksjon. Årsaken skyldes enten kompresjon av lumen (fra WON eller pseudocyster) eller inflammatorisk infiltrat og fibrose av duodenum. Kompresjon fra WON/pseudocyster behandles som beskrevet over. Fibrotiske stenoser er mer komplisert å behandle. Ballongdilatasjon har ofte begrenset og forbigående effekt og kan kompliseres av tarmperforasjon. Duodenalstent er også lite egnet på grunn av komplikasjonsrisiko ved langvarig stenting. Kirurgisk gastroenterostomi har lenge vært ansett som "gullstandarden" for behandling av ikke-reversible obstruksjoner, men også her har endoskopien gjort fremskritt. EUS veiledet gastroenterostomi ved hjelp av LAMS (Fig 6) har hovedsakelig vært brukt ved malign obstruksjon, men fremstår som et lovende minimalt invasivt alternativ også ved benigne strikturer. EUS veiledet gastroenterostomi gir rask symptomlindring og et kort sykehusopphold samtidig
som den tilbyr en mer langvarig løsning enn luminal stenting og med lavere komplikasjonsrisiko enn kirurgi. Det er foreløpig ingen konsensus hvordan disse pasienten skal følges og behandles videre etter innleggelse av LAMS.
Gastriske varicer
Miltvenetrombose og utvikling av gastriske varicer kan også forekomme ved kronisk pankreatitt, men har lavere forekomst enn ved akutt pankreatitt. Blødningsrisiko og behandlingen er som beskrevet over.
Pankreascancer
Pasienter med kronisk pankreatitt har økt risiko (7 x normalbefolkningen) for adenocarcinom i pankreas. Mange symptomer på kronisk pankreatitt overlapper med symptomer på pankreascancer noe som kan gjøre det vanskelig å stille diagnosen tidlig. Man bør ha lav terskel for å vurdere malignitet ved nye eller endrede symptomer, som for eksempel forverring av smerter, uforklarlig vekttap eller ikterus. Det er viktig med god bildediagnostikk og kirurgisk vurdering før eventuell endoskopisk intervensjon vurderes.
Konklusjon
Endoskopisk behandling kan bli aktuelt i forløpet av både akutt alvorlig pankreatitt og kronisk pankreatitt. Ved akutt pankreatitt har særlig endoskopisk drenasje av infiserte nekroser fått mye oppmerksomhet og bidratt til et paradigmeskifte i behandlingen. Ved kronisk pankreatitt vil endoskopisk behandling først og fremst være aktuell i behandling av kroniske smerter. Endoskopiens stadig større betydning ved akutt alvorlig pankreatitt har ført til en diskusjon hvorvidt disse pasienten som tidligere stort sett ble behandlet av kirurger skal tilhøre medisin eller kirurgi. Ved kronisk pankreatitt er det kanskje motsatt; kirurgene må tidligere på banen enn det som har vært vanlig til nå. Pasientene håndteres imidlertid best i et team hvor både medisinere og kirurger med erfaring i vurdering og behandling av tilstandene er til stede. For kronisk pankreatitt er effekt av behandling avhengig av avholdenhet fra alkohol og tobakk, og det diskuteres i internasjonale fora i hvilken grad man kan kreve avholdenhet før man iverksetter kompliserte og meget ressurskrevende endoskopiske eller kirurgiske tiltak hos denne sammensatte og ofte krevende pasientgruppen.
Anbefalt litteratur
• Pankreatitt. Kirurgen 3-22, https://www.kirurgen.no/pdfarkiv/
• Diagnosis and Management of Acute Pancreatitis. Gastroenterology 2024
• Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guideline. Endoscopy 2018
• Chronic pancreatitis. Lancet 2024
• Endoscopic treatment of chronic pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2018
• Long-term Outcomes of Early Surgery vs Endoscopy first in Chronic Pancreatitis. Follow-Up Analysis of the ESCAPE Randomized Clinical Trial. JAMA Surgery 2024
• American Society for Gastrointestinal Endoscopy guideline on the role of endoscopy in the management of chronic pancreatitis: summary and recommendations. Gastrointestinal Endoscopy 2024
• EUS før og nå. NGF nytt 2-24, https://gastroenterologen.no/pdf-arkiv/
• Visceral artery pseudoaneurysms in necrotizing pancreatitis: risk of early bleeding with lumen-apposing metal stents. Gastrointestinal Endoscopy 2022
• Management of the Disconnected Pancreatic Duct in Pancreatic Necrosis. Clinical Gastroenterology and Hepatology 2025
• Natural history of pancreatitis-induced splenic vein thrombosis: review and meta-analysis of its incidence and rate of gastrointestinal bleeding. HPB 2011
• Kronisk pankreatitt – utredning og behandling. Tidsskriftet 2018.

We believe our PolypAIDTM will provide Confidence in outcomes by offering a second pair of eyes operating with the same attention and dedication on Friday afternoon as on Monday morning detecting possible polyps in just 1/10 of a second.
PolypAIDTM integrates seamlessly with endoscopic workflow by monitoring and augmenting the video feed. The endoscopist is alerted of potential polyps, and a quadrant indicator lights up for a few seconds. If an AI-detected polyp moves out of view, our unique quadrant indicator remains lit for a few seconds to notify the endoscopist of a potential missed polyp.

In comparison with comparable devices and experienced colonoscopists, PolypAIDTM has demonstrated high detection rates and accuracy with a low number of false positives¹ Augere Medical has collected 941 full colonoscopy examinations with pathological data from Oslo University Hospital. These videos have been carefully annotated, creating a machine learning data set and a separate test dataset.

Ingvild Farnes MD, PhD, Avdeling for Hepatopankreatobiliær kirurgi (HPB), Oslo Universitetssykehus, Rikshospitalet
Endoskopisk ultralyd (EUS) har etablert seg som et helt sentralt ledd i diagnostikk og behandlingsstrategi ved pankreaskreft. Gjennom EUS-veiledet finnålsaspirasjon (FNA) eller biopsi (FNB) kan man sikre histologisk diagnose med høy presisjon, samtidig som metoden åpner for skreddersydd og målrettet kreftbehandling.
En nylig populasjonsbasert prospektiv studie fra Oslo universitetssykehus, Rikshospitalet – NORPACT-2 – har undersøkt ytelse og sikkerhet ved EUS-FNA/FNB og ERCP hos pasienter med borderline resektabel (BRPC) og lokalavansert pankreaskreft (LAPC). Studien representerer en større systematisk gjennomgang av disse prosedyrene i en prospektiv, uselektert, regional pasient kohort.
Behov for rask og presis vevsdiagnose
Pankreaskreft forventes å bli den nest hyppigste årsaken til kreftrelatert død innen 2030 (1). Flertallet av pasientene presenterer dessverre med metastatisk sykdom på diagnosetidspunktet (50 %), mens kun 15 % er kan opereres direkte. 35 % av pasientene presenterer med borderline-resektabel (BRPC) eller lokalavansert (LAPC) sykdom der tumor affiserer sentrale blodkar i varierende grad og dermed ikke ansees som direkte teknisk resektabel.
Kirurgi er eneste kurative behandling. For pasienter uten fjernmetastaser, men med BRPC eller LAPC, er neoadjuvant kjemoterapi anbefalt som førstelinjebehandling (2). Formålet med neoadjuvant kjemoterapi er å øke andel av frie reseksjonsrender (R0) samt å redusere størrelsen på tumor slik at den kan bli teknisk resektabel. Tumorskrumpning fasiliterer for at flere pasienter kan gjennomgå kurativ kirurgisk reseksjon.
For å kunne starte neoadjuvant behandling kreves sikker histologisk bekreftelse av malignitet og effektiv avlastning ved eventuell obstruktiv ikterus. EUS benyttes for vevsprøvetaking, mens endoskopisk retrograd cholangiopankreatografi (ERCP) er standard for biliær stenting (3).
Table 1. Pasient karakteristika for 223 pasienter som gjennomgikk EUS FNA/FNB. (Farnes I et al. Scand J Gastroenterol. 2024 Apr;59(4):496-502.)
EUS FNA/FNB of 223 patients with radiologically borderline or locally advanced pancreatic cancer
First EUS attempt
FNA N=134
FNB N=23
FNA+FNB N=66
N=223
Adenocarcinoma N=169
Malignant N=6
Suspicious for malignancy N=13
Atypical, not specified N=12
Benign N=10
Inadequate N=13
Second EUS attempt
FNA N=18
FNB N=5
FNA+FNB N=10 N=33
Adenocarcinoma N=20
Malignant N=1
Suspicious for malignancy N=1
Atypical, not specified N=6
Benign N=3
Inadequate N=2
Definite diagnosis*
Third EUS attempt
FNA N=2
FNB N=1
FNA+FNB N=5 N=8
Adenocarcinoma N=3
Benign N=3
Inadequate N=2
Fourth EUS attempt
FNA N=1
FNB N=1
FNA+FNB N=2
N=4
Adenocarcinoma N=3
Benign N=1
Pancreatic ductal adenocarcinoma N=214
Pancreatic neuroendocrine tumor N=2
Pancreatic neuroendocrine carcinoma N=1
Chronic pancreatitis N=3
Intraductal papillary mucinous neoplasm N=1
IgG 4 related disease N=1
Acinar cell carcinoma N=1
Diagnostic accuracy for first EUS FNA and/or FNB=86.1% (192/223)
Cumulative diagnostic accuracy for all EUS and/or FNB attempts=96% (214/223)
False positive rate for malignancy=0.9% (2/223)
Figur 1: Patologisk resultat av cytologi/biopsi etter 268 EUS FNA/FNB hos 223 pasienter med radiologisk diagnose BRPC eller LAPC. (Farnes I et al. Scand J Gastroenterol. 2024 Apr;59(4):496-502.)
Studiepopulasjon og metode
I perioden 2018–2020 ble 251 pasienter med radiologisk BRPC eller LAPC inkludert. 230 av disse gjennomførte endoskopisk utredning.
• 223 (89 %) gjennomgikk EUS-FNA/FNB for vevsdiagnose. (Tabell 1)
• 133 (53 %) fikk utført ERCP med stentinnleggelse.
• 41 pasienter hadde kombinert EUS og ERCP i samme seanse.
De fleste undersøkelsene ble utført ved Rikshospitalet av erfarne endoskopører. Rapid On-Site Evaluation (ROSE) ble brukt der det var tilgjengelig, slik at man ved usikkerhet kunne ta ny prøve under samme endoskopiseanse.
Resultater: Høy diagnostisk presisjon og lav risiko
EUS-FNA/FNB viste meget god ytelse:
• Diagnostisk nøyaktighet ved første forsøk: 86 %.
• Kumulativ nøyaktighet etter gjentatte forsøk: 96 %.
• Falsk positiv malignitet: kun 0,9 %.
Hos ca. 15 % av pasientene var det behov for gjentatt EUS, som i nesten alle tilfeller førte til korrekt diagnose. (Figur 1) Kombinasjon av FNA og FNB ble brukt i 83 prosedyrer, og bidro til økt vevskvalitet for immunhistokjemiske og molekylære analyser – i tråd med nyere anbefalinger om EUS-FNB som førstevalg ved avansert sykdom (4).
For ERCP var suksessraten 80 % ved første forsøk og 94 % etter to forsøk.
Flertallet fikk innlagt selv-ekspanderende metallstent (SEMS), som har lengre levetid og lavere reintervensjonsrate enn plaststenter (5). Dette er spesielt viktig ettersom flertallet av pasientene mottar neoadjuvant kjemoterapi over flere måneder og et stentbytte vil kunne resultere i uønskete komplikasjoner og forsinkelser i behandlingen.
Kombinert EUS og ERCP i én seanse viste seg både praktisk og trygt, i tråd med internasjonale retningslinjer, samtidig som det er en tidsbesparende strategi når det er praktisk mulig (6).
Komplikasjoner
Komplikasjonsfrekvensen i vår kohort var lav (Tabell 2):
• EUS-FNA/FNB: 3 % (primært pankreatitt).
• ERCP: 15 % (primært pankreatitt, kolangitt).
• Kombinert EUS + ERCP: 10 %.
De fleste hendelser var milde og forbigående, og alvorlige komplikasjoner var sjeldne (< 1 %). Disse tallene samsvarer godt med internasjonal litteratur (7).
Klinisk betydning
Studien viser at EUS-basert vevsprøvetaking er både sikker og svært presis, og at gjentatt EUS ved ikke-konklusiv første prøve gir høy gevinst. Metoden gir tilstrekkelig materiale ikke bare for histologi, men også for molekylærpatologisk analysering. Dette er særlig relevant ettersom internasjonale retningslinjer (NCCN, ESMO) nå anbefaler EUS-FNB ved BRPC og LAPC for å muliggjøre målrettet og persontilpasset kreftbehandling (8).
Testing for MSI og KRAS er nå implementert i nasjonalt handlingsprogram for pancreascancer.
Resultatene understøtter også at kombinert diagnostisk og terapeutisk EUS-/ERCP-seanse er trygg, og kan bidra til raskere oppstart av neoadjuvant behandling – et sentralt mål i et behandlingsforløp hvor tid til terapi er avgjørende for prognose.
Denne norske, populasjonsbaserte studien dokumenterer at:
• EUS-FNA/FNB gir 96 % diagnostisk treffsikkerhet og lav komplikasjonsrate.
• ERCP lykkes i over 80 % av tilfellene ved første forsøk, og nær 94 % totalt.
• Samtidig EUS og ERCP kan trygt utføres og effektivisere pasientforløpet.
EUS-veiledet vevsprøvetaking fremstår dermed som hjørnesteinen i diagnostikk og behandlingsplanlegging ved BRPC og LAPC, og utgjør et avgjørende grunnlag for fremtidens målrettede, presisjonsbaserte pankreaskreftbehandling.
*En pasient opplevde luftveisobstruksjon og respirasjonsvansker under ERCP. To pasienter utviklet nyresvikt som følge av dehydrering og langvarig prosedyre.
¤ En pasient fikk umiddelbar gallelekkasje og stent dislosering
+ En pasient utviklet nyresvikt etter dehydrering og langvarig prosedyre
Table 2: Prosedyrerelaterte komplikasjoner etter ERCP, PTC/PTBD eller EUS FNA/FNB (Farnes I et al. Scand J Gastroenterol. 2024 Apr;59(4):496-502.)
Kilder:
1) Rahib L, Smith BD, Aizenberg R, et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res. 2014;74(11):2913– 2921. doi: 10.1158/0008-5472.CAN-14-0155
2) Tempero MA, Malafa MP, Al-Hawary M, et al. Pancreatic adenocarcinoma, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2021;19(4):439–457. doi: 10.6004/ jnccn.2021.0017.
3) Dumonceau JM, Deprez PH, Jenssen C, et al. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European society of gastrointestinal endoscopy (ESGE) clinical guideline - updated january 2017. Endoscopy. 2017;49(7):695–714. doi: 10.1055/s-0043-109021.
4) Levine I, Trindade AJ. Endoscopic ultrasound fine needle aspiration vs fine needle biopsy for pancreatic masses, subepithelial lesions, and lymph nodes. World J Gastroenterol. 2021;27(26):4194–4207. doi: 10.3748/ wjg.v27.i26.4194.
5) Almadi MA, Barkun A, Martel M. Plastic vs. self-expandable metal stents for palliation in malignant biliary obstruction: a series of meta-analyses. Am J Gastroenterol. 2017;112(2):260–273. doi: 10.1038/ ajg.2016.512. stents for palliation in malignant billary obstruction: a series of meta-analyses. Am J Gastroenterol. 2017;112(2):260-273. doi: TO. 1038/ ajg.2016.512.
6) Jenssen C, Hocke M, Fusaroli P, et al. EFSUMB guidelines on interventional ultrasound (INVUS), part IV – EUS-guided interventions: general aspects and EUS-guided sampling (long version). Ultraschall Med. 2016;37(2):E33–E76. doi: 10.1055/s-0035-1553785.
7) Cotton PB, Eisen GM, Aabakken L, et al. A lexicon for endoscopic adverse events: report of an ASGE workshop. Gastrointest Endosc. 2010;71(3):446–454. doi: 10.1016/j.gie.2009.10.027.
8) Mosele F, Remon J, Mateo J, et al. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO precision medicine working group. Ann Oncol. 2020;31(11):1491–1505. doi: 10.1016/j.annonc.2020.07.014.



Ingrid Kvåle Nordaas, LIS/ Leder for norsk interessegruppe for pankreassykdommer, Haukeland universitetssjukehus, Bergen
Truls Hauge, pensjonert overlege, gastromedisinsk avdeling, Oslo universitetssykehus Trond Engjom, overlege seksjon for fordøyelsessjukdommer, Haukeland universitetssjukehus, Bergen
Eksokrin pankreassvikt kan oppstå som følge av flere ulike tilstander, men de kliniske konsekvensene er uavhengig av årsak. I året som gikk ble det publisert nye europeiske retningslinjer for diagnostikk og behandling av eksokrin pankreassvikt (1). Fra Norge deltok Truls Hauge og Trond Engjom i dette arbeidet.
I denne artikkelen ønsker vi å gi en oppsummering av noen viktige hovedpunkter i de nye retningslinjene.
Intakt eksokrin pankreasfunksjon er en viktig del av fordøyelsen og bidrar til å sikre normal ernæringsstatus. Ved eksokrin pankreassvikt kan pasientene ha symptomer som oppblåsthet, diaré, steatore, magesmerter og flatulens. Eksokrine svikt kan også føre til malabsorbsjon av protein, fettløselige vitaminer, mikronutrienter med påfølgende vekttap, osteoporose og sarkopeni (2-4). Ettersom det er stor variasjon i symptombyrde og grad av ernæringssvikt, er det også store ulikheter i hvordan eksokrin svikt påvirker livskvaliteten og langtidskomplikasjoner.
Tradisjonelt har eksokrin pankreassvikt vært definert på bakgrunn av pankreas sin sviktende sekretoriske funksjon (evne til å skille ut bikarbonat og pankreasenzymer). Dette har skapt utfordringer når det gjelder klinisk relevans av begrepet. Det har også vært utfordrende å inkludere andre mekanismer for sviktende pankreas enzymrelatert fordøyelse i definisjonen.
De nye europeisk retningslinjene representerer et paradigmeskifte i definisjon av eksokrin pankreassvikt. Her beveger man seg bort fra en definisjon utlukkende knyttet til pankreas sekretoriske kapasitet. I de nye retningslinjene defineres eksokrin pankreassvikt som redusert eksokrin pankreasekresjon og/eller intraluminal aktivitet av pankreasenzymer under nivået som er nødvendig for normal fordøyelse av næringsmidler (1). Her slås det med andre ord fast at diagnosen settes basert på en samlet vurdering av funksjonstest, symptomer og ernæringsstatus. På denne måten kan også sykdommer der intraluminal enzymrelatert fordøyelse er nedsatt av annen årsak inkluderes i definisjonen.
Diagnostikk av eksokrin pankreassvikt
Retningslinjene anbefaler å utrede for eksokrin pankreassvikt ved preeksisterende høyrisikotilstander som kronisk pankreatitt, cystisk fibrose, pankreaskreft, akutt nekrotiserende pankreatitt og etter gjennomgått pankreaskirurgi. I tillegg skal pasienter med diaré/
steatoré og ledsagende tegn til malabsorpsjon utredes.
Generelt anbefales det at diagnosen PEI baserer seg på en kombinert vurdering av symptomer, ernæringsstatus, og pankreas funksjon.
Funksjonstesting anbefales med non-invasive tester. Det betyr i praksis måling av fekal elastase i avføring. En vanlig brukt grense for normal FE1 er > 200 µg elastase-1/g feces. Dette er en rimelig og lett tilgjengelig test, men svakheter er at testen er sårbar for utvanning og dermed falsk positive resultater hos pasienter med løs/vandig avføring. Testen har lav sensitivitet for mild og moderat eksokrin svikt (5, 6). En fordel med FE1 er at resultatet ikke påvirkes ved bruk pankreasenzymsubstitusjon (pancreas enzyme replacement therapy, PERT). En annen non-invasiv test som anbefales er 13C-MTG pusteprøve. Denne testen er god, men tidkrevende og lite tilgjengelig i Norge. Direkte pankreasfunksjonstester er ikke lenger anbefalt i klinisk praksis ettersom det i de aller fleste tilfeller ikke vil gi konsekvens for behandling (1).
Bildediagnostikk anbefales ikke til diagnostikk av eksokrin pankreassvikt, men hører likevel med i vurderingen av underliggende årsak. Radiologiske funn som uttalt atrofi, tett pankreasgang (konkrement, tumor mm.) eller parenkymforandringer i hele kjertelen kan være indikatorer på redusert eksokrin funksjon (7).
Behandling av eksokrin pankreassvikt
Når ny definisjon for eksokrin pankreassvikt benyttes, vil diagnosen medføre behandlingsindikasjon. Vi skal her behandle funksjonssvikten, ikke den lave funksjonstesten. Behandlingen er pankreasenzymer (PERT), i doser avhengig av alder, alvorlighetsgrad av den eksokrine svikten og fettinnholdet i kostholdet. For voksne er typiske startdoser 40000-50000 enheter til hovedmåltider og 25000 enheter til snacks. Det er viktig at pasientene får god
Redusert sekresjon av enzymer/ bikarbonat
Tap av funksjonelt eksokrint vev ved kronisk pankreatitt, cystisk fibrose, autoimmun pankreatitt, etter pankreasreseksjoner og nekrotiserende pankreatitt.
Redusert postprandial stimulering av eksokrin pankreas ved cøliaki, Crohns, giardiasis, endret anatomi etter kirurgi.
Obstruert pankreasgang ved for eksempel pankreaskreft, konkrementer.
Manglende effekt av enzymene
Postcibal asynkroni gir eksokrin svikt grunnet manglende blanding av næringsmiddel og pankrerasjuice, og sees hovedsaklig ved kirurgisk endret anatomi i øvre GI-traktus.
Mekanismer ved eksokrin pankreassvikt
informasjon om at kapslene skal tas sammen med måltider. Målet med behandlingen er å øke fett- og proteinabsorpsjonen, bedre kroppsvekt, ernæringsstatus og symptomer, og gjennom dette også bedre livskvalitet, morbiditet og mortalitet. Det er også et mål at behandlingen skal tillate et nær normalt kosthold.
Tabell 1: Vurderinger ved utilstrekkelig effekt av PERT
Kontroller etterlevelse / riktig bruk
Vurder doseøkning
Legge til PPI?
Tilby oppfølgning ved klinisk ernæringsfysiolog med erfaring innen pankreassykdommer
Differensialdiagnoser: Cøliaki, matintoleranse, IBS, IBD, medikamentrelatert diaré, gallesyremalabsorpsjon, mikroskopisk kolitt med flere.
Eksokrin svikt ved kronisk pankreatitt og cystisk fibrose
Ved de klassiske primære pankreassykdommene følges ovenstående råd om testing og behandling. Hos pasienter med kronisk pankreatitt varierer forekomsten av eksokrin svikt mellom kohortene og svikten utvikler seg ofte over tid. I den skandinavisk-baltiske kronisk pankreatitt kohorten var forekomst av behandlingstrengende eksokrin svikt 51% (8). Hos cystisk fibrosebarn med to alvorlige mutasjoner er eksokrin pankreas svikt så vanlig at eksokrin svikt bør vurderes så snart diagnosen er etablert. Hos barn doseres pankreas enzymer etter vekt.
Intraluminal pH <4 inaktiverer pankreasenzymene, for eksempel ved Zollinger-Ellison syndrom.
Eksokrin svikt etter akutt pankreatitt
Prevalensen av eksokrin svikt ved akutt pankreatitt varierer med tid og alvorlighet. Under innleggelse er det rapportert prevalenser opptil 62%, fallende til 27-35% ved oppfølgning etter pankreatitten (9, 10). Eksokrin svikt er hyppigst etter alvorlige akutte pankreatitter, ved store nekroser og etter akutt pankreatitt hos pasienter med alkoholoverforbruk. Det er nå anbefalt screening for eksokrin pankreassvikt etter gjennomgått akutt pankreatitt, særlig ved alvorlige pankreatitter (1). Behandling gjennomføres etter vanlige retningslinjer, men ettersom det er forventet at en andel av pasientene vil få tilbake normal pankreasfunksjon må man revurdere indikasjonen etter en tids bruk.
Eksokrin svikt ved pankreaskreft
De siste årene har det vært økt fokus på den betydelige forekomsten og konsekvensene av eksokrin pankreassvikt hos pasienter med pankreaskreft. Ettersom patogenesen særlig er relatert til tumorobstruksjon av pankreas hovedgangen, er forekomsten særlig høy ved tumor lokalisert i caput pankreas og ved avansert sykdom (prevalenser mellom 66% og 80%) (11-13). Alle pasienter med pankreaskreft bør testes, og behandling med PERT er anbefalt ved påvist svikt. Det er åpning for å starte tidlig med PERT og ernæringstiltak så snart cancerdiagnose er satt, uten å vente til svar på eksokrin testing foreligger. Nasjonale faglige retningslinjer for pankreaskreft anbefaler i tillegg rutinemessig postoperativ substitusjon med PERT etter pankreatoduodenektomi og total pankreatektomi uavhengig av testing (14). Ubehandlet eksokrin svikt gir dårligere prognose og redusert livskvalitet hos disse pasientene.
Eksokrin svikt etter kirurgi
Eksokrin pankreassvikt er vanlig etter pankreaskirurgi, og prevalensen avhenger naturlig nok av typen kirurgi, alt fra 10% til 100% (1). Diagnostikk utføres som vanlig, men er overflødig etter total pankreatektomi. Det er viktig å være klar over at FE1 kan være normal tross eksokrin svikt i tilfeller der problemet ikke er mengden enzym, men at enzym og næringsmiddel ikke blandes i tarmen (postcibal asynkroni). Denne tilstanden kan sees etter pankreatikoduodenektomi og annen øvre GI-kirurgi inkludert delvis eller totale gastrektomier, bariatrisk kirurgi (spesielt Roux-en-Y). Behandling med PERT gjøres som ved andre årsaker til eksokrin svikt, men særlig etter pankreaskirurgi kan det være behov for høyere doser enn ellers. Det finnes ikke sikker evidens for åpning av kapsler og svelging av granulatet hos opererte pasienter, men det er foreslått at dette kan forsøkes hos pasienter med rask tarmpassasje eller der enzymkapslene ikke utsettes for ventrikkelsyre.
Oppsummering
Gjennom de nye europeiske retningslinjene presenteres en mer klinisk relevant definisjon for eksokrin pankreassvikt. Tilstanden defineres ikke lenger ut fra redusert pankreassekresjon alene, men legger vekt på funksjonssvikt alvorlig nok til å kunne gi symptomer og/eller påvirket ernæringsstatus. Behandlingen som består av PERT kombinert med gode kliniske ernæringsråd, er viktig for å oppnå behandlingsmålene i form av normalt kosthold, bedret ernæringsstatus og reduserte symptomer, og for å hindre komplikasjoner som osteoporose og sarkopeni.
Den nye og mer helhetlige definisjonen muliggjør bedre pasientbehandling, men fører med seg utfordringer i det en stor andel av tidligere publiserte studier på eksokrin pankreassvikt ikke lenger passer med dagens definisjon.
Referanser
1. Dominguez-Munoz JE, Vujasinovic M, de la Iglesia D, Cahen D, Capurso G, Gubergrits N, et al. European guidelines for the diagnosis and treatment of pancreatic exocrine insufficiency: UEG, EPC, EDS, ESPEN, ESPGHAN, ESDO, and ESPCG evidence-based recommendations. United European Gastroenterol J. 2025;13(1):125–72.
2. Lindkvist B, Phillips ME, Dominguez-Munoz JE. Clinical, anthropometric and laboratory nutritional markers of pancreatic exocrine insufficiency: Prevalence and diagnostic use. Pancreatology. 2015;15(6):589–97.
3. Kuan LL, Dennison AR, Garcea G. Prevalence and Impact of Sarcopenia in Chronic Pancreatitis: A Review of the Literature. World J Surg. 2021;45(2):590–7.
4. Martinez-Moneo E, Stigliano S, Hedstrom A, Kaczka A, Malvik M, Waldthaler A, et al. Deficiency of fat-soluble vitamins in chronic pancreatitis: A systematic review and meta-analysis. Pancreatology. 2016;16(6):988–94.
5. Lankisch PG, Schmidt I, Konig H, Lehnick D, Knollmann R, Lohr M, et al. Faecal elastase 1: not helpful in diagnosing chronic pancreatitis associated with mild to moderate exocrine pancreatic insufficiency. Gut. 1998;42(4):551–4.
6. Vanga RR, Tansel A, Sidiq S, El-Serag HB, Othman MO. Diagnostic Performance of Measurement of Fecal Elastase-1 in Detection of Exocrine Pancreatic Insufficiency: Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2018;16(8):1220–8 e4.
7. Nordaas IK, Trelsgard AM, Tjora E, Frokjaer JB, Haldorsen IS, Olesen SS, et al. Pancreatic atrophy is a predictor for exocrine pancreatic dysfunction: Data from a large cohort of patients with chronic pancreatitis. Pancreatology. 2024;24(8):1244–51.
8. Olesen SS, Poulsen JL, Drewes AM, Frokjaer JB, Laukkarinen J, Parhiala M, et al. The Scandinavian baltic pancreatic club (SBPC) database: design, rationale and characterisation of the study cohort. Scand J Gastroenterol. 2017;52(8):909–15.
9. Hollemans RA, Hallensleben NDL, Mager DJ, Kelder JC, Besselink MG, Bruno MJ, et al. Pancreatic exocrine insufficiency following acute pancreatitis: Systematic review and study level meta-analysis. Pancreatology. 2018;18(3):253–62.
10. Huang W, de la Iglesia-Garcia D, Baston-Rey I, Calvino-Suarez C, Larino-Noia J, Iglesias-Garcia J, et al. Exocrine Pancreatic Insufficiency Following Acute Pancreatitis: Systematic Review and Meta-Analysis. Dig Dis Sci. 2019;64(7):1985–2005.
11. Iglesia D, Avci B, Kiriukova M, Panic N, Bozhychko M, Sandru V, et al. Pancreatic exocrine insufficiency and pancreatic enzyme replacement therapy in patients with advanced pancreatic cancer: A systematic review and meta-analysis. United European Gastroenterol J. 2020;8(9):1115–25.
12. Dominguez-Munoz JE, de la Iglesia-Garcia D, Nieto-Garcia L, Alvarez-Castro A, San Bruno-Ruz A, Monteserin-Ron L, et al. Endoscopic Pancreatic Drainage Improves Exocrine Pancreatic Function in Patients With Unresectable Pancreatic Cancer: A Double-Blind, Prospective, Randomized, Single-Center, Interventional Study. Pancreas. 2021;50(5):679–84.
13. Tseng DS, Molenaar IQ, Besselink MG, van Eijck CH, Borel Rinkes IH, van Santvoort HC. Pancreatic Exocrine Insufficiency in Patients With Pancreatic or Periampullary Cancer: A Systematic Review. Pancreas. 2016;45(3):325–30.
14. Helsedirektoratet (2017-04-26T00:00). Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med pancreaskreft [nettdokument]. Oslo: Helsedirektoratet (siste faglige endring 28. mars 2025, lest 25. oktober 2025). Tilgjengelig fra https://www.helsedirektoratet.no/retningslinjer/pancreaskreft-bukspyttkjertelkreft-handlingsprogram
Den eneste JAK-hemmeren som er godkjent for både
1, 2
RINVOQ® er indisert til behandling av voksne pasienter med moderat til alvorlig aktiv ulcerøs kolitt og Crohns sykdom som har hatt utilstrekkelig respons, mistet respons eller var intolerante overfor enten konvensjonell behandling eller et biologisk legemiddel1.
KLINISK RESPONS allerede i uke 2* 1
MUKOSAL TILHELING etter induksjonsfase**1
KLINISK REMISJON som vedvarer † 1

1 tablett
én gang daglig1
*UC: Symptomatisk respons iht. paMS for RINVOQ vs placebo (UC-1: 60,1% vs 27,3%; UC-2: 63,3 % vs 25,9 % [konfidensintervall er ikke publisert], p<0,0001). CD: Klinisk respons CR-100 for RINVOQ vs placebo (CD-1: 33 % vs 12 % [95 % KI, 14–28], p<0,001. CD-2: 32 % vs 20 % [95 % KI, 4–19], p<0,01).
**UC: ES ≤ 1 for RINVOQ vs placebo. Uke 8: (UC-1: 36,3% vs 7,4% [95% KI, 22,6–35,9], p<0,001. UC-2: 44% vs 8,3% [95% KI, 28,6–41,6], p<0,001. CD: SES- CD delscore på 0 for overflatisk sårdannelse hos pasienter med SES-CD delscore ≥ 1 ved baseline for RINVOQ vs placebo. Uke 12: (CD-1: 17% vs 0% [95% KI, 13–21], nominell p<0,001. CD-2: 25% vs 5% [95% KI, 14–25], nominell p<0,001.
†UC: Klinisk remisjon iht. aMS (primært endepunkt) for RINVOQ vs placebo. Uke 8: (UC-1: 26,1% vs 4,8% [95% KI, 15,8–27,4], p<0,001. UC-2: 33,5% vs 4,1% [95% KI, 23,2–34,7], p<0,001. Uke 52: (UC-3: 15/30 mg 42,3/51,7% vs 12,1% [95% KI, 21,7–39,8/29,7–48,2], p<0,001. CD: Klinisk remisjon SF/APS (primært endepunkt) for RINVOQ vs placebo. Uke 12: (CD-1: 40% vs 14% [95% KI, 19–33], p<0,001. CD-2: 51% vs 22% [95% KI, 21–36], p<0,001. Uke 52: (CD-3: 15/30 mg 36/46% vs 14% [95% KI, 14–30/23–40], p<0,001).
UC-1 (U-ACHIEVE Induction) dobbeltblindet RCT, RINVOQ 45 mg n=319, PBO n=154. UC-2 (U-ACCOMPLISH) dobbeltblindet RCT, RINVOQ 45 mg n=341, PBO n=174. UC-3 (U-ACHIEVE Maintenance) dobbeltblindet RCT, RINVOQ 15 mg n=148, RINVOQ 30 mg n=154, PBO n=149. CD-1 (U-EXCEED) dobbeltblindet RCT, RINVOQ 45 mg n=324, PBO n=171. CD-2 (U-EXCEL) dobbeltblindet RCT, RINVOQ 45 mg n=350, PBO n=176. CD-3 (U-ENDURE) dobbeltblindet RCT, RINVOQ 15 mg n=169, RINVOQ 30 mg n=168, PBO n=165.
RINVOQ utvalgt sikkerhetsinformasjon1
Advarsler og forsiktighetsregler:
Kontraindikasjoner
RINVOQ bør kun brukes dersom ingen egnede behandlingsalternativer er tilgjengelige hos pasienter:
-65 år og eldre, -pasienter med tidligere aterosklerotisk kardiovaskulær sykdom eller andre kardiovaskulære risikofaktorer (slik som nåværende eller tidligere langtidsrøykere), -pasienter med risikofaktorer for malignitet (f.eks. nåværende malignitet eller tidligere malignitet).
•Overfølsomhet overfor innholdsstoffene (se avsnitt 4.4 i SPC).
•Ak tiv tuberkulose eller aktive alvorlige infeksjoner.
•Alvorlig nedsatt leverfunksjon.
•Graviditet (prevensjon under behandling, og minst 4 uker etter siste dose).
Amming Skal ikke brukes ved amming
Behandling skal ikke initieres ved:
Vanligste bivirkninger for ulcerøs kolitt og Crohns sykdom (≥4 % av pasientene)
1.Absolutt lymfocyttall (ALC) <0,5 x 10 9 celler/l. 2. Absolutt nøytrofiltall (ANC) <1 x 10 9 celler/l.
3.Hemoglobin (Hb)-nivå <8 g/dl.
Øvre luftveisinfeksjon (19,9 %), pyreksi (8,7 %), økt CPK i blodet (7,6 %), anemi (7,4 %), hodepine (6,6 %), akne (6,3 %), herpes zoster (6,1 %), nøytropeni (6,0 %), utslett (5,2 %), pneumoni (4,1 %), hyperkolesterolemi (4,0 %).
Vanligste alvorlige bivirkninger Alvorlige infeksjoner.
Interaksjoner
Sterke CYP3A4-hemmere: Eksponeringen for upadacitinib øker ved samtidig administrering.
Sterke CYP3A4-induktorer: Eksponeringen for upadacitinib reduseres ved samtidig administrering.
RINVOQ utvalgt produktinformasjon1
Reseptgruppe: C. Dosering ulcerøs kolitt og Crohns sykdom: Induksjon: 45 mg, én gang daglig i 8 uker (ulcerøs kolitt) eller 12 uker (Crohns sykdom). Vedlikehold: 15 mg eller 30 mg én gang daglig, avhengig av pasientens tilstand. 15 mg anbefales ved høyere risiko for VTE, MACE eller malignitet; 30 mg for de med høy sykdomsbyrde uten økt risiko. Eldre ≥ 65 år: 15 mg én gang daglig for vedlikeholdsbehandling. Se SPC for mer info om forlenget induksjon, seponering, nedsatt nyrefunksjon og samtidig bruk av CYP3A4-hemmere. Priser og pakninger: 15 mg x 28 stk. (blister) kr 9617,70. 15 mg x 98 stk. (blister) kr 33571,20. 30 mg x 28 stk. (blister) kr 19199,10. 45 mg x 28 stk. (blister) kr 28780,50. Finansiering: Dette er et avtaleprodukt besluttet innført til behandling av Crohns sykdom. Anbudsstart CD 01. mai 2025, del av LIS TNF Bioanbudet for 20253 Ulcerøs kolitt har foreløpig ikke mottatt positiv metodevurdering av Beslutningsforum. Referanser: 1. RINVOQ SPC avsnitt 4.1, 4.2, 4.3, 4.4, 4.6, 5.1, sist godkjent 02.06.2025. 2. Rinvoq SPC avsnitt 4.1 sist godkjent 02.06.2025, Xeljanz SPC avsnitt 4.1 sist godkjent 13.02.2025, Jyseleca SPC avsnitt 4.1 sist godkjent 02.06.2025, Olumiant SPC avsnitt 4.1 sist godkjent 21.11.2024, Cibinqo SPC avsnitt 4.1 sist godkjent 23.06.2025. 3. https://www.nyemetoder.no/metoder/upadacitinib-rinvoq-indikasjon-vi/ Lesedato 25.09.2025. AbbVie AS • Postboks 565 • 1327 Lysaker • Telefon +47 67 81 80 00. www.abbvie.no


Erling Tjora, overlege, pediatrisk klinikk, Haukeland universitetssjukehus. Bergen Trond Engjom, overlege seksjon for fordøyelsessjukdommer, Haukeland universitetssjukehus. Bergen
Barn får også pankreatitt, og det forekommer hyppigere enn vi har trodd. Det er nok pasienter som i barndommen har fått diagnosen «tilbakevendende magesmerter», og som egentlig har hatt residiverende pankreatitter.
Epidemiologi
Økt oppmerksomhet og kunnskap om tilstanden gjør nok at flere barn får diagnosen pankreatitt i dag. Vi har ikke holdepunkter for at insidensen av pankreatitt hos barn er økende (1, 2). Det er ikke norske eller nordiske materialer for pediatrisk pankreatitt, og studiene som beskriver forekomst er stort sett fra de amerikanske INSPPIRE kohortene. For akutt pankreatitt angis en insidens på 3-13/100000/år, noe som er opp mot størrelsesorden med de laveste insidenstallene som angis for voksne. Prevalens av kronisk pankreatitt i barnepopulasjon angis å være 6/100000 (1, 3).
Mellom 20 og 30 % av barn får minst ett residiv av akutt pankreatitt, og en relativt høy andel av de som får residiv, utvikler kronisk pankreatitt i løpet av livet. Noen også i barndommen (4).
Etiologi
Det er ganske stor forskjell på barn og voksne når det gjelder årsak til pankreatitt. Røyking og alkoholmisbruk er heldigvis svært sjelden årsak. Obstruksjon av pankreasgang og bivirkning av medikamenter (f.eks. asparaginase i kreftbehandling, valproat og thiopuriner) er hyppigste årsaker til akutt pankreatitt (3). Fedme har også vært foreslått som risikofaktor for akutt pankreatitt, og er assosiert med mer alvorlig forløp hos barn (5). Ved residiverende akutt og kronisk pankreatitt seiler mutasjoner i pankreatittgener, som PRSS1, SPINK1 og CFTR opp som vanligste årsak. Genetiske risikofaktorer er til stede hos mer enn halvparten av disse pasientene (3). Autoimmun pankreatitt forekommer også som årsak til residiverende pankreatitt. Det er vanligvis en type 2 lignende variant (ikke IgG4 assosiert) som ofte er assosiert med inflammatorisk tarmsykdom (6). Som hos voksne, er årsak til pankreatitt ofte multifaktoriell, og kan være kronglete å nøste opp i.
Diagnostikk
Akutt pankreatitt kjennetegnes ved minst to av tre av følgende: typiske smerter, stigning i amylase og/eller lipase til > 3 x øvre referansenivå og typiske bildefunn for pankreatitt. Transabdominal ultralyd er førstevalg som bildediagnostikk hos barn. CT eller MR
er forbeholdt der man ikke får god nok diagnostikk med ultralyd, eller ved mistanke om komplikasjoner i forløpet (7).
Ved residiverende akutt pankreatitt, skal det være minst en måned mellom to av episodene med akutt pankreatitt. Hvis anfallene kommer tettere, regnes det å være del av den samme episoden med akutt pankreatitt.
Kronisk pankreatitt kjennetegnes som hos voksne med typiske permanente forandringer ved bildediagnostikk av pankreas, samt symptomer og tegn i form av smerte, og/eller svikt i eksokrin og endokrin pankreasfunksjon.
Behandling
European pancreatic club og Hungarian pancreatic study group kom i 2018 med kunnskapsbaserte retningslinjer for utredning og behandling av pankreatitt hos barn (7).
Akutt pankreatitt behandles med god smertelindring og intravenøs væskebehandling. Det er ofte store tredjeromstap, og nylig vist gunstigere forløp hos de som får rikelig med væske (>1,5 x basalbehov) i forhold til de som får mindre væske (8). Det er sannsynligvis bra med tidlig enteral ernæring. Barnet kan derfor spise når det har lyst på mat, og bør ernæres via sonde (gastrisk eller jejunal) hvis det ikke kommer i gang med matinntak innen tre døgn (7). Ved klinisk og bildemessig mistanke om autoimmun pankreatitt kan prednisolon 1-1,5 mg/kg/dag forsøkes i 2-4 uker før nedtrapping. Det er ingen konsensus om steroidsparende behandling ved residiv, men sannsynligvis er god behandling av annen ledsagende autoimmun sykdom beskyttende mot tilbakefall (6).
Kronisk pankreatitt behandles med smertelindring – fortrinnsvis uten opiater og substitusjonsbehandling for eksokrin og endokrin svikt hvis det foreligger. Endoskopisk og kirurgisk behandling kan være indisert ved vanskelig smerteproblematikk (7).
Utredning
Ved residiv av pankreatitt eller kronisk pankreatitt, vil genetisk utredning være indisert. Det brukes nå next generation sequencing «pakker», der de vanligste pankreatittgenene blir undersøkt. Tomografisk bildediagnostikk, fortrinnsvis MR, for å se etter tegn til autoimmun pankraetitt eller strukturelle anomalier og annen obstruksjonsårsak er også indisert. Det er få studier på effekt av intervensjon på slike anomalier, og som hos voksne, skal man være edruelig på indikasjoner. For eksempel er pankreas divisum assosiert med residiverende akutt pankreatitt hos barn (9), men det er lite kunnskap om dekomprimerende prosedyrer har noe for seg. Påvisning av autoantistoff og forhøyete IgG4 nivåer er i liten grad undersøkt ved pediatrisk autoimmun pankreatitt, og har liten plass i utredning (6).
Konklusjon
Barn får også pankreatitt. Ved akutt pankreatitt er obstruksjon av gallegang og medikamenter hyppigste årsaker, mens mer enn halvparten av de som har residiverende akutte og kroniske pankreatitter i barndommen har genetiske risikofaktorer. Ved residiverende akutt pankreatitt er utredning av årsak viktig, fordi en relativt høy andel av pasienter som får dette utvikler livslang pankreassykdom.
Referanser
1. Sellers ZM, MacIsaac D, Yu H, Dehghan M, Zhang KY, Bensen R, et al. Nationwide Trends in Acute and Chronic Pancreatitis Among Privately Insured Children and Non-Elderly Adults in the United States, 2007-2014. Gastroenterology. 2018;155(2):469-78 e1.
2. Oracz G, Wejnarska K, Kolodziejczyk E, Kierkus J. Pediatric Acute and Chronic Pancreatitis: Increase in Incidence or Increasing Awareness? Pancreas. 2017;46(6):e55-e6.
3. Uc A, Husain SZ. Pancreatitis in Children. Gastroenterology. 2019;156(7):1969-78.
4. Gariepy CE, Ooi CY, Maqbool A, Ellery KM. Demographics and risk factors for pediatric recurrent acute pancreatitis. Curr Opin Gastroenterol. 2021;37(5):491-7.
5. Jeong IS, Lee YJ, Kim SC, Lee YM, Yi DY, Choi SY, et al. Clinical Characteristics of Acute and Chronic Pancreatitis in Children and Impact of Obesity. Pancreas. 2025.
6. Scheers I, Palermo JJ, Freedman S, Wilschanski M, Shah U, Abu-El-Haija M, et al. Recommendations for Diagnosis and Management of Autoimmune Pancreatitis in Childhood: Consensus From INSPPIRE. J Pediatr Gastroenterol Nutr. 2018;67(2):232-6.
7. Parniczky A, Abu-El-Haija M, Husain S, Lowe M, Oracz G, Sahin-Toth M, et al. EPC/HPSG evidence-based guidelines for the management of pediatric pancreatitis. Pancreatology. 2018;18(2):146-60.
8. Norris N, Farrell P, Ibrahim S, Fei L, Sun Q, Vitale DS, Abu-El-Haija M. Liberal Fluid Resuscitation is Associated with Improved Outcomes in Pediatric Acute Pancreatitis. J Pediatr. 2025;276:114329.
9. Lin TK, Abu-El-Haija M, Nathan JD, Palermo JP, Barth B, Bellin M, et al. Pancreas Divisum in Pediatric Acute Recurrent and Chronic Pancreatitis: Report From INSPPIRE. J Clin Gastroenterol. 2019;53(6):e232-e8.




Trond Engjom, overlege seksjon for fordøyelsessjukdommer, Haukeland universitetssjukehus, Bergen
Liv Sagatun, overlege gastroseksjonen, St. Olavs Hospital, Trondheim
Kim Waardal, overlege, gastrokirurgisk seksjon, Haukeland universitetssjukehus, Bergen
Erling Tjora, overlege, pediatrisk klinikk, Haukeland universitetssjukehus, Bergen
Ingrid Kvåle Nordaas, LIS/ Leder for norsk interessegruppe for pankreassykdommer, Haukeland universitetssjukehus, Bergen
Akutt pankreatitt (AP) er vanlig forekommende. Etter 2 eller flere episoder adskilt med minst 3 måneder defineres det som «residiverende akutt pankreatitt» (RAP). Ved systematisk utredning kan årsak identifiseres hos 70-90% av disse pasientene og hos over halvparten kan forebyggende tiltak være mulig. Der årsak til første AP ikke identifiseres, er tilbakevendende anfall hyppigere. Vi ønsker gjennom denne artikkelen å sette fokus på tilstanden og foreslå en tilnærming som for en del av pasientene kan bedre prognosen.
Nye definisjoner samler alle stadier av inflammatoriske pankreas sykdommer fra i et fibro-inflammatorisk syndrom (1). Denne forståelsen muliggjør forebyggende strategier for å forhindre inflammatoriske episoder og progresjon mot endeorganskade. De siste årene har pankreas miljøene utviklet flere guidelines som omhandler AP og RAP (2-4).
Pankreatitter og epidemiologi
I en pankreasfrisk populasjon får omtrent 40 av 100000 sitt første anfall av pankreatitt pr år. I underkant av 20 % av disse får residiverende anfall (5). Residiverende akutte pankreatitter rammer yngre pasienter og er hyppigst menn (65 %) i aldersgruppen 30-40 år (6). Anfallene ved RAP er vanligvis mildere, kortere og har sjeldnere organsvikt og lavere mortalitet (7). Gjentatte episoder øker sannsynlighet for organskade og etter tredje anfall av akutt pankreatitt er sjansen større for å finne tegn til kronisk pankreatitt og utvikling mot organsvikt. Omtrent en fjerdedel av RAP pasienter utvikler kronisk pankreatitt (6).
Hvordan identifiserer vi årsaken til pankreatittene?
Kartlegging av etiologi er nøkkelen for å identifisere forebyggende tiltak hos pasienter med RAP. Mest brukt i dag er TIGAR-O (8). Dette systemet er et nyttig arbeidsverktøy som gir både oversikt og detaljer nødvendig for å kartlegge etiologien hos pasienter med pankreatitter.
Ved første gangs akutte pankreatitt er årsaken i ca 50 % av tilfellene gallestenssykdom (6). Gallestenspankreatitt verifiseres ved funn av konkrementer, mikrolithiasis eller sludge ved ultralyd eller annen billedmodalitet av galleblære eller gallegang. ALAT stigning > 150 U/L innen 48 timer etter symptomdebut av akutt pankreatitt er også en indikasjon på biliær etiologi med en positiv prediktiv verdi på 85 % (9). Dersom biliær pankreatitt håndteres riktig med tidlig cholecystektomi og håndtering av resterende konkrementer i gallegang, bør forekomst av biliær årsak være lav både i en RAP og KP populasjon (3, 10).
Alkohol finnes som etiologi hos ca 20 % av første gang AP, 40 % av RAP og >50 % av KP pasientene (6, 11). Alkohol som årsak er vanligst i alderen 35 til 55 år. Tobakk er også regnet som en viktig faktor for både RAP og KP (12).
Etiologisk faktor Kommentarer
RAP- anfallet
Toksisk
Vurdering av første anfall er viktig. Skade ved første akutte pankreatitt kan være utløsende for videre RAP.
Alkohol er årsak hos 40 % av RAP
Røyk øker risiko for RAP
Hyperkalsemi, nyresvikt og hyper-triglyseridemi kan være utløsende.
Medikamentelle pankreatitter er vanlig
Avdekke gallesten som årsak
Avdekke stenoser i galle/ pankreasgang og andre årsaker til obstruksjon.
Effekt av tiltak
Vurdere utløsende faktorer, lokalisasjon og strukturelle skader er første ledd i utredning.
Alkoholavhold reduserer risiko for RAP fra 60 % til 20 % ved alkoholiske pankreatitter. Vi vet lite om effekt av røykestopp.
Behandling gir vanligvis opphør av RAP.
Seponering av utløsende medikamenter gir vanligvis opphør av RAP.
Riktig behandling av gallestenssykdom (Tidlig cholecystectomi og behandling av gallegangs-konkrementer) reduserer risiko for RAP etter biliær pankreatitt fra 30–50 % til under 10 %.
Obstruktiv
Genetisk
Autoimmun
Avlastende terapi (Endoskopi eller kirurgi) er effektivt når mekanisk obstruksjon identifiseres og kan fjernes.
Idiopatisk
PRSS1 mutasjon: 80 % RAP
SPINK1, CTRC og CASR mutasjoner gir sjelden RAP
Et utvalg av milde CFTR mutasjoner gir risiko for RAP
Autoimmun pankreatitt type 1 gir sjelden RAP, mens det er noe hyppigere ved type 2.
Ved sikker stenose i distal pankreasgang kombinert med RAP gir spincterotomi/ stenting vanligvis opphør av RAP.
Avlastende tiltak ved pankreas divisum, cyster, IPNM e.l har mer usikker effekt og inngrep må vurderes individuelt og i forståelse med pasienten
Vi har ikke korrigerende tiltak mot RAP hos pasienter med PRSS1 mutasjoner. Avdekking av mutasjoner kan likevel ha betydning for oppfølging av pasienten.
Bruk av CFTR stimulatorer gir opphør av RAP.
Ved autoimmun pankreatitt gir prednisolon vanligvis opphør av RAP.
Hos 10–30 % av RAP pasientene finnes ingen årsak. Repetert utredning reduserer andelen idiopatiske:
• Streng alkoholabstinens og røykeslutt.
• Gjentatt billeddiagnostikk mtp obstruksjon
• Mer liberal genetisk testing
• Nøye medikamentanamnese
• Vurdering andre autoimmune faktorer (Lupus, Sjøgren)
Medikamenter er årsak i < 5 % av AP, men er noe vanligere hos pas med RAP. Når det gjelder reversible metabolske faktorer finnes hypertriglyceridemi hos 2-5 % av AP. Hyperkalsemi som årsak til AP er meget sjelden (<1 %). Ubehandlet vil alle disse med høy sannsynlighet gi nye anfall.
Obstruktive faktorer utgjør en mindre andel av pasientene med RAP, men er likevel viktig å identifisere da en i disse gruppene kan finne virksomme forebyggende tiltak eller overse alvorlig underliggende patologi. Oppfølgende CT eller MR hører med i den initiale utredning av RAP hvor gallesten eller alkohol årsak ikke er sannsynlig. Forekomst av tumor som årsak til akutt pankreatitt er relativt uvanlig og finnes først og fremst ved debut i høy alder med overvekt av menn. Mindre obstruerende lesjoner kan vokse og avdekkes først under oppfølging (4). En studie viste at risiko for å finne cancer er størst de første 2 årene etter debut av RAP (13). Dette gir grunn for å følge opp pasientene med gjentatt billeddiagnostikk.
Genetiske årsaker til RAP bør vurderes hos alle der initial utredning ikke avdekker årsak og spesielt hos pasienter med alder under 35-40 år og/eller med familiehistorikk på pankreatitter. Påvist genetisk årsak vil først og fremst ha diagnostisk og prognostisk betydning, men ved påviste CFTR mutasjoner kan også terapeutiske muligheter finnes.
Finnes det forebyggende tiltak mot anfallene?
Fortsatt mangler store prospektive studier som kartlegger effekt av forebyggende tiltak. Vi har ovenfor omtalt viktigheten av riktig håndtering av biliær pankreatitt. Høyt alkoholforbruk er også en viktig driver mot RAP og KP. En liten japansk studie viste at hos pasienter som fortsatte uforandret høyt alkoholinntak etter første AP episode fikk 60 % RAP og 40 % KP. For gruppen som kuttet sitt høye forbruk fikk 20 % RAP og14 % KP (14). Når det gjelder røykeslutt og effekt på RAP vet vi lite, men det er vist en klar og doseavhengig sammenheng med utvikling mot KP (10, 15). Øvrige tiltak som å behandle hyperlipidemier og hyperkalsemier, seponere medisiner som gir pankreatitter, behandle autoimmun pankreatitt og enkelte intervensjoner ved genetiske årsaker er viktige for å stanse anfall av RAP og hindre utvikling mot KP der slike faktorer identifiseres.
Hva med endoskopi og kirurgi som tiltak ved RAP? Endoskopiske eller kirurgiske tiltak har en viktig plass i behandling av RAP der mekanisk obstruksjon identifiseres og kan avlastes (4). Det er imidlertid mange eksempler på at en for aggressiv tilnærming til endoskopisk terapi i tilfeller der den obstruktive faktor er mer uklar, kan være både kontraproduktivt og medføre komplikasjoner. Best effekt av avlastende tiltak sees ved intervensjoner mot distale gallegangskonkrementer eller der det påvises
distale strikturer i galle eller pankreasgang. En mer individualisert tilnærming kreves der det identifiseres obstruerende elementer som juxta-papillære divertikler, pankreas cyster, IPNM eller obstruerende tumores (4). Pankreas divisum er vanlig forekommende, men en generell tilnærming med stenting av aksessoriske pankreasganger har ikke vist effekt. Noen pasienter kan imidlertid ha effekt av målrettet drenasje av områder der det identifiseres gjentatte inflammatoriske episoder(4). Her benyttes multidisiplinære team for å diskutere seg frem til riktig strategi.
Avlastende kirurgiske inngrep er vanligere ved gjentatte episoder av akutt på kronisk pankreatitt, men kan selvsagt også benyttes ved RAP i fravær av KP der effekt av endoskopiske tiltak er forbigående og medfører gjentatte prosedyrer (4).
En strategi for utredning
Etiologisk gjennomgang med støtte i Tigar-O klassifikasjonen er nødvendig og nyttig for å identifisere forebyggende tiltak. Forekomst av etiologiske faktorer endrer seg gjennom forløpet fra første AP og frem mot etablert kronisk pankreatitt. Dette bør avspeiles i rekkefølge av utredningen. I tabellen nedenfor presenteres hvilke faktorer som bør gis fokus og hvilke tiltak mot de enkelte faktorer som kan gi effekt. Vi presenterer også et forslag til flowchart for utredning av RAP (figur 1).
Hva gjør vi der utredningen ikke avdekker en årsak?
Selv etter nøye gjennomgang gjenstår en gruppe der tilstanden må klassifiseres som idiopatisk. I denne gruppen lønner det seg å følge opp og ta en ekstra runde dersom anfallene vedvarer. Det er et mål å holde denne gruppen så liten som mulig, all den tid residiverende og plagsomme anfall av pankreatitter uten påvist årsak kan være frustrerende både for pasient og behandler.
Utredning med endoskopisk ultralyd eller MRCP 4-6 uker etter anfall av idiopatisk AP er et nyttig verktøy for å avdekke oversett biliær etiologi eller obstruerende prosess. I papilleområdet har trolig EUS noe bedre sensitivitet enn MRCP. Den kontroversielle rollen til ERCP med papillotomi ved idiopatisk RAP og pankreas divisum eller normal duct anatomi er omtalt ovenfor (4). Mer liberal genetisk testing kan også vurderes i idiopatisk gruppe med persisterende RAP. Involver gjerne multidisplinære team i diskusjonen.
Konklusjon
Residiverende anfall av akutte pankreatitter er en plagsom tilstand som dersom den vedvarer har en høy andel av progresjon mot kronisk pankreatitt og funksjonssvikt. Ved riktig håndtering kan denne fasen av det fibroinflammatoriske pankreatitt-syndromet være et vindu for forebyggende tiltak.
Bekreftet RAP (Atlanta kriterier, ≥ 2 anfall)
Identifisert etiologi Vurdere forebyggende tiltak?
Første screening
UL abdomen- Biliær pankreatitt?
Blodprøver: Triglycerider, Ca
Alkohol: Anamnese, audit, B-PETH Medikamentgjennomgang Vurdere CT om ikke gjennomført i akuttfase
Utvidet biokjemi?
IgG4, PTH (Ved høy Ca), ANA
Utvidet anatomisk gjennomgang (Gallestener, anatomiske anomalier, tumores) EUS/MRCP, CT (Modalitet etter tilgjengelighet)
Genetisk testing Next generation sequencing pakker (PRSS1, CFTR, CASR, SPINK 1)
Idiopatisk RAP Ny gjennomgang?
Fig 1: Flow chart for utredning av residiverende akutte pankreatitter. Et forslag tilpasset norske forhold fra norsk interessegruppe for pankreassykdommer
Referanseliste
1. Whitcomb DC, Frulloni L, Garg P, Greer JB, Schneider A, Yadav D, et al. Chronic pancreatitis: An international draft consensus proposal for a new mechanistic definition. Pancreatology : official journal of the International Association of Pancreatology (IAP) [et al]. 2016;16(2):218–24.
2. Guda NM, Muddana V, Whitcomb DC, Levy P, Garg P, Cote G, et al. Recurrent Acute Pancreatitis: International State-of-the-Science Conference With Recommendations. Pancreas. 2018;47(6):653–66.
3. International Association of Pancreatology Revised Guidelines on Acute Pancreatitis 2025: Supported and Endorsed by the American Pancreatic Association, European Pancreatic Club, Indian Pancreas Club, and Japan Pancreas Society. Pancreatology : official journal of the International Association of Pancreatology (IAP) [et al]. 2025;25(6):770–814.
4. Strand DS, Law RJ, Yang D, Elmunzer BJ. AGA Clinical Practice Update on the Endoscopic Approach to Recurrent Acute and Chronic Pancreatitis: Expert Review. Gastroenterology. 2022;163(4):1107–14.
5. Cook ME, Bruun NH, Davidsen L, Drewes AM, Olesen SS. Multistate Model of the Natural History of Inflammatory Pancreatic Diseases: A Nationwide Population-based Cohort Study. Gastroenterology. 2023;165(6):1547–57.e4.
6. Hegyi PJ, Soós A, Tóth E, Ébert A, Venglovecz V, Márta K, et al. Evidence for diagnosis of early chronic pancreatitis after three episodes of acute pancreatitis: a cross-sectional multicentre international study with experimental animal model. Sci Rep. 2021;11(1):1367.
7. Lee PJ, Bhatt A, Holmes J, Podugu A, Lopez R, Walsh M, et al. Decreased Severity in Recurrent Versus Initial Episodes of Acute Pancreatitis. Pancreas. 2015;44(6):896–900.
8. Whitcomb DC. Pancreatitis: TIGAR-O Version 2 Risk/Etiology Checklist With Topic Reviews, Updates, and Use Primers. Clinical and translational gastroenterology. 2019;10(6):e00027.
9. Cammarata F, Rovati L, Fontana P, Gambitta P, Armellino A, Aseni P. Endoscopic Ultrasound to Identify the Actual Cause of Idiopathic Acute Pancreatitis: A Systematic Review. Diagnostics (Basel). 2023;13(20).
10. Yadav D, O'Connell M, Papachristou GI. Natural history following the first attack of acute pancreatitis. AmJGastroenterol. 2012;107(7):1096–103.
11. Olesen SS, Poulsen JL, Drewes AM, Frokjaer JB, Laukkarinen J, Parhiala M, et al. The Scandinavian baltic pancreatic club (SBPC) database: design, rationale and characterisation of the study cohort. Scandinavian journal of gastroenterology. 2017;52(8):909–15.
12. Ahmed Ali U, Issa Y, Hagenaars JC, Bakker OJ, van Goor H, Nieuwenhuijs VB, et al. Risk of Recurrent Pancreatitis and Progression to Chronic Pancreatitis After a First Episode of Acute Pancreatitis. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2016;14(5):738–46.
13. Sadr-Azodi O, Oskarsson V, Discacciati A, Videhult P, Askling J, Ekbom A. Pancreatic Cancer Following Acute Pancreatitis: A Population-based Matched Cohort Study. The American journal of gastroenterology. 2018;113(11):1711–9.
14. Takeyama Y. Long-term prognosis of acute pancreatitis in Japan. ClinGastroenterolHepatol. 2009;7(11 Suppl):S15–S7.
15. Tjora E, Dimcevski G, Haas SL, Erchinger F, Vujasinovic M, Löhr M, et al. Patient reported exposure to smoking and alcohol abuse are associated with pain and other complications in patients with chronic pancreatitis. Pancreatology : official journal of the International Association of Pancreatology (IAP) [et al]. 2020;20(5):844–51.

Jørgen Valeur, Unger-Vetlesens Institutt, Lovisenberg Diakonale Sykehus og Institutt for klinisk medisin, Universitetet i Oslo

Figur 1. Kappklippegrevling (Procavia capensis). Illustrasjon fra Die Säugthiere in Abbildungen nach der Natur (1774). © Purix Verlag Volker Christen / Bridgeman Images.
Skinnet bedrar: Klippegrevlinger er ikke gnagere, slik de ser ut som (fig. 1); ei heller mårdyr, slik navnet antyder. Undersøker man dem nøye, vil man faktisk oppdage at de har små støttenner og en marin myoglobinvariant (1): De er merkelig nok nære slektninger av elefanter og sjøkuer (fig. 2). Klippegrevlinger bor i fjellklipper og trær i Afrika og Midtøsten, og etablerer latriner som benyttes i generasjoner over flere hundre år. Ekskrementene hoper seg opp i store møddinger og vil etterhvert forstenes – en prosess som gir opphav til et interessant naturprodukt: Hyraceum.
For geologer representerer de fossilerte møddingene et verdifullt «arkiv», der analyser av pollen, stabile isotoper og biomarkører kan brukes til å rekonstruere fortidens miljø (2). I parfymeindustrien er hyraceum kjent som pierre d’Afrique – «Afrikastein» – og er en ettertraktet ingrediens grunnet sin karakteristiske, animalske duft. I folkemedisinen har hyraceum blant annet blitt brukt som motgift mot slange- og skorpionbitt og mot ulike krampetilstander, som
Figur 2. Kladogram over Paenungulata, etter Tabuce et al. (5). Illustrasjon: Jørgen Valeur.
kolikk og epilepsi. Preliminære undersøkelser tyder på at materialet kan være et uoppdaget «apotek», en droge som blant annet inneholder antioksidanter (3) og benzodiazepin-lignende substanser (4).
Det nederlandske ordet for grevling er das, og i Sør-Afrika, hvor man snakker afrikaans, kalles klippegrevlinger for dassies. Dassiepis lyder kanskje mer prosaisk enn hyraceum, men navnet er ganske dekkende som betegnelse for ublandet Eau de Toilette.
Litteratur:
1. Mirceta S, Signore A, Burns JM, Cossins AR, Campell KL, Berenbrink M. Evolution of mammalian diving capacity traced by myoglobin net surface charge. Science 2013; 340: 1234192.
2. Chase BM, Scott L, Meadows ME, Gil-Romera G, Boom A, Carr AS, Reimer PJ, Luc T, Valsecchi V, Quick LJ. Rock hyrax middens: A palaeoenvironmental archive for southern African drylands. Quart Sci Rev 2012; 56: 107-25.
3. Magama S, Rantsâ T, Asita AO, Taole M. Evaluation of Procavia capensis hyraceum used in traditional medicine for antioxidant activity. J Med Plants Res 2018; 12: 248-57.
4. Olsen A, Prinsloo LC, Scott L, Jäger AK. Hyraceum, the fossilized metabolic product of rock hyraxes (Procavia capensis): shows GABA-benzodiazepine receptor affinity. S Afr J Sci 2007; 103: 437-8.
5. Tabuce R, Asher RJ, Lehmann T. Afrotherian mammals: a review of current data. Mammalia 2008; 72: 2-14.
A review article published by Gastroenterologists at Sahlgrenska University Hospital (Sweden) concludes:
“BAD
is common, and likely underdiagnosed. BAD should be considered relatively early in the differential diagnosis of chronic diarrhoea.”1
SeHCAT is strongly recommended as a diagnostic tool for investigation of BAD in the BSG guidelines2
“In those with functional bowel or IBS-diarrhoea, a positive diagnosis of BAD should be made either by SeHCAT testing or serum bile acid precursor 7ɑ-hydroxy-4-cholesten-3-one(depending on local availablity)”
Grade of evidence level 1
Strength of recommendation strong2
“There is insufficient evidence to recommend use of an empirical trial of treatment for bile acid diarrhoea rather than making a positive diagnosis”
Grade of evidence level 5
Strength of recommendation strong2
Studies have shown there is a relationship between the severity of malabsorption and the response to therapy3
Response to therapy in relation to SeHCAT retention score
SeHCAT kapsler
(Vennligst konsulter fullstendig preparatomtale [SPC] før bruk) VIRKESTOFF tauroselkol(75Se)syre - 370 kBq ved referansetidspunktet.
INDIKASJONER Brukes ved undersøkelse av malabsorpsjon av gallesyre og måling av tap fra gallesyre-pool. Kan også brukes ved vurdering av ileumfunksjon, ved undersøkelse av inflammatorisk tarmsykdom og kronisk diarè samt ved studier av enterohepatisk sirkulasjon. DOSERING OG ADMINISTRASJONSMÅTE Normal dose for voksne og eldre er oral administrasjon av en kapsel. Hvis preparatet skal administreres til barn, brukes samme dose som til voksne. Det finnes ingen doseringsform eller klinisk erfaring med bruk av produktet til barn.
KONTRAINDIKASJONER Hypersensitivitet mot virkestoffet eller noen av hjelpestoffene.
ADVARSLER OG FORSIKTIGHETSREGLER Ved overømfintlighet- eller anafylaktisk reaksjon stanses administrasjonen av legemidlet omgående og intravenøs behandling igangsettes om nødvendig. Legemidler og utstyr til resuscitering (f.eks. endotrakealslange og respirator) skal være lett tilgjengelig. Forsiktighet må utvises ved administrering av SeHCAT til pasienter med alvorlig leverinsuffisiens eller obstruksjon av galleganger ettersom stråledosen til leveren økes signifikant i slike til tilfeller. Individuell nytte / risikovurdering foretas for den enkelte pasient. Den administrerte radioaktiviteten må i hvert tilfelle være slik at stråledosen blir så lav som mulig vurdert opp mot behovet for å oppnå det ønskede diagnostiske resultat. Nedsatt leverfunksjon: En nøye vurdering av forholdet mellom nytte og risiko er påkrevd hos disse pasientene siden en økt eksponering for radioaktivitet er mulig. Pediatrisk populasjon: Ingen data er tilgjengelig. En nøye vurdering av indikasjon er nødvendig siden den effektive dose pr. MBq er høyere enn for voksne. Pasienten bør være godt hydrert før undersøkelsen og oppfordres til å late vannet så hyppig som mulig i løpet av de første timene etterpå for å redusere strålingen. Produkter inneholder 3,01 mmol (71,04 mg) natrium pr. kapsel. Dette må tas hensyn til for pasienter på kontrollert natriumdiett. Se fullstendig SPC for generell advarsel om håndtering av radiofarmasøytiske legemidler, og for informasjon om administrasjon og destruksjon av SeHCAT.
GRAVIDITET OG AMMING Når administrasjon av radiofarmaka til en kvinne i fertil alder er planlagt, er det viktig å fastslå hvorvidt hun er gravid. Dersom det er tvil om hennes mulige graviditet, skal alternative teknikker som ikke bruker ioniserende stråling (om tilgjengelig) tilbys pasienten. Det finnes ingen opplysninger om bruk av produktet under graviditet. Nukleærmedisinske undersøkelser av gravide kvinner medfører stråledoser til fosteret. Kun nødvendige undersøkelser må derfor utføres under svangerskapet, når den sannsynlige nytteverdien langt overstiger risikoen påført mor og foster. Dersom administrasjonen til ammende kvinner anses nødvendig, må amming avbrytes og morsmelken kastes ca. 3-4 timer etter inntak av SeHCAT, før ammingen kan gjenopptas.
BIVIRKNINGER Bivirkninger av tauroselkol(75Se)syre er sjeldne. Enkelte tilfeller av mulige allergiske reaksjoner er rapportert etter bruk av produktet, men kausalitet er ikke endelig klarlagt. Eksponering for ioniserende stråling innebærer risiko for induksjon av kreft og mulighet for utvikling av arvelige defekter. Siden den effektive dosen er 0,26 mSv når den maksimale anbefalte aktiviteten på 370 kBq administreres, er sannsynligheten for at disse bivirkningene forekommer forventet å være lav. Hypersensitivitets reaksjoner er rapportert (ukjent frekvens). Melding av mistenkte bivirkninger etter godkjenning av legemidlet er viktig. Det gjør det mulig å overvåke forholdet mellom nytte og risiko for legemidlet kontinuerlig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Dette gjøres via meldeskjema som finnes på nettsiden til Statens legemiddelverk: www.legemiddelverket.no/meldeskjema.
GODKJENT UTSALGSPRIS 1 kapsel: kr. 6023.30.
RESEPTGRUPPE C.
INNEHAVER AV MARKEDSFØRINGSTILLATELSEN: GE Healthcare Buchler GmbH & Co. KG, Braunschweig, Tyskland. MT-nummer 8321. Dato for revisjon av tekst: April 2024, basert på SPC datert 08.01.2019
BSG: British Society of Gastroenterology
References:
1. Mottacki N, Simrén M, Bajor A et al. Alliment Pharmacol Ther 2016; 43 (8): 884-98.
2. Arasaradnam RP, Brown S, Forbes A et al. Gut 2018 Aug; 67(8): 1380-99. doi: 10.1136/gutjnl-2017-315909.
3. Wedlake L, Aʼhern R, Russell D et al. Aliment Pharmacol Ther 2009; 30 (7): 707-17.
© 2025 GE HealthCare.
SeHCAT is a trademark of GE HealthCare. GE is a trademark of General Electric Company used under trademark license. GE Healthcare AS, Nycoveien 1, Postboks 4220 Nydalen, 0401 Oslo, www.gehealthcare.no 02-2025 JB00286NO/PRT/OS NORWAY





Ingrid M. Mikalsen, Gastromedisinsk avdeling, Oslo universitetssykehus Ullevål
Institutt for Klinisk medisin, Det medisinske fakultet, Universitetet i Oslo
Kim V. Ånonsen, Gastromedisinsk avdeling, Oslo universitetssykehus Ullevål
Vendel A. Kristensen, Gastromedisinsk avdeling, Oslo universitetssykehus Ullevål
Institutt for Klinisk medisin, Det medisinske fakultet, Universitetet i Oslo
Asle W. Medhus, Medisinsk klinikk, Oslo universitetssykehus Ullevål
Institutt for Klinisk medisin, Det medisinske fakultet, Universitetet i Oslo
Endoskopisk retrograd kolangiopankreatografi (ERCP) ble første gang utført i Norge i 1973. Det som startet som et diagnostisk hjelpemiddel, er i dag en avansert terapeutisk prosedyre og førstelinjebehandling ved en rekke tilstander i galle- og pankreasganger. Prosedyren har utviklet seg, men har kvalitetsarbeidet holdt tritt? Hvordan står det til med kvaliteten på ERCP i Norge? Det vet vi ikke godt nok – og det ønsker vi å gjøre noe med.
ERCP – fra diagnoseverktøy til avansert behandling
ERCP ble først introdusert i Norge av Arne R. Rosseland ved Skien sykehus (1). Kort tid etter tok også Magne Osnes prosedyren i bruk ved Ullevål sykehus (2). Den gang var ERCP først og fremst et diagnostisk verktøy og et viktig fremskritt, da det muliggjorde fremstilling av områder som tidligere ikke kunne visualiseres radiologisk. Dette har endret seg med innføringen av MRCP. I dag er ERCP primært en terapeutisk prosedyre som benyttes ved steinssykdom, benigne og maligne stenoser, og postoperative komplikasjoner. Årlig gjennomføres det om lag 6000 ERCP-prosedyrer i Norge (3).
ERCP har relativt høy risiko for komplikasjoner. Milde sedasjonsreaksjoner dominerer, men alvorlige komplikasjoner som pankreatitt, blødning, perforasjon eller infeksjon forekommer også. I litteraturen varierer komplikasjonsraten fra 4 % til 13 % (4, 5). Den store variasjonen skyldes blant annet ulik studiedesign, pasientseleksjon og definisjon av komplikasjoner(6, 7). For å vurdere om komplikasjonsrisikoen står i forhold til nytten for pasientene, trenger vi pålitelige kvalitetsregistre.
Registrering i Gastronet – når bare to av tre prosedyder telles
For å sikre faglig standard registreres ERCP-prosedyrer i det nasjonale kvalitetsregisteret Gastronet. De viktigste kvalitetsindikatorene, som baserer seg på ESGEs retningslinjer (8), er listet i tabell 1.
Tabell 1: Kvalitetsindikatorer for ERCP, Gastronet
Kvalitetsindikatorer Målsetning
Måloppnåelse >90 %
Gallegangskanylerinsrate >90 %
Post-ERCP-pankreatitt <10 %
Komplikasjoner (30 dager) Ikke angitt/definert
Mortalitet (30 dager) Ikke angitt/definert
Kvaliteten på dataene avhenger av dekningsgrad, altså hvor stor andel av prosedyrene som rapporteres til registeret. I 2024 var den nasjonale dekningsgraden på 65 %, men variasjonen mellom sykehusene var stor, fra ingen innrapportering til over 90 % (3). Når bare to av tre prosedyrer registreres, blir det vanskelig å trekke sikre konklusjoner. Vi vet rett og slett ikke om dataene vi har er representative. De kan både over- og underrapportere faktisk kvalitet.
Erfaring fra Ullevål:
Hva skjer når man styrker registreringen?
Ved Oslo universitetssykehus (OUS) Ullevål oppnådde vi kun én gang mellom 2018 og 2023 målet om 80 % dekningsgrad (Figur 1). Fra 1. januar 2024 begynte vi å registrere våre ERCP-er i et nytt forsknings- og kvalitetsregister, GasReg. Det førte til økt innrapportering til Gastronet, noe som resulterte i signifikante endringer i måloppnåelse (Figur 2), fra 94 % til 85 %. Det var ingen signifikante endringer for de øvrige kvalitetsindikatorene.
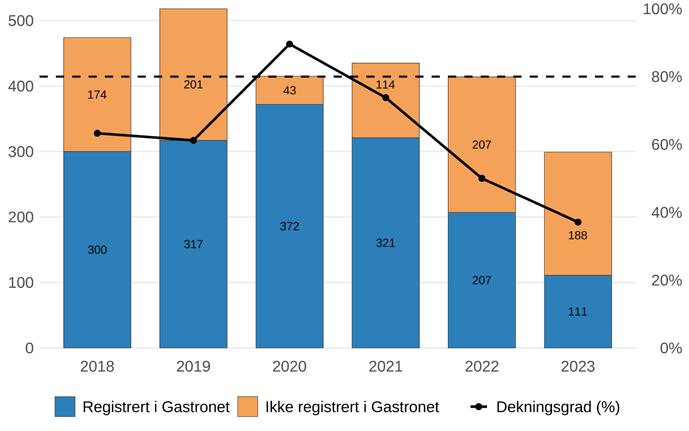
Figur 1: Dekningsgrad i Gastronet for ERCP, Gastromedisinsk avdeling OUS Ullevål, 2018-2023
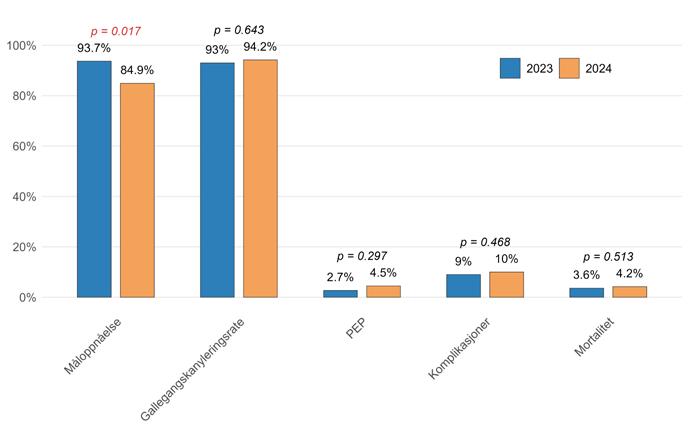
Figur 2: Endring i kvalitetsindikatorer for ERCP, fra 2023 til 2024. Post-ERCP-pankreatitt (PEP), komplikasjoner og mortalitet er innen 30 dager etter ERCP.
En nærmere analyse viste at forskjellen i måloppnåelse fortsatt var signifikant når vi inkluderte delvis måloppnåelse og oppnådde delmål (Figur 3). Vi vurderte også prosedyrens kompleksitet etter ASGE-klassifikasjonen, men fant ingen klare forskjeller mellom årene. Det er mulig at økt dekningsgrad har ført til mer representativ registrering, inkludert prosedyrer som tidligere ble utelatt. Mer komplekse prosedyrer tar ofte lenger tid, noe som kan føre til at registrering nedprioriteres. Annen rapporteringsbias kan også forekomme, for eksempel underrapportering av prosedyrer med lavere suksessrate og høyere risiko, ofte omtalt som “gaming”(9).
Komplikasjonsraten ga også interessante funn (figur 4). Selv om antallet post-ERCP-pankreatitter (PEP) ikke økte signifikant, så vi prosentvis nesten en dobling. Andelen kanyleringer av pankreasgangen, en kjent risikofaktor, økte også signifikant. Dette kan skyldes mer nøyaktig registrering. Bruken av PEP-profylakse (NSAIDs, rektal stikkpille) økte, men andelen er fortsatt for lav. Vi mistenker at dette kan ha sammenheng med at variabelen ikke er obligatorisk i Gastronet, og at registreringen dermed ofte uteblir.
Disse funnene baserer seg på små tall og må tolkes med forsiktighet. De bør etterprøves i et større materiale fra flere sykehus.
Innføringen av GasReg la grunnlaget for økt registrering ved vår avdeling. Endoskopørene ble informert om viktigheten av registrering. Vi gikk jevnlig gjennom prosedyrelistene og fulgte opp dersom en prosedyre ikke var registrert. I tillegg ble det innført rutiner for oppfølging av 30-dagers komplikasjoner og godkjenning av skjema. Dette kunne gjøres av lege, eller sykepleier under oppfølging fra lege. Vi samarbeidet tett med sykepleierne, som nå også er medansvarlige for opprettelse og utfylling av ERCP-skjemaet. Når dette gjøres systematisk, krever det lite ekstra ressurser. Samtidig ser vi at registreringen nå er mer nøyaktig, og kan brukes aktivt i egenevaluering og forbedring.
Hvorfor vi trenger bedre data nå Den siste nasjonale gjennomgangen ble gjort av Glomsaker, med data fra perioden 1998 til 2009 (10-12). Mye har skjedd siden den gang. ERCP er i utvikling, og nye teknikker som duktoskopi og endoskopisk ultralyd (EUS) er tatt i bruk. Det er derfor viktig å undersøke om denne utviklingen har påvirket indikasjoner og komplikasjonsrater. Pasientpopulasjonen har også endret seg, med økt alder og komorbiditet. Vi vet lite om hvordan dette påvirker ERCP-praksis i dag. Følger vi retningslinjene? Brukes ERCP på riktig indikasjon og til riktig pasient? Det er på høy tid med en ny, systematisk gjennomgang.
Vi er allerede pålagt å registrere ERCP i Gastronet. Kvalitetsdata handler ikke bare om pasientsikkerhet, men også om teknisk og faglig utvikling for den enkelte lege. Internasjonale retningslinjer anbefaler systematisk registrering for alle som utfører ERCP. Dette er vist å ha nytte både for pasient og behandler. I Sverige har GallRiks hatt høy dekningsgrad, mange publikasjoner og er vist å øke kvaliteten på pasientbehandlingen (13). Det samme gjelder for Nederland hvor innføring av ERCP-registrering fra 2011 ga en klar kvalitetsforbedring (14).
Doktorgradsprosjektet: Et nasjonalt løft
Ved OUS Ullevål har vi igangsatt et PhD-prosjekt for å kartlegge indikasjoner, komplikasjoner og mortalitet etter ERCP i Norge, og gi en oppdatert status på nasjonal praksis. Vi vil bruke data fra Gastronet, NPR, Kreftregisteret og Dødsårsaksregisteret. Et godt datagrunnlag fra Gastronet forutsetter høyere dekningsgrad.
Vi håper at våre erfaringer kan vise verdien av økt innrapportering og samtidig inspirere til større engasjement for kvalitetsarbeid.
Bedre data gir et tryggere beslutningsgrunnlag, til nytte for både pasientene og fagmiljøet.
Referanser
1. Paulsen V. Arne Rosseland - den siste mohanikaner? NGF-nytt. 2012;2:30–1.
2. Glomsaker T. ERCP: Er kvaliteten på prosedyren god nok ved norske sykehus? NGF-nytt. 2013;4:18–21.
3. Huppertz-Hauss GT, Magnus. Gastronet – Årsrapport for 2024. Skien: Sykehuset i Telemark, Gastronet; 2025 2025 Jun 15.
4. Dumonceau JM, Kapral C, Aabakken L, Papanikolaou IS, Tringali A, Vanbiervliet G, et al. ERCP-related adverse events: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2020;52(2):127–49.
5. Committee ASoP, Chandrasekhara V, Khashab MA, Muthusamy VR, Acosta RD, Agrawal D, et al. Adverse events associated with ERCP. Gastrointest Endosc. 2017;85(1):32–47.
6. Anderson MA, Fisher L, Jain R, Evans JA, Appalaneni V, Ben-Menachem T, et al. Complications of ERCP. Gastrointest Endosc. 2012;75(3):467–73.
7. Bishay K, Meng ZW, Khan R, Gupta M, Ruan Y, Vaska M, et al. Adverse Events Associated With Endoscopic Retrograde Cholangiopancreatography: Systematic Review and Meta-Analysis. Gastroenterology. 2025;168(3):568–86.
8. Domagk D, Oppong KW, Aabakken L, Czakó L, Gyökeres T, Manes G, et al. Performance measures for ERCP and endoscopic ultrasound: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy. 2018;50(11):1116–27.
9. Shahian DM, Jacobs JP, Badhwar V, D'Agostino RS, Bavaria JE, Prager RL. Risk Aversion and Public Reporting. Part 1: Observations From Cardiac Surgery and Interventional Cardiology. Ann Thorac Surg. 2017;104(6):2093–101.
10. Glomsaker T, Hoff G, Kvaløy JT, Søreide K, Aabakken L, Søreide JA. Patterns and predictive factors of complications after endoscopic retrograde cholangiopancreatography. Br J Surg. 2013;100(3):373–80.
11. Glomsaker T, Soreide K, Aabakken L, Soreide JA. A national audit of temporal trends in endoscopic retrograde cholangiopancreatography in Norway. Scand J Gastroenterol. 2011;46(1):116–21.
12. Glomsaker T, Søreide K, Hoff G, Aabakken L, Søreide JA. Contemporary use of endoscopic retrograde cholangiopancreatography (ERCP): a Norwegian prospective, multicenter study. Scand J Gastroenterol. 2011;46(9):1144–51.
13. Enochsson L, Sandblom G, Osterberg J, Thulin A, Hallerback B, Persson G. [GallRiks 10 years. Quality registry for gallstone surgery have improved health care]. Lakartidningen. 2015;112.
14. Theunissen F, van der Wiel SE, Ter Borg PCJ, Koch AD, Ouwendijk RJT, Slangen RME, et al. Implementation of mandatory ERCP registration in The Netherlands and compliance with European Society of Gastrointestinal Endoscopy performance measures: a multicenter database study. Endoscopy. 2022;54(3):262–7.
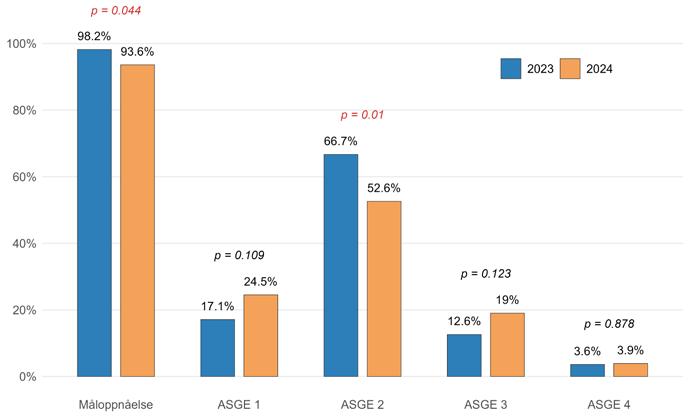
Figur 3: Subgruppeanalyse på kvalitetsindikatoren måloppnåelse, hvor også oppnådd delmål eller delvis måloppnåelse er inkludert. Prosedyrens kompleksitet etter ASGE-klassifikasjonen, fra 1: minst kompleks, til 4: mest kompleks.
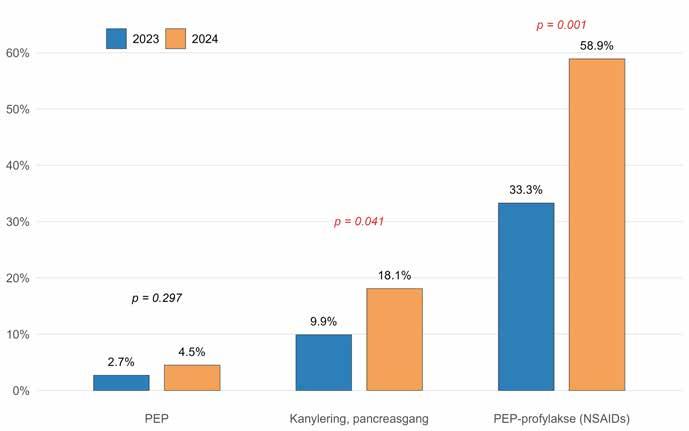



Jens Aksel Nilsen, Overlege Bærum sykehus og OUS Gastrolab Rikshospitalet/ Ullevål, Endoskopiskolen, PhD stipendiat Klinisk effektforskningsgruppe, UiO Nima Mottacki, Overlege Sahlgrenska Universitetssykehus og Östra sjukhuset, Sahlgrenska - Gøteborg Ole Darre-Næss, Leder Endoskopiskolen, Overlege Bærum sykehus og Gastrolab OUS Rikshospitalet
I Norge har ESD har de siste årene gått fra å være en lavvolumprosedyre til bli et realistisk, organbevarende behandlingsalternativ for store polypper og overfladisk kreft i GI-traktus. Nedenfor oppsummeres status, hva prosedyren innebærer i klinisk praksis, hvilke pasienter som bør behandles med ESD, hvordan etterarbeidet organiseres—og hvorfor gastroenterologens aktive deltagelse i onkokirurgiske MDT-møter er avgjørende for kvalitet og pasientsikkerhet. Denne artikkelen handler først og fremst om ESD i tykk- og endetarm, men vi kommer kort innom ESD i øvre GI-traktus også.
Hva er ESD – og hvorfor en-bloc?
Endoskopisk submukosal disseksjon (ESD) er en organbevarende reseksjonsteknikk der en overflatisk neoplasi fjernes i én sammenhengende bit ved hjelp av diatermikniv gjennom et fleksibelt endoskop (figur 1). Hovedpoenget med ESD er å fjerne lesjonen komplett i én bit. Da kan patologen vurdere marginer og hele lesjonens biologi presist, og pasienten kan oppnå kurativ, organbevarende behandling når onkologiske kriterier er oppfylt. Dette står i klar kontrast til piecemeal-teknikker, som ofte gir usikre marginer, høyere residivrate og lavere kurasjonsrater ved tidlig kreft fordi histologien blir fragmentert og vanskelig å tolke. ESD har i praksis ingen øvre størrelsesbegrensning og som hovedregel utføres der man trygt når frem med et fleksibelt endoskop, altså i spiserør, magesekk, tykktarm og endetarm. Enkelte lokalisasjoner er teknisk mer takknemlige (spiserør, antrum og midtre endetarm), mens andre krever betydelig mer av operatøren (anorektal overgang, ulike deler av tykktarmen, samt cardia–fundus og til dels corpus ventriculi).
Behovet for en pålitelig en-bloc-plattform er tydelig også i norsk sammenheng. Til tross for at benigne kolorektale polypper i utgangspunktet skal behandles endoskopisk, viser en nasjonal registerstudie at kirurgiske reseksjoner av benigne polypper økte i perioden 2008–2021, samtidig som andelen pasienter som ble operert bare sank marginalt (1). Dette innebærer at overbehandling fortsatt er utbredt i Norge med høyere komplikasjons- og kostnadsbyrde enn nødvendig, og understreker verdien av standardiserte polyppmøter, styrket endoskopisk kompetanse og økt bruk av en-bloc-teknikker som ESD når onkologien krever det.
Indikasjoner og seleksjon – «riktig lesjon til riktig metode»
Hovedindikasjonen for ESD er lesjoner der en-bloc-reseksjon er nødvendig eller klart ønskelig – typisk ved mistanke om høygradig dysplasi eller overflatisk T1-kreft, og når størrelse og lokalisasjon gjør piecemeal uegnet. Pre-reseksjonsvurderingen er endoskopibasert og bør være systematisk: angi lokalisasjon og størrelse, beskriv morfologi (Paris og LST), og vurder overflaten med hvitt lys og NBI (JNET). Enkelte mønstre peker særlig mot behov for en-bloc: lateralt spredende polypper med blandet granulært mønster når en nodulus er over 10 mm (LST-Gm), glatte (non-granulære) LST, og lesjoner med sentral forsenkning (Paris IIc). JNET 2B-mønster bør utløse vurdering for en-bloc reseksjon, ofte med ESD, og dette gjelder særlig i rektum og distale tykktarm, men bør også diskuteres ved tilsvarende morfologi og overflate i proksimale tykktarm. En-bloc anbefaling ved overnevnte funn gjelder uansett størrelse, men for polypper under 20 mm anbefales (u)EMR, fordi metoden er raskere og ofte gir komplett reseksjon for mindre polypper. Ved behandling av polypper over 20 mm faller R0-raten for EMR markant; ved en-bloc-indikasjon i denne størrelsesgruppen anbefales derfor ESD. Ved optiske tegn til dyp submukosal invasjon (JNET 3) anbefales målrettet biopsi, full radiologisk stadieinndeling (CT thorax/abdomen/bekken og MR ved rektale lesjoner) og diskusjon i GI-MDT før behandlingsvalg som etter retningslinjer som hovedregel er kirurgi, men unntak kan gjøres dersom det er høy kirurgisk risiko. For øvrige benigne og overflatisk maligne polypper er rutinemessig radiologi ikke nødvendig, og beslutning om en-bloc (ofte ESD) kan fattes uten forutgående MDT – men med lav terskel for å ta saken opp i møte ved tvil. Viktig presisering: polypper som antas benigne eller overflatisk maligne (som hovedregel opp til og med JNET 2B) bør ikke biopseres før reseksjon; henvis i stedet til et miljø med ESD-kompetanse for helhetlig vurdering og en-bloc-strategi.
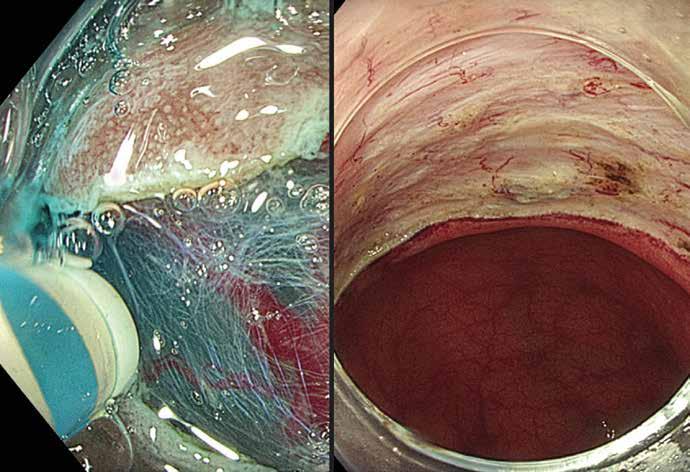
Hva med transanal mikrokirurgi som TEM og TAMIS? Direkte sammenligninger, har inntil i år manglet, og valget mellom TEM/TAMIS og ESD har vært gjort på bakgrunn av lokale tradisjoner og ekspertise. I 2025 har det endelig kommet tre komparative studier, hvorav to er randomiserte studier. Studiene viser gjennomgående høyere reseksjonskvalitet og lavere residiv etter ESD enn etter TEM/TAMIS ved store, overfladiske rektale lesjoner (2); dette bør i fremtiden vektlegges i metodevalget i de regionene hvor ESD er et utviklet tilbud med god kvalitet.
Prosedyregjennomføring og teamarbeid – praktiske prinsipper ESD planlegges med standard tarmtømming og valg av skop tilpasset lokalisasjon og lesjonsstørrelse. Reseksjonen bygger på submukosal injeksjon og kontrollert disseksjon med ESD-kniv. Mekanisk traksjon med klips og strikk brukes hyppig for å åpne disseksjonsplanet. Undervannsteknikk kan gi bedre oversikt i
planet, redusere termisk skade og samtidig dempe CO₂-relaterte plager under inngrepet som gir bedre prosedyretoleranse. I rektum kan endoskopisk intermuskulær disseksjon eller selektiv fullveggsdisseksjon vurderes hos pasienter der det peroperativt er mistanke om dyp submukosal vekst eller hvor man på forhånd har vurdert at primær kirurgi ikke er egnet; slike valg bør forankres i et multidisiplinært møte på forhånd. Intraoperative hendelser håndteres systematisk: perforasjoner forekommer sjelden, men skal identifiseres umiddelbart og lukkes med klips med mål om å kunne fullføre endoskopisk. De fleste ESD kan gjennomføres under våken sedasjon, mens dyp sedasjon eller generell anestesi vurderes selektivt ved store eller teknisk krevende polypper, særlig i tykktarm. ESD er lagarbeid: erfarne sykepleiere som kjenner prosedyreforløpet, tydelig rollefordeling og konsekvent «closed-loop»-kommunikasjon er grunnleggende for sikker disseksjon og høy kvalitet.
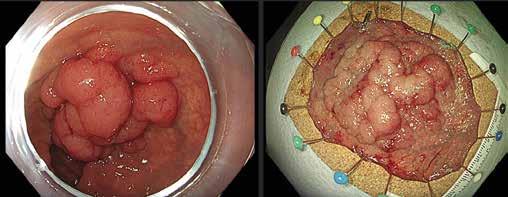
Histologi og kurativitet
Preparatet pinnes på kork og fikseres i formalin. Ved preparering av polyppen skjæres den i 2 mm skiver før detaljert mikroskopisk vurdering. Komplett reseksjon (R0) defineres som histologisk fri margin ≥ 0,1 mm (3). Kurativ reseksjon defineres som enten i) R0 av benign lesjon, eller ii) R0 av lav-risiko T1 (lavgradig carcinom, negativ LVI, Tumor-budding grad 1 og (submukosal invasjon < 1 mm –men dette kriteriet er mindre viktig enn de øvrige)). Disse definisjonene ligger til grunn for MDT-beslutning om enten observasjon eller kompletterende kirurgi.
Polypp spent på kork etter vellykket ESD. Bilde fra Bærum sykehus.
Etterarbeid, oppfølging og behov for kompletterende kirurgi
Oppfølging styres av reseksjonsstatus og histologi. Etter komplett en-bloc-reseksjon av polypper ≥10 mm anbefales kontrollkoloskopi etter tre år. Ved piecemeal-reseksjon eller R1/Rx av polypper ≥10 mm anbefales tidlige tomtekontroller – vanligvis etter seks måneder og, for lesjoner ≥20 mm, også etter 18 måneder – før man går over til treårsintervall ved normal tomt. Dette illustrerer en praktisk fordel med ESD: når en benign polypp >20 mm fjernes komplett i én bit, slipper pasienten (og sykehuset) de to ekstra kontrollkoloskopiene som ellers ville vært nødvendig.
Alle maligne polypper skal diskuteres i GI-MDT. Ved lavrisikokriterier (en-bloc R0, lavgradig tumor, ingen lymfovaskulær infiltrasjon, lav tumorbudding, (invasjonsdybde sm1/<1mm)) kan endoskopisk behandling anses kurativ; øvrige tilfeller vurderes for kompletterende kirurgi. Det er viktig at pasientfaktorer også diskuteres før endelig beslutning om ev. kompletterende behandling fattes – av og til er risikoen knyttet til kirurgi så stor at man aksepterer et kompromiss.
For pasienter som trenger kompletterende kirurgi etter ikke-kurativ lokal reseksjon, viser flere studier at primær lokal eksisjon ikke gir prognosetap sammenlignet med primær kirurgi; hos eldre og multimorbide kan strukturert oppfølging være et akseptabelt alternativ. Beslutning tas i MDT med avveiing mellom risiko for lymfeknutespredning (og for tilbakefall av CRC) og operasjonsrisiko.
Figur 2: Venstre: Polypp i øvre rektum av LST-GM type, hvor det ble utført ESD. Høyre: Bilde av samme polypp på kork under. Bilde fra Bærum sykehus.
Polyppkonferansen i HSØ og Polypp-MDT i Helse
Vest – beslutningsstøtte som virker
Formålet med polyppfora er enkelt: å redusere kirurgisk overbehandling av benigne polypper og hindre underbehandling som piecemeal-fjerning av tidlig kreft. Løsningen er å tilgjengeliggjøre kunnskap, standardisere vurderingen av polypper og heve kompetansen i alle ledd, samtidig som henvisningsveien for en-bloc-behandling (ESD) blir kort når det er indisert.
I Helse Sør-Øst drives en ukentlig, digital polyppkonferanse med Ahus, Bærum og OUS Ullevål som arrangørsykehus. Alle helseforetak og sykehus i HSØ er invitert til å melde inn saker for felles, strukturert vurdering og anbefaling, samt avklaring av om behandling bør gjøres lokalt eller ved ekspertsenter. I Helse Vest er Polypp-MDT ved Haukeland etablert som fast møte med gastroenterologer, gastrokirurger og patologer; erfaringen er at møtene gir bedre seleksjon før prosedyre og mer presis etterbehandling (4). Modellen er nå i startfase også i Stavanger, Midt- og Nord-Norge. Målet er likeverdig praksis nasjonalt: riktig metode til riktig pasient, færre unødvendige operasjoner og trygg en-bloc-strategi når onkologiske faktorer krever det.
Gastroenterologen bør være fast deltaker ved GI-MDT, og alle maligne polypper skal diskuteres der. I Helse Vest ivaretas dette i Polypp-MDT, mens HSØ, Stavanger, Midt og Nord bruker GI-MDT etter reseksjon. Endoskopørens dokumentasjon og vurdering av reseksjonskvalitet og lokalfunn er ofte avgjørende for beslutningen om kompletterende kirurgi eller oppfølging, og taler for at gastroenterologene deltar fast.
Organisering i Norge – hvor står vi?
Kolorektal ESD utføres i dag ved Haukeland, Bærum, Ahus, Ullevål og UNN Tromsø, og Stavanger og Bodø er i gang med å etablere prosedyren. Øvre GI-ESD tilbys ved Haukeland, Ullevål og UNN Tromsø. ESD har beveget seg fra spissmetode til etablert behandling med solide resultater: både Haukeland og Bærum har publisert resultater som ligger på eller over ESGEs kvalitetsmål for en-bloc, R0 og sikkerhet (5). Erfaringen samsvarer med internasjonale anbefalinger: høy kvalitet forutsetter robuste volumer, forutsigbar anestesi- og teamkapasitet, strukturert opplæring og systematisk kvalitetsmåling. Derfor bør ESD samles ved få, sterke miljøer med tydelig henvisningsflyt og felles kvalitetsindikatorer, fremfor å spre aktiviteten tynt. Med regionale polyppfora, fast for-
ankring i GI-MDT, et nasjonalt treningssenter og et kvalitetsregister på plass, ligger alt til rette for en konsentrert høyvolumsmodell som gir likeverdig tilgang og god kvalitet i hele landet.
Veien videre i 2026
Revisjonen av kapittel 6 («polyppkapittelet») i handlingsprogrammet planlegges publisert vinteren 2025/26 og vil skjerpe linjene for vurdering og behandling: standardisert endoskopisk vurdering (lokalisasjon, størrelse, morfologi og overflatemønster inkl. JNET), god bildedokumentasjon, konsekvent bruk av polyppkonferanse/ MDT, tydelige kompetanseanbefalinger og sentralisering av ESD der indikasjon foreligger. ESD løftes samtidig frem som foretrukket plattform for en-bloc behandling av polypper >20mm ved mistanke om høygradig dysplasi eller overflatisk T1-kreft. Dette forutsetter mer standardisert henvisningsflyt, prioritering av ESD-kapasitet og systematisk kvalitetsmåling i drift.
Kompetansebyggingen forsterkes: Endoskopiskolen åpner et nasjonalt ESD-treningssenter med strukturert opplæringsløp og teamtrening i januar 2026, og viderefører polyppkurs med teori, teambaserte øvelser. I tillegg tilbyr skolen hands-on polypp-kurs rundt på sykehusene etter nærmere avtale. Endoskopiskolen finansierer og har drevet frem det nasjonale kvalitetsregisteret for ESD og eFTR på Gastronet-plattformen, slik at sentrene kan måle en-bloc, R0, komplikasjoner og behov for kirurgi på en felles plattform og lære av hverandre. Skolen har også vært pådriver for innføring av egne ESD-koder fra 1.1.2026, dette blir viktig for å jobbe mot en mer bærekraftig finansiering fremover. Parallelt styrkes forskningen på endoskopisk behandling av tidlig kolorektalkreft, slik at kliniske valg kan understøttes av stadig bedre evidens.
Det norske ESD-miljøet kjemper også for bedre tilgang til anestesiressurser. Vi har tro på at økt fokus og annerkjennelse av metoden vil hjelpe. Ideelt bør kanskje 20-40% av ESD prosedyrene i rektum gjennomføres i propofolsedasjon eller generell anestesi, og ved ESD i tykktarm er generell anestesi ofte en fordel.
Summen av alt dette peker i samme retning: en mer standardisert, kompetent og bærekraftig ESD-tjeneste, til pasientens beste.
Nordic Endoluminal Therapy Society (NETS)
Å bygge spesialiserte miljøer i Norden er krevende. Lange avstander, små pasientgrunnlag og få tilgjengelige eksperter som kan gi tett veiledning og fungere som mentor gjør utvikling og drift av avansert endoskopi utfordrende. Dette var situasjonen ved Sahlgrenska for fire år siden: en fungerende ESD-virksomhet, men begrenset tilgang på erfarne supervisører og faglige ressurspersoner. Samtidig tok kolleger fra Norge kontakt for observasjon og erfaringsutveksling. Det som startet som enkelttiltak – jevnlige «Grand Rounds» om komplekse reseksjoner, hospitering, kurs og harmonisering av variabler for forskning – vokste raskt til et bredt nordisk samarbeid. Etter hvert ble enheter i Sverige, Norge, Island, Danmark og Finland involvert, og live-endoskopi ble etablert for hele nettverket, med inviterte internasjonale eksperter og med støtte fra SADE.
Det naturlige neste steget var å formalisere samarbeidet som Nordic Endoluminal Therapy Society (NETS). På kort sikt vil NETS hjelpe nordiske enheter å etablere og videreutvikle avansert endoskopi gjennom faglig støtte, regelmessige fysiske og digitale møter og målrettet kompetansebygging. På lengre sikt er målet felles forskningsprosjekter i Norden. Live-endoskopi skal fortsatt være en rød tråd: alle skal få innsyn i nye metoder, kunne spørre, utfordre og utvikle faget sammen. Med etablerte samarbeid – blant annet med SADE – ønsker vi kolleger med interesse for avansert kolorektal endoskopi velkommen til NETS.
Konklusjon
ESD er på vei fra lavvolumsprosedyre til etablert behandling i Norge, med resultater på nivå med europeiske kvalitetsmål. Veien videre er å øke behandlingskvaliteten ved å unngå over- og underbehandling gjennom standardisert endoskopisk vurdering, aktive polyppfora og fast deltakelse av gastroenterologer ved GI-MDT-møter. Med treningssenter, nasjonalt kvalitetsregister, dedikerte koder og tettere nordisk samarbeid ligger alt til rette for robuste høyvolumsmiljøer—så lenge vi bruker strukturene konsekvent, henviser riktig, dokumenterer godt og lærer mer av hverandre.
ESD – nøkkelbegreper
• Indikasjon for en-bloc: Mistanke om høygradig dysplasi/overflatisk T1 eller morfologi som krever en-bloc. <20 mm: EMR hvis R0 er sannsynlig. >20 mm: ESD ved en-bloc-indikasjon. Unngå biopsi ved malignitetsmistanke – henvis for helhetlig vurdering.
• Endoskopisk vurdering: Standardiser beskrivelse (lokalisasjon, størrelse, morfologi og overflate) med god foto/videodokumentasjon før beslutning om behandling. Bruk Polyppforum ved tvil om behandlingsvalg.
• Komplikasjoner: Perforasjoner identifiseres og lukkes oftest endoskopisk; mål om <1 % kirurgi for komplikasjon.
• Kvalitetsmål: En-bloc >90 %, R0 >80 %, perforasjon ~<3 %; rapporter til nasjonalt register.
• Etterarbeid (benigne): En-bloc R0 ≥10 mm g kontrollkoloskopi etter 3 år. Piecemeal/R1/Rx ≥10 mm g tomtekontroller (6 mnd; ved ≥20 mm også 18 mnd), deretter 3-årsintervall ved normal tomt.
• MDT og etterarbeid maligne polypper: Gastroenterolog skal delta fast i GI-MDT; alle maligne polypper diskuteres.
Referanseliste
1. Nilsen JA, Bernklev L, Bretthauer M, et al. Surgical treatment of benign colorectal polyps 2008–21. Tidsskrift for Den norske legeforening 2024.
2. de Frutos Rosa D, Sebastián IA, Declara DB, et al. A randomized trial of Endoscopic Submucosal Dissection vs Transanal Minimally Invasive Surgery in Early Rectal Neoplasms. DSETAMIS-2018 Study. Gastroenterology.
3. Gijsbers KM, van der Schee L, van Veen T, et al. Impact of ≥ 0.1-mm free resection margins on local intramural residual cancer after local excision of T1 colorectal cancer. Endoscopy international open 2022; 10: E282-e90.
4. Chawla RS, Houf JT, Havre RF, et al. Multidisiplinært team styrker samarbeidet om kolorektale polypper. Tidsskrift for Den norske legeforening 2024.
5. Nilsen JA, Juul FE, Egeland A, et al. Colorectal ESD in a nordic community hospital: learning curves and clinical outcomes. Scandinavian Journal of Gastroenterology: 1-10.
Forskningsmidlene skal anvendes til forskning innen fordøyelsessykdommer. Det kan søkes om støtte til drift, utstyr og lønnsmidler.
Søker må være medlem av NGF.
Det benyttes ikke skjema. Søknaden skal inneholde:
1) prosjektbeskrivelse (maks 2 sider)
2) CV for søker
3) beskrivelse av forskningsgruppen (maks 1 side).
Søkere uten doktorgrad må vedlegge anbefaling fra veileder.
Søknader som er ufullstendige, overstiger angitt lengde, mangler angitte vedlegg eller blir innsendt etter fristen behandles ikke.
Søknadsfrist 4. januar 2026
Søknaden m/vedlegg sendes elektronisk som 1 pdf-fil til komiteens styreleder
Kim Nylund: kiny@helse-bergen.no
Tildeling offentliggjøres på NGFs vintermøte 2026.

Til behandling av mild til moderat akutt ulcerøs kolitt og til vedlikehold av remisjon
HØY
SYKDOMSAKTIVITET
Ved akutt sykdom opptil 3 tabletter en gang daglig for induksjonsbehandling
Moderat
SYKDOMSAKTIVITET
2 tabletter en gang daglig for å oppnå remisjon
LAV
SYKDOMSAKTIVITET
1 tablett en gang daglig for å opprettholde remisjon
Utvalgt produkt- og sikkerhetsinformasjon Asacol TABLETTER MED MODIFISERT FRISETTING 1600 mg (mesalazin)
Indikasjon: Ulcerøs kolitt. For behandling av mild til moderat akutt sykdom. For vedlikehold av remisjon.
Dosering: Voksne Dosen bør justeres iht. sykdommens alvorlighetsgrad og toleranse.
Vedlikeholdsbehandling: 1600 mg 1 gang daglig. Akutt sykdom: Ved forverring kan dosen økes til 4800 mg 1 gang daglig eller fordelt på 2-3 doser. Ved remisjon bør dosen gradvis reduseres til vedlikeholdsdose. Fortsatt behandling bør vurderes nøye hos personer som ikke har respondert ved uke 8.
Administrering: Kan tas med eller uten mat. Skal svelges hele med et glass vann.
Kontraindikasjoner: Overfølsomhet for innholdsstoffene eller salisylater.
Alvorlig nedsatt lever- eller nyrefunksjon (GFR <30 ml/minutt/1,73 m2).
Vanligste bivirkninger: Dyspepsi, utslett ((≥1/100 til <1/10).
Forsiktighetsregler: Blodprøver (differensial blodtelling, leverfunksjonsparametere som ALAT og ASAT, serumkreatinin) bør tas og urinstatus (dip-sticks) sjekkes før og under behandlingen iht. behandlende leges vurdering.
Nedsatt nyrefunksjon: Bør ikke brukes ved nedsatt nyrefunksjon.
Nyrestein: Er sett, inkl. steiner som består av 100% mesalazin.
Misfargning av urinen: Mesalazin kan gi rødbrun misfargning av urinen etter kontakt med blekmidler inneholdende natriumhypokloritt.
Alvorlige kutane bivirkninger: Det er rapportert alvorlige kutane bivirkninger (SCAR), herunder legemiddelindusert utslett med eosinofili og systemiske symptomer (DRESS), Stevens-Johnson syndrom (SJS) og toksisk epidermal nekrolyse (TEN). Behandling med mesalazin bør avbrytes ved første tegn på og symptomer i form av alvorlige hudreaksjoner slik som utslett, slimhinnelesjoner eller andre tegn på overfølsomhet.
Bloddyskrasi: Er sett. Behandlingen skal seponeres umiddelbart ved mistanke om eller bevis på bloddyskrasi (tegn som uforklarlig blødning, blåmerker, purpura, anemi, vedvarende feber eller sår hals), og pasienten skal umiddelbart oppsøke medisinsk hjelp. Nedsatt leverfunksjon: Økte leverenzymnivåer er sett. Forsiktighet anbefales ved nedsatt leverfunksjon.
Kardiale overfølsomhetsreaksjoner: Mesalazininduserte overfølsomhetsreaksjoner (myo- og perikarditt).
Pulmonær sykdom: Pasienter med pulmonær sykdom, spesielt astma, bør følges opp nøye under behandlingen.
Overfølsomhet for sulfasalazin: Pasienter som har fått bivirkningsreaksjoner ved sulfasalazinbehandling bør være under nøye medisinsk overvåkning.
Mage- og duodenalsår: Forsiktighet anbefales ved eksisterende mage- eller duodenalsår. Idiopatisk intrakraniell hypertensjon (IIH): Er sett hos pasienter som får mesalazin. Pasienter bør gjøres oppmerksomme på tegn/symptomer på IIH, inkl. alvorlig eller gjentagende hodepine, synsforstyrrelser og tinnitus. Dersom IIH inntreffer bør seponering vurderes. Eldre personer: Skal administreres med forsiktighet til eldre pasienter.
Pediatrisk populasjon: Begrenset dokumentasjon.
Graviditet/Amming: Asacol bør bare brukes hvis mulig fordel oppveier mulig risiko.
Fertilitet: Effekt på fertilitet er ikke sett.
Referanser:
1. Asacol 1600 mg SPC, sist oppdatert 2025-06-20. * DMP Legemiddelsøk: https://www.legemiddelsok.no/sider/ default.aspx?searchquery=mesalazin&f=Han;MtI;Vir;ATC;Var; Ikk;Mar;Mid;Avr;gen;par;&pane=0, 2025-08-25.
Pakninger og priser: 60 stk. (blister) kr 1 038,30. Refusjon: Blåresept, Reseptgruppe C. Basert på SPC godkjent av DMP: 20.06.2025
For utfyllende informasjon om dosering, forsiktighetsregler, interaksjoner og bivirkninger – se felleskatalogen.no
Tillotts Pharma, Tel: +46 8-704 77 40 PM-ASA1600-NO-00040, AUG 2025
Kontakt Ellen Merete Oppi Christiansen på tlf. 992 27 686 eller via mail ellen-oppi.christiansen@tillotts.com Kontakt Ingunn Skeie på tlf. 900 60 952 eller via mail ingunn.skeie@tillotts.com
Tillotts Pharma AB | Gustavslundsv. 135, 167 51 Bromma | Tel: +46 8-704 77 40 nordicinfo@tillotts.com | www.tillotts.com

Gert Huppertz-Hauss

Gastronet har eksistert som kvalitetsregister siden 2003 med status som nasjonalt kvalitetsregister fra 2012. Det er også NGFs offisielle kvalitetssikringsplattform.
Besøk oss på www.Gastronet.no
Henvendelser til: Gert Huppertz-Hauss hhge@sthf.no eller Magnus Tarangen Magnus.Tarangen@sthf.no eller Gastronet@sthf.no
En godt tømt tykktarm er avgjørende for en god koloskopikvalitet. En utilstrekkelig tømt tarm kan føre til at viktige funn blir oversett, og det kan i verste fall føre til en overhyppighet av postkoloskopi cancer (1). I tillegg vil en koloskopi etter dårlig tarmpreparering være mer tidskrevende og muligens mer smertefull for pasienten.
I dag brukes det stort sett tre ulike tømmingsmidler i Norge: polyetylenglykol oppløsninger med høyt og lavt volum (Laxabon®/ Plenvu®) og picosulfatoppløsninger med lavt volum (Citrafleet®/ Picoprep®). Orale natriumfosfat oppløsninger (Phosphoral®) brukes ikke lenger rutinemessig grunnet frykten for bivirkninger.
For å oppnå et best mulig tømmingsresultat anbefales noen tiltak i dagene før koloskopien. Pasienten bør bruke en fiberredusert kost i flere dager. I denne sammenhengen bør korn (fullkornbrød/ müsli) uskrelt ris, appelsiner, druer, sopp, paprika og mais unngås. Derimot kan skrelt frukt uten kjerner, kokte gulrøtter, ost, kjøtt, fisk, loff, mel/yoghurt/is spises (2). Det er ikke nødvendig å spise flytende kost (3). I tillegg er en grundig og samtidig lett forståelig pasientinformasjon viktig. Det beste tarmtømmingsregime nytter ikke, hvis pasienten ikke bruker det riktig.
Har noen av de mest brukte tømmingsregimene fordeler frem for andre?
ESGE gir ingen spesiell anbefaling av regimet for rutinemessig tarmtømming. Alle de nevnte tarmtømmingspreparatene er effektive. Det foreligger ikke entydige studieresultater som dokumenterer bedre polyppdeteksjonsrater eller bedre tarmpreparasjonsscores avhengig av tømmingsvæsken som ble valgt (4). Dette gjelder også for sammenlikningen mellom lavvolum PEG og picosulfat (5). Derimot er pasientcompliance bedre i forbindelse med lavvolumsammenliknet med høyvolum PEG (6). Utover det kan lavvolum PEG gi hyppigere kvalme, men hadde mindre innvirkning på nattesøvn enn picosulfat preparater (5).
Uavhengig av preparatet som brukes må splittømming anbefales for alle pasienter. De som skal undersøkes sent på dagen bør splitte tømmingen på samme dagen. Splittømming gir et klart bedre tømmingsresultat som fører til signifikant bedre deteksjonsrater for adenomer og serraterte polypper (7). Tilsetning av laktulose eller simeticon kan ha positiv effekt på tømmingsresultatet. Derimot har additiva som bisacodyl, ascorbinsyre, linaclotide ikke vist effekt på tømmingsresultat og adenomdeteksjonsrate.
Hva viser egne erfaringer?
Gastronetdata fra 2022 til 2024 har vist en lettgradig, men signifikant bedre Boston Bowel Preparation Score (BBPS) etter lavvolum PEG- tømming sammenliknet med picosulfat- og høyvolum PEG-tømming (tabell 1). Dette har dog ikke hatt innflytelse på polyppdeteksjonsraten.
Kollegaene på Gastrolab Ullevål presenterte en studie på NGF sitt årsmøte hvor man sammenliknet tømmingseffekten av picosulfat med 2 l PEG oppløsning før videre rensninger ble gjort under en vannkoloskopi. Man benyttet en modifisert BBPS med dikotomisering til tilfredsstillende eller utilfredsstillende sikt. PEG oppløsningen førte til et signifikant bedre resultat med adekvat tarmtømming i hhv. 84,1 % og 68,5 % (9).
Sammenfattende gir alle tømmingsregimene gode tømmingsresultater, men norske resultater kan tyde på at tømmingsgraden blir noe bedre med 2 l PEG enn med picosulfat oppløsninger. Samtidig tolereres lavvolumregimer bedre enn preparasjoner med høyt volum. Splittømming og fiberredusert kost er viktige tilleggstiltak for et godt tømmingsresultat.
Tabell 1. Effekter av ulike tarmtømmingsregimer før koloskopi
Tømmingsmiddel N (164 706) BBPS (95 % CI)
Tilfredsstillende tømming
Endofalk avreg. 62
Moviprep avreg. 97
Annet/ukjent 5267
PDR > 5: polyppdeteksjonsrate for polypper på 5 mm og større, CIR: Cøkum intubasjonsrate
Referanser
1. Corley, DA, Jensen CD et al. Adenoma detection rate and risk of colorectal cancer and death N Engl j Med 2014, 1298-1306
2. Wu K-L, Rayner CK, Chuah S-K et al. Impact of low-residue diet on bowel preparation for colonoscopy. Dis Colon Rectum 2011; 54: 107 – 112
3. Alvarez-Gonzales M, Pantaleon M et al. Randomized clinical trial: A normocaloric low-fiber diet the day before colonoscopy is the most effective approach to bowel preparation in colorectal cancer screening colonoscopy Diseases of the Colon & Rectum 62(4):p 491-497, April 2019
4. Hassan C, East J et al. Bowel preparation for colonoscopy: European society of gastrointestinal endoscopy (ESGE) Guideline – update 2019 DOI https://doi.org/10.1055/a-0959-0505
5. Shan J, Su Y et al Comparing the bowel cleansing efficacy between sodium picosulfate vs. 2L polyethylene glycol electrolyte lavage solution for colonoscopy: a prospective BMC gastroenterology, 2025, 25:164
6. Xie Q, Chen L et al. A meta-analysis of randomized controlled trials of low-volume polyethylene glycol plus ascorbic acid versus standard-volume polyethylene glycol solution as bowel preparations for colonoscopy. PLoS One 2014; 9: e99092
7. K Zawaly, C Rumbolt, The efficacy of split-dose bowel preparations for polyp detection: a systematic review and meta-analysis Am J Gastroenterol 2019;114:884–892
8. Maida M, Marasco G Comparative efficacy of different bowel preparations for colonoscopy: A network meta-analysis. Digestive and Liver Disease 57 (2025) 688–696
9. Sarna VK, Innføring av Plenvu som tømmingsmiddel for koloskopi, Presentasjon årsmøte Norsk Gastroenterologisk Forening 2025
Arrangeres på Scandic Lillehammer Hotel 29.–31. januar 2026
Påmelding innen 29. des 2025 på https://www.trippus.net/ng2026/deltaker
Hotellet kan bli fullt, så anbefaler påmelding så snart som mulig!

møtt til årsmøtet 2026
Hjertelig velkommen til NGFs årsmøte! Dette er årets viktigste møtested for gastrointeresserte leger i Norge. Det er tid for forskningsformidling, diskusjoner og uformelle samtaler. Og vi deler ut fagpriser og stipender til våre dyktigste kolleger. Vi garanterer hyggelig sosialt samvær.
Deltakelse på årsmøtet er søkt tellende som valgfritt kurs (10 timer) for leger i spesialisering og for spesialistenes etterutdanning i følgende spesialiteter: Indremedisin, generell kirurgi og fordøyelsessykdommer.
Torsdag 29. januar
11.30-14.00 Lunsj
14.00-14.05 Velkommen til årsmøtet
14:05-14:40 Informasjon fra Gastronet, Tarmscreeningprogrammet og Mage-tarmforbundet
14.40-17.00 Presentasjoner av abstrakt
17.00-19.00 Generalforsamling
20.00 Middag

Fredag 30. januar
11.30-13.30 Lunsj
13.30-18.10 Presentasjoner av abstrakt
18.10-18.40 Prof. Johs Myrens minneforelesning Ultrasound in Gastroenterology. If in doubt, sound it out! ved Odd Helge Gilja
20.00 Festmiddag med prisutdelinger
Lørdag 8. februar
09.00-12.15 Lørdagssymposium
Tema: Hepatologisk ultralyd med «live demo» ved Interessegruppen for ultralyd i gastroenterologi
12.15 Lunsj
Torsdag 29. januar 2026 | Klokken 17:00 – 19:00 | Scandic Lillehammer Hotel
Dagsorden:
1. Valg av referent og dirigent
2. Konstituering, godkjenning av innkalling
3. Styrets årsrapport for 2025
4. Legeforeningens høringer i 2025
5. Regnskap, budsjett og revisjon
6. NGFs tildelingskomité for forskningsmidler
7. Rapport fra spesialitetskomitéen
8. Rapport fra NGFs interessegrupper
9. Rapport fra Scandinavian Journal of Gastroenterology
10. Rapport fra NGF-nytt-redaksjonen
11. NGFs stipendtildelinger og industristipender
Endoscopic ultrasound–guided evaluation of aldosteroneproducing adenomas – preliminary results
Akerkar SR1,2, Sulen A2, Waage CW1,2, Pham KDC1, Havre RF1,2, Grytaas M1,2
1Haukeland University Hospital / Health Bergen, Bergen, Norway; 2University of Bergen, Bergen, Norway.
Cost-Effectiveness of Computer-aided detection in Colorectal Cancer Screening
Halvorsen N1,2, Hassan C3,4, Correale L3, Helsingen LM1,2,5, Foroutan F6, Vandvik PO7, Sultan S8, Løberg M1,2, Bretthauer M1,2,9, Mori Y*1,2,10, Kalager M*1,2 *Joint last authors
1Clinical Effectiveness Research Group, Institute of Health and Society, University of Oslo, Oslo, Norway; 2Clinical Effectiveness Research Group, Department of Transplantation Medicine, Oslo University Hospital, Oslo, Norway; 3IRCCS Humanitas Research Hospital, Milan, Italy; 4Humanitas University, Department of Biomedical Sciences, Pieve Emanuele, Italy; 5Department of Clinical Medicine, Faculty of Health Sciences, UiT, The Arctic University of Norway; 6Ted Rogers Centre for Heart Research, University Health Network, Toronto, Ontario, Canada; 7Department of Medicine, Lovisenberg Diaconal Hospital, Oslo, Norway; 8Minneapolis VA Healthcare System, Minneapolis, Minnesota; University of Minnesota, Minneapolis, Minnesota; 9Section for Gastroenterology, Department of Transplantation Medicine, Oslo University Hospital, Norway; 10Digestive Disease Center, Showa University Northern Yokohama Hospital, Yokohama, Japan
Endoskopisk behandling av sphincter Oddii-dysfunksjon (SOD)
Hovde Ø
Gastromedisinsk seksjon, Sykehuset Innlandet, Gjøvik
Rendez-vous ERCP med kjærkommen drahjelp Løitegård T1, Borgen L2 1Medisinsk avdeling, Gastromedisinsk seksjon, Drammen Sykehus, Vestre Viken HF; 2Avdeling for bildediagnostikk, Intervensjonsradiologisk seksjon, Drammen Sykehus, Vestre Viken HF
Duodenoskopassistert kolangiopankreatikografi – data fra et tertiærsenter
Mikalsen IM1,2, Kristensen V1,2, Evensen H1, Medhus AW1,2, Fossmark R1,3, Seeberg KA1, Larsson G1, Larssen L1, Ånonsen KV1
1Gastromedisinsk avdeling, Oslo universitetssykehus Ullevål; 2Institutt for Klinisk medisin, Det medisinske fakultet, Universitetet i Oslo; 3Institutt for klinisk og molekylær medisin, Fakultet for medisin og helsevitenskap, Norges teknisk-naturvitenskapelige universitet
Endoskopisk disseksjon av tidlig kolorektalkreft ved Bærum sykehus i perioden 2021–25
Nilsen JA1,2, Egeland A1, Eskeland S1, Hvattum S1, Tandberg P1 1Medisinsk avdeling, Vestre Viken Bærum sykehus; 2Klinisk effektforskning, UiO
EUS-veiledet drenasje av bekkenabscess
Stornes T1, Drivenes Ø2, Qvigstad G3
1Seksjon nedre gastrokirurgi, Kirurgisk klinikk, St. Olavs Hospital; 2Seksjon barnekirurgi, Kirurgisk klinikk, St. Olavs Hospital; 3Avdeling for fordøyelses- og leversykdommer, Medisinsk klinikk, St. Olavs Hospital
Polyppdeteksjon ved OUS
Rynning-Tønnesen S1, Ånonsen KV1, Kristensen V1,2 Sarna VK1 1Gastromedisinsk avdeling, Oslo universitetssykehus Ullevål; 2Medisinsk fakultet, Universitetet i Oslo
Plenvu gir bedre tarmtømming enn Citrafleet/Picoprep
Sarna VK1, Rynning-Tønnesen S1, Kristensen VA1, Ånonsen KV1 1Avdeling for gastromedisin, OUS – Ullevål
Anti-TNF Withdrawal or long-term treatment in ulcerative colitis (BIOSTOP): A multicenter, open-label, randomised controlled trial
Berset IP1,2, Lerang F3, Moum B2,3, Jahnsen J2,4, Grimstad T5,11, Kristensen V2,6, Wiig H7, Aabrekk T8, Ness-Jenssen E9, Eskeland S10, Melsom E1, vonVolkmann H11, Huppertz-Hauss G12,Torp R13, Hovlid Ø1,Buset M14, Riise G11,Horvei G19, Finjord T15, Jelsness-Jørgensen L-P3,16, Olsen IC6, Jahnsen FL2,6, Myklebust TÅ1,17, Mølsæter K1, Hoff DAL1,18* and Lundin KEA2,6* *Shared senior authors
1Møre og Romsdal Hospital Trust, Ålesund, Volda & Kristiansund, Norway; 2Institute of Clinical Medicine, Faculty of Medicine, University of Oslo, Oslo, Norway; 3Østfold Hospital Trust, Department of Gastroenterology, Kalnes, Norway; 4Akershus University Hospital Trust, Lørenskog, Norway; 5Stavanger University Hospital Trust, Stavanger, Norway; 6Oslo University Hospital Trust, Rikshospitalet & Ullevål, Oslo, Norway; 7Sorlandet Hospital Trust Kristiansand, Kristiansand, Norway; 8Vestfold Hospital Trust, Tønsberg, Norway; 9Department of Medicine, Levanger Hospital, Nord-Trøndelag Hospital Trust Norway; 10Vestre Viken Hospital Trust, Bærum, Norway; 11Haukeland University Hospital Trust, Department of Gastroenterology, Bergen & Voss, Norway; 12Telemark Hospital Trust, Skien, Norway; 13Innlandet Hospital Trust, Hamar, Norway; 14University hospital of North-Norway, Harstad, Harstad, Norway; 15Førde Hospital Trust, Førde, Norway; 16Østfold University College; 17Cancer Registry of Norway, Norwegian Institute of Public Health; 18Department of Health Sciences, Faculty of Medicine and Health Sciences, Norwegian University of Science and Technology; 19Haraldsplass Hospital, Bergen, Norway
Biomarkører for IBD: ekstracellulære matriksproteiner som diagnostisk verktøy
Glad IF1,2,3, Øyås O4, Mortensen JH5, Füchtbauer JD6, Halfvarson J7, NORDTREAT-gruppen, IBSEN III-gruppen, Negård A8, Valeur J2, Høivik ML3, Kristensen VA3 1Lovisenberg diakonale sykehus; 2Unger-Vetlesens Institutt; 3Gastromedisinsk avdeling, Oslo Universitetssykehus Ullevål; 4Oslo senter for biostatistikk og epidemiologi; 5Nordic Bioscience, Herlev, Danmark; 6Afdeling for Medicinske Mavetarmsygdomme, Odense Universitetssykehus, Danmark; 7Medisinsk fakultet, Universitetet i Örebro, Sverige; 8Radiologisk avdeling, Akershus Universitetssykehus
«Sonorescue»-behandlingsrespons ved «rescue»-behandling av pasienter med akutt alvorlig ulcerøs kolitt målt med gastrointestinal ultralyd Nylund K1,2, Gjengstø A1, von Volkmann HL1, Aziz A3, Gro Riise1,4, Gilja OH 1,2
1Medisinsk Klinikk, Haukeland Universitetssjukehus (HUS); 2 Klinisk Institutt 1, Universitetet i Bergen; 3 Medisinsk Klinikk, Haraldsplass Diakonale Sykehus (HDS); 4Medisinsk avdeling, Voss Sjukehus
Adalimumab Drug Survival in a Norwegian Cohort
Otterstad M1,2, Anisdahl K1, Lundekvam JA1,2, Høivik ML1,2
1Department of Gastroenterology, Oslo University Hospital; 2Institute of Clinical Medicine, University of Oslo
Changes in gene expression in multiplex IBD families, consequences of shared household: a multiplex IBD family study
Aabrekk TB 1, 2, Aamodt G3, Detlie TE 4, Høivik ML1, 5, Kristensen VA1, 5, Ricanek P 6, Bai B7, Tannæs TM 7, Böttcher Y 8,7, Bengtson MB 2
1University of Oslo, Institute of Clinical Medicine, Oslo, Norway; 2Vestfold Hospital Trust, Department of Gastroenterology, Tønsberg, Norway; 3Norwegian University of Life Sciences, LANDSAM, Ås, Norway; 4Akershus University Hospital, Department of gastroenterology, Lørenskog, Norway; 5Oslo University Hospital, Gastroenterology, Oslo, Norway, 6Lovisenberg Diaconal Hospital, Department of Gastroenterology, Oslo, Norway; 7Akershus University Hospital, Medical Division (EpiGen), Lørenskog, Norway; 8University of Oslo, Department of Clinical Molecular Biology, Oslo, Norway
SABAT-studien (NormaliSAtion TNF gene expression as a criterion for withdrawal of Biologic medicATion)
Aasen LM1, Goll R1
1Medisinsk klinikk, fordøyelse- og nyremedisinsk avdeling, Universitetssykehuset Nord-Norge Tromsø
Plasma-C4 som potensiell biomarkør for cholangiocarcinom ved primær skleroserende cholangitt
Andersen IM1,2,3,Braadland PR2,4, Molinaro A5,6, Henricsson M5, Karlsen TH1,2,3,4, Vesterhus M2,7,8, Hov JR 1,2,3,4, Folseraas T1,2,3 1Seksjon for gastromedisin, Avdeling for transplantasjonsmedisin, Klinikk for kirurgi og spesialisert medisin, Oslo universitetssykehus Rikshospitalet; 2Norsk senter for PSC, Klinikk for kirurgi og spesialisert medisin, Oslo universitetssykehus Rikshospitalet; 3Institutt for klinisk medisin, Universitetet i Oslo, Oslo, Norge; 4Institutt for indremedisinsk forskning, Klinikk for kirurgi og spesialisert medisin, Oslo universitetssykehus, Rikshospitalet; 5Avdelningen för molekylär och klinisk medicin/Wallenberg Laboratoriet, Sahlgrenska Akademin, Göteborgs universitet, Göteborg, Sverige; 6Institutionen för medicin, Seksjon for gastroenterologi och hepatologi, Sahlgrenska universitetssjukehus, Göteborg, Sverige; 7Medisinsk avd. Haraldsplass diakonale sykehus; 8Klinisk institutt 2, Universitetet i Bergen
Presis deteksjon av cholangiocarcinom ved hjelp av DNAmetyleringsmarkører i galle og plasma Vedeld HM1, Breder S2,3, Pharo H1, Brodal HP1, Thorkildsen EM1, Brandt-Winge S1, von Seth E4, Grimsrud MM2,3,5, Yaqub S3,6, Karlsen TH2,3,7, Grzyb K8, Paulsen V7, Färkkilä MA9, Bergquist A4, Aabakken L3,7, Boberg KM2,3,7, Folseraas T2,7, Lind GE1,10 1Seksjon for molekylær onkologi, Institutt for kreftforskning, Oslo Universitetssykehus, Radiumhospitalet, Norge; 2Norsk senter for PSC forskning, Avdeling for transplantasjonsmedisin, Oslo Universitetssykehus, Norge; 3Institutt for klinisk medisin, Universitet i Oslo, Norge; 4Avdeling for medisin, Huddinge, Enhet for gastroenterologi og ernæring, Karolinska Institutet, Karolinska universitetssykehus, Stockholm, Sverige; 5Onkologisk avdeling, Akershus Universitetssykehus, Norge; 6Seksjon for HPB-kirurgi, Avdeling for gastro- og barnekirurgi, Oslo Universitetssykehus, Norge; 7Seksjon for gastromedisin, Avdeling for transplantasjonsmedisin, Klinikk for kirurgi og spesialisert medisin, Oslo Universitetssykehus, Rikshospitalet, Norge; 8Avdeling for patologi, Oslo Universitetssykehus, Rikshospitalet, Norge; 9Helsinki Universitet og Avdeling for medisin, Klinikk for gastromedisin, Helsinki Universitetssykehus, Finland; 10Institutt for biovitenskap, Det matematisk-naturvitenskapelige fakultet, Universitetet i Oslo, Norge
Betydelig variasjon i immunosuppressiv behandling etter levertransplantasjon ved primær skleroserende kolangitt
Juliebø AT1,2, Folseraas T1,2, Karlsen TH1,2, Boberg KM1,2 1Institutt for klinisk medisin, Universitet i Oslo, Norge; 2Norsk senter for PSC, Avdeling for transplantasjonsmedisin, Oslo Universitetssykehus, Norge
Progress towards elimination of HCV infection in Norway Whittaker R1, Wüsthoff L2, Midtbø J1, Dalgard O3,4*, Midgard H5,4*
1Norwegian Institute of Public Health; 2Department of Addiction Treatment, Oslo University Hospital; 3Department of Infectious Diseases, Akershus University Hospital; 4Institute of Clinical Medicine, University of Oslo; 5Department of Gastroenterology, Oslo University Hospital. *Shared last authorship
PRO-C3: An emerging tool for dynamic evaluation of disease progression in primary sclerosing cholangitis
Tharmathas U1,2, Zawadzki A3, Fredriksen P3, Leeming DJ3, Tjønnfjord SKB2.4.5, Helgadottir H5.6, Braadland BR4, Ling L7, Hirschfield GM8, Folseraas T4.5, Hov JER2,4,5, Karsdal M3, Karlsen TH2,4,5 Vesterhus M4,6 & Jørgensen KJ1,2,4
1Dept. of Gastroenterology Ahus; 2Institute of Clinical Medicine; 3Nordic Bioscience AS, Herlev Denmark; 4Norwegian PSC Research Center; 5Dept. of Gastroenterology Oslo University Hospital, Rikshopitalet; 6Dept. of Medicine, Haraldsplass Deaconess Hospital; 7NGM Biopharmaceutical Inc; 8Toronto Centre for Liver Disease, Toronto General Hospital, University of Toronto
Impact of inflammatory bowel disease and colectomy on circulating biomarkers associated with prognosis in primary sclerosing cholangitis
Tjønnfjord SKV1,2, Helgadóttir H1,3, Folseraas T1,2,4, Cornillet M5, Nesbakken A2,6,7, Lothe RA2,6, Michelsen AE2, Molinaro A8, Ueland PM9, McCann A9, Høivik ML10, Karlsen TH1,2,4, Rosenberg W11, Ueland T2,12, Bergquist A5, Vesterhus M1,3, Hov JH*1,2,4, Braadland PR*1
1 Norwegian PSC Research Center, Oslo University Hospital; 2 Institute of Clinical Medicine, University of Oslo; 3 Department of Medicine, Haraldsplass Deaconess Hospital; 4 Section of Gastroenterology, Division of Surgery and Specialized Medicine, Oslo University Hospital; 5 Unit of Gastroenterology and Nutrition, Department of Medicine
Huddinge, Karolinska Institutet, Karolinska University Hospital 6 Department of Molecular Oncology, Institute for Cancer Research, Oslo University Hospital,7 Department of Gastrointestinal Surgery, Oslo University Hospital; 8 Department of Molecular and Clinical Medicine/Wallenberg Laboratory, Institute of Medicine, University of Gothenburg and Sahlgrenska University Hospital; 9 BEVITAL AS, Bergen, Norway; 10 Department of Gastroenterology, Oslo University Hospital; 11 The Institute for Liver and Digestive Health, University College London Division of Medicine, University College London; 12 K. G. Jebsen Thrombosis Research and Expertise Center (TREC), The Arctic University of Norway. *Shared senior authorship
Vedvarende tarmfloradysbiose og tarm-hjerne-akse-påvirkning etter mild til moderat covid-19-infeksjon
Berentsen B¹, Hillestad E¹, Kuwelker K¹, Assmus J², Hausken T¹, Cox R³, Langeland N¹ ¹Nasjonalt senter for funksjonelle mage-tarm-sykdommer, Medisinsk avdeling, Haukeland universitetssjukehus og Klinisk institutt 1, Universitetet i Bergen; ²Senter for klinisk forskning, Haukeland universitetssjukehus; ³Influensasenteret, Avdeling for mikrobiologi, Haukeland universitetssjukehus
Possible mechanisms underlying the effects of faecal microbiota transplantation in patients with irritable bowel syndrome
El-Salhy M1, Skarvatun T1, Hoff DAL2, Steinsvik EK1, Lunding J3, Gilja OH1, Hatlebakk JG1
1National Centre for Functional Gastrointestinal Disorders, Department of Medicine, Haukeland University Hospital, Bergen; 2Department of Medicine, Ålesund Hospital, Møre and Romsdal Hospital Trust; 3Department of Medicine, Diakonhjemmet Hospital, Oslo
Er 4 uker lenge nok for å bedømme respons etter lav FODMAP-kosthold?
Khan U1, Brønstad I1,2, Hillestad EMR3,4, Steinsvik EK1,2, 3 Hausken T1,3,4, Berentsen B1,3, Lied GA1,3,4
1Medisinsk klinikk, Haukeland universitetsykehus; 2Nasjonalt kvalitets- og kompetansenettverk for gastroenterologisk ultralyd; 3Nasjonalt kvalitets- og kompetansenettverk for funksjonelle mage-tarmsykdommer, Haukeland Universitetsykehus; 4Klinisk Institutt 1, Universitetet i Bergen
Lav FODMAP-kosthold fører til stigning i GLP-1 og PYY hos IBS-pasienter
Khan, U1,4, Brønstad, I1,2, Hillestad, EMR3,4, Steinsvik, EK1,2, 3Hausken, T1,3,4, Berentsen B1,3, Lied, GA1,3,4
1Medisinsk klinikk, Haukeland universitetsykehus; 2Nasjonalt kvalitets- og kompetansenettverk for gastroenterologisk ultralyd; 3Nasjonalt kvalitets- og kompetansenettverk for funksjonelle mage-tarmsykdommer, Haukeland Universitetsykehus; 4Klinisk Institutt 1, Universitetet i Bergen
Tarmflorasammensetning og funksjon etter 12 ukers streng FODMAP-diett hos IBS-pasienter
Randulff Hillestad EMR1,2, Benítez-Páez A3, Steinsvik EK2, Teige ES1, Brønstad I2, Tolosa-Enguís V3, Sanz Y3, Lied GA1,2, Lundervold A7, Lundervold A4,5, Trygve Hausken T2,6, Kurt Hanevik K6, Berentsen B2,6
1Senter for ernæring, Medisinsk fakultet, Universitetet i Bergen; 2Nasjonalt Nettverk for funksjonelle magetarmsykdommer, Medisinsk klinikk, Haukeland Universitetssjukehus; 3Microbiome, Nutrition and Health, Institute of Agrochemistry and Food Technology, Spanish National Research Council (IATA-CSIC), Paterna-Valencia, Spain; 4Biomedisinsk institutt, Universitetet i Bergen; 5Mohn Medical Imaging and Visualization Center, Radiologisk avdeling, Haukeland Universitetssjukehus; 6Klinisk institutt, Medisinsk fakultet, Universitetet i Bergen; 7Institutt for biologisk og medisinsk psykologi, Universitetet i Bergen
De første resultatene fra NORECa-Endoskopi – et nasjonalt prospektivt register over pasienter med dysplasi og spiserørskreft i tidlig stadium Hauge Tobias1, Rushfeldt C2, Aahlin E2, Pham KDC3, Pham T4, Qvigstad G5, Rekstad LC6, Fossmark R7, Mala T1, Evensen H7 1Gastrokirurgisk avdeling, OUS Ullevål; 2Gastrokirurgisk avdeling, UNN Tromsø; 3Gastroseksjonen, Medisinsk avdeling, Haukeland Universitetssykehus; 4Gastrokirurgisk avdeling, Haukeland Universitetssykehus; 5Gastromedisinsk avdeling, St. Olavs Hospital; 6Gastrokirurgisk avdeling, St. Olavs Hospital; 7Gastromedisinsk avdeling OUS Ullevål
Idiopatisk hypomagnesemi behandlet med subkutant Mg Hovde ع, Joy CH², Fjerdrumsmoen T², Olafsson S¹ ¹Medisinsk avdeling, Sykehuset Innlandet, Gjøvik (SIG); ²Sykehusapoteket, SIG
Serumproteomikk som mål på sykdomsaktivitet ved cøliaki
Ibsen J1,2, Lund S1,2, Stamnæs J1,4, Sollid LM1,3, Risnes LF1,2, Lundin KEA1,2
1Norsk Senter for Cøliakiforskning, UiO; 2OUS Rikshospitalet, Avdeling for transplantasjonsmedisin, Seksjon for gastromedisin; 3OUS, Rikshospitalet, Avdeling for immunologi og transfusjonsmedisin; 4OUS Kjernefasilitet for proteomikk, UiO
TPM502, A Tolerizing Nanoparticle Mixture for Celiac Disease Treatment, Induces Long-Lasting Phenotypic Changes in HLA-DQ2.5-Gliadin-Specific Tetramer+ CD4+ T Cells, Indicating Antigen-Specific Immunomodulatory Effects
Lundin KE1,2, Risnes LF1, Sollid LM2, Asnaghi V3, Van Schaick E4, Klarenbeek N4, Meijs A4, Hellström P5, Scheinin M6, Goll R7, Daveson J8, Wang SH3, Fleischer S3, de Min C3 1Avdeling for Transplantasjonsmedisin, OUS Rikshospitalet; 2Norsk Senter for Cøliakiforskning, Universitetet i Oslo; 3Topas Therapeutics, Hamburg, Tyskland; 4Leiden, The Netherlands; 5 Uppsala, Sweden; 6Helsinki, Finland; 7UNN, Tromsø, Norge; 8Brisbane, Australia
Protonpumpehemmer og adenokarsinom i ventrikkel
Duru O1, Santoni G1, Holmberg D1, Birgisson H2, Kauppila JH1,3, von Euler-Chelpin M4, Ness-Jensen E1,5,6, Lagergren J1,7 1Institutionen för molekylär medicin och kirurgi, Karolinska Institutet & Karolinska Universitetssjukhuset; 2Icelandic Cancer Registry; 3Medical Research Centre Oulu, University of Oulu & Oulu University Hospital; 4Institut for Folkesundhedsvidenskab, Københavns Universitet; 5HUNT forskningssenter & HUNT senter for molekylær og klinisk epidemiologi, NTNU; 6Medisinsk avdeling, Sykehuset Levanger; 7School of Cancer and Pharmaceutical Sciences, King’s College London & Guy’ and St Thomas’ Foundation Trust
Protonpumpehemmer og nevroendokrine svulster i ventrikkel Ness-Jensen E1,2,3, Santoni G3, Radkiewicz C3,4, von Euler-Chelpin M5, Kauppila JH3,6, Birgisson H7, Fossmark R8,9,10, Lagergren J3,11 1HUNT forskningssenter & HUNT senter for molekylær og klinisk epidemiologi, NTNU; 2Medisinsk avdeling, Sykehuset Levanger; 3Institutionen för molekylär medicin och kirurgi, Karolinska Institutet & Karolinska Universitetssjukhuset; 4Kirurg och onkologkliniken, Capio S:t Görans Sjukhus; 5Institut for Folkesundhedsvidenskab, Københavns Universitet; 6Medical Research Centre Oulu, University of Oulu & Oulu University Hospital; 7Icelandic Cancer Registry; 8Institutt for klinisk og molekylær medisin, NTNU; 9Gastromedisinsk avdeling, OUS, Ullevål; 10Fedmepoliklinikken, St. Olavs Hospital; 11School of Cancer and Pharmaceutical Sciences, King’s College London & Guy’ and St Thomas’ Foundation Trust
Sensitive celiac disease patients elicit serum IL-2-responses to low-dose barley and malted barley challenge
Odden N1, Risnes L.F.2,3, Lund S. R2,3, Tissen E4, Weiss T5, Scherf K. A.6, Henriksen C.7, Lundin K. E. A. 2,3
1Section of Clinical Nutrition, Dept. of Clinical Service, Divison of Cancer Medicine, Oslo University Hospital-Rikshospitalet, Norway; 2Norwegian Coeliac Disease Research Centre, Institute of Clinical Medicine, University of Oslo, Oslo, Norway; 3Department of Gastroenterology, Oslo University Hospital-Rikshospitalet, Oslo, Norway; 4Leibniz Institute for Food Systems Biology at the Technical University of Munich, Germany; 5R-Biopharm AG, Darmstadt, Germany; 6Technical University of Munich, TUM School of Life Sciences, Freising, Germany; 7Department of Nutrition, Institute of Basic Medical Sciences, University of Oslo, Oslo, Norway
5-year follow-up on a randomized controlled trial with a low FODMAP diet in treated celiac patients
van Megen, F1,2,3, Veierød, MB4, Henriksen, C2,3 and Lundin, KEA3,5
1Department of Clinical services, Oslo University Hospital Rikshospitalet, Oslo, Norway; 2Department of Nutrition, Institute of Basic Medical Sciences, University of Oslo, Norway; 3Norwegian Coeliac Disease Research Centre, Faculty of Medicine, University of Oslo, Norway; 4Oslo Centre for Biostatistics and Epidemiology, Department of Biostatistics, Institute of Basic Medical Sciences, University of Oslo, Norway; 5Department of transplantation medicine, Oslo University Hospital, Oslo, Norway
Helicobacter pylori predisponerer for cancer ventriculi via hypergastrinemi
Waldum H
Fakultet for medisin og helsevitenskap, Norges teknisk-naturvitenskapelige universitet
Kardiovaskulær risiko hos individer med cøliaki i HUNT4
Zühlke, S1,2; Hjort, R1,2; Moksnes, MR1; Lyngbakken, MN3,4; Alam, MS1; Aksaas, AK5; Mostad, IL5; Lundin, KEA6,7; Omland, T3,4; Ness-Jensen, E1,2
1HUNT Forskningssenter, NTNU; 2Medisinsk avdeling, Sykehuset Namsos, Helse Nord-Trøndelags 3Medisinsk avdeling, Sykehuset Levanger, Helse Nord-Trøndelag; 3K. G. Jebsen-senter for hjertemarkører, Universitetet i Oslo; 4Akershus Universitetssykehus; 5St. Olavs Hospital; 6Norsk Senter for cøliakiforskning, Universitetet i Oslo; 7Oslo Universitetssykehus
i forbindelse med NGFs årsmøte 29–31. januar 2026, Lillehammer.
Foreløpig program
09.00 Introduksjon til tema og foredragsholdere. Eivind Ness-Jensen
09.05 Grunnleggende leverultralyd. Odd Helge Gilja
09.25 Tips og triks for optimalisering av bilder og målinger. Kim Nylund
09.40 Cirrhose og portal HT. Håvard Midgard
10.00 HCC-overvåking - metode – Systematisk scanning og dokumentasjon med cine loops. John Willy Haukeland
10.20 HCC-overvåking. Paneldiskusjon. Gilja, Nylund, Haukeland, Midgard. Ordstyrer: Steinsvik, Sarna.
10.40 Pause
11.20 Fettleversykdom. Vikas Sarna
11.35 Endohepatologi. Kim Ånonsen
12.00 Oppsummering/avslutning. Jens Pallenschat / Jan-Magnus Kvamme
Om NGFs interessegruppe for ultralyd:
Gruppen består av:
Vikas Sarna (leder, Oslo universitetssykehus)
Jan Magnus Kvamme (Universitetssykehuset Nord-Norge)
Jens Pallenchat (Sørlandet sykehus Flekkefjord)
Odd Helge Gilja (Haukeland Universitetssykehus)
Eivind Ness-Jensen (Helse Nord-Trøndelag Levanger)
Elisabeth Steinsvik (Haukeland Universitetssykehus)
Håvard Midgard (Oslo universitetssykehus).
Interessegruppen skal fungere som nettverk og bidra til å styrke bruk av ultralyd som diagnostisk hjelpemiddel innen gastroenterologien.
Mye av kursaktiviteten foregår via nasjonalt kvalitets- og kompetansenettverk for gastroenterologisk ultralyd (NSGU) lokalisert ved Haukeland Universitetssjukehus i Bergen.
Årshjulet for ultralyd-utdanning består av flere årlige kurs og symposier. Det starter i november med tredagers REGUT grunnkurs i Bergen. På foråret kommer foredrag/symposier på NGF og NFUD sine årsmøter. I mai kommer hands-on-trening for alle som har vært på REGUT kurset. Utpå høsten kommer superbrukerkurset i tillegg til kursene på UEGW-kongressen.


Et grunnleggende prinsipp innen persontilpasset medisin er å identifisere pasienter som med størst sannsynlighet vil respondere på en spesifikk behandling1
Leger kan nå benytte det digitale støtteverktøyet
Vedolizumab Clinical Decision Support Tool VDZ-CDST for å persontilpasse behandling med vedolizumab ved Crohns sykdom
Entyvio (vedolizumab) er indisert til behandling av voksne pasienter med moderat til alvorlig aktiv Crohns sykdom som har hatt utilstrekkelig respons, mistet respons eller som var intolerante overfor enten konvensjonell behandling eller en TNFα-antagonist. Entyvio skal ikke brukes av pasienter med aktive alvorlige infeksjoner som tuberkulose (TB), sepsis, cytomegalovirus, listeriose og opportunistiske infeksjoner som progressiv multifokal leukoencefalopati (PML)3
VDZ-CDST er en validert kalkulator som anvender pasientens kliniske variabler for å predikere sannsynlighet for respons til behandling med vedolizumab hos voksne pasienter med Crohns sykdom2
Pasienter med høy sannsynlighet for respons (>19 poeng) hadde raskere og vedvarende større reduksjon i HBI-score fram til uke 521

Scann QR-koden for å registrere deg og få tilgang til verktøyet.
VDZ-CDST bør ikke være det eneste grunnlaget for beslutninger vedrørende behandling. Resultatene fra verktøyet kan være til hjelp når det gjelder valg av behandling, men for alle behandlingsmetoder og –beslutninger bør forskrivende lege vurdere ytterligere pasientinformasjon og andre kliniske data.
Pakninger, priser og finansiering: Pulver til konsentrat til infusjonsvæske: 20 ml (hettegl.) kr 27 335,50. Injeksjonsvæske, oppløsning i ferdigfylt penn: 1 stk. (ferdigfylt penn) kr 6 102,80. 2 stk. (ferdigfylt penn) kr 12 169,30. 6 stk. (ferdigfylt penn) kr 36 435,30. H-resept. Besluttet innført av Beslutningsforum 16.11.2015. Inngår i TNF BIO anbefalinger 2025-2026. Reseptgruppe: C. For fullstendig preparatomtale av Entyvio, se SPC, www.legemiddelsok.no

Gro-Riise, Overlege, Haukeland Universitetssykehus og Voss sykehus
Det femte nasjonale IBD symposium blei avholdt ved Oslo Event Hub 5.september 2025. Nasjonal interessegruppe for IBD med leder Silje Thorsvik i spissen hadde sett i sammen eit spennande faglig program med dyktige forelesere både frå inn- og utland. Hovudtema for årets symposium var multidisiplinære håndtering av IBD pasienten.
Silje Thorsvik og Jonas Lundekvam ynskte alle 105 deltagere velkomen. Ved årets møte var det deltagere frå alle 4 helseforetakene representert. Eit av målene til interessegruppen er å få samla fagpersoner på tvers av helseforetak til diskusjon og oppdatering, og på den måten bidra til meir heilhetlig og samkjørt behandling i heile landet.
Duo behandling ved IBD
Anarkjente Dr Peter Bossout frå Bodenheim i Belgia starta dagen med eit aktuelt tema i IBD behandlingen, kombinasjonsbehandling. Han gav ein oversikt over kva ein veit så langt om duo behandling i IBD, og presiserte korrekt at duo behandling i IBD har vært praktisert tilbake til 60-talet, om enn i noko anna form enn det som blir referert til i nyare litteratur.
Hos behandlingsresistente pasienter har det de siste årene blitt vanligere å kombinere ulike biologiske og små-molekylære medikament. Dr. Bossout refererte mellom annet til VEGA studien frå 2023, ein dobbeltblinda randomisert studie der ein viste signifikant bedre remisjonsrate ved kombinasjonsbehandling med TNF-alfa og IL-23, enn ved monoterapi med enten TNF-alfa eller IL-23. Dr. Bossout presiserer at ein ved kombinasjonsbehandling må ha kunnskap om farmakologi og biomekanismen til medikamentene, for å oppnå optimal og synergistisk effekt ved kombinasjonsbehandling. Tilgjengelige studoer viser lovande resultat, men det krever fleire studier i framtida før ein har tilstrekkelig data på sikkerhet, korleis og i kva grad ein skal kombinere de ulike medikamenter som er tilgjengelig.
Tarmreseksjon ved IBD
Andre internajonale foredragsholde var professor Anja Poulsen frå Rikshospitalet i Købehavn. Dr. Poulsen holdt ein flott forelesning om profylaktisk behandling etter tarmreseksjon ved IBD. Etter introduksjon av TNFalfa-hemmere på 2000-talet har beho-
vet for kirurgisk reseksjon falt betydelig. Tall frå Danmark har vist at før år 2000 var 1-års risiko for operasjon ved Crohn sjukdom 23 og 10 års risiko for operasjon 46 %, mens etter år 2000 og den «biologiske-era» har 1 års risiko for kirurgi falt til 12 % og 10-års risiko er redusert til 26 %.
Derimot har risiko for re-reseksjon ikkje endret seg i samme tidsperiode. Diskusjonen er om ein bør tilby biologisk behandling til pasienter etter reseksjon? Poulsen viste til data frå stor dansk retrospektiv populasjons studie, som viser at 25 % ikkje får tilbakefall av sjukdomen sin etter 10 år. Hos de som får tilbakefall er derimot median tid frå reseksjon til tilbakefall av inflammasjon 11 mnd. Dataen viser også at visse risikofaktorer skiljer seg ut mtp recidiv av sjukdom etter operasjon. Røyking og involvering av colon ved tynntarms Crohn skiljer seg ut som klare risikofaktorer for tilbakefall av inflammasjon. Poulsen presiserer at 25 % ikkje får recidiv etter reseksjon, som er ei ikkje uebtydelig gruppe, og viktig å finne gode strategier for å unngå overbehandling. Det er behov for risikostratifiseringer i forkant av operasjon, og intervenere tidlig nok i etterkant av operasjon for sikre behandling til de pasienter som har nytte av medikamentell behandling.
Gastrokirurg Hanne Skoglund tok oss vidare i programmet og holdt forelesningen «When and where should Crohn`s patient undergo surgery». Dr. Skoglund snakket om timing av IBD kirurgi og preoperativ optimalisering av desse pasientene. IBD pasienter med behov for kirurgisk intervensjon er ofte kompliserte pasienter og kompliserte operasjoner. Det er anbefalt at komplekse IBD pasienter opereres på høg-volumsenter med dedikerte IBD kirurger, og at det er tilstrekkelig kompentase tilgjengelig for optimal pre- og postoperative håndteringen. Både norske og internasjonale guidlines anbefaler MDT møter med gastrokirurg, gastroenterolog og ernæringsfysiolog. I slike møter bør det legges gode planer for timing av kirurg, gjennomføringen av nødvendig kirurgi og optimalisering av pre- og postoperative behandlingen.
Ekstraintestinal affeksjon av IBD
Etter velsmakende lunsj på Oslo Hub senter tok møteleder Kim Nylund oss igjennom ein serie forelesninger om ekstraintestinal affeksjon av IBD. Dyktige forelesere frå ulike fagfelt gav inspirasjon og nyttig påfyll av kunnskap for andre organ affeksjoner av
IBD. Revmatolog Inger Jorid Berg frå Diakonhjemmet, hudlege Øystein Sandanger frå dermatologisk avdeling OUS og øyelege Jon Roger Eidet gav alle grundige og oversiktlige foredrag om ulike EIM ved IBD.
Leddaffeksjon vansligaste ekstraintestinal affeksjon, og Dr. Berg referer til IBSEN studie der 50 % av nydiagnostiserte IBD pasienter sjølvrapporterer om muskel og skjellettplager, og ein finn IBD assosisert artritt hos 17 %. Det er ingen egen behandlingsanbefalinger for artritt ved IBD, men behandlingsvalg vil styres av manifestasjon og tilpasses IBD komorbiditet.
Hud manifestasjon ved IBD kan kome i fleire former og Sandanger tok oss mesterlig igjennom ulike kutane manifestasjoner. Kutane manifestasjoner ses oftere hos Mb Crohn pasienter enn hos pasienter med ulcerøs kolitt. Kutane manifestasjoner kan deles i 3 hovudkategorier: Spesifikke manifestarjoner, forandringer som ses med samme histopatologiske bilde som Crohn sjukdom. Reaktive forandringar der ein ikkje ser samme histopatologiske bilde, men har overlappende patogenetiske mekanismer som t.d Pyoderma gangrenosum og Sweet syndrom. Og assosierte manifestasjoner der ein har lite overlappande patogenetiske mekansimer, men ser allikavel dette oftare hos IBD pasienter, som aftøs stomatitt. I tillegg til dette blir ofte hudlegene involvert i hudmanifestarsjoner som kan vere relatert til behandlingen, som paradoks psoriasis ved bruk av TNF alfa hemmer og hudkreft ved langvarig bruk av immunsuppresjon.
Også øyemanifestasjoner, som hudmanifestasjon ses oftere hos Crohn pasienter enn ulcerøs kolitt, og er det 3. mest affiserte ekstraintestinale organet. Der episkleritt er vanligaste manifestasjon, mens iriodcyclitt ses noe sjeldnere(<3,5 %). Dr. Eidet presiserte at ved rødt og smertefullt øye skal det alltid henvises til øyelege. Bemerkar også at bakre uveitt ofte ikkje gir rødt øye, men
kun uklart syn og krever tilsyn av øyelege for diagnostikk. Både bakre og fremre uveitt og skleritt kan vere synstruande og viktig med rett behandling.
I siste siste bolken for dagen opna Øystein Kittel Moe frå UNN vanskelige om omdebattert tema, nemlig når skal ein avslutte biologisk behandling. Dr Moe drar inn fleire aspekter i det som gastroenterologer står i til dagen. Kapasitet ved poliklinikk over heile landet er sprengt og stadig økonomiske utfordringer gjer at ein bør tenke på seponering av medikamenter, i tillegg kanskje viktigaste spørsmålet om ein driv overbehandling av pasienter? Fins lite og vage retningslinjer for når ein skal avslutte biologisk behandling. Dr. Kittel Moe fortalte om «Tromsø modellen», der de mellom annet måler TNF alfa i biopsier frå slimhinner frå pasienter i endoskopisk remisjon før ein vurderer seponering TNFalfa hemmer.
Avslutningsvis i dagen holdt nfeksjonsmedisiner Jan Kristian Damås frå St Olavs eit glimrande foredrag om infeksjonsrisiko ved immunsuppresjon, risiko for reaktivering av virus og vaksineanbefalinger ved bruk av ulike immunsuppressiva. Presiserte at kunnskap om ulike virkningsmekanismer og tyngden av immunsuppresjon er avgjerande for kva type infeksjon ein ser hos pasientene.
Stephen Brackmann frå AHUS fekk æren av å avrunde ein meget innholdsrik og interessant IBD dag med oppdatering om data for CRC screening hos IBD pasienter.
Ein vellykka IBD dag der interessegruppen har gjort imponerande arbeid med å sette sammen eit faglig og variert program. Vi ser allerede fram til neste års symposium.

Trond Engjom, overlege seksjon for fordøyelsessjukdommer, Haukeland universitetssjukehus. Bergen
Den akademiske postkassen fylles stadig med tilbud fjern og nær om bidrag av artikler for tidsskrifter du aldri har hørt om eller deltagelse i arrangementer på fjerne steder. De fleste tilbudene innebærer at den inviterte stiller med både innsats og finansiering.
En vårdag i april, mens undertegnede satt med bena på skrivebordet og magen full etter en god lunsj i pancreasklubben, tikket det inn et tilbud som skilte seg ut. Innledningen var «Dear honored professor» (en smigrende innledning for en enkel kliniker uten akademiske pontifikalia), men fortsettelsen vakte straks oppmerksomhet: we would herby like to invite you to attend our annual congress of the indian pancreatic club at CMC Vellore as invited faculty»
For å skjønne hva som vakte oppmerksomheten her, må vi dvele litt ved internasjonale pankreas samfunn. Felles for disse er termen «clubs». Heri ligger en eim av kjennskap, vennskap og hjemmekos. Alle samfunnene driver samarbeid innen forskning og fagutvikling i pankreatologien. Vår eget Bergen Pancreas Club er medlem i Skandinavisk Baltisk pankreas club som igjen er medlem i European Pancreatic Club. De største pankreas samfunnene utenfor Europa er Japan pancreas society, Chinese association Pancreatology, American pancreatic club og nettopp Indian Pancreatic club. Indian pancreatic club er ikke størst, men et samfunn som representerer 1,4 mrd innbyggere i en voksende økonomi må tas alvorlig. Organisasjonen har omfattende bidrag til faget. Etter en kort drøfting med en alltid velvillig frue, kunne jeg svare ivrig og med forventning ja til dette tilbudet.
Bidragende til entusiasmen var også Haukeland Universitetssykehus sin langvarige relasjon til Christian Medical Hospital (CMC) Vellore. Vi har brukt CMC som verter for sør-sør utveksling av kandidater i utdanningsprogrammer i Afrika. Helse Bergen har donert et eget Haukeland House på campus som brukes regelmessig til egne ansatte og utdanningskandidater. CMC er en imponerende institusjon med 125 års tradisjon blant de 10 beste sykehus og akademiske institusjoner i India. Her må selv en Bergenser med ydmykhet anerkjenne en institusjon som både i volum, kvalitet og akademisk merittering overgår det meste vi kan stille med i hjemlandet.
Den årlige kongressen for Indian Pancreatic club 2025 var en suksess med ca 500 deltagere fra hele India og 3 dager med foredrag

Helse Bergen har donert et eget Haukeland House til CMC. Her kan ansatte og studenter bo trygt og komfortabelt.
fra hele pankreatologien. Mine bidrag om residiverende akutte pankreatitter og om SBPC studiene ble holdt i en hyggelig atmosfære av interesse og diskusjoner. Kontakt og sosial interaksjon med deltagere i et sterkt internasjonalt faculty var også nyttig og interessant, og kan muligvis legge grunnlag for fremtidig samarbeid om fag og akademi. Det er ikke ofte en får anledning til å treffe legendene og chief editors i de fleste tidsskriftene i eget fagfelt samlet på ett brett i en slik tett kontekst.
I tillegg må det legges til at vertene tok svært godt vare på sine gjester. Her ble begrepet «all included» tatt til et nytt nivå. Alt i alt blir konklusjonen at det kan det lønne seg å vie litt oppmerksomhet til spammen i innboksen. Kanskje er det faktisk gull det som glimrer ...

Det nybygde CMC Ranipet campus er et nybygd og moderne sykehus ned en stor og fremoverlent gastroseksjon. Offisielt bilde fra CMC Vellore. https://www.cmch-vellore.edu/ our-campuses/ranipet-campus/

Rishab S. Chawla, Jan Thomas Houf, Kristoffer Vassbotten Olsen, Thomas Geisner, Håvard Mjørud Forsmo Gastrokirurgisk avdeling, Haukeland Universitetssjukehus
I september 2025 ble Vestlandske Polyppdager arrangert for andre år på rad – et symposium viet kolorektale polypper og teknikker innen endoluminal terapi i kolorektum for sykehusene i Helse Vest RHF.
Deltakere kom fra Helse Stavanger, Helse Fonna, Helse Bergen, Helse Førde, Haraldsplass diakonale sykehus, Kanalspesialistene og Aleris Bergen. Formålet har vært å styrke samarbeidet om avanserte kolorektale polypper og tidlig kreft i kolorektum som kan behandles endoskopisk. Målgruppen har inkludert kirurger, intervensjonsskopører, gastromedisinere, patologer, onkologer, sykepleiere og merkantile.
De mest avanserte endoskopiske intervensjonene i kolorektum på Vestlandet – særlig kolorektal ESD og eFTR av tidlig kreft – har i hovedsak vært sentralisert til Helse Bergen. Vurderingene samles via Norges første multidisiplinære team (MDT) for kolorektale polypper, etablert i 2023 for å standardisere behandling av avanserte polypper. MDT Polypp har faste medlemmer bestående av kreftkirurger, dedikerte patologer, intervensjonsskopører, gastromedisinere, sykepleiere, merkantile koordinatorer – og er åpent via Teams for sykehusene i regionen.
Gjennom Vestlandske Polyppdager har målet vært å styrke båndene mellom sykehusene, dele erfaringer og synliggjøre de avanserte prosedyrene som siden 2022 er utviklet i Helse Bergen. Vi har vektlagt resultater fra kvalitetsregistre, forskning, innovasjon og pasienterfaringer, samt behovet for smidige og tverrfaglige vurderinger mellom sykehusene.
Symposiet gikk over to dager, med foredrag dag 1 og praktisk hands-on trening dag 2. Bidragsytere inkluderte gastrokirurger med erfaring innen kreftkirurgi, TEM/TEO, onkologer med særskilt interesse for T1-cancer, patologer med ekspertise på polypper og T1-lesjoner, sykepleiere som har gjennomført kvalitetsprosjek-
ter for å optimalisere støtteapparatet, merkantile som har bidratt gjennom merkantilpoliklinikk, koordinatorfunksjoner, samt erfarne intervensjonsskopører som utfører EMR, ESD, EID, eFTR og kolonstenting. I samarbeid med Vivariet – forskningsinstituttet og dyrelaben – ble det gjennomført opplæring i avanserte teknikker på modeller. Deltakerne fikk øve på closure-teknikker, ESD og EMR.
En viktig del av programmet var å synliggjøre den infrastrukturen som er etablert rundt avansert polyppbehandling ved Haukeland. Dette inkluderer dedikerte patologer, sykepleiere, merkantile, radiologer, onkologer, gastromedisinere og kirurger som sammen bidrar til et robust støtteapparat.
Vår erfaring er at åpenhet, dialog og felles forståelse på tvers av faggrupper er avgjørende for å kunne tilby helhetlig og best mulig pasientbehandling i et geografisk stort helseområde. Enkelte avanserte prosedyrer – som ESD og EID i kolorektum – bør likevel sentraliseres for å sikre kvalitet, opprettholde læringskurver og unngå komplikasjoner. Internasjonale studier viser at suksessraten øker i takt med strukturert samarbeid, høytvolumsentre og et godt tilpasset støtteapparat.
Vestlandske Polyppdager har blitt en arena som ikke bare samler fagmiljøene på tvers av sykehus og spesialiteter, men også bygger broer for fremtidens behandling av kolorektale polypper og tidlig kreft. Gjennom åpenhet, kunnskapsdeling og felles læring skaper vi et fundament for tryggere pasientforløp og sterkere faglig fellesskap i hele regionen. Veien videre handler om å løfte hverandre – på tvers av profesjoner og institusjoner – slik at vi sammen kan utvikle behandlingen, styrke kvaliteten og inspirere neste generasjon fagfolk til å tenke enda mer helhetlig.
Reference: 1. Budenofalk SmPC 2024/08, www.fass.se
Budenofalk (budenosid)
ATC kode: A07EA06. Utleveringsgruppe C. Reseptbelagt legemiddel. Kan forskrives på blå resept. Står forbudt å bruke på WADAs dopingliste. STIKKEPILLER, 4 mg
Indikasjoner: Korttidsbehandling av mild til moderat akutt ulcerøs kolitt begrenset til rektum (ulcerøs proktitt) hos voksne pasienter. Dosering: Den anbefalte daglige dosen er 4 mg budesonid som én stikkpille på 4 mg. Administrasjon: Kun til rektal administrasjon. Budenofalk 4 mg stikkpiller skal administreres rundt sengetid. Tarmen bør, om mulig, være tom før administrasjon av Budenofalk 4 mg stikkpiller for å få best mulig resultater. Behandlingens varighet avgjøres av legen. En akutt episode avtar som regel etter 6 til 8 uker. Budenofalk 4 mg stikkpiller bør ikke brukes etter denne tidsperioden. Kontraindikasjoner: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene. Levercirrhose. Advarsler og forsiktighetsregler: Det er nødvendig å utvise forsiktighet hos pasienter med tuberkulose, hypertensjon, diabetes mellitus, osteoporose, magesår, glaukom, katarakt, familiehistorikk med diabetes, familiehistorikk med glaukom eller noen annen tilstand der glukokortikosteroider kan ha negative virkninger. Det kan oppstå systemiske virkninger av glukokortikosteroider. Infeksjon: Risikoen for forringelse av bakterielle, fungale, amøbiske og virale infeksjoner under glukokortikosteroidbehandling må vurderes nøye. Vannkopper: Vannkopper krever spesiell oppmerksomhet siden det vanligvis er en ufarlig sykdom, men kan være dødelig hos pasienter med nedsatt immunforsvar. Pasienter som det ikke er sikkert at har hatt vannkopper, bør rådes til å unngå nærkontakt med vannkopper eller herpes zoster, og hvis de eksponeres, bør de søke umiddelbar legehjelp. Hvis pasienten er et barn, må foreldrene få rådene ovenfor. Meslinger: Pasienter med nedsatt immunforsvar som har kommet i kontakt med meslinger, bør så fremt det er mulig, motta normal immunglobulin så snart som mulig etter eksponering. Vaksiner: Levende vaksiner skal ikke gis til personer med kronisk kortikosteroidbruk. Antistoffresponsen på andre vaksiner kan være forminsket. Pasienter med leverfunksjonssykdommer: Basert på erfaring med pasienter som lider av primær biliær kolangitt (PBC) i sent stadium med levercirrhose, forventes det en økt systemisk tilgjengelighet for budesonid hos alle pasienter med alvorlig nedsatt leverfunksjon. Pasienter med nyresykdommer: Selv om det ikke forventes at farmakokinetikken til budesonid vil bli endret hos pasienter med nedsatt nyrefunksjon, bør det i mangel av ytterligere data utvises forsiktighet ved administrering av legemidlet til pasienter med alvorlig nedsatt nyrefunksjon. Eldre (> 65 år): Det bør tas hensyn til at det oftere kan oppstå bivirkninger hos eldre pasienter. Derfor bør eldre pasienter overvåkes nøye for bivirkninger. Se SPC for flere advarsler og forsiktighetsregler. Interaksjoner: Hjerteglykosider: Virkningen av glykosidet kan forsterkes av kaliummangel, noe som er en potensiell og kjent bivirkning av glukokortikoider. Saluretika: Samtidig bruk av glukokortikoider kan føre til forsterket kaliumutskillelse og forverret hypokalemi. Cytokrom P450 (CYP): Samtidig behandling med CYP3A hemmere, inkludert legemidler som inneholder kobicistat, forventes å øke risikoen for systemiske bivirkninger. Sammensetninger eller legemidler som karbamazepin og rifampicin, som induserer CYP3A4, kan redusere den systemiske, men også den lokale, eksponeringen av budesonid i tarmenes slimhinner. Sammensetninger eller legemidler som metaboliseres av CYP3A4 kan komme til å konkurrere med budesonid. Graviditet og amning: Graviditet: Administrasjon under graviditet bør unngås med mindre det finnes tvingende årsaker til behandling med Budenofalk 4 mg stikkpiller. Amning: Tatt i betraktning fordelene av amming for barnet og fordelene av behandling for moren, må det tas en beslutning om ammingen skal opphøre eller om behandlingen med budenosid skal avsluttes/avstås fra. Bivirkninger: Svært vanlige: Nedsatt kortisol. Mindre vanlige: Binyreinsuffisiens, hodepine, rødming, abdominalsmerte, flatulens, pankreatitt, utslett, menstruasjonsforstyrrelse, uregelmessig menstruasjon. Pakninger og priser: 30 stk, 2455,60 NOK. Refusjon: Blå resept. A07E A06_6 Budesonid – Stikkpiller. Refusjonsberettiget bruk: Korttidsbehandling av mild til moderat akutt ulcerøs kolitt begrenset til rektum (ulcerøs proktitt) hos voksne. Refusjonskode: ICPC D94 - kronisk enteritt/ulcerøs kolitt. ICD K51 - ulcerøs kolitt. Vilkår: (272) Refusjon ytes kun når pasienten har forsøkt budesonid rektalvæske uten tilstrekkelig effekt eller med uakseptable bivirkninger. Basert på SPC godkjent: 22.05.2024. Innehaver av markedsføringstillatelsen: Dr Falk Pharma GmbH, Leinenweberstr. 5, 79108 Freiburg, Tyskland. Kontakt (repr.): Vifor Pharma Nordiska AB, Gustav III:s Boulevard 46, 169 73 Solna, Sverige, e-post: info.nordic@viforpharma.com. Les felleskatalogtekst eller preparatomtalen (SPC) for mer informasjon, se www.felleskatalogen.no
www.cslvifor.se


Tobias Hauge, Overlege PhD, Gastrokirurgisk avdeling OUS Ullevål og Utdanningsansvarlig i Nordic Early Esophageal Neoplasia Association (NEENA)


Den 2. og 3. oktober foregikk et av årets virkelige store begivenheter for alle Barrettsinteresserte – det 4. nordiske møtet om Barretts øsofagus (BE) og spiserørskreft i tidlig stadium. Møtet, som tidligere har foregått i Stockholm, Oslo og på Reykjavik, var nå lokalisert til Gøteborg (bilde 1). Nytt av året var også at møtet har byttet navn til NEENA-møtet, for å signalisere at det er den nyopprettede nordiske interesseorganisasjonen Nordic Early Esophageal Neoplasia Association (NEENA) som står bra. To intense og spennende dager ventet 94 deltakerne fra ni land med et spekkfult program fylt med live-endoskopi, foredrag fra internasjonale kapasiteter og presentasjon av spennende nordiske forskningsprosjektet. Hensikten med møtet er som tidligere: utdanning av lokale endoskopører og et sted hvor ekspertene kan møtes.
Rapp, live-endoskopi og hvordan undersøke en pasient med Barretts øsofagus?
Møtet startet med et smell – i stedet for den tradisjonelle muntlig gjennomgang av programmet, hadde de laget en musikkvideo (rapp) som gjorde jobben. Et virkelig sjakktrekk som løsnet stemningen før et at møtets virkelige høydepunkter – live-endoskopi. Vi fikk se Nima Mottacki (Sahlgrenska Universitetssjukhus) og Martin Jeremiasen (Skånes Universitetssjukhus) utføre en elegant endoskopisk submukosal disseksjon (ESD) av en suspekt lesjon i øsofagus etterfulgt av en diagnostisk endoskopi på en nyhenvist pasient med mistanke om høygradig dysplasi (HGD) (bilde 2). Sistnevnte kasus, illustrerte flere viktige poenger, blant annet at det histologisk kan være vanskelig å skille dysplasi fra inflammasjon og at man bør unngå å ta biopsier under en aktiv øsofagitt (1).
Etter en kort pause, fulgte «state-of-the-art lecture» med Professor Raf Bisschops (UZ Leuven) (bilde 3). Bisschops, som har vært med å utforme de europeiske retningslinjene (ESGE) for BE, gjennomgikk basale, men viktige prinsipper for å signifikant øke deteksjonsrate av dysplasi og kreft i tidlig stadium i spiserøret: bruk det beste endoskopet du har, sett av godt med tid (1 min per cm BE), få spiserøret helt rent før du begynner, suspekte lesjoner skal biopseres og klassifiseres etter Paris-klassifiseringen, BE-utbredelse etter Praha-klassifiseringen og biopseres etter


Seattle-protokollen (kvadrantbiopsier hver 2. cm) (1). Glem ikke å retroflekter for å vurdere cardia. Det ble videre påpekt at bruk av eddik ikke kan erstatte Seattle-protokollen, da det ikke fører til økt deteksjonsrate (2).
Det foreligger stor uenighet blant patologer hva som egentlig er lavgradig dysplasi (LGD) (3). Professor Marnix Jansen (University College London) presenterte en multisenterstudie hvor 51 patologer fra over 20 land ble spurt om å vurdere 55 BE-biopsier (4). Konklusjonen er at patologer i stor grad enige om diagnosen ikke-dysplastisk BE og HGD, men kun 42 % av patologene var enige om diagnosen LGD.
For å bøte på denne usikkerheten, ble vi presentert en KI-basert modell (TissueCypher) som ved hjelp av molekylærbiologiske analyser av vevsprøven, har vist signifikant å øke sannsynligheten for korrekt diagnose og dermed korrekt behandling av pasienten (5).
Dagen ble avsluttet med en særdeles hyggelig middag, hvor nye og gamle bekjentskap ble pleid (bilde 4).
Bruk av ikke-endoskopiske metoder og overdiagnostikk
Dag to startet med en av de virkelige store innenfor Barretts øsofagus – professor Rebecca Fitzgerald fra University of Cambridge (bilde 5). Hun står bak flere banebrytende studier, blant annet om bruk av ikke-endoskopiske metoder for å påvise BE. I den prospektive BEST3-studien, med over 13.000 pasienter > 50 år som har brukt PPI siste 6 måneder, har de vist at bruk av Cytosponge (en «kapselsvamp» som svelges, løses seg opp i magesekken, og når dras ut, tar celleprøver fra hele øsofagus og cardia som senere
undersøkes ved spesifikke biomarkører), kan påvise BE 18 ganger hyppigere enn «standard care» (henvisning til gastroskopi etter individuell vurdering) (6). Om økt deteksjon av BE fører til lavere cancerrelatert mortalitet og morbiditet, undersøkes fortiden i BEST4-studien hvor per nå 30.000 briter er inkludert (inklusjonsmål: 140.000 personer).
Studiene over er for «case finding», altså påvisning av BE hos asymptomatiske høyrisikoindivider. Men, Fitzgerald presenterte også data på at slike «kapselsvamper» kan brukes til «sile ut» hvilke nyhenviste symptomatiske pasienter som trenger gastroskopi og for subklassifisere pasienter med ikke-dysplastisk BE etter risiko for progresjon og dermed hvor hyppig pasientene bør kontrolleres. (7-8). Førstnevnte er vist i en britisk prospektiv studie med 1300 pasienter henvist for gastroskopi på indikasjon refluks. Her klarte «kapselsvampen» å «sile ut» 70 % av pasientene som ikke trengte gastroskopi! (8). Av de 70 % av pasientene som ikke gikk til gastroskopi, ble det i etterkant funnet spiserørskreft hos én pasient.
Vi kontrollerer for mange pasienter med BE. Dette understrekes i den nylig publiserte BOSS-studien (Barrett´s Oesophagus Surveillance Versus Endoscopy at Need Study) - en britisk prospektiv studie med 3453 pasienter med kjent BE, hvor pasientene ble randomisert til gastroskopi-kontroll hvert 2. år (med kvadrantbiopsier hver 2. cm) eller gastroskopi på indikasjon (9). Etter median 12.8 år fant studien ingen forskjell i total-overlevelse, kreft-spesifikk overlevelse eller risiko for å utvikle adenokarsinom i spiserøret. Studien har i etterkant fått kritikk for å være betydelig underdimensjonert for å kunne vise en evt forskjell i et så fast endepunkt som total-overlevelse (10). Videre er insidensen av spiserørskreft

5: Professor Rebecca Fitzgerald (University of Cambridge) foreleser.

Bilde 6: Ken Namikawa (Landspitali University Hospital, Reykjavik) presenterer planlagt studie om screening av orofaryngeal plateepitelkarsinom hos høyrisikoindivider.
i «gastroskopi på indikasjon»-gruppen hele 4.5 ganger høyere enn nasjonale britiske tall. Vi kan nok således ikke avskaffe gastroskopi-kontroller for ikke-dysplastiske BE-pasienter, men det kan nok reduseres betydelig og kanskje kan vi i framtiden få hjelp av «kapselsvampene» til å lage et individuelt oppfølgingsopplegg for den enkelte pasient? (7).
Pågående og planlagte nordiske forskningsprosjekter
Dagen ble avsluttet med et av høydepunkt for mange: presentasjon av pågående og planlagte nordiske forskningsprosjekter. Både danskene og svenskene arbeider med kartlegging av endoskopirapporter på BE-pasienter og hvordan kvaliteten kan bedres. Undertegnede presenterte tall fra det nyopprettede NORECa-endoskopi registeret vi har i Norge: et prospektivt register, utgående fra de fire universitetssykehusene som behandler pasienter med dysplastisk BE og spiserørskreft i tidlig stadium. Et register det ikke finnes mange av i verden. Vi fikk også høre om et spennende prosjekt fra Island, hvor de har ansatt Ken Namikawa fra Cancer Institute Hospital i Tokyo. Han har tatt med seg kunnskap fra Østen om screening av orofaryngeal plateepitelkarsinom hos høyrisikoindivider, som nå planlegges gjennomført i en nordisk studie (bilde 6). Namikawa kunne også rapportere at han endoskopisk hadde påvist orofaryngeal platepitelkarsinom (og behandlet pasienten selv med ESD) i tilfeller hvor øre-nese-hals legen ikke hadde klart å påvise tumoren!
Nordic Early Esophageal Neoplasia Association (NEENA) arrangerer webinarer
Avslutningsvis fikk vi en presentasjon av den Nordiske interesseorganisasjonen for dysplasi og kreft i tidlig stadium (NEENA) som også var medarrangør for møtet. Gruppen arbeider med undervisning, forskning og har som mål å være en møteplass for endoskopører med interesse for pasientgruppen. De har nylig avholdt et webinar med tips og triks for deteksjon og gradering av plateepitelkarsinom i tidlig stadium i øsofagus og det planlegges et
nytt webinar om screening av orofaryngeal plateepitalkarsinom hos høyrisiko-individer. Begge webinarer fra vår japanske kollega på Island. Se www.theneena.com for mer informasjon.
Alt i alt, et meget vellykket møte. Neste års NEENA-møte vil være i Helsinki 8-9.10.2026! Hjertelig velkommen!
Referanser:
1. Weusten BLAM, Bisschops R, Dinis-Ribeiro M, di Pietro M, Pech O, Spaander MCW, et al. Diagnosis and management of Barrett esophagus: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2023(EFirst).
2. Beaufort I, Boer L, Milne A, Alderlieste Y, Baars J, Bos P, et al. Acetic acid chromoendoscopy for the detection of neoplastic Barrett Esophagus: a stepped wedge cluster randomized clinical trial. Endoscopy. 2025;57(S 02):BA005.
3. Vennalaganti P, Kanakadandi V, Goldblum JR, Mathur SC, Patil DT, Offerhaus GJ, et al. Discordance Among Pathologists in the United States and Europe in Diagnosis of Low-Grade Dysplasia for Patients With Barrett's Esophagus. Gastroenterology. 2017;152(3):564-70.e4.
4. van der Wel MJ, Coleman HG, Bergman J, Jansen M, Meijer SL. Histopathologist features predictive of diagnostic concordance at expert level among a large international sample of pathologists diagnosing Barrett's dysplasia using digital pathology. Gut. 2020;69(5):811-22.
5. Duits LC, Khoshiwal AM, Frei NF, Pouw RE, Smolko C, Arora M, et al. An Automated Tissue Systems Pathology Test Can Standardize the Management and Improve Health Outcomes for Patients With Barrett's Esophagus. Am J Gastroenterol. 2023;118(11):2025-32.
6. Fitzgerald RC, di Pietro M, O'Donovan M, Maroni R, Muldrew B, Debiram-Beecham I, et al. Cytosponge-trefoil factor 3 versus usual care to identify Barrett's oesophagus in a primary care setting: a multicentre, pragmatic, randomised controlled trial. Lancet. 2020;396(10247):333-44.
7. Tan WK, Ross-Innes CS, Somerset T, Markert G, Markowetz F, O'Donovan M, et al. Biomarker risk stratification with capsule sponge in the surveillance of Barrett's oesophagus: prospective evaluation of UK real-world implementation. Lancet. 2025;406(10500):271-82.
8. Chien S, Glen P, Bryce G, Cruickshank N, Penman I, Robertson K, et al. Clinical application of capsule sponge testing in symptomatic reflux disease: a national prospective cohort study. BMC Gastroenterol. 2024;24(1):431.
9. Old O, Jankowski J, Attwood S, Stokes C, Kendall C, Rasdell C, et al. Barrett's Oesophagus Surveillance Versus Endoscopy at Need Study (BOSS): A Randomized Controlled Trial. Gastroenterology. 2025;169(6):1233-43.e8.
10. Fitzgerald RC, Sasieni P. Lessons learned from the BOSS trial: new directions in Barrett's oesophagus. Lancet Gastroenterol Hepatol. 2025;10(9):783-5.

Vi jobber hele tiden for å bidra til bedre kunnskap innenfor gastroenterologi. Skann QR-koden for å kontakte Tillotts-teamet ditt for forespørsel om boken.




Eivind Ness-Jensen
Overlege, Medisinsk avdeling, Sykehuset Levanger Førsteamanuensis, HUNT forskningssenter, NTNU
Hypergastrinemi, ofte forårsaket av kronisk atrofisk gastritt eller Helicobacter pylori (H. pylori) -infeksjon, er kjent for å øke risikoen for ventrikkelkreft og nevroendokrine neoplasmer (NEN). Langvarig bruk av protonpumpehemmere (PPI) gir også hypergastrinemi, men sammenhengen med NEN i ventrikkel har vært lite undersøkt. I denne studien fant vi at langvarig bruk av PPI var assosiert med økt risiko for NEN i ventrikkel i et doseavhengig forhold og særlig hos yngre pasienter.
Introduksjon
Hypergastrinemi, forårsaket av kronisk atrofisk gastritt eller H. pylori-assosiert pangastritt, er forbundet med økt risiko for ikke-cardial ventrikkelkreft. Nyere studier har også funnet økt risiko for ventrikkelkreft hos langtidsbrukere av PPI. Pasienter med kronisk atrofisk gastritt har også økt risiko for NEN på grunn av hypergastrinemi. Det er imidlertid ikke undersøkt om langvarig bruk av PPI øker risikoen for NEN i ventrikkel i den generelle befolkningen.
Mål og metoder
Målet med denne studien var å vurdere risikoen for NEN i ventrikkel blant langtidsbrukere av PPI i en multinasjonal, populasjonsbasert studie fra de nordiske landene (Danmark, Finland, Island, Norge og Sverige). Studien var en kasus-kontrollstudie matchet for kjønn, alder, kalenderår og land, og inkluderer alle voksne (≥18 år) med ventrikkel- eller øsofaguskreft i de nordiske landene. I denne studien ble forekomsten av nye tilfeller med NEN i ventrikkel identifisert i kreftregistrene i de ulike landene, og eksponeringen var langvarig bruk av PPI, kategorisert i tre like store grupper (tertiler) av definerte døgndoser (DDD) fra legemiddelregistrene i perioden 1996–2020. Multivariabel logistisk regresjon ble brukt til å beregne odds ratio (OR) og 95 % konfidensintervall (KI), justert for kronisk atrofisk gastritt, NEN i duodenum eller pankreas, og H. pylori-infeksjon identifisert i pasient- og legemiddelregistrene.
Resultater
Totalt ble 1 790 pasienter med NEN i ventrikkel sammenlignet med 17 897 kontrollpersoner. Etter en utvaskingsperiode på ett år var median oppfølgingstid 11,8 år. Risikoen for nye NEN i ventrikkel økte hos PPI-brukere sammenlignet med ikke-brukere på
en doseavhengig måte. Justert OR for nye NEN i ventrikkel var 1,83 (95 % KI 1,56–2,15) i den høyeste tertilen av PPI-bruk (>385 DDD i hele legemiddelhistorien) sammenlignet med ingen PPIbruk (se tabell). Risikoen var høyere i den yngre aldersgruppen (<65 år) enn i den eldre (≥65 år), og estimatene var konsistente når man ekskluderte personer med kronisk atrofisk gastritt, andre NEN og H. pylori-infeksjon.
Konklusjon
I denne populasjonsbaserte studien fra de fem nordiske landene var risikoen for NEN i ventrikkel økt hos PPI-brukere sammenlignet med ikke-brukere, tilsynelatende på en doseavhengig måte. Risikoen var høyere i yngre aldersgrupper av PPI-brukere sammenlignet med eldre. Et abstrakt av studien ble presentert på årets European United Gastroenterology Week i Berlin.
Tabell: Risiko for nevroendokrine neoplasmer (NEN) i ventrikkel etter eksponering for protonpumpehemmere (PPI) definert ved tertiler av definerte døgndoser (DDD) for hele legemiddelhistorien mellom 1996 og 2020.
PPI (DDD)* Ujustert OR (95 % KI)** Justert OR (95 % KI)***
Ingen 1,00 (referanse) 1,00 (referanse)
Tertil 1 1,46 (1,25–1,70) 1,34 (1,14–1,58)
Tertil 2 1,54 (1,30–1,81) 1,37 (1,15–1,64)
Tertil 3 1,92 (1,65–2,24) 1,83 (1,56–2,15)
* Tertiler: 1 ≤56 DDD; 2 >56–385 DDD; 3 >385 DDD.
** Matchet for kjønn, alder, kalenderår og land.
*** Matchet for kjønn, alder, kalenderår og land, og justert for kronisk atrofisk gastritt, NEN i duodenum eller pankreas, og H. pylori-infeksjon.
UTVALGT SIKKERHETSINFORMASJON
Kontraindikasjoner: Kontraindisert ved overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene, alvorlig nedsatt leverfunksjon, alkoholmisbruk, alvorlig nedsatt nyrefunksjon, underliggende bloddyskrasi, alvorlige, akutte eller kronske infeksjoner, sår i munnhulen og kjent aktiv gastrointestinal ulcussykdom, graviditet og amming, samtidig vaksinering med levende vaksiner. Advarsler og forsiktighetsregler: Pasienter som får behandling skal være under passende overvåkning slik at tegn på eventuelle toksiske effekter eller bivirkninger kan oppdages og vurderes med minimal forsinkelse. Bivirkninger: De alvorligste bivirkningene av metotreksat inkluderer benmargssuppresjon, lungetoksisitet, levertoksisitet, nyretoksisitet, nevrotoksisitet, tromboemboliske hendelser, anafylaktisk sjokk og Stevens-Johnson syndrom. De hyppigst (svært vanlige) observerte bivirkningene av metotreksat inkluderer gastrointestinale sykdommer og unormale leverfunksjonsprøver. Andre hyppige (vanlige) bivirkninger er leukopeni, anemi, trombopeni, hodepine, tretthet, døsighet, pneumoni, interstitiell alveolitt/ pneumonitt ofte forbundet med eosino- fili, munnsår, diaré, eksantem, erytem og pruritus. Graviditet og amning: Metotreksat er kontratndisert ved graviditet og amning ved ikkeonkologiske indikasjoner. Kvinner skal ikke bli gravide under metotreksat-behandling og sikker prevensjon skal brukes under behandling med metotreksat og deretter i minst 6 måneder. Som forholdsregel anbefales seksuelt aktive mannlige pasienter eller deres kvinnelige partnere å bruke sikker prevensjon under behandlingen av den mannlige pasienten og i minst 3 måneder etter at bruken av metotreksat er avsluttet. Menn bør ikke donere sæd under behandlingen og i 3 måneder etter seponering av metotreksat.
Behandling av aktiv revmatoid artritt hos voksne pasienter, polyartrittiske former av alvorlig, aktiv, juvenil idiopatisk artritt, hvor respons på ikke-steroide antiinflammatoriske legemidler (NSAIDs) ikke har vært adekvat, moderat til alvorlig psoriasis hos voksne pasienter som er kandidater for systemisk behandling, samt kraftig psoriasisartritt hos voksne, mild til moderat Crohns sykdom, enten alene eller i kombinasjon med kortikosteroider, hos voksne pasienter som ikke reagerer på behandling eller som er intolerante overfor tiopuriner.
Metex®penn(metotrexat)50mg/ml7,5-30mginjeksjonsvæske, oppløsning i ferdigfylt penn, ATC-kode: L04AX03 Dosering: Skal injiseres subkutant én gang i uken. Feildosering kan føre til alvorlige bivirkninger, inkludert dødsfall. Metotreksat bør kun forskrives av leger med ekspertise innen bruk av metotreksat og grundig forståelse av risikoene ved behandling med metotreksat. Pasienter som selv skal sette metotreksat, må få opplæring og trening i korrekt injeksjonsteknikk. Den første injeksjonen med Metex® Penn bør utføres under direkte tilsyn av lege. Reseptgruppe: C Refusjon: Blå resept. Pakninger og priser: Pakninger og priser, AUP (trinnpris): Ferdigfylte penner som inneholder 1 x 0,15 ml (7,5 mg) NOK 190,80 (NOK 155,40), 6 x 0,15 ml (7,5 mg) NOK 961,50 (NOK 751,20), 1 x 0,2 ml (10 mg) NOK 218,80 (NOK 168,10, 6 x 0,2 ml (10 mg) NOK 1102 (NOK 827,10), 1 x 0,25 ml (12,5 mg) NOK 230,30 (NOK 180,40), 6 x 0,25 ml (12,5 mg) NOK 1179,40 (NOK 901,40), 1 x 0,3 ml (15 mg) NOK 240,20 (NOK 186,10), 6 x 0,3 ml (15 mg) NOK 1256,30 (NOK 935,40), 1 x 0,35 ml (17,5 mg) NOK 258,40 (NOK 199,10), 6 x 0,35 ml (17,5 mg) NOK 1346,80 (NOK 1013,10), 1 x 0,4 ml (20 mg) NOK 269,80 (NOK 211,00), 6 x 0,4 ml (20 mg) NOK 1431,90 (1084,90), 1 x 0,45 ml (22,5 mg) NOK 279,10 (NOK 225,60), 6 x 0,45 ml (22,5 mg) NOK 1493,30 (NOK 1172,60), 1 x 0,5 ml (25 mg) 279,10 (NOK 225,60), 6 x 0,5 ml (25 mg) 1493,30 (NOK 1172,60) eller 1 x 0,6 ml (30 mg) NOK 340,20. For utfyllende informasjon om dosering, kontraindikasjoner, advarsler og forsiktighetsregler, interaksjoner og bivirkninger, se Metex® penn SPC godkjent 18.09.2024. medac, info@medac.no, tlf +47 90 63 81 04, Postbox 84, 1312 Slependen, Norge.


Høyere biotilgjengelighet sammenlignet med oral administrering *1
Injeksjonsvolum 0,15-0,60 ml1
Hurtig injeksjon - maks. 5 sek1
Europeisk produksjon2
1. Godkjent SPC Metex® penn 09-2024, felleskatalogen.no
2. Metex® penn pakkningvedlegg 08-2024, felleskatalogen.no
* Etter oral administrasjon er den gjennomsnittlige biotilgjengeligheten omtrent 70 %, men betydelige individuelle avvik (25100 %) er mulig. Biotilgjengelighet ved subkutan, intravenøs og intramuskulær injeksjon kan sammenlignes og er nær 100 %.
AVTALE MØTE? Kontakt meg på: a.persia@medac.no +47 97



UEGW
Oral presentasjon av abstrakt, UEGW, Berlin 06.10.25 ved Jolanta Lorentzen, overlege, Sykehuset i Vestfold, Tønsberg

Bakgrunn:
Jolanta H. Lorentzen, Gastromedisinsk avdeling og Hormon-, overvekt- og ernæringsavdelingen – Forskningsseksjonen, Sykehuset i Vestfold, Tønsberg
Asle W. Medhus, Professor, OUS
Birgitte Seip, Sykehuset i Vestfold, Tønsberg
Jostein W. Hauge, Sykehuset i Vestfold, Tønsberg
Få studier har kartlagt gastroøsofageal reflukssykdom (GØRS) og øsofageal dysmotilitet hos pasienter med fedme og diabetes type 2 (T2D) operert med sleeve-gastrektomi (SG) eller gastrisk bypass (RYGB) (2). Vi har nylig rapportert generell forekomst av gastroøsofagealreflukssykdom (GØRS) i denne pasientgruppen (3) og hadde nå som mål å undersøke potensielle forskjeller mellom de to kirurgiske metodene angående forekomsten av dysmotilitet 5 år etter operasjonen. Videre hadde vi også som mål å analysere og rapportere GØRS-data i detalj. Forekomsten av GØRS er økende, med en prevalens på opptil 72 % hos personer med fedme og 41 % hos de som har T2D (4,5,6). Forekomsten av øsofageal dysmotilitet hos pasienter med fedme og/eller T2D er 20-61 % (7). De vanligste motilitesforstyrrelsene rapportert i andre studier etter SG eller RYGB, viste endring i basaltrykket i nedre øsofagussfinkter (LES), forstyrret LES-relaksasjon, ineffektiv øsofageal motilitet (IEM) og hyperkontraktil øsofagus (8). Forandringene er rapportert til å forekomme oftere etter SG.
Materiale og metoder:
Osebergstudien (Obesity surgery in Tønsberg) er en singelsenter, én-til-én randomisert, kontrollert og trippel-blind studie (RCT-studie), som startet ved Sykehuset i Vestfold i januar 2013. Studien inkluderte voksne pasienter med T2D (HbA1c ≥6.5 % eller bruk av antidiabetika med HbA1c ≥6.1 %) og fedme (KMI ≥35 kg/m²).
Alle studiepasienter ble undersøkt med gastroskopi (Los Angeles klassifikasjon av erosiv reflukssykdom), 24-timers pH-registrering (Acid Exposure Time (AET) >6 %) og høyoppløsnings-øsofagusmanometri (Chicago klassifikasjon vs.3). Spørreskjemaet «Gastroesophageal Reflux Disease Questionnaire» (GerdQ, skår ≥8) ble brukt for kartlegging av reflukssymptomer. Pasienter med refluksøsofagitt LA grad C-D, Barretts øsofagus, hiatushernie >5 cm, eller distal kontraktil integral (DCI) >5000 mm Hg*s*cm med symptomer, ble ekskludert ved baseline.
Jens Kristoffer Hertel, Sykehuset i Vestfold, Tønsberg
Marius Svanevik, Sykehuset i Vestfold, Tønsberg
Rune Sandbu, Sykehuset i Vestfold, Tønsberg
Jøran Hjelmesæth, Professor, Sykehuset i Vestfold, Tønsberg Dag Hofsø, Sykehuset i Vestfold, Tønsberg
Resultater:
125 pasienter gjennomgikk screening, 16 pasienter ble ekskludert eller trakk samtykket, slik at 109 pasienter ble allokert enten til SG (n=55) eller RYGB (n=54). Ved baseline var gjennomsnittsalder 47,7 år (SD 9,6), KMI 42,3 kg/m2 (5,3) og 66 % var kvinner. Ved femårsoppfølging gjennomførte 62 (57 %) pasienter gastroskopi, 49 (45 %) 24-timers pH-måling, 50 (46 %) manometri og 84 (77 %) besvarte spørreskjemaet. Kun sju (17 %) pasienter rapporterte dyspepsisymptomer (GerdQ ≥8). Vi fant ingen signifikante endringer i de manometriske parametrene fem år etter SG eller RYGB (Tabell 1). Øsofageal dysmotilitet ble diagnostisert hos 14 (61 %) pasienter etter SG sammenlignet med 19 (73 %) pasienter etter RYGB. De fleste av disse pasientene (n = 22) hadde hypertensiv eller hypotensiv LES, uten forskjell mellom gruppene. De resterende 11 pasientene hadde ineffektiv øsofageal motilitet (IEM) eller forhøyet distal kontraktil integral (DCI) (Tabell 2). Ingen av pasientene med dysmotilitet rapporterte svelgevansker eller brystsmerter ved matinntak. Forekomsten av erosiv øsofagitt etter SG og RYGB var høy ved femårskontrollen, 38 % mot 41 %, de fleste hadde erosiv øsofagitt, LA klassifikasjon grad A-B, én pasient i hver gruppe hadde nyoppstått Barretts øsofagus. Andel pasienter med pH <4 over 6 % av døgnet (AET) var sju ganger høyere etter SG sammenlignet med RYGB, 59 % mot 8 %, p<0,0001.
Oppsummering:
Femårsresultatene fra Oseberg-studien viste omtrent like høy forekomst av øsofageal dysmotilitet (2 av 3 pasienter) og erosiv reflukssykdom (2 av 5 pasienter), mens sju ganger høyere forekomst av patologisk syremåling etter SG sammenlignet med RYGB. Ingen av pasientene med dysmotilitet rapporterte brystsmerter eller svelgevansker ved matinntak. Få pasienter rapporterte dyspepsiplager.
Mean DCI, mm Hg.cm.s
Baseline 2910 (2170) 3293 (2137) 5 years 2686 (2209) 2626 (1781) 0.61 Hiatal hernia, 5 years* 9/23 (39) 11/26 (42) 1.00
Mean (SD); *all hiatal hernia ≥1 cm and <5 cm LES= Lower esophageal sphincter DCI=distal contractile integral
Konklusjon:
Vi foreslår at objektiv vurdering av GØRS bør inngå i langtidsoppfølgingen etter SG for å forebygge utvikling av utalt reflukssykdom, Barretts øsofagus og dysplasi.
Den høye forekomsten av asymptomatisk dysmotilitet i øsofagus har usikker klinisk relevans.
Referanser
1. Lorentzen J. Esophageal motility and gastroesophageal reflux disease in patients with type 2 diabetes operated with gastric bypass or sleeve gastrectomy, 5-year results from the Oseberg study. UEG Week 2025,October 6th, Session: Burning issues in GERD, Neurogastroenterology&Motility.
2. Memon MA, Osland E, Yunus RM, Hoque Z, Alam K, Khan S. The effect of laparoscopic vertical sleeve gastrectomy and laparoscopic rouxen-Y gastric bypass on gastroesophageal reflux disease: An updated meta-analysis and systematic review of 5-year post-operative data from randomized controlled trials.
Ineffectivec Esophageal Motility (IEM) (hypocontractile esophagus)
Baseline 1/51 (2) 3/51 (6) 5 years 2/23 (9) 6/26 (23) 0.26
Jackhammer (hypercontractile esophagus)
Baseline 6/52 (12) 8/51 (16) 5 years 2/23 (9) 1/26 (4) 0.59
Hypotensive LES
Baseline 1/52 (2) 4/51 (8)
5 years 5/23 (22) 7/26 (27) 0.65
Hypertensive LES
Baseline 23/52 (44) 20/51 (39)
5 years 5/23 (22) 7/26 (27) 0.65
3. Hauge JW et al., Effect of gastric bypass versus sleeve gastrectomy on the remission of type 2 diabetes, weight loss, and cardiovascular risk factors at 5 years (Oseberg): secondary outcomes of a single-centre, triple-blind, randomised controlled trial. Lancet Diabetes Endocrinol. 2025 Apr 1:S2213-8587(24)00396-6.
4. Eusebi LH, Ratnakumaran R, Yuan Y, Solaymani-Dodaran M, Bazzoli F, Ford AC. Global prevalence of, and risk factors for, gastro-oesophageal reflux symptoms: a meta-analysis. Gut. 2018 Mar;67(3):430-440.
5. Hampel H, Abraham NS, El-Serag HB. Meta-analysis: obesity and the risk for gastroesophageal reflux disease and its complications. Ann Intern Med. 2005 Aug 2;143(3):199-211
6. Sakitani K, Suzuki N, Ihara S, Hirata Y, Kawazu S, Iwamoto Y, Koike K. Decline in perception of acid regurgitation symptoms from gastroesophageal reflux disease in diabetes mellitus patients. PLoS One. 2018 Mar 15
7. Hampel H, Abraham NS, El-Serag HB. Meta-analysis: obesity and the risk for gastroesophageal reflux disease and its complications. Ann Intern Med. 2005 Aug 2;143(3):199-211
8. Valentini DF Jr, Mazzini GS, Lazzarotto-da-Silva G, Simões AB, Gazzi VS, Alves JBO, Campos VJ, Gurski RR. Significant and distinct impacts of sleeve gastrectomy and Roux-en-Y gastric bypass on esophageal acid exposure, esophageal motility, and endoscopic findings: a systematic review and meta-analysis. J Gastrointest Surg. 2024 Sep;28(9):1546-1557.

Knut E. A. Lundin, Professor, dr. med., Norsk Senter for Cøliakiforskning, Institutt for klinisk medisin, Det medisinske fakultet, Universitetet i Oslo Overlege, Seksjon for fordøyelsessykdommer, Avdeling for transplantasjonsmedisin, Klinikk for spesialisert medisin, Oslo Universitetssykehus Rikshospitalet
Cøliaki skyldes en skadelig immunreaksjon mot gluten, som rammer tynntarmen og hele kroppen. VI har nå brukt nanopartikkel-teknologi for å indusere antigen-spesifikk nedregulering av immunreaksjonen. Prinsippet er lovende som immunterapi av cøliaki og andre immunsykdommer.


Bakgrunn
Cøliaki er en vanlig immunsykdom som rammer 1,5 % av befolkningen i Norge – dette er tydelig vist i studier fra både Tromsø og Nord-Trøndelag (HUNT). Den skyldes en skadelig immunreaksjon mot gluten fra hvete, rug og bygg. Denne immunreaksjonen starter hos de fleste cøliakere i barneår, mens diagnosen som oftest stilles mye senere i livet. Immunpatogenesen er meget godt kartlagt, og vi har i Oslo bidratt med denne forståelsen med arbeidet vårt siden 1980-tallet. Dette arbeidet bygger på samarbeid mellom undertegnete på den kliniske siden og professor, dr. med., Ludvig M. Sollid på den basalmedisinske og immunologiske siden.
Immunologisk mekanisme
Gluten er et særegent protein med svært mange prolamin- og glutaminresiduer. Når disse proteinene fordøyes, brytes de ned til korte, mellomlange og lange peptidkjeder inkludert et 33 aminosyrer-langt fragment. Glutaminresiduer i disse kjedene kan modifiseres til glutaminsyre ved enzymet transglutaminase 2. Dette skjer sannsynlig i lumen, og gir såkalte deamiderte glutenpeptider. Det
kan nevnes at antistoffer mot transglutaminase 2 og deamiderte glutenpeptider er viktige innen diagnostikk. De deamiderte glutenpeptidene binder seg til HLA-molekylene HLA-DQ2 eller -DQ8, vevstypeantigener som bæres av nesten halvparten av den norske befolkningen, men så godt som alle cøliakere. Det unike hos cøliakerne er CD4+ T-celler som gjenkjenner deamiderte glutenpeptider presentert av HLA-DQ2 og -DQ8. Det er disse T-cellene som er «master switch» i sykdommen, og som vi nå har studert i en immunterapimodell.
Samarbeid med industri
Utvikling av medisiner er avhengig av samarbeid med industri. I dette tilfeller Topas Therapeutics fra Tyskland, som arbeider med å utvikle immunterapi på basis av forskning utført ved Universitetet i Hamburg. Prinsippet for immunterapi er å koble spesifikke antigener inn i nanopartikler. Disse nanopartiklene søker seg raskt til spesiell immunoregulatoriske celler i leveren kalt «liver sinusoidal endothelial cells» (LSEC).

Til ve. professor Knut Lundin og til hø. Professor Las Aabakken, begge OuS Rikshospitalet etter prisutdelingen på UEGWs åpningsdag. (Foto: Martin Hörmandinger, Jan Pauls og UEG.)
Klinisk studie
Vi rekrutterte pasienter til en placebo-kontrollert, randomisert, dobbelt-blindet studie. Pasientene hadde alle sikker cøliaki, og alle var i remisjon av sin sykdom målt ved kliniske tegn og med negativ serumtest på IgA mot transglutaminase 2. Kun cøliakere som var HLA-DQ2.5 positive, men HLA-DQ2.2 og HLA-DQ8 negative kunne delta. Dette innebar at vi måtte rekruttere mange, siden alle disse variantene er vanlige blant cøliakere. Det første skrittet etter dette var å gi cøliakerne to kjeks med til sammen seks gram gluten. De som responderte med en tydelig interleukin-2 utskillelse i serum fire timer etter å ha spist kjeksen, kunne delta videre. Disse fikk så økende doser nanopartikler med glutenpeptider (TPM502) eller nanopartikler uten gluten (placebo), to infusjoner hver, dag 1 og dag 15. Syv dager etter siste infusjon fikk de så to nye kjeks med gluten. Alle andre dager fortsatte de med sitt glutenfrie kosthold.
Resultater
Trettiseks pasienter fullførte hele studien. Vi noterte mange hendelser i studien, spesielt kvalme, hodepine og oppkast, både etter gluteninntak og medisin. Men vi så at de høyeste dosene med nanopartikler reduserte den kliniske responsen på glutenprovo-
kasjon. Vi testet reaksjon i blodet i et såkalt fullblods cytokinfrisettings-assay. De høyeste dosene med TPM502 nærmest slukket ut utskillelse av både interleukin-2 og interferon-gamma i dette assayet. Dette så vi helt opp til dag 43. I gruppen til Sollid har vi utviklet en metode for å påvise gluten-spesifikke T-celler med såkalte HLA-DQ:gluten tetramerer. I blodet (og i tarmen) er det veldig få av disse T-cellene, typisk mindre enn 10 per 1 million T-celler. Men vi kunne vise at disse T-cellene hadde endret fenotype og hadde flere likhetstrekk med det vi kjenner som regulatoriske T-celler, som kan dempe immunreaksjonene.
Presentasjoner på DDW og UEGW
Første del av dette arbeidet ble presentert på Digestive Disease Week i San Diego i mai 2025, andre del med immunregulatoriske celler på United European Gastroenterology Week i Berlin i oktober 2025. Abstraktet til UEGW ble belønnet med pris for ett av fem beste innsendte arbeider.
Hva skjer videre?
Vi planlegger videre studier, som vi håper snart kommer i gang.


Jolanta H. Lorentzen, Redaksjonsmedlem NGF Nytt, Overlege gastromedisinsk avdeling og Hormon-, overvekt- og ernæringsavdelingen – Forskningsseksjonen, Sykehuset i Vestfold, Tønsberg
Roald Flesland Havre, Leder NGF, Overlege avdeling fordøyelsessykdommer, Haukeland Universitetsykehus
Det er en stor glede for redaksjonen i NGF-nytt å kunne dele nyheten om at Professor Lars Aabakken ved OUS, Rikshospitalet ble nylig tildelt en velfortjent «Lifetime Achievement Award» fra United European Gastroenterology (UEG) for sitt enestående og banebrytende arbeid innen gastroenterologi og endoskopi. Han mottok prisen under en høytidelig åpningsseremoni den 5.oktober 2025 i Berlin.
Lifetime Achievement Award er en tung utmerkelse. Men dette er ikke bare en pris, det er takkepris fra en hel fagverden. Gjennom en lang og imponerende karriere har professor Aabakken vært en ledende kraft innen endoskopi og fagutvikling. Han har spilt en sentral rolle innenfor utdanning, forskning og innovasjon. Lars har vært en inspirasjon og mentor for mange yngre og eldrekollegaer.
Som professor ved Universitetet i Oslo og seksjonsoverlege ved Oslo Universitetssykehus, Rikshospitalet, har han hatt en sentral rolle i å bygge opp sterke fagmiljøer, og i å utdanne og veilede nye generasjoner spesialister. Som forsker utførte Lars Aabakken banebrytende arbeid om effekter av NSAID i gastrointestinale trakt ved å bruke nye metoder som Cr-EDTA for å teste permabilitet og Cr-markerte erytrocytter for å kvantifisere tap av blod. Han forsvarte sin PhD allerede i 1991, bare fem år etter medisinsk embetseksamen ved Universitetet i Oslo. Senere har Lars Aabakken har bidratt vesentlig til medisinsk utdanning i Norge. Han utarbeidet Turnuslegeboka, utgitt første gang i 1991 og boken har oppdaterte utgaver. Som ung lege i Volda, så han behovet for metodebok i skadebehandling og skrev sammen med en kollega en slik illustrert veildening som har vært i bruk lenge. Han er også redaktør av første utgave av det første norske komplette undervisningsverket «Indremedisin. Hans vitenskapelige produksjon inkluderer over 260 PubMed-indexed publikasjoner. Han har veiledet utallige PhD-studenter og har hatt ansvar for lærebokkapitler innen ndremedisin/gastroenterologi. Han har før mange andre hatt fokus på kvalitetsregistreiring og står bak Norsk ERCP register. Dette registeret har senere blitt inkludert i Gastronet som også registrerer koloskopi og EUS kvalitetsdata.
Lars Aabakken har vært en viktig representant for norsk gastroenterologi i internasjonale fagmiljøer. Han har vært Chair av WEO Standardization Committee og ledet arbeidet med å utvikle Minimal Standard Terminology. Han har og har hatt flere lederverv i

store Europiske og globale fagorganisasjoner innen gastroenterologisk endoskopi som president for Scandinavian Association for Digestive Endoscopy (SADE) og president for European Society of Gastrointestinal Endoscopy (ESGE) som første skandinav i denne rollen.

Han har vært sekretær for Scientific Committee of the 3rd UEG meeting i Oslo 1994 og medlem av UEG Education Committee 2002-2011. Lars Aabakken har også gjennom flere år vært sjefredaktør for Scandinavian Journal of Gastroenterology. Han er for tiden president av World Endoscopy Organization (WEO). Lars har i tillegg også vært engasjert i utdannelse og støtte til endo-
skopi i Afrika som del av internasjonalt arbeid. Han har deltatt i utviklings- og opplæringsprogrammer i flere afrikanske land som Etiopia, Kenya, Rwanda, Tanzania, Namibia, Senegal og Ghana.
Prisen ble utdelt under en høytidelig åpningsseremoni av United European Gastroenterology Week den 5.oktober i Berlin. Lars holdt en sterk og personlig takketale som gjorde dypt inntrykk på alle tilstedeværende. I talen trakk han frem viktige mentorer, bl.a. Magne Osnes, han takket også sin ekskone i 17 år, Karen. Med varme, klokskap og glimt i øyet delte han tilbakeblikk fra karrieren. Det var en påminnelse om at store fagpersoner også er store mennesker. Tildelingen er en velfortjent heder til en kollega som har vært en drivkraft for kvalitet, kunnskapsdeling og internasjonalt samarbeid.
Både NGF nytt redaksjonen og NGF styret gratulerer Lars hjerteligst med denne velfortjente anerkjennelsen og takker for det fantastiske arbeidet han har gjort og fortsatt gjør for gastroenterologien og endoskopien.
Takk for at dere annonserer i NGF-nytt. Deres bidrag er en forutsetning for at bladet kan gis ut i nåværende form. NGF-nytt har med årene gjennomgått betydelige forbedringer, både layout- og innholdsmessig. Opplaget er nå på 1300 og vi sender 4 utgaver per år til alle norske gastroenterologer og gastrokirurger som er medlemmer i NGF, endoskopienheter, gastroseksjoner og sykehusbiblioteker, samt til leger som er i spesialisering i fordøyelsessykdommer og gastrokirurgi.
Redaksjonen får mange positive tilbakemeldinger fra våre lesere og registrerer også en stadig økende trafikk på nettutgaven (gastroenterologen.no). Bladet har også blitt oppfattet som interessant for de offentlige organer Norsk Gastroenterologisk Forening samarbeider med.
Vi håper på fortsatt godt samarbeid i tiden som kommer!
Mvh Redaksjonen






Norsk Selskap for Klinisk Ernæring ønsker velkommen til ernæringskonferansen 2026
Ernæring og fordøyelsessystemet
Torsdag 22. januar 2026
Tid: 09:00-17:00
Sted: Månefisken, Sagveien 23 A-5, 0SLO
Det blir forelesninger og diskusjoner om mikrobiota, brain-gutaksen og ny behandlingsveileder for IBS, behandlingsmuligheter ved cøliaki, eosinofil øsofagitt og ernæringsbehandling ved IBD.
Påmelding og fullt program finnes på nettsiden: www.nske.no
Ønsker du å bli medlem i NSKE Se NSKE.no for informasjon om innmelding og fordeler
Det blir arrangert Presymposium av Nutricia kvelden før NSKE-konferansen, onsdag 21.januar, med høydepunkter fra ESPEN konferansen. Tid, sted og påmelding finnes på nettsiden.
Våre firmamedlemmer og støttespillere er:









Metaanalyse som involverer 6490 UC-pasienter som brukte ulike 5-ASA-preparater: Granulat gir like god mukosal tilheling som tabletter1
Mukosal tilheling hos UC-pasienter behandlet med 5-ASA*
* Metaanalyse med 90 behandlingsarmer og 6490 pasienter. Målet med studien var å systematisk gjennomgå medisinsk litteratur for å sammenligne effekten av ulike 5-ASA-preparater på mukosal tilhelning.
2 g og 4 g – valget er ditt
Pentasa «Ferring Legemidler AS»
Pentasa Sachet «Ferring Legemidler AS»
Antiinflammatorisk middel, aminosalisylsyrepreparat.
DEPOTTABLETTER 500 mg og 1 g: Pentasa: Hver depottablett inneh.: Mesalazin 500 mg, resp. 1 g, povidon, etylcellulose, magnesiumstearat, talkum, mikrokrystallinsk cellulose.
REKTALVÆSKE, suspensjon 1 g: Pentasa: 100 ml inneh.: Mesalazin 1 g, natriummetabisulfitt (E 223), natriumacetattrihydrat (E 262), dinatriumedetat, konsentrert saltsyre til pH 4,8, renset vann.
STIKKPILLER 1 g: Pentasa: Hver stikkpille inneh.: Mesalazin 1 g, magnesiumstearat, talkum, povidon, makrogol 6000.
DEPOTGRANULAT 1 g, 2 g og 4 g: Pentasa Sachet: Hver dosepose inneh.: Mesalazin 1 g, resp. 2 g og 4 g, etylcellulose, povidon.
Indikasjoner: Depottabletter og depotgranulat: Ulcerøs kolitt og Morbus Crohn. Rektalvæske: Ulcerøs proktosigmoiditt. Stikkpiller: Aktiv ulcerøs proktitt. Dosering: Depottabletter og depotgranulat: Individuell dosering. Ulcerøs kolitt hos voksne: Aktiv sykdom: Opptil 4 g 1 gang daglig eller fordelt på flere doser. Remisjon: Opptil 4 g/dag fordelt på flere doser. Anbefalt vedlikeholdsdose ved mild til moderat sykdom er 2 g 1 gang daglig. Morbus Crohn hos voksne: Aktiv sykdom og remisjon: Opptil 4 g/dag fordelt på flere doser. Ulcerøs kolitt og Morbus Crohn hos barn ≥6-18 år: Begrenset dokumentasjon mht. effekt. Generelt anbefales halv voksen dose til barn ≤40 kg og normal voksen dose til barn >40 kg. Aktiv sykdom: Start med 30-50 mg/kg/dag, fordelt på flere doser. Maks. dose 75 mg/kg/dag, fordelt på flere doser. Total dose bør ikke overskride 4 g/dag. Remisjon: Start med 15-30 mg/kg/dag, fordelt på flere doser. Total dose bør ikke overskride anbefalt voksen dose. Rektalvæske: Ulcerøs proktosigmoiditt: Voksne: 1 klyster hver kveld før sengetid i 2-4 uker. Barn: Liten erfaring og begrenset dokumentasjon mht. effekt. Stikkpiller: Aktiv ulcerøs proktitt: Voksne: 1 stikkpille 1 gang daglig. Barn: Liten erfaring og begrenset dokumentasjon mht. effekt. Spesielle pasientgrupper: Nedsatt lever-/nyrefunksjon: Se Kontraindikasjoner og Forsiktighetsregler. Administrering: Depottabletter: Kan tas med eller uten mat. Kan ev. slemmes opp i litt vann eller juice umiddelbart før inntak for å lette inntaket. 500 mg: Skal ikke tygges. Skal ikke knuses. Kan deles. 1 g: Skal svelges hele. Rektalvæske: Følg bruksanvisning i pakningsvedlegget. Stikkpiller: Følg instruksjoner i pakningsvedlegget.. Depotgranulat: Kan tas med eller uten mat. Inntas umiddelbart etter åpning av doseposen. Depotgranulatet bør tømmes på tungen og svelges med vann eller juice. Alternativt kan innholdet i doseposen tas med yoghurt. Skal ikke tygges. Kontraindikasjoner: Overfølsomhet for innholdsstoffer eller salisylater. Alvorlig nedsatt nyre- eller leverfunksjon. Forsiktighetsregler: Forsiktighet bør utvises ved nedsatt leverfunksjon. Leverfunksjonsparametre bør følges nøye og vurderes før og under behandling. Bør ikke brukes ved nedsatt nyrefunksjon. Nyrefunksjonen bør kontrolleres regelmessig, spesielt i starten av behandlingen. Urinstatus (urinstix) bør kontrolleres før og under behandling. Mesalazinindusert nefrotoksisitet bør mistenkes ved utvikling av nyreinsuffisiens under behandling. Nyrestein (inkl. steiner av 100% mesalazin) er sett; det anbefales å sikre tilstrekkelig væskeinntak. Bør gis med forsiktighet til pasienter som er overømfintlige for sulfasalazin. Alvorlige kutane bivirkninger, herunder legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS), Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN) er sett. Ved akutte overfølsomhetsreaksjoner (f.eks. abdominalkramper, akutte abdominalsmerter, feber eller, kraftig hodepine, samt ved første tegn/symptomer i form av hudreaksjoner som utslett, slimhinnereaksjoner eller andre tegn på overfølsomhet) skal behandlingen seponeres umiddelbart. Pasienter med lungesykdommer, spesielt astma, bør overvåkes spesielt nøye under behandling. Idiopatisk intrakraniell hypertensjon er rapportert, og pasienten bør gjøres oppmerksom på tegn/symptomer, inkl. alvorlig/gjentagende hodepine, synsforstyrrelser og tinnitus. Ved idiopatisk hypertensjon bør seponering vurderes. Ved mistanke om eller påviste tilfeller av mesalazinindusert myo- og perikarditt eller alvorlig bloddyskrasi bør behandlingen avbrytes. Differensiert blodtelling bør utføres før og under behandling. Som en retningslinje anbefales oppfølgingstester 14 dager etter behandlingsstart, og deretter ytterligere 2-3 tester med 4 ukers mellomrom. Ved normale funn, bør oppfølgingstester utføres hver 3. måned. Ved ytterligere symptomer, bør slike tester utføres omgående. Bilkjøring og bruk av maskiner: Ingen eller ubetydelig påvirkning på evnen til å kjøre bil og bruke maskiner. Interaksjoner: For utfyllende informasjon om relevante interaksjoner, bruk interaksjonsanalyse. Ved samtidig bruk av andre kjente nefrotoksiske legemidler bør nyrefunksjonen kontrolleres hyppig. Hos pasienter som får azatioprin, 6-merkaptopurin eller tioguanin, kan samtidig mesalazinbehandling øke risikoen for bloddyskrasi og myelosuppressive virkninger. Regelmessig overvåkning av hvite blodceller anbefales, og doseringen av tiopuriner bør om nødvendig justeres. Ved mistanke om eller påviste tilfeller av slike bivirkninger, bør behandlingen avbrytes. Mesalazin kan muligens redusere den antikoagulerende effekten av warfarin. Graviditet, amming og fertilitet: Forsiktighet bør utvises. Bør kun brukes i samråd med lege etter nøye vurdering av fordeler/ulemper. Graviditet: Passerer placentabarrieren. Teratogen effekt er ikke observert i dyrestudier. Adekvate og velkontrollerte studier hos gravide foreligger ikke. Forstyrrelser i blodbildet er sett hos nyfødte barn av mødre som har brukt mesalazin. 1 tilfelle av nyresvikt hos et nyfødt barn etter langtidsbruk av høy dose mesalazin (2-4 g oralt) under graviditet er rapportert. Amming: Går over i morsmelk. Mesalazinkonsentrasjonen i morsmelk er lavere enn i morens plasma, mens konsentrasjonen av metabolitten acetylmesalazin forekommer i samme eller høyere konsentrasjon. Begrenset erfaring. Overfølsomhetsreaksjoner som diaré hos spedbarn er rapportert og kan ikke utelukkes. Dersom barnet får diaré, bør ammingen avsluttes. Fertilitet: Dyrestudier viste ingen effekt på fertilitet. Bivirkninger: Vanlige (≥1/100 til <1/10): Gastrointestinale: Abdominalsmerter, diaré, flatulens, kvalme, oppkast. Generelle: Anal kløe1, analt ubehag1, irritasjon på applikasjonsstedet1, rektale tenesmer1. Hud: Utslett (inkl. urticaria og erytematøst utslett). Nevrologiske: Hodepine. Sjeldne (≥1/10 000 til <1/1000): Gastrointestinale: Akutt pankreatitt2, økt amylase. Hjerte: Myokarditt2, perikarditt2. Hud: Fotosensitivitet3. Nevrologiske: Svimmelhet. Svært sjeldne (<1/10 000): Blod/lymfe: Endrede antall blodceller (anemi, aplastisk anemi, agranulocytose, nøytropeni, leukopeni (inkl. granulocytopeni), pancytopeni, trombocytopeni, eosinofili (som del av en allergisk reaksjon)). Gastrointestinale: Pankolitt. Generelle: Legemiddelfeber. Hud: Allergisk dermatitt, erythema multiforme, reversibel alopesi. Immunsystemet: Overfølsomhetsreaksjoner (inkl. anafylaktisk reaksjon). Kjønnsorganer/bryst: Oligospermi (reversibel). Lever/galle: Hepatitt2, hepatotoksisitet (inkl. kolestatisk hepatitt, cirrhose, leversvikt), økt nivå av kolestaseparametre (f.eks. alkalisk fosfatase, γ-GT, bilirubin), økte transaminaser. Luftveier: Allergiske og fibrotiske lungereaksjoner (inkl. dyspné, hoste, bronkospasmer, allergisk alveolitt), interstitiell lungesykdom, lungeinfiltrasjon, pneumonitt, pulmonal eosinofili. Muskel-skjelettsystemet: Artralgi, lupus erythematosus-lignende syndrom, myalgi. Nevrologiske: Perifer nevropati. Nyre/urinveier: Akutt og kronisk interstitiell nefritt2, nedsatt nyrefunksjon (inkl. nefrotisk syndrom, nyresvikt). Ukjent frekvens: Hud: DRESS, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse. Nevrologiske: Idiopatisk intrakraniell hypertensjon. Nyre/urinveier: Misfarging av urin, nyrestein. Flere av disse bivirkningene kan også være et ledd i den inflammatoriske tarmsykdommen. 1. Gjelder kun rektale former. 2. Ukjent mekanisme; kan være av allergisk natur. 3. Mer alvorlige reaksjoner er rapportert ved eksisterende hudtilstander som atopisk dermatitt og atopisk eksem. Overdosering/Forgiftning: Symptomer: Begrenset erfaring, men ingen indikasjon på nyre- eller levertoksisitet. Symptomer på salisylattoksisitet kan forekomme. Behandling: Overvåkning av nyrefunksjon. Symptomatisk og støttende behandling. Se Giftinformasjonens anbefalinger A07E C02 på www.felleskatalogen.no. Egenskaper: Virkningsmekanisme: Ikke fullstendig klarlagt, men antas å virke lokalt på tarmmucosa. Mekanismer som aktivering av PPAR-γ og hemming av NF-κB i tarmmucosa er trolig involvert. Leukocyttkjemotakse hemmes og dannelsen av cytokiner, leukotriener og frie radikaler reduseres. Absorpsjon: Depottabletter og depotgranulat: Ca. 30%. Tmax 1-6 timer. Steady state nås etter 5 dager. Systemisk eksponering kan øke ved samtidig matinntak. Rektalvæske: Ca. 15-20%. Stikkpiller: Ca. 10%. Proteinbinding: Mesalazin: Ca. 50%. Acetylert metabolitt: Ca. 80%. Fordeling: Depottabletter og depotgranulat frigjør virkestoff kontinuerlig fra drasjert mikrogranulat gjennom hele tarmkanalen, uavhengig av pH-forhold og matinntak. Rektalvæsken frigjør virkestoff i distale deler av tarmen, til og med colon descendens. Stikkpillene frigjør virkestoff i rektum. Halveringstid: Depottabletter og depotgranulat: Mesalazin: Ca. 40 minutter. Acetylert metabolitt: Ca. 70 minutter. Metabolisme: Acetylering, trolig doseavhengig og mettbar, i tarmslimhinnen og i lever samt til en viss grad via tarmbakterier. Oppbevaring og holdbarhet: Oppbevares i originalemballasjen for å beskytte mot lys. Andre opplysninger: Mesalazin kan gi rødbrun misfarging av urinen i toalett vasket med blekemidler inneholdende natriumhypokloritt. Pakninger og priser pr. desember 2025: Pentasa: Depottabletter: 500 mg: 100 stk. (blister) kr 487,10. 3 × 100 stk. (blister) kr 1388,80. 1 g: 60 stk. (blister) kr 553,50. Rektalvæske: 7 × 100 ml kr 335,10. Stikkpiller: 28 stk. (blister) kr 521,80. Pentasa Sachet: Depotgranulat: 1 g: 150 stk. (dosepose) kr 1471,60. 2 g: 60 stk. (dosepose) kr 1051,60. 4 g: 30 stk. (dosepose) kr 1001,80. Refusjon: Refusjonsberettiget bruk: Pentasa: Depottabletter: Ulcerøs kolitt og Crohns sykdom. Rektalvæske: Ulcerøs proktosigmoiditt. Stikkpiller: Behandling av aktiv ulcerøs proktitt. Pentasa Sachet: Depotgranulat: Ulcerøs kolitt og Crohns sykdom. Refusjonskode: ICPC: Pentasa: Depottabletter: D94 Kronisk enteritt/ulcerøs kolitt (-). Rektalvæske: D94 Kronisk enteritt/ulcerøs kolitt (-). Stikkpiller: D94 Ulcerøs proktitt (-). Pentasa Sachet: Depotgranulat: D94 Kronisk enteritt/ulcerøs kolitt (-). ICD: Pentasa: Depottabletter: K50 Crohns sykdom (-), K51 Ulcerøs kolitt (-). Rektalvæske: K51 Ulcerøs kolitt (-). Stikkpiller: K51.2 Ulcerøs (kronisk) proktitt (-). Pentasa Sachet: Depotgranulat: K50 Crohns sykdom (-), K51 Ulcerøs kolitt (-). Basert på SPC godkjent av DMP 28.01.2025 & 08.09.2025. For fullstendig preparatomtale (SPC), se www.legemiddelsok.no. 1. Römkens TE, Kampschreur MT, Drenth JP, van Oijen MG, de Jong DJ. High mucosal healing rates in 5-ASA-treated ulcerative colitis patients: results of a meta-analysis of clinical trials. Inflamm Bowel Dis. 2012 Nov;18(11):2190-8.


Divisun (kolekalsiferol) 20µg, 50µg eller 100µg
•En gang daglig. Pasienters individuelle behov avgjør hvilken styrke som velges.
• Dosen skal justeres avhengig av ønskede serumnivåer av 25-hydroksykolokalsiferol (25(OH)D), sykdommens alvorlighetsgrad og pasientens respons på behandlingen.
•Dagsdosen bør ikke overskride 100μg (4000 IE). Kan tas med eller uten mat, kan svelges hele eller knuses ved behov.
•Individuell refusjon for Divisun med blåreseptsøknad, ifølge § 5-14, blåreseptforskriften, sendes via tjenesteportalen for helseaktører.

Kodene for individuell refusjon
finner du ved å lese av QR-koden.1





Kontraindisert ved sykdommer og/eller tilstander som fører til hyperkalsemi eller hyperkalsiuri. Kontraindisert ved nefrolitiasis, nefrokalsinose og hypervitaminose D.
Nedsatt nyrefunksjon: Ved alvorlig nedsatt nyrefunksjon kan andre former for vitamin D være nødvendig. Brukes med forsiktighet ved nedsatt nyrefunksjon. Effekt på kalsium-og fosfatnivået bør kontrolleres. Bør forskrives med forsiktighet ved sarkoidose og bør kontrolleres mht kalsiuminnhold i serum og urin. Ved langtidsbehandling bør kalsiumnivåene i serum kontrolleres og nyrefunksjonen kontrolleres ved målinger i serumkreatinin. Spesielt viktig hos eldre som bruker hjerteglykosider eller diuretika, og de med stor tendens til caculusdannelse.
•Divisun inneholder isomalt, sukrose og natrium.
Oppbevaring: Maks 30°C, i originalpakningen for å beskytte mot lys og fuktighet.
Pakninger og priser: Reseptgruppe C. Alle styrker inneholder 90 tabletter i blisterpakning. 20 µg: kr 127,- 50 µg: kr 306,80 og 100 µg: kr 423,50.
Ytterligere informasjon preparatomtalen, SPC:
• Divisun SPC: 800 IE, 2000IE og 4000IE (30.06.2023)
Referanse: 1. Helsedirektoratet, rundskriv, stønad ved helsetjenester, vedlegg 1 til § 5-14 legemiddellisten, https://www.helsedirektoratet.no/rundskriv/kapittel-5-stonad-vedhelsetjenester/vedlegg-1-til--5-14-legemiddellisten/virkestoffer/kolekalsiferol-vitamin-d3, lest 30.10.2025
Viatris AS | Hagaløkkveien 26, PB 194, 1371 Asker, Norway infonorge@viatris.com – www.D-vitaminmangel.no



