Propiedades periódicas
Tarea Química
Institucion:
CTP Fernando Volio Jimenez
Tema:
Propiedades periódicas
Estudiante: Allison Yenory Morales Marroquín
Profesor: Emiliano Murillo Murillo
Sección: 11-3 B
Año: 2023
Quebradilla, Cartago, Costa Rica
¿Que son?
Propiedades periódicas
Las propiedades o tendencias periódicas son patrones definidos en la tabla periódica que explican las propiedades de un elemento. Estas propiedades pueden ir desde el tamaño de un elemento hasta su reactividad química.
Ley periódica: Afirma que las propiedades físicas y químicas de los elementos se relaciona directamente con sus números atómicos. Los elementos presentan características que varían periódicamente de acuerdo con su ubicación dentro de la tabla periódica.

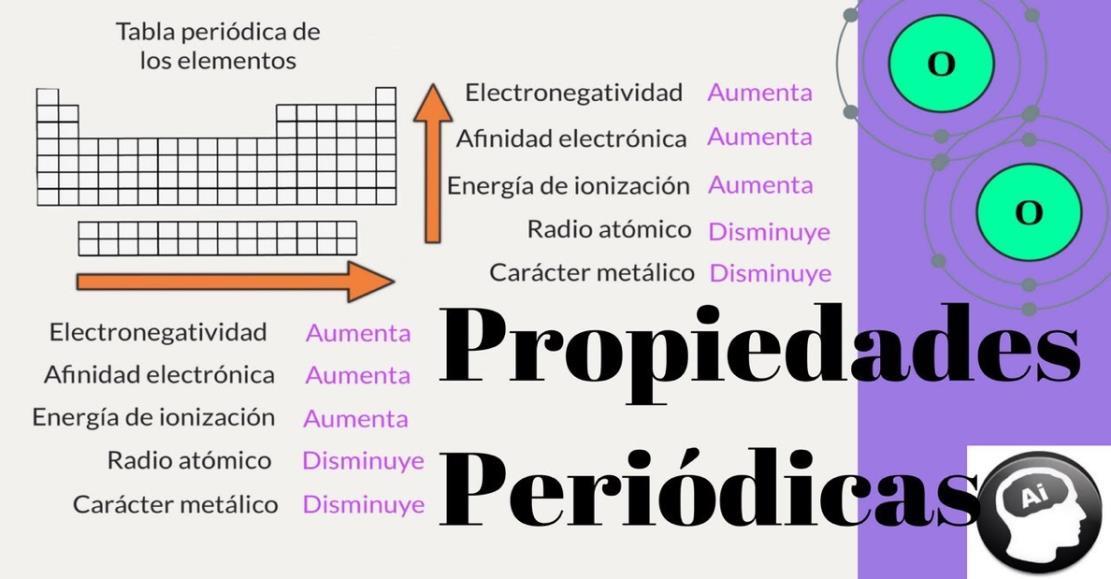
Algunas de las propiedades periódicas más importantes son:
Radio atómico: se define como la mitad de la distancia entre los centros de dos átomos que formen un enlace. En un mismo grupo el radio atómico aumenta conforme aumenta el número atómico. Determina el tamaño del átomo. El radio atómico aumenta de derecha a izquierda en un mismo período.

Radio iónico: Es el radio que tiene un átomo cuando ha ganado o perdido electrones, adquiriendo la estructura electrónica del gas noble más cercano

Energía de ionización: La energía de ionización mide los cambios energéticos que van asociados con la remoción de electrones de los átomos en el estado gaseoso o aislado. Es la energía necesaria para desprender un electrón del átomo. El átomo queda con carga positiva y se le llama catión.

Afinidad electrónica: Es la energía liberada cuando un átomo neutro en estado gaseoso captura un electrón para formar un ión negativo anión. Representa la capacidad que presenta un átomo para aceptar un electrón en su capa de valencia. La afinidad electrónica aumenta de izquierda a derecha en un mismo período.

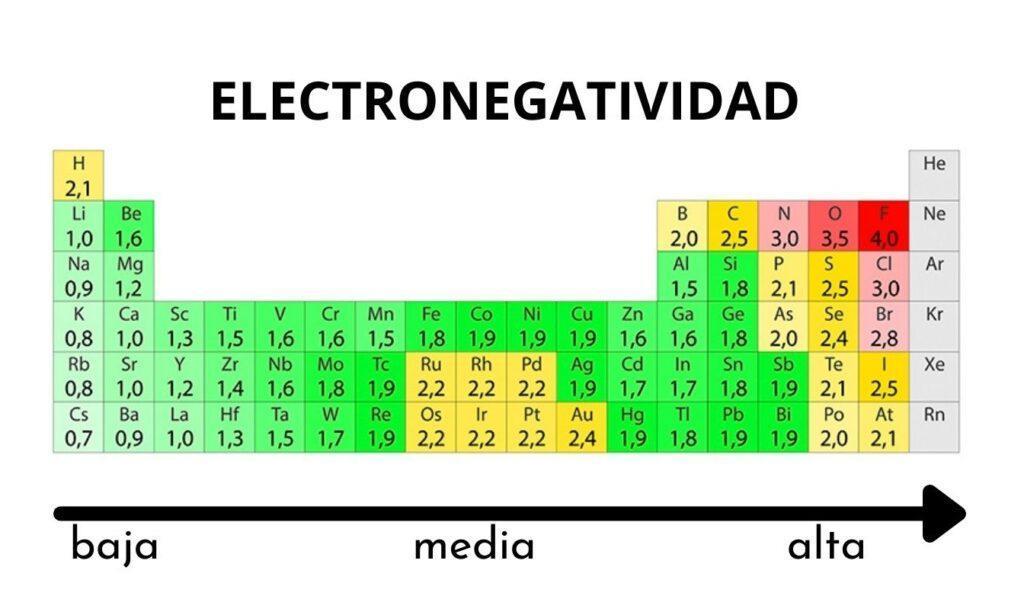
Electronegatividad: Es la capacidad relativa de un átomo para atraer electrones que participan en un enlace químico. Es la fuerza con la que los átomos de una molécula atraen electrones que participan en un enlace químico, a mayor afinidad electrónica, mayor electronegatividad.
Formulas químicas
Las fórmulas químicas son una representación gráfica de una molécula e indica la proporción o cantidad de elementos que intervienen en el compuesto. Las fórmulas más utilizadas son:
Empírica: Es la formula mas simple de un compuesto. Expresa la proporción de átomos de cada elemento presentes en un compuesto.
Ejemplos: CH2O (glucosa) CO (Monóxido de carbono).
Molecular: Indica la cantidad total de cada elemento que hay en una molécula de un compuesto. Siempre será un múltiplo entero de la fórmula empírica.
Ejemplos: C6H12O6 (glucosa) C2H6 (etano).
Estructural: Está fórmula establece la posición que ocupan unos átomos en relación con otros. Proporciona mayor información que la formula empírica y molecular.


