
3 minute read
Zahnreise: Von PatientInnen durch das Labor und wieder zurück
Orale Krankheiten wie Karies und Erkrankungen des Zahnhalteapparates (Parodont) sind weitverbreitet und können in schweren Fällen zu Zahnverlust führen. Die größte Herausforderung in der modernen Zahnheilkunde ist die Wiederherstellung von gesundem, funktionellem und ästhetisch zufriedenstellendem parodontalen Gewebe. Das Parodont ist ein komplexes Gewebe, das aus mehreren Hart- und Weichgeweben besteht; daher stellt die parodontale Regeneration eine große Herausforderung dar. Eine konservative Parodontaltherapie allein reicht oft nicht für die Gewebewiederherstellung und die parodontale Geweberegeneration ist ohne Anwendung neuartiger Ansätze des Tissue Engineerings, der Digitalisierung sowie der Nanotechnologie undenkbar. Die Entwicklung neuer Methoden zur Zahnregeneration ist eine der Hauptaufgaben des Competence Center for Periodontal Research.
Advertisement
Fortschritte im oralen Tissue-Engineering
Das moderne Tissue Engineering basiert auf drei Säulen: Zellen, Gerüste und bioaktive Moleküle. Im Labor werden die Zellen auf dem 3D-Gerüst gezüchtet, ihr Wachstum durch verschiedene Wachstumsfaktoren optimiert und schließlich wird diese Konstruktion in den Zahndefekt eingebracht. In den letzten Jahren wurden, dank kontinuierlicher und schneller Modifikationen des Gerüsts und der Entwicklungen in der Pharmakologie, Fortschritte im oralen TissueEngineering und in der regenerativen Zahnheilkunde erzielt. Moderne 3D-gedruckte Gerüste, die mit Hightech-Nanotechnologien hergestellt werden, ahmen die Architektur des Zahns nach. Moderne pharmakologische Produkte unterstützen die Zahnregeneration optimal. Ohne „richtige Zellen“ sind diese Ansätze jedoch sinnlos. Und die besten Zellen für die Zahnregeneration könnten nur jene sein, die aus dem Zahn selbst gewonnen werden. Diese Zellen können aus den verschiedenen Geweben von dem-/ derselben PatientIn oder von anderen SpenderInnen erhalten werden. Danach werden die Zellen im Labor vermehrt und sollen in Zukunft anschließend für die Behandlung der PatientInnen verwendet werden. Zellen machen also die Reise vom/von der PatientIn über das Labor zu einer/einem PatientIn zurück.
Die Reise beginnt …
… am PatientInnenstuhl. Dort erfolgt die schonende Entfernung des SpenderInnenzahns, der vom Patienten, von der Patientin nicht mehr benötigt wird (Abb. 1). In den meisten Fällen handelt es sich dabei um Weisheitszähne, die nicht vollständig durchbrechen können. Aber auch andere Zähne, die aufgrund eines Engstands entfernt werden müssen, können als Spenderzähne herangezogen werden. Unmittelbar nach der Zahnentfernung wird der SpenderInnenzahn in ein steriles Gefäß mit einem speziellen Nährmedium platziert und umgehend ins Labor gebracht. Dort angekommen, wird der Zahn unter sterilen Bedingungen vorsichtig gewaschen, um etwaige Verun-
Abb. 1: Zahnextraktion
reinigungen zu beseitigen. Im Anschluss wird das am Zahn anhaftende Zahnfleisch mit einem Skalpell abgeschabt und die Gewebefragmente in einer Petrischale mit speziellem Nährmedium platziert. Die am SpenderInnenzahn haftende Wurzelhaut (parodontales Ligament) wird auf dieselbe Art und Weise entnommen und in eine gesonderte Petrischale transferiert (Abb. 2). Um das Zahnmark (Pulpa) aus dem Inneren des Zahnes zu erhalten, muss dieser mithilfe eines Hammers aufgebrochen werden. Das Gewebe kann dann ebenfalls in eine Petrischale mit speziellem Nährmedium überführt werden. Damit die Zellen aus den Gewebefragmenten herauswachsen
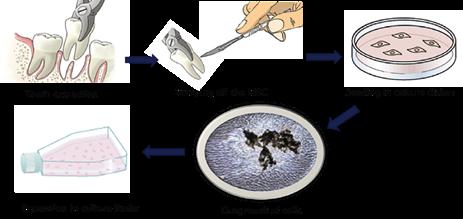
Abb. 2: Auswachsende Zellen
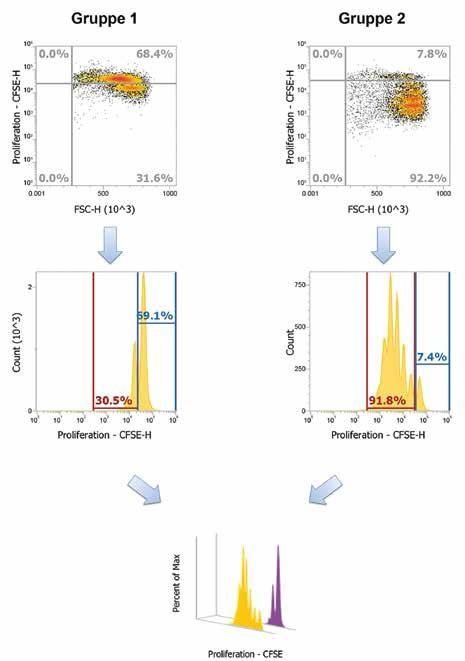
Abb. 3: Zellwachstums-Analyse: Durchflusszytometrie können, müssen nur noch die richtigen Bedingungen geschaffen werden: Wärme, Nahrung und Zeit. Die Gewebefragmente werden dafür für mehrere Wochen in Inkubatoren mit Körpertemperatur aufbewahrt und regelmäßig mit frischem Nährmedium versorgt. Mit etwas Geduld können dann unter dem Mikroskop zahlreiche kleine Zellen rund um die Gewebefragmente gesichtet werden.
Bestes Potenzial herausfiltern
Nur aus starken Zellen kann funktionsfähiges und gesundes Zahngewebe hergestellt werden. Daher müssen für die weitere Reise jene Zellen herausgefiltert werden, die das beste Potenzial aufweisen. Ein wesentlicher Bestandteil dieser Charakterisierung ist die Bestimmung des Ex-vivo-Proliferationspotenzials dieser Zellen. Dafür wird am Competence Center eine hoch spezialisierte Methode angewendet. Dabei wird das Innere der Zellen, das sogenannte Zytoplasma, mit dem Fluoreszenzfarbstoff Carboxyfluoresceinsuccinimidylester (CFSE) angefärbt. Nach einer bestimmten Zeit in Kultur wird die Intensität des Fluoreszenzfarbstoffes mittels Durchflusszytometrie auf Single-cell-Basis gemessen. Die Intensität des Fluoreszenzfarbstoffes, die sich mit jeder Zellteilung halbiert, gibt darüber Auskunft, wie oft sich eine bestimmte Zelle geteilt hat. Dies ermöglicht es, Aussagen darüber zu treffen, wie viele Zellgenerationen neben der Elterngeneration in einer bestimmten Zellpopulation vorhanden sind (Abb. 3). Das Besondere an der CFSE-Methode ist, dass die Zellproliferation direkt evaluiert werden kann. Dadurch unterscheidet sie sich von den zahlreichen anderen Messmethoden, die auf der Bestimmung der metabolischen Aktivität der Zellen beruhen und somit nur indirekt auf das Proliferationsverhalten von Zellen rückschließen lassen. Mithilfe dieser Methode ist es uns möglich, ausschließlich Veränderungen im Proliferationsverhalten der isolierten Zellen zu detektieren, die bestimmten Faktoren, beispielsweise Wachstumsfaktoren, Vitamin D3, biologischen Materialien, Nanopartikeln, ausgesetzt sind.


