
19 minute read
Biofilms microbianos en la industria alimentaria
Biofilms microbianos en la industria alimentaria Protegen a las bacterias, mejoran su supervivencia y optimizan su multiplicación Rodríguez, R., Frizzo, L.S, y Martínez Espinosa, E.L.
Las bacterias pueden existir en la naturaleza en dos formas o estados, la forma planctónica (de libre flotación) suspendidas en el fluido circundante y la forma o estado sésil (formadoras de biofilm) “adheridas” a superficies sólidas. Se considera que alrededor del 80% de la biomasa microbiana se encuentra en la forma de biofilms y células sésiles, lo que muestra entonces que son el modo de vida predominante de los microorganismos en la naturaleza. Un biofilm, como vamos a describir en esta sección, es un conjunto de microorganismos asociados (adheridos) a una superficie, en donde las células están encerradas en una matriz de sustancia polimérica extracelular (sintetizada por ellas mismas), denominada EPS. Hay tres factores principales y necesarios para el desarrollo de ese biofilm: superficie, humedad y nutrientes. El biofilm proporciona protección contra “los depredadores” (agentes que afecten a los microrganismos tales como los sanitizantes), mejora (asegura) la supervivencia y optimiza la reproducción o multiplicación microbiana. Es verdaderamente un atributo microbiano de resiliencia. En los próximos párrafos vamos a desarrollar ciertos conceptos aplicables a la dinámica de la formación de los biofilms microbianos, especialmente en las cadenas agroalimentarias. En las etapas iniciales de los estudios en este campo de la microbiología, llamaba la atención apreciar que las bacterias adheridas a veces eran capaces de desarrollar y proliferar, en tanto sus contrapartes planctónicas eran incapaces de crecer. Durante la década del´70, este estado comenzó a explorarse con intensidad y se lo relacionó a una “matriz de moléculas tipo limo” producida en las bacterias adheridas, nótese que en esos tiempos se hablaba sólo de adherencia microbiana. La matriz tipo limo junto con las células respectivas luego se llamaría "biofilm", un término desarrollado y estudiado extensamente por J. William (Bill) Costerton y sus colegas en las décadas siguientes. Si bien el hecho que las bacterias podían adherirse a diferentes superficies, especialmente marinas, había sido demostrado varias décadas antes por Claude E. Zobell, fue Bill Costerton quien estableció un nuevo paradigma en microbiología con la publicación en 1978 de un artículo en donde afirmaba que las bac
Advertisement

terias se adhieren a las superficies disponibles en las cubiertas con un “glicocálix” (matriz extracelular) y que estas poblaciones de bacterias sésiles se daban predominantemente en los ambientes naturales, el sector industrial y, en particular, en los ecosistemas médicos, desarrollando de esta manera “la teoría del biofilm”. A Costerton, precisamente, se lo considera el padre de la teoría de los biofilms. Esa matriz extracelular conforma las secreciones protectoras que rodean a las células en el biofilm y proporciona un "ambiente construido" para contener los procesos en el mismo, ayudando al armado de una especie de “tejido microbiano”. La revelación científica de que las bacterias adheridas eran diferentes de las células planctónicas en su comportamiento fisiológico y adaptabilidad lanzó una era de intensa exploración y estudio experimental y de campo adicional en esta área de la microbiología. Así, en la década del noventa, se acuño el término EPS (en inglés, “extracellular polymeric substances”) por Thomas Neu y colegas, para abarcar las “sustancias extracelulares poliméricas o secreciones” como una propiedad emergente primaria del biofilm. El término EPS se creó y describió para enfatizar la amplia gama de moléculas, tales como proteínas, polisacáridos, ácidos nucleicos y lípidos, que comprenden estas secreciones. En términos microbiológicos, la formación de biofilms se define como la capa microscópica mediante la cual los microorganismos se adhieren a una dada superficie. En el área de contacto entre las bacterias y la superficie, las células microbianas pueden interactuar a través de varios apéndices de proteínas y polisacáridos (pili, flagelos, LPS, polisacáridos capsulares), dependiendo del tipo de bacteria. Sobre la base del biofilm, las células bacterianas están integradas en una matriz que contiene altas concentraciones de ADN, además de proteínas y polisacáridos. El ADN


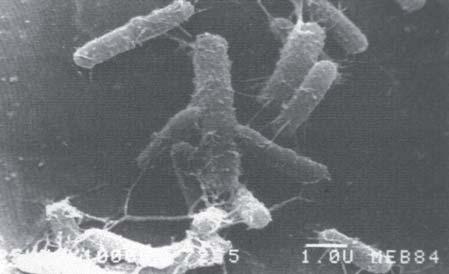
desempeña un papel importante en la formación temprana de biofilms. En el núcleo del biofilm, los canales de agua que llevan iones y nutrientes cruzan la matriz que contiene altas concentraciones de sustancias exopoliméricas. Todos estos compuestos exocelulares forman un gel protector alrededor de los microorganismos. En el área de desprendimiento del biofilm, las enzimas microbianas destruyen la matriz exopolimérica y liberan las células que recuperan la movilidad para poder colonizar nuevas superficies (Figura 3). Los biofilms pueden encontrarse en cualquier nicho ecológico y revisten especial importancia para la industria alimentaria en general, sus procesos y medioambientes, no solamente por los aspectos ligados a la vida útil de los productos y a la salud pública, sino también ligado a la toma de muestra para los análisis microbiológicos y especialmente a los procedimientos de limpieza y sanitización. Las bacterias en el biofilm son resistentes a los tratamientos con biocidas y sanitizantes, pueden ser hasta 100 veces más resistentes a los antibióticos y hasta 500 veces más resistentes a la acción de sanitizantes, debiéndose incrementar entre 10 y 100 veces el tiempo de exposición y concentración de éstos para eliminar las células en el biofilm, en comparación con las planctónicas, tal como ha sido demostrado. Es más, se ha demostrado también que ciertas bacterias patógenas, especialmente en los biofilms, pueden ser resistentes a ciertos agentes sanitizantes. Aunque los biofilms pueden contener un solo tipo de célula bacteriana, ya sea un patógeno o un alterador, es mucho más común que contenga varias especies bacterianas. Incluso en estas comunidades pueden participar, además de bacterias, protozoarios e incluso algas, como ha sido demostrado en biofilms de Legionella en tanques de enfriamiento y tuberías de transporte de agua (Figura 4).
COMUNICACIÓN ENTRE MICRORGANISMOS. ARQUITECTURA Y MADURACIÓN DEL BIOFILM.
Como se indicó, durante mucho tiempo se creyó que las bacterias existían como “individuos aislados”, células que buscaban principalmente encontrar nutrientes y multiplicarse. Sin embargo, las bacterias llevan a cabo con frecuencia “un censo” efi
Figura 4 - Biofilm de Legionella en tubería

ciente de su población y perciben el ambiente, los anfitriones y competidores. Todo esto es de fundamental importancia en el enfoque y abordaje de la ecología microbiana de los alimentos. En esta línea, en la primera década del nuevo milenio se desarrolló en microbiología toda una nueva línea de estudio e investigación en “comunicación celular”. Así se genera el “quórum sensing” (QS), un término introducido originalmente por Fuqua y Winans para describir la comunicación de célula a célula. El QS (“percepción de quórum”) es el mecanismo utilizado por las bacterias para determinar los cambios en su entorno y aplicar estrategias específicas que le permiten la adaptación ambiental en el espacio y el tiempo. Este proceso de adaptación continua se ve afectado fuertemente por la comunicación microbiana, expresada precisamente a través del QS. Aunque los estudios sobre QS son relativamente recientes, se ha podido establecer que las bacterias producen, liberan, detectan y responden a pequeñas moléculas parecidas a las hormonas de señalización llamadas "autoinductores". Cuando se logra una concentración umbral crítica de la molécula de señal, las bacterias detectan su presencia e inician una cascada de señalización que da lugar a cambios en la expresión génica respectiva (“target”). La comunicación célula-célula ha sido demostrada dentro y entre especies, con mecanismos sustancialmente diferentes en las bacterias
Grampositivas (G+) y Gramnegativas (G-). Los QS identificados en varias bacterias G+ y G- relacionadas con los alimentos incluyen la síntesis de bacteriocinas, la detección del quórum luxS y en las interacciones entre las bacterias ácido-lácticas en productos fermentados, entre otros. Otros eventos relacionados con QS en los biofilms incluyen la formación de canales y estructuras tipo pilar, las cuales aseguran la entrega eficiente de nutrientes a los organismos dentro de la comunidad a través de la regulación de producción de tensioactivos y de sistemas de adquisición de hierro. El QS modula la expresión genética y produce cambios fenotípicos que adaptan a las bacterias a las condiciones ambientales de crecimiento. Cuando se expande la densidad microbiana, la concentración de estas moléculas aumenta e induce la regulación de la expresión genética. La concentración de estos compuestos de señalización en el medio ambiente (por ejemplo, crecimiento), medio o matriz crea zonas de gradientes de concentración. Es decir, la concentración de gradiente a través de la célula / colonia / ambiente. La difusión de compuestos entre las células conduce a una acumulación localmente alta. Cuando esta concentración alcanza el nivel requerido (es decir, “el nivel de quórum”), las moléculas de señalización se unen a receptores en la célula bacteriana, iniciando los cambios en la expresión génica en la célula respondedora. Es importante señalar también que el QS está involucrado, además de la formación de biofilms, en varios fenómenos importantes en microbiología, entre ellos, regulación de virulencia, desarrollo de competencia genética, esporulación, síntesis de péptidos antimicrobianos y otros aún no identificados. La comprensión del QS como mecanismo de señalización extracelular puede proporcionar una nueva base para el control sobre el proceso molecular y celular tanto de las bacterias patógenas como alteradoras, así como también las bacterias beneficiosas en alimentos, cuyos comportamientos son principalmente consecuencias de muy complejas interacciones comunitarias. Un biofilm, como se indicó, es una agregación de células, a menudo de múltiples especies, en estructuras complejas heterogéneas que están unidas a una superficie sólida. La formación de biofilm es un proceso de varios pasos o etapas. Inicialmente la superficie sólida sufre un proceso de acondicionamiento que permite que las células sean absorbidas por fuerzas electrostáticas reversibles débiles. Luego la formación de EPS sigue rápidamente y ancla estas células. La mayor parte de la biomasa del biofilm comprende EPS hidratado, en lugar de células microbianas. La autoorganización de las moléculas de EPS en la matriz se basa en interacciones intermoleculares entre componentes EPS, que también determinan las propiedades
mecánicas y la actividad fisiológica de los organismos en el biofilm. Las moléculas de EPS median la formación de la arquitectura del biofilm, que es un proceso continuo y dinámico que produce una organización espacial en la que las células forman clústeres en microcolonias. El componente principal de la matriz es el agua (hasta un 97%), que contiene los componentes estructurales y funcionales de la matriz: polisacáridos solubles, formadores de gel, proteínas y DNA, así como componentes insolubles como los amiloides, celulosa, fimbrias, pili y flagellas. Se ha demostrado que los poros y canales entre las microcolonias que forman vacíos en la matriz facilitan el transporte de líquidos, inspirando el concepto de un "sistema de circulación rudimentario" para el biofilm. Los componentes estructurales de la matriz también pueden tener otras funciones que benefician al biofilm. Por ejemplo, en biofilms formados por E. coli, el principal componente estructural de la matriz es la proteína Curli, que junto con la celulosa contribuye a la tolerancia de desecación del biofilm. Bacillus subtilis utiliza proteínas llamadas hidrofobinas para formar biofilms -altamente hidrofóbicasque flotan en la interfaz aire-líquido. Otros componentes funcionales de la matriz de biofilms incluyen filamentos proteínicos y nanocables que son capaces de transportar electrones.La estructura no rígida del biofilm, en la que distintas zonas tienen viscosidades sustancialmente diferentes, permite el movimiento de las células en la matriz, con consecuencias para la porosidad, propiedades mecánicas y microrreología. Las observaciones incluyen la migración vertical de las poblaciones bacterianas, como en las capas microbianas hipersalinas, y la migración como un esfuerzo de colaboración de las poblaciones que involucra la división del trabajo. Una propiedad emergente importante es la tolerancia a la desecación, ya que los microorganismos en el ambiente experimentan regularmente estrés hídrico. Las bacterias en el biofilm responden activamente a la desecación mediante la producción de moléculas de EPS, que, debido a la alta proporción de polímeros hidratados protege actuando como un hidrogel que retiene agua. Además, las capas superiores de EPS generan una barrera de evaporación efectiva. Esta síntesis de la matriz es regulada por QS, detectando cuando la concentración local de células aumenta. A esto le sigue la formación de microcolonias que tienen límites definidos que permite que los canales fluidos corran a través de la biomatriz. Esto se asemeja, como se indicó, a un “sistema circulatorio” primitivo. Tal sistema requiere diferenciación de alto nivel, QS, o comunicación de célula a célula para evitar que el crecimiento indiferenciado llene estos canales, que aportan nutrientes y eliminan desechos. En este punto el biofilm está “maduro”, consolidado. Finalmente, las células se pueden desprender (liberarse) del biofilm para iniciar nuevos biofilm o instalarse en otros entornos. Se ha demostrado que en la adherencia de las bacterias alteradoras a carne bovina estéril intervienen dos fenómenos distintos, que a su vez incluyen otras tantas fases. En la primera las células se unen por fuerzas físicas como las de Van der Waals, esta fase es reversible; en una segunda fase, tiempo dependiente, se produce la formación del EPS que une fuertemente a las bacterias entre sí y con la superficie en cuestión (Figura 3). El fenómeno de adherencia bacteriana y prevención de la adherencia en carne ha sido estudiado por Ockerman y col. en los ´80, cuando la teoría de los biofilms no estaba todavía tan difundida y consolidada entre la comunidad científica. Estos autores señalan que la aplicación temprana de los agentes antimicrobianos previene la adherencia, especialmente de Pseudomonas, uno de los organismos alteradores más frecuentes de carnes frescas y refrigeradas. Experimentalmente, se ha demostrado que las bacterias alteradoras de la carne pueden desarrollar, en condiciones ideales de medio ambiente, “microfibrillas de adherencia” en tiempos tan cortos como 60 minutos. Los mismos estudios señalan que al poner en contacto una cantidad conocida de Pseudomonas –principal responsable de la alteración en condiciones de aerobiosis- con músculo bovino estéril, el 80% de las bacterias presentes se adhieren antes del primer minuto de contacto con la carne

Figura 6 - Adherencia bacteriana sobre tejido muscular bovino estéril. Porcentaje de adherencia a lo largo de 120 minutos de contacto. La flecha indica la dirección del análisis estadístico. Letras diferentes indican diferencias estadísticamente significativas. (Tomado de Rodríguez, R., 2006).

(Figuras 5 y 6). Esto conlleva una importante significación práctica, la de reducir al mínimo la contaminación inicial de los alimentos con la biota respectiva. Como expresamos, el biofilm influencia tanto el procedimiento de toma de muestra como la aplicación de los programas de limpieza, ya que las bacterias que estén fuertemente adheridas habrán podido generar en este nicho ecológico una condición que atemperará el efecto del medio y de los agentes externos. El desarrollo de biofilms protege a los microorganismos y dificulta su remoción de los equipos de procesamiento, empaque y conservación de alimentos. La adherencia y formación de biofilms de E. coli a diversas superficies y materiales (Figuras 7 y 8) comúnmente utilizados en la industria de la carne ha sido también demostrada. Los biofilms constituyen una vía muy estructurada para proveer homeostasis, una red para desarrollar funciones especiales en cooperación con las células que forman el nicho colonizado y finalmente, una gran protección contra los agentes antimicrobianos que pudieren aplicarse, incluyendo por ejemplo el aumento de la resistencia a los antibióticos por parte de bacterias Gram negativas aisladas desde biofilms en carnes. Patógenos como Escherichia coli productor de toxina Shiga (STEC), Listeria monocytogenes, Salmonella y Staphylococcus aureus son fuertes productores de biofilms, tanto en los productos como en las superficies donde se elaboran, manipulan
Figura 7 - Escherichia coli adherido sobre una esponja de poliuretano estéril. (Tomado de Rodríguez, R., 2006).


Figura 8 - Escherichia coli dherido sobre polietileno estéril. (Tomado de Galli, et al., 2016).
y envasan, así como también L. monocytogenes en sistemas de refrigeración, drenajes y pisos. Especificidades sobre aspectos de los biofilms tales como maduración, así como atributos diferenciales y de quórum sensing relevantes se describirán en las secciones respectivas de industria láctea, frutícola, cárnica bovina y aviar.
ESTRATEGIAS DE CONTROL DE LOS BIOFILMS. TENDENCIAS
La eliminación de los biofilms es una tarea difícil y exigente. Muchos factores afectan el desprendimiento de los biofilms desde la superficie en la que se encuentran adheridos, por ejemplo, la temperatura, el tiempo, las fuerzas mecánicas y la potencia química. Es imprescindible que el personal esté debidamente capacitado y sea responsable de mantener un buen nivel de higiene del proceso en la planta procesadora de alimentos. La clave para una limpieza efectiva en una planta es que el personal comprenda la naturaleza y el tipo de suciedad, incluidos los organismos que deben eliminarse desde las superficies de la planta. El tiempo mecánico y químico, la temperatura y el tiempo de contacto en el régimen de limpieza deben elegirse cuidadosamente para lograr un efecto de limpieza adecuado. La eficacia de la limpieza también se ve afectada por la accesibilidad y el tipo de equipo a ser limpiado. Un procedimiento de limpieza eficiente consiste en una secuencia de aplicaciones de detergente y desinfectante a concentraciones efectivas y temperaturas correctas, así como enjuagues con agua. La tarea básica de los detergentes es reducir las tensiones interfaciales de los restos de suciedad adherida para que los mismos, incluidos los biofilms unidos a las superficies, se disuelvan y mezclen en agua. El efecto de los tensioactivos puede ser aumentado incorporando el efecto mecánico del flujo turbulento o la presión del agua, o por abrasivos, por ejemplo, cristales de sal. La exposición prolongada de las superficies al detergente hace que la eliminación sea más eficiente. La tarea de los sanitizantes o desinfectantes es inactivar los microorganismos que quedan en las superficies después del procedimiento de limpieza. Los residuos de desinfectantes no deben dejarse en las superficies del proceso, sino que deben enjuagarse retirándolos desde las superficies con agua potable. Además, los desinfectantes que se dejan en las superficies durante largos períodos si se usan en con
Adaptado de Rossi et al. (2017).

centraciones subletales pueden generar resistencia por parte de los microorganismos. Finalmente, el equipo y las líneas de proceso deben dejarse secar en áreas bien ventiladas, porque los microorganismos no crecen en superficies secas y limpias. Recientemente se han revisado las estrategias de control de biofilms, especialmente algunas novedosas. En estos trabajos se describen estudios y ensayos con aceites esenciales, polisacáridos, enzimas, nisina y diferentes ácidos orgánicos. Es interesante destacar que Rodríguez y col., en los ´90, reportaron la acción de nisina y ácido láctico sobre el bloqueo de la adherencia en algunas de las principales bacterias alteradoras de la carne bovina. El ácido láctico fue muy efectivo en prevenir la adherencia de las bacterias en las condiciones experimentales ensayadas. Hay que enfatizar que las células bacterianas en los biofilms son más resistentes a los antimicrobianos en comparación con las células planctónicas y esto hace que su eliminación de las instalaciones de procesamiento de alimentos sea un gran desafío. En esa línea, la aparición de bacterias resistentes a los antimicrobianos convencionales demuestra claramente que se requieren nuevas estrategias de control de biofilm en la industria de los alimentos. En los últimos años, muchos estudios se han centrado en los procedimientos de limpieza y desinfección con métodos físicos y químicos para controlar los biofilms microbianos. Se usan tres compuestos químicos primarios como desinfectantes en la industria de servicios de alimentos: limpiadores a base de cloro, amonio cuaternario y desinfectantes de yodo. Debido a la toxicidad de los residuos de desinfectante y / o al aumento de la resistencia bacteriana a estos reactivos de descontaminación, las moléculas alternativas que son preferentemente naturales con baja toxicidad humana y animal se están probando por su efecto sobre los biofilms. Se ha demostrado que muchos aceites esenciales tienen una buena actividad antibiofilm contra los patógenos transmitidos por los alimentos. Por ejemplo, las micelas tensioactivas cargadas con eugenol o carvacrol, dos aceites esenciales aislados desde clavo y tomillo, son capaces de inactivar E. coli O157:H7 dentro del biofilm. Sin embargo, esa matriz puede permanecer unida a la superficie, lo que hace que la regeneración del biofilm sea un peligro potencial. Si bien los aceites esenciales se dirigen a la viabilidad celular, la mejor manera de eliminar y prevenir la nueva formación del biofilm en una superficie es degradar el EPS que rodea a la bacteria mediante un tratamiento enzimático. Una combinación de un agente antimicrobiano para matar células dentro del biofilm con un agente de grado alimentario capaz de eliminar toda la matriz de la comunidad podría ser una solución para reducir y potencialmente eliminar los biofilms de las plantas de procesamiento. También se han investigado otras estrategias, como los tratamientos con bacteriófagos. El bacteriófago KH1 reduce la población de células STEC O157:H7 unidas al acero inoxidable, pero no de las que están dentro de una matriz de biofilm. El efecto de técnicas combinadas como vapor y ácido láctico, desinfectantes en aerosol, UV y calor seco también se estudiaron y tienen el potencial de controlar STEC en superficies presentes en la industria alimentaria. El mejor enfoque para controlar biofilm de STEC
debería inactivar el patógeno dentro del biofilm y eliminar la matriz desde la superficie contaminada. Por ejemplo, una combinación de vapor y ácido láctico pudo inactivar E. coli O157:H7 y eliminar la matriz de biofilm desde las superficies de acero inoxidable. Otros estudios se están enfocando en el efecto de las moléculas en la dispersión de biofilms y también se centran en biofilms mixtos que contengan bacterias patógenas y no patógenas. En la Tabla 1 se describen los agentes utilizados para combatir los biofilms microbianos y los sitios de acción respectivos. A nivel de la industria es importante tener en cuenta el diseño e ingeniería de los equipos de procesamiento y las superficies que toman contacto con los alimentos para impedir, por ejemplo, la adsorción inicial en la formación de los biofilms. Adicionalmente, en relación con biofilms, QS y ecología microbiana de los alimentos, se ha indicado que, es necesario avanzar en el papel del QS en el deterioro de los alimentos, los factores que “pueden apagar” la actividad de QS en los alimentos y los posibles inhibidores de QS que podrían "inducir a error" en la coordinación bacteriana de las actividades de deterioro. Esos inhibidores podrían utilizarse como biopreservadores y aumentar la comprensión de cómo el QS afecta el comportamiento microbiano y ayudar de ese modo a encontrar respuestas sobre cómo podemos manejar el QS en beneficio de la preservación de los alimentos, la mejora de la vida útil y la seguridad (inocuidad) alimentaria. En la última década se han estado produciendo cantidades crecientes de reportes sobre adherencia y formación de biofilms por bacterias transmitidas por los alimentos, STEC, L. monocytogenes y microorganismos alteradores, entre otros, en diversos alimentos y ambientes de procesamiento, así como sobre las causas, implicancias de las interacciones y estrategias de control en la industria, incluyendo métodos novedosos y alternativos. Se señala que en las diferentes secciones del artículo se consideran también aspectos de las estrategias y métodos de control relevantes de los biofilms microbianos.






