
16 minute read
TRIOSAFOSFATO ISOMERASA
from Testlapalli número 6
by omar24_ga
INGENIERÍA AMBIENTAL
TRIOSAFOSFATO ISOMERASA
Advertisement
foto: www.pexels.com
María Eugenia Cruces Ángeles 1
1 Tecnológico de Estudios Superiores del Oriente del Estado de México. División de Ingeniería Ambiental, Paraje de San Isidro S/N, Barrio de Tecamachalco, 56400, Los Reyes Acaquilpan, Estado de México.
ABSTRACT:
Triosephosphate isomerase (TIM) is considered as a stable homodimer, although the catalytic residues are present in each monomer, the enzyme activates only in its dimeric form, the reasons for this oligomeric nature remain unclear. It is a ubiquitous enzyme, there are many TIM present in both from prokaryotes to eukaryotes organisms. Most TIMs studied come from parasitic sources, this may be due to the impact of parasites in human health., this is probably due to the impact of these parasites on human health. TIM plays an important role in several metabolic pathways, and it is essential for the efficient energy production, Because of this, it has been considered as the target in the design of drugs that may act against the enzyme of parasites located in the blood of mammals, where they consume the available glucose, causing diseases such as malaria and trypanosomiasis [Goméz-Puyou et al., 1995; Tellez-Valencia, et al., 2002]. Deficiencies in human TIM, caused by mutations, produce an increase in levels of DHAP,wich generate (with a simple point mutation (I170V)) chronic hemolytic anemia (Orosz et al., 2009); The E104D mutation produces a serius progressive neurological disorder (Rodríguez-Almazán et al., 2008). Keywords: TIM, G3P, DHAP, ubiquitous, mutation.
RESUMEN: La triosafosfato isomerasa (TIM) se considera un homodímero estable, aunque los residuos catalíticos están presentes en cada monómero, la enzima está activa solo en su forma dimérica, las razones para su naturaleza oligomérica no es clara. Al ser una enzima ubicua, hay muchos informes de TIM de organismos desde procariotas a eucariotas. La mayoría de las TIMs estudiadas provienen de fuentes parasitarias, esto se debe probablemente al impacto de estos parásitos en la salud humana. La TIM desempeña un papel importante en varias vías metabólicas y es esencial para la producción eficiente de la energía, razón por la cual ha sido considerada como blanco en el diseño de fármacos que puedan actuar contra la enzima de parásitos que se encuentran alojados en la sangre de mamíferos, donde consumen la glucosa presente causando enfermedades tales como la malaria y la tripanosomiasis [Goméz-Puyou y col., 1995; Tellez-Valencia, y col., 2002]. Deficiencias en la TIM de humano, causadas por mutaciones, producen un aumento en los niveles de DHAP provocando (con una simple mutación puntual (I170V)) anemia hemolítica crónica (Orosz y col., 2009); la mutación E104D produce un grave trastorno neurológico progresivo y (Rodríguez-Almazán y col., 2008).
Palabras clave: TIM, G3P, DHAP, ubicua, mutación.
1. ANTECEDENTES
La triosafosfato isomerasa (TIM) es la quinta enzima en la vía de la glucólisis, y cataliza la interconversión de los productos que provienen de la catálisis de la aldolasa, (el gliceraldehído 3 fosfato (G3P) y el fosfato de dihidroxiacetona (DHAP)), a través de un intermediario, el enodiol. Solamente el G3P continúa la ruta hasta obtener el ATP neto de la glucolisis y producir una molécula de piruvato extra por cada molécula de glucosa (Figura 1).
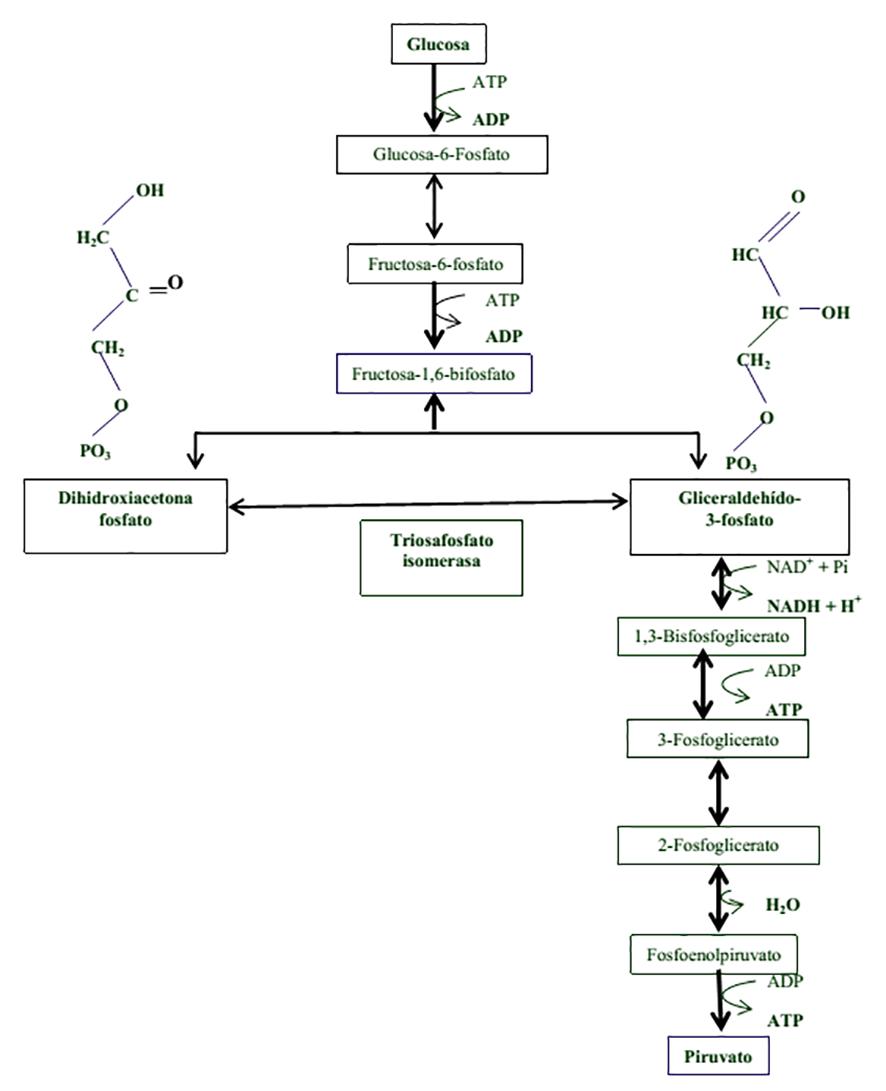
Figura 1. Vía de la glucolisis
ESTRUCTURA Triosafosfato isomerasa es una de las enzimas más estudiadas, de acuerdo con la base de datos de la herramienta bioinformática, The European Molecular Biology Laboratory–European Bioinformatics Institute (EMBL-EBI (http://www.ebi.ac.uk/embl/)), se tienen registradas 40,428 secuencias de enzimas de la familia de la TIM, provenientes de diferentes especies. La enzima TIM está presente en los tres dominios de la vida (Eucariota, Archaea y Bacteria). De las 40,428 secuencias reportadas, 31,352 pertenecen a bacterias, 7,746 a eucariotas y 1,330 a arqueas. Hasta la fecha se han reportado en el Protein Data Bank (PDB) 218 estructuras cristalográficas de la TIM, tanto de
tipo silvestre como variantes con algún tipo de ligando, o con algún monómero artificial. Las estructuras cristalográficas reportadas incluyen la descripción de 42 diferentes organismos. Estos datos cristalográficos muestran que todas las TIM adoptan un plegamiento de barril (α/β) 8 , es el prototipo del barril α/β o “TIM barrel”. Basado sobre su plegamiento de barril α/β, cada monómero de la TIM consta de 8 hebras β paralelas que forman la parte interna del barril rodeado por 8 hélices α, unidas mediante asas, en donde cada segmento tiene de 24 a 44 residuos de aminoácidos (Lolis, y col., 1990; Davenport y col, 1991). El conocimiento de su estructura de las ocho regiones de la enzima, permitió la construcción de algunas quimeras, en donde, una o varias regiones de una sola especie (monómero) se asociaran con otra subunidad de otra especie de TIM. (García-Torres y col. 2011; Rodríguez-Bolanos y col. 2016; Guzmán-Luna y col. 2017). En la mayoría de las especies, la TIM es un homodímero de aproximadamente 500 residuos con pesos moleculares cercanos a 54 kDa; pero, en algunos organismos termófilos la enzima es un tetrámero. Las subunidades se asocian a través de interacciones no covalentes. Ambos monómeros tienen un sitio activo completo localizado cerca de la interfase, y los residuos catalíticos de cada subunidad están ubicados en las asas 1 (Lys12), 4 (His95) y 6 (Glu 165). Ya que sólo la especie dimérica presenta actividad biológica, se asume que los residuos de una subunidad son decisivos para mantener la integridad o la estabilidad del sitio activo de la otra subunidad (Wierenga y col., 2010). La interfase del dímero se compone principalmente por las asas 1, 2, 3, 4 y 8. Las asas 3, 4, 5, 6 y 8 tienen al menos ocho residuos. Las asas 4, 5 y 8 adoptan una conformación helicoidal. Las asas 5, 6 y 7 muestran flexibilidad conformacional. El asa 3 y la 6 sobresalen en la superficie del monómero (Figura 2) (Wierenga y col., 1992). El asa 3 (formada por los residuos 68 al 79) se le conoce como asa de la interfase; se acopla a un hueco cercano del sitio activo de la otra subunidad entre las asas 1 y 4, en donde, las estructuras cristalográficas demuestran que la asa 1 y la asa 4 son rígidas, debido a interacciones muy fuertes con residuos de la otra subunidad (Wierenga y Noble, 1992). El asa 6 (residuos 165 al 177), que es llamada asa flexible o catalítica, forma una especie de tapa que se abre y se cierra sobre el sitio activo; esta asa catalítica sufre un cambio conformacional notable, llegando a moverse hasta 7 Å desde una posición “abierta” hacia una “cerrada”. Estudios de resonancia magnética nuclear (RMN) muestran que la unión del sustrato (o ligando), o la salida del producto no inducen el movimiento del asa 6, sino que esté es un movimiento natural de la proteína (Williams y McDermott, 1995).
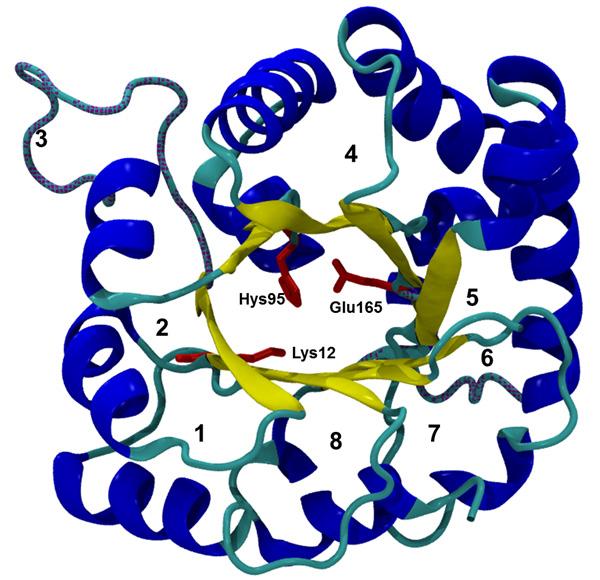
Figura 2. Estructura tridimensional de un monómero de la TIM. Se observa la estructura característica de un barril TIM. Las 8 hélices α (listones azules), rodean a las hebras (flechas amarillas) dispuestas en el centro y se unen por 8 asas. Se muestran los residuos catalíticos (de acuerdo a la secuencia de la triosafosfato isomerasa de Saccharomyces cerevisei (ScTIM). (Archivo de Protein Data Bank; 1YPI (Lolis y col., 1990)).
CATÁLISIS
La TIM está considerada como una “enzima perfecta” debido a que su velocidad de conversión de G3P a DHAP se controla por difusión; lo que significa que la eficiencia catalítica (k cat /K M ) en esa dirección se encuentra cerca de su máximo valor: 10 9 M -1 s -1 , siendo un valor comparable al calculado para re-
acciones biomoleculares en solución controladas por difusión (108 - 1010 M-1 s-1). (Albery y Knowles, 1976; Blacklow y col., 1988; Knowles, 1991). La TIM es solamente activa como dímero (Waley, 1973; Casal y col., 1987; Garza-Ramos y col., 1992). Varios de estos estudios han pretendido resolver la pregunta si la TIM es un dímero obligado, diseñando TIM monomérica de diferentes especies que han resultado en estructuras de barriles (α/β) 8 , cuya actividad catalítica es reducida más de 1000 veces. Borchert y col., 1993 diseñaron una variante monomérica de la triosafosfato isomerasa de Trypanosoma brucei deletando la asa 3, el principal componente en la interfase. La asa 3 es mayoritariamente hidrofóbica, 7 de sus 15 residuos fueron remplazados por residuos hidrofílicos. La versión modificada de la triosafosfato isomerasa resultó ser una versión monomérica de la enzima llamada MonoTIM, la cual fue estable, pero con eficiencia catalítica 1000 veces menor que la k cat (constante catalítica) de la proteína dimérica silvestre (Schliebs y col., 1996). La estructura cristalográfica de la MonoTIM muestra que las asas 1 y 4 sufren cambios conformacionales. La asa 1 (donde se encuentra el residuo catalítico Lys 12) es completamente flexible y la asa 4 (donde se encuentra el residuo catalítico His 95) adopta una conformación muy diferente que la enzima silvestre (Schliebs y col., 1996). Otros ensayos para obtener una TIM monomérica han sido dirigidos para desestabilizar la interacción del asa 3 con la otra subunidad, mediante una repulsión electrostática a través de una introducción de residuos cargados positivamente al final de la asa 3 (Schliebs y col., 1997). La proteína obtenida fue un monómero, pero su actividad fue tan baja como la original MonoTIM. En la TIM de humano, Mainfroid y col. (1996) trataron de desestabilizar la interfase, mutando el residuo Met 14 por Gln y Arg 98 por Gln. Solamente la doble mutante mostró ser una proteína monomérica, pero la actividad y estabilidad, decayeron considerablemente. Saab-Rincón y. (2001) sometieron a la monoTIM creada por Borchert y col., (1993) a evolución dirigida para obtener un incremento en su actividad catalítica. La caracterización cinética de dos de las mutantes más activas mostraron un incremento de 11 veces en la k cat y una reducción de 4 veces en la K M , sin embargo se observaron pequeñas diferencias en la velocidad de crecimiento cuando los dos genes mutantes fueron comparados, lo cual es atri
buible a una diferencia en la solubilidad de la proteínas. Estas variante de la monoTIM, son las más activas reportadas hasta el momento. En la tabla 1 se presentan los parámetros cinéticos para algunas TIM monoméricas y su dímero silvestre. También se presenta un factor que indica el decremento en eficiencia catalítica que nos permite observar la disminución de la actividad de las mutantes con respecto a la enzima silvestre. Son tres los aminoácidos que están involucrados directamente en la catálisis: Lys12, His95 y Glu165 (de acuerdo a la numeración de triosafosfato isomerasa de Saccharomyces cerevisei (ScTIM) (Lolis y col., 1990)). La reacción de isomerización comienza cuando el carboxilo del Glu165 y el anillo imidazol de la His95 realizan las protonaciones y desprotonaciones necesarias para la formación del intermediario cis-enodiol (Knowles, 1991). Por su parte, la función que realiza la Lys12 es la de neutralizar las cargas del sustrato, permitiendo así la unión al sitio activo correcta. Adicionalmente, existen otros residuos que se han considerado importantes para la catálisis de la TIM: Asn10, Ser96, Glu97 y Cys126, con respecto al residuo Ser96, se cree que interviene en el posicionamiento apropiado del Glu165; sin embargo, la eficiencia catalítica de la mutante S96T de TIM de pollo no mostró diferencia significativa, respecto a la enzima sin modificar (Blaklow y col., 1991). La Asn10 actúa como posible proveedor de un potencial electrostático estabilizando un estado intermediario o de transición de la reacción (Kursula y col., 2001). Asimismo el papel que juegan los residuos Glu97 y Cys126 en la catálisis parece ser de muy poca importancia para la referida actividad. En estudios realizados por González-Mondragón y col. (2004), encontró que la sustitución de la Cys126 de la ScTIM (por Ala o Ser no afectó la eficiencia catalítica de la enzima. Igualmente Cruces-Ángeles y col., (2011) reportaron que la mutación del residuo Cys126Val disminuyó solamente 7 veces su eficiencia catalítica con respecto a la enzima silvestre. Al parecer la introducción de una cadena lateral más grande e hidrofóbica en la posición 126 perturba considerablemente el ambiente cercano al Glu165 catalítico. Esta perturbación puede ser el resultado de un efecto estérico o de cambios de polaridad del sitio catalítico, parece ser que hay algunas restricciones en cuanto al tamaño e hidrofobicidad de la cadena lateral que
Parámetros cinéticos de TIM monoméricas
Fuente Descripción 1 T. brucei WT
Estado de dimerización Dímero K M (mM) k cat (min -1 ) 0.38 ± 0.04 2.5 x 10 5
2 T. cruzi
3 T. brucei
3 T. brucei
3 T brucei
4 T brucei
5 T. brucei
6 T. brucei
7 T cruzi
WT
Dímero
0.45 ± 0.03 2.7 x 10 5
MonoTIM Monómero 4.1 ± 0.6 3.1 x 10 2
MonoTIM-SS Monómero 6.1 ± 0.5 4.7 x 10 2
MonoTIM-W Monómero 3.1 ± 1.3 2.6 x 10 2
RE-TIM Monómero 1.4 ± 0.2 1.3 x 10 2
MonoTIM Monómero 5.3 ± 0.09 3.1 x 10 2
RMMO Monómero 1.19 ± 0.07 3.5 x 10 3
MonoTcTIM Monómero 11.2 ± 2.6 3.1 x 10 3
kcat/KM (mM -1 min -1 )
11.0 x 10 5
*Comparación de eficiencia -
6.0 x 10 5
75 14,667
77 14,286
84 13,095
93 11,828
58 18,966
2.9 x 10 3
2.7 x 10 2
379 222
Tabla 1. 1Zomosa-Signoret y col., 2007, 2Cabrera y col., 2008, 3Schliebs y col., 1996, 4Schliebs y col., 1997, 5Borchert y col., 1994, 6Saab-Rincón y col., 2001, 7Zárate- Pérez y col., 2009. *kcat/KM de la enzima silvestre entre la kcat/KM de la proteína mutante
ocupa la posición 126 para mantener una eficiencia catalítica apropiada, pero la presencia de un grupo sulfhidrilo no es requerida en este sitio. Datos no reportados de la mutación Glu97Gln de la enzima ScTIM, encontraron que la eficiencia catalítica es del mismo orden de magnitud que la enzima silvestre.
ASPECTOS EVOLUTIVOS Las TIMs de diferentes especies tienen actividades catalíticas similares y son muy parecidas en sus estructuras tridimensionales. Es notorio el hecho de que los aminoácidos que conforman el sitio catalítico se encuentran altamente conservados en las secuencias disponibles. Sin embargo han ocurrido muchos cambios en las secuencias primarias de aminoácidos de la TIM, sin afectar la eficiencia catalítica de la enzima a lo largo de la evolución. Por ejemplo la TIM de pollo y la TIM levadura poseen una eficiencia catalítica máxima in vivo, sin embargo sus secuencias de aminoácidos son idénticas sólo en un 52% (Wierenga y Noble, 1992). Las secuencias alineadas de los genes codificados para la TIM de más de 40,428 organismos que van desde la arqueobacteria Pyroccocus woesi al Homo sapiens revelan que menos de 10 de los aproximadamente 250 residuos de aminoácidos que componen a un monómero se encuentran conservados. Las identidades de las secuencias disponibles oscilan desde un 98% para enzima de humano y de conejo, hasta 37% para enzimas como levadura y Bacillus stearothermophilus. El resultado de estas secuencias alineadas se encontró a 7 residuos que a través de la evolución han permanecido invariantes: Lys12, Thr75, His95, Glu97, Cys126, Glu165 y Pro166 (triada catalítica). En resumen, la secuencia de aminoácidos de las diferentes especies que conforman las TIMs estudiadas, difieren en su secuencia primaria, pero su estructura tridimensional es muy semejante y su función catalítica es similar. El número de diferencias entre proteínas homologas provenientes de varias especies está relacionado con el parentesco evolutivo entre ellas, es decir, provienen de un ancestro común.
REFERENCIAS
Albe, K.R., Butler, M.H., Wright, B.E. (1990). Cellular concentrations of enzymes and their substrates. J. Theor. Biol. 143: 163-195.
Albery, J.W., Knowles, J.R. (1976). Evolution of enzyme function and the development of catalytic efficiency? Biochemistry. 15: 5631-5640. Blacklow, S.C, Liu, K.D, Knowle,s J.R. (1991). Stepwise improvements in catalytic effectiveness: independence and interdependence in combinations of point mutations of a sluggish triosephosphate isomerase. Biochemistry. 30: 8470-8476. Blacklow, S.C., Raines, R.T., Lim, W.A., Zamore, P.D., Knowles, J.R. (1988). Triosephosphate isomerase catalysis is diffusion controlled. Appendix: Analysis of triose phosphate equilibria in aqueous solution by 31P NMR. Biochemistry. 27: 1158-1167.
Borchert, T. V., Abagyan, R., kishan, K. V., Zeelen, J. P. and Wierenga. R. K. (1993). The crystal structure of an engineered monomeric triosephosphate isomerase, monoTIM: the correct modelling of an eight-residue loop. Structure. 1: 213-215 Casal, J. I., Ahern, T. J., Davenport, R. C., Petsko, G. A., y Klibanov, A. M. (1987). Subunit interface of triosephosphate isomerase: site-directed mutagenesis and characterization of the altered enzyme. Biochemistry. 26: 1258-1264 Cruces-Ángeles, M.E, Cabrera, N,, Pérez-Montfort R, Reyes-López, C.A,, Hernández- Arana A. (2011). Thermodynamic and kinetic destabilization of triosephosphate isomerase resulting from the mutation of conserved and non-conserved cysteines. Protein Pept Lett. 18: 201 1290-1298. Davenport, R.C., Bash, P.A., Seaton, B.A., Karplus, M., Petsko, G.A., Ringe, D. (1991). Structure of the triosephosphate isomerase phosphoglycolohydroxamate complex: an analog of the intermediate on the reaction pathway. Biochemistry. 30: 5821-5826
García-Torres I., Cabrera N., Torres-Larios A., Rodríguez-Bolaños M., Díaz-Mazariegos S., Gómez-Puyou A., Perez-Montfort R. (2011). Identification of amino acids that account for long-range interactions intwo triosephosphate isomerases from pathogenic trypanosomes. PLoS One. 6: e18791 Garza-Ramos, G., Tuena de Gómez-Puyou, M., Gómez-Puyou, A. y Gracy, R.W. (1992). Dimerization and reactivation of triosephosphate isomerase in reverse micelles. Eur. J. 211 Biochem. 208: 389-95 Gómez-Puyou, A., Saavedra-Lira, E., Becker, I., Zubillaga, R.A., Rojo-Domínguez, A., y Pérez-Montfort, R. (1995). Using evolutionary changes to achieve species-specific inhibition
of enzyme action--studies with triosephosphate isomerase. Chem. Biol. 2: 847-855. González-Mondragón, E., Zubillaga, R.A., Saavedra, E., Chánez-Cárdenas, M.E., Pérez-Montfort, R., Hernández-Arana, A. (2004). Conserved cysteine 126 in triosephosphate is required not for enzymatic activity but for proper folding and stability. Biochemistry. 43: 218 3255-3263. Guzman-Luna V., Quezada A.G., Díaz-Salazar A.J., Cabrera N., Perez-Montfort R., Costas M. (2017). The effect of specific proline residues on the kinetic stability of the triosephosphate isomerases of two trypanosomes. Proteins. 85: 571-579 Knowles, J.R. (1991). Enzyme catalysis: not different, just better. Nature. 350: 121-124. Kursula, I., Partanen, S., Lambeir, A.-M., Antonov, A.M., Augustyns, K., y Wierenga, R.K. (2001). Structural determinants for ligand binding and catalysis of triosephosphate isomerase. Eur. J. Biochem. 268: 5189–5196
Lolis, E., Alber, T., Davenport, R.C., Rose, D., Hartman, F.C., Pestko, A.G. (1990). Structure of yeast triosephosphate isomerase at 1.9 Å resolution. Biochemistry. 29: 6609-6618 Orosz, F., Oláh, J., Ovádi, J. (2009). Triosephosphate isomerase deficiency: new insights into an
enigmatic disease. Biochim Biophys Acta. 1792: 1168-1174. Rodríguez-Almazán, C., Arreola, R., Rodríguez-Larrea, D., Aguirre-López, B., de Gómez-Puyou, M.T., Pérez-Montfort, R., Costas, M., Gómez-Puyou, A., Torres-Larios, A. (2008). Structural basis of human triosephosphate isomerase deficiency: mutation E104D is related to alterations of a conserved water network at the dimer interface. J Biol Chem. 283: 23254- 23263. Rodriguez-Bolanos M, Cabrera N, Perez-Montfort R. (2016). Identification of the critical residues responsible for differential reactivation of the triosephosphate isomerases of two trypanosomes. Open Biol. 6: 160294. Saab-Rincón, G., Rivelino, V. J., Osuna, J. F., & Soberón, X. (2001). Different strategies to recover the activity of monomeric triosephosphate isomerase by directed evolution. Protein 240 Engineering. 14: 149-155. Schliebs, W., Thanki, N., Eritja, R. and Wierenga, R. (1996). Active site properties of monomeric triosephosphate isomerase (monoTIM) as deduced from mutational and structural studies. Protein Sci, 5: 229-239. Schliebs, W., Thanki, N., Jaenicke, R. and Wierenga, R. K. (1997). A double mutation at the tip of the dimer interface loop of triosephosphate isomerase generates active monomers with reduced stability. Biochemestry, 36: 9655-9662.
Téllez-Valencia A., Avila-Ríos S., Pérez-Montfort R., Rodríguez-Romero A., Tuena de Gómez-Puyou M., López-Calahorra F., Gómez-Puyou A. (2002). Highly specific inactivation of triosephosphate isomerase from Trypanosoma cruzi. Biochem Biophys Res Commun. 295: 958-63 Wierenga, R.K., Kapetaniou, E.G., Venkatesan, R. (2010). Triosephosphate isomerase: a highly evolved biocatalyst. Cell Mol Life Sci. 67: 3961- 3982. Wierenga. R.K., Noble, M.E. (1992). Comparison of the refined crystal structures of liganded and unliganded chicken, yeast and trypanosomal triosephosphate isomerase. J. Mol. Biol. 224: 1115-1126 Williams, J.C., McDermott, A.E. (1995). Dynamics of the flexible loop of triosephosphate isomerase: the loop motion is not ligand gated. Biochemistry. 34: 8309-8319. Zarate-Pérez, F., Chanez-Cárdenas, M.E., Rodrigo Arreola, A. Torres-Larios, A., Vázquez-Contreras E. (2009). Different catalytic properties of two highly homologous triosephosphate isomerase monomers. Biochemical and Biophysical Research Communications. 382: 626-630. Zomosa-Signoret, V., Aguirre-López, B., Hernández-Alcántara, G., Pérez-Monfort, R., Tuena de, M., Goméz-Poyou, A. Crosstalk between the subunits of the homodimeric enzyme triosephosphate isomerase. (2007) Proteins. 67: 75-83. 265 266





