
10 minute read
SECCIONES
from Ateuves 91
by Grupo Asís
La rinitis
Uno de los problemas más comunes del tracto respiratorio superior es la rinitis o inflamación de las membranas mucosas de la nariz. Si también afecta al revestimiento de los senos paranasales recibe el nombre de sinusitis. Dado que las fosas nasales tienen una importante función de filtración, su mal funcionamiento puede llegar a afectar a los pulmones al dejar pasar polvo y microorganismos dañinos. La rinitis puede ser leve, de modo que se produce solo un poco de secreción nasal clara, o puede ser lo suficientemente grave como para que la secreción sea verde, amarilla e incluso con sangre.
Advertisement
Rinitis
La rinitis es la inflamación de la membrana mucosa de las fosas nasales.
Diagnóstico
El diagnóstico se basa en el historial y el examen físico. Para que el estudio sea completo se debería hacer un análisis de sangre, radiografías del cráneo, un cultivo del conducto nasal y de su descarga y una endoscopia.
Causas
La inflamación de las mucosas puede tener diversas causas: • Virus (herpesvirus felino y moquillo canino) • Parásitos (ácaros nasales) • Infecciones fúngicas • Defectos de nacimiento (paladar hendido) • Trauma facial o en la cabeza • Cuerpos extraños (briznas de hierba, semillas, espigas, etc.) • Alergias • Bacterias Los casos de rinitis pueden ser crónicos o agudos. La rinitis crónica tiene episodios intermitentes y recurrentes de estornudos y secreción nasal; a veces habrá una respuesta parcial a los antibióticos, pero no lo suficiente como para deshacerse de ellos para siempre. Los casos de rinitis crónica/rinosinusitis en gatos a menudo se denominan snufflers crónicos.
Signos clínicos
Los principales signos de rinitis incluyen la secreción nasal, que puede ser clara o contener pus debido a una infección bacteriana secundaria. También estornudos, que pueden ser el resultado de que el animal intente limpiar las vías respiratorias superiores de la secreción. Los ronquidos y la respiración con la boca abierta o con dificultad se deben a un estrechamiento de los conductos nasales debido a la inflamación que el paciente trata de compensar. Si los animales se tocan o arañan la cara es posible que se deba a la presencia de un cuerpo extraño. Por lo general, junto con la inflamación de las vías respiratorias superiores se puede observar lagrimeo y conjuntivitis o inflamación de la membrana que rodea los ojos. Los tumores o los hongos pueden ocasionar una secreción nasal crónica unilateral pero que se vuelve bilateral.
Tratamiento y pronóstico
El tratamiento depende de la causa subyacente de la rinitis. Si existe una infección bacteriana se pueden administrar antibióticos. La rinitis causada por hongos se puede tratar con un producto específico para los mismos una vez se ha identificado el hongo en concreto (Aspergillus fumigatus es la causa más común de rinitis fúngica en perros). Si el problema se debe a la presencia de cuerpos extraños o a un tumor es posible que se necesite cirugía; en este último caso se suele aplicar radioterapia. El pronóstico depende de la causa subyacente de la rinitis y la cronicidad del caso. En casos leves o de aparición reciente, el tratamiento para aliviar los signos clínicos puede ser efectivo.



La parvovirosis canina (II)
En la segunda parte de este artículo describimos el abordaje terapéutico de esta enfermedad tan frecuente en la clínica, que se basa en el tratamiento de soporte y la prevención de infecciones secundarias.
Cristina Baño ATV en Aúna Especialidades Veterinarias Supervisado por: Raquel Francés MSc, LV Servicio Urgencias y Cuidados Intensivos en Aúna Especialidades Veterinarias Imágenes cedidas por la autora
Fluidoterapia
La fluidoterapia es una parte esencial del tratamiento de la parvovirosis canina (PC), ya que aborda la hipovolemia y la deshidratación, ayudando a prevenir complicaciones asociadas a la hipoperfusión1. Para evitar subestimar el alcance total de la pérdida de líquidos, es imprescindible realizar un control exhaustivo del peso, outputs e inputs (ver primera parte de este artículo). El uso de empapadores y sondas tipo Foley nos permite la recogida, pesaje y contaje de los outputs. Siempre que la hipoperfusión esté controlada, la deshidratación puede corregirse en 6, 12 o 24 h, reajustando el plan de fluidoterapia según sea necesario. Los fluidos de elección para el mantenimiento tienden a ser soluciones electrolíticas isotónicas de balance como el lactato de Ringer. No obstante, en pacientes con shock séptico, anemia, hipoalbuminemia o vasculitis, puede ser necesarias transfusiones de sangre, plasma, albumina humana o coloides sintéticos2,3 .
Antieméticos
Los vómitos y regurgitaciones contribuyen a la anorexia y la deshidratación del paciente, además de favorecer la aparición de complicaciones como esofagitis, acidez y desequilibrios electrolíticos2,3. El uso de fármacos antieméticos como el maropitant, metoclopramida o el ondasentron favorece la reducción de la náusea y estimulan la motilidad intestinal2-4. Algunos, como la metoclopramida, pueden administrarse en infusión continua con sistemas protegidos de la luz, ya que son fotosensibles5 .
Nutrición
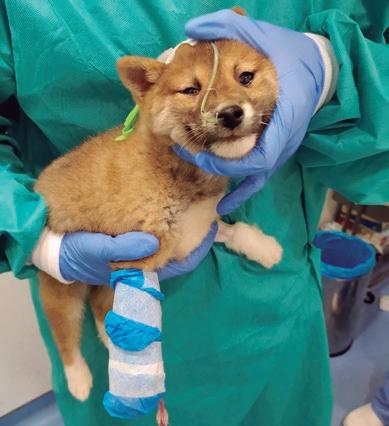
Existe fuerte evidencia sobre los beneficios de la alimentación temprana enteral en la recuperación del paciente3,6. Aunque la alimentación parenteral puede ser una opción en animales anoréxicos, es preferible la vía enteral. La presencia de alimento en el tracto digestivo es muy beneficiosa para la restitución de la integridad y la funcionalidad de la mucosa intestinal, así como la disminución del riesgo de translocación bacteriana1,6 . Con frecuencia, los pacientes con PC se niegan a comer y beber por sí mismos, no obstante, la alimentación forzada puede ser contraproducente al favorecer las náuseas, la aversión a la comida y el riesgo de aspiración. Una de las vías más utilizadas son las sondas nasogástricas (figura 1) 1-3,6-8 que, además de favorecer la descompresión gástrica y reducir las nauseas2,3,8 , permiten aumentar progresivamente los requerimientos de energía en reposo (RER) hasta que vuelven a mostrar interés por la comida (tablas 1 y 2).
Antiparasitarios
La presencia de otros patógenos entéricos puede agravar los signos clínicos después de la infección, por este motivo, es habitual usar antiparasitarios como el fenbendazol para contro-
lar una gran variedad de parásitos intestinales incluyendo helmintos y protozoos3,4 .
Antibióticos
Se requiere la administración de antibióticos debido a la inmunosupresión y el riesgo de translocación bacteriana. Generalmente se optará por un antibiótico de amplio espectro como la amoxicilina2,3. No obstante, si hay evidencia o gran riesgo de sepsis, se podrán administrar combinaciones de antibióticos con actividades frente a organismos grampositivos, gramnegativos y anaerobios (por ej.: ampicilina, amikacina, etc.)2,3,8. Algunos de estos antibióticos tienen efectos adversos que deben considerarse. En cachorros se desaconseja el uso de quinolonas, ya que puede afectar al crecimiento del cartílago articular2. Por otro lado, los aminoglucósidos son nefrotóxicos y, si el paciente no está bien hidratado y perfundido, pueden contribuir al desarrollo de una insuficiencia renal, por lo que deben monitorizarse los valores renales como la creatinina, glucosuria y proteinuria, para asegurar la correcta funcionalidad renal del paciente2,3 .
Analgesia y control del dolor
La enteritis y la distensión gástrica generan dolor visceral que varía de moderado a grave. Aunque las palpaciones abdominales son de gran ayuda para la detección de focos de dolor y posibles invaginaciones intestinales1 , es importante aplicar un método objetivo para determinar el grado de dolor que presenta el paciente y evaluar la necesidad de aplicar un rescate analgésico. Las diferentes escalas de dolor, como por ejemplo la escala de Glasgow modificada, constituyen métodos de evaluación del dolor basados en el comportamiento (vocalización, actividad, postura, etc.), dejando de lado parámetros fisiológicos que pueden ser menos específicos a la hora de evaluar el dolor (por ej.: frecuencia cardiaca)9 . En función del grado de dolor, se optará por la administración de agonistas parciales (por ej.: buprenorfina) u opioides puros (por ej.: metadona, morfina o fentanilo)3. Estos últimos son reversibles y al administrarlos en infusión continua permiten ajustarse a la dosis requerida en
Tabla 1. Fórmulas matemáticas para el cálculo de los requerimientos energéticos en reposo (RER) y la pauta de alimentación.
Tabla 2. Ejemplo de pauta de alimentación para un perro de 5 kg al que se le administrará una dieta líquida comercial que cubre 1,5 kcal/ml.
Fórmula Unidades
RER= (30 x PV)+70 Kcal/día
RER= 70+PV0,75 Kcal/día
% RER= RER x % 100 Kcal/día
RER Kcal/ml ml/día
24 (h) F (h)
ml T ml/toma
Descripción
Determina el número de kcal por día que requiere el animal en reposo. Esta fórmula sirve para animales que pesen entre 2 y 30 kg. Determina el número de kcal por día que requiere el animal en reposo. Esta fórmula sirve para animales que pesen <2 y >30 kg. Determina el número de kcal diarias para cada porcentaje del RER. El % RER irá incrementándose progresivamente según la tolerancia del paciente. Determina los ml diarios de alimento necesarios para cubrir el RER. Se calcula en función de la concentración de kcal por ml de alimento. Esta suele aparecer indicada en el etiquetado del producto. Determina el número de tomas diarias en las que se debe administrar el alimento, donde F equivale a la frecuencia en horas. Determina la cantidad de ml que deben administrarse en cada toma, donde T equivale al número de tomas diarias.
Pauta de alimentación
Peso vivo (PV) = 5 kg Dieta líquida de fácil digestión baja en grasa y proteínas. Concentración: 1,5 kcal/ml RER (%) 25 % 50 % 75 % 100 % kcal/día 55 110 165 220 ml/día 36,6 73,3 110 146,6 Frecuencia 4 h 4 h 6 h 8 h Tomas 6 6 4 3 ml/toma 6,1 12,2 27,5 48,8
cada momento. No obstante, los opioides puros empeoran el íleo paralitico y dificultan el vaciado gástrico10, por lo que pasadas 12-24 h es conveniente añadir procinéticos3. Los antiinflamatorios no esteroideos y agonistas α-adrenergicos están contraindicados en estos pacientes, porque disminuyen el flujo sanguíneo a la mucosa gástrica favoreciendo la ulceración intestinal. Además, en pacientes deshidratados o hipovolémicos pueden generar insuficiencia renal aguda3,7 .
Pauta de alimentación con sonda nasogástrica
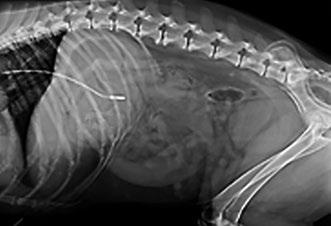
1. Si el estado mental del paciente es normal, se ha de ofrecer comida y agua por vía oral antes de la toma. 2. Aspirar el tubo antes de cada toma y anotar los ml de vaciado gástrico. Si no se aspira contenido, la presión negativa en la jeringa nos indica la correcta localización de la sonda en el estómago. Si hay dudas de que la sonda esté mal colocada (por ej.: aspirar aire), haremos una radiografía para comprobar la ubicación (figura 2) y evitar el riesgo de neumonía por aspiración. Figura 2. Radiografía que muestra la sonda 3. Colocar al paciente en posición esternal y reali- nasogástrica en el estómago. zar un flushing de agua (5-10 ml) a temperatura ambiente antes y después del alimento para limpiar el circuito y evitar obstrucciones. 4. Administrar el alimento a temperatura ambiente en 10-15 min. Si aparecen signos de náusea reducir la velocidad o parar. 5. Al terminar, las aperturas de las sondas han de permanecer limpias, cerradas y protegidas con gasas y venda cohesiva. Se recomienda el uso de collar isabelino para prevenir la retirada accidental de la sonda. 6. Revaluar el RER pasadas 24 h en función del nivel de tolerancia al alimento: naúseas, regurgitaciones, vómitos, cantidad y aspecto del contenido gástrico aspirado, etc.
Bibliografía
1. Garcia Segovia, I. Manejo clínico de la parvovirosis canina en urgencias. Rev. Complut. ciencias Vet. 1, 510–516 (2007). 2. Li, R. & Humm, K. R. Canine parvovirus infection. in
Small Animal Critical Care Medicine, Second Edition 568–572 (2014) 3. Francés, R., Mengual, C. & Vigueras, I. Parvovirosis canina: manejo del paciente hospitalizado. Argos 214, 36–39 (2019). 4. Ramsey, I. K. & Tennant, B. Manual de enfermedades infecciosas en pequeños animales. (2006). 5. Sánchez-Quiles, I., Nájera-Pérez, M. D., Espuny-Miró, A. & Titos-Arcos, J. C. Review of the stabitlity of photosensitive medications. Farm. Hosp. 35, 204–215 (2011). 6. Scott-Morris, B. & Walker, D. Nursing the patient with parvovirus. Veterinary Nursing Journal 31, 25–29 (Informa
UK Limited, 2016). 7. Judge, P. R. Management of the Patient with Canine Parvovirus Enteritis. Proceedings of the New Zeland Veterinary
Nursing Association Annual Conference 5–11 (2015). 8. Mazzaferro, E. M. Update on Canine Parvoviral Enteritis.
Vet. Clin. North Am. - Small Anim. Pract. 50, 1307–1325 (2020). 9. Rioja García, E., Salazar Nusio, V., Martínez Fernández F. & Martínez Taboada, M. Manual de anestesia y analgesia de pequeños animales. 72 (2013). 10. Kurz, A. & Sessler, D. I. Opioid-induced bowel dysfunction: Pathophysiology and potential new therapies. Drugs 63, 649–671 (2003).

