108 FORMACIÓN CONTINUA
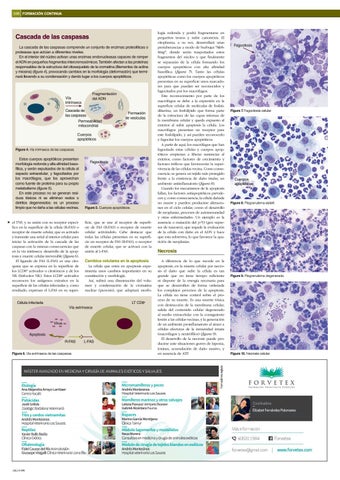
La cascada de las caspasas comprende un conjunto de enzimas proteolíticas o proteasas que actúan a diferentes niveles. En el interior del núcleo activan unas enzimas endonucleasas capaces de romper el ADN en pequeños fragmentos intercromosómicos. También afectan a las proteínas responsables de la estructura del citoesqueleto de la cromatina (filamentos de actina y miosina) (figura 4), provocando cambios en la morfología (deformación) que terminará llevando a su condensación y dando lugar a los cuerpos apoptóticos.
Fragmentación del ADN
Vía intrínseca
Cascada de las caspasas Permeabilidad mitocondrial
Formación de vesículas
Cuerpos apoptóticos Figura 4. Vía intrínseca de las caspasas.
Estos cuerpos apoptóticos presentan morfología redonda y alta afinidad basofílica, y serán expulsados de la célula al espacio extracelular, y fagocitados por los macrófagos, que los aprovechan como fuente de proteína para su propio metabolismo (figura 5). En este proceso no se generan residuos tóxicos ni se eliminan restos o detritos degenerados: es un proceso limpio que no daña a las células vecinas.
el TNF, y su unión con su receptor específico en la superficie de la célula (R-FAS) o receptor de muerte celular, que es activado y transmite una señal al interior celular para iniciar la activación de la cascada de las caspasas con la mismas consecuencias que en la vía intrínseca: desarrollo de la apoptosis y muerte celular irreversible (figura 6). El ligando de FAS (L-FAS) es una citoquina que se expresa en la superficie de los LCD8+ activados o citotóxicos y de los NK (linfocitos NK). Estos LCD8+ activados reconocen los antígenos extraños en la superficie de las células infectadas y, como resultado, expresan el L-FAS en su super-
Fagocitosis
Figura 5. Cuerpos apoptóticos.
ficie, que se une al receptor de superficie de FAS (R-FAS) o receptor de muerte celular activándolo. Cabe destacar que todas las células presentan en su superficie un receptor de FAS (R-FAS), o receptor de muerte celular, que se activará con la unión al L-FAS.
Cambios celulares en la apoptosis La célula que entra en apoptosis experimenta unos cambios importantes en su constitución y morfología. Así, sufrirá una disminución del volumen y condensación de la cromatina nuclear (picnosis), que adoptará morfo-
Célula infectada
LT CD8+ Vía extrínseca
Virus Apoptosis R-FAS
L-FAS
Figura 6. Vía extrínseca de las caspasas.
logía redonda y podrá fragmentarse en pequeños trozos y sufrir cariorrexis. El citoplasma, a su vez, desarrollará unas protuberancias a modo de burbujas “blebbing”, donde serán trasportados estos fragmentos del núcleo y que finalmente se separarán de la célula formando los cuerpos apoptóticos con alta afinidad basofílica (figura 7). Tanto las células apoptóticas como los cuerpos apoptóticos presentan en su superficie unos marcadores para que puedan ser reconocidos y fagocitados por los macrófagos. Este reconocimiento por parte de los macrófagos se debe a la expresión en la superficie celular de moléculas de fosfatidilserina, un fosfolípido que forma parte de la estructura de las capas internas de la membrana celular y queda expuesto al exterior al sufrir apoptosis la célula. Los macrófagos presentan un receptor para este fosfolípido, y así pueden reconocerlo y fagocitar los cuerpos apoptóticos. A partir de aquí, los macrófagos que han fagocitado estas células y cuerpos apoptóticos empiezan a liberar sustancias al exterior, como factores de crecimiento y factores tróficos que favorecerán la supervivencia de las células vecina. Como consecuencia, se genera un tejido más protegido frente a la existencia de daño tisular, un ambiente antiinflamatorio (figura 8). Cuando los mecanismos de la apoptosis fallan, los factores antiapoptóticos prevalecen y, como consecuencia, la célula dañada no muere y pueden producirse alteraciones en el ciclo celular, como el desarrollo de neoplasias, procesos de autoinmunidad y otras enfermedades. Un ejemplo es la ausencia o mutación del p-53 (gen supresor de tumores), que impide la evaluación de la célula con daño en el ADN y hace que esta sobreviva, lo que favorece la aparición de neoplasias.
A diferencia de lo que sucede en la apoptosis, en la muerte celular por necrosis el daño que sufre la célula es tan grande que no tiene tiempo suficiente ni dispone de la energía necesaria para que se desarrollen de forma ordenada los complejos procesos de la apoptosis. La célula no tiene control sobre el proceso de su muerte. Es una muerte tóxica con destrucción de la membrana celular, salida del contenido celular degenerado al medio extracelular con la consiguiente lesión a las células vecinas, y la generación de un ambiente proinflamatorio al atraer a células efectoras de la inmunidad innata (macrófagos y neutrófilos) (figura 9). El desarrollo de la necrosis puede producirse ante situaciones graves de hipoxia, toxinas, acumulación de daño masivo, y en ausencia de ATP.
Etología
Micromamíferos y peces
Psitácidas
Mamíferos marinos y otros salvajes
Titis y cerdos vietnamitas
Rapaces
Reptiles
Módulo lagomorfos y mustélidos
Oftalmología
Módulo de cirugía de tejidos blandos en exóticos
Jordi Grìfols Zoològic Badalona Veterinarià Andrés Montesinos Hospital Veterinario Los Sauces Xavier Balls Badia Clínica Exòtics Fidel Causse del Río Animalvisión Giussepe Visigalli Clínica Veterinaria Liana Blu
196
Figura 7. Fagocitosis celular.
Cuerpos apoptóticos
Figura 8. Piogranuloma estéril.
Necrosis
MÁSTER AVANZADO EN MEDICINA Y CIRUGÍA DE ANIMALES EXÓTICOS Y SALVAJES
Ana Alejandra Arroyo Lambaer Centro Yocalti
Fagocitosis
Andrés Montesinos Hospital Veterinario Los Sauces
Figura 9. Piogranuloma degenerado.
Figura 10. Necrosis celular.
*Formación no reglada
Cascada de las caspasas
Letizia Fiorucci Vet4pets Bicester Gabriel Alcántara Faunia Marino García Montijano Clínica Taimyr
Neus Morera Consultora en medicina y cirugía de animales exóticos Andrés Montesínos Hospital veterinario Los Sauces
Clínica Veterinaria Exotely