6
Nuevos agentes etiológicos en porcino
SENECAVIRUS A EN GANADO PORCINO Se trata de un virus patógeno emergente en el ganado porcino. En este artículo se proporciona información Matthew Sturos y Fabio Vannucci Laboratorio de Diagnóstico Veterinario Universidad de Minnesota Saint Paul, Minnesota (EE. UU.) Imágenes cedidas por los autores Senecavirus A (SVA) es la única especie del género Senecavirus de la familia Picornaviridae y se trata de un virus patógeno emergente en el ganado porcino (Segalés et al., 2017). Ensayos experimentales en cerdos han demostrado que el SVA puede causar enfermedad vesicular en cerdos; esta presentación de la enfermedad tiene un particular interés porque es indistinguible de otras enfermedades vesiculares transfronterizas reguladas como la fiebre aftosa (Chen et al., 2016; Joshi et al., 2016; Montiel et al., 2016). SVA también se ha asociado con diarrea y aumento de la mortalidad en lechones jóvenes en granjas de madres naturalmente infectadas que se ha denominado mortalidad neonatal epidémica transitoria (ENTL), pero este fenómeno no se ha reproducido experimentalmente todavía (Vannucci et al., 2015; Canning et al., 2016; Leme et al., 2016).
Caracterización del virus El SVA se caracterizó por primera vez en un laboratorio de investigación en 2002 como un virus contaminante que causaba efectos citopáticos inesperados en una línea celular humana. Se le denominó Seneca Valley-001 (SVV-001), en honor al parque estatal Seneca Creek, situado cerca del laboratorio de investigación (Hales et al., 2008; Segalés et al., 2017). Este efecto citopático se ha documentado en tumores neuroendocrinos humanos
general sobre el virus y el conocimiento actual de la patogénesis y las características de la enfermedad.
y, por lo tanto, SVA se ha investigado como posible inmunoterapia en medicina humana (Rudin et al., 2011). Las investigaciones genéticas y estructurales del SVV-001 revelaron que el virus no presenta envoltura, tiene una cápside icosaédrica de entre 27 nm y 32,5 nm de diámetro y contiene un genoma (+) ssRNA no segmentado de aproximadamente 7.300 pb (Hales et al., 2008; Venkataraman et al., 2008). Basado en el análisis de secuencia, SVA está emparentado en su mayoría con los miembros del género Cardiovirus, entre los que se encuentra el virus de la encefalomiocarditis, y más lejanamente relacionado con otros picornavirus importantes que afectan al ganado porcino, como el virus de la fiebre aftosa (FMDV) o Teschovirus A (Hales et al., 2008). Hay cuatro proteínas estructurales que forman la cápside: VP1, VP2 y VP3, que componen la superficie de la porción expuesta, y VP4, que se encuentra internamente (Venkataraman et al., 2008).
La enfermedad vesicular Después de la caracterización de SVA, la investigación retrospectiva de virus tipo picorna previamente aislados de tejidos porcinos en los EE. UU. documentó que el virus había estado presente en el ganado porcino estadounidense desde al menos 1988 (Knowles et al., 2005). El primer informe publicado de la enfermedad en cerdos asociada con SVA fue una descripción de la enfermedad vesicular idiopática en una carga de cerdos finalizados de Manitoba (Canadá), que se presentaron para su inspección antes del sacrificio en Minnesota en 2007. Los
La enfermedad vesicular en cerdos tiene un particular interés porque es indistinguible de otras enfermedades vesiculares transfronterizas reguladas como la fiebre aftosa.
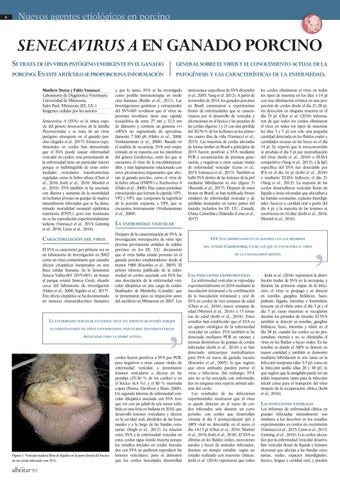
Figura 1. Vesícula madura llena de líquido en la parte dorsal del hocico de un cerdo infectado con SVA.
’212
cerdos fueron positivos a SVA por PCR, pero negativos a otras causas virales de enfermedad vesicular, y presentaron lesiones vesiculares o úlceras en las pezuñas (25-30 % de los cerdos) o en el hocico (6,4 %), y el 80 % mostraba cojera (Pasma, Davidson y Shaw, 2008). Un segundo informe de enfermedad vesicular idiopática asociada con SVA tuvo que ver con un jabalí de seis meses exhibido en una feria en Indiana en 2010, que desarrolló lesiones vesiculares y úlceras en la cavidad oral, alrededor de las fosas nasales y a lo largo de las bandas coronarias (Singh et al., 2012). La relación entre SVA y la enfermedad vesicular en estos cerdos sigue siendo incierta porque los estudios iniciales en cerdos inoculados con SVA no pudieron reproducir las lesiones vesiculares, pero se demostró que los cerdos inoculados desarrollan
anticuerpos específicos de SVA (Knowles et al., 2005; Yang et al. 2012). A partir de noviembre de 2014, los ganados porcinos en Brasil comenzaron a experimentar brotes de enfermedades que se caracterizaron por el desarrollo de vesículas y ulceraciones en el hocico y las pezuñas de las cerdas (figuras 1 y 2) con una pérdida del 30-70 % de los lechones en los primeros cuatro días de vida (Vannucci et al., 2015). Las muestras de cerdas afectadas de forma similar en Brasil a principios de 2015 fueron positivas a SVA mediante PCR y secuenciación de próxima generación, y negativas a otras causas virales de enfermedad vesicular (Leme et al., 2015; Vannucci et al., 2015). También se halló SVA dentro de las lesiones de la piel mediante hibridación in situ (figura 3) (Resende et al., 2017). Después de estos brotes en Brasil, se han notificado brotes similares de enfermedad vesicular y de pérdidas neonatales en varios países del mundo, incluidos los EE. UU., Canadá, China, Colombia y Tailandia (Leme et al., 2017).
los cerdos eliminaron el virus en todos los tipos de muestra en los días 1-14 pi con una eliminación errática en una proporción de cerdos desde el día 21-28 pi, sin detección en ninguna muestra en el día 35 pi. Chen et al. (2016) informaron de que todos los cerdos eliminaron el virus en todos los tipos de muestras los días 3 y 7 pi con solo una pequeña cantidad detectada en los fluidos orales y cantidades escasas en las heces en el día 14 pi. Se reportó que la seroconversión se produjo el día 5 pi por neutralización del virus (Joshi et al., 2016) o ELISA competitivo (Yang et al., 2012), y la IgG específica del SVA fue detectable por IFA en el día 10 pi (Joshi et al., 2016) o mediante ELISA indirecto el día 21 (Yang et al., 2012). La mayoría de los cerdos desarrollaron vesículas llenas de líquido o áreas ulceradas que afectaban a las bandas coronarias, espacios interdigitales, hocicos o cavidad oral a partir del día 4 pi, y la mayoría de las lesiones se resolvieron en 10 días (Joshi et al., 2016; Montiel et al., 2016).
SVA está emparentado en su mayoría con los miembros del género Cardiovirus, entre los que se encuentra el virus de la encefalomiocarditis.
Las infecciones experimentales
La enfermedad vesicular se reprodujo experimentalmente en 2016 mediante la inoculación intranasal o la combinación de la inoculación intranasal y oral de SVA en cerdos de tres semanas de edad (Chen et al., 2016), nueve semanas de edad (Montiel et al., 2016) o 15 semanas de edad (Joshi et al., 2016). Estos estudios han establecido que el SVA es un agente etiológico de la enfermedad vesicular en cerdos. SVA también se ha detectado mediante PCR en ratones y moscas domésticas de granjas de cerdas infectadas (Joshi et al., 2016) y se han detectado anticuerpos neutralizantes para SVA en suero de ganado vacuno (Knowles et al., 2005), lo que sugiere que otros animales pueden portar el virus o infectarse. Sin embargo, SVA aún no se ha asociado con enfermedades en ninguna otra especie animal además del cerdo. Los resultados de las infecciones experimentales mostraron que el virus se puede detectar en el suero de cerdos infectados solo durante un corto periodo, con cerdos que desarrollan viremia el día 3 posinoculación (pi) y ARN viral no detectable en el suero el día 14-15 pi (Chen et al., 2016; Montiel et al., 2016; Joshi et al., 2016). El SVA se elimina en los fluidos orales, secreciones nasales y heces de animales infectados, durante un tiempo variable, según un estudio realizado con muestras clínicas. Joshi et al. (2016) reportaron que todos
Joshi et al. (2016) reportaron la distribución tisular de SVA en la necropsia, y durante las primeras etapas de la infección, el virus se propagó y se detectó en tonsilas, ganglios linfáticos, bazo, pulmón, hígado, intestino e intermitentemente en el riñón entre el día 3 pi y el día 7 pi, cuyas muestras se recogieron durante los periodos de viremia. El SVA también se detectó en tonsilas, ganglios linfáticos, bazo, intestino y riñón en el día 38 pi, cuando los cerdos ya no presentaban viremia y no se eliminaba el virus en los fluidos o heces orales. En las tonsilas es donde el ARN se detectó en mayor cantidad y también se demostró mediante hibridación in situ tanto en la infección temprana (días 3-7 pi) como en la infección tardía (días 28 y 38 pi), lo que sugiere que la amígdala puede ser un tejido importante tanto para la infección inicial como para el transporte del virus después de la recuperación clínica (Joshi et al., 2016).
Las infecciones naturales
Los informes de enfermedad clínica en granjas infectadas naturalmente son similares a los descritos en los estudios experimentales en cerdos en crecimiento (Vannucci et al., 2015; Leme et al., 2015; Canning, et al., 2016). Los cerdos afectados por la enfermedad vesicular desarrollan vesículas llenas de líquido y lesiones ulcerosas que afectan a las bandas coronarias, suelas, espacios interdigitales, hocico, lengua y cavidad oral, y pueden