






In deze module leer je onder andere hoe macromoleculen gemaakt worden uit aardolie. Maar wist je ook dat producten op basis van aardolie ook in onze voeding zitten?
Als goedkoper alternatief op de dure vanillestokjes, bestaat er vanillearoma op basis van aardolie. De meeste producten met vanillesmaak in de supermarkt bevatten geen echte vanille, maar een synthetische variant.

Scan de QR-code en bekijk het fragment over de ware aard van vanillesmaak.
Vind je dat producenten zomaar een afbeelding van vanillestokjes mogen gebruiken als er geen echte vanille in hun product zit? En denk je dat je het verschil kan proeven tussen echte vanille en synthetisch vanillearoma?

In de koolstofchemie worden reacties aan het koolstofatoom bestudeerd. Koolstofverbindingen bestaan uit bindingen tussen koolstofatomen. Als vele koolstofatomen aan elkaar binden tot koolstofketens ontstaan macromoleculen. De grote verscheidenheid aan koolstofverbindingen en de verschillende mogelijkheden waarbij koolstofatomen aan elkaar binden in ketens en ringstructuren kunnen verklaard worden aan de hand van de specifieke eigenschappen van het C-atoom. De verschillende soorten koolstofverbindingen bestudeert men in de koolstofchemie.
De koolstofchemie wordt nog vaak verkeerdelijk de organische chemie genoemd omdat men in de eerste helft van de 20ste eeuw alleen koolstofverbindingen kende afkomstig van levende wezens.
De elektronenverdeling van het koolstofatoom: 2elektronen op de K-schil, 4 elektronen op de L-schil
Het C-atoom gedraagt zich verschillend in vergelijking met de andere atomen die tot de groep niet-metalen behoren.
• Koolstof kan een octetstructuur aangaan door 4 elektronen op te nemen, 4 elektronen af te staan of 4 elektronen gemeenschappelijk te stellen om chemische bindingen aan te gaan.
• Koolstof kan enkelvoudige bindingen aangaan met zichzelf en/of andere atomen, maar ook dubbele en drievoudige bindingen.
• Koolstof kan bindingen aangaan met andere koolstofatomen en daardoor lange ketens vormen (vertakt en onvertakt).
Vertakte keten van koolstofatomen (voorstelling in skeletstructuur)
Skeletstructuur van testosteron
• Koolstof kan ringvormige structuren maken bestaande uit koolstof- en heteroatomen. Als in de ring(en) dubbele bindingen en heteroatomen zijn opgenomen, dan krijgt deze ringstructuur specifieke chemische eigenschappen.
De combinatie van al deze eigenschappen zorgt ervoor dat er veel verschillende koolstofverbindingen zijn, zowel in de biologische wereld als in de chemie. Bovendien kan men door inzicht en kennis van de chemische structuur van bestaande koolstofverbindingen en biomoleculen nieuwe producten maken die toepassingen vinden in de geneeskunde, de biochemie, de kunststoffen en de biomaterialen.
1.1.2Voorstellingen van koolstofverbindingen
• Je kan moleculen voorstellen met behulp van de brutoformule (BF). Deze geeft aan hoeveel atomen van elke soort in de molecule opgenomen zijn.
Voorbeeld: C6H14
Deze BF geeft zeer weinig informatie over de structuur van de molecule, je kan hiermee niet te weten komen op welke manier de atomen aan elkaar gebonden zijn. Je kent alleen het aantal atomen en de soort atomen in de molecule.
• Daarom gebruikt men vaak een duidelijkere formule voor koolstofverbindingen: de structuurformule (SF).
Voorbeeld:
Structuurformule van C6H14 Je ziet een keten van 6 koolstofatomen die met elkaar enkelvoudig gebonden zijn. Elk koolstofatoom is ook nog eens gebonden aan een aantal waterstofatomen.
• Wil men de structuur van een molecule beknopter aangeven, dan gebruiken we de skeletnotatie:
We schrijven alleen de bindingen tussen de koolstofatomen. We noteren geen homoatomen (C en H).
We noteren wel heteroatomen (O, S, P, N, …). We noteren bindingen met heteroatomen.
Voorbeelden:
Skeletnotatie van C6H14 (alkaan - hexaan)
Skeletnotatie van C5H12O (ether - ethoxypropaan)
Skeletnotatie van C2H3CI (halogeenalkeen - vinylchloride of monochlooretheen)
Skeletnotatie van C7H14O2 (ester - propylbutyraat)
Om inzicht in de koolstofverbindingen te verwerven, is het noodzakelijk dat je ook basiskennis hebt over de andere minerale verbindingen (die je vorige jaren hebt leren kennen). Inzicht begint bij indelen (weten in welke groep bepaalde stoffen thuishoren).



We herhalen de indeling van de chemische zuivere stoffen zoals we dit gezien hebben in de vorige jaren.
INDELING VAN (ZUIVERE) STOFFEN
Metalen

Palladium, goud, zilver en platina Niet-metalen

Zuivere Stoffen
Enkelvoudige stoffen (bestaan uit 1 atoomsoort)
Koolstof Fosfor Zwavel Edelgassen
Zuivere Stoffen
Samengestelde stoffen (bestaan uit meerdere atoomsoorten)
Minerale verbindingen (anorganische stoffen): oxiden, zuren, hydroxiden, zouten


Koolstofverbindingen (organische stoffen)
Als we de (niet-ringvormige) koolstofverbindingen indelen, kunnen ze ingedeeld worden volgens de specifieke groepen atomen of “functionele groepen” die in de moleculen voorkomen. De ervaring en experimenten met koolstofverbindingen hebben ons geleerd dat de “chemische” structuur van moleculen bepalend is voor de specifieke chemische eigenschappen van deze moleculen. Daarom worden koolstofverbindingen ingedeeld met als criterium de chemische structuur.

Dit zijn (C,H)-verbindingen die bestaan uit koolstofatomen enkelvoudig aan elkaar gebonden en omgeven door waterstofatomen. Deze moleculen hebben geen specifieke functionele groepen en zijn daarom weinig chemisch reactief. Het zijn ofwel gassen of vluchtige vloeistoffen (tot C10), ofwel vaste stoffen (met vele C-atomen). Ze worden gebruikt als oplosmiddel voor vetten (wasbenzine) en als brandstoffen.
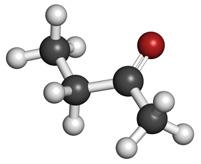
Voorbeeld 2: Alcoholen (alkanolen)
C2H5OH ethanol
Deze moleculen hebben een functionele groep –OH (hydroxylgroep). Die is verantwoordelijk voor anderechemische eigenschappen in vergelijking met alkanen. Als vloeistof hebben ze een hoger kookpunt als de overeenkomstige alkanen omdat ze onderling krachten op elkaar uitoefenen. Deze intermoleculaire krachten tussen ethanolmoleculen noemt men H-bruggen. Zo ontstaat een netwerk waarin de moleculen gevangen zitten. Dat verklaart het hoger kookpunt van alcoholen.
Voorbeeld 3: Alkenen
C2H4 etheen
Deze moleculen hebben als functionele groep een dubbele binding tussen 2 koolstofatomen. Deze dubbele binding is minder stabiel dan een enkelvoudige binding en daarom zijn alkenen chemisch reactiever dan alkanen. In de etheenmolecule (monomeer) is één van de dubbele bindingen reactiever. Zo kan een etheenmolecule gemakkelijk met een andere etheenmolecule een binding aangaan (vorming van een dimeer). Als dit proces zich vele malen herhaalt, ontstaat een polymeer. De chemische eigenschappen van het monomeer (aanwezigheid van een dubbele binding) bepalen de toepassingsmogelijkheid van deze molecule.
De structuur van moleculen en de specifieke functionele groepen die in de molecule aanwezig zijn bepalen de chemische eigenschappen van de moleculen.
Dankzij inzicht in de structuur en de functionele groepen van moleculen kan men nieuwe moleculen en nieuwe toepassingsmogelijkheden creëren.
Kennis en inzicht in structuren in moleculen en daarmee verbonden specifieke chemische reacties zijn een uitdaging voor de ontwikkelingen in de chemische industrie.
Deze kennis en dit inzicht kunnen gebruikt worden bij:
De productie en de recyclage van kunststoffen. Dit leidt tot een meer duurzame chemie (afval wordt gebruikt als productiemateriaal voor nieuwe kunststoffen).
De productie van biodegradeerbare of composteerbare bioplastics zodat de afvalberg op aarde gereduceerd wordt (zie later).
De koolstofverbindingen kunnen verder ingedeeld worden volgens de aanwezigheid van de verschillende atoomsoorten en volgens de aanwezige functionele groepen.
Gebruik de QR-code om de determinatietabel voor monofunctionele koolstofverbindingen te bekijken.
Monofunctioneel betekent dat de stof maar 1 functionele groep bevat. We zullen later voorbeelden geven van bifunctionele verbindingen (deze bevatten 2 functionele groepen). Bv. aminozuren, hydroxycarbonzuren.
Zoek aan de hand van de determinatietabel de stofklasse waartoe volgende verbindingen behoren en geef de brutoformule van deze stoffen.
a CH3 CH2 COOH
b CH2 CICHCI CH3
c CH3 CH2 CH2 CHOH CH3
d CH3 CH2 C
CH2 CH3
e CH3 CH2 CHNH2 CH2 CH3
f CH3 CH CH3 CH2 C
g CH3 CH2 C
CH2 CH3
h CH3 C CI CH2 COOH i CH3 CH2 C
We weten dat koolstofverbindingen functionele groepen bezitten waardoor ze bepaalde karakteristieke chemische eigenschappen vertonen. Dit verklaart ook waarom ze bepaalde toepassingsmogelijkheden hebben.
Hieronder geven we enkele voorbeelden van de gekendste toepassingen van koolstofverbindingen in het dagelijks leven. Via de QR-code kun je een uitgebreid overzicht bekijken met meerdere voorbeelden.
• Ethanol is een kleurloze vloeistof die zeer goed oplosbaar is in water. Het wordt gebruikt als bestanddeel in alcoholische dranken.

Het wordt ook gebruikt in desinfecterende ontsmettingsmiddelen

• Methanol is een zeer giftige, kleurloze vloeistof. Het is zeer goed oplosbaar in water.

Het wordt gebruikt als brandstof voor fondue of gourmetstelletjes.
Het wordt ook gebruikt als oplosmiddel en als basisproduct in de organische chemie wegens grotere reactiviteit.
• Etheen is een plantenhormoon dat de rijping van vruchten bevordert. Zuiderse vruchten worden onrijp getransporteerd en nadien op de eindbestemming behandeld met etheen.
Het is ook het monomeer bij chemische productie van plasticfolie (polymeren) zoals PE.




• Methaanzuur of mierenzuur is een kleurloze prikkelende vloeistof die de huid kan aantasten.
Mieren, bijen en wespen scheiden deze stof af wanneer ze steken of bijten.
Brandnetels zijn verantwoordelijk voor het brandend gevoel dat ontstaat wanneer je in contact komt met deze plant.

• Huishoudazijn is een 7% oplossing van azijnzuur in water.
Het wordt gebruikt als conserveringsmiddel en smaakverbeteraar in gerechten met een zure smaak.
• Esters zijn aanwezig in vruchten en groenten, in geurstoffen en parfums, in kruiden en specerijen. Ze ontstaan door een condensatiereactie tussen een alkaanzuur en een alcohol (verestering). Dit geeft meestal een uniek aroma als resultaat.
Voorbeelden
• Butylmethionaat: framboosaroma
• Pentylacetaat: banaanaroma
• Benzylacetaat: vanillearoma
Mag op een yoghurtpotje een afbeelding van de betreffende vrucht staan wanneer alleen aroma (ester van die vruchtensmaak) is toegevoegd? Wanneer moeten producenten het woord ‘smaak’ vermelden?

Als het product écht fruit bevat (of fruitextract, fruitconcentraat of fruitsap), dan mag het fruit op de verpakking afgebeeld worden.
Bij gebruik van een aroma (bv. ester van aardbeismaak) zonder toevoeging van fruit, mag de afbeelding van de fruitsoort op de verpakking staan onder voorwaarde dat in de nabijheid het woord ‘smaak’ komt te staan.
Als echt fruit wordt gebruikt in combinatie met een aroma, mag de fruitsoort zonder meer afgebeeld worden op de verpakking. Het toevoegen van de vrucht (of sap, concentraat of extract) geeft namelijk meestal daadwerkelijk extra smaak aan de yoghurt.
Toen
Leo
in 1907
werd met het kunsthars bakeliet, werd de weg geopend voor een nieuwe industrie, nl. deze van de synthetische materialen. Deze synthetische materialen, ook kunststoffen genoemd, worden gebruikt voor het vervaardigen van o.a. verpakkingen, bouwmaterialen, huishoudartikelen, textiel, lijmen, verven en autoonderdelen.


De kunststoffen zijn uit ons dagelijks leven haast niet meer weg te denken. Denk maar aan lichtkoepels van plexiglas, grammofoonplaten van pvc, braadpannen met een bekleding van teflon, kledingstukken van Terlenka, enz.

Macromoleculen zijn niet meer weg te denken uit ons dagelijkse leven. We gebruiken macromoleculen in allerhande toepassingen in het dagelijkse leven:
• huishouden: verpakkingsmaterialen
• inrichting: zetels, bedden, kasten, tapijten
• vervoer: een auto bestaat uit vele kunststofonderdelen
• bouw: afvoerpijpen, vloerbedekking, isolatiematerialen, verven, lakken, plastic



In deze module gaan we uitleggen waarom we aan macromoleculen een apart hoofdstuk besteden in de chemielessen. De studie van dit soort moleculen is zeer uitgebreid, zeer innovatief en in een voortdurende ontwikkeling. Elke dag worden er nieuwe macromoleculen ontwikkeld om de kwaliteit, de milieuvriendelijkheid, de recycleerbaarheid en de toepassingsmogelijkheden te verbeteren.
Macromoleculen kunnen chemisch opgedeeld worden in 2 grote groepen: kunststoffen en biomoleculen
• Kunststoffen zijn ontwikkeld vanaf de jaren 1950 en hebben als basisproduct aardolie. Het zijn de zogenaamde klassieke plastics.
• Biomoleculen zijn de macromoleculen die in levende cellen aanwezig zijn. Ze worden in de levende cel, tijdens de stofwisseling gemaakt of afgebroken uit basiseenheden (of monomeren) in de cel zelf.
Nucleïnezuren, lipiden, sachariden en proteïnen
Koolstof kan vele complexe verbindingen vormen. De studie van deze verbindingen is complex en uitgebreid en gestart in de naoorlogse jaren. Door de opkomst van de auto als vervoermiddel in de jaren 1950 en later, werd er in de petrochemische industrie onderzoek gedaan naar het raffineren van aardolie in verschillende fracties zodat die kunnen gebruikt worden als brandstof. Anderzijds experimenteerde men om nieuwe stoffen te vervaardigen die niet in de natuur voorkomen maar ons dagelijkse leven eenvoudiger maakten. Dat waren de eerste plastics of klassieke kunststoffen.
Momenteel hanteert men als definitie voor kunststoffen de volgende criteria:
Stoffen die opgebouwd zijn uit koolstofatomen (ook wel koolstofverbindingen of organische stoffen genoemd)
Stoffen bestaande uit moleculen opgebouwd uit minstens 10000 atomen (macromoleculen)
Kunststoffen (bioplastics) die ontstaan via een chemisch proces door wijziging van natuurproducten (voorbeelden 1 en 2)


Klassieke kunststoffen die ontstaan door synthese uit grondstoffen afkomstig uit aardolie (voorbeelden 3 en 4)
Voorbeeld 1: Rubber
Natuurlatex Gevulkaniseerd synthetisch rubber
Rubber kan verkregen worden door de transformatie van de latex die door bepaalde planten wordt afgescheiden (natuurlijk rubber), ofwel synthetisch uit monomeren afkomstig van aardolie (synthetisch rubber).


Latex werd ontdekt door de Azteken. In die tijd gebruikten ze de hars van een boom, de rubberboom, om stoffen waterdicht te maken.
In 1839 ontdekte Charles Goodyear per ongeluk hoe de latex te stabiliseren zodat het beter bestand is tegen temperatuursveranderingen. Door het materiaal met zwavel uit te harden, ontstaan er bruggen tussen moleculaire ketens. Dit proces, dat vulkanisatie wordt genoemd, transformeert de eigenschappen van latex, waardoor het ongevoeliger is voor temperatuurschommelingen met behoud van zijn flexibiliteit en elasticiteit. Met deze kwaliteiten werd rubber gebruikt voor het maken van laarzen, kleding, doppen ...
De uitvinding van de ventielautoband in 1888 door John Dunlop zorgde voor het ontstaan van de rubberindustrie. In Duitsland aan het begin van de 20ste eeuw fabriceerde men synthetisch rubber met als basisproduct aardolie voor de autobandenindustrie.
Margarine is een product dat ontstaan is uit olie door een chemische reactie (hydrogenatie, dat is een reactie waarbij de dubbele binding wordt omgezet in een enkelvoudige binding). Dit product is vaster dan olie en toch nog minder hard dan boter. In de koelkast is het product hard en op de eettafel is het zachter. Vandaar de benaming ‘koelkastsmeerbaar’.

Voorbeeld 3: Polyetheen (PE)

Polyetheen is de meest gebruikte kunststof ter wereld. Het wordt gebruikt voor de vervaardiging van buizenenafsluiters voor water-, riolerings-, ventilatie- en verwarmingssystemen, containers voor vloeistoffen, chemicaliën, … Ook de oudere naam polyethyleen wordt gebruikt, voornamelijk door de producenten en verbruikers van deze kunststof.


Het basisproduct is etheen (C2H4), een product afkomstig uit de destillatie van aardolie. De kunststof PE ontstaat doordat de basismoleculen (monomeer) etheen reageren met elkaar en zo een lange molecule (polymeer) vormen.

De macromoleculen die zo ontstaan, zijn lange ketens die niet onderling verbonden zijn, maar bij temperatuursverhoging kunnen bewegen: de kunststof is een thermoplast
Voorbeeld 4: Bakeliet
Bakeliet (of fenolhars), de eerste volledig synthetische kunststof, werd vooral rond het midden van de 20ste eeuw veel gebruikt. Bakeliet is genoemd naar de uitvinder van deze kunststof, de Gentse chemicus Leo Baekeland. De kunststof kende talloze toepassingen vanaf de jaren 1950 tot 1980 en werd onder andere gebruikt in elektrische isolatie, hittebestendige handvatten, doppen en deksels.
De macromoleculen vormen een netwerk waardoor de kunststof bij temperatuursverhoging niet plastisch wordt: de kunststof is een thermoharder

Aardolie, soms petroleum genoemd, is naast aardgas, een van de fossiele brandstoffen. Het is een brandbare vloeistof die bestaat uit een mengsel van koolwaterstoffen dat over miljoenen jaren is ontstaan uit organische resten (afgestorven plankton) die zich op de zeebodem hadden afgezet.


Deze aardolie wordt uit de bodem opgehaald via boortechnieken en via schepen en pijpleidingen vervoerd naar de chemische industrie. In de chemische industrie wordt deze ruwe olie gescheiden in een aantal fracties in een destillatiekolom. De lichtste fractie bevat de kleinste moleculen (moleculen met enkele koolstofatomen) en die bevinden zich bovenaan in de fractioneerkolom. Deze kleinste moleculen worden gebruikt om kunststoffen te maken met behulp van chemische reacties.
De ruwe aardolie wordt onderaan in de destilleerkolom gebracht en verwarmd. De kleine moleculen (met 2 tot 4 C-atomen) stijgen het vlugste omhoog (zij hebben het laagste kookpunt) en belanden helemaal bovenaan in de destilleerkolom. Daar kunnen ze als een aparte fractie opgevangen worden en verder gebruikt en gezuiverd worden.
De kleine moleculen die in deze fractie aanwezig zijn noemt men monomeren. De monomeren kunnen onderling (onder specifieke omstandigheden) met elkaar reageren en zo ontstaat een lange keten van monomeren: dat is een macromolecule of een polymeer Deze polymeren kunnen macroscopisch in een bepaalde vorm gebracht worden en zo ontstaat een kunststofproduct. Na afkoelen ontstaat een voorwerp dat bruikbaar is als o.a. verpakkingsproduct, weefsel, lak, vernis, … Algemeen noemt men het eindproduct het kunststofproduct
De chemische structuur van de kunststof bepaalt de fysische eigenschappen van de kunststof en dus ook de toepassingsmogelijkheden. Met als criterium de structuur van de kunststof kan je de kunststoffen indelen in 3 groepen: thermoplasten, thermoharders en elastomeren.
Deze kunststoffen zijn opgebouwd uit lineaire ketens die onderling chemisch niet verbonden zijn. Tussen de ketens onderling bestaan zwakke aantrekkingskrachten.
Ze kunnen bij hogere temperaturen plastisch vervormd worden. Door verwarmen kunnen ze de gewenste vorm aannemen.

Voorbeeld 1: Polyetheen (PE)
De kunststof polyetheen is momenteel een zeer populaire kunststof, omwille van de volgende redenen:
• PE is sterk, slijtvast en goedkoop.
• Afhankelijk van de gebruikte grondstoffen, kan PE worden gebruikt tot een temperatuur van 70 tot 90 °C
• PE is uiterst duurzaam (door het toevoegen van additieven tijdens het productieproces) en UV-bestendig.
• PE is nauwelijks onderhevig aan corrosie of oxidatie.
• PE is daarnaast goed te recyclen, want als thermoplast kan het worden omgesmolten en hergebruikt.
Voorbeeld 2: Polyvinylchloride (pvc)

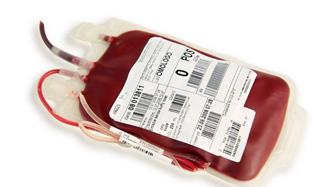

In de geneeskunde heeft pvc glasgrotendeels verdrongen en wordt het vooral gebruikt bij vooraf gesteriliseerde voorwerpen. Deze stof is zeer chemisch stabiel, chemisch inert en flexibel vervormbaar. Daarom wordt het gebruikt als infuuszakmateriaal en bloedzakmateriaal.
In de bouw- en auto-industrie wordt pvc veelvuldig toegepast in constructies, riolering, dashboards en vloeren.

Voorbeeld 3: Nylon

Nylon was de eerste commercieel succesvolle synthetische vezel. Het wordt gebruikt voor kleding omdat het gemakkelijk te reinigen is en gemakkelijk droogt. Het wordt ook gebruikt voor koorden en touwen omdat het sterk materiaal is.




Voorbeeld 4: Polyester

Ook zacht polyester wordt gebruikt in kleding.


De lineaire ketens van deze kunststoffen zijn chemisch onderling verbonden in ingewikkelde driedimensionale netwerken.
De lineaire ketens kunnen ten opzichte van elkaar niet verschuiven of bewegen. Deze stoffen blijven dan ook na verwarming hard en zijn niet vervormbaar door temperatuursverhoging.

Voorbeeld 1: Bakeliet
Aan de schematische tekening van het molecuulmodel zie je dat bakeliet een netwerk vormt. Door deze opbouw is bakeliet eenthermoharder. Een thermoharder is een kunststof die bij verhoging van temperatuur eerder uiteenvalt dan zacht wordt. Een thermoharder kan daardoor niet worden gebogen of vervormd. Een product moet direct in de definitieve vorm worden gemaakt.
Voorbeeld 2: Melamineformaldehyde (MF)
Melamineformaldehyde wordt gebruikt als het duurdere camping- en kinderservies. Ook in de jaren 1950 en 1960 werd deze kunststof gebruikt om serviezen en keukenmateriaal te vervaardigen.




Het werd veel gebruikt in de vorm van een laminaat. Hierbij wordt papier of linnen gedrenkt in een hars van MF en ontstaat een hard materiaal (bv. formica). Na de Tweede Wereldoorlog werd formica gebruikt als bedekking van stoelen, tafels en kasten omdat het gemakkelijk afwasbaar was en in vele kleuren verkrijgbaar.


Voorbeeld 3: Polyesterharsen

Vernissen en lakken op basis van thermoharders weerstaan aan hevige weersomstandigheden. Daarom wordt polyesterhars gebruikt om boten te lakken en te repareren bij scheuren. Polyesterhars wordt ook gebruikt om zwembaden te coaten.
Elastomeren hebben ook een driedimensionale structuur waarbij de lineaire ketens met elkaar chemisch verbonden zijn. De ketens zitten echter niet in een stevig driedimensionaal netwerk waardoor de bewegingsvrijheid van de ketens behouden blijft. De kunststof is elastisch omdat lineaire ketens maar hier en daar aan elkaar verankerd zijn.

Voorbeeld: Rubber
Het bekendste voorbeeld van een elastomeer is rubber. De naam komt van het Engelstalige werkwoord voor wrijven (to rub), verwijzend naar hetuitgommen van potloodlijnen.
Om zachte rubber te verkrijgen uit latex (bestaande uit lineaire ketens, plastisch en zeer vervormbaar) wordt latex chemisch behandeld met zwavel zodat er zwavelbruggen gelegd worden tussen de ketens. Dit proces heet vulkanisatie. Zo ontstaat een vast materiaal dat goed vervormbaar is.
Een gum of vlakgom is hier een toepassing van. Hiermee kun je (door wrijven) lijnen of teksten verwijderen die met potlood zijn gemaakt. Voor het verwijderen van inkt is een hardere gum nodig dan voor het verwijderen van potloodstrepen.
Latex nog meer vulkaniseren met zwavel geeft een product dat minder vervormbaar, maar wel nog elastisch is. Het is na deze behandeling dat rubber kan gebruikt worden als autoband



Bij nog verder doorgevoerde vulkanisatie van rubber gaat de beweeglijkheid van de ketens onderling verloren omdat er nog meer zwavelbruggen gevormd worden en zo ontstaat een thermoharder. Deze kunststof noemt men eboniet

Toepassingen van eboniet: een wapenstok (gummiknuppel) en mondstukken voor saxofoons en klarinetten
Polymerisatie is een chemisch proces (met behulp van speciale katalysatoren) waarbij het monomeer een kleine bouwsteen is die één dubbele binding bevat. Tijdens de chemische reactie klapt de dubbele binding open en reageren de kleine moleculen met elkaarzodat de monomeren aan elkaar gaan hangen en lange ketens vormen. Zo ontstaat een polymeerketen. Bij deze chemische reactie ontstaat geen enkel nevenproduct.
Voorbeeld 1: De vorming van PE
n kanvan1000tot50000variëren
Voorbeeld 2: De vorming van PVC
n C H H C Cl H Vinylchloride (chlooretheen)
Voorbeeld 3: De vorming van latex
n C C H2 C H3 C H CH2
2-methyl-1,3-butadieenofisopreen
2.5.2Polycondensatie
C H H C Cl H ên Polyvinylchloride(PVC)
C C H2 C H3 C H CH2
Polycondensatie is een chemisch proces waarbij het onderling verbinden van een groot aantal monomeren gepaard gaat met de afsplitsing van een kleine molecule (water).
Voorbeeld 1: Vorming van PET plastic
Deze kunststof wordt onder andere gebruikt voor recycleerbare petflessen.
Voorbeeld 2: Vorming nylon 6,6

Nylon 6,6 is een van de meest gebruikte synthetische vezels in de textielindustrie.





Polyadditie is een chemisch proces waarbij een chemische reactie gebeurt tussen de karakteristieke groepen van de monomeren zonder afsplitsing van een kleine molecule

Voorbeeld: Vorming van polyurethaan (PUR)
Polyurethaan wordt gebruikt als isolatie, en ook voor vastzetten van deuren en ramen.
PUR kan ook gebruikt worden bij 3D-printen. Een veelgebruikte methode bij 3D-printen is het gebruikmaken van een fijn poeder (polyurethaan, polyester, epoxy-bioplastics) waarbij er telkens lagen van dit poeder met elkaar verbonden worden, waarna deze een vaste vorm aannemen.




























Het is belangrijk dat we de afvalberg van de kunststoffen zo klein mogelijk maken. Dit kan alleen door zo weinig mogelijk weg te gooien en zoveel mogelijk te recycleren. Klassieke kunststoffen zijn milieuvreemde stoffen en zullen in de kringloop van de biologische processen op aarde niet afgebroken worden.
Gekleurde plastickorrels worden in de industrie gebruikt om plastic producten van te maken, maar dagelijks komen er miljarden van deze korrels in het milieu terecht.

Daarom moeten we kritisch kijken naar ons gebruik van kunststoffen, ze hergebruiken en recycleren. Indien ze als restafvalstof uiteindelijk moeten verbrand worden omdat een andere toepassing niet meer mogelijk is, dan is energierecuperatie van deze verbrandingsprocessen aangeraden om het milieu zo weinig mogelijk schade te berokkenen. Slechts in laatste instantie mogen we het restafval storten.
Klassieke plastics zijn niet afbreekbaar in de natuur. Het duurt vele jaren vooraleer weggegooide plastic materialen omgezet zijn in microplastics. Als we de geproduceerde plastics als “grondstof” hergebruiken, dan worden nieuwe materialen geproduceerd met een veel kleinere negatieve milieuimpact.



In een circulaire economie zijn er twee streefdoelen in verband met de productie van plastics:
Het gebruik van nieuwe grondstoffen zoveel mogelijk vermijden
Het incorporeren van gerecycleerd materiaal in nieuwe producten
In de module ‘Duurzame chemie’ van Isaac-natuurwetenschappen 6 gaan we uitgebreid in op de impact van kunststoffen op onze planeet. Met een kritische blik evalueren we het gebruik van plastics in ons dagelijks leven en gaan we op zoek naar alternatieven.
NUCLEIC ACIDS
LIPIDS NUCLEIC ACIDS
LIPIDS
CARBOHYDRATESPROTEINS
NUCLEIC ACIDS
CARBOHYDRATESPROTEINS
LIPIDS
CARBOHYDRATESPROTEINS
NUCLEIC ACIDS
Cellen bevatten 4 grote families biopolymeren: sachariden (of koolhydraten), lipiden, proteïnen (of eiwitten) en nucleïnezuren. Dit zijn macromoleculen en zoals we weten zijn polymeren opgebouwd uit hun specifieke monomeren
De monomeren zijn:
• Monosachariden: de bouwstenen van polysachariden
• Vetzuren en glycerol: de bouwstenen van vetten en oliën en membraanlipiden
• Aminozuren: de bouwstenen van eiwitten
• Nucleotiden: de bouwstenen van DNA- en RNA-moleculen
Energierijke chemische verbindingen
CARBOHYDRATESPROTEINS
Sachariden zijn C,H,O-verbindingen waarin de verhouding van de aanwezige elementen kan voorgesteld worden als:
Hierbij kan m kleiner dan of gelijk zijn aan n
De belangrijkste functie van de sachariden in de levende wezens is energieopstapeling.
zonlicht
fotosynthese in planten directe verbranding indirecte verbranding (ademhaling)
In groene planten kent men dit proces als fotosynthese. Zonlicht wordt gebruikt om koolstofdioxide en water om te zetten in sachariden en dizuurstof. Glucose is een energierijke verbinding die door verbranding terug kan omgezet worden in koolstofdioxide en water. In de levende plantaardig cel kan glucose omgezet worden tot zetmeel: de energieopslagmolecule van plantaardige cellen.
Aardappelen en maïs zijn voorbeelden van groenten die veel zetmeel bevatten

Afhankelijk van de chemische samenstelling kunnen de sachariden in 3 grote groepen ingedeeld worden: monosachariden, disachariden en polysachariden.
Monosachariden of enkelvoudige suikers zijn de eenvoudigste vorm van sachariden. Ze kunnen niet worden afgebroken tot kleinere suikermoleculen en vormen zo de bouwstenen van alle sachariden. Ze hebben als brutoformule Cn(H2O)n of CnH2nOn waarbij n ⩾ 3.
Monosachariden met vijf koolstoffen (pentose) of zes koolstoffen (hexose) kunnen voorkomen als open keten of als gesloten ringstructuur. De ringstructuur wordt gevormd door een condensatiereactie in de lineaire open keten.
Monosachariden en disachariden worden snel afgebroken en geabsorbeerd in het lichaam, waardoor ze snel beschikbare energiebronnen zijn.
• Glucose wordt ook wel dextrose of druivensuiker genoemd.
• Het is bij de meeste organismen een essentiële energiebron.
• Bij planten wordt glucose aangemaakt tijdens de fotosynthese
Eigenschappen
• Fructose wordt ook levulose of vruchtensuiker genoemd.
• Je vindt het terug in zoete groente-enfruitsoorten
• Het is meestal afkomstig van sacharose.
• Fructose wordt vaak gebruikt als zoetmiddel dat zo’n 2,5 keer zoeter is dan glucose.
Eigenschappen
• Je vindt galactose terug in zuivelproducten als onderdeel van lactose
• Het wordt in het lichaam snel omgezet naar glucose.
Eigenschappen
• Ribose wordt aangemaakt door het lichaam uit glucose.
• Het is een essentieel onderdeel van RNA
• Het is een onderdeel van transportmoleculen ATP, FAD, NAD, NADP en coenzym A.
Eigenschappen
• Desoxyribose is een essentieel onderdeel van nucleotiden (de bouwstenen van DNA).
Disachariden of tweevoudige suikers bestaan uit twee monosacharide-eenheden die aan elkaar zijn gebonden door afsplitsing van water via een condensatiereactie. Disachariden zijn voorbeelden van dimeren, verbindingen die bestaan uit 2 monomeren.
De belangrijkste disachariden hebben als brutoformule C12H22O11 en zijn opgebouwd uit twee hexosen. Ze zijn zeer goed oplosbaar in water en hebben een zoete smaak. DISACHARIDEN
Eigenschappen
• Sacharose wordt ook sucrose of rietsuiker genoemd.
• Het wordt gevormd uit de monosachariden glucose en fructose.
• Het komt in hoge concentraties voor in suikerriet en suikerbieten. Maltose
Eigenschappen
• Maltose wordt ook moutsuiker genoemd.
• Het wordt gevormd uit 2 glucose-eenheden
• Maltose ontstaat door vertering van zetmeel bij mens en dier.
• Het ontstaat ook bij het brouwen van bier als tussenproduct.
• Maltose wordt door fermentatie omgezet in alcohol
Eigenschappen
• Een andere naam voor lactose is melksuiker.
• Het wordt gevormd uit glucoseengalactose
• Je vindt het terug in melkproducten
Oligosachariden en polysachariden zijn meervoudige suikers die bestaan uit lange ketens van monosacharide-eenheden die aan elkaar zijn gebonden. Oligosachariden bestaan uit drie tot vijftien monosachariden. Bij een langere keten van monosachariden spreken we van polysachariden.
Beide hebben een breed scala aan functies, waaronder energieopslag en structuurondersteuning. Door verschillende condensatiereacties worden meerdere monosachariden aan elkaar gebonden, waarbij telkens een watermolecule wordt afgesplitst. Dit proces, waarbij een polymeer wordt gevormd, wordt ook polycondensatie genoemd.
Polysachariden worden, in tegenstelling tot mono- en disachariden, langzamer afgebroken en bieden een meer geleidelijke energieafgifte.
Zetmeel, glycogeen en cellulose zijn polysachariden met brutoformule (C6H10O5)x. Toch hebben deze 3 stoffen sterk verschillende eigenschappen.
POLYSACHARIDEN
Structuurformule
Zetmeel
Amylose
Amylopectine
Eigenschappen
• Zetmeel is een reservestof die we aantreffen in planten en granen.
• Zetmeel bestaat voor 20% uit amylose en 80% uit amylopectine
• Een teveel aan glucose wordt in plantencellen opgeslagen onder de vorm van zetmeel.
Eigenschappen
• Glycogeen treffen we vooral aan in de spieren en de lever van mens en dier.
• Het is de reservestof in de lever die door glucagon wordt vrijgemaakt om in de bloedbaan glucose te leveren. Als we zetmeel verteren tot glucose kan het door het hormoon insuline omgezet worden tot glycogeen dat in de lever wordt opgeslagen.
Glucose Insuline Glycogeen
Glucagon
Structuurformule
Eigenschappen
• Cellulose is opgebouwd uit een lineaire keten van vele glucose-eenheden
• Het heeft een structuurfunctie in plantencellen door aanwezigheid in de celwand.
• Hout bestaat voor de helft uit cellulose, katoen bijna volledig.
Celwand
Lipiden zijn ook moleculen die opgebouwd zijn uit de elementen koolstof, waterstof en zuurstof. Lipiden staan, net zoals de sachariden, in voor de energielevering. In het menselijk lichaam dekt de afbraak van lipiden zo’n 20 à 30% van onze energiebehoefte. Verder zorgen ze ook voor de bescherming van onze cellen en weefsels, omdat ze dienst doen als stootkussen.
De belangrijkste moleculen binnen de groep van de lipiden zijn de triglyceriden, fosfolipiden, steroïden en wassen.
Triglyceriden zijn opgebouwd uit een glycerolmolecule en drie vetzuren. De vorming van triglyceriden gebeurt via een condensatiereactie waarbij een OH-groep van elk vetzuur wordt afgesplitst en water vormt met een H-atoom van glycerol.
Glycerol 3 vetzuren
Triglyceriden
Vorming van H2O
Er bestaan twee types vetzuren: verzadigde en onverzadigde vetzuren. Het type vetzuur bepaalt het karakter van het triglyceride.
VERZADIGD VETZUUR ONVERZADIGD VETZUUR
• Enkelvoudige bindingen
• Lineaire ketens
• Hoog smelt- en kookpunt
• Vast bij kamertemperatuur
• Dierlijke oorsprong (uitzondering: kokosolie)
• ‘Slechte’ vetten (aderverkalking)
Structuur
Koolstofketen Carboxygroep
• Een of meerdere dubbele bindingen
• Knik in de keten ter hoogte van een dubbele binding
• Lager smelt- en kookpunt
• Vloeibaar bij kamertemperatuur
• Plantaardige oorsprong (uitzondering: visolie)
• ‘Goede’ vetten (gezonder)
Structuur
Koolstofketen Carboxygroep
Geen dubbele binding in structuur
Laurinezuur
1 of meer dubbele bindingen
Palmitoleïnezuur
Fosfolipiden zijn structurele lipiden, aanwezig in celmembranen. Dit wil zeggen dat ze essentieel zijn bij de bouw en functie van de celmembranen, die opgebouwd zijn uit een fosfolipide dubbellaag.
Een fosfolipide bestaat uit een hydrofiele (wateraantrekkende) polaire kop en een hydrofobe (waterafstotende) apolaire staart. De kop wordt gevormd door een fosfaatgroep, gebonden aan een glycerolmolecule. Aan de andere zijde van het glycerolmolecule zijn twee vetzuren verbonden.
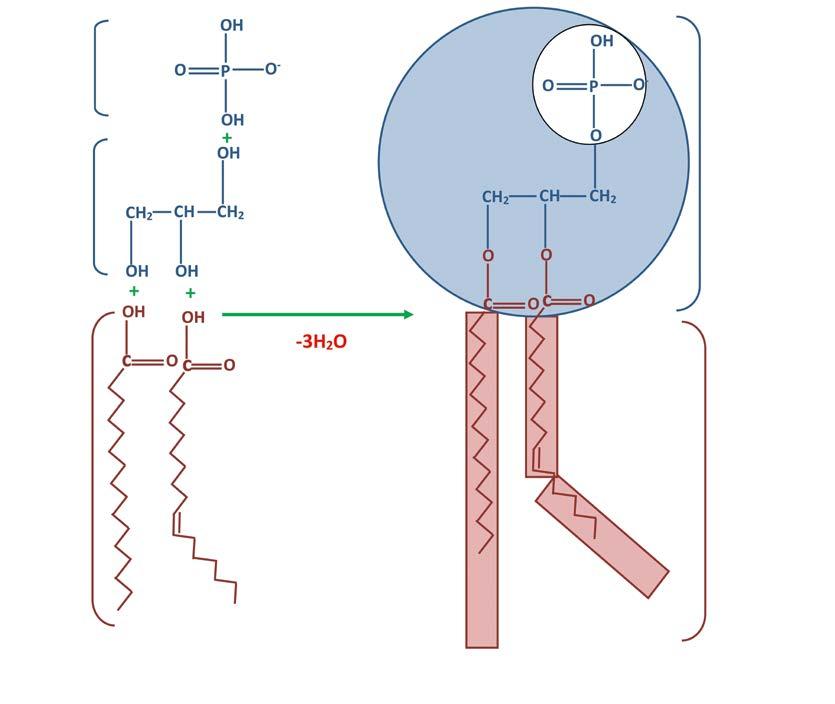
Fosfaat Glycerol
Vetzuren
Hydrofiele kop
Hydrofobe staart
VerzadigdOnverzadigd
Fosfolipide
Door dit amfipathische karakter (een hydrofiel en een hydrofoob deel) van fosfolipiden zullen ze in een waterig milieu steeds een fosfolipide dubbellaag vormen. De hydrofobe staarten keren zich immers naar elkaar toe, weg van het water.
Hydrofiele kop
Fosfolipide
Hydrofobe staart
Polair
Apolair
Polair
Dubbele laag fosfolipiden van een celmembraan
Steroïden bestaan uit vier geconjugeerde koolstofringen (drie cyclohexaanringen en een cyclopentaanring) en verschillende functionele groepen.
De specifieke structuur van steroïden bepaalt hun biologische functies. Ze beïnvloeden de soepelheid van celmembranen (cholesterol) en doen dienst als signaalmoleculen (geslachtshormonen).
Eigenschappen
• Cholesterol is de bouwsteen van steroïdhormonen, vitamine D en galsap
• Het is een vette substantie die in alle lichaamscellen aanwezig is en een levensnoodzakelijke rol speelt in het organisme.
• Het is een celverstevigend element van het celmembraan, speelt een rol bij de aanmaak van galzuren (in de lever) en helpt bij de aanmaak van bepaalde hormonen.
Structuurformule
Testosteron
Eigenschappen
• Testosteron is het belangrijkste mannelijke geslachtshormoon
• Het is belangrijk bij de ontwikkeling van de mannelijke primaireen secundaire geslachtskenmerken
• Het wordt in de teelballen en de bijnieren geproduceerd.
• Het komt ook voor bij vrouwen, maar in veel lagere concentraties.
Eigenschappen
• Oestradiol is een van de oestrogenen, een verzamelnaam van vrouwelijke hormonen.
• Oestrogenen spelen een belangrijke rol bij de ontwikkeling van de vrouwelijke geslachtskenmerken, de menstruele cyclus en de zwangerschap.
• Ze worden onder andere afgescheiden door de eierstokken.
• Ze komen ook in lagere concentraties voor bij de man.
Structuurformule
Progesteron
Eigenschappen
• Progesteron is een vrouwelijk geslachtshormoon dat wordt aangemaakt tijdens de menstruatiecyclus en tijdens de zwangerschap
• Dit hormoon regelt samen met oestrogeen het slaapritme, het bevordert de vetopname, voorkomt baarmoederhals- en borstkanker en regelt de werking van de schildklier.
WIST-JE-DAT
Anabole steroïden zijn synthetische hormonen die de opbouw van de spiermassa bevorderen. Ze worden veel gebruikt om sportprestaties te verbeteren, vooral bij gewichtheffen en bodybuilding. Ze zijn afgeleid van het mannelijk geslachtshormoon testosteron. Ze worden beschouwd als doping, en zijn daarom verboden.
Wassen zijn organische verbindingen die bestaan uit lange koolstofketens met een hydrofobe kop en een hydrofiele staart. Hierdoor hebben wassen de eigenschap dat ze zich aan elkaar kunnen hechten en aan oppervlakten kunnen blijven plakken.
Wassen worden geproduceerd door verschillende organismen, waaronder planten, insecten en zelfs mensen. Ze hebben diverse functies, waaronder bescherming tegen uitdroging, insecten en schimmels, en het reguleren van de transpiratie bij planten. Een veel voorkomende was is ceramide, dat we terugvinden in celmembranen. Ceramide
Een ander voorbeeld is bijenwas. Bijenwas wordt door sommige soorten bijen geproduceerd om de cellen te maken in de raten. In deze zeshoekige holten worden honing en stuifmeel opgeslagen en deze dienen als voedsel voor de jonge bijen in de bijenpopulatie.
Tegenwoordig wordt bijenwas onder andere gebruikt in cosmetische producten of om kaarsen van te maken.


De proteïnen zijn de meest verspreide koolstofverbindingen in de cel. Samen met de lipiden zijn het belangrijke bouwstoffen van de cellen van organismen.Ze hebben een veelheid aan biologische functies.
STATISCHE FUNCTIES
Structuurfunctie
• Vezelproteïnen: keratine, collageen
• Celstructuren: ribosomen, cytoskelet
• Spierwerking: actine, myosine
Reservefunctie
• Globulinen: ovalbumine, caseïne
Beschermende functie
• Fibrinogeen en thrombine (bloedstolling)
DYNAMISCHE FUNCTIES
Katalytische functie
• Proteasen (breken proteïnen af)
• Amylasen (breken zetmeel af)
• Lipasen (breken vetten af)
Regulerende functie
• Bloedsuikerspiegelhormonen: insuline, glucagon
• Spijsverteringshormonen: gastrine, cholecystokinine (CCK)
• DNA- en RNA-polymerase
Transportfunctie
• Serumalbumine (vettransport)
• Hemoglobine (zuurstoftransport)
Afweerfunctie
• Immunoglobulinen (antilichamen)
Scan de QR-code om enkele concrete toepassingen van eiwitten te bekijken.
Eiwitten zijn biopolymeren samengesteld uit α-aminozuren. (α betekent dat de aminegroep op het koolstofatoom naast de carboxygroep staat.) De algemene formule voor een α-aminozuur is R-CH(NH2)-COOH.
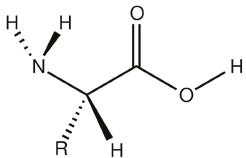
Aminozuren zijn bifunctionele verbindingen: ze bevatten een carboxygroep (COOH-groep) en een aminegroep (NH2-groep).
Er zijn in totaal 25 aminozuren die als bestanddelen voorkomen in eiwitten. Deze worden opgedeeld in:
• Essentiële aminozuren worden niet in hetmenselijk lichaamgemaakt. Ze moeten daarom in voldoende mate in de voeding aanwezig zijn. Een gezond en evenwichtig voedingspatroon is nodig om al deze aminozuren via de voeding te bekomen.
• Niet-essentiëleaminozuren kunnen worden aangemaakt door het lichaamzelf en moeten dus niet uit de voeding aangevoerd worden. Ze kunnen gemaakt worden uit andere aangevoerde aminozuren.
Lijst van α-aminozuren:
Twee aminozurenkunnen samen reageren in een condensatiereactie met vorming vaneen dipeptide. Daarbij reageert de carboxygroep van het eerste aminozuur met de aminegroep van het tweede aminozuur. De binding in het dipeptide die ontstaat tussen de twee aminozuren is de peptidebinding (CO-NH-binding).
Voorbeeld 1:
Vorming van de dipeptide Ala-Ala uit de twee aminozuren alanine en alanine:
Voorbeeld 2:
Vorming van de dipeptides Ala-Gly en Gly-Ala uit de aminozuren alanine en glycine:
Merk op dat de volgorde waarin de aminozuren aan elkaar gebonden zijn van belang is.
Voorbeeld 3:
De tripeptide Gly-Ser-Ala uit de aminozuren glycine, serine en alanine:
Dit opent de mogelijkheid om een keten van aminozuren te maken met behulp van herhaalde kop-staartreacties. De macromolecule die zo ontstaat wordt een polypeptideketen genoemd. Een keten van vele aminozuren noemt men een proteïne.
Aminozuren Peptide Proteïne
3.3.3Ruimtelijke structuur van eiwitten
Om de structuur van eiwitmoleculen te beschrijven, maken we een onderscheid tussen de volgende 4 aspecten: de primaire, secundaire, tertiaire en quaternaire structuur.
Aminozuren
Primaire structuur
Secundaire structuur
Tertiaire structuur
Quaternaire structuur
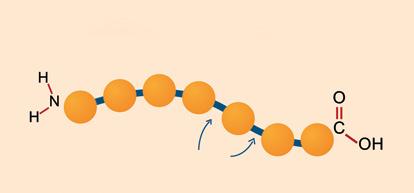
De volgorde van de aminozuren is bepalend voor de structuur en de eigenschappen van een proteïne. Deze opeenvolging is specifiek voor elke proteïne en wordt de primaire structuur van deze proteïne genoemd.
Voorbeeld: Insuline
Menselijk insuline (hormoon dat de suikerspiegel in het bloed regelt) bestaat uit een polypeptideketen van 51 aminozuren. Het bestaat uit twee aminozuurketens: keten A (met 21 aminozuren) en keten B (met 30 aminozuren).Deze 2 ketens worden door de 3 zwavelbruggen (S-S) van het aminozuur cysteïneaan elkaar gebonden.
Ketting B 30 aminozuren
Ketting A 21 aminozuren
Waterstofbruggen
α-helix β-plaatstructuur
De secundaire structuur wordt veroorzaakt doordat de aminozuren van de proteïneketen met elkaar interageren via H-bruggen. Zo ontstaan twee mogelijkheden: ofwel rolt de keten op tot een spiraal (α-helix), ofwel krijgt ze de vorm van een glooiend vlak (β-plaat). Het glooiende vlak ontstaat doordat de polypeptideketen evenwijdige lussen vormt. De spiraal- en plaatstructuren worden door waterstofbruggen in hun ruimtelijke vorm gehouden.
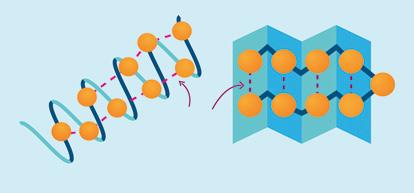
C) Tertiaire structuur
Ruimtelijke vorm
Gevouwen polypeptideketen
De α-helixen en de β-platen van de secundaire structuur kunnen een ruimtelijke vorm aannemen. Zo ontstaat de tertiaire structuur die een vezel- of kluwenstructuur aanneemt. Bij de tertiaire structuur spelen waterstofbruggen en zwavelbruggen een grote rol. Zwavelbruggen zijn atoombindingen die kunnen optreden tussen cysteïnefragmenten die binnen de keten vaak ver van elkaar zijn verwijderd.
α-helix


D) Quaternaire structuur
β-plaat Zwavelbruggen
Meerdere polypeptideketens
De quaternaire structuur ontstaat door de combinatie van meerdere afzonderlijk gevouwen polypeptiden.
Voorbeeld: Hemoglobine
Hemoglobine is een eiwit dat zorgt voor het transport van zuurstof en koolstofdioxide in het bloed van dieren. In elke rode bloedcel bevinden zich ongeveer 270 miljoen hemoglobinemoleculen.
Het hemoglobinemolecule bestaat uit vier subeenheden die twee aan twee identiek zijn: in de figuur blauw en groen gekleurd. Menselijk hemoglobine bestaat uit 4 subeenheden, 2 alfaglobine ketens en 2 bèta-globine ketens. Elke keten bevat een heemgroep (vier liganden in het midden gebonden aan een ijzerion). Aan dit centrale ijzerion wordt een zuurstofmolecule/ koolstofdioxidemolecule gebonden. Deze binding is reversibel: dit betekent dat het ijzerion dizuurstof kan binden in de longen en afgeven in de cellen.























Nucleotiden zijn verbindingen die de bouwstenen vormen van de nucleïnezuren DNA en RNA. DNA en RNA zijn dragers van de erfelijke informatie in organismen en bevinden zich steeds in de kern van een cel.
In de module ‘Erfelijk materiaal en celdelingen’ van Isaacnatuurwetenschappen5 zul je meer leren over nucleotiden en de bouw van DNA en RNA.
Moleculen kunnen op drie verschillende manieren geschreven worden. De voorstelling kan zijn: een brutoformule, een structuurformule en een koolstofskelet. Geef voor de onderstaande moleculen de brutoformule en de structuurformule.
h Br
i NH2
Geef voor de onderstaande moleculen de brutoformule en de skeletnotatie.
a CH3 CH2 CH CI CH2 CH3
b CH3 CH2 C CH3 OH CH3
c CH3 CH2 O CH2 CH2 CH3
d CH3 CH2 CH2
CH3 C
f CH3 CH CH3 CH2 NH2
Beschrijf het verschil tussen kunststoffen en biomoleculen.
Tot welke stofklasse behoren volgende biomoleculen? Wees zo specifiek mogelijk.
Zijn de volgende moleculen mono-, di- of polysachariden?
Welke molecule is het monomeer van een eiwit?
Dit monomeer is bifunctioneel, wat betekent dit? Welke specifieke groepen bevat deze molecule?
Op welke manier (via welke chemische reactie) worden dipeptides gevormd? Geef een voorbeeld van de vorming van zo’n dipeptide.
Chitine is een polysacharide dat voorkomt als bouwstof in de celwanden van schimmels en in het exoskelet van geleedpotigen. Chitine is, na cellulose, het meest voorkomende biopolymeer op aarde.
Bekijk de structuur van chitine. Als je die structuur vergelijkt met een zuivere polysacharide, dan bevat een chitine-eenheid een groep die niet voorkomt bij deze andere polysachariden. Duid die groep aan op de onderstaande figuur.
Wat zijn de verschillen tussen verzadigde en onverzadigde vetzuren? Wat zijn de overeenkomsten tussen verzadigde en onverzadigde vetzuren? Wat is margarine en hoe ontstaat het?
Alle steroïden hebben chemisch dezelfde basisstructuur. Teken dit basisskelet.
Wat zijn de functies van eiwitten in levende wezens? Geef voor elke functie een voorbeeld van een eiwit.
Geef van de volgende koolstofverbindingen de klasse waartoe ze behoren. Gebruik voor deze oefening de determinatietabel (zie QR-code).
a O b OH
c O NH2
h Br i NH2
j CH3 CH2 CH CI CH2 CH3
k CH3 CH2 C CH3 OH CH3
l CH3 CH2 O CH2 CH2 CH3
m CH3 CH2 CH2 C O H
n CH3 C O O CH3
o CH3 CH CH3 CH2 NH2
Bespreek de structuur van eiwitten aan de hand van de afbeelding.
Vergelijk de structuur van galactose en glucose. Wat zijn de overeenkomsten, en wat zijn de verschillen?
Tip: Om het onderscheid gemakkelijker te beschrijven, maak je best gebruik van de nummering van de koolstofatomen in de ring.
Geef 1 mannelijk en 1 vrouwelijk geslachtshormoon, en bespreek hun overeenkomsten en verschillen qua structuur en functie.
Geef de reactievergelijking (met skeletstructuur) van de dimeervorming van Ser-Ala.
Verklaar het proces van zuurstoftransport in het bloed aan de hand van de reactievergelijking in de rode bloedcellen in onderstaande figuur.
Kunststoffen kunnen in 3 categorieën ingedeeld worden volgens hun structuur. Welke categorie stellen de onderstaande figuren voor? Geef voor elke categorie 1 voorbeeld.
Welke uitspraak of uitspraken zijn waar? Verklaar.
Di- en polysachariden worden gevormd door een condensatiereactie waarbij water vrijkomt.
Di- en polysachariden kunnen ontleed worden in hun monosachariden. Zowel di- als polysachariden zijn snelle suikers.
Isomeren zijn moleculen die dezelfde brutoformule hebben, maar een verschillende structuurformule. Het is belangrijk om het onderscheid te maken, aangezien isomeren sterk verschillende chemische eigenschappen kunnen hebben.
Zoek de structuurformule op van de isomeren van volgende stoffenen noteer.
de 2 isomeren van C4H10 de 3 isomeren van C3H8O de 7 isomeren van C4H10O2
Esters ontstaan door een condensatiereactie tussen een alkaanzuur en een alcohol:
Voorbeeld: De vorming van methylpropionaat (tropisch fruitaroma)
Reactievergelijking:propaanzuur + methanol → methylpropionaat + water
CH3CH2COOH + CH3OH→CH3CH2COOCH3 + H2O
Methaanzuur/mierenzuur/H-formiaat HCOOH Methanol CH3OH
Ethaanzuur/azijnzuur/H-acetaat CH3COOH Ethanol CH3CH2OH
Propaanzuur/H-propionaat CH3CH2COOH Propanol CH3CH2CH2OH
Butaanzuur/H-butyraat CH3CH2CH2COOH Butanol CH3CH2CH2CH2OH
Pentaanzuur CH3CH2CH2CH2COOH Pentanol CH3CH2CH2CH2CH2OH
Geef de reactievergelijking voor de vorming van de volgende smaken. Maak gebruik van de tabel hierboven en het voorbeeld.
Butylmethionaat (framboosaroma)
Pentylacetaat (banaanaroma)
Propylacetaat (peeraroma)
Propylpropionaat (tropisch fruitaroma)
Vervolledig de volgende tekst door de gevraagde structuurformules (1) en systematische namen (2) op te zoeken.
Jan en Mieke organiseren een barbecue voor hun vrienden. Eerst ruimt Jan de tuin een beetje op want op de plaats waar ze de gastentafel willen plaatsen, groeien er nog enkele brandnetels, die bevatten ((1) … / (2) … ). Hij verwijdert deze met behulp van handschoenen om zo via de haren geen huidreactie te krijgen.


Ondertussen maakt Mieke de rauwe groenten klaar voor de salade. Ze aromatiseert de salade met vinaigrette, deze bevat een lage concentratie aan azijnzuur ((1) … / (2) … ).

Na het opruimen van de tuin steekt Jan de barbecue aan met een beetje brandspiritus ((1) / (2) ), tot grote ergernis van Mieke want die beseft dat dat gevaarlijk is.
Om te drinken zet Jan de flessen rode wijn, die 12% alcohol ((1) … / (2) … ) bevat al klaar.

Natuurlijk voorziet hij ook frisdrank en bruiswater, die bevatten het gas ((1) … / (2) … ). Bij het openen van deze flessen ontsnapt dit gas uit de fles met de vorming van bubbels.
Geef de reactievergelijking voor de vorming van Ser-Ala-Gly. Geef de reactievergelijking voor de vorming van Ala-Gly-Ser.

Tijd om aan de slag te gaan met polymeren! In dit experiment leer je hoe je zelf een draad kan spinnen uit een oplossing van het polymeer polyvinylalcohol.


Ik kan koolstofverbindingen voorstellen met behulp van de brutoformule, de structuurformule en de skeletnotatie. p. 6-7
Ik ken de indeling van de chemische zuivere stoffen. p. 7-8
Ik kan koolstofverbindingen indelen aan de hand van de determinatietabel. p. 9
Ik kan verschillende toepassingen van koolstofverbindingen in het dagelijkse leven opsommen. p. 10-12
Ik kan het onderscheid tussen de macromoleculen kunststoffen en biomoleculen verwoorden. p. 14-15
Ik kan voorbeelden geven van verschillende kunststoffen.
Ik weet hoe klassieke kunststoffen uit aardolie verkregen worden en ken de syntheseprocessen voor de vorming van macromoleculen.
Ik kan kunststoffen indelen op basis van hun structuureigenschappen.
Ik kan verwoorden waarom we met een kritische blik moeten kijken naar het gebruik van klassieke kunststoffen in functie van duurzame chemie.
p. 15-16, 19-25
p. 15-18
p. 19-23
p. 26-27
Ik ken de verschillende biopolymeren en weet wat hun specifieke monomeren zijn. p. 28
Ik weet wat sachariden zijn, hoe ze opgebouwd zijn en kan bij elk type verschillende voorbeelden opsommen.
Ik weet wat lipiden zijn, hoe ze opgebouwd zijn en kan bij elk type verschillende voorbeelden opsommen.
Ik weet wat proteïnen zijn, hoe ze opgebouwd zijn en kan verschillende voorbeelden opsommen.
p. 28-35
p. 36-40
p. 41-48
Ik ken de algemene functies van eiwitten. p. 41
Ik kan de ruimtelijke structuur van eiwitten beschrijven aan de hand van de primaire, secundaire, tertiaire en quaternaire structuur.
p. 44-48
Colofon
Auteur Ann Gilis
Eerste druk 2023
SO 0346/2023
Bestelnummer 65 900 0825 (module 1 van 9)
ISBN 978 90 4864 710 1
KB D/2023/0147/162
NUR 126
Thema YPMP
Verantwoordelijke uitgever die Keure, Kleine Pathoekeweg 3, 8000 Brugge
RPR 0405 108 325 - © die Keure, Brugge
Die Keure wil het milieu beschermen. Daarom kiezen wij bewust voor papier dat het keurmerk van de Forest Stewardship Council® (FSC®) draagt. Dit product is gemaakt van materiaal afkomstig uit goed beheerde, FSC®-gecertificeerde bossen en andere gecontroleerde bronnen.