

INHALT
1
DIGITALISIERUNG
Telemedizin in der Hausarztzentrierten Versorgung (HZV)
3
ARRIBA®
in der Hausarztzentrierten Versorgung – Mit den Patientinnen und Patienten auf Augenhöhe

5
FORTBILDUNG
PTQZ-Thema Biologika und Biosimilars


IHRE SERVICEANGEBOTE DES HZV-TEAMS
INFORMATIONEN UND SCHULUNGEN ZUR HZV VOR ORT UND ONLINE
• Individuelle Praxisschulungen
• Infoveranstaltungen für Hausärztinnen und Hausärzte sowie MFA
• Zahlreiche unterschiedliche Online-Schulungen zur erfolgreichen Umsetzung der HZV im Praxisalltag
Schnell, einfach und unkompliziert: Jetzt online und sofort Mitglied im Hausärzteverband werden und zeitgleich die Teilnahme an den HZV-Verträgen beantragen: www.hausarztservice-online.de
Für Ihre Praxis sowie Ihre Patientinnen und Patienten: Wir bieten Ihnen Info- und Werbematerialien wie z. B. Filme für Ihr Wartezimmer, Printmaterialien und verschiedene Give-aways: www.hzv.de
Fotos: ZTM Bad Kissingen GmbHHassan Akhtarin, ustasstock.adobe.com, skynesheriStockphoto
Gelungene Digitalisierung Telemedizin in der Hausarztzentrierten Versorgung (HZV)
Mit dem Einsatz von telemedizinischen Anwendungen, die die Versorgung verbessern und dabei gleichzeitig Hausärztinnen, Hausärzte und Praxisteams entlasten, gewinnen alle. Auch die Patientinnen und Patienten, die das häufig als Aufwertung des Hausbesuchs empfinden.
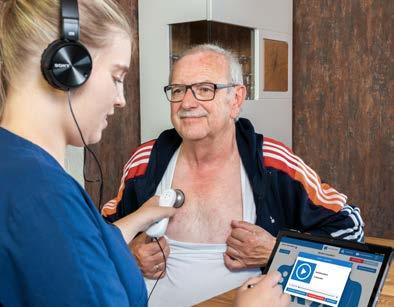
Wenn Eva Wess, VERAH® aus der „Hausarztpraxis Fulda“, Hausbesuche bei immobilen und chronisch kranken HZV-Patientinnen und -Patienten macht, hat sie immer eine Tasche voller Technik dabei. Die Praxis, in der sie arbeitet, nimmt nicht nur an der Hausarztzentrierten Versorgung mehrerer Krankenkassen teil, sie nutzen dort, wo es Bestandteil des jeweiligen HZV-Vertrages ist, auch das so genannte Telemedizinische Versorgungsmodul (TMVM). In einer Zeit, in der viele Hausärztinnen, Hausärzte und deren Praxisteams das Thema „Digitalisierung“ vor allem mit schlechten Erfahrungen im Praxisalltag verbinden, ist es verständlich, wenn sie digitale Prozesse erst einmal mit Vorsicht beäugen. Projekte, wie beispielswei-
se das E-Rezept, wurden fernab jeglicher Praxisrealität entwickelt und nicht ausreichend getestet, sodass sie Praxisabläufe stören oder im schlimmsten Fall gänzlich lahmlegen. Der Deutsche Hausärzteverband spricht sich deshalb seit langem dafür aus, dass die Digitalisierung der Prozesse in den hausärztlichen Praxen vor allem das Praxisteam soweit wie möglich entlasten und die Patientenversorgung verbessern muss.
Ein Beispiel, wie der gelungene Einsatz von digitalen Mitteln zum Vorteil von Patientin, Patient und Praxis aussehen kann, ist das Telemedizinische Versorgungsmodul (TMVM) in der Hausarztzentrierten Versorgung. Das Modul bewährt sich in der Praxis bereits seit 2019. Damals wurde die telemedizinische Versorgung erstmals in den HZV-Vertrag mit den, von der GWQ Service Plus AG, vertretenen Betriebs- und Innungskrankenkassen aufgenommen. Mittlerweile sind entweder das TMVM oder aber einzelne telemedizini-

sche Leistungen bundesweit in 13 Regionen in zahlreichen HZV-Verträgen verankert, z.B. mit der AOK Hessen, den Betriebskrankenkassen in Bayern oder der TK.
Ohne VERAH® geht es nicht
Die zentrale Rolle beim Einsatz telemedizinischer Leistungen spielt einmal mehr die Versorgungsassistenz in der Hausarztpraxis, die VERAH®. Sie entlastet die Hausärztinnen und Hausärzte ja bereits dadurch, dass sie ihnen delegierte Hausbesuche bei chronisch erkrankten oder immobilen Patientinnen und Patienten abnimmt. Sind diese in einen HZVVertrag eingeschrieben, kann Telemedizin die Versorgung noch besser machen. Je nach Erkrankung der Patientin, des Patienten kann Eva Wess bei ihrem Hausbesuch nicht nur Sauerstoffgehalt, Blutdruck oder Blutzucker messen, sie kann auch vor Ort ein EKG schreiben oder die Lungenfunktion messen. Bei Bedarf ist sie in der Lage, auch Merkmale zur Wundanalyse oder Sturzprophylaxe digital zu ermitteln.
Da die in der Praxis genutzte Software über eine Schnittstelle zu ihrer Ausrüstung verfügt, sind die Daten der Patientin, des Patienten direkt dort hinterlegt. Das ist ein großer Vorteil, findet Eva Wess. „Ich muss nicht im Anschluss an den Besuch die Daten überspielen, die Dokumentation ist somit einfach und komfortabel, das spart viel Zeit.“ Vor allem aber kann die Hausärztin, der Hausarzt sofort auf die Daten zugreifen und diese auswerten. Sollte dringender Handlungsbedarf oder Unklarheiten bestehen, kann sie/er jederzeit per Videokonferenz dazu geschaltet werden. Diese Möglichkeit direkt aus der Häuslichkeit der Patientin, des Patienten ein Videotelefonat mit der Hausärztin, dem Hausarzt zu führen, wenn es erforderlich ist, hat Vorteile für alle Beteiligten. „Für mich bedeutet das vor allem zusätzliche Sicherheit“, so VERAH® Eva Wess.
Technische Unterstützung
Bislang sind zwei Anbieter telemedizinischer Geräte für die Nutzung im Rahmen der HZV zugelassen. Weitere sollen folgen. Die Anbieter sind an klar definierte Anforderungen gebunden, die in den jeweiligen HZV-Verträ-
INFOS
Informationen zu MIA vom ZTM unter: www.ztm.de/produkte/mia
TeleDoc Portable von Docs in Cloud unter: docsinclouds.com/telecare/teledoc-portable/
gen festgelegt sind. So müssen beispielsweise ein mobiles Endgerät mit der entsprechenden Software, wie Smartphone oder Tablet, aber auch ein Medizinprodukt zur Messung und Darstellung der (elektrischen) Herzaktion bereitgestellt werden. Informations- und Schulungsunterlagen sind ebenso verpflichtend vorgeschrieben, damit die VERAH® über alle Funktionen der telemedizinischen und datenschutzrechtlichen Komponenten informiert ist. Die bislang zugelassenen Anbieter sind MIA („Mobile telemedizinische Assistenz“) des Zentrums für Telemedizin Bad Kissingen, sowie das TeleDoc Portable von Docs in Cloud. Sie unterscheiden sich in der Zusammensetzung ihrer Basispakete sowie in zubuchbaren Erweiterungen und den monatlich anfallenden Kosten.

Die Teilnahme – Voraussetzungen und Antrag Möchte eine Praxis im Rahmen ihrer HZVTeilnahme an einem Vertrag telemedizinische Versorgung nutzen, muss sie zwei Voraussetzungen erfüllen. Sie muss an einem HZV-Vertrag teilnehmen, der das Telemedizinische Versorgungsmodul oder einzelne telemedizinische Leistungen beinhaltet und eine VERAH® im Praxisteam haben, die eine telemedizinische Weiterbildung erhalten hat. Hier geht es vor allem darum, die Geräte routiniert bedienen zu können. Diese Schulung erfolgt deshalb auch über den jeweiligen Hersteller, über den die Praxis ihr Equipment bezieht.
Zur Teilnahme am Telemedizinischen Versorgungsmodul reichen die Praxen einen entsprechenden Nachweis über das „Meldeformular digitale Infrastrukturmerkmale in der
Bei Unklarheiten oder dringendem Handlungsbedarf kann die Hausärztin, der Hausarzt direkt per Videotelefonie dazugeschaltet werden.
* Das ist noch nicht bei allen gängigen Praxissystemen gegeben, hier sollte man bei seinem Anbieter nachfragen.
Hausarztpraxis“ ein. Dieses ist auf der Webseite www.hzv.de unter den jeweiligen vertragsübergreifenden Dokumenten für die jeweilige Region zu finden. Die für diese Art der Betreuung in Frage kommenden Patientinnen und Patienten müssen nicht gesondert für die telemedizinische Versorgung im Rahmen ihrer Teilnahme eingeschrieben werden. Entscheidet sich eine Praxis für den Einsatz von Telemedizin im Rahmen der HZV, lohnt sich das für alle Beteiligten. Das Honorarplus ist nur ein Argument. Die Vergütung eines Hausbesuchs einer telemedizinisch geschulten VERAH® und anderer im Rahmen
des TMVM implementierter Leistungen unterscheidet sich allerdings deutlich je nach Vertrag. Hier lohnt ein Blick in die einzelnen Verträge. Nach ihrer Erfahrung mit Hausbesuchen unter Einsatz von Telemedizin, würde Eva Wess anderen Praxen das Modul empfehlen? „Definitiv! Die Patientinnen und Patienten empfinden das als deutliche Aufwertung des Hausbesuchs und fühlen sich noch besser versorgt. Und wenn die Schnittstelle zur Praxissoftware eine direkte Einspielung der erhobenen Daten erlaubt*, ist auch für uns die Zeitersparnis bei der Dokumentation enorm.“
Mit Patientinnen und Patienten auf Augenhöhe arriba® in der Hausarztzentrierten Versorgung

Gemeinsam mit der Patientin, dem Patienten eine passende Therapie zu finden, das kann in vielen Fällen den Behandlungserfolg maßgeblich beeinflussen. Dabei ist das so genannte Shared Decision Making nicht neu und bietet für Ärztinnen, Ärzte und Patientin und Patient viele Vorteile.
Einige Krankenkassen haben den Nutzen von Shared Decision Making (SDM) bereits erkannt und fördern deshalb den Einsatz von arriba®, der meistgenutzten Entscheidungsund Beratungshilfe für die Hausarztpraxis in deutscher Sprache, auch in ihren Verträgen zur Hausarztzentrierten Versorgung (HZV). Bis heute gilt die partizipative Entscheidungsfindung, das so genannte Shared Decision Making, als das am weitesten entwickelte Konzept, wenn es darum geht, Patientinnen und Patienten in die Therapieentscheidung einzubeziehen. Aufgabe der Ärztin, des Arztes ist in diesem Fall, ihnen alle medizinisch relevanten Informationen über die angebotenen Leistungen zur Verfügung zu stellen, damit sie mit der Ärztin, dem Arzt gemeinsam eine informierte Entscheidung treffen können. Dies beinhaltet in erster Linie Informationen über die möglichen Behandlungsstrategien mit ihren
Leicht verständlich visualisiert: arriba® Module hier am Beispiel „kardiovaskuläre Prävention“.
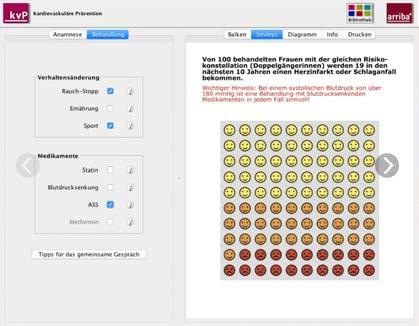
jeweiligen Chancen und Risiken. So wird die Patientin, der Patient in die Lage versetzt, die Vor- und Nachteile der Therapieoptionen zu verstehen und die Wahrscheinlichkeit möglicher Folgen zu überblicken. Gemeinsam werden Therapiemöglichkeiten abgewogen und Entscheidungen getroffen. Diese besondere Art der Kommunikation eignet sich besonders bei chronischen Erkrankungen und mehreren Therapieoptionen.
Nutzen für beide Seiten Einer der großen Vorteile dieser Art der Kommunikation ist wohl unbestritten die vertiefte Arzt-Patienten-Bindung. Sie erhöht ebenso die Adhärenz und hat so positive Effekte auf die Therapietreue und den Behandlungserfolg. Benefit für die Patientin, den Patienten: Sie verstehen ihre Krankheit besser und können auch den Behandlungserfolg dadurch realistischer einschätzen. Erfahrungsgemäß empfinden Patientinnen und Patienten, die durch Shared Decision Making in die Behandlung einbezogen werden, ein deutlich höheres Maß an Selbstbestimmung. Das erhöht letztlich die Patientenzufriedenheit.
Für die Ärztin, den Arzt ergibt sich durch die Dokumentation des gemeinschaftlich abgestimmten Vorgehens zudem eine größere Rechtssicherheit.
Einsatz von arriba®
Aber wie genau funktioniert jetzt dieser Prozess von Informieren einerseits und Entscheiden mit der Patientin, dem Patienten
andererseits? Dabei hilft arriba ®, eine softwaregestützte Entscheidungs- und Beratungshilfe. Anders als bei herkömmlichen Infobroschüren, Patientenfilmen oder Webseiten unterstützt sie unmittelbar im Moment des Arzt-Patienten-Gespräches. Dabei gehen die Ärztin, der Arzt und Patientin, Patient gemeinsam einen Fragenkatalog durch, im Falle des arriba®-Moduls „Depression“ beispielsweise basierend auf dem Fragebogen PHQ-9, der als Screening-Instrument zur Diagnostik von Depressivität entwickelt wurde. Anschließend werden auf Basis epidemiologischer und klinischer Daten mögliche Therapieoptionen in arriba® einfach und verständlich visualisiert und erleichtern so die gemeinsame Therapieentscheidung.

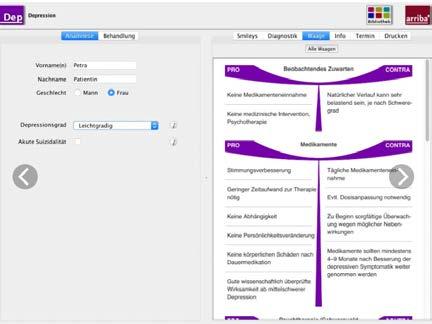
arriba® im Rahmen der HZV kostenfrei Hausärztinnen und Hausärzte, die an der HZV teilnehmen, können die arriba®-Module Depression, Kardiovaskuläre Prävention und Orale Antikoagulation bei Vorhofflimmern über ihren Arztportal-Zugang (arztportal. hausaerzteverband.de) kostenfrei herunterladen. Ein weiterer Vorteil: Zahlreiche Krankenkassen vergüten den Einsatz bestimmter arriba®-Module im Rahmen ihrer Verträge zur Hausarztzentrierten Versorgung. Interessierte Hausärztinnen und Hausärzte können sich hierzu unter www.hzv.de oder auf der Homepage ihres Hausärzteverbandes informieren.
INFOS
Wie genau der Einsatz von arriba® aussehen kann, zeigt ein Schulungsvideo am Beispiel des Moduls „Depression“.
FORTBILDUNG
Biologika und Biosimilars
Die Arzneimittel-Richtlinie des G-BA enthält seit November 2020 Hinweise für eine wirtschaftliche Verordnung von biotechnologisch hergestellten biologischen Arzneimitteln. Der für den Sommer 2022 geplante Beschluss des G-BA über die Möglichkeiten zum Austausch von verordneten Biologika in Apotheken wurde auf 2023 verschoben. Dass Hausärztinnen und -ärzte dennoch gut über Biologika und Biosimilars informiert sind, ist in Hinblick auf die dann möglicherweise anstehende automatische Substitution besonders wichtig. Im Fokus dieser Fortbildung stehen die immunmodulatorisch wirksamen Biologika und ihre Anwendung bei den Indikationen Psoriasis und rheumatoide Arthritis.
INHALT
• Biologika
Biosimilars

An der Umstellung (Switch) führt kein Weg vorbei
Psoriasis
Schweregradeinteilung
Therapie
Auch auf Herz und Gefäße achten
Rheumatoide Arthritis
Therapie
Medikamentensicherheit
Infektionen und Impfungen
Malignome
Rituximab und COVID-19
Ein Fall aus der Praxis
AUTOR
• Dr. Reinhard Merz (Interessenkonflikte: keine)
Biotechnisch hergestellte Arzneimittel (Biologika) unterscheiden sich in vielen Punkten von den chemisch synthetisierten „small molecules“.
•
Biosimilars können zur Entlastung des Gesundheitssystems beitragen. Es handelt sich um ein biologisches Arzneimittel, das einem bereits existierenden Arzneimittel (dem Referenzarzneimittel RAM) ähnelt. Es muss genauso wirksam und sicher wie das Referenzarzneimittel sein.
•
Die Gleichwertigkeit von Biosimilars für Patienten, die zum ersten Mal ein Biologikum verordnet bekommen, gilt mittlerweile als unstrittig.
•
Die Verordnung von Biologika wird aufgrund der hohen Kosten von den Kassen häufig geprüft. Hier besteht konkrete Regressgefahr. Bei den in den Rahmenvorgaben (KVen / GKV) aufgeführten Biologika ist die Verordnung der Originalpräparate daher nicht zu empfehlen – das betrifft auch Patienten, die schon länger auf das Originalpräparat eingestellt sind.
•
Für die Behandlung der Psoriasis vulgaris ist seit Februar 2021 die aktuelle Version der deutschen S3-Leitlinie verfügbar. Sie beschreibt den Einsatz der Basistherapie, der topischen Therapie bei leichter Psoriasis und der sytemischen Therapie bei mittelschwerer und schwerer Psoriasis.
•
Psoriasis-Patienten haben ein erhöhtes Risiko für Herz-Kreislauf-Erkrankungen. Sie müssen darauf aufmerksam gemacht werden, dass eine adäquate Behandlung der Haut auch für die Reduktion des kardiovaskulären Risikos von zentraler Bedeutung ist.
•
Bei der rheumatoiden Arthritis ist die zielgerichtete Therapie (Treat-to-Target) das Therapiekonzept von der Diagnose an. Ziel ist die Krankheitsremission gemessen mit einem validierten Instrument. Bei Verfehlen des Therapieziels soll die Therapie eskaliert werden.
•
Das Spektrum der unerwünschten Arzneimittelwirkungen (UAW) von Biologika unterscheidet sich von dem klassischer, niedermolekularer Wirkstoffe. In der Akutphase sind das v. a. Zytokinfreisetzungssyndrom und Hypersensitivität. Die Immunogenität der Biologika kann aber auch langfristige klinische Konsequenzen haben.
•
Allen in der Therapie der Psoriasis und der rheumatoiden Arthritis verwendeten Biologika ist gemeinsam, dass sie supprimierend in das Immunsystem eingreifen. Patienten werden also in einen immunsupprimierten Status versetzt. Aus den in klinischen Studien dokumentierten unerwünschten Ereignissen stechen allgemeine und opportunistische Infektionen als häufigstes Problem hervor.
•
Mit zunehmendem Alter der Patienten muss nicht nur mit gehäuftem Auftreten, sondern auch mit schwereren Verläufen von Infektionen gerechnet werden.
•
Die Entscheidung über die Verordnung eines Originator-Produktes oder eines Biosimilars unterliegt der Therapiehoheit des Arztes. Vor diesem Hintergrund prüfen viele Kassen, ob zu Verordnungen eines Biologikums wirtschaftlichere Alternativen vorlagen. Dabei gelten Biosimilars, zu denen die AOK Baden-Württemberg einen Rabattvertrag abgeschlossen hat, während der Vertragslaufzeit stets als die wirtschaftlichste Alternative.
Biologika
Das Prinzip gentechnisch hergestellter Arzneimittel (Biopharmazeutika oder Biologika) wurde 1982 erstmals mit der Produktion von Humaninsulin in E. coli realisiert. Heute sind 323 Arzneimittel mit 286 Wirkstoffen (Stand Juni 2022) gemäß dem 1995 eingeführten zentralisierten EU-Verfahren zugelassen [1].
Biotechnisch hergestellte Biologika unterscheiden sich in vielen Punkten von den chemisch synthetisierten „small molecules“. Chemische Arzneimittel bestehen aus rund zwei Dutzend bis wenige hundert Atomen (ASS = 21 Atome, Ramipril = 62 Atome), haben eine relativ einfache Molekülstruktur und werden üblicherweise oral angewendet. Biologika bestehen aus mehreren Hundert bis Tausenden Atomen (Insulin = ca. 790 Atome, monoklonale Antikörper ca. 25.000 Atome), sind hochkomplex aufgebaute Proteine, strukturell heterogen (Mischung nahe verwandter Moleküle) und werden üblicherweise als Injektion verabreicht. Die Wirkung der Biologika kommt immer durch ihre dreidimensionale Tertiärstruktur zustande. Diese wird bereits durch geringe Energieeinträge (Erwärmung, Agitation) gestört, die aktive („native“) Struktur geht in eine inaktive („denaturierte“) Struktur über. Da Biologika keine extremen pH-Werte tolerieren, sind die Wirkstoffe immer parenteral zu applizieren. Die strukturelle Übereinstimmung mit dem molekularen Vorbild ist vielfach von untergeordneter Bedeutung, mehr als die Hälfte aller derzeit zugelassenen rekombinanten Wirkstoffe kann man als „nicht naturidentisch“ einstufen. So besteht Etanercept aus Teilen
des humanen TNF-Rezeptors und Teilen eines humanen Antikörpermoleküls. Therapeutisch wirksame Antikörper haben eine besonders hohe molekulare Komplexität mit multiplen Funktionszentren. Sie binden mit ihren variablen Regionen an spezifische molekulare Oberflächen, was zur funktionellen Aktivierung der konstanten Region der schweren Ketten führt, die daraufhin mit Makrophagen oder natürlichen Killerzellen interagieren. Zudem sind Antikörper komplex glykosyliert, was die biologische Halbwertszeit und die Interaktion mit anderen Komponenten des Immunsystems beeinflusst. Biologika sind mittlerweile von hoher therapeutischer und wirtschaftlicher Relevanz. Ihr Umsatz erhöhte sich 2020 gegenüber 2019 um 14 % auf 14,6 Milliarden Euro, der Anteil am Arzneimittelmarkt stieg von 29,0 % auf 30,8 % [2]. Sie gehören fast ausnahmslos zu den sehr hochpreisigen Arzneimitteln mit hohen finanziellen Belastungen für das Gesundheitssystem.
Biosimilars
Nachahmerprodukte, sogenannte Biosimilars, können zur Entlastung des Gesundheitssystems beitragen. Die EMA definiert Biosimilars als „… biologisches Arzneimittel, das derart entwickelt wurde, dass es einem bereits existierenden Arzneimittel (dem Referenzarzneimittel RAM) ähnelt.“ Es muss dennoch genauso wirksam und sicher wie das Referenzarzneimittel sein und wird gewöhnlich – aber nicht notwendigerweise –in derselben Dosis zur Behandlung derselben Krankheiten verwendet.
Biotechnisch hergestellte Biologika unterscheiden sich in vielen Punkten von den chemisch synthetisierten „small molecules“
Biosimilars können zur Entlastung des Gesundheitssystems beitragen
Während der Wirkstoff eines Generikums identisch mit dem des Originalpräparats ist, ist ein Biosimilar nur ähnlich zum Original. Das liegt an der unvermeidlichen Mikroheterogenität dieser komplexen Wirkstoffe. Die zusätzlichen Studien zur Wirksamkeit und Sicherheit machen die Entwicklung eines Biosimilars deutlich aufwendiger (Abb. 1) Während ein Generikum in 3–5 Jahren mit einem Kostenaufwand von 1–5 Mio. € entwickelt werden kann, dauert das bei einem Biosimilar 8–10 Jahre und kostet 100–200 Mio. Euro. Der Prozess der Patentabläufe beschleunigt sich zurzeit rasant und mit Etanercept (Enbrel®), Rituximab (Rituxan®), Infliximab (Remicade®) und Adalimumab (Humira®) sind mittlerweile für vier dieser immunmodulatorisch wirksamen Antikörper Biosimilars verfügbar [3] (Tab. 1).
Abb. 1 ANFORDERUNGEN FÜR DIE ZULASSUNG VON GENERIKA UND BIOSIMILARS
Referenzarzneimittel auf ein Biosimilar weder die Wirksamkeit noch die Sicherheit der Therapie negativ beeinflusst [4, 6–9]. Die Rahmenvorgaben der KVen und des GKVSpitzenverbandes benennen zur Kostendämpfung daher Verordnungsmindestquoten. Voraussetzung für einen Aut-idem-Austausch wird die Feststellung der Austauschbarkeit durch den G-BA sein. Das verordnete Biologikum muss zudem über eine Zulassung für die Indikation verfügen, für die es eingesetzt werden soll [10].
Beim Wechsel von einem RAM auf ein Biosimilar können ggf. negative Auswirkungen des Nocebo-Effekts eine Rolle spielen [11]. Eine Reihe von Strategien soll helfen, den Effekt in der Praxis zu reduzieren:
• einen positiven Rahmen für die Einführung des Biosimilars setzen („Framing“),
• das Wissen über das Biosimilar vergrößern (Patienten und Therapeuten)
• die Anwendung standardisierter Switching-Programme [12]
In einer Studie erhöhte positives Framing signifikant die Bereitschaft, auf ein Biosimilar umzusteigen (2,4-mal häufiger) sowie die wahrgenommene Wirksamkeit der Therapie [13]. Eine aktuelle britische Studie bestätigte die Ergebnisse [14]. Die Arzneimittelkommission hat Fragen, die im Vorfeld adressiert werden sollten, zusammengestellt [4]. Die wichtigsten Punkte:
An der Umstellung (Switch) führt kein Weg vorbei
• Warum wird der Patient umgestellt?
Die Verordnung von Biologicals wird aufgrund der hohen Kosten von den Kassen häufig geprüft
Die Gleichwertigkeit von Biosimilars für Patienten, die zum ersten Mal ein Biologikum verordnet bekommen, gilt mittlerweile als unstrittig. Verunsicherung besteht jedoch bezüglich der Austauschbarkeit des RAM mit einem Biosimilar oder von Biosimilars untereinander (Switch): Ärztinnen und Ärzte waren deswegen sehr zurückhaltend bei der Umstellung von Patientinnen und Patienten auf ein Biosimilar, die unter Umständen über Jahre erfolgreich mit dem Referenzarzneimittel behandelt worden waren [4, 5]. In der Zwischenzeit konnten viele Studien und Metaanalysen auch für die immunmodulatorisch wirksamen Antikörper zeigen, dass der Switch von einem
• Wie wird das jeweilige Biosimilar verabreicht (Dosierung, Handhabung des Devices)?
• Weitere Informationen zu den Biosimilars (Patienteninformation, Schulungsmaterial) sollten übergeben werden.
CAVE: Die Verordnung von Biologicals wird aufgrund der hohen Kosten von den Kassen häufig geprüft. Hier besteht konkrete Regressgefahr.
Bei den in den Rahmenvorgaben (KVen / GKV) aufgeführten Biologika ist die Verordnung der Originalpräparate daher nicht zu empfehlen – das betrifft auch Patienten, die schon länger auf das Originalpräparat eingestellt sind.
Psoriasis
Psoriasis als chronische, rezidivierende, entzündliche Erkrankung von Haut, Kopfhaut, Nägeln und Gelenken präsentiert sich klinisch heterogen. Am häufigsten ist die chronische Psoriasis vom Plaque-Typ [15].
Neben einer genetischen Prädisposition tragen Risikofaktoren wie die Adipositas zur Krankheitsentstehung bei. Triggerfaktoren können zu Schüben der Erkrankung führen. Der mit Abstand häufigste Triggerfaktor ist Stress, relevant sind auch Infekte, Nikotinabusus, Alkoholkonsum und Betablocker (v. a. lipophile) [15].
Neben der chronischen Entzündung der Haut birgt Psoriasis auch ein erhöhtes Risiko für Entzündungen der Gelenke, des Herzens und der Blutgefäße. Aktuelle Studien legen nahe, dass es eine hochsignifikante Korrelation zwischen dem Schweregrad der Schuppenflechte und dem Grad einer Gefäßentzündung gibt [16].
Stimuliert durch Triggerfaktoren produzieren Immunzellen (dendritische Zellen, Makrophagen) in der Haut von genetisch prädeterminierten Personen IL-6 und IL-23. und im Rahmen der Inflammationskaskade werden weitere Zytokine (u. a. TNFα, IL-17A) gebildet und freigesetzt [17, 18]. Mittlerweile weiß man, dass die schwere Psoriasis ein eigenständiger kardiovaskulärer Risikofaktor ist [18].
Schweregradeinteilung
Gebräuchlich sind der Prozentsatz der erkrankten Körperoberfläche (Body Surface Area, BSA, in Prozent) sowie der Psoriasis Area and Severety Index (PASI, von 0 bis 72 Punkten). Die Leitlinie definiert eine Psoriasis als mittelschwer bis schwer, wenn der PASI oder BSA mehr als 10 bzw. 10 % betragen [19].
Im Praxisalltag gibt es Patienten, die keinen PASI / BSA > 10 erreichen, aber dennoch eine starke Beeinträchtigung ihrer Lebensqualität haben, weil sensitive Areale der Haut von Läsionen betroffen sind. In solchen Fällen können ggf. die „Upgrade-Kriterien“ beachtet
PASI – Berechnung und Stufen
Kopf (Punktsumme x 0,1)
Fläche
Fläche
Arme (Punktsumme x 0,3)
Körper (Punktsumme x 0,2)
Beine (Punktsumme x 0,4)
Gebräuchlich zur Schweregradeinteilung der Psoriasis sind die Indizes BSA und PASI
Der Kopf wird mit 0,1, der Stamm mit 0,3, die obere Extremität mit 0,2 und die untere Extremität mit 0,4 gewichtet. Der PASI kann Werte von 0 bis 72 annehmen und berechnet sich nach einer komplexen Formel. Rechner im Internet erleichtern diese Berechnung. PASI-Werte ≤ 10 gelten als leichte Psoriasis, Werte > 10 als mittelschwere bis schwere Form.
Die schwere Psoriasis ist ein eigenständiger kardiovaskulärer Risikofaktor
werden, die trotz niedrigem PASI und BSA die Klassifikation der Schuppenflechte als mittelschwer bis schwer zulassen [19, 20].
Dazu zählen:
• Befall sichtbarer Körperregionen (Gesicht)
• Psoriasis capitis
• Genitalbefall
• Befall der Handinnenflächen und Fußsohlen
• Nagelbeteiligung mit Onycholyse oder Onychodystrophie von mehr als zwei Fingernägeln
• starker Pruritus, der zum Kratzen führt
• Bestehen von therapieresistenten einzelnen Plaques
Therapie
Für die Behandlung der Psoriasis vulgaris ist seit Februar 2021 die aktuelle Version der deutschen S3-Leitlinie verfügbar. Sie umfasst fast alle derzeit zugelassenen Therapieoptionen und gibt Hilfestellung bei besonderen klinischen Situationen und bei die Therapie beeinflussenden Begleiterkrankungen [19, 20]. Die Behandlung besteht aus Basisempfehlungen für alle Patienten und zusätzlich je nach Schweregrad aus topi-
schen und / oder systemischen Therapien (Abb. 2).
Basistherapie
Eine Eigentherapie der Patientinnen und Patienten mit Feuchtigkeitsbehandlung und Entfernung der Schuppen vor der topischen Therapie ist wichtig. Zur Basistherapie nutzt man wirkstofffreie Salbengrundlagen sowie topische Zubereitungen von Harnstoff und Salicylsäure (jeweils 3–10 %, verschreibungspflichtig). Die Empfehlungen für die Eigentherapie lauten:
• Tägliche Feuchtigkeitszufuhr mithilfe von Feuchtigkeitscremes und häufigen Ölbädern in Alltag integrieren.
• Die Entfernung der Schuppen ist eine Bedingung dafür, dass weitere lokale Therapiemaßnahmen wirken können.
Natürliche Sonnenstrahlung und Salzwasser- bzw. Meerwasserbäder haben bei den meisten Patientinnen und Patienten mit Psoriasis positive Wirkung. Dabei gilt es, Sonnenbrände zu vermeiden, da diese im Sinne zur Verschlimmerung der Erkrankung beitragen können.
Leichte Psoriasis
Für die leichte Psoriasis kommen topische Wirkstoffe zum Einsatz [19]:
• Was ist zum Start einer systemischen Therapie empfohlen? Die Einleitung einer “konventionellen” Systemtherapie wird entsprechend des Wirtschaftlichkeitsgebots empfohlen.
• Wann ist MTX indiziert? Bei Patienten mit einer mittelschweren bis schweren Psoriasis mit einer aktiven peripheren Gelenkbeteiligung oder bei einer potenziell schlechteren Prognose aufgrund von Polyarthritiden, erhöhten Entzündungsmarkern und erosiven Veränderungen trotz des Einsatzes von NSAR/Coxiben oder ggf. GlukokortikoidInjektionen. Eine frühzeitige Einleitung der Therapie mit einem konventionellen synthetischen DMARD (MTX) wird empfohlen, um ein Voranschreiten der Erkrankung und eine erosive Zerstörung der Gelenke zu verhindern.
• Wann kann ein Biologikum eingesetzt werden? Die Einleitung einer Therapie mittels Biologikum wird empfohlen, wenn die konventionelle Therapie keinen ausreichenden Therapieerfolg gezeigt hat oder unverträglich ist oder kontraindiziert ist.
• Schnittstelle Rheumatologe: Es wird empfohlen, die Diagnosestellung und Therapieauswahl bei einer Psoriasis-Arthritis interdisziplinär in Kooperation mit einem Rheumatologen durchzuführen, wann immer dies erforderlich ist.
• Calcineurininhibitoren (Tacrolimus und Pimecrolimus): nur erwägen bei Lokalisation im Gesicht, Intertrigines oder Genitoanalbereich (mittlere Evidenz).
• Glukokortikoide: ab Klasse III zur Induktionstherapie bei leichter bis mittelschwerer Psoriasis (sehr hohe Evidenz), unter Abwägen der erhöhten Risiken auch mit Klasse IV (hohe Evidenz). Für das Risiko einer dermalen Atrophie durch eine Langzeitbehandlung fehlt es weiterhin an Beweisen.
• Vitamin D und Analoga (u. a. Calcipotriol und Calcitriol): zur Induktionsbehandlung bei leichter bis mittelschwerer Psoriasis (sehr hohe Evidenz); Kombination von Vitamin-D-Derivaten mit Kortikoiden zur Induktion (sehr hohe Evidenz).
Wenn konventionelle Therapien keinen ausreichenden Therapieerfolg erwarten lassen***
*** z. B. besonders schwere Ausprägung (z. B. PASI ≥ 20) oder rasche Verschlechterung oder schwere Beteiligung der Nägel oder des Genitalbereichs oder der Kopfhaut oder besonders hohe Beeinträchtigung der Lebensqualität (z. B. DLQI ≥ 15)
Adalimumab (anti-TNF α )
Brodalumab (anti-IL-17)
Certolizumab (anti-TNF α )
Guselkumab (anti-IL-23) Ixekizumab (anti-IL-17) Risankizumab (anti-IL-23) Secukinumab (anti-IL-17) Tildrakizumab (anti-IL-23)
ggf. BEGLEITENDE PSYCHOSOZIALE THERAPIE
ggf. TOPISCHE THERAPIE
Etanercept
alpha)
ggf.
Die Systemtherapie der Psoriasis sollte nur erfolgen, wenn die klassischen externen Behandlungsmethoden ausgeschöpft sind
Tab. 2: FÜR
DIE THERAPIE DER PSORIASIS ZUGELASSENE BIOLOGIKA Klasse
Wirkstoffe
Adalimumab, Certolizumab, Etanercept, Infliximab anti-IL-17a Ixekizumab, Secukinumab anti-IL-17a und -17F Bimekizumab anti-IL-17RA Brodalumab anti-IL-23
anti-TNF α
Guselkumab, Risankizumab, Tildrakizumab anti-IL-12/23 Ustekinumab
• Phototherapie: UV-B und PUVA zur Induktion bei großflächiger Erkrankung und mittelschwerer bis schwerer Psoriasis (sehr hohe Evidenz); UV-B als Phototherapie der ersten Wahl zur Induktion wegen geringeren Malignitätsrisikos und besserer Praktikabilität (hohe Evidenz). Wegen der Risiken durch die kumulative UV-Dosis nicht zur Langzeittherapie empfohlen.
Ein Cochrane-Review sieht die Kombination aus Steroid plus Vitamin-D-Derivat wirksamer als jeder der Wirkstoffe allein [21].
Mittelschwere und schwere Psoriasis
Bei schwerer Psoriasis erfolgt eine Phototherapie (UV-B, PUVA oral oder Creme / Bade-PUVA) oder eine systemische Behandlung. Die Indikation zur Systemtherapie der Psoriasis sollte nur gestellt werden, wenn die klassischen externen Behandlungsmethoden ausreichend ausgeschöpft sind und durch diese externen Therapieansätze kein akzeptabler Hautzustand zu erreichen ist und lange (mehr als 2 Monate pro Jahr) Krankheitsperioden mit erheblichem Leidensdruck bestehen. Für die Psoriasis zugelassene Medikamente sind [22]:
• Fumarsäureester (z. B. Skilarence®, Fumaderm®): günstige Nutzen-RisikoRelation. Als Langzeittherapie geeignete Therapie. Die pharmakologischen Effekte der Fumarsäureester sind bis heute noch nicht ausreichend bekannt. Kombinationen mit anderen systemischen Antipsoriatika wie (MTX, Ciclosporin, Retinoide) sind nicht zu empfehlen. Laboruntersu-
chungen mit Blutbildkontrollen, Kontrolle der Leber- und Nierenfunktion sowie Urinstatus sind 4-wöchentlich notwendig.
• Acitretin (Neotigason®): Vitamin A-Derivat, verursacht raschen Verlust der psoriatischen Schuppung. Klinische Erscheinungsfreiheit wird bei der Psoriasis vulgaris in nahezu 25 % der Patienten erreicht. Lange Halbwertszeit (80–100 Tage) und Teratogenität reduzieren die Einsatzmöglichkeiten bei Frauen im gebärfähigen Alter. Eine Schwangerschaft sollte unbedingt verhindert werden.
• Ciclosporin A: Hohe Ansprechrate, Nephrotoxizität und mögliche Kanzerogenität in der Langzeittherapie sind bekannte NW. Regelmäßige Laborkontrollen, insbesondere des Blut-, Leber-, und Nierenstatus, sind erforderlich.
• Glukokortikoide: Nur sehr kurzfristig (2–3 Tage) bei hoher Schubaktivität einsetzbar, keine systemische Langzeitgabe.
• Methotrexat (MTX): MTX hat einen gesicherten klinischen Effekt bei der mittelschweren und schweren Psoriasis vulgaris und ist gemäß der Deutschen und der Europäischen S3-Leitlinie geeignet.
• Einphasentherapie: Wöchentliche einmalige Applikation von 7,5–25 mg MTX.
• Akute Toxizität ist selten (ältere Menschen mit eingeschränkter Nierenfunktion). Initiale Applikation von 2,5 mg p. o. oder i. m.; nach 5–7 Tagen Kontrolle des Blutbildes; falls neutroph. Leukoz. unter Norm: Therapieabbruch.
• Langzeitapplikation verursacht bei etwa 33 % der Patienten Leberwertveränderungen. Regelmäßige Kontrollen der Blut-, Leber- und Nierenwerte (14-tägig) sind notwendig. Ebenso sind halbjährliche sonografische Leberuntersuchungen zu empfehlen.
• Apremilast (Otezla®), orales ThalidomidAnalogon (Phosphodiesterase-4-Inhibitor)
• Leflunomid (Arava®) ist zugelassen für die Therapie der Psoriasisarthritis.
Außerdem sind verschiedene Biologika für die Therapie der Psoriasis zugelassen (Tab. 2). Deren Einsatz ist gerechtfertigt, wenn bisher andere für die Erkrankung etablierte und kostengünstigere Therapieformen sich entweder als unwirksam, nicht verfügbar, kontraindiziert erwiesen haben oder wegen unerwünschter Arzneimittelwirkungen nicht verabreicht werden konnten. Ein Patient sollte – unter Berücksichtigung der individuellen Kontraindikationen – vor Verordnung von Biologika das gesamte etablierte Therapiespektrum kostengünstigerer Behandlungsmaßnahmen bis zur mangelnden Wirksamkeit durchlaufen haben. In Einzelfällen ist aber auch der primäre Einsatz der für die Primärtherapie zugelassenen Biologika bei schwerstbetroffenen Patienten denkbar und durch Vereinbarungen zu bundesweiten Praxisbesonderheiten gedeckt.
Das minimale Therapieziel nach Beendigung der Induktionstherapie (in der Regel nach 10 bis 16 Wochen Behandlungszeit) sollte das Erreichen einer 75 %-igen Verbesserung des PASI sein (PASI-75-Ansprechen). Alternativ wäre ein Minimalziel auch bei einer Reduktion des PASI um 50 % erreicht, wenn gleichzeitig eine gute Lebensqualität erzielt werden konnte.
Auch auf Herz und Gefäße achten
Das erhöhte Risiko für Herz-KreislaufErkrankungen bei der Psoriasis ist nicht von der Hand zu weisen [18]. Insgesamt scheint die IL-17A mediierte, chronische Hautentzündung bei schwerer Psoriasis zu einer Entzündung in der Gefäßwand zu führen.
Das erfordert einen interdisziplinären medizinischen Versorgungsansatz mit dermatologischer und hausärztlicher / kardiologischer Betreuung. Bei Psoriasis besteht selbst ohne klassisches kardiovaskuläres Risikoprofil ein erhöhtes kardiovaskuläres Risiko.
Der exakte Mechanismus der Haut-GefäßInteraktion ist noch nicht abschließend geklärt. Eine adäquate Behandlung der Hautinflammation ist für die Reduktion des kardiovaskulären Risikos jedoch wesentlich. Verschiedene Surrogatmarker der Atherosklerose ließen sich unter effektiver antipsoriatischer Therapie (Biologika, Fumarsäure, MTX oder Cyclosporin) eindämmen [23]. Eine strikte Vermeidung weiterer kardiovaskulärer Risikofaktoren ist somit unbedingt nötig. Als behandelnder Hausarzt ist bei Psoriatikern ähnlich wie bei Diabetikern und anderen kardiovaskulären Risikopatienten eine adäquate Blutdruckeinstellung obligat (am besten inklusive Langzeitblutdruckmessung zur Kontrolle), zudem eine strikte Reduktion aller übrigen kardiovaskulären Risikofaktoren [24].
Der Psoriasispatient muss darauf aufmerksam gemacht werden, dass eine adäquate Behandlung seiner Haut auch für die Reduktion seines kardiovaskulären Risikoprofils von zentraler Bedeutung ist. Gerade Psoriasispatienten in jungem Lebensalter sollten bei ersten Symptomen intensiv kardiologisch abgeklärt werden.
Psoriasis-Arthritis – ein häufiges Phänomen
Der Einsatz von Biologika ist gerechtfertigt, wenn andere Therapieformen sich als unwirksam oder kontraindiziert erwiesen haben bzw. wegen UAW nicht verabreicht werden konnten
Arthritiden sind bei Psoriasis-Patienten ein häufiges Phänomen (6–42 %). Diese chronisch-progredient verlaufende, entzündliche, muskuloskelettale Psoriasis-Arthritis (PsA) entwickelt sich häufig mehrere Jahre nach Psoriasis und birgt unbehandelt Gefahr von Gelenkzerstörung und Behinderung. Auch Patienten mit milder Psoriasis können an schwerer PsA leiden, da die Schwere von Haut- und Gelenksymptomen nicht korreliert.
Die Leitlinien der Deutschen Gesellschaft für Dermatologie empfiehlt eine frühzeitige Therapie mit DMARDs (Disease Modifying Anti-Rheumatic Drugs) innerhalb von 6 Monaten nach Auftreten erster Gelenksymptome um strukturelle Gelenkschäden und Funktionsverluste zu verhindern.
Alle Patienten sollen von der Diagnosestellung einer rheumatoiden Arthritis an mit DMARDs behandelt werden
Rheumatoide Arthritis
Die rheumatoide Arthritis (RA) ist eine Krankheit, die keinen Aufschub verträgt. Bei neu aufgetretenen Gelenkschwellungen sollte eine Diagnose deshalb innerhalb von 6 Wochen gesichert werden. Differenzialdiagnostisch zu unterscheiden ist die Arthrose als degenerative, nicht-entzündliche Erkrankung des Knorpels eines Gelenks, die meist als physiologische Alterserscheinung auftritt. Erhöhte Belastungszustände in
C-reaktives Protein, CRP) auf, die dann auch gut die Krankheitsaktivität widerspiegeln. Spezifische Labortests, welche die Diagnose einer RA erhärten, sind Untersuchungen auf Antikörper (Ak) gegen (cyclische) citrullinierte Peptide (CCP) und auf IgM-Rheumafaktoren (RF).
Kriterien der CSA
• Dauer der Symptome unter einem Jahr
• Beschwerden an den MCP-Gelenken
• Morgensteifigkeit ≥ 60 Minuten
• stärkste Beschwerden in den Morgenstunden
• Familienangehörige 1. Grades mit RA
• Schwierigkeiten beim Faustschluss
• positiver „Querdruckschmerz“ an MCP-Gelenken
Ab drei positiven Kriterien besteht ein erhöhtes Risiko für die Entwicklung einer RA. Die Sensitivität beträgt 90 %. Um auch eine Spezifität von 90 % zu erreichen, müssen mindestens vier Kriterien zutreffen.
einem Gelenkabschnitt verstärken dabei das Risiko (bspw. Übergewicht, starke einseitige Belastung oder Gelenkfehlstellungen).
Die klinische Untersuchung sollte einen Ganzkörperstatus beinhalten.
Die Bildgebung über Röntgen ist nach wie vor erforderlich, Sonografie (Powerdoppler) und Kernspintomografie erfassen den Befall eines Gelenkabschnittes jedoch zu einem früheren Zeitpunkt. Neben Bildgebung und Labor wurden objektivierbare Kriterien entwickelt, die es ermöglichen, Patienten mit einem erhöhten Risiko für eine manifeste RA mit Gelenkdestruktion zu entwickeln. Dies wird unter dem Begriff der „clinically suspect arthralgia“ (CSA) subsummiert (Kasten). Die CSA ist keine eigenständige Erkrankung, sondern ein Komplex aus Symptomen und Zeichen.
Therapie
Wenn die Remission nach spätestens 6 Monaten nicht erreicht ist, soll die Therapie angepasst werden
Patienten mit einer aktiven RA weisen meist unspezifische serologische Entzündungszeichen (Blutsenkungsgeschwindigkeit, BSG;
Die zielgerichtete Therapie (Treat-to-Target) ist heute das Therapiekonzept der RA von der Diagnose an. Ziel ist die Krankheitsremission gemessen mit einem validierten Instrument (Kasten). Alle Patienten sollen von der Diagnosestellung einer rheumatoiden Arthritis an mit DMARDs (DMARD: Disease Modyfying Anti Rheumatic Drug) behandelt werden, um eine Verzögerung der
Validierte Instrumente zum Messen der Krankheitsaktivität
ACR-Kriterien
Ermittelt werden die Anzahl schmerzempfindlicher Gelenke (von 68), Anzahl geschwollener Gelenke (von 66), Einstufung der Schmerzen durch den Patienten, Grad der Funktionseinschränkung, CRP-Wert, Gesamteinschätzung der Erkrankung durch den Patienten und Gesamteinschätzung der Erkrankung durch den Arzt. Ein ACR-20-Ansprechen ist definiert als Reduzierung des Gelenkbefalls um 20 % sowie Verbesserung um mindestens 20 % von drei der weiteren fünf Beurteilungskriterien.
DAS 28
Der DAS (Disease Activity Score) 28 ermittelt die Krankheitsaktivität über 28 Gelenke (Abb. rechts).
Krankheitsprogression zu erzielen und damit die Langzeitprognose zu verbessern [25] (Abb. 3). Zur Gruppe der DMARDs gehören csDMARDs (konventionelle synthetische DMARDs), tsDMARDs (zielgerichtete synthetische DMARDs) und bDMARDs (biologische DMARDs).
Theoretisch sollten solche Patienten möglichst zeitnah einem Rheumatologen vorgestellt werden, organisatorisch stellt das aber eine besondere Herausforderung dar. Die Wartezeiten betragen bis zu 6 Monate. Um das therapeutische Fenster zu nutzen, sollte in solchen Fällen die Therapie vom Hausarzt initiiert und geführt werden. Die Krankheitsaktivität soll dabei regelmäßig erfasst und dokumentiert werden. Unter den csDMARD in der Monotherapie ist Methotrexat (MTX) seitens der Wirksamkeit und Verträglichkeit zu bevorzugen. Als Starttherapie führt MTX in 20–30 % der Fälle zu einer DAS-Remission. Bei zusätzlicher Verwendung von Kortikoiden kann nach 16 Wochen eine Remissionsrate von 74 %, nach einem Jahr eine von 60,2 % erreicht werden [26]. Das am zweithäufigsten verwendete csDMARD ist Leflunomid, gefolgt von Sulfasalazin und Cyclosporin A. Eine ausführliche Aufklärung des Patienten zu MTX ist erforderlich, um eine möglichst hohe Therapiesicherheit und Therapieadhärenz zu erzielen [27]. Zusätzlich erfordert eine präferierte parenterale (überwiegend s. c.) Gabe von MTX eine intensive Anleitung und Beratung des Patienten. Der Patient sollte über beide Varianten intensiv beraten werden, gemeinsame Entscheidungsfindung zur Applikationsform vor Therapiebeginn und bei erforderlicher Therapieumstellung. Notwendiges Monitoring umfasst Differenzialblutbild, GPT, gGT, GFR:
• vor Therapie
• nach 2–3 Wochen
• dann alle 3–4 Wochen
• ab 4. Monat quartalsweise
Wenn das Ziel der Therapie, die Remission, nach spätestens 6 Monaten nicht erreicht ist, soll die Therapie angepasst werden. Bei Patienten, die nicht ausreichend auf eine csDMARD-Therapie ansprechen, ist ein biologisches bDMARD oder ein zielgerichte-
Abb. 3 THERAPIEALGORITHMUS RHEUMATOIDE ARTHRITIS [25]
Kontraindikation gegen MTX?
Methotrexat + Glukokortikoid
Therapieanpassung in Woche 6
Response in Woche 12?
ja
Target erreicht in Woche 12?
Target erreicht in Woche 24?
2 3
Eskalation
0 1 4 5 6 7 9
Patient mit RA Phase 1
ja ja
Leflunomid oder Sulfasalazin + Glukokortikoid nein nein nein nein
sofortige Eskalation DMARD fortsetzen Glukokortikoid weiter ausschleichen
keine Response nach 12 Wochen bzw. Verfehlen des Target nach 24 Wochen
ungünstige Prognose und / oder hohe Aktivität?
nein
zweite csDMARD-Strategie
Response innerhalb von 12 Wochen bzw. Erreichen des Target nach 24 Wochen?
Patient mit RA Phase 1
ja
Therapie fortsetzen, Glukokortikoid absetzen
Patient mit RA Phase 1 0 1 2 4 5 6 1 3
8 10 11
ja
nein
Therapie fortsetzen
Phase 1 Phase 2 Phase 3
3
bDMARD oder tsDMARD möglichst Kombi mit MTX (Phase 3) ja
Response innerhalb von 12 Wochen bzw. Erreichen des Target nach 24 Wochen? ja
0 2 4 fortsetzen
Wechsel des bDMARD bzw. Wechsel von tsDMARD auf bDMARD bzw. Wechsel von bDMARD auf ts DMARD(Phase 3)
nein nein
Response innerhalb von 12 Wochen bzw. Erreichen des Target nach 24 Wochen?
In direkten Vergleichen waren Wirksamkeit und UAW von Referenzarzneimittel und Biosimilars vergleichbar
Tab. 3: FÜR DIE THERAPIE DER RA ZUGELASSENE BIOSIMILARS
Wirkstoff Biosimilar Adalimumab Amgevita Solymbic Imraldi Hulio Hyrimo Hefiya Idacio Amsparity Yuflyma Etanercept Benepali Erelzi Nepexto Infliximab Inflectra Remsima Flixabi Zessly Rituximab Truxima Rixathon Riximyo Ritemvia Ruxience in Baden-Württemberg rabattierte Präparate
tes synthetisches tsDMARD als Kombinationspartner in der Eskalation der Therapie der nächste Schritt. Spätestens jetzt sollte der Rheumatologe hinzugezogen werden. Neben den vier Original Biologicals (boDMARDs) sind mittlerweile auch eine Reihe von Biosimilars (bsDMARDS) für die Therapie der RA zugelassen (Tab. 3) Neben der Prüfung bezüglich Sicherheit und Wirksamkeit der Biosimilars im Vergleich zu den Referenzpräparaten wurden Studien zur Vergleichbarkeit einzelner Biosimilars untereinander durchgeführt. Die Sicherheit bzw. die UAWs der Arzneimittel waren in allen Therapiearmen über den gesamten Zeitraum vergleichbar. UAWs waren Pyelonephritis, Urtikaria, Appendizitis, septische Arthritis und Bronchitis. Auch eine Antikörperbildung gegen die Biologika war in den Vergleichsgruppen identisch [28].
Über die Jahre ist eine Remission nur in weniger als der Hälfte der Betroffenen zu
erwarten, weswegen ein rasches und effektives Management der Erkrankung notwendig ist. Die Physiotherapie ist ein wesentlicher Bestandteil der Behandlung von RA-Patienten, auch mit ERA (early RA). Zentrale Elemente der Physiotherapie sind Sport- bzw. Bewegungsprogramme und physikalische Therapie, bei denen die Behandlung individuell auf die jeweilige Situation des Patienten angepasst wird. Sind Handfunktionen betroffen, ist eine gezielte Ergotherapie anzuraten, um Alltagsaktivitäten einschließlich der beruflichen Tätigkeit wieder ausüben zu können [26].
Nichtmedikamentöse Therapie
Neben den Medikamenten kann vor allem Funktions- und Bewegungstraining eine wichtige Säule der Therapie sein. Die Deutsche Rheuma-Liga hat zusammen mit anderen Institutionen und Experten ein spezielles Bewegungstraining entwickelt, das seit vielen Jahren erfolgreich angeboten wird: das Funktionstraining aktiv-hoch-r (www.rheuma-liga.de/angebote/aktiv-hochr). Es bietet speziell auf die Situation abgestimmte Bewegungs- und Trainingseinheiten und ist als Präventionskurs bei den Krankenkassen zugelassen. Zu jeder Kurseinheit gehört neben der Bewegungspraxis ein Informationsteil. Sie erfahren: • wie man ein Bewegungstraining sinnvoll aufbaut und durchführt
• welche Effekte mit welchen Übungen erreicht werden können
• wie Kraft- und Ausdauerübung individuell dosiert werden
• wie Betroffene Strategien entwickeln können, um Bewegung und körperliche Aktivität in ihren Alltag einzubauen Patientenschulungsprogramme, die u.a. auch von der Rheuma-Liga angeboten werden, sollen den Betroffenen Hilfestellungen zur Krankheitsbewältigung geben.
1. Sobald die Diagnose einer RA gestellt ist, soll eine Therapie mit DMARD begonnen werden (A).
2. Das Ziel der Therapie ist das Erreichen und die Erhaltung einer Remission (A).
3. Kontrollen der Krankheitsaktivität sollten bei aktiver Erkrankung häufig (alle 1–3 Monate) und mit einem Composite Score erfolgen. Wenn 3 Monate nach Beginn der Therapie keine Verbesserung zu sehen ist oder wenn nach 6 Monaten das Ziel nicht erreicht wird, sollte die Therapie angepasst werden (B).
4. Methotrexat (MTX) soll als erstes csDMARD eingesetzt werden, ein Vorteil für eine initiale Kombination mehrerer csDMARDs ist nicht sicher belegt (A).
5. Falls MTX nicht einsetzbar ist (z.B. wegen Kontraindikationen), soll die Therapie mit Leflunomid oder mit Sulfasalazin begonnen werden (A)
6. Glukokortikoide (GC) sollten bei initialer Therapie ergänzend zum csDMARD gegeben werden. Empfehlenswert ist eine Startdosis bis 30 mg Prednisolonäquivalent / Tag mit Reduktion auf eine niedrige Dosis („low-dose“) innerhalb von 8 Wochen. Die GC-Therapie soll auf 3–6 Monate beschränkt werden. Eine zusätzliche intraartikuläre GC-Gabe kann sinnvoll sein (A).
7. Bei Verfehlen des Therapieziels mit der optimierten Starttherapie soll die Therapie eskaliertwerden. Bei Fehlen von ungünstigen Prognosefaktoren und moderater Krankheitsaktivität kann eine Kombinationmehrerer csDMARDs eingesetztwerden. Bei hoher Krankheitsaktivität und / oder Vorliegen ungünstiger Prognosefaktorensoll die Kombination eines csDMARD (in der Regel MTX) mit einem bDMARD oder tsDMARD zum Einsatz kommen (A).
8. Nach unzureichendem Ansprechen zweier csDMARD-Therapien soll eine bDMARD oder tsDMARD-Therapie zum Einsatz kommen (A).
9. Jede bDMARD und tsDMARD-Therapie soll, wenn möglich, mit MTX kombiniert werden (A).
10. Bei nicht ausreichendem Ansprechen oder Unverträglichkeit der ersten bDMARD-Therapie soll der Wechsel auf ein alternatives bDMARD mit gleichem oder anderem Wirkprinzip oder auf ein tsDMARD erfolgen. Ein nochmaliger Wechsel ohne Änderung des Wirkprinzips ist nicht sinnvoll (A). Wird die Therapie nach csDMARDs mit einem tsDMARD anstatt einem bDMARD begonnen, so sollte bei Nichtansprechen auf ein bDMARD gewechselt werden (D).
Medikamentensicherheit
Das Spektrum der unerwünschten Arzneimittelwirkungen (UAW) von Biologika unterscheidet sich von dem klassischer, niedermolekularer Wirkstoffe. Besonderheiten sind ihre Herkunft (nicht körpereigene Proteine), Molekülgröße (Proteine) und ihr Wirkmechanismus (Beeinflussung des Immunsystems) [29].
Biologika bergen per se aufgrund der biotechnologischen Herstellung kein Infektionsrisiko, können aber akute immunvermittelte Reaktionen hervorrufen. Im Einzelnen können folgende UAWs auftreten:
• akute Infusionsreaktionen: treten typischerweise bei oder nach der ersten Anwendung auf
• akute und massive Freisetzung von Zytokinen
• Autoantikörper
• autoimmunartige Syndrome
• neurologische Störungen („multiple Sklerose-artige“ Syndrome)
• Herzinsuffizienz: es kann zur Verschlechterung einer vorbestehenden Herzinsuffizienz kommen
In der Akutphase sind das v. a. Zytokinfreisetzungssyndrom („cytokine release syndrome, CRS) und Hypersensitivität [30].
Die Hypersensitivitätsreaktionen werden eingeteilt in frühe (während der Infusion und bis 1 Std. nach Infusion) und verzögerte Reaktionen (>1 Std. bis einige Tage). Aufgrund des unterschiedlichen Wirkmechanismus werden die Akutreaktionen in IgE- und nicht-IgE-vermittelte Reaktionen eingeteilt [30].
Die Immunogenität der Biologika kann auch langfristige klinische Konsequenzen haben. Dazu gehört eine veränderte Wirksamkeit bei dauerhaft hohen Spiegeln neutralisierender Antikörper. Das kann die Wirksamkeit aller Produkte der gleichen Klasse verringern. Neben allgemeinen Immunreaktionen (allergische Reaktionen) kann es auch
Alle in der Therapie der Psoriasis und RA verwendeten Biologika greifen supprimierend ins Immunsystem ein
Um die Impfantwort auf eine COVID-19-Vakzinierung zu verbessern, kann es gerechtfertigt sein, die nächste RTX-Gabe hinauszuzögern
zu schwerwiegenden Nebenwirkungen kommen wie der Induktion von Autoantikörpern (antinukleäre Antikörper, Antikörper gegen Doppelstrang-DNA) und bis hin zu Autoimmunerkrankungen mit Ähnlichkeit zum systemischen Lupus erythematodes („lupus-like syndrome“) [30].
Zu den weiteren Risiken, die grundsätzlich mit Biologika verbunden sind, zählen erhöhtes Infektionsrisiko, Entwicklung von Neoplasien wie z. B. nicht-melanomatösem Hautkrebs, Verschlechterung zugrunde liegender bzw. Reaktivierung latenter Erkrankungen sowie hämatologische Störungen.
Infektionen und Impfungen
Allen in der Therapie der Psoriasis und der rheumatoiden Arthritis verwendeten Biologika ist gemeinsam, dass sie supprimierend in das Immunsystem eingreifen. Patienten werden also in einen immunsupprimierten Status versetzt. Aus den in klinischen Studien dokumentierten unerwünschten Ereignissen stechen allgemeine und opportunistische Infektionen als häufigstes Problem hervor [31].
In einer großen Cochrane-Analyse verschiedener Biologika konnte gezeigt werden, dass bei Einsatz der Biologika mit einem erhöhten Infektionsrisiko zu rechnen ist (Hazard Ratio HR 1,37; 95 %-KI 1,04–1,82). Das relative Risiko einer schweren Infektion hängt dabei stark von der einzelnen Substanz ab [32]. Relevant ist zudem, ob und in welcher Dosis gleichzeitig mit Kortikosteroiden behandelt wird. Infektionen unter einer Biologikatherapie rheumatischer Erkrankungen treten meist innerhalb der ersten 3 Monate auf und werden danach seltener beobachtet [30]. Unter Behandlung mit IL-6-Rezeptor-Blockern sind messbare Nebenwirkungen häufig (bis zu 80 %), v. a. Infektionen (5 %) der oberen Atemwege, akute Divertikulitiden mit dem Risiko der Darmperforation. Unter Behandlung mit TNFα-Inhibitoren sind vor allem auch atypische Infektionen prägend (u. a. atypische Erreger wie Candida und Aspergillus). Das Risiko der Reaktivierung einer Tuberkulose ist fast verdoppelt (OR
1,92; 95 %-KI 0,92–4,03). Daher sollte jeder Patient bereits vor Start einer anti-TNFαTherapie auf eine latente Tuberkulose gescreent werden [30].
Mit zunehmendem Alter der Patienten und der damit einhergehenden Immunoseneszenz muss nicht nur mit gehäuftem Auftreten, sondern auch mit schwereren Verläufen von Infektionen gerechnet werden [31]. Die Hazard Ratio für das Auftreten einer Infektion liegt für die über 60-Jährigen bei 1,6 und für die über 80-Jährigen bei 2,4. Das genaue Infektionsrisiko hängt jeweils vom Wirkmechanismus ab. Biologika gegen IL-17A oder seinen Rezeptor begünstigen Candidainfektionen, anti-TNF-Therapien sind in Zusammenhang mit Tuberkulose besonders problematisch, da sie zur Auflösung der Granulome und Dissemination des Bakteriums führen können. Diese Risiken sollten auch bedacht werden, wenn Patienten unter Biologikatherapie Fernreisen planen.
Vor Beginn jeder immunsupprimierenden Therapie sollten der Impfstatus überprüft und fehlende Impfungen nachgeholt oder aufgefrischt werden. Lebendimpfstoffe sind unter allen immunsupprimierenden Therapien gefährlich und daher kontraindiziert. Lässt sich eine Lebendimpfung nicht vermeiden, so muss das Biologikum oder auch jedes andere DMARD oder Steroid pausiert werden. Der dabei einzuhaltende Sicherheitsabstand ist von Präparat zu Präparat verschieden. COVID 19-, Pneumokokken- und Influenzaimpfung werden explizit empfohlen, können ggf. aber weniger wirksam sein. Sie sollen in der Mitte des Intervalls zwischen zwei Injektionen verabreicht werden. Die UAW von immunmodulatorischen Therapeutika sind in der Tabelle zusammengefasst [33] (Tab. 4)
Malignome
Das Risiko für Malignome wird kontrovers diskutiert. Metaanalysen und Daten aus den Biologika-Registern sprechen nicht dafür, dass durch den Einsatz von Biologika ein signifikant erhöhtes Neoplasierisiko besteht [34]. Für Hauttumoren (NMSC, eventuell
4: HÄUFIGE UAW VON IMMUNMODULATORISCHEN THERAPEUTIKA UND INDIKATIONEN ZUM THERAPIEABBRUCH
Medikament / Klasse
Methotrexat
Leflunomid
Sulfasalazin
Hydroxychloroquin
TNF-Inhibitoren
IL-17-Inhibitoren
IL-6-Inhibitoren
Abatacept
Rituximab
Apremilast
Häufigste UAW Indikation zur Therapieunterbrechung
• Dermatologie: Stomatitis, Alopezie
• Gastroenterologie: Übelkeit, Erbrechen, TransaminasenErhöhung (meist ohne Effekt auf die Leberfunktion)
• Haut: Ekzem, Alopezie, Hautausschlag, Urtikaria, Juckreiz
• GI: Diarrhö, Übelkeit, Erbrechen, Bauchschmerzen, orale Ulzera, Transaminasen-Erhöhung
• Blut: Leukopenie
• andere: Hypertonie, Schwindel, Schwächegefühl, Kopfschmerzen, Gewichtsverlust, Polyneuropathie
• Haut: Exanthem, Juckreiz
• GI: Übelkeit, Bauchschmerzen
• Blut: Hyperchromasie
• andere: Kopfschmerzen, Schwächegefühl, Müdigkeit, Oligospermie (reversibel)
• Haut: Juckreiz
• GI: Bauchschmerzen, Übelkeit, Diarrhö
• andere: Akkommodationsstörungen
• Haut: Injektionsreaktionen, Hautausschlag, Hautinfektionen
• GI: Transaminasen-Erhöhung
• Blut: Leukopenie, Thrombopenie
• andere: atypische Infektionen, Infektion der oberen Atemwege, Pneumonie, Harnwegsinfektionen
• Haut: orale Herpes-Infektion, orale Pilzinfektionen
• GI: Diarrhö
• andere: Infektionen der oberen Atemwege
• Haut: Hautausschlag, Juckreiz, Herpes-Infektionen
• GI: Hyperlipidämie, Transaminasenerhöhung, Mundulzera, Gastritis
• Blut: Leukopenie, Neutropenie
• andere: Infektion der oberen Atemwege, Pneumonie, Kopfschmerz, Schwindel, Konjunktivitis, Hypertonie
• Haut: Hautausschlag, Herpes-Infektionen
• GI: Hyperlipidämie, Bauchschmerzen, Übelkeit, Diarrhö, Dyspepsie
• Blut: Leukopenie
• andere: Bronchitis, Husten, Infektionen der oberen Atemwege, Harnwegsinfektion, Müdigkeit, Gewichtsverlust, Hypertonie, Flush-Symptomatik
• andere: Infektionen, Infusionsreaktion, vorübergehende Hyperurikämie
• GI: Diarrhö, Übelkeit, Erbrechen, Bauchschmerzen, Appetitminderung
• andere: Infektionen der oberen Atemwege
schwere Infektionen, Stomatitis, Exanthem, Transaminasen-Erhöhung > 3x Norm, fortschreitende Leberfibrose/zirrhose, Leukopenie < 2500/ µ L, Granulopenie < 1500/ µ L absolut, Thrombopenie < 100 x 10 3 / µ L, aplastische Anämie, Kreatinin-Anstieg, Pneumonitis
Leukopenie < 2500/ µ L, Granulozytopenie < 1500/ µ L absolut, Lymphozytopenie < 800/ µ L Thrombopenie < 80 x 10 3 / µ L bzw. Abfall > 100 x 10 3 / µ L vom Start, Transaminasen-Erhöhung > 3x Norm
Exanthem, Stomatitis, stärkere gastrointestinale Beschwerden, Hepatitis, Cholestase, Leukopenie < 3000/ µ L, Granulozytopenie < 2000/ µ L, Thrombopenie < 100 000/ µ L, aplastische Anämie, anhaltende Proteinurie > 0,3 g/L, Kreatinin-Anstieg, Hämaturie, neurologische Beschwerden, allergische Symptome, Kinderwunsch (Männer mit Oligospermie)
neue oder progrediente Retinopathie, toxische Myopathie
schwere Infektionen, Symptome einer demyelinisierenden Erkrankung, Lupus-ähnliches Syndrom mit Entwicklung von dsDNA-Antikörpern, neue oder progrediente Herzinsuffizienz
akute fieberhafte Infekte
schwere Infektion, schwerwiegende allergische Reaktion, Transaminasen-Erhöhung auf das > 3- bis 5-fache der Norm, Absetzen bei persistierender Erhöhung > 3fache nach Pause, sonst Dosisreduktion.
Granulozytopenie: Pause bei neutrophilen Granulozyten 0,5–1/nL, Wiederbeginn mit Dosisreduktion, wenn >1/nL, Absetzen bei < 0,5/nL
Thrombopenie: Pause bei 50–100 x 10 3 / μ L, Wiederbeginn bei > 100 x 10 3 / μ L mit Dosisreduktion, Absetzen bei < 50 x 10 3 / μ L
schwere Infektion
schwere Infektionserkrankung, Herzinsuffizienz
Neuauftreten oder Verschlechterung einer Depression, ausgeprägter Gewichtsverlust
IMPRESSUM
Auftraggeber: Hausärztliche Vertragsgemeinschaft AG (HÄVG) im Auftrag des Deutschen Hausärzteverbandes e.V.
Verlag: © mm medizin + medien Verlag GmbH, 202§
Geschäftsführung: Dr. Monika von Berg
Autor: Dr. Reinhard Merz
Zertifiziert durch: Institut für hausärztliche Fortbildung im Deutschen Hausärzteverband (IHF) e.V. Für Angaben zu Dosierungen und Applikations formen übernehmen Autoren und Verlag keine Gewähr.
auch für Melanome) kann ein leicht erhöhtes Risiko durch eine anti-TNF-Therapie nicht ausgeschlossen werden. Die Rezidivrate von Neoplasien ist unter TNF-Inhibitoren nicht signifikant erhöht [34]. Für den JAK-Hemmer Tofacitinib ist ein erhöhtes Risiko von Krebserkrankungen bei Patienten mit rheumatoider Arthritis beschrieben [35].
Rituximab und COVID-19 Immunmodulierende Therapien können den Verlauf einer SARS-CoV-2-Infektion verschlechtern und den Impferfolg gefährden. Vor allem Substanzen, die B-Zellen depletieren wie Rituximab sind hier zu nennen. Es konnte aber gezeigt werden, dass auch Menschen unter RTX-Therapie gegen COVID-19 geimpft werden können und selbst solche mit sehr niedriger B-Zell-Zahl unter 1 % nach zweimaliger Impfung mit einer mRNA-Vakzine nachweisbar Antikörper bilden. Zudem bauen – unabhängig von der B-Zell-Zahl – mehr als die Hälfte der Patienten eine robuste T-Zell-Antwort auf [36]. Um die Impfantwort auf eine COVID19-Vakzinierung zu verbessern, kann es bei Patientinnen und Patienten mit stabiler Grunderkrankung gerechtfertigt sein, die nächste RTX-Gabe hinauszuzögern, bis es zu einer Repopulation von B-Zellen im peripheren Blut kommt.
Ein Fall aus der Praxis
77-jährige Patientin, ED RF und CCP-neg Rheumatoide Arthrtitis, stationär behandelt und nach hoher Prednisolon-Dosis auf MTX eingestellt. Problematisch diesbezüglich ist ein bis dato diätetisch eingestellter Diabetes mellitus, der sich im Laufe der PrednisolonTherapie deutlich verschlechterte. Im weiteren Verlauf Dosisreduktion Prednisolon und MTX. Nach knapp 2 Jahren akute Exazerbation, unter 25 mg Prednisolon auf Dauer nicht beschwerdefrei, insbesondere Schmerzen und Schwellungen an den Fingern. Umstellung auf Enbrel, nachdem auch MTX 12,5 mg / Woche nicht zur Beschwerdefreiheit führten.
Situation in Baden-Württemberg
In Anlehnung an die Stellungnahmen von AkdÄ und PEI stellen Biosimilars für die AOK Baden-Württemberg äquivalente Therapieoptionen zu ihren Referenzarzneimitteln dar. Die Entscheidung über die Verordnung eines Originator-Produktes oder eines Biosimilars unterliegt der Therapiehoheit des Arztes. Vor diesem Hintergrund prüft die AOK Baden-Württemberg, ob zu Verordnungen eines Biologikums wirtschaftlichere Alternativen mit • gleichem Wirkstoff und • gleicher Wirkstärke in Form eines wirtschaftlichen Biosimilar-Arzneimittels oder eines für die AOK rabattierten Arzneimittels vorlagen. Dies gilt sowohl für Erstverordnungen als auch für Folgeverordnungen zur Fortsetzung einer Therapie. Dabei gelten Biosimilars, zu denen die AOK Baden-Württemberg einen Rabattvertrag abgeschlossen hat, während der Vertragslaufzeit stets als die wirtschaftlichste Alternative. Informationsblätter (getrennt für Ärzte und Patienten) finden sich unter: https://dgrh.de/Start/Versorgung/ Therapieinformationen/ Therapieinformationsbögen.html
Verordnung meist durch den Rheumatologen, zuletzt durch den Hausarzt, dieser stellte auf Benepali um ohne Zeichen eines Wirkverlustes. Laborkontrollen erfolgen beim Hausarzt (BSG, gr. BB, GOT, GPT, Kreatinin), Vorstellung bei der Rheumatologin anfangs 1 x im Quartal, jetzt 1 x pro Jahr. Aktuelle Therapie: MTX 7,5 mg, 1 x / Wo., Etanercept 1x / Wo s. c., Prednisolon 1 mg / Tag, Folsäure 5 mg 1 x / Wo.
Aktueller Status: Arthralgien bei starkem Wetterumschlag, keine Gelenkschwellungen, Steifigkeit morgens unter 5 Minuten. Im Befund leichte synovitische Gelenkschwellung in den Fingermittelgelenken.
Foto: privat

Wir beantworten Ihre Fragen!
Das HZV-Team des Deutschen Hausärzteverbandes: Sie erreichen uns von Mo-Do 8-17 Uhr, Fr 8-15 Uhr unter Tel.: 02203 57 56-12 09 oder via E-Mail unter ptqz@hzv.de


Ihre Ansprechpartnerin Masa Maric beantwortet all Ihre Fragen zu Qualitätszirkeln in der HZV.
Impressum QZ kompakt Q1/2023
Herausgeber: HZV-Team des Deutschen Hausärzteverbandes. Ein Service der Hausärztlichen Vertragsgemeinschaft AG (HÄVG) im Auftrag des Deutschen Hausärzteverbandes e. V. Edmund-Rumpler-Str. 2 51149 Köln Tel.: 02203 5756-1209 ptqz@hzv.de
Verlag: V.i.S.d.P.: Dr. Monika von Berg Redaktion: Masa Maric, Siv Vogeler Redaktion Medizin: Dr. Reinhard Merz Layout: Gabi Kellner © mm medizin+medien Verlag GmbH Konrad-Zuse-Platz 8, 81829 München www.hausarzt.digital Titelfoto: Andy - iStockphoto
UnsergesamtesFortbildungsprogrammunter:
FürHausärztinnen&Hausärzte www.ihf-fobi.de kontakt@ihf-fortbildung.de
FürVERAH&MFA www.verah.de verah@ihf-fortbildung.de
Die Hausar z tverträge
Weniger Bürokratie, mehr wirtschaftliche Sicherheit und eine bessere Versorgung: Profitieren auch Sie von den vielen Vorteilen der Hausarztzentrierten Versorgung (HZV). Das HZV-Team des Deutschen Hausärzteverbandes berät Sie gerne telefonisch, per Mail oder auch persönlich bei Ihnen in der Praxis. Tel.: 02203/5756-1210 · info@hzv-team.de · www.hzv.de

