15 minute read
Dossier: Immunotherapie bij het gemetastaseerd renaalcelcarcinoom / Immunothérapie en cas de carcinome rénal métastatique
from Urobel 058
by Urobel vzw
Prof. Dr. Sevilay Altintas, Senior staflid oncologie UZA Prof. Dr. Sevilay Altintas, Membre senior de l’équipe d’oncologie de l’UZA
Advertisement
Nierkanker of renaalcelcarcinoom (RCC) vertegenwoordigt ongeveer 2 tot 3% van alle kankers, en komt het meest voor in de westerse landen. De piekincidentie is tussen de leeftijd van 60-70 jaar, 1,5 tot 3,1 x vaker bij mannen dan bij vrouwen. Ongeveer 14% van de patienten presenteren zich met gemetastaseerde ziekte bij diagnose en ongeveer 50% van de patienten met een vroegtijdig diagnose zullen over de jaren heen metastasen vertonen. Zeventig tot 75% van de niercelcarcinomen vertonen een heldercellig type. Overige 25-30% vertonen een andere minder gunstige type. De laatste jaren is er echter flinke vooruitgang geboekt op het gebied van uitgezaaide heldercellig renaalcelcarcinoom met de toediening van geneesmiddelen die de vorming van nieuwe bloedvaten afremmen (angiogenese inhibitoren, TKI’s). De tumoren zijn ook wel in zekere mate gevoelig voor immunotherapie, een behandeling die het immuunsysteem activeert. De laatste jaren zijn er verschillende studies gepubliceerd in verschillende lijnen met zowel de TKI’s als immunotherapie als de combinatie van (mRCC) Le cancer du rein, ou carcinome rénal (RCC), représente environ 2 à 3% de tous les cancers. Sa prévalence est la plus grande dans les pays occidentaux. Le pic de l’incidence se situe entre 60 et 70 ans et il est 1,5 à 3,1 x plus fréquent chez l’homme que chez la femme. Près de 14% des patients se présentent avec une maladie diagnostiquée comme métastatique, tandis que quelque 50% d’entre eux présentent un diagnostic précoce et ne développeront pas de métastases au fil des ans. De 70 à 75% des carcinomes rénaux sont de type cellule claire, les 25 à 30% restants sont d’un type moins favorable. Ces dernières années, d’importantes avancées ont été réalisées dans le domaine du carcinome rénal métastatique à cellule claire grâce à d’administration de médicaments qui freinent le développement de nouveaux vaisseaux (inhibiteurs de l’angiogenèse, TKI). Les tumeurs sont par ailleurs sensibles, dans une certaine mesure, à l’immunothérapie, un traitement qui beiden. Keuze van behandeling is afhankelijk van de uitgebreidheid van de ziekte, snelheid van progressie en voorafgaande behandeling. Bijna alle fase II-III studies zijn verricht rekening houdend met 6 prognostische criteria waaarbij patienten onderverdeeld worden in good risk, intermediate risk en poor risk volgens het IMDC (International Metastatic Renal Cell Carcinoma Database Consortium).
SOORTEN IMMUNOTHERAPIE EN WERKINGSMECHANISME
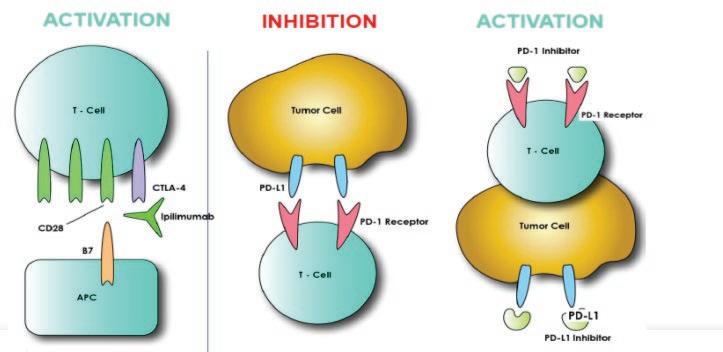
Recent werden naast de TKI’s twee grote groepen van geneesmiddelen ontwikkeld om de onderdrukking en omzeiling van de immuniteit door de kankercellen op te heffen: monoclonale antistoffen tegen cytotoxisch T-lymfocyt geassocieerde proteine-4 (CTLA-4) m.n. ipilimumab en geneesmiddelen die interfereren met de “programmed death” (PD) receptor van de T-cellen o.a.. nivolumab en pembroluzimab, en zijn liganden PD-L1, o.a. avelumab, aanwezig
Immunothérapie en cas de carcinome rénal métastatique
in tumoraal weefsel. active le système immunitaire. Ces dernières années, plusieurs études ont été publiées portant sur des traitements tant à base de TKI que d’immunothérapie ou d’une combinaison des deux. Le choix du traitement dépend de l’étendue de la maladie, de sa vitesse de progression et d’éventuels traitements antérieurs. Presque toutes les études de phases II-III sont réalisées en tenant compte de 6 critères pronostiques et avec répartition des patients selon les catégories de risque de l’IMDC (International Metastatic Renal Cell Carcinoma Database Consortium): risque élevé, risque intermédiaire et risque faible.
TYPES D’IMMUNOTHÉRAPIE ET MÉCANISME DE FONCTIONNEMENT
A côté des TKI, deux grands groupes de médicaments ont récemment été développés afin de lever la suppression et le contournement de l’immunité par les cellules cancéreuses: les anticorps monoclonaux contre l’antigène 4 du lymphocyte T cytotoxique (CTLA-4), à savoir
Figuur 1: Checkpoint inhibitoren: kankercellen brengen specifieke checkpoint eiwitten tot expressie om te kunnen ontsnappen aan het immuunsysteem. Een doelgerichte inhibitie van deze receptoren gaat de t-cel respons aanwakkeren tegenover de tumor.
Figure 1: inhibiteurs check-point: les cellules cancéreuses font s’exprimer des protéines check-point spécifiques pour pouvoir échapper au système immunitaire. Une inhibition ciblée de ces récepteurs active la réponse de la cellule t face à la tumeur.
KLINISCHE STUDIES
Jarenlang is sunitinib en nadien ook pazopanib als standaard eestelijnstherapie gebruikt bij het mRCC met een verbetering van de outcome van de mRCC patienten die tot dan een sombere prognose hadden. Zoals in andere typen tumoren is ook bij het mRCC vandaag de dag een behandeling met immunotherapie met checkpointinhibitoren ondenkbaar.
In de recentste jaren zijn er 3 fase III immunotherapiestudies met als standaardarm sunitinib opgezet (cfr tabel 1) met mooie resultaten en waarbij men bij sommige patienten zeer langdurige responsen en zelfs complete remissies bereikt heeft: CheckMate 214 studie (nivolumab plus ipilimumab vs sunitinib, n=1096), Keynote-426 (pembroluzimab plus Axitinib vs sunitinib, n=861) en JAVELIN Renal 101(avelumab plus axitinib vs sunitinib, n=886). Met de combinatie van nivolumab/ ipilumumab zag met een verbeterde overleving van 32%, pembroluzimab/axitinib verbeterde de overleving met 47% en voor de combinatie avelumab/axitinib zijn de overlevingsdata te immatuur.

ipilimumab, et les médicaments qui interfèrent avec le récepteur « programmed death » (PD) des cellules T, comme nivolumab et pembroluzimab, et ses protéines PD-L1, comme avelumab, présentes dans le tissu tumoral.
ETUDES CLINIQUES:
Pendant des années, sunitinib et par la suite pazopanib a été utilisé comme thérapie de première ligne standard en cas de mRCC avec une amélioration du résultat pour les patients mRCC, qui avaient jusque-là un pronostic sombre. Tout comme pour d’autres types de tumeurs, un traitement par immunothérapie avec inhibiteurs check-point n’est à ce jour pas envisageable en cas de mRCC.

Ces dernières années, trois études d’immunothérapie phase III avec pour standard le sunitinib ont été menées (voir tableau 1) avec de bons résultats. Chez certains patients, des réponses de longue durée ont été obtenues, voire des rémissions complètes dans le cas des études CheckMate 214 (nivolumab + ipilimumab vs sunitinib, n=1096), Keynote-426 (pembroluzimab + axitinib vs sunitinib, n=861) et JAVELIN Renal 101(avelumab + axitinib vs sunitinib, n=886). La combinaison nivolumab/ ipilumumab affiche une amélioration du taux de survie de 32% et pembroluzimab/axitinib de 47%. Pour la combinaison avelumab/axitinib,
Vergeleken met sunitinib vertoonden de combinatie immunotherapie in zowel de CheckMate 214 als de Keynote-426 studie een verbeterde objectieve responsrate in zowel de intermediate als de poor-risk patienten. Voor de patienten met een favorable risk profiel bleek sunitinib even goed te zijn.
De CheckMate 025 studie bevestigt dat Nivolumab beter is dan everolimus na een follow up van minstens 5 jaren, bij patienten met reeds een voorbehandeling. Na een mediane follow up van 72 maanden bedroeg de mediane totale overleving resp 25,8 en 19,7 maanden (HR=0,73; p<0,0001). Na 60 maanden was het responspercentage resp. 26% en 18%, waaronder een hoog percentage patienten met een lange overleving.
Lopende fase III studies met de combinatie van een TKI en een checkpointinhibitor opent nieuwe perspectieven. De CLEAR studie vergelijkt lenvatinib plus everolimus vs lenvatinib plus pembroluzimab vs sunitinib. De COSMIC 313 studie vergelijkt cabozantinib plus ipilimumab/ nivolumab vs ipilumumab/nivolumab. Het is nu afwachten op de resultaten en uiteraard de
les données de survie sont encore immatures. Comparé à sunitinib, la combinaison d’immunothérapie fait état dans le cas des études CheckMate 214 et Keynote-426 d’un meilleur taux de réponse objectif tant chez les patients à risque faible que chez ceux présentant un risque intermédiaire. Chez les patients au profil de risque élevé, sunitinib s’est avéré aussi efficace.
L’étude CheckMate 025 confirme que nivolumab est meilleur qu’everolimus après un suivi d’au moins 5 ans chez les patients ayant suivi un traitement préalable. Après un suivi médian de 72 mois, la survie médiane était de respectivement 25,8 et 19,7 mois (HR=0,73; p<0,0001). Après 60 mois, le taux de réponse était de respectivement 26% en 18%, dont un pourcentage élevé de patients a atteint une longue survie.
Des études de phase III en cours combinant un TKI et un inhibiteur check-point ouvre de nouvelles perspectives. L’étude CLEAR compare lenvatinib + everolimus vs lenvatinib + pembroluzimab vs sunitinib. L’étude COSMIC 313 compare cabozantinib + ipilimumab/ nivolumab vs ipilumumab/nivolumab. Il faut à présent attendre les résultats et la toxicité bien sûr étant donné que la qualité de vie gagne en importance à l’heure où on s’attend à de toxiciteit gezien QOL des te belangrijker wordt in een era waar we lange overlevers verwachten met al deze combinaties.
Ook is de combinatie van immunotherapie met ipi/nivo en stereotactische body bestraling (SBRT) bestudeerd bij patienten met hoofdzakelijk intermediate risk groep mRCC (RADVAX studie), dit gaf ook mooie resultaten vergelijkbar met deze van de CheckMate-214, ook naar toxiciteit bleek deze combinatie haalbaar te zijn.
De GETUG-AFU 26 NIVOREN fase II studie bestudeerde de activiteit en veiligheid van nivolumab bij patienten met heldercellig mRCC die faalden op een voorafgaande antiVEGF therapie. In totaal werden 73 patienten prospectief geselecteerd met hersenmetastasen
REFERENTIES/RÉFÉRENCES
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12. Motzer RJ., Hutson TE., Tomczak P, et al. Sunitinib versus Interferon Alfa in Metastatic RenalCell Carcinoma. N Engl J Med 356:115-124,2007 Sternberg CN., Davis ID., Mardiak J et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol. 2010;28:1061-1068. Motzer RJ, Tannir NM, McDermott DF, et al: Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 378:1277-1290, 2018. Tannir N., Mc Dermott D., Escudier B. et al. Overall survival and independent review of response in CheckMate-214 with 42-month follow-up; ASCO GU 2020, abstract #609 Rini BI, Plimack ER, Stus V, et al: Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 380:1116-1127, 2019. Motzer RJ, Penkov K, Haanen J, et al: Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 380:1103-1115, 2019. Motzer R., Tykodi S., Escudie B. et al. Final analysis of the CheckMate 025 trial comparing nivolumab versus everolimus with >5 years of follow up in patients with advanced RCC; ASCO GU 2020, Abstract #617 Multicenter, Open-label, Randomized, Phase 3 Trial to Compare the Efficacy and Safety of Lenvatinib in Combination With Everolimus or Pembrolizumab Versus Sunitinib Alone in First-Line Treatment of Subjects With Advanced Renal Cell Carcinoma (CLEAR), https:// clinicaltrials.gov/ct2/show/NCT02811861 A multicenter, randomized, double-blinded, controlled Phase 3 trial of cabozantinib in combination with nivolumab and ipilimumab versus nivolumab and ipilimumab in combination with matched placebo (COSMIC-313), https://clinicaltrials.gov/ct2/show/ NCT03937219 Hammers H., Vonmerveldt D., Ahn C. et al. Combination of dual immune checkpoint inhibition with stereotactic radiation (SBRT) in metastatic renal cell carcinoma (RADVAX RCC); ASCO GU 2020, Abstract #614 Flippot R. , Dalban C., Laguerre B. et al. 1. Safety and Efficacy of Nivolumab in Brain Metastases From Renal Cell Carcinoma: Results of the GETUG-AFU 26 NIVOREN Multicenter Phase II Study. J Clin Oncol. 3, 2019 Powles T., Larkin J., Patel P. et al. A phase II study investigating the safety and efficacy of savolitinib and darvelumab in metastatic papillary renal cancer (CALYPSO); ASCO GU 2020, Abstract #545
longues survies grâce à toutes ces combinaisons. Par ailleurs, la combinaison de l’immunothérapie avec ipi/nivo et la radiothérapie stéréotaxique (RTST) a été étudiée chez des patients issus principalement du groupe à risque intermédiaire mRCC (étude RADVAX). Celle-ci a également donné de bons résultats, comparables à ceux de CheckMate-214. En termes de toxicité également, cette combinaison s’est avérée intéressante. L’étude GETUG-AFU 26 NIVOREN phase II a étudié l’activité et la sécurité de nivolumab chez les patients présentant un mRCC à cellules claires et qui ne réagissent pas à une thérapie anti-VEGF antérieure. Au total, 73 patients présentant des métastases cérébrales ont été sélectionnés prospectivement. Parmi eux, 39 n’avaient pas encore reçu de traitement local pour les métastases cérébrales, contre 34 qui en avaient déjà reçu un. L’activité de nivolumab était limitée chez les patients dont les métastasas cérébrales n’avaient pas été traitées. La recommandation était de traiter les métastases cérébrales avant de démarrer le traitement aux inhibiteurs check-point.
Une toute nouvelle combinaison, présentée au ASCO GU 2020, est l’étude CALYPSO, qui combine durvalumab, un antagoniste PDL-1, et savolitinib, un inhibiteur MET, chez 41 patients atteints d’un carcinome papillaire du rein, une sous-catégorie de cancer qui se caractérise par
waarvan 39 nog geen lokale behandeling kregen voor hun hersenmetastasen en 34 wel. Nivolumab activiteit was beperkt bij patienten met onbehandelde hersenmetastasen. Advies was om hersenmetastasen te behandelen voor het opstarten van checkpointinhibitoren.
Een heel nieuwe combinatie, voorgesteld op de ASCO GU 2020 is de CALYPSO studie met de combinatie van durvalumab, een PDL-1 antagonist, plus Savolitinib, een MET-inhibitor bij 41 patiënten met een papillaire nierkanker. Deze laatste is een subtype dat gekenmerkt wordt door specifieke afwijkingen van het MET-gen. Deze patiëntenpopulatie was of niet behandeld of had niet gereageerd op een voorgaande TKI. Na een mediane follow up van 14,3 maanden bedroeg het percentage objectieve respons 25% bij de patienten met een PD-L1 expressie en 40% bij de patienten met een MET+ tumor. De gegevens over PFS en OS zijn nog immatuur maar veelbelovend. De totale overleving na 12 maanden was 52,1% in de totale patientengroep, en al of niet overexpressie van de PD-L1 of MET maakte geen verschil in prognose. des déviances spécifiques du gène MET. Cette population de patients n’avait soit pas été traitée, soit pas réagi à un traitement TKI antérieur. Après un suivi médian de 14,3 mois, le taux de réponse positive était de 25% chez les patients avec une expression PD-L1 et de 40% chez les patients avec une tumeur MET+. Les données relatives à la survie sans progression (PFS) et à la survie globale (OS) sont encore immatures, mais prometteuses. Le taux de survie total après 12 mois était de 52,1% pour l’ensemble du groupe de patients, la surexpression de la PDL1 ou la MET n’affectant en rien le pronostic.
CONCLUSION
Partant des données des études cliniques actuelles, tant les combinaisons nivolumab/ ipilimumab que pembrolizumab/axitinib sont un bon choix de traitement de première ligne chez les patients présentant un risque faible et intermédiaire. Le choix est souvent individuel et basé sur le rapport risque/bénéfice par patient. En première ligne, la préférence va peut-être un peu plus vers la combinaison nivo/ipi en raison des données plus matures et des données de qualité de vie (QOL) dont l’on dispose déjà. Pour le groupe à risque élevé, la combinaison pembro/axitinib ou la monothérapie avec un
BESLUIT:
Gebaseerd op de huidige klinische studiegegevens is zowel de combinatie nivolumab/ipilimumab als de combinatie pembrolizumab/axitinib een goede keuze in eerste lijn bij de intermediate en poor-risk groep. De keuze is vaak individueel en gebaseerd op de risico/benefiet verhouding per patient. De combinatie nivo/ipi verkiest misschien iets meer de voorkeur in eerste lijn vanwege de meer mature data en reeds beschikbare QOL data. Voor de favorite risk groep is pembro/axitinib of monotherapie met een TKI (sunitinib of pazopanib) een goede keuze. In deze favorite risk groep kan je ook gaan voor de nivo/ ipi combinatie indien arts en patiënt zich er comfortabel bij voelen. Dit laatste meer met het idee dat je door combinatie immunotherapie langdurige responsen en mogelijks in enkele gevallen zelfs complete remissies kan bereiken. Dit laatste kon men in het verre verleden ook al eens zeldzaam bereiken door hoge dosis IL-2 te geven, maar hiervan is men afgestapt gezien de uitgesproken toxische overlijdens. In ieder geval kunnen we concluderen dat de laatste jaren de behandeling van het mRCC TKI (sunitinib ou pazopanib) est un bon choix. Pour ce groupe, on peut aussi opter pour la combinaison nivo/ipi si le médecin et le patient se sentent à l’aise avec ce choix, et ce dans l’idée surtout que la combinaison d’immunothérapie peut permettre d’obtenir une réponse de longue durée, voire une rémission complète dans quelques cas. Dans un passé lointain, ce résultat pouvait, dans de rares cas, être obtenu également grâce à l’administration d’une forte dose d’IL-2, mais ce traitement a été abandonné en raison des décès toxiques prononcés. On peut conclure en tout cas que ces dernières années le traitement du mRCC au moyen des TKI, des inhibiteurs m-TOR, des inhibiteurs MET et de l’immunothérapie est entré dans une phase d’accélération, si bien qu’on arrive depuis plusieurs années déjà à maintenir les patients en vie. Compte de tenu de cette amélioration de la survie, les études à venir mettront de plus en plus l’accent sur la qualité de vie. Davantage de combinaisons signifie aussi davantage de toxicité, facteur sur laquelle il faudra veiller attentivement. De nouvelles études combinant l’immunothérapie et la radiothérapie, où la radiation active la met de TKI’‘s, de m-TOR inhibitoren, de metinhibitoren en de immunotherapie in een stroomversnelling is gekomen waarbij we nu patiënten reeds jaren in leven kunnen houden. Gezien deze lange overlevers zullen de toekomstige studies meer en meer de focus leggen op kwaliteit van leven. Meer combinaties betekent ook meer toxiciteit waarover we ten zeerste moeten waken.
Nieuwe studies met combinaties van immunotherapie en radiotherapie waarbij bestraling de T-celreactie activeert en zo het antitumor effect versterkt is een interessante piste die momenteel wordt bewandeld. Andere veelbelovende combinaties zijn deze met immunotherapie en MET-inhibitoren en specifieke orale moleculen gericht tegen HIF-2 alfa, een belangrijke schakel in het ontstaan van
het renaalcelcarcinoom. réaction de la cellule T, en renforçant ainsi l’effet anticancéreux, constituent une piste intéressante qui est actuellement à l’étude. D’autres combinaisons prometteuses sont celles qui allient l’immunothérapie et les inhibiteurs MET et des molécules orales spécifiques dirigées contre le HIF-2 alfa, un maillon important dans le développement du carcinome rénal.
Tabel 1
MEDIANE FOLLOW-UP
OBJECTIEVE RESPONSPERCENTAGE
COMPLETE RESPONSPERCENTAGE
Checkmate-214 Nivolumab/Ipilimumab
49 MAANDEN
39%
10-13%
Keynote-426 Nivolumab/Ipilimumab
12.8 MAANDEN
59%
5.8%
MEDIANE PROGRESSIEVRIJE OVERLEVING
MEDIANE TOTALE OVERLEVING 12 VS 8.3 MAANDEN VOOR SUNITINIB
47 VS 26.6 MAANDEN VOOR SUNITINIB (ASCO GU 2020) 15.1 VS 11.1 MAANDEN VOOR SUNITINIB
Tabel 1: Eerste lijns Fase III studies met immunotherapie gebaseerde combinaties in mRCC





