
5 minute read
Reglas
from Fichero Nomenclatura
by epinto0203
Hidruros 6. Ejemplos Fórmula: MgH 1.Nombre del grupo: Hidruros S.Clasico: Hidruro de magnesio 2. Fórmula General: M+H S.Estequiométrico: Dihidruro de magnesio En esta imagen se observa los átomos en el compuesto Hidruro de 3. Nombre Genérico: Hidruromagnesio S.Stock: Hidruro de magnesio (II)
4.Reglas:
Advertisement
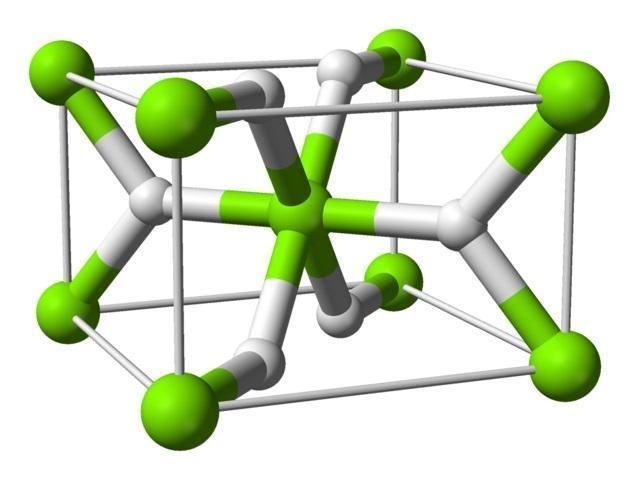
El hidrógeno a siempre tiene número de oxidación de -1 y los metales poseen números de oxidación positivos Al nombrar un Hidruro se utilizan las reglas de los tres sistemas Existen 2 tipos de Hidruros: metálicos y no metálicos
5. Excepciones (Si no aplica, se indica): Existen combinaciones especiales con el hidrógeno;( estas combinaciones son con no metales pero se forman como si fuesen hidruros) ; combinación hidrógeno con el Boro, combinación hidrógeno con elementos del grupo IVA (no metales) , combinación hidrógeno con el grupo VA (no metales), estos compuestos son nombrados de manera diferentes a los casos normales.
Producto Gaseoso Disuelto en H2O Hidrácidos HF (g)Fluoruro de hidrógeno HF(ac)Ácido Fluorhídrico 1.Nombre del grupo: Hidrogenados HCI (g)Cloruro de hidrógeno HCI (ac)Ácido Clorhídrico 2. Fórmula General: H+ + NM HBr (g)Bromuro de hidrógeno HBr (ac)Ácido Bromhídrico 3. Nombre Genérico: Hiperoxido HI (g)Ioduro de hidrógeno HI (ac)Ácido Yodhídrico 4.Reglas: H2S (g)Sulfuro de hidrógeno H2S (ac)Ácido Sulfhídrico

El nombre genérico se forma con la raíz del nombre del no metal terminado en uro y el nombre específico es, de hidrógeno.
5. Excepciones (Si no aplica, se indica): Cuando estos compuestos se disuelven en agua forman soluciones que tienen propiedades ácidas recibiendo el nombre de Hidrácidos.
Joshua Berreondo


Sal neutra
1.Nombre del grupo: Compuestos sin oxigeno e hidrogeno. 2.Fórmula General: M(+) + NM(-) 3.Nombre Genérico: Sal Neutra. 4.Reglas: El no metal (anión) se nombra primero y se le da la terminación uro. Luego, se nombra el metal conforme a las reglas de cada sistema. 5.Excepciones (Si no aplica, se indica): Se elimina la Palabra ácido y los sufijos se sustituyen, por ejemplo: -ico por -ato; -oso por -ito.
6.Ejemplos:
Fórmula Sistema StockSistema estequiométrico Sistema Funcional
CoF2Fluoruro de cobalto (II) Bifluoruro de cobalto Fluoruro cobaltoso
Nb3P5Fosfuro de niobio (V) Pentafosfuro de triniobio Fosfuro nióbico
Joshua Berreondo
Sal Volatil

1.Nombre del grupo: Oxosales. 2.Fórmula general: NM(+) + NM(-). 3.Nombre Genérico: Sal Volátil. 4.Reglas: 1. Al anión se le agrega la terminación uro. 2.
Generalmente son elementos de los grupos 16 y 17 quienes trabajan como aniones. 3. En los tres sistemas de nomenclatura se siguen las mismas reglas.
5.Excepciones (Si no aplican, se indican): No Aplica. 6.Ejemplos:

Fórmula Sistema stockSistema estequiométrico Sistema funcional CS2Sulfuro Carbónico Disulfuro de Carbono Sulfuro de Carbono (IV) PCl5Cloruro Fosfórico Pentacloruro de fósforo Cloruro de Fósforo (V) IBr5Bromuro Yódico Pentabromuro de Yodo Bromuro de Yodo (V)
6. Ejemplos
Aleación FórmulaNombre FórmulaNombre especial ZrPtAleación de Zirconia y Platino PbSn Peltre

1. Nombre del grupo : Aleación CuSn6 Aleación de Cobre CuNi Cuproníquely Estaño 2. Fórmula General: M + MFeCr Aleación de Hierro y Cobre FeMn Ferromanganeso 3. Nombre Genérico: Aleación NiCuAleación de Níquel y Cobre CrNiNicrom
4. Reglas:
● No considera ninguno de los sistemas de nomenclatura y tampoco considera los E.O. ● Se coloca “aleación” seguido del nombre del metal en electronegatividad creciente para nombrarlo. ● Se colocan los símbolos que representan a los metales de igual manera en electronegatividad creciente para formularlos. ● Al variar los porcentajes de los elementos que las constituyen, las aleaciones no poseen una fórmula verdadera.
5. Excepciones (Si no aplica, se indica): Algunas aleaciones tienen nombres específicos que han sido aceptados por la nomenclatura actual. Emilio Pinto Malouf, K., & Beltethón, J. (2012).

Amalgama Fórmula Nombre NaHgAmalgama de sodio
1. Nombre del grupo : Amalgama CrHgAmalgama de cromo 2. Fórmula General: M + Hg NiHgAmalgama de níquel 3. Nombre Genérico: Amalgama FeHgAmalgama de hierro
4. Reglas:
● No cumple ninguna de las reglas de los tres sistemas. ● No toma en cuenta los E.O. ● Se colocan el nombre genérico, seguido por el nombre del metal para nombrarlo. ● No se considera que sean producto de reacciones químicas al ser soluciones de un metal en otro.
Emilio Pinto Malouf, K., & Beltethón, J. (2012). Juárez, A. (2020).

Hidróxido 6. Ejemplos Fórmula: Ba(OH)2 1.Nombre del grupo: Hidróxido S.Clasico: Hidróxido Bárico 2. Fórmula General: M+OH S.Estequiométrico: Dihidróxido de bario En esta imagen se observa el 3. Nombre Genérico: Hidróxido compuesto de Hidróxido Bárico S.Stock: Hidróxido de Bario (II)
4.Reglas:

El nombre en el sistema clásico no aplica cuando el catión tiene más de 2 estados de oxidación. El ion (OH) actúa con carga -1. Cuando su índice es mayor a 1 , el ion se coloca entre paréntesis. Normalmente los hidróxidos son sintetizados con la reacción de un óxido básico con el agua.
5. Excepciones (Si no aplica, se indica): No aplica
Fátima Lucero Juárez, A. (2020), Enciclopedia de Ejemplos (2019)
Referencias:
Juárez, A. (2020). Nomenclatura de Compuestos inorgánicos. Recuperado de: https://drive.google.com/file/d/1jtrUvu3qHyWxXN_ogPdCIaDCP-wmxvOE/view Juárez, A. (2020). Nomenclatura de Compuestos inorgánicos. Recuperado de: https://drive.google.com/file/d/1Q2z-9t0HRiD7co0FGtN4D1V8ixi84p_m/view Juárez, A. (2020). Nomenclatura de Compuestos inorgánicos. Recuperado de: https://drive.google.com/file/d/1012bgpfsudyx_ww6nxMQcXmMGCna3Z9i/view Juárez, A. (2020). Nomenclatura de Compuestos inorgánicos. Recuperado de: https://drive.google.com/file/d/1JxNliii4CGMHeBUYtEznYP4WYgDdWNrI/view Juárez, A. (2020). Nomenclatura de Compuestos inorgánicos. Recuperado de: https://drive.google.com/file/d/1h3coKpv7d6leIDpZSPF80EVmh2d9_-pI/view Nelly. (s.f). SoloEjemplos . Obtenido de 20 ejemplos de óxidos ácidos con su fórmula química y nomenclaturas: https://www.soloejemplos.com/20-ejemplos-de-oxidos-acidos-con-su-formula-quimica-y-nomenclaturas/ Anónimo. (s,f). Formulación y nomenclatura de compuestos inorgánicos. Obtenido de: http://www.lainmaculada.net/Valladolid/va_documentos_files/PROFESORES/FIS%203%20Formulacion%20Inorganica.pdf Gamaliel, E. (agosto de 2020). Nomenclatura Química Inorgánica. Enciclopedia de Ejemplos (2019). "Hidróxidos". Recuperado de: https://www.ejemplos.co/25-ejemplos-de-hidroxidos/
Referencias:
Malouf, K., & Beltethón, J. (2012). Nomenclatura Química Inorgánica. México: Pearson. Caballero, L. (2015). Material didáctico de apoyo para nomenclatura de la química inorgánica. Obtenido de https://bit.ly/31BzwM9 Escuela de Química. (agosto de 2020). Manual de Nomenclatura de Compuestos. Gamaliel, E. (agosto de 2020). Nomenclatura Química Inorgánica.


