LA VOCE AICCER
ASSOCIAZIONE ITALIANA DI CHIRURGIA DELLA CATARATTA E REFRATTIVA
RIVISTA SCIENTIFICA DI INFORMAZIONE

1
SPECIALE

Nome rete: AICCER 2024
Nome rete: AICCER 2024
Password: aiccer_2024
Password: aiccer_2024









Nome rete: AICCER 2024
Password: aiccer_2024

CHIRURGIA REFRATTIVA
L’estrazione della cataratta ha un effetto significativo sulla IOP in occhi affetti da glaucoma o ipertensione oculare? Metanalisi della letteratura
CHIRURGIA REFRATTIVA
Semeiotica strumentale dopo chirurgia refrattiva corneale
CHIRURGIA DELLA CATARATTA
Cosa fare prima e dopo la chirurgia della cataratta?
CHIRURGIA DELLA CATARATTA
Tecniche avanzate di facoemulsificazione: cataratta e AMD
CHIRURGIA REFRATTIVA
Il laser ad eccimeri per il glaucoma

2024
FGE S.r.l. - Reg. Rivelle 7/F - 14050 Moasca (AT) - Trimestrale nr. 1/24 - Anno XXVI
Garze sterili
Spray oculare Collirio






SICUREZZA IN OFTALMOLOGIA
Nella prevenzione delle infezioni dell’occhio e dei suoi annessi.

ASSOCIAZIONE
DI INFORMAZIONE
Responsabile Editoriale
Scipione Rossi
Direttore Responsabile
Ferdinando Fabiano
Comitato Pubblicazioni AICCER
Giovanni Alessio, Roberto Bellucci, Vincenzo Orfeo, Riccardo Sciacca
Redazione
Segreteria AICCER
AIM Group International - Milan Office
Via G. Ripamonti 129 - 20141 Milano
tel. 02 56601.1 - fax 02 70048578
e-mail: segreteriaaiccer@aimgroup.eu
Scipione Rossi
e-mail: scipione.rossi@gmail.com
Grafica e Stampa
FGE S.r.l.
Pubblicità
FGE S.r.l.
Reg. Rivelle 7/F - Moasca (AT)
tel. 0141 1706694
e-mail: info@fgeditore.it


ISSN 1973-9419








Registrazione presso il Tribunale di Asti n° 5/98 del 15/12/1998
Il contenuto degli articoli pubblicati è di esclusiva responsabilità degli autori.
La riproduzione di articoli o parte di essi deve essere autorizzata dall’Editore.
Inserzionisti: ALCON
CSO
FB vision OFF HEALTH
Santen ZEISS
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI)
Sede operativa: FGE srl − Regione Rivelle 7/F − 14050 Moasca (AT) – Tel. 0141 1706694 – Fax 0141 856013
e-mail: info@fgeditore.it − www.fgeditore.it
12024
SCIENTIFICA
RIVISTA
ITALIANA DI CHIRURGIA DELLA CATARATTA E REFRATTIVA
LA VOCE AICCER RIVISTA SCIENTIFICA DI INFORMAZIONE 2024 1 FGE S.r.l. Reg. Rivelle 7/F 14050 Moasca (AT) Trimestrale nr. 1/24 Anno XXVI ASSOCIAZIONE ITALIANA DI CHIRURGIA DELLA CATARATTA E REFRATTIVA CHIRURGIA REFRATTIVA L’estrazione della cataratta ha un effetto significativo sulla IOP in occhi affetti da glaucoma o ipertensione oculare? Metanalisi della letteratura CHIRURGIA REFRATTIVA Semeiotica strumentale dopo chirurgia refrattiva corneale CHIRURGIA DELLA CATARATTA Cosa fare prima e dopo la chirurgia della cataratta? CHIRURGIA DELLA CATARATTA Tecniche avanzate di facoemulsificazione: cataratta e AMD CHIRURGIA REFRATTIVA Il laser ad eccimeri per il glaucoma SPECIALE Nome rete: AICCER 2024 Password: aiccer_2024 Nome rete: AICCER 2024 Password: aiccer_2024 Nome rete: AICCER 2024 Password: aiccer_2024 Disponibile anche su APP Scaricala gratuitamente



SOMMARIO EDITORIALE di Daniele Tognetto 7 INTERAZIONI • NOTIZIE DAL CONSIGLIO DIRETTIVO di Vincenzo Orfeo 9 CHIRURGIA REFRATTIVA L’estrazione della cataratta ha un effetto significativo sulla IOP in occhi affetti da glaucoma o ipertensione oculare? Metanalisi della letteratura 10 di Andrea Pasquali, Luigi Varano, Nicola Ungaro, Viola Tagliavini, Paolo Mora, Matteo Goldoni, Stefano Gandolfi CHIRURGIA REFRATTIVA Semeiotica strumentale dopo chirurgia refrattiva corneale 20 di Massimo Camellin, Umberto Camellin CHIRURGIA DELLA CATARATTA Cosa fare prima e dopo la chirurgia della cataratta? 28 di Vincenzo Orfeo, Mario Giannì CHIRURGIA DELLA CATARATTA Tecniche avanzate di facoemulsificazione: cataratta e AMD 34 di Andrea Castegnaro CHIRURGIA REFRATTIVA Il laser ad eccimeri per il glaucoma 42 di Alberto Cerini ORDINA LA TUA COPIA SU WWW.FGEDITORE.IT FABIANO GRUPPO EDITORIALE Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it L'OCT nella pratica quotididiana Marco Rispoli Bruno Lumbroso Maria Cristina Savastano



di Daniele Tognetto
Nuovi orizzonti per AICCER: riflessioni e prospettive nel 2024
È tempo di riflessione profonda sul ruolo dell’oftalmologia in un panorama sanitario in continua evoluzione. La formazione di giovani oftalmologi e la diffusione delle conoscenze restano le fondamenta con cui affrontare un futuro di incertezza legato ad una situazione contingente critica nella quale la figura dell’oftalmologo comincia a cambiare ruolo.
Il congresso AICCER 2023 ha segnato un notevole successo di partecipazione con un ampio gradimento riaffermando la validità dell’impegno della nostra società nell’aggiornamento professionale e nella condivisione di esperienze. L’occasione di confronto tra professionisti ha sottolineato l’essenzialità di creare ponti formativi che colleghino le generazioni, integrando la saggezza dell’esperienza con l’innovazione tecnologica.
AICCER si impegna a essere in prima linea, promuovendo programmi di formazione avanzati che sfruttino le potenzialità delle nuove tecnologie, inclusa l’intelligenza artificiale, per preparare i professionisti a un servizio sanitario che cambia rapidamente.
Per il congresso del 2024, puntiamo a innovare ulteriormente, esplorando nuovi territori scientifici e metodologici. Il nostro obiettivo è quello di enfatizzare la formazione pratica e interattiva, garantendo che ogni sessione, da quelle di chirurgia live a quelle teoriche, sia un’occasione di vera crescita professionale per tutti i partecipanti. Particolare attenzione sarà rivolta all’education dei giovani medici, incoraggiando il loro coinvolgimento attivo attraverso il confronto diretto con le eccellenze del settore.
L’esigenza di affrontare la prevista carenza di medici nel prossimo decennio ci spinge a rafforzare le nostre iniziative di formazione, rendendole più accessibili e mirate. L’obiettivo di AICCER è di formare nuovi talenti, promuovendo l’oculistica come campo di eccellenza e innovazione, capace di offrire grandi soddisfazioni professionali e personali.
In conclusione, il 2024 per AICCER è l’anno di consolidamento di un percorso di crescita che guarda al futuro con ottimismo, valorizzando ogni aspetto della professione. Il nostro impegno è rivolto a sostenere lo sviluppo di una comunità medica sempre più competente e preparata, capace di rispondere con efficacia alle sfide sanitarie attuali e future.
AICCER si conferma così non solo come punto di riferimento nel panorama oculistico italiano ma anche come catalizzatore di progresso e innovazione.
7 LA VOCE AICCER 1/2024


INTERAZIONI
NOTIZIE DAL CONSIGLIO DIRETTIVO
di Vincenzo Orfeo

Sempre meno soldi per la cataratta DRG ridotto del 20%?
Cari amici dell’Aiccer, purtroppo è in arrivo una ulteriore, deprecabile batosta per i chirurghi della cataratta.
Le nuove tariffe dei DRG recentemente stabiliti dal ministero della Salute prevedono una riduzione del 20% sul rimborso dell’intervento di cataratta, già molto sottostimato.
In Italia siamo arrivati, secondo dati recenti, a eseguire 820.000 interventi di cataratta all’anno. Si va a colpire, quindi, dopo la procedura del parto, l’intervento chirurgico più richiesto dalle persone.
La nostra popolazione sta invecchiando ed è nostro dovere contribuire a mantenere tutti in buona salute. Ma senza poter garantire ai cittadini una sufficiente condizione visiva ciò diventa impossibile.
Purtroppo dobbiamo ricordare che il ministero, nello stabilire questi contributi, lavora sempre con la consulenza di alcuni oculisti.… Dovremmo, tutti noi professionisti, anche se prediligiamo un’altra sotto specialità, renderci conto delle conseguenze delle nostre consulenze.
A questa riduzione si aggiunga che, come sempre avviene, le tariffe dei DRG ministeriali sono modulabili da ogni singola Regione e, di norma, le Regioni abbassano ulteriormente il contributo stabilito dal ministero della Salute. Agli ospedali, e alle strutture accreditate, arriveranno davvero pochi spiccioli. Certo non sufficienti per eseguire una chirurgia di livello.! Per rientrare nei costi dovremo infatti rivalutare e certamente ridurre anche la qualità dei materiali che andiamo a impiantare negli occhi delle persone.
Tutti noi di Aiccer siamo molto preoccupati per questa situazione che comporterà inevitabilmente disagi per la popolazione, soprattutto in termini di un ulteriore allungamento delle liste di attesa per la cataratta. Bisogna, inoltre, considerare che, costituendo la chirurgia della cataratta circa l’80% delle prestazioni chirurgiche di oculistica, noi oculisti diventiamo sempre meno appetibili per chi investe in sanità e potremmo vedere distogliere investimenti dalla nostra branca specialistica verso branche economicamente più remunerative. Eppure è da tutti riconosciuto che la vista è il bene più prezioso che abbiamo!
Da molti anni, ormai, la politica sta portando l’oculistica a diventare come l’odontoiatria. Ma per una necessità tanto importante quanto la vista, come si può pensare che ci si rivolga esclusivamente al privato? È vero che si riscontra un aumento del ricorso alle assicurazioni e al privato, ma bisogna fare comunque delle considerazioni. Le assicurazioni assumono a riferimento i DRG e, in base a una loro riduzione, è prevedibile anche una diminuzione delle tariffe da parte delle assicurazioni stesse.
Il privato puro ci permette di impiantare più cristallini artificiali Premium con maggiore soddisfazione dei nostri pazienti, ma ovviamente non è per tutti. Ed è nostro obbligo di medici pensare anche a chi non è assicurato e non può permettersi l’accesso alla sanità privata; per queste persone la situazione si fa sempre più difficile. L’ulteriore riduzione degli investimenti in oculistica comporterà inevitabilmente l’incremento dei già lunghissimi tempi di attesa per un intervento in convenzione ospedaliera. Siamo estremamente sconfortati.
È nostro dovere e impegno informare la popolazione che Aiccer sta cercando di porre rimedio a queste sviste politiche con una richiesta di revisione dei DRG. In questo siamo sostenuti dai Presidenti e dal Direttivo di SISO e AIMO che hanno ben presente la problematica e che stanno lavorando a un tavolo contrattuale con il ministro della Salute, il prof. Orazio Schillaci che, da medico, è sensibile verso i nostri problemi. Recentemente anche IAPB (Agenzia internazionale per la prevenzione della cecità), tramite il Presidente Mario Barbuto e il Segretario Tiziano Melchiorre, ha avuto modo di manifestare al ministro profonda preoccupazione, ottenendo l’impegno a rivalutare le decisioni prese.
Auspichiamo di riuscire nel nostro intento.
9 LA VOCE AICCER 1/2024
CHIRURGIA REFRATTIVA
di Andrea Pasquali, Luigi Varano, Nicola Ungaro, Viola Tagliavini, Paolo Mora, Matteo Goldoni, Stefano Gandolfi
L’estrazione della cataratta ha un effetto significativo sulla IOP in occhi affetti da glaucoma o ipertensione oculare? Metanalisi della letteratura
Introduzione
Oltre 20 anni fa, di comune accordo tra la World Health Organization e l’International Agency for Prevention of Blindness, fu promossa l’iniziativa “Vision 2020: The Right to Sight” i cui risultati, recentemente pubblicati, ci rivelano come, negli adulti di età maggiore o uguale a 50 anni, le due principali cause di cecità o riduzione moderata / severa dell’acuità visiva siano rispettivamente la Cataratta (45,4%) e il Glaucoma (11%) [1]. Due patologie che spesso coesistono in un singolo paziente e si influenzano l’un l’altra [2] .
Materiali e Metodi
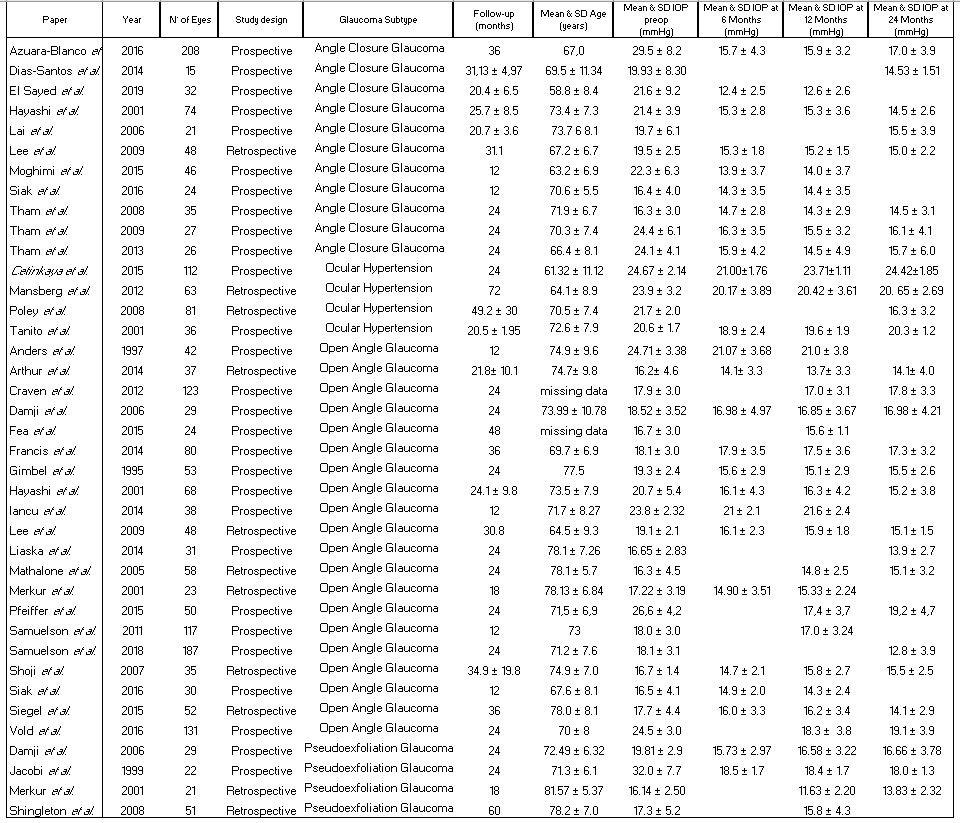
Un totale di 34 studi, comprendenti 39 gruppi, dal 1995 al 2018, sono stati inclusi per le metanalisi (Tabella 1), basandosi sui seguenti criteri di inclusione ed esclusione.
Criteri di inclusione:
1. Studi che fornissero informazioni sulla IOP prefacoemulsificazione e post-facoemulsificazione.
2. Studi approvati da un Gruppo di revisione istituzionale o da un comitato etico.
Criteri di esclusione:
1. Articoli non disponibili in lingua inglese.
2. Articoli non disponibile in formato digitale
3. Risultati su popolazione non umana.
4. Studi condotti su pazienti di età minore di 18 anni.
5. Precedente o concomitante trabeculectomia, altra importante chirurgia oculare o patologia rilevante.
6. Follow-up minore di 12 mesi.
7. Numero di occhi analizzati inferiore a 15.
8. Studi su MIGS privi di un braccio trattato con solo facoemulsificazione.
9. Differenti sottotipi di glaucoma compresi nello stesso braccio.
Il risultato di primario interesse nella nostra metanalisi era la variazione di IOP ai tempi t1 (6 mesi), t2 (12 mesi) e t3 (24 mesi) rispetto al preoperatorio t0 (baseline).
Metodo di ricerca della letteratura
Abbiamo raccolto le pubblicazioni riguardanti gli effetti dell’intervento di cataratta nei pazienti con glaucoma o ipertensione oculare attraverso un’accurata ricerca sui database MEDLINE, Co-chrane Library ed EMBASE fino al 1° Aprile 2021. Assieme agli altri autori scelto i termini della ricerca e i criteri di inclusione/esclusione.
I termini utilizzati nella ricerca sono stati: (“Glaucoma, Open-Angle” OR “Glaucoma, Angle-Closure” OR glaucoma) AND (“Phacoemulsification” OR “phacoemulsification”) AND (“In-traocular Pressure” OR “intraocular pressure”) AND (“Ocular Hypertension” OR “ocular hy-pertension”) AND (“Glaucoma, Pseudoexfoliative”) AND (“Cataract Extraction” OR “cataract extraction”) AND (“Cataract Surgery” OR “cataract surgery”).
Se gli studi riportavano un braccio di trattamento addizionale, ad esempio MIGS combinata con intervento di estrazione di cataratta, solo il braccio della facoemulsificazione è stato incluso nell’analisi. Alcuni studi riportavano diversi sottotipi di glaucoma
10 LA VOCE AICCER 1/2024
all’interno dello stesso gruppo e sono stati pertanto esclusi dall’analisi. Altri studi sono stati esclusi perché estratti dallo stesso set di dati di articoli precedentemente pubblicati. Talvolta non venivano esclusi occhi che aveva-no subito, prima o durante il periodo di follow-up interventi chirurgici o procedure laser (e.g. SLT) e quindi sono stati esclusi. Alcuni studi contemplavano un wash-out dei farmaci come parte della loro metodologia, poiché ciascuno studio ha usato protocolli differenti, negli studi in cui la IOP post wash-out era dispo-nibile alla baseline e nei vari follow-up questi valori sono stati utilizzati
CHIRURGIA REFRATTIVA
nell’analisi; quando que-sto non era disponibile sono stati utilizzati i valori di IOP durante il trattamento farmacologico.
Un totale di 39 gruppi (20 POAG, 11 ACG, 4 PXG e 4 OH) sono stati selezionati dai 34 studi. Dai bracci selezionati 11 erano retrospettivi e 28 prospettici. Un totale di 2227 occhi è stato ana-lizzato all’inizio dei follow-up.
Analisi e sintesi dei dati
Le metanalisi sono state completate tramite Statsdirect 3.2 (StaTsdirect, UK).
Utilizzando il “random effects model” possiamo pro-
11 LA VOCE AICCER 1/2024
Tabella 1. Elenco studi che soddisfano i criteri di inclusione ed esclusione con relative caratteristiche [3-36]
CHIRURGIA REFRATTIVA
vare a stimare la media della distribuzione dell’effetto reale. Gli studi più grandi hanno meno probabilità di dominare l’analisi e gli studi più piccoli di essere sottovalutati.
La pooled difference ci permette di stimare la differenza comune assumendo che le diverse po-polazioni abbiano la stessa varianza. Lo Z test ci permette di valutare un’ipotesi se conosciamo la varianza della popolazione o se il campione è ≥ 30.
La non combinabilità degli studi è stata valutata tramite Cochran Q test che permette di verificare se i trattamenti hanno identico effetto. L’eterogeneità è stata calcolata tramite I2 test e per valori compresi tra il 75% e il 100% è considerabile e depone a favore della lettura della metanalisi at-traverso il random effects model.
Gli indicatori di Bias usati sono il Begg & Mazundar rank correlation, test che stima la correla-zione tra i gradi dell’ampiezza dell’effetto e i gradi della loro varianza, e la regressione di Egger che ci dà il grado di asimmetria del funnel plot.
Risultati
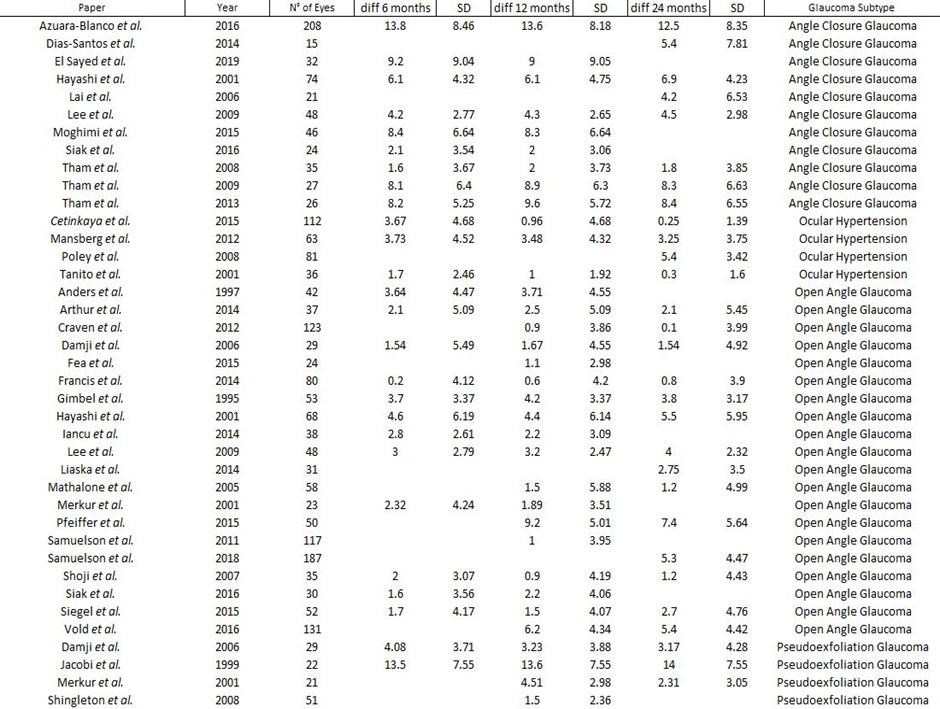
Nella Tabella 2 sono raccolti tutti gli studi selezionati dalla ricerca dei database che ottemperano ai criteri di inclusione/esclusione dei quali abbiamo calcolato la media della differenza con relati-va deviazione standard rispetto al preoperatorio ai tempi 6 mesi, 12 mesi e 24 mesi. Dalle meta-nalisi dei diversi sottogruppi (POAG, ACG, PXG e OH) abbiamo ricavato i seguenti risultati. I risultati mostrano una significativa riduzione
12 LA VOCE AICCER 1/2024
Tabella 2. Autore, anno di pubblicazione, numero di occhi e differenze medie con relativa DS a 6, 12 e 24 me-si, sottotipo di glaucoma degli studi selezionati per le metanalisi. (3-36)
dell’IOP dopo l’intervento di estrazione della cataratta a tutti e tre i time-points 6, 12 e 24 mesi per il POAG. Data l’alta eterogeneità degli studi inclusi in questo sottogruppo in qualsiasi timepoint (rispettivamente, I2 = 78%, I2 = 94% e I2 = 94.7%), nell’analisi della riduzione dell’IOP nel POAG, è stato applicato il modello DerSimonian & Laird.
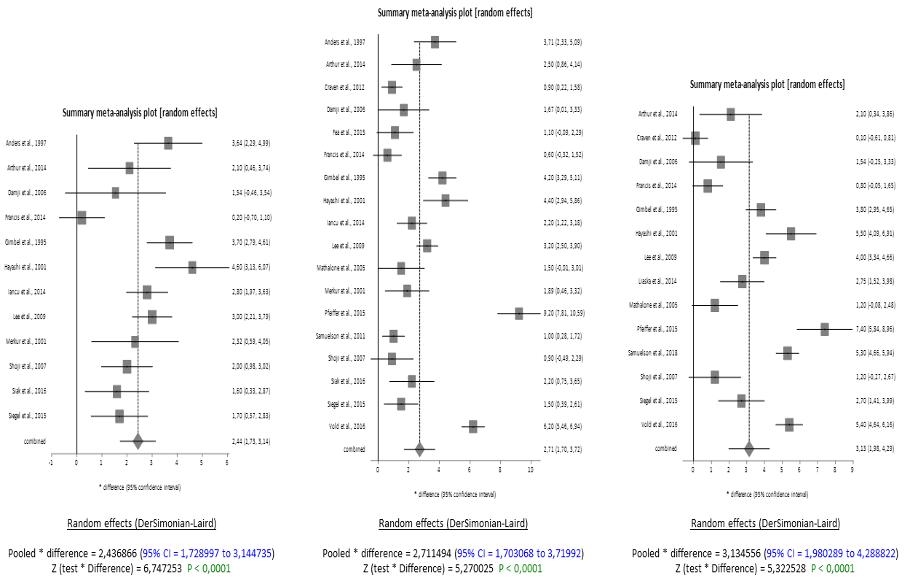
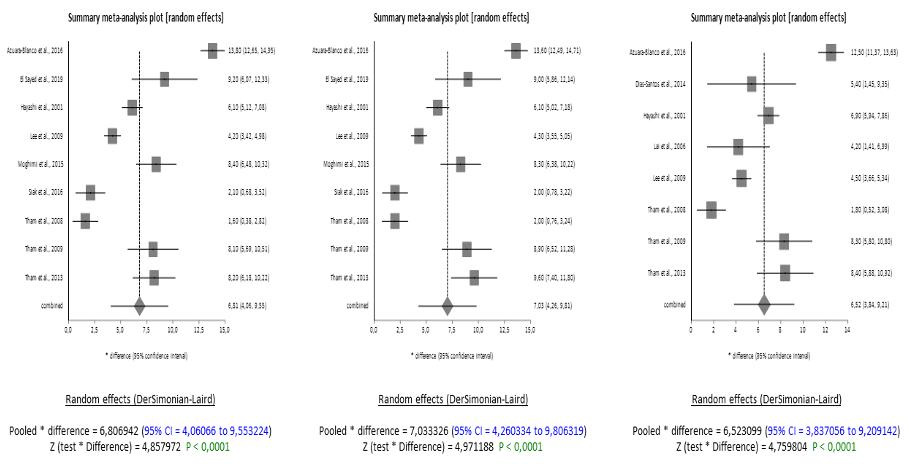
La differenza media combinata era di 2.44 mmHg a 6 mesi, 2.71 mmHg a 12 mesi e 3.13 mmHg a 24 mesi (IC al 95%). Gli Z-tests delle differenze avevano tutti p-values inferiori a 0.0001, indicando significatività (Figura 1).
I Forest plot dimostrano che i set di dati sono di buona qualità e non presentano bias di pubblicazione data la simmetria nei Funnel plot. Lo stesso vale, agli stessi intervalli di tempo, per il glaucoma ad angolo chiuso. L’analisi mostra che, dopo la facoemulsificazione, c’è una significativa riduzione dell’IOP nei pazienti con ACG a 6, 12 e 24 mesi dal baseline (Figura 2). La differenza media combinata nella riduzione dell’IOP era di 6.81 mmHg (IC 95% = 4.06 a 9.55) a 6 mesi, 7.03 mmHg (IC 95% = 4.26 a 9.81) a 12 mesi e 6.52 mmHg (IC 95% =
3.84 a 9.21) a 24 mesi. I risultati degli Z-tests indicavano che le riduzioni, con p-values inferiori a 0.0001, erano significative.
I forest plot mostrano che anche i data-set nell’ACG sono di buona qualità, non ci sono tracce di bias di pubblicazione come confermato dai risultati della Begg and Mazundar rank correlation e della regressione di Egger.
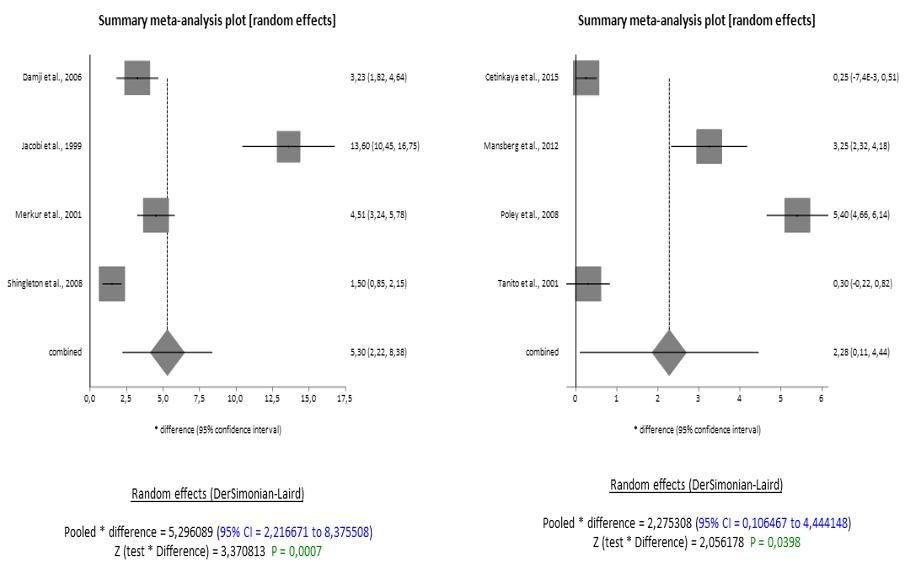
Nonostante la scarsità di studi idonei, anche nei due sottogruppi, PXG e OH, i risultati hanno mostrato che la riduzione dell’IOP era significativa a 12 mesi dal baseline nel PXG con una differenza combinata di 5.30 mmHg (IC 95% = 2.216671 a 8.375508), e significativa a 24 mesi dal baseline nell’OH, con una differenza combinata di 2.28 mmHg (IC 95% = 0.106467 a 4.444148) (Figura 3). Il random effects model è stato applicato anche in questi sottogruppi a causa dell’alta eterogeneità e i funnel plot suggeriscono che non è stato rilevato alcun bias di pubblicazione.
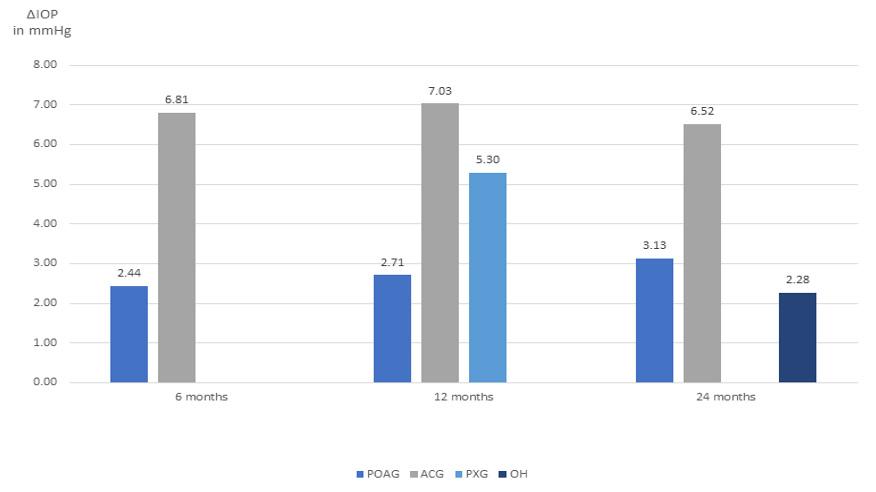
Come possiamo notare dalla Figura 4 la riduzione maggiore della IOP, in ciascuno dei tempi presi in esame, rimane sempre ad appannaggio del Glaucoma ad Angolo Chiuso, con valori rispettivamen-
13 LA VOCE AICCER 1/2024
CHIRURGIA REFRATTIVA
Figura 1. Forest plots POAG a 6, 12 e 24 mesi rispettivamente.
CHIRURGIA REFRATTIVA
te di 6,81 mmHg, 7,03 mmHg e 6,52 mmHg. Al contrario la riduzione minore, in termini assoluti, è quella dell’Ipertensione Oculare, con un valore al follow-up dopo 24 mesi di 2,28 mmHg. Numerosi studi hanno ormai dimostrato che la rimozione di una cataratta, significativamente impattante sulla qualità visiva, può portare ad un miglioramento della funzione visiva con conseguente miglioramento della qualità di vita ad essa
associata, in particolare nei pazienti con preesistenti danni del campo visivo come quelli glaucomatosi.
Questi benefici vanno attentamente discussi coi pazienti glaucomatosi, spiegando dettagliatamente anche i rischi correlati e le implicazioni dell’intervento [38]
L’estrazione di cataratta da sola può aiutare la riduzione della IOP, in pazienti selezionati, nel
14 LA VOCE AICCER 1/2024
Figura 2. Forest plots ACG a 6, 12 e 24 mesi rispettivamente.
Figura 3. Forest plot PXG a 12 mesi e OH a 24 mesi rispettivamente.
tentativo di migliorare la loro funzionalità visiva, nel breve e lungo termine [39] .
Sebbene questa analisi abbia risultati significativi, bisogna riconoscere le sue limitazioni. Sono stati aggregati i dati degli studi che contemplavano il wash-out terapeutico, spesso con protocolli diversi per eseguirlo, e di altri studi in cui questo non è stato eseguito. Un ulteriore lavoro di confronto tra i primi e i secondi sarebbe certamente interessante per valutare il peso di questo protocollo sull’effetto della chirurgia della cataratta nella gestione dell’IOP, quando non è influenzato dalla terapia farmacologica.
Un altro aspetto che merita sicuramente una valutazione è come il trattamento viene modificato nel tempo dopo la facoemulsificazione, attingendo a questo per capire meglio l’entità dell’effetto dei singoli principi attivi nel periodo post-operatorio.
Conclusioni
Sebbene ricerche aggiuntive siano necessarie per approfondire meccanismi e variabili individuali della riduzione di IOP, è ormai innegabile l’effetto benefico della facoemulsificazione di cataratta nei pazienti glaucomatosi e con ipertono oculare, non solo a breve distanza dall’intervento, ma anche negli anni successivi.
L’effetto risulta sicuramente eclatante nel glaucoma ad Angolo Chiuso ma non va assolutamente sottovalutato neanche nel glaucoma ad Angolo Aperto e nel suo sottotipo Pseudoesfoliativo, in cui risulta anche maggiore.
Non da ultimo dobbiamo rilevare che, anche nei pazienti con semplice Ipertensione Oculare, si ha una modica riduzione del tono ma rilevante, protettiva nei confronti del danno glaucomatoso verso cui potrebbe evolvere.
Il punto di partenza di questo articolo era dimostrare la correlazione tra l’intervento chirurgico della cataratta e il principale fattore modificabile nel glaucoma, la pressione intraoculare. Avendo dimostrato l’esistenza di questa correlazione e la sua significatività statistica in tutti i sottogruppi, suggeriamo di inserire questa procedura nel quadro terapeutico per altri sottogruppi, come è già il caso per l’ACG. Riconosciamo comunque pienamente i rischi, potenzialmente anche catastrofici, che presenta, ma i nostri risultati suggeriscono che dovrebbe essere considerato per aiutare a raggiungere il valore target dell’IOP per il paziente. In conclusione, suggeriamo di considerare la facoemulsificazione non solo come un trattamento per la cataratta, ma anche per aiutare nella gestione dei pazienti con glaucoma e OH.
15 LA VOCE AICCER 1/2024 CHIRURGIA REFRATTIVA
Figura 4. DIOP combinata nei sottogruppi analizzati ai differenti intervalli di tempo.
CHIRURGIA
Bibliografia
1. GBD 2019 Blindness; Vision Impairment Collaborators; The Vision Loss Expert Group of the Global Burden of Disease Study. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: The Right to Sight: An analysis for the Global Burden of Disease Study. Lancet Glob. Health 2021, 9, e144–e160; Erratum in Lancet Glob. Health 2021, 9, e408. https://doi.org/10.1016/ S2214-109X(20)30489-7.
2. Young, C.E.C.; Seibold, L.K.; Kahook, M.Y. Cataract surgery and intraocular pressure in glaucoma. Curr. Opin. Ophthalmol. 2020, 31, 15–22. https://doi. org/10.1097/ICU.0000000000000623.
3. Azuara-Blanco, A.; Burr, J.M.; Cochran, C.; Ramsay, C.; Vale, L.; Foster, P.; Friedman, D.; Quayyum, Z.; Lai, J.; Nolan, W.; et al. The effectiveness of early lens extraction with intraocular lens implantation for the treatment of primary angle-closure glaucoma (EAGLE): Study protocol for a randomized controlled trial. Trials 2011, 12, 133. https://doi. org/10.1186/1745-6215-12-133.
4. Dias-Santos, A.; Ferreira, J.; Abegão Pinto, L.; Domingues, I.; Silva, J.P.; Cunha, J.P.; Reina, M. Phacoemulsification versus peripheral iridotomy in the management of chronic primary angle closure: Long-term follow-up. Int. Ophthalmol. 2015, 35, 173–178. https://doi.org/10.1007/s10792-0149926-8.
5. El Sayed, Y.M.; Elhusseiny, A.M.; Albalkini, A.S.; El Sheikh, R.H.; Osman, M.A. Mitomycin C-augmented Pha-cotrabeculectomy Versus Phacoemulsification in Primary Angle-closure Glaucoma: A Randomized Controlled Study. J. Glaucoma 2019, 28, 911–915. https://doi.org/10.1097/IJG.0000000000001345.
6. Hayashi, K.; Hayashi, H.; Nakao, F.; Hayashi, F. Effect of cataract surgery on intraocular pressure control in glaucoma patients. J. Cataract Refract. Surg. 2001, 27, 1779–1786. https://doi.org/10.1016/ s0886-3350(01)01036-7.
7. Lai, J.S.M.; Tham, C.C.Y.; Chan, J.C.H. The clinical outcomes of cataract extraction by phacoemulsification in eyes with primary angle-closure glaucoma (PACG) and co-existing cataract: A prospective case series. J. Glaucoma 2006, 15, 47–52. https://doi. org/10.1097/01.ijg.0000196619.34368.0a.
8. Lee, Y.-H.; Yun, Y.-M.; Kim, S.H.; Lee, E.-K.; Lee, J.-E.; Kim, C.-S. Factors that influence intraocular pressure after cataract surgery in primary glaucoma. Can. J. Ophthalmol. 2009, 44, 705–710. https://doi. org/10.3129/i09-186.
9. Moghimi, S.; Latifi, G.; ZandVakil, N.; Mohammadi, M.; Khatibi, N.; Soltani-Moghadam, R.; Lin, S. Phacoemulsification Versus Combined Phacoemulsification and Viscogonioplasty in Primary Angle-Closure Glaucoma: A Randomized Clinical Trial. J. Glaucoma. 2015, 24, 575–582. https://doi.org/10.1097/ IJG.0000000000000196.
10. Siak, J.; Quek, D.; Nongpiur, M.E.; Ho, S.-W.; Hto-
on, H.M.; Perera, S.; Aung, T.; Wong, T. Anterior Chamber Angle and Intraocular Pressure Changes After Phacoemulsification: A Comparison Between Eyes with Closed-angle and Open-angle Glaucoma. J. Glaucoma 2016, 25, e259–e264. https://doi. org/10.1097/IJG.0000000000000271.
11. Tham, C.C.; Kwong, Y.Y.; Baig, N.; Leung, D.Y.; Li, F.C.; Lam, D.S. Phacoemulsification versus trabeculectomy in medically uncontrolled chronic angleclosure glaucoma without cataract. Ophthalmology 2013, 120, 62–67. https://doi.org/10.1016/j.ophtha.2012.07.021.
12. Tham, C.C.; Kwong, Y.Y.; Leung, D.Y.; Lam, S.W.; Li, F.C.; Chiu, T.Y.; Chan, J.C.; Chan, C.H.; Poon, A.S.; Yick, D.W.; et al. Phacoemulsification versus combined phacotrabeculectomy in medically controlled chronic angle closure glaucoma with cataract. Ophthalmology 2008, 115, 2167–2173.e2. https://doi.org/10.1016/j.ophtha.2008.06.016.
13. Tham, C.C.; Kwong, Y.Y.; Leung, D.Y.; Lam, S.W.; Li, F.C.; Chiu, T.Y.; Chan, J.C.; Lam, D.S.; Lai, J.S. Phacoemulsification versus combined phacotrabeculectomy in medically uncontrolled chronic angle closure glaucoma with cataracts. Ophthalmology 2009, 116, 725–731.e3. https://doi.org/10.1016/j. ophtha.2008.12.054.
14. Cetinkaya, S.; Dadaci, Z.; Yener, H.I.; Acir, N.O.; Cetinkaya, Y.F.; Saglam, F. The effect of phacoemulsification surgery on intraocular pressure and anterior segment anatomy of the patients with cataract and ocular hypertension. Indian, J. Ophthalmol. 2015, 63, 743–745. https://doi.org/10.4103/03014738.171020.
15. Mansberger, S.L.; Gordon, M.O.; Jampel, H.; Bhorade, A.; Brandt, J.D.; Wilson, B.; Kass, M.A.; Ocular Hypertension Treatment Study Group. Reduction in intraocular pressure after cataract extraction: The Ocular Hypertension Treatment Study. Ophthalmology 2012, 119, 1826–1831. https://doi. org/10.1016/j.ophtha.2012.02.050.
16. Poley, B.J.; Lindstrom, R.L.; Samuelson, T.W. Long-term effects of phacoemulsification with intraocular lens implantation in normotensive and ocular hypertensive eyes. J. Cataract Refract. Surg. 2008, 34, 735–742. https://doi.org/10.1016/j. jcrs.2007.12.045.
17. Tanito, M.; Ohira, A.; Chihara, E. Surgical outcome of combined trabeculotomy and cataract surgery. J. Glaucoma 2001, 10, 302–308. https://doi. org/10.1097/00061198-200108000-00010.
18. Anders, N.; Pham, T.; Holschbach, A.; Wollensak, J. Combined phacoemulsification and filtering surgery with the ‘nostitch’ technique. Arch. Ophthalmol. 1997, 115, 1245–1249. https://doi.org/10.1001/ archopht.1997.01100160415004.
19. Arthur, S.N.; Cantor, L.B.; WuDunn, D.; Pattar, G.R.; Catoira-Boyle, Y.; Morgan, L.S.; Hoop, J.S. Efficacy, safety, and survival rates of IOP-lowering effect of phacoemulsification alone or combined with canaloplasty in glauco-ma patients. J. Glauco-
16 LA VOCE AICCER 1/2024
REFRATTIVA
ma. 2014, 23, 316–320. https://doi.org/10.1097/ IJG.0b013e3182741ca9.
20. Craven, E.R.; Katz, L.J.; Wells, J.M.; Giamporcaro, J.E.; iStent Study Group. Cataract surgery with trabecular mi-cro-bypass stent implantation in patients with mild-to-moderate open-angle glaucoma and cataract: Two-year fol-low-up. J. Cataract Refract. Surg. 2012, 38, 1339–1345. https://doi. org/10.1016/j.jcrs.2012.03.025.
21. Damji, K.F.; Konstas, A.G.P.; Liebmann, J.M.; Hodge, W.G.; Ziakas, N.G.; Giannikakis, S.; Mintsioulis, G.; Merkur, A.; Pan, Y.; Ritch, R. Intraocular pressure following phacoemulsification in patients with and without exfoliation syndrome: A 2 year prospective study. Br. J. Ophthalmol. 2006, 90, 1014–1018. https://doi.org/10.1136/bjo.2006.091447.
22. Fea, A.M.; Consolandi, G.; Zola, M.; Pignata, G.; Cannizzo, P.; Lavia, C.; Rolle, T.; Grignolo, F.M. Micro-Bypass Implantation for Primary Open-Angle Glaucoma Combined with Phacoemulsification: 4-Year Follow-Up. J. Oph-thalmol. 2015, 2015, 795357. https://doi.org/10.1155/2015/795357.
23. Francis, B.A.; Berke, S.J.; Dustin, L.; Noecker, R. Endoscopic cyclophotocoagulation combined with phacoemul-sification versus phacoemulsification alone in medically controlled glaucoma. J. Cataract Refract. Surg. 2014, 40, 1313–1321. https://doi. org/10.1016/j.jcrs.2014.06.021.
24. Gimbel, H.V.; Meyer, D.; DeBroff, B.M.; Roux, C.W.; Ferensowicz, M. Intraocular pressure response to combined phacoemulsification and trabeculotomy ab externo versus phacoemulsification alone in primary open-angle glaucoma. J. Cataract Refract. Surg. 1995, 21, 653–660. https://doi.org/10.1016/ s0886-3350(13)80561-5.
25. Iancu, R.; Corbu, C. Intraocular pressure after phacoemulsification in patients with uncontrolled primary open angle glaucoma. J. Med. Life 2014, 7, 11–16.
26. Liaska, A.; Papaconstantinou, D.; Georgalas, I.; Koutsandrea, C.; Theodosiadis, P.; Chatzistefanou, K. Phaco-trabeculectomy in controlled, advanced, open-angle glaucoma and cataract: Parallel, randomized clinical study of efficacy and safety. Semin. Ophthalmol. 2014, 29, 226–235. https://doi.org/10. 3109/08820538.2014.880491.
27. Mathalone, N.; Hyams, M.; Neiman, S.; Buckman, G.; Hod, Y.; Geyer, O. Long-term intraocular pressure control af-ter clear corneal phacoemulsification in glaucoma patients. J. Cataract Refract. Surg. 2005, 31, 479–483. https://doi.org/10.1016/j. jcrs.2004.06.046.
28. Merkur, A.; Damji, K.F.; Mintsioulis, G.; Hodge, W.G. Intraocular pressure decrease after phacoemulsification in patients with pseudoexfoliation syndrome. J. Cataract Refract. Surg. 2001, 27, 528–532. https://doi.org/10.1016/s0886-3350(00)00753-7.
29. Pfeiffer, N.; Garcia-Feijoo, J.; Martinez-de-la-Casa, J.M.; Larrosa, J.M.; Fea, A.; Lemij, H.; Gandolfi, S.; Schwenn, O.; Lorenz, K.; Samuelson, T.W. A
Randomized Trial of a Schlemm’s Canal Microstent with Phacoemulsification for Reducing Intraocular Pressure in Open-Angle Glaucoma. Ophthalmology 2015, 122, 1283–1293. https://doi.org/10.1016/j. ophtha.2015.03.031.
30. Samuelson, T.W.; Chang, D.F.; Marquis, R.; Flowers, B.; Lim, K.S.; Ahmed, I.I.K.; Jampel, H.D.; Aung, T.; Crandall, A.S.; Singh, K.; HORIZON Investigators. A Schlemm Canal Microstent for Intraocular Pressure Reduction in Pri-mary Open-Angle Glaucoma and Cataract: The HORIZON Study. Ophthalmology 2019, 126, 29–37. https://doi.org/10.1016/j.ophtha.2018.05.012.
31. Samuelson, T.W.; Katz, L.J.; Wells, J.M.; Duh, Y.J.; Giamporcaro, J.E.; US iStent Study Group. Randomized evalua-tion of the trabecular microbypass stent with phacoemulsification in patients with glaucoma and cataract. Oph-thalmology 2011, 118, 459–467. https://doi.org/10.1016/j.ophtha.2010.07.007.
32. Shoji, T.; Tanito, M.; Takahashi, H.; Park, M.; Hayashi, K.; Sakurai, Y.; Nishikawa, S.; Chihara, E. Phacovisco-canalostomy versus cataract surgery only in patients with coexisting normal-tension glaucoma: Midterm out-comes. J. Cataract Refract. Surg. 2007, 33, 1209–1216. https://doi.org/10.1016/j. jcrs.2007.03.027.
33. Siegel, M.J.; Boling, W.S.; Faridi, O.S.; Gupta, C.K.; Kim, C.; Boling, R.C.; Citron, M.E.; Siegel, M.J.; Siegel, L.I. Combined endoscopic cyclophotocoagulation and phacoemulsification versus phacoemulsification alone in the treatment of mild to moderate glaucoma. Clin. Exp. Ophthalmol. 2015, 43, 531–539. https://doi.org/10.1111/ceo.12510.
34. Vold, S.; Ahmed, I.I.K.; Craven, E.R.; Mattox, C.; Stamper, R.; Packer, M.; Brown, R.H.; Ianchulev, T.; CyPass Study Group. Two-Year COMPASS Trial Results: Supraciliary Microstenting with Phacoemulsification in Patients with Open-Angle Glaucoma and Cataracts. Ophthalmology 2016, 123, 2103–2112. https://doi.org/10.1016/j.ophtha.2016.06.032.
35. Jacobi, P.C.; Dietlein, T.S.; Krieglstein, G.K. Comparative study of trabecular aspiration vs trabeculectomy in glaucoma triple procedure to treat pseudoexfoliation glaucoma. Arch. Ophthalmol. 1999, 117, 1311–1318. https://doi.org/10.1001/archopht.117.10.1311.
36. Shingleton, B.J.; Laul, A.; Nagao, K.; Wolff, B.; O’Donoghue, M.; Eagan, E.; Flattem, N.; Desai-Bartoli, S. Effect of phacoemulsification on intraocular pressure in eyes with pseudoexfoliation: Single-surgeon series. J. Cataract Refract. Surg. 2008, 34, 1834–1841. https://doi.org/10.1016/j.jcrs.2008.07.025.
37. Tsui, J.L.; Chan, N.C.; Tham, C.C. The role of lens extraction in glaucoma management. Ann. Transl. Med. 2020, 8, 1550. https://doi.org/10.21037/atm20-3251a.
38. Shah, M.; Law, G.; Ahmed, I.I.K. Glaucoma and cataract surgery: Two roads merging into one. Curr. Opin. Oph-thalmol. 2016, 27, 51–57. https://doi. org/10.1097/ICU.0000000000000224.
17 LA VOCE AICCER 1/2024 CHIRURGIA REFRATTIVA

IN COLLABORAZIONE CON 18-19-20 APRILE 2024 ROMA | ERGIFE PALACE HOTEL S.I.S.O. CONGRESSO NAZIONALE SEGRETERIA ORGANIZZATIVA CONGRESSO
0141 1706694 int. 3
S.I.S.O. Tel. +39 0601904733 +39 3246075902 dal lunedì al venerdì dalle ore 9:00 alle ore 17:30 congresso@sisoets.org www.sisoets.org Per INFO e ISCRIZIONI SCAN
Tel.
iscrizioni@sisoets.org SEGRETERIA




CHIRURGIA REFRATTIVA
di Massimo Camellin, Umberto Camellin
Tratto da “Appunti di SemeiOTTICA fisiopatologica - Volume 1”
Semeiotica strumentale dopo chirurgia refrattiva corneale
La semeiotica strumentale dopo chirurgia refrattiva corneale ha un ruolo molto importante nel monitoraggio degli interventi eseguiti negli anni. Gli strumenti principali per lo studio della superficie corneale sono i topografi, la Scheimpflug camera e l’OCT del segmento anteriore. Quest’ultimo strumento permette di ottenere informazioni dettagliate non solo sulla morfologia della cornea ma anche della camera anteriore ed offre, grazie all’alta risoluzione, la ricostruzione delle mappe epiteliali (tabella 1). Dunque, in questo capitolo verranno affrontati casi clinici più o meno complessi evidenziando i limiti ed i vantaggi delle singole metodiche e i diversi strumenti diagnostici oggi a disposizione.
Topografia
dopo chirurgia refrattiva corneale
La topografia corneale è un esame fondamentale per lo studio della curvatura della superficie anteriore della cornea. Dalla topografia è possibile an-


Semeiotica strumentale del segmento anteriore
Topografia
Scheimpflug’s camera
OCT del segmento anteriore
Mappe epiteliali
Tabella 1. Semeiotica strumentale dopo chirurgia refrattiva corneale
che ricavare l’aberrometria di superficie detta anche corneal wavefront (CW). Questo rappresenta il fronte d’onda di cui è responsabile la sola superficie anteriore. Molti topografi hanno la possibilità di ricavare i raggi di curvatura e trasformarli in aberrazioni di fronte d’onda. Dopo aver ricavato il fronte d’onda complessivo della superficie anteriore dell’occhio è possibile, attraverso successive elaborazioni, analizzare le singole aberrazioni tramite la scomposizione di Zernike o tramite l’analisi di Fourier.
20 LA VOCE AICCER 1/2024
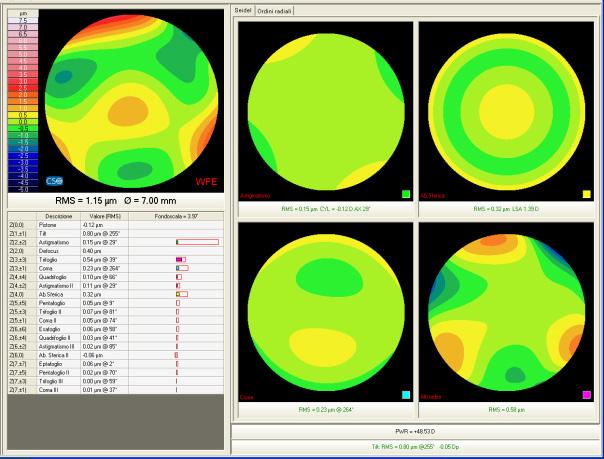
Figura 1. opografia ed aberrometria di una cornea ideale. Sono nella norma gli indici di regolarità corneali di Maloney BFTI (Keratron OD 0.36 OS 0.27). L’aberrometria di superficie (a destra) con analisi di Zernike in un’area di 7 mm presenta un valore complessivo pari a RMS=1.15 μm (assolutamente nella norma). Le aberrazioni sono state analizzate anche per gruppi, astigmatismo, aberrazione sferica, coma ed alti ordini.

La mappa cromatica in topografica tangenziale di una cornea vergine ideale (figura 1) mostra una zona centrale curva, di colore verde ed una zona più piatta in periferia di colore blu, espressione della normale asfericità corneale.
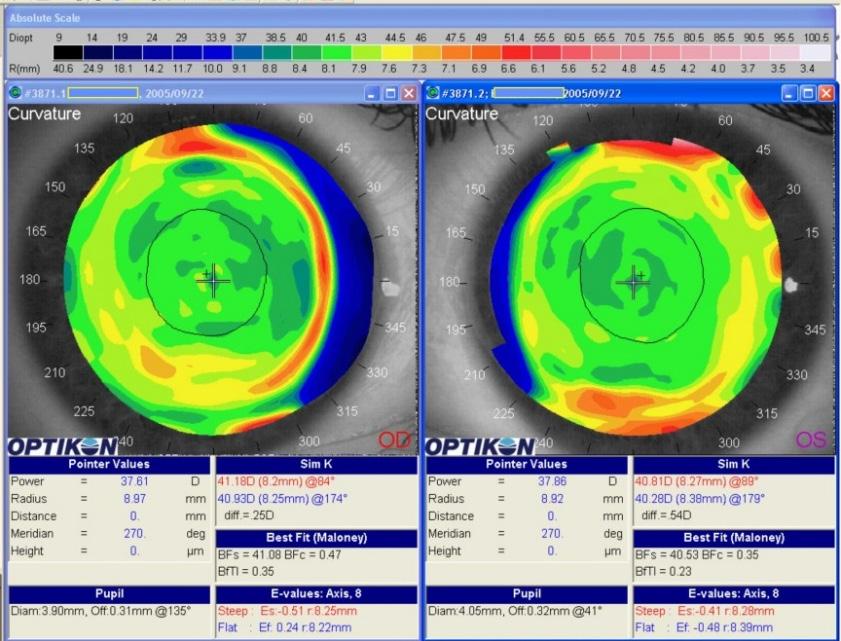
Abbiamo selezionato alcuni casi clinici per illustrare come usare l’analisi topografica in situazioni comuni. La figura 2-6 mostra un trattamento di PRK in miopia elevata con regressione supero-temporale bilaterale (zona verde presente in entrambi gli occhi nel settore supero temporale).
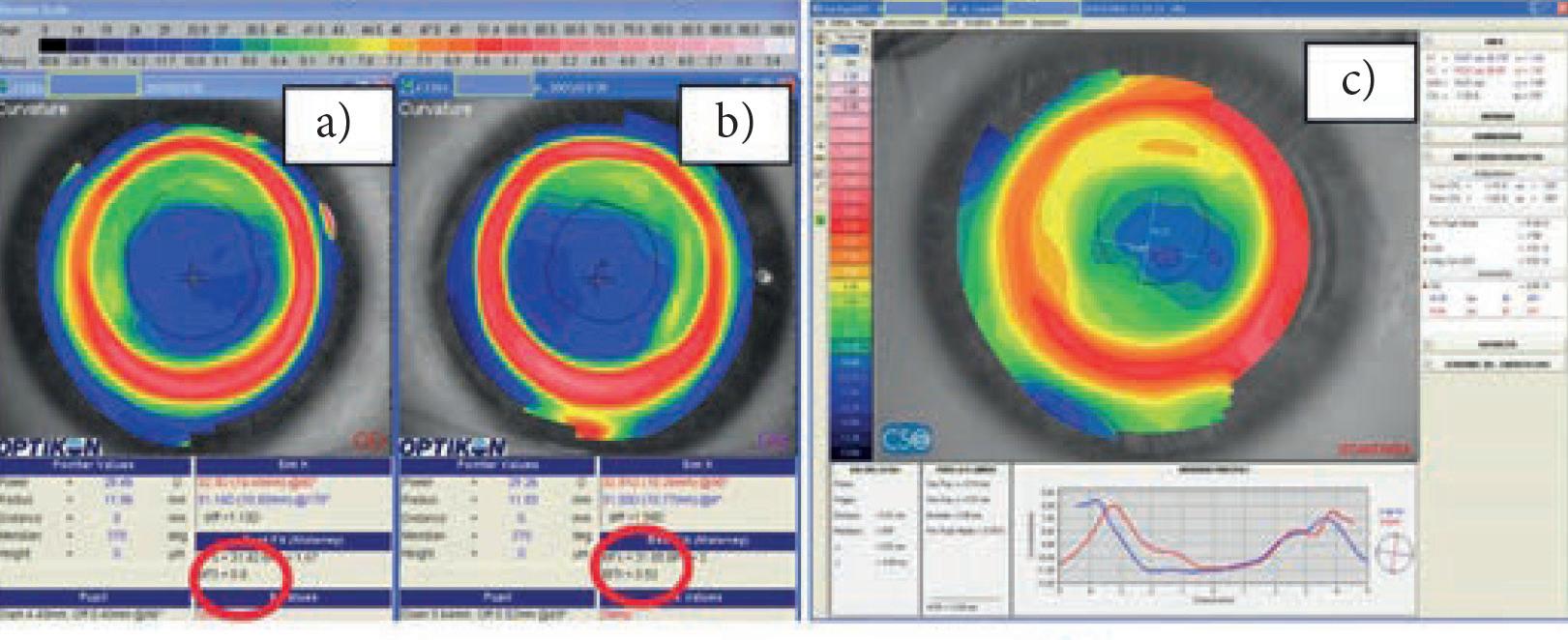
Nell’analisi delle topografie va posta attenzione alla scala, che in figura 2a è assoluta mentre in 2c è normalizzata. La scala condiziona l’aspetto cromatico dell’immagine. È evidente un’area centrale di appiattimento di colore blu in corrispondenza della zona ottica centrale ed un ginocchio detto di transizione, di colore rosso, concentrico alla zona ottica. Il ginocchio di transizione risulta tanto più evidente quanto più è brusco il raccordo tra centro e periferia, questo particolarmente nel caso di trattamenti per miopie elevate. Tale topografia potrebbe riferirsi ad
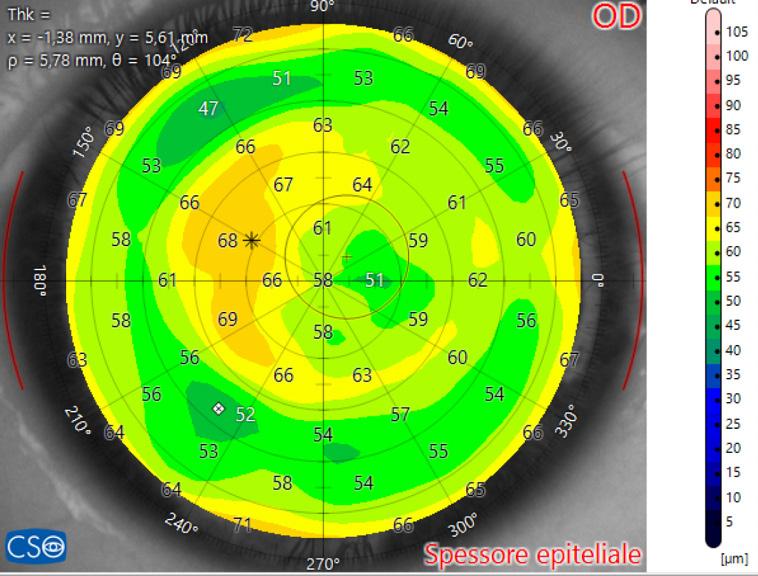
Figura 2. Regressione supero-temporale in PRK per miopia elevata. Topografia tangenziale in scala assoluta occhio destro (a) ed occhio sinistro (b) (Keratron). BFTI OD: 0.8 OS: 0.52 (valori superiori alla normalità generalmente di 0.25). c) Topografia tangenziale in scala normalizzata dell’occhio destro (CSO) in cui si evidenzia una zona centrale ovale per effetto della regressione supero temporale. d) Mappa epiteliale dello stesso paziente a distanza di anni con OCT MS-39 (CSO): si nota l’iperplasia epiteliale nei settori temporali paracentrali.
un trattamento laser di superficie (LASEK, PRK) o ad un trattamento intrastromale (LASIK) ma generalmente nella LASIK la transizione è più morbida per la presenza del flap stromale. Osservando le topografie di entrambi gli occhi, si può osservare che l’area di appiattimento centrale non si estende per 360° fino al ginocchio di transizione, ma è presente un’area verde in sede supero-temporale espressione di un aumento di curvatura rispetto alla zona centrale. Questo aspetto topografico si riscontra spesso nei trattamenti laser di superficie effettuati in passato per difetti elevati ed è riconducibile ad una ricrescita di tessuto che tende a colmare la zona ablata. Tale ricrescita è inizialmente dovuta ad iperplasia epiteliale ma, nel corso degli anni, si assiste ad una metaplasia delle cellule epiteliali. In questo caso il visus preoperatorio del paziente era OD: -10 sf -3 cil a 175° 6-7/10 e OS: -8.50 sf -3.25 cil a 180° 8/10. Il risultato postoperatorio è stato OD: -0.75 sf 5/10 e OS: +0.25 sf -1.25 cil a 15° 8/10, quindi abbiamo una lieve riduzione del visus nell’occhio destro. Si tratta adesso di valutare se tale riduzione del visus
21 LA VOCE AICCER 1/2024
REFRATTIVA
CHIRURGIA
CHIRURGIA

nell’occhio destro sia conseguente all’irregolarità dovuta al trattamento oppure a problematiche retiniche connesse alla miopia elevata preesistente. Lo studio della cheratoscopia procede con l’analisi dell’indice di regolarità BFTI di Maloney (presente nel Keratron) oppure utilizzando altri indici presenti in altre piattaforme (es. Phoenix, CSO) che mostra una differenza tra i due occhi risultando pari a 0.8 nell’occhio destro e 0.52 nell’occhio sinistro. Una cornea vergine ha un BFTI in-
torno a 0.25 quindi possiamo giustificare il visus ridotto con una superficie corneale non perfetta. Successivamente si esegue l’analisi della mappa in scala normalizzata. Con questa elaborazione è possibile osservare con maggior dettaglio la zona ottica del paziente, non perfetta in OD, valutare i profili di curvatura ed evidenziare se l’irregolarità della superficie giustifica la riduzione del visus. Attualmente nei casi di miopie così elevate preferiamo l’impianto di lenti fachiche intraoculari (ICL).
22 LA VOCE AICCER 1/2024
REFRATTIVA
Figura 3. Astigmatismo centrale residuo in trattamento di PRK per miopia lieve (-3 D). BFTI OD: 0.28 OS: 0.27. Ad ore 12 in od è presente un artefatto (chiazza blu periferica ore 12) dovuto ad una cattiva laminazione del film lacrimale.
Figura 4. Quadro topografico regolare post trattamento LASEK in entrambi gli occhi per miopia lieve, algoritmo True/tangenziale in scala assoluta. Il ginocchio di transizione è discontinuo e poco evidente per il basso valore della correzione.
a)
Figura 5. Persistenza di astigmatismo dopo LASEK miopica: quadro topografico (a) ed aberrometrico (b, c). Le aberrazioni aumentano in rapporto al diametro pupillare, sono bassissime in una zona ottica di 3 mm (b) ed aumentano allargando l’analisi a 5 mm (c). Il VISUS corretto post operatorio è comunque molto migliorato OD: -1.75 cil a 15 7-8/10.
b) c)
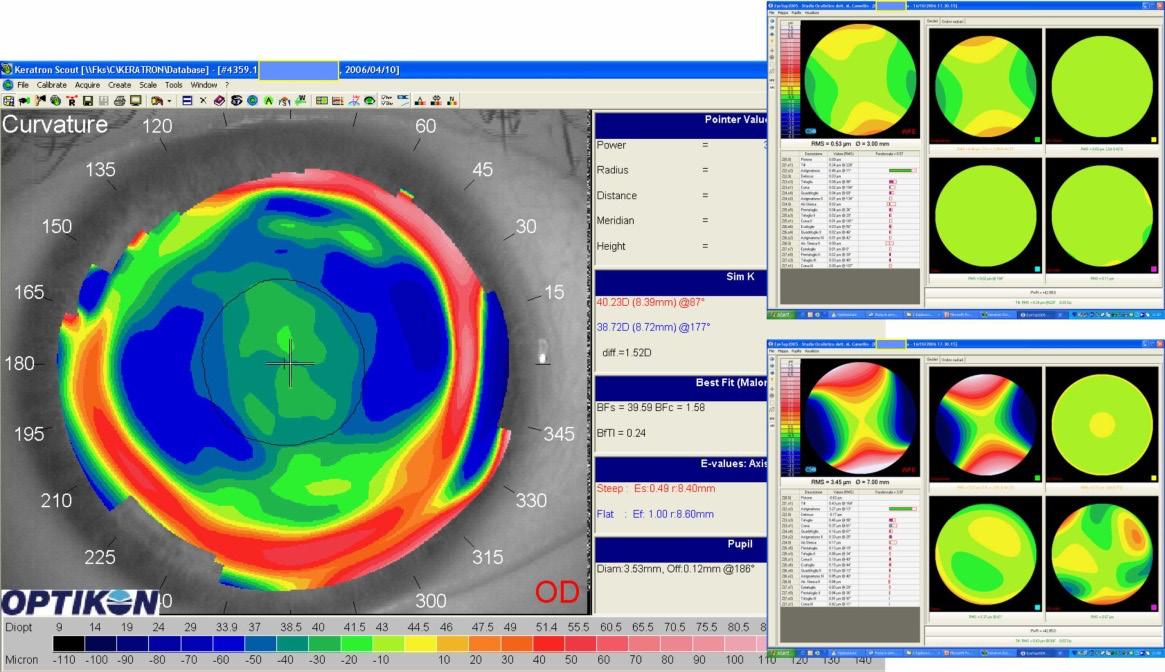
In figura 3 è rappresentata la topografia eseguita dopo un trattamento di PRK bilaterale per miopia lieve (circa -3 D).
Come già detto l’analisi inizia sempre dallo studio delle mappe cromatiche in scala assoluta con algoritmo tangenziale; in questo caso il ginocchio di transizione è molto poco visibile (in OD) in quanto il difetto preoperatorio era lieve, mentre nella zona centrale è presente una piccola clessidra astigmatica in appiattimento (in OO). La clessidra (in appiattimento) è posta, in questo caso, sul meridiano orizzontale che risulta per l’appunto più piatto. Si tratta quindi di una cornea che a seguito del trattamento laser ha assunto una forma oblata, cioè più piatta al centro e più curva in media periferia. La clessidra che ne deriva è detta clessidra in appiattimento. In questo caso il BFTI è basso, rispettivamente 0.28 nell’occhio destro e 0.27 nell’occhio sinistro, segno di curvatura molto regolare. Il caso rappresentato in figura 4 si riferisce ad un trattamento con tecnica LASEK per la correzione di una miopia di circa -3 D eseguito in entrambi gli occhi. La tecnica LASEK (LASer Epithelial Keratomileusis) è stata introdotta dal dott. Camellin M. nel 1998 e consiste nella creazione di un lembo epiteliale (flap epiteliale) dopo applicazione di una soluzione alcolica al 20% sulla superficie corneale per 20 secondi. Il lembo viene sollevato e posizionato superiormente grazie ad una cerniera di circa 90° ad ore 12. Si effettua l’abla-
zione laser ed il lembo viene quindi riposizionato sullo stroma ablato. Si applica poi una lente a contatto morbida protettiva per alcuni giorni. In questo caso si osserva un quadro topografico perfetto con un ginocchio di transizione centrato ma non continuo per il basso valore della miopia corretta. Alcune microirregolarità di superficie presenti non influenzano la capacità visiva del paziente. Anche i valori di BFTI sono molto bassi, 0.35 OD e 0.23 OS. La Figura 5 mostra un caso di LASEK per il trattamento di un astigmatismo miopico con visus preoperatorio OD: -4.25 sf -3.75 cil a 10° 4/10. Il risultato postoperatorio è buono con visus OD: -1 sf -0.75 cil a 15° 7-8/10. Ottimo miglioramento della capacità visiva, ma è evidente un lieve astigmatismo residuo al centro della zona ottica, frequente esito nei trattamenti eseguiti con i laser di vecchia generazione. Lo studio aberrometrico della clessidra posta lungo l’asse 100 mostra che le aberrazioni variano in base alle dimensioni della zona ottica analizzata.
L’aberrazione astigmatica è minima nella zona ottica di 3 mm mentre si manifesta nella zona ottica a 5 mm. L’aberrazione è tanto più evidente quanto più si aumenta il diametro della zona analizzata; da un punto di vista pratico ne consegue che, in condizioni scotopiche, il paziente potrà lamentare un peggioramento della visione.
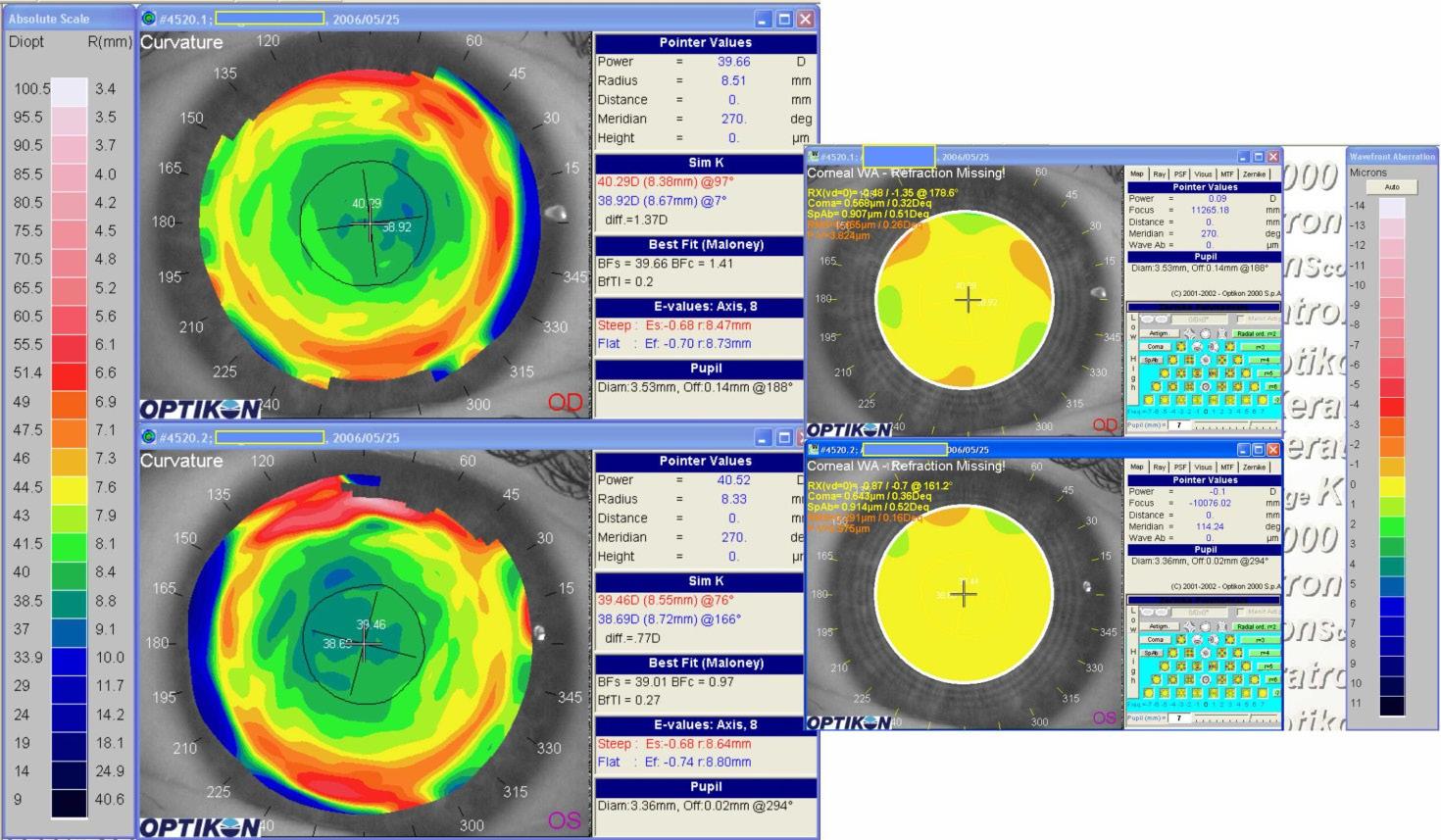
La Figura 6 rappresenta un caso di Epi-LASIK (ide-
23 LA VOCE AICCER 1/2024
REFRATTIVA
CHIRURGIA
a) b) c) d)
Figura 6. Quadro topografico ed aberrometrico di trattamento di Epi-LASIK in occhio destro a) e LASEK c) in occhio sinistro. Astigmatismo indotto in OD con Epi-LASIK. VISUS pre OD -5.25 sf -1.25 cil a 180° 10/10 OS -5.25 sf -0.75 cil a 175° 10/10; VISUS post OD -1.75 cil a 175° 10/10 OS -0.25 sf +0.5 cil a 80° 10/10. Nell’occhio destro b) (Epi-LASIK) sono presenti aberrazioni di alto ordine. Queste sono identificabili dopo aver deselezionato le componenti di basso ordine, di coma ed aberrazione sferica, nella piramide di Zernike. In OS d) non sono evidenziabli aberrazioni significative.
CHIRURGIA
ata da Pallikaris nel 2003) in occhio destro e LASEK in occhio sinistro. La tecnica Epi-LASIK prevedeva lo scollamento meccanico dell’epitelio con la sua membrana basale (lamina lucida e lamina densa), per mezzo di un microcheratomo con lama non tagliente. Successivamente si effettuava l’ablazione laser ed il riposizionamento dell’epitelio. Tale tecnica è stata in seguito abbandonata perché si è visto che le cellule epiteliali vitali rilasciavano citochine infiammatorie, che influenzavano negativamente i processi di cicatrizzazione. Nella tecnica Lasek, come già detto, per asportare l’epitelio si utilizza l’alcool al 20% che induce una parziale necrosi cellulare (separazione fra lamina lucida e lamina densa), pertanto, quando si riposiziona il lembo epiteliale, c’è un effetto di protezione sullo stroma da parte di uno strato cellulare solo parzialmente vitale.
Questo riduce il rilascio di mediatori dell’infiammazione mantenendo comunque un effetto di scudo sulla superficie trattata. Paradossalmente, dunque, le cellule epiteliali vitali non sono vantaggiose nel processo di guarigione.
La topografia dell’occhio destro evidenzia la comparsa di un astigmatismo indotto, infatti il visus preoperatorio in OD risultava pari a -5.25 sf -1.25 cil a
180° 10/10 ed il visus postoperatorio sempre in OD -1.75 cil a 175° 10/10.
L’analisi aberrometrica dell’occhio destro mostra alcune aberrazioni di alto ordine, quasi assenti nell’occhio sinistro. Spesso in Epi-LASIK abbiamo visto un aumento dell’astigmatismo postoperatorio. La figura 7-6 documenta il caso di un residuo di astigmatismo periferico dopo PRK.
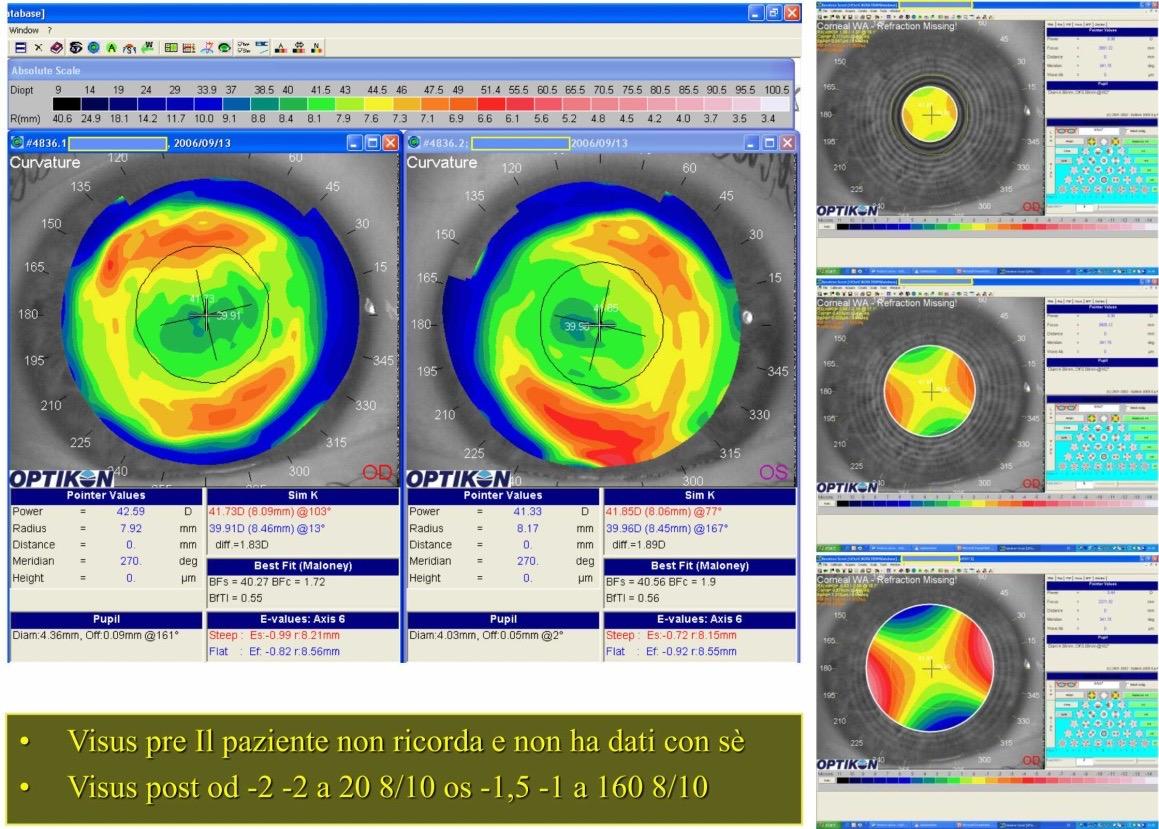
La PRK è stata la prima tecnica laser introdotta per la correzione dei difetti refrattivi. Prevede l’asportazione dell’epitelio con una piccola spatola od una spazzola rotante (ultimamente anche con alcool diluito) ed il successivo trattamento con laser ad eccimeri. Nei trattamenti laser di prima generazione si tendevano a realizzare zone ottiche piccole, in caso di miopie elevate, per risparmiare tessuto.
In questo caso, è stato effettuato un trattamento bilaterale con zona ottica troppo piccola rispetto alla forma astigmatica dell’occhio. Il risultato è la persistenza di un aumento di curvatura in media periferia in entrambi gli occhi, espressione del residuo astigmatico per incompleto trattamento periferico da cattivo raccordo. L’analisi del CW (Corneal Wavefront) evidenzia un aumento delle aberrazioni di alto ordine all’aumentare del diametro pupillare con conseguente scarsa qualità della visione per il paziente in condizioni di luce scotopica.
24 LA VOCE AICCER 1/2024
REFRATTIVA
d) e)
Figura 7. Residuo di astigmatismo periferico dopo PRK bilaterale: quadro topografico (a, b) ed aberrometrico di superficie (c, d, e). Le aberrazioni aumentano in rapporto al diametro pupillare. In particolare, si nota la persistenza della componente astigmatica periferica. Si prevede di conseguenza una cattiva visione in condizioni scotopiche.
a) b) c)
ORDINA LA TUA COPIA SU WWW.FGEDITORE.IT

Volume 1

Volume 2
Appunti di semeiOTTICA fisiopatologica
Massimo Camellin, Umberto Camellin
Lo scopo di questo manuale è fornire una sintesi pratica dell’ottica fisiopatologica associata alla semeiotica degli ultimi 20 anni. È stato da me concepito per gli studenti di ortottica ed assistenti di oftalmologia durante i corsi di insegnamento che ho tenuto presso l’Università di Ferrara.
La materia sviluppata è utile però anche per gli specializzandi che possono trovare un riassunto pratico delle comuni patologie refrattive.
Ho aggiornato il capitolo del calcolo delle IOL, argomento in continua evoluzione, per adattarlo alle nuove tipologie di lenti. Per le Lenti a contatto mi sono rifatto alla storia, e quindi alla mia esperienza, con un breve aggiornamento sulle nuove Lenti Minisclerali. Esistono autorevoli testi, citati in bibliografia, che spiegano i dettagli ottico-matematici dell’ottica fisiopatologica, materia questa affascinante ma non sempre semplice.
Aver giocato con le parole nel titolo, in realtà pone l’accento sulla combinazione che ormai ottica e semeiotica hanno nella pratica clinica dell’oftalmologo.
Quando ho iniziato ad usare il primo topografo computerizzato nel 1989 (CMS – Corneal Modeling System) esisteva storicamente solo l’oftalmometro del secolo precedente.
La cornea è la sede delle più importanti chirurgie refrattive.
Molte di queste chirurgie sono state soppiantate da tecniche più moderne e precise ma vi sono ancora molti pazienti operati che richiedono il nostro operato per migliorare la qualità della visione e calcolare per esempio una lente intraoculare. Ho pensato quindi di menzionare non solo la diagnostica nella sua evoluzione, ma gli sviluppi che occhi operati hanno avuto con tecniche non più attuali.
Chi avrà la pazienza di leggere il testo, lo potrà fare in relazione ad esigenze di studio o per approfondire qualche caso clinico. Buona lettura.
Massimo Camellin

FABIANO GRUPPO EDITORIALE
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI)
Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT)
Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it

XXIII CONGRESSO NAZIONALE DI IPOVISIONE

Presidente
Marcella Nebbioso (Roma)
Vice presidente
Emilia Gallo (Catania)
Segretario scientifico
Maria Rosaria Franco (Lecce)
Consiglieri
Federico Bartolomei (Bologna)
Rocco Di Lorenzo (Palermo)
Luigi Donato (Messina)
Federica Franzone (Torino)
Paolo Giuseppe Limoli (Milano)
Marco Ulisse Morales (Padova)
Erika Rigoni (Latina)
Sergio Zaccaria Scalinci (Bologna)
Lucia Scorolli (Bologna)
Gianfrancesco Villani (Verona)
Enzo Maria Vingolo (Roma)
Segreteria Organizzativa
Reg. Rivelle 7/F - Moasca (AT)
Tel. 0141 1706694 - Fax 0141 856013
info@fgeditore.it

Updates in ambito clinico-terapeutico e riabilitativo
www.lowvisionacademy.org 27-28 settembre 2024 ROMA
BORSE DI STUDIO NICOLA PESCOSOLIDO ALLE MIGLIORI TESI DI SPECIALIZZAZIONE O DOTTORATO IN OFTALMOLOGIA AA 2022/23 PROGRAMMA PRELIMINARE Consulta il
2
Le IOL Monofocali Clareon® forniscono ai pazienti una visione intermedia funzionale, pur mantenendo un'eccezionale nitidezza nella visione da lontano1-4
Dimostrato clinicamente
In


4. Alcon Data on File, 2022. [A01970-REP-211731] - Optical Equivalency of Clareon Monofocal and AcrySof IQ IOL Version 1.2 REF-15172. Basato su studi con AcrySof®; Clareon® and AcrySof® sono otticamente equivalenti con lo stesso design asferico da -0,2μm, con conseguente miglioramento della profondità di messa a fuoco. 5. Alcon Data

Defocus corretto alla migliore distanza binoculare 1.50 1.00 0.50 0.00 -0.50 -1.00 -1.50 -2.00 -2.50 -3.00 -3.50 Defocus (D) 1.00 0.90 0.80 0.70 0.60 0.50 0.40 0.30 0.20 0.10 0.00 -0.10 Clareon (n=155) Eyhance (n=155) Media 66 cm 1. AcrySof® IQ Vivity® Extended Vision IOL Directions for Use, 2020. 2. Bala, Chandra, et al. Multi-country clinical outcomes of a new nondiffractive presbyopia-correcting intraocular lens. Journal of Cataract and Refractive Surgery Publish Ahead of Print DOI: 10.1097/j.jcrs.0000000000000712, 2021. 3. Varma, Devesh, et al. Clinical Outcomes of a New Non-Diffractive Presbyopia-Correcting Intraocular Lens From Two Large Confirmatory Studies. American Academy of Ophthalmology, 2020. Abstract: PA005.
on File, 2023. [REF-20899]. Sulla base di uno studio clinico retrospettivo comparativo (Clareon vs. Tecnis Eyhance§) con 310 pazienti dalla presentazione del Dr. Morgan Micheletti all'ASCRS, maggio 2023. § I marchi registrati sono di proprietà dei rispettivi titolari. ©2024 Alcon Inc. 01/24 IT-SG-2400008 Per la lista completa di indicazioni, controindicazioni e avvertenze fare riferimento alle istruzioni per l'uso o ai manuali di istruzioni d'uso dei rispettivi prodotti. Visitate il sito Alcon https://ifu.alcon.com/ per importanti informazioni di prodotto. DCIVA media 66 mm logMAR (SD) 0.24 (0.11) 0.19 (0.11)
uno studio comparativo di Clareon® e Eyhance con 310 pazienti, entrambe le IOL misurano la stessa DCIVA media5 Curva di defocus binoculare (LogMAR) Where is the Plus?

CHIRURGIA DELLA CATARATTA
di Vincenzo Orfeo, Mario Giannì
Cosa fare prima e dopo la chirurgia della cataratta?
L’approccio moderno alla chirurgia intraoculare sta cambiando; grazie ad una serie di protocolli che si stanno diffondendo, il rischio infettivo postchirurgico negli ultimi anni si è ridotto. L’endoftalmite infettiva è la complicanza più temuta di una chirurgia intraoculare potenzialmente devastante. Almeno l’85% degli organismi che causano endoftalmite post chirurgia della cataratta proviene dalla flora perioculare del paziente. Questa consapevolezza spinge inevitabilmente il chirurgo, nel preoperatorio, a cercare di eliminare, in tutti i modi, la flora potenzialmente patogena dalla congiuntiva. Il timore, non infondato, di conseguenze di tipo medicolegale alla sfortunata evenienza di una endoftalmite, ha portato negli anni scorsi la maggioranza dei chirurghi italiani ed europei ad utilizzare nel preoperatorio degli antibiotici locali, prolungandone l’utilizzo, purtroppo non sempre a dosi piene, nel postoperatorio. Il crescente e grave problema delle resistenze batteriche ha fatto sì che alcuni enti regolatori come l’EMA, si pronunciassero contro l’uso inappropriato degli antibiotici sistemici e locali, quando non era presente un’infezione. Si è arrivati quindi alla determinazione che un antibiotico debba essere utilizzato a dosi piene per 5-7 giorni. Quindi, la consuetudine di prescrivere un antibiotico nei 3 giorni preoperatori, non sempre a dosi piene, non solo non ha mai ottenuto prove sufficienti che modifichi l’eventuale esito infettivo, ma risultava anche dannosa e quindi assolutamente da evitare. In questo “vuoto di potere” si sono inseriti gli antisettici che sono stati spesso proposti al posto degli antibiotici, come se fossero un loro equivalente. Gli antisettici sono un presidio importantissimo, ma non sono antibiotici!
Hanno un diverso meccanismo d’azione ed hanno anche una diversa rapidità di azione. Darli 3 giorni prima dell’intervento non sempre è una scelta cor-
retta. La maggioranza degli antisettici più potenti, come lo Iodopovidone al 5%, agiscono in pochissimi minuti eliminando circa il 98% dei germi presenti e agendo anche su virus e miceti. In questa situazione a dir poco confusa e variegata, AICCER (Associazione Italiana della Chirurgia della Cataratta e Refrattiva) ha organizzato una survey per indagare le abitudini prescrittive di 102 esperti della chirurgia della cataratta nel pre e postoperatorio. Ne è uscito un quadro molto vario. Tutti i chirurghi utilizzavano lo Iodopovidone al 5% in soluzione acquosa per 2-3 minuti sulle palpebre e nel fornice congiuntivale, così come consigliato da tutte le linee guida internazionali. Molti utilizzavano antibiotici o antisettici nei 3 giorni precedenti la chirurgia. Molti utilizzavano il Cefuroxime intracamerulare a fine intervento. Nel postoperatorio la terapia di associazioni cortisonico - antibiotiche veniva prolungata più in relazione all’infiammazione che al rischio di infezione.
Aiccer è così entrata nella determinazione di produrre un documento condiviso da una Consensus conference di esperti validata col metodo Delphi, per valutare, con l’ausilio della Letteratura internazionale e di esperti di cataratta ma anche di superficie oculare e microbiologi, quale protocollo proporre agli oculisti italiani.
Le conclusioni, riguardo al preoperatorio, sono state che, se il paziente è in buon compenso e non mostra segni di infiammazione o infezione, non è necessario prescrivere alcun trattamento preventivo. Nei casi di blefarite si consiglia invece un trattamento a base di antibiotico, soprattutto nelle forme stafilococciche. In pazienti immunocompromessi o molto anziani si consiglia un trattamento antisettico per ridurre la flora patogena. Comunque un antisettico, a giudizio dell’oculista, può sempre essere usato, ma nel documento si raccomanda che si
28 LA VOCE AICCER 1/2024
scelga una sostanza in grado di proteggere la superficie oculare senza creare sofferenza. Dobbiamo ricordare che la popolazione che si sottopone a chirurgia della cataratta è spesso anziana e frequentemente ha una superficie oculare in compenso precario. Questa considerazione sta alla base dei tanti casi di Discomfort postchirurgico che sempre più spesso riscontriamo: un paziente con dei segni clinici di Dry Eye, ma che non avverte sintomi prima della chirurgia, è un potenziale paziente scontento dopo la chirurgia. (Figure 1 e 2) Lo slatentizzarsi di una situazione di Dry Eye pregresso è molto probabile dopo la chirurgia. L’intervento stressa molto la superficie oculare ed una superficie già alterata, senza capacità di recupero, è molto più esposta a manifestazioni infiammatorie. Lo stress della superficie si verifica per vari motivi: l’uso obbligatorio e necessario di potenti disinfettanti come lo Iodopovidone 5% in soluzione acquosa che, prima della chirurgia, devono distruggere la quasi totalità della flora batterica per permetterci di incidere e penetrare nell’occhio in sicurezza; l’uso di vari farmaci nell’immediato preoperatorio come gli anestetici ed i midriatici, a volte usati in quantità eccessiva; la luce del microscopio se l’intervento si prolunga; i farmaci in collirio (che si auspica siano senza conservanti) nel postoperatorio ecc ecc. Per tutte queste cause un occhio anche sano può lamentare dei fastidi nel postoperatorio. Un occhio che presenta un Dry Eye non diagnosticato, peggiorando in relazione ai vari insulti inevitabili che una chirurgia prevede, difficilmente ritroverà il suo equilibrio precario scivolando molte volte in un Dry Eye manifesto, con sintomi fastidiosi di cui incol-
CHIRURGIA DELLA CATARATTA
perà il chirurgo. Il Dry Eye ha una sintomatologia continua che stressa moltissimo il nostro paziente e dobbiamo comprenderlo quando diventa assillante nell’esporci i suoi fastidi. Avvisare prima della chirurgia un paziente che soffre di una malattia cronica come il Dry Eye, anche se non lamenta sintomi è essenziale. Bisogna iniziare a curarlo con sostituti lacrimali ed eventualmente cortisonici di superficie posticipando di qualche settimana l’intervento in attesa di miglioramenti dei segni corneo-congiuntivali. Tutto ciò avrà anche un effetto psicologico sul nostro paziente che comprenderà meglio il suo stato e si lamenterà meno se avvertirà dei fastidi nel postoperatorio. È scientificamente provato che un paziente avvisato si lamenta molto meno della comparsa di sintomi dopo la chirurgia. Migliorare la superficie oculare dovrebbe essere il nostro obiettivo più che distruggere tutti i germi presenti. Dobbiamo considerare che la congiuntiva dispone di molti meccanismi difensivi che operano in sinergia, prevenendo e limitando le infezioni. La normale flora congiuntivale ospita diversi batteri aerobi e anaerobi, che mantengono l’omeostasi superficiale ed esiste quindi una certa immunoregolazione spontanea della congiuntiva sana. Dobbiamo rispettare la biodiversità del microbiota oculare presente sulla superficie oculare. Questo equilibrio rimane fondamentale per la funzione immunomodulatoria e per il mantenimento delle interazioni con altri organismi microbici presenti sulla superficie oculare e nei tessuti circostanti. Non dobbiamo mirare, né possiamo aspettarci, una completa sterilizzazione della superficie oculare prima dell’intervento di cataratta, poiché nessun regime antisettico

29 1/2024
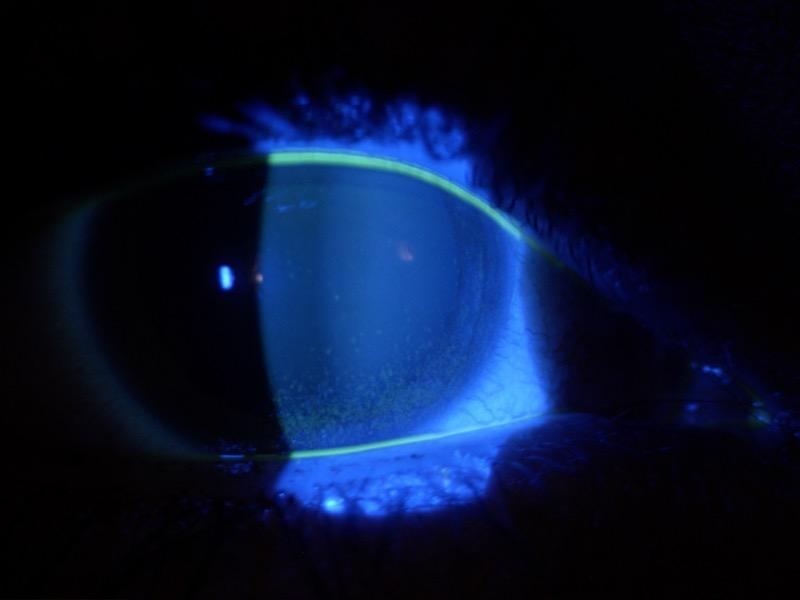
Figura 1. Dopo colorazione con Fluoresceina si nota uno staining inferiore tipico del Dry Eye
Figura 2. Congiuntivocalasi, uno dei segni più frequentemente associati al Dry Eye
CHIRURGIA DELLA CATARATTA

è in grado di decontaminare la superficie oculare durante tutto il periodo perioperatorio.
In questa ottica dobbiamo valutare gli antisettici come un valido supporto cercando però di indirizzarci verso quelli che aiutano a sostenere il corretto equilibrio della superficie oculare.
Subito prima dell’inizio della chirurgia è obbligatorio l’utilizzo dello Iodopovidone al 5% in soluzione acquosa sia sulle palpebre che nel fornice congiuntivale.
Un altro personale consiglio che mi permetto di dare è di valutare sempre l’ansia del paziente prima di iniziare la chirurgia. In molti casi è necessario intervenire con dei blandi calmanti magari con l’ausilio dell’anestesista per far rilassare il paziente. Un paziente ansioso ci creerà problemi durante l’intervento. Stringerà gli occhi sul blefarostato potendo indurre alterazioni al muscolo orbicolare, o addirittura la spremitura delle ghiandole di Meibomio. (Figure 3 e 4)
Il suo ricordo dell’intervento non sarà piacevole. Invece, valutare se usare un paio di cc di Midazolam, in accordo con l’anestesista, in molti casi fa avere al paziente una esperienza più serena e non traumatizzante.
La Delphi Aiccer inoltre conferma la necessità di
somministrare a fine intervento un antibiotico (Cefuroxime 1 mg) intracamerulare perché grazie anche a questa corretta abitudine si stanno riscontrando riduzioni significative del numero delle endoftalmiti infettive.
La Delphi promossa da Aiccer, si conclude con le raccomandazioni per la terapia postoperatoria. In pratica si consiglia di limitare l’uso dell’antibiotico da solo o in associazione, a 7 giorni dopo l’intervento e sempre a dosi piene (cioè almeno 4 volte al giorno per il collirio e 3 per il gel) anche perché consideriamo chiusa la ferita chirurgica entro i 7 giorni dalla chirurgia. L’invito è di non prescrivere più una associazione antibiotico-cortisone a scalare; è un grave errore perché alimenta notevolmente le resistenze batteriche.
Dopo i 7 giorni, valutare il paziente ed eventualmente prescrivere un collirio cortisonico per modulare la sola terapia steroidea a seconda della infiammazione residua o decidere di usare cortisonici meno potenti per qualche settimana anche se non è evidente una infiammazione; si ritiene infatti che il tessuto resti infiammato per più di un mese dall’intervento. Preferire sempre i farmaci senza conservanti. Utilizzare i Fans per la prevenzione dell’edema maculare cistoide, tranne che nei pazienti con Dry Eye
30 LA VOCE AICCER 1/2024
Figura 3. Sala operatoria: paziente ansioso; durante la chirurgia la contrazione delle palpebre sul blefarostato induce delle intaccature sulla rima palpebrale
Figura 4. Sala operatoria: paziente ansioso; la contrazione sul blefarostato provoca la spremitura delle ghiandole di Meibomio con fuoriuscita di mebo
significativo dove il Fans potrebbe indurre alterazioni.
Utili per tutti i sostituti lacrimali per qualche mese. Cerchiamo quindi di modificare le nostre abitudini in base alle nuove evidenze scientifiche con lo scopo di ottimizzare il benessere del nostro paziente.
Bibliografia
1. Orfeo V, Aragona P, Rossi S, Mastropasqua L, Alessio G, Vinciguerra P, Ciprandi G, Tognetto D. Management of patients undergoing cataract surgery: An Italian survey. Eur J Ophthalmol. 2022 Dec 12:11206721221145055.
2. Barry P., Cordoves L., Gardner S. Linee guida ESCRS per la prevenzione ed il trattamento dell’endoftalmite secondaria ad intervento di cataratta ESCRS 2013
CHIRURGIA DELLA CATARATTA
3. Orfeo V., D’Andrea L. Il Discomfort oculare post-chirurgico - Aiccer Educational; Fabiano Editore 2020
4. Behndig A. et al Endophthalmitis prophylaxis in cataract surgery: overview of current practice patterns in 9 European countries J. Cataract Refract Surg 2013; 39:1421–1431 Q 2013 ASCRS and ESCRS
5. Orfeo V, Aragona P, Alessio G., Drago L., Mastropasqua L, Rossi S., Vinciguerra P, Ciprandi G, Tognetto D. Expert consensus on the management of patients undergoing cataract surgery: A Delphi study Eur J Ophthalmol. 1-7 2023 10.1177/11206721231200996
6. ESCRS Endophthalmitis Study Group. Prophylaxis of postoperative endophthalmitis following cataract surgery: results of the ESCRS multicenter study and identification of risk factors. J Cataract Refract Surg 2007; 33:978–988
Tratto da Viscochirurgia



31 LA VOCE AICCER 1/2024
ORDINA LA TUA COPIA SU WWW.FGEDITORE.IT FABIANO GRUPPO EDITORIALE Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it Volume 1 Volume 2 ATLANTE DI DIAGNOSTICA OCULARE Guida alla interpretazione delle immagini: Ecografia, OCT, OCTA, Fluorangiografia Luisa Pierro



ORDINA LA TUA COPIA SU WWW.FGEDITORE.IT FABIANO GRUPPO EDITORIALE Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it Ophthalmology UP-TO-DATE Volume 1 Atlas of anterior segment OCT Volume 3

Ci impegniamo nel gestire e limitare il nostro impatto ambientale, riducendo emissioni, utilizzo di acqua, e rifiuti.

Programma riduzione packaging Riduzione dei rifiuti operativi

1 2 3 4


Partnership con Plastic Bank Efficienza energetica e riduzione GHG




90% dei rifiuti del

© 2024 Alcon Inc. 01/24 IT-SG-2400005
Per la lista completa di indicazioni, controindicazioni e avvertenze fare riferimento alle istruzioni per l'uso o ai manuali di istruzioni d'uso dei rispettivi prodotti.
CHIRURGIA DELLA CATARATTA
di Andrea Castegnaro
Kirchhof B, Yoyng CB, Klevering BJ, Koenekoop RK, Fauser S, den Hollander AI (2012). Cumulative Effect
CFH, ARMS2, and VEGFA on the Response to Ranibizumab Treatment in Age -Related Macular Degeneration.
Ophthalmology (in press)
Tecniche avanzate di facoemulsificazione: cataratta e AMD
Malattia di Alzheimer: l’associazione con AMD è in corso di accertamenti Curr 29. doi: 10.2174/1874609813666200129161833. Neovascular age -related macular degeneration and Alzheimer's disease. Papadopoulos Z1
Introduzione
La degenerazione maculare legata all’età (AMD) è una degenerazione acquisita della retina che causa un significativo deficit visivo centrale attraverso una combinazione di disturbi non neovascolari (drusen, anomalie dell’epitelio pigmentato retinico e atrofia geografica) e disturbi neovascolari (CNV - membrana neovascolare coroidale). La malattia avanzata può presentarsi con aree focali di perdita/atrofia dell’epitelio pigmentato retinico (EPR), emorragia sottoretinica o sub-EPR o liquido sieroso, nonché fibrosi sottoretinica.
Vengono classicamente distinte due tipologie di degenerazione maculare legata all’età: la forma umida (wet) e la forma secca (dry).
Malattie cardiovascolari, ipertensione, genere femminile, etnia caucasica, ipercolesterolemia, obesità, ipermetropia, storia familiare, iridi chiare.
La forma umida è caratterizzata da neovasi sanguigni nello spazio tra l’EPR (epitelio pigmentato retinico) e la membrana di Bruch. La funzione di barriera dell’EPR è compromessa, con trasudazione di liquido a livello intraretinico ed emorragie, che danneggiano la macula.
Vengono classicamente distinte due tipologie di degenerazione maculare legata all’età: umida (wet) e la forma secca (dry).
L’AMD è la terza causa di cecità nel mondo dopo la cataratta e il glaucoma e si prevede che colpirà circa 300 milioni di persone entro il 2040.
I fattori di rischio ad ora accertati sono:
- L’età: il rischio di AMD aumenta con l’età. Il rischio aumenta più di tre volte nei pazienti di età superiore a 75 anni rispetto al gruppo di pazienti di età compresa tra 65 e 74 anni (Beaver Dam Eye Study; Framingham Eye Study).
Questo comporta la perdita e la disfunzione dei fotorecettori, dell’EPR e del complesso coroideale. Membrana neovascolare coroideale classica nella degenerazione maculare legata all’età all’angiografia con fluoresceina che mostra un’iperfluorescenza precoce con iperfluorescenza progressivamente crescente nelle immagini successive.
La forma umida è caratterizzata da neovasi sanguigni nello spazio tra l’EPR (epitelio retinico) e la membrana di Bruch. La funzione di barriera dell’EPR è compromessa, trasudazione di liquido a livello intraretinico ed emorragie, che danneggiano la macula. Questo comporta la perdita e la disfunzione dei fotorecettori, dell' EPR e del complesso
- Fumo di sigaretta: i fumatori hanno il doppio delle probabilità di avere perdita della vista correlata alla degenerazione maculare legata all’età rispetto ai non fumatori; gli ex fumatori avevano un rischio leggermente maggiore (odds ratio di 1,13) e coloro che avevano smesso di fumare più di 20 anni prima non avevano un rischio aumentato per lo sviluppo di AMD con perdita della vista.
- Suscettibilità genetica: oltre ad aumentare il rischio di sviluppare AMD, alcuni loci genetici sono stati associati ad effetti variabili sulla risposta al trattamento, come gli agenti anti-VEGF intravitreali.
- Malattia di Alzheimer: l’associazione con AMD è in corso di accertamenti.
- Malattie cardiovascolari, ipertensione, genere femminile, etnia caucasica, ipercolesterolemia, obesità, ipermetropia, storia familiare, iridi chiare.
La forma secca è caratterizzata dalla disfunzione dell’EPR con perdita di fotorecettori e degenerazione retinica; termina con l’atrofia geografica.
34 LA VOCE AICCER 1/2024
Di tutte le forme di AMD, la forma secca rappresenta l’85-90% e la forma umida il 10-15%: i sottotipi possono sovrapporsi in un dato paziente.
L’intervento di cataratta è l’intervento in assoluto più comune nei paesi sviluppati, più del parto.
Evidenze recenti supportano il ruolo della chirurgia della cataratta in pazienti affetti da AMD, dimostrando un miglioramento dell’acuità visiva. Cataract surgery in neovascular AMD: impact on visual acuity and disease activity.
È inoltre dimostrata l’assenza di progressione significativa della malattia, con il miglioramento della qualità della vita del paziente stesso.
CHIRURGIA DELLA CATARATTA
iolAMD
Scharioth lens
Fresnel Prism
IOL-VIP System
implantable miniature telescope
Lipshitz macular implant.
Le IOL progettate per pazienti affetti da AMD
- Utilizzo di microincisioni - I FANS dovrebbero essere prescritti per almeno 2 mesi dopo l’intervento
1) GALILEAN TYPE TELESCOPE
Facoemelsificazione in pazienti affetti da AMD
Molti studi epidemiologici su larga scala non hanno ad oggi dimostrato se la chirurgia della cataratta sia un intervento in grado di aumentare il rischio di progressione dell’AMD.
Alcuni studi trovano una significativa correlazione positiva tra la chirurgia della cataratta e la progressione dell’AMD oltre che la progressione più rapida dell’AMD da precoce a tardiva in pazienti con un follow-up più lungo.
Nei pazienti affetti da AMD che si sottopongono all’intervento di cataratta, è maggiore il rischio di sviluppo di edema maculare post-operatorio. The effects of cataract surgery on patients with wet macular degeneration.
Altri studi invece non correlano un peggioramento dell’AMD dopo l’intervento di cataratta.
Per questi motivi, l’intervento di facoemulsificazione in pazienti con AMD, dovrebbe rispettare le seguenti caratteristiche per ottenere una maggior garanzia di risultato in termini di acuità visiva a lungo termine: - Rapidità di esecuzione (minor esposizione dell’occhio agli ultrasuoni)
- Delicatezza
- Evitare l’utilizzo del femtolaser, poiché provocando un rialzo delle citochine proinfiammatorie intraoculari, aumenta il rischio di sviluppo dell’edema maculare cistoide.
Lenti intraoculari (IOL) nella
degenerazione maculare legata all’età
La letteratura ha dimostrato come le IOL multifocali siano controindicate in pazienti con AMD, diminuendo queste la sensibilità al contrasto, già molto compromessa.
Di prima scelta sono le lenti intraoculari monofocali (di gran lunga le più impiantate), mentre alcuni studi hanno dimostrato come lenti EDOF AcrySof IQ Vivity IOL possano essere impiantate con successo.
Da diversi anni, gli impianti intraoculari appositamente progettati sono diventati un modo possibile e interessante per evitare molti dei problemi incontrati negli ausili visivi extraoculari.
Sette differenti IOL progettate per pazienti affetti da AMD: implantable miniature telescope (IMT), IOLVIP System, Lipshitz macular implant (LMI), sulcusimplanted Lipshitz macular implant, LMI-SI, Fresnel Prism Intraocular Lens, iolAMD e Scharioth Macula Lens.
12mm), il che ne limita l’utilizzo.
1) Galilean type telescope È l’approccio più comune, dove vengono utilizzati due elementi ottici ad alto potere positivo e negativo in combinazione con la cornea.
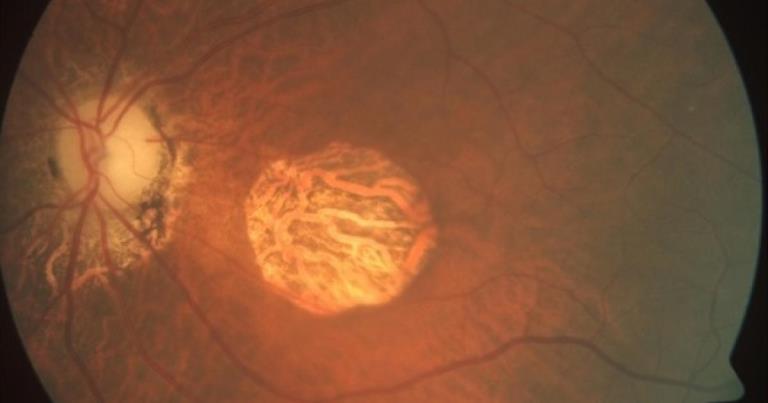
Atrofia geografica in paziente affetto da degenerazione maculare senile secca.
L’intervento di cataratta è l’intervento Lancet Glob Health. –
inoltre dimostrata l’a
l’
35 LA VOCE AICCER 1/2024
CHIRURGIA DELLA CATARATTA

Necessita di un’incisione corneale di 7 mm.

Necessita di un’incisione corneale di 7 mm.
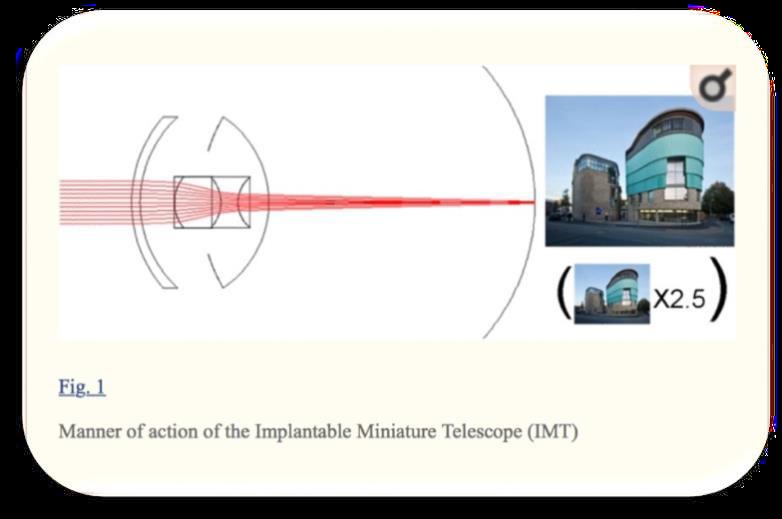
a) Le lenti IMT (Impiantable Miniature Telescope) possono raggiungere un ingrandimento maggiore rispetto ad altri sistemi perché le lenti positiva e negativa sono immerse nell’aria. Questa configurazione aumenta il potere diottrico in ciascuna delle lenti in un ordine di grandezza che non può essere ottenuto con lenti immerse in un mezzo acquoso.
Vengono impiantate monolateralmente: l’occhio impiantato fornisce la visione centrale, mentre quello controlaterale conserva la visione periferica. Richiedono un’incisione corneale molto ampia (1012mm), il che ne limita l’utilizzo.
b) Il sistema IOL-VIP richiede l’impianto della lente positiva nella camera anteriore (+55D) e una lente negativa nel sacco capsulare (-66D).
I candidati all’impianto del sistema IOL-VIP vengono selezionati utilizzando un software che raccoglie i loro dati clinici. Tutti i pazienti vengono sottoposti ad un allenamento preoperatorio di 2 settimane (12 sessioni di allenamento da 30 minuti) e ad un programma di riabilitazione postoperatoria di 3 mesi (cinque sessioni di allenamento da 30 minuti a settimana per 12 settimane) volto ad allenare e consolidare il locus retinico preferito (PRL). Necessita di un’incisione corneale di 7 mm.
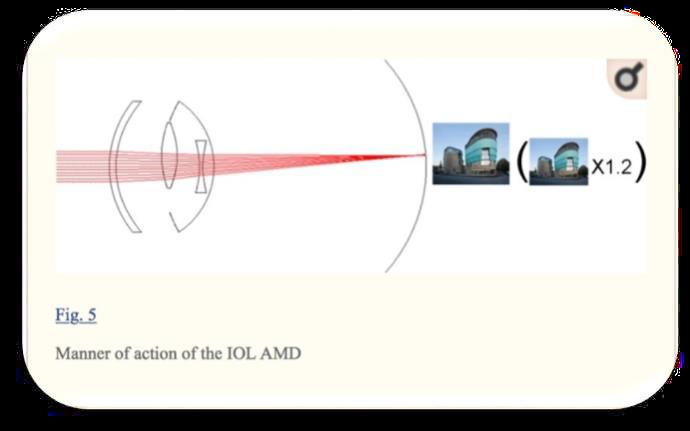
c) La iolAMD è la più recente, e richiede sempre l’impianto di due lenti: una negativa nel sacco capsulare (-49D) e una positiva nel solco (+63D). Essa incorpora l’asfericità nella lente positiva per ottenere profondità di messa a fuoco ed essere altamente tollerante ai piccoli cambiamenti nella
Lente IMT
Figura illustrante la modalità di azione del Implantable Miniature Telescope (IMT)
36 LA VOCE AICCER 1/2024
Figura illustrante la modalità di azione del IOL-VIP System
CHIRURGIA DELLA CATARATTA

fornire un elevato ingrandimento, ma l’uso di specchi di piccole dimensioni potrebbe
un’incisione corneale di 6.5 mm.


distanza assiale nominale tra entrambe le lenti. Le lenti sono in acrilico idrofobo, quindi pieghevoli ed iniettabili. Necessita di un’incisione corneale di 2.75 mm.
d) Il dispositivo Lipshitz macular implant (LMI) utilizza specchi invece di lenti. Può fornire un elevato ingrandimento, ma l’uso di specchi di piccole dimensioni potrebbe generare il rischio di effetti di abbagliamento, dovuti alla diffrazione. Necessita di un’incisione corneale di 6.5 mm.
2) Fresnel Prism IOL
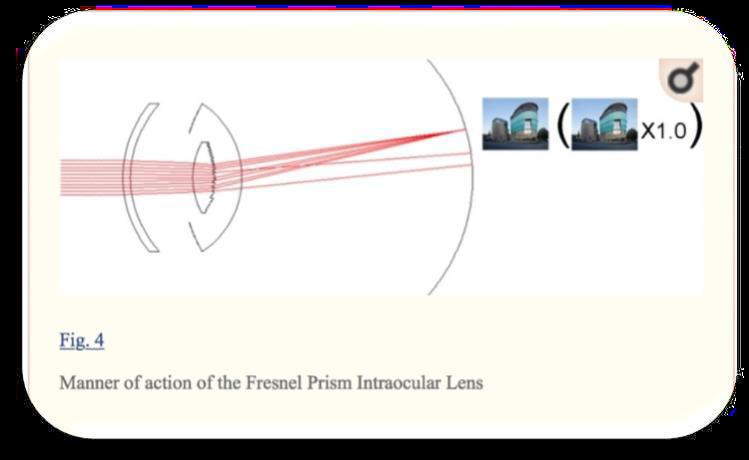
La lente intraoculare con prisma di Fresnel non fornisce alcun ingrandimento. Si limita a spostare l’immagine retinica di 6° rispetto la macula danneggiata. È stato creato per lo spostamento ottico dello sco-
toma centrale causato dalla DMLE, per evitare di spostare la retina con tutti i rischi che comporta un intervento di traslocazione maculare. Un potenziale problema di questo approccio potrebbe essere la diffrazione e la luce diffusa ai bordi di ciascuna zona di Fresnel. Necessita di un’incisione sclero-corneale di 7 mm.
3) SCHARIOT Macular IOL
Si basa sull’ingrandimento a distanze più ravvicinate. Più l’oggetto è vicino all’occhio, maggiore è l’ingrandimento. L’ingrandimento si ottiene solo quando l’oggetto si trova a una distanza compresa tra 10 e 15 cm dall’occhio. Non fornisce alcun ingrandimento della visione a distanza. È una IOL iniettabile nel solco (13mm di diametro). Ha un potere di +10 D nei
Lipshitz macular implant (LMI)
Figura illustrante la modalità di azione del Lipshitz macular implant
IOL-AMD
di un’incisione
Figura illustrante la modalità di azione della IOL-AMD
Necessita di un’incisione sclero 37 LA VOCE AICCER 1/2024
2) F resnel Prism IOL
Necessita di un’incisione sclero

3) SCHARIOT Macular IOL
. E’ una I mm centrali. Necessita di un’incisione corneale di 2.2 mm.

5) Lentis Max IOL E’
una distanza di 15 cm
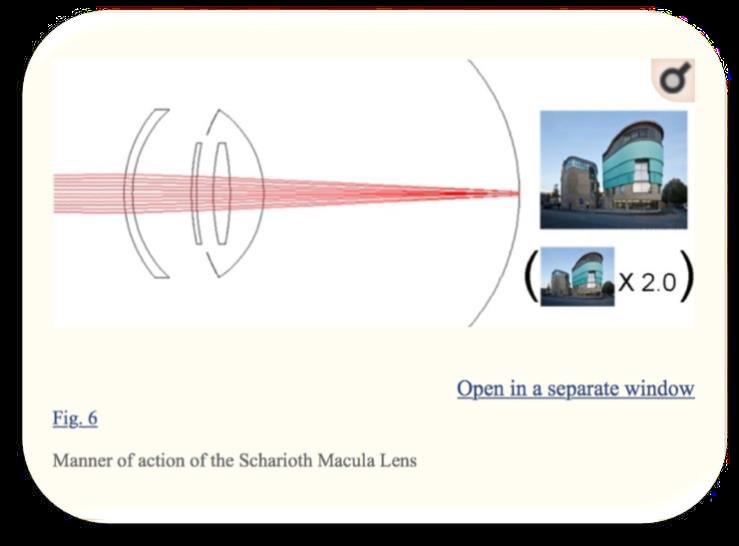

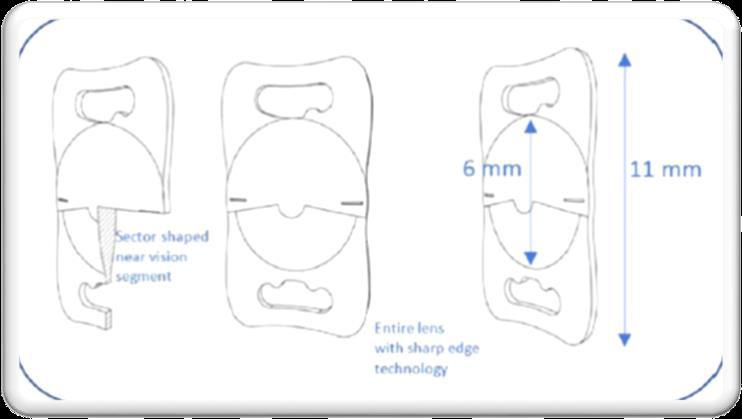
ono IOL 13 mm). EyeMax Mono è disponibile in due versioni: la precedentemente impiantata. E’ progettata per migliorare la qualità dell'immagine retinica in tutte le aree della macula ≤10° dalla fissazione, aumentando l'
Fresnel Prism IOL Fresnel Prism IOL
Fresnel Prism IOL
Schariot Macular IOL
Eyemax Mono IOL
Lentis Max IOL
Figura illustrante la modalità di azione del Fresnel Prism IOL
Figura illustrante la modalità di azione della Schariot Macular IOL
– Andreas F. Borkenstein, 1 EvaMaria Borkenstein,1 and Albert J. Augustin2 Max IOL distanza di 15 cm
38 LA VOCE AICCER 1/2024
DELLA
CHIRURGIA
CATARATTA
CHIRURGIA DELLA CATARATTA

Tabella illustrante alcune complicanze delle IOLs in pazienti affetti da AMD
1.5 mm centrali. Necessita di un’incisione corneale di 2.2 mm.
4) Eyemax Mono IOL
CONCLUSIONI
Si tratta di una IOL acrilica monopezzo, morbida e idrofobica, paragonabile a una IOL standard in termini di dimensioni (6–13 mm). EyeMax Mono è disponibile in due versioni: la prima è progettata per l’impianto del sacco capsulare dopo facoemulsificazione, e la seconda è utilizzata per l’impianto del solco e l’uso in combinazione con una IOL monofocale precedentemente impiantata. È progettata per migliorare la qualità dell’immagine retinica in tutte le aree della macula ≤10° dalla fissazione, aumentando l’ampiezza della messa a fuoco e riducendo la sfocatura. Fornisce un ingrandimento da ×1,1 a ×1,2.
La chirurgia della cataratta presenta però molti vantaggi per i pazienti affetti da AMD: è stata dimostrata l’assenza di progressione significativa della malattia e il miglioramento della qualità della vita. I FANS dovrebbero essere prescritti per almeno 2 mesi dopo l’intervento, essendo più frequente, in questi pazienti, l’edema maculare cistoide post-operatorio.
Solo l’IMT è approvato dalla
Bibliografia
1. Gheorghe A, Mahdi L, Musat O. Age-related macular degeneration. Rom J Ophthalmol. 2015;59:74–7
questi pazienti ed è l’unica lente supportata dai risultati di uno studio clinico prospettico a Medicine (Baltimore)
5) Lentis Max IOL
È una IOL monofocale, idrofobica, acrilica, asferica che consente un ingrandimento ×3 a una distanza di 15 cm. Si tratta di una lente biconvessa con la superficie asferica che presenta due settori con un potere aggiuntivo totale di +8 diottrie. I vantaggi includono una procedura di routine che non introduce rischi aggiuntivi, poiché la lente ha dimensioni standard. Necessita di una incisione di 2.75 mm.
dimostrata l’assenza
Conclusioni
2. Klein R, Klein BEk, Linton KLP (1992). Prevalence of Agerelated Maculopathy-The Beaver Dam Eye Study. Ophthalmology 99(6): 933-943
3. Evans JR, Fletcher AE, Wormald RPL (2005). 28,000 Cases of age-related macular degeneration causing visual loss in people aged 75 years and above in the United Kingdom may be attributable to smoking. Br J Ophthalmol 89: 550-553.
può essere difficoltosa l’esecuzione di il che ne limita l’utilizzo.
4. Smailhodzic D, Muether PS, Chen J, Kwestro A, Zhang AY, Omar A, Johannes PHV, Keunen JEE, Kirchhof B, Yoyng CB, Klevering BJ, Koenekoop RK, Fauser S, den Hollander AI (2012). Cumulative Effect of Risk Alleles in CFH, ARMS2, and VEGFA on the Response to Ranibizumab Treatment in AgeRelated Macular Degeneration. Ophthalmology (in press)
5. Curr Aging Sci. 2020 Jan 29. doi: 10.2174/18746098136 66200129161833. Neovascular age-related macular degeneration and its association with Alzheimer’s disease. Papadopoulos Z1
6. Wong WL, Su X, Li X, Cheung CM, Klein R, Cheng CY, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health. 2014;2:e106–16.
essendo più frequente, in questi pazienti, l’edema maculare
In conclusione, sono disponibili numerosi dispositivi intraoculari per il miglioramento della vista nei pazienti con AMD avanzata. Solo l’IMT è approvato dalla FDA per il trattamento di questi pazienti ed è l’unica lente supportata dai risultati di uno studio clinico prospettico a lungo termine su larga scala. Per molte IOL è richiesta una incisione corneale ampia, può essere difficoltosa l’esecuzione di capsulotomia Yag Laser o la funduscopia, il che ne limita l’utilizzo.
2 mesi dopo l’intervento
7. Tang HY, Rosén M, Granstam E.BMC Ophthalmol. 2023 Jun 16;23(1):276. doi: 10.1186/s12886-023-03028-7
8. Curr Opin Ophthalmol. 2017 Jan;28(1):58-62. Cataract surgery and age-related macular degeneration. Ehmann D S,Ho Ac
9. Effect of cataract surgery on the progression of age-related macular degeneration, 04\11\2022, Zhaoyan Chen, PhD, a,* Ya Zeng, MD,a and Fangyuan Tian, PhDa
39 LA VOCE AICCER 1/2024
CHIRURGIA DELLA CATARATTA
10. Saraf SS, Ryu CL, Ober MD.Am J Ophthalmol. 2015 Sep;160(3):487-492.e1. doi: 10.1016/j.ajo.2015.06.006. Epub 2015 Jun 19.PMID: 26095263 Clinical Trial
11. Baatz H, Darawsha R, Ackermann H, et al.. Phacoemulsification does not induce neovascular age-related macular degeneration. Invest Ophthalmol Vis Sci. 2008;49:1079–83
12. Expression of Cytokines, Chmokines and Growth Factors in Patients Undergoing Cataract Surgery with Femtosecond Laser Pretreatment Hui Chen, Haotian Lin, Danying Zheng, Yuhua Liu, Weirong Chen, Yizhi Liu PLoS One. 2015; 10(9)
13. Analysis of Korean Retinal Specialists’ Opinions on Implanting Diffractive Multifocal Intraocular Lenses in Eyes with Underlying Retinal Diseases – 26 Mar. 2022
14. Extended Depth-of-Focus Intraocular Lens Implantation in Patients with Age-Related Macular Degeneration: A Pilot Study - 13 Feb. 2024. Akshaya Lakshmi Thananjeyan, 1 Anna Siu, 2 Angela Jennings, 2 and Chandra Bala 2
15. Graefes Arch Clin Exp Ophthalmol. 2017; 255(9): 1687–1696. Published online 2017 Jul 24. doi: IIntraocular lenses in age-related macular degeneration Andrzej Grzybowski,1,2, Weronika Wasinska-Borowiec,4 Jorge L. Alio,5,6 Pedro Amat-Peral,5,6 and Juan Tabernero
16. Implantable vision-enhancing devices and postoperative rehabilitation in advanced age-related macular degeneration – 22\07\2022, Andreas F. Borkenstein, 1 Eva-Maria Borkenstein,1 and Albert J. Augustin2
17. Auffarth GU, Reiter J, Leitritz M, Bartz-Schmidt KU, Höhn F, Breyer D, et al. High-addition segmented refractive bifocal intraocular lens in inactive age-related macular degeneration: a multicenter pilot study.
18. Borkenstein AF, Borkenstein EM. A case report detailing use of a new intraocular lens with advanced technology, designed specifically for patients with center-involving macular disorders. Medicine (Baltimore)
ORDINA LA TUA COPIA SU WWW.FGEDITORE.IT

L’evoluzione delle lenti intraoculari multifocali
Roberto Carnevali

FABIANO GRUPPO EDITORIALE
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI)
Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT)
Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it
40 LA VOCE AICCER 1/2024
UN PASSO AVANTI NELL’USO DELLE TERAPIE ANTIBIOTICHE1





1 mg/ml desametasone + 5 mg/ml levofloxacina, collirio, soluzione
DUCRESSA “1 mg/ml + 5 mg/ml, collirio,soluzione” 1 flacone in LDPE da 5 ml con contagocce (AIC n. 047874019)
Classificazione ai fini della fornitura: RR - medicinale soggetto a prescrizione medica
Classe ai fini della rimborsabilità: Classe C Prezzo al pubblico (IVA inclusa): € 19,90
Bibliografia:
1) Bandello F et al. Eye (Lond). 2020 May 4. doi: 10.1038/s41433-020-0869-1. Online ahead of print.
2) RCP Ducressa.




La combinazione fissa
Levofloxacina / Desametasone indicata per la prevenzione e il trattamento dell’infiammazione e per la prevenzione dell’infezione associata all’intervento chirurgico per la cataratta 2




Ducressa fornisce l’efficacia antibatterica con una sola settimana di trattamento dopo l’intervento di cataratta 1
TERAPEUTICA EFFICACE
UNA STRATEGIA
ED INNOVATIVA 1
Depositato in AIFA in data 07/02/2024 - Codice AIFA: DUC-IT-230005

CHIRURGIA REFRATTIVA
di Alberto Cerini
Il laser ad eccimeri per il glaucoma
L’avvento delle chirurgie Mini-invasive (microinvasive glaucoma surgeries – MIGS) ha cambiato significativamente la chirurgia del glaucoma degli ultimi anni.
Tra queste si possono distinguere le chirurgie mininvasive caratterizzate dalla formazione di bozze filtranti congiuntivali (MIBS - microinvasive bleb surgeries, come lo Xen o il Preserflo) e le MIGS pure, ad approccio angolare (ELIOS, I-stent), che risparmiano la congiuntiva.
Questi interventi presentano notevoli vantaggi: sono rapidi, sicuri, efficaci e di facile esecuzione.
Grazie a queste caratteristiche, molti medici oculisti che precedentemente si occupavano quasi esclusivamente della chirurgia della cataratta, hanno potuto cimentarsi nel trattamento chirurgico del glaucoma.
Allo stesso tempo sono quindi aumentati il numero dei chirurghi ed il numero dei pazienti a cui proporre l’intervento. I due terzi dei pazienti glaucomatosi presentano infatti una forma lieve-moderata per la quale non c’è indicazione ad un intervento di chirurgia maggiore come la trabeculectomia, sia per l’eccessiva capacità filtrante sia per il rischio di complicanze postoperatorie.
Al contrario la possibilità di impiantare le MIGS durante lo stesso intervento di cataratta, l’estrema sicurezza ed il rapido recupero post-operatorio, le rendono idonee ad un ampio bacino di pazienti che dopo anni di terapia topica ipotonizzante possono risolvere con un unico accesso ambulatoriale due problemi.
Sono al contempo ideali anche nelle situazioni di glaucoma terminale, per favorire un abbassamento pressorio senza rischiare il danneggiamento delle fibre residue del nervo ottico.
In questo contesto si colloca il laser ad eccimeri ELIOS VISION EXTRA II, proposto dall’azienda ELIOS VISION: un macchinario che sfrutta la capacità fotoablativa del laser per creare dei canali attraverso il trabecolato e la porzione più interna del

canale di Schlemm (Trabeculostomia Laser ad eccimeri-ELT).
Questi canali, larghi 210 micron e profondi 20 micron, hanno lo scopo di favorire il deflusso di umor acqueo e l’abbassamento della IOP.
Il laser, precedentemente utilizzato nell’ambito della chirurgia refrattiva, utilizza in questo nuovo approccio una lunghezza d’onda di 308 nm: la precisione accurata, il minimo danno termico e la bassa diffusione dell’energia ai tessuti adiacenti, rendono questa procedura un mezzo estremamente sicuro ed efficiente.
42 LA VOCE AICCER 1/2024
L’esecuzione pratica di ELIOS prevede l’utilizzo di una sonda a fibre ottiche, dalle dimensioni di 500 micron, che attraversa un’incisione di 0.8 mm in cornea chiara.
Successivamente si pone a contatto la sonda con il trabecolato e con l’utilizzo del pedale si avvia la trasmissione di energia, con la conseguente formazione automatica dei canali: la procedura prevede la costituzione di 10 shunt su un’ampiezza angolare di 90 gradi.
È possibile che si manifesti della perdita ematica o delle microbolle, che invece di spaventare, devono rassicurarci, quali sinonimo di corretto svolgimento dell’intervento.
Nei giorni successivi all’operazione, si può avere un minimo ipertono: una lieve infiammazione della cornea ed in camera anteriore, ma di solito non si verificano complicanze aggiuntive.
Sono state eseguite già diverse metanalisi sui risultati funzionali a distanza di circa 8-10 anni, che hanno evidenziato un abbassamento della IOP di circa il 20% ed una significativa riduzione del numero di instillazioni dei colliri ipotonizzanti.
Come le altre MIGS, la loro efficacia è correlata alla giusta selezione del paziente ed alla severità del glaucoma, contro il quale dobbiamo armarci del maggior numero di strategie possibili per uscirne vittoriosi.
ORDINA LA TUA COPIA SU WWW.FGEDITORE.IT


Occhio secco
Diagnosi e terapia
Giuseppe Di Meglio
Luigi Marino
Maria Luisa Verbelli
Lucio Buratto
43 LA VOCE AICCER 1/2024
REFRATTIVA
CHIRURGIA
FABIANO GRUPPO EDITORIALE
Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it
Redazione:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
1. DENOMINAZIONE DEL MEDICINALE Ducressa 1 mg/ml + 5 mg/ml, collirio, soluzione
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di collirio, soluzione contiene desametasone sodio fosfato, equivalente a 1 mg di desametasone e levofloxacina emiidrato, equivalente a 5 mg di levofloxacina. Una goccia (circa 30 microlitri) contiene circa 0,03 mg di desametasone e 0,150 mg di levofloxacina. Eccipienti con effetti noti: Un ml di collirio soluzione contiene 0,05 mg di benzalconio cloruro e una goccia contiene circa 0,0015 mg di benzalconio cloruro. Un ml di collirio soluzione contiene 4,01 mg di fosfati e una goccia contiene 0,12 mg di fosfati. Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA Collirio, soluzione (collirio). Soluzione limpida, giallo-verdastra, praticamente priva di particelle con un pH di 7,0-7,4 e osmolalità di 270-330 mOsm/Kg. Le gocce erogate appaiono trasparenti ed incolore.
4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Ducressa collirio, soluzione è indicato per la prevenzione e il trattamento dell’infiammazione e per la prevenzione dell’infezione associata all’intervento chirurgico per cataratta negli adulti. Tenere in considerazione le linee guida ufficiali sull’uso appropriato degli agenti antibatterici. 4.2 Posologia e modo di somministrazione Posologia Dopo l’intervento chirurgico, instillare una goccia nel sacco congiuntivale ogni 6 ore. La durata del trattamento è di 7 giorni. Fare attenzione a non interrompere anticipatamente la terapia. Se si dimentica una dose, il trattamento deve essere proseguito assumendo la dose successiva come pianificato. Dopo una settimana di trattamento con Ducressa collirio si raccomanda di rivalutare il paziente per stabilire se è necessario proseguire con la somministrazione di un collirio a base di corticosteroidi in monoterapia. La durata di questo trattamento può dipendere dai fattori di rischio del paziente e dall’esito dell’intervento chirurgico e deve essere stabilita dal medico dopo un esame con lampada a fessura e in base alla gravità del quadro clinico. Un trattamento di follow-up con collirio a base di steroidi non dovrebbe di norma superare le 2 settimane. Fare comunque attenzione a non interrompere anticipatamente la terapia. Popolazione pediatrica: La sicurezza e l’efficacia di Ducressa nei bambini e negli adolescenti di età inferiore a 18 anni non sono state stabilite. Non ci sono dati disponibili. L’uso di Ducressa non è raccomandato nei bambini e negli adolescenti di età inferiore a 18 anni. Pazienti anziani: Non c’è necessità di modificare la dose nei pazienti anziani. Uso nella compromissione renale/ epatica Ducressa non è stato studiato nei pazienti con compromissione renale/epatica e pertanto, Ducressa deve essere utilizzato con cautela in questi pazienti. Modo di somministrazione Uso oftalmico. Una goccia deve essere somministrata nel canto laterale applicando, nel contempo, una pressione a livello del canto mediale per evitare il drenaggio delle gocce. I pazienti devono essere istruiti a lavarsi le mani prima dell’uso e a evitare il contatto con la punta del contenitore e l’occhio o le aree circostanti, in quanto ciò potrebbe causare lesioni oculari. Inoltre, è necessario informare i pazienti che le soluzioni oftalmiche, se maneggiate in modo improprio, possono venire contaminate da batteri comuni in grado di causare infezioni oculari. L’uso di soluzioni contaminate può arrecare gravi danni all’occhio e successiva perdita della vista. L’occlusione nasolacrimale mediante compressione dei dotti lacrimali può ridurre l’assorbimento sistemico. In caso di trattamento concomitante con altri colliri, le instillazioni devono avvenire a distanza di 15 minuti. 4.3 Controindicazioni • Ipersensibilità al principio attivo levofloxacina o ad altri chinoloni, al desametasone o ad altri steroidi, o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1; • Cheratite da herpes simplex, varicella e altre malattie virali della cornea e della congiuntiva; • Infezioni oculari da micobatteri causate, ad esempio, da bacilli acido-resistenti quali Mycobacterium tuberculosis, Mycobacterium leprae o Mycobacterium avium; • Micosi delle strutture oculari; • Infezioni oculari purulente non trattate. 4.4 Avvertenze speciali e precauzioni di impiego Effetti oculari: Ducressa è esclusivamente per uso oftalmico. Ducressa non deve essere somministrato per iniezione sottocongiuntivale. La soluzione non deve essere introdotta direttamente nella camera anteriore dell’occhio. L’uso prolungato può indurre resistenza agli antibiotici con conseguente proliferazione di organismi non sensibili, inclusi i miceti. In presenza di infezioni è necessario interrompere il trattamento e adottare una terapia alternativa. Ogni qual volta richiesto dal giudizio clinico, il paziente deve essere esaminato mediante visualizzazione ingrandita, ad esempio tramite biomicroscopia con lampada a fessura ed eventualmente colorazione con fluoresceina. L’uso prolungato di corticosteroidi per uso topico oftalmico può causare ipertensione oculare/glaucoma, il verificarsi di tale evenienza è, tuttavia, improbabile se Ducressa viene utilizzato per il periodo di trattamento raccomandato (7 giorni). È in ogni caso consigliabile un controllo frequente della pressione intraoculare. Il rischio di innalzamento della pressione intraoculare indotto da corticosteroidi è maggiore nei pazienti predisposti (per es. i diabetici). Con l’uso di corticosteroidi sistemici e topici possono essere riferiti disturbi della vista. Se un paziente si presenta con sintomi quali visione offuscata o altri disturbi visivi, è necessario considerare la visita con un oftalmologo per la valutazione delle possibili cause che possono essere collegate a complicanze postoperatorie, allo sviluppo di glaucoma o a patologie rare, quali la corioretinopatia sierosa centrale (CSC), che sono state segnalate dopo l’uso di corticosteroidi sistemici e topici. I corticosteroidi per uso topico oftalmico possono rallentare la guarigione delle ferite corneali. È noto che anche i FANS per uso topico oftalmico possono rallentare o ritardare la guarigione. L’uso concomitante di FANS e steroidi per uso topico oftalmico può aumentare il rischio di problemi di guarigione. Nei pazienti con patologie che causano assottigliamento della cornea o della sclera, è stato riscontrato che si verificano perforazioni con l’uso di corticosteroidi topici. Effetti sistemici I fluorochinoloni sono stati associati a reazioni di ipersensibilità anche dopo una singola dose. In presenza di una reazione allergica alla levofloxacina, interrompere il trattamento. Durante la terapia sistemica con fluorochinoloni, compresa la levofloxacina, possono verificarsi l’infiammazione e la rottura dei tendini, in particolare nei pazienti più anziani e in quelli trattati contemporaneamente con corticosteroidi. È, pertanto, necessario essere cauti e interrompere il trattamento con Ducressa ai primi segni di tendinite (vedere paragrafo 4.8). La Sindrome di Cushing e/o soppressione surrenalica associate con l’assorbimento sistemico di desametasone oculare possono verificarsi dopo terapia intensiva o continuata per lunghi periodi in pazienti predisposti, compresi bambini e pazienti trattati con inibitori del CYP3A4 (compresi ritonavir e cobicistat). In questi casi, il trattamento dovrebbe essere sospeso progressivamente. Effetti sul sistema immunitario L’uso prolungato (in genere si osservano entro le 2 settimane di trattamento) può anche causare infezioni oculari secondarie (batteriche, virali o micotiche), dovute alla soppressione della risposta dell’ospite o a un ritardo nella guarigione. Inoltre, i corticosteroidi per uso topico oftalmico possono favorire, aggravare o mascherare i segni e i sintomi di infezioni oculari causate da microrganismi patogeni. Il verificarsi di tali patologie è limitato se il trattamento con corticosteroidi è di breve durata, come quello suggerito con Ducressa. Eccipienti Benzalconio cloruro: Sono stati riportati casi di irritazione agli occhi, occhio secco, alterazione del film e della superficie corneali a seguito di somministrazione oftalmica di benzalconio cloruro. Da usare con cautela nei pazienti con occhio secco e con compromissione della cornea. I pazienti devono essere monitorati in caso di uso prolungato. Dopo l’intervento di cataratta, i pazienti non devono portare lenti a contatto per tutta la durata del trattamento con Ducressa. 4.5 Interazioni con altri medicinali e altre forme di interazione Non sono stati effettuati studi di interazione. Dato che dopo somministrazione oculare le concentrazioni massime nel plasma di levofloxacina e desametasone sono almeno 1000 volte inferiori a quelle riferite dopo dosi orali standard, è improbabile che le interazioni con altri prodotti per uso sistemico siano clinicamente rilevanti. L’uso concomitante di probenecid, cimetidina o ciclosporina con levofloxacina ha alterato alcuni parametri farmacocinetici della levofloxacina, ma non in misura clinicamente significativa. L’uso concomitante di steroidi topici e FANS topici può aumentare il rischio di problemi di guarigione della cornea. Gli inibitori del CYP3A4 (inclusi ritonavir e cobicistat) possono ridurre la clearance del desametasone potenziandone gli effetti. La combinazione deve essere evitata, a meno che il beneficio non sia superiore al rischio aumentato di effetti collaterali sistemici causati dal corticosteroide, nel qual caso i pazienti devono essere monitorati per tali effetti sistemici. 4.6 Fertilità, gravidanza e allattamento Gravidanza I dati relativi all’uso di desametasone e levofloxacina in gravidanza non sono disponibili o sono in numero limitato. I corticosteroidi attraversano la placenta. L’uso prolungato o ripetuto di corticosteroidi durante la gravidanza è stato associato a un maggiore rischio di ritardo di crescita intrauterina, a un minor peso alla nascita e al rischio di ipertensione, disturbi vascolari e insulino-resistenza in età adulta. I lattanti nati da madri che hanno assunto dosi considerevoli di corticosteroidi durante la gravidanza devono essere sottoposti ad accurati controlli per rilevare eventuali segni di iposurrenalismo. Negli studi condotti sugli animali i corticosteroidi hanno mostrato tossicità riproduttiva ed effetti teratogeni (tra cui palatoschisi; vedere paragrafo 5.3). Dato che non può essere esclusa un’esposizione sistemica rilevante ai corticosteroidi conseguente alla somministrazione oculare, il trattamento con Ducressa non è raccomandato durante la gravidanza, in particolare durante i primi tre mesi, e dovrebbe essere impiegato solo dopo un’attenta valutazione dei rischi e dei benefici. Allattamento La levofloxacina e i corticosteroidi sistemici vengono escreti nel latte materno. Non vi sono dati disponibili per stabilire se nel latte materno possano passare quantità di desametasone tali da produrre effetti clinici nel lattante. Un rischio per il lattante non può essere escluso. È necessario decidere se interrompere l’allattamento con latte materno o interrompere/sospendere la terapia con Ducressa, valutando il beneficio per il bambino derivante dall’allattamento con latte materno e il beneficio per la donna derivante dal trattamento. Fertilità I corticosteroidi somministrati per via sistemica possono compromettere la fertilità maschile e femminile influenzando la secrezione ormonale dell’ipotalamo e dell’ipofisi, come pure la gametogenesi nei testicoli e nelle ovaie. Non è noto se il desametasone per uso oftalmico comprometta la fertilità umana. La levofloxacina non ha causato alcuna compromissione della fertilità nei ratti, a livelli di esposizione notevolmente più elevati rispetto all’esposizione massima nell’uomo dopo la somministrazione oculare. 4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari Come con qualsiasi altro collirio, un offuscamento transitorio della vista o altri disturbi visivi possono pregiudicare la capacità di guidare veicoli e di usare macchinari. In caso di offuscamento della vista, il paziente deve attendere che la vista ritorni nitida prima di mettersi alla guida o usare macchinari. 4.8 Effetti indesiderati Riassunto del profilo di sicurezza 438 pazienti sono stati trattati con Ducressa nell’ambito degli studi clinici. Non si sono verificate reazioni avverse gravi. Le reazioni avverse non gravi più comunemente riportate sono irritazione dell’occhio, ipertensione oculare e cefalea. Elenco tabulare delle reazioni avverse Le seguenti reazioni avverse correlate a Ducressa sono state riportate nel corso di studi clinici in cui sono stati arruolati pazienti sottoposti a intervento chirurgico di cataratta (all’interno di ciascuna categoria di frequenza, le reazioni avverse sono presentate in ordine di frequenza decrescente).
La frequenza delle possibili reazioni avverse di seguito elencate è stata definita sulla base della seguente convenzione:
molto comune
comune
≥1/10
≥1/100, <1/10 non comune
≥1/1.000, <1/100 rara
≥1/10.000, <1/1.000 molto rara
≤1/10.000 non nota
La frequenza non può essere definita sulla base dei dati disponibili
Ducressa (combinazione di levofloxacina/desametasone)
Classificazione per sistemi e organi
Frequenza Reazioni avverse
Patologie del sistema nervoso Non comune Cefalea, disgeusia.
Patologie dell’occhio Non comune Irritazione dell’occhio, sensazione anomala all’occhio, ipertensione oculare.
Patologie della cute e del tessuto sottocutaneo
Non comune Prurito.
Esami diagnostici Non comune Pressione intraoculare aumentata (*). (*) > 6 mmHg che significa aumento significativo della pressione intraoculare
Le reazioni avverse osservate con i singoli principi attivi per uso oftalmico (levofloxacina o desametasone) e che possono potenzialmente manifestarsi anche con Ducressa sono riportate di seguito:
Levofloxacina
Classificazione per sistemi e organi
Frequenza Reazioni avverse
Disturbi del sistema immunitario Rara Reazioni allergiche extraoculari, incluso rash cutaneo.
Molto rara Anafilassi.
Patologie del sistema nervoso Non comune Cefalea.
Patologie dell’occhio
Patologie respiratorie, toraciche e mediastiniche
Desametasone
Classificazione per sistemi e organi
Patologie dell’occhio
Comune Bruciore agli occhi, diminuzione della vista e produzione di filamenti mucosi.
Non comune Formazione di croste sul margine palpebrale, chemosi, reazione papillare congiuntivale, edema palpebrale, fastidio oculare, prurito oculare, dolore oculare, iperemia congiuntivale, follicoli congiuntivali, secchezza oculare, eritema palpebrale e fotofobia.
Non comune Rinite.
Molto rara Edema laringeo.
Frequenza Reazioni avverse
Molto comune
Comune
Aumento della pressione intraoculare*.
Fastidio*, irritazione*, bruciore*, dolore puntorio*, prurito* e visione offuscata*.
Non comune Reazioni allergiche e di ipersensibilità, ritardata guarigione delle ferite, cataratta capsulare posteriore*, infezioni opportunistiche, glaucoma*.
Molto rara Congiuntivite, midriasi, ptosi, uveite indotta da corticosteroidi, calcificazioni corneali, cheratopatia cristallina, alterazioni dello spessore corneale*, edema corneale, ulcera corneale e perforazione corneale.
Patologie della cute e tessuto sottocutaneo Molto rara Edema facciale.
Patologie endocrine
Frequenza non nota Sindrome di Cushing, soppressione surrenalica.
* vedere il paragrafo Descrizione di alcune reazioni avverse
Descrizione di selezionate reazioni avverse Aumento della pressione intraoculare Possono manifestarsi aumento della pressione intraoculare (PIO) e glaucoma. L’uso prolungato di corticosteroidi può comportare ipertensione oculare/glaucoma (in particolare nei pazienti con precedente PIO elevata indotta da steroidi o con PIO elevata o glaucoma preesistenti). Bambini e anziani possono essere particolarmente suscettibili all’insorgere di PIO indotta da steroidi (vedere paragrafo 4.4). Anche i diabetici sono più soggetti a sviluppare cataratte sottocapsulari dopo somministrazione prolungata di steroidi topici. Reazioni avverse post-procedurali Nel corso degli studi clinici sono stati segnalati disturbi oculari (per es. edema corneale, irritazione dell’occhio, sensazione anomala all’occhio, aumento della lacrimazione, astenopia, disturbi della cornea, secchezza oculare, dolore oculare, fastidio oculare, uveite, visione offuscata, luminosità visiva, congiuntivite) e nausea. Queste reazioni sono generalmente lievi e transitorie e si reputa siano connesse all’intervento stesso di cataratta. Possibili reazioni avverse connesse alla cornea Nelle patologie che causano assottigliamento della cornea, l’uso topico di steroidi può talora comportare perforazione corneale (vedere paragrafo 4.4). Molto raramente sono stati riportati casi di calcificazione della cornea associati all’uso di colliri contenenti fosfati in pazienti con cornea significativamente danneggiata. Ulteriori reazioni avverse osservate con l’uso prolungato del principio attivo levofloxacina che possono potenzialmente verificarsi anche con Ducressa Rotture dei tendini della spalla, della mano, del tendine di Achille e di altri tendini, che hanno richiesto una riparazione chirurgica, o hanno comportato un’invalidità prolungata, sono state riferite in pazienti trattati con fluorochinoloni per via sistemica. Studi ed esperienze post-marketing con i chinoloni per via sistemica indicano che il rischio di tali rotture può essere aumentato nei pazienti trattati con corticosteroidi, in particolare nei pazienti geriatrici e nei tendini sottoposti a sollecitazioni elevate, incluso il tendine di Achille (vedere paragrafo 4.4). Segnalazione delle reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all’indirizzo www.aifa.gov.it/content/segnalazioni-reazioni-avverse 4.9 Sovradosaggio La quantità totale di levofloxacina e desametasone 21-Fosfato contenuta nel flaconcino di Ducressa è troppo esigua per indurre effetti tossici dopo un’assunzione accidentale.
In caso di sovradosaggio topico il trattamento deve essere interrotto. In caso di irritazione prolungata, sciacquare l’occhio/gli occhi con acqua sterile. La sintomatologia dovuta a ingestione accidentale non è nota. Il medico può considerare la lavanda gastrica o l’emesi.
5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: agenti antinfiammatori e antinfettivi in combinazione, corticosteroidi e antinfettivi in combinazione. Codice ATC: S01C A01. Ducressa è una combinazione fissa di due principi attivi: levofloxacina e desametasone. Levofloxacina: Meccanismo d’azione: La levofloxacina, L-isomero attivo dell’ofloxacina, è un agente antibatterico della classe dei fluorochinoloni che inibisce le topoisomerasi batteriche di tipo II: DNA girasi e topoisomerasi IV. I target della levofloxacina sono principalmente la DNA girasi nei batteri Gram-negativi e la topoisomerasi IV nei batteri Gram-positivi. Lo spettro di attività contro i patogeni oculari include microrganismi aerobi Gram-positivi (per es. S. aureus MSSA, S. pyogenes, S. pneumoniae e gli streptococchi del gruppo viridans), batteri aerobi Gram-negativi (per es. E. coli, H. influenzae, M. catarrhalis, isolati ambientali di P. aeruginosa) e altri organismi (per es. Chlamydia trachomatis). Meccanismo di resistenza La resistenza batterica alla levofloxacina può svilupparsi principalmente attraverso due meccanismi principali: una riduzione della concentrazione intrabatterica del farmaco o alterazioni dei suoi enzimi target. L’alterazione del sito target deriva da mutazioni dei geni cromosomici che codificano la DNA girasi (gyrA e gyrB) e la topoisomerasi IV (parC e parE; grlA e grlB nello Staphylococcus aureus). La resistenza dovuta a una bassa concentrazione intrabatterica del farmaco può essere legata a un’alterazione delle porine della membrana esterna (OmpF), con conseguente riduzione del passaggio dei fluorochinoloni all’interno dei batteri Gram-negativi, oppure alle pompe di efflusso. La resistenza mediata dalle pompe di efflusso è stata descritta in pneumococchi (PmrA), stafilococchi (NorA), anaerobi e batteri Gram-negativi. Infine, una resistenza ai chinoloni mediata dai plasmidi (determinata dal gene qnr) è stata descritta nella Klebsiella pneumoniae e nell’E. coli Resistenza crociata Può verificarsi una resistenza crociata tra i fluorochinoloni. Le singole mutazioni possono non comportare resistenza clinica, tuttavia le mutazioni multiple generalmente comportano resistenza clinica a tutti i farmaci appartenenti alla classe dei fluorochinoloni. Le porine alterate della membrana esterna e i sistemi di efflusso possono avere un’ampia specificità di substrato, individuando diverse classi di agenti antibatterici, con conseguente resistenza multipla. Criteri interpretativi dei saggi di sensibilità Non ci sono criteri interpretativi. Desametasone: Meccanismo d’azione: I corticosteroidi come il desametasone sopprimono l’espressione delle molecole di adesione delle cellule endoteliali vascolari, delle ciclossigenasi I o II e delle citochine. Tale azione culmina in un’espressione ridotta dei mediatori proinfiammatori e nella soppressione dell’adesione dei leucociti circolanti all’endotelio vascolare, impedendo pertanto la loro migrazione nel tessuto oculare infiammato. Il desametasone esercita una spiccata attività antinfiammatoria con un’attività mineralcorticoide limitata rispetto ad alcuni altri steroidi, ed è uno dei più importanti agenti antinfiammatori. Efficacia clinica: L’efficacia di Ducressa è stata indagata in uno studio controllato per valutare la non inferiorità di Ducressa rispetto al trattamento standard con una formulazione commerciale di tobramicina (0,3%) e desametasone (0,1%) in gocce oculari, per la prevenzione e il trattamento dell’infiammazione e per la prevenzione delle infezioni associate all’intervento chirurgico per cataratta negli adulti. Allo Sperimentatore addetto alla valutazione dei parametri dello studio non è stata resa nota l’assegnazione del trattamento. I pazienti che dopo l’intervento di cataratta non presentavano complicanze sono stati assegnati a Ducressa collirio, 1 goccia 4 volte al giorno per 7 giorni, seguito da desametasone 0,1% collirio, 1 goccia 4 volte al giorno, per altri 7 giorni, o al trattamento di riferimento con tobramicina + desametasone collirio, 1 goccia 4 volte al giorno per 14 giorni. I dati di efficacia sono disponibili in 395 pazienti trattati con Ducressa e in 393 pazienti trattati con il prodotto di riferimento dopo l’intervento di cataratta. Dopo 14 giorni di trattamento, la percentuale di pazienti che non presenta segni di infiammazione (endpoint primario dello studio) nel gruppo Ducressa seguito da desametasone è del 95,19%, rispetto al 94,91% del gruppo tobramicina + desametasone. La differenza tra le due percentuali è di 0,0028 (IC al 95%: [-0,0275; 0,0331]), dimostrano pertanto la non inferiorità del regime di trattamento sperimentale rispetto a quello di riferimento. Nel corso dello studio l’endoftalmite non è stata riscontrata in nessuno dei due gruppi. Nel braccio Ducressa, i segni di infiammazione della camera anteriore sono risultati assenti nel 73,16% dei pazienti al giorno 4 e nell’85,57% dei pazienti al giorno 8 successivi all’intervento chirurgico. Nel braccio tobramicina + desametasone, i segni di infiammazione della camera anteriore sono risultati assenti nel 76,84% dei pazienti al giorno 4 e nell’86,77% dei pazienti al giorno 8. L’iperemia congiuntivale è già assente al giorno 4 nell’85,75% dei pazienti del braccio Ducressa rispetto all’82,19% del braccio tobramicina + desametasone. Il profilo di sicurezza è risultato simile in entrambi i gruppi. Popolazione pediatrica L’Agenzia europea per i medicinali ha previsto l’esonero dall’obbligo di presentare i risultati degli studi con Ducressa in tutti i sottogruppi della popolazione pediatrica per la prevenzione e il trattamento dell’infiammazione e per la prevenzione delle infezioni associate all’intervento chirurgico per cataratta (vedere paragrafo 4.2 per informazioni sull’uso pediatrico). 5.2 Proprietà farmacocinetiche L’instillazione oculare di Ducressa comporta l’assorbimento di entrambi i principi attivi nei tessuti oculari e, in misura molto minore, nella circolazione sistemica. Nei conigli, dopo instillazione oculare, le concentrazioni plasmatiche di levofloxacina aumentano con la dose, sia dopo somministrazione singola, sia dopo somministrazione ripetuta. I livelli di desametasone sodio fosfato misurati nel plasma sono bassi. Infatti, il desametasone sodio fosfato viene rapidamente metabolizzato in vivo in desametasone, che è il metabolita attivo. L’esposizione al desametasone aumenta con la dose e dopo dosi ripetute è evidente un lieve accumulo sia di levofloxacina sia di desametasone. Nei tessuti oculari (umore acqueo, cornea e congiuntiva) i livelli di levofloxacina e di desametasone risultano superiori ai livelli massimi plasmatici dopo dosi singole e ripetute. In particolare, dopo 28 giorni di trattamento i livelli di levofloxacina e desametasone nei tessuti oculari sono superiori alla Cmax plasmatica da 50 a 100 volte e da 3 a 4 volte, rispettivamente. Centoventicinque pazienti sottoposti a intervento chirurgico di cataratta sono stati assegnati in modo casuale a 3 gruppi: levofloxacina, desametasone e Ducressa. Una goccia di ciascun farmaco è stata somministrata 90 e 60 minuti prima della paracentesi limbare. La media dei valori osservati per la concentrazione di levofloxacina era di 711,899 ng/ml (IC al 95%: 595,538; 828,260) nel gruppo Ducressa, e di 777,307 ng/ml (IC al 95%: 617,220; 937,394) con somministrazione della sola levofloxacina. Le concentrazioni di levofloxacina nell’umore acqueo sono ben al di sopra delle concentrazioni minime inibitorie per i patogeni oculari nello spettro di attività della levofloxacina. Quando Ducressa è stato somministrato con desametasone si è raggiunta una concentrazione nell’umore acqueo di 11,774 ng/ml (IC al 95%: 9,812; 13,736) rispetto ai 16,483 ng/ml (IC al 95%: 13,736; 18,838) con somministrazione del solo desametasone. Sia la levofloxacina sia il desametasone vengono eliminati con le urine. 5.3 Dati preclinici di sicurezza Gli studi sulla tossicità oculare per dosi ripetute condotti nei conigli con la combinazione fissa di levofloxacina/desametasone per un periodo di 28 giorni hanno evidenziato tossicità sistemiche attribuibili a effetti farmacologici esagerati del desametasone (necrosi focale delle cellule tubulari e glomerulopatia con necrosi e/o depositi ialini nei reni, ipertrofia epatica con inclusioni ialine intracellulari e necrosi di singole cellule, atrofia della corteccia surrenale e diminuzione dei linfociti dovuta ad atrofia della milza, del timo e dei linfonodi). Tali effetti sono stati osservati solo a esposizioni circa 3 volte superiori rispetto a quelle raggiunte alla massima dose oftalmica raccomandata per l’uomo, a indicare la scarsa rilevanza nell’uso clinico. Gli studi condotti sugli animali hanno dimostrato che gli inibitori della girasi causano disturbi nella crescita delle articolazioni portanti. Nel ratto e nel cane la levofloxacina, come altri fluorochinoloni, ha mostrato effetti sulla cartilagine (formazione di vesciche e cavità) dopo dosi elevate per via orale. Genotossicità e cancerogenicità Il desametasone e la levofloxacina non rivelano alcun potenziale genotossico o cancerogeno clinicamente rilevante. Tossicità riproduttiva: La levofloxacina non ha influenzato la fertilità e ha compromesso lo sviluppo embrio-fetale negli animali solo a esposizioni notevolmente più elevate di quelle raggiungibili con la dose terapeutica per via oftalmica raccomandata per l’uomo. La somministrazione topica e sistemica di desametasone ha compromesso la fertilità maschile e femminile e indotto effetti teratogeni che comprendono formazione di palatoschisi, ritardo di crescita intrauterina e mortalità fetale. È stata osservata anche una tossicità peri- e postnatale del desametasone. Potenziale fototossico: Gli studi nel topo, dopo dosaggio sia orale sia endovenoso, hanno mostrato che la levofloxacina svolge un’attività fototossica solo a dosi molto elevate.
6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Sodio diidrogeno fosfato monoidrato, Disodio fosfato dodecaidrato, Sodio citrato, Benzalconio cloruro, Sodio idrossido/acido cloridrico (per la correzione del pH), Acqua per preparazioni iniettabili 6.2 Incompatibilità Non pertinente. 6.3 Periodo di validità 3 anni. Eliminare entro 28 giorni dopo la prima apertura. 6.4 Precauzioni particolari per la conservazione Questo medicinale non richiede alcuna precauzione particolare per la conservazione. 6.5 Natura e contenuto del contenitore Flacone da 5 ml in polietilene a bassa densità (LDPE), con un contagocce in LDPE e un tappo a vite in polietilene ad alta densità (HDPE). Confezione da: 1 flacone x 5 ml 6.6 Precauzioni particolari per lo smaltimento L’antibiotico non utilizzato o la soluzione antibiotica residua e i materiali utilizzati per la somministrazione devono essere smaltiti in conformità alla normativa locale vigente.
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO SANTEN OY Niittyhaankatu 20 33720 Tampere Finlandia
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO AIC n. 047874019 - “1 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE” 1 FLACONE IN LDPE DA 5 ML CON CONTAGOCCE
9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE Data della prima autorizzazione: 15 ottobre 2020. Data del rinnovo più recente:
10. DATA DI REVISIONE DEL TESTO 07/2022
DUCRESSA “1 mg/ml + 5 mg/ml, collirio, soluzione” 1 flacone in LDPE da 5 ml con contagocce (AIC n. 047874019). Classificazione ai fini della fornitura: RR - medicinale soggetto a prescrizione medica. Classe ai fini della rimborsabilità: classe C. Prezzo al pubblico (IVA inclusa): € 19,90
Depositato in AIFA in data 07/02/2024 - Codice AIFA: DUC-IT-230005














SCOPRI PERCHÉ È IMPORTANTE CONTROLLARE GLI OCCHI SIN DAI PRIMI ANNI DI VITA! 10/10 9/10 8/10 Lions Clubs International MULTIDISTRETTO 108 - ITALY Campagna di prevenzione dell’ambliopia INIZIATIVA PROMOSSA DA Con il patrocinio di Una iniziativa Lions Clubs International MULTIDISTRETTO 108 - ITALY LA VISIONE NEL istruzioniBAMBINO: per l’uso Manuale pratico per genitori consapevoli Puoi richiedere n. 50 copie gratuite da mettere a disposizione dei tuoi pazienti in sala d’attesa Richiedi gli opuscoli a: info@fgeditore.it ADERISCI ANCHE TU! www.sightforkids.it Con il sostegno di










Dispositivi medici CE0123. Consultare il foglietto illustrativo per l’utilizzo, le precauzioni, le avvertenze e le controindicazioni. ©2023 Alcon. IT-SYY-2300012































































































































