DOCUMENTO DI INDIRIZZO
Prevenzione e controllo delle infezioni da Clostridioides difficile
Revisione n° 2 — dicembre 2022
Numero4 — Volume12 — ottobre-dicembre2022
GImPIOS
Giornale Italiano Multidisciplinare per la Prevenzione delle Infezioni nelle Organizzazioni Sanitarie
www.gimpios.it
Organo Ufficiale
Società Italiana Multidisciplinare per la Prevenzione delle Infezioni nelle Organizzazioni Sanitarie
Direttore
Maria Luisa Moro
Redattore Capo
Beatrice Casini
Segretario di redazione
Cesarina Curti
Comitato di Redazione
Fabio Arena, Silvia Bagnato, Veronica Ciorba, Maria Luisa Cristina, Giulia De Angelis, Claudio Farina, Enrica Martini, Angelo Pan, Andrea Patroni, Grazia Tura
SImPIOS
Società Italiana Multidisciplinare per la Prevenzione delle Infezioni nelle Organizzazioni Sanitarie
Consiglio Direttivo
Pr esidente: Maria Luisa Moro
PastPr esident: Angelo Pan
VicePr esidenti: Dalia Palmieri, Annibale Raglio
Segr etario: Laura Cavazzuti
Tesorier e: Gaetano Privitera
Consiglieri: Fabio Arena, Luca Arnoldo, Costanza Bertoni, Beatrice Casini, Cesarina Curti, Domenica Di Benedetto, Elisa Fabbri, Antonio Goglio, Stefania Greghini, Nicol Marcatelli, Matteo Moro, Daniela Pasero, Giancarlo Ripabelli, Massimo Sartelli
Coordinatore Delegati
Regionali: Antonio Goglio
Delegati Regionali:
Francesco Bisetto ( Veneto)
Marina Busetti (Friuli Venezia Giulia)
Gioia Calagreti (Umbria)
Maria Luisa Cristina (Liguria)
Federica D’Agostino (Campania)
Giulio De Stefano (Basilicata)
Luca Fabbri (Trentino)
Maurizio Formoso (Puglia)
Irene Gatte (Lombardia)
Enrica Martini (Marche)
Placido Mondello (Sicilia)
Roberto Novati ( Valle d’Aosta)
Andrea Fausto Piana (Sardegna)
Angela Pieri (Alto Adige)
Anna Poli (Toscana)
Ennio Polilli (Abruzzo)
Giancarlo Ripabelli (Molise)
Andrea Rocchetti (Piemonte)
Francesco Rose (Calabria)
Antonio Silvestri (Lazio)
Sara Tedeschi (Emilia-Romagna).
Revisori dei Conti:
Bruno Balicco [Presidente],
Silvia Bagnato, Andrea Patroni
Sede: Via Farini, 81 – 20159 Milano
Vol. 12, n. 4, ottobre-dicembre 2022
DOCUMENTODIINDIRIZZO
Prevenzione e controllo delle infezioni da Clostridioides difficile
Revisione n° 2 – dicembre 2022
Questo documento è frutto della collaborazione di molte persone ed è stato condiviso con gli or gani collegiali della SImPIOS. Hanno partecipato in particolar e alla pr eparazione del documento:
coordinator e: Andr ea Patr oni
INDICE
partecipantiagruppi dilavor o: Beatrice Casini, Costanza Bertoni, Dalia Palmieri, Fabio Ar ena, Laura Cavazzuti, Massimo Sartelli, Stefania Gr eghini r evisorideldocumento: Andr ea Patr oni, Costanza Bertoni.
176 Obiettivo del documento Strutturazione del documento Acronimi
177 “Raccomandazioni” per la prevenzione e il controllo delle infezioni da Clostridioidesdifficile
1771 Infezione da Clostridioidesdifficile
1 1 Introduzione
1 2 Epidemiologia
1.2.1 Prevalenza, incidenza, morbilità, mortalità
1 2 2 Tipi di ceppo e cambiamento epidemiologico
1 2 3 ICD in comunità e popolazioni speciali ad elevato rischio
1.2.4 Colonizzazione ed infezione
1.2.5 ICD nella popolazione pediatrica
1802 Modalità di trasmissione e fattori di rischio
2 1 Modalità di trasmissione
2 2 Fattori di rischio
1813. Diagnosi di ICD
3 1 Definizione di caso per la sor veglianza
3.2 Diagnosi endoscopica e radiologica
3 3 Diagnosi di laboratorio
3 3 1 Il paziente target
3 3 2 I test disponibili e loro indicazioni
3 3 3 Protocollo diagnostico
3.3.4 Tipizzazione dei ceppi isolati
1844 Strategie per la sor veglianza e il controllo delle ICD
4 1 Diagnosi tempestiva
4 2 Sor veglianza attiva
4 3 Formazione-informazione
4.4 Isolamento
4.5 Igiene delle mani
4 6 Igiene ambientale
4 7 Gestione di dispositivi e attrezzature
4.8 Corretta gestione degli antibiotici
4 9 Terapia dell’ICD
4 9 1 Prevenzione dell'ICD con probiotici
La r evisionen°2, condivisa con gli or gani collegiali SImPIOS, è stata curata da Andr ea Patr oni gruppodilettura: Cesarina Curti, Maria Luisa Mor o, Angelo Pan
4 11 Misure da adottare in caso di epidemia
4 12 Clostridioides difficile bundle


1935. Bibliografia
198AllegatoA– Tabella sinottica delle linee guida consultate
Diagnosi
Igiene delle mani, precauzioni da contatto, pulizia ambientale e disinfezione, formazione, antibiotic stewardship, trattamento dei casi di CD
212AllegatoB– La formazione continua del personale sanitario
Esempio di una metodologia di Problem Based Learning (PBL)
216AllegatoC– L’informazione a paziente e familiari
1. Fac simile di scheda informativa
2 Fac simile di segnalazione precauzioni da contatto
219AllegatoD– L’igiene dell’ambiente e delle attrezzature
1 Traccia per la elaborazione di un protocollo
2 Monitoraggio dell’adesione alle procedure indicate dal protocollo
221AllegatoE– Gestione di eventi epidemici
224AllegatoF– Misure di prevenzione e controllo
1 Misure preventive di carattere generale
2 “Bundle” per minimizzare la trasmissione crociata di Clostridioides difficile
3 Esempio di check-list per verifica interna dell’applicazione delle misure di controllo per Clostridioides difficile
tel 02 69 90 14 48
fax 02 66 86 699 info@simpios.it – www.simpios.it
Segreteria: martedì e giovedì 9-13
4 9 2 Terapia dell'ICD
4.10 Trapianto di microbiota fecale
227AllegatoG– Strumenti per verificare, da parte della struttura, l'implementazione delle misure di controllo raccomandate per Clostridioidesdifficile Criteri e indicatori per attività di sor veglianza
–
umero Prevenzione
e controllo delle infezioni da Clostridioides difficile
Prevenzione e controllo delle infezioni da Clostridioides difficile
Revisione n° 2 - dicembre 2022
Obiettivo del documento
Questo documento, revisione del precedente del 2011,1 intende proporre, in modo sintetico, informazioni sulle infezioni da Clostridioides difficile e indicazioni sugli inter venti che, allo stato attuale delle conoscenze, sono ritenuti di dimostrata efficacia nella prevenzione, controllo e trattamento dell’infezione
Obiettivo principale del documento è rendere disponibile per gli operatori sanitari/assistenziali uno strumento di lavoro adeguato alle esigenze/caratteristiche del contesto italiano, che possa essere di utile riferimento per definire, nelle diverse situazioni, quali sono le attività di prevenzione e controllo da implementare, le relative priorità di inter vento e i metodi per monitorare l’impatto degli inter venti effettuati.
Nell’approccio alla problematica è anche opportuno aver presente che a) nell’ambito del clinical risk management il controllo delle infezioni è considerato attività indispensabile a garantire la sicurezza del paziente, b) tutto il personale di assistenza, ciascuno secondo le proprie attribuzioni, è direttamente responsabile della corretta applicazione delle attività di prevenzione e controllo.
Strutturazione del documento
L'allegato A propone la tabella sinottica delle linee guida consultate e precisa la qualità delle evidenze e la forza della raccomandazione per le misure di controllo messe a punto da:
European Society of Clinical Microbiology and Infectious Diseases (ESCMID),2,3
Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA),4,5
European Centre for Disease Prevention and Control (ECDC),6
The American Society of Colon and Rectal Surgeons (ASCRS) 7
SImPIOS condivide queste indicazioni
I capitoli in cui si articolano il documento e gli allegati, elaborati da SImPIOS sulla base di varie fonti, introducono ad una lettura del problema, commentano e discutono le raccomandazioni e propongono metodologie applicative
A C R O N I M I
ASCRS The American Society of Colon and Rectal Surgeons
CA Community-Associated – Infezione Comunitaria
CCM Centro nazionale per la prevenzione e il Controllo delle Malattie
CCNA Cell Cytotoxicity Neutralization Assay
CD Clostridioides difficile
CDC Centers for Disease Control and Prevention
CIO Comitato controllo Infezioni Ospedaliere
CO Community Onset – Esordio in comunità
CO-HA Community Onset, Healthcare facility-Associated
DPI Dispositivi di Protezione Individuale/ Mezzi di barriera
ECDC European Centre for Disease Prevention and Control
EIA Enzyme Immunoassay
EIP Emerging Infections Program
ESCMID European Society of Clinical Microbiology and Infectious Diseases
FDA Food and Drug Administration
GDH Glutammato deidrogenasi
HA Healthcare facility-Associated –
Associate alle strutture sanitarie
HO Healthcare facility-Onset –Esordio nelle strutture sanitarie
ICA Infezioni Correlate all’Assistenza
ICD Infezione da Clostridioides difficile
IDSA Infectious Diseases Society of America
IPP Inibitore della Pompa Protonica
ISS Istituti Superiore di Sanità
LTCFs Long-Term Care Facilities
MRSA Methicillin-Resistant Staphylococcus Aureus
NAAT Nucleic Acid Amplification
NaDCC Sodiodicloroisocianurato
NHSH National Healthcare Safety Network
PNCAR Piano Nazionale Contro l’Antibiotico Resistenza
ppm Parti per milione
rRNA RNA ribosiomale
RX Radiografia
RSA Residenza Sanitaria Assistenziale
SHEA Society for Healthcare Epidemiology of America
TAC Tomografia Assiale Computerizzata
TAT Turnaround Time
TC Toxinogenic Culture
tcd Tossina di Clostridioides difficile
UO Unità Operativa
VRE Vancomycin-Resistant Enterococcus
® I diritti di traduzione, di memorizzazione elettronica, di riproduzione e di adattamento totale o parziale con qualsiasi mezzo (compresi i microfilm e le copie fotostatiche)
sono riser vati per tutti i paesi. La violazione di tali diritti è perseguibile a norma di legge. Autorizzazione del Tribunale di Roma n 62/92
Il Pensiero Scientifico
Editore s r l
Via San Giovanni Valdarno, 8 00138 Roma
T 06 862 821
F 06 862 822 50
E-mail: pensiero@pensiero it
Internet: http://www pensiero it www gimpios it
Direttore responsabile: Luca De Fiore
Produzione: Manuela Baroncini
Pubblicità: Livia Costa
Abbonamenti: Andrea De Fiore
Stampa: Ti Printing, via delle Case Rosse, 23 00131 Roma
febbraio 2023
La forza delle raccomandazioni e la qualità delle evidenze sono riportate nell'allegato A
1.
1.1 Introduzione
Clostridioides difficile (CD) è il nuovo nome assegnato al Clostridium difficile nel 2016 8 La storia del Clostridium difficile inizia quando nel 1935 Ivan C. Hall e Elizabeth O’Toole9 isolarono in materiale fecale di neonati un batterio che venne denominato inizialmente Bacillus difficilis, per la difficolt à incontrat a nel suo isolamento e per la sua estrema lentezza di crescit a in coltura Successivamente il microrganismo fu assegnato al genere Clostridium per le caratteristiche fenotipiche che lo rendevano simile agli altri membri della famiglia: anaerobio, Gram-positivo, sporigeno Divenne quindi a tutti gli effetti Clostridium difficile.
Con l’avvento delle metodiche molecolari, cominciarono ad essere studiate le diversit à filogenetiche del genere Clostridium, apport ando sempre nuove conoscenze su particolari sequenze geniche import anti per la classificazione del genere. In particolare, l’appartenenza al “rRNA cluster I” fu riconosciut a come quella caratterizzante il genere Clostridium vero e proprio. Nel 2015 Lawson e Rainey10 avanzarono la propost a di circoscrivere il genere Clostridium al C butyricum e specie correlate, tutte appartenenti al suddetto “cluster I”. Delle 238 specie e sottospecie appartenenti al genere, solo meno di 80 potevano essere considerate Clostridium in senso stretto. Tra gli esclusi il C. difficile, compreso nel cluster XI
Una ulteriore complicazione si presentò quando, sempre sulla base di studi molecolari, venne proposto che i microrganismi appartenenti al cluster XI dovessero essere inclusi in una nuova famiglia denominat a Peptostreptococcaceae Yutin e Galperin,11 confermando l’appartenenza del Clostridium a quest a famiglia, proposero di coniare il nuovo genere del Peptoclostridium per mantenere un legame con la precedente denominazione
Passare dal Clostridium difficile al Peptoclostridium difficile si rivelò una “mission impossible” I termini Clostridium difficile, C diff e tutti gli acronimi ad essi collegati (CDI – C difficile infection; CDAD – C. difficile associated diarrhea) avrebbero dovuto essere modificati in PDI e PDAD, creando confusione con altri simili, associati ad altri tipi di patologie (è not a la predilezione anglosassone per acronimi di ogni specie). Adott are un nome decisamente diverso avrebbe inoltre comport ato danni economici rilevantissimi per la necessit à di aggiornare materiali, imballaggi, marchi di prodotti, nomi registrati, tecnologie informatiche, ecc.,
oltre allo spreco di tutto il materiale esistente, non più utilizzabile. Le aziende commerciali avrebbero dovuto modificare cat aloghi, siti e pagine web; gli ospedali aggiornare test diagnostici, reportistica, codici farmaceutici ed amministrativi, protocolli, materiali formativi e divulgativi, e così via Ci sarebbero voluti anni per un cambiamento completo e definitivo, e, in ambito clinico, l’inevit abile confusione nella terminologia avrebbe potuto comport are molteplici effetti negativi sull’assistenza e sulla cura dei pazienti
Nel 2016 la definitiva riclassificazione del C. difficile fu possibile grazie alla contropropost a di Lawson, et al 12 di scegliere piuttosto un nuovo nome che iniziasse con la C, anzi meglio ancora con “Clost” in modo da poter continuare ad utilizzare le abbreviazioni C difficile, C diff e tutti gli acronimi collegati; le più modeste modifiche necessarie su documenti, marchi, imballaggi, ecc sarebbero st ate accett abili. La loro propost a di denominare il nuovo genere “Clostridioides” sembrò subito la più plausibile, t anto più che il suffisso -oides, derivante dal greco eidos che significa forma, aspetto, richiamava la somiglianza del nuovo genere con il Clostridium
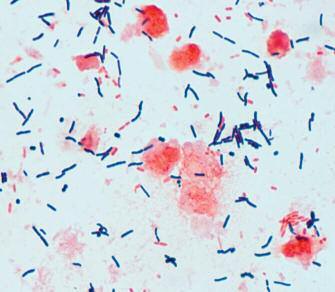
CD è un bacillo Gram positivo, anaerobio, sporigeno, largamente diffuso nell’ambiente e presente nel tratto intestinale degli animali e dell’uomo Anche se let ale in un certo numero di specie a causa della produzione di una esotossina, era solo occasionalmente isolato nell’uomo, in cui il suo ruolo di patogeno era considerato irrilevante.13 A seguito della introduzione di clindamicina, antibiotico ad ampio spettro con significativa attivit à anti-anaerobi, la colite divenne una seria complicanza associat a al tratt amento.14 Prima di allora, St aphylococcus aureus era considerato il principale agente eziologico di colite antibiotico-associat a.15 Quando Staphylococcus aureus venne escluso come causa di colite clindamicina-associat a, iniziò una gara per identificare l’agente eziologico responsabile. Bartlett et al. furono i primi, nel 1978, a suggerire CD tossigenico come causa di colite clindamicina-associat a.16 Negli ultimi tre decenni l’incidenza di infezioni da Clostridioides difficile (ICD) è aument at a in tutto il mondo ed è divent at a la più comune causa di infezione nosocomiale.17 Al contrario di precedenti studi epidemiologici che consideravano l’ICD principalmente acquisite in ospedale, esse sono ora una delle principali cause di diarrea in comunit à, compresi i pazienti più giovani e quelli che non present ano fattori di rischio per ICD, come una precedente ospedalizzazione e una recente esposizione ad antibiotici 18 Tra i diversi determinanti dell’aumento dell’incidenza, morbilit à e mort alit à delle ICD, l’emergenza e
Infezione da Clostridioidesdifficile
177 GImPIOS Vol 12, n 4, ottobre-dicembre 2022 Prevenzione
e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
“Raccomandazioni” per la prevenzione e il controllo delle infezioni da Clostridioidesdifficile
“Tabella sinottica delle Linee guida consultate”.
la diffusione di ceppi ipervirulenti di CD hanno sicuramente svolto un ruolo molto rilevante.19
In ambito clinico, CD è responsabile di diverse tipologie di infezioni di differente gravit à: da diarrea lieve a gravi complicanze come colite pseudomembranosa, megacolon tossico, perforazione intestinale, sepsi e morte 20 Le manifest azioni cliniche gravi, alle quali soprattutto si associa un elevato rischio di mort alit à, sono più frequenti se l’infezione è sostenut a da ceppi iper-virulenti, caratterizzati da resistenza ai fluorochinoloni, produzione aument at a di spore, maggiore produzione di tossine, maggior percentuale di recidive.21,22
CD è in grado di sopravvivere in una variet à di condizioni ambient ali per la formazione di spore, che rappresent ano la principale via di trasmissione. L’ICD sintomatica si inst aura nel colon quando le spore di CD si trasformano nella forma veget ativa, che produce due principali esotossine, l’enterotossina A e la citotossina B, responsabili degli effetti patogeni di CD. Queste tossine inattivano i membri della famiglia Rho della guanosina trifosfat asi (Rho GPTasi), determinando la produzione di citochine e chemochine, afflusso di neutrofili, morte delle cellule epiteliali e rottura definitiva della barriera mucosa intestinale 23
In aggiunt a alle tossine A e B, alcuni ceppi di CD associati a casi gravi di colite producono una terza tossina, denominat a tossina binaria (CDT) 24
Uno degli aspetti critici delle ICD è la frequenza di recidive, che compaiono in una elevat a percentuale di casi anche in pazienti tratt ati corrett amente. In genere la recidiva compare entro 4-8 settimane dal termine della terapia antibiotica 25
La colonizzazione asintomatica è la condizione nella quale CD viene isolato in assenza di sintomi d’infezione È st ato sostenuto che i pazienti asintomatici colonizzati non progrediscono in infezione in quanto sono in grado di sviluppare una rispost a immunit aria di tipo umorale nei confronti della tossine.26 Tutt avia questi pazienti rappresent ano un serbatoio d’infezione e quindi un rischio per gli altri 16-28 La prevalenza di colonizzazione asintomatica varia in differenti gruppi di pazienti: 18-90% nei neonati e bambini sani, 0-15% negli adulti sani, 0-51% negli anziani ospiti in case di cura, 0,6-50% nei pazienti ospedalizzati, 0-13% negli operatori sanit ari 29
1.2 Epidemiologia
1.2.1 Prevalenza, incidenza, morbilità e mortalità
CD è la più comune causa di diarrea infettiva in ambito sanit ario In 711 ospedali per acuti di 28 st ati partecipanti al National Healthcare Safety Network (NHSN) dei Centers for Disease Control and Prevention (CDC) nel 2010 è st ato registrato un t asso di ICD correlate all’assistenza sanit aria di 7,4 (mediana 5,4) per 10.000 giorni-paziente.30
Dai dati dell’Emerging Infections Program (EIP)31 dei CDC nel 2011, negli St ati Uniti, sono st ati stimati 453.000 casi di ICD, con un’incidenza di 147,2 casi/100.000 persone 32 L’incidenza era più alt a tra coloro che present avano et à superiore ai 65 anni, nelle donne e nei bianchi. Dei
453 000 casi 293 300 (64,7%) erano da considerarsi correlati all’assistenza sanit aria, di questi il 37% era insorto in ospedale, il 36% in strutture di assistenza a lungo termine (long-term care facilities, LTCFs) ed il 28% in comunit à (paziente ambulatoriale o dimesso dall’ospedale da ≥3 giorni o pernott amento in un centro di accoglienza nelle 12 settimane precedenti). Dei 159.700 casi insorti in comunit à (non pernott amento in un centro di accoglienza nelle precedenti 12 settimane) l’82% era correlato all’assistenza sanit aria ambulatoriale; quindi, la stragrande maggioranza (94%) dei casi di ICD era correlat a all’assistenza sanit aria 32,33
In un’indagine di prevalenza delle infezioni correlate all’assistenza sanit aria (ICA), condott a dall’EIP nel 2011, è emerso che CD è il più comune patogeno responsabile delle infezioni riscontrate in 183 ospedali: 61 su 504 (12,1%).34
I dati di dimissione ospedaliera mostrano che negli St ati Uniti le diagnosi di ICD hanno raggiunto il valore più alto tra il 2011 e il 2013 35
I dati dell’EIP suggeriscono che nelle LTCFs il t asso di colonizzazione e infezione da CD è alto; più del 20% di tutte le ICD identificate nel 2011 ha avuto inizio nelle LTCFs 32 Inoltre nel 2012 sono st ati stimati 112.800 casi di ICD con esordio in LTCFs 36; il 57% di questi era st ato dimesso dall’ospedale nell’ultimo mese. Al contrario, nel 20% delle ICD insorte in ospedale erano interessati pazienti che avevano risieduto in LTCFs nelle ultime 12 settimane 37
Dal 2000 si è osservato un considerevole incremento del numero di ICD con aument at a morbilit à, mort alit à e costi attribuibili, sia in nord America che in Europa. Tali cambiamenti epidemiologici sono stati principalmente attribuiti all’emergenza di nuovi ceppi ipervirulenti, per primo il ribotipo 027, responsabile di numerosi outbreaks in nord America ed Europa, e, in misura minore, il ribotipo 078 38 Prima del 2000 la mort alit à attribuibile a ICD era <2%.39 Dal 2000 la mort alit à attribuibile a ICD è risult at a essere più alt a, sia durante i periodi endemici (da 4,5% a 5,7%) che epidemici (da 6,9% a 16,7%).40 Tutt avia uno studio condotto in 6 ospedali canadesi ha valut ato i casi di ICD nel 20062007 e ha rilevato una mort alit à attribuibile dell’1,7%.41 Secondo i dati dell’EIP nel 2011 il numero stimato di morti entro 30 giorni dalla diagnosi di ICD negli St ati Uniti era 29.300.32
I costi attribuibili a ICD rappresent ano un onere considerevole per il sistema sanit ario. Alcuni studi hanno dimostrato che il costo attribuibile a ICD in ospedali per acuti è pari a 3 427-9 960 dollari per episodio, con un costo annuo stimato di 1,2-5,9 miliardi di dollari.40
Da gennaio 2016 l’European Centre for Disease Prevention and Control (ECDC) coordina la sorveglianza di ICD negli ospedali per acuti dei Paesi europei 6 Nel 2016 20 Paesi europei, per un tot ale di 556 ospedali, hanno segnalato 7.711 casi di ICD, 5.756 dei quali (74,6%) erano correlati all’assistenza sanit aria, 1 955 (22,4%) erano acquisiti in comunit à; nel 44,9% dei casi era interessato il sesso maschile e 75 anni era la mediana dell’et à L’incidenza di ICD correlate all’assistenza sanit aria era di 2,9 casi per 10.000 giorni-paziente, quella dei casi acquisiti in comunit à di 0,8 casi per 10.000 giorni-paziente Seicentoundici dei 7 711 (7,9%) casi segnalati erano recidive; il 16,7% dei casi avevano present ato
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 178
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
una complicanza: ricovero per caso di comunit à, ricovero in unit à di cura intensiva, chirurgia per megacolon tossico o decesso La mort alit à attribuibile a ICD era 3,9% L’85,6% dei casi di ICD esordiva nel medesimo ospedale in cui veniva diagnosticato, mentre per il 7,4% l’esordio avveniva in un altro ospedale e per il 2,1% in LTCFs 42
1 2 2 Tipi di ceppo e cambiamento epidemiologico
Nei primi anni 2000 l’emergenza del ceppo virulento ed epidemico ribotipo 027 ha determinato maggiori incidenza, gravit à e mort alit à delle ICD, ed epidemie in tutto il nord America,43,44 Inghilterra,45,46 parte dell’Europa 47,48 e Asia.49
Gli isolati più recenti del ceppo 027 sono molto più resistenti ai fluorochinoloni rispetto ai ceppi storici dello stesso tipo; quest a è probabilmente la conseguenza dell’aument ato uso di fluorochinoloni registrato in tutto il mondo.44
I pazienti infett ati dal ceppo epidemico 027 hanno present ato una ICD più severa e con peggior prognosi rispetto ai pazienti infett ati da altri ceppi.41,43,50
Dall’emergenza e diffusione del ceppo 027, recenti dati riferiti all’Europa suggeriscono che la prevalenza di questo ceppo è in riduzione In Inghilterra il ribotipo 027 si è ridotto significativamente tra il 2007 e il 2010, passando da una prevalenza del 55% al 21%, coincidente con una significativa riduzione dell’incidenza di ICD e della sua mort alit à. La riduzione della prevalenza del ribotipo 027 è st at a probabilmente conseguenza della significativa riduzione dell’utilizzo di fluorochinoloni nel medesimo periodo.51
La continua tipizzazione molecolare ha consentito il rilevamento di ceppi emergenti di CD con nuovi fattori di virulenza, nuovi fattori di rischio e nuovi patterns di antibiotico-resistenza In Olanda è st ato isolato un ceppo virulento, il ribotipo 078; la sua prevalenza è aument at a dal 2005 al 2008, le sue ICD si sono dimostrate severe come quelle del ribotipo 027, ma interessavano persone più giovani ed insorgevano prevalentemente in comunit à.52 Nella relazione epidemiologica annuale 2016-2017 dell’ECDC 14 dei 20 ribotipi più comunemente segnalati erano Clade 1*, incluso il più comune ribotipo 014/020 (16,8%) Il ribotipo 078 (Clade 5) è st ato più frequentemente segnalato da Belgio, Cechia, Irlanda e Paesi Bassi (7-11% dei casi). Il ribotipo 027, noto per la sua ipervirulenza, è st ato il terzo ribotipo più frequentemente segnalato nel 2016-2017 e particolarmente diffuso in Ungheria (67,6%), Polonia (63,0%) e Slovenia (44,4%) Per quanto concerne l’It alia, dal 2009 al 2018, sono st ati tipizzati 980 ceppi e identificati 100 ribotipi con predominanza dei ribotipi 018 e 607 (dati dell’ISS).
1.2.3 ICD in comunità e popolazioni speciali ad elevato rischio
Nel contesto dei cambiamenti epidemiologici delle ICD in ambiente ospedaliero dei primi anni 2000, alcuni dati evidenziano anche un aumento dell’incidenza di ICD in comunit à e in persone sane, in precedenza a basso rischio, comprese le donne in gravidanza.53-55
Le fonti e i fattori di rischio di ICD in comunit à non sono ben definiti. Un’analisi delle ICD acquisite in comunit à segnalate negli anni 2009-2011 nell’EIP dei CDC ha mostrato che la maggioranza dei casi (82%) aveva present ato una precedente esposizione sanit aria nelle 12 settimane precedenti la diagnosi di ICD Il 36% dei casi non present ava alcuna esposizione ad antibiotici nelle 12 settimane precedenti la diagnosi di ICD; di questi il 31% aveva utilizzato un inibitore di pompa protonica 33
I pazienti con malattie infiammatorie croniche intestinali, soprattutto rettocolite ulcerosa, present ano un rischio aument ato di ICD, non solo primaria ma anche recidiva, ed elevate morbilit à e mort alit à. Il rischio di ICD entro 5 anni dalla diagnosi di rettocolite ulcerosa può essere maggiore del 3% e rende peggiore la prognosi (maggior ricorso a colectomia, maggiori complicanze post-chirurgiche, morte) 56 Rispetto alla popolazione generale i pazienti con malattia infiammatoria cronica intestinale hanno il 33% in più di probabilit à di present are una recidiva di ICD 57
Un’altra popolazione di pazienti ad elevato rischio di ICD sono coloro che hanno subito un trapianto di organo solido. Essi present ano una prevalenza di ICD pari a 7,4%.58
Il rischio è più elevato per il trapianto multiorgano, seguono polmone, fegato, intestino, rene e pancreas, con una prevalenza di malattia severa del 5,3% e un rischio di recidiva di ICD di circa 20% 59
I pazienti con insufficienza renale cronica hanno un rischio aument ato di ICD primaria e recidiva di 2-2,5 volte, un rischio di malattia severa e morte di 1,5 volte 60
I pazienti sottoposti a trapianto di midollo present ano un t asso di ICD circa 9 volte più elevato di quello di altri pazienti ospedalizzati; all’interno di quest a popolazione i t assi di ICD sono doppi nei trapianti allogenici rispetto agli autologhi Il rischio maggiore viene registrato nei primi 100 giorni post-trapianto.61
1.2.4 Colonizzazione ed infezione
Alcuni studi hanno determinato che la prevalenza di colonizzazione asintomatica da CD è del 3-26% in adulti degenti in ospedali per acuti41,62 e del 5-7% in anziani ospiti presso le LTCFs 63-66 La prevalenza di CD nelle feci di adulti asintomatici senza recente esposizione sanit aria è <2%.65
* La struttura della popolazione di C. difficile è costituit a principalmente da cinque cladi filogenetici designati da 1 a 5 Alcuni genotipi del clade 5 sono associati e ceppi alt amente patogeni
Il tempo che intercorre tra la colonizzazione da CD e l’insorgenza di ICD (periodo di incubazione) è st ato stimato essere di circa 3-4 giorni,56,57 mentre recenti evidenze fanno presumere un periodo di incubazione maggiore di una settimana.66 Altri recenti studi suggeriscono che i soggetti che rimangono colonizzati asintomatici per lunghi periodi di tempo present ano un ridotto rischio di sviluppare ICD.62,67-69 Il rischio di progressione giornaliero dalla colonizzazione all’infezione non è statico, ma decresce nel tempo; quindi si pensa che la protezione indotta da una colonizzazione a
179 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
Prevenzione
lungo tempo possa essere mediat a in parte da un aumento nel siero dei livelli di anticorpi contro le tossine A e B di CD 41,67,68 È anche possibile che, finché un individuo è colonizzato da un ceppo di CD, sia protetto nei confronti di un’infezione da altro ceppo.69
1.2.5 ICD nella popolazione pediatrica
Come per gli adulti, dal 2000 l’incidenza di ICD è aument at a anche nei bambini.70-72 Uno studio di popolazione condotto su bambini residenti in Minnesot a, tra il 1991 e il 2009, ha identificato un aumento di incidenza di ICD dal 2,6 al 32,6 per 100.000.69 L’aumento di incidenza interessava anche bambini in comunit à e ambulatoriali 70,71,73 Dai dati dell’EIP dei CDC emerge che il 71% dei casi di ICD pediatrici hanno esordito in comunit à; questi dati indicano un cambio epidemiologico, con un incremento di malattia in bambini non ospedalizzati.74
Un’import ante caratteristica epidemiologica di CD nei bambini è la presenza di colonizzazione asintomatica da parte di ceppi sia tossigeni che non, con t assi più elevati, che possono superare il 40%, sotto i 12 mesi d’et à 75-78 I ceppi non tossigeni sono molto più comuni dei ceppi tossigeni tra i bambini colonizzati, ma la colonizzazione è transitoria e diversi ceppi possono colonizzare lo stesso bambino in tempi diversi.76-77 La colonizzazione è meno frequente nei bambini allatt ati al seno rispetto a quelli allatt ati artificialmente.78-79 Alcune evidenze indicano l’ambiente ospedaliero come sorgente di acquisizione di ceppi colonizzanti.75,76,79 I t assi di colonizzazione si riducono con il crescere dell’et à.78,80 Dai 2-3 anni di et à circa l’1-3% dei bambini è port atore asintomatico di CD, t asso simile a quello osservato in adulti sani. Mentre è improbabile che i bambini presentino ICD, quando sono colonizzati possono rappresent are una fonte di trasmissione per gli adulti.33,77,81
I principali fattori di rischio per ICD nel bambino sono gli stessi dell’adulto: recente esposizione agli antibiotici, ospedalizzazione, neoplasia maligna, trapianto d’organo solido, malattia infiammatoria cronica intestinale, gastrostomia o digiunostomia, assunzione di inibitori di pompa protonica o ant agonisti dei recettori dell’ist amina 82-86
Le forme di ICD severa e le complicanze sono meno comuni nel bambino,83 ma sono st ate descritte.87,88 Nei bambini ospedalizzati le ICD hanno prognosi peggiore, prolungano l’ospedalizzazione, aument ano i costi ospedalieri e present ano un t asso di mort alit à più elevato 89
2. Modalità di trasmissione e fattori di rischio
2.1 Modalità di trasmissione
Le mani del personale sanit ario, transitoriamente cont aminate dalle spore di CD,90 e la cont aminazione ambient ale66,91,92 sono probabilmente le modalit à principali con le quali il CD si diffonde in ambiente sanit ario. Sebbene l’occupazione di una st anza di degenza precedentemente occupat a da un paziente con ICD rappresenti un significativo fattore di rischio per la sua acquisizione, ciò accade approssimativamente nel 10% dei casi,93 indicando in t al modo che altre modalit à di trasmissione sono più comuni.94
È ancora controverso il ruolo dei pazienti asintomatici colonizzati nella trasmissione di CD95, dal momento che la cont aminazione ambient ale da parte di questi pazienti è minore rispetto a quella dei pazienti con sintomatologia.96 Tutt avia, è st ato dimostrato che il 29% dei casi di ICD in un ospedale sono associati con port atori asintomatici, mentre il 30% con pazienti sintomatici.66 La trasmissione ambient ale è st at a osservat a in 4 di 61 casi di ICD 66
Due studi hanno evidenziato come gli antibiotici possano influenzare il rischio di ICD. La prescrizione di antibiotici a livello di reparto è un fattore di rischio per ICD indipendente dagli antibiotici o altri fattori individuali del paziente.97 Inoltre, il rischio individuale di ICD è più alto nei pazienti ricoverati in una st anza dove ad un precedente paziente con ICD sono st ati somministrati antibiotici, suggerendo una diffusione di CD da parte di port atori asintomatici 98
La diffusione di spore di CD è particolarmente alt a tra i pazienti recentemente tratt ati per ICD, anche dopo risoluzione della diarrea.90,99 In uno studio la frequenza di cont aminazione cut anea e diffusione ambient ale sono rimaste alte al momento della risoluzione della diarrea (rispettivamente 60% e 37%), si sono ridotte alla fine del tratt amento e sono di nuovo aument ate 1-4 settimane dopo il tratt amento (rispettivamente 58% e 50%).99
2.2 Fattori di rischio
L’et à avanzat a è uno dei più import anti fattori di rischio per ICD,41,100 come la durat a dell’ospedalizzazione Il quotidiano incremento del rischio di acquisire CD durante l’ospedalizzazione suggerisce che la durat a di quest’ultima può essere mandat aria della durat a e del grado di esposizione al microrganismo, della probabilit à di esposizione agli antibiotici, della gravit à della malattia di base 41,62
Il più import ante fattore di rischio per ICD modificabile è l’esposizione agli antibiotici. Negli anni è emerso che potenzialmente qualsiasi antibiotico può essere associato a ICD, tutt avia per alcune classi il rischio è più elevato: cefalosporine di III e IV generazione,101 fluorochinoloni,43,103 carbapenemi101 e clindamicina.103 L’assunzione di antibiotici aument a il rischio di ICD perché essi sopprimono il normale microbiot a intestinale, fornendo a CD l’occasione di prosperare.104 L’alterazione del microbiot a intestinale da
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 180
e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
parte degli antibiotici è di lunga durat a e il rischio di ICD aument a sia durante la terapia sia nei 3 mesi dopo l’interruzione della stessa Il rischio più alto di ICD (7-10 volte) pare sia risult ato nel primo mese dopo l’esposizione ad antibiotici.101 Sia il tempo di esposizione che l’utilizzo di più molecole antibiotiche increment ano il rischio di ICD 103 Ciò nonost ante, anche un’esposizione molto limit at a, come una singola dose di profilassi antibiotica perioperatoria, aument a il rischio per il paziente di colonizzazione e infezione da CD.105 Tutt avia la colonizzazione asintomatica può non essere associat a a precedente esposizione ad antibiotici 65
La chemioterapia antitumorale è un altro fattore di rischio per ICD, in parte per l’attivit à antibiotica di diversi agenti chemioterapici,106 in parte per i suoi effetti immunosoppressivi (neutropenia).107
CD è un import ante patogeno responsabile di diarrea batterica nei pazienti con infezione da HIV; questi present ano un elevato rischio di ICD per la loro immunodeficienza, per l’esposizione ad antibiotici e ad ambienti sanit ari potenzialmente cont aminati.108
Altro fattore di rischio per ICD è rappresent ato dalla chirurgia gastrointestinale e dalla aliment azione tramite sondino naso-gastrico, da gastrostomia e digiunostomia 109
I fattori di rischio per recidiva di ICD sono: et à avanzat a, esposizione prolungat a ad antibiotici, utilizzo di inibitori di pompa protonica, infezione da ceppi virulenti, precedente esposizione a fluorochinoloni.110,111
I fattori di rischio per ICD complicat a sono: et à avanzat a, leucocitosi, insufficienza renale e comorbilit à.
I fattori di rischio per elevat a mort alit à da ICD sono: et à, comorbilit à, ipoalbuminemia, leucocitosi, insufficienza renale acut a, infezione da ribotipo 027.111
Dati recenti confermano il ruolo dell’immunit à umorale, principalmente contro la tossina B, come fattore protettivo nei confronti delle recidive di ICD.112
La vit amina D potrebbe essere un fattore protettivo nei confronti dell’ICD: bassi livelli di vit amina D sono risult ati essere un fattore di rischio indipendente nei pazienti con infezione acquisit a in comunit à, negli anziani e in coloro che present ano una malattia infiammatoria cronica intestinale 113
Rimane ancora controverso se l’utilizzo dei medicinali in grado di ridurre l’acidit à gastrica, come gli inibitori della pompa protonica (IPP) e gli antagonisti dei recettori-H2 dell’ist amina possano rappresent are un fattore di rischio Sebbene alcuni studi abbiano suggerito un’associazione tra questi farmaci e l’ICD,114,115 i risult ati di altri studi controllati suggeriscono che in t ale associazione rientrano fattori di confondimento come la gravit à della malattia di base, la diarrea non determinat a da CD, la durat a dell’ospedalizzazione.43,116 In uno studio retrospettivo di 754 pazienti con ICD correlate all’assistenza, l’utilizzo continuativo di IPP è risult ato associato ad un aumento del 50% delle recidive, mentre l’esposizione ad antibiotici solamente del 30%.117 Inoltre l’utilizzo a lungo termine di IPP ha mostrato ridurre la diversità microbica del tratto gastrointestinale inferiore.118
3. Diagnosi di ICD
3.1 Definizione di caso per la sor veglianza
I casi di ICD per la sorveglianza sono st ati definiti dallo ECDC come qui indicato.6
Un caso di ICD deve soddisfare almeno uno dei seguenti criteri:
1. paziente con feci diarroiche o megacolon tossico (evidenziato mediante criteri clinici e indagini radiologiche) e presenza di CD tossinogenico nelle feci, accert at a mediante test microbiologici; oppure
2. colite pseudomembranosa all’esame endoscopico; oppure
3. diagnosi istopatologica di ICD (con o senza diarrea) su campione ottenuto durante esame endoscopico, colectomia o autopsia.
Un episodio di ICD con test di laboratorio positivo a meno di 14 giorni (2 settimane) dall’ultimo test positivo non è considerato un caso di ICD ricorrente (recidiva)
Caso di ICD ricorrente (recidiva): nuovo episodio di ICD che si verifica tra 2 e 8 settimane dopo la complet a risoluzione di un precedente episodio Nella pratica clinica non è possibile distinguere tra una ricadut a (reinfezione da medesimo ceppo) e reinfezione da ceppo diverso, per cui il termine “ricorrenza” è usato come designazione per entrambi.
Un caso di ICD può essere classificato in base alla dat a e luogo di insorgenza dei sintomi. Se le informazioni sulla dat a dell’insorgenza dei sintomi non sono disponibili, può essere utilizzata la data del primo test di laboratorio positivo.
Inizio in ospedale Inizio in comunità
CDI correlata CDI di origine CDI di origine all’assistenza indeterminata comunitaria
CDI di origine comunitaria
Mc Donald,119 modificata
Caso di ICD correlat a all’assistenza, insort a in ospedale o in s t r u t t u r a r e s i d e n z i a l e ( h e a l t h c a r e - o n s e t , h e a l t h c a r e - a s s o c i ated/HO-HA CDI): patologia insort a dopo più di 48 ore dal ricovero in ospedale o dall’ingresso in una struttura residenziale.
Caso di ICD correlat a all’assistenza, insort a in comunit à (community-onset, healthcare-associated/CO-HA CDI): patologia insort a in comunit à o entro 48 ore dal ricovero in paziente dimesso da un ospedale o da una struttura residenziale da non più di 4 settimane.
181 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
Ricovero Dimissione
0 48 h 0 4 settimane 12 settimane
Prevenzione
Caso di ICD di origine comunit aria (community-associated/CA
CDI): patologia insort a in comunit à o entro 48 ore dal ricovero in paziente che non sia st ato ricoverato in ospedale/struttura sanit aria nelle precedenti 12 settimane.
Caso di ICD di origine indeterminat a (unknown association/UA CDI): patologia insort a tra 4 e 12 settimane dopo un ricovero.
3.2 Diagnosi endoscopica o radiologica
Le indagini endoscopiche e radiologiche non sono raccomandate di routine nella diagnosi di ICD.7
In caso di forme severe di ICD (es ileo, megacolon tossico) la diagnosi si basa, oltre che su criteri clinici, anche su criteri radiologici (RX, TAC dell’addome); nella colite pseudomembranosa la diagnosi può essere endoscopica e/o istopatologica.4,120
3.3 Diagnosi di laboratorio
3.3.1 Il paziente target
I pazienti che present ano diarrea inspiegabile, di nuova insorgenza, con ≥3 scariche di feci non formate nelle 24 ore, rappresent ano il t arget preferito per il test di laboratorio.4
Il numero e la frequenza delle scariche diarroiche richiesti per giustificare l’esecuzione del test di laboratorio per la ricerca di CD sono andati diminuendo negli ultimi 40 anni. Tedesco et al. nel 1974 indicavano diarrea >5 scariche di feci liquide al giorno;121 Teasley et al. nel 1983 >6 scariche di feci liquide in 36 ore;122 Fekety et al nel 1989 >4 scariche di feci liquide al giorno per almeno 3 giorni;123 Johnson et al. nel 2013 ≥3 scariche di feci liquide in 24 ore 124 Utilizzando quest’ultima definizione di diarrea, Dubberke et al. e Peterson et al. hanno analizzato la presenza di sintomi in pazienti le cui feci venivano sottoposte al test per la ricerca di CD.125,126 Peterson et al. dimostrarono che il 39% dei pazienti non present ava i criteri clinici definenti la diarrea, per cui veniva escluso da ulteriori analisi.126 Dubberke et al., utilizzando la medesima definizione di diarrea (≥3 scariche di feci tipo 6 o 7 secondo la scala di Bristol127 nelle 24 ore) o diarrea e dolore addominale crampiforme riferito dal paziente, hanno dimostrato che il 36% dei pazienti non present avano i criteri clinici definenti la diarrea, ma non uscivano dallo studio 125 Gli autori segnalano che, anche in presenza di sintomi clinici di diarrea, ci può essere un problema clinico confondente, come l’utilizzo di lassativi, che è st ato individuato nel 19% dei casi nelle 48 ore prima dell’esecuzione del test.125
3.3.2 I test disponibili e loro indicazioni
Esiste una variet à di metodi di laboratorio per la diagnosi di ICD;128,129 questi sono in grado di rilevare dirett amente nelle feci il microrganismo oppure una od entrambe le sue maggiori tossine (A e B) Nella t abella che segue sono elencati i test di laboratorio in ordine decrescente di sensibilit à analitica.
Coltura tossigenica (toxigenic culture, TC): prevede la semina del campione, previo arricchimento, su terreni se-
lettivi/differenziali: l’identificazione di specie si avvale di semplici criteri morfologici e “organolettici” (aspetto delle colonie, odore caratteristico) È ritenuto il test più sensibile e anche specifico a condizione che venga saggiat a la capacit à degli isolati di produrre tossine. A causa del tempo richiesto (3-5 giorni per coltura più identificazione) non è indicat a quale test di screening. L’esecuzione della coltura può tutt avia permettere di fare diag n o s i d i I C D n e i c a s i i n c u i i t e s t i m m u n o l o g i c i o molecolari per la ricerca della tossina siano risult ati negativi ed ha comunque una insostituibile valenza epidemiologica.4
Amplificazione di acido nucleico (nucleic acid amplification test, NAAT): il test ha iniziato ad apparire in letteratura nei primi anni ’90 e la prima piatt aforma autorizzat a dalla Food and Drug Administration (FDA) negli St ati Uniti non è st at a disponibile fino al 2009.128 Sono disponibili oggi almeno 12 piatt aforme commerciali in grado di rilevare una varietà di bersagli genetici: tcdA, tcdB, tcdC, cdtA e RNA ribosomiale (rRNA) 16S. L’automazione delle fasi di estrazione, amplificazione e lettura, insieme al tempo di esecuzione intorno ad un’ora, ne fanno il test diagnostico ideale 4,130
G l u t a m m a t o d e i d r o g e n a s i ( g l u t a m a t e d e h y d r o g e n a s e , GDH): consiste nella ricerca del cosiddetto “antigene comune”, indice di presenza di CD, sia tossigenico che non. Il test è dot ato di buona sensibilit à ma bassa specificit à, per cui, in caso di positivit à, richiede conferma con un test più specifico, in grado di evidenziare la presenza delle tossine A e B. Rappresent a il primo test di screening negli algoritmi diagnostici a 2 o 3 step che lo combinano con il test della tossina e/o con il test molecolare per la rilevazione del gene della tossina 4,128 Ricerca delle tossine mediante coltura di tessuti e test di n e u t r a l i z z a z i o n e ( c e l l c y t o t o x i c i t y n e u t r a l i z a t i o n a s s a y , CCNA): ritenut a il gold st andard per sensibilit à e specificità, presenta alcuni inconvenienti che ne hanno limitato la diffusione (necessit à di linee cellulari, scarsa st andardizzazione, TAT > 48 ore).4
Test di laboratorio per diagnosi di infezione da Cdifficile4
TestSensibilitàSpecificitàTarget Coltura Alta Bassaa Forma tossinogenica vegetativa (TC) o spore
Amplificazione Alta Bassa/media Acido nucleico di acido nucleico (NAAT )
Glutammato Alta Bassaa Antigene comune deidrogenasi di CD (GDH)
Neutralizzazione Alta Alta Tossine libere della citotossicità di CD in coltura cellulare (CCNA)
Immunoanalisi Bassa Media Tossine libere enzimatica delle di CD tossine A e B (EIA)
aDeve essere combinato con un test per la ricerca delle tossine
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 182
e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Ricerca delle tossine A e B con metodiche immunoenzimatiche (enzyme immunoassay, EIA): mediamente sensibile (con notevole variabilit à tra i test in commercio), è dot ato di buona specificit à; per la sua praticit à e affidabilit à è il test attualmente più diffuso nei laboratori.126 L’utilizzo di questo test come unico strumento per la diagnosi di infezione da CD è tutt avia criticato per due motivi: ha sensibilit à meno elevat a rispetto alla ricerca dell’antigene e le tossine si degradano piuttosto rapidamente se il campione non viene conservato a 2°-8°C.4
A causa delle limit azioni inerenti a ciascun metodo, sono st ate proposte numerose combinazioni di test diagnostici di laboratorio, che, in genere, prevedono due metodi in sequenza, di cui il primo più sensibile e il secondo più specifico (two step workup).3,4,131
Gli approcci di seguito elencati sono ritenuti accett abili: ricerca dell’antigene comune (GDH) e successiva conferma dei risult ati positivi mediante ricerca delle tossine
A e B (EIA); ricerca dell’antigene comune (GDH) e successiva conferma dei risult ati positivi mediante NAAT;161 ricerca dell’acido nucleico (NAAT) e successiva conferma dei risult ati positivi mediante ricerca delle tossine A e B (EIA); ricerca dell’antigene comune (GDH) e delle tossine A e B (EIA); successive indagini molecolari (NAAT) in caso di risult ati discordanti; ricerca dell’antigene comune (GDH) e delle tossine A e B (EIA); successiva coltura tossigenica (TC) in caso di risult ati discordanti.
Se in una istituzione esistono criteri condivisi tra clinici e laboratorio per il triage dei campioni per la diagnosi di ICD (es non vengono inviati campioni di feci di pazienti che assumono lassativi e vengono inviati i campioni di pazienti con ≥3 scariche di feci non formate nelle 24 ore), secondo le linee guida IDSA,4 è proponibile un approccio single step basato solamente su test NAAT.
Per scopi epidemiologici, almeno in caso di positivit à della ricerca dirett a delle tossine nelle feci, si raccomanda di eseguire la coltura su idonei terreni selettivi/differenziali La tipizzazione dei ceppi isolati, da eseguire mediante tecniche genotipiche biomolecolari, presso centri di riferimento, è raccomandat a solo nei seguenti casi: aumento dell’incidenza dei casi di ICD o elevata endemia; aumento della gravit à o del numero di complicanze; aumento della mort alit à associat a; aumento d’incidenza delle recidive.
Se o quando eseguire il test per la ricerca di CD è intrinsecamente legato all’accuratezza del metodo impiegato. L’uso ripetuto di test con specificit à sub-ottimale ha elevat a possibilit à di generare falsi positivi. Inoltre, alcuni studi hanno dimostrato che il vant aggio diagnostico di ripetere il test entro 7 giorni è circa del 2% 132,133 Quindi, IDSA-SHEA3 consigliano di non ripetere il test (entro 7 giorni) durante lo stesso episodio di diarrea e di non eseguirlo nei pazienti asintomatici.
Il test per la ricerca di CD non va utilizzato per st abilire l’efficacia del tratt amento: >60% dei pazienti può rimanere positivo anche dopo una terapia efficace.134,135
Il t asso di colonizzazione da CD tra i neonati asintomatici può superare il 40% ed è più elevato tra i neonati ospedalizzati 136 Sebbene il t asso di colonizzazione diminuisca durante il primo anno di vit a, nel 15% dei bambini di 12 mesi possono essere rilevate ancora tossine.137 Per questo, quando si esegue un test in neonati e bambini, c’è un sost anziale rischio di ottenere un risult ato falso positivo. IDSA-SHEA consigliano di non eseguire di routine il test in neonati o bambini di et à ≤12 mesi con diarrea, ma solo se vi è evidenza di colite pseudomembranosa o megacolon tossico, oppure in caso di diarrea clinicamente significativa, dopo aver escluso altre cause. Anche i bambini tra 1 e 2 anni d’et à non dovrebbero essere sottoposti di routine al test, che dovrebbe essere eseguito solo una volt a escluse altre cause di diarrea. Nei bambini di et à ≥ 2 anni il test dovrebbe essere eseguito in caso di diarrea prolungat a o in peggioramento, in presenza di fattori di rischio per ICD: malattia infiammatoria cronica intestinale, condizioni di immunocompromissione, recente cont atto con il servizio sanit ario o recente somministrazione di antibiotici.
3.3.3 Protocollo diagnostico e comunicazione dei risultati
Al fine di scongiurare risult ati falsi negativi si raccomanda di osservare scrupolosamente le corrette modalit à di raccolt a, conservazione e trasporto del campione (fase preanalitica).
Campioni idonei: feci diarroiche (che assumono la forma del contenitore - scala di Bristol 5-7). Applicando l’algoritmo proposto, di norma, l’esame su un campione è sufficiente Tutt avia, a fronte di un primo risult ato negativo in presenza di forte sospetto clinico di ICD può essere utile ripetere l’indagine, informando il laboratorio di Microbiologia, che potrebbe utilizzare un diverso iter diagnostico.
Campioni non idonei: t ampone rett ale e feci formate (scala di Bristol 1-4), eccetto il caso di sospetto ileo associato a CD
Trasporto e conservazione del campione: inviare in laboratorio il campione di feci entro 1 ora dall’emissione Quest a indicazione temporale è strett amente collegat a con l’esigenza priorit aria di effettuare la diagnosi nel più breve tempo possibile Per opportuna conoscenza, comunque, si segnala che, ove necessario, il campione di feci conservato a +4°C per non più di 48 ore mantiene l’integrit à delle tossine
Accesso al laboratorio: il laboratorio deve essere in condizioni di eseguire il test sette giorni su sette e 24 ore su 24, almeno come ricerca dell’antigene. Il tempo di rispost a deve essere il più breve possibile; il risult ato di un eventuale test positivo deve essere comunicato tempestivamente (sia telefonicamente che telematicamente) all’Unità Operativa e al personale addetto al controllo delle infezioni, così come la richiest a di effettuare ulteriori controlli in caso di esito dubbio
183 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
3.3.4 Tipizzazione dei ceppi isolati
Si raccomanda di eseguire la coltura su idonei terreni selettivi/differenziali per scopi epidemiologici almeno in caso di positivit à della ricerca dirett a della tossina nelle feci.
La tipizzazione dei ceppi isolati, da eseguire mediante tecniche biomolecolari presso centri di riferimento, è raccomandat a solo nei seguenti casi:
aumento dell’incidenza dei casi di ICD o elevat a endemia;
aumento della gravit à o del numero di complicanze; aumento della mort alit à associat a; aumento di incidenza delle recidive.
4. Strategie per la sor veglianza e il controllo delle ICD
Per minimizzare l’esposizione a C difficile è richiesto un approccio multifattoriale; è bene not are che diverse metodologie possono essere più o meno efficaci in contesti differenti, in rapporto all’epidemiologia ed alle risorse locali.3,4
In ogni caso, le strategie di controllo raccomandate hanno l’obiettivo di identificare tempestivamente il patogeno, isolare e tratt are efficacemente i pazienti affetti da ICD, al fine di ridurre la disseminazione delle spore e prevenire i casi secondari, nonché di minimizzare i fattori di rischio prevenibili attraverso l’applicazione di protocolli di best practice per l’adozione di corrette procedure comport ament ali, l’implement azione di adeguate misure di sanificazione ambient ale e di una corrett a politica antibiotica 136,137
Gli interventi da porre in atto per la prevenzione sono: diagnosi tempestiva; sorveglianza attiva; formazione ed informazione; isolamento; igiene delle mani; igiene ambient ale; antibiotic stewardship
4.1 Diagnosi tempestiva
Per ridurre il rischio di trasmissione di CD ad altri pazienti/residenti è essenziale che i casi sintomatici vengano identificati tempestivamente:
effettuare pront amente le indagini microbiologiche per la ricerca di CD tossigeno; sottoporre al test solo pazienti sintomatici. Tra i pazienti ricoverati, devono essere sottoposti al test i soggetti che present ano:
diarrea al ricovero non attribuibile a causa not a; diarrea insort a entro le prime 48 ore, se dimessi da un ospedale da non più di 4 settimane o se provenienti da RSA o case protette; diarrea insort a dopo almeno 2 giorni di ricovero
Tra i pazienti ambulatoriali, devono essere sottoposti al
test i soggetti con diarrea, dimessi da un ospedale da non più di 4 settimane o provenienti da RSA o case protette.
Eseguire il test per la ricerca di CD tossigeno solo su campioni di feci ottenute in corso di diarrea, quindi su campioni di feci non formate. Solo in caso di sospetto ileo da CD si effettua la ricerca su feci formate Si raccomanda di non effettuare la ricerca nei campioni di feci di soggetti asintomatici.
Considerare la ripetizione del test in caso di negativit à della ricerca delle tossine A e B in presenza di un forte sospetto clinico (possibile scarsa sensibilit à del test).
Quando si sospett a una recidiva di ICD, ripetere il test per CD, ma escludere altre cause possibili di diarrea.
Dopo il tratt amento non eseguire il test di conferma della guarigione.
Conservare i ceppi di CD tossigeno isolati, specialmente in presenza di un quadro clinico grave di malattia o nelle situazioni in cui si verifichi una epidemia; questo, infatti, consente di poter effettuare la tipizzazione, ove necessario, anche retrospettivamente.
4.2 Sor veglianza attiva
È vivamente raccomandato il mantenimento di una sorveglianza attiva. Tutti gli ospedali dovrebbero assicurare l’inclusione di CD tra i patogeni per i quali è attiva la sorveglianza dei microrganismi “sentinella”.4
La segnalazione di test positivi per CD deve essere inoltrat a ai clinici del reparto che hanno richiesto il test e alle figure addette al controllo delle infezioni.3 È import ante garantire la tempestivit à della segnalazione, per consentire l’attivazione immediat a delle misure di isolamento e l’eventuale indagine epidemiologica 140 Quale che sia la metodica di comunicazione adott at a (dirett a, per telefono, altro), bisogna registrare: giorno e ora della segnalazione, a chi viene fornito il risult ato, quale è il risult ato, gli eventuali provvedimenti richiesti.
L’adozione di un sistema di sorveglianza delle ICD consente di misurare in ogni struttura sanit aria il loro impatto ed anche di misurare l’efficacia o meno degli interventi adott ati È quindi necessario che ogni struttura sanit aria definisca una propria modalit à di sorveglianza delle ICD coinvolgendo anche specifiche unit à operative, l’intera struttura o la rete assistenziale.
In base ai risult ati della ricerca di CD tossigeno, è fondament ale rilevare per Ospedale/gruppi di reparti (es chirurgie, lungodegenze)/singola unit à operativa, l’incidenza di ICD e la soglia superat a per valut are la necessit à di attuare misure di controllo supplement ari.
I casi possono essere riport ati come: eventi individuali: offrono l’opportunit à di raccogliere dati aggiuntivi che possono consentire attivit à di revisione delle procedure operative, di ricerca, ecc ; t assi di incidenza di ICD (numero di casi/10.000 giornipaziente per le HO HA CDI, numero di casi/1 000 pazienti ricoverati per le CO HA CDI) nell’unit à di tempo di interesse.4
È import ante porre attenzione alle variazioni della frequenza, delle complicanze (comprendendo le recidive della
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 184
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
malattia) e della gravit à di ICD in quanto potrebbero indicare la presenza di nuovi ceppi.138,141
In accordo con la normativa,142 le strutture sanit arie sono tenute alla notifica delle ICD alla struttura prepost a dell’Azienda sanit aria competente per territorio, con riferimento alla definizione di caso possibile, probabile o confermato, la quale deve poi provvedere a caricarla sulla piatt aforma del Sistema PREMAL
In It alia non è ancora attivo un Sistema di sorveglianza nazionale delle ICD, ma nel 2019 è st ato avviato il progetto “Sostegno alla Sorveglianza delle infezioni correlate all’assistenza anche a supporto del PNCAR”, finanziato dal Centro nazionale per la prevenzione e il Controllo delle Malattie (CCM) e coordinato dall’Istituto Superiore di Sanit à (ISS), che prevede la predisposizione di un sistema nazionale dedicato alla sorveglianza delle ICA, inclusa la sorveglianza delle ICD. La fase pilot a della sorveglianza delle ICD si svolge nel periodo 2022-2023, basandosi sul protocollo operativo proposto dall’ECDC, e coinvolge un numero rappresent ativo di strutture ospedaliere pubbliche it aliane. Durante la sorveglianza pilot a vengono raccolti dati epidemiologici e microbiologici. Questi ultimi sono forniti dall’analisi (caratterizzazione e tipizzazione molecolare) dei ceppi inviati all’ISS dalle strutture ospedaliere partecipanti.
4.3 Formazione-informazione
Una raccomandazione trasversale a molte linee guida in tema di prevenzione e controllo delle infezioni correlate all’assistenza riguarda l’educazione 3 La forza intrinseca della raccomandazione è dat a da una significativa correlazione tra formazione/informazione e successiva riduzione del rischio; quest a risult a connessa alla modificazione dei comport amenti del personale sanit ario e degli studenti, ma anche del personale afferente a ditte appalt ate, dei visit atori, delle persone che, con vari ruoli, si prendono cura del paziente
a Operatori
La formazione indirizzat a al personale che opera nelle Unit à Operative deve fornire informazioni/indicazioni in merito a:
• origine della malattia e meccanismi patogenetici;
• potenziali serbatoi di infezione, cont aminazione ambient ale, modalit à di trasmissione;
• procedure evidence-based per l’igiene delle mani e la decont aminazione delle superfici;
• tratt amento della biancheria;
• misure di controllo delle infezioni, con particolare rig u a r d o a l l e p r e c a u z i o n i d a c o n t a t t o e a l l ’ u s o d e i guanti.
La formazione deve essere rivolt a al personale sanit ario (medici, infermieri, fisioterapisti, ecc.) e non sanit ario, in particolare a quello coinvolto negli interventi di pulizia
La formazione/informazione deve raggiungere anche il personale che opera in servizi centrali o appalt ati (pulizie, lavanderia) A t al fine è utile un collegamento con gli Uffici Amministrativi di riferimento nella struttura.
L’allegato B propone una modalit à di approccio strutturat a in merito alla formazione degli operatori sanit ari su CD.
b. Paziente, familiari, ecc.
Per un intervento efficace, la informazione/formazione deve essere rivolt a anche a tutti coloro che, a vario titolo, hanno rapporti con il paziente (parenti, visit atori, personale non sanit ario che si prende cura del paziente)
Ove possibile, il paziente stesso deve essere corrett amente informato in merito alle caratteristiche della patologia da cui è affetto e alle precauzioni da cont atto da applicare sistematicamente per prevenire la disseminazione di spore; un impegno particolare si deve porre sugli aspetti priorit ari, specie sulla esigenza di una appropriat a igiene delle mani, in generale e nei momenti critici (dopo l’uso dei servizi igienici, prima di lasciare la st anza, prima di mangiare)
L’attivit à formativa/informativa dovrebbe essere support at a dall’utilizzo di dépliant esplicativi che, in modo sintetico, con linguaggio semplice e preferibilmente con supporto visivo di illustrazioni, diano indicazioni sulle misure di prevenzione raccomandate (allegato C)
Nell’ambito delle attivit à informative/educative indirizzate ai visit atori, sarebbe opportuno che le strutture ospedaliere indicassero nelle norme locali (ad esempio nella Guida all’utente, che viene normalmente consegnat a all’ingresso in ospedale) che soggetti che present ano diarrea non dovrebbero visit are pazienti in ospedale.
4.4 Isolamento
La tempestivit à è un aspetto molto import ante nelle misure di controllo delle infezioni; per questo è vivamente raccomandato che le precauzioni per ICD vengano implement a t e i n b a s e a l l a p r e s e n z a d i s i n t o m i , s e n z a a t t e n d e r e i risult ati dei test In uno studio canadese gli ospedali che si attenevano a questa regola non hanno registrato focolai/epidemie lungo il corso di un anno 143
IDSA-SHEA3 raccomandano di sistemare il paziente con ICD in st anza singola con servizi igienici dedicati; in caso di numero limit ato di st anze singole, dare la priorit à a pazienti con incontinenza fecale; se necessario, costituire una coorte di pazienti tutti infetti dallo stesso microrganismo
Come regola generale, ai pazienti con diarrea dovrebbe essere riservato un servizio igienico dedicato Anche se molte fonti indicano che in assenza di un servizio dedicato si può utilizzare una comoda personale, non si può sottovalut are il fatto che ciò comport a varie difficolt à gestionali, legate sia alla generale carenza di spazi da dedicare ad un idoneo posizionamento della comoda sia alla difficolt à di procedere sistematicamente in corso d’uso al suo corretto tratt amento. Per questo si ritiene opportuno raccomandare di assegnare, nei limiti del possibile, un servizio igienico al paziente deambulante con ICD.
Con t ale premessa, in presenza di pazienti deambulanti con diagnosi di ICD si possono configurare tre situazioni: a. disponibilit à di camera singola con servizio igienico: la camera singola è sempre consigliat a, ma è particolar-
185 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
mente raccomandat a quando il paziente è incontinente, ha un basso livello igienico e ci si attende che non sia collaborativo nell’osservanza delle misure di controllo previste;
b. non è disponibile la st anza singola: dedicare al paziente con ICD l’intera st anza a più letti oppure riservargli il servizio igienico della st anza. In questo secondo caso, in corso di assistenza nel passaggio dal paziente infetto a quello non infetto provvedere al cambio dell’abbigliamento protettivo e all’igiene delle mani;144
c sono contemporaneamente presenti più pazienti con ICD: più pazienti con ICD possono essere collocati nella stessa st anza (coorte di pazienti) L’isolamento di coorte non deve essere adott ato tra pazienti colonizzati/infetti con microrganismi diversi (es. CD, VRE, MRSA).
L’isolamento di coorte consente di:
delimit are l’area potenzialmente cont aminat a facilit ando le operazioni di pulizia e la verifica del loro livello di efficacia; dedicare personale formato o ben addestrato in merito alle misure di controllo per minimizzare il rischio di infezioni crociate ad altri pazienti.
Se nessuna delle soluzioni prospett ate è ritenut a percorribile, si consideri l’uso della comoda personale, definendo a priori la sua localizzazione e gestione per evit are problemi e rischi agli altri pazienti
Per i pazienti allett ati utilizzare padella e/o pannoloni. La padella deve essere monouso o dedicat a; nel secondo caso, se non è protett a da sacchetti igienici monouso, deve essere tratt at a in macchine lavapadelle.
I sacchetti igienici monouso (hygienic bags), dot ati di propriet à assorbenti, vanno applicati sulla padella o sul vaso della comoda e, dopo l’uso, chiusi e smaltiti Essi rappresent ano una nuova metodica, che ha il potenziale di limit are la dispersione di spore con un contenimento dei rifiuti all’origine 145
Sacchetti igienici e pannoloni devono essere smaltiti come rifiuti a rischio infettivo
IDSA-SHEA4 e ESCMID3 raccomandano l’utilizzo di guanti e camici monouso da parte del personale sanit ario prima di entrare nella st anza e di attuare misure assistenziali al paziente con ICD.
Le precauzioni da adott are in presenza di pazienti, autosufficienti o allett ati, con ICD sono di tipo organizzativo e operativo Si indicano sinteticamente le principali: apporre sulla port a della st anza una segnaletica idonea ad indicare l’isolamento da cont atto e le relative precauzioni da adott are (allegato C2); se possibile, affidare l’assistenza al paziente ad una equipe dedicat a e format a; in assenza di ciò, bisogna comunque garantire che il personale addetto sia ben addestrato in merito alle misure di prevenzione; usare idonei dispositivi di protezione/mezzi di barriera (guanti e sovracamice con maniche lunghe); i DPI devono essere indossati per ogni cont atto con il paziente e/o l’ambiente (in particolare superfici di facile cont aminazione, superfici del servizio igienico); usare preferibilmente materiali monouso, da eliminare subito dopo l’impiego in appositi contenitori per rifiuti
a rischio infettivo, posti all’interno della st anza; non rilevare la temperatura per via rett ale; disporre all’interno della st anza un corredo personalizzato di dispositivi medici e altro materiale destinato all’assistenza: sfigmomanometro (con copribracciale mon o u s o ) , t e r m o m e t r o ( p r e f e r i b i l m e n t e a i n f r a r o s s i , front ale o auricolare), sedia a rotelle, padella, pappagallo, biancheria di ricambio del letto, ecc ; se alcuni dispositivi/materiali in uso devono essere condivisi con altri pazienti, sottoporli ad un accurato intervento di pulizia e disinfezione dopo l’utilizzo (cfr gestione dei dispositivi);
nel corso di pratiche assistenziali porre attenzione ad evit are la dispersione di cont aminanti nell’ambiente (ad esempio, evit are il cont atto delle mani guant ate con le superfici circost anti);
concentrare le attivit à assistenziali (rilevazione parametri vit ali, medicazioni, svuot amento sacche drenaggio, ecc.), ove possibile, in momenti ben definiti della giornat a e procedere immediat amente alla eliminazione dei rifiuti, all’allont anamento della biancheria sporca, secondo le regole locali per materiali a rischio infettivo, ed alla detersione e disinfezione delle superfici potenzialmente cont aminate.
È misura utile la predisposizione di una check-list per l’allestimento della st anza di isolamento e del relativo servizio igienico
I trasferimenti del paziente con ICD devono essere limit ati a quelli necessari per esigenze diagnostico-terapeutiche
In caso di spost amento del paziente si deve: avvisare il personale del servizio/UO ricevente, per evitare st azionamenti non opportuni; igienizzare le mani del paziente con acqua e sapone prima che lasci la st anza di degenza; dot are il paziente trasport ato, se incontinente, di dispositivi (es pannoloni) per ridurre il rischio di cont aminazione ambient ale; segnalare le condizioni del paziente al personale addetto al trasporto, per mettere in atto gli opportuni interventi di pulizia e disinfezione sui dispositivi utilizzati per il trasporto; in caso di trasferimento ad altra struttura, anche dopo risoluzione della patologia, segnalare per iscritto la ICD, al fine di consentire il proseguimento di una attent a sorveglianza clinica (elevat a frequenza di recidive).
Anche se ci sono evidenze che i pazienti con ICD possono continuare ad eliminare spore nelle feci dopo la risoluzione dei sintomi, IDSA-SHEA3 indicano che è sufficiente mantenere le precauzioni da cont atto sino a 48 ore dopo l’ultima scarica diarroica Il razionale di quest a indicazione è legato al fatto che il rischio di trasmissione è molto ridotto in assenza di diarrea e risult a generalmente governabile con l’applicazione delle misure precauzionali st andard e, in particolare, di un’attent a igiene delle mani da parte di tutti coloro che, a vario titolo, si occupano dell’assistenza del paziente (personale di assistenza, di supporto, visit atori).
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 186
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Laddove si ravvisassero situazioni di difficile governabilit à, la scelt a locale può essere quella di mantenere l’isolamento da cont atto sino alla dimissione 146
In alcune situazioni assistenziali, soprattutto in presenza di pazienti cronici affetti da ICD, potrebbe risult are difficile garantire la disponibilit à di personale dedicato e formato. Premesso che t ale requisito è critico per il successo degli interventi e rimane pert anto un obiettivo da perseguire, come misura temporanea è almeno necessario assicurare le seguenti modalit à organizzative: a la presenza di una procedura aziendale che specifichi le misure di prevenzione e controllo da adott are tempestivamente in presenza di un caso sospetto o accert ato di ICD;
b. il rapido coinvolgimento del CIO e l’intervento di personale infermieristico specialist a nel rischio infettivo per verificare, attraverso il sopralluogo, l’adozione delle misure raccomandate, la presenza di eventuali criticit à e per effettuare eventuali re-training formativi sul campo.
4.5 Igiene delle mani
La cont aminazione delle mani di operatori sanit ari e pazienti con CD (forme veget ative e/o spore) rappresent a una import ante via di trasmissione. È st at a individuat a una forte correlazione tra il livello di cont aminazione delle mani e l’intensit à della cont aminazione ambient ale, pert anto entrambi rappresent ano due componenti fondament ali dei programmi mirati a prevenire la trasmissione di questo patogeno.
Un corretto approccio all’igiene delle mani prevede tre tipologie di intervento.
Il primo è di tipo strutturale e richiede di verificare se la dot azione/localizzazione di lavandini è idonea (es presenza di un sistema di erogazione dell’acqua di tipo notouch) per favorire una corrett a implement azione della procedura nella/e st anza/e da assegnare a pazienti con ICD In caso negativo è necessario segnalare la problematica all’attenzione di CIO/ Direzione Sanit aria per valut are nuove eventuali possibili soluzioni.
Il secondo è di tipo procedurale e richiede di definire in quali momenti assistenziali e con quale tempistica attuare l’igiene delle mani e indossare i guanti
Igiene delle mani: quando?
• Prima e dopo ogni cont atto con il paziente;
• passando da una procedura assistenziale all’altra sullo stesso paziente;
• prima di una manovra asettica;
• dopo il cont atto con l’ambiente circost ante del paziente (unit à del malato: letto, comodino, test aletto, pulsante di chiamat a, ecc.) e con tutte le superfici dei servizi igienici;
• dopo il cont atto con materiali potenzialmente cont aminati;
• dopo la rimozione dei guanti;
• prima di lasciare la st anza.
Igiene delle mani: con quali prodotti?
IDSA-SHEA4 e ESCMID 3 raccomandano di prediligere il lavaggio con acqua e soluzione detergente o detergente-antisettica alla frizione alcolica.
Il CD può essere presente allo st ato veget ativo e/o di spora e i ceppi tossigenici sono i maggiori produttori di spore.
Gli antisettici hanno spettro d’azione limit ato e agiscono solo sulle forme veget ative. Per questo, nei casi di sospett a/accert at a diarrea infettiva da CD, l’igiene delle mani dopo l’avvenuto cont atto con il paziente infetto o con superfici o materiali potenzialmente cont aminati deve essere effettuat a mediante lavaggio con:
acqua e soluzione detergente oppure acqua e soluzione detergente e antisettica.
Nel primo caso l’attivit à detergente garantisce l’effetto meccanico di rimozione di materiale organico (visibile o meno) e, con questo, di una buona parte di microrganismi potenzialmente presenti, comprese le spore; nel secondo l’effetto meccanico di rimozione, assicurato dal detergente, è accompagnato da quello antisettico, che agisce sulle forme veget ative eventualmente presenti.
La frizione alcolica non ha indicazione priorit aria in presenza di diarrea di origine infettiva perché l’alcol è efficace sulle forme veget ative, ma non sulle spore che sopravvivono al tratt amento e che possono poi essere trasmesse. La frizione alcolica ha tutt avia corrett a indicazione:
prima di indossare i guanti per il cont atto con il paziente o l’ambiente;
in particolari situazioni, dopo aver rimosso i guanti, purché la mano non sia visibilmente sporca. Quest a seconda indicazione, che ha evidenti margini di incertezza di efficacia, deve essere considerat a una alternativa solo in presenza di obiettive difficolt à ad esplet are la procedura st andard (es per carenza di lavandini)
Ovviamente, se la mano è visibilmente sporca deve essere sempre attuato il lavaggio con soluzione detergente o detergente-antisettica.
Guanti È raccomandato l’utilizzo di guanti protettivi monouso quando si prevede il cont atto diretto con il paziente e con i suoi liquidi biologici potenzialmente infetti come misura precauzionale aggiuntiva, e non sostitutiva, all’igiene delle mani.
È quindi raccomandato il loro impiego al fine di:
• ridurre la cont aminazione transitoria delle mani degli operatori, fattore di rischio per la cont aminazione crociat a (cross-cont amination);
• ridurre il rischio di acquisizione dell’infezione da parte del personale di assistenza attraverso il cont atto diretto con il paziente infetto o con superfici ambient ali cont aminate
È raccomandato di rimuovere pront amente i guanti cont aminati dopo il loro utilizzo, eliminandoli come materiale potenzialmente infetto, prima di entrare in cont atto con superfici non cont aminate; deve seguire un immediato lavaggio delle mani con acqua e soluzione detergente o detergente-antisettica.
187 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Il terzo intervento è di tipo formativo/informativo/educazionale in merito ai comport amenti e deve essere indirizzato sia al personale addetto che a pazienti, visit atori, caregiver, ecc.
4.6 Igiene ambientale
È largamente document ato che in presenza di malattia da CD si ha cont aminazione ambient ale (forme veget ative e spore); il problema è particolarmente critico se il paziente ha abbondanti scariche di feci liquide o è incontinente. La cont aminazione può riguardare oggetti nelle vicinanze del paziente (campanello di chiamat a, telefono, ecc.), l’area circost ante (sponde del letto, comodino, sedie, ecc.), dispositivi medici/materiali in uso, superfici ambient ali di maggior cont atto (maniglie, pavimenti, ecc.) e, in particolare, i servizi igienici (superficie WC, bidet, superficie lavandino, padella, pappagallo, ecc.). È noto altresì che vi è una forte correlazione tra cont aminazione ambient ale e trasmissione di C difficile in ambito sanit ario 147
Le forme veget ative di CD sopravvivono nell’ambiente per breve tempo (circa 15’) su superfici asciutte, ma possono rimanere vit ali per alcune ore in presenza di umidit à; le spore batteriche, invece, sono alt amente resistenti e, in assenza di un adeguato tratt amento, possono sopravvivere per periodi di tempo anche molto lunghi (mesi). La cont aminazione ambient ale è spesso all’origine della trasmissione di CD, che si può verificare anche a dist anza di tempo se non vengono effettuate adeguate misure di sanificazione delle superfici ambient ali
L’attenzione alla decont aminazione ambient ale ha quindi un ruolo cardine negli interventi di prevenzione
Le forme veget ative di CD sono sensibili ai comuni disinfett anti ambient ali e vengono facilmente eliminate. Molto più difficile è garantire attivit à sulle spore perché, dovendo spesso effettuare il tratt amento in presenza del paziente, le problematiche di tipo tossicologico e organizzativo non consentono di utilizzare disinfett anti di livello alto a concentrazioni e per tempi di cont atto sporicidi Per questo, anche nell’igiene ambient ale ha un ruolo import ante una adeguat a detersione preliminare, che garantisca la rimozione meccanica di materiale organico (sporco) e con questo di una elevat a quot a di cont aminante, e che deve essere sostenut a/accompagnat a dalla disinfezione
È fondament ale tener presente che l’uso di disinfett anti non efficaci e di concentrazioni non adeguate può favorire la sporulazione e quindi la persistenza del batterio nell’ambiente.148
La letteratura non dà indicazioni univoche in merito alle modalit à di sanificazione routinaria più efficace; si propongono qui di seguito proposte operative che, al momento attuale, sono considerate di buona affidabilit à, in base a studi effettuati e/o ad un razionale teorico.
La detersione (detergente+acqua+sfregamento, seguiti da risciacquo) rappresent a una misura necessaria, ma non sufficiente, per la rimozione delle spore.
I cloroderivati sono i disinfett anti di scelt a in presenza di infezioni da CD. La concentrazione d’uso indicata è di al-
meno 1 000 ppm 147 Concentrazioni superiori (5 000 ppm) risult ano di difficile applicazione quando si opera in presenza di pazienti Per i diversi cloroderivati disponibili si propongono alcune considerazioni:
• le soluzioni di candeggina (ipoclorito commerciale) non sono sempre affidabili per quanto riguarda la concentrazione, che è soggett a a decadimento soprattutto se le condizioni di conservazione (tempo, temperatura, esposizione alla luce) non sono corrette;
• le soluzioni di sodio ipoclorito registrate come PMC e dotate di scadenza presentano buone caratteristiche di st abilit à;
• sodiodicloroisocianurato (NaDCC) è il prodotto con il miglior profilo di st abilit à, anche in presenza di materiale organico, e con minore corrosivit à. Le concentrazioni d’uso consigliate sono uguali a quelle indicate per ipoclorito (1.000-5.000 ppm).
È possibile tratt are le superfici ambient ali utilizzando miscele di detergenti con disinfett anti, prodotti che, al tempo stesso, rimuovono lo sporco e agiscono sui microrganismi cont aminanti In presenza di CD è di prima scelt a l’associazione di un detergente con cloroderivato, garantendo le concentrazioni in cloro sopra indicate Considerato il rischio che deriva dalla sopravvivenza di spore residue e la loro resistenza, l’area interessat a deve ricevere un tratt amento in due fasi: un primo passaggio di pulizia, seguito dal risciacquo, consente la rimozione/eliminazione di una importante frazione di sporco e di cont aminanti, il secondo passaggio potenzia l’effetto di detersione e disinfezione.
Per l’uso, si inumidiscono le superfici da tratt are con il prodotto scelto, garantendo un tempo di cont atto di almeno 10 minuti per concentrazioni di 5 000 ppm o di 20 minuti per concentrazioni inferiori. È assolut amente critica la fase di detersione, cui compete di eliminare una import ante quot a delle spore presenti, facilit ando così l’attivit à del disinfett ante. È raccomandato di prolungare, per quanto possibile, il tempo di cont atto e quindi l’azione del disinfett ante, anche ripetendo l’intervento. Ceppi ipervirulenti, come il ribotipo 027, possono risult are meno suscettibili alle concentrazioni di cloro pari a 1.000 ppm, pert anto è raccomandato l’uso di concentrazioni più alte 158
Per evit are problemi di corrosivit à sui met alli a seguito di impiego ripetuto/prolungato, risciacquare con acqua le superfici met alliche disinfett ate, trascorso il tempo di cont atto previsto.
Poiché le superfici, soprattutto quelle a stretto cont atto con il paziente, possono venire ripetut amente cont aminate, è raccomandat a la ripetizione degli interventi nell’arco della giornat a (allegato D).
Il risult ato di una sanificazione ambient ale è fortemente dipendente dalle modalit à operative. Per questo, in presenza di CD, che comport a una situazione ad elevato rischio infettivo, è import ante che il personale addetto alle pulizie: sia presente in numero adeguato e con una formazione specifica: quest a deve comprendere le modalit à per il corretto utilizzo dei prodotti alle concentrazioni racco-
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 188
mandate e dei materiali, per evitare di diffondere le spore in altri locali;
venga immediat amente avvisato di una eventuale cont aminazione ambient ale con feci, che deve essere pront amente rimossa.138
Qualora il servizio di pulizie fosse appalt ato a ditt a esterna, è opportuno che nel contratto d’appalto con la ditt a stessa siano specificati sia il numero adeguato di operatori sia la necessit à di una formazione ripetut a degli stessi e di un controllo regolare per garantire la qualit à della pulizia.
Alla dimissione/trasferimento del paziente con sospett a/accert at a CDI è necessario effettuare un intervento di sanificazione di tutte le superfici ed oggetti presenti, utilizzando i prodotti sopra indicati; in quest a situazione, operando in assenza del paziente è indicato l’impiego di soluzioni di cloroderivati ad una concentrazione di 5.000 ppm È inoltre import ante che i panni utilizzati siano opportunamente ricondizionati, altrimenti è preferibile utilizzare panni monouso, anche pre-impregnati, con dimostrat a attivit à sporicida secondo lo st andard EN ISO 16615, o per il biocida lo st andard EN ISO 14347.
È altresì import ante sostituire copri-materasso, coperte e cuscini, inviandoli al lavaggio nell’apposito sacco per biancheria infett a.
Per una sistematica e corrett a implement azione degli interventi è necessario che ogni struttura predisponga una procedura in merito agli interventi di igiene ambient ale da porre in atto in presenza di CDI (allegato D).
È opportuno che l’efficacia del protocollo operativo utilizzato per la pulizia e disinfezione ambient ale sia regolarmente valut at a con osservazione dirett a, o, preferibilmente, con l’utilizzo di marker fluorescenti o con la determinazione dell’ATP, se le risorse lo consentono. I ruoli e le responsabilit à dell’applicazione dei protocolli alle apparecchiature mediche mobili, condivise tra i reparti, devono essere chiaramente definiti nelle procedure operative e l’aderenza ai protocolli regolarmente valut at a attraverso monitoraggio, come descritto in precedenza.159 Qualora il servizio di pulizie fosse appaltato a ditta esterna, è opportuno che nel contratto d’appalto con la ditt a stessa sia specificat a la necessit à di un controllo regolare per garantire la qualit à della pulizia
Negli ultimi anni per l’eradicazione di CD dall’ambiente è st ato proposto l’impiego di tecnologie di disinfezione “no-touch” Questi dispositivi utilizzano radiazioni ultraviolette o la aerosolizzazione/nebulizzazione di biocidi, come il perossido di idrogeno, per disinfett are l’ambiente Diversi studi hanno dimostrato che sono efficaci nel ridurre la presenza di spore di CD nelle st anze dei pazienti 149-151 Nessuna tecnologia “no-touch” è risult at a essere superiore ai protocolli st andard nel ridurre l’incidenza di ICD. Ci sono diversi reports che associano l’uso di tecnologie “no-touch” di disinfezione a riduzioni di ICD, ma tutti present ano almeno un limite, tra cui metodi st atistici inappropriati, altri interventi simult anei, elevat a incidenza di ICD prima dell’implement azione, ecc. Solo nello studio “BETR Disinfection”, Anderson et al hanno dimostrato una significativa riduzione delle ICD dopo l’implement azione del protocollo
st andard con la disinfezione ultraviolett a a luce pulsat a 159
IDSA-SHEA3 e ESCMID2 sostengono che al momento i dati disponibili sono troppo limit ati per trarre delle conclusioni in merito a se e quando questi metodi di disinfezione possano essere considerati componenti di un programma di prevenzione delle ICD
4.7 Gestione dei dispositivi medici e delle attrezzature
Le raccomandazioni3,138 focalizzano l’attenzione su quattro punti critici.
a In presenza di infezione da CD i dispositivi medici/attrezzature di difficile tratt amento dovrebbero essere, ove possibile, di tipo monouso.
b Alcune tipologie di dispositivi, che per loro natura non sono di facile tratt amento (es. bracciali per pressione, stetoscopi e ossimetri) dovrebbero essere di impiego personalizzato e comunque sottoposti ad accurat a pulizia/disinfezione dopo l’uso.
c Una attenzione particolare merit ano i dispositivi per la rilevazione della temperatura.
• I termometri elettronici rett ali possono avere un ruolo import ante nella trasmissione131 e quindi dovrebbero essere utilizzati solo in presenza di specifiche esigenze cliniche; in questo caso, devono essere dedicati ed essere detersi e disinfett ati con cloroderivati dopo ogni uso L’esigenza della detersione e disinfezione permane se si utilizzano con coprisonda monouso.
• È indicato l’utilizzo di altre tipologie di termometri elettronici o dei termometri timpanici a infrarossi; in ogni caso è opportuno che il termometro sia personalizzato e utilizzato con dispositivi di rilevazione monouso, per limit are il rischio di cont aminazione. d. Dispositivi medici e strument ario da riutilizzare, devono essere sottoposti, subito dopo l’uso, a decont aminazione, seguit a dalla detersione e, secondo i casi, da sterilizzazione o disinfezione con un prodotto ad attivit à sporicida, operando con concentrazioni d’uso e tempo d’azione idonei a garantire l’efficacia
Gli endoscopi gastrointestinali, dopo l’uso, sono facilmente cont aminati da spore di CD; tutt avia la corrett a applicazione delle procedure st andard di tratt amento, che prevedono detersione e disinfezione di alto livello, garantisce da possibili trasmissioni Uno studio caso-controllo retrospettivo ha infatti dimostrato che il rischio di acquisizione di ICD correlato a endoscopia è molto basso, se confront ato al rischio associato all’alterazione del microbioma intestinale causato dalla preparazione e dalla profilassi antibiotica pre-procedura 160
Un’attenzione particolare va indirizzat a alla gestione delle padelle. La termodisinfezione con l’uso di lavapadelle rappresent a una metodica diffusa nelle strutture sanit arie e assistenziali In genere, le apparecchiature in uso operano ad una temperatura massima di 90-92°C per un tempo che va da 1’45” a 2’ attuando in t al modo una disinfezione di alto livello, ma non sporicida In presenza di pazienti con ICD si consiglia di prevedere le seguenti opzioni:
189 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
adott are la padella monouso o con sacchetto igienico; adott are la padella personalizzat a ed effettuare il suo tratt amento nella lavapadelle (se presente) oppure decont aminazione/detersione, disinfezione con cloroderivati e risciacquo; alla dimissione/guarigione effettuare lavaggio e disinfezione della padella (immersa complet amente) con cloroderivato 5 000 ppm per 30 minuti, risciacquo e asciugatura.
4.8 Corretta gestione degli antibiotici
L’esposizione agli antibiotici, in terapia e/o profilassi, svolge un import ante ruolo favorente la ICD in rapporto a due aspetti: a) anzitutto, provoca alterazioni del microbiot a gastrointestinale determinando una nicchia ecologica favorevole alla proliferazione di CD, b) in secondo luogo, seleziona mut anti di CD resistenti nei confronti di clindamicina e fluorochinoloni, e si ritiene che questo rappresenti altresì un import ante fattore di virulenza 154 Attualmente gli antibiotici sono quindi considerati, insieme con il fattore “et à”, uno dei principali fattori di rischio per ICD; per questo nell’ambito della prevenzione è fondament ale adott are strategie che indirizzino ad un uso prudente degli stessi nella routine 155
Anche se la letteratura non propone dati univoci in merito al ruolo che singoli antibiotici o singole classi possono assumere nella genesi del problema, ed è spesso costituit a da studi con limiti metodologici, è opinione condivisa che alcune classi siano coinvolte più frequentemente di altre: fluorochinoloni, cefalosporine, clindamicina, penicilline associate a inibitori delle β-latt amasi, carbapenemi, aztreonam.4
Non tutti gli studi confermano un impatto significativo di politiche di riduzione selettive della prescrizione; più che l’esposizione ad una singola classe è il consumo globale di antibiotici delle singole strutture sanit arie che si propone come varabile di massimo valore predittivo.4, 156 Gli interventi che si sono dimostrati efficaci per prevenire/ridurre il rischio di ICD sono: applicare nell’istituzione una politica antibiotica prudente, restringere l’uso di farmaci di elevata efficacia a situazioni ben individuate e specifiche, informare i clin i c i s u l l ’ a n d a m e n t o d e l l e p r e s c r i z i o n i / c o n s u m i d i antibiotici;
evit are terapie di associazione, utilizzandole solo nei pochi casi in cui sono indispensabili, e limit are la durat a delle terapie;
evit are qualsiasi forma di prescrizione inappropriat a di antibiotici.
In corso di epidemia, rivalut are quanto prima possibile la politica di prescrizione antibiotica in atto nell’istituzione (principi attivi, frequenza di utilizzo, posologie giornaliere, durat a della terapia) ed evit are preferibilmente l’impiego di molecole potenzialmente più idonee a favorire ICD nei pazienti a rischio, utilizzando antibiotici nel contesto di protocolli clinici condivisi
4.9 Terapia dell’ICD
4 9 1 Prevenzione dell'ICD con probiotici
Diverse met analisi indicano che i probiotici possono essere efficaci a prevenire la ICD quando somministrati a pazienti senza storia pregressa di ICD che assumono antibiotici Tutt avia, gli studi considerati present ano delle limit azioni metodologiche, per cui al momento non ci sono dati sufficienti per raccomandare la somministrazione di probiotici per la prevenzione primaria di ICD al di fuori di studi clinici.4
4.9.2 Terapia dell'ICD
Le strategie di tratt amento dei casi accert ati di ICD, oltre alle misure restrittive e comport ament ali degli operatori sanit ari, prevedono di: sospendere quanto prima possibile ogni terapia con antibiotici; in caso di necessit à terapeutica non procrastinabile, selezionare classi potenzialmente meno implicate in casi di ICD quali aminoglicosidi, cotrimoxazolo, macrolidi, tetracicline, glicopeptidi; reintegrare liquidi ed elettroliti persi; porre il paziente in idonea aliment azione; evit are ogni tipo di farmaco antiperist altico, se non in caso di frequenze estreme di scariche; effettuare terapia antibiotica specifica.
Sebbene esist a un’associazione epidemiologica tra uso di inibitori di pompa protonica (IPP) e ICD, non ci sono prove sufficienti a dimostrare che la loro sospensione sia una misura efficace per prevenire le ICD.3
La terapia antibiotica specifica deve essere impost at a in funzione del tipo di infezione (primo episodio, recidiva) e della gravit à del caso In allegato A sono sintetizzate le raccomandazioni terapeutiche presenti nelle linee guida ESCMID1-3, IDSA/SHEA 4,5 e ASCRS.6
Il tratt amento antibiotico del primo episodio di ICD nell’adulto, forma non grave, e delle recidive fa riferimento a tre molecole: vancomicina, fidaxomicina e metronidazolo 4,5
L’Agenzia Italiana del Farmaco (AIFA - Gazzetta Ufficiale n° 38 del 16 02 16, pag 18) prevede l’uso di vancomicina, metronidazolo e fidaxomicina per il tratt amento della prima ICD e per una prima recidiva. In particolare le indicazioni prevedono:
• vancomicina: indicat a nel tratt amento della colite pseudo membranosa da C difficile associat a ad antibioticoterapia (Gazzetta Ufficiale n° 185 del 8 08 2002),
• metronidazolo: da utilizzare nel trattamento del primo episodio o della prima recidiva (se della stessa gravit à del primo evento),
• fidaxomicina: il farmaco è rimborsabile da parte del SSN (classificandolo in H) con prescrizione mediante una scheda di monitoraggio che ne limit a l’uso al tratt amento:
a. del primo episodio di ICD in pazienti intolleranti o che non rispondono alla terapia di prima scelta (vancomicina e metronidazolo) oppure in pazienti ad alto rischio di recidiva (ad es. pazienti immunocompromessi o con altre gravi patologie concomit anti);
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 190
b degli episodi di ICD successivi al primo (tratt amento delle infezioni ricorrenti da CD).
La letteratura di questi ultimi anni ha modificato le strategie di cura, limit ando l’uso del metronidazolo ed ampliando quello della fidaxomicina Secondo le linee guida internazionali di IDSA-SHEA4,5 ed ESCMID6 vancomicina e fidaxomicina sono infatti da preferire a metronidazolo, al seguente dosaggio:
fidaxomicina orale 200 mg 2 volte al giorno per 10 giorni oppure
vancomicina orale 125 mg 4 volte al giorno per 10 giorni.
Nei casi in cui non vi sia disponibilit à di fidaxomicina e vancomicina, solo nei casi di ICD non grave, si consiglia metronidazolo 500 mg 3 volte al giorno per 10 giorni.
Quando l’accesso a fidaxomicina è limit ato, essa è raccomandat a quando è elevato il rischio di recidiva di ICD: et à avanzat a del paziente (> 65 anni) e presenza di uno o più fattori di rischio (HA-CDI, ricovero negli ultimi 3 mesi, uso concomit ante di antibiotici, uso di inibitori della pompa protonica iniziato durante/dopo la diagnosi di ICD, precedente episodio di ICD).
Secondo le linee guida IDSA-SHEA4 ed ESCMID6 nelle forme gravi (forme fulminanti, ileo paralitico o megacolon tossico) dell’adulto, vancomicina orale o tramite sondino nasogastrico 125 mg 4 volte al giorno oppure fidaxomicina 200 mg 2 volte al giorno sono i regimi di prima scelt a; se è presente ileo, aggiungere vancomicina rett ale 500 mg in 100 ml di soluzione salina 4 volte al giorno. Metronidazolo endovena 500 mg 3 volte al giorno rappresent a un’alternativa, ma in associazione a vancomicina orale o rett ale 4,5
Nell’ambito della gestione delle forme gravi, nei rari casi di megacolon tossico refratt ario alla terapia, deve essere preso in considerazione il ricorso al tratt amento chirurgico: colectomia subtotale con ileostomia terminale oppure, in alternativa, ileostomia e lavaggio del colon con vancomicina 4,7
Sebbene le forme particolarmente severe possano rappresent are una vera e propria emergenza clinica, il problema gestionale più complesso è tutt avia rappresent ato dal tratt amento delle forme recidive, che possono essere espressione sia di reinfezione da ceppi differenti che di mancat a eradicazione dello stipite originario. 157
Posto che la recidiva non è definit a dalla sola positivit à della ricerca di tossine ma dall’associazione del parametro microbiologico con quello clinico, il rischio aument a esponenzialmente con il numero di episodi; esso, infatti, è stimato intorno al 20% dopo il primo evento di ICD, ma sale al 40% dopo la prima recidiva ed al 60% dopo le successive È dunque evidente come la gestione delle recidive sia un problema clinico non indifferente
Le linee guida IDSA-SHEA4,5 ed ESCMID 6 , per il tratt amento antibiotico della prima recidiva di ICD nell’adulto, fanno riferimento a vancomicina e fidaxomicina al seguente dosaggio:
vancomicina orale 125 mg 4 volte al giorno per 10 giorni oppure
vancomicina orale 125 mg 4 volte al giorno per 10-14 giorni, 2 volte al giorno per 7 giorni, 1 volt a al giorno per 7 g i
oppure
fidaxomicina orale 200 mg 2 volte al giorno per 10 giorni oppure
fidaxomicina orale 200 mg 2 volte al giorno per 10 giorni o 200 mg 2 volte al giorno per 5 giorni e a seguire 200 mg 1 volt a al giorno per 20 giorni
Se l’episodio iniziale di ICD è st ato tratt ato con fidaxomicina, prendere in considerazione l’aggiunt a di bezlotoxumab ad un tratt amento antibiotico st andard orale con vancomicina o fidaxomicina.
Nei casi di recidive plurime nell’adulto, le linee guida IDSA/SHEA4,5 ed ESCMID6 raccomandano i seguenti regimi: vancomicina orale 125 mg 4 volte al giorno per 10-14 giorni, 2 volte al giorno per 7 giorni, 1 volt a al giorno per 7 giorni, infine ogni 2-3 giorni per 2-8 settimane oppure
vancomicina orale 125 mg 4 volte al giorno per 10 giorni, seguit a da rifaximina 400 mg 3 volte al giorno per 20 giorni oppure
trapianto di microbiot a fecale (Fecal Microbiot a Transplant, FMT) dopo tratt amento antibiotico orale oppure
bezlotoxumab in aggiunt a al tratt amento antibiotico orale
Nel contesto delle terapie di supporto all’antibiotico per la gestione delle recidive, l’immunoterapia rappresent a una valida strategia. Per i pazienti con un episodio di ICD ricorrente negli ultimi 6 mesi, le linee guida IDSA-SHEA5 suggeriscono di utilizzare l’anticorpo monoclonale bezlotoxumab 10 mg/kg somministrato una volt a per via endovenosa nell’arco di 60 minuti, in contemporanea alla terapia antibiotica specifica. Bezlotoxumab può essere preso in considerazione anche per i pazienti con primo episodio di ICD e altri fattori di rischio per recidiva di ICD (per esempio et à ≥65 anni, immunocompromessi per storia o uso di terapia immunosoppressiva, ICD grave alla present azione). I dati sulla combinazione di bezlotoxumab e fidaxomicina sono limit ati La FDA raccomanda un uso cauto di bezlotoxumab nel paziente con scompenso cardiaco congestizio.
L’AIFA ha ammesso bezlotoxumab alla rimborsabilit à da parte del SSN con prescrizione mediante una “scheda di monitoraggio” che ne limit a l’uso al tratt amento dei pazienti con diagnosi microbiologica di recidiva di ICD, già in tratt amento con terapia antibiotica specifica, in presenza di almeno una tra le seguenti condizioni: soggetti di et à maggiore di 65 anni, forma severa di ICD, soggetti immunodepressi
Per quanto concerne l’et à pediatrica, il tratt amento consigliato dalle linee guida IDSA-SHEA4,5 per il primo episodio e la prima recidiva di ICD è il seguente:
metronidazolo orale 7,5 mg/kg 3-4 volte al giorno (dose massima 500 mg 3-4 volte al giorno) per 10 giorni oppure
vancomicina orale 10 mg/kg 4 volte al giorno (dose massima 125 mg 4 volte al giorno) per 10 giorni.
i , i n f i n e o g n i 2 - 3 g i o r n i p e r 2 - 8 s e t t i m a n e
o r n
191 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione
In caso di primo episodio di ICD severa/fulminante in et à pediatrica, le linee guida IDSA-SHEA4,5 consigliano vancomicina orale 10 mg/kg 4 volte al giorno (dose massima 500 mg 4 volte al giorno) con o senza metronidazolo orale 10 mg/kg 3 volte al giorno (dose massima 500 mg 3 volte al giorno) per 10 giorni
Per il tratt amento della seconda o successiva recidiva di ICD in et à pediatrica le linee guida IDSA-SHEA4,5 prevedono il ricorso a:
vancomicina orale 10 mg/kg 4 volte al giorno (dose massima 125 mg 4 volte al giorno) per 10-14 giorni, 2 volte al giorno per 7 giorni, 1 volt a al giorno per 7 giorni, infine ogni 2-3 giorni per 2-8 settimane oppure
vancomicina orale 10 mg/kg 4 volte al giorno (dose massima 500 mg 4 volte al giorno), seguita da rifaximina 400 mg 3 volte al giorno per 20 giorni oppure
trapianto di microbiot a fecale (Fecal Microbiot a Transplant, FMT) dopo tratt amento antibiotico orale
4.10 Trapianto di microbiota fecale
Il trapianto di FMT è presente da molto prima della medicina moderna. Il primo caso document ato di materiale fecale ingerito per scopi medicinali risale al IV secolo della medicina cinese, quando il medico Ge Hong usò quest a tecnica per tratt are gravi diarree o intossicazioni aliment ari. È st ato document ato come “zuppa gialla”, nella Cina del XVI secolo, nel libro Bencao Gangmu di Li Shizhen, per il tratt amento delle malattie gastrointestinali Una pratica simile al FMT, chiamat a “rumen transfaunation”, è ampiamente utilizzat a in medicina veterinaria ed è st at a document at a per la prima volt a in Svezia nel 1776; il processo prevede il trasferimento di cibo parzialmente digerito dal primo stomaco di un animale donatore sano per tratt are l’indigestione in un animale ricevente malato.162
Nella medicina moderna, la prima ricerca pubblicat a sul concetto di FMT è st at a condott a da Eiseman et al nel 1958 e prevedeva clisteri fecali come tratt amento aggiuntivo per la colite pseudomembranosa indott a da antibiotici Sebbene tra il 1958 e il 2010 non vi sia st at a più alcuna pubblicazione in letteratura su quest a tecnica, dal 2010 il FMT è st ato sempre più considerato come efficace terapia per le ICD con frequenti recidive.163,164
Il principio alla base del FMT consiste nel ripristinare un microbiot a intestinale sano (simbiosi) da uno st ato alterato del microbiot a intestinale (disbiosi); questo viene effettuato tramite il trasferimento di feci da un donatore con microbioma presumibilmente sano a un ricevente con un microbioma alterato Poiché CD è considerato un batterio opportunist a, che causa la malattia in condizioni di disbiosi, il ripristino di una normale microflora intestinale ne consente la competizione con quella del ceppo tossigeno di CD con conseguente risoluzione dell’ICD. Un documento di consenso del 2010 ha identificato 3 indicazioni primarie per il FMT: (1) ICD recidivanti multiple, (2) ICD
moderat a senza rispost a alla terapia st andard (vancomicina o fidaxomicina) per almeno 1 settimana e (3) ICD grave o fulminante senza rispost a alla terapia st andard entro 48 ore.165
I donatori di FMT devono essere sottoposti ad un rigoroso screening per ridurre al minimo il potenziale rischio di trasmettere un’infezione. Le attuali linee guida sul FMT raccomandano l’utilizzo di un questionario per i donatori simile a quello utilizzato per la donazione di sangue, seguito da una valut azione sierologica (HIV, sifilide, HAV, HBV, HCV) e delle feci per rischio infettivo ed esclusione di altre condizioni potenzialmente correlate con la trasmissione della malattia Lo screening sierologico include la ricerca di: HIV, Treponema pallidum, HAV, HBV e HCV. Lo screening delle feci include la ricerca di: Clostridioides difficile, Giardia, Cryptosporidium, Isospora e Cyclospora, Escherichia coli 0157, Rot avirus, Listeria, Vibrio, Norovirus, Cytomegalovirus, Human T-cell lymphotropic virus, Epstein-Barr virus, Dient amoeba fragilis, Blastocystis hominis, Strongyloides stercoralis, Ent amoeba histolytica, Helicobacter pylori, Schistosoma, JC virus, Vancomicyn-resist ant enterococci, Methicillin-resist ant St aphylococcus aureus. I criteri di esclusione per i donatori di feci comprendono: febbre di origine sconosciut a, sospetto di malattia infettiva, diabete mellito, obesit à, sindrome met abolica, malattia autoimmune, malattia neurologica, malattia trasmissibile attiva (HIV, HBV, HAV, HCV, ecc.), esposizione a fattori di rischio per epatiti o HIV negli ultimi 12 mesi, viaggio in aree ad alto rischio per diarrea di origine infettiva negli ultimi 12 mesi, sindrome diarroica acut a negli ultimi 6 mesi, disturbi diarroici cronici (sindrome dell’intestino irrit abile o diarrea funzionale, malattie infiammatorie intestinali, colite microscopica, malattia celiaca), costipazione cronica, neoplasia maligna del colon, storia di ICD, ospedalizzazione negli ultimi 12 mesi, terapia antimicrobica negli ultimi 12 mesi, comport amento sessuale a rischio (omosessualit à, multipli partner sessuali), terapia immunosoppressiva o antineoplastica, uso illecito di droghe, tatuaggi recenti, incarcerazione, recente ingestione di allergeni non noti, malnutrizione moderat a o severa 166,167
I primi passi nella preparazione delle feci del donatore per il FMT includono la diluizione del campione, di solito con soluzione fisiologica, seguit a dall’omogeneizzazione e filtrazione delle feci. Le feci preparate possono essere utilizzate dirett amente o congelate per uso futuro 163
Per la somministrazione di feci i metodi attualmente utilizzati includono il tratto gastrointestinale superiore con endoscopia, tubi nasointestinali o ingestione di pillole, la parte prossimale del colon mediante colonscopia, la parte dist ale del colon mediante clistere, tubo rett ale o sigmoidoscopia. Nei casi più complessi può essere preferibile un metodo combinato di somministrazione.167
I pazienti sottoposti a FMT durante il ricovero sono spesso costretti a letto e molto probabilmente si trovano in un ambiente cont aminato dalle spore del CD Immediat amente prima del FMT è quindi indispensabile che il letto e la st anza del paziente siano puliti adeguat amente, per ridurre al minimo il carico di spore del CD e migliorare i t assi di efficacia del FMT.167
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 192
e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
ESCMID,3 IDSA-SHEA4 e ASCRS7 raccomandano di considerare il FMT nei pazienti con ICD multi-recidivante o refratt aria ai regimi terapeutici convenzionali
4.11 Misure da adottare in caso di epidemia
Non esiste una definizione univoca di epidemia (outbreak) che, secondo differenti autori, può essere identificat a al verificarsi di:
un incremento dei t assi di ICD nello spazio e nel tempo, che si ritiene essere superiore a quanto atteso dal puro caso;152
occorrenza di 2 o più casi correlati in un arco di tempo definito ed in uno spazio determinato, tenendo conto dei t assi normali 153
Si definisce focolaio (cluster) la situazione che si verifica a fronte di un gruppo di casi di ICD che si present ano entro una “cornice” di tempo e localizzazione suggestive di una possibile associazione tra i casi rispetto alla trasmissione. Il sospetto si basa sul dato epidemiologico; la conferma si basa sullo studio dei ceppi, per verificare se si tratt a di uno stesso ceppo
Quando si individua un aumento del numero di casi di ICD rispetto ai dati st andard di una unit à operativa/struttura, è comunque necessario intervenire rapidamente: conducendo una accurat a indagine epidemiologica; ponendo in atto una serie di misure idonee a contenere il rischio infettivo (applicazione del bundle).
Le misure raccomandate come priorit arie sono di due tipi: di sistema e comport ament ali
Misure di sistema
• Verifica del corretto utilizzo dei DPI.
• Verifica dell’adesione all’igiene delle mani.
• Utilizzo di materiali dedicati/monouso, verifica delle procedure di riprocessazione dei dispositivi medici.
• Adozione delle precauzioni da cont atto
• Isolamento/isolamento per coorte/minimizzazione del numero di pazienti per st anza L’isolamento di pazienti con sospett a ICD prima della diagnosi di laboratorio è risultata misura efficace in corso di epidemia.
• Intensificazione dell’igiene ambient ale
Misure educative-comport ament ali
• Diagnosi rapida e rapido tratt amento empirico
• Richiamo all’attenzione/eventuali cambiamenti nelle misure di igiene delle mani
• Informazioni al paziente e ai visit atori.
• Strategie per il corretto utilizzo degli antibiotici, in particolare limit ando l’utilizzo di antibiotici ad alto rischio di favorire ICD.
Poiché il verificarsi di un episodio epidemico richiede interventi rapidi, è opportuno che ogni struttura disponga di un protocollo locale scritto con l’indicazione delle misure da adott are in t ale evenienza.
4.12 Clo
stridi
Il bundle per la prevenzione e il controllo delle ICD prevede i seguenti sei punti
1. Inviare, nel sospetto di infezione da CD (diarrea non imput abile ad altre cause), le feci in laboratorio per il test
2. Applicare, nei casi confermati o sospetti, le precauzioni da cont atto, se possibile isolare il paziente in st anza singola
3. Effettuare, dopo aver assistito il paziente, l’igiene delle mani con acqua e sapone o detergente-antisettico
4 Verificare la terapia antibiotica e sospendere gli antibiotici non indispensabili.
5 Verificare che l’ambiente circost ante il paziente e il servizio dedicato vengano regolarmente puliti e disinfett ati con una soluzione disinfett ante a base di cloro.
6 Informare il paziente, i parenti/visit atori ed il personale di supporto sulle problematiche relative al CD.
5. Bibliografia
1. SImPIOS. Documento di indirizzo “Prevenzione e controllo delle infezioni da Clostridium difficile – DOCUMENTO DI INDIRIZZO – Revisione n° 1 - febbraio 2011”. GImPIOS 2011; 1 (Suppl 1).
2. Crobach MJT, Planche T, Eckert C, et al. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect 2016; 22: S63-S81.
3. Tschudin-Sutter S, Kuijper EJ, Durovic A, et al. Guidance document for prevention of Clostridium difficile infection in acute healthcare settings. Clin Microbiol Infect 2018; 24: 1051-4.
4 Clifford McDonald L, Gerding DN, Johnson S, et al Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). CID 2018; 1-48.
5. Johnson S, Lavergne V, Skinner AM, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA): 2021 Focused Update Guidelines on Management of Clostridioides difficile Infection in Adults. CID 2021; 75: e1029-44.
6. European Centre for Disease Prevention and Control. European Surveillance of Clostridioides (Clostridium) difficile infections. Surveillance protocol version 2.4 2019. www.ecdc.europa.eu
7. The American Society of Colon and Rect al Surgeons Clinical Practice Guidelines for the Management of Clostridioides difficile Infection. Dis Colon TRectum 2021; 64: 650-68.
8. Martini E. Clostridiodes difficile: un nuovo nome per una vecchia conoscenza. GImPIOS 2019; 9: 154-55.
9 Hall IC, O’Toole E Intestinal flora in new-born infants with a description of a new pathogenic anaeroe, Bacillus difficilis J Dis Child 1935; 49: 390-402.
193 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
Per ulteriori informazioni in merito alla gestione degli eventi epidemici vedi allegato E. oidesdifficilebundle
Il bundle è un insieme contenuto di pratiche evidencebased che, applicate congiunt amente e in modo adeguato, migliorano la qualit à e l’esito dei processi con un effetto maggiore di quello che le stesse determinerebbero se fossero attuate separat amente.
10 Lawson PA, Rayney FA Proposal to restrict the genus Clostridium (Prazmowski) to Clostridium butyricum and related species Int J Syst Evol. Microbiol 2015; 66: 1009-16.
11. Yutin N, Galperin MY. A genomic update on clostidial phylogeny: Gram-negative spore formers and other misplaced clostridia Envirom Microbiol 2013; 15: 2631-41
12 Lawson PA, Citron DM, Tyrrell KL, Finegold SM Reclassification of Clostridium difficile as Clostridioides difficile (Hall na O’Toole, 1935) Prevot 13938. Anaerobe 2016: 2631-41.
13. Smith LDS, King EO. Occurrence of Clostridium difficile in infections of man J Bacteriol 1962; 84: 65-67
14 Tedesco FJ, Barton RW, Alpers DH Clindamycin-associated colitis A prospective study Ann Intern Med 1974; 81: 429-33
15 Altemeier WA, Hummel RP, Hill EO St aphylococcus enterocolitis following antibiotic therapy. Anna Surg 1963; 157: 847-58.
16. Bartlett JG, Chang TW, Gurwith M, Gorbach SL, Onderdonk AB. Antibiotic-associated pseudomembranous colitis due to toxin-producing clostridia N Engl J Med 1978; 298: 531-4
17 Miller BA, Chen LF, Sexton DJ, Anderson DJ Comparison of the burdens of hospit al-onset, healthcare facility-associated Clostridium difficile infection and of healthcare-associated infection due to meticillin-resist ant St aphylococcus aureus in community hospit als Infect Control Hosp Epidemiol 2011; 32: 387-90
18 Khanna S, Pardi DS The epidemiology of community-acquired Clostridium difficile infection: a population-based study Am J Gastroenterol 2012; 107: 89-95.
19. Elliott B, Androga GO, Knight DR, Riley TV. Clostridium difficile infection: Evolution, phylogeny and molecular epidemiology Infection, Genetics and Evolution 2017; 49: 1-11
20 Rupnik M, Wilcox MH, Gerding DN Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nat Rev Microbiol 2009; 7: 526-36.
21. Miller M et al. Health care-associated Clostridium difficile infection in Canada: patient age and infecting strain type are highly predictive of severe outcome and mort ality Clin Infect Dis 2010; 50: 194-201.
22. Walker AS, Eyre DW, Wyllie DH, et al. Relationship between bacterial strain type, host biomarkers, and mort ality in Clostridium difficile infection Clin Infect Dis 2013; 56: 1589-1600
23 Leffler DA, Lamont JT Clostridium difficile infection N Engl J Med 2015; 273: 287-8
24 Aktories K, Schwan C, Jank T Clostridium difficile Toxin Biology Annu Rev Microbiol 2017; 71: 281-307.
25. Baxter R. Case-control study of antibiotic use and subsequent Clostridium difficile-associated diarrhea in hospedalized patients Infect Control Hosp Epidemiol 2008; 29: 44-50
26 Shim JK, Johnson S, Samore MH, Bliss DZ, Gerding DN Primary symptomless colonisation by Clostridium difficile and decreased risk of subsequent diarrhoea. Lancet 1998; 351: 633-6.
27. Riggs MM, Sethi AK, Zabarsky TF, et al. Asymptomatic carriers are a potential source for transmission of epidemic and nonepidemic Clostridium difficile strains among long-term care facility residents. Clin Infect Dis 2007; 45: 992-8.
28. McFarland LV, Mulligan ME, Kwok RY, St amm WE. Nosocomial acquisition of Clostridium difficile infection. N Engl J Med 1989; 320: 204-10
29 Furuya-Kanamori L, Marquess J, Yakob L et al Asyntomatic Clostridium difficile colonization: epidemiology and clinical implications. BMC Infect Dis 2015; 15: 516-26.
30. Centers for Disease Control and Prevention. Vit al signs: prevention Clostridium difficile infection MMWR Morb Mort al Wkly R e p 2 0 1 2 Av a i l a b l e a t : h t t p : / w w w c d c g o v / m m w r / p r e v i e w / mmwrhtml/mm6109a3 htm Accessed 9 March 2016
31 Centers for Disease Control and Prevention Emerging Infections Program healthcare-associated infections projects. 2015. Available at: http:/www cdc gov/hai/eip/index htm Accessed 9 March 2016
32 Lessa FC, Mu Y, Bamberg WM et al Burden of Clostridium difficile infection in the United St ates N Engl J Med 2015; 372: 825-34
33. Chitnis AS, Holzbuer SM, Belflower RM, et al. Epidemiology of community-associated Clostridium difficile infection, 2009 through 2011 JAMA Intern Med 2013; 173: 1359-67
34 Magill SS, Edward JR, Bamberg W, et al Emerging Infections Program Healthcare-Associated Infections and Antimicrobial Use Prevalence Survey Team Multist ate point-prevalence survey of healthcare-associated infections N Engl J Med 2014; 370: 1198208.
35. Agency for Healthcare Research and Quality. Healthcare Cost and Utilization Project (HCUP) 2016 Available at: http//hcupnet ahrq gov/ Accessed 9 March 2016
36 Hunter JC, Mu Y, Dumyati GK, et al Burden of nursing home-onset Clostridium difficile infection in the United St ates: estimates of incidence and patient outcomes Open Forum Infect Dis 2016; 3: ofv196
37 Dubberke ER, Olsen MA Burden of Clostridium difficile on the healthcare system. Clin Infect Dis 2012; 55 (Suppl 2): S88-92.
38. Freeman J, Bauer MP, Baines SD, et al. The changing epidemiology of Clostridium difficile infections Clin Microbiol Rev 2010; 23(3): 529-49
39 Kyne L, Hamel MB, Polavaram R Kelly CP Health care costs and mort ality associated with nosocomial diarrhea due to Clostridium difficile Clin Infect Dis 2002; 34: 346-53
40 Kwon JH, Olsen MA, Dubberke ER The morbility, mort ality, and costs associated with Clostridium difficile infection Infect Dis Clin North Am 2015; 29: 123-34.
41. Loo VG, Bourgault AM, Poirier L et al. Host and pathogen factors for Clostridium difficile infection and colonization N Engl J Med 2011; 365: 1693-703
42 European Centre for Disease Prevention and Control Healthcare-associated infections: Clostridium difficile infections. In: ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2018.
43 Loo VG, Poirier L, Miller MA, et al A predominantly clonal multiinstitutional outbreak of Clostridium difficile-associated diarrhea with high morbility and mort ality. N Engl J Med 2005; 353: 24429.
44 McDonald LC, Killgore GE, Thompson A, et al An epidemic, toxin gene-variant strain of Clostridium difficile N Engl J Med 2005; 353: 2433-41.
45. Warny M, Pepin J, Fang A, et al. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe Lancet 2005; 366: 1079-84
46 Health Protection Agency Outbreak of Clostridium difficile infection in a hospit al in southeast England. CDR Wkly 2005; 15.
47. Kuijper E, Barnut F, Brazier J, et al. Update of Clostridium difficile infection due to PCR ribotype 027 in Europe, 2008 Euro Surveill 2008; 13: 18942
48 Kuijper EJ, Debast SB, Van Kregten E, et al Clostridium difficile ribotype 027, toxinotype III in The Notherlands (in dutch). Ned Tijdschr Geneeskd 2005; 149: 2087-9.
49 Kato H, Ito Y, Van Den Berg R, Kuijper E, Arakawa Y First isolation of Clostridium difficile 027 in Japan Euro Surveill 2007; 12: EO70111.3.
50. See I, Mu Y, Cohen J, et al. NAPI atrain type predicts outcomes from Clostridium difficile infection Clin Infect Dis 2014; 58: 1394400
51 Wilcox MH, Shetty N, Fawley WN, et al Changing epidemiology of Clostridium difficile infection following the introduction of a national ribotyping-based surveillance scheme in England. Clin Infect Dis 2012; 55: 1056-63
52 Goorhuis A, Bakker D, Corver J, et al Emergence of Clostridium difficile infection due to a new hypervirulent strain, polymerase chain reaction ribotype 078. Clin Infect Dis 2008; 47: 1162-70.
53 Centers for Disease Control and Prevention Severe Clostridium difficile-associated disease in populations previously at low risk-four st ates, 2005. MMWR Morb Mort al Wkly Rep 2005; 54: 1201-5.
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 194
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
54. James AH, Kats VL, Dotters DJ, Rogers RG. Clostridium difficile infection in obstretic and gynaecologic patients. South Med J 1997; 90: 889-92.
55. Kyne L, Merry C, O’Connell B, et al. Community-acquired Clostridium difficile infection. J Infect 1998; 36: 287-8.
56 Negron ME, Rezaie A, Barkema HW, et al Ulcerative colitis patients with Clostridium difficile are at increased risk of death, clectomy, and postoperative complications: a population-based inception cohort study. Am J Gastroenterol 2016; 111: 691-704.
57 Razik R, Rumman A, Bahreini Z, McGeer A, Nguyen GC Recurrence of Clostridium difficile infection in patients with infiammatory bowel disease: the RECIDIVISM Study Am J Gastroenterol 2016; 111: 1141-6
58 Donnelly JP, Wang HE, Locke JE, et al Hospit al-onset Clostridium difficile infection among solid organ transplant recipients Am J Gastroenterol 2015; 15: 2970-7
59 Paudel S, Zacharioudakis IM, Zervou FN, Ziakas PD, Mylonakis E Prevalence of Clostridium difficile infection among solid organ transplant recipients: a met a-analysis of published studies PLoS One 2015; 10: e0124483
60 Phatharacharukul P, Thongprayoon C, Cheungpasitporn W, et al The risks of incident and recurrent Clostridium difficile-associated diarrhoea in chronic kidney disease and end-stage kidney disease patients: a systematic review and meta-analysis Dig Dis Sci 2015: 60: 2913-22
61 Zacharioudakis IM, Ziakas PD, Mylonakis E Clostridium difficile infection in the hematopoietic unit: a met a-analysis of published studies Biol Bllod Marrow Transplant 2014; 20: 1641-65
62 McFarland LV, Mulligan ME, Kwok RY, St amm WE Nosocomial acquisition of Clostridium difficile infection N Engl J Med 1989; 320: 204-10
63. Walker KJ, Gilliland SS, Vance-Bryan K, et al. Clostridium difficile colonization in residents of long-term care facilities: prevalence and risk factors J Am Geriatr Soc 1993; 41: 940-6
64. Rivera EV, Woods S. Prevalence of asymptomatic Clostridium difficile colonization in a nursing home population: a cross-sctional study. J Gend Specif Med 2003; 6: 27-30.
65. Viscidi R, Willey S, Bartlett JG. Isolation rates and toxigenic potential of Clostridium difficile isolates from various patient populations. Gastroenterology 1981; 81: 5-9.
66. Curry SR, Muto CA, Schlackman JL, et al. Use of multilocus variable number of tandem repeats analysys genotyping to determine the role of asymptomatic carriers in Clostridium difficile transmission. Clin Infect Dis 2013; 57: 1094-102.
67 Kyne L, Warny M, Qamar A, Kelly CP Asymptomatic carraige of Clostridium difficile and serum levels of IgG antibody against toxin A. N Engl J Med 2000; 342: 390-7.
68 Kyne L, Warny M, Qamar A, Kelly CP Association between antib o d y r e s p o n s e t o t o x i n A a n d p r o t e c t i o n a g a i n s t r e c u r r e n t Clostridium difficile diarrhoea Lacet 2001; 357: 189-93
69 Shim JK, Johnson S, Samore MH, Bliss DZ, Gerding DN Primary symptomless colonization by Clostridium difficile and decreased risk of subsequent diarrhoea Lacet 1998; 351: 633-6
70 Benson I, Song X, Campos J, Singh N Changin epidemiology of Clostridium difficile-associated disease in children Infect Control Hosp Epidemiol 2007; 28: 1233-5
71 Khanna S, Baddour LM, Huskins WC, et al The epidemiology of Clostridium difficile infection in children: a population-based study Clin Infect Dis 2013; 56: 1401-6
72 Zilberberg MD, Tillotson GS, McDonald C Clostridium difficile infections among hospit alised children, United St ates, 1997-2006 Emerg Infect Dis 2010; 16: 604-9
73. Baker SS, Faden H, Sayei W, Patel R, Baker RD. Increasing incidence of community-associated atypical Clostridium difficile disease in children. Clin Pediatr (Phila) 2010; 49: 644-7.
74. Wendt JM, Cohen JA, Mu Y, et al. Clostridium difficile infection among children across diverse US geographic locations. Pediatrics 2014; 133: 651-8.
75. Bolton RP, Tait SK, Dear PR, Losowsky MS. Asymptomatic neonat al colonization by Clostridium difficile Arch Dis Child 1984; 59: 466-72
76 Delmée M, Verellen G, Avesani V, Fancois G Clostridium difficile in neonates: serogrouping and epidemiology Eur J Pediatr 1988; 147: 36-40.
77. Rosseau C, Lemée L, Le Monnier A, et al. Prevalence and diversity of Clostridium difficile strains in infants. J Med Microbiol 2011; 60: 1112-8
78 Tullus K, Aronsson B, Marcus S, Mollby R Intestinal colonization with Clostridium difficile in infants up to 18 months of age Eur J Clin Microbiol Infect Dis 1989; 8: 390-3.
79. Penders J, Stobberingh EE, Van Den Brandt PA, Van Ree R, Thijs C. Toxigenic and non-toxigenic Clostridium difficile determinants of intestinal colonization and role in childhood atopic manifest ations Gut 2008; 57: 1025-6
80 Matsuki S, Ozaki E, Shozu M, et al Colonization by Clostridium difficile of neonates in a hospit al, and infants and children in three day-care facilities of Kanazawa, Japan. Int Microbiol 2005; 8438
81 Stoesser N, Crook DW, Fung R, et al Molecolar epidemiology of Clostridium difficile strains in children compared with that of strains circulating in adults with Clostridium difficile-associated infection J Clin Microbiol 2011; 49: 3994-6.
82. Pant C, Anderson MP, Deshpande A, et al. Health care burden of Clostridium difficile infection in hospit alised children with infiammatory bowel disease Infiamm Bowel Dis 2013; 19: 1080-5
83 Sandora TJ, Fung M, Flaherty K et al Epidemiology and risk factors for Clostridium difficile infection in children Pediatr Infect Dis J 2011; 30: 580-4.
84. Tai E, Richardson LC, Townsend J, Howard E, McDonald LC. Clostridium difficile infection among children with cancer. Pediatr Infect Dis J 2011; 30: 610-2
85 Nylund CM, Eide M, Gorman GH Association of Clostridium difficile infections with acid suppression medications in children J Pediatr 2014; 165: 979-84
86 Brown KE, Knoderer CA, Nichols KR, Crumby AS Acid-suppressing agents and risk for Clostridium difficile infection in pediatric patients Clin Pediatr (Phila) 2015; 54: 1102-6
87 Pokorn M, Radsel A, Cizman M, et al Severe Clostridium difficileassociated disease in children Pediatr infect Dis J 2008; 27: 9446
88 Kim J, Shaklee JF, Smathers S, et al Risk factors and outcomes associated with severe Clostridium difficile infection in children. Pediatr Infect Dis J 2012; 31: 134-8.
89. Sammons JS, Localio R, Xiao R, Coffin SE, Zaoutis T. Clostridium difficile infection in associated with increased risk of death and prolonged hospit alisation in children Clin Infect Dis 2013; 57: 18.
90. Bobulsky GS, Al-Nassir WN, Riggs MM, Sethi AK, Donskey CJ. Clostridium difficile skin cont amination in patients with C. difficileassociated disease Clin Infect Dis 2008; 46: 447-50
91 Mayfield JL, Leet T, Miller J, Mundy LM Environment al control to reduce transmission of Clostridium difficile Clin Infect Dis 2000; 31: 995-1000
92 Wilcox MH, Fawley WN, Wigglesworth N, et al Comparison of the effect of detergent versus hypochlorite cleaning on environment al cont amination and incidence of Clostridium difficile infection J Hosp Infect 2003; 54: 109-14
93 Shaughnessy MK, Micielli RL, DePested DD, et al Evaluation of hospital room assignment and acquisition of Clostridium difficile infection. Infect Control Hosp Epidemiol 2011; 32: 201-6.
94. Brooks SE, Veal RO, Kramer M, et al. Reduction in the incidence of Clostridium difficile-associated diarrhea in an acute care hospit al and a killed nursing facility following replacement of electronic thermometers with single-use disposables Infect Control Hosp Epidemiol 1992; 13: 98-103.
195 GIm PIOS Vol 12, n 4, ottobre-dicembre 2022
95. Wilcox MH, Fawley WN, Settle CD, Davidson A. Recurrence of symptoms in Clostridium difficile infection-relapse or reinfection? J Hosp Infect 1998; 38: 93-100.
96. Doll M, Marra AR, Apisarnthanarak A, et al. Prevention of Clostridioides difficile in hospitals: A position paper of the International Society for Infectious Diseases Int J Infect Dis 2021; 102: 188-95
97. Brown K, Valent a K, Fisman D, Simor A, Daneman N. Hospit al ward antibiotic prescribing and the risks of Clostridium difficile infection JAMA Intern Med 2015; 175: 626-33
98. Freefberg DE, Salmasian H, Cohen B, Abrams JA, Larson EI. Receipt of antibiotics in hospit alised patients and risk for Clostridium difficile infection in subsequent patients who occupy the same bed. JAMA Intern Med 2016; 176: 1801-8.
99 Sethi AK, Al-Nassir WN, Nerandzic MM, Bobulsky GS, Donskey CJ Persistence of skin cont amination and environment al shedding of Clostridium difficile during and afeter treatment of C. difficile infection Infect Control Hosp Epidemiol 2010; 31: 21-7
100 McDonald L, Owings M, Jernigan D Clostridium difficile infection in patients dicharged from US short-st ay hospit als, 1996-2003. Emerg Infect Dis 2006; 12: 409-15
101 Hensgens MP, Goorhuis A, Dekkers OM, Kuijper EJ Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics J Antimicrob Chemother 2012; 67: 742-8
102 Pépin J, Saheb N, Coulombe MA, et al Emergence of fluoroquinolones as the predominant risk factor for Clostridium difficileassociated diarrhea: a cohort study during an epidemic in Quebec Clin Infect Dis 2005; 41: 1254-60
103. Johnson S, Samore MH, Farrow KA, et al. Epidemics of diarrhea caused by a clindamicyn-resistent strain of Clostridium difficile in four hospit als N Engl J Med 1999; 341: 1645-51
104. Dethlefsen L, Huse S, Sogin ML, Relman DA. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by step 16s rRNA sequencing PLoS Biol 2008; 6: e280
105. Privitera G, Scarpellini P, Ortisi G, et al. Prospective study of Clostridium difficile intestinal colonization and disease following single-dose antibiotic prophylaxis in surgery Antimicrob Agents Chemother 1991; 35: 208-10.
106 Anand A, Glatt AE Clostridium difficile infection associated with antineoplastic chemotherapy, a review Clin Infect Dis 1993; 17: 109-13.
107 Gorschluter M, Glasmacher A, Hahn C, et al Clostridium difficile infection in patients with neutropenia Clin Infect Dis 2001; 33: 786-91.
108 Sanchez T, Brooks J, Sullivan P, et al Bacterial diarrhea in persons with HIV infection, Unites St ates, 1992-2002 Clin Infect Dis 2005; 41: 1621-7.
109. Bliss DZ, Johnson S, Savik K, et al. Acquisition of Clostridium difficile and Clostridium difficile-associated diarrhea in hospit alised patients receiving tube feeding. Ann Intern Med 1998; 129: 10129
110 Deshpande A, Pasupuleti V, Thot a P, et al Risk factors for recurrent Clostridium difficile infection: a systematic review and met aanalysis Infect Control Hosp Epidemiol 2015; 36: 452-60
111 Abou Chakra CN, Pepin J, Sirard S, Valiquette I Risk factors for recurrence, complications and mort ality in Clostridium difficile infection; a systematc review PLoS One 2014; 9: e98400
112 Bauer MP, Nibbering PH, Poxton IR, Kuijper EJ, Van Dissed JT Humoral immune response as predictor of recurrence in Clostridium difficile infection Clin Microbiol Infect 2014; 20: 1323-8
113 Wang WJ, Gray S, Sison C, et al Low vit amin D level is an independent predictor of poor outcomes in Clostridium difficile-associated diarrhea Therap Adv Gastroenterol 2014; 7: 14-9
114 Stevens V, Dumyati G, Brwn J, Wijngaarden E Differential risk of Clostridium difficile infection with proton pump inhibitor use by level of antibiotic exposure Pharmacoepidemiol Drug Saf 2011; 20: 1035-42
115. Howell MD, Novack V, Grgurich P, et al. Iatrogenic gastric acid suppression and the risk of nosocomial Clostridium difficile infection. Arch Intern Med 2010; 170: 784-90.
116. Novack L, Kogan S, Gimpelevich L, et al. Acid suppression therapy does mot predispose to Clostridium difficile infection: the case of the potential bias. PLoS One 2014; 9: e110790.
117 McDonald EG, Milligan J, Frenette C, Lee TC Continuos proton pump inhibitor therapy and the associated risk of recurrent Clostridium difficile infection. JAMA Inter Med 2015; 175: 784-91.
118 Seto CT, Jeraldo P, Orenstein R, Chia N, DiBaise JK Prolonged use of a proton pump inhibitor reduces microbial diversit à: implications for Clostridium difficile susceptibility Microbiome 2014; 2: 42
119 McDonald LC, Coignard B, Dubberke E, et al Recommendations for surveillance of Clostridum difficile-associated disease Infect Control Hosp Epidemiol 2007; 28: 140-5
120 Sayedi L, Kothari D, Richards RJ, et al Toxin megacolon associated Clostridium difficile colitis World J Gastrointest Endoscop 2010; 2: 293-7
121 Tedesco FJ, Barton RW, Alpers DH Clindamycin-associated colitis A prospective study Ann Intern Med 1974; 81: 429-33
122. Teasley DG, Gerding DN, Olson MM, et al. Prospective randomised trial of metronidazole bersus vancomycin for Clostridium difficile-associated diarrhoea and colitis Lancet 1983; 2: 1043-6
123. Fekety R, Silva J, Kauffman C, Buggy B, Deery HG. Treatment of antibiotic-associated Clostridium difficile colitis with oral vancomycin: comparison of two dosage regimens. Am J Med 1989; 86: 15-9.
124. Johnson S, Louie TJ, Gerding DN et al. Polymer Alternative for CDI Treatment (PACT) Investigators. Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: results from two multinational, randomised, controlled trials. Clin Infect Dis 2014; 59: 345-54.
125. Dubbetke ER, Han Z, Bobo I, et al. Impact of clinical symptoms on interpret ation of diagnostic assay for Clostridium difficile infections. J Clin Microbiol 2011; 49: 2887-93.
126. Peterson LR, Manson RU, Paule SM, et al. Detection of toxigenic Clostridium difficile in stool samples by real-time polymerase chain reaction for the diagnosis of C. difficile-associated diarrhea. Clin Infect Dis 2007; 45: 1152-60.
127 Lewis SJ, Heaton KW et al Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol 1997; 32: 920-4.
128 Burnham CA, Carroll KC Diagnosis of Clostridium difficile infection: an ongoing conundrum for clinicians and for clinical laboratories Clin Microbiol Rev 2013; 26: 604-30
129 Wilcox MH Overcoming barriers to effective recognition and diagnosis of Clostridium difficile infection Clin Microbiol Infect 2012; 18 (Suppl 6): 13-20
130 Swindells J, Brenwarld N, Reading N, Oppenheim B Evaluation of diagnostic tests for Clostridium difficile infection J Clin Microbiol 2010; 48: 606-8
131 Crobach MJ, Planche T, Eckert C, et al European society of clinical Microbiology and infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection Clin Microbiol Infect 2016; 22: S63-81
132 Aichnger E, Schleck CD, Harmsen WS, Nyre LM, Patel R Nonutility of repeat laboratory testing for detection of Clostridium difficile by use of PCR or enzyme immunoassay J Clin Microbiol 2008; 46: 3795-7
133. Cardona DM, Rand KH. Evaluation of repeat Clostridium difficile enzyme immunoassay testing J Clin Microbiol 2008; 46: 3686-9
134. Abujamel T, Cadnum JL, Jury LA, et al. Defining the vulnerable period for re.est ablishment of Clostridium difficile colonization after treatment of C. difficile infection with oral vancomycin or metronidazole. PLos One 2013; 8: e76269.
135. Gerding DN, Meyer T, Lee C, et al. Administration of spores of nontoxigenic Clostridium difficile strain M3 for prevention of recurrent C. difficile infection: a randomised clinical trial. JAMA 2015; 313: 1719-27.
GIm PIOS Vol 12, n 4, ottobre-dicembre 2022 196
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
136. Dont a ST, Myers MG. Clostridium difficile toxin in asymptomatic neonates. J Pediatr 1982; 100: 431-4.
137. Rousseau C, Poilane I, De Pontual L, et al. Clostridium difficile carriage in healthy infants in the community: a potential reservoir for pathogenetic strains. Clin Infect Dis 2012; 55: 1209-15.
138 Volberg RP, Kuijper EJ, Wilcox MH et al Infection Control measures to limit the spread of Clostridium difficile Clin Microbiol Infect 2008; 14 (Suppl 5): 2-20.
139 Yokoe DS, Mermel LA, Anderson DJ, et al A compendium of strategies to prevent healthcare associated infections in acute care hospit als Infect Control Hosp Epidemiol 2008; 29 (S1): 1221
140 Verdoorn BP, Orenstein R, Wilson JW et al Effect of telephoned notification of positive Clostridium difficile test results on the time to ordering of antimicrobial therapy Infect Control Hosp Epidemiol 2008; 29: 658-60
141 Smith PS, Bennett G, Bradley S et al SHEA/APIC Guideline: infection prevention and control in the long-term care facility Infect Control Hosp Epidemiol 2008; 29: 785-814
142 Decreto Ministeriale del 15 novembre 1990 “Sistema informativo delle malattie infettive e diffusive” Gazzett a Ufficiale del 8 gennaio 1991, n 6 e successive integrazioni
143 Gravel D, Gardam M, Taylor G, et al Infection control practices related to Clostridium difficile infection in acute care hospit als in Canada Am J Infect Control 2009; 37: 9-14
144. Compendio delle principali misure per la prevenzione e il cont r o l l o d e l l e i n f e z i o n i c o r r e l a t e a l l ’ a s s i s t e n z a . P r o g e t t o I N FOSS/CCM http://asr regione emiliaromagna it
145. Dionne GD. The Canadian Cont ainment Approach to Clostridium difficile. Am J Infect Control 2010; 38: e-43.
146. Sethi AK, Al-Nassir WN, Nerandzic MM, Bobulsky GS, Donskey CJ. Persistence of Skin Cont amination and Environment Shedding of Clostridium difficile during and after treatment of C. difficile Infection. Infect Control Hosp Epidemiol 2010; 31: 21-7.
147. Weber DJ, et al. Role of hospit al surfaces in the transmission of emerging health care-associated pathogens: Norovirus, Clostridium difficile, and Acinetobacter species. Am J Infect Control 2010; 38: S25-33.
148 Cohen SH, et al Clinical Practice Guidelines for Clostridium difficile Infection in Adults: 2010 Update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31: 431-55.
149 Sitzlar B, Deshpande A, Fertelli D, et al An environment al disinfection odyssey: evaluation of sequential interventions to improve disinfection of Clostridium difficile isolation rooms Infect Control Hosp Epidemiol 2013: 34: 459-65.
150 Boyce JM, Havill NL, Otter JA, et al Impact of hydrogen peroxide vapor room decont amination on Clostridium difficile environment al cont amination and transmission in a healthcare setting Infect Control Hosp Epidemiol 2008; 29: 723-9
151 Barbut F, Menuet D, Verachten M, Girou E Comparison of the efficacy of a hydrogen peroxide dry-mist disinfection system and sodium hypochlorite solution for eradication of Clostridium difficile spores Infect Control Hosp Epidemiol 2009; 30: 507-14
152 Dubberke ER, Gerding DN, Classen D, et al Strategies to prevent Clostridium difficile infections in acute care hospit als Infect Control Hosp Epidemiol 2008; 29 (Suppl 1): 81-92
153 National Clostridium difficile Standards Group National Clostridium difficile St andards Group: Report to the Department of Health J Hosp Infect 2004; 56 (Suppl 1): 1-38
154 Pepin J, Saheb N, Coulombe MA, et al Emergence of fluoroquinolones as the predominant risk factor for Clostridium difficileassociated diarrhoea: a cohort study during an epidemic in Quebec Clin Infect Dis 2005; 41: 1254-60
155 Henrich TJ, Krakower D, Bitton A, Yokoe DS Clinical risk factors for severe Clostridium difficile associated disease Emerg infect Dis 2009; 15: 415-22
156. Barlam TF, Cosgrove SE, Abbo LM, et al. Executive summary: implementing an antibiotic stewardship program: guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis 2016; 62: 1197-202.
157. Morgan DJ, Leekha S, Croft L, et al. The Import ance of Colonization with Clostridium difficile on Infection and Transmission. Curr Infect Dis Rep 2015; 17:43.
158. Dawson LF, Valiente E, Donahue EH, Birchenough G, Wren BW. Hypervirulent Clostridium difficile PCR-Ribotypes Exhibit Resistance to Widely Used Disinfect ants. PLoS ONE 2011; 6(10): e25754.
159 Anderson DJ, Moehring RW, Weber DJ, et al Effectiveness of t argeted enhanced terminal room disinfection on hospit al-wide acquisition and infection with multidrugresist ant organisms and Clostridium difficile: a secondary analysis of a multicentre cluster randomised controlled trial with crossover design (BETR Disinfection). Lancet Infect Dis 2018; 18: 845.853.
160 Silinger CP, Greer S, Sutton CJ Is gastrointestinal endoscopy a risk factor for Clostridium difficile associated diarrhea? Am J Infect Control 2010; 38: 581-2.
161 Kraft CS, Parrott JS, Cornish NE, et al A Laboratory Medicine Best Practices Systematic Review and Met a-analysis of Nucleic Acid Amplification Tests (NAATs) and Algorithms Including NAATs for the Diagnosis of Clostridioides (Clostridium) difficile in Adults. Clin Microbiol Rev. 2019; 32: e00032-18.
162 Moayyedi P, Yuan Y, Baharith H, Ford AC Faecal microbiot a transplant ation for Clostridium difficile-associated diarrhoea: a systematic review of randomised controlled trials MJA 2017; 207: 166-172
163 Bakken JS, Borody T, Brandt LJ, et al Treating Clostridium difficile infection with fecal microbiot a transplant ation Clin Gastroenterol Hepatol 2011; 9: 1044-1049
164 Kelly CR, Kahn S, Kashyap P, et al Update on fecal microbiot a transplant ation 2015: indications, methodologies, mechanisms, and outlook Gastroenterology 2015; 149: 223-37
165 Rariq R, Khanna S Clostridium difficile infection: Updates in management Indian J Gastroenterol 2017; 36: 3-10
166. Liubakka A, Vaughn BP. Clostridium difficile Infection and Fecal Microbiota Transplant AACN Advanced Critical Care 2016; 27: 32437
167. Eiseman B, Silen W, Bascom GS, Kauvar AJ. Fecal anema a san adjunct in the treatment of pseudomembranous enterocolitis. Surgery 1958; 44: 854-9.
197 GIm PIOS Vol 12, n 4, ottobre-dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
ALLEG ATO A
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Tabella sinottica delle linee guida consultate
Quando si sospetta una ICD, si deve raccogliere una anamnesi specifica con attenzione a fattori di rischio, sintomi, comorbilità e segni di malattia grave o fulminante (Qualità evidenze bassa; raccomandazione forte)
I pazienti devono essere valutati per determinare la gravità di ICD e l’eventuale presenza di peritonite o insufficienza d'organo multisistemica. (Qualità evidenze bassa; raccomandazione forte)
I test per ICD non dovrebbero essere eseguiti solo su specifica richiesta del curante (Qualità evidenze elevata, raccomandazione forte)
Almeno tutti i campioni di feci non formate di pazienti d’età ≥3 anni dovrebbero essere testati per ICD (Qualità evidenze molto bassa, raccomandazione debole)
In bambini con <3 anni d’età eseguire il test per ICD isolo su specifica richiesta del curante. (Qualità evidenze bassa, raccomandazione debole)
I pazienti con ≥3 scariche di feci non formate in 24 ore in assenza di cause note e di nuova insorgenza rappresentano la popolazione target per i test per ICD (Qualità evidenze molto bassa, raccomandazione debole)
A causa dell'elevata prevalenza di portatori asintomatici di CD tossigenico nei neonati, i test per ICD non dovrebbero mai essere raccomandati di routine per neonati o bambini di età ≤12 mesi con diarrea (Qualità evidenze moderata, raccomandazione forte)
Il test per ICD non deve essere eseguito di routine nei bambini di 1-2 anni di età con diarrea, a meno che non siano state escluse altre cause infettive o non infettive. (Qualità evidenze bassa, raccomandazione debole)
Nei bambini di età ≥2 anni, il test per ICD è raccomandato se presentano diarrea prolungata o in peggioramento e fattori di rischio (malattia infiammatoria intestinale sottostante o condizioni di immunocompromissione) o esposizioni rilevanti (contatto con il SSN o antibiotici recenti). (Qualità evidenze moderata, raccomandazione debole)
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 198
Buona pratica Raccomandazione forte
ESCMID 2016
IDSA/SHEA 2017 ESCMID 2018
ASCRS 2021
D I A G N O S I
Campioni di feci formate non dovrebbero essere testati per ICD (ad eccezione che in caso di ileo paralitico). (Buona pratica)
In pazienti con sospetto ileo paralitico utilizzare un tampone rettale per la coltura (tossigenica), NAAT o GDH EIA (Qualità evidenze moderata, raccomandazione forte)
La diagnosi di ICD dovrebbe basarsi su segni clinici e sintomi associati ad esami di laboratorio La decisione di trattare o meno per ICD è una decisione clinica e può essere giustificata anche in caso di test di laboratorio negativi. (Buona pratica)
Non utilizzare un singolo test rapido in assenza di altri test dato il VPP inadeguato in situazioni endemiche. (Qualità evidenze moderata, raccomandazione forte)
È raccomandato l'uso di un algoritmo a due fasi. (Qualità evidenze moderata, raccomandazione forte)
Tale algoritmo dovrebbe iniziare con NAAT o GDH EIA . I campioni risultati negativi al primo test devono essere refertati come negativi. (Qualità moderata, raccomandazione forte)
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
I campioni risultati positivi al primo test devono essere testati ulteriormente con EIA per la ricerca della tossina A/B I campioni risultati positivi ad un secondo test possono essere refertati come positivi (Qualità evidenze moderata, raccomandazione forte)
Utilizzare un test della tossina fecale come parte di un algoritmo multifase (ovvero, glutammato deidrogenasi [GDH] più tossina; GDH più tossina, arbitrato dal test di amplificazione dell'acido nucleico [NAAT ]; o NAAT più tossina) piuttosto che un NAAT da solo per tutti i campioni ricevuti nel laboratorio clinico in assenza di criteri concordati a livello della istituzione per la richiesta di esami delle feci del paziente (Qualità evidenze bassa; raccomandazione debole)
Utilizzare un NAAT da solo o un algoritmo multifase per il test (ovvero, GDH più tossina; GDH più tossina, arbitrato da NAAT; o NAAT più tossina) piuttosto che un solo test della tossina quando sono stati concordati nella istituzione criteri per la richiesta di esami delle feci del paziente (Qualità evidenze bassa; raccomandazione debole)
Per diagnosticare l’ICD si raccomanda un test a due fasi (GDH o NAAT per i geni della tossina seguito da un test della tossina altamente sensibile o GDH in combinazione con un test della tossina) In caso di esito negativo del test della tossina, è possibile eseguire NAAT (se non già parte del primo step diagnostico) o coltura tossigenica in base alla valutazione clinica o alle esigenze locali di prevenzione delle infezioni (Qualità evidenze moderata, raccomandazione forte)
La diagnosi di ICD dovrebbe basarsi su test di laboratorio delle feci utilizzando un algoritmo a due fasi per aumentare l’accuratezza. (Qualità evidenze alta; raccomandazione forte)
Un algoritmo alternativo è quello di testare i campioni sia con GDH che con EIA per la ricerca della tossina A/B. I campioni con risultati concordanti positivi o negativi possono essere refertati come tali I campioni con un test GDH negativo ma positivo alla ricerca della tossina devono essere testati nuovamente perché tale risultato non è valido (Qualità evidenze moderata, raccomandazione forte)
199 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
ESCMID
2016 IDSA/SHEA 2017 ESCMID 2018 ASCRS 2021
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
I campioni con un primo test positivo e un secondo test negativo ed i campioni con un test GDH positivo ma un test negativo per tossina A/B possono rappresentare campioni indicativi di infezione oppure di colonizzazione da CD e possono essere eccezionalmente testati con TC o NAAT (se non già eseguiti) (Qualità evidenze moderata, raccomandazione debole)
Si raccomanda di effettuare la TC o la tipizzazione molecolare degli isolati prelevati in caso di situazioni epidemiche. (Buona pratica)
In caso di situazione endemica, dopo un primo campione positivo, durante lo stesso episodio diarroico, non è raccomandata la ripetizione del test. (Qualità evidenze moderata, raccomandazione forte)
La ripetizione del test dopo un primo campione negativo, durante lo stesso episodio diarroico, può essere utile in casi selezionati per sospetto clinico nel corso di un evento epidemico o in un contesto endemico (Qualità evidenze moderata, raccomandazione forte)
Non è raccomandato eseguire il test per dimostrare la guarigione. (Buona pratica)
Non ripetere il test (entro 7 giorni) durante lo stesso episodio di diarrea e non testare le feci di pazienti asintomatici, eccetto che per studi epidemiologici. (Qualità evidenze moderata, raccomandazione forte)
Non è raccomandata la valutazione endoscopica di routine per diagnosticare o determinare l'estensione della ICD. (Qualità evidenze bassa; raccomandazione forte)
La valutazione radiologica ha un'utilità limitata nella ICD (Qualità evidenze bassa; raccomandazione debole)
Non ci sono dati sufficienti per raccomandare l'uso di lattoferrina fecale o altri marcatori biologici a scopi diagnostici
(Nessuna raccomandazione)
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 200
ESCMID 2016 IDSA/SHEA 2017 ESCMID 2018 ASCRS 2021
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
IDSA SHEA 2017
Sorveglianza
Per aumentare la comparabilità tra i diversi setting assistenziali, utilizzare le seguenti definizioni di caso standardizzate: (1) ICD con esordio in strutture sanitarie (HO); (2) ICD con insorgenza in comunità, associata a struttura sanitaria (CO-HCFA); (3) ICD associata alla comunità (CA) (Buona pratica)
Come minimo, condurre la sor veglianza per HO-CDI in tutte le strutture sanitarie ospedaliere per rilevare tassi elevati o focolai di ICD all'interno della struttura (Qualità evidenze bassa; raccomandazione debole)
Esprimere il tasso di HO-CDI come numero di casi per 10.000 giornipaziente Esprimere il tasso di prevalenza CO-HCFA come numero di casi per 1000 ricoveri (Buona pratica)
Stratificare i dati in base al setting di acquisizione dell’infezione per orientare le misure di controllo quando l'incidenza di ICD è superiore agli obiettivi di riduzione nazionale e/o della struttura o in presenza di un focolaio epidemico. (Bassa qualità, Raccomandazione debole)
Utilizzare le stesse definizioni di casi standardizzate (HO, CO-HCFA, CA) e le stesse misure di frequenza (casi per 10 000 pazienti di paziente per HO, casi per 1000 ammissioni di pazienti per CO-HCFA) nei pazienti pediatrici come negli adulti (Buona pratica)
Condurre la sor veglianza per HO-CDI nelle strutture pediatriche ospedaliere ma non includere casi <2 anni di età (Qualità bassa; raccomandazione debole)
Considerare la sor veglianza di CA-CDI per rilevare i trend nella comunità (Qualità evidenze bassa; raccomandazione debole)
ESCMID 2018
In caso di epidemia, eseguire la sor veglianza di ICD e fornire feedback tempestivi dei tassi di infezione sia a livello di ospedale che a livello di singolo reparto. (Qualità evidenze molto bassa; raccomandazione forte)
In un contesto endemico, eseguire la sor veglianza di ICD in combinazione con feedback tempestivi dei tassi di infezione. (Qualità evidenze molto bassa; raccomandazione forte)
Scr eening
Non ci sono dati sufficienti per raccomandare lo screening per i portatori asintomatici e l'adozione di precauzioni di contatto nei portatori asintomatici. (Nessuna raccomandazione)
Non è raccomandato lo screening per CD per identificare i pazienti colonizzati/portatori con l'obiettivo di ridurre il rischio di progredire a ICD in soggetti colonizzati o altri pazienti e quindi ridurre i tassi di ICD (Qualità evidenze molto bassa in contesti endemici; raccomandazione condizionale)
Non è raccomandato lo screening degli operatori sanitari per la colonizzazione intestinale con CD come misura di controllo di routine per ICD (Qualità evidenze molto bassa in contesti endemici; raccomandazione forte)
201 GIm PIOS Vol 12, n 4, ottobre-dicembre 2022
S O R V E G L I A N Z A E S C R E E N I N G
IDSA SHEA 2017
Igienedellemani
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
ESCMID 2018
ASCRS 2021
Dovrebbero essere implementate misure di controllo delle infezioni per i pazienti ospedalizzati con ICD. (Qualità evidenze moderata; raccomandazione forte)
In contesti endemici, eseguire l’igiene delle mani con acqua e sapone o con un prodotto a base di alcol, prima e dopo il contatto con un paziente con ICD e dopo aver rimosso i guanti (Qualità evidenze moderata; raccomandazione forte)
In focolai epidemici di ICD o situazioni iperendemiche (alti tassi sostenuti nel tempo), preferire l'igiene delle mani con acqua e sapone piuttosto che con prodotti per l'igiene delle mani a base di alcol prima e dopo la cura di un paziente con ICD, data la maggiore efficacia di sapone e acqua nella rimozione di spore. (Qualità evidenze bassa; raccomandazione debole)
Il lavaggio delle mani con sapone e acqua è da preferire se c'è un contatto diretto con le feci o un'area nella quale è probabile la contaminazione fecale (ad esempio, la regione perineale). (Buona pratica)
Incoraggiare i pazienti a lavarsi le mani e a eseguire la doccia per ridurre la quantità di spore sulla cute. (Buona pratica)
Dispositividipr otezioneindividuale(DPI)
Il personale sanitario deve utilizzare guanti e camici prima di entrare nella stanza di un paziente con ICD e durante la cura dei pazienti con ICD. (Qualità elevata per i guanti, moderata per il camice; raccomandazione forte)
Non è possibile formulare raccomandazioni specifiche sulla tecnica/prodotto più efficace per la rimozione di spore di CD (Nessuna raccomandazione)
In caso di epidemia, passare dall'igiene delle mani con prodotti idroalcolici al lavaggio con acqua e sapone a causa della mancanza di attività in vitro dei prodotti alcolici contro le spore. (Qualità molto bassa; raccomandazione condizionale)
In situazione endemica, non passare dalla frizione con prodotti idroalcolici al lavaggio delle mani con acqua e sapone per ridurre l'incidenza di ICD (Qualità evidenze molto bassa; raccomandazione condizionale)
In caso di focolai epidemici e situazioni endemiche, avviare inter venti per aumentare la adesione all'igiene delle mani (Qualità evidenze molto bassa; raccomandazione condizionale)
In caso di epidemia, utilizzare DPI (guanti e camici/grembiuli usa e getta) per ridurre la trasmissione di CD o l’incidenza di ICD (Qualità evidenze molto bassa; raccomandazione forte)
In caso di epidemia o di situazione endemica, utilizzare DPI (guanti e camici/grembiuli usa e getta) per ridurre la trasmissione di CD o l’incidenza di ICD (Qualità evidenze molto bassa; raccomandazione condizionale)
Pr ecauzionidacontatto
Accogliere i pazienti con ICD in una stanza singola con bagno dedicato per ridurre la trasmissione ad altri pazienti Se esiste un numero limitato di camere singole, dare la priorità ai pazienti con incontinenza fecale (Qualità evidenze moderata; raccomandazione forte)
Se è necessario il cohorting dei pazienti, si raccomanda di collocare assieme pazienti infetti o colonizzati con lo stesso microrganismo, vale a dire non collocare assieme pazienti con ICD e pazienti con altri microrganismi multiresistenti come lo Staphylococcus aureus resistente alla meticillina oppure l'Enterococcus resistente alla vancomicina (Qualità evidenze moderata; raccomandazione forte)
In caso di epidemia e di situazione endemica, utilizzare le precauzioni di contatto per ridurre la trasmissione di CD e ridurre l'incidenza di ICD. (Qualità evidenze molto bassa; raccomandazione forte)
GIm PIOS Vol 12, n 4, ottobre-dicembre 2022 202
I G I E N E D E L L E M A N I , D P I , P R E C A U Z I O N I D A C O N T A T T O , P U L I Z I A A M B I E N T A L E E D I S I N F E Z I O N E , F O R M A Z I O N E
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
IDSA SHEA 2017
Pr ecauzionidacontatt
I pazienti con sospetta ICD, in attesa dei risultati del test per CD, devono essere preventivamente assistiti con precauzioni da contatto se i risultati non possono essere ottenuti lo stesso giorno (Qualità evidenze moderata; raccomandazione forte)
Continuare le precauzioni da contatto per almeno 48 ore dopo la risoluzione della diarrea (Qualità evidenze bassa; raccomandazione debole)
Prolungare le precauzioni da contatto fino alla dimissione se i tassi di ICD rimangono elevati nonostante l'implementazione delle misure standard di controllo delle ICD (Qualità bassa; raccomandazione debole)
Utilizzare attrezzature usa e getta per il paziente quando possibile e assicurarsi che l'attrezzatura riutilizzabile sia accuratamente pulita e disinfettata, preferibilmente con un disinfettante sporicida compatibile con l'attrezzatura (Qualità bassa; raccomandazione debole)
Puliziaambientaleedisinfezione
La pulizia quotidiana con un agente sporicida dovrebbe essere considerata in combinazione con altre misure per prevenire le ICD durante focolai o in contesti iperendemici (tassi alti sostenuti nel tempo) o se vi sono prove di casi ripetuti di ICD nella stessa stanza (Qualità evidenze bassa; raccomandazione debole)
La pulizia terminale della stanza con un agente sporicida deve essere considerata in combinazione con altre misure per prevenire le ICD, nel caso di tassi elevati endemici o focolai epidemici o se vi sono evidenze di casi ripetuti di ICD nella stessa stanza. (Qualità evidenze bassa; raccomandazione debole)
In questo momento ci sono dati limitati per raccomandare l'uso della disinfezione automatizzata terminale utilizzando un metodo sporicida per la prevenzione di ICD (Nessuna raccomandazione)
Utilizzare misure di efficacia della pulizia per garantire la qualità della pulizia ambientale (Buona pratica)
Formazione
In caso di epidemia, introdurre la disinfezione sporicida ambientale quotidiana e la disinfezione terminale delle stanze dei pazienti con ICD per ridurre la trasmissione di ICD (Qualità molto bassa; raccomandazione forte)
In un contesto endemico, introdurre la disinfezione sporicida ambientale quotidiana e la disinfezione terminale delle stanze dei pazienti con ICD per ridurre la trasmissione di ICD (Qualità molto bassa; raccomandazione condizionale)
In contesto endemico il panel ritiene che i sistemi di disinfezione no touch sono efficaci quanto l'ipoclorito nel ridurre la contaminazione ambientale con CD. (Qualità evidenze molto bassa; Nessuna raccomandazione)
Educare gli operatori sanitari sulla prevenzione delle ICD per migliorare le loro conoscenze e competenze sulle strategie di prevenzione (Qualità evidenze molto bassa in contesti endemici, assente per eventi epidemici; raccomandazione forte)
Implementare un programma formativo insieme ad altre misure di inter vento per ridurre i tassi di ICD (la formazione del personale dei ser vizi ambientali si è rivelata di particolare importanza per la prevenzione delle ICD per garantire una pulizia continua di alta qualità) (Qualità evidenze molto bassa; raccomandazione condizionale)
Educare i pazienti con ICD e i loro visitatori sulle misure di prevenzione per ICD (Qualità delle evidenze non classificata per scarsità di dati; raccomandazione forte)
203 GIm PIOS Vol 12, n 4, ottobre-dicembre 2022
o
ESCMID 2018
ASCRS 2021
IDSA/SHEA 2017
Antibioticstewardship
Per ridurre il rischio di ICD ridurre al minimo la frequenza e la durata della terapia antibiotica ad alto rischio e il numero di agenti antibiotici prescritti (Qualità evidenze moderata; raccomandazione forte)
Implementare un programma di antibiotic stewardship (Buona pratica)
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
In caso di epidemia, la restrizione di agenti/classi antibiotici è efficace nel ridurre i tassi ICD (Qualità evidenze bassa; raccomandazione forte)
In situazione endemica, la restrizione di agenti/classi antibiotici è efficace nel ridurre i tassi ICD (Qualità evidenze moderata; raccomandazione forte)
La scelta degli antibiotici sui quali concentrare gli inter venti si deve basare sull'epidemiologia locale e sui ceppi di CD. È opportuno considerare la restrizione di fluorochinoloni, clindamicina e cefalosporine (ad eccezione della profilassi antibiotica chirurgica) (Qualità evidenze moderata; raccomandazione forte)
RuolodeiPPI
Sebbene esista un'associazione epidemiologica tra l'uso dell'inibitore di pompa protonica (IPP) e l’ICD, e sebbene gli IPP non necessari dovrebbero essere sempre sospesi, non vi sono prove sufficienti a sostenere l’interruzione degli IPP come misura per prevenire le ICD (Nessuna raccomandazione)
Pr ofilassiperlapr evenzionedi
Al momento non vi sono dati sufficienti per raccomandare la somministrazione di probiotici per la prevenzione primaria delle ICD al di fuori degli studi clinici. (Nessuna raccomandazione)
Ridurre la durata della terapia antibiotica è efficace nel ridurre i tassi ICD (Qualità evidenze molto bassa; raccomandazione forte)
Non è raccomandata la somministrazione di routine di probiotici per prevenire le ICD durante un trattamento antibiotico. (Qualità evidenze bassa; raccomandazione forte)
La profilassi di routine con antibiotici anti-ICD durante un trattamento antibiotico sistemico non è raccomandata. (Buona pratica)
In pazienti molto selezionati, con una storia di ICD con recidive multiple per l'uso di antibiotici sistemici, può essere considerata la profilassi con microbiota, che risparmia antibiotici anti-ICD, dopo aver bilanciato attentamente il rischio e i benefici e dopo il consulto con uno specialista in malattie infettive o in microbiologia clinica (Buona pratica)
L'implementazione di un programma di antibiotic stewardship può ridurre i tassi di ICD (Qualità evidenze moderata; raccomandazione forte)
I probiotici possono essere utili nella prevenzione della ICD, ma non nel trattamento (Qualità evidenze alta; raccomandazione debole)
GIm PIOS Vol 12, n 4, ottobre-dicembre 2022 204
ESCMID 2018
ESCMID 2021
IDSA/SHEA 2021 ASCRS 2021
A N T I B I O T I C S T E W A R D S H I P , T R A T T A M E N T O D E I C A S I D I C D
ICD
IDSA/SHEA 2017
Trattamentodeipazienticon
Interrompere la terapia con agenti antibiotici promotori di ICD il più presto possibile, in quanto ciò può influenzare il rischio di recidiva (Qualità evidenze moderata; raccomandazione forte)
La terapia antibiotica per ICD dovrebbe essere avviata empiricamente per situazioni in cui si prevede un notevole ritardo nella conferma di laboratorio o in caso di ICD fulminante.
(Qualità evidenze bassa: raccomandazione debole)
Si raccomanda la vancomicina o la fidaxomicina invece che il metronidazolo per un episodio iniziale di ICD. Il dosaggio è vancomicina 125 mg per via orale 4 volte al giorno o fidaxomicina 200 mg due volte al giorno per 10 giorni (Qualità evidenze alta; raccomandazione forte)
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Effettuare un trattamento precoce dei pazienti con diagnosi di ICD. (Qualità evidenze molto bassa; raccomandazione condizionale)
In caso di ICD non grave, interrompere la terapia antibiotica, se possibile, con l'antibiotico promotore di ICD e monitorare attentamente il paziente per 48 ore (Buona pratica)
Per l'episodio iniziale di ICD si consiglia fidaxomicina 200 mg due volte al giorno per 10 giorni. (Qualità evidenze moderata; raccomandazione forte)
Per i pazienti con un episodio iniziale di ICD, suggeriamo di usare la fidaxomicina piuttosto che un ciclo standard di vancomicina Questa raccomandazione attribuisce un valore elevato agli effetti benefici e alla sicurezza della fidaxomicina, ma la sua implementazione dipende dalle risorse disponibili La vancomicina rimane un'alternativa accettabile (Qualità evidenze moderata; raccomandazione condizionale)
La vancomicina orale o la fidaxomicina sono considerate il trattamento di prima linea per ICD, mentre il metronidazolo da solo non è più considerato un trattamento di prima linea appropriato (Qualità evidenze alta; raccomandazione forte)
Quando l'accesso alla fidaxomicina è limitato, è ragionevole effettuare una stratificazione del rischio per un uso selezionato In questo caso, la fidaxomicina è raccomandata ogni volta che i medici ritengono elevato il rischio di recidiva Ciò può essere supportato da un'età avanzata del paziente (>65 anni) più la presenza di uno o più fattori di rischio aggiuntivi, ad esempio ICD associata all'assistenza sanitaria, precedente ricovero negli ultimi 3 mesi, uso concomitante di antibiotici, IPP iniziato durante/dopo la diagnosi di ICD e un precedente episodio di ICD Si presume che il rischio di recidiva sia maggiore con la presenza di più fattori di rischio. (Qualità evidenze moderata; raccomandazione condizionale)
205 GIm PIOS Vol 12, n 4, ottobre-dicembre 2022
ESCMID 2018 ESCMID 2021 IDSA/SHEA 2021 ASCRS 2021
ICD
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
IDSA/SHEA 2017
In contesti in cui l'accesso alla vancomicina o alla fidaxomicina è limitato, suggeriamo di utilizzare il metronidazolo solo per un episodio iniziale di ICD non grave. (Qualità evidenze alta; raccomandazione debole)
Il dosaggio suggerito è metronidazolo 500 mg per via orale 3 volte al giorno per 10 giorni. Evitare cicli ripetuti o prolungati a causa del rischio di neurotossicità cumulativa e potenzialmente irreversibile. (Qualità evidenze moderata; raccomandazione forte)
Quando la fidaxomicina non è disponibile o fattibile, la vancomicina orale 125 mg quattro volte al giorno per 10 giorni è un'alternativa adeguata. (Qualità evidenze alta; raccomandazione forte)
Il metronidazolo orale 500 mg tre volte al giorno per 10 giorni deve essere utilizzato solo quando la vancomicina e la fidaxomicina non sono disponibili o fattibili. (Qualità evidenze moderata; raccomandazione forte)
L'uso di vancomicina 500 mg quattro volte al giorno non è raccomandato (Qualità evidenze molto bassa; raccomandazione forte)
Considerare la somministrazione prolungata di fidaxomicina (fidaxomicina estesa), cioè 200 mg due volte al giorno nei giorni 1-5 e 200 mg una volta al giorno a giorni alterni nei giorni 7-25, per un episodio di ICD con aumentato rischio di recidiva, specialmente nei pazienti anziani ospedalizzati (Qualità evidenze bassa; raccomandazione debole)
Quando la fidaxomicina non è disponibile o fattibile, prendere in considerazione l'aggiunta di bezlotoxumab al trattamento standard per via orale per un episodio di ICD con aumentato rischio di recidiva Nei pazienti con una storia di insufficienza cardiaca congestizia, l'uso di bezlotoxumab deve essere limitato a quando i benefici superano i rischi. (Qualità evidenze moderata; raccomandazione debole)
GIm PIOS Suppl vol 12, n 4, ottobre-dicembre 2022 206
Trattamentodeipazienticon
ESCMID 2018 ESCMID 2021 IDSA/SHEA 2021 ASCRS 2021
ICD
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
IDSA/SHEA 2017
T
Per l’ICD fulminante (la ICD fulminante, precedentemente indicata come ICD grave e complicata, può essere caratterizzata da ipotensione o shock, ileo o megacolon), la vancomicina somministrata per via orale è il regime di scelta (Qualità evidenze moderata; raccomandazione forte)
Le opzioni per il trattamento di qualsiasi episodio di ICD grave e grave-complicato includono vancomicina 125 mg quattro volte al giorno per 10 giorni o fidaxomicina 200 mg due volte al giorno per 10 giorni. Non ci sono dati a sostegno della superiorità dell'uno sull'altro. (Buona pratica)
Se è presente ileo, la vancomicina può essere somministrata anche per via rettale (Qualità evidenze bassa; raccomandazione debole)
Il dosaggio di vancomicina è di 500 mg per via orale 4 volte al giorno e di 500 mg in circa 100 ml di soluzione fisiologica normale per via rettale ogni 6 ore come clistere di ritenzione. Il metronidazolo somministrato per via endovenosa deve essere somministrato insieme a vancomicina per via orale o rettale, in particolare se è presente ileo. Il dosaggio del metronidazolo è di 500 mg per via endovenosa ogni 8 ore (Qualità evidenze moderata; raccomandazione forte)
Per le ICD gravi l'aggiunta di routine di metronidazolo endovena alla terapia orale non è raccomandata. (Qualità evidenze molto bassa; raccomandazione debole)
Quando un paziente sta peggiorando o progredisce verso una ICD grave complicata mentre è in terapia antibiotica anti-ICD, l'aggiunta di tigeciclina ev 50 mg due volte al giorno (dose di carico di 100 mg) può essere presa in considerazione caso per caso (Qualità evidenze molto bassa; raccomandazione debole)
Consultare un chirurgo per qualsiasi caso grave-complicato (Buona pratica)
La chirurgia per la colite da CD dovrebbe essere tipicamente riser vata ai pazienti con perforazione del colon o colite grave che non migliora con terapia medica (Qualità evidenze bassa; raccomandazione forte)
Se per pazienti gravemente malati è necessario ricorrere alla chirurgia, eseguire la colectomia subtotale con conser vazione del retto (Qualità evidenze moderata; raccomandazione forte)
L’ileostomia con deviazione dell'ansa e lavaggio anterogrado del colon con vancomicina è un approccio alternativo che può portare a risultati migliori.
(Qualità evidenze bassa; raccomandazione debole)
La colectomia addominale totale potrebbe essere prevenuta dalla colectomia parziale o dall'ileostomia. (Qualità evidenze molto bassa; raccomandazione debole)
La colectomia subtotale con ileostomia finale è la procedura chirurgica raccomandata per la colite da CD grave, complicata o fulminante (Qualità evidenze bassa; raccomandazione forte)
L’ileostomia con deviazione dell'ansa e lavaggio anterogrado del colon può essere un'alternativa alla colectomia subtotale per il trattamento di ICD gravi o fulminanti (Qualità evidenze bassa; raccomandazione debole)
207 GIm PIOS Suppl vol 12, n 4, ottobre-dicembre 2022
rattamentodeipazienticon
ESCMID 2018 ESCMID 2021 IDSA/SHEA 2021 ASCRS 2021
ICDinformasevera/fulminante
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
IDSA/SHEA 2017
Quando la terapia orale non è possibile, tentare la somministrazione intraluminale (gastroduodenale o coloscopica) di vancomicina o fidaxomicina (Buona pratica)
Prendere in considerazione il trattamento aggiuntivo con metronidazolo endovena 500 mg tre volte al giorno o tigeciclina endovena 50 mg due volte al giorno (dose di carico di 100 mg) (Qualità evidenze molto bassa; raccomandazione debole)
Quando un’ICD non complicata non risponde al trattamento e il paziente non sta peggiorando o non progredisce verso una ICD complicata, rivalutare attentamente la diagnosi di ICD e considerare una diagnosi alternativa (Qualità evidenze molto bassa; raccomandazione debole)
Consultare un chirurgo non appena le condizioni del paziente peggiorano e il paziente non risponde al trattamento standard (Buona pratica)
L'FMT può essere una terapia di salvataggio per i pazienti con ICD grave e complicata, che sono peggiorati nonostante il trattamento antibiotico per ICD e per i quali la chirurgia non è fattibile. L'analisi del rapporto rischio-beneficio dell'FMT e/o della gestione chirurgica dovrebbe essere presa caso per caso e discussa dal team multidisciplinare (Qualità evidenze molto bassa; raccomandazione debole)
GIm PIOS Vol 12, n 4, ottobre-dicembre 2022 208
Trattamentooralenonpossibile
ESCMID 2018 ESCMID 2021 IDSA/SHEA 2021 ASCRS 2021
Nonrispostaallaterapia
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
IDSA/SHEA 2017 T
Trattare una prima recidiva di ICD con vancomicina orale con un regime di riduzione graduale e pulsato piuttosto che un secondo ciclo standard di 10 giorni di vancomicina (Qualità evidenze bassa; raccomandazione debole)
Se l'episodio iniziale di ICD è stato trattato con vancomicina o metronidazolo, la fidaxomicina 200 mg due volte al giorno per 10 giorni è l'agente preferito per il trattamento di una prima recidiva di ICD. (Qualità evidenze bassa; raccomandazione forte)
Nei pazienti con episodi ricorrenti di ICD, suggeriamo fidaxomicina (regime standard o a impulsi estesi) piuttosto che un ciclo standard di vancomicina. La vancomicina in un r egime ridotto e pulsato o la vancomicina come ciclo standard sono alternative accettabili per una prima r ecidiva di ICD Per i pazienti con r ecidive multiple, la vancomicina in un r egime ridotto e pulsato, la vancomicina seguita da rifaximina e il FMT sono opzioni in aggiunta alla fidaxomicina. (Qualità evidenze bassa; raccomandazione debole)
Un ciclo prolungato di vancomicina, l'aggiunta di bezlotoxumab o l'uso di fidaxomicina, è una terapia accettabile per ICD ricorrenti o refrattarie in pazienti stabili (Qualità evidenze moderata; raccomandazione forte)
Trattare una prima recidiva di ICD con un ciclo di 10 giorni di fidaxomicina piuttosto che con un ciclo standard di 10 giorni di vancomicina (Qualità evidenze moderata; raccomandazione debole) oppure
Se l'episodio iniziale di ICD è stato trattato con fidaxomicina, prendere in considerazione l'aggiunta di bezlotoxumab (quando disponibile e fattibile) ad un trattamento antibiotico standard orale, ad esempio vancomicina o fidaxomicina (Qualità evidenze per l'aggiunta a vancomicina moderata; raccomandazione debole. Per fidaxomicina buona pratica)
Per i pazienti con un episodio ricorrente di ICD negli ultimi 6 mesi, suggeriamo di utilizzare bezlotoxumab insieme agli antibiotici standard piuttosto che ai soli antibiotici standard Questa raccomandazione attribuisce un valore elevato ai potenziali benefici clinici, ma l'implementazione è spesso limitata da considerazioni di fattibilità (Qualità evidenze molto bassa; raccomandazione condizionale)
Trattare una prima recidiva di ICD con un ciclo standard di 10 giorni di vancomicina piuttosto che con un secondo ciclo di metronidazolo, se il metronidazolo è stato utilizzato per l'episodio primario
(Qualità evidenze bassa; raccomandazione debole)
Le opzioni di trattamento antibiotico per i pazienti con >1 recidiva di ICD includono la terapia orale con vancomicina utilizzando un regime di riduzione graduale e pulsato oppure un ciclo standard di vancomicina orale seguito da rifamixina o fidaxomicina.
(Qualità evidenze bassa; raccomandazione debole)
Considerare uno schema di trattamento di riduzione graduale e pulsata della vancomicina quando fidaxomicina o bezlotoxumab non sono disponibili o fattibili. (Qualità evidenze molto bassa; raccomandazione debole)
Le opzioni terapeutiche per una seconda o ulteriore recidiva di ICD includono FMT dopo pretrattamento antibiotico standard o bezlotoxumab in aggiunta al trattamento antibiotico standard. La scelta tra l'uno e l'altro dipende dalle caratteristiche dei pazienti, dal trattamento precedente, dalle normative locali, dalla disponibilità e dalla fattibilità Per FMT è obbligatoria un'adeguata valutazione multidisciplinare del rischio e i prodotti FMT dovrebbero essere disponibili con preparazione e screening standardizzati.
(Qualità evidenze moderata per FMT, bassa per bezlotoxumab; raccomandazione debole)
209 GIm PIOS Suppl vol 12, n 4, ottobre-dicembre 2022
rattamentodeller ecidive
ESCMID 2018 ESCMID 2021 IDSA/SHEA 2021 ASCRS 2021
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
IDSA/SHEA 2017
È raccomandato il trapianto di microbiota fecale nei pazienti con recidive multiple di ICD che non hanno risposto agli appropriati trattamenti antibiotici (Qualità evidenze moderata; raccomandazione forte)
Il trapianto di microbiota fecale (FMT ) è raccomandato per i pazienti con recidive multiple di ICD che hanno fallito trattamenti antibiotici appropriati. (Qualità evidenze moderata; raccomandazione forte)
Nei pazienti con ICD ricorrente o refrattaria di dovrebbe considerare la batterioterapia fecale (p es , trapianto di microbiota intestinale) quando le misure convenzionali, incluso un adeguato trattamento antibiotico, hanno fallito (Qualità evidenze moderata; raccomandazione forte)
Al momento non ci sono dati sufficienti per raccomandare di estendere la durata di un antibiotico anti-CD oltre il ciclo di trattamento raccomandato o iniziare empiricamente un nuovo ciclo con un antibiotico antiCD per i pazienti che richiedono una terapia antibiotica continua dell'infezione sottostante o che richiedono un ritrattamento con antibiotici poco dopo il completamento del trattamento anti-CD (Nessuna raccomandazione)
Nei casi di recidiva o ICD refrattaria si può considerare il trattamento con altri agenti inclusi altri antimicrobici, agenti leganti e probiotici (Qualità evidenze bassa; raccomandazione debole) Trattamentoinetàpediatrica
Per il trattamento di bambini con un episodio iniziale o una prima recidiva di ICD non grave, sono raccomandati il metronidazolo o la vancomicina (Qualità evidenze bassa; raccomandazione debole)
Per i bambini con un episodio iniziale di ICD grave, la vancomicina orale è raccomandata rispetto al metronidazolo.
(Qualità evidenze moderata; raccomandazione forte)
Per i bambini con un secondo o più episodio di ICD ricorrente, la vancomicina orale è raccomandata rispetto al metronidazolo
(Qualità evidenze bassa; raccomandazione debole)
Considerare il FMT per i pazienti pediatrici con recidive multiple di ICD dopo il trattamento antibiotico standard (Qualità evidenze bassa; raccomandazione debole)
GIm PIOS Suppl vol 12, n 4, ottobre-dicembre 2022 210
Trattamentodeller ecidive
ESCMID 2018 ESCMID 2021 IDSA/SHEA 2021 ASCRS 2021
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
IDSA/SHEA 2017
I fattori di rischio più importanti per l’ICD grave sono l'età avanzata (>65 anni) e la presenza di molteplici comorbilità (Qualità moderata; raccomandazione forte)
L'età avanzata (> 65 anni) è il fattore di rischio più importante per l’ICD ricorrente (Qualità evidenze moderata; raccomandazione forte)
I pazienti con precedenti episodi di ICD sono a maggior rischio di ICD ricorrente. (Qualità evidenze moderata; raccomandazione forte)
I pazienti con ICD associata all'assistenza sanitaria e precedente ricovero negli ultimi tre mesi sono considerati a maggior rischio di ICD ricorrente. (Qualità evidenze bassa; raccomandazione debole)
I pazienti con uso concomitante di antibiotici non anti-CD dopo la diagnosi di ICD sono considerati a maggior rischio di recidiva di ICD (Qualità evidenze molto bassa; raccomandazione debole)
I pazienti che assumono IPP iniziati durante/dopo la diagnosi di ICD sono considerati ad aumentato rischio di ICD ricorrente. (Qualità evidenze molto bassa; raccomandazione debole)
Riferimenti bibliografici
European Society of Clinical Microbiology and Infectious Diseases (ESCMID)
Crobach MJT et al. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection Clin Microbiol Infect 2016; 22: S63-S81
Tschudin-Sutter S et al Guidance document for prevention of Clostridium difficile infection in acute healthcare settings Clin Microbiol Infect 2018; 24: 1051-54
Van Prehn J et al European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin Microbiol Infect 2021; suppl 2: S1-S21
Infectious Diseases Society of America (IDSA) e Society for Healthcare Epidemiology of America (SHEA)
McDonald LC et al Clinical practice guidelines for Clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA) Clin Infect Dis 2018;336:1049
Johnson S et al Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA): 2021 Focused Update Guidelines on Management of Clostridioides difficile Infection in Adults. Clin Infect Dis 2021; 75(5): e1029-44
American Society of Colon and Rect al Surgeons (ASCRS)
Poylin V et al. The American Society of Colon and Rect al Surgeons Clinical Practice Guidelines for the Management of Clostridioides difficile Infection Dis Colon Rectum 2021; 64: 6508
211 GIm PIOS Suppl vol 12, n 4, ottobre-dicembre 2022
Fattoripr ognostici
ESCMID 2018 ESCMID 2021
IDSA/SHEA 2021 ASCRS 2021
ALLEG ATO B
La formazione continua del personale sanitario
La formazione del personale sanit ario deve essere considerat a nell’ambito delle teorie dell’educazione e dell’apprendimento dell’adulto.
L’adulto, oltre ad avere una personalit à ben definit a, ha percezione di sé come persona responsabile e chiede di essere tratt ato di conseguenza; egli ha l’esigenza di conoscere lo scopo e l’utilit à dell’apprendimento per la sua vit a o per la sua carriera ed è motivato ad apprendere ciò che gli serve nel momento in cui gli serve.
Esiste un ulteriore fattore fondament ale: l’esperienza Ciò che viene insegnato si deve inserire in un contesto di esperienze o conoscenze e dare vit a ad una riorganizzazione dei saperi: se ciò non accade, il rischio è quello di un apprendimento fittizio e di breve durat a.
D’altro canto, l’esperienza dell’adulto è un grande valore per l’apprendimento e può essere proficuamente utilizzat a facendo ricorso a tecniche e metodologie didattiche che simulano, ad esempio, il vissuto lavorativo della persona (case studies, simulazioni, attivit à di problem solving o laboratori)
L’insegnamento all’adulto (andragogia) si fonda quindi su un modello di apprendimento basato sul processo, piuttosto che sui contenuti: la differenza è che il modello contenutistico si occupa di trasmettere informazioni e abilit à, che nel tempo divent ano obsolete, mentre il modello di processo intende fornire metodi e risorse per aiut are i discenti ad acquisire informazioni e abilit à in modo continuativo
Il metodo PBL (Problem Based Learning)
In quest a prospettiva si inserisce il metodo del PBL che, a partire da una situazione problematica che necessit a di una spiegazione e di una soluzione, induce i partecipanti a ricercare, sotto la guida di un tutor, le informazioni necessarie per capirla e a ipotizzare le soluzioni più adeguate per affront arla
L’apprendimento basato su problemi, essendo un metodo che propone a un gruppo di professionisti di affront are situazioni molto vicine alla realt à, è ben accetto e può indurre alla riflessione in merito alla modifica di atteggiamenti e di consuetudini considerate non adeguate nel controllo delle infezioni.
Di seguito si riport ano alcune note esplicative del metodo accompagnate da un esempio utilizzabile per una sessione formativa in merito all’assistenza di una persona affett a da ICD.
L’esempio RUOLI
Gruppo di apprendimento Generalmente è costituito da 6-8 persone
Nell’ambito della formazione continua è preferibile che il gruppo sia multiprofessionale in quanto nella realt à l’analisi dei problemi è più corrett a e complet a se condott a congiunt amente da più operatori e professionisti (medici, infermieri, personale di supporto, ); la multiprofessionalit à, inoltre, facilit a la riflessione e il confronto, sottolineando le differenze di approccio, ma anche i punti in comune che possono aiut are a trovare la soluzione più adeguat a al problema, sotto il profilo dell’organizzazione e dei comport amenti
Tutor del gruppo di apprendimento
È colui che favorisce la discussione e lo sviluppo delle fasi. Il tutor indirizza i partecipanti alla ricerca delle fonti bibliografiche e di altre informazioni, sostiene il gruppo nella scelt a di soluzioni pertinenti basate sull’evidenza scientifica, facilit a l’apprendimento rendendo consapevoli i partecipanti del loro ragionamento, ma non trasmette conoscenze né t antomeno soluzioni preconfezionate.
Nel nostro caso il ruolo del tutor può essere affidato ad un medico o ad un infermiere/a con competenze specifiche nella sorveglianza e controllo delle infezioni o ad un professionist a con esperienza tutoriale affiancato/a comunque da uno/due esperti nel campo della sorveglianza e controllo delle infezioni
Condizioni organizzative Nell’ambito della formazione continua è necessario razionalizzare i tempi e le risorse disponibili Per t ali motivi il PBL può essere concentrato in poche ore; è necessario usufruire, anche temporaneamente, di un locale in cui i partecipanti possono disporre di un t abellone o di una lavagna a fogli o di un pc.
Devono essere predisposte le copie necessarie del documento di consenso SImPIOS, fogli per appunti,
Fasi di conduzione del PBL
1a fase - Presentazione del problema
Descrizione: il problema è l’elemento centrale ed è concepito come una situazione di stimolo alla successiva discussione
Organizzazione: si consegna ad ogni partecipante un foglio con la descrizione della situazione problematica che riport a un titolo emblematico.
GIm PIOS Suppl vol 12, n 4, ottobre-dicembre 2022 212
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
La situazione problematica...
Maècosìimportante?
R V è una signora di 82 anni ricoverata in un reparto di medicina per un focolaio broncopneumonico; dopo alcuni giorni dal ricovero presenta diarrea. L’infermiera Florence registra in cartella infermieristica la situazione problematica e riferisce alla coordinatrice Virginia: “La Signora RV ha evacuato 4 volte feci liquide in poche ore forse è di nuovo un caso di Clostridioides difficile, dobbiamo insistere nell’igiene delle mani, in particolare il lavaggio antisettico” Uno studente infermiere del 1° anno del corso di laurea inter viene: “Abbiamo studiato che il frizionamento sostituisce il lavaggio mani, perché dobbiamo lavarci le mani?” L’infermiera Florence riprende il discorso: “La signora è in una stanza a tre letti e non vi sono altre camere disponibili, che cosa facciamo? Questo è il 2° caso di diarrea in una settimana, dovremmo procedere a un isolamento da contatto”.
La coordinatrice Virginia: “Concordo! È meglio che ripassiamo tutti come dobbiamo procedere. Florence ti chiedo di verificare come si comportano gli addetti alla sanificazione ambientale”
Il medico Ignazio: “Abbiamo informato la Direzione Sanitaria dell’accaduto, dovremo collaborare ad una indagine epidemiologica volta a definire se è in corso un cluster epidemico Il laboratorio mi ha avvisato che in tutti i casi di ICD le tossine A e B erano positive” “Ma è così importante?” pensa lo studente del 1° anno
La coordinatrice Virginia: “Dobbiamo fornire anche delle informazioni ai parenti e ai visitatori”
Il medico Ignazio e la coordinatrice Virginia propongono di individuare degli indicatori per il futuro, in quanto: “…ci possono aiutare a mantenere un controllo effettivo di questo problema”.
2a fase - Analisi dei termini del problema
Descrizione: la situazione viene analizzat a attraverso l’intervento di tutti; il tutor stimola le libere associazioni e l’esplicit azione delle parole chiave, dei termini e dei concetti non immediat amente comprensibili e che richiedono uno studio specifico
Durante la discussione il tutor invit a a riflettere e a verificare le conoscenze del gruppo in relazione ai passaggi significativi del problema.
È possibile che si evidenzino anche ulteriori aspetti del problema non descritti nella situazione problematica
Organizzazione: nel proseguire la discussione, specie se il gruppo proviene da sedi lavorative diverse, è probabile che siano evidenziate differenze sost anziali che non trovano conferma o consensi nel gruppo; il tutor registra e sistematizza le terminologie e gli aspetti che richiedono approfondimento sul t abellone/lavagna/PC
2a fase - L’esempio
R.V. è una signora di 82 anni ricoverat a in un reparto di medicina per un focolaio broncopneumonico; dopo alcuni giorni dal ricovero present a diarrea
PassaggiTermini–Concetti
1 L’infermiera Florence registra in cartella infermieristica la situazione problematica e riferisce alla coordinatrice Virginia: “La Signora RV ha evacuato 4 volte feci liquide in poche ore forse è di nuovo un caso di Clostridioides difficile, dobbiamo insistere nell’igiene delle mani, in particolare il lavaggio antisettico”
2. La coordinatrice: “Nell’adottare le misure precauzionali standard, in questo caso, dobbiamo preferire il lavaggio della mani con detergente-antisettico” Uno studente infermiere del 1° anno del corso di laurea inter viene: “Abbiamo studiato che il frizionamento sostituisce il lavaggio mani, perché dobbiamo lavarci le mani?”.
3. L’infermiera Florence riprende il discorso: “La signora è in una stanza a tre letti e non vi sono altre camere disponibili, che cosa facciamo? Questo è il 2° caso di diarrea in una settimana, dovremmo procedere a un isolamento da contatto”.
4. La coordinatrice: “Concordo! Ma è meglio che ripassiamo tutti come dobbiamo procedere. Florence ti chiedo di verificare come si comportano gli addetti alla sanificazione ambientale”.
5. Il medico Ignazio: “Abbiamo informato la Direzione Sanitaria dell’accaduto, dovremo collaborare a un’indagine epidemiologica volta a definire se è in corso un cluster epidemico”. Il laboratorio mi ha avvisato che in tutti i casi di ICD le tossine A e B erano positive.
6. La coordinatrice: “Dobbiamo fornire anche delle informazioni semplici ma esaustive a parenti e visitatori”
7. Il medico Ignazio e la Coordinatrice Virginia propongono di individuare degli indicatori per il futuro, in quanto: “ ci possono aiutare a mantenere un controllo effettivo di questo problema”
Clostridioides difficile, diarrea, quadri clinici, modalità di trasmissione
Misure precauzionali, igiene mani, frizionamento alcolico delle mani
Isolamento da contatto, misure di controllo comportamentali e dell’ambiente
Sanificazione dell’ambiente
Indagine epidemiologica, cluster epidemico, tossine A e B, esame colturale
Informazione, educazione terapeutica e sanitaria
Indicatore, criterio, standard
213 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Formulazione dei bisogni di apprendimento e identificazione del percorso di studio
3a fase
Descrizione: in quest a fase si esplicit ano i bisogni formativi o gli argomenti che necessit ano di ulteriore approfondimento e i riferimenti bibliografici per lo studio.
Organizzazione: a ogni componente del gruppo viene con-
3a Fase - L’esempio
segnat a la bibliografia; nel nostro caso il riferimento principale è il documento di indirizzo SImPIOS “Prevenzione e controllo delle infezioni da Clostridioides difficile” al quale si possono affiancare altre document azioni, se del caso. Il tutor ha una funzione di continuo supporto, pone domande per creare ulteriori curiosit à
PassaggiTermini-ConcettiBisognidiapprendimentoDocumentazione
1 L’infermiera Florence registra in cartella infermieristica la situazione problematica e riferisce alla coordinatrice Virginia: “La Signora RV ha evacuato 4 volte feci liquide in poche ore forse è di nuovo un caso di CD, dobbiamo insistere nell’igiene delle mani, in particolare il lavaggio antisettico”.
2. La coordinatrice: “Nell’adottare le misure precauzionali standard, in questo caso, dobbiamo preferire il lavaggio delle mani con detergente-antisettico”. Uno studente infermiere del 1° anno del corso di laurea inter viene: “Abbiamo studiato che il frizionamento sostituisce il lavaggio mani, perché dobbiamo lavarci le mani?”
3 L’infermiera Florence riprende il discorso: “La signora è in una stanza a tre letti e non vi sono altre camere disponibili, che cosa facciamo? Questo è il 2° caso di diarrea in una settimana, dovremmo procedere a un isolamento da contatto”
4 La coordinatrice: “Concordo! Ma è meglio che ripassiamo tutti come dobbiamo procedere Florence ti chiedo di verificare come si comportano gli addetti alla sanificazione ambientale”
5. Il medico Ignazio: “Abbiamo informato la Direzione Sanitaria dell’accaduto, dovremo collaborare a un’indagine epidemiologica volta a definire se è in corso un cluster epidemico Il laboratorio mi ha avvisato che in tutti i casi di CDI le tossine AeB erano positive”.
6. La coordinatrice: “Dobbiamo fornire anche delle informazioni semplici ma esaustive a parenti e visitatori”.
7. Il medico Ignazio e la coordinatrice Virginia propongono di individuare degli indicatori per il futuro, in quanto: “ … ci possono aiutare a mantenere un controllo effettivo di questo problema”
Clostridioides difficile, diarrea, quadri clinici, modalità di trasmissione
Eziopatogenesi e modalità di trasmissione dell’agente causale
Documento SImPIOS (1 1, 1 2, 2 1, 2 2)
Misure precauzionali, igiene mani, frizionamento alcolico delle mani
Modalità, i 5 momenti fondamentali per l’igiene delle mani, proprietà delle soluzioni detergenti-antisettiche, vantaggi e svantaggi d’uso
Documento SImPIOS (4.5).
Documento OMS igiene mani “Clean Care is safer Care”
Isolamento da contatto, misure di controllo comportamentali e dell’ambiente
Precauzioni standard e da contatto, comportamenti nei confronti della persona e del materiale sanitario
Sanificazione dell’ambiente Modalità e frequenza della sanificazione ambientale e dell’unità paziente
Indagine epidemiologica, cluster epidemico, tossine AeB, es colturale
Informazione, educazione terapeutica e sanitaria
Significato di indagine epidemiologica: focolaio, epidemia Raccolta, trasporto del campione,
Informazioni utili per l’educazione sanitaria
Indicatore, criterio, standard Significato di indicatore, criterio, standard, criteri di scelta degli indicatori
Documento SImPIOS (4.6)
Documento SImPIOS e allegato C
Documento SImPIOS e allegato D
Documento SImPIOS e allegati AeB
Documento INF-OSS
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 214
–
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
4a fase - Lo studio
Descrizione: i partecipanti si attivano per lo studio individuale e di gruppo utilizzando la bibliografia specifica e interpellano gli esperti per approfondire gli eventuali dubbi sollevati durante le discussioni nelle fasi precedenti.
Organizzazione: i partecipanti consult ano la bibliografia e conducono il loro studio.
5a fase - Socializzazione dell’apprendimento condotto
Descrizione: il gruppo si riunisce per riprendere in considerazione il problema e per chiarire gli argomenti alla luce dello studio condotto sulla base della document azione fornit a per trovare le soluzioni migliori basate su prove di efficacia
Organizzazione: il tutor mantiene un clima di apprendimento libero e creativo, sollecit a una reinterpret azione della situazione problematica alla luce dei dati forniti, pone domande in merito alla possibilit à di valut are l’intervento scelto per la soluzione del problema port ando i partecipanti a scegliere l’indicatore opportuno.
6a fase - Valutazione
Descrizione: la valut azione è la parte finale dell’evento formativo Generalmente si propongono due tipi di questionari uno sul gradimento (pianificazione, efficacia formativa, tempo, ...) l’altro sull’apprendimento conseguito.
Considerazione finale
Il metodo dell’apprendimento per problemi, se ricondotto nell’ambito di una strategia condivisa tra Comit ato di controllo, formazione, organizzazione della struttura sanit aria, consente di recuperare l’esperienza professionale e le motivazioni utili a modificare i comport amenti nella realt à quotidiana e a rivalut are l’organizzazione di alcune attivit à a rischio infettivo I bisogni formativi espressi, l’apprendimento e l’interiorizzazione di un possibile cambiamento (si può fare), sono il preambolo per una successiva rivalut azione sul campo delle attivit à, che potrà essere misurat a (uso degli indicatori) o rivalut at a nell’ottica del miglioramento della qualit à
Indicatore
Il gruppo ha elaborato una procedura per la gestione dei pazienti con sospett a o accert at a infezione da Clostridioides difficile per l’unit à operativa /ospedale
Bibliografia
1 Knowles MS Quando l’adulto impara Pedagogia e andragogia Milano: Franco Angeli, 2002.
2 Sasso L, Lotti A Problem-based learning per le professioni sanit arie. Milano: McGraw-Hill, 2007.
215 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
ALLEG ATO C
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
L’informazione a pazienti e familiari
1. SCHEDA INFORMATIVA
Malattia da Clostridioidesdi
fficile
PRECAUZIONI E IGIENE
Clostridioidesdifficile(Cdifficile) è un batterio che può essere presente nell’intestino, ma che si può trovare come contaminante anche nell’ambiente nella sua forma più difficile da eliminare, la spora, che può sopravvivere per settimane. C . difficile si introduce per via orale, raggiunge l’intestino e produce tossine che causano una infiammazione a livello della mucosa intestinale.
Clinicamente la malattia si manifesta con un quadro di enterocolite (diarrea acquosa, perdita di appetito, nausea, dolori addominali). Le forma cliniche generalmente sono lievi, tanto che alcuni soggetti non accusano sintomi particolari. In altri casi, invece, il quadro clinico può diventare più importante. Alcune persone hanno un maggior rischio di infezione: sono, ad esempio, gli anziani, i soggetti con difese immunitarie ridotte, i pazienti che hanno effettuato una prolungata terapia antibiotica
C.difficile è il maggior responsabile di diarrea infettiva negli ospedali e in altre strutture assistenziali, dove si può manifestare anche in forma epidemica, interessando più persone.
C. difficile si trasmette generalmente attraverso le mani, che si contaminano per contatto diretto (con le feci) o indiretto (con oggetti o superfici contaminate) È quindi necessario adottare precauzioni che siano in grado di interrompere la trasmissione, in particolare usare i guanti e lavarsi le mani.
La diagnosi di infezione si basa sul quadro clinico e su esami di laboratorio, in particolare sulla ricerca delle tossine A e B nelle feci. La terapia consiste nell’assunzione di antibiotici che agiscono a livello intestinale In alcuni casi risulta necessario ripetere la terapia perché si è manifestata una recidiva dell’infezione.
LE MISURE DI CONTROLLO
La sistematica applicazione delle misure di seguito elencate è in grado di interrompere la catena di trasmissione e di prevenire la comparsa di nuovi casi di infezione da C . difficile. Ulteriori informazioni possono essere richieste al medico curante e all’infermiere che presta assistenza al paziente.
Segnalazione sulla porta della camera. Il cartello che si trova sulla porta ha lo scopo di richiamare tutti quelli che entrano ad adottare le misure di prevenzione indicate.
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 216
→
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Le mani sono il primo veicolo di diffusione: per questo è vivamente raccomandato che il paziente, gli operatori ed i visitatori si lavino accuratamente le mani con acqua e sapone o con acqua e sapone antisettico, soprattutto in alcuni momenti a particolare rischio infettivo. Il paziente autosufficiente deve lavare le mani dopo l’uso dei ser vizi igienici; il paziente allettato o confuso deve essere aiutato ad effettuare l’igiene delle mani in più momenti della giornata (anche con frizione alcolica, meglio se con salviettine imbevute: questa pratica non è efficace quanto il lavaggio con acqua e sapone, ma riduce comunque in modo significativo la contaminazione)
I visitatori devono lavare le mani prima di contatti con il paziente (per evitare di trasmettergli microrganismi) e prima di lasciare la stanza (per evitare di trasferire C . difficile all’esterno).
Gli operatori sanitari effettuano l’igiene delle mani prima e dopo l’assistenza e dopo aver manipolato biancheria sporca, oggetti o materiali potenzialmente contaminati, anche se hanno indossato i guanti: infatti i guanti non garantiscono una protezione assoluta
La camera singola con bagno dedicato è sempre preferibile, ma è particolarmente raccomandata quando la persona è incontinente o non collabora attivamente all’osser vanza delle misure di controllo. In caso contrario, si applicano le precauzioni da contatto, con particolare attenzione a quanto attiene il potenziale contatto con le feci del paziente È perciò consigliato l’uso di una sedia comoda personalizzata o di padella che sia monouso o personalizzata.
Visite di familiari, badanti, ecc.: è preferibile limitare, per quanto possibile, il numero di visitatori La visita di bambini deve essere rimandata al termine dell’isolamento del paziente affetto da infezione da C difficile
Anche per i visitatori si raccomanda l’impiego di guanti e camice monouso prima del contatto diretto con il paziente, la biancheria del letto o personale, le feci. Durante la visita è bene non sedersi sul letto, non appoggiare oggetti sul comodino e, in caso di telefonate al cellulare, evitare di far toccare la superficie del telefono al paziente.
Prima di lasciare la stanza, dopo aver tolto guanti e camice i visitatori si devono lavare le mani, anche se hanno indossato i guanti.
Se si verificassero casi di diarrea tra i familiari/visitatori, è necessario informarne subito il proprio medico curante.
Il trattamento della biancheria a domicilio In reparto bisogna manipolare con attenzione la biancheria, non appoggiarla a terra o sulla sedia, ma metterla in un sacchetto e portarla direttamente al lavaggio. Per il lavaggio a domicilio temperature uguali o superiori a 60°C e l’uso di detersivo sono considerati adeguati; in caso di contaminazione con feci, aggiungere nel prelavaggio 200 ml di candeggina (circa due bicchieri da tavola) o altro prodotto a base di cloro
La pulizia dell’ambiente a domicilio: è importante per impedire la trasmissione di C . difficile. La massima attenzione deve essere riser vata al ser vizio igienico: si devono pulire i sanitari (compreso l’asse del WC e il bidet), i rubinetti, gli interruttori, la maniglia della porta, il pavimento. Dopo aver pulito si deve disinfettare con un prodotto a base di cloro: candeggina (20 ml in un litro di acqua) o altri prodotti a base di cloro reperibili normalmente presso la grande distribuzione (es. Amuchina®, Milton®), utilizzando le concentrazioni d’uso consigliate dal produttore.
Il testo di questa scheda è stato utilizzato per la realizzazione di una locandina pieghevole con illustrazioni reperibile sul sito internet SImPIOS.
217 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
→
ALLEG ATO C L’informazione a pazienti e familiari
2. SEGNALAZIONE DELLE PREC AUZIONI DA CONTATTO











PRIMA di ENTRARE nella stanza di degenza
PARENTI e VISITATORI sono invitati a consultare il personale infermieristico dell’Unità Operativa e a ritirare e leggere il foglio informativo predisposto, che dà indicazioni sulle precauzioni da adottare in ospedale e al domicilio.
PRECAUZIONI DA CONTATTO
PRIMA di ENTRARE nella stanza di degenza:
lavare le mani con acqua e sapone o detergente antisettico
se le mani sono visibilmente pulite, si può effettuare frizione alcolica




indossare i guanti protettivi monouso
indossare il sovracamice

PRIMA di LASCIARE la stanza di degenza:
rimuovere sovracamice e guanti e deporli nell’apposito contenitore per rifiuti a rischio infettivo
lavare le mani con acqua e sapone o detergente antisettico
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 218 Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Igiene dell’ambiente e delle attrezzature
1. TRACCIA PER LA ELABORAZIONE DI UN PROTOCOLLO
a. Formazione del personale addetto
In presenza di infezione da Clostridioides difficile è import ante ridurre in modo rapido e drastico il serbatoio di spore nell’ambiente mediante misure specifiche di tratt amento. Per ottenere questo è necessario che tutto il personale addetto agli interventi di igiene ambient ale sia educato/formato sulle modalit à con cui si devono effettuare le operazioni di pulizia e disinfezione nelle aree che ospit ano pazienti con ICD; l’attivit à di formazione deve precisare quali sono gli interventi da fare in presenza di CD rispetto a quelli posti in atto per altri patogeni (es. MRSA) come misura precauzionale verso gli altri pazienti e verso se stessi e le relative motivazioni.
Nel caso in cui le pulizie vengano effettuate da ditte esterne, la medesima attivit à di formazione deve essere garantit a anche per il personale delle stesse che ha accesso alla struttura
b. Materiali da utilizzare negli inter venti di detersionedisinfezione in presenza di sospetta/diagnosticata patologia da Clostridioidesdifficile Gli interventi di pulizia e disinfezione di ambienti che ospit ano pazienti con sospett a/accert at a patologia da CD devono essere effettuati al termine della pulizia delle altre st anze di degenza, utilizzando attrezzature e materiali dedicati all’ambiente in questione.
È preferibile che i panni siano monouso, da eliminare come potenzialmente infetti. Se si usano panni riutilizzabili, questi devono essere sottoposti a detersione e disinfezione subito dopo l’uso e prima del riutilizzo Per la disinfezione utilizzare un cloroderivato 1.000 ppm di cloro attivo lasciando in cont atto per 20’; sciacquare e far asciugare. Se gli interventi vengono effettuati da una ditt a appalt atrice che utilizza panni pluriuso, è necessario richiedere alla stessa document azione sulle modalit à di tratt amento adott ate prima del riutilizzo, che devono dare garanzie di attivit à sporicida
Al termine delle operazioni, i materiali riutilizzabili (carrello, secchi, ecc ) devono essere detersi e disinfett ati con un cloroderivato 1 000 ppm lasciando in cont atto almeno 10’; poi sciacquare, se met allici, e lasciar asciugare
I materiali monouso utilizzati devono essere smaltiti in un contenitore per rifiuti sanit ari a rischio infettivo
c. Detersione e disinfezione dell’ambiente in presenza di sospetta/diagnosticata patologia da Clostridioides d
cile
Tutte le superfici orizzont ali della st anza e gli oggetti posti in vicinanza del paziente devono essere detersi e disinfett ati due volte al giorno, ponendo particolare attenzione alle superfici che possono essere più facil-
mente toccate (letto e sbarre, interruttori luce, pulsantiera di chiamat a, maniglie, rubinetti, piano del comodino, telefono, ecc.).
La detersione deve essere approfondit a e accompagnat a dall’azione meccanica dello sfregamento e dal risciacquo; alla detersione segue la disinfezione con cloroderivato 1 000 ppm (cfr t abella I) che deve essere lasciato in situ per circa 10’.
Se si utilizza un detergente-disinfett ante, il disinfett ante deve sempre essere un cloroderivato e la concentrazione d’uso deve garantire 1.000 ppm di cloro attivo. In questo caso si fa un primo tratt amento seguito da risciacquo e poi un secondo tratt amento, lasciando in cont atto per 10’.
Le superfici verticali (pareti) della camera di degenza devono essere tratt ate in modo analogo con detersione, risciacquo e disinfezione solo se visibilmente sporche (presenza di macchie, impronte).
Particolare attenzione deve essere riservat a agli interventi sul servizio igienico dedicato, che dovrebbe essere tratt ato tre volte al giorno e tutte le volte che la situazione lo richieda Tutte le superfici potenzialmente cont aminate devono essere deterse/disinfett ate, ponendo un’attenzione particolare a quelle a più facile cont aminazione (t avolett a del WC, bidet, piano della comoda, dispenser di sapone, ecc.) senza trascurare le superfici che possono più facilmente essere all’origine di trasmissione (rubinetto del lavandino, interruttore della luce, ecc.).
d. Detersione e disinfezione dell’ambiente alla dimissione/trasferimento di paziente con sospetta/diagnosticata patologia da Clostridioides difficile
Alla dimissione/trasferimento del paziente la detersione-disinfezione del locale deve essere effettuat a al termine della pulizia delle altre st anze di degenza Prima di iniziare le operazioni di pulizia-disinfezione rimuovere ed eliminare nel contenitore dei rifiuti a rischio infettivo tutti i materiali d’uso presenti (sapone liquido, asciugamani in cart a, cart a igienica, spazzolino WC, ecc ) e gli eventuali dispositivi medici monouso Pulire gli oggetti riutilizzabili e inviarli ai processi di disinfezione o sterilizzazione
Rimuovere i materassi e gli altri effetti letterecci (coprimaterasso, copert a, cuscini, materasso antidecubito, ecc ), collocarli negli appositi sacchi e inviarli al servizio di lavanderia per il trattamento di lavaggio e disinfezione. Detergere tutte le superfici iniziando dalle zone pulite (es. finestre) per terminare a quelle sporche (servizio). La detersione deve essere dirett a in modo capillare su tutte le superfici strutturali (pareti, pavimenti) e di materiali/oggetti presenti nell’ambiente (letto, test aletto,
219 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
ffi
i
ALLEG ATO D
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
campanello di chiamat a, comodino, cassetti, armadio, sedia, t avolino, sostegno per fleboclisi, monitor, TV, interruttori, maniglie, flussimetro, carrozzina, ecc )
Far seguire alla detersione una disinfezione con un cloroderivato alla concentrazione di 5.000 ppm (vedi t a-
Tabella I – La diluizione dei cloroderivati *
bella I) e lasciare in cont atto per circa 10’ Risciacquare, soprattutto le superfici met alliche, e lasciar asciugare. Ripristinare la funzionalit à dell’ambiente sostituendo tutti i materiali eliminati o inviati ad un tratt amento di sanificazione.
Concentrazione iniziale Quantità necessaria per ottenere 5 lt alla concentrazione di cloro attivo di 1.000 ppm 5.000 ppm
Sodio ipoclorito 1,1 %
Sodio ipoclorito 2,7 %
Sodio ipoclorito 5 % (candeggina**)
ml
Sodiodicloroisocianurato (NaDCC) cp 4,6 g 2 compresse 10 compresse
Sodiodicloroisocianurato (NaDCC) cp 23 g Non applicabile 2 compresse
*La diluizione deve essere fatta giornalmente, meglio ancora estemporaneamente, operando in ambiente aerato
** Attenzione alla stabilità delle preparazioni commerciali: la concentrazione in cloro potrebbe non risultare esatta.
2. MONITORAGGIO DELL’ADESIONE ALLE PROCEDURE INDIC ATE DAL PROTOCOLLO
Definito un protocollo operativo, è necessario monitorare se il personale addetto aderisce in modo sistematico alle indicazioni date La tabella II propone una check list di controllo per tale verifica
Tabella II – Check list per monitoraggio degli inter venti ambientali.*
CriteridivalutazioneSìNoNote
• La stanza di isolamento è pulita al termine della pulizia delle altre stanze ▫▫
• La camera di degenza è pulita e disinfettata con la periodicità prevista ▫▫ dal protocollo aziendale
• Il bagno è pulito e disinfettato con la periodicità prevista dal protocollo aziendale ▫▫
• Le operazioni di pulizia sono effettuate rispettando le sequenza delle operazioni ▫▫ previste dal protocollo aziendale
• Durante le operazioni di pulizia sono trattate prima le superfici più pulite, ▫▫ poi quelle più sporche
• Per la pulizia è utilizzato materiale dedicato ▫▫
• La disinfezione è effettuata con cloroderivato 1 000 ppm di cloro attivo ▫▫ rispettando il tempo di contatto di 10’
• Il materiale pluriuso e le attrezzature utilizzati per le pulizie al termine dell’attività ▫▫ sono detersi, disinfettati e asciugati secondo protocollo
• Il personale utilizza correttamente i DPI ▫▫
• Al termine degli inter venti panni, guanti e camice sono smaltiti nei contenitori ▫▫ per rifiuti a rischio infettivo
• Al termine delle pulizie il personale effettua il lavaggio delle mani ▫▫
• Alla dimissione la biancheria piana e tutti gli effetti letterecci sono rimossi ▫▫ e inviati alla lavanderia negli appositi sacchi per biancheria a rischio infettivo
• Alla dimissione il materiale monouso viene rimosso ed è sostituito con nuovo materiale ▫▫
• Il materiale monouso rimosso viene eliminato nei contenitori per rifiuti a rischio infettivo ▫▫
• Alla dimissione la camera è pulita a fondo ed è disinfettata accuratamente ▫▫
* Questa lista non è esaustiva di tutte le operazioni di pulizia, che possono differenziarsi secondo il contesto della struttura, le procedure adottate, l’organizzazione, ecc Essa, quindi, dovrà essere articolata in funzione delle esigenze locali
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 220
450
2 275
ml
185
925
ml
ml
100
500
ml
ml
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Gestione di eventi epidemici
In presenza di un aumento dei casi di infezione da Clostridioides difficile in una unit à operativa ospedaliera o in una struttura residenziale, è import ante intensificare gli sforzi mirati a ridurre il rischio che altri pazienti contraggano l’infezione
Per raggiungere t ale obiettivo è import ante:
Intensificare le attivit à del gruppo operativo per il controllo delle infezioni: valut are frequentemente l’andamento di nuovi isolamenti di Clostridioides difficile, individuare un referente nella unit à operativa/struttura interessat a, condurre una indagine epidemiologica.
Istituire una sorveglianza attiva a livello locale
Intensificare le misure di isolamento: valut are il contesto, definire un piano operativo.
Rinforzare tutte le misure igieniche e le pratiche di sanificazione ambient ale, con particolare attenzione all’unit à del paziente, alle attrezzature di uso comune a più pazienti che non si possono personalizzare (es. l’attrezzatura per la mobilizzazione dei pazienti/solleva persone)
Ridurre i movimenti dei pazienti e dello st aff al minimo: evit are i trasferimenti di pazienti con diarrea da un reparto all’altro, limit are il trasferimento di letti, comode e altre attrezzature tra reparti diversi.
Rivalut are con attenzione la terapia antibiotica di ogni paziente e programmare interventi mirati all’antimicrobial stewardship
Promuovere la comunicazione tra tutte le parti coinvolte e gli operatori: dirigenza aziendale, equipe medico assistenziale coinvolt a, gruppo operativo controllo infezioni, pazienti, ufficio relazioni con il pubblico, ecc.
Obiettivo dell’indagine epidemiologica è identificare i serbatoi di infezione e le modalit à di trasmissione allo scopo di prevenire ulteriori casi La t abella I riport a un elenco dei possibili fattori di rischio correlati all’ospite, all’assistenza, all’ambiente, che possono giocare un ruolo nel contribuire all’insorgenza di una epidemia da Clostridioides difficile.
La tabella II sintetizza le fasi della indagine epidemiologica con indicate le diverse responsabilit à e le azioni da svolgere
Tabella I – Fattori di rischio potenzialmente correlati ad epidemie da Clostridioides difficile.
Fattoridirischiodell’ospiteFattoriassociatiallacuraeall’assistenzaFattoriambientali
• Immunodepressione
• Polipatologia
• Condizioni cliniche severe
• Antibioticoterapia prolungata
• Età avanzata
• Inadeguata igiene della persona
• Paziente non autosufficiente
Dispositivieattrezzaturemediche
• Presidi per l’eliminazione (es padelle)
• Apparecchiature per la detersione e disinfezione di presidi per l’eliminazione dei rifiuti (es lavapadelle)
• Contenitori per raccolta urine
• Carrelli utilizzati per le cure igieniche delle persone (es bricchi e catini) e piani dei carrelli di lavoro
• Attrezzature per il monitoraggio dei parametri vitali
• Pompe infusionali
• Termometri, bracciali dello sfigmomanometro, stetoscopi
• Sostegni per fleboclisi
Organizzazionedell’assistenzaepratichediassistenza
• Inadeguata registrazione di segni e sintomi di infezione nella documentazione clinico-assistenziale
• Modello assistenziale per compiti
• Insufficiente flusso informativo in merito alle condizioni dei pazienti
• Scarsa adesione all’igiene delle mani e alle precauzioni da contatto
• Eventuali indagini endoscopiche
• Trasferimento del paziente ad altra unità di cura
• Assistenza al paziente prestata da personale non adeguatamente preparato (volontari, parenti, visitatori, badanti, ecc )
• Inadeguata pulizia e/o disinfezione di:
- superfici ambientali,
- unità del paziente: letto, comodino effetti letterecci, protezioni del letto
- presidi per la mobilizzazione del paziente (sollevatori)
- ser vizi igienici
• Mobilità del paziente
• Carenze di spazi per l’isolamento del paziente o la possibilità di fare una coorte
221 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
ALLEG ATO E
Tabella II – Fasi, responsabilità, inter venti, strumenti per l’indagine epidemiologica.
Fasidell’indagineResponsabilitàAzioni/InterventiStrumenti incasodiepidemia(Chi?)(Checosa/Come?)(Conchecosa?)
1. Segnalazione dei casi sospetti o accertati
2 Preparare il piano dei lavori
3 Verificare la diagnosi dei casi (sospetti e accertati) e confermare l’esistenza dell’epidemia
Laboratorio® U.Operativa/Operatori® Uff. Igiene/CIO®
Ufficio Igiene/CIO® Microbiologo® Infettivologo® Medici® Infermieri, Operatori socio sanitari dell’unità operativa© Uff Igiene/CIO®
• Recepimento delle informazioni ricevute
• Attivazione della procedura di accertamento
• Protocollo di gestione di un evento epidemico
• Notifica di malattia infettiva e diffusiva
• Lettura delle procedure aziendali relative agli eventi epidemici da Clostridioides difficile; in loro assenza ricerca e lettura della bibliografia
• Raccolta di informazioni relative ai singoli casi sospetti o accertati
• Verifica che non si tratti di un incremento solo apparente
• Confronto con la frequenza endemica di Clostridioides difficile (es tassi per 100 ricoveri e 1 000 giornate di degenza)
• Comunicazione degli accertamenti in corso all’equipe medico assistenziale
• Definizione e comunicazione delle prime misure di controllo da adottare (misure EBM/EBN)
• Sor veglianza degli alert
• Comunicazione telefonica, fax o via informatica, registrando l’avvenuta comunicazione
• Procedure o Protocolli
• Costituzione di un gruppo di lavoro (es Gruppo operativo CIO + infettivologo + epidemiologo) da attivare alla conferma di epidemia
• Bibliografia
• Check-list per identificare i fattori correlati all’ospite, ai fattori ambientali e alle attività umane (il tutto riferito a “persona”, “tempo”, “luogo”)
• Valutare l’opportunità di avvalersi di una consulenza
• Identificare i componenti chiave del processo assistenziale e le potenziali motivazioni di mancata compliance
• Incontri individuali e/o a piccoli gruppi con gli operatori sanitari o socio sanitari dell’unità operativa
4. In caso di epidemia
Medico e Infermiere unità operativa/e© Gruppo di lavoro Clostridioides difficile®
• Attivazione del gruppo di lavoro Clostridioides difficile
• Definizione delle indagini microbiologiche necessarie
• Il coordinatore del gruppo di lavoro informa costantemente la Dirigenza Aziendale (Direttore Generale, Direttore Sanitario, Direttore Amministrativo), che definisce chi prende contatti con i mezzi di comunicazione, se del caso
• Bibliografia su eventi epidemici che coinvolgono Clostridioides difficile
• Ufficio relazioni con il pubblico e/o Ufficio addetto alle comunicazioni dell’Azienda Sanitaria e/o Direzione Sanitaria
5. Descrivere i casi in base alle caratteristiche “persona”, “luogo”, “tempo”
Epidemiologo® Medico o Infermiere addetto al controllo delle infezioni® Operatori UO©
• Inter viste ai singoli operatori dell’equipe medico assistenziale per la raccolta di informazioni
• Ripetuti sopralluoghi nella/e strutture
• Contatti informali con gli operatori dell’unità operativa
• Inter viste semistrutturate
• Colloqui e sopralluoghi
• Tabelle riassuntive delle informazioni raccolte riferite a: persona, luogo, tempo.
• Grafico della cur va epidemica (tassi per 100 ricoveri e 1 000 giornate di degenza)
6. Formulare e testare un’ipotesi
7. Valutare l’ipotesi. Se necessario ridefinire l’ipotesi ed eseguire studi supplementari
8. Implementare le misure di prevenzione e controllo
9. Comunicare i risultati
10 Che cosa abbiamo imparato dall’evento epidemico
® Responsabile © Collabora
Gruppo di lavoro CD®
Gruppo di lavoro CD® Epidemiologo®
Infermiere addetto al controllo delle infezioni® Equipe medico assistenziale®
Ufficio Igiene/CIO®
Ufficio Igiene/CIO®
• Definire e comunicare all’equipe medico assistenziale le misure di prevenzione e controllo generali e specifiche
• Sor veglianza per valutare l’andamento dell’evento
• Studio di epidemiologia analitica (studio caso-controllo, di coorte)
• Incontro informativo con il personale medico e di assistenza sulle misure di controllo necessarie
• Fornire documentazione a supporto
• Stesura del rapporto
• Organizzazione di uno o più incontri informativi
• Imparare dall’esperienza: esercitazione sull’evento epidemico
• Come prevenire e controllare
• Incontri con gli operatori e documentazione
• Bibliografia su analoghi studi di epidemiologia analitica
• Schede informative sulle misure da adottare per gli operatori sanitari
• Schede informative per personale di assistenza non sanitario (es. parenti, badanti)
• Report, Evento formativo
• Ufficio relazioni con il pubblico o Ufficio addetto alle comunicazioni dell’Azienda Sanitaria
• Politiche di appropriatezza della prescrizione antibiotica
• Audit sulle misure di prevenzione e controllo mirate
• Poster dell’andamento endemico del microrganismo nell’unità operativa
• Monitoraggio e pubblicazione dei risultati
GIm PIOS Vol 12, n 4, ottobre-dicembre 2022 222
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Bibliografia
1 Cromer AL, Hutsell SO, Latham SC, et al Impact of implementing a method of feedback and account ability related to cont act precautions compliance Am J Infect Control 2004; 32: 451-5
2 Layton B, McDonald L, Gerding D, Liedtke L, Strasbaugh L IDSA Emergin Infections Network Perceived increases in incidence and severity of Clostridium difficile disease: an emerging threat that continues to unfold 15th Annual Scientific Meeting of the Society for Healthcare Epidemiology of America, Los Angeles, CA April 9-12, 2005 Abstract 66 2005
3 Health Protection Agency – Department of Health Clostridium difficile infection:how to deal with the problem, Publication date December 2008
4. Loo V, Poirier L, Miller M, et al. A predominantly clonal multiinstitutional outbreak of Clostridium difficile-associated diarrhea with high morbidity and mort ality. N Engl J Med 2005; 26: 27380.
5 McDonald L OwngsM, Jerringan D Clostridium difficile infection
in patients dischared fron US short-st ay hospit als 1996-2003 Emerg Infect Dis 2006; 12: 409-15
6 Mc Donald L, Killgore G, Thompson A, et al An epidemic, toxin gene-variant strain of Clostridium difficile N Engl J Med 2005; 353: 2433-41
7 Mooney H Annual incidence of MRSA falls in England, but Clostridium difficile continues to rise BMJ 2007; 335: 958
8 Muto C, Pokrywka M, Shutt K, et al A large outbreak of Clostridium difficile – associated disease with an unexpected proportion of deaths and colectomies at a teaching hospit al following increased fluoroquinolone use. Infect Control Hosp Epidemiol 2005; 26: 273-80
9. PIDAC. Ministry of Health and Long-Terme care. Ont ario, Best Practice Document for the Management of Clostridium difficile in all health care settings Gennaio, 2009
10 Vonberg RP, Kuijper EJ, Wilcox MH, et al Infection control measures to limit the spread of Clostridium difficile Clin Microbiol Infect 2008; 14 (Suppl 5).
223 GIm PIOS Vol 12, n 4, ottobre-dicembre 2022
ALLEG ATO F
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Misure di prevenzione e controllo
Negli ultimi decenni, a fronte dell’importante incremento di casi e gravit à delle infezioni da Clostridioides difficile, molte istituzioni/strutture hanno messo a punto indicazioni indirizzate a contenere il fenomeno Sfortunatamente sino ad ora i dati di letteratura in merito alla prevenzione delle ICD sono limitati: questo fa sì che non esista un “bundle” validato, cioè l’indicazione di 3-6 interventi di forte evidenza scientifica la cui contemporanea applicazione permett a di controllare il problema 1,2 Ciò premesso, è altresì vero che varie esperienze effettuate, riscontrabili in parte nelle voci bibliografiche qui riport ate, consentono di selezionare e proporre un set di misure che hanno dimostrato di essere priorit arie ed indispensabili per contrast are il fenomeno delle ICD.
1. MISURE PREVENTIVE DI CARATTERE GENERALE
a. Formazione ed Educazione del personale sanitario che opera nella struttura sulle problematiche legate a Clostridioides difficile
b. Politica di un uso prudente degli antibiotici (antimicr obial stewardship)
c. Attività di sor veglianza
Queste misure sono st ate indicate dalla linea guida comunit aria del 5 giugno 2009 sulla sicurezza dei pazienti, contesto in cui rientra anche la prevenzione e il controllo delle infezioni associate all’assistenza. Esse sono indirizzate a mantenere ad un elevato livello gli interventi assistenziali e nel contempo a prevenire su tutt a la struttura il fenomeno delle infezioni correlate all’assistenza (ICA), tra le quali spesso rientrano le ICD
1.a “…È importante promuovere, in modo continuativo, l’istruzione e la formazione multidisciplinare di tutto il personale addetto all’ assistenza ”
Nell’ambito della prevenzione e controllo infezioni quest a attivit à deve essere indirizzat a con particolare enfasi alle patologie emergenti, tra le quali si trova l’ICD Nel caso specifico, ad esempio, è fondament ale che sia patrimonio comune conoscere la priorit à degli interventi: richiedere con tempestivit à il test, soprattutto in situazioni a rischio, è utile al paziente, che beneficia di rapida diagnosi e conseguente tratt amento, ma nel contempo port a ad una automatica riduzione del rischio di trasmettere l’infezione, perché limit a il numero di giorni in cui il soggetto con ICD non è in isolamento.
Per le modalit à applicative si fa riferimento all’allegato
1.b “…È opportuno elaborare strategie mirate ad un uso prudente degli antimicrobici ” , soprattutto per quanto attiene la problematica delle resistenze. È anche dimostrato che l’esposizione agli antibiotici, in particolare ad alcune classi con ampio spettro, favorisce in modo import ante l’infezione, sintomatica o asintomatica, da Clostridioides difficile La letteratura è ricca di riferimenti che dimostrano come l’adozione di un generalizzato uso prudente determini anche una riduzione di quest a patologia Ovviamente, per avere un reale impatto sia sulle resistenze che sulla prevenzione di ICD, un intervento di politica antibiotica deve coinvolgere l’intera struttura ed essere affiancato da un attento monitoraggio dei consumi.
1.c Alla luce dell’aumento di casi e gravit à delle ICD, è necessario che tutte le strutture assistenziali promuovano attivit à di sistematica sorveglianza (es microrganismo sentinella, rapida identificazione di epidemie), per monitorare l’epidemiologia del patogeno e per mettere in atto con tempestivit à le opportune misure di prevenzione e controllo.
2. “BUNDLE” PER MINIMIZZARE LA TRASMISSIONE CROCIATA DI CLOSTRIDIOIDES DIFFICILE
1 Nel sospetto di ICD (diarrea non imputabile ad altre cause) invia le feci in laboratorio per il test
2. Nei casi confermati o sospetti applica le precauzioni da contatto, se possibile isola il paziente in stanza singola
3. Dopo aver assistito il paziente esegui sempre l’igiene delle mani con acqua e sapone o detergente-antisettico
4. Verifica la terapia antibiotica e sospendi gli antibiotici non indispensabili
5. Verifica che l’ambiente circostante il paziente ed il ser vizio dedicato vengano regolarmente puliti e disinfettati con una soluzione disinfettante a base di cloro
6 Informa il paziente, i parenti/visitatori ed il personale di supporto sulle problematiche relative a Clostridioides difficile
Più in analitico, a livello di Unit à Operativa si deve procedere come qui di seguito indicato:
GIm PIOS Vol 12, n 4, ottobre-dicembre 2022 224
A
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
a Alla comparsa di diarrea non imput abile ad altre cause
– adott are misure di isolamento da cont atto,
inviare le feci in laboratorio per il test
b. Alla rispost a positiva del test
– bloccare eventuali terapie inappropriate e inst aurare adeguato tratt amento,
– segnalare l’isolamento da cont atto (allegato B1),
fornire le opportune informazioni a paziente e parenti/visit atori (allegato B2).
c. Adott are una corrett a igiene delle mani e l’uso di idonei dispositivi di protezione individuale Educare e assistere il paziente nell’igiene delle mani.
3.
d Garantire
– interventi di igiene dell’ambiente e di attrezzature e materiali in uso idonei per tempestivit à, modalit à e frequenza (allegato C),
– ove opportuno, l’adozione di materiali monouso/dedicati
e. In caso di spost amento/trasferimento segnalare la patologia in atto al reparto/servizio ricevente
f. Determinare la sospensione delle misure di isolamento.
g Monitorare l’applicazione delle misure indicate (check-list di controllo).
ESEMPIO DI CHECK-LIST PER VERIFICA INTERNA DELL’APPLICAZIONE DELLE MISURE DI CONTROLLO PER CLOSTRIDIOIDES DIFFICILE
Unità Operativa
Paziente deambulante Sì ▫ No ▫
OggettoverificaSìNoNote
• Il paziente è in isolamento? ▫▫
• La terapia antibiotica è stata rivalutata e gli antibiotici non indispensabili sono stati sospesi? ▫▫
• Al paziente deambulante è stato dedicato un bagno per uso esclusivamente personale? ▫▫
• Se no, ha disponibilità di una comoda per uso esclusivamente personale? ▫▫
• Se il paziente non è deambulante è opportunamente posizionato un contenitore rifiuti ▫▫ infetti dedicato?
• La stanza di isolamento è segnalata con l’apposito cartello?
• Nell’assistenza al paziente gli operatori dell’unità operativa applicano le precauzioni da contatto con particolare riguardo a:
- igiene delle mani
- uso dei guanti
- uso del sovracamice
monouso in TNT
• Sono stati destinati ad uso personalizzato per il paziente:
- padella, ▫▫
- pappagallo, ▫▫
- termometro, ▫▫
- sfigmomanometro ▫▫ e fonendoscopio,
- laccio emostatico ▫▫
• Nella camera con isolamento da contatto dove è ricoverato il paziente con ICD è presente:
- contenitore per rifiuti a rischio infettivo ▫▫
- sacco per la raccolta della biancheria ▫▫
• Il paziente e i visitatori sono stati informati sulle precauzioni da contatto da osser vare? ▫▫
• Il personale addetto all’igiene ambientale è stato informato della necessità di applicare ▫▫ lo specifico protocollo per Clostridioides difficile?
• Il protocollo di igiene ambientale viene applicato secondo i modi e tempi concordati, ▫▫ utilizzando soluzioni a base di cloro?
• Tutti coloro che hanno indossato DPI li rimuovono dopo il contatto con il paziente ▫▫ o comunque prima di uscire dalla stanza di degenza?
• In cartella è segnalato che il paziente è in isolamento? ▫▫
• In cartella è segnalata la data di inizio isolamento da contatto del malato? ▫▫
• In cartella è segnalata la data di fine isolamento da contatto del malato? ▫▫
225 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
–
–
▫▫
▫▫
▫▫
▫▫
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
La lista non è esaustiva degli adempimenti da monitorare, ma si propone solo come una traccia da articolare in funzione delle esigenze locali.
Potrebbero essere introdotte osser vazioni specifiche su singoli operatori per misurare l'applicazione delle precauzioni da contatto utilizzando lo schema di indagine seguente:
Osservazionedelpersonale
▫ Medico ▫ Infermiere ▫ OSS ▫ Studente ▫ Altro
Il professionista che sto osser vando:
a prima del contatto con il paziente e prima di manovra asettica effettua l’igiene delle mani ▫ Sì ▫ No
Se sì con:
▫ Acqua e sapone ▫ Acqua e detergente antisettico ▫ Soluzione alcolica
b. in corso di assistenza diretta usa
Guanti ▫ Sì ▫ No Sovracamice ▫ Sì ▫ No
c. dopo l’assistenza diretta e dopo aver tolto i guanti effettua igiene delle mani ▫ Sì ▫ No
Se sì, con:
▫ Acqua e sapone ▫ Acqua e detergente antisettico ▫ Soluzione alcolica
Tutti coloro che hanno indossato DPI (personale di assistenza, visitatori, ecc ) li rimuovono ▫ Sì ▫ No dopo contatto con il paziente o comunque prima di uscire dalla stanza di degenza?
Eventuali osser vazioni e/o inter venti da implementare
Data Firma
Riferimenti bibliografici
1 Marwick C, Davey P Care bundles: the holy grail of infectious risk management in hospit al? Curr Opin Infect Dis 2009; 22: 364-69.
2. Dubberke ER. Prevention of Healthcare-Associated Clostridium difficile Infection: What Works? Infect Control Hosp Epidemiol 2010; 31: S38-S41
3. Raccomandazioni del Consiglio del 9 giugno 2009 sulla sicurezza dei pazienti, comprese la prevenzione e il controllo delle infezioni associate all’assistenza sanitaria (2009/C 151/01) Gazzett a ufficiale dell’Unione europea, 3 7 2009
4 Muto CA, Blank MK, Marsh JW, et al Control o fan Outbreak of Infection with the Hypervirulent Clostridium difficile BI Strain in a University Hospit al Using a Comprehensive “Bundle” Approach. Clinical Infect Dis 2007; 45: 1266-73.
5. Mears A, White A, Cookson B, et al. Healthcare-associated infection in acute hospit al? With interventions are effective? J Hosp Infect 2009; 71: 307-13
6 Abbett SK, Yokoe DS, Lipsitz SR, et al Proposed Checklist of Hospit al Interventions to Decrease the Incidencer of Healthcare-Associated Clostridium difficile Infection. Infect Control Hosp Epidemiol 2009; 30: 1062-9
7. Hardy KJ, Gossain S, Thomlinson D, et al. Reducing Clostridium difficile through early identification of cluster and the use of st andardised set of interventions J Hosp Infect 2010; 75: 27781.
8 Duerden BI Contribution of government t arget to controlling Clostridium difficile In the NHS in England. Anaerobe 2011; 1-5 (in press)
9 w w w h e a l t h g o v o n c a / e n g l i s h / p r o v i d e r s / p r o g r a m / i n f e ctious/diseases/ic cdiff html
10 www hps scot nhs uk/haiic/ic/bundles aspx
11. www.cdc.gov/getsmart/healthcare/support-efforts/asp-int-cdiff html
GImPIOS Vol 12, n 4, ottobre-dicembre 2022 226
ALLEG ATO G
Prevenzione e controllo delle infezioni da Clostridioides difficile Revisione n° 2 - dicembre 2022
Strumenti per verificare, da parte della struttura, l’implementazione delle misure di controllo raccomandate per Clostridioidesdifficile
Criteri e indicatori per attività di sor veglianza
CriterioIndicatoreStandard
La struttura effettua la ricerca di Clostridioides difficile tossinogenico
• Numero totale di indagini effettuate dal laboratorio per la ricerca di Clostridioides difficile tossinogenico/10 000 giornate di degenza
• Numero di Unità Operative per le quali è stato effettuato il test oppure
• Numero totale di indagini effettuate dal laboratorio per la ricerca di Clostridioides difficile tossinogenico/10 000 giornate di degenza per unità operative più a rischio (es Geriatria, Lungodegenza, Medicina)
La ricerca di Clostridioides difficile tossinogenico viene effettuata 7/7 giorni
La struttura ha in atto una sor veglianza delle ICD correlate all'assistenza
La struttura ha in atto politiche di controllo delle ICD
Disponibilità del test (almeno GDH) anche nei giorni festivi
Incidenza annuale di ICD diagnosticate come casi ospedalieri/ 10 000 giornate di degenza dell’Ospedale (degenze ordinarie, esclusi Day Hospital/Day Surgery e bambini di età <2 anni)
1 Esiste un sistema di allarme per individuare rapidamente eventuali focolai di ICD
2 Di norma il risultato delle indagini microbiologiche per Clostridioides difficile tossinogenico viene comunicato entro 24 ore
3 In tutti i reparti di ricovero e assistenza è presente il protocollo aziendale per l'attuazione delle misure di isolamento
4 La struttura dispone di una check list per valutare l’implementazione delle misure di isolamento per pazienti, operatori, visitatori
5. La struttura dispone di una check list per valutare l'implementazione degli inter venti mirati di igiene ambientale in presenza di ICD
La struttura conduce inter venti di valutazione dell'attuazione delle politiche di controllo
• Sono valutati mediante osser vazione sulla base di una check list gli inter venti di controllo messi in atto in presenza di casi di ICD
• La compliance al rispetto delle misure di isolamento controllata sulle check list dell'anno in corso è almeno dell'85%
• La compliance al rispetto delle misure di igiene ambientale controllata sulle check list dell'anno in corso è almeno dell'85%
È in atto una attività di informazione/formazione relativa a Clostridioides difficile
Sono presenti nei reparti opuscoli informativi e/o cartelli illustrati per pazienti e visitatori/personale non sanitario che presta assistenza e sono documentate attività di informazione per operatori sanitari e non sanitari (ditta appaltatrice pulizie)
227 GImPIOS Vol 12, n 4, ottobre-dicembre 2022
…...…/10.000 gd n° /n° totale /10 000 gd Sì ▫ No ▫ ……/10.000 gd Sì ▫ No ▫ Sì ▫ No ▫ Sì ▫ No ▫ Sì ▫ No ▫ Sì ▫ No ▫ Sì ▫ No ▫ Sì ▫ No ▫ Sì ▫ No ▫ Sì ▫ No ▫
LE RIVISTE 2023 www.pensiero.it/riviste
Andrea De Fiore Ufficio abbonamenti 06.86282324 andrea.defiore@pensiero.it ISSNUscite Abb. Priv. (print+online) Abb. Ist. (print+online) Abb. Estero (print+online) Copia singola ANNALI DELL’ISTITUTO SUPERIORE DI SANITÀ www.annali-iss.eu 0021-2571457,0067,0067,00 21,00 AREA PEDIATRICA www.area-pediatrica.it 1591-0075 4 70,00120,00180,0020,00 ASSISTENZA INFERMIERISTICA E RICERCA www.air-online.it 1592-59864 85,00190,00260,00 35,00 C.A.R.E. www.careonline.it 1128-5524 6 90,00120,00 200,00 25,00 ECOLOGIA DELLA MENTE www.ecologiadellamente.it 0394-1310 285,00170,00220,0045,00 GIORNALE PREVENZIONE INFEZIONI ORGANIZZAZIONI SANITARIE www.gimpios.it 1122-407X 4 85,00190,00 210,00 30,00 GIORNALE ITALIANO DI CARDIOLOGIA www.giornaledicardiologia.it 1827-6806 12 150,00260,00315,00 40,00 GIORNALE ITALIANO DI FARMACIA CLINICA www.farmaciaclinica.it 1120-3749 4 110,00190,00315,00 35,00 GIORNALE ITALIANO DI FARMACIA CLINICA + BOLLETTINO SIFO200,00290,00400,00N.D. THE ITALIAN JOURNAL OF GENDER-SPECIFIC MEDICINE www.gendermedjournal.it 2421-7212 3 85,00170,00260,00 35,00 NOOS www.e-noos.com 1590-0711 3 85,00170,00240,00 30,00 PEDIATRIA sip.it/sezioni/pediatria-magazine 2240-3183 8 40,0080,00 120,00 25,00 POLITICHE SANITARIE www.politichesanitarie.it 1590-069X 4 100,00170,00260,00 35,00 RECENTI PROGRESSI IN MEDICINA www.recentiprogressi.it 0034-1193 12 130,00270,00320,00 40,00 RICERCA & PRATICA www.ricercaepratica.it 1120-379X 6 95,00170,00260,00 35,00 RICHARD E PIGGLE www.richardepiggle.it 1121-9602 4 85,00170,00 240,00 40,00 RIVISTA DI PSICHIATRIA www.rivistadipsichiatria.it 0035-6484 6 105,00190,00260,00 35,00 RIVISTA ITALIANA DI CURE PALLIATIVE www.ricp.it 1972-6481 4 105,00190,00260,00 30,00 RIVISTA DI NEUROLOGIA www.rivistadineurologia.it 0035-6344 4 85,00170,00240,00 40,00 TRAPIANTI www.trapiantionline.com 1590-072X 4 95,00170,00260,00 40,00
Riassunto delle caratteristiche del prodotto
1. DENOMINAZIONE DEL MEDICINALE DIFICLIR 200 mg compresse rivestite con film
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa rivestita con film contiene 200 mg di fidaxomicina. Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA Compresse rivestite con film. Compresse a forma di capsula di 14 mm, di colore da bianco a biancastro, con impresso “FDX” su un lato e “200” sull’altro lato.
4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche DIFICLIR compresse rivestite con film è indicato per il trattamento delle infezioni da Clostridioides difficile (CDI) note anche come diarrea associata a C. difficile (CDAD) nei pazienti adulti e pediatrici con un peso corporeo di almeno 12,5 kg (vedere paragrafi 4.2 e 5.1). Devono essere prese in considerazione le linee guida ufficiali sull’uso appropriato di medicinali antibatterici.
4.2 Posologia e modo di somministrazione Posologia Adulti Dosaggio standard La dose raccomandata è pari a 200 mg (una compressa) somministrati due volte al giorno (una volta ogni 12 ore) per 10 giorni (vedere paragrafo 5.1). DIFICLIR 40 mg/ml granuli per sospensione orale può essere usato nei pazienti adulti che abbiano difficoltà ad ingerire le compresse Dosaggio esteso-pulsato Fidaxomicina compresse 200 mg somministrate due volte al giorno per 1-5giorni (da non assumere al giorno 6), successivamente una volta al giorno a giorni alterni per 7-25 giorni (vedere paragrafo 5.1). Se viene saltata una dose, tale dose mancata va assunta il prima possibile o, se vicina alla dose successiva, va saltata. Popolazioni speciali Pazienti anziani Non è considerato necessario alcun aggiustamento della dose (vedere paragrafo 5.2). Compromissione renale Non è considerato necessario alcun aggiustamento della dose. A causa dei dati clinici limitati in tale popolazione, fidaxomicina deve essere utilizzata con cautela in pazienti con compromissione renale severa (vedere paragrafi 4.4 e 5.2). Compromissione epatica Non è considerato necessario alcun aggiustamento della dose. A causa dei dati clinici limitati in tale popolazione, fidaxomicina deve essere utilizzata con cautela in pazienti con compromissione epatica da moderata a severa (vedere paragrafi 4.4 e 5.2).
Popolazione pediatrica La dose raccomandata nei pazienti pediatrici con un peso di almeno 12,5 kg è pari a 200 mg somministrati due volte al giorno (una volta ogni 12 ore) per 10 giorni utilizzando le compresse rivestite con film o i granuli per sospensione orale. Per i pazienti con un peso corporeo inferiore a 12,5 kg sono raccomandate dosi ridotte. Fare riferimento al Riassunto delle Caratteristiche del Prodotto di DIFICLIR 40mg/ml granuli per sospensione orale. Modo di somministrazione DIFICLIR deve essere somministrato per via orale. Le compresse rivestite con film devono essere deglutite intere con acqua. Possono essere assunte con o senza cibo.
4.3 Controindicazioni Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
4.4 Avvertenze speciali e precauzioni di impiego Reazioni di ipersensibilità Sono state riportate reazioni di ipersensibilità, compreso angioedema severo (vedere paragrafo 4.8). Se durante il trattamento con fidaxomicina si verificano severe reazioni allergiche, la somministrazione deve essere sospesa e devono essere prese opportune misure. Alcuni pazienti con reazioni di ipersensibilità hanno riferito una storia di allergia ai macrolidi. Fidaxomicina deve essere usata con cautela in pazienti con allergia nota ai macrolidi. Compromissione renale ed epatica A causa dei limitati dati clinici, fidaxomicina deve essere utilizzata con cautela in pazienti con severa compromissione renale o con compromissione epatica da moderata a severa (vedere paragrafo 5.2). Colite pseudomembranosa, CDI fulminante o tale da causare pericolo di vita A causa dei limitati dati clinici, fidaxomicina deve essere utilizzata con cautela nei pazienti con colite pseudomembranosa, con CDI fulminante o tale da causare pericolo di vita. Co-somministrazione di potenti inibitori della glicoproteina-P La co-somministrazione di potenti inibitori della glicoproteina-P quali ciclosporina, ketoconazolo, eritromicina, claritromicina, verapamil, dronedarone e amiodarone non è raccomandata (vedere paragrafi 4.5 e 5.2). Si consiglia cautela nel caso in cui fidaxomicina venga somministrata in concomitanza con potenti inibitori della glicoproteina-P. Popolazione pediatrica Negli studi clinici, un solo paziente pediatrico di età inferiore ai 6 mesi è stato esposto a fidaxomicina. Di conseguenza, i pazienti di età inferiore ai 6 mesi devono essere trattati con cautela. I test per la colonizzazione di C. difficile o della tossina non sono raccomandati nei bambini con meno di 1 anno a causa dell’alto tasso di colonizzazione asintomatica, salvo sia presente diarrea grave negli infanti con fattori di rischio per la stasi come nella malattia di Hirschsprung, nell’atresia anale operata o in altri gravi disturbi della motilità. Devono sempre essere cercate eziologie alternative e deve essere provata l’enterocolite da C. difficile 4.5 Interazioni con altri medicinali ed altre forme di interazione Effetti degli inibitori della P-gp su fidaxomicina Fidaxomicina è un substrato della glicoproteina P (P-gp). La co-somministrazione di dosi singole dell’inibitore della P-gp ciclosporina A e di fidaxomicina in volontari sani ha comportato un aumento di 4 e 2 volte rispettivamente della Cmax e dell’AUC di fidaxomicina e un aumento di 9,5 e 4 volte rispettivamente della Cmax e dell’AUC del principale metabolita attivo OP-1118. Poiché la rilevanza clinica di questo aumento dell’esposizione non è chiara, la co-somministrazione di potenti inibitori della P-gp quali ciclosporina, ketoconazolo, eritromicina, claritromicina, verapamil, dronedarone e amiodarone non è raccomandata (vedere paragrafi 4.4 e 5.2). Effetti della fidaxomicina sui substrati della P-gp Fidaxomicina può essere un inibitore da lieve a moderato della P-gp intestinale. Fidaxomicina (200 mg due volte al giorno) ha avuto un effetto lieve ma non clinicamente rilevante sull’esposizione a digossina. Tuttavia, non è possibile escludere un effetto maggiore sui substrati della P-gp con minore biodisponibilità più sensibili all’inibizione della P-gp intestinale, come dabigatran etexilato. Effetti di fidaxomicina su altri trasportatori Fidaxomicina non ha un effetto clinicamente significativo sull’esposizione di rosuvastatina, un substrato per i trasportatori OATP2B1 e BCRP. La co-somministrazione di fidaxomicina 200mg due volte al giorno con una dose singola da 10 mg di rosuvastatina in soggetti sani, non ha un effetto clinicamente significativo sull’AUCinf di rosuvastatina. Pazienti pediatrici Sono stati effettuati studi di interazione solamente negli adulti.
4.6 Fertilità, gravidanza e allattamento Gravidanza Non ci sono dati disponibili sull’uso di fidaxomicina in donne in gravidanza. Gli studi sugli animali non indicano effetti dannosi diretti o indiretti di tossicità riproduttiva. A scopo precauzionale, è preferibile evitare l’uso di fidaxomicina durante la gravidanza. Allattamento Non è noto se fidaxomicina e i suoi metaboliti siano escreti nel latte materno. Sebbene non si ritenga che fidaxomicina possa causare effetti su neonati/lattanti dal momento che l’esposizione sistemica a fidaxomicina è bassa, non può essere escluso il rischio per i neonati/lattanti. Deve quindi essere presa una decisione se interrompere l’allattamento con latte materno o interrompere/non iniziare la terapia con fidaxomicina, tenendo conto del beneficio dell’allattamento per il bambino e del beneficio della terapia per la donna.
Fertilità Fidaxomicina non ha avuto effetti sulla fertilità, quando valutata nei ratti (vedere paragrafo 5.3).
4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari DIFICLIR non altera o altera in modo trascurabile la capacità di guidare veicoli o di usare macchinari.
4.8 Effetti indesiderati Riassunto del profilo di sicurezza Le reazioni avverse più comuni sono vomito (1,2%), nausea (2,7%) e costipazione (1,2%). Tabella delle reazioni avverse La Tabella 1 mostra le reazioni avverse associate alla somministrazione due volte al giorno di fidaxomicina durante il trattamento di infezioni da C. difficile segnalate in almeno due pazienti, presentate in base alla classificazione per sistemi e organi. La frequenza delle reazioni avverse è definita come segue: molto comune (≥1/10), comune (≥1/100 , <1/10), non comune (≥1/1.000 , <1/100), raro (≥1/10.000 , <1/1.000), molto raro (<1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili). Nell’ambito di ogni gruppo di frequenza, le reazioni avverse sono presentate in ordine di gravità decrescente.
Tabella 1: Reazioni avverse
Classificazione MedDRA organo sistema Comune Non comune Frequenza non nota
Disturbi del sistema immunitario Rash, prurito Reazioni di ipersensibilità (angioedema, dispnea)
Disturbi del metabolismo e della nutrizione Diminuzione dell’appetito
Patologie del sistema nervoso Capogiro, cefalea, disgeusia
Patologie gastrointestinali Vomito, nausea, costipazione Distensione addominale, flatulenza, bocca secca
Descrizione di reazioni avverse selezionate Dopo la commercializzazione, sono state riportate reazioni di ipersensibilità acuta, come angioedema e dispnea (vedere paragrafi 4.3 e 4.4). Popolazione pediatrica La sicurezza e l’efficacia di fidaxomicina sono state valutate in 136 pazienti di età compresa fra la nascita e una età inferiore ai 18 anni. Si prevede che frequenza, tipologia e gravità delle reazioni avverse nei bambini risultino uguali a quelle riscontrate nei pazienti adulti. In aggiunta alle reazioni avverse riportate nella tabella 1, sono stati segnalati due casi di orticaria. Segnalazione di reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/ rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il Agenzia Italiana del Farmaco, Sito web: https:// www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
4.9 Sovradosaggio Non sono state riportate reazioni avverse per sovradosaggio acuto durante gli studi clinici o dai dati dopo la commercializzazione. Tuttavia, la possibilità di insorgenza di reazioni avverse non può essere esclusa e sono raccomandate misure generali di supporto.
5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: antidiarroici, antinfiammatori/antinfettivi intestinali, antibiotici. Codice ATC: A07AA12 Meccanismo d’azione Fidaxomicina è un antibiotico appartenente alla classe degli antibatterici macrociclici. Fidaxomicina è un battericida e inibisce la sintesi dell’RNA da parte della RNA polimerasi batterica. Interferisce con l’RNA polimerasi in un sito diverso da quello delle rifamicine. L’inibizione della RNA polimerasi dei Clostridi avviene a una concentrazione 20 volte più bassa rispetto a quella dell’enzima di E. coli (1 μM vs. 20 μM), il che spiega in parte la significativa specificità dell’attività di fidaxomicina. Fidaxomicina ha dimostrato di inibire la sporulazione di C. difficile in vitro. Relazione farmacocinetica/farmacodinamica (PK/PD) Fidaxomicina è un farmaco ad azione locale. Essendo un farmaco topico, le relazioni sistemiche tra farmacocinetica e farmacodinamica non possono essere stabilite, tuttavia dati in vitro dimostrano che fidaxomicina ha attività battericida tempo-dipendente e suggeriscono che il rapporto tempo/MIC (MIC- Minimum Inhibitory Concentration, concentrazione minima inibitoria) possa essere il parametro maggiormente predittivo dell’efficacia clinica. Limite di sensibilità (breakpoint) Fidaxomicina è un farmaco ad azione locale che non può essere utilizzato per trattare infezioni sistemiche; per tale motivo non è rilevante stabilire un limite clinico di sensibilità (breakpoint). Il valore limite epidemiologico per fidaxomicina e C. difficile, che distingue i batteri “wild type” dagli isolati con caratteristiche di resistenza acquisita, è ≥ 1,0 mg/l. Spettro antimicrobico Fidaxomicina è un antimicrobico a stretto spettro con attività battericida contro il C. difficile. Fidaxomicina ha una MIC90 pari a 0,25 mg/l nel C. difficile, e il suo metabolita principale, OP-1118, ha una MIC90 di 8 mg/l. I batteri Gram negativi sono intrinsecamente non sensibili alla fidaxomicina. Effetti sulla flora intestinale Studi hanno dimostrato che il trattamento con fidaxomicina non ha intaccato le concentrazioni di Bacteroides o gli altri maggiori componenti dell’ambiente microbico nelle feci dei pazienti affetti da CDI. Meccanismo di resistenza Non ci sono elementi noti trasferibili che conferiscano resistenza alla fidaxomicina. Inoltre non è stata rilevata resistenza crociata con nessuna altra classe di antibiotici inclusi β-lattami, macrolidi, metronidazolo, chinoloni, rifampicina, e vancomicina. Mutazioni specifiche della RNA polimerasi sono associate con una ridotta sensibilità alla fidaxomicina. Efficacia clinica negli adulti L’efficacia della fidaxomicina è stata valutata in due studi clinici di fase III randomizzati a doppio cieco (Studio 003 e 004). La fidaxomicina è stata comparata con vancomicina somministrata oralmente. L’endpoint primario è stato definito come guarigione clinica dopo 12 giorni. La non inferiorità della fidaxomicina comparata con la vancomicina è stata dimostrata in entrambi gli studi (vedere Tabella 2).
Tabella 2 Risultati combinati degli studi 003 e 004
*per differenza di trattamento
Negli studi clinici pivotali in pazienti adulti, la frequenza di riacutizzazione nei 30 giorni seguenti il trattamento è stata valutata come endpoint secondario. La frequenza di riacutizzazione (recidive comprese) è stata significativamente inferiore con fidaxomicina (14,1% vs. 26,0% con un IC al 95% di [-16,8%, -6,8%]), tuttavia queste sperimentazioni non erano state disegnate prospetticamente per dimostrare la prevenzione della reinfezione con un nuovo ceppo. Descrizione della popolazione di pazienti negli studi clinici pivotali negli adulti Nei due studi clinici pivotali su pazienti affetti da CDI, il 47,9% (479/999) dei pazienti (popolazione “per protocol”) era di età ≥ 65 anni e il 27,5% (275/999) dei pazienti è stato trattato in concomitanza con antibiotici durante il periodo dello studio. Al basale, il ventiquattro percento dei pazienti rispondeva ad almeno uno dei tre criteri seguenti per il punteggio della severità: temperatura corporea > 38,5°C, conta dei leucociti > 15.000 o valore della creatinina ≥ 1,5 mg/dl. I pazienti affetti da colite fulminante e i pazienti con episodi multipli (definiti come più di un episodio pregresso nell’arco dei 3 mesi precedenti) di CDI sono stati esclusi dagli studi. Trial con fidaxomicina somministrata con dosaggio esteso-pulsato (EXTEND) EXTEND è stato un trial randomizzato, open-label che ha comparato la dose di fidaxomicina estesa pulsata con vancomicina somministrata oralmente. L’endpoint primario è stato il raggiungimento della guarigione clinica 30 giorni dopo la fine del trattamento (giorno 55 per la fidaxomicina, giorno 40 per vancomicina). La guarigione clinica sostenuta 30 giorni dopo la fine del trattamento è stata significativamente più alta per la fidaxomixina vs. vancomicina (vedi Tabella 3).
Tabella 3 Risultati dello studio EXTEND
modified Intent-to-Treat (mITT)
Fidaxomicina (200mg bid per 5 giorni successivamente 200mg a giorni alterni) Vancomicina (125mg qid for 10 days)
Per Protocol (PP) Fidaxomicina (200mg bid per 10 giorni) Vancomicina (125mg qid per 10 giorni) 95% Intervallo di Confidenza* Guarigione clinica 91.9% (442/481 pazienti) 90.2% (467/518 pazienti) (-1.8, 5.3) modified Intent-to-Treat (mITT) Fidaxomicina (200mg
Vancomicina (125mg qid) 95% Intervallo di Confidenza* Guarigione clinica 87.9% (474/539 patients) 86.2% (488/566 patients) (-2.3, 5.7)
bid)
trattamento 70.1% (124/177 pazienti) 59.2% (106/179 pazienti) (1.0, 20.7)
95% Intervallo di Confidenza* Guarigione clinica 30 giorni dopo la fine del
*per differenza di trattamento
Descrizione della popolazione di pazienti in trial con dose estesa-pulsata Il trial è stato condotto su adulti di 60 anni o più anziani. L’età media dei pazienti era 75 anni. Il 72% (257/356) ha ricevuto altri antibiotici nei 90 giorni precedenti. Il 36.5% dei pazienti aveva infezioni severe. Popolazione pediatrica La sicurezza e l’efficacia di fidaxomicina nei pazienti pediatrici di età compresa fra la nascita e una età inferiore ai 18 anni, sono state valutate in uno studio multicentrico, cieco per lo sperimentatore, a gruppi randomizzati paralleli, dove 148 pazienti sono stati randomizzati per ricevere fidaxomicina o vancomicina in un rapporto di 2:1. Un totale di 30, 49, 40 e 29 pazienti sono stati randomizzati rispettivamente nei gruppi di età dalla nascita a <2 anni, da 2 a <6 anni, da 6 a <12 anni e da 12 a <18 anni. La risposta clinica confermata 2 giorni dopo la fine del trattamento è risultata simile tra il gruppo fidaxomicina e il gruppo vancomicina (77,6% vs 70,5% con una differenza percentuale del 7,5% e IC al 95% [-7,4%, 23,9%]). Il tasso di riacutizzazione, 30 giorni dopo la fine del trattamento, era numericamente più basso con fidaxomicina (11,8% vs 29,0%), ma la differenza fra i tassi non è statisticamente significativa (differenza percentuale di -15,8% e IC al 95% per la differenza [-34,5%, 0,5%]). Entrambi i trattamenti avevano un profilo di sicurezza simile.
5.2 Proprietà farmacocinetiche Assorbimento La biodisponibilità nell’uomo non è nota. In soggetti sani adulti, la Cmax è all’incirca pari a 9,88 ng/ml e l’AUC0-t è di 69,5 ng∙hr/ml dopo somministrazione di 200 mg di fidaxomicina, con un Tmax di 1,75 ore. Nei pazienti con CDI, i livelli di picco plasmatico medi di fidaxomicina e del suo metabolita principale OP-1118 tendono ad essere da 2 a 6 volte più alti rispetto ai soggetti adulti sani. L’accumulo di fidaxomicina o di OP-1118 nel plasma in seguito a somministrazione di 200 mg di fidaxomicina ogni 12 ore per 10 giorni è stato molto limitato. Le Cmax di fidaxomicina e di OP-1118 nel plasma sono state del 22% e del 33% inferiori dopo l’assunzione di un pasto ad elevato contenuto di grassi rispetto al digiuno, ma la misura dell’esposizione (AUC 0-t) era equivalente. Fidaxomicina e il metabolita OP-1118 sono substrati della P-gp. Studi in vitro hanno dimostrato che fidaxomicina e il metabolita OP-1118 sono inibitori dei trasportatori BCRP, MRP2 e OATP2B1, ma non sono substrati. In condizioni di utilizzo clinico, fidaxomicina non ha un effetto clinicamente rilevante sull’esposizione di rosuvastatina, un substrato per OATP2B1 e BCRP (vedere paragrafo 4.5). La rilevanza clinica dell’inibizione di MRP2 non è ancora nota. Distribuzione Il volume di distribuzione nell’uomo non è noto, a causa dell’assorbimento di fidaxomicina molto limitato. Biotrasformazione A causa dei bassi livelli di assorbimento sistemico di fidaxomicina, non sono state condotte analisi approfondite sui metaboliti presenti nel plasma. Un metabolita principale, OP-1118, viene formato attraverso idrolisi dell’isobutirril estere. Gli studi in vitro sul metabolismo hanno dimostrato che la formazione di OP-1118 non dipende dagli enzimi del CYP450. Anche questo metabolita presenta attività antimicrobica (vedere paragrafo 5.1). Fidaxomicina non induce o inibisce gli enzimi del CYP450 in vitro. Eliminazione In seguito a dose singola pari a 200 mg di fidaxomicina, la maggior parte della dose somministrata (più del 92%) è stata ritrovata nelle feci sotto forma di fidaxomicina o del suo metabolita OP-1118 (66%). La via di eliminazione principale della fidaxomicina disponibile a livello sistemico non è ancora stata caratterizzata. L’eliminazione attraverso l’urina è trascurabile (<1%). Nelle urine umane erano rintracciabili soltanto livelli molto bassi di OP-1118 e nessuna traccia di fidaxomicina. L’emivita di fidaxomicina è approssimativamente di 8-10 ore. Popolazioni speciali Anziani I livelli plasmatici sembrano essere aumentati nei pazienti anziani (età ≥65 anni). I livelli di fidaxomicina e OP-1118 sono stati approssimativamente 2 volte più elevati nei pazienti di età ≥65 anni, rispetto ai pazienti di età inferiore ai 65 anni. Questa differenza non è considerata rilevante da un punto di vista clinico. Popolazione pediatrica Dopo la somministrazione di compresse rivestite con film, i livelli plasmatici medi (DS) nei pazienti pediatrici da 6 a meno di 18 anni erano rispettivamente 48,53 (69,85) ng/ml e 143,63 (286,31) ng/ml per fidaxomicina e il suo principale metabolita OP-1118, da 1 a 5 ore dopo la dose. Malattia Infiammatoria Intestinale Dati ottenuti da uno studio in aperto, a braccio singolo in pazienti adulti con CDI e concomitante malattia infiammatoria intestinale (IBD), non hanno indicato differenze significative nelle concentrazioni plasmatiche di fidaxomicina o del suo metabolita principale OP-1118 in pazienti con IBD rispetto a dati ottenuti in altri studi su pazienti senza IBD. I livelli plasmatici massimi di fidaxomicina e OP-1118 nei pazienti con CDI e IBD concomitante erano compresi nell’intervallo dei valori riscontrati nei pazienti con CDI senza IBD. Compromissione epatica Dati limitati ottenuti in pazienti adulti con una storia attiva di cirrosi epatica cronica negli studi di Fase 3 hanno dimostrato che la mediana dei livelli plasmatici di fidaxomicina e OP-1118 può essere rispettivamente di 2 e 3 volte circa più elevata che nei pazienti non cirrotici. Compromissione renale Dati limitati relativi a pazienti adulti suggeriscono che non vi sia alcuna differenza sostanziale nella concentrazione plasmatica di fidaxomicina o di OP-1118 tra pazienti con funzione renale ridotta (clearance della creatinina <50 ml/min) e pazienti con normale funzionalità renale (clearance della creatinina ≥ 50 ml/ min). Genere, peso ed etnia Dati limitati suggeriscono che sesso, peso corporeo e razza non hanno un’influenza sostanziale sulla concentrazione plasmatica di fidaxomicina o di OP-1118.

5.3 Dati preclinici di sicurezza I dati preclinici non rivelano rischi particolari per l’uomo sulla base di studi convenzionali di safety pharmacology, tossicità a dosi ripetute, genotossicità, e tossicità della riproduzione. I parametri riproduttivi e di fertilità non hanno mostrato differenze statisticamente significative in ratti trattati con fidaxomicina a dosi fino a 6,3 mg/kg/die (per via endovenosa). Negli animali giovani non sono stati osservati organi bersaglio per la tossicità, e negli studi preclinici non sono stati osservati potenziali rischi importanti che possano essere rilevanti per la popolazione pediatrica.
6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Nucleo delle compresse: Cellulosa microcristallina Amido pregelatinizzato (mais) Idrossipropilcellulosa Idrossitoluene butilato Sodio amido glicolato Magnesio stearato Rivestimento: Alcool polivinilico Titanio diossido (E171) Talco Glicole polietilenico Lecitina (soia)

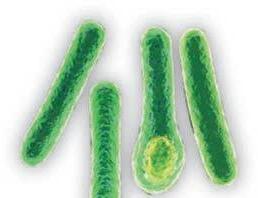
6.2 Incompatibilità Non pertinente.
6.3 Periodo di validità 3 anni.
6.4 Precauzioni particolari per la conservazione Questo medicinale non richiede alcuna condizione particolare di conservazione.
6.5 Natura e contenuto del contenitore Blister alu/alu divisibile per dose unitaria; 100 x 1 compresse rivestite con film. Blister alu/alu divisibile per dose unitaria; 20 x 1 compresse rivestite con film. È possibile che non tutte le confezioni siano commercializzate.
6.6 Precauzioni particolari per lo smaltimento Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente.
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO Tillotts Pharma GmbH Warmbacher Strasse 80 79618 Rheinfelden Germania
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO EU/1/11/733/003-004
9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE Data di prima autorizzazione: 05 Dicembre 2011 Data dell’ultimo rinnovo: 22 Agosto

2016
10. DATA DI REVISIONE DEL TESTO 12 dicembre 2022
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web della Agenzia europea dei medicinali: http://www.ema.europa.eu.
Classe di rimborsabilità: CLASSE H
Prezzo al pubblico: € 2.487,44
Medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile - vietata la vendita al pubblico
Depositato presso Aifa in data 06/03/2023 Cod. Difadv23








Clostridioides Difficile?1 Le linee guida ESCMID raccomandano DIFICLIR® già dal primo episodio.2 Classe di rimborsabilità: CLASSE H Prezzo al pubblico: € 2.487,44 Classificazione ai fini della fornitura: OSP Bibliografia: 1. DIFICLIR® Riassunto delle Caratteristiche del Prodotto 2. Van Prehn J et al. Clin Microbiol Infect 2021;S1198-743X(21)00568-1 VIETATA LA DISTRIBUZIONE/ESPOSIZIONE AL PUBBLICO Depositato presso AIFA in data 06/03/2023 Cod. Difadv23 Consulta il RCP
Infezioni da




















