Aften
 HEMATOLOGISK NORSK
HEMATOLOGISK NORSK
EHA 2023





Kjære leser,
10. juni 2023 ble hematologisk Norsk aften arrangert i Frankfurt hvor årets EHA kongress ble gjennomført. Det var med stor glede vi kunne konstatere at årets møte resulterte i et enda større oppmøte av tilreisende norske kongressdeltakere som er vårt andre møte som vi har arrangert i kongressbyen.
Denne ettermiddagen og kvelden fikk vi høre gode presentasjoner med oppsummeringer fra årets kongress, god faglig diskusjon i pauser og rundt bordene, og ikke minst den sosiale delen avslutningsvis med felles bespisning. Intet unntak, det ble en fin sosial ramme under middagen denne gangen også.

Vi ønsker å rette en stor takk til vårt faglige panel som her har beskrevet deres mest interessante «funn» fra EHA 2023. Summen av den gode kvaliteten på innleggene vi får presentert sammen med god deltakelse fra representanter fra sykehus i sør, vest, nord og øst, gjør at denne møteplassen og forumet har sin misjon og relevans.
Neste hematologisk Norsk aften vil bli arrangert i Oslo, torsdag 11. Januar 2023 på Radisson BLU Scandinavia hvor vi får presentert nyhetene fra ASH 2023. Følg med på norskaften.no etter sommeren for mer informasjon og påmelding.
Vennlig hilsen,
Sindre Hauge
Arrangør av Hematologisk Norsk Aften Apriil Congress AS
EHA 2023 norskaften.no

INNHOLD
6/ Fokus på AIHA, CAD og WM
Sigbjørn Berentsen
11/ Myelomatose – Immunterapi fortsetter å dominere
Frida Bugge Askeland og Jakob Nørrgård
16/ Nyheter om AML på EHA 2023
Anders E. A. Dahm
20/ Fokus på KLL, AL- amyloidose og ITP
Galina Tsykunova
30/ Drømmen om behandling av B-ALL uten kjemoterapi ble tydeligere under årets EHA
Hilde Skuterud Wik
EHA 2023
Fokus på AIHA, CAD og WM
Autoimmun hemolytisk anemi
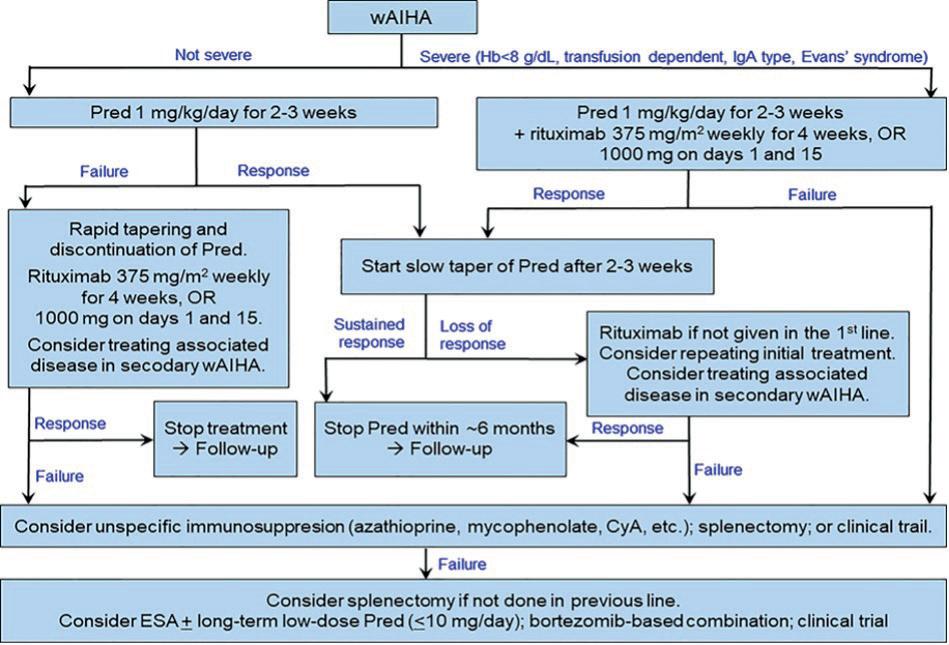
På EHA 2023 var det noen originalpresentasjoner om autoimmun hemolytisk anemi (AIHA) av varmeantistofftype (wAIHA). Jeg skal referere to presentasjoner som er klart relevante for norsk hverdagshematologi og en presentasjon av et mulig framtidig nytt behandlingsprinsipp. Som bakgrunn kan det være nyttig å ta utgangspunkt i den terapeutiske algoritmen som er vist under (Figur 1.)
Transfusjon ved wAIHA
Francesco Versino og medarbeidere fra hematologisk avdeling ved IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milano, Italia, hadde en posterpresentasjon av en retrospektiv studie av transfusjoner ved wAIHA. Det er ikke rasjonelt å sette et fast hemoglobin(Hb)-nivå som rutinemessig skal utløse transfusjon ved wAIHA. Mer hensiktsmessige indikasjoner er raskt fallende Hb og/ eller kritiske kliniske symptomer på anemi, slik som sirkulatoriske, kardiale eller cerebrale symptomer. Når spesifikke forholdsregler
følges er transfusjon vanligvis trygt og bør ikke unnlates når det er indisert. Imidlertid gir man nødvendigvis uforlikelig (om enn typelikt) erytrocyttkonsentrat, med en viss risiko for akutte eller forsinkede transfusjonsreaksjoner eller utvikling av alloimmunitet. Sistnevnte er antatt å kunne gi økende problemer ved seinere transfusjoner.
Materialet omfattet 103 transfunderte pasienter (av totalt 408 pasienter med AIHA) behandlet ved senteret fra 1997 til 2022. Forfatterne konkluderer med at erytrocytt-transfusjoner ved AIHA er effektivt med en median stigning i Hb på 1,0 g/dL per enhet transfundert konsentrat. De registrerte mindre enn 10% transfusjonsreaksjoner. Alloimmunisering inntrådte hos 19% av pasientene og var assosiert med mindre økning i Hb og økt rate av transfusjonsreaksjoner. Forfatterne antar at «pre-storage» leukocyttreduksjon, mer restriktiv indikasjonsstilling og implementering av omfattende fenotyping av resipient og donor, slik man har praktisert de siste to årtiene, har ført til redusert antall transfusjoner og redusert hyppighet av alloimmunisering.
6
Sigbjørn Berentsen
Figur 1. Terapeutisk algoritme for wAIHA (Berentsen S, Fattizzo B, Barcellini W. Front Immunol 2023; 14:1180509).
Rekombinant erytropoietin (EPO) ved AIHA med inadekvat retikulocytose
En poster ved G.L.Pedona, W. Barcellini og B. Fattizzo fra IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Milano, Italia, beskrev en prospektiv studie av dette emnet. Fra før har to forholdsvis små, retrospektive studier tydet på at EPO har effekt ved AIHA med inadekvat retikulocytose, d.v.s. hos de pasientene som har nedsatt eller normalt absolutt retikulocyttall i motsetning til den markante økningen man finner hos flertallet ved AIHA. Den prospektive studien omfattet 35 pasienter med AIHA (både wAIHA og kuldeagglutininsykdom, CAD) med inadekvat retikolocytose. De fleste pasientene hadde også manglende eller påfallende liten økning av endogent EPO.
Median endring av Hb i hele gruppen var +1,3 g/dL på dag 15, +2,0 g/dL på dag 30 og +3,2 g/dL på dag 90. «Overall response rate» var 49% på dag 15, 70% på dag 30 og 75% på dag 90. Raten av pasienter som ble vurdert som transfusjonstrengende avtok fra 26% ved behandlingsstart til 9% ved dag 30 og 6% ved dag 90. Hos 74% ble EPO seponert etter en median behandlingstid på 125 dager, og 63% oppnådde vedvarende respons etter seponering (Referentens merknad: wAIHA er en kronisk residiverende sykdom mer enn en
kronisk sykdom, og posteren opplyste dessuten ikke hvor mange som i mellomtiden hadde respondert på annen behandling). Det var ingen tydelig forskjell i responsrate eller -mønster mellom wAIHA og CAD. Residiv under pågående behandling ble observert hos 14%. Behandlingen ble godt tolerert; 1 pasient (0,3%) fikk lungeemboli som sannsynligvis mest var utløst av tilbakefall av AIHA og alvorlig infeksjon.
Forfatterne (og denne referenten) konkluderer med at ved wAIHA eller CAD med dårlig respons på første- og annenlinjebehandling kan EPO være nyttig som tredjelinjebehandling eller supplerende behandling. Indikasjonsområdet bør sannsynligvis avgrenses til pasienter med inadekvat retikulocytose og/eller liten endogen EPO-respons.
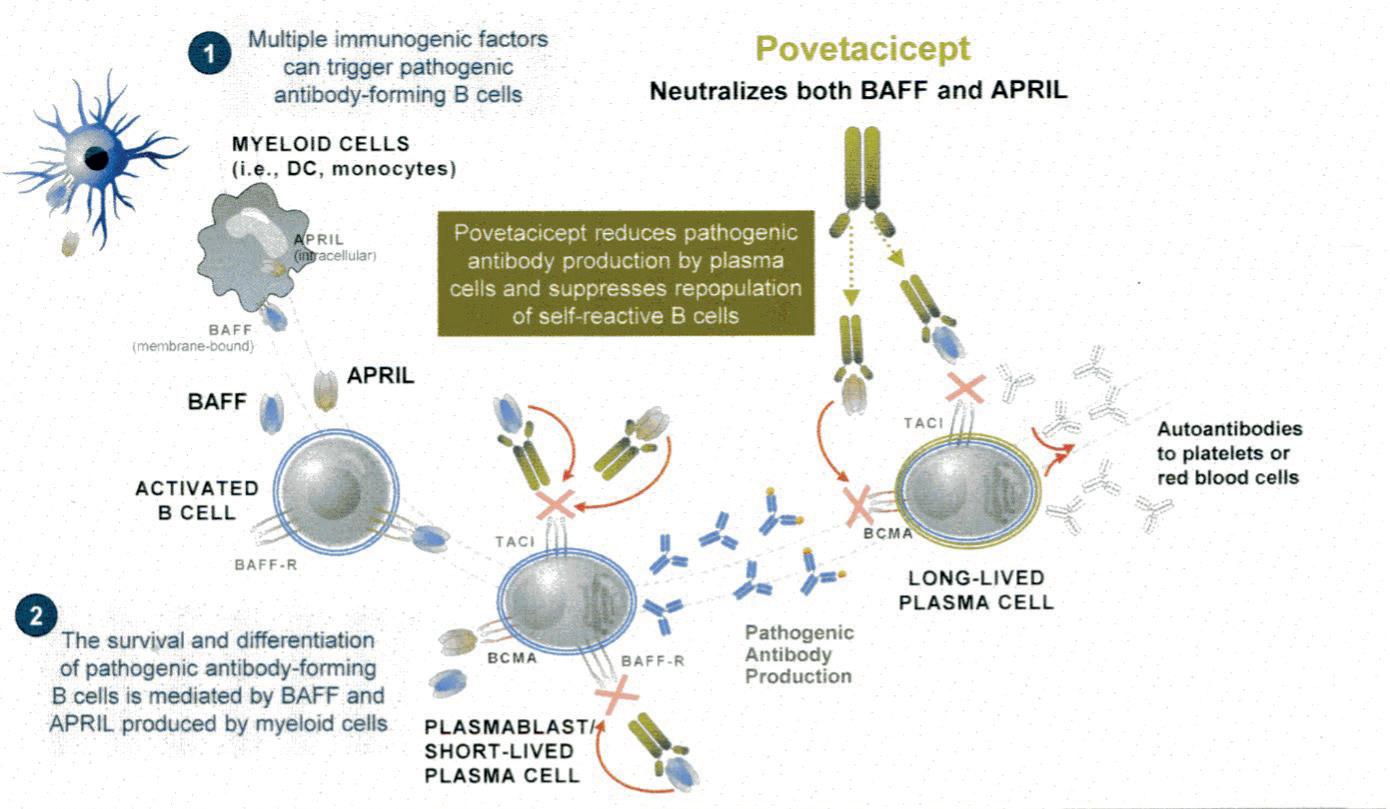
Povetacicept (ALPN-303): Nytt medikament «entering the pipeline» En oral presentasjon ved Stacey Dillon (Seattle, USA) hadde tittelen «Povetacicept (ALPN-303), a dual BAFF/APRIL antagonist, for the treatment of autoimmune cytopenias and other antibody-related diseases.” Dette monoklonale antistoffet blokkerer cytokinene APRIL og BAFF, som begge dannes av myeloide celler og stimulerer B-lymfocytter og plasmaceller. Ved å blokkere begge disse
7
Figur 2. Virkningsmekanisme for povetacicept.
cytokinene virker antistoffet på B-celler helt fra pro-B-stadiet til «long-lived» plasmaceller. Virkningsmekanismen er vist side 7 (Figur 2.).
Man vil undersøke om medikamentet kan brukes til behandling av wAIHA, CAD og ITP. Det er utført in vitro- og prekliniske studier samt forsøk på friske frivillige, medikamentet ser ut til å være trygt, og det er klart for fase 1-studier på pasienter.
Kuldeagglutininsykdom
Langtidseffekt av komplementhemming ved CAD
I likhet med de fleste EHA- og ASH-kongresser de siste årene hadde også dette årets EHA en rekke presentasjoner om kuldeagglutininsykdom (CAD). En av dem var posteren “Sustained efficacy of sutimlimab, a complement C1s inhibitor, in patients with cold agglutinin disease: Results from part B of the phase 3 Cadenza study” av Alexander Röth, Sigbjørn Berentsen, Wilma Barcellini, et al, også med Tor Henrik Tvedt som medforfatter. Dette var en ekstensjonsstudie av den prospektive, randomiserte Cadenza-studien, som viste svært god effekt av komplement C1shemmeren sutimlimab på hemolytisk anemi og fatigue ved CAD. Ekstensjonsstudien viser at da pasientene i placebogruppen (som ikke oppnådde noen bedring) etter 26 uker skiftet over til aktiv behandling, oppnådde også de en umiddelbar normalisering av bilirubinnivå og en svært rask Hb-stigning til normale eller lett subnormale nivåer. Normaliseringen var ledsaget av en tilsvarende bedring av livskvalitetsskår. Under fortsatt behandling var effekten stabil i hele studiens varighet (dvs. mer enn et år). Medikamentet ble fortsatt godt tolerert.
CAD og kryoglobulinemi
Nicole Japzon og medarbeidere fikk publisert et abstrakt om samtidig kuldeagglutininsykdom og kryoglobulinemi, «PB2549 Co-existent cold agglutinin disease and cryoglobulinemia». Forfatterne arbeider ved senteret for Waldenströms makroglobulinemi (WM) og relaterte sykdommer ved University College London Hospitals, London, UK – samme senter som på ASH 2022 presenterte et arbeid om kryoglobulinemi ved WM (se referat i Norsk Hematologisk Aften, post-ASH 2022).
Hos 24 konsekutive CAD-pasienter som ble diagnostisert eller behandlet ved senteret fant forfatterne kryoglobulin (vanligvis type 1) hos 15, mens 9 ikke hadde påvisbart kryoglobulin. De med kryoglobulin hadde større tendens til iskemiske sirkulatoriske symptomer enn de uten kryoglobulin. Av 3 pasienter med alvorlige sirkulatoriske symptomer hadde alle påvisbart kryoglobulin.
Referentens merknad: Funnene er overraskende, og det bør gjøres flere studier av andre CAD-kohorter for å se om de er representative. Det har også tidligere vært beskrevet funn av kryoglobulin hos CAD-pasienter, både i kasuistikker og i våre deskriptive studier, sannsynligvis best forklart ved at det samme monoklonale IgM kan ha egenskaper som både kuldeagglutinin og kryoglobulin. Andelen CAD-pasienter som har kryoglobulin har imidlertid til nå vært ukjent (og antatt å være svært mye lavere), ettersom forekomst av kryoglobulin ikke har vært systematisk undersøkt i CAD-studier.
Inntil videre gir denne rapporten grunn til å undersøke på kryoglobulin hos alle CAD-pasienter med sterke sirkulatoriske symptomer eller kanskje hos alle pasienter med CAD.
Satellittsymposier om CAD og wAIHA
Torsdag 9. juni ble det arrangerte Sanofi et satellittsymposium om CAD. Wilma Barcellini, Milano, snakket om diagnostikk og vektla distinksjonen mellom CAD og sekundært kuldeagglutininsyndrom (CAS). Josephine Vos, Amsterdam, ga en omtale av hvordan CAD påvirker livskvaliteten. Hun framhevet betydningen av de kuldeinduserte sirkulatoriske symptomene, som etter hennes (og denne referentens) oppfatning er underrapportert og undervurdert. Bernd Jilma fra Wien snakket om individualisert valg av B-cellerettet versus komplementrettet behandling, og Alexander Röth fra Essen (Tyskland) ga en nærmere oversikt over evidensmaterialet for komplementhemming ved CAD.
I de etterfølgende «virtuelle dagene» av EHA-kongressen ble det onsdag 14. juni gjennomført et nettbasert satellittsymposium om AIHA, både wAIHA og CAD, arrangert av Physician’s Educational Resource (PER). Wilma Barcellini skisserte og diskuterte diagnostisk utredning ved wAIHA, Sigbjørn Berentsen snakket om behandling av wAIHA, Catherine Broome (Washington DC, USA) omtalte diagnostisering av CAD, og Alexander Röth tok for seg individualisert behandling ved CAD. Til sammen ga disse foredragene en omfattende oversikt og oppdatering om emnet og kan anbefales, ikke minst for kolleger som ikke er helt oppdatert innen AIHA. Alle som var registrerte deltakere på EHA, kan følge symposiet i ettertid på https://eha2023.ehaweb.org/eha/eha2023/en-GB/ session/95886 .
Waldenströms makroglobulinemi (WM)
Bortezomib, rituksimab og deksametason (BDR) ved WM – retrospektive data
Det var få presentasjoner om WM på EHA i år. Thomas Hueso fra Sorbonne-universitetet i Paris hadde en poster med tittelen «P961. Bortezomib, rituximab and dexamethasone regimen (BDR) in Waldenström macroglobulinemia: a retrospective analysis». En tidligere prospektiv fase 2-studie dokumenterte høye responsrater, god remisjonsvarighet og tilfredsstillende toleranse for dette regime ved WM, og det har siden vært i nokså omfattende bruk på verdensbasis. I det norske Handlingsprogrammet anbefaler vi vanligvis bendamustin-rituksimab i første linje, men har tatt med BDR som et alternativt førstelinjeregime fordi det ikke er beinmargstoksisk og derfor tåles godt av pasienter med beinmargssvikt ved behandlingsstart.
Den franske retrospektive studien analyserte data fra 33 pasienter behandlet med BDR. De fant 80% «overall response rate» og median progresjonsfri overlevelse på 39 måneder, dvs. «real life»-resultater som står seg godt sammenliknet med både den opprinnelige prospektive studien og andre aktuelle regimer. De fant ingen assosiasjon med prognostisk skår (IPSS-WM) eller molekylære funn, men som forfatterne selv påpeker kan dette skyldes liten statistisk styrke pga. relativt få pasienter.
8 EHA 2023
UTVALGT PRODUKT OG SIKKERHETSINFORMASJON FOR EMPLICITI®
VIKTIG SIKKERHETS-OG FORSKRIVNINGSINFORMASJON Empliciti® (elotuzumab)
Utleveringsgruppe C, Reseptbelagt legemiddel.
Indikasjoner: I kombinasjon med lenalidomid og deksametason til behandling av myelomatose hos voksne som har fått minst 1 tidligere behandling. I kombinasjon med pomalidomid og deksametason til behandling av voksne med tilbakevendende og refraktær myelomatose som har fått minst 2 tidligere behandlinger, inkl. lenalidomid og en proteasomhemmer, og sykdomsprogresjon er vist med siste behandling.
Dosering: Voksne inkl. eldre: Premedisinering for forebygging av infusjonsrelaterte reaksjoner (IRR) skal gis. Empliciti i kombinasjon med lenalidomid og deksametason gis som IV, 10 mg/kg kroppsvekt ukentlig de 2 første syklusene, deretter 20 mg/kg kroppsvekt dag 1 i de påfølgende syklusene. Empliciti i kombinasjon med pomalidomid og deksametason gis som IV, 10 mg/kg kroppsvekt ukentlig de 2 første syklusene, deretter 20 mg/ kg kroppsvekt dag 1 i de påfølgende syklusene. En syklus er 28 dager. For detaljert doseringsskjema se www.felleskatalogen.no.
Vanligste bivirkninger: De vanligste bivirkningene (oppstod hos > 10 % av pasientene) ved elotuzumab behandling var IRR, diaré, herpes zoster, nasofaryngitt, hoste, pneumoni, øvre luftveisinfeksjon, lymfopeni og vektreduksjon.
Alvorlige biverkninger: Den alvorligste bivirkningen som kan oppstå under elotuzumab behandling er pneumoni.
Kontraindikasjoner*: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene. Preparatomtalene for lenalidomid, pomalidomid og deksametason som brukes i kombinasjon med Empliciti skal gjennomgås før oppstart av behandling.
Advarsler og Forsiktighetsregler: IRR er rapportert hos pasienter som har fått elotuzumab. Premedisinering skal gis før infusjon. Pasienten bør overvåkes for utvikling av Sekundære primære maligniteter (SPM). I kliniske studier hos pasienter med myelomatose var forekomsten av alle infeksjoner, inkludert pneumoni, høyere hos pasienter behandlet med Empliciti. Pasienter bør overvåkes og infeksjoner bør håndteres med standardbehandling. For fullstendig informasjon, se preparatomtale og SPC tilgjengelig på www.felleskatalogen.no.
Interaksjoner: Ingen farmakokinetiske interaksjonsstudier er utført. Metabolisme via CYP450 enzymer eller andre legemiddelmetaboliserende enzymer forventes ikke. Empliciti kan påvises i serumproteinelektroforese (SPEP) og ved immunfiksering i serum hos myelompasienter og kan interferere med riktig responsklassifisering. Tilstedeværelse av elotuzumab i pasientens serum kan forårsake en liten topp i begynnelsen av gamma regionen på SPEP som tilsvarer IgGƙ ved immunfiksering i serum. Denne interferensen kan påvirke vurderingen av fullstendig respons og mulig tilbakefall fra fullstendig respons hos pasienter med IgG kappa myelomprotein. I tilfeller hvor det påvises ekstra topper ved immunfiksering i serum bør en mulig biklonal gammopati utelukkes.
Pakninger, priser og refusjon: 300 mg: 1 stk. (hettegl.) 15190,30 kroner. 400 mg: 1 stk. (hettegl.) kr 20241,70 kroner. Empliciti er godkjent refundert i kombinasjon med lenalidomid og deksametason til pasienter som har fått 3 tidligere behandlingslinjer.
Se felleskatalogen for fullstendig forskrivningsinformasjon før forskrivning.
Bristol Myers Squibb Norge, Lysaker Torg 35 1366 Lysaker, telefon: 23 12 06 37 , www.bms.com/no
Versjon 1
Bristol Myers Squibb Lysaker Torg 35 1366 Lysaker www.bms.com/no
Godkjent av beslutningsforum, i kombinasjon med lenalidomid og deksametason, hos voksne myelomatosepasienter som har fått minst 3 tidligere behandlingslinjer1.
1. Beslutningsforum for nye metoder 23.05.2022 sak 064-2022 689-NO-2300001 / Utarbeidet feb 2023
Bugge Askeland og Jakob Nørrgård
Myelomatose – Immunterapi fortsetter å dominere
Med juni kommer ASCO og EHA og dermed spennende tider for oss som jobber med myelomatose. Som «vanlig» dreide det meste seg om immunterapi, nærmere bestemt CAR-T og bispesifikke antistoffer.
CAR-T: Flyttes fremover i behandlingsforløpet
Inntil nå har vi bare hatt data på CAR-T hos pasienter som har mottatt flere linjer med behandling. Cilta-Cel, med BCMA som angrepspunkt, har vist best data på progresjonsfri overlevelse (PFS) i denne gruppen. Oppdaterte tall fra ASCO i år viste at median PFS med Cilta-Cel i CARTITUDE-1 studien var hele 35 måneder, overlegent bedre enn all annen behandling for denne pasientgruppen.
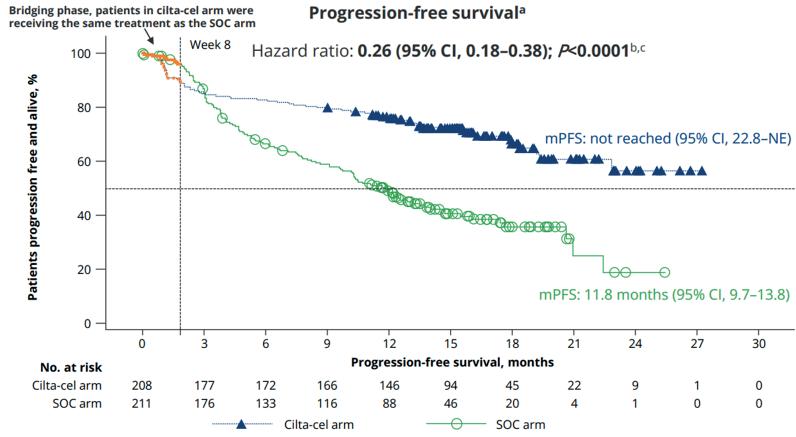
På EHA fikk vi presentert data fra CARTITUDE-4 studien. Inkluderte pasienter var refraktære for lenalidomid, og kunne ha mottatt 1 til 3 tidligere linjer. Pasientene ble randomisert 1:1 mellom standardbehandling og Cilta-Cel. Standardardbehandlingen besto av enten Daratumumab-Pomalidomid-Deksametason (DPd) eller Pomalidomid-Velcade-Deksametason (PVd). En innvending mot studien er at Daratumumab-Carfilzomib-Deksametason (DKd) ikke var en del av denne standardbehandlingen, da DKd trolig er mer effektiv enn DPd og PVd. Pasientene som ble randomisert til CAR-T fikk først «bridging» med minst en syklus standardbehandling, og
deretter Cilta-Cel. Studien viste en statistisk signifikant forbedring i progresjonsfri overlevelse (PFS) i favør av Cilta-Cel, der median PFS var ikke nådd, i motsetning til standardarmen hvor median PFS var 12 måneder. Et annet interessant funn var at man fant mindre cytopenier, cytokine release syndrome (CRS) og nevrotoksistet i CARTITUDE-4 sammenlignet med studier hvor man har gitt Cilta-Cel i senere linjer. En bivirkning man forøvrig er blitt mer og mer oppmerksom på, er hjernenerveutfall som f.eks. facialisparese. Dette kan komme sent i forløpet, og som oftest går det tilbake med steroider. Alt i alt er dette oppmuntrende resultater for Cilta-Cel, selv om data på overall survival (OS) mangler.
Til tross for imponerende data på PFS, progredierer pasientene også etter BCMA-rettet behandling. Vi trenger derfor behandlingsalternativer der man angriper et annet målprotein. På EHA fikk vi data fra en fase I studie med CAR-T rettet mot G-protein koblet reseptor gruppe 5 type D (GPRC5D). Dette målproteinet er kjent fra før, da det bispesifikke antistoffet Talquetamab også retter seg mot dette. I motsetning til BCMA som vi vet er nødvendig for at for at plasmacellene skal overleve, vet vi ikke hvilken funksjon GPRC5D har, men vi vet det er uttrykt på plasmaceller og i keratinisert vev som hud og negler. Responsraten for CAR-T rettet mot GPRC5D var rundt 85%, noe som er veldig bra hos en gruppe som hadde mottatt minst tre klasser myelomatosemedikamenter tidligere, og
11
Frida
Figur 1: Kaplan-Meier kurve fra CARTITUDE-4 studien, Cilta-Cel i blått og standardbehandling i grønt.
flere hadde fått CAR-T mot BCMA. Ved behandling med bispesifikke antistoffer mot GPRC5D har man sett at de fleste pasientene får bivirkninger med dårlig smak, hud- og negleforandringer, dette så man mindre av med dette CAR-T produktet.
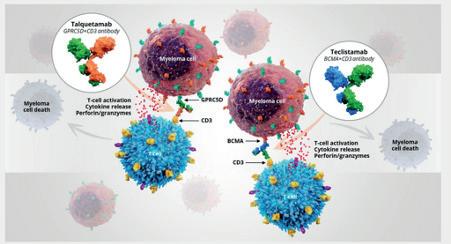
Bispesifikke antistoffer: BCMA eller GPRC5D, eller kanskje begge samtidig?
Vi fikk presentert oppdaterte data fra MAJESTEC-1 studien. Her ga man Teclistamab, et bispesifikt antistoff mot BCMA, til pasienter med myelomatose refraktære mot tre klasser medikamenter. Responsraten var 63%, median PFS var 11 måneder og median OS var 22 måneder. Dette er gode tall sammenlignet med all annen behandling, med unntak av CAR-T. Fordelen til Teclistamab og andre bispesfikke antistoffer er at det er lettere tilgjengelig og kan gis med en gang, uten forutgående høsting, bridging og lymfodeplesjon som ved CAR-T. Bivirkningene med CRS, nevrotoksisitet og uttalt infeksjonstendens er kjent og beskrevet godt fra før. Infeksjonstendensen må tas på alvor med lav terskel for substitusjon med immunoglobiliner, profylakse mot herpes zoster og PCP, samt behandling mot covid-19.
Videre ble det presentert mer data angående Talquetamab, et bispesifikt antistoff mot GPRC5D. I MonumenTAL-1 studien ble denne gitt pasienter som hadde fått minst tre tidligere linjer. Det interessante med studien var at pasientene kunne ha fått tidligere T-cellerettet behandling (bispesfikke antistoffer eller CAR-T) mot
BCMA. Hos disse pasientene var responsraten 75%. Altså er dette et håp for pasienter som har progrediert etter CAR-T eller bispesfikke antistoffer mot BCMA. Det er imidlertid fortsatt et stort problem at de fleste pasientene får munnhuleproblemer i form av dårlig smak, og dermed ofte redusert apetitt og vektnedgang. I tillegg sees altså hud- og negleforandringer. Forhåpentlig vil vi lære å bruke denne behandlingen (med å justere doser og frekvens) på en måte som balanserer effekt og bivirkninger, litt som vi har lært å bruke Velcade (ved å gi s.c. istedenfor i.v. og ukentlig istedenfor to ganger i uken, som gir mindre nevropati).
Til slutt: RedirecTT-1 studien ble presentert, og det er den første studien innenfor ikke bare myelomatose, men hele hematologifeltet, som har testet kombinasjonen av to bispesifikke antistoffer samtidig. 93 pasienter ble inkludert, median antall tidligere linjer var 4, og de fleste var refraktære for siste linje med behandling. Sikkerheten var omtrent som ved å gi medikamentene hver for seg, uten additiv toksisitet. Responsraten var 96% for hele gruppen. Studien inkluderte også en god del pasienter med ekstramedullære plasmacytomer (32% av pasientene). Vi vet godt at dette er en gruppe pasienter med svært dårlig prognose, og her så man en responsrate på 86%. Dette er lovende responsrater, men median PFS for denne gruppen med ekstramedullære plasmacytomer var på 10 måneder, så man har fortsatt et forbedringspotensiale. Resultatene støtter i alle fall videre studier, så får vi vente og se.
12
EHA 2023
Figur 2: Bispesifikke antistoffer gjør at myelomatosecellene og T-cellene kommer nærme hverandre, slik at T-cellen kan drepe myelomatosecellene. Både Teclistamab og Talquetamab binder CD3 på T-cellene, og henholdsvis GPRC5D og BCMA på myelomatosecellene.
Bosulif er indisert til behandlingen av voksne pasienter med:
• Nydiagnostisert Philadelphiakromosom-positiv kronisk myelogen leukemi (Ph+ KML) i kronisk fase (KF).
• Ph+ KML i KF, akselerert fase (AF) og blastfase (BF) som tidligere er behandlet med én eller flere tyrosinkinasehemmere (TKIs) og hvor imatinib, nilotinib og dasatinib ikke ansees som egnede behandlingsalternativer.
Bosulif «Pfizer»
Proteinkinasehemmer
Filmdrasjerte tabletter 100 mg, 400 mg og 500 mg
Utvalgt sikkerhetsinformasjon:
L01E A04 (Bosutinib)
Behandling med bosutinib er assosiert med forhøyet nivå av serumtransaminaser (ALAT, ASAT). Nedsatt leverfunksjon er kontraindisert. Det bør tas leverfunksjonstester før behandlingsstart, og månedlig de første tre månedene av behandlingen, og som klinisk indisert.
Behandling med bosutinib er assosiert med diaré og oppkast. Forsiktighet bør derfor utvises hos pasienter med nylig eller pågående klinisk signifikant gastrointestinal sykdom. Behandling med bosutinib er assosiert med myelosuppresjon. Fullstendig blodtelling bør utføres ukentlig den første måneden, og deretter månedlig, eller som klinisk indisert. Behandling med bosutinib kan være assosiert med væskeretensjon, inkludert perikardial effusjon, pleuraeffusjon, lungeødem og/eller perifert ødem. Pasienter bør monitoreres og gis standardbehandling. Infeksjoner: Kan predisponere for infeksjoner. Proarytmisk potensiale: Forsiktighet bør utvises ved tidligere eller predisposisjon for QTC-forlengelse, ved ukontrollert eller signifikant hjertesykdom, eller ved bruk av legemidler kjent for å forlenge QTC.
Interaksjoner: Samtidig bruk av kraftige eller moderate CYP3A-hemmere bør unngås, da de øker plasmakonsentrasjonen av bosutinib. Vis forsiktighet ved samtidig bruk av svake CYP3A-hemmere.
Dosering
Behandling bør startes opp av lege med erfaring i diagnostisering og behandling av KML. Nydiagnostisert KF Ph+ KML: anbefalt dose 400 mg 1 gang daglig. KF, AF eller BF Ph+ KML med resistens/intoleranse mot tidligere behandling: anbefalt dose 500 mg 1 gang daglig.
Dosejustering
Doser >600 mg/dag er ikke undersøkt og bør ikke gis. Doser <300 mg/dag er brukt, men effekt ikke fastslått.
Dosejustering og/eller seponering kan være nødvendig ved ikke-hematologiske bivirkninger og ved alvorlig eller vedvarende nøytropeni og trombocytopeni, se preparatomtale for ytterligere informasjon.
Administrering: Tas 1 gang daglig om morgenen. Skal tas med mat, men samtidig inntak av grapefrukt/grapefruktjuice skal unngås.
Kontraindikasjoner
Overfølsomhet for innholdsstoffene. Nedsatt leverfunksjon.
Svært vanlige og vanlige bivirkninger:
Organklasse Bivirkning
Blod/lymfe
Svært vanlige Anemi (inkl. redusert hemoglobin), nøytropeni (inkl. redusert nøytrofiltall), trombocytopeni (inkl. redusert blodplatetall)
Vanlige Leukopeni (inkl. redusert antall hvite blodceller)
Gastrointestinale
Svært vanlige Abdominalsmerter, diaré, kvalme, oppkast
Vanlige Gastritt, gastrointestinal blødning, pankreatitt (inkl. akutt pankreatitt)
Generelle
Svært vanlige Asteni, fatigue (inkl. asteni, malaise), feber, ødem (inkl. ansiktsødem, lokalisert ødem, perifert ødem)
Vanlige Brystsmerter (inkl. ubehag i brystet), smerter
Hjerte
Vanlige Perikardiell effusjon
Hud
Svært vanlige Kløe, utslett (inkl. generalisert, makuløst, makulopapuløst, papuløst og kløende utslett)
Vanlige Akne, fotosensitivitetsreaksjon, urticaria
Immunsystemet
Vanlige Legemiddeloverfølsomhet
Infeksiøse
Svært vanlige Luftveisinfeksjon (inkl. øvre/nedre, samt viral luftveisinfeksjon), nasofaryngitt
Kar
Vanlige Hypertensjon
Lever/galle
Svært vanlige Økt ALAT, økt ASAT
Vanlige Hepatotoksisitet (inkl. hepatitt, toksisk hepatitt, leversykdom), unormal leverfunksjon, økt bilirubin i blod (inkl. hyperbilirubinemi), økt γ-GT
Luftveier
Svært vanlige Dyspné, hoste, pleuraeffusjon
Vanlige Pulmonal hypertensjon (inkl. pulmontal arteriell hypertensjon, økt pulmonalt arterietrykk respirasjonssvikt)

Muskel-skjelettsystemet
Svært vanlige Artralgi, ryggsmerter
Vanlige Myalgi
Nevrologiske
Svært vanlige Hodepine, svimmelhet
Vanlige Dysgeusi
Nyre/urinveier
Vanlige Akutt nyresvikt, nedsatt nyrefunksjon, nyresvikt
Stoffskifte/ernæring
Svært vanlige Redusert appetitt
Vanlige Dehydrering, hyperkalemi (inkl. økt kalium i blod), hypofosfatemi (inkl. redusert fosfor i blod)
Sist endret: 03.05.2022
Basert på SPC godkjent av SLV/EMA: 07.04.2022

Bosulif, TABLETTER, filmdrasjerte:
Styrke Pakning Refusjon1 Pris (kr) Reseptgruppe
100 mg 28 stk. (blister) H-resept 9 511,10 C
400 mg 28 stk. (blister) H-resept 41 132,70 C
500 mg 28 stk. (blister) H-resept 41 828,80 C
1 Blåresept (T) gjelder forhåndsgodkjent refusjon. For informasjon om individuell stønad, se HELFO For H-resept, se Helsedirektoratet.
Pfizer AS - Postboks 3 - 1324 Lysaker - Besøksadresse: Drammensveien 288 Telefon 67526100 - www.pfizer.no
C
Referanse: Bosulif SPC 07.04.2022, pkt 4.1
Bosulif® ved PH+KML
PP-BOS-NOR-0070
3952_Bosulif_Ann_185x267mm.indd 1 10.01.2023 09:29
Bosulif QR-code FK Bosulif QR-code
DARZALEX® + Rd FORLENGER
TOTALOVERLEVELSE1–3
Lenger oppfølgingstid (>5år) bekrefter signifikant OS med DRd sammenlignet med Rd alene hos pasienter nydiagnostisert myelomatose hvor HMAS ikke er aktuelt.
Overall survival (median follow-up 64 months)1
DRd median: NR months
Rd median: 65.5 months
Adapted from DARZALEX® SC summary of product characteristics.1
*Median oppfølging på 64 måneder1
DRd, DARZALEX® + lenalidomide + dexamethasone; mOS, median overall survival; HR, hazard ratio; CI, confidence interval; HMAS, høydosebehandling
1. Darzalex SmPC, 11/2022, avsnitt 4.1, 4.8, 5.1. 2. Facon T, Kumar SK, Plesner T et al. Daratumumab, lenalidomide, and dexamethasone versus lenalidomide in newly diagnosed multiple myeloma (MAIA): overall survival results from a randomised, open-label, phase 3 trial Lancet Oncol. 2021;22:1582–1596. al. Daratumumab Plus Lenalidomide and Dexamethasone (D-Rd) Versus Lenalidomide and Dexamethasone (Rd) Alone in Transplant-Ineligible Patients Myeloma (NDMM): Updated Analysis of the Phase 3 Maia Study. Blood (2022) 140 (Supplement 1): 10150–10153.
351 336 317 300 281 258 241 223 204 157 117 65 26 8 4 0 369 343 324 308 294 270 251 232 214 195 186 350 344 334 316 302 286 273 255 248 200 148 103 42 16 5 0 368 346 338 328 305 297 280 266 249 246 240 DRd Rd No. at risk 100 80 60 40 20 0 % surviving Months HR: 0.66 (95% CI: 0.53–0.83) 3 9 15 21 27 33 39 45 51 60 63 66 69 72 75 78 0 6 12 18 24 30 36 42 48 54 57
fordel pasienter med aktuelt.*1,3
34%
reduksjon i risiko for død HR: 0.66 (95% CI: 0.53-0.83)
Ingen nye bivirkninger ble observert for DRd etter lenger oppfølgingstid1,3
høydosebehandling med autolog stamcellestøtte. lenalidomide and dexamethasone alone 2021;22:1582–1596. 3. Kumar SH, Moreau P, Bahlis NJ et Patients with Newly Diagnosed Multiple
UTVALGT PRODUKT OG SIKKERHETSINFORMASJON FOR DARZALEX® INTRAVENØS (IV)
OG SUBKUTAN (SC)
INDIKASJONER
Myelomatose (Darzalex® IV og SC)
• I kombinasjon med lenalidomid og deksametason eller med bortezomib, melfalan og prednison til behandling av voksne pasienter med nydiagnostisert myelomatose, hvor autolog stamcelletransplantasjon ikke er aktuelt.
• Se SPC for fullstendig oversikt over godkjente indikasjoner.
DOSERING OG ADMINISTRASJONSMÅTE
Gis som intravenøs infusjon eller subkutan injeksjon og skal administreres av helsepersonell med tilgjengelige ressurser for resuscitering. Subkutan formulering er ikke beregnet til intravenøs administrering, og skal kun gis ved subkutan injeksjon med angitt dosering. Det skal gis pre og post infusjonsbehandling/injeksjonsbehandling for å redusere risikoen for infusjonsrelaterte reaksjoner (IRR).
Myelomatose: Anbefalt dose er 16 mg/kg kroppsvekt gitt som IV. infusjon eller 1800 mg oppløsning til s.c. injeksjon gitt over ca. 3–5 minutter. For doseringsplan for daratumumab per indikasjon se SPC. For dose og doseringsplan for legemidler som gis sammen med daratumumab gitt som en i.v. infusjon eller s.c. injeksjon, se SPC og tilhørende preparatomtaler.
KONTRAINDIKASJONER
Overfølsomhet for virkestoffet eller noen av hjelpestoffene.
ADVARSLER OG FORSIKTIGHETSREGLER
Infusjonsrelaterte reaksjoner (IRR): Darzalex® kan forårsake kraftige og/eller alvorlige IRR. Det skal gis pre- og post-infusjonsbehandling/injeksjonsbehandling for å redusere risikoen for IRR, som ble rapportert i kliniske studier hos henholdsvis ca. 50 % av pasientene ved IV og 9 % ved SC. Ved enhver IRR, skal behandlingen avbrytes umiddelbart og symptomer håndteres. Dersom øyesymptomer oppstår, skal DARZALEX® avbrytes og umiddelbar oftalmologisk evaluering foretas før Darzalex® gjenopptas.
Interferens med indirekte antiglobulintest (indirekte Coombs test): Darzalex® kan medføre positiv indirekte Coombs test. Pasienter skal typebestemmes og screenes før oppstart. Ved planlagt transfusjon skal blodtransfusjonssenteret gjøres oppmerksom på denne interferensen med indirekte antiglobulintester. Ved akutt transfusjon kan det gis ikke-kryssmatchede ABO/RhD-kompatible erytrocytter i henhold til lokal blodbankpraksis.
Reaktivering av hepatitt B-virus (HBV): Hepatitt B-virusreaktivering er rapportert, og HBV-screening skal foretas hos alle pasienter før oppstart av behandling.
Bivirkninger: De hyppigste bivirkningene uavhengig av grad (≥ 20 % av pasientene) med daratumumab (intravenøs eller subkutan formulering) gitt som monoterapi eller kombinasjonsbehandling var IRR, fatigue, kvalme, diaré, forstoppelse, feber, hoste, nøytropeni, trombocytopeni, anemi, perifert ødem, perifer sensorisk nevropati og øvre luftveisinfeksjon. Alvorlige bivirkninger var pneumoni, bronkitt, øvre luftveisinfeksjon, sepsis, lungeødem, influensa, feber, dehydrering, diaré, atrieflimmer og synkope. For fullstendig oversikt over bivikningene, se SPC
PAKNINGER, PRISER OG REFUSJON
Pakninger og priser: Injeksjonsvæske:15 ml (hettegl.) 72770,60 kr. Konsentrat til infusjonsvæske: 5 ml (hettegl.) 6097,40 kr. 20 ml (hettegl.) 24281,00 kr.
Basert på SPC 02/2023. CP-380944
Les fullstendig preparatomtale før foreskrivning av Darzalex.
CP-395497
OS
FORLENGER
Nyheter om AML på EHA 2023
Studier på FLT3 hemmere ved AML. Quiziartinib er en 2. generasjons type II FLT3 hemmer. Det vil si at den i teorien kun hemmer mutasjoner i FLT3 som klassifiseres som FLT3-ITD og ikke FLT3-TKD. Sorafenib er en 1. generasjons type II FLT3 hemmer. I motsetning så er gilteritinib og midostaurin type I hemmere og de skal i teorien hemme både FTL3-ITD og FLT3-TKD mutasjoner.
Nylig ble QuANTUM-First studien publisert (Erba 2023) som randomiserte mellom 7 + 3 og 7 + 3 + quizartinib hos voksne pasienter 18-75 år med FLT-ITD mutert AML publisert. Der fant man at quizartinib armen ga bedre overlevelse.
QUIZARTINIB:
Abstract S130. QUIWI studien sammenliknet 7 + 3 med 7 + 3 + quizartinib hos voksne med AML og FLT3-ITD wild type. Interimanalyser ble presentert på EHA og viste bedre event-free survival og total overlevelse på tross av likt antall komplette remisjoner etter 1. og 2. syklus. Unntaket var pasienter med ELN adverse risk der det ikke var noen forskjell mellom armene. Endelige resultater av studien er ventet mot slutten av 2023. Det kan altså være at quizartinib har gunstig effekt på alle typer AML. Dette likner det som har blitt funnet tidligere med sorafenib (Rollig 2021).
Abstract S131. NCRI AML18 studien sammenliknet quizartinib mot ikke-quizartinib + forskjellige varianter av intensiv kjemoterapi i AML pasienter over 60 år. Først randomiserte de alle typer AML,
men mot slutten av studien kun FLT3-ITD mutert AML. Det var en veldig kompleks studiedesign med mange randomiseringstrinn og uttesting av multiple hypoteser samtidig. Det betød at det ble gitt mange forskjellige behandlingsregimer som «backbone». Når man gjorde opp resultatene hos de som fikk quizartinib eller ikke så var det tilsynelatende ingen forskjell på total overlevelse. Muligens en effekt hos pasienter med FLT3-ITD mutert AML. Selv synes jeg det var vanskelig å tolke resultatene når pasientene fikk så ulik behandling.
Konklusjonen så langt for quizartinib er at det kanskje hjelper ved FLT3-ITD mutert AML sammmen med 7+3, men kanskje ikke hos de som er over 60 år. Og kanskje hjelper Quizartinib uansett på alle AML-typer uavhengig av FLT3 mutasjon. Siste ord om dette er neppe sagt.
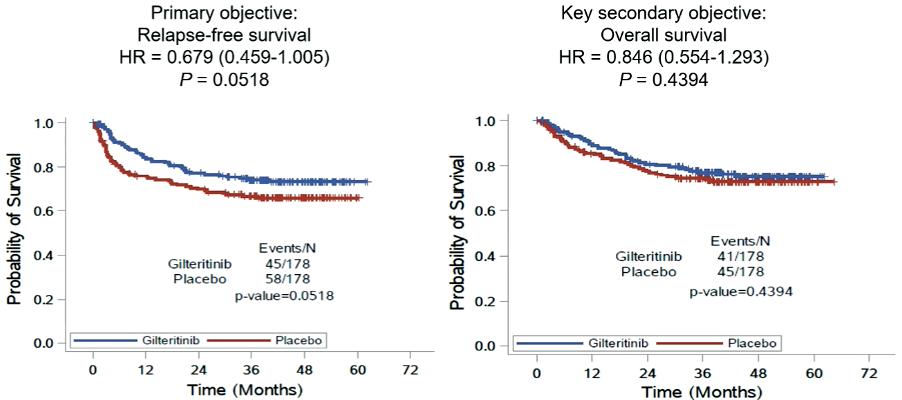
GILTERITINIB:
Abstract LB2711: BMT-CTN (Morpho) studien. Randomisering mellom gilterinib (GIL) vedlikeholdsbehandling og placebo etter stamcelletransplantasjon for FLT3-ITD mutert AML. Stratifisert på blant annet MRD present/absent. 356 pasienter randomisert. Flere adverse events i GIL armen. Ingen stor effekt av azoler på GIL konsentrasjonen. GIL ga sannsynligvis bedre Relapse-free survival selv om det ikke var statistisk signifikant (p=0.052). Totaloverlevelsen var ganske lik, men det så ut til at effekten av GIL først og fremst var i gruppen av MRD positive pasienter. En annen merkelig observasjon var forskjellen mellom regioner. I
16
Anders E. A. Dahm

Europa så var placebo armen bedre enn GIL armen! I Asia var det ingen forskjell mellom armene, mens det var stor fordel GIL i Nord-Amerika. Når man sammenliknet placebo-armene mellom regionene så man at det gikk mye bedre med placebo armen i Europa og Asia. Denne studien vil nok bli en del diskutert. Dels er det en veldig stor randomisert studie på FLT3-ITD mutert AML, noe som alltid er bra. Men studien er egentlig ikke designet for å vurdere effekten av MRD. Det andre problemet er om effekten man ser er av GIL eller rett og slett av at pasientene får behandling. Det besvares heller ikke av denne studien. Det tredje problemet er den merkelig store forskjellen i respons mellom de geografiske regionene.
Abstract P485: Venetoclax-Azacitidine-Gilteritinib hos 30 pasienter med FLT3 mutert AML. I syklus 1 AZA 7 dager, Ven 28 dager, Gil 28 dager. Ved <5% blaster dag 14, nulling av Ven og Gil. I syklus 2 Aza i 5 dager (75 mg/m2), Ven 7 dager, Gil kontinuerlig. Omtrent 75% i live etter 2 år.
Andre studier på AML
Abstract P554. En randomsiert fase 2 studie av hypometylerende behandling vs hypometylerende + eltrombopag ved nydiagnostisert AML hos eldre med plater under 75. De inkluderte 166 pasienter. Det var dessverre ingen effekt på overlevelse, blodplatenivå, transfusjoner eller blødninger.
Abstract P525: 33 unfit AML pasienter som hadde deltatt i tidligere studier av hypometylerende + venetoklax og gikk videre til allogen stamcelletransplantasjon. 60% av pasienten med adverse risk etter ELN 2022. . Median totaloverlevelse etter stamcelletransplantasjon var 29.9 måneder (95% CI, 15.8-NR), med 69% totaloverlevelse 12 måneder etter stamcelletransplantasjonen.
18
EHA 2023
UTVALGT PRODUKT OG SIKKERHETSINFORMASJON FOR EMPLICITI®
VIKTIG SIKKERHETS-OG FORSKRIVNINGSINFORMASJON Empliciti® (elotuzumab)
Utleveringsgruppe C, Reseptbelagt legemiddel.
Indikasjoner: I kombinasjon med lenalidomid og deksametason til behandling av myelomatose hos voksne som har fått minst 1 tidligere behandling. I kombinasjon med pomalidomid og deksametason til behandling av voksne med tilbakevendende og refraktær myelomatose som har fått minst 2 tidligere behandlinger, inkl. lenalidomid og en proteasomhemmer, og sykdomsprogresjon er vist med siste behandling.
Dosering: Voksne inkl. eldre: Premedisinering for forebygging av infusjonsrelaterte reaksjoner (IRR) skal gis. Empliciti i kombinasjon med lenalidomid og deksametason gis som IV, 10 mg/kg kroppsvekt ukentlig de 2 første syklusene, deretter 20 mg/kg kroppsvekt dag 1 i de påfølgende syklusene. Empliciti i kombinasjon med pomalidomid og deksametason gis som IV, 10 mg/kg kroppsvekt ukentlig de 2 første syklusene, deretter 20 mg/ kg kroppsvekt dag 1 i de påfølgende syklusene. En syklus er 28 dager. For detaljert doseringsskjema se www.felleskatalogen.no.
Vanligste bivirkninger: De vanligste bivirkningene (oppstod hos > 10 % av pasientene) ved elotuzumab behandling var IRR, diaré, herpes zoster, nasofaryngitt, hoste, pneumoni, øvre luftveisinfeksjon, lymfopeni og vektreduksjon.
Alvorlige biverkninger: Den alvorligste bivirkningen som kan oppstå under elotuzumab behandling er pneumoni.
Kontraindikasjoner*: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene. Preparatomtalene for lenalidomid, pomalidomid og deksametason som brukes i kombinasjon med Empliciti skal gjennomgås før oppstart av behandling.
Advarsler og Forsiktighetsregler: IRR er rapportert hos pasienter som har fått elotuzumab. Premedisinering skal gis før infusjon. Pasienten bør overvåkes for utvikling av Sekundære primære maligniteter (SPM). I kliniske studier hos pasienter med myelomatose var forekomsten av alle infeksjoner, inkludert pneumoni, høyere hos pasienter behandlet med Empliciti. Pasienter bør overvåkes og infeksjoner bør håndteres med standardbehandling. For fullstendig informasjon, se preparatomtale og SPC tilgjengelig på www.felleskatalogen.no.
Interaksjoner: Ingen farmakokinetiske interaksjonsstudier er utført. Metabolisme via CYP450 enzymer eller andre legemiddelmetaboliserende enzymer forventes ikke. Empliciti kan påvises i serumproteinelektroforese (SPEP) og ved immunfiksering i serum hos myelompasienter og kan interferere med riktig responsklassifisering. Tilstedeværelse av elotuzumab i pasientens serum kan forårsake en liten topp i begynnelsen av gamma regionen på SPEP som tilsvarer IgGƙ ved immunfiksering i serum. Denne interferensen kan påvirke vurderingen av fullstendig respons og mulig tilbakefall fra fullstendig respons hos pasienter med IgG kappa myelomprotein. I tilfeller hvor det påvises ekstra topper ved immunfiksering i serum bør en mulig biklonal gammopati utelukkes.
Pakninger, priser og refusjon: 300 mg: 1 stk. (hettegl.) 15190,30 kroner. 400 mg: 1 stk. (hettegl.) kr 20241,70 kroner. Empliciti er godkjent refundert i kombinasjon med lenalidomid og deksametason til pasienter som har fått 3 tidligere behandlingslinjer.
Se felleskatalogen for fullstendig forskrivningsinformasjon før forskrivning.
Bristol Myers Squibb Norge, Lysaker Torg 35 1366 Lysaker, telefon: 23 12 06 37 , www.bms.com/no
Versjon 1
Bristol Myers Squibb Lysaker Torg 35 1366 Lysaker www.bms.com/no
Godkjent av beslutningsforum, i kombinasjon med lenalidomid og deksametason, hos voksne myelomatosepasienter som har fått minst 3 tidligere behandlingslinjer1.
1. Beslutningsforum for nye metoder 23.05.2022 sak 064-2022 689-NO-2300001 / Utarbeidet feb 2023
Galina Tsykunova
Fokus på KLL, AL- amyloidose og ITP
Kronisk lymfatisk leukemi
På EHA 2023 ble det presentert oppdaterte resultater på flere kjente studier.
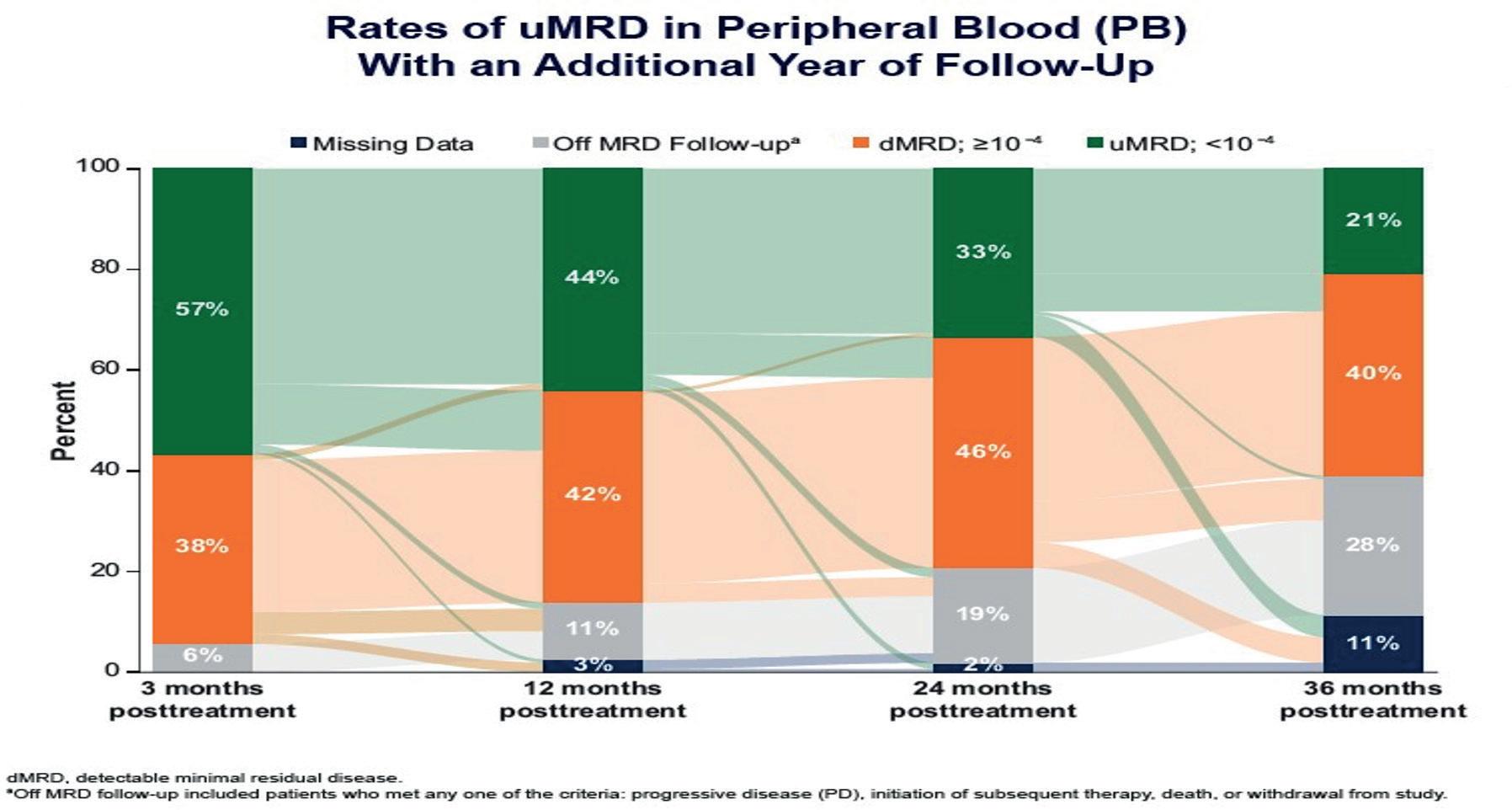
CAPTIVATE studie: 4- års follow up (Ghia P. et al.):
I CAPTIVATE studien fikk KLL pasienter tidsbegrenset behandling med ibrutinib og venetoclax (Ibr+Ven).
159 voksne, tidligere ubehandlet pasienter ≤70 år ble inkludert. 56% av studiedeltakere hadde umutert IGVH, 17% hadde del17p/TP53 mutasjon.
Pasienter fikk 3 sykluser med ibrutinib monoterapi etterfulgt av 12 sykluser med ibrutinib+venetoclax (Ibr+Ven).
PFS og OS ved 4- års follow-up
FD Cohort (N=159)
Del(17p) g/eller TP53(n=27)
uIGVH (n=89)
uMRD ved EOT+3, PB (n=90)
dMRD at EOT+3, PB (n=57)
20
4 års PFS (95% CI) 79 (71-84) 63 (41-79) 73 (62-81) 90 (81-95) 66(52-77) 4års OS (95% CI) 98 (94-99) 96 (76-99) 97 (90-99) 100 100
19 pasienter totalt har fått tilbakefall så langt i studien, og hadde re- startet behandling med ibrutinib. 17 av disse er evaluert så langt, hvorav 1 pasient oppnådde CR, 13- PR, 1 -PR med lymfocytose, 1- SD og 1- PD
Oppsummert, støtter 4 års follow-up tidligere funn i denne studien, og viser at tidsbegrenset behandling med Ibr+Ven er effektiv og trygg førstelinje alternativ for KLL pasienter, inkludert pasienter med høy-risiko avvik. Resultatene ser også lovende for pasienter som behandles med ibrutinib etter tilbakefall i studien.
GLOW studie: hvordan påvirker gentiske avvik behadlingsresultatet? (Kater A. Et al.)
I denne studien for pasienter med tidligere ubehandlet KLL, sammenlignet en tidsbegrenset behandling med ibrutinib+ venetoclax (Ibr+Ven) med klorambucil+ obinutuzumab (Clb+O). Studien inkluderte eldre pasienter (≥ 65 år) uten høyrisiko avvik (del(17p) eller TP53).
Målet med analysen var å se hvordan forskjellige genetiske avvik påvirker MRD (negativ MRD status ved 3 mnd etter avsluttet behandling (EOT+3) samt på PFS i begge behandlingsgrupper.
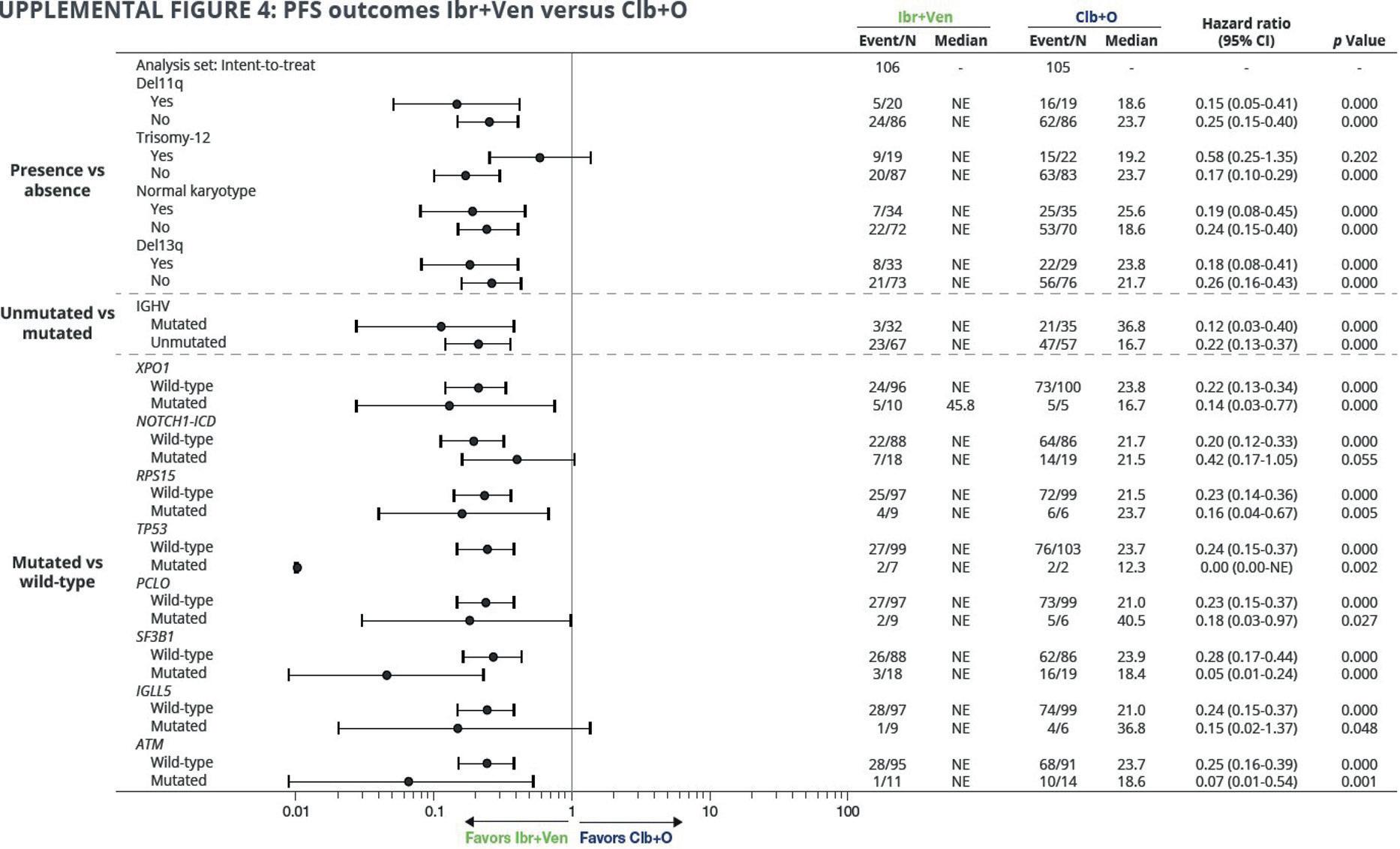
Som fremgår av oversikten, skilte PFS seg signifikant til fordel for Ibr+Ven kombinasjon i alle grupper, med unntak av +12; NOTCH1 mut og IGLL5 mut (som viste ikke signifikant trend til fordel for Ibr+Ven). I Ibr+Ven gruppe, +12 og umutert IGVH var assosiert med kortere PFS enn wild-type og mutert IGVH. Sistnevnte funn må tolkes med forsiktighet grunnet lavt antall tilfeller samt flere tidlige ikke- progresjon relaterte hendelser i gruppen.
Flere pasienter i Ibr+Ven gruppe oppnådde negativ MRD status, igjen med unntak av pasienter med trisomi 12, pasienter med mutert IGVH og IGLL5 mutasjon.
Ved 46 mnd follow-up hadde pasienter i Ibr+Ven gruppe signifikant bedre PFS og OS sammenlignet med pasienter behandlet med Clb+O.
21
På analysetidspinktet var det totalt 19 (40%) pasienter i arm B som restartet behandling med Ibr-Ve.15 av disse gjennomførte 12 nye sykluser med Ibr+Ven, hvorav 8 (42%) oppnådde ny MRD negativitet, 5 pasienter
HOVON 141/Vision studie: 4 års follow-up. 225 KLL pasienter med relapsed/refractory (R/R) sykdom ble inkludert i denne studien, 64% hadde umutert IGVH, og 24% hadde tp53 avvik. Alle pasienter ble behandlet med 2 sykluser med ibrutinib etterfulgt av 13 sykluser med ibrutinib+venetoclax (Ibr+Ven). Pasienter som var MRD positive etter avsluttet behandling med Ibr+Ven fortsatte videre med ibritinib vedlikehold. Pasienter som oppnådde minimum PR og negativ MRD status

etter 15 sykluser med Ibr-Ven, ble randomisert 1:2 til enten til vedlikehold ibrutinib (arm A) eller MRD- basert behandlingsfri observasjon (arm B). Pasienter i arm B restartet med Ibr+Ven ved konvertering til MRD positiv status.
Totalt 32% (72 pasienter) oppnådde MRD negativitet, og kunne randomiseres videre.
22
EHA 2023
OS, % 8 8 86 95 91 PFS, % 79 76 90 85 TtNT (%) 83 81 86 88 Resultater for OS, PFS og TtNT ( time to next treatment) Overall Ibr Maintenance (MRD pos) Arm A (ibr) Arm B (stop)
Anbudsvinner: LIS 2299I ITPperoral behandling fra 01.09.2022 med forlengelse til 31.08.20242
Doptelet® (avatrombopag) er indisert til behandling av primær kronisk immunologisk trombocytopeni (ITP) hos voksne pasienter som er refraktære overfor andre behandlinger (f.eks. kortikosteroider, immunoglobuliner). Den anbefalte startdosen med Doptelet er 20 mg (1 tablett) én gang daglig med mat.1

▼ Doptelet «avatrombopag» tabletter

Reseptgruppe C H
Dette legemidlet er underlagt særlig overvåkning.
Indikasjon: Primær kronisk immunologisk trombocytopeni (ITP) hos voksne som er refraktære overfor andre behandlinger. Dosering: Laveste dose for å oppnå og opprettholde blodplatenivå på ≥ 50 × 10 9 /liter. Startdose på 20 mg 1 gang daglig, maks 40 mg daglig. Overvåkning av blodplatetall påkrevet. Se SPC for detaljer rundt hyppighet av overvåkning og dosejustering basert på respons av blodplatetall, samt anbefalt startdose ved samtidig administrering av andre legemidler. Behandling skal innledes av lege med erfaring innen hematologiske sykdommer. Blodplatetall måles før behandlingsoppstart og på prosedyredagen. Se Forsiktighetsregler og Interaksjoner i SPC. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Økt risiko for trombotiske/trombo emboliske hendelser ved kronisk leversykdom. Bør ikke brukes ved kronisk immunologisk trombocytopeni i forsøk på å normalisere blodplatetallet. Bør kun brukes ved alvorlig nedsatt leverfunksjon dersom forventet nytte overgår forventet risiko. Behandling i samsvar med klinisk praksis og nøye oppfølging mtp. tegn på forverring eller nyoppstått hepatisk encefalopati, ascites og trombose eller blødningstendens. Trombocytopeni vil sannsynligvis komme tilbake etter avsluttet behandling hos pasienter med ITP, noe som kan føre til blødninger . Nøye overvåkning og gjenopptatt ITP behandling anbefales. Risiko for økt retikulin i benmarg . Undersøkelser for cellulære morfologiske abnormaliteter og fullstendig hematologisk status anbefales. Ved opprettholdt effekt og unormalt perifert blodutstryk bør nytte risiko av avatrombopag og alternative ITP behandlinger vurderes på nytt. Skal ikke brukes for behandling av trombocytopeni grunnet MDS, da det er fare for progresjon av eksisterende MDS Graviditet, amming og fertilitet: Ikke anbefalt under graviditet og hos fertile kvinner som ikke bruker prevensjon. Risiko for barn som ammes kan ikke utelukkes; nytte /risiko må vurderes. Effekt på fertilitet kan ikke utelukkes. Bivirkninger: Svært vanlige: Fatigue, hodepine. Vanlige: Anemi, splenomegali, trombocytopeni, diaré, flatulens, kvalme, oppkast, øvre abdominalsmerte, asteni, akne, kløe, petekkier, utslett, hypertensjon, dyspné, epistakse, artralgi, muskel skjelettsmerter, myalgi, ryggsmerter, smerte i ekstremitet, migrene, parestesi, svimmelhet, ubehag i hodet, hyperlipidemi, redusert appetitt, redusert blodglukose, redusert blodplatetall, økt ALAT, økt LDH, økt blodglukose, økt blodplatetall, økt gastrin, økte triglyserider. Mindre vanlige: Hjerteinfarkt, dyp venetrombose, trombose i halsvene, portvenetrombose, lungeembolisme, cerebrovaskulær hendelse, TIA, myelofibrose, retinal arterieokklusjon, synssvekkelse. For mer informasjon, se felleskatalog eller preparatomtalen (SPC). Innehaver av markedsføringstillatelsen: Swedish Orphan Biovitrum AB, SE 112 76 Stockholm, Sweden. Dato: 06.04.2021. Basert på SPC godkjent av SLV/EMA: 31.03.2021. Pakninger og priser: Blisterpakninger: 10 stk. kr. 7471,70; 15 stk. kr. 11189,40; 30 stk. kr. 22342,50 (priser og ev. refusjon oppdateres hver 14. dag). Refusjon: H resept. Vilkår 216. Refusjon ytes kun etter resept fra sykehuslege eller avtale spesialist.
1. Doptelet EMA Summary of Product Characteristics 31/03/2021, www.ema.europa.eu/en/medicine.s/human/EPAR /doptelet
2. LIS 2299I ITP – Meddelelse om valg av leverandør fra Sykehusinnkjøp, saksnummer: 2021/1226;03/2022
PP19339 June 2023 © 2023 Swedish Orphan Biovitrum AB (publ) – All rights reserved. Sobi™ and Doptelet™ are trademarks of Swedish Orphan Biovitrum AB (publ).
▼
Uten kostrestriksjoner ved behandling av ITP1
For ytterligere informasjon se fullstendig preparatomtale eller www.felleskatalogen.no
På analysetidspinktet var det totalt 19 (40%) pasienter i arm B som restartet behandling med Ibr-Ve.15 av disse gjennomførte 12 nye sykluser med Ibr+Ven, hvorav 8 (42%) oppnådde ny MRD negativitet, 5 pasienter hadde MRD respons uten at de oppnådde MRD negativitet på nytt. 10 pasienter (53%) oppnådde klinisk remisjon mens 2 (11%) hadde progresjon og 1 pasient måtte avsluttet behandling grunnet toksisitet.
I arm B, MRD konvertering forekom oftere hos pasienter med ≥ 3 genomiske aberrasjoner og TP53 aberrasjoner, samme trenden ble ikke observert hos pasienter med umutert IGHV.
Oppsummert, støtter disse resultatene MRD- basert tilnærming til KLL behandling hos pasienter med R/R sykdom. Ibr+Ven fremstår å være godt alternativ for pasienter som konverterer til MRD positiv status.
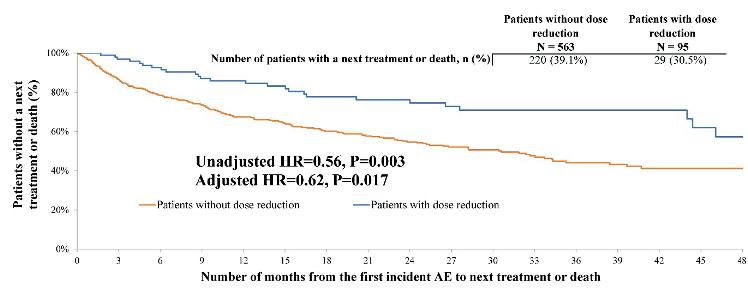
Hvordan påvirker dosereduksjon av Ibrutinib grunnet behandlingsrelatert bivirkning resultatet: real-world data.
Shadman og medarbeidere har analysert real- world data for doseringsmønster og tid for neste behandling (TTNT) for tidligere ubehandlede pasienter med CLL/SLL.
Totalt 658 pasienter tilfredstilte inklusjonskriterier, av disse 14.4% (95 pasienter) fikk ibrutinib dosereduksjon (DR) som følge av behandlingsrelatert bivirkning.
Sammenligning av TTNT for pasienter uten- og med dosereduksjon etter episode med uønsket hendelse ifm behanding.
Uten DR Med DR
Mean (median varighet, 1L (dager)
735 (606)
992 (842)
Mean (median tid til første AE (dager)
227 (119)
161 (51)
Mean (median) tid mellom første AE og neste beh. linje (dager)
508 (365)
760 (725)
TTNT,mnd
Som fremgår av tabellen og illustrasjonen over, hadde pasienter som dosereduserte ibrutinib, lengre TTNT enn de uten dosereduksjon. Om en bruker TTNT som markør for sykdomsprogresjon, kan en basert på disse, konkludere med at dosereduksjon i denne settingen kan være en god strategi for å minske behandlingsrelaterte bivirkninger og samtidig beholde pasienter lengre i remisjon.
24
EHA 2023
30.6 59.5
AL- amyloidose
Resultater etter 18 mnd oppfølging for CAEL-10, anti- amyloid monoklonalt antistoff i fase II studie
Grad av hjerteaffeksjon ved AL- amyloidose er, som kjent, den viktigste prediktor for overlevelse. De etablerte terapiene retter seg mot plasmacelleklon, men ikke mot de allerede eksisterende avleiringene.
Målet med denne studien var å teste sikkerhet og toleranse for CAEL-10 som ble gitt i kombinasjon med CyBorDex+/- daratumumab. 25 pasienter med European Mayo stadium II-IIIa ble inkludert. 18 mnd evaluering konkluderer med god toleranse og gunstig risikoprofil.
Det er allerede 2 randomiserte multisenter fase III studier for CAEL-10, som i gang med å rekruttere pasienter med AL amyloidose i st IIIa-IIIb.
Belantamab mafodotin for pasienter med relapsed/ refractory AL- amyloidose (RRAL)

Denne studien gjennomføres i regi av European Myeloma Network, og har som mål å evaluere effekt og sikkerhet ved bruk av belantamab hos 36 pasienter med RRAL. Pasienten i alle stadier, unntatt Mayo 3b, kan delta.
På EHA ble det presentert interim analyse fra denne studien, og resultatene er oppsummert i tabellen. Belantamab var effektiv, og induserte raske responser.
Belantamab i denne studien blir administrert med forlenget intervall (6 uker) for å unngå okulær toksisitet. Det så imidlertidig ikke ut til å forhindre okulære bivirkninger som forekom hos 96% pasienter. Pasienten opplevde ellers ingen uventede bivirkninger utover det som er kjent fra studiene for pasienter med myelomatose- og det er ikke observert forverring av preeksisterende redusert hjerte- eller nyrefunksjon
Venetoclax for RRAL- retrospektive data
Venetoclax er fra tidligere kjent å være effektiv terapi for pasienter med plasmacelle sykdom og t (11;14).
t (11;14) kan påvises hos rundt 50% pasienter med AL- amyloidose, og kan venetoclax være aktuelt behandlingsalternativ for mange. Det foreligger flere tidligere rapporter om effekt av venetoclax ved AL- amyloidose.
Abstrakt fra denne retrospektive, real- wold data studie fra 7 sentre i 3 forskjellige land, ble publisert på årets EHA.
26 pasienter ble inkludert, og oversikt over pasientog sykdoms karakteristika er presentert i tabell.
Alder ved oppstart venetoclax , median ( range)
Median dFLC ved diagnose, mg/L
Antall involverte organsystemer
Hjerteaffeksjon, n (%)
Stadium, n (%) I II III a III b missing t (11;14), n (%)
Ledsagende klinisk MM,n (%)
Antall tidligere behandlinger, n(range)
Tidligere behandlinger, n (%) Bor Len Pom
Venetoclax, n (%) Monoterapi Komb med dex Komb med dara Komb med dara+bor
Overall response rate var 23/26 (88%) etter 33 mnd follow-up. 35% hadde CR, 35% VGPR og 19% PR. Responsen varte i gjennomsnitt 25 mnd, med median EFS på 25 mnd.
46% pasienter i denne studien mottok antibiotika profylakse, 3 pasienter hadde alvorlig infeksjon. Det ble ikke observert noen tilfeller av tumorlyse i denne gruppen.
26
EHA 2023
Alkylator ASCT
Dara
Cohort (n=26) 65 (55-88) 348 (120-551) 2 (1-6) 20 (77) 6 (23) 9 (35) 8 (31) 2 (8) 1 (4) 22/25 (88%) 8 (31%) 3.5 (1-7) 26 (100) 17 (65) 13 (50) 22 (85) 23 ( 88) 5 (19) 9 (35) 9 (35) 7 (27) 1 (3,8%)
Autolog stamcelletransplantasjon for AL- amyloidose (HOVON 104)
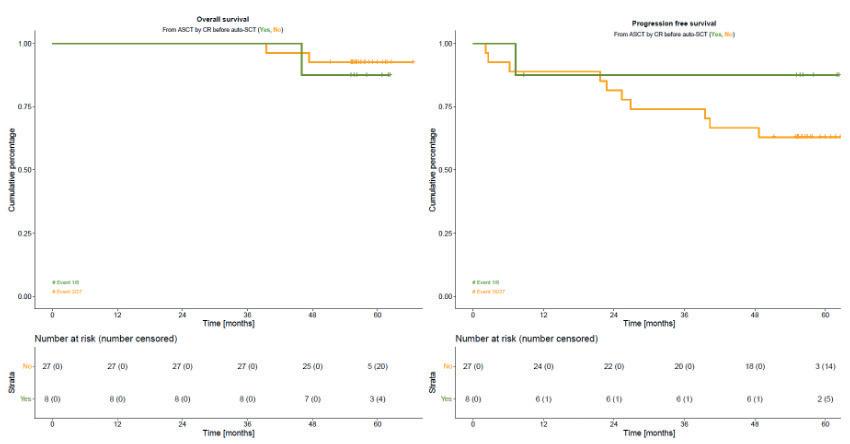
HOVON gruppen har publisert resultater av langtidsoppfølging for pasienter som har gjennomgått autolog stamcelletransplantasjon (ASCT) etter bortezomib basert induksjon. Studien hadde fokus på PFS, OS og en annen viktig parameter ved AL- amyloidose - organ respons.
Ved 5 år var OS og PFS , analysert for 35 pasienter, henholdvis 91% og 68%. CR status før ASCT var ikke assosiert med forlenget OS eller PFS etter transplantasjon.
ASCT førte til økning i nyreresponsen fra 69% før transplantasjon til 79% (23/29 pasienter), og fra 78 til 91% i hjerterespons.16 pasienter mottok neste linje behandling ila av observasjonstiden, median tid til neste behandling var 14 mnd.
27
Immun trombocytopeni (ITP).
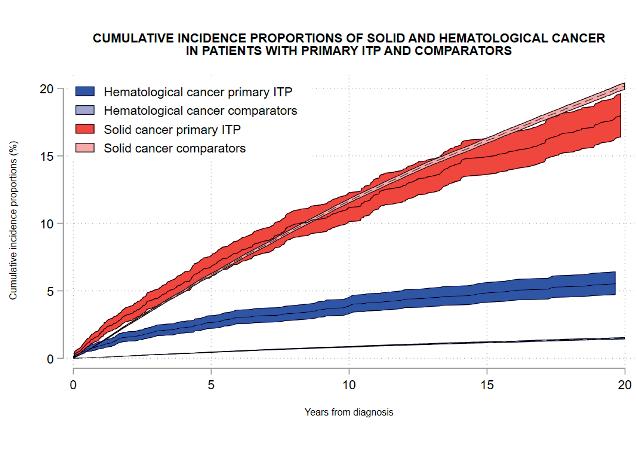
Mannering og medarbaidere presenterte register- basert studie som evaluerte risiko for utvikling av kreft i voksen ITP populasjon. Data for 4768 pasienter med primær ITP og 189662 kontroller ble analysert. Risikoen var økt for både solide og hematologiske maligniteter. Denne risikoen var betraktelig høyere for utvikling av hematologisk kreft (leukemi/ lymfom), ila første året fra ITP diagnosen (1 års kumulativ insidens for hematologisk kreft på 0.94% (0.69-1.26) vs 0.08% (0.07-0.09) i kontoll gruppe). Noe av funnene kan kanskje forklares med at en del pasienter som ble klassifisert som primær ITP, kunne i realiteten hatt underliggende malign hematologisk lidelse med immun trombocytopeni som første presentasjon.
28 EHA 2023
Efgartimod, humant IgG1 antistoff Fc fragment
Det er publisert resultater for ADVANCE+ (open label extention trial for pasienten som deltok i ADVANCE studie). Efgartimod var effektiv hos 26,3% studiedeltakere (10/38) som fikk placebo i hovedstudie.
Efgraftimod reduserte kraftig IgG nivåene. En var derfor bekymret for økt infeksjonsrisiko hos studiedeltakere, noe som ikke så ut til å være tilfelle.
Baricitinib, selektiv og reversibel JAK 1 og JAK 2 inhibitor
Zhao og medarbeidere evaluerte 6 mnd respons for baricitinib i fase 2 studie for voksne pasienter med steroid refraktær eller tilbakefall av ITP. 71% (20) pasienter responderte på behandlingen. Den vanligste bivirkning var infeksjon (21,4%), bivirkningene var hovedsakelig milde.
Fostamatinib
Moulis og medarbeidere fikk publisert abstrakt om real-world bruk av fostamatinib i Frankrike. Det var relativt få pasienter (50), fellesnevneren for disse var lang sykdomsvarighet (median 6,5 år) og mange tidligere behadnlingslinjer (median 8). Mesteparten
av pasientene var tidligere behandlet med både rituximab og TPO- agonist, og 37% var splenektomerte. Responsraten var 30%, og flere pasienter kunne ila av observasjonstid avslutte konkomitant behandling med steroider (4/18); IVIG (4/28) og TPO- agonist (13/25). De kjente bivirkningene var også vanligste i denne analysen, med diare og hypertensjon. Det var registrert 1 trombosetilfelle som hadde andre årsaker enn fostamatinib bruk.
Castellano og medarbeidere hadde en poster med tittelen «P1614. Tapering scheme and sustained response in patients with ITP treated with Fostamatinib». Blant 44 pasienter som ble inkludert i analysen, 70% hadde 3 eller flere behadnlingslinjer, median varighet av ITP var 56 mnd. Pasienter har hatt minimum 6 måneder med CR før nedtrappingen starter. Fostamatinib dose ble trappet ned med 30% hver 4. uke så lenge pasient beholdt trombocytt nivåer > 100x109/L. Doseredukjson ble oppnådd hos 10 av 44 pasienter, og 5 av disse kunne avslutte behandlingen med fostamatinib. Kun 1 av disse 5 fikk tilbakefall etter seponering, og responderte på fostamatinib på nytt.
29
Drømmen om behandling av B-ALL uten kjemoterapi ble tydeligere under årets EHA
I Norge har vi gode resultater ved behandling av voksne med Ph neg ALL opp til 70 år med langtidsoverlevelse rundt 70%. Pasientene får langvarig behandling med tøff kjemoterapi som har mange bivirkninger både akutt og som langtidskomplikasjoner. Det ser ikke ut som om økning av kjemoterapiintensiteten vil bedre prognosen for denne pasientgruppen. De senere årene har det derfor vært stadig mer fokus på å kunne redusere bruken av kjemoterapi ved bruk av mer målrettet behandling. Hovedfokuset på årets EHA var behandling av både Ph pos og Ph neg B-ALL med mindre eller kanskje aller helst ingen kjemoterapi og stemningen på møtet var positiv. Det ble ikke presentert nye langtidsresultater fra større randomiserte studier på EHA, men det kommer likevel stadig mer evidens for nytten av mer målrettet behandling.
Inotuzumab er i Norge godkjent av Beslutningsforum som bro til transplantasjon ved kjemorefraktær eller residiv av CD22+ B-ALL hos voksne. En syklus blinatumomab i tillegg til kjemoterapi ble i 2021 godkjent av Beslutningsforum ved MRD positiv CD19+ B-ALL i første remisjon. Ingen av medikamentene har foreløpig godkjenning ved Ph pos B-ALL.
Ph neg B-ALL
Blinatumomab ser også ut til å være nyttig hos pasienter som er MRD negative etter kjemoterapi, ikke bare hos de med vedvarende restsykdom.
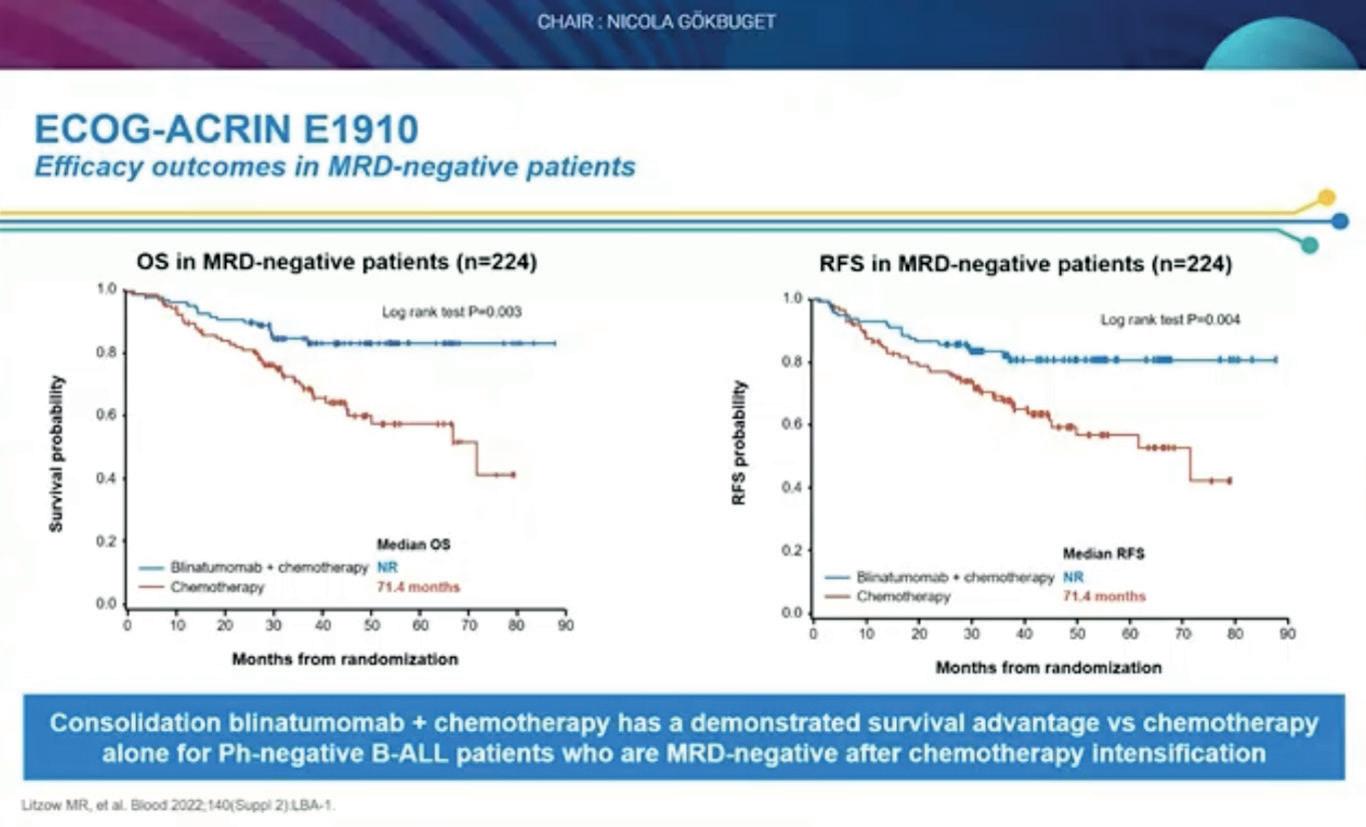
Abstract #S115. Subgruppeanalyser fra ECOG-ACRIN E1920 som var en fase 3 studie som randomiserte pasienter 30-70 år med Ph neg B-ALL til kjemoterapi +/- blinatumomab og viste at pasienter i blinatumomabarmen som var MRD neg etter induksjonen hadde signifikant bedret overlevelse sammenliknet med de som ikke hadde fått blinatumomab. 488 pasienter ble inkludert og median alder var 51 år. 224 pasienter som var MRD negative ble randomisert 50/50 til tillegg av blinatumomab eller standardbehandling. Overlevelsen var signifikant bedre i blinatumomabgruppen. Effekten av blinatumomab var spesielt god for pasienter < 55 år og ved MRD som ikke var påvisbar (sammenliknet med MRD som var påvisbar, men < 0,01%).
30 Hilde Skuterud Wik
Abstract #S117.
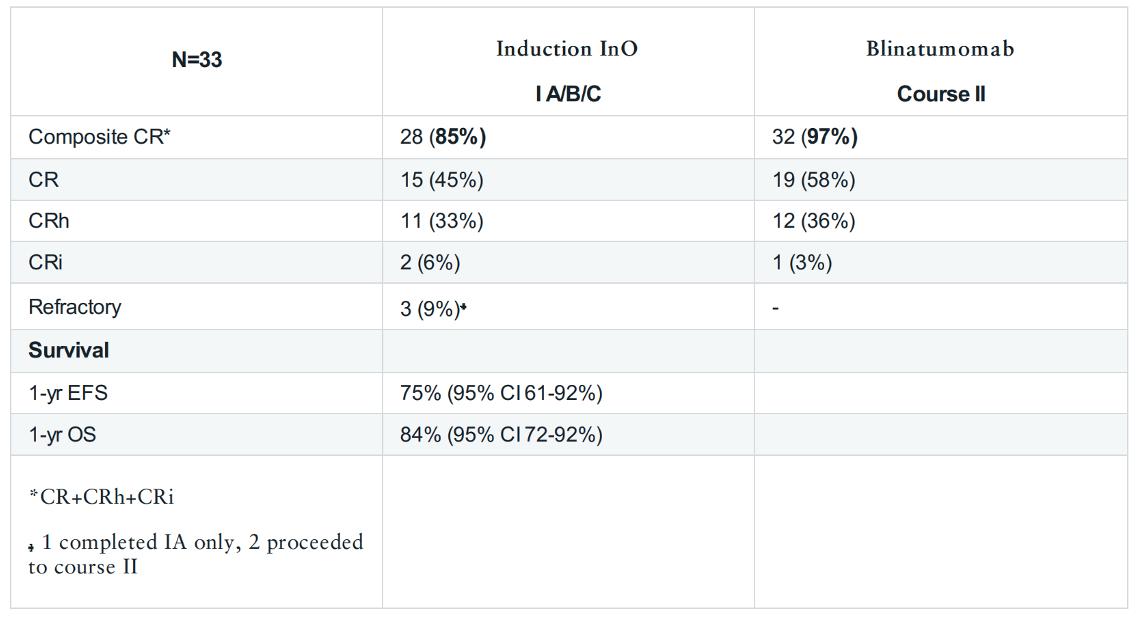
Pasienter ≥ 60 år med Ph neg CD22+ B-ALL som ikke var kandidater for allo-HSCT fikk inotuzumab som induksjonsbehandling og deretter blinatumomab som vedlikeholdsbehandling. Pasienter med CNSaffeksjon eller leversykdom ble ekskludert. Det ble gitt 8 doser intratekal metotreksat profylaktisk. 33 pasienter med median alder 71 år ble behandlet og etter median oppfølging på 22 mnd var 1 års EFS 75%. Ni pasienter fikk tilbakefall, to døde i CR og en pasient døde med VOD. OS etter 1 år var 84%. Ni pasienter er døde, 6 seks etter tilbakefall.
Abstract #P373.
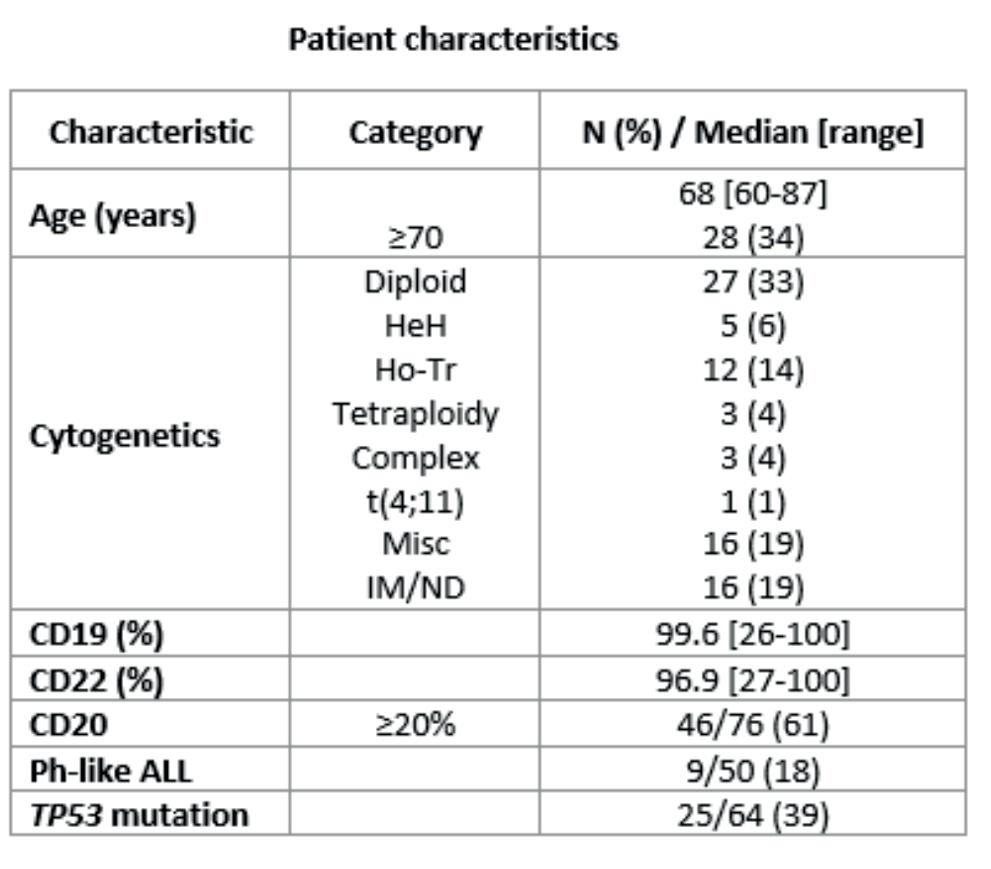
En fase 2 studie fra MD Anderson inkluderte pasienter
≥ 60 år med nyoppdaget B-ALL og ga opptil 8 sykluser kjemoterapi med redusert intensitet (mini-HyperCVAD) med tillegg av inotuzumab i syklus 2-4 og deretter fire sykluser blinatumomab. Pasienter med CD20+ sykdom fikk tillegg av rituximab og profylaktisk intratekal kjemoterapi ble gitt. Respondere ble gitt vedlikeholdsbehandling med POMP i inntil tre år. Studien hadde ingen kontrollgruppe. 83 pasienter ble behandlet i studien hvorav 77 kunne evalueres. Av disse kom 76 (99%) i komplett remisjon. 94% av disse ble MRD negative ved flowcytometri og det var ingen tidlige dødsfall. 11 (13%) pasienter fikk tilbakefall, 4 (5%) gjennomgikk allogen benmargstransplantasjon (allo-HSCT), 34 (41%) er fortsatt i remisjon og 33 (41%) døde i remisjon hvorav tre utviklet sekundær MDS/AML. Tre pasienter fikk VOD, to av disse etter allo-HSCT. Etter median oppfølging på 65 mnd var 5 års varighet av remisjon 78% og OS 48%. Alder ≥ 70 år og kompleks cytogenetikk var assosiert med dårlig prognose. Den dårlige prognosen hos pasienter ≥ 70 skyltes hovedsakelig død i komplett remisjon.
31
Ph pos B-ALL
D-ALBA (Dasatinib–Blinatumomab for Ph-Positive Acute Lymphoblastic Leukemia in Adults) ble publisert allerede i 2020 (Foà et al. N Engl J Med 2020; 383:1613-1623), men ble likevel mye omtalt på årets EHA fordi dette var førstelinjebehandling helt uten kjemoterapi med gode resultater. Dette var en enarmet fase 2 studie hvor dasatinib pluss steroider etterfulgt av 2 sykluser med blinatumomab ble gitt til 63 voksne (24 til 82 år) med nyoppdaget Ph pos B-ALL. 61 pasienter fullførte induksjonen med dasatinib. Etter median oppfølgingstid på 18 mnd var overlevelsen 95% og sykdomsfri overlevelse 88%. Kun 24 pasienter gjennomgikk allo-HSCT. Seks pasienter fikk tilbakefall (kumulativ insidens 8%) og fem av disse hadde T315I mutasjon. Fire pasienter døde hvorav to var i CR1, en døde av infeksjon i induksjonsfasen og en døde av VOD etter allo-HSCT.
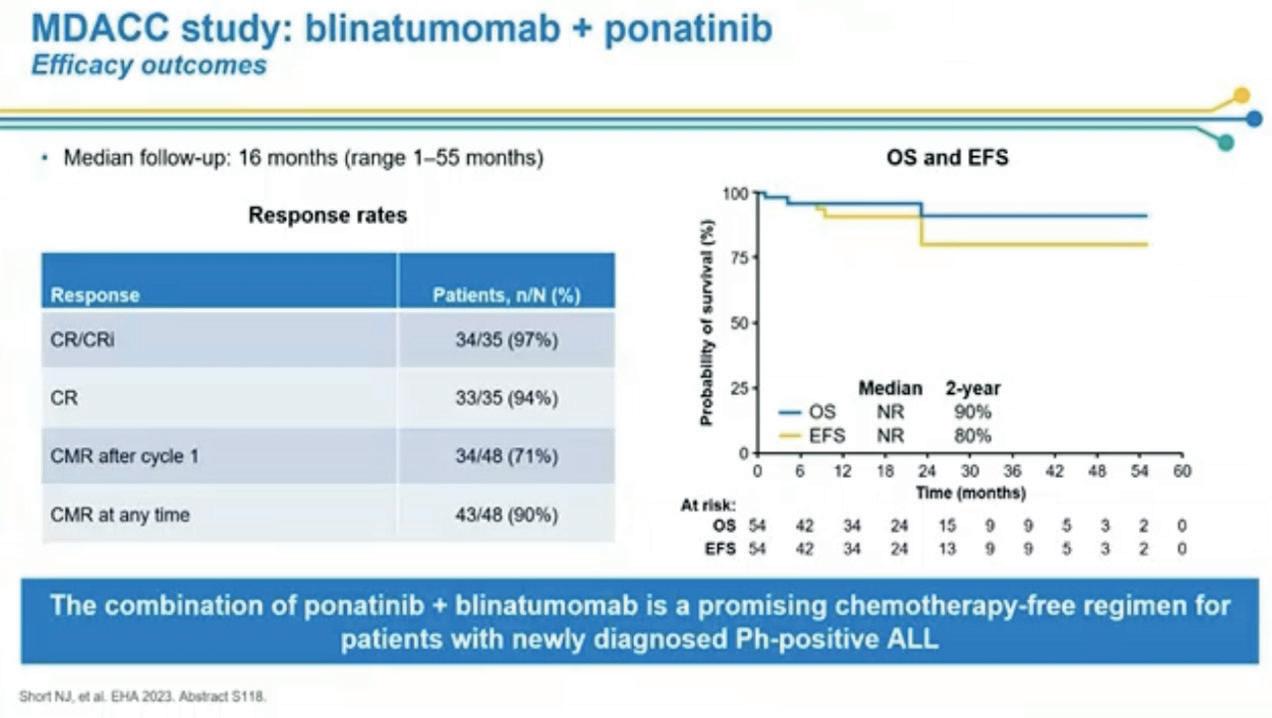
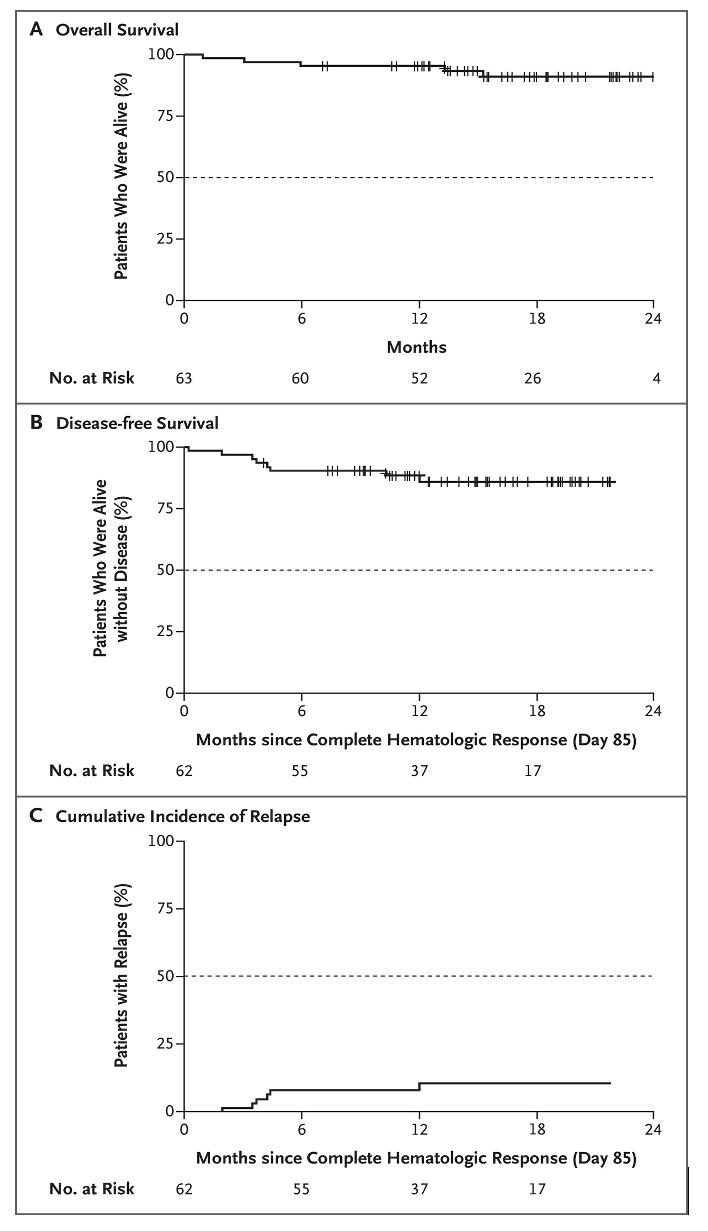
Abstract #S118.
Nicolas Short fra MD Anderson presenterte en fase 2 studie der voksne pasienter med nyoppdaget Ph pos B-ALL fikk kjemoterapifri vedlikeholdsbehandling med ponatinib og blinatumomab etter at de først hadde fått 1-2 sykluser med kjemoterapi med eller uten TKI. 54 pasienter ble inkludert mellom juni 2018 og januar 2023. Av de 53 pasientene som fikk minst en komplett syklus med ponatinib pluss blinatumomab, døde to i komplett remisjon (CR) og tre fikk tilbakefall. Bare en pasient gjennomgikk allo-HSCT i CR1 pga. vedvarende MRD-positivitet. Etter median oppfølging på 16 mnd har det ikke oppstått leukemirelaterte dødsfall og estimert 2 års overlevelse er 90% og leukemifri overlevelse 80%.
32 EHA 2023
CAR-T
Abstract #P367.
Brexu-cel er en autolog CD19 CAR-T celleterapi som er godkjent i USA for pasienter med tilbakefall/kjemorefratær B-ALL som er ≥ 26 år basert på resultatene av ZUMA-3 studien (Shah et al. Lancet 2021), N=55. På EHA ble 3 års data fra denne studien presentert. Median oppfølging var 39 mnd. For pasientene som var ≥ 26 år var 72% i CR/CRi og median OS var 34 mnd. Overlevelsen var lenger hos de som hadde fått færrest tidligere behandlingslinjer og hos de som ikke hadde fått blinatumomab, men forskjellene var ikke signifikante.
Residiv av T-ALL er fortsatt vanskelig med færre behandlingsmuligheter
Det ble ikke presentert data fra kliniske studier fra denne pasientgruppen, men det ble presentert en kommende studie utgående fra Oslo universitetssykehus ved Jochen Büchner et al.(abstract #PB2501). Studien heter InsighT-1 og er en fase I/IIa first-inhuman studie som vil evaluere sikkerhet, gjennomførbarhet, farmakodynamikk og preliminær effekt av genetisk modifiserte T-celler rettet mot TdT hos barn og voksne med tilbakefall/refraktær
TdT+ T- og B- celle ALL/LBL hvor det ikke er standard kurativ behandling tilgjengelig. Målet er å inkludere 15 pasienter over tre år og inklusjon i studien kan forhåpentligvis starte i 2024.
Konklusjon: Det var altså ikke veldig nytt om ALL på EHA som vi kan ta i bruk med det aller første, men fremtiden for ALL pasientene blir stadig litt lysere. Det er behov for randomiserte studier før vi kan innføre kjemoterapifri behandling for B-ALL. Og når vi ser resultater fra internasjonale studier blir vi minnet på at vi i Norge har resultater i verdensklasse for denne pasientgruppen som det er god grunn til å være stolte av. Våre gode resultater må vi ha i mente når vi ser resultater fra randomiserte studier hvor standardarmen ofte dårligere resultater enn vi har ved vår standard behandling.
33

HEMATOLOGISK NORSK Aften norskaften.no

HEMATOLOGISK NORSK Aften norskaften.no
 HEMATOLOGISK NORSK
HEMATOLOGISK NORSK
































