7



Abbiamo visto finora molte proprietà della materia, ma ce n’è una che non abbiamo ancora incontrato: la carica elettrica.
La carica elettrica si manifesta, per esempio, quando una penna acquista la capacità di attirare pezzetti di carta dopo essere stata strofinata con un panno di lana, oppure quando riceviamo una piccola scossa toccando la portiera di un’auto in una giornata molto secca. In queste circostanze, la penna e la portiera si dicono elettrizzate.
Già gli antichi Greci avevano scoperto che gli oggetti di ambra, strofinati con un panno di lana, sono in grado di attirare la paglia sminuzzata. Per questa ragione, i Greci hanno chiamato l’ambra elektron, il termine da cui deriva la parola elettricitˆ che oggi usiamo per parlare di tutti quei fenomeni in cui i corpi si attraggono o si respingono per effetto della carica elettrica.
Possiamo realizzare un esperimento piuttosto semplice per iniziare a ragionare sull’elettrizzazione dei corpi.
1. Fissiamo a un tavolo una striscia di nastro adesivo, quindi stacchiamola con un colpo deciso. Dopo lo strappo, il nastro viene debolmente attratto dalla nostra mano, perché ha acquisito una carica elettrica opposta rispetto a quella del nostro dito.
2. Fissiamo a un tavolo due strisce di nastro adesivo una di fianco all’altra, quindi strappiamole insieme con un colpo deciso. Le strisce si respingono una rispetto all’altra, perché hanno assunto un tipo di elettrizzazione uguale.
Da questa e da esperienze analoghe, possiamo trarre alcune conclusioni generali:
1. su alcuni materiali che sono sottoposti a strofinio si genera una carica elettrica;
2. la carica elettrica può essere di due tipi e, per convenzione, si distingue in positiva (+) e negativa (-);
3. le cariche che hanno lo stesso segno, (+) e (+) oppure (-) e (-), si respingono;
4. le cariche di segno opposto, (+) e (-), si attraggono.
1 Che cosa succede a due strisce di nastro adesivo che si attraggono tra loro, se vengono accostate a una cannuccia caricata negativamente per strofinio con un panno di plastica?
2 Che cosa accade se avvicini a dei pezzetti di carta una bacchetta di plastica e una di metallo entrambe strofinate con un panno di lana?
Video
Come si comportano le cariche elettriche?
LA LEGGE DI COULOMB
Nel Settecento lo scienziato francese Charles Augustin de Coulomb (17361806) elaborò la legge di Coulomb
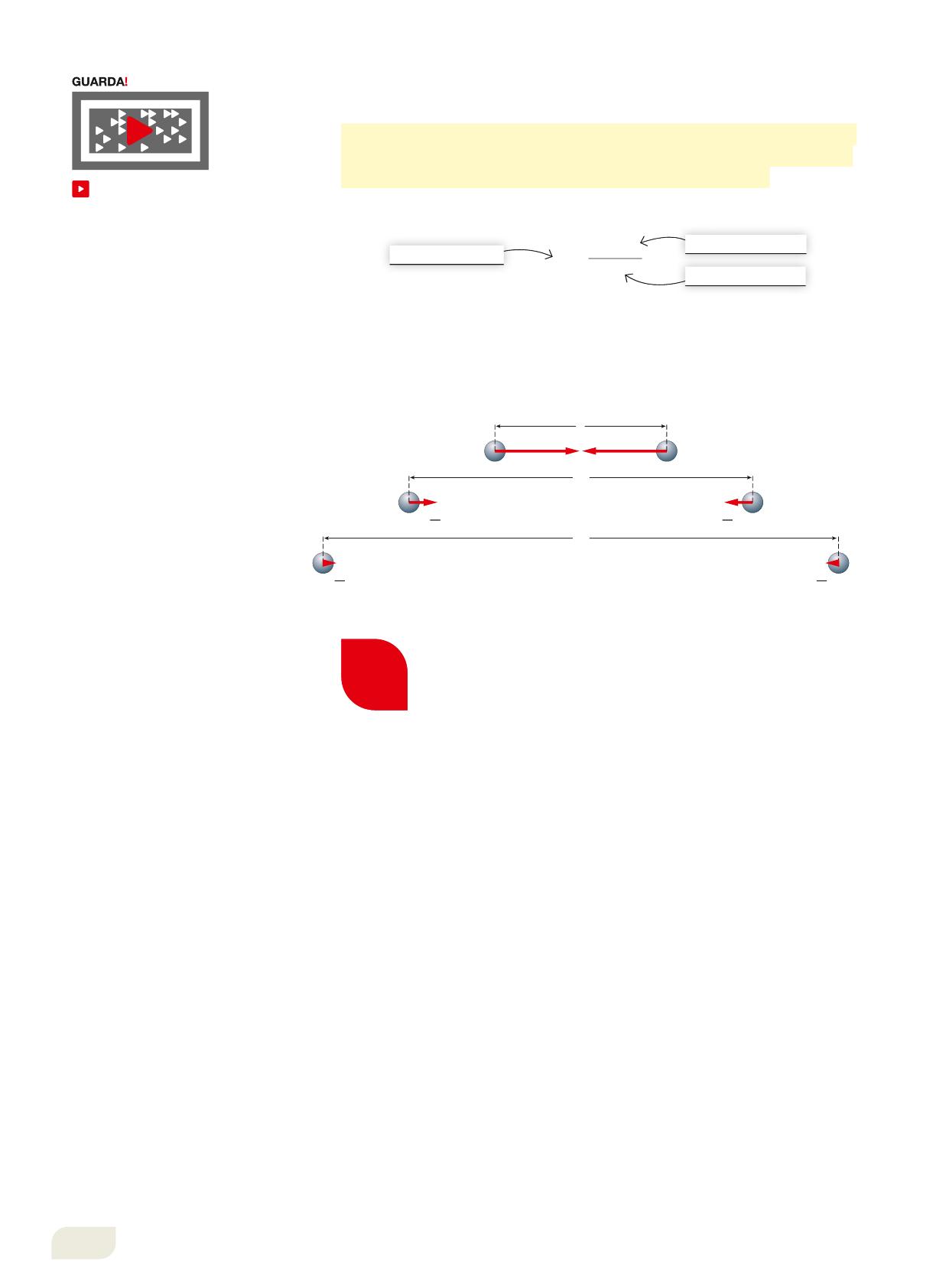
La legge di Coulomb afferma che la forza che si stabilisce tra due corpi di carica Q1 e Q2 è direttamente proporzionale al prodotto delle due cariche e inversamente proporzionale al quadrato della loro distanza.
La legge di Coulomb si esprime matematicamente con la relazione:
forza, newton (N)
F d kQQ 2 2 1 =
carica, coulomb (C)
distanza, metri (m)
Il coulomb (C) è l’unità di misura della carica elettrica nel SI e il suo valore è preceduto dal segno che indica il tipo di carica. La costante k dipende dal materiale tra le cariche: per l’aria si approssima a 9,0 # 109 N m2/C2, cioè il valore determinato sperimentalmente nel vuoto (Figura 1, Video).
La forza elettrica F agisce su due corpi carichi con la stessa intensità: la retta che congiunge le due cariche rappresenta la direzione, il verso dipende dal loro segno.
La carica elettrica, quindi, si manifesta in casi particolari, come quando un oggetto viene strofinato. Dobbiamo dedurre che la carica elettrica ha origine dallo strofinio di due corpi oppure preesiste nella materia?
L’indagine sulla natura della carica elettrica è iniziata a metà del Settecento, grazie agli studi del fisico americano Benjamin Franklin (1706-1790). Franklin postulò l’esistenza di un fluido elettrico costituito da particelle reciprocamente repulsive, che aveva distinto con il nome di elettricità positiva e negativa. Alcuni anni dopo, grazie all’invenzione della pila di Alessandro Volta (1745-1827), divenne evidente il collegamento tra forze chimiche ed elettriche. Questo portò il chimico svedese Jöns Jacob Berzelius (1779-1848) a suggerire l’idea che in ogni atomo fossero presenti entrambi i tipi di carica.
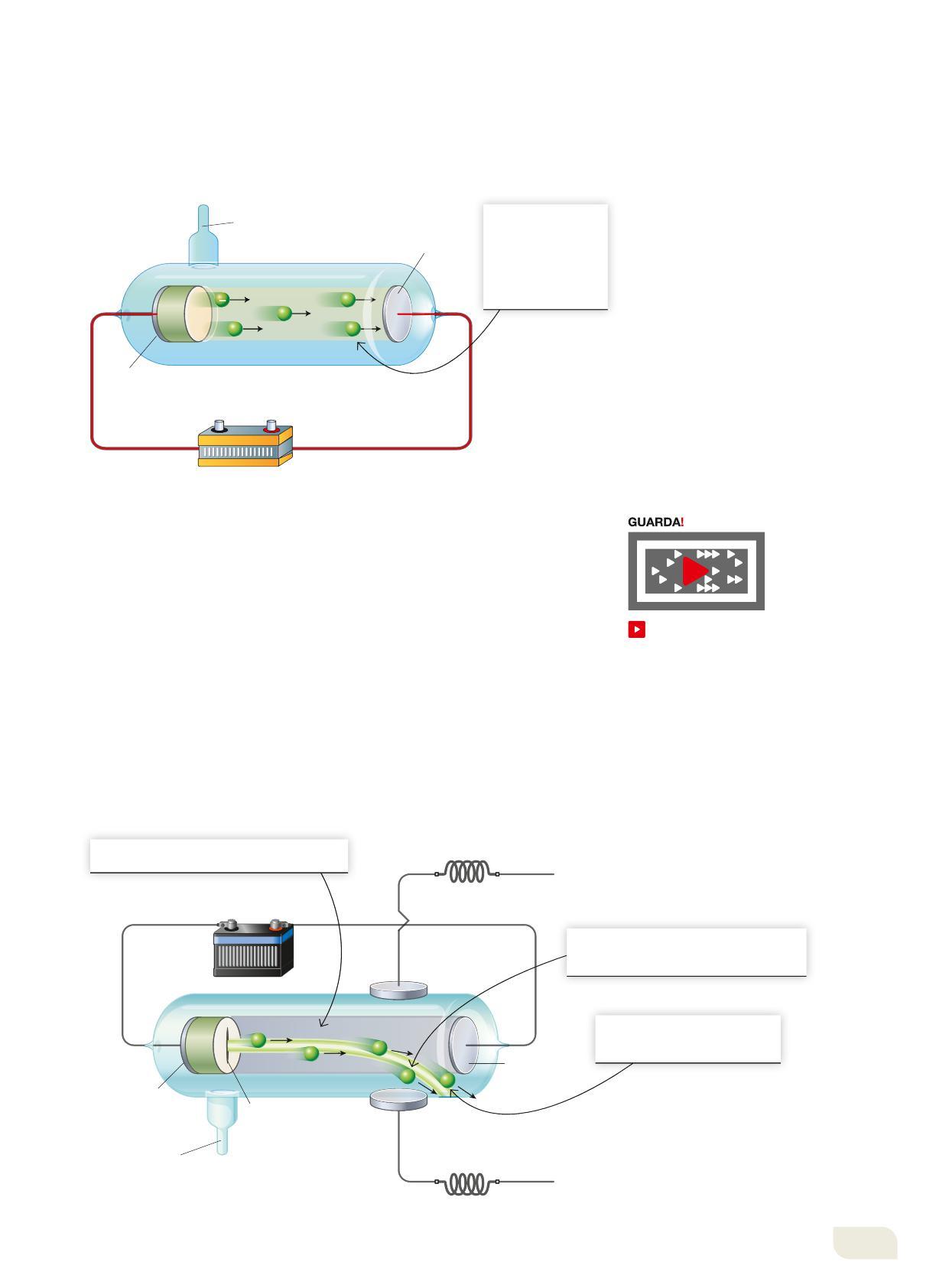
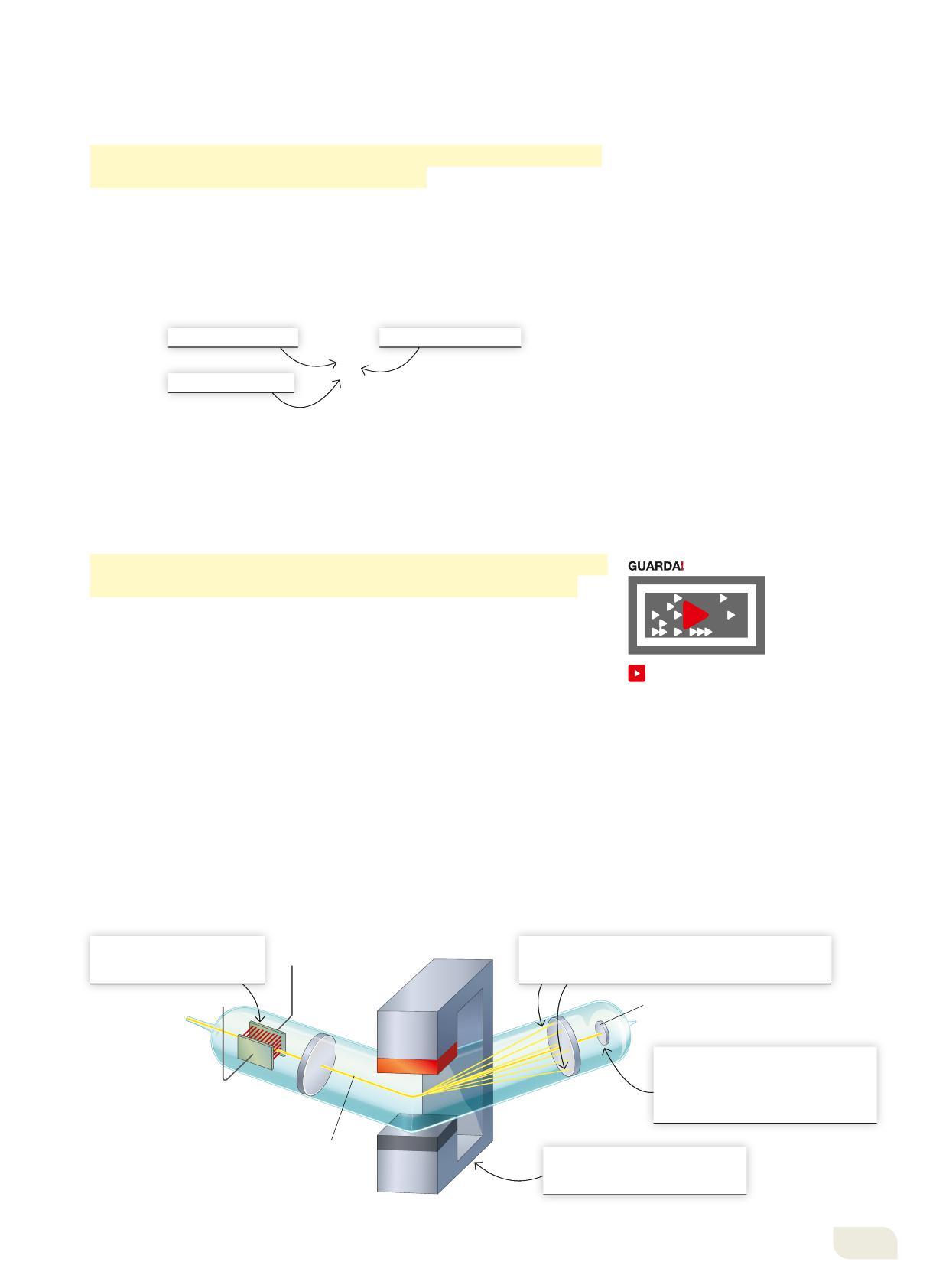
Alla fine dell’Ottocento, la relazione tra materia e carica elettrica divenne più chiara grazie agli studi che indagavano su quello che accadeva se si provoca una scarica elettrica in un tubo di vetro riempito con un gas a bassa pressione (Figura 2). Al passaggio di corrente fra le due placche metalliche poste alle estremità del tubo si diffondeva una luce colorata (rossastra nel caso in cui il tubo fosse riempito di neon), ma se la pressione veniva ridotta fino a un milionesimo di atmosfera non si aveva più emissione di luce da parte del gas: si osservava invece che dal polo negativo, il catodo (-), venivano emesse delle radiazioni che producevano una luminosità sull’altro lato del tubo, di fronte al polo positivo, l’anodo (+).
Le radiazioni che si generano in questo modo e che chiamiamo raggi catodici hanno una serie di caratteristiche:
• non cambiano al variare del metallo che costituisce il catodo né al variare del gas nel tubo;
• sono deviati verso il polo positivo di un campo elettrico;
• sono uguali per gli atomi di tutti gli elementi.
collegamento alla pompa da vuoto +
anodo (+)
A pressioni di circa 10-6 atm, gli elettroni emessi dal catodo urtano la parete opposta dando origine a una luminescenza.
Figura 2
Schema di un dispositivo per la generazione di raggi catodici. La fluorescenza è la proprietà di alcuni materiali di emettere luce visibile quando vengono colpiti da radiazione luminosa della giusta energia.
catodo (-)
generatore elettrico
Nel 1897 il fisico inglese Joseph John Thomson (1856-1940) proseguì gli studi sui raggi catodici. In particolare, studiò quale fosse l’effetto provocato da un campo magnetico e dalla presenza di un ostacolo sui raggi catodici. Per farlo, usò particolari tubi di vetro progettati dal collega William Crookes (1832-1919): scoprì in questo modo che i raggi catodici venivano deflessi da un campo elettrico o da un campo magnetico (Figura 3).
In questo modo Thomson scoprì che i raggi catodici erano particelle dotate di carica e che questa carica aveva segno negativo. Misurò anche il rapporto carica/massa di tali particelle, scoprendo che il valore del rapporto non cambiava al variare del gas o del metallo. Questo permise di concludere che le particelle dovevano essere uguali per gli atomi di tutti gli elementi. Chiamò queste particelle elettroni (Video). Fu la prima dimostrazione sperimentale del fatto che gli atomi non fossero indivisibili, come aveva sostenuto Dalton e come si era creduto fino a quel momento.
Lo schermo ricoperto con solfuro di zinco rileva la «scia» dei raggi catodici.
Video
Come è stato scoperto l’elettrone?
Schema dell’apparecchio adoperato da Thomson per determinare il rapporto carica/massa dell’elettrone.
Il rapporto carica/massa dell’elettrone si determina misurando la deflessione dei raggi.
La deviazione dei raggi catodici è causata dalla carica elettrica delle piastre.
Come
La carica elettrica dell’elettrone fu determinata nel 1910 dal fisico statunitense Robert Millikan (1868-1953): il suo valore, - 1,602 10-19 C, è la minima quantità di carica. La carica elettrica, quindi, può assumere solo valori multipli interi della carica dell’elettrone a cui, per convenzione, si è attribuita carica - 1. Nota la carica dell’elettrone, è stato possibile determinarne la massa: 9,109 $ 10-31 kg, un valore davvero piccolo (Video).
Oggi sappiamo che gli elettroni sono responsabili dell’elettrizzazione dei corpi. Se, per esempio, si strofina un pezzo di plastica con un panno di lana, la plastica si carica negativamente perché sottrae elettroni alla lana. L’elettrizzazione, quindi, non è dovuta alla creazione di cariche ma al trasferimento di elettroni da un corpo all’altro.

In base al principio di conservazione della carica il numero delle cariche acquistate è uguale al numero delle cariche cedute. La più piccola variazione di carica può avvenire spostando un solo elettrone, che per questo si chiama carica elementare.
1 Una penna, strofinata con un panno di lana, acquista una carica elettrica pari a - 6,41 10-7 C. Qual è la carica presente sul panno di lana?
2 Un panno strofinato con una bacchetta di vetro ha assunto una carica elettrica pari a - 14,41 10-7 C. Quanti elettroni è riuscito a strappare alla bacchetta?
A questo punto, sappiamo che gli atomi non sono indivisibili. Sappiamo anche che gli elettroni hanno carica negativa, mentre l’atomo nel suo complesso è neutro: dobbiamo dedurre che devono esistere delle particelle con carica positiva che rendono nulla la carica complessiva dell’atomo.
Il fisico tedesco Eugen Goldstein (1850-1930) identificò queste particelle con esperimenti condotti in tubi di vetro, dotati di un catodo forato e riempiti di gas rarefatto. Le particelle generate dal gas si muovevano verso il polo negativo generando dei raggi anodici (Figura 4). In questo caso:
• le masse delle particelle sono diverse a seconda del gas contenuto nel tubo;
• quando il gas è idrogeno si registra la massa più piccola;
• le masse delle particelle positive sono multipli interi della massa dell’atomo di idrogeno.
Il
(+) anodo catodo (-)
Proviamo a spiegare i risultati sperimentali. Gli atomi e le molecole dei gas contenuti nel tubo, bombardati dai raggi catodici, perdono alcuni elettroni e si trasformano in frammenti positivi degli atomi stessi, che vengono attirati verso il catodo. Poiché le particelle positive hanno masse multiple dell’idrogeno, gli atomi devono essere costituiti da questa unità fondamentale. A tale particella elementare positiva, che ha lo stesso valore della carica dell’elettrone, nel 1920 Ernest Rutherford (1871-1937) assegnò il nome di protone (p+ ). La sua massa è 1836 volte maggiore di quella dell’elettrone, cioè 1,673 10-27 kg.
Nel 1932, il fisico inglese James Chadwick (1891-1974) scoprì una terza particella subatomica: il neutrone (n), che è elettricamente neutro, cioè privo di carica. La sua massa è 1839 volte maggiore di quella dell’elettrone.
La Tabella 1 riassume le caratteristiche delle tre particelle elementari che costituiscono gli atomi di tutti gli elementi.
Tabella 1
Le particelle fondamentali che compongono l’atomo.
Protoni e neutroni sono confinati nel nucleo, una zona molto piccola dell’atomo (circa centomila volte più piccola dell’atomo stesso) e molto densa. Per questo protoni e neutroni si dicono nucleoni
A partire dagli anni Trenta del Novecento sono stati inventati gli acceleratori e i collisori di particelle: questi strumenti operano in condizioni di energia molto superiori a quelle del mondo quotidiano e hanno permesso di dimostrare che neutroni e protoni sono a loro volta costituiti dai quark. Per comprendere i fenomeni chimici, tuttavia, ci basta considerare gli atomi come costituiti da elettroni, protoni e neutroni, senza ulteriori suddivisioni.
In Figura 5 è rappresentato uno dei cinque rivelatori di particelle dell’acceleratore del CERN di Ginevra. Questa infrastruttura di ricerca è un anello di 25 km di diametro, lungo 46 metri e del peso di 7000 tonnellate. È stato realizzato nel 1954 e vi lavorano oltre 13 000 scienziate e scienziati di 110 Paesi grazie a un budget annuale di circa 800 milioni di euro.
Uno dei cinque «rivelatori» dell’acceleratore di particelle del CERN di Ginevra. Gli acceleratori di particelle, sempre più grandi e potenti, consentono di raccogliere informazioni e verificare teorie sulla natura degli atomi e della materia.

(A) L’esperimento di Rutherford, in cui le particelle alfa positive (a) emesse da una sorgente radioattiva venivano inviate su una sottile lamina d’oro. (B) La deviazione delle particelle a da parte dei nuclei positivi degli atomi d’oro.
Gli studi sull’elettrizzazione della materia andarono di pari passo con quelli che cercavano di comprendere la natura dell’atomo. Pochi anni dopo la scoperta dell’elettrone, infatti, Thomson propose per l’atomo un modello continuo.
Secondo il modello atomico di Thomson:
• la massa è distribuita in modo uniforme, mentre la carica positiva si dispone come una nube e occupa tutto il volume dell’atomo stesso;
• gli elettroni sono dispersi nell’atomo in posizioni regolari.
Per Thomson, quindi, l’atomo assomiglierebbe a un panettone, nel quale la carica, ovvero gli elettroni, è dispersa uniformemente come l’uvetta. Per questo in inglese si chiama plum pudding model, ovvero «modello a panettone». Si trattava, tuttavia, di una descrizione tutt’altro che esaustiva, come fu dimostrato qualche anno più tardi dai primi studi sulla radioattività.
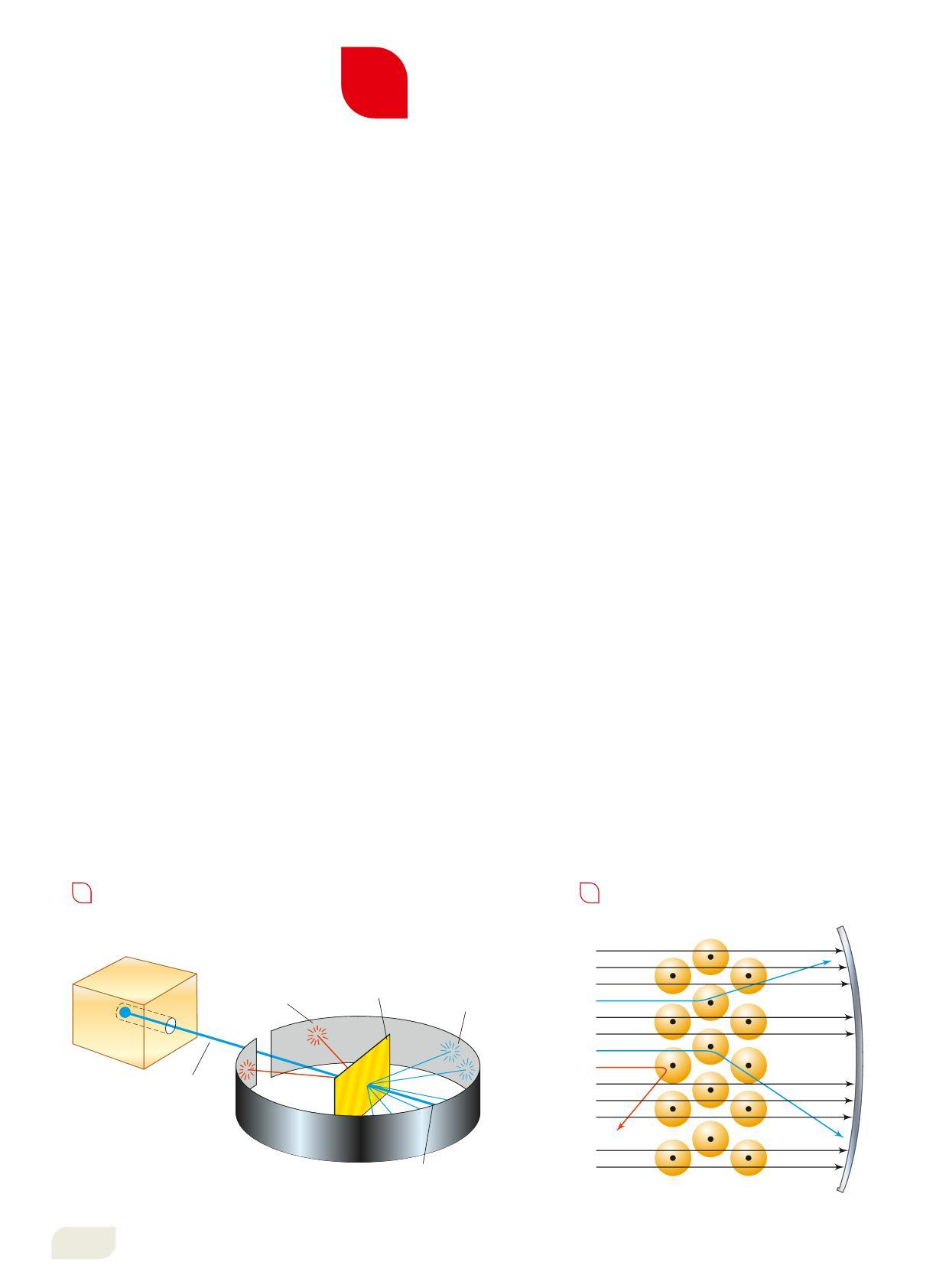
I primi studi di questo tipo furono effettuati dal chimico e fisico inglese Ernest Rutherford (1871-1937). Rutherford studiò le radiazioni emesse dall’uranio e determinò la natura delle particelle alfa (a): nuclei positivi di elio (He2+ ) 7300 volte più pesanti di un elettrone.
Le particelle alfa erano i proiettili ideali per scandagliare la struttura dell’atomo e Rutherford elaborò un esperimento nel quale queste particelle andavano a colpire gli atomi di un sottilissimo foglio d’oro, dello spessore di 0,01 mm. Dopo aver colpito la lamina d’oro, le particelle alfa, invisibili all’occhio umano, venivano raccolte da uno schermo in grado di evidenziare la loro presenza (Figura 6). In base al modello atomico di Thomson la distribuzione uniforme della massa e delle cariche nello spazio avrebbe dovuto deviare di poco la traiettoria delle particelle con carica positiva sparate a grande velocità.
I risultati dell’esperimento mostrarono invece che:
• gran parte delle particelle alfa attraversava il foglio d’oro senza subire deviazioni;
• alcune particelle venivano deviate di angoli più o meno grandi;
• pochissime rimbalzavano indietro, come se avessero colpito un corpo molto denso e carico positivamente.
Le osservazioni portarono Rutherford a elaborare un nuovo modello secondo cui:
1. l’atomo è composto da un nucleo centrale, in cui sono concentrate tutta la carica positiva e la massa dell’atomo;
2. gli elettroni, leggerissimi, occupano lo spazio vuoto intorno al nucleo;
3. il diametro del nucleo (10-15 m) è circa centomila volte più piccolo dello spazio occupato dagli elettroni (10-10 m);
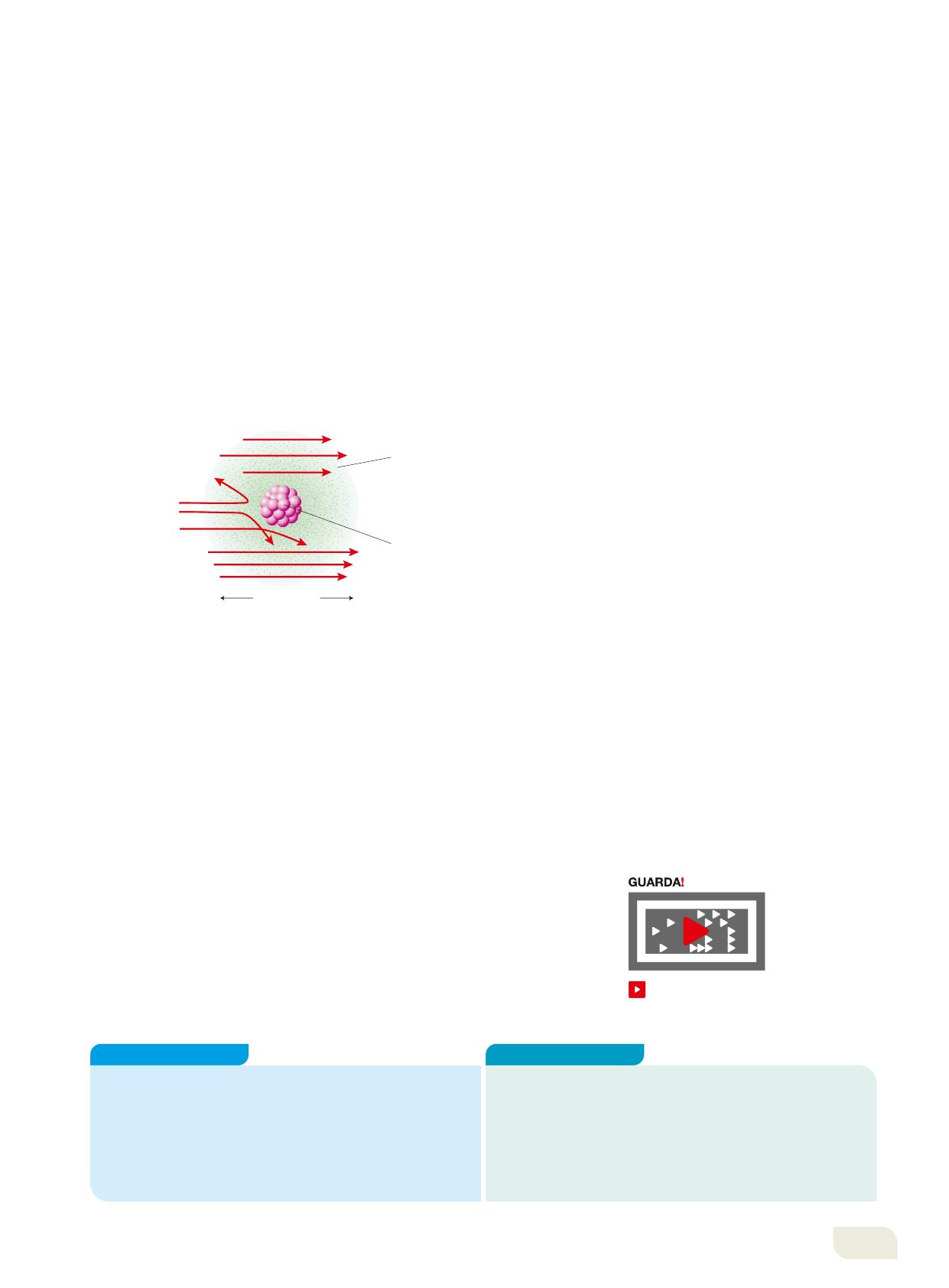
4. gli elettroni ruotano intorno al nucleo come pianeti intorno al Sole e sono in numero tale da bilanciare la carica positiva del nucleo.
A differenza di quello di Thomson, l’atomo di Rutherford spiega i dati sperimentali (Figura 7). Infatti, le poche particelle alfa che arrivano molto vicine al nucleo sono respinte dalla sua carica positiva, come se fosse un muro impenetrabile, e tornano indietro. Le altre sono invece deflesse o proseguono indisturbate, perché lontano dal nucleo la forza repulsiva è minore e attenuata dalla presenza di elettroni.
nube elettronica negativa
nucleo positivo (diametro á 10-15 m)
Ripetendo l’esperimento con materiali diversi, Rutherford dimostrò che gli angoli di deflessione delle particelle a dipendevano dall’elemento che formava la lamina: atomi di elementi diversi avevano quindi una diversa carica nucleare. Ricerche successive dimostrarono che questo è dovuto al fatto che hanno un diverso numero di protoni nel nucleo.
Questo modello descrive correttamente l’atomo come una struttura essenzialmente vuota, ma ha dei limiti (Video): per esempio, non spiega come sono disposti gli elettroni intorno al nucleo. Rutherford, infatti, si limitò a descrivere l’atomo come una struttura formata da una carica positiva centrale, con valore N, circondata dalla carica compensatrice di N elettroni. Tuttavia, citò il modello atomico di Hantarō Nagaoka (1865-1950), un fisico giapponese che aveva supposto che in un atomo la carica positiva dovesse essere concentrata nel nucleo, mentre gli elettroni dovevano disporsi in anelli intorno ad essa. Nel riportare il modello di Nagaoka, Rutherford spiegò che, dal suo punto di vista, la disposizione ad anelli era instabile e non poteva descrivere la distribuzione delle cariche negative. In effetti, vedremo che per giustificare la disposizione degli elettroni intorno al nucleo occorrerà attendere gli studi di Bohr e la meccanica quantistica. Video Come è stato scoperto il nucleo?
RIFLETTI E RISPONDI
Da considerazioni energetiche Rutherford calcolò che il diametro del nucleo degli atomi di oro doveva essere 3,4 10-14 m, mentre il suo raggio atomico era conosciuto dell’ordine di 10-10 m. Quale sarebbe il raggio atomico di un atomo di oro se il suo nucleo avesse un diametro pari a quello di una pallina da ping pong (40 mm)?
Determina il rapporto tra gli ordini di grandezza del diametro dell’atomo e del nucleo. Misura il diametro del cerchio che puoi costruire unendo le tue braccia. Se il diametro dell’atomo fosse uguale a quello del cerchio che hai tracciato con le tue braccia, quale sarebbe il diametro del nucleo?
a) Ipotizza prima un valore.
b) Verifica la tua ipotesi con dei calcoli.
RIFLETTI E IPOTIZZA
Che cosa succede se un atomo di ferro perde due elettroni? Cambierà il suo numero atomico? Quanti elettroni avrà?
Per completare la conoscenza del mondo microscopico, soffermiamoci sul nucleo, cioè sul cuore dell’atomo. Abbiamo già acquisito due nozioni fondamentali:
1. le particelle del nucleo, protoni e neutroni (cioè i nucleoni), occupano uno spazio estremamente ridotto rispetto al volume totale dell’atomo;
2. l’atomo ha una struttura essenzialmente vuota nella quale si muovono gli elettroni, la cui massa è considerata praticamente trascurabile. Possiamo sfruttare queste conoscenze per identificare un elemento chimico attraverso il numero atomico

Il numero atomico (Z) è il numero di protoni presenti nel nucleo di un atomo. In un atomo neutro, Z coincide con il numero degli elettroni.
Il numero atomico riportato nella tavola periodica è caratteristico di ogni elemento. Per esempio, tutti i nuclei degli atomi di carbonio, C, hanno 6 protoni e tutti gli atomi con 7 protoni nel nucleo sono atomi di azoto, N. Esiste una relazione tra il numero delle cariche positive presenti nel nucleo e la posizione di un atomo nella tavola periodica.
Nel 1913 Henry Moseley (1887-1915), un giovane scienziato inglese, determinò accuratamente i numeri atomici degli elementi. Per farlo, studiò i raggi X, cioè radiazioni elettromagnetiche con un elevato contenuto energetico, che venivano emessi da atomi bombardati con elettroni ad alta velocità. Infatti, il tipo di raggi X che sono emessi da un atomo dipende dal numero di cariche elettriche positive presenti nel nucleo, che corrisponde alla posizione occupata dall’elemento nella tavola periodica. In questo modo riuscì a determinare, per esempio, che l’atomo che occupa l’ottava posizione, cioè l’atomo di ossigeno, ha 8 protoni nel nucleo e, di conseguenza, 8 elettroni intorno ad esso; il suo numero atomico è quindi Z = 8.
Oggi sappiamo che gli atomi neutri possono acquisire o perdere elettroni: per esempio, l’atomo di cloro ha Z = 17. Quando acquista un elettrone forma lo ione Cl-, che ha 18 cariche negative, mentre le sue cariche positive (i protoni) rimangono invariate, cioè 17. Il magnesio, che ha Z = 12, quando forma lo ione Mg2+ perde due elettroni e ha un totale di 10 elettroni e 12 protoni.
è uguale a Z dipende dalla carica si ricava dalla tavola periodica CATIONE
numero delle cariche positive = numero degli elettroni persi
numero delle cariche negative = numero degli elettroni acquistati
Poiché i neutroni e i protoni sono le particelle che determinano la massa atomica, al numero di nucleoni di un atomo si dà il nome di numero di massa e si indica con la lettera A.
Il numero di massa (A) è uguale alla somma del numero di protoni (Z) e del numero di neutroni (n) contenuti nel nucleo.
A = Z + n = numero di protoni + numero di neutroni
Il nucleo di un atomo, di cui si conoscono Z e A, si chiama nuclide. Per rappresentare un nuclide, il numero di massa si scrive in alto a sinistra e il numero atomico in basso a sinistra del simbolo oppure si fa seguire al nome dell’elemento un trattino seguito dal numero di massa.
numero di massa (A) simbolo dell’elemento
A ZX
numero atomico (Z)
Conoscendo il numero atomico e il numero di massa di un atomo si può risalire al numero di neutroni contenuti nel nucleo:
n = A - Z
Il numero dei neutroni dell’atomo cloro-35 è perciò 18 (35 - 17 = 18). Possiamo dare una nuova e più completa definizione del termine isotopo
Gli isotopi sono atomi dello stesso elemento con le stesse proprietà chimiche ma masse diverse, perché contengono un diverso numero di neutroni.
La maggior parte degli elementi non è costituita da atomi esattamente uguali tra loro, come ipotizzato da Dalton, ma contiene una quantità più o meno grande di isotopi dello stesso elemento. Lo strumento utilizzato per determinare la massa atomica di un isotopo e la sua percentuale in un campione è lo spettrometro di massa (Figura 8, Video). Una volta introdotto nello strumento, il campione dell’elemento è vaporizzato e ionizzato. Come conseguenza, i suoi atomi perdono elettroni e si trasformano in ioni positivi che vengono poi accelerati da un campo elettrico. Gli ioni acquistano velocità, tanto maggiore quanto più piccola è la loro massa. L’applicazione successiva di un campo magnetico consente di suddividere in più fasci il raggio ionico iniziale, cioè di separare i diversi isotopi. Il segnale ottenuto grazie a un apposito sistema di rilevazione viene convertito in un grafico che riporta in ascissa le masse atomiche degli isotopi e in ordinata l’abbondanza relativa di ciascun isotopo.
Il campione è vaporizzato e trasformato in ioni positivi da una scarica elettrica.
fascio di ioni positivi
Video
Come funziona lo spettrometro di massa?
Figura 8
In uno spettrometro di massa gli atomi del campione sono trasformati in ioni positivi, poi accelerati da un campo elettrico e deviati da un campo magnetico. Si possono determinare sia la massa dell’isotopo sia la sua percentuale nel campione.
Gli ioni di massa diversa sono separati. La velocità e la curvatura dipendono dal rapporto carica/massa di ciascuno ione.
rivelatore
Un fascio può giungere al rivelatore solo se la sua traiettoria passa per una fenditura. Il rivelatore registra una corrente proporzionale al numero di ioni che lo colpiscono.
Nel tubo vuoto, il raggio ionico passa all’interno di un campo magnetico variabile.
I tre isotopi dell’idrogeno hanno Z = 1. Essi possiedono masse diverse, ma tutti formano molecole d’acqua per reazione con l’ossigeno. Le proprietà chimiche sono infatti identiche.
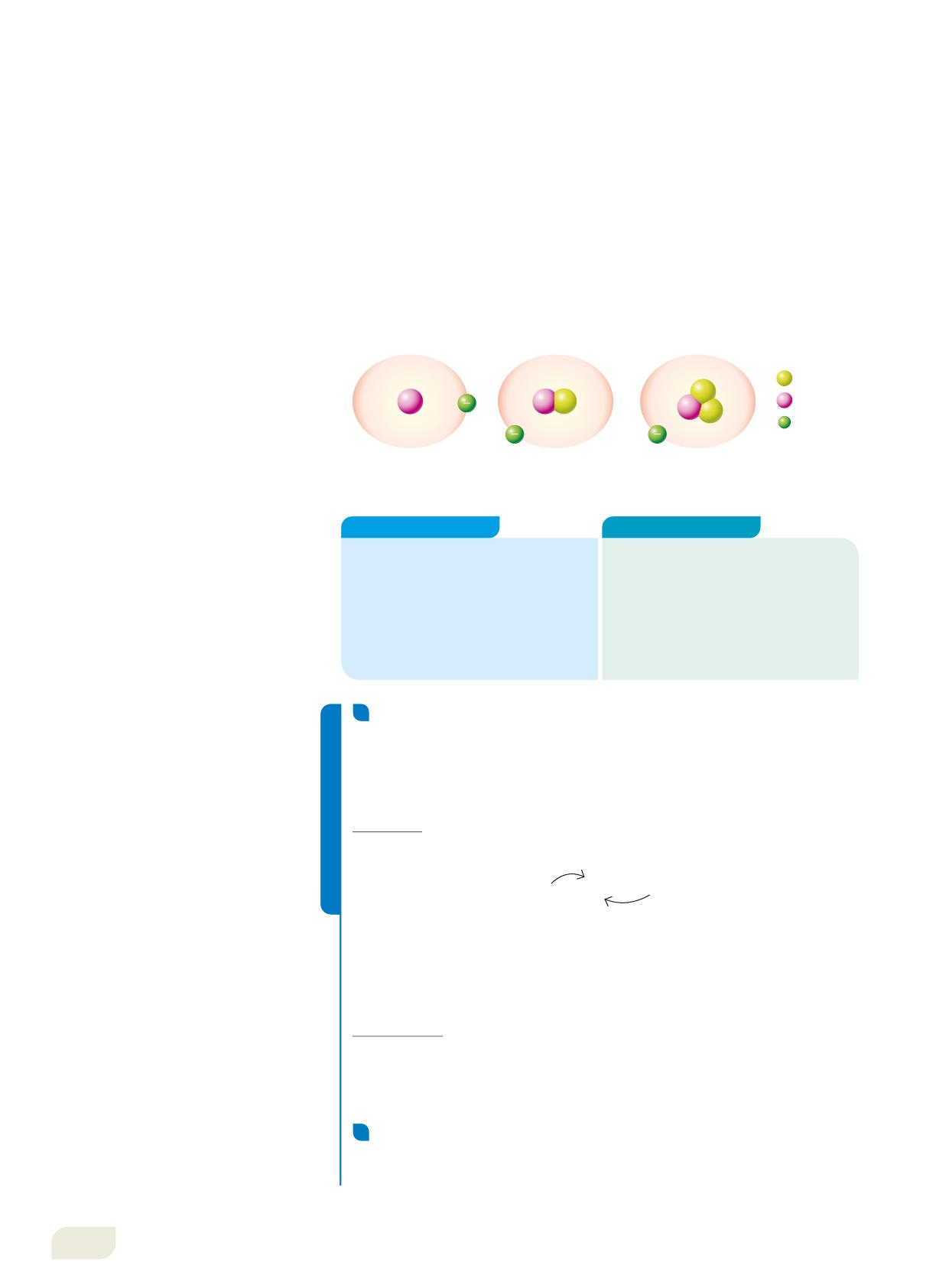
L’idrogeno naturale è in massima parte costituito da atomi con un protone e un elettrone. In piccola percentuale, però, troviamo anche atomi di idrogeno con un protone, un elettrone e uno o due neutroni (Figura 9). Gli isotopi dell’idrogeno hanno nomi specifici: l’isotopo con A = 1 è il pròzio, quello con A = 2 è il deuterio (simbolo D), quello con A = 3, che esiste in natura solo in tracce, è il trizio. Anche in questo caso, la presenza dei neutroni in più nel nucleo non modifica le proprietà chimiche dell’atomo, che restano identiche a quelle dell’isotopo con un solo protone: a variare sono le proprietà fisiche. Il deuterio, come l’idrogeno, si lega agli atomi di ossigeno per formare D2O, detta «acqua pesante», che ha proprietà fisiche diverse da H2O: bolle a 101,4 °C, fonde a 3,8 °C e la sua densità è 1,10 g/mL. In natura è mescolata ad H2O in una proporzione di circa 1 molecola ogni 20 milioni e si concentra nei fondali oceanici, poiché ha densità maggiore.
In uno spettrometro di massa, a parità di carica, gli ioni più leggeri subiscono una deviazione maggiore o minore rispetto a quelli più pesanti?
Un nuclide di potassio ha: A = 40 e Z = 19.
Che cosa succede se per effetto di una reazione nucleare perde due neutroni? Quanto varranno il suo numero di massa e il suo numero atomico? Cambierà la natura dell’elemento?
PROBLEMI SU MISURA 7.1
PROBLEMA SVOLTO
USARE A E Z PER DETERMINARE IL NUMERO DI PARTICELLE IN UN ATOMO
L’isotopo dell’uranio, 235 92U, è stato usato per costruire la prima bomba atomica. Calcola quanti protoni, elettroni e neutroni possiede.
STRATEGIA
• Dal simbolo del nuclide possiamo ricavare A e Z:
A 235 92U Z
• Il numero di massa A è la somma del numero di protoni e di neutroni.
• Noto il numero atomico Z, possiamo ricavare anche il numero di elettroni.
SVOLGIMENTO
numero dei protoni = numero degli elettroni = numero atomico Z = 92 numero di neutroni = numero di massa A - numero atomico Z =
= 235 - 92 = 143 neutroni
ORA PROVA TU
Determina il numero di protoni, elettroni e neutroni di: a. 11 5B b. 23 11Na+ c. 32 16S2-
I nuclei di tutti gli atomi a eccezione di quelli di idrogeno contengono, stipati in un piccolissimo volume, un numero più o meno grande di protoni, cioè di cariche elettriche di ugual segno, e di neutroni. Nonostante l’intensità delle forze elettriche repulsive, che aumenta rapidamente al diminuire della distanza tra le cariche, la maggior parte dei nuclei presenti in natura è stabile, per cui essi si mantengono inalterati nel tempo. Questo è possibile perché, tra le particelle del nucleo, cioè tra i nucleoni, agisce una forza attrattiva molto grande, chiamata forza nucleare forte, che prevale nettamente sulle forze elettriche repulsive e consente al nucleo di non disintegrarsi.
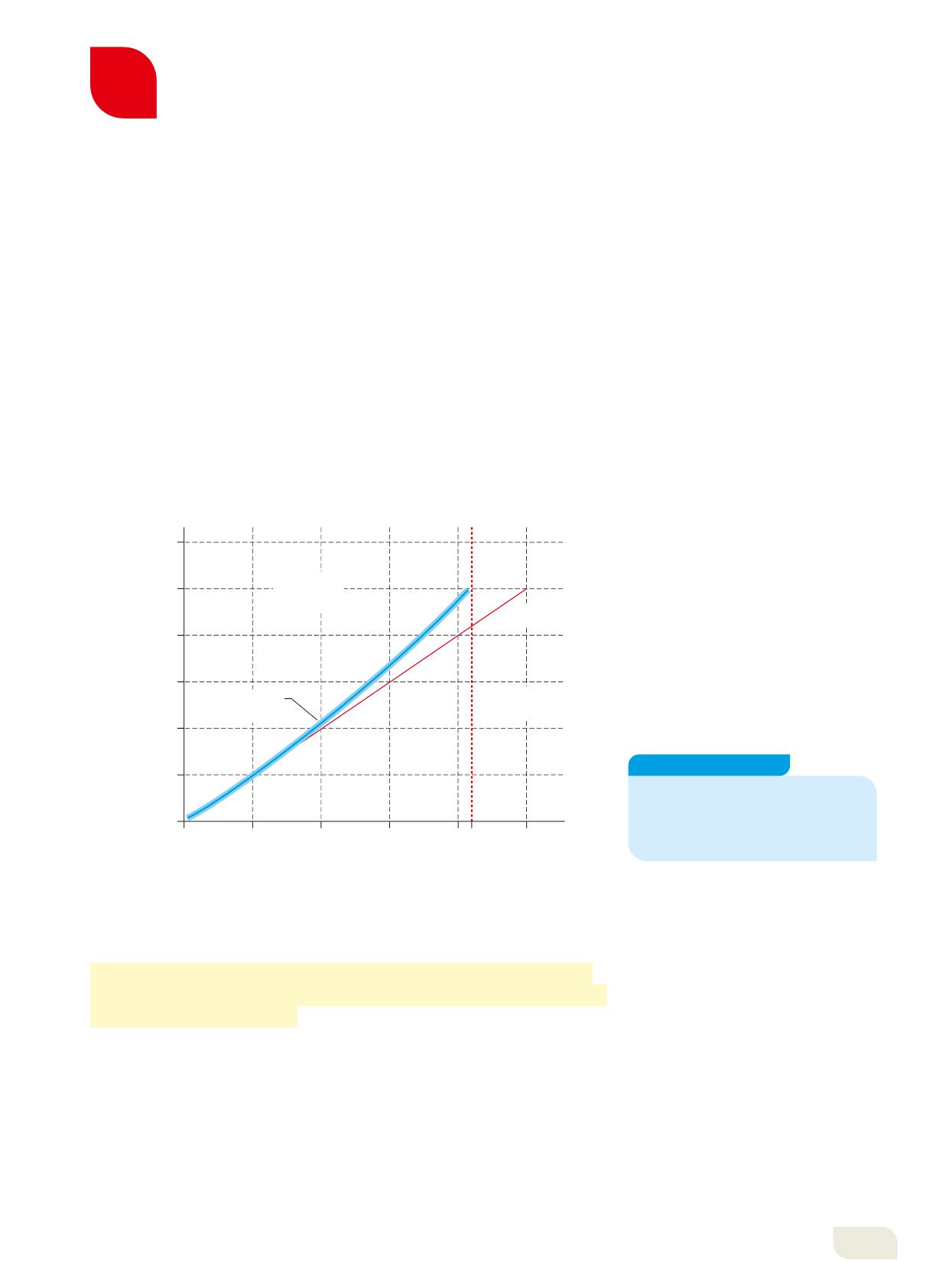
La stabilità dei nuclei dipende dal numero di protoni e neutroni che essi contengono. Infatti (Figura 10):
• i nuclei con Z compreso tra 1 e 20 circa sono stabili se hanno approssimativamente tanti neutroni quanti protoni, cioè se A . 2 Z;
• i nuclei con Z compreso tra 20 e 84 sono stabili se hanno un numero di neutroni superiore a quello dei protoni;
• i nuclei con Z $ 84 sono instabili.
Banda di stabilità dei nuclei atomici: i nuclei che si trovano lungo questa linea sono in genere stabili.
Gli isotopi instabili emettono spontaneamente una particella trasformandosi nel nucleo di un altro elemento. Tale processo si chiama decadimento radioattivo.
Il decadimento radioattivo è un processo che trasforma il nucleo di un elemento nel nucleo di un elemento diverso. La radioattività è il processo di emissione della radiazione.
In una trasformazione chimica gli atomi di ciascun elemento rimangono inalterati, perché si determinano rotture e formazioni di legami chimici in cui sono coinvolti soltanto gli elettroni. In una trasformazione nucleare, invece, gli atomi di un elemento cambiano la propria identità, in quanto viene intaccata la struttura del nucleo. Con la scoperta della radioattività, quindi, cade un altro assunto della teoria di Dalton, cioè che gli atomi siano indivisibili e indistruttibili.
Esaminando il grafico, sai dire quanti neutroni deve possedere approssimativamente un nucleo di calcio per essere stabile?
La radioattività fu scoperta nel 1896 dal fisico francese Antoine Henri Becquerel (1852-1908). Mentre analizzava l’emissione di raggi X di un sale d’uranio, rilevò che esso provocava l’annerimento di una lastra fotografica anche senza l’esposizione alla luce solare. Alcuni anni dopo Rutherford dimostrò che le radiazioni emesse dal nucleo di un elemento radioattivo sono di tre tipi, perché un campo elettrico provoca effetti diversi sulla loro propagazione. Rutherford diede il nome di raggi a (alfa) alle radiazioni respinte da un elettrodo carico positivamente, di raggi b (beta) a quelle attratte dallo stesso elettrodo e di raggi c (gamma) alle radiazioni che non subiscono deviazioni della traiettoria. Rutherford dimostrò poi che:
• i raggi a sono costituiti da nuclei di elio, con carica 2+ e numero di massa 4; sono indicati con il simbolo 4 2He;
• i raggi b sono fasci di elettroni veloci, indicati dal simbolo bo -1 0e, in cui 0 e - 1 stanno a sottolineare, rispettivamente, che non hanno massa rilevante e che portano una carica elettrica negativa;
• i raggi c sono radiazioni elettromagnetiche, come la luce e i raggi X, ma di frequenza ed energia ancora maggiori.
Le radiazioni alfa, beta e gamma hanno una diversa capacità di penetrazione (Figura 11). I nuclei instabili possono decadere emettendo particelle a o b, che sono spesso accompagnate da radiazioni c. Oggi sappiamo che possono essere emesse anche altre particelle, fra cui la più importante è il positrone, b+, con massa uguale a quella dell’elettrone e carica positiva.
foglio di carta
penetrante raggio beta
a)
I raggi a sono trattenuti da un semplice foglio di carta.
I raggi b vengono bloccati dall’alluminio.
I raggi c sono assorbiti soltanto da uno spesso schermo di piombo.
Queste radiazioni, chiamate anche radiazioni ionizzanti, sono costantemente prodotte dagli isotopi radioattivi presenti in natura nelle rocce, nel suolo o nell’aria: per questo gli esseri viventi sono continuamente sottoposti a una radiazione di fondo.
Quando prodotte in modo controllato, le radiazioni ionizzanti trovano molte applicazioni in ambito medico, sanitario e ambientale. Per esempio, si usano nella cobaltoterapia per uccidere le cellule tumorali; per sterilizzare presidi medicali come siringhe, corredi per dialisi o sacche per contenere il sangue; per degradare i polimeri e rendere più efficace il loro smaltimento e riciclo. Inoltre, irradiando i cibi con radiazioni ionizzanti, si possono eliminare in modo sicuro agenti patogeni come la salmonella e rallentare i processi di maturazione dei prodotti vegetali.
Il decadimento di un nucleo è descritto da un’equazione nucleare, che risulta bilanciata quando:
1. la somma dei numeri di massa, A, dei reagenti è uguale alla somma dei numeri di massa dei prodotti;
2. la somma dei numeri atomici, Z, dei reagenti è uguale alla somma dei numeri atomici dei prodotti.
Di seguito sono indicati i tipi più frequenti di fenomeni radioattivi.
1.
Nuclei con numero atomico superiore a 83 e numero di massa superiore a 220 decadono emettendo particelle a positive (nuclei di elio). Così il numero di massa diminuisce di quattro unità, mentre Z diminuisce di due unità. Il nuovo nuclide risulta spostato di due posizioni indietro nella tavola periodica. Un esempio è il decadimento del torio-232 (Figura 12):

Decadimento del torio-232, uno dei più abbondanti elementi radioattivi della crosta terrestre e potenziale sostituto dell’uranio come fonte di energia nucleare.
Il decadimento b è tipico dei nuclei troppo ricchi di neutroni rispetto ai protoni, che dunque devono aumentare il numero di protoni per stabilizzarsi. Un neutrone, 1 0n, isolato è instabile e può disintegrarsi dando un protone, 1 1p, e una coppia di particelle (un elettrone veloce -1 0e, cioè un raggio b, e l’antineutrino, oe ):
Gli antineutrini trasportano solo energia, rendendo più stabili i nuclei da cui sono stati emessi. Possiamo trascurarli in quanto, avendo massa molto più piccola dell’elettrone e carica nulla, non influenzano l’identità del nucleo che si forma. Il nuovo nuclide è quindi spostato di una posizione a destra nella tavola periodica. Consideriamo il trizio (Figura 13):
Figura 13
Nel decadimento del trizio resta inalterato il numero totale di nucleoni (3) e la carica dovuta ai protoni (1 = 2 - 1).
Figura 14
Il potassio-40 costituisce lo 0,01% del potassio terrestre ed è responsabile della maggior parte della radiazione di origine naturale nelle specie viventi e nel suolo.
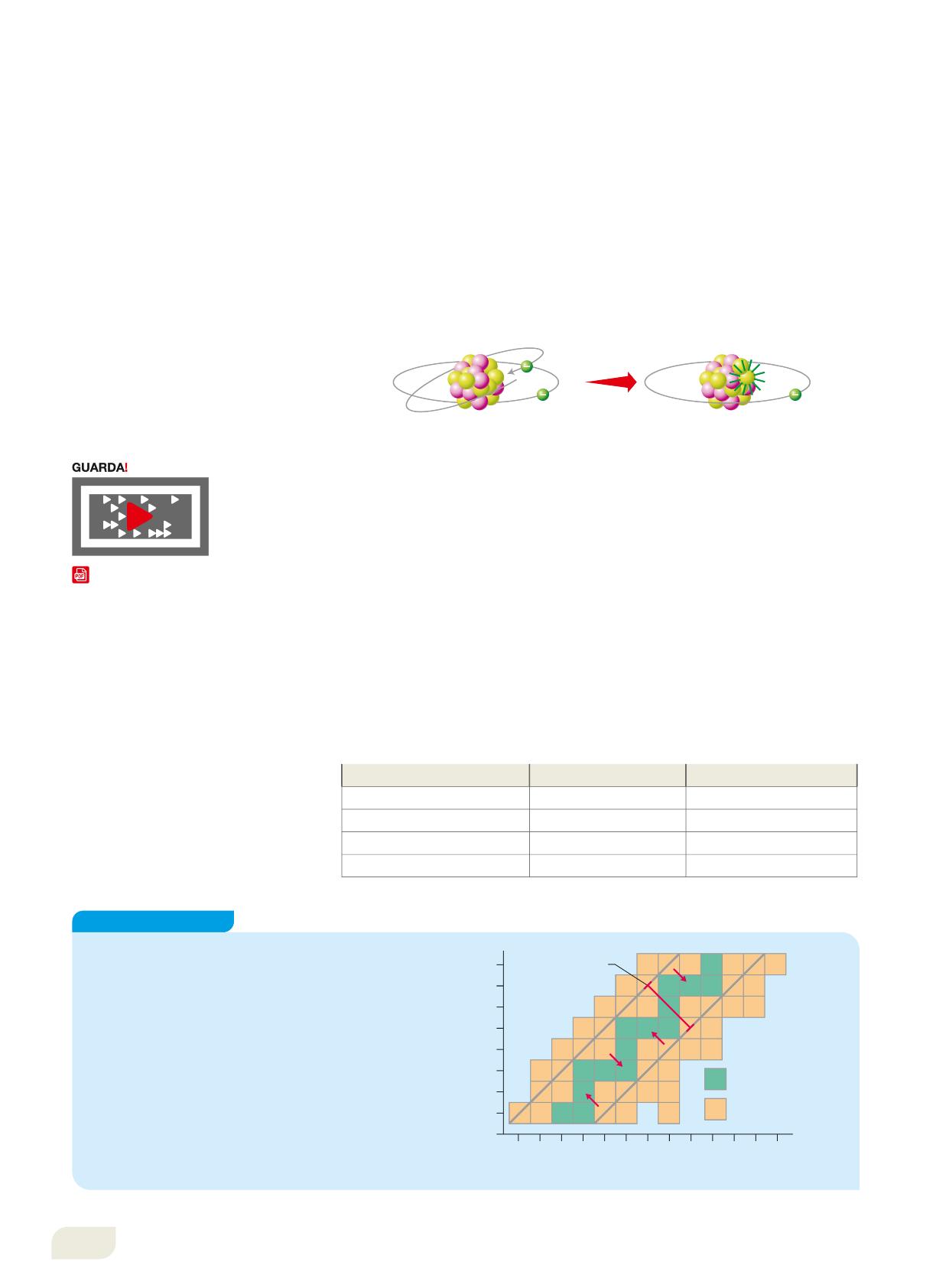
3. Emissione b+ e cattura elettronica
L’emissione di elettroni positivi (b+ o positroni) o la cattura di elettroni avviene quando il numero di protoni è troppo elevato rispetto ai neutroni. In tal caso, un protone può trasformarsi in neutrone emettendo una particella equivalente in massa all’elettrone ma con carica opposta (+1 0e, o positrone), oppure assorbendo (cioè «catturando») un elettrone orbitante tra quelli più vicini al nucleo. In entrambi i casi, la trasformazione del protone in neutrone produce un atomo con numero atomico Z diminuito di un’unità, mentre il numero di massa resta uguale. Il nuovo nuclide risulta quindi spostato di una posizione a sinistra nella tavola periodica.
Un esempio di cattura elettronica è offerto dal potassio-40 (Figura 14):
Sull’emissione b+ si basa una tecnica diagnostica di medicina nucleare: la tomografia a emissione di positroni, o PET, in cui si somministra una sostanza, come il glucosio, legata a un isotopo radioattivo. Così si individuano le cellule tumorali, che accumulano più glucosio di quelle sane.
Scheda
4. Emissione gamma (c)
La perdita di qualsiasi tipo di particelle non garantisce tuttavia che l’atomo decaduto diventi subito stabile. Accade che, anche in seguito a uno dei decadimenti visti, vi sia la possibilità di un altro fenomeno, a cui corrisponde una perdita di energia. Dopo un’emissione a o b si può liberare energia dal nucleo, in forma di raggi c: restano invariati sia il numero atomico sia il numero di massa.
La Tabella 2 riassume i vari tipi di decadimento radioattivo.
- 4 decadimento b + 1 nessuna emissione b+ - 1 nessuna emissione c nessuna nessuna
Nella figura è rappresentata una sezione ingrandita della banda di stabilità con indicati alcuni decadimenti.
a) Perché il fluoro-20 decade a neon-20? Quale particella viene emessa? Scrivi l’equazione nucleare relativa.
b) Il fluoro-17 aumenta invece la sua stabilità grazie all’emissione di un positrone. Scrivi l’equazione nucleare relativa e spiega perché il fluoro-17 emette positroni.
c) Il magnesio-23 diventa stabile trasformandosi in sodio-23: qual è il decadimento caratteristico di questa trasformazione? Scrivi la sua equazione bilanciata.
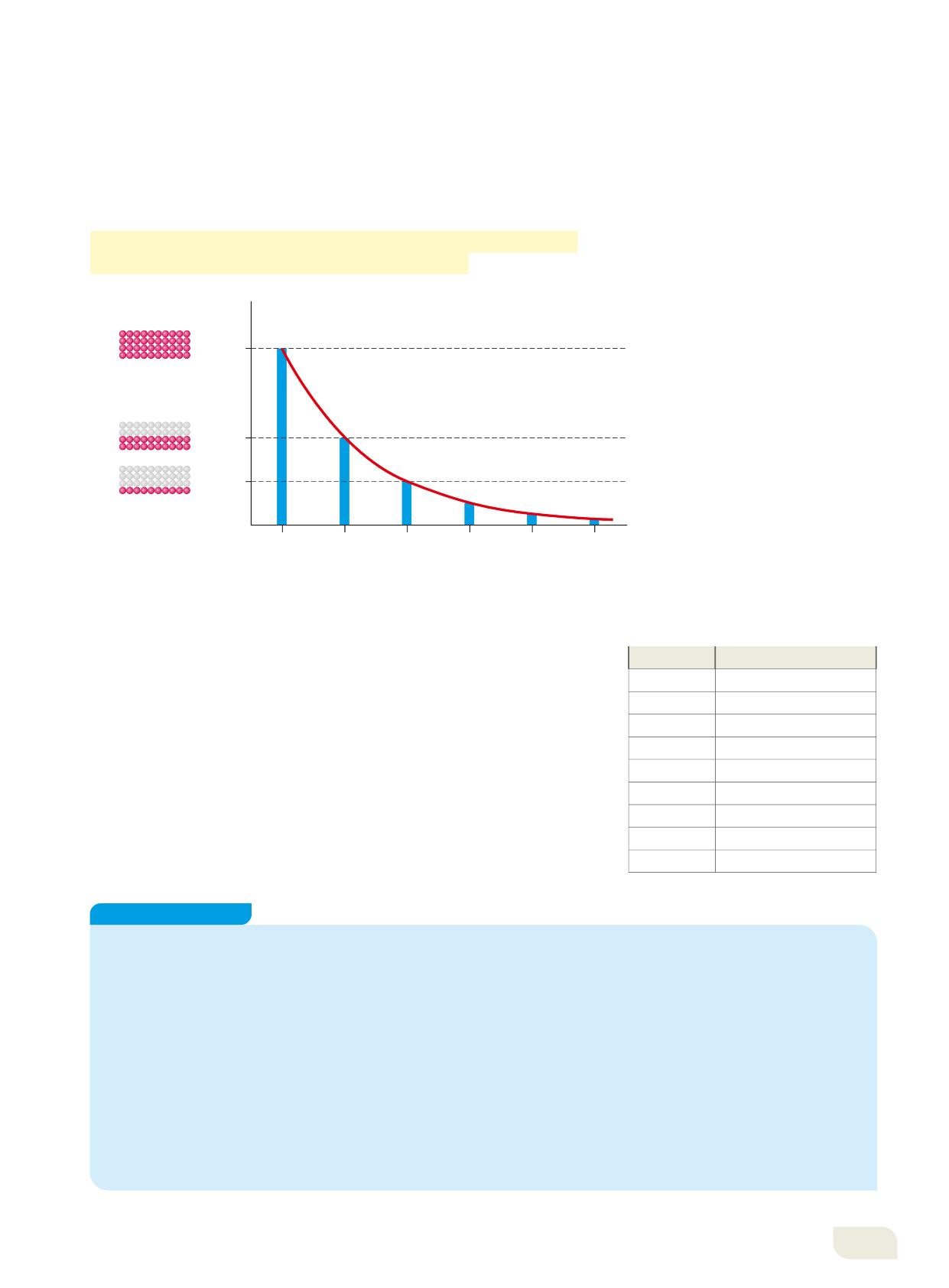
Il momento esatto in cui avviene il decadimento non può essere previsto da nessuna legge fisica, è un fenomeno del tutto casuale. Tuttavia, tutti i processi di decadimento evolvono nel tempo secondo uno stesso schema descritto da una curva che ha un andamento esponenziale decrescente, detta curva di decadimento. In intervalli di tempo successivi e costanti, si disintegra sempre la stessa percentuale dei nuclei presenti all’inizio di quell’intervallo. Si definisce così il tempo di dimezzamento (Figura 15).
Il tempo di dimezzamento o emivita (t1/2) è il tempo che occorre per ridurre alla metà la quantità di un isotopo radioattivo.
Trascorso un intervallo pari al tempo di dimezzamento, il numero dei nuclei ancora radioattivi è uguale alla metà di quelli presenti all’inizio.
Spesso il decadimento di un isotopo radioattivo non porta a un isotopo stabile ma alla formazione di un nuovo isotopo radioattivo, che a sua volta decade; tale processo può continuare fino a quando non si produce un isotopo stabile. Questa successione di decadimenti fino alla formazione di un isotopo stabile si chiama serie di disintegrazione radioattiva. Il valore del tempo di dimezzamento cambia al variare del tipo di isotopo (Tabella 3). Il tempo di decadimento degli isotopi naturali si utilizza in geologia e in archeologia per determinare l’età assoluta di formazioni rocciose, minerali e reperti biologici fossili attraverso una tecnica nota come radiodatazione Dato un campione di materiale, si può misurare la concentrazione di isotopo stabile che contiene. Conoscendo i rapporti tra isotopo stabile e instabile, e il suo tempo di dimezzamento, si può ricavare il tempo che è trascorso da quando il radioisotopo è stato immagazzinato (cioè l’età del reperto).
RIFLETTI E RISPONDI
Il carbonio-14, detto anche radiocarbonio, si forma in atmosfera per effetto dell’urto dei neutroni prodotti dai raggi cosmici con l’azoto-14. La sua concentrazione è più o meno costante in atmosfera e ha subito un lieve aumento solo per effetto dei neutroni dispersi dalle esplosioni termonucleari condotte a scopo di test dopo la Seconda guerra mondiale.
a) Scrivi l’equazione nucleare che porta alla formazione di 14C.
b) Il carbonio-14 entra nella struttura di ogni organismo vivente in percentuale costante, ma cessa di essere assimilato appena l’organismo muore e smette di alimentarsi. Da quel momento, la quantità di 14C si riduce regolarmente, dimezzandosi ogni 5730 anni con emissione beta. Scrivi l’equazione nucleare.
Isotopo Tempo di dimezzamento
tecnezio-996 ore
iodio-131 8 giorni
cobalto-605,3 anni
trizio 12 anni e 3 mesi
stronzio-9028,1 anni
cesio-137 30,17 anni
carbonio-145730 anni
potassio-401,28 109 anni
uranio-2384,51 109 anni
Sui resti di un organismo vivente (come un reperto osseo o un fossile), si può misurare la quantità di radiocarbonio residuo attraverso la sua emissione beta. Dalla percentuale di 14C residuo sul carbonio totale si risale al numero di dimezzamenti subiti, e quindi al tempo trascorso dalla morte dell’organismo.
c) Quanti t1/2 sono trascorsi dal decesso se un reperto archeologico emette radiazioni b pari a 1/4 di quelle emesse da un essere vivente?
d) Qual è l’età approssimativa del reperto?
e) Stabilisci in base alla Tabella 3 a quale isotopo radioattivo si potrebbe ricorrere per reperti più antichi, come le rocce.
Nel linguaggio comune, l’espressione «energia nucleare» è associata a una forma di energia prodotta nei reattori nucleari o liberata in modo devastante da un ordigno bellico. In ambito scientifico, invece, «energia nucleare» assume un significato più preciso, perché indica l’energia che tiene legati i protoni e i neutroni nel nucleo.
L’energia nucleare è l’energia che bisognerebbe spendere per separare i nucleoni uno dall’altro. La stessa quantità di energia è ceduta nel processo di aggregazione dei nucleoni che costituiscono il nucleo.
L’entità dell’energia nucleare di un nucleo corrisponde al difetto di massa registrato quando i nucleoni si aggregano per formare il nucleo stesso. La massa effettiva di un qualsiasi nucleo è, infatti, sempre inferiore alla somma delle masse dei nucleoni componenti. Il difetto di massa è la differenza tra la somma delle masse dei nucleoni che si devono aggregare per formare un nucleo e la massa nucleare effettiva. Per esempio, il nucleo del deuterio ha massa relativa 2,01300, mentre la somma delle masse del protone e del neutrone corrisponde a 2,01595. Il difetto di massa è 0,00295 (Figura 16).
protone + n + n
neutrone Mp = 1,00728 MD = 2,01300
La relazione che consente di calcolare l’energia nucleare a partire dal valore del difetto di massa di un nucleo deriva dalla teoria della relatività di Albert Einstein (1879-1955), secondo cui esiste un’equivalenza tra massa ed energia. La massa si può considerare «una forma di energia»: è possibile che essa si trasformi in energia e che l’energia si trasformi in massa. Tali trasformazioni sono regolate dalla relazione:
energia, la cui unità di misura è il joule
E = m c2
massa, la cui unità di misura è il kilogrammo
la velocità della luce nel vuoto, pari a circa 3,00 108 m/s
Si ha fissione nucleare quando un nucleo pesante si scinde in due nuclei più piccoli di massa simile. Questa trasformazione può avvenire spontaneamente, oppure può essere stimolata bombardando con dei neutroni un nucleo pesante che, in tal caso, si dice fissile. Ne sono esempi l’uranio-235 e il plutonio-239. Quando un neutrone colpisce un nucleo di uranio-235, questo si scinde in due nuclei liberando energia e due o tre neutroni.
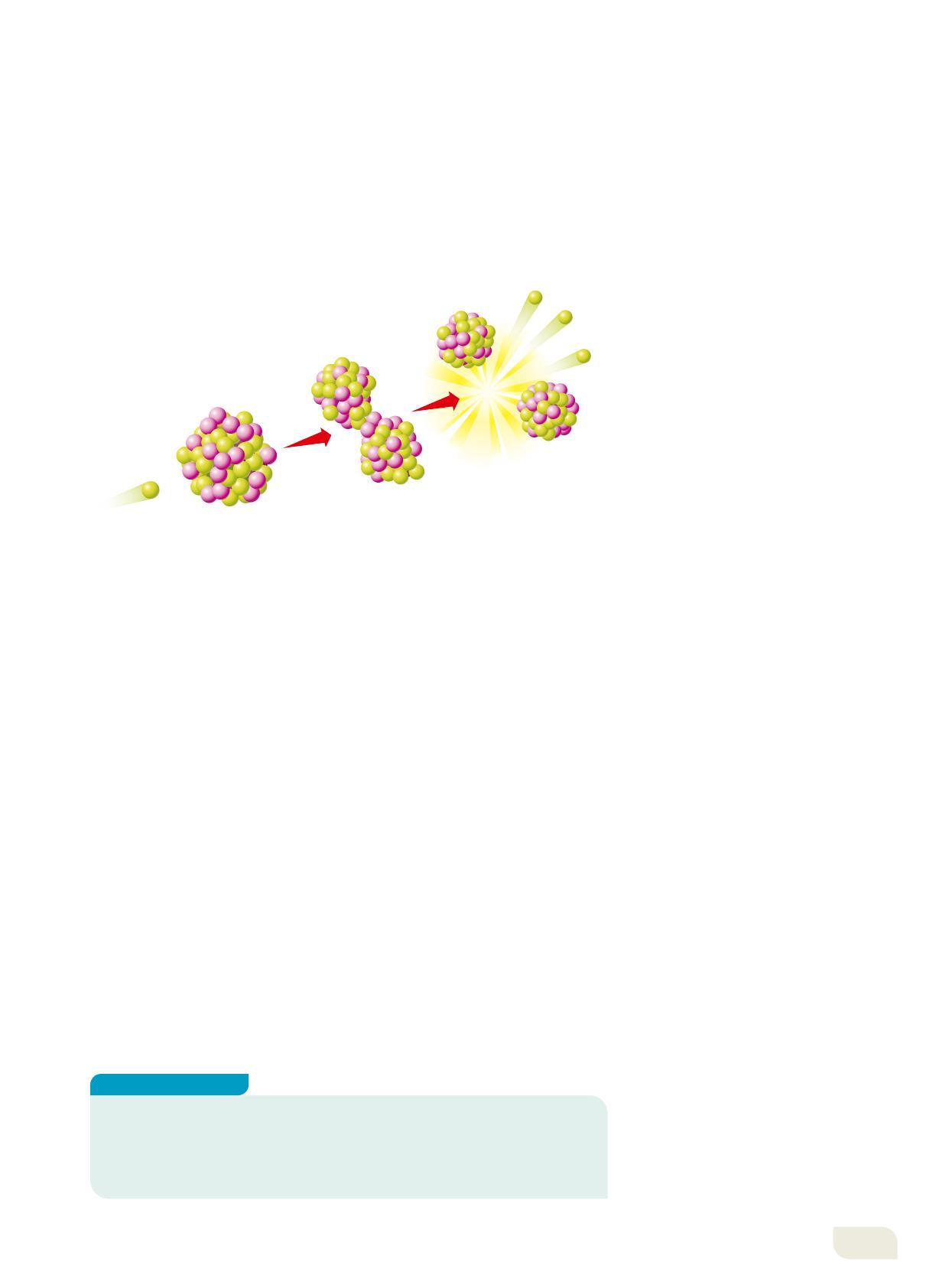
I neutroni emessi all’interno della massa dell’uranio-235 possono urtare altri nuclei e provocarne la fissione con liberazione di altra energia e altri neutroni (Figura 17).
La fissione di un nucleo di uranio-235. I frammenti possono essere anche diversi da Ba-142 e Kr-92.
Se la quantità di elemento radioattivo supera una certa massa, detta massa critica, i neutroni prodotti sono in numero sufficiente a innescare una reazione a catena, cioè la fissione praticamente simultanea di tutti i nuclei fissili, che sfocia in un’esplosione nucleare. La massa critica del plutonio-239, per esempio, è pari a circa 10 kg, ma se l’elemento è circondato da materiale che riflette indietro i neutroni può scendere fino a 4 kg, corrispondente a una sfera delle dimensioni di un’arancia.
Nei reattori nucleari impiegati per produrre energia su larga scala, la reazione a catena viene, invece, controllata in modo che la liberazione di energia termica sia graduale: il calore è quindi convertito in vapore e poi in energia elettrica. Per diminuire il numero di neutroni si ricorre alle barre di controllo costituite di elementi come il boro e il cadmio: quando sono inserite tra le barre di uranio, assorbono un gran numero di neutroni bloccando la reazione a catena. Il rallentamento dei neutroni si ottiene circondando la massa di uranio con un moderatore, come la grafite o l’acqua pesante (D2O).
L’impiego di reattori nucleari per la produzione di energia, benché molto vantaggioso in termini di resa, porta con sé due importanti e gravi problemi: uno connesso con la possibilità di incidenti e uno legato alle scorie di fissione. Dalla reazione di fissione si producono infatti molti nuclei leggeri: isotopi di vari elementi che sono a loro volta instabili e radioattivi (scorie radioattive). Il loro smaltimento rappresenta uno dei principali punti deboli nell’impiego della tecnologia nucleare per la produzione di energia.
L’energia liberata da 1,0 g di uranio-235 (che contiene 2,6 1021 nuclei) corrisponde a circa 8,2 107 kJ. Se volessi ottenere la stessa quantità di energia dal metano, quanti kilogrammi dovresti bruciarne? Considera che 1,0 kg di metano libera 5,2 104 kJ di energia quando viene bruciato. A quale volume di metano corrisponde in condizioni STP?
La reazione di fusione nucleare all’interno del Sole produce un nucleo di elio a partire da deuterio e trizio.
Nelle reazioni di fusione nucleare due nuclei leggeri si fondono per darne uno più pesante. Nella reazione di fusione più comune quattro nucleoni (protoni e neutroni) si uniscono dando luogo alla formazione di un nucleo di elio, 4 2He (Figura 18):
Un nucleo di deuterio, urtando un nucleo di trizio, produce un nucleo di elio e un neutrone. Questo processo libera circa 20 MeV.
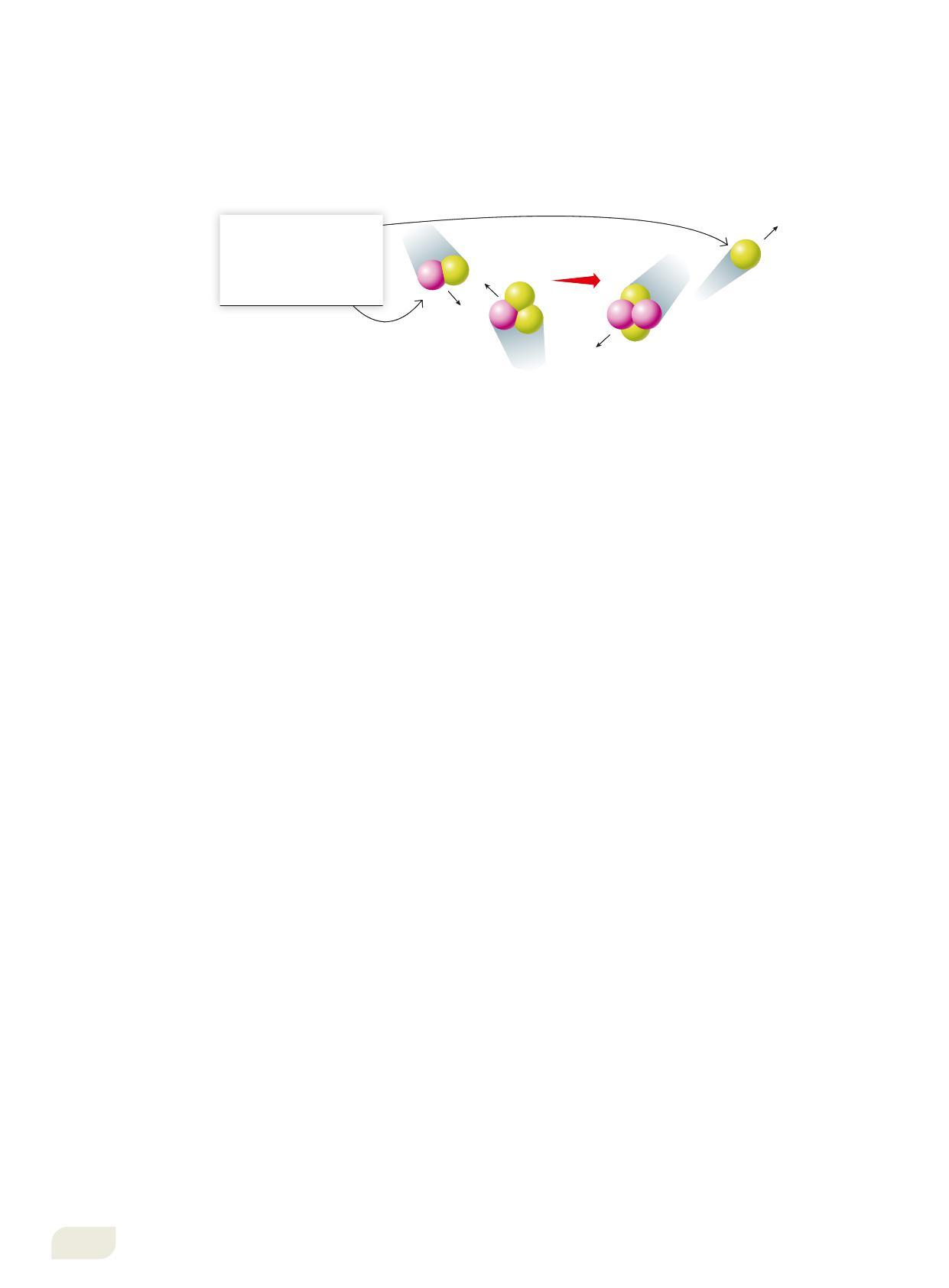
Poiché quando i protoni si avvicinano l’uno all’altro si sviluppa una forte repulsione, nella pratica è molto difficile ottenere la fusione nucleare. Essa avviene invece nel Sole (e in altre stelle) grazie all’elevatissima temperatura che si raggiunge nella sua parte centrale: l’agitazione termica delle particelle, e quindi la loro energia cinetica, è così grande che esse sono in grado di vincere la forza repulsiva che altrimenti le allontanerebbe.
La reazione di fusione nucleare è indubbiamente uno dei processi più studiati negli ultimi decenni. Se si valuta che per ogni mole di elio generata dalla fusione di deuterio e trizio si ricavano 1,7 109 kJ di energia, è facile comprendere quale possa essere l’interesse della comunità scientifica e dell’intera società. Soprattutto se si considera che, a differenza della fissione, la fusione non produce scorie nucleari difficili da smaltire. Si tratterebbe, quindi, di una fonte di energia pulita e praticamente inesauribile.
Lo scoglio da superare per poter utilizzare la fusione nucleare come fonte di energia è la temperatura a cui si innesca la reazione. Nel caso della reazione tra deuterio e trizio questa temperatura è di 200 milioni di gradi. Il problema non è tanto raggiungere queste temperature, ma dove far avvenire la reazione. Non esistono, infatti, materiali capaci di reggere a condizioni tanto estreme.
La soluzione più promettente al momento è quella del confinamento magnetico. Praticamente i gas coinvolti nella reazione vengono ionizzati in modo che siano formati da particelle cariche che possono interagire con un campo magnetico esterno. Si ottiene così un plasma, un particolare stato della materia globalmente neutro, ma formato da particelle cariche allo stato gassoso. Il campo magnetico generato da potenti magneti può tenere confinato il plasma evitando che tocchi le pareti del reattore.
Al momento il reattore a fusione nucleare più avanzato è quello cui si sta lavorando nell’ambito del progetto ITER, un programma internazionale che vede coinvolti Unione Europea, Russia, Cina, Giappone, Stati Uniti d’America, Corea del Sud e India. Si tratta di un reattore sperimentale il cui scopo è verificare l’effettiva possibilità di realizzare la fusione nucleare ricavandone energia.
Nel 2021 ricercatrici e ricercatori del consorzio EUROfusion sono riusciti a ricavare più energia di quella investita, per il confinamento magnetico del plasma, dall’impianto sperimentale JET (Joint European Torus). Si tratta di un risultato molto importante che spinge a pensare che ci troviamo davvero a un passo dalla possibilità di accendere una stella sulla Terra.
La crescente domanda energetica a livello globale ha indotto molti Paesi a considerare l’energia nucleare una delle possibili fonti di approvvigionamento energetico.
I primi reattori nucleari furono costruiti dopo la Seconda guerra mondiale da Stati Uniti, Unione Sovietica, Francia e Gran Bretagna per produrre ordigni atomici. Le potenze nucleari ingaggiarono una corsa agli armamenti che portò alla produzione di bombe atomiche sempre più distruttive, spesso fatte detonare in atmosfera per provarne l’efficacia. A partire dal 1945 sono stati condotti centinaia di test atomici e gli isotopi radioattivi dispersi in atmosfera sono ricaduti sull’intero Pianeta, al punto da essere considerati tra i possibili marcatori per definire l’inizio dell’Antropocene (Figura A). Negli anni Cinquanta si pensò di sfruttare l’enorme quantità di calore prodotto dalle centrali nucleari anche a scopi civili, per generare energia elettrica. Il calore liberato nelle reazioni di fissione poteva infatti essere impiegato per creare un flusso di vapore con cui azionare le pale di una turbina: l’energia termica veniva trasformata in energia meccanica rotatoria, la quale a sua volta, era convertita in elettricità accoppiando la turbina a un alternatore. È lo stesso principio di funzionamento di una centrale a gas o a carbone, ma il calore che alimenta le turbine è prodotto dalla fissione nucleare anziché dalla combustione degli idrocarburi.
La fissione nucleare avviene quando un nucleo pesante si scinde in due nuclei più piccoli di massa simile. Può essere spontanea o stimolata bombardando un nucleo pesante, detto fissile, con dei neutroni. Ne sono esempi l’uranio-235 e il plutonio-239. Colpito da un neutrone, il nucleo di uranio-235 si scinde in due nuclei, liberando energia e due o tre neutroni. L’energia emessa da 1 g di uranio-235 (che contiene 2,6 1021 nuclei) corrisponde quindi a circa 8 107 kJ; per ottenere la stessa quantità di energia bruciando metano ne servirebbero circa 1500 kg. I neutroni emessi all’interno della massa di uranio-235 possono urtare altri nuclei e provocarne la fissione, liberando altra energia e altri neutroni. Se la quantità di elemento radioattivo supera una massa detta critica, i neutroni prodotti sono abbastanza da innescare una reazione a catena, cioè la fissione praticamente simultanea di tutti i nuclei fissili, che sfocia in un’esplosione nucleare. La massa critica del plutonio-239, per esempio, è pari a circa 15 kg.
Nei reattori nucleari il calore prodotto dalla fissione si usa per produrre energia elettrica. Per farlo, occorre controllare la reazione evitando che si verifichi un’esplosione. Per questo si deve ridurre il numero e la velocità dei neutroni che vagano nella massa di uranio rendendo graduale la liberazione di energia termica. Il rallentamento dei neutroni si ottiene circondando la massa di uranio con un moderatore, come la grafite o l’acqua pesante (D2O). Per diminuire il numero di neutroni si ricorre alle barre di controllo, costituite da elementi come il boro e il cadmio: quando sono inserite tra le barre di uranio, assorbono un gran numero di neutroni bloccando così la reazione a catena (Figura B).
Oggi l’energia nucleare fornisce circa il 5% dell’energia primaria e il 10% dell’elettricità consumata nel mondo, ma deve fare i conti con la diffidenza verso la sicurezza delle centrali e con la crescente competitività di fonti energetiche rinnovabili come l’eolico e il fotovoltaico. Nei prossimi anni, inoltre, la progressiva dismissione degli impianti più vecchi costringerà ad affrontare la questione dello smaltimento dei rifiuti radioattivi.
Il problema degli incidenti e dei rischi associati a questa tecnologia va ricercato nella storia, ma anche nelle vicende più recenti che hanno toccato l’Europa e la sua popolazione.
Il 26 aprile 1986 si verificò il più grande incidente atomico della storia, il disastro di C ˇ ernobyl’, nell’ex Unione Sovietica. Secondo le stime dell’ONU, nell’incidente morirono direttamente 65 persone, tra soccorritori, vigili del fuoco e addetti ai lavori. Le scorie radioattive rilasciate in atmosfera furono trasportate in tutta Europa, mentre la popolazione ucraina convive ancora con malformazioni, tumori, problemi alle gravidanze, contaminazioni di piante e animali. L‘11 marzo 2011 anche il Giappone visse la paura di un rilascio radioattivo, a seguito dello tsunami che si abbatté sulle sue coste orientali causando la fuoriuscita di ingenti livelli di radioattività dall’impianto di Fukushima Dai-ichi.
Più recentemente, la guerra in Ucraina scoppiata nel 2022, con lo schieramento delle truppe russe e gli attacchi militari diretti alla centrale atomica di Zaporizhzhia, la più grande del continente europeo, hanno riportato l’attenzione e acceso la paura del rilascio di materiale radioattivo, mettendo di nuovo la comunità internazionale di fronte ai rischi, per la salute e per l’ambiente, che possono derivare dalla presenza delle centrali nucleari.
Il fungo atomico prodotto dalla detonazione di XX-10 Priscilla, una bomba atomica di 37 kilotoni esplosa il 24 giugno 1957 nel Nevada Proving Grounds, USA. Priscilla è stata sospesa a circa 200 m di altezza sopra al deserto del Nevada prima della detonazione.

vapore acqueo
barra di controllo alzata barra di controllo abbassata
liquido refrigerante
combustibile nucleare moderatore barriera di protezione della radiazione
Schema di funzionamento di un reattore. Le barre rosse costituiscono il combustibile fissile, quelle verdi le barre di controllo. Più una barra è abbassata, tanto più diminuisce la quantità di neutroni liberi, perché vengono assorbiti dalla barra stessa.
Tutte le attività che sfruttano l’energia nucleare producono rifiuti radioattivi (o scorie) che possono costituire un pericolo per l’ambiente e per la salute umana. In ambito civile, circa il 90% dei rifiuti radioattivi è generato nelle centrali nucleari, il restante 10% deriva da attività mediche, industriali o di ricerca scientifica. Le scorie radioattive sono classificate in due categorie:
• i rifiuti a bassa attività, che contengono modeste concentrazioni di isotopi radioattivi a vita breve, cioè con tempi di dimezzamento non superiori a 30 anni;
• i rifiuti ad alta attività, che contengono elevate concentrazioni di isotopi a vita lunga, che restano radioattivi per decine o anche centinaia di migliaia di anni.
La gestione dei rifiuti a bassa attività si basa sull’assunzione che restino pericolosi per circa 300 anni: occorre attendere dieci volte il tempo di dimezzamento dei radionuclidi affinché i livelli di radioattività sia paragonabili a quelli della radioattività naturale. In molti Paesi si è deciso di confinare in bunker tecnologici i rifiuti radioattivi a bassa attività, cioè ogni oggetto irradiato in una centrale nucleare o, in misura minore, nei laboratori scientifici e industriali, e nei reparti ospedalieri di radiologia – guanti, tute e stivali degli operatori, attrezzi e macchinari, persino i muri e le tubature delle centrali dismesse – è radioattivo.
Anche l’Italia ha deciso di affidarsi a un deposito di superficie per smaltire i rifiuti radioattivi, prodotti in gran parte dalle quattro centrali nucleari spente nel 1987, dopo il referendum che ha sancito l’uscita del Paese dal club dei produttori di energia atomica. Si tratta di quasi 100000 metri cubi di scorie radioattive attualmente custodite in una ventina di depositi provvisori. Il primo passo è stato compiuto con la pubblicazione della Carta Nazionale delle Aree Potenzialmente Idonee (CNAPI), da cui sono state escluse le zone a elevato rischio sismico, idrogeologico e vulcanico, le aree a oltre 700 metri di altitudine o con pendenze maggiori del 10%, le località a meno di 5 km dal mare o in prossimità di centri abitati, autostrade, ferrovie, aeroporti, dighe, siti industriali e militari, aree naturali protette. Considerando la presenza di habitat e specie a rischio, produzioni agricole di pregio e luoghi di interesse storico o archeologico, sono state individuate le 67 macroaree con minori criticità. Una volta che il luogo sarà definito, i rifiuti radioattivi saranno inglobati in una matrice cementizia e sigillati in contenitori metallici (prima barriera), che a loro volta saranno sistemati in grandi blocchi di calcestruzzo speciale (seconda barriera). I blocchi saranno impilati in celle in cemento armato (terza barriera) e l’intera struttura sarà ricoperta con più strati di materiali isolanti (quarta barriera) per evitare infiltrazioni d’acqua, che potrebbero corrodere i contenitori.
Sebbene circa il 95% delle scorie nucleari sia composta da rifiuti a bassa attività, i maggiori problemi di smaltimento derivano dalla frazione di rifiuti ad alta attività, per la loro lunga emivita. Si tratta soprattutto del combustibile esausto (ormai incapace di sostenere la fissione) impiegato nei reattori nucleari, che ogni due/tre anni va sostituito. Si stima che un tipico reattore di una centrale nucleare produca ogni anno 25-30 tonnellate di combustibile esausto (nel mondo si sono già accumulate almeno 400 000 tonnellate di scorie ad alta attività). Parte del combustibile esausto prodotto in Italia, circa 400 metri cubi di materiale, oggi si trova negli impianti di Sellafield (Regno Unito) e La Hague (Francia), dove viene trattato chimicamente per recuperare gli elementi più pregiati, come l’uranio e il plutonio (Figura C). Ciò che avanza dovrà rientrare in Italia entro il 2025. Ancora una vota si tratterà però di una sistemazione provvisoria, perché i de-
positi di superficie non sono idonei a contenere le scorie ad alta attività. Abbandonata l’idea di ricorrere a espedienti pericolosi e impraticabili come spedire le scorie nello spazio o inabissarle nelle fosse oceaniche, oggi i rifiuti sono accumulati, non senza rischi, in depositi provvisori o in speciali vasche di raffreddamento costruite accanto alle centrali: l’incidente di Fukushima, per esempio, danneggiò anche alcune di queste vasche, e da allora i tecnici giapponesi sono impegnati nel rimuovere il combustibile nucleare che si trovava al loro interno. Il fatto è che nessuna barriera artificiale può resistere alle radiazioni e al calore sprigionati per millenni dai rifiuti ad alta attività, cosicché oggi si ritiene che l’unica opzione a lungo termine sia confinare le scorie in un deposito geologico, ovvero seppellirle in conformazioni rocciose geologicamente stabili e impermeabili. L’unico deposito geologico operativo esistente al mondo si trova nel Nuovo Messico (Stati Uniti) a quasi 700 metri di profondità. È noto come Waste Isolation Pilot Plant (WIPP) ed è un impianto militare per la custodia di rifiuti bellici contaminati da plutonio, la cui struttura e il cui funzionamento sono coperti in gran parte da segreto.
Smaltire i rifiuti ad alta attività, destinati a restare radioattivi per centinaia di migliaia di anni, resta un problema senza soluzione. Per superare questi problemi, nel 2000 il Dipartimento dell’Energia degli Stati Uniti d’America ha promosso un forum internazionale, il GIF («Generation IV International Forum»), per progettare e sperimentare reattori a fissione innovativi che potranno stabilire come saranno fatte, nei prossimi anni, le centrali di quarta generazione. Queste dovranno:

• essere più protette di quelle attuali nei confronti di incidenti, attacchi o sabotaggi;
• non creare, come sottoprodotti, materiali radioattivi (per esempio plutonio-239) utilizzabili per la costruzione di armi;
• minimizzare la produzione di scorie radioattive a vita media;
• essere vantaggiose dal punto di vista economico.
La chiave per superare i pericoli del nucleare potrebbe essere la costruzione di minireattori, che invece di generare 1 GW di potenza ne producano 300 MW o meno e che siano distribuiti in reti formate da moltissimi nodi. I piccoli impianti sono più facili da gestire e possono più efficacemente incorporare delle misure di sicurezza intrinseche, cioè basate su fenomeni fisici che «funzionano» sempre, come la convezione, la gravità, la resistenza di certi materiali alle alte temperature.
ELETTRONE (e-)
• massa 9,109 10-31 kg
• carica negativa: -1,602 10-19 C
NEUTRONE (n)
• massa 1,675 10-27 kg
• carica: nessuna (0 C)
PROTONE (p+)
• massa 1,673 10-27 kg
• carica positiva: +1,602 10-19 C
Usa le parole evidenziate nella mappa per costruire il glossario del capitolo. Puoi realizzarlo sul tuo quaderno oppure su un file condiviso con la classe.
LEGGE DI COULOMB F d kQQ 2 12 =
ATOMO formato da particelle cariche
• leggeri, occupano lo spazio vuoto ruotando intorno al nucleo
• bilanciano la carica positiva del nucleo
NUMERO ATOMICO (Z)
è il numero di protoni nel nucleo Z identifica ogni elemento (X)
TEMPO DI DIMEZZAMENTO (t1/2)
detti NUCLEONI perché sono nel NUCLEO
protoni + neutroni: NUMERO DI MASSA (A)
A Z X
nel NUCLEO sono concentrate tutta la CARICA POSITIVA e la MASSA dell’atomo
A = Z + n
Xn+ CATIONE (ione con carica +) perde e-
XnANIONE (ione con carica -) acquista e-
tempo per ridurre di 1/2 la quantità di isotopo, utilizzato per la datazione dei reperti archeologici e delle rocce
DECADIMENTO a
Z 2 83 e A 2 220
Z " diminuisce di 2
A " diminuisce di 4
ISOTOPI atomi con stesso Z e diverso A stesse proprietà chimiche masse atomiche diverse proprietà fisiche diverse
EQUAZIONE NUCLEARE
• somma A reagenti = somma A prodotti
• somma Z reagenti = somma Z prodotti
DECADIMENTO b nucleo troppo ricco di n rispetto ai p+
Z " aumenta di 1
A " rimane invariato
EMISSIONE b+ o cattura elettronica nucleo troppo ricco di
p+ rispetto ai n
Z " diminuisce di 1
A " rimane invariato
può trasformarsi nel nucleo di un altro elemento attraverso il DECADIMENTO RADIOATTIVO
EMISSIONE c avviene dopo
DECADIMENTO a o b
Z " rimane invariato
A " rimane invariato
1 Come si comportano due bacchette di plastica strofinate con un panno di lana?
2 Indica due fenomeni della tua vita quotidiana riconducibili all’elettrizzazione per strofinio.
3 Al supermercato capita di prendere la «scossa» toccando il carrello mentre è in movimento.
a) Perché?
b) Perché ciò non avviene se, anziché toccare il metallo del carrello, tocchiamo il rivestimento di plastica?
4 Tra due cariche elettriche si stabilisce una forza di 16 N. Se l’intensità di una carica raddoppia, il valore della forza diventa:
A 8 N
B 16 N
C 32 N
D 64 N
5 Due corpi distanti hanno entrambi carica + 1 C e sono posti alla distanza di 1 m.
a) Quale tipo di forza si stabilisce tra loro?
b) Qual è il suo valore?
c) Quale valore assume se i due corpi vengono portati alla distanza di 2 m?
6 Come varia l’intensità della forza F che si stabilisce tra due corpi di carica Q1 e Q2 se raddoppiano entrambe la quantità di carica e raddoppia anche la distanza?
7 Quando strofiniamo i piedi su un tappeto, trasferiamo elettroni alle nostre scarpe e acquistiamo una carica di 2,0 10-6 C.
a) Ci carichiamo positivamente o negativamente?
b) Quanti elettroni vengono trasferiti?
8 Quanti elettroni ha acquistato una bacchetta di vetro, elettrizzata per strofinio, che possiede 2,64 109 cariche negative?
• Qual è la carica elettrica della bacchetta di vetro?
9 Quando si trasferiscono elettroni da un corpo a un altro, si crea una differenza in accumulo di cariche, ossia una differenza di potenziale elettrico, con un eccesso di cariche, negative da una parte e positive dall’altra.
Indica in quale dei tre casi seguenti la differenza di potenziale è maggiore, se gli elettroni trasferiti sono rispettivamente:
a) 1200 b) 1,2 105 c) 12 103

10 Nel risolvere gli esercizi 8 e 9 bisogna fare riferimento a un importante principio. Quale?
11 Se il rapporto carica/massa, misurato da Thomson, fosse dipeso dalla natura del gas nel tubo, si sarebbe dedotto che le particelle portatrici di elettricità
A sono presenti in tutti gli atomi.
B hanno tutte la stessa carica ma diversa massa.
C possono avere carica positiva.
D sono diverse a seconda dell’elemento chimico di provenienza.
12 Cambiando il tipo di gas nel tubo catodico a pressione bassissima, la natura dei raggi catodici e il loro comportamento non si modificano.
• Sapresti spiegare perché?
13 La costante di Faraday (F ) corrisponde alla carica trasportata da una mole di elettroni (NA e -).
• Quanto vale F ?
14 Robert Millikan determinò la carica di un elettrone studiando la velocità di caduta di minuscole goccioline d’olio che acquistavano elettroni provenienti dalla ionizzazione di un gas provocata da raggi X.
• Determina il numero di elettroni presenti su una gocciolina di olio con carica 9,6 10-19 C.
15 Quali sono le particelle fondamentali dell’atomo?
16 Confronta protone e neutrone dal punto di vista della carica e della massa.
17 Moltiplicando la massa del protone per 3,0 1027 , esso peserebbe 5,0 kg, come una palla da bowling.
• Quale sarebbe la massa di un elettrone rispetto a questo protone ingrandito?
18 Indica quanti elettroni occorrono per avere la stessa massa di un protone.
• Esiste un elemento che ne possiede così tanti?
19 Quale contributo diede il fisico inglese James Chadwick alla scoperta delle particelle subatomiche?
20 Nei tubi di scarica, i raggi positivi hanno origine:
A dall’elettrodo positivo o anodo.
B dalla parete di vetro che sta davanti al catodo.
C dal metallo che forma gli elettrodi.
D dal gas contenuto nel tubo.
21 Se l’atomo avesse un diametro di circa 1 km, quale sarebbe il diametro del suo nucleo?
22 Un atomo di idrogeno è costituito da un protone e da un elettrone. Conoscendo la massa del protone e quella dell’elettrone, quanti atomi di idrogeno ci sono in 1,00 g dell’elemento?
23 Da che cosa è costituita una particella a?
24 In che cosa il modello di Rutherford è ancora valido?
25 L’atomo di alluminio ha un diametro di 3,0 10-8 cm, quello del suo nucleo è 2,0 10-13 cm.
• Qual è il rapporto fra i due diametri?
26 Se l’atomo di Thomson fosse una sfera omogenea carica di elettricità positiva in cui sono immersi gli elettroni, le particelle alfa
A sarebbero deviate in gran parte dalla carica distribuita nell’atomo.
B sarebbero respinte in gran parte dalla carica distribuita nell’atomo.
C attraverserebbero la lamina quasi indisturbate.
D sarebbero attratte dalla carica negativa concentrata in una piccola regione dell’atomo.
27 Se il rapporto tra diametro del nucleo e quello dell’atomo è 1 a 105, qual è il rapporto tra il volume del nucleo e il volume dell’atomo? (Vsfera = 4/3 r r3)
28 Descrivi l’esperimento grazie al quale Rutherford costruì il modello atomico che porta il suo nome.
29 Se l’atomo fosse come ipotizzato da Thomson:
a) in quale o quali posizioni le particelle alfa colpirebbero lo schermo?
b) come riprogetteresti l’apparecchio di Rutherford?
30 Usando lamine di metalli diversi, si misurano angoli di deviazione diversi. Come interpreti questo fatto?
31 La deviazione subita dalle particelle a è analoga alla collisione tra due palle da biliardo? Spiega.
32 Sia per Thomson sia per Rutherford, l’atomo è costituito da
A elettroni, protoni e neutroni.
B protoni e neutroni, che formano il nucleo.
C un numero uguale di protoni e di elettroni.
D una sola particella subatomica: l’elettrone.
33 Determina la densità del nucleo di un atomo di oro sapendo che il diametro dell’atomo è 288 pm.
34 Come si definisce il numero atomico Z ?
35 Da chi sono stati misurati i numeri atomici? Come?
36 Che cosa si intende con il termine nucleoni?
37 Individua il numero di protoni ed elettroni delle seguenti specie chimiche.
a) P
b) Na+
c) O2-
38 Quanti sono protoni, neutroni ed elettroni di 40Ar?
39 Quali sono le caratteristiche degli isotopi?
40 Scrivi i seguenti simboli:
a) un isotopo del bromo con 46 neutroni;
b) un isotopo neutro con 9 elettroni e 10 neutroni;
c) un isotopo con A = 33 e 16 protoni.

41 Quanti e quali sono gli isotopi dell’idrogeno?
42 Scrivi il simbolo dei seguenti isotopi.
a) Il carbonio con numero di massa 11.
b) Lo iodio con 75 neutroni.
c) Un atomo elettricamente neutro con 18 protoni e 22 neutroni.
d) Un atomo elettricamente neutro con 7 elettroni e 7 neutroni.
e) Il cloro-35 con un elettrone in più rispetto all’atomo neutro.
f) Il bario con 2 cariche positive e 81 neutroni.
43 Definisci i termini decadimento radioattivo e radioattività.
44 In che cosa differiscono i raggi a, b e c?
45 Quale tra i seguenti isotopi ha un nucleo instabile?
A 56 26Fe B 23 11Na C 222 86Rd
46 Quale tra i seguenti è un isotopo stabile?
A Z = 10 A = 20
B Z = 50 A = 97
C Z = 80 A = 227
D Z = 1 A = 3
47 Perché i raggi c, se sottoposti all’azione di un campo elettrico esterno, non mostrano deflessione ma si propagano sempre in linea retta?
48 Quali, tra le radiazioni emesse da un nucleo radioattivo, possono essere arrestate solo da uno schermo di piombo? Quali hanno il minor potere penetrante?
49 Quali sono i principali tipi di decadimento?
50 Quale tipo di particelle emettono gli atomi ricchi di neutroni quando decadono?
51 Quali nuclei decadono emettendo particelle a? Quali conseguenze provoca il decadimento a?
52 Quale tipo di decadimento si verifica in un elemento che possiede un numero di protoni molto elevato rispetto al numero di neutroni?
d) Ba2+ e) Si f) F-
53 Il carbonio14 subisce decadimento b.
a) Quali sono Z e A del nucleo prodotto?
b) Qual è l’elemento?
54 Il boro-12 decade e si trasforma in carbonio-12.
• Quale particella emette il nucleo?
55 Qual è il prodotto del decadimento del radon-220, che emette particelle a?
56 A quale tipo di decadimento è più facile che vada incontro un nucleo di radon-222?
57 Completa l’equazione. Di che decadimento si tratta?
40 19K $ 40 20Ca +
58 Il fluoro-18 è un radionuclide artificiale del fluoro. È estremamente instabile, ha t1/2 = 110 minuti e si usa in medicina nucleare per condurre esami PET. Il decadimento del 18F porta alla formazione di 18O.
• Quale tipo di decadimento si verifica?
59 James Chadwick, bombardando il berillio con particelle a, scoprì il neutrone. La reazione nucleare
è: 9 4Be + 4 2a $ a bX + 1 0n.
• Trova i valori di a e b e identifica l’elemento X.
• Rutherford, prima di Chadwick, aveva operato in modo simile con l’azoto. Completa l’equazione:
14 7N + 4 2a $ 17 8O + ..................
60 Il nettunio, Np, primo degli elementi transuranici, fu ottenuto nel 1940 bombardando con neutroni nuclei di uranio-238. L’uranio, acquistando un neutrone, si trasforma in uranio-239, che spontaneamente decade secondo l’equazione: 239 aU $ b cNp + -1 0 e
• Individua i valori corretti di a, b, c.
61 Un isotopo radioattivo ha t1/2 = 36,0 min.
• Quale frazione della sua quantità originaria rimane dopo 108,0 min?
62 La radioattività di un certo campione si è ridotta a 32 1 rispetto a quella di partenza.
• Quanti t1/2 sono trascorsi?
63 Nel fallout radioattivo (ricaduta a terra del materiale radioattivo per effetto della gravità o delle precipitazioni) che segue a un’esplosione atomica, si libera stronzio-90, con t1/2 = 29 anni. È pericoloso perché tende a sostituirsi al calcio delle ossa.
• Qual è la quantità residua di un campione di 90,0 g di stronzio-90 dopo 87 anni?
64 Il fosforo-32 ha t1/2 = 14 giorni. In quanti giorni il campione si riduce a 1 4 della quantità iniziale?
65 Quale particella manca nella seguente equazione?
27Al + $ 30P + 1n
66 Completa le seguenti reazioni di decadimento radioattivo, suddivise per tipologie.
a) Decadimento a 222
b) Decadimento b
214Pb $ + -1e
3H $ + -1e
c) Cattura elettronica
55Fe + -1e $ ....................
57Co + -1e $
d) Emissione c
99Tc $ + 0c
113In $ .................... + 0c
67 Il grafico rappresenta le curve di decadimento di due elementi radioattivi, A e B, presenti in un campione.
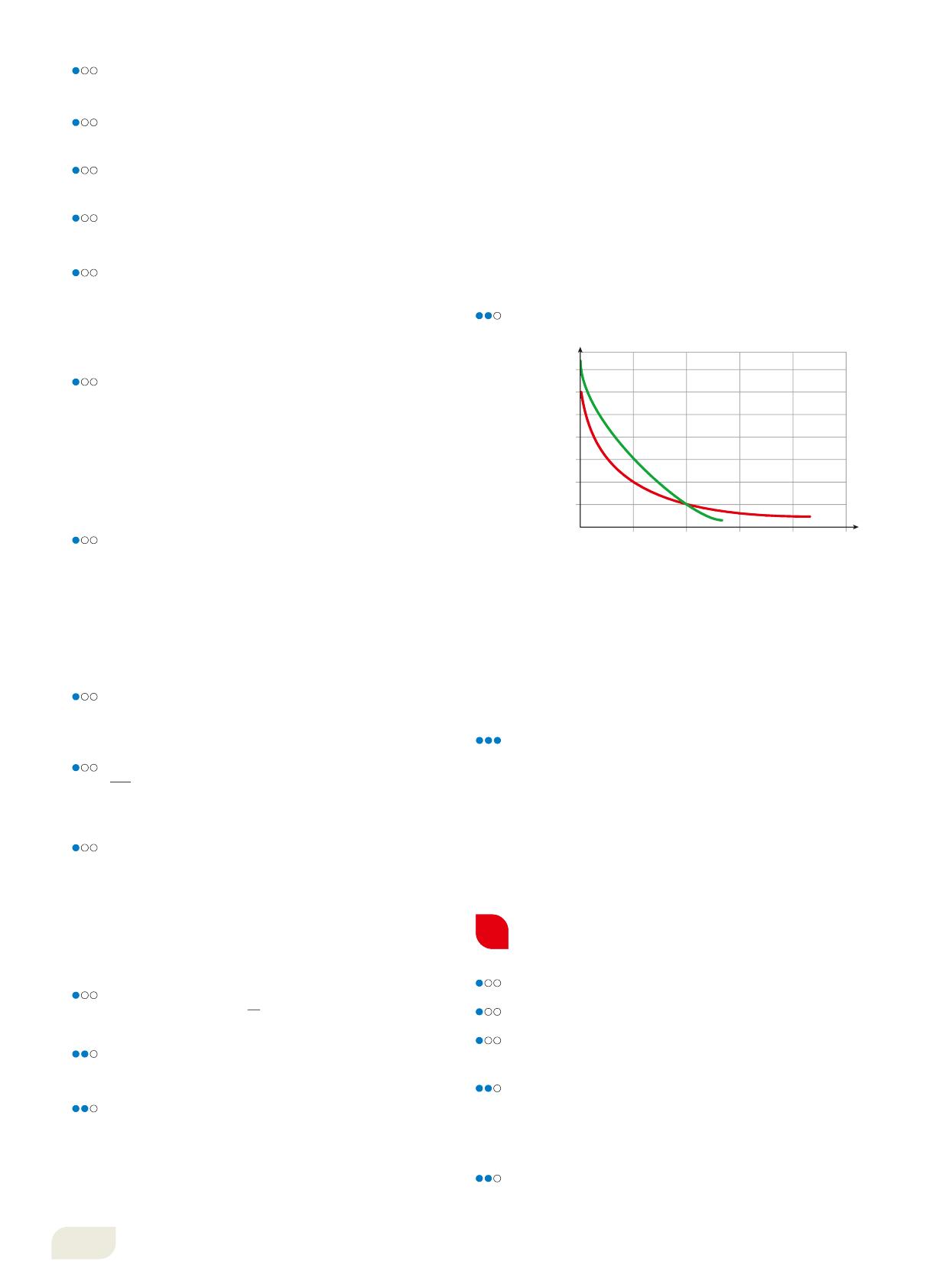
a) Quale elemento era il più abbondante, all’inizio, nel campione?
b) Dopo quanti anni le quantità di A e B sono uguali?
c) Quanti atomi dell’elemento A e quanti dell’elemento B sono rimasti dopo 106 anni?
d) Quale ha t1/2 minore?
68 Lo iodio-131 (t1/2 = 8 giorni) si usa nella diagnosi e nella cura di alcune patologie della tiroide, che usa lo ione ioduro per produrre ormoni.
a) Se a un paziente sono somministrati 1,4 10-5 g di 131I, quale sarà la quantità residua dopo 32 giorni?
b) A quale tipo di decadimento andrà incontro?
c) Quali sono Z e A del nucleo prodotto? Di quale elemento si tratta?
8
L’ENERGIA NUCLEARE
69 Che cos’è l’energia nucleare?
70 Che cosa si intende per difetto di massa?
71 A che cosa corrisponde l’energia in gioco in una trasformazione nucleare?
72 Un nucleo di uranio-235 è colpito da un neutrone e subisce fissione, formando un nucleo di tellurio-137 e uno di zirconio-97.
• Quanti neutroni si liberano dalla fissione?
73 Qual è la differenza tra decadimento radioattivo e fissione nucleare?
74 Supponiamo che un atomo, per esempio di idrogeno, abbia un raggio atomico dell’ordine di 10-10 m e un raggio nucleare dell’ordine di 10-15 m. Determina:
a) il volume dell’atomo e il volume del nucleo;
b) la parte del nucleo espressa come percentuale del volume dell’atomo;
c) la densità dell’atomo di idrogeno e la densità del suo nucleo (per la massa dell’atomo di idrogeno assumi il valore di 1,67 10-27 kg e considera la massa dell’elettrone trascurabile);
d) il raggio che avrebbe la Luna se avesse la densità del nucleo dell’atomo di idrogeno. La massa della Luna è 7,34 1022 kg e il suo raggio è 1,74 106 m.
75 Determina l’energia liberata nella formazione di una mole di elio-4 con massa 4,0026 in joule e in elettronvolt.
a) Quanti litri di metano misurati a STP occorrono ottenere la stessa quantità di energia?
(La combustione del metano libera 890 kJ mol-1.)
b) Il contenuto di una nave metaniera sarebbe sufficiente?
L’attività A di un materiale radioattivo, cioè il numero di decadimenti che avviene in un secondo, si misura in becquerel (Bq). L’attività è direttamente proporzionale a una costante k, che dipende dal tempo di semitrasformazione del nuclide, e al numero di nuclei radioattivi presenti:
A = k N. È possibile determinare il valore della costante di decadimento con l’espressione: k = 0,693/t1/2 (s -1). Con queste informazioni risolvi i problemi 76, 77 e 78.

76 L’arsenico è un elemento tossico. La quantità che produce effetti tossici nell’uomo è pari a 50 mg. Il 75Se è un radioisotopo del selenio impiegato come radiofarmaco in medicina nucleare e decade con un T1/2 di 118,5 giorni a 75As.
a) Qual è il tipo di decadimento?
b) Se ad un paziente vengono somministrati 300 MBq di 75Se, supponendo, che tutto il 75Se decada ad arsenico nel corpo del paziente (la maggior parte viene escreta), calcola quanti mg di As si formano e stabilisci se esistono pericoli di intossicazione.
77 Le banane sono tra i frutti più radioattivi in natura. La radioattività delle banane è così intensa che un carico di banane può far scattare i detector di porti e aeroporti per verificare che non si stia trasportando illegalmente materiale radioattivo. Il contenuto di potassio nelle banane è pari a 385 mg/100 g. Sono noti tre isotopi naturali del potassio, due stabili (39K e 41K ) e uno radioattivo, 40K. La sua abbondanza percentuale è di 0,01%, ha una massa pari a 39,964 e decade con una emivita di 1,25 $ 109 anni.
• Determina la radioattività iniziale di una tonnellata di banane.
78 Il radon (Rn) è un gas radioattivo naturale, incolore e inodore, con un tempo di emivita di 3,82 giorni, che deriva dal decadimento dell’uranio-238. È otto volte più pesante dell’aria ed è presente in tutta la crosta terrestre. È considerato il contaminante radioattivo più pericoloso negli ambienti chiusi e si stima che sia responsabile di quasi il 50% dell’esposizione media della popolazione mondiale alle sorgenti naturali di radiazione.
a) Come decade il radon-222?
b) Calcola la concentrazione media del radon-222 in g/m3 nelle abitazioni italiane, in cui la sua radioattività media è 75 Bq/m3
c) La direttiva 2013/59/ Euratom fissa il valore limite oltre il quale attivare misure di prevenzione a 300 Bq/m3. Quanti nuclei di radon-222 producono questa attività in un metro cubo d’aria?
79 L’americio-241 si usa nei rivelatori di fumo, perché emette particelle alfa che rendono conduttrice l’aria in prossimità del rivelatore.
a) Qual è il prodotto del decadimento?
b) Che cosa accade in presenza di fumo?
80 Nei prossimi anni occorrerà individuare un deposito nazionale per i rifiuti radioattivi che dovrà contenere, in modo temporaneo, i rifiuti delle centrali nucleari dismesse come plutonio e nettunio.
a) Il tempo di dimezzamento del plutonio (239Pu) è di 24 100 anni. Partendo da 100 kg di plutonio, quanti kg rimangono dopo 96 400 anni?
b) Sapendo che il nettunio (237Np) ha t1/2 di 2 144 000 anni, quanti anni occorrono perché perda il 75% della sua radioattività?
81 Le radiazioni ad alta energia, oltre agli scopi medici, si usano in ambito alimentare. Il sito web del Ministero della Salute italiano cita: «L’irradiazione è un trattamento fisico degli alimenti effettuato con radiazioni ionizzanti ad alta energia, in grado di inattivare gli enzimi degradativi presenti nell’alimento ritardandone il deterioramento e di inibire la moltiplicazione dei microrganismi».
a) Secondo la normativa italiana, quali alimenti si possono trattare con le radiazioni ad alta energia? E secondo quella europea?
b) Quali sono i rischi, le paure e le informazioni scientifiche in merito alla sicurezza di questi trattamenti? Fai una ricerca in rete.
82 La trasformazione di un isotopo in un altro, trasmutazione, può avvenire per bombardamento di nuclei con particelle ad alta energia accelerati in un campo elettrico. Al momento dell’impatto si forma un nucleo composto che tende a liberarsi dell’energia in eccesso con un processo di decadimento.
a) Quale nucleo composto si forma per la cattura di particelle alfa da parte di nuclei di azoto-14?
b) Quale prodotto si ottiene da questo nucleo composto per perdita di un protone? E per perdita di un neutrone?
83 Lo ione potassio, K+, un nutriente essenziale per il corpo umano, si trova nel cibo come KCl. Uno degli isotopi naturale di K, il potassio-40, è radioattivo. La sua abbondanza naturale è di 0,0117%.
a) Qual è il numero di protoni, neutroni ed elettroni di 40K+ ?
b) Quanti ioni 40K+ sono presenti in 10,0 g di KCl?
c) Il potassio-40 subisce un decadimento per cattura elettronica, per emissione beta e per emissione di positroni. Scrivi le equazioni nucleari relative.
84 Nel Sole l’energia è prodotta grazie a un processo di fusione, detto reazione protone-protone, durante il quale quattro nuclei di idrogeno si fondono in un nucleo di elio. La prima tappa di tale processo è:
1 1H + 1 1H $ a bX + +1 0 e
a) Quale tipo si emissione di verifica?
b) Quali sono i valori di a, b?
c) Che cos’è X?
85 L’elemento X è costituito da un solo isotopo. Un suo composto con il magnesio, Mg (MA = 24,31), che ha formula MgX2 , contiene il 61,00% di X. Determina:
a) il numero delle moli di Mg e di X presenti in 100 g di composto;
b) la massa molare e la massa atomica di X;
c) il simbolo di X, il numero di massa e il numero di elettroni dell’atomo neutro.
86 Il polonio, 214 84Po, per emissione alfa si trasforma in un isotopo del piombo che a sua volta decade a 210Bi.
• Scrivi le equazioni nucleari di entrambi i processi.
87 Assumi, per la distanza media tra due protoni nel nucleo dell’uranio, il valore di 7,0 $ 10-15 m.
a) Determina il valore della forza di natura elettrica che si instaura tra i protoni.
b) Di che genere è la forza?
88 L’espressione matematica della legge di Coulomb ricorda quella della legge di gravitazione universale
FG d mm 2 12 = , dove G = 6,67 10-11 M m2 kg-2
a) Indica differenze e analogie tra queste leggi.
b) Una bacchetta di plastica e una di vetro, ciascuna con una massa di 1,0 kg, si trovano a una distanza di 10 cm. La bacchetta di plastica viene strofinata con un panno di lana e si carica con una carica q = 1,0 10-6 C, quella di vetro assume una carica uguale ma di segno opposto. Tra le bacchette è maggiore l’attrazione elettrica o gravitazionale? Formula un’ipotesi e verificala svolgendo i calcoli.
c) Secondo te, le conclusioni ottenute sono valide anche per le forze di attrazione che si possono stabilire tra un protone e un elettrone?
89 Metti a confronto i dispositivi usati per lo studio dei raggi catodici e per l’esperimento di Goldstein.
90 Metti a confronto le caratteristiche delle tre principali particelle subatomiche.
91 Realizza una tabella per riassumere i vari modelli atomici studiati fino a questo capitolo. Nella prima colonna elenca i modelli proposti, nella seconda le caratteristiche essenziali di ciascuno e nella terza gli esperimenti scientifici a supporto. Puoi aggiungere una colonna con la rappresentazione grafica dei modelli e prevederne una per i limiti del modello. Lascia spazio per ulteriori righe: nei prossimi capitoli miglioreremo la conoscenza dell’atomo.
92 Electric charge can be positive, negative or neutral. True or False?
93 Electrons are the same for atoms of all elements. True or False?
94 Is it correct to say that two materials of the same species, when electrified, repel each other? Why?
95 What does quarks mean?
96 By what instruments was it possible to determine the existence of new subatomic particles?
97 What a nuclide is? Give three examples.
98 Define half-life time.
99 What is the difference between nuclear fission and nuclear fusion?
100 According to Rutherford’s atomic model, what is the arrangement of electrons around the nucleus?
101 Do a brief search and determine which of the alpha, beta, and gamma rays are the most penetrating and what units of measure they have.
102 Why, through the percentage of residual 14C compared to its total amount, is it possible to determine the elapsed time since the organism’s death?
