EduQ
Societat Catalana de Química - Filial de l’Institut
Enllaç químic i estructura
Teaching and learning the concept of chemical bonding
Enlace químico y estructura: construcción de modelos y explicaciones a partir de datos experimentales
Hydrogen bond made visible by molecular modelling

Una incursió en el rerefons històric de les idees de valència, enllaç i estructura
d’Estudis CatalansEducació Química EduQ
Octubre 2015, número 21
Editors
Fina Guitart, CESIRE-CDEC, SCQ, Barcelona
Aureli Caamaño, SCQ, Barcelona
Pere Grapí, INS Joan Oliver, Sabadell
Consell Editor
Josep Corominas, Escola Pia, Sitges
Jordi Cuadros, IQS-URL, Barcelona
Josep Durán, UdG, Girona
Mercè Izquierdo, UAB, Barcelona
Claudi Mans, UB, Barcelona
Àngel Messeguer, CSIC, Barcelona
Neus Sanmartí, UAB, Barcelona
Montse Tortosa, INS Ferran Casablancas, Sabadell
Amparo Vilches, UV, València
Consell Assessor
Consell Assessor Catalunya / Espanya
Joan Aliberas, INS Puig i Cadafalch, Mataró
Miquel Calvet, INS Castellar, Castellar del Vallès
Francesc Centellas, UB, Barcelona
Regina Civil, Escola Sakado, Barcelona
Anicet Cosialls, INS Guindàvols, Lleida
Carlos Durán, Centro Principia, Màlaga
Xavier Duran, TV3, Barcelona
Josep M. Fernández, UB, Barcelona
Dolors Grau, UPC, Manresa
Paz Gómez, INS Provençana, l’Hospitalet de Llobregat
Elvira González, Centro de Ciencias, Bilbao
Pilar González Duarte, UAB, Barcelona
Ruth Jiménez, UAL, Almeria
Teresa Lupión, Centro de Recursos UMA, Màlaga
María Jesús Martín-Díaz, IES Jorge Manrique, Madrid
Conxita Mayós, Departament d’Ensenyament, Barcelona
José María Oliva, UCA, Cadis
Gabriel Pinto, UPM, RSEQ, Madrid
Marta Planas, UdG, Girona
Anna Roglans, UdG, Girona
Núria Ruiz, URV, Tarragona
Olga Schaaff, Escola Rosa dels Vents, Barcelona
Marta Segura, Escola Pia Nostra Senyora, Barcelona
Rosa Maria Tarín, UAB, Barcelona
Romà Tauler, IDAEA-CSIC, Barcelona
Gregori Ujaque, UAB, Barcelona
Nora Ventosa, ICMAB-CSIC, Barcelona
Josep Anton Vieta, UdG, Girona
Consell Assessor Internacional
María del Carmen Barreto, Universitat de Piura, Perú Liberato Cardellini, U. Politecnica delle Marche, Itàlia Agustina Echeverria, Universitat Federal de Goiás, Brasil
Sibel Erduran, Universitat de Bristol, Regne Unit
Odilla Finlayson, Universitat de Dublín, Irlanda
Lidia Galagowsky, Universitat de Buenos Aires, Argentina Marcelo Giordan. Universitat de São Paulo, Brasil
Gisela Hernández, UNAM, Mèxic Èric Jover, Observatori de la Sostenibilitat d’Andorra Isabel Martins, Universitat d’Aveiro, Portugal Eduardo Mortimer, Universitat de Minas Gerais, Belo Horizonte, Brasil
Carlos Javier Mosquera, Universitat Distrital, Bogotà, Colòmbia Fátima Paixão, Castelo Branco, Portugal Vincent Parbelle, Lycée La Martinière, Lió, França Ilka Parchmann, Universitat de Kiel, Alemanya Mario Quintanilla, Pontifícia Universitat Catòlica, Xile Santiago Sandi-Urena, Universitat de Tampa, Florida, EUA Wilson dos Santos, Universitat de Brasília, Brasil Vicente Talanquer, Universitat d’Arizona, EUA
Societat Catalana de Química (SCQ) http://blogs.iec.cat/scq/ President: Carles Bo filial de l’ Institut d'Estudis Catalans (IEC) Barcelona. Catalunya. Espanya
Impressió: Gráficas Rey
ISSN: 2013-1755
Dipòsit Legal: B-35770-2008
ÍNDEX
Editorial
Enllaç químic i estructura .
Fina Guitart, Aureli Caamaño i Pere Grapí
Monografia: Enllaç químic i estructura
Enllaç químic i estructura de les substàncies a l’educació secundària: una crítica a l’ensenyament tradicional i una proposta didàctica alternativa .
Aureli Caamaño
Teaching and learning the concept of chemical bonding
Rachel Mamlok-Naaman, Avi Hofstein i Tami Levy Nahum
Perspective philosophique sur les relations entre structure, propriétés et fonctions .
Bernadette Bensaude Vincent
Enlace químico y estructura: construcción de modelos y explicaciones a partir de datos experimentales .
Vicente Talanquer
Hydrogen bond made visible by molecular modelling
33 Jan Lundell
Una incursió en el rerefons històric de les idees de valència, enllaç i estructura química
Pere Grapí
Enlazando didáctica e historia de la ciencia: clasificaciones y modelos de las uniones químicas en los libros de texto de física y química de secundaria (2007-2016)
Luis Moreno Martínez
Intercanvi
.37
.45

Velocidad de fusión del hielo en distintas disoluciones: un ejemplo de aprendizaje activo de la ciencia 54 Gabriel Pinto i Pascual Lahuerta
In memoriam
Andoni Garritz –membre del Consell Assessor Internacional d’EduQ– va morir el 17 de juliol de 2015. Llicenciat en enginyeria química, doctor en química i professor titular de la Facultat de Química de la Universitat Autònoma de Mèxic, va ser pioner a Mèxic i a Llatinoamèrica en la millora de l'educació científica i l’ensenyament de la química, que va contribuir a difondre a través de la revista Educación Química, de la qual va ser fundador i director, i també a través d’articles a Educació Química EduQ. Hem perdut un gran professor i investigador de la didàctica de la química i un estimadíssim amic, però ens deixa un llegat que ens permetrà tenir-lo sempre entre nosaltres.
Editors i Consell Editord’Educació Química EduQ
Editorial
Monografia: «Enllaç químic i estructura»
estudi de l’enllaç químic i l’estructura de les substàncies és un dels temes del currículum de química de l’ESO i el batxillerat més importants, i un dels que presenta més dificultats conceptuals. La relació entre les propietats de les substàncies i la seva estructura depèn del tipus de partícules que formen la substància i del tipus d’interacció que s’estableix entre elles.
Freqüentment, els llibres de text utilitzen un model d’enllaç que no dóna compte de la interacció electrostàtica que implica qualsevol unió o enllaç entre àtoms o molècules. Es parteix dels models de Lewis i Kossel, que conceptualitzen l’enllaç covalent entre els àtoms d’una molècula com una compartició d’electrons i l’enllaç iònic com una transferència d’electrons d’un àtom molt electronegatiu a un altre molt electropositiu. Aquesta compartició o transferència té com a objectiu que els àtoms enllaçats o els ions resultants tinguin les capes de valència completes amb vuit electrons (regla de l’octet). A banda del caire teleològic d’aquesta explicació, se situa erròniament l’enllaç covalent a les molècules i l’enllaç iònic a un mateix nivell estructural, quan en un cas es produeix en el nivell atomicomolecular i en l’altre, en el multiatòmic o multiònic.
La problemàtica del nivell estructural del qual és convenient partir per a un aprenentatge eficaç dels diferents models d’enllaç químic és un tema a debat. Alguns enfocaments modelitzen l’enllaç partint de les unions entre les partícules atòmiques que constitueixen les substàncies (enfocament «de baix a dalt»), mentre que d’altres modelitzen l’enllaç químic tractant d’elaborar models estructurals i d’enllaç que donin compte de les diferents pro-pietats de les substàncies i, per tant, parteixen del nivell macroscòpic (enfocament «de dalt a baix»).
El present monogràfic pretén mostrar una varietat de maneres d’abordar la modelització de l’enllaç químic i les forces intermoleculars, destacant-ne els inconvenients i els avantatges, i oferir recomanacions didàctiques per millorar els processos de modelització. També pretén abordar el rerefons històric dels diferents models d’enllaç químic per poder situar i diferenciar correctament aquests models en l’àmbit escolar
En l’article «Enllaç químic i estructura de les substàncies a l’educació secundària: una crítica a l’ensenyament tradicional i una proposta didàctica alternativa», Aureli Caamaño reflexiona i analitza les dificultats d’aprenentatge, les concepcions alternatives de l’enllaç químic i algunes dificultats. Proposa una alternativa didàctica centrada en l’enllaç químic com a interacció i com a procés en el nivell estructural adequat.
Rachel Mamlok-Naaman, Avi Hofstein i Tami Levy Nahum, en l’article «Teaching and learning the concept of chemical bonding», consideren que, per tal de millorar la comprensió de l’enllaç, és essencial revisar el contingut científic, l’enfocament pedagògic i els mètodes d’avaluació. Posen el focus en les causes de les concepcions alternatives, en els nous mètodes d’ensenyar el concepte enllaç químic i en les activitats d’avaluació.
L’article «Perspective philosophique sur les relations entre structure, propriétés et fonctions», de Bernadette Bensaude,
destaca la relació causal lineal entre estructura, propietats i funcions que s’utilitza a l’escola i empra la història per desemmascarar els pressupòsits implicats en la seqüència «estructura > propietats > funcions».
Vicente Talanquer, en l’article «Enlace químico y estructura: construcción de modelos y explicaciones a partir de datos experimentales», descriu una seqüència guiada per la necessitat d’involucrar els estudiants d’una manera més activa en la construcció del coneixement. Ha estat implementada en un curs de química general en l’àmbit universitari i parteix del fet que els coneixements es generen a partir de la interpretació d’observacions i mesures.
L’article «Hydrogen bond made visible by molecular modelling», de Jan Lundell, explica com els nous coneixements desafien la nostra manera d’ensenyar l’enllaç d’hidrogen i proposa el modelatge molecular com una eina moderna en els processos atòmics. Aquesta eina permet, tant a l’investigador com a l’estudiant, analitzar com succeeixen els processos en el nivell atòmic i com els canvis que es produeixen impacten en les energies del sistema.
L’article «Una incursió en el rerefons històric de les idees de valència, enllaç i estructura química», de Pere Grapí, pretén explorar les rutes que més significativament van contribuir al desenvolupament d’aquests conceptes posant de manifest que l’itinerari d’aprenentatge sovint no reflecteix l’aproximació històrica.
Luis Moreno Martínez, en l’article «Enlazando didáctica e historia de la ciencia: clasificaciones, modelos y protagonistas de las uniones químicas en los libros de texto de física y química de ESO y bachillerato (2007-2016)», analitza la forma en la qual es presenten els enllaços químics en llibres de text i la seva història.
El número es completa amb l’article d’intercanvi de Gabriel Pinto i Pascual Lahuerta, «Velocidad de fusión del hielo en distintas disoluciones: un ejemplo de aprendizaje activo de la ciencia», en el qual es presenta una experiència que estudia la velocitat de fusió de blocs de gel en diferents solucions aquoses, que introdueix alumnes de diferents nivells educatius en els procediments propis de la metodologia científica.
Esperem que el número sigui del vostre interès i que els articles del monogràfic siguin una mostra enriquidora i útil per iniciar una reflexió entorn de l’ensenyament i l’aprenentatge de l’enllaç químic i l’estructura.



Enllaç químic i estructura de les substàncies a l’educació secundària: una crítica a l’ensenyament tradicional i una proposta didàctica alternativa
Chemical bonding and structure of substances in secondary education: a critique of traditional teaching and a didactic alternative
Aureli Caamaño / Societat Catalana de Químicaresum

L’estudi de l’enllaç químic i l’estructura de les substàncies és un dels continguts conceptuals més importants i també més difícils dels que formen el currículum de química de l’educació secundària obligatòria i el batxillerat. Tanmateix, l’ensenyament tradicional de l’enllaç químic comporta una sèrie de dificultats d’aprenentatge i indueix una sèrie de concepcions alternatives. En aquest article analitzem algunes d’aquestes dificultats i proposem una alternativa didàctica centrada en la integració de l’enllaç químic com a interacció i com a procés en el nivell estructural adequat, alhora que destaquem la importància de relacionar propietats de les substàncies, estructura i enllaç.
paraules clau
Enllaç químic, estructura multimolecular, estructura gegant, regla de l’octet, forces intermoleculars.
abstract
The study of chemical bonding and the structure of substances is one of the most important and the most difficult concepts that make up the chemistry curriculum of compulsory secondary education and high school education. The traditional teaching of chemical bonding involves a series of learning difficulties and induces a series of alternative conceptions. In this article, we look at some of these difficulties and propose an alternative teaching focused on the integration of chemical bonding as integration and as a process in the appropriate level, emphasizing the importance to link substances properties, structure and bonding.
keywords
Chemical bonding, multimolecular structure, giant structure, octet rule, intermolecular forces.
Algunes consideracions crítiques sobre l’ensenyament tradicional de l’enllaç químic
L’enllaç químic és un dels temes més difícils de la química en l’educació secundària i la investigació didàctica ha mostrat que dóna lloc a un ampli ventall de concepcions alternatives
(Riboldi, Pliego i Odetti, 2004; Levy Nahum et al., 2008; Bergqvist et al., 2013; Luxford i Lowery, 2013).
A continuació, fem una descripció de la forma més habitual en què aquest tema es presenta als llibres de text i a les aules i dels problemes conceptuals que comporta.
L’enllaç covalent i l’iònic interpretats a través de la regla de l’octet
Normalment, la formació de l’enllaç covalent entre dos àtoms s’explica com a conseqüència de la compartició d’electrons de la capa de valència per aconseguir que cada un estigui envoltat per vuit electrons a l’última capa.
Cada parell d’electrons compartit dóna lloc a un enllaç covalent, que es representa amb dos punts o amb una ratlla (fig. 1).
La formació de l’enllaç iònic s’explica habitualment com a conseqüència de la transferència d’electrons de la capa de valència d’un àtom (del primer o segon grup de la taula periòdica) a la d’un altre àtom (dels grups 16 o 17) per formar ions de diferent signe amb l’última capa completa amb vuit electrons (fig. 2).
cedeixen o comparteixen electrons amb la finalitat d’adquirir l’estructura del gas noble més pròxim». Aquesta explicació pot acabar conferint involuntàriament un cert caràcter «animista» als electrons, com si fossin entitats que tenen la voluntat d’adquirir una estructura determinada, i ens deixa sempre amb la pregunta: com «saben» els electrons que han de tendir a adquirir l’estructura del gas noble més pròxim? (Caamaño,

Figura 1. Formació de l’enllaç covalent entre dos àtoms de clor per compartició d’un electró de l’última capa de cada àtom. Cada àtom de clor queda envoltat per vuit electrons a l’última capa.

Figura 2. Explicació de l’enllaç iònic per transferència d’un electró de l’última capa d’un àtom de sodi a un altre de clor. Amb aquesta transferència, els ions Na+ i Cl han aconseguit tenir vuit electrons a l’última capa.
Aquesta explicació de la formació de l’enllaç covalent i de l’enllaç iònic es basa en la coneguda regla de l’octet, segons la qual «els àtoms, quan s’uneixen, tendeixen a organitzar les seves capes electròniques externes guanyant, perdent o compartint electrons fins a adquirir l’estructura del gas noble més pròxim».
El principal problema de l’ús de la regla de l’octet per explicar l’enllaç químic és que sovint es presenta o és entesa com un principi teleològic: «Els àtoms
2016a; Talanquer, 2007; Talanquer, 2013).
La justificació que es dóna a la regla de l’octet és que l’estructura dels gasos nobles és molt estable i, per tant, se suposa que l’adquisició per part d’un àtom contigu a la taula periòdica d’una configuració electrònica anàloga a l’última capa li proporcionarà també una estructura més estable. Ara bé, una configuració més estable implica una energia potencial menor; d’aquesta manera, la tendència a comple-
tar l’última capa d’electrons estaria justificada per la tendència a adquirir una estructura amb menys energia. Però el fet que un àtom d’un gas noble tingui una estructura electrònica molt estable no implica que la cessió d’un electró d’un àtom immediatament posterior a la taula periòdica doni lloc a una espècie més estable.
De fet, el procés de cessió d’un electró (ionització) és un procés endotèrmic, ja que suposa que l’extracció d’un electró vencent la força d’atracció del nucli condueix a un ió i un electró separats que tenen més energia que l’àtom (Taber, 2009). Ni tan sols la consideració conjunta d’aquest procés d’ionització amb el de captació de l’electró per part d’un altre àtom (electroafinitat) dóna lloc a un procés global exotèrmic. Per exemple, en el cas del NaCl(s):
Na(g) à Na+(g) + 1e
∆H°f = 493,7 kJ mol−1
Cl(g) + 1e à Cl (g)
∆H°f = −364,4 kJ mol−1
El procés de formació d’ions a partir dels àtoms no seria possible si no fos perquè hi ha una tercera etapa que implica l’aproximació dels ions per formar una xarxa iònica, Na+Cl (s), una etapa que és fortament exotèrmica (energia reticular) (fig. 3):
Na+(g) + Cl (g) à Na+Cl (s)
∆H° ret = −769 kJ mol−1
Per tant, per explicar energèticament la formació de l’enllaç iònic en un sòlid iònic, cal plantejar-se les tres etapes: formació dels ions positius, formació dels ions negatius i aproximació dels ions positius i negatius per formar l’estructura gegant iònica. Això sense tenir en compte que la formació del NaCl(s) no es produeix, en realitat, a partir dels

Figura 3. Formació ideal de l’estructura gegant iònica del NaCl(s) a partir dels seus ions en estat gasós.
àtoms de sodi i de clor en estat gasós, sinó a partir de Na(s) i Cl2(g) (Taber, 2016).
L’explicació tradicional de l’enllaç iònic, en centrar l’atenció en la transferència d’un o més electrons de valència d’un àtom a un altre i no en la formació d’una estructura gegant iònica, indueix a pensar que es formen parells iònics (fig. 2) i no una xarxa d’ions positius i negatius en posicions alternades, és a dir, una xarxa o estructura gegant iònica. D’altra banda, aquests parells iònics acaben adquirint en la ment dels estudiants l’estatus d’una mena de molècula totalment polaritzada, sobretot després d’estudiar l’enllaç covalent polaritzat.
El problema rau en el fet que la formació d’una molècula és un procés que té lloc a escala atòmica o molecular, mentre que la formació d’un sòlid iònic té lloc necessàriament a escala multiiònica. No pot explicar-se de la mateixa manera la formació d’una molècula i la d’una estructura gegant iònica, perquè corresponen a nivells estructurals diferents.
Amb aquesta crítica a l’ús de la regla de l’octet per explicar l’enllaç covalent i l’iònic no volem dir que aquesta regla no sigui útil amb altres finalitats. Es tracta d’una regla heurística que permet predir amb una gran facilitat la valència iònica i covalent més probable dels elements dels tres primers períodes de la taula periòdica. És, doncs, una regla


Figura 4. Modelització de l’enllaç metàl·lic en el sodi: ions sodi envoltats per un mateix nombre d’electrons de valència, representats per punts (a) o per un ombrejat (b).
molt útil per fer aquestes prediccions i desenvolupa un paper important en la determinació dels diagrames de Lewis de les molècules. El que estem posant en qüestió és si resulta la manera més adequada per explicar la formació de l’enllaç covalent i l’iònic.
L’enllaç metàl·lic
A diferència de l’enllaç covalent i l’iònic, l’enllaç metàl·lic no s’explica a través del seu procés de formació, sinó en funció de les forces electrostàtiques existents entre les partícules que formen l’estructura del metall ja constituït. Per tant, la modelització de l’enllaç metàl·lic es fa en termes d’interacció elèctrica i se situa en el nivell estructural correcte: una estructura gegant metàl·lica.
La modelització de l’enllaç metàl·lic es realitza a partir del model d’estructura gegant d’un sòlid metàl·lic, constituïda per una xarxa d’ions positius envoltats dels electrons de la capa de valència. Aquests electrons se suposa que es mouen lliurement a través del cristall, és a dir, que estan «deslocalitzats» i formen una mena de «núvol» electrònic, i es representen o bé mitjançant punts desordenats, o bé mitjançant un ombrejat continu entre els ions, amb la intenció de visualitzar el concepte núvol electrònic (fig. 4).
Les forces intermoleculars
Les forces intermoleculars es presenten com la interacció que manté unides les molècules en els sòlids moleculars, si bé habitualment es presta més atenció a la interacció entre un parell de molècules que a l’estructura multimolecular d’aquests sòlids.
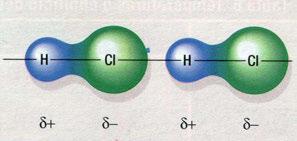
Figura 5. Explicació gràfica de la força intermolecular dipol-dipol entre dues molècules polars de HCl.

Figura 6. Explicació gràfica de la força intermolecular de dispersió (dipol instantani-dipol induït) entre dos àtoms o dues molècules apolars.
Es postulen dos tipus de forces intermoleculars: les forces dipol-dipol, que actuen entre molècules polars (fig. 5), i les forces de dispersió de London, que s’introdueixen per poder explicar l’atracció entre molècules apolars (fig. 6).
En fer aquesta presentació, cal tenir present que els estudiants poden acabar pensant que les forces de dispersió només es
donen en molècules apolars i que la intensitat de les forces dipoldipol sempre és més gran que la de les forces de dispersió. Cal, doncs, destacar que les forces de dispersió tenen lloc en tot tipus de molècules i que són més intenses com més gran és el nombre d’electrons de les molècules (i no com més gran és la seva massa, com es diu a molts llibres de text, ja que el moment dipolar dels dipols instantanis és més gran com més gran és el núvol electrònic que es desplaça, però no té cap relació causal amb la massa de les molècules).
L’enllaç d’hidrogen
L’enllaç d’hidrogen es presenta sovint com un cas particular de força intermolecular que es produeix entre molècules que tenen àtoms de N, O o F enllaçats amb un àtom de H, i que es forma entre un d’aquests àtoms i l’hidrogen d’una molècula contigua. Acostuma a representar-se amb una línia de punts per indicar que és més feble que l’enllaç covalent (fig. 7).
que a la de les forces intermoleculars. Tot i així, cal tenir en compte que la comprensió de la naturalesa de l’enllaç d’hidrogen a un nivell superior requereix considerar-lo també com una força intermolecular electrostàtica (Lundell, 2016).
Algunes recomanacions didàctiques
Amb la finalitat de realitzar una modelització dels diferents tipus d’enllaç que eviti les concepcions alternatives que acabem d’esmentar, fem a continuació una proposta didàctica alternativa a la tradicional a través d’una sèrie de recomanacions.
1. Cal explicar l’enllaç químic com una interacció electrostàtica
La causa de qualsevol unió entre àtoms, ions o molècules és una força de caràcter electrostàtic. El procés de modelització i explicació de l’enllaç químic pot fer-se sobre la base de la interacció de càrregues elèctriques, que podem suposar puntuals (llei de Coulomb), en el cas dels nuclis i

Tanmateix, és preferible conceptualitzar l’enllaç d’hidrogen com un enllaç i no com una força intermolecular, ja que és un enllaç direccional que es caracteritza per tenir una longitud i una direcció determinades. D’altra banda, la seva intensitat és més propera a la d’un enllaç covalent
electrons que formen les molècules, els ions dels sòlids iònics i els «cors» positius i electrons dels sòlids metàl·lics, o de la interacció entre dipols elèctrics, en el cas dels sòlids moleculars. La formació d’un enllaç implica l’aproximació dels àtoms, ions o molècules fins a una distància mínima
en què les forces d’atracció s’equilibren amb les forces de repulsió (fig. 8). Aquesta situació d’equilibri caracteritza la longitud de l’enllaç, en el cas del covalent i del d’hidrogen, i les distàncies entre partícules, en l’estructura d’un sòlid.

Figura 8. Formació d’una molècula d’hidrogen mitjançant la formació d’un enllaç covalent entre dos àtoms d’hidrogen.
2. Cal fer ressaltar que la formació d’un enllaç químic implica una disminució de l’energia del sistema Quan es forma una molècula o una estructura gegant, el sistema adquireix una energia potencial mínima, és a dir, el sistema té menys energia que abans de la formació de l’enllaç o de la unió i, per tant, es produeix un despreniment d’energia en aquesta formació. Aquesta energia despresa en la formació de l’enllaç entre àtoms o en l’aproximació dels ions o les molècules polars és una mesura de la intensitat de l’enllaç format o de la interacció que ha tingut lloc. Així, per exemple, l’energia d’un enllaç covalent entre dos àtoms es mesura com l’energia de formació de la molècula a partir dels seus àtoms en estat gasós (energia despresa en la formació de l’enllaç) o com l’energia
7 Enllaç químic i estructura de les substàncies a l’educació secundària Figura 7. Representació dels enllaços d’hidrogen entre molècules de H2O, de HF i de NH3d’atomització d’aquesta molècula (energia aportada per al trencament de l’enllaç).
Aquesta visió energètica de la formació de l’enllaç s’acostuma a representar mitjançant un diagrama energia potencial-distància, per al cas de la formació d’un enllaç covalent (fig. 9), però diagrames similars també poden descriure els altres tipus d’interaccions.

Figura 9. Diagrama energia potencial-distància en la formació d’una molècula de H2
3. Cal integrar el model «interacció» i el model «disminució de l’energia» en la formació d’un enllaç
Un aspecte essencial de la construcció del model d’enllaç químic és la doble mirada sobre l’enllaç com a interacció i com a procés que dóna lloc a canvis estructurals i a una disminució de l’energia de les partícules que s’enllacen. Quan adoptem el punt de vista de la variació de l’energia potencial en el procés de formació de l’enllaç, en lloc de forces, parlem d’energia, concretament, d’energia d’enllaç en la formació d’una molècula o de l’energia reticular en la formació d’un sòlid iònic, o de l’energia reticular covalent, metàl·lica o intermolecular en la formació d’un sòlid reticular covalent, metàl·lic o molecular, tot i que aquestes últimes energies no acostumen a abordar-se en l’educació secundària. En lloc de fixar-nos en l’estructura molecular o multiatòmica ja constituïda, ens fixem en el seu procés de formació.
Convé realitzar una integració d’aquests dos tipus d’aproximació, especialment en els cursos de batxillerat, però ha de fer-se en el nivell estructural que correspon a cada enllaç: el nivell atòmic o molecular, en el cas de la formació d’enllaços covalents en una molècula, i el nivell «multi-», en el cas de l’enllaç iònic, metàl·lic o covalent en la formació d’una estructura gegant iònica, metàllica o covalent, respectivament. També en el nivell «multi-», en el cas dels enllaços d’hidrogen i les forces intermoleculars en una estructura multimolecular.
4. Cal considerar l’enllaç en el nivell estructural adequat
La modelització de l’enllaç covalent entre els àtoms que formen una molècula correspon al nivell molecular, però la modelització de l’enllaç iònic, del metàl·lic, del d’hidrogen i de les forces intermoleculars correspon a un nivell multiiònic, multiatòmic o multimolecular. Cal respectar aquesta diferència de nivell estructural quan es modelitzen aquests tipus d’enllaç diferents, la qual cosa implica considerar alhora l’enllaç i l’estructura.
5. Les propietats de les substàncies han de ser explicades en funció de l’estructura i l’enllaç, i no només en funció de l’enllaç
La justificació de les propietats de les substàncies ha d’establir-se a través de les característiques de l’estructura de la substància, sigui una estructura multimolecular o una estructura gegant (iònica, metàl·lica o covalent), i no únicament a través de consideracions sobre el tipus d’enllaç. És evident que l’estructura està condicionada pel tipus d’enllaç i que, per tant, hi ha una relació entre les propietats de les substàncies i el tipus d’enllaç, però el nexe d’unió entre aquests dos conceptes cal establir-lo a través del concepte estructura, que inclou el tipus d’enllaç.
L’error de plantejament que implica centrar l’atenció només en l’enllaç s’evidencia, per exemple, quan els estudiants volen relacionar erròniament les propietats de les substàncies moleculars amb l’enllaç covalent, pel fet que els àtoms de les molècules estan units per enllaços covalents; un error que també pot ser induït pel fet d’anomenar substàncies covalents aquestes substàncies, en lloc de substàncies moleculars, que és el nom més apropiat. En efecte, les propietats físiques de les substàncies moleculars estan determinades per la naturalesa de les forces intermoleculars, és a dir, tenen a veure amb les forces que cohesionen l’estructura multimolecular que les constitueix i no amb l’estructura interna de les molècules.
6. Cal diferenciar entre estructures multimoleculars i estructures gegants
Pel que hem dit fins aquí, és evident que la modelització de l’enllaç químic i l’estructura de les substàncies requereix diferenciar clarament entre estructures multimoleculars i estructures gegants.
Una estructura multimolecular (fig. 10) és un conjunt ininterromput de molècules unides per forces intermoleculars, que són febles, la qual cosa explica els baixos punts de fusió de les substàncies moleculars i que moltes siguin líquids o gasos a temperatura ambient.
Una estructura gegant (fig. 11) és un conjunt ininterromput d’àtoms o ions units fortament entre si. Els enllaços o les forces que uneixen els àtoms o els ions poden ser enllaços covalents, en el cas d’una estructura gegant covalent, o forces electrostàtiques, en el cas dels sòlids iònics i metàl·lics, sense oblidar que els enllaços covalents són també interaccions electrostàtiques entre els nuclis positius i els electrons de l’enllaç.

Figura 10. Estructura multimolecular del sofre.
excloents: les substàncies moleculars també es poden presentar en forma de cristalls.
La taula 1 resumeix les característiques dels dos tipus fonamentals d’estructures: multimolecular i gegant.
7. Cal fer ressaltar la diferència entre el significat dels termes enllaç i força
El terme enllaç té un doble significat: en un sentit genèric, implica tot tipus d’unió entre

Figura 11. Representació de diferents estructures gegants. Noteu la forma de representació diferent de les estructures gegants covalents del carboni diamant i el diòxid de silici i de les estructures gegant iònica del clorur de sodi i gegant metàl·lica del ferro.
Quan els sòlids moleculars presenten enllaços d’hidrogen, la seva estructura també participa en part de les característiques d’una estructura gegant a causa de la direccionalitat i la intensitat més gran dels enllaços d’hidrogen (fig. 12).
La importància didàctica del concepte estructura gegant va ser destacada als anys vuitanta en els projectes Nuffield i Química Faraday (Grup Recerca-Faraday, 1990). Alguns textos fan servir, en lloc d’aquest concepte, el de xarxa o cristall. En aquest punt, és important fer una precisió terminològica: el concepte alternatiu a estructura multimolecular no és cristall, sinó estructura gegant, ja que estructura multimolecular i cristall no són conceptes

Figura 12. Representació de l’estructura de l’aigua sòlida, on es pot observar com els enllaços d’hidrogen donen lloc a una estructura similar a les estructures covalents reticulars, però amb enllaços més febles.
entre dos àtoms. Amb aquest significat, només els enllaços covalents i els d’hidrogen són pròpiament enllaços, que es caracteritzen per una longitud d’enllaç, un angle d’enllaç i una energia d’enllaç. Són els únics que representem amb una ratlla o amb una línia de punts. Cal advertir els estudiants que les ratlles que s’utilitzen en les representacions de les cel·les unitàries dels cristalls metàl·lics o iònics no
Taula 1. Estructura, partícules constituents i tipus d’interacció de les substàncies sòlides amb estructura multimolecular i gegant
SubstànciaEstructuraPartícules
Molecular
Multimolecular
Amb estructura gegant
Tipus d’interacció
MolèculesForces intermoleculars
Enllaços d’hidrogen
IònicaGegant iònicaIons positius i negatius
Metàl·licaGegant metàl·lica
Enllaç iònic
Ions positius i electrons Enllaç metàl·lic
CovalentGegant covalent Àtoms Enllaç covalent
àtoms, ions o molècules; en aquest sentit, es parla tant de l’enllaç covalent com de l’enllaç iònic, metàl·lic i molecular. Però, en un sentit més restrictiu, un enllaç és una unió direccional
són enllaços, sinó una manera de donar compte de la disposició a l’espai dels àtoms o ions.
En sentit estricte, no hi ha enllaços iònics ni enllaços metàl·lics, tot i que podem parlar
en sentit genèric de l’enllaç iònic i del metàl·lic. Ni enllaços intermoleculars, a excepció dels enllaços d’hidrogen. El que hi ha entre els ions d’un sòlid iònic o entre els nuclis positius i els electrons d’un sòlid metàl·lic són forces electrostàtiques. En el cas d’un sòlid molecular amb molècules polars, l’orientació de les molècules és aquella que fa que l’energia potencial de l’estructura multimolecular sigui mínima.
8. Cal discutir amb els estudiants el significat de la varietat de representacions gràfiques per representar els diferents tipus d’enllaç i les estructures
La gran varietat de representacions de l’enllaç i de les estructures suposa una dificultat conceptual interpretativa. El significat d’aquesta varietat de representacions gràfiques ha de ser discutit amb els estudiants.
9. Cal fer èmfasi en la unitat de l’enllaç químic
Per concebre la unitat que hi ha en els diferents tipus d’enllaç, pot resultar útil l’ús de diagrames en els quals es representin els «cors» dels àtoms i dels ions, mitjançant un cercle amb el signe positiu de la càrrega neta del «cor», i els electrons de valència, mitjançant un núvol concèntric. El «cor» està format pel nucli d’un àtom més tota l’escorça electrònica excepte els electrons de la capa de valència (fig. 13).
10. En l’aprenentatge de l’estructura i l’enllaç químic, cal tenir en compte la diferència entre els nivells nanoscòpic, molecular, multimolecular i estructura gegant i macroscòpic
La fig. 14 mostra la relació entre els nivells nanoscòpic, molecular, «multi-» (multimolecular o gegant) i macroscòpic amb relació a les partícules i l’enllaç que intervenen en les diferents estructures (Caamaño, 2014).

Figura 13. Representació de diferents tipus d’enllaç i estructures mitjançant l’ús de «cors» positius i núvols d’electrons de valència. A l’enllaç metàl·lic, el núvol també pot representar-se de manera uniforme per indicar la deslocalització dels electrons de valència (fig. 4b).

14. Nivells nanoscòpic, molecular, multimolecular/gegant i macroscòpic dels sòlids moleculars i dels sòlids amb estructures gegants.
Una proposta de seqüenciació per a l’aprenentatge de l’estructura i l’enllaç químic
D’acord amb les recomanacions fetes, proposem una modelització de l’estructura i l’enllaç químic basada en quatre conceptes: el tipus de partícula constitutiva (àtoms, ions, nuclis positius, electrons, molècules); l’estructura (de les molècules i de les estructures multimoleculars i gegants); el tipus d’enllaç o interacció entre les partícules, i la intensitat o energia de la interacció (Caamaño, 2016b). En general, la
seqüenciació pot fer-se de baix a dalt (Levy Nahum et al., 2008) o de dalt a baix, és a dir, del nivell nanoscòpic al macroscòpic o del macroscòpic al nanoscòpic (Grup Recerca-Faraday, 1990).
Proposem utilitzar aquest segon enfocament, és a dir, començar per fer una classificació dels sòlids en funció de les seves propietats físiques. Per exemple, començar per la consideració de les propietats del sofre, l’aigua sòlida, el carboni diamant, el diòxid de silici, el clorur de sodi i el coure (taula 2). A continuació,
tenir en compte aquelles propietats que més fàcilment puguin ser relacionades amb els elements clau de l’estructura. Per exemple, la baixa temperatura de fusió, en el cas dels sòlids moleculars, com el sofre; l’alta conductivitat elèctrica en estat sòlid dels sòlids metàl·lics; la conducció elèctrica dels compostos iònics en estat líquid; l’alta temperatura de fusió i la nul·la conductivitat elèctrica dels sòlids tipus diamant o diòxid de silici, etc.
Caldria iniciar la modelització fent hipòtesis sobre les partícules
constituents d’aquests sòlids i sobre la intensitat dels enllaços o les interaccions entre aquestes partícules, per tal d’explicar-ne les propietats físiques més significatives. I fer una primera diferenciació entre sòlids moleculars amb forces intermoleculars febles i sòlids amb estructures gegants amb interaccions fortes entre les seves partícules constitutives.
Amb aquestes consideracions, les etapes de la modelització de l’enllaç químic i de l’estructura dels sòlids podrien ser les següents:
Taula 2. Estructura i tipus d’enllaç de sis substàncies sòlides preses com a punt de partida per abordar la modelització dels diferents tipus d’enllaç i estructures
Substància
Sofre(s) / Aigua(s) Diamant / Diòxid de silici(s)


Estructura
Clorur de sodi(s)Coure(s)

i partícules

MultimolecularGegant covalentGegant iònicaGegant metàl·lica
Molècules d’octosofre, S8

Molècules d’aigua, H2O, en el gel

Àtoms de C

Àtoms de Si i de O

Ions sodi (Na+) i ions clorur (Cl ) Ions coure (Cu2+) envoltats d’electrons de valència lliures


Tipus d’enllaç o interacció Forces intermoleculars.
Enllaços d’hidrogen (en el cas de l’aigua) Enllaç covalent (forces electrostàtiques entre els electrons compartits i els nuclis)
Enllaç iònic (forces electrostàtiques entre els ions)
1. Classificació de les substàncies sòlides d’acord amb les seves propietats: temperatura de fusió, duresa, conductivitat elèctrica, etc.
2. Diferenciació entre substàncies moleculars i substàncies amb estructures gegants.
3. Modelització de l’enllaç covalent i de l’estructura de les molècules. Model de Lewis. Diagrama de Lewis. Model electrostàtic. Visió energètica de l’enllaç (diagrama energia potencial-distància entre àtoms). Enllaços simples, dobles i triples. Excepcions a la regla de l’octet. Polaritat de l’enllaç covalent. Predicció de la geometria i la polaritat de les molècules.
4. Modelització de l’estructura i del tipus d’enllaç de cada tipus de substància sòlida, atesos el tipus d’interacció entre les partícules, la intensitat de la interacció i l’energia de formació, amb l’objectiu d’explicar-ne les propietats:
— Substàncies moleculars.
— Substàncies moleculars amb enllaços d’hidrogen.
— Substàncies iòniques.
— Substàncies metàl·liques.
5. Recapitulació i síntesi: la unitat de l’enllaç químic.
Conclusions
Enllaç metàl·lic (forces electrostàtiques entre els ions positius i els electrons de valència deslocalitzats)
L’ensenyament tradicional de l’enllaç químic presenta una manca d’unitat d’enfocament en la modelització dels diferents tipus d’enllaç. A vegades es presenta com a conseqüència d’un procés de compartició o transferència d’electrons entre els àtoms (en els enllaços covalent i iònic) i d’altres, com una interacció entre ions (en l’enllaç iònic), entre ions positius i electrons (en l’enllaç metàl·lic) o entre molècules entre si (en l’enllaç entre molècules). D’altra banda, l’explicació de l’enllaç químic es planteja a escala
En el present article, hem apuntat una sèrie de recomanacions didàctiques per abordar la modelització de l’enllaç químic des d’una perspectiva integradora
atòmica, en el cas de l’enllaç covalent i de l’iònic, a causa de l’ús de la regla de l’octet, quan aquest últim tipus d’enllaç requereix una interpretació en el nivell multiiònic. A més, l’enfocament didàctic tradicional no acaba de resoldre bé la relació entre les propietats de les substàncies i els tipus d’enllaç, en no tenir sempre en compte el nivell estructural multiiònic, multiatòmic o multimolecular de les substàncies.
En el present article, hem apuntat una sèrie de recomanacions didàctiques per abordar la modelització de l’enllaç químic des d’una perspectiva integradora: d’una banda, com una interacció electrostàtica considerada en el nivell estructural adequat; de l’altra, com un procés que condueix a una disminució d’energia del sistema. I hem fet èmfasi en els conceptes estructura multimolecular i estructura gegant com a mediadors entre el nivell atomicomolecular i el macroscòpic de les substàncies i les seves propietats.
També hem tingut en compte algunes consideracions terminològiques i de representació gràfica dels models que creiem essencials per a una conceptualització de l’enllaç químic millor. Totes aquestes orientacions poden contribuir a una modelització més coherent de l’enllaç químic i l’estructura de les substàncies, alhora que poden ajudar a evitar l’aparició de les concepcions
alternatives descrites. Finalment, hem proposat una seqüenciació didàctica per a la modelització de l’enllaç i l’estructura que parteix de les propietats físiques de les substàncies que volem explicar i que fa hipòtesis sobre l’estructura i el tipus d’enllaç.
Referències
Bergqvist, A.; Drechsler, M.; Jong, O. de; runDgren, S. C. (2013). «Representations of chemical bonding models in school textbooks: help or hindrance for understanding?». Chemistry Education Research and Practice, núm. 14, p. 589-606. caamaño, A. (2014). «La estructura conceptual de la química: realidad, conceptos y representaciones simbólicas». Alambique, núm. 78, p. 7-20. — (2016a). «Un enfoque para vencer errores y ambigüedades. Enlace químico y estructura de las sustancias en secundaria». Alambique, núm. 86, p. 8-18. — (2016b). «Secuenciación didáctica para el aprendizaje de los modelos de enlace». Alambique, núm. 86, p. 39-45. grup recerca-FaraDay (1990). Química Faraday. Barcelona: Teide, p. 97-108.
levy nahum, T.; mamlok-naaman, R.; hoFstein, A.; kronik, L. (2008). «A new bottom-up framework for teaching chemical bonding». Journal of Chemical Education, vol. 85, núm. 12, p. 1680-1685.
lunDell, J. (2016). «Hydrogen bond made visible by molecular modelling». Educació Química EduQ, núm. 21, p. 33-36.
luxForD, C. J.; lowery, S. (2013). «Moving beyond definitions: what student-generated models reveal about their understanding of covalent bonding and ionic bonding». Chemistry Education Research and Practice, núm. 14, p. 214-222.
riBolDi, L.; pliego, O.; oDetti, H. (2004). «El enlace químico: una conceptualización poco comprendida». Enseñanza de las Ciencias, vol. 22, núm. 2, p. 195-212.
taBer, K. (2001). «Building the structural concepts of chemistry: some considerations from educational research». Chemistry Education Research and Practice, núm. 2, p. 123-158. — (2009). «Challenging misconceptions in the chemistry classroom: resources to support teachers». Educació Química EduQ, núm. 4, p. 13-20. — (2016). «Enlace químico y estructura atómico-molecular en secundaria». Alambique, núm. 86, p. 19-27. talanquer, V. (2007). «Explanations and teleology in chemistry education». International Journal of Science Education, vol. 29, núm. 7, p. 853-870. — (2013). «When atoms want». Journal of Chemical Education, núm. 90, p. 1419-1423.

Aureli Caamaño Ros
És doctor en química per la Universitat de Barcelona (UB). Ha estat catedràtic de física i química de secundària i professor del CAP i del màster de formació del professorat de secundària de la UB. És coautor de diversos llibres i de més de seixanta articles sobre l’ensenyament de la química i de les ciències. Codirector de la revista Alambique i coeditor de la revista Educació Química EduQ, actualment treballa en l’àmbit de la formació del professorat i en l’elaboració de materials curriculars i estudia el grau d’humanitats a la Universitat Pompeu Fabra.
A/e: aurelicaamano@gmail.com
Teaching and learning the concept of chemical bonding
Ensenyar i aprendre el concepte enllaç químic
Rachel Mamlok-Naaman and Avi Hofstein / The Weizmann Institute of Science (Israel)
Tami Levy Nahum / Branco Weiss Institute (Israel)
abstract

The knowledge of chemical bonding is essential to the understanding of almost every topic in chemistry. However, it is very difficult to learn, and students have a lot of misconceptions regarding this concept. In order to improve students’ understanding of this concept, it is essential to revise the scientific content, the pedagogical approach and the assessment methods regarding this concept. In this paper, we will review two studies. The first one will refer to aspects that have influenced students’ misconceptions regarding the topic of chemical structure and bonding, and the other one referring to new methods for teaching the concept of chemical bond, as well as assessment tasks.
keywords
Chemical structure and bonding, learning goals, learning performances, organization principles.
resum
El coneixement de l’enllaç químic és essencial per comprendre gairebé qualsevol tema de química. Tanmateix, és molt difícil d’aprendre i els estudiants tenen una gran quantitat de concepcions alternatives en relació amb aquest concepte. Amb l’objectiu de millorar la comprensió dels estudiants entorn d’aquest concepte, és essencial revisar el contingut científic, l’enfocament pedagògic i els mètodes d’avaluació. En aquest article, revisem dos estudis. El primer es refereix als aspectes que han determinat les concepcions alternatives dels estudiants respecte del tema de l’estructura i l’enllaç químic, i l’altre es refereix als nous mètodes d’ensenyar el concepte enllaç químic, així com a les activitats d’avaluació.
paraules clau
Estructura i enllaç químic, objectius d’aprenentatge, resultats d’aprenentatge, principis organitzadors.
Introduction
The theoretical content of chemistry is best seen as a set of models. Gilbert (1998) claims that models play a major role in all science disciplines; nevertheless, they seem to be particularly problematical to chemistry students. Students live and operate in the macroscopic world of matter. Unfortunately, they do not perceive chemistry as related to their surroundings. Moreover, they do not easily follow shifts between the macroscopic and microscopic levels (Johnstone, 1991; Gabel, 1996;
Tsaparlis, 1997; Pabuçcu & Geban, 2012). Chemical concepts are very abstract and students find it difficult to explain chemical phenomena by using these concepts. The study of students’ alternative conceptions and conceptual frameworks has been an active field among science educators for more than two decades. According to Gabel (1996, p. 43):
The theoretical content of chemistry is best seen as a set of models
The complexity of chemistry has implications for the teaching of chemistry today. We know that chemistry is a very complex subject from both the research on problem solving and misconceptions […] and from our own experience […] students possess these misconceptions not only because chemistry is complex, but also because of the way the concepts are taught.
In this paper, we will review two studies that were done regarding teaching the concept of chemical bond, as well as assessment tasks.
First study: several aspects that have influenced students’ misconceptions regarding the topic of chemical structure and bonding
This study focuses on several aspects that have influenced students’ misconceptions regarding the topic of chemical structure and bonding. In Israel, although there has been a serious effort to overcome this problem, the same misconceptions arise each year. We assume that most of these difficulties derive from the characteristics of chemistry learning, such as the central role of models, the linguistic cues and phenomena explained through the sub-microscopic level. Nevertheless, we suggest that there are also external misleading factors, namely, the way the teachers teach (pedagogy, contents and textbooks) and the way students learn, which lead to students’ misconceptions.
In this study, we reviewed the analyses of the results of fourteen years of chemistry matriculation examinations (Hofstein, 1991-1994; Bar-Dov, 1995-2003) regarding this topic. Based on these results, we investigated the sources for these misconceptions through further research with students, teachers and scientists. Our assumption was that one of the main factors, which is significant regarding this problem, is the way students are evaluated. In this study we indicated that teaching and learning of this particular topic are very much influenced by the obligatory matriculation examination. Moreover, we suggest that these examinations, in their present
The questions entitled «Chemical bonding and structure» that are provided each year are very similar. These questions and the students’ answers were analyzed. Fourteen years of analyses revealed that students possess a variety of misconceptions regarding the chemical bonding concept
form, in fact amplify students’ misconceptions.
The questions entitled «Chemical bonding and structure» that are provided each year are very similar. These questions and the students’ answers were analyzed. Fourteen years of analyses revealed that students possess a variety of misconceptions regarding the chemical bonding concept. Although there has been a serious effort to overcome this problem, the same crucial misunderstanding regarding the bonding concept has arisen each year for the last two decades. We used several methods and sources in order to explore the problem and based on the findings we suggest that students demonstrate a shallow understanding of chemical bonding not only because this topic has intrinsic complexities, but also as a result of external «misleading factors» concerning the traditional approach used for teaching the bonding concept. These factors are detailed in the sections that follow and supported by studies conducted worldwide.
The data analysis showed that students possess these alternative conceptions not only because this topic has its intrinsic complexities. Students’ misconceptions stem also from several misleading
factors. We have mentioned the content and pedagogical components, but we assume that the way students are evaluated is critical to the way this topic is taught. More specifically, we claim that the existence of the matriculation examination in its current form causes students to use slogans and declarations, explain facts by «drawers», and students demonstrate a very shallow understanding of the key concepts. According to Atzmon (1991), Birenboum (1997), and Dori (2003), this system of assessment detracts from teachers’ efforts to ensure meaningful learning and the development of students’ higher-level thinking abilities.
In light of this, we highly recommend making a real change in the traditional approach used for teaching this topic, abandoning the current pattern of fixative questioning and instead to form new assessment tools. Gilbert (2003) criticized the way of questioning and claimed that the teachers’ role is to change this system. He suggested using completely different teaching and assessment methods. We suggest not examining a narrow range of skills, but instead to evaluate students’ argumentation and thinking skills as well as the skills in creativity. Such a change requires developing a new curriculum and promoting the development of teachers’ PCK. Therefore, an improvement will occur only by a systemic solution such as revising the curriculum, the assessment method as well as the teaching methods.
Second study: developing a new teaching approach for the chemical bonding concept aligned with current scientific and pedagogical knowledge
This study is based on the first study described above (Levy Nahum et al., 2004) that we have
conducted during the academic years 2002-2004. The main goal of this study was to develop a new teaching approach for the bonding concept by de-construction of the traditional approach and construction of a reformed approach aligned with the scientists’ views. We were looking for a more scientific and effective teaching approach in order to improve students’ understanding of this topic. The main goal of this study was to develop «an outline for a new teaching approach» for high-school chemistry students in order to improve understanding of the chemical bonding concept. Thus, it was necessary to align the teaching of this topic with current scientific and pedagogical knowledge.
The research questions of this study were: 1) what are the key-learning goals and what is suggested as a reform approach to teaching the chemical bonding concept in accordance with senior scientists and with chemistry lead-teachers?, and 2) are the new assessment tasks, which were developed based on specified key-learning goals and learning performances (according to the insights raised from the previous question), more diagnostic than the traditional questions on high stakes examination with regard to students’ understanding of the chemical bonding concept?
We adapted the «assessmentdriven design» model (Reiser et al., 2003) for dealing with the systemic problem that was presented above, namely, the problematic approach of teaching and assessing bonding in the last decades, worldwide. According to Reiser et al. (2003), the central idea of the «assessment-driven design» process is to identify the keylearning goals and to use these «big ideas» to guide all phases of the curriculum and activity design, while constantly assessing
whether the tasks are aligned with the «big ideas». This idea is supported by Kesidou & Roseman (2002), who suggest that the instructional design of the curricular materials has to effectively support the attainment of the specified student learning goals. The mere presence of specific content in a curriculum material does not ensure that students will learn that content. For learning to take place, curriculum materials need to focus sound instructional and assessment strategies specifically on the ideas and skills that students are intend to learn and perform.
During the whole process of developing instructional materials, it is important to ensure that the learning goals, the pedagogical approach as well as the learning performances and the new assessment tasks are aligned in order to foster meaningful learning
During the whole process of developing instructional materials, it is important to ensure that the learning goals, the pedagogical approach as well as the learning performances and the new assessment tasks are aligned in order to foster meaningful learning. Based on the model of Reiser et al. (2003) and on the literature review, we designed this study process, which enabled us to re-construct a conceptual framework for teaching and assessing the concept of bonding
Based on the finding from our first study that the examinations’ demands amplify students’ misconceptions and pseudo-conceptions, we began our process
with discussions regarding the common questions (the highstakes testing) that have a central influence on the way this topic is taught. In order to re-characterize the concept of chemical bonding we had to align the scientific content and the pedagogical approach with current scientific views and knowledge. We have based the new approach on the research participants’ views. According to the research participants’ views regarding the «big ideas» and their pedagogical insights we could build an outline for an alternative pedagogy. This process included the formulation of specified learning goals and learning performances with respect to the scientific practice. Based on these learning performances several assessment tasks were developed.
Accordingly, in this study, a group of ten experts was selected and assembled by the authors of this paper to discuss and comment based on their personal experience on the way that chemical bonding should be taught. We held six meetings, each of which lasted for four hours. During the workshop, the following issues were discussed and elaborated by using a focus group method:
–The common questions regarding this topic, more specifically the problematic content and structure of the high-stakes questions and the «acceptable» answers.
–The scientists’ views regarding the concept of chemical bonding and their ideas regarding the learning goals associated with its teaching.
–The design of new assessment tasks based on decisions regarding the learning goals and the learning performances.
In all the discussions there was a continuous collaborative
exchange of ideas. The useful data produced by the interactions within the group provided the researchers with pedagogical insights that could be used for the development of a new pedagogical approach. In order to enrich the data collected, we used a unique technique during the workshop meetings in which one of the authors, as a focus group moderator, made a reference to parts of previous discussions quotations and asked the participants questions about them. During the meetings each sentence was recorded and the transcripts were analyzed.
Analysis of the discussions held during the workshop, regarding the common questions, revealed that teachers do not want their students simply repeat by rote what they had taught them; instead they want to provide them with meaningful knowledge by which they can advance. During the discussions,
they mentioned the existence of the final examinations, and claimed that the type of questions asked on these examinations along with the acceptable answers lead to superficial learning. In preparing them to do well on these examinations, teachers asked their students specific questions, with the goal of successfully fulfilling the requirement of the final examinations, with little regard to students’ actual comprehension of the key-concepts. Based on the results of this study, we may conclude that if students are assessed on parallel items, they can succeed in the common questions, but they may exhibit low levels of understanding regarding the new assessment tasks that we have developed during this process. We suggest that constructing the teaching and learning of a topic based on carefully specified learning goals, which are described in terms of
performances, may enable educators to foster and examine much deeper levels of students’ understanding.
We have developed a new experimental curriculum that is based on the suggested outline for a new approach. On the academic year 2005, the new unit was implemented in ten classes and preliminary information is provided in the next section. However, this research study was not designed to assess the effectiveness of the new teaching approach for chemical bonding concept. Furthermore, much work is needed to apply it in all classrooms of high-school chemistry. This appears to be an enormous challenge, since conceptual systemic change will occur only if: 1) the teachers accept and assimilate the new approach, after many years of experience in teaching according to the traditional approach, and 2) the national examinations

will be aligned with the new curriculum. Additionally, continuous professional development for teachers is required in order to be able to implement effectively the new curriculum regarding this topic.
bonding as extreme cases of various continuum scales (stage 3). Equipped with this knowledge, students can then construct a coherent understanding of different molecular structures (stage 4) and properties (stage 5).

Based on the long-term collaboration between prominent scientists, researchers in chemistry education and expert teachers, an innovative program aimed at teaching the chemical bonding concept, which follows a holistic approach to curriculum (Levy Nahum et al., 2007), was developed and implemented in 11thgrade chemistry classes in Israel. Its general approach relies on basic concepts such as coulombic forces and energy at the atomic level to build a coherent and consistent perspective for dealing with all types of chemical bonds. As described by Levy Nahum et al. (2008, p. 1680): «It is possible to show how this diversity [of bond types] arises from a small number of fundamental principles instead of presenting it as a large number of disparate concepts». The framework proposed by Levy Nahum et al. (2008) introduces the elemental principles of an isolated atom (stage 1); this is followed by discussions of general principles of chemical bonding between two atoms (stage 2), and the general principles are then used to present the different traditional categories of chemical
In the academic year 2010-2011, the new program was implemented in all 11th-grade chemistry classes in Israel, which is possible because the educational system is centralized. In due course, a full-scale study assessing both teaching and learning will be conducted, aiming at reporting broader and statistically sound field results. In the framework of the new program, building on a knowledge-in-pieces perspective, Yayon, Mamlok-Naaman & Fortus (2012) describe the development and testing of a matrix that represents a systematic organization of the canonical knowledge on chemical bonding required at high-school level and a tool for representing students’ knowledge of bonding. The matrix contains three strands: the structure of matter at the nanoscopic level, electrostatic interactions between charged entities, and energy aspects related to bonding. In each strand there are hierarchically ordered cells that contain fine grain concepts. The matrix, as it appeared at this stage, is available at http://stwww.weizmann.ac.il/ g-chem/the_matrix.doc
Discussion and summary
This research consists of all the components of a curricular process, a diagnostic study, followed by curricular development and implementation regarding the teaching of the bonding concept. High-school students lack a fundamental understanding regarding the key-concepts of chemical bonding. One of the goals of the chemistry teaching community is to develop more effective and scientifically aligned strategies to teach high-school students this key concept.
The traditional pedagogical approach to teaching chemical bonding and structure is often overly simplistic and thus is not aligned with the most up-to-date scientific knowledge and models. The problematic approach by which this topic is presented in many chemistry textbooks worldwide has been examined extensively in the last two decades by researchers of chemistry teaching (Ashkenazi & Kosloff, 2006; Hurst, 2002; Justi & Gilbert, 2002; Taber, 1998; Taber, 2001; Taber, 2002; Taber, 2011; Atzmon, 1991). The traditional approach, as it appears in many textbooks, is oversimplified and thus leads to overgeneralizations as well as a lack of scientific tools that may promote students’ understanding. Taagepera et al. (2002) claim that effective comprehension and thinking require a coherent understanding of the «organizing principles». Hurst (2002) concluded his paper with the suggestion that bonding theory and related concepts need to be taught in a «uniform» manner.
The unit «Bonding» was designed to fulfill these needs. In the first stage of the study (Levy Nahum et al., 2004), we used several methods and sources in order to explore the problem, and based on the findings we suggest
It should be emphasized that the chemistry teachers were deeply involved in the curricular process; they cooperated with the developers and provided their feedback and insights throughout the process. Their contribution to the design of the new approach, in all its stages, was enormous
that students display a shallow understanding of chemical bonding not only because this topic has intrinsic complexities, but also as a result of external «misleading factors» concerning the traditional approach used for teaching the bonding concept.
In fact, as we described based on our paper (Levy Nahum et al., 2008), and as we mentioned above, the problem is with the textbooks; so in a retro-perspective view, we could have started by analyzing chemistry textbooks and based on the conclusions to develop a new framework for a new unit, but starting as we have started, from the problematic assessment approach, and the process it generated, provided us with rationalization and a deep foundation for a meaningful and detailed analysis and insights regarding the misleading factors. These factors are detailed in Levy Nahum et al. (2004) and supported by studies conducted worldwide. In view of that, we recommended making a real change in the traditional approach used for teaching this topic.
Based on the findings of the previous phase, we proposed a plan to eliminate the addressed problems. In the second stage (Levy Nahum et al., 2007), we describe a collaborative develop-
ment process with leading-teachers, researchers in chemistry teaching and senior chemists. We related to all the problematic aspects of the traditional approach and obtained a consensus regarding the organizing principles and the key concepts of this topic based on «a partnership between senior scientists and expert teachers» that follows a holistic approach to the curriculum. During this process, a conceptual framework was constructed for re-characterizing of chemical bonding, including the formulation of LG and LP.
It should be emphasized that the chemistry teachers were deeply involved in the curricular process; they cooperated with the developers and provided their feedback and insights throughout the process. Their contribution to the design of the new approach, in all its stages, was enormous. Thus, we highly recommend that any curricular development should be conducted with teachers’ collaboration.
References
ashkenazi, G.; kosloFF, R. (2006). «The uncertainty principle and covalent bonding». Chemical Educator, No. 11, p. 66-76. atzmon, A. (1991). Natural science curriculum as designer of the image of science using rhetorical patterns within the socio-political system. Unpublished doctoral dissertation. Jerusalem: Hebrew University. [In Hebrew] Bar-Dov, Z. (1995-2003). The analyses of the matriculation examination: Manuscripts Rehovot: Weizmann Institute of Science. [In Hebrew] BirenBoum, M. (1997). Alternatives in assessment. Tel Aviv: Ramot. Dori, Y. J. (2003). «From nationwide standardized testing to school-based alternative embedded assessment in
Israel: students’ performance in the matriculation 2000 project». Journal of Research in Science Teaching, No. 40, p. 34-52.
gaBel, D. (1996). The complexity of chemistry: Research for teaching in the 21st century. Paper presented at the 14th International Conference on Chemical Education. Brisbane, Australia.
gilBert, J. (1998). «Explaining with models». In: ratcliFFe, M. (ed.). ASE guide to secondary science education. London: Stanley Thornes.
— (2003). Personal communication.
gillespie, R. (1997). «The great ideas of chemistry». Journal of Chemical Education, No. 74, p. 862-864.
hoFstein, A. (1991-1994). The analyses of the matriculation examination: Manuscripts. Rehovot: Weizmann Institute of Science. [In Hebrew] hurst, O. (2002). «How we teach molecular structure to freshmen». Journal of Chemical Education, vol. 79, No. 6, p. 763-764.
Johnstone, A. H. (1991). «Why is science difficult to learn? Things are seldom what they seem». Journal of Computer Assisted Learning, No. 7, p. 75-83.
Justi, R.; gilBert, J. (2002). «Models and modeling in chemical education». In: gilBert, J.; Jong, O. de; Justy, R.; treagust, D. F.; Driel, J. H. van (ed.). Chemical education: Towards research-based practice. Dordrecht: Kluwer, p. 47-68.
kesiDou, S.; roseman, J. E. (2002). «How well do middle school science programs measure up? Findings from project 2061’s curriculum review». Journal of Research in Science Teaching, vol. 39, No. 6, p. 522-549.
levy nahum, T.; hoFstein, A.; mamlok-naaman, R.; Bar-
Dov, Z. (2004). «Can final examinations amplify students’ misconceptions in chemistry?». Chemistry Education: Research and Practice in Europe, vol. 5, No. 3, p. 301-325.
levy nahum, T.; mamlok-naaman, R.; hoFstein, A.; kraJcik, J. (2007). «Developing a new teaching approach for the chemical bonding concept aligned with current scientific and pedagogical knowledge». Science Education, No. 91, vol. 4, p. 579-603
levy nahum, T.; mamlok-naaman, R.; hoFstein, A.; kronik, L. (2008). «A new bottom-up framework for teaching chemical bonding». Journal of Chemical Education, vol. 85, No. 12, p. 1680-1685.
paBuçcu, A.; geBan, O. (2012). «Students’ conceptual level of understanding on chemical bonding». International Online Journal of Educational Sciences, No. 4/2012, p. 563-580.
reiser, B.; kraJcik, J.; moJe, E.; marx, R. (2003). Design strategies for developing science instructional materials. Paper presented at the Annual Meeting of the National Association of Research in Science Teaching. Philadelphia, USA.
taagepera, M.; arasasingham, R.; potter, F.; sorouDi, A.; lam, G. (2002). «Following the development of the bonding concept using knowledge space theory». Journal of Chemical Education, vol. 79, No. 6, p. 756-762.
taBer, K. S. (1998). «An alternative conceptual framework from chemistry education». International Journal of Science Education, No. 20, p. 597-608.
— (2001). «The mismatch between assumed prior knowledge and the learners’ conceptions: a typology of learning impediments». Educational Studies, vol. 27, No. 2, p. 159-171.
— (2002). Chemical misconceptions: Prevention, diagnosis and cure. Vol. 1: Theoretical background London: Royal Society of Chemistry.
— (2011). «Models, molecules and misconceptions: a commentary on Secondary school students’ misconceptions of covalent bonding». Journal of Turkish Science Education, No. 8, p. 3-18.
tsaparlis, G. (1997). «Atomic and molecular structure in chemical education: a critical analysis from various perspectives of science education».
Journal of Chemistry Education, No. 74, p. 922-925.
yayon, M.; mamlok-naaman, R.; Fortus, D. (2012). «Characterizing and representing students’ canonical knowledge of chemical bonding». Chemistry Education: Research and Practice in Europe, No. 13, p. 248–267.
 Rachel Mamlok-Naaman
Rachel Mamlok-Naaman
Is a senior staff scientist and coordinator of the Chemistry Group in the Department of Science Teaching at the Weizmann Institute of Science. She got the Maxine Singer Prize for outstanding staff scientists at the Weizmann Institute for professional development of teachers in chemistry in whole Israel. She is engaged in the development, implementation and evaluation of new curricular materials, and research on students’ perceptions of chemistry concepts, assessment and professional development of science teachers.
E-mail: rachel.mamlok@weizmann.ac.il.

Avi Hofstein
Is an Emeritus Professor in the Department of Science Teaching at the Weizmann Institute of Science. He was head of Science Teaching Department and head of the Center for Chemistry Teachers’ PD for several years. Over a period of almost fifty years, he has been involved in several aspects of R&D related to chemistry learning and teaching chemistry including the following: development of CPD models, development of leadership among chemistry teachers, research on the effectiveness of laboratory work, attitudinal studies, and students’ interest in chemistry learning.
E-mail: avi.hofstein@weizmann.ac.il.

Tami Levy Nahum
Is a member of a pedagogical research and development group at Branco Weiss Foundation in Israel. Her research deals with exploring and consolidating pedagogical basic criteria for meaningful learning. During her graduate studies at the Weizmann Institute, she focused on the inquiry-type approach in the chemistry laboratory, and on teaching and learning the concept of chemical bonding Tami Levy Nahum took part in two European projects in the framework of FP6 and FP7.
E-mail: ntami@weizmann.ac.il.
Perspective philosophique sur les relations entre structure, propriétés et fonctions
Perspectiva filosòfica sobre les relacions entre estructura, propietats i funcions
Philosophical perspective on structure, properties and functions
Bernadette Bensaude Vincent / Université Paris 1 Panthéon-Sorbonne (France)
résumé

Pour les enseignants, de chimie en particulier, il importe de bien mettre en lumière la relation causale entre structure, propriétés et fonctions : c’est un moyen de rendre intelligibles les comportements et réactions des substances individuelles, qui permet aux élèves et étudiants de mieux mémoriser la masse de connaissances qu’ils doivent acquérir et maîtriser sur une foule de matériaux. Le but de ce bref article n’est pas de faire un historique de l’introduction des notions de structure en chimie, mais plutôt d’utiliser l’histoire pour dégager les présupposés en jeu dans la séquence « structure > propriétés > fonctions ». Ces présupposés ne sont généralement pas explicités, tant ils semblent inhérents à la démarche rationnelle et explicative qui caractérise la méthode scientifique. Mais en les questionnant on peut ouvrir de nouvelles perspectives.
mots clés
Atomes, molécules, matériaux, causalité, procédé.
resum
Per als professors, particularment de química, és important destacar la relació causal entre estructura, propietats i funcions: és una manera de fer intel·ligible el comportament i les reaccions de les substàncies individuals, la qual cosa permet als alumnes i estudiants memoritzar millor el bagatge de coneixements que necessiten per adquirir i dominar tota una varietat de materials. El propòsit d’aquest breu article no és fer una introducció històrica sobre la noció d’estructura en la química, sinó més aviat utilitzar la història per desemmascarar els pressupòsits implicats en la seqüència «estructura > propietats > funcions». Aquestes suposicions generalment no es fan explícites, perquè són inherents a l’enfocament racional i explicatiu que caracteritza el mètode científic. No obstant això, el fet de qüestionar-les permet obrir noves perspectives.
paraules clau
Àtoms, molècules, materials, causalitat, procés.
abstract
For teaching purposes, of chemistry in particular, it is important to emphasize the relationships between structure, properties and functions in order to make the behaviour and reactions of individual substances intelligible, thus enabling the students to better memorize and master the load of knowledge they have to acquire about of individual substances. Rather than trying to provide a historical survey of the introduction of the notion of structure in chemistry, this brief article makes use of history to disentangle the preassumptions of the causal sequence «structure > properties > functions». These preassumptions usually remain implicit because they are integral part of the rational and explanatory approach, which is typical of science. By questioning what is usually taken for granted may in turn open up new perspectives.
keywords
Atoms, molecules, materials, causality, process.
Il est bien connu que les philosophes ont la manie de questionner ce qui va de soi, de voir des problèmes là où les autres n’en voient pas. Voici donc quelques problèmes relatifs à l’usage courant de trois concepts de base pour tout enseignement de chimie.
Structure, propriétés, fonctions : ces trois concepts ne sont pas propres à la chimie mais ils sont très précieux pour les chimistes dans la mesure où ils fournissent des outils pour maîtriser la multiplicité et la diversité des substances. Parce que la chimie s’intéresse à des individualités matérielles plutôt qu’à la matière en général comme la physique, elle serait une science purement descriptive, une sorte d’histoire naturelle, si les chimistes se bornaient à décrire les propriétés des substances connues, sans les mettre en relation avec les deux autres termes : structure et fonction. Selon la formule ironique (et probablement légendaire) qu’on attribue à Ernest Rutherford, la chimie serait analogue à une collection de timbres : « That which is not physics is stamp collecting ».
Pour les enseignants de chimie en particulier, il importe de mettre en relation structure, propriétés et fonctions pour rendre intelligibles les comportements et réactions des substances individuelles, pour permettre aux élèves et étudiants de mémoriser et de s’orienter dans la masse de connaissances chimiques à maîtriser.
Historiquement, la relation entre les propriétés des composés et la nature et proportion des composants a fourni un premier outil d’intelligibilité au niveau macroscopique. Cela correspond, en gros, à la chimie lavoisienne, laquelle repose sur la décomposition puis recomposition des corps. Mais la découverte de corps qui
ont la même composition avec des propriétés physiques, chimiques, voire biologiques différentes que Jans Jacob Berzelius dénomma isomères montre l’insuffisance de cette logique analytique. Grâce à l’introduction des notions d’atome et de molécule, une chimie structurale a pu être développée qui prend en compte la structure moléculaire des composés pour rendre intelligibles leurs propriétés. La relation structure-propriétés-fonction établit un pont entre l’échelle nanoscopique (de la structure des atomes et molécules) et l’échelle macroscopique où se déroulent nos opérations et interactions avec divers matériaux. Grâce à cette mise en relation, on peut y voir plus clair dans la jungle des matériaux ; on peut même prédire des nouvelles substances, on peut en fabriquer à la demande.
Le but de ce bref article n’est pas de faire un historique de l’introduction de cette logique structurale en chimie mais plutôt d’utiliser l’histoire pour dégager les présupposés en jeu dans la séquence « structure-d’où-propriétés-d’où-fonctions ». Ces présupposés ne sont généralement pas explicités, tant ils semblent inhérents à la démarche scientifique qui se veut rationnelle et explicative. Tentons pourtant de les expliciter et de les questionner, car cela peut conduire à ouvrir de nouvelles perspectives.
Les présupposés
Le triplet « structure-d’oùpropriétés-d’où-fonctions » est un outil pédagogique extrêmement puissant. Il permet d’éclairer non seulement la différence de propriétés physiques (conduction, semi-conduction, etc.) des corps, mais aussi leurs fonctions au sens de possibilités de liaison qui déterminent les réactions sélectives de ces corps. Ce triplet peut aussi être mobilisé de façon
plaisante dans la littérature de vulgarisation. Ainsi, par exemple, dans un best-seller de chimie populaire, Sam Kean décrit plaisamment le contraste entre friendly carbon et aggressive oxygen en raison du nombre d’électrons sur la couche externe de leurs atomes respectifs : l’oxygène ayant besoin de deux électrons supplémentaires pour satisfaire la loi de l’octet peut « dicter ses propres termes », mais le « pauvre carbone » ayant besoin de quatre électrons supplémentaires ne peut se montrer trop exigeant pour former des liaisons : il s’accroche virtuellement à presque tout (Kean, 2010, p. 34-35).
Voici donc un triplet de concepts précieux. Mais est-ce un principe effectif d’intelligibilité ou un simple artifice pédagogique ? Quand on mobilise le concept de structure pour rendre compte des propriétés d’un corps et de ses fonctions, on établit une séquence qui est strictement linéaire et, de plus, à sens unique. Ce raisonnement implique trois présupposés assez faciles à repérer : 1. D’abord, que la matière est composée de briques élémentaires, des atomes agencés en molécules. Cela fait partie du stock des connaissances communes que les enfants acquièrent sans problème dès leurs débuts à l’école même si les représentations qui les accompagnent sont parfois assez fantaisistes.
2. Ensuite, qu’on connaît leur structure grâce à des instruments de plus en plus performants pour visualiser l’invisible : ce fut d’abord la diffraction des rayons X développée par William Henry Bragg au début du xxe siècle (fig. 1), puis la microscopie électronique vers le milieu du xxe siècle et enfin la microscopie en champ proche (scanning tunneling microscope et atomic force microscope) vers la fin du xxe siècle.
3. Enfin, qu’on peut établir un lien de causalité entre la structure des atomes, leur agencement en molécules puis les fonctions de ces molécules. En d’autres termes, que l’on peut déduire de la structure à l’échelle nanoscopique des propriétés et comportements opérant à notre échelle. La simulation moléculaire pour prédire le comportement de certains matériaux avant qu’ils adviennent à l’existence physique, c’est à dire avant leur synthèse, est une pratique courante et largement développée dans l’industrie chimique et pharmaceutique.
Or chacun de ces trois présupposés appelle des remarques quant au type de raisonnement qu’il mobilise.

1. Premier spectromètre à rayons X conçu par Sir William Lawrence Bragg (1890-1971). Il fut le premier à montrer en 1921 que la structure moléculaire peut être déduite à partir du cliché de diffraction des rayons X par un échantillon de cristal.
Le chemin entre structure et propriétés
Il faut d’abord remarquer que le recours à l’atomisme dans la relation entre structure et propriété est avant tout de l’ordre de l’intuition. Cette relation a été établie bien longtemps avant que l’on puisse visualiser la structure des atomes et des molécules.
Comme le remarquait Jean Perrin (fig. 2) dans l’introduction du livre où il donne une démonstration magistrale de la réalité moléculaire, « expliquer du visible compliqué, par de l’invisible simple, voilà la forme d’intelligence intuitive, à laquelle grâce à des hommes tels que Dalton ou Boltzmann, nous devons l’Atomistique » (Perrin, 1913, p. 4). La relation entre propriétés des corps et la forme des atomes qui les forment était à la base de l’atomisme antique. Pour Épicure, tous les corps sont formés d’atomes, indivisibles et invisibles qui diffèrent uniquement par leur forme. Les qualités sensibles des corps n’existent pas en elles-mêmes, elles résultent de l’assemblage des atomes individuels. Bien entendu, ces atomes antiques n’ont qu’un lien d’homonymie avec les atomes de la science actuelle, mais le raisonnement est le même en son principe : il s’agit d’expliquer le visible par des entités invisibles, ce qui est apparent au niveau des phénomènes à des structures cachées. Et de ce fait on peut réduire les qualités sensibles à des variables purement géométriques ou mécaniques telles figure et mouvement. Mais il est clair que le chemin emprunté par les atomistes antiques est d’aller du

sensible, du visible vers l’invisible en posant une hypothèse. Il faut insister sur le caractère hypothétique des structures. Cette notion qui a permis à René-Just Haüy de distinguer des espèces de cristaux est transposée par Auguste Laurent dans l’interprétation des réactions de substitution. Laurent imagine un « noyau » atomique autour duquel se greffent divers atomes. De même, Charles Gerhardt imagine des « types chimiques » dont il tire des formules qu’il dénomme formules rationnelles. Rationnelles, car elles permettent d’induire des analogies et de classer les composés, mais ces formules structurales ne prétendent pas livrer une représentation de la réalité. Ce sont des formules, c’est à dire des façons de parler (ou plutôt des façons d’écrire) et de deviner ce qui se passe dans les combinaisons chimiques (Blondel-Mégrelis, 1996 ; Brooke, 1975). Contrairement à la vision intuitive d’une architecture moléculaire bien réelle qui aurait le pouvoir d’expliquer ce qui se passe aux niveaux supérieurs, les pionniers de la chimie structurale ne croient pas à la réalité physique des atomes et molécules. Pour Gerhardt, les radicaux ou groupements d’atomes n’existent pas comme des entités physiques isolables. Ce sont seulement des schèmes taxonomiques, qui manifestent des analogies, des homologies. Le radical est « le rapport suivant lequel se substituent ou se transportent d’un corps à un autre, dans la double décomposition, certains éléments ou groupes d’éléments » (Gerhardt, 1856, p. 568-569). Gerhardt, comme August von Kekulé, qui a proposé la structure hexagonale du benzène, base de tous les composés aromatiques, ne se prononcent pas sur l’existence réelle des atomes déclarant qu’on ne peut rien savoir sur la consti-
tution réelle des substances et prévient toute représentation réaliste de ses types chimiques (Bensaude Vincent, 2008).
L’explication des propriétés par la structure ne consiste donc pas, comme on le laisse entendre dans l’enseignement, à déduire des propriétés macroscopiques de la structure et de la conformation topologique d’entités microscopiques préalables. Les formules structurales sont plutôt à voir comme des « outils de papier » (Klein, 2002) qui permettent de prévoir et de synthétiser des corps aux propriétés nouvelles. Les propriétés observées ne sont pas déduites de la structure réelle des atomes ; elles sont construites à partir de ces formules grâce aux opérations de synthèse. Bachelard (1953) a beaucoup insisté sur cette originalité de la démarche chimique qu’il nomme matérialisme rationnel. Il reprend une citation de Laurent (« La chimie d’aujourd’hui est devenue la science des corps qui n’existent pas ») en la détournant de son sens polémique (critique des radicaux imaginés par ses contemporains, notamment Berzelius) pour exalter le pouvoir créateur des formules rationnelles. Les composés sont fictifs, prévus avant d’être réels. La chimie est une science qui va du fictif au factice. L’image pensée ou rêvée par Kekulé d’un hexagone du benzène avec deux doubles liaisons oscillantes a stimulé la prévision de nombreux isomères di-substitués du benzène. Koerner isole les isomères ortho-, méta- et para- du benzène répondant aux différentes positions des doubles liaisons. Mais en sens inverse, Jacobus Henricus van ’t Hoff a tiré argument de la non-existence de certains isomères du méthane pour penser l’atome du carbone dans l’espace. En effet, si l’on imagine un atome plan avec quatre valences, beaucoup d’isomères sont possibles. Or la
plupart d’entre eux sont des « objets qui n’existent pas » au sens de Laurent. Donc leur non-existence invalide la théorie qui les inspire. On voit que les formules structurales fictives fonctionnent doublement comme outils de prédiction : tantôt elles sont un outil de validation par le faire, en passant « du fictif au factice », comme dit Bachelard ; tantôt elles servent à invalider, pour réfuter, par l’impossibilité de faire.
On voit donc que dans la recherche chimique les structures ne sont pas pensées comme des causes bien réelles d’où on pourrait déduire des effets non moins réels. Elles sont plutôt pensées comme des êtres fictifs ou de simples formules qui guident la pratique des synthèses. Elles sont un peu à la chimie ce que les « expériences de pensée » sont à la physique (Ramberg, 2001).
Le modèle linéaire à l’épreuve des fonctions
Le chemin structure d’où propriétés est pourtant effectivement pratiqué, mais pas nécessairement par les chimistes. Il a plutôt contribué à la transformation de la métallurgie en une science nouvelle vers le milieu du xxe siècle : la physique du solide (Hoddeson et al., 1992). La diffraction des rayons X en donnant accès à la microstructure des métaux a permis d’établir une relation entre certaines propriétés bien connues de divers métaux et alliages avec une structure caractéristique. Puis la microscopie électronique a permis de connecter les propriétés conductrices à la présence ces défauts (sites vacants, dislocations) dans la structure électronique de ces cristaux. Comme le souligne l’un des pionniers de la science des matériaux en Grande Bretagne, Robert W. Cahn : « La catégorie scientifique de microstructure est
la contribution spécifique de la physique métallurgique à l’étude de la physique du solide, et fut par la suite étendue à la science des matériaux » (Cahn, 1987, p. 85).
Plus que la chimie, la science des matériaux, qui émerge comme une discipline à part entière dans les années 1960, semble en effet emprunter le chemin qui va de structure à propriétés, qu’elle prolonge jusqu’aux fonctions. Et il ne s’agit plus seulement de fonctions au sens chimique, mais de fonctions au sens de performances. En effet, les matériaux se définissent généralement par leurs utilisations à des fins techniques : ainsi, par exemple, le terme verre dans la langue commune désigne tout gobelet destiné à la boisson même s’il est en carton ou en plastique!
La séquence « structure > propriétés > fonctions » commande l’organisation des manuels de science des matériaux (Bensaude Vincent, 2001). Typiquement, ils commencent par quelques chapitres de physique atomique et quantique, ensuite viennent des chapitres consacrés aux diverses familles de matériaux : métaux, céramiques, matériaux pour l’électronique, etc. Comme si les propriétés et fonctions des « matériaux pour… » étaient simplement déductibles des structures. Bref, comme si des principes généraux de la science découlaient les avancées technologiques. C’est un cliché que développent bien souvent les introductions de ces manuels : ils racontent que, pendant des siècles, la connaissance des matériaux fut purement empirique, et fut acquise par des pratiques aveugles, ignorantes des raisons du choix de tel ou tel matériau. Mais au xxe siècle, tout aurait changé : la physique des solides venant éclairer les pratiques aveugles et se mettre au service des progrès techniques.
L’exposé didactique masque le contraste des démarches entre la physique et la science des matériaux. Bien que la structure électronique des atomes soit considérée comme la clé, elle ne tient pas le même rôle dans les deux contextes. Plus exactement, en science des matériaux, on n’étudie pas la structure des atomes ni les lois qui président à leur organisation, mais une configuration précise qui détermine une propriété désirée, source potentielle de performances. On s’intéresse à ce que font les structures plutôt qu’à ce qu’elles sont. C’est la fonction, au sens large de performance, qui transforme une substance chimique connue en matériau. Dans bien des cas, la recherche procède à partir de l’étude approfondie d’un matériau dont les propriétés présentent quelque intérêt dans un contexte économique ou technologique donné. Par exemple, le silicium a fait l’objet de recherches intensives du jour où ses propriétés de semi-conducteur en ont fait un matériau stratégique pour la micro-électronique naissante. Ou encore une substance aussi commune que l’alumine est devenue une vedette dans les années 1970 quand la forme alumine-β (fig. 3) a été perçue comme un matériau potentiel d’électrolyte solide pour batteries destinées à alimenter des véhicules électriques. Le capital de savoir amassé sur ce matériau, grâce à un fort investissement de recherche, on a amassé un capital de savoir sur l’alumine-β qui est devenue un matériau-modèle. À partir de ce matériau singulier, ont été dégagées les conditions structurelles générales d’une bonne conductivité ionique. Et du général, on a pu déduire que d’autres matériaux de structure analogue étaient aussi des candidats à la fonction
d’électrolyte solide. En d’autres termes, dans la science des matériaux, le passage par la structure générale n’est qu’un moment de la démarche investigatrice, encadrée aux deux bouts par l’étude des singularités. La structure entre dans la recherche comme un niveau de généralité qui permet d’aller d’une singularité à l’autre. Mais les structures ne sont objets propres de la recherche en science des matériaux que dans la mesure où elles sont supports de propriétés intéressantes.
matériau : étant donné tel ensemble de fonctions visées, définir les propriétés requises pour les accomplir puis trouver la structure optimale pour supporter ces propriétés et les procédés pour la fabriquer. Mais cette démarche linéaire est purement théorique. L’approche ingénieur bouscule le triplet conceptuel « structure > propriétés > fonctions ». Ce n’est plus un axe central, une poutre maîtresse, mais seulement la base d’un réseau de concepts qui forme la charpente de la science des

Figure 3. L’alumine-β est un oxyde ternaire ordinaire identifié comme une forme allotropique de l’alumine en 1916, dans le procédé Bayer pour la préparation de l’alumine. Dans les années 1970, l’alumine-β attire un gros effort de recherche de la part des chimistes du solide grâce à sa fonction de conduction ionique.
En effet, contrairement à la physique du solide, la science des matériaux a une orientation très appliquée. On parle d’ailleurs généralement de science et génie des matériaux. L’intime connexion d’une base scientifique et d’une approche ingénieur caractérise le profil de ce qu’on appelle désormais les technosciences. S’il est vrai que le chemin structurepropriété qui est l’axe de la physique du solide fut une étape nécessaire pour former une notion générale de matériaux à partir du concept de solide, ce n’est pas une condition suffisante. Un solide n’est pas un matériau, non seulement parce qu’il y a des matériaux liquides ou gazeux mais aussi et surtout parce qu’un matériau se définit par ses fonctions.
On pourrait certes poser ainsi le problème de la recherche d’un
matériaux. Il faut en effet introduire un quatrième acteur, le procédé, car la science des matériaux ne se contente pas de concevoir sur le papier, ou sur l’écran, une belle structure en vue d’une ou plusieurs fonctions visées. Il faut la « réaliser », produire un échantillon concret palpable pour le soumettre ensuite à tous les tests nécessaires à sa mise en œuvre. Il faut donc convoquer le génie des procédés, ou chemical engineering, pour choisir une structure adaptée à la fonction visée. La relation structure-propriété n’était que l’amorce, la première étape d’une méthode bien plus complexe. En réalité, il faut aller et venir d’un terme à l’autre, considérer la faisabilité des procédés pour sélectionner une structure, chercher des compromis entre les quatre pôles (struc-
ture, propriétés, fonctions et procédés) en circulant dans un espace présenté comme un tétraèdre (fig. 4). Cette démarche qui consiste à décomposer le matériau concret selon quatre points de vue ou en fonction des quatre paramètres (structure, propriété, fonction, procédés) invite à voir le matériau comme un tout, comme un système où tout se tient.

Figure 4. Ce tétraèdre illustre l’approche systémique de la science et génie des matériaux.
Mais cette approche systémique, hybride de science et d’ingénierie, ne signifie pas pour autant un renoncement aux ambitions cognitives. Car les procédés de synthèse d’un matériau affectent sa structure comme ses propriétés. C’est donc un enrichissement de la connaissance. La science des matériaux peut être source d’avancées scientifiques. Plus exactement, elle livre un autre regard sur la nature. Alors qu’une science limitée à la logique « structured’où-propriétés-d’où-fonctions » construit une représentation idéale de la nature qui atteint des principes généraux en faisant abstraction des frottements, des pertes de masse, de chaleur, de travail… le réel que construit le tétraèdre structure (propriétés, fonctions, procédés) n’est plus un idéal abstrait sans rapport avec le monde vécu de l’expérience quotidienne.
Conclusion
On voit que la séquence linéaire « structure-d’où-propriétés-d’où-fonctions » qui semble aller de soi est en fait hautement problématique. Par les présupposés qu’elle enveloppe elle modèle notre vision des corps matériels sur une rationalité scientifique qui procède du général au particulier, et déduit le comportement des matériaux singuliers des propriétés de la matière en général. Cette approche encourage le partage entre science pure et science appliquée, ou plus précisément le postulat que la technique est une résultante des avancées de la science pure. En revanche, les technosciences comme la science des matériaux, les nanotechnologies ou les biotechnologies qui sont tournées vers l’utilité, la société ou l’économie, invitent à une remise en question de ce partage et à un renouvellement des méthodes d’éducation.
Références
BachelarD, g (1953). Le matérialisme rationnel. Paris : PUF
BensauDe vincent, B. (2001). « The construction of a discipline : materials science in the USA ». Historical Studies in the Physical and Biological Sciences, nº 31, part 2, p. 223-248. — (2008). Matière à penser : Essais d’histoire et de philosophie de la chimie. Paris : Presses Universitaires de Paris Ouest.
BlonDel-mégrelis, m (1996). Dire les choses : Auguste Laurent et la méthode chimique. Paris : Vrin.
Brooke, J. (1975). « Laurent, Gerhardt, and the philosophy of chemistry ». Historical Studies in the Physical Sciences, nº 6, p. 405-429.
cahn, r w (1987). « Solid state physics and metallurgy ». À : weaire, D. L.; winDsor, C. G. (éd.). Solid state science : Past, present, predicted. Bristol : Adam Hillger, p. 79-108.
gerharDt, c (1856). Traité de chimie organique. Vol. IV. Paris : Firmin-Didot.
hoDDeson, l.; Braun, e.; teichman, J.; weart, s (éd.) (1992). Out of the crystal maze : Chapters from the history of solid state physics. Oxford : Oxford University Press.
kean, s (2010). The disappearing spoon and other true tales of madness, love, and the history of the world from the periodic table of elements. New York : Back Bay Books.
klein, u (2002). Experiments, models and paper tools : Cultures of organic chemistry. Stanford : Stanford University Press. perrin, J. (1913). Les atomes. Paris : Alcan. [Cité dans la réédition Paris : PUF, 1948]
ramBerg, p (2001). « Paper tools and fictional worlds : prediction, synthesis, and auxiliary hypotheses in chemistry ».
À : klein, U. (éd.). Tools and modes of representation in the laboratory sciences. Dordrecht : Kluwer Academic Publications, p. 61-78.

Bernadette Bensaude Vincent
A été professeur à l’UFR de philosophie de l’Université Paris 1 Panthéon-Sorbonne. Parmi ses publications plus récentes, il convient de mentionner Fabriquer la vie. Où va la biologie de synthèse ? (2011), Les vertiges de la technoscience. Façonner le monde atome par atome (2009) et Chemistry. The impure science (2008). Sa recherche actuelle s’est focalisée dans l’histoire des sciences chimiques ainsi que des nano- et biotechnologiques. Courriel : bensaudevincent@gmail.com
Enlace químico y estructura: construcción de modelos y explicaciones a partir de datos experimentales
Enllaç químic i estructura: construcció de models i explicacions a partir de dades experimentals
Chemical bonding and structure: building models and explanations from experimental data
Vicente Talanquer / Universidad de Arizona. Departamento de Química y Bioquímica (EUA)
resumen

Reformas educativas en la enseñanza de las ciencias en todos los niveles educativos en los últimos treinta años han enfatizado la necesidad de involucrar a los estudiantes de manera más activa en la construcción de su propio conocimiento. En particular, se espera que los estudiantes no solo adquieran conocimientos fundamentales, sino también que comprendan cómo tales conocimientos se generan a partir de observaciones y mediciones. En esta contribución se describe una secuencia de actividades guiada por esta filosofía educativa e implementada en un curso de química general a nivel universitario.
palabras clave
Enlace químico, enseñanza, prácticas científicas, química general.
resum
Reformes educatives en l’ensenyament de les ciències a tots els àmbits educatius en els últims trenta anys han posat l’èmfasi en la necessitat d’involucrar els estudiants d’una manera més activa en la construcció del coneixement propi. En particular, s’espera que els estudiants no només adquireixin coneixements fonamentals, sinó també que comprenguin com aquests coneixements es generen a partir d’observacions i mesures. En aquesta contribució es descriu una seqüència d’activitats guiada per aquesta filosofia educativa i implementada en un curs de química general en l’àmbit universitari.
paraules clau
Enllaç químic, ensenyament, pràctiques científiques, química general.
abstract
Reform efforts in science education at all educational levels in the last thirty years have emphasized the need for more actively engaging students in the construction of their own understandings. In particular, it is expected that students will not only acquire fundamental knowledge, but also learn how such knowledge is developed from observations and measurements. In this contribution we describe a set of activities guided by this educational philosophy and implemented in a general chemistry course at the college level.
keywords
Chemical bonding, teaching, scientific practices, general chemistry.
Introducción
Las llamadas a transformar la enseñanza de las ciencias en los últimos años enfatizan la necesidad de crear más oportunidades para que los estudiantes se involucren de manera activa en la generación de explicaciones y argumentos sobre problemas relevantes (National Research Council, 2011). Se espera que los alumnos desarrollen la capacidad para analizar datos, identificar regularidades y crear o utilizar modelos para dar sentido a observaciones sobre las propiedades y el comportamiento de sistemas de interés. El objetivo no es que los estudiantes «descubran» por sí solos las leyes y principios de la química u otras ciencias, sino que comprendan y ganen experiencia en la aplicación de prácticas científicas, al mismo tiempo que desarrollan sus conocimientos sobre conceptos e ideas centrales en cada disciplina.
Convencidos de los beneficios de involucrar a los estudiantes de manera más activa en la construcción de ideas en clase, en los últimos ocho años hemos trabajado en la transformación del curso introductorio de química general en la Universidad de Arizona. La filosofía general de nuestra reforma educativa se centra en ayudar a los estudiantes a desarrollar formas de «pensamiento químico» que son de gran utilidad en el análisis y la resolución de problemas en diversas áreas, desde la contaminación ambiental hasta el desarrollo de fuentes alternativas de energía (Talanquer y Pollard, 2010; Talanquer, 2014). Como parte del proceso de reforma, hemos generado diversas unidades didácticas centradas en la construcción de conceptos centrales en química a partir del análisis de datos experimentales sobre los siste-
Un objetivo central de los cursos introductorios de química es que los estudiantes aprendan a relacionar las propiedades físicas y químicas de las sustancias con su estructura a nivel submicroscópico
mas de interés. En particular, en esta contribución se describe la secuencia de actividades que utilizamos para ayudar a los estudiantes a dar respuesta a una pregunta esencial en química: ¿por qué se forman enlaces químicos entre átomos?
Las actividades que se presentan en este artículo ilustran nuestro método de trabajo en clase con más de doscientos alumnos. Estos alumnos trabajan frecuentemente en grupos de dos o tres personas, bajo la guía y con el apoyo de un instructor principal y varios estudiantes asistentes.
¿Por qué se forman enlaces químicos entre átomos?
Un objetivo central de los cursos introductorios de química es que los estudiantes aprendan a relacionar las propiedades físicas y químicas de las sustancias con su estructura a nivel submicroscópico. Esta tarea demanda que los estudiantes comprendan cómo y por qué se forman enlaces químicos entre los diversos tipos de átomos que componen una sustancia. En particular, en nuestro curso de química general, nos interesa que los estudiantes reconozcan que, cuando dos o más átomos interaccionan, comúnmente se producen redistribuciones electrónicas que reducen la energía total de los átomos en interacción. Cuando esto pasa, decimos que la formación de enlaces da lugar a siste-
mas más estables, pues se requiere invertir energía para separar los átomos que los componen. El tipo de redistribución electrónica que se produce depende de la naturaleza de los átomos involucrados y determina el tipo de enlace que se forma entre ellos.
Análisis de datos
Dado nuestro interés en que los estudiantes reconozcan los cambios energéticos asociados a la formación de enlaces químicos, el trabajo en el aula se centra en ayudar a los estudiantes a desarrollar modelos sobre la distribución de los electrones en distintos niveles energéticos en diversos átomos y moléculas. Para ello utilizamos datos experimentales generados por espectroscopia fotoelectrónica (Gillespie, Spencer y Moog, 1996 a ). Esta técnica de análisis se basa en la extracción de electrones de los átomos o moléculas de interés haciendo uso de radiación electromagnética de alta energía (rayos X). La diferencia entre la energía de la radiación incidente y la energía cinética de los electrones removidos es una medida de la energía requerida para ionizar los diferentes electrones presentes en el sistema. Los resultados experimentales pueden representarse en espectros como los ilustrados en la fig. 1 para los átomos de hidrógeno, flúor y sodio. Estos espectros incluyen información sobre la energía
El trabajo en el aula se centra en ayudar a los estudiantes a desarrollar modelos sobre la distribución de los electrones en distintos niveles energéticos en diversos átomos y moléculas
Nos interesa que los estudiantes comparen y contrasten los espectros de diferentes átomos para identificar similitudes y diferencias, así como regularidades en la estructura de los espectros en función del número atómico
necesaria para ionizar distintos grupos de electrones (eje de las abscisas) y sobre el número de electrones en cada grupo (eje de las ordenadas). Para facilitar el trabajo de los estudiantes, hemos construido una herramienta computacional interactiva que les permite desplegar el espectro fotoelectrónico de diversos átomos y moléculas de forma individual o por pares



(Talanquer, 2009). Esta herramienta está disponible en la siguiente página web: https:// sites.google.com/site/ctinteractives/ atomic-structure (seleccione «Photolectron Spectra»).
La primera tarea de los estudiantes es analizar varios de estos espectros y discutir en pequeños grupos la información que nos proporcionan. En particular, nos interesa que los estudiantes comparen y contrasten los espectros de diferentes átomos para identificar similitudes y diferencias, así como regularidades en la estructura de los espectros en función del número atómico. Por ejemplo, se espera que los estudiantes reconozcan la presencia, en cada tipo de átomo, de grupos de electrones con la misma energía de ionización; la presencia de números característicos de electrones (2, 6, 10) en cada uno de estos grupos; la existencia de grupos de electrones equivalentes en distintos tipos de átomos, y la relación entre número atómico y energías de ionización en grupos equivalentes de electrones en distintos átomos.
Construcción de modelos
El análisis de los espectros de espectroscopia fotoelectrónica se utiliza para crear la necesidad de generar explicaciones sobre las similitudes, diferencias y regularidades observadas. Estas explicaciones demandan la construcción de modelos sobre la distribución de electrones en cada tipo de átomo. Con este fin, solicitamos a los estudiantes que colaboren en la elaboración de dibujos y diagramas que representen la distribución de los electrones en un átomo de manera que sean consistentes con los resultados experimentales. Estos dibujos y diagramas deben representar tanto la distribución de los electrones en el espacio como en distintos niveles de energía. Si es
necesario, construimos de forma colectiva estas representaciones para un tipo de átomo (fig. 2) y, después, pedimos a los estudiantes que extiendan estas ideas a otros sistemas.
difícil entender la relación entre energía potencial de los electrones y su energía de ionización: cuanto menor sea el valor de la energía potencial (más negativo), mayor será la energía de ioniza-

Durante la construcción y representación de los modelos, se espera que los estudiantes reconozcan y comprendan las relaciones entre energía de ionización, fuerza de atracción entre protones y electrones en un átomo y energía potencial de este sistema de partículas. En general, la mayoría de nuestros estudiantes asocia con facilidad la energía de ionización con la distancia relativa entre diferentes grupos de electrones y el núcleo atómico (a mayor distancia, menor fuerza de atracción y menor energía de ionización). Esto les facilita la construcción de diagramas tipo «átomo de Bohr», que ilustran distribuciones electrónicas espaciales consistentes con los datos experimentales (fig. 2). Sin embargo, un gran número de alumnos tiene dificultades para generar los diagramas energéticos correspondientes. Les resulta particularmente
ción. Es por ello que gran parte de nuestro trabajo en esta etapa se centra en ayudar a los estudiantes a entender de manera significativa el concepto energía potencial, así como la relación entre cambios en la posición
relativa de partículas en interacción y cambios en la energía potencial y cinética de sistemas atómicos.
Generación de explicaciones y predicciones
Una vez que los estudiantes generan diagramas energéticos correspondientes a distintos tipos de átomos, su trabajo se dirige a la comparación y contrastación de estas representaciones con el fin de identificar diferencias, similitudes y regularidades en su estructura. En un principio, este análisis se realiza de forma cualitativa (fig. 3).
Nuestro objetivo es que los estudiantes reconozcan que los datos experimentales pueden explicarse si asumimos que: a) los electrones en cada átomo ocupan niveles de energía con valores específicos; b) no todos los electrones ocupan el mismo nivel de energía; c) existe un número máximo de electrones en cada nivel de energía, y d) la distribución de niveles de energía es similar para los distintos átomos, aunque los valores de la energía asociada con cada nivel dependen del número atómico. Los estudiantes también pueden

notar que los electrones de valencia en átomos metálicos tienden a ocupar niveles energéticos con mayor energía que los electrones de valencia en átomos no metálicos.
Dado nuestro interés en ayudar a los estudiantes a generar y utilizar modelos para generar explicaciones y hacer predicciones, el trabajo en el aula constantemente se dirige a esta meta. Por ejemplo, el análisis de los diagramas espaciales y energéticos abre la puerta a plantear una pregunta central en la comprensión de cómo y por qué se forman enlaces entre átomos: ¿cómo esperamos que los niveles energéticos y la distribución de electrones se modifiquen cuando dos átomos entren en interacción? Antes de presentar los datos experimentales que permiten dar respuesta a esta pregunta, solicitamos a los estudiantes que hagan predicciones y las justifiquen con base en sus modelos y conocimientos sobre los efectos de interacciones entre electrones y protones. Esta actividad nos permite evaluar la comprensión de los estudiantes y clarificar conceptos e ideas, si es necesario.
Evaluación de predicciones
Con el fin de verificar sus predicciones acerca de los efectos de interacciones atómicas sobre la distribución de
electrones, los estudiantes analizan los espectros fotoelectrónicos de dos moléculas distintas: H2 y HF


Figura 4. Espectro fotoelectrónico de la molécula de: a) hidrógeno y b) fluoruro de hidrógeno.

Con el fin de verificar sus predicciones acerca de los efectos de interacciones atómicas sobre la distribución de electrones, los estudiantes analizan los espectros fotoelectrónicos de dos moléculas distintas: H2 y HF. Este análisis se hace de manera gradual, comenzando por la molécula de hidrógeno (fig. 4a). Como se hizo con anterioridad, el trabajo de análisis implica generar diagramas espaciales y energéticos que sean compatibles con los datos experimentales, y comparar y contrastar dichas representaciones con las de los átomos individuales (fig. 5). Este análisis revela que la formación de un enlace viene acompañada por la redistribución de un par de
Figura 5. Diagramas energéticos cualitativos correspondientes a dos átomos de hidrógeno (H) individuales y a la molécula de hidrógeno (H2 ).
electrones de valencia en niveles con menor energía que los que
ocupaban en los átomos individuales. Como resultado de esta redistribución, la energía total del sistema disminuye. Este fenómeno se verifica a través de la comparación de los espectros fotoelectrónicos de los átomos de hidrógeno (fig. 1a) y flúor (fig. 1b) con el de la molécula de fluoruro de hidrógeno (fig. 4b).
Extensiones
El trabajo descrito en las secciones anteriores puede completarse en tres o cuatro horas de trabajo en el aula. Sin embargo, el análisis y las discusiones de los estudiantes pueden ser extendidos y enriquecidos en varias direcciones. Por ejemplo, los datos experimentales contenidos en los espectros fotoelectrónicos de átomos y moléculas pueden utilizarse para cuantificar la energía de ionización promedio de los electrones de valencia en cada tipo de sistema. Esta energía de ionización promedio < EI > se define de la siguiente manera (Gillespie, Spencer y Moog, 1996b):

donde a y b son los números de electrones en cada nivel de valencia, y EIa y EIb son las energías de ionización correspondientes a los electrones en dichos niveles. A continuación se muestran los resultados cuando esta relación se aplica a los datos representados en la fig. 1 para los átomos de hidrógeno (H), flúor (F) y sodio (Na):
La información contenida en los espectros fotoelectrónicos de átomos y moléculas también puede utilizarse para introducir el concepto energía de enlace y realizar estimaciones de su valor para un par de moléculas
entre los electrones de valencia y los protones en el núcleo de cada átomo. Estas cantidades son, de hecho, una medida indirecta de la electronegatividad de cada tipo de átomo, por lo que su cálculo en el aula también puede utilizarse para introducir este concepto a partir del análisis de datos experimentales. Haciendo uso de los diagramas energéticos construidos por los alumnos, la diferencia de electronegatividades entre dos átomos puede relacionarse con la diferencia en el promedio de la energía potencial de sus electrones de valencia. De esta manera, lo que tradicionalmente se presenta como una «tendencia» de los electrones en un enlace a desplazarse en la dirección del átomo más electronegativo puede explicarse en términos de redistribución de electrones desde estados de alta energía potencial a estados de menor energía potencial.
La información contenida en los espectros fotoelectrónicos de átomos y moléculas también puede utilizarse para introducir el concepto energía de enlace y realizar estimaciones de su valor

Estos números son una medida de la fuerza de atracción
para un par de moléculas. La magnitud de la energía de enlace
debe ser cercana a la disminución en la energía de los electrones cuando el enlace se forma (o a la energía requerida para separar los átomos y retornar los electrones a sus niveles energéticos originales). Por ejemplo, los datos contenidos en la fig. 1a para el átomo de hidrógeno y en la fig. 4a para la molécula de hidrógeno sugieren que la formación de una molécula de H2 causa una disminución en la energía potencial de cada electrón igual a la diferencia en energías de ionización: (1,31 − 1,49) MJ/mol = −0,18 MJ/mol. La energía de enlace puede entonces estimarse como 2 × 0,18 MJ/mol = 360 kJ/mol. Aunque este número difiere del valor experimental (432 kJ/mol), su cálculo y las discusiones asociadas a él ayudan a los estudiantes a comprender de mejor modo el concepto energía de enlace y a relacionarlo con cambios en la distribución de electrones en un sistema. Este análisis también hace patente que la formación de enlaces resulta en la disminución de energía total de los átomos involucrados e involucra, por tanto, una transferencia de energía desde el sistema hacia sus alrededores (proceso exotérmico). Varias investigaciones sobre concepciones alternativas en la enseñanza de la química han demostrado la gran dificultad que los estudiantes tienen para comprender la relación entre enlace químico y energía (Kind, 2004). Nuestro método de trabajo ha ayudado a reducir la incidencia de este tipo de problemas conceptuales entre nuestros alumnos.
Comentarios finales
La secuencia de actividades descrita en la sección anterior representa un ejemplo de cómo podemos ayudar a los estudiantes a construir conceptos e ideas centrales en química con base en el análisis de datos experimentales y en la generación de modelos
para explicarlos. Esta forma de involucrar a los estudiantes en la construcción de conocimientos puede utilizarse en el estudio de una gran variedad de temas presentes en los currículos tradicionales de química a nivel universitario y preuniversitario. Por ejemplo, nosotros usamos este abordaje en la discusión y el análisis de las propiedades físicas de compuestos moleculares y compuestos iónicos; en la caracterización de relaciones entre estructura y fuerza ácida, y en la caracterización de relaciones entre la estructura de reactivos y productos y la direccionalidad de las reacciones químicas. En todos estos casos, el análisis de datos permite identificar regularidades que pueden explicarse a través de la construcción de modelos sencillos de los sistemas de interés. Una vez que estos modelos se construyen, los utilizamos para realizar predicciones en otros contextos.
Este método de trabajo con los estudiantes tiene varias ventajas. Primero, ayuda a los alumnos a entender mejor las prácticas científicas y el proceso de generación de conocimientos en la disciplina bajo estudio. Segundo, involucra a los estudiantes de forma activa en la construcción de conceptos e ideas, haciendo más explícitas las conexiones entre las propiedades y fenómenos que observamos y los modelos y teorías que se generan para explicarlos. Tercero, el proceso de construcción de conocimientos fortalece la habilidad de los estudiantes para generar explicaciones mecanísticas de sistemas y procesos químicos, esto es, explicaciones basadas en el análisis de las interacciones entre partículas en un sistema y sus efectos en la distribución espacial y energética de sus componentes. Estas explicaciones mecanísticas contrastan con las explicaciones
teleológicas que muchos estudiantes generan tras ser expuestos a la enseñanza tradicional sobre el enlace químico. Las explicaciones teleológicas atribuyen propósitos al comportamiento de los átomos, considerando que estas partículas forman enlaces porque quieren alcanzar un estado más deseable (Talanquer, 2013).
Desde la perspectiva docente, la enseñanza centrada en el análisis de datos, la generación de modelos y la construcción de explicaciones y argumentos crea múltiples oportunidades para evaluar formativamente el conocimiento de los estudiantes y proporcionarles apoyo de manera más efectiva. En este método de trabajo, los estudiantes expresan sus ideas públicamente, ya sea en pequeños grupos; en forma de dibujos, diagramas y esquemas que comparten con el maestro y con otros compañeros, o en discusiones generales que involucran a toda la clase. Estas representaciones públicas de ideas permiten desarrollar una mejor comprensión de las dificultades de aprendizaje con que se enfrentan los alumnos y abren la puerta a la retroalimentación constante de manera individual o colectiva. Este método de trabajo no solo ha incrementado la motivación de los estudiantes en nuestros cursos de química general, sino también los conocimientos que demuestran en exámenes finales estandarizados.
Referencias
gillespie, R. J.; spencer, J. N.; moog, R. S. (1996a). «Demystifying introductory chemistry: electron configurations from experiment». Journal of Chemical Education, n.º 73, p. 617-622. — (1996b). «Demystifying introductory chemistry: ionization energies, electronegativity, polar bonds and partial changes». Journal of Chemical Education, n.º 73, p. 627-631.
kinD, V. (2004). Beyond appearances: Students’ misconceptions about basic chemical ideas. 2.ª ed. Londres: Royal Society of Chemistry. También disponible en línea en: <http://www.rsc. org/images/Misconceptions_ update_tcm18-188603.pdf> [Consulta: setembre 2015] national research council (2011). A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. Washington: The National Academies Press.
talanquer, V. (2009). «Construyendo puentes conceptuales entre las varias escalas y dimensiones de los modelos químicos». Educació Química EduQ, n.º 5, p. 11-17.
— (2013). «When atoms want». Journal of Chemical Education, n.º 90, p. 1419-1423. — (2014). «Desarrollando pensamiento químico en contextos sociales y ambientales».
Educació Química EduQ, n.º 17, p. 4-11.
talanquer, V.; pollarD, J. (2010). «Let’s teach how we think instead of what we know». Chemistry Education Research and Practice, n.º 11, p. 74-83.

Vicente Talanquer
Es profesor en la Universidad de Arizona. Autor o coautor de más de diez libros de texto para primaria y secundaria y de más de noventa artículos arbitrados de investigación en educación química y pensamiento docente. Su trabajo de investigación se centra en el estudio de las formas de razonamiento de los estudiantes y profesores de química. C. e.: vicente@email.arizona.edu
Hydrogen bond made visible by molecular modelling
Fer visible l’enllaç d’hidrogen mitjançant modelatge molecular
Jan Lundell / University of Jyväskylä (Finland)
abstract

Our understanding of hydrogen bonding is growing and becoming more precise. At the same time, the new knowledge challenges how hydrogen bonds is taught. Molecular modelling provides a modern tool on atomistic processes, and enables the researcher and student alike to study how atomic level processes happen and how the changes that occurre impact the energetics of the system.
keywords
Chemical bond, hydrogen bond, computational chemistry.
resum
La nostra comprensió de l’enllaç d’hidrogen s’està tornant més profunda i precisa. Al mateix temps, el nou coneixement desafia la nostra manera d’ensenyar l’enllaç d’hidrogen. El modelatge molecular proporciona una eina moderna per abordar els processos atòmics, i permet tant a l’investigador com a l’estudiant analitzar com tenen lloc els processos en el nivell atòmic i com els canvis que es produeixen modifiquen l’energia del sistema.
paraules clau
Enllaç químic, enllaç d’hidrogen, química computacional.
Introduction
Chemical bonding is one of the key concepts in chemistry. For over a century chemists have used straight lines to describe the sharing of electrons between atoms or dotted lines describing the interaction between atoms and molecules. Learning chemistry requires understanding of the physical forces behind chemical bonds, understanding how the consequences of interactions on the microscopic level appear on the macroscopic level, and how the chemical bonds are presented. Hydrogen bonding is a prevalent and important intermolecular interaction, which is frequently addressed in chemistry education and learning. The different models and representations used in connection with explaining and conceptualizing hydrogen bonding
yield a challenging task for the learners to understand and apply hydrogen bonding as a chemical concept. A wide literature has been published discussing the nature of hydrogen bond (fig. 1, taken from author’s bookshelf) and the consequences of hydrogen bond in nature and in research.

The current definition of the hydrogen bond
The hydrogen bond is an attractive interaction between a hydrogen atom from a molecule or a
molecular fragment X–H, in which X is more electronegative than H, and an atom or a group of atoms in the same or a different molecule, in which there is evidence of bond formation. A typical hydrogen bond may be depicted as X–H···Y–Z, where the three dots denote the bond. X–H represents the hydrogen bond donor. The acceptor may be an atom or an anion Y, or a fragment or a molecule Y–Z, where Y is bonded to Z. In some cases, X and Y are the same. In more specific cases, X and Y are the same, and X–H and Y–H distances are the same as well leading to symmetric hydrogen bonds. In any event, the acceptor is an electron rich region such as, but not limited to, a lone pair of Y or π-bonded pair of Y–Z (Arunan el al., 2011).
This revised definition is in line with the original definition given by
Linus Pauling already in 1939 focusing on hydrogen-mediated interaction between electronegative atoms or moieties. This thought has been translated to literature and school books in the light of biological chemistry so that hydrogen bond is something that occurs only if there is oxygen, nitrogen and fluorine present. And this is what students tend to memorise by heart. However, going deeper in the origin of the interaction becomes clear that they are many aspects of the interaction and its appearance, which are neglected in education (even at the university level). This is mainly because things tend to be presented in a simplified manner, but restrictions of the model used or the validity of the model applied is downplayed.
Criteria for a hydrogen bond
Criteria for a hydrogen bond X–H···Y–Z according to IUPAC (Arunan et al., 2011) are the following:
1) The forces involved in the formation of a hydrogen bond include those of an electrostatic origin, those arising from charge transfer between the donor and acceptor leading to partial covalent bond formation between H and Y, and those originating from dispersion.
2) The atoms X and H are covalently bonded to one another and the X–H bond is polarized, the H···Y bond strength increasing with the increase in electronegativity of X.
3) The X–H···Y angle is usually linear (180º) and the closer the angle is to 180º, the stronger is the hydrogen bond, and the shorter is the H···Y distance.
4) The length of the X–H bond usually increases on hydrogen bond formation leading to a red shift in the infrared X–H stretching frequency and an increase in the infrared absorption cross-section for the X–H stretching vibration. The greater the lengthening of the X–H bond in X–H···Y, the stronger is the H···Y bond. Simultaneously,
new vibrational modes associated with the formation of the H···Y bond are generated.
5) The X–H···Y–Z hydrogen bond leads to characteristic NMR signatures that typically include pronounced proton deshielding for H in X–H, through hydrogen bond spin-spin couplings between X and Y, and nuclear Overhauser enhancements.
6) The Gibbs energy of formation for the hydrogen bond should be greater than the thermal energy of the system for the hydrogen bond to be detected experimentally.
What follows from these distinct descriptors of the properties of a hydrogen bond is that the interaction we regard simple and straightforward have many facets that can’t be classified as a standard hydrogen bond. These definitions and characteristics also challenge researchers about the nature of bonding and scholars about teaching about hydrogen bonding. In the end, what we call a hydrogen bond is actually an electrostatic interaction where hydrogen happens to be mediating the interaction. Consequently, hydrogen bonding is not unique but a demonstration of a general phenomenon that can be extended to lithium bonding, halogen bonding or pnictogen bonding, just to name a few. What can be done is to understand the physical origin of the interaction and use that as a starting point for teaching and learning.
Noteworthy, the IUPAC criteria for hydrogen bonding employs structural, energetic and spectroscopic observables. The common nominator for all the observables is electrostatic nature of the interactive species. What is interesting is that IUPAC uses the concept of electronegativity, which appears to be a source of misconceptions in many cases, especially if the bonding classification is strictly
based on electronegativity differences (Ünal et al., 2006).
Molecular modelling makes interactions visible
Recent works in educational research in Israel have shown that change towards electrostatic models involving a current view of atoms and molecules with nuclei and electron clouds provide a better approach, so called bottom-up approach, from atoms and molecules via chemical interactions all the way to macroscopic properties (Levy Nahum et al., 2007).
A simplified model based on electrostatic interactions has recently been proposed by Joki et al. (2015). Both of these approaches take advantage of using electrostatic interactions on the atomistic level to explain behaviour and macroscopic consequences. All what is needed are positive nuclei and negative electron clouds forming the basis of the chemical interaction, especially in the case of intermolecular interactions. Also, one needs to understand how the energy changes when the interaction takes place. This is demonstrated in fig. 2 showing the hydrogenbonded complex of two water molecules. Both 2D and 3D models of the equilibrium structure (minimum energy structure) of the complex are shown on the left. The potential energy curve describes the change in energy when the distance between the two molecules is changed. The curve has been generated from one hundred single point quantum chemical calculations. The computed-equilibrium structure bond distances are also given in fig. 2 to demonstrate the elongation of the O–H bond upon interaction.
A more elaborate analysis of the interaction energy has revealed that the interaction results about 80 % from electrostatic interactions raised by permanent electrostatic moments like dipole
and quadrupole moments. The remaining 20 % originates from temporary fluctuations in the electron clouds, which we know as dispersive forces or Van der Waals interactions. From an educational point of view, the energy curve can be used to deduce the interaction energy from only two points of the curve as the energy difference between the energy of the equilibrium structure and the energy of the dissociated complex, i.e. when the molecules are detached from each other. This is observed as the energy curve flattening out on the right side of the graph. Using this approach it is seen that the computed interaction energy (strength of H-bond) in a water dimer is about 20 kJ/mol. This is close to what we consider to be a moderate and normal hydrogen bond prevalent in nature (Jeffrey, 1997).
Here, the current scientific approaches, especially computational methods, can be utilized to the benefit of education. A research conducted with high-school teachers revealed a distinct belief in molecular modelling to enhance and add value to chemistry learning and teaching (Aksela & Lundell, 2008). Molecular modelling provides us tools to see and understand the interactions and changes in energy upon structural changes. Molecular modelling provides us a tool to observe the changes on the atomistic level (and to visualize them). This can be done in the classroom as it is done in a research laboratory to support experimental studies. Moreover, modelling programs can be easily employed as inquiry tools to study molecular properties, chemical reactions and even dynamical processes like solubility and phase transitions. Computers are becoming very cheap compared to their performance, and many computational programs originally developed for scientific research have been downscaled

Figure 2. Models of water dimer and an energy curve describing the change of potential energy of the system when the intermolecular distance changes. The curve is drawn according to computational data presented in.

Figure 3. Snapshots of a movie of breaking the hydrogen bond in water dimer. The pink line between the molecules is denoting the reaction coordinate used in the computations. The coloured shells describe the electron density of the water molecules: red is negative, blue is positive.
for educational purposes. This puts modern molecular modelling tools to the hands of teachers and students alike.
The water dimer is used here as an example to study hydrogen bonding. Modelling can provide information about energy changes, structural changes and electrostatic changes. The interaction between electron clouds of molecules provides a first-hand understanding where the change in the interaction energy comes from. This is seen in fig. 3 showing snapshots of a movie generated from the computed structures including the electron density maps. Such interactive movies can be used to study the results of the
computed system going back and forth to look on the details presented. The use of a movie dismiss the need of doing the actual computation, but acts as a good starting point for studying the complex and the consequences of the interaction even on macroscopic scale.
The University of Jyväskylä offers chemistry teacher students a special course on models and visualization in education. One of the goals is to teach how to use molecular modelling to support chemistry education and to visualize the atomistic processes. The movie on water dimer has been used as an exercise in the course to provide pre-service teachers hands-on experience of using
modeling programs and applying them in teaching practice. It has been noted to be important that the pre-service teachers have the own experience with modelling tools and ICT during their studies. This makes it easier for them to apply the tools available in a more pedagogical way. The course focuses on three types of modelling tools: 2D/3D drawin g tools (ChemSketch), animation tool (ChemSense) and molecular modelling tool (Spartan). Combining these tools together with Internet-based materials, electronic books and mind-map tools form a good basis to use ICT in a meaningful way in chemistry education. Learning these tools also prepare the students to the ever-changing ICT environment in society and education.
Some notes on chemical bonding
Many of the misconceptions on chemical bonding take place because of poor connection between microscopic and macroscopic levels of knowledge, because of insufficient models used and because of poor understanding of the concepts and phenomena (Özmen, 2004). Chemical bonding can be made much more clear and understandable if the students are introduced to electrostatic interactions and the concept of electron density. The latter is in fact an observable quantity whereas orbitals are not. Molecular modelling can make both of these visible on the computer screen, and deepen the learner’s understanding how atoms and molecules actually interact (and at the same time provide insight on the different structural models chemists use).
Molecular modelling can demystify learning of chemical bonding by introducing tools and approaches used in research laboratories. Currently, hydrogen bond researchers are discussing topological analysis of electron
density and extensive interaction energy decomposition schemes to quantify the hydrogen bond precisely. In education positive and negative charges being attractive or repulsive towards each other is a good starting point. Inclusion of structural and energy changes in a macroscopic context makes chemical bonding understandable, comprehensive and visually interesting.
Based on quantum chemical calculations all chemical bonds are similar in origin: they all appear because of electrostatic interactions between atoms and molecules. What makes chemical bonds different is the language we use to talk about them. Chemists want to distinguish different variations of chemical bonds by giving them distinct names. From educational point of view, the continuum of electrostatic interactions of different strengths provide a solid physical basis to understand shared electrons as in covalent bonding, coulombic interactions as in ionic bonded salts, directional and undirectional long range attractions like in hydrogen bonding and Van der Waals interactions, respectively. In the long run, understanding the origin of bonding is what counts both in research and in education.
References
aksela, M.; lunDell, J. (2008). «Computer-based molecular modelling: Finnish school teachers’ experiences and views». Chem. Educ. Res. Pract., No. 9, p. 301-308. arunan, E.; DesiraJu, G. R.; klein, R. A.; saDleJ, J.; scheiner, S.; alkorta, I.; clary, D. C.; craBtree, R. H.; DannenBerg, J. J.; hoBza, P.; kJaergaarD, H. G.; legon, A. C.; mennucci, B.; nesBitt, D. J. (2011). «Definition of the hydrogen bond (IUPAC recommendations 2011)». Pure Appl. Chem., vol. 83, No. 8, p. 16371641.
JeFFrey, G. A. (1997). An introduction to hydrogen bonding. Oxford: Oxford University Press.
Joki, J.; lavonen, J.; Juuti, K.; aksela, M. (2015). «Coulombic interaction in Finnish middle school chemistry: a systemic perspective on students’ conceptual structure of chemical bonding». Chem. Educ. Res. Pract., No. 16, p. 901-917. levy nahum, T.; mamlok-naaman, R.; hoFstein, A.; kraJcik, J. (2007). «Developing a new teaching approach for the chemical bonding concept aligned with current scientific and pedagogical knowledge». Sci. Educ., No. 91, vol. 4, p. 579-603.
Özmen, H. (2004). «Some student misconceptions in chemistry: a literature review of chemical bonding». J. Sci. Educ. Techn., No. 13, p. 147-159.
Ünal, S.; çalik, M.; ayas, A.; coll, R. K. (2006). «A review of chemical bonding studies: needs, aims, methods of exploring students’ conceptions, general knowledge claims and students’ alternative conceptions». Res. Sci. Techn. Educ., vol. 24, No. 2, p. 141-172.

Jan Lundell
Is professor of chemistry and responsible of chemistry teacher education at the Department of Chemistry, University of Jyväskylä (Finland). He is also the director of the Central Finland LUMA (STEM) Centre. His research interests include molecular interactions both from the educational and physical chemistry side, computational chemistry, light-induced chemistry, and using ICT in chemistry education. E-mail: jan.c.lundell@jyu.fi
Una incursió en el rerefons
històric de les idees de valència, enllaç i estructura química
A foray into the historical background of the ideas of chemical valence, bond and structure
Pere Grapí / Universitat Autònoma de Barcelona. Centre d’Història de la Ciència
resum

Per als estudiants, res és tan habitual com interpretar les lleis ponderals de la química mitjançant el concepte valència i exemplificar-les mitjançant compostos inorgànics simples. De la mateixa manera, aquestes substàncies inorgàniques solen utilitzar-se per exemplificar les nocions d’enllaç i estructura química en els llibres de text de química. No obstant això, l’itinerari d’aprenentatge no reflecteix l’aproximació històrica, atès que va ser en el camp de la química orgànica, més que en el de la inorgànica, on va existir la necessitat de conèixer la composició i l’estructura íntima dels compostos. Aquest article pretén explorar aquelles rutes que més significativament van contribuir al desenvolupament dels conceptes valència, enllaç i estructura química
paraules clau
València, enllaç químic, radical, estructura química, tipus.
abstract
For current students nothing is more natural than to interpret in valence terms the laws of chemical combination exemplified by simple inorganic compounds. Similarly, inorganic substances are often used to illustrate the concepts of chemical bond and structure in chemistry textbooks. However, the learning pathway does not reflect the historical approach, because there existed in the field of organic chemistry, rather than in inorganic chemistry, the need to know the inner structure and composition of their compounds. This article is intended to explore those routes that most significantly contributed to the development of the concepts of chemical valence, bond and structure
keywords
Valence, chemical bond, radical, chemical structure, type.
El desencís del «somni newtonià» i l’electrificació del canvi químic Una bona part dels químics del segle xviii trobà en la hipòtesi de Newton sobre l’existència d’una atracció de curt abast, anàloga a la gravitatòria però entre partícules dels cossos, la inspiració per progressar en la comprensió de les reaccions químiques. La recerca d’aquestes atraccions i, molt particularment, les ànsies de poder-les manipular per articular explicacions sobre els fenòmens químics sumiren
una bona part dels químics en l’anomenat somni newtonià fins a principi del segle xix
L’atracció de curt abast entre partícules fou considerada la causa immediata de les afinitats observades en les reaccions químiques. El sistema de les afinitats químiques de final del segle xviii fou el resultat de la fascinació que en la gent de ciència havien produït les idees de Newton sobre la combinació química. No obstant això, aquest «somni newtonià» va començar a
esvair-se durant la segona dècada del segle xix, quan es va perdre l’esperança d’explicar satisfactòriament els fenòmens químics a partir de forces d’atracció newtonianes de curt abast (Grapí, 2004, p. 50-55). La controvèrsia que s’establí a la darreria del segle xviii entre Luigi Galvani i Alessandro Volta sobre l’origen de l’electricitat animal acabà en el descobriment per part d’aquest últim de la pila elèctrica, que impulsà una nova tradició en la química. La desco-
berta dels efectes químics que l’electricitat generava obrí noves perspectives en les quals s’integrarien les afinitats químiques. El químic anglès Humphry Davy dugué a terme, a partir del 1810, una sèrie d’experiments aprofitant el potencial analític de la pila que el portaren al convenciment que l’afinitat química i la interacció elèctrica eren manifestacions d’una mateixa força subjacent. El 1806, Davy va fer públiques les seves primeres idees sobre la naturalesa elèctrica de les afinitats químiques, que es poden resumir de la manera següent: primer, dos cossos que tenen tendència a combinar-se s’electritzen amb polaritats contràries en entrar en contacte; segon, les forces que així es generen propicien la unió dels cossos en un nou compost elèctricament neutre, encara que els components amb càrrega elèctrica oposada romanguin elèctricament carregats en la nova combinació.
Les aportacions de Davy, conjuntament amb les d’Ørsted, Ampère i Faraday, constituïren uns tímids intents per construir una teoria electroquímica del canvi químic que acabaria completant Jöns Jacob Berzelius. Aquest, a partir del 1811, començà a comprendre que el canvi químic estava irremeiablement vinculat a variacions en l’estat elèctric dels components de les substàncies. Entre els anys 1813 i 1815, Berzelius inicià la construcció d’un sistema explicatiu tant del canvi químic com de les proporcions de combinació. Aquest sistema ha estat qualificat de dualista per estar fonamentat en la idea que en qualsevol partícula coexisteixen dues parts o pols, un dels quals posseeix més electricitat d’un tipus que la que l’altre pol pot neutralitzar mitjançant electricitat del tipus contrari (Grapí, 2008, p. 53-58).
La teoria dels radicals i el dualisme electroquímic de Berzelius
La idea de radical en química va sorgir el 1787, de mans de Guyton de Morveau, durant el procés de construcció de la nova química de l’oxigen. Els radicals es consideraven les parts més senzilles dels àcids que modificaven l’oxigen. Per a Lavoisier, els àcids orgànics eren òxids de radicals que contenien com a mínim carboni i hidrogen. Berzelius va captar aquesta idea de radical i la va convertir en la peça integral del seu sistema. La base del sistema electroquímic era el supòsit que dos elements o radicals es combinaven fins a assolir la neutralització d’electricitats oposades. Berzelius forçà la química a entrar en un mode dualístic que va dur a una visió analítica dels compostos químics, la qual resultà de gran ajuda per al posterior desenvolupament del concepte valència
La teoria rebé un reconeixement força general a Alemanya, sobretot, i una certa ascendència temporal a França. A Alemanya, el principal impulsor va ser Justus von Liebig, que, insatisfet amb la formació química rebuda al seu país, va realitzar una estada de dos anys a París (1822-1824), on aleshores es liderava la recerca de compostos orgànics. De tornada a Alemanya, va exercir durant vint anys, a Giessen, de director del laboratori de recerca i ensenyament més famós del seu temps. El mateix Liebig, conjuntament amb Friedrich Wöhler, va anunciar les seves recerques sobre el radical benzoïl que havia d’estar present en substàncies com el benzaldehid, l’àcid benzoic, el clorur de benzoïl o la benzamida. A partir del 1838, la hipòtesi dualística de Berzelius que sostenia la teoria dels radicals va començar a entrar en crisi. La persistència de Berzelius que els radicals no
podien contenir oxigen va ensopegar amb l’anomalia que representava el radical benzoïl. La teoria va remuntar en mans de Hermann Kolbe (fig. 1), que es va convertir en el protagonista d’una renovada teoria dels radicals. Kolbe havia estat alumne de Wöhler a Göttingen, collaborador de Robert Wilhelm Bunsen a Marburg i, més tard, de Playfair a Londres, on va conèixer Edward Frankland. El 1851 va retornar a Marburg per substituir Bunsen, que havia obtingut la càtedra a Heildelberg. Mentrestant, a París, el 1839, Charles Frédéric Gerhardt havia introduït el terme còpula per indicar la part orgànica d’una molècula disposada a unir-se a una part inorgànica. Berzelius va adoptar aquesta aproximació i, finalment, va imaginar l’àcid acètic com un compost resultant de la «copulació» o «conjugació» de l’àcid oxàlic amb la «còpula» (C2H3): C2H3 + C2O3 + HO.
Quan Kolbe va sintetitzar l’àcid tricloroacètic, va seguir l’aproximació de Berzelius i el va formular com a C2Cl3 + C2O3 + HO, i el corresponent progenitor, l’àcid acètic, com a C2H3 + C2O3 + HO.1 Així, doncs, la teoria dualística dels radicals de Berzelius va revifar amb l’impuls de Kolbe i, també, de Frankland (Russell, 1971, p. 22-25).
Edward Frankland s’havia format com a col·laborador de Playfair al Col·legi per a Enginyers Civils de Putney. En aquesta institució va ser on inicià amistat i una complicitat científica amb Kolbe. Després d’una curta estada amb aquest últim al laboratori de Bunsen a Marburg, va retornar a Anglaterra el 1847 per exercir de professor al Col·legi Queenwood
1 Aquestes fórmules es van elaborar prenent els valors 6 i 8 per als pesos atòmics del carboni i l’oxigen, respectivament.

àtoms d’hidrogen i vuit de carboni (C8H12) repartits entre les arestes (H) i els vèrtexs (C) del prisma (fig. 2). Un àtom de clor, per exemple, podia substituir-ne un d’hidrogen i així formar un «nucli derivat» que es podia combinar amb altres àtoms. D’altra banda, el clor també podia addicionar-se a una cara del prisma per formar un producte d’addició. En qualsevol cas, la posició d’un àtom, però no la seva naturalesa ni la seva càrrega, en determinava el comportament químic.
estructura química de Hampshire. Frankland va dedicar ingents esforços a aconseguir l’aïllament d’alguns radicals (com el metil i l’etil) que finalment van resultar no ser veritables radicals, sinó els seus dímers. No obstant això, aquestes recerques el van conduir a la síntesi dels primers compostos organometàl·lics (dimetilzinc i dietilzinc) i a imaginar l’acoblament de la teoria dels radicals amb l’emergent teoria dels tipus (Frankland, 1852).
La teoria dels tipus químics i la controvèrsia «funció» vs «estructura» Tot i que la teoria dels radicals i la dels tipus dugueren, quasi independentment, a la idea de valència, cal dir que la teoria dels tipus va dominar la química orgànica de mitjan segle xix de forma espectacular. La teoria dels tipus va emergir com un intent d’ordenar el desconcert que imperava en la química orgànica en aquells casos en què la teoria dels radicals no reeixia. La teoria dels radicals va rebre un fort contratemps quan es va descobrir que el clor (electronegatiu) podia substituir l’hidrogen (electropositiu), quelcom inacceptable des del punt de vista del dualisme electroquímic. El descobriment d’altres anomalies semblants va
suposar un descrèdit envers la concepció de les molècules com una conjunció de radicals, i es van començar a imaginar de forma més holística, com a unitats. Aquesta tendència va agafar volada per la limitació de la teoria dels radicals d’entendre els àcids tan sols com a òxids de radicals o hidrats d’òxids. El 1843, Gerhardt va demostrar que els àcids acètic i tricloroacètic obeïen a una única fórmula (C2H4O2 i C2HCl3O2), excloent-ne la presència d’aigua. El buit teòric posterior al col·lapse de la teoria dels radicals va ser ocupat per la nova teoria dels tipus, comandada des de l’escola de París per Jean-Baptiste Dumas. Aquest va publicar, el 1838, la seva versió de la teoria dels tipus Les semblances entre els àcids acètic i tricloroacètic, o entre el cloral i l’acetaldehid, li van fer suposar que en la química orgànica hi havia uns certs «tipus» que romanien intactes, fins i tot quan l’hidrogen era substituït per un halogen (clor, brom o iode). Els «tipus» eren substàncies que contenien el mateix nombre d’equivalents units de la mateixa manera i que mostraven les mateixes propietats químiques fonamentals.
L’essència de la teoria era que la unicitat d’un compost químic i les seves propietats estaven determinades més per les posicions de les partícules i no tant per la seva naturalesa química.
Ara bé, la gènesi de la teoria no s’entendria sense les aportacions d’Auguste Laurent, que havia estat col·laborador de Dumas. Aquest últim va formar part del tribunal de la tesi doctoral de Laurent, on va presentar la seva teoria nuclear com una interpretació geomètrica de la constitució química. La teoria de Laurent aplicada als hidrocarburs considerava que aquests disposaven d’un nucli representat per un prisma rectangular amb dotze

Figura 2. El nucli d’un hidrocarbur segons Laurent. Els dotze àtoms d’hidrogen i els vuit de carboni representats per cercles a les arestes (H) i als vèrtexs (C) d’un prisma rectangular.
Ambdues propostes teòriques de Dumas i Laurent cal entendreles com a aproximacions diferents a les tradicions de la història natural del moment. La teoria nuclear de Laurent era deutora de la classificació cristal·logràfica i de l’isomorfisme químic en les tradicions de René Just Haüy i Eilhard Mitscherlich, respectivament. Contràriament, la teoria dels tipus de Dumas estava basada en la classificació dels organismes, pròpia de la tradició de la història natural que ell mateix havia assimilat del botànic Augustine Pyrame de Candolle. Tot plegat encara es pot comprendre millor en el context de la disputa, a començament dels anys trenta del segle xix, entre el paleontòleg Georges
Cuvier i el zoòleg Éttiene Geoffroy Saint-Hilaire sobre els fonaments d’un sistema de classificació natural en la zoologia. No obstant això, la qüestió anava més enllà d’una classificació formal. Es tractava d’un debat que acabaria incidint en el desenvolupament de la química orgànica: el de la relació entre funció i estructura en els organismes vius. Cuvier advocava per la idea que les necessitats i funcions dels animals n’havien determinat l’estructura. En canvi, Geoffroy Saint-Hilaire defensava que hi havia una relació definida entre el nombre i l’ordenació de les parts d’un organisme que era independent de la seves formes i funcions. Dumas clarament va manllevar la teoria dels tipus químics de les tradicions de la història natural dels organismes vius i de la teoria nuclear de Laurent (Nye, 1996, p. 121-124).
A partir del 1840, la teoria dels tipus va començar a ser acceptada i una generació de químics va proposar diferents tipus químics. Alexander William Williamson va proposar el tipus «aigua»; Gerhardt, els tipus «hidrogen» i «clorur d’hidrogen», i Charles Adolphe Wurtz i August Wilhelm von Hofmann, el tipus «amoníac». La proposta del cinquè tipus, «gas de maresma» (metà), per part de Friedrich August Kekulé, tindria conseqüències definitives per al futur de la química. D’aquesta manera, per exemple, el dietilèter, l’alcohol etílic i l’àcid acètic es consideraven derivats de l’aigua per substitució dels àtoms d’hidrogen. De la mateixa manera, l’etilamina i la fenilamina es podien considerar derivats de l’amoníac (fig. 3).
Molts químics començaren a considerar les analogies entre molècules i organismes naturals més apropiades que les analogies entre molècules i boles de billar. La teoria dels radicals, amb el seu

dualisme electroquímic, va desaparèixer de la química orgànica després del 1860 i no tornaria a reaparèixer fins a començament del segle xx. No obstant això, en tot aquest desenvolupament no hi havia cap insinuació sobre l’existència real d’aquests tipus. És més, hi havia un veritable «escepticisme estructural» en una bona part de la comunitat química. Els tipus químics donaven pistes sobre les possibles reaccions que un compost podia sofrir sense suggerir res sobre la disposició dels seus àtoms.
El concepte valència i la doctrina de Kekulé Mentre l’escola de París culminava el desenvolupament de la teoria dels tipus, a Londres es gestaven algunes modificacions que aplanarien el camí a la idea de valència química. Allí eren, entre d’altres, Alexander William Williamson, deixeble de Liebig, i William Odling, deixeble de Gerhard. Però qui acabaria liderant els esdeveniments seria Friedrich August Kekulé (fig. 4), col·laborador de John Stenhouse a l’hospital St. Bartholomew entre els anys 1853 i 1855. Kekulé havia
estat deixeble de Liebig i de Gerhardt. Durant aquesta època, a Londres, Williamson i Kekulé van travar una sòlida amistat. Va resultar inevitable que la naturalesa de l’àtom que compartia la gran majoria dels compostos orgànics, el de carboni, acabés sent objecte d’escrutini. El 1858, Kekulé i Archibald Scott Couper van anunciar, amb un mes de diferència i de forma independent, els seus punts de vista sobre la naturalesa del carboni.
Tot va començar el 1857, amb la publicació per part de Kekulé de l’article «Sobre la constitució del fulminat de mercuri». L’article va
servir per fer la presentació del tipus químic «gas de maresma», al qual Kekulé va assignar compostos com ara el cloroform, l’acetonitril i el mateix fulminat de mercuri.
El tipus «gas de maresma» (metà)
H H H H gas de maresma
H Cl Cl Cl cloroform
(NO4) Hg Hg (C2N) fulminat de mercuri
Per a Kekulé, tots els compostos assimilats a aquest tipus estaven relacionats no tant per semblances de propietats, sinó més aviat pel fet que utilitzant els reactius adequats cadascun es podia obtenir o transformar en qualsevol altre. La posició de Kekulé va suposar una ruptura amb la teoria clàssica dels tipus de Gerhard, que els atribuïa meres semblances de reactivitat. Aquesta era una ruptura profunda, perquè implicava passar d’uns tipus «químics» a un altre de més aviat «mecànic», on prevalien les relacions de constitució, gairebé d’estructura, enfront de les relacions de reacció (Russell, 1971, p. 62-63).
El 1858, Kekulé va publicar el seu gran article de referència, «Sobre la constitució i les metamorfosis dels compostos químics i la naturalesa química del carboni», en el qual presentaria un relat sistemàtic de la seva doctrina. Kekulé va començar a utilitzar dos conceptes clau, atomicitat i unitat d’afinitat entre àtoms. L’atomicitat d’un element expressava el nombre d’àtoms amb els quals un àtom de l’element era capaç d’arribar a saturar-se. Així, es parlava d’elements monoatòmics, diatòmics, triatòmics o tetratòmics, si un àtom d’un element es podia saturar amb un màxim d’un, dos, tres o
quatre altres àtoms. Inicialment, els termes atomicitat i basicitat eren intercanviables. Els adjectius monobàsic, bibàsic, etc., s’havien estat utilitzant des de feia temps en tractar sobre els àcids i les sals.2
El carboni era, doncs, un element tetratòmic o tetrabàsic. Això implicava que, per a substàncies amb només un àtom de carboni, la suma de les unitats químiques dels elements units a l’àtom de carboni havia de ser igual a quatre
El carboni era, doncs, un element tetratòmic o tetrabàsic. Això implicava que, per a substàncies amb només un àtom de carboni, la suma de les unitats químiques dels elements units a l’àtom de carboni havia de ser igual a quatre. Així, l’àtom de carboni es combinava amb quatre àtoms d’un element monoatòmic o amb dos àtoms d’un element diatòmic. A més, calia suposar que els àtoms de carboni també es podien unir entre si. D’aquesta manera, per a un compost de dos àtoms de carboni, una «unitat d’afinitat» d’un àtom estava unida a una de l’altre. És a dir, de les vuit (2 × 4) unitats d’afinitat dels dos àtoms de carboni, dues s’utilitzaven per unir ambdós àtoms i les sis unitats d’afinitat restants es completaven amb àtoms d’altres elements. En resum, un grup de dos àtoms de carboni (C2) era hexatòmic (Kekulé, 1963, p. 127-128).
Els termes basicitat i atomicitat van ser els antecedents d’un nou terme, valència, que faria fortuna
2 Actualment, l’atomicitat indica tan sols el nombre d’àtoms d’una molècula.
en la química fins als nostres dies. El 1865, August Wilhelm von Hofmann va plantejar un atac amb tota regla contra l’ús del terme atomicitat, en considerar que comportava interpretacions errònies. Com a contrapartida, va proposar el terme quantivalència i designar els elements com a univalents, bivalents, trivalents o tetravalents, d’acord amb la capacitat per fixar un respectiu nombre d’àtoms. Finalment, el 1868, Hermann Wichelhaus, en un important article sobre derivats del fòsfor, va substituir el terme quantivalència pel més curt valència (Valenz). Tot i així, aquesta no va ser la primera vegada que el terme va ser utilitzat. Kekulé ja l’havia introduït l’any anterior, en un breu article sobre el mesitilè.
La concepció de l’enllaç químic. Els paper de les fórmules gràfiques La idea de la unitat d’afinitat entre àtoms introduïda per Kekulé va tenir un ús molt generalitzat a Alemanya. D’alguna manera, la vaguetat del terme reflectia la reticència dels químics a tractar sobre la naturalesa d’allò que cohesionava els àtoms de les molècules. En aquest aspecte, els químics anglesos van ser més atrevits, i va ser Frankland qui més va contribuir a la construcció del concepte enllaç químic. A partir del 1866, Frankland va formalitzar aquesta idea com un mer punt de fixació o d’inserció (point of attachment), de naturalesa desconeguda, mitjançant el qual un àtom estava unit a un altre element. La seva intenció era disposar d’una expressió més concreta que atomicitat o valència (Frankland, 1866, p. 18). Caracteritzar ontològicament el concepte enllaç químic no va ser fàcil, però, a final de la dècada dels anys setanta del segle xix, pocs químics estaven disposats a oposar-s’hi.
Una incursió en el rerefons històric de les idees de valència , enllaç i estructura química
L’acceptació i els dubtes sobre la idea d’un enllaç químic van anar simultàniament acompanyats de l’ús d’un segment per simbolitzar-lo gràficament. Un segment atorgava més realisme que un parèntesi en un dels tipus químics o que la juxtaposició de cercles d’una de les representacions atòmiques de Dalton. Un segment era més identificable amb objectes tan reals com una vareta o una agulla. Però, un cop admès com a símbol, va resultar difícil sostenir la idea que no hi havia res «real» que mantingués units els àtoms d’una substància.
Archibald Scott Couper va ser el primer a utilitzar segments per representar «valències».
Couper havia estudiat lògica i matemàtiques, i el 1855 es va instal·lar a Berlín, on, per raons desconegudes, va començar a estudiar química. El 1856 va entrar com a col·laborador al laboratori de Wurtz a París, i el 1858 va publicar, en francès i en anglès, l’article «Sobre una nova teoria química», on mostrava la seva oposició a la teoria dels tipus. El seu rebuig era bàsicament metafísic, en sostenir que les comparacions que establia la teoria tenien uns fonaments falsos. En aquest article, va introduir línies de punts (en la versió anglesa) o segments (en la francesa) entre alguns àtoms de la representació gràfica de compostos (fig. 5).
Val a dir que, en el seu moment, l’article de Couper va tenir una influència limitada, en comparació de la que va tenir el de Kekulé. No obstant això, cal apuntar un parell d’observacions que no es poden menystenir. La primera és que Couper va coincidir, com a col·laborador de Wurtz, amb el químic rus Aleksandr Mikhàilovitx Bútlerov, amb el qual va discutir aspectes del seu article. Bútlerov seria el responsable del debut de la nova teoria

estructural de la química. La segona observació té a veure amb el retorn de Couper a Escòcia. Couper va estar uns mesos a la Universitat d’Edimburg, on va coincidir amb Alexander Crum Brown, que aleshores duia a terme el doctorat. Crum Brown va introduir una nova representació gràfica de les fórmules químiques que no tan sols va contribuir extensament a l’èxit de la futura teoria estructural, sinó que també va tenir una longeva influència fins als nostres dies. La tesi doctoral de Crum Brown va suposar la primícia d’un nou sistema de fórmules que es van publicar per primera vegada el 1864. Les fórmules mostraven cada àtom per separat i indicaven clarament els enllaços simples o múltiples (fig. 6).

Una representació tan senzilla i gens ambigua va suscitar encara més preguntes, com, per exemple, la justificació d’una disposició plana i simètrica de les valències atòmiques. Si bé aquestes noves fórmules van ser ràpidament acceptades pel món acadèmic britànic, no va passar el mateix a l’Europa continental. Probablement, els diferents contextos educatius d’Anglaterra i del continent (Alemanya i França, sobretot) explicarien aquest decalatge (Russell, 1971, p. 104).
El 1865, Hofmann va il·lustrar una conferència seva a la Royal Institution de Londres amb un model fet a base de pilotes de croquet i varetes (fig. 7). Aquests models es designaren amb el nom fórmules glíptiques (per distingir-les de les fórmules bidimensionals).
Les fórmules gràfiques van ser molt ben acollides i utilitzades. El 1867 ja es podien veure fórmules gràfiques sense encerclar els símbols dels elements (fig. 8).
Contràriament, l’acceptació i l’ús d’aquestes fórmules gràfiques a Alemanya van ser més lents i incerts. Kekulé era qui controlava la situació. Primer, va rebutjar les fórmules de Crum Brown i, en el primer volum de Lehrbuch der organischen Chemie (1859), va proposar el seu sistema de fórmules gràfiques (fig. 9).
En aquestes fórmules «salsitxa» (Wurst), cada unitat representava un àtom i la mida de cada unitat era proporcional a la valència de l’àtom en qüestió. Només hi havia unions «verticals» entre àtoms, sense unions «horitzontals», i un enllaç múltiple s’indicava per un doble contacte entre unitats adjacents. El 1867, Kekulé va explicar que no trobava acceptable el sistema de formulació anglès perquè, si tots els enllaços havien de ser coplanars, era impossible considerar la formació d’enllaços triples. Per

Val a dir que, en el seu moment, l’article de Couper va tenir una influència limitada, en comparació de la que va tenir el de Kekulé

aquest motiu va proposar un model tetraèdric, però a la pràctica va utilitzar representacions semblants a la de Crum Brown. El 1868 va començar a utilitzar, fins i tot, fórmules gràfiques més simples.
La idea d’estructura química
El famós article de Kekulé del 1858 va servir, també, per manifestar el seu escepticisme entorn de la possibilitat de determinar les posicions espacials reals dels àtoms en una molècula. D’acord amb Kekulé, allò que es coneixia sobre la constitució de les substàncies provenia, bàsicament, de l’estudi de les reaccions
químiques i, en menor extensió, de l’estudi de les propietats físiques de molècules estables no reactives. Els químics podien expressar les seves hipòtesis sobre la constitució molecular mitjançant «fórmules racionals» diferents de les «fórmules empíriques» obtingudes a partir de dades experimentals. No obstant això, les fórmules racionals no podien ser res més que fórmules per interpretar reaccions, i la «més racional» entre les possibles fórmules de reacció d’un compost era la que permetia explicar més reaccions. No obstant això, aquest escepticisme va tenir un vessant positiu, en el sentit que va espero-
nar la constatació experimental d’hipotètiques ordenacions seqüencials d’àtoms en una molècula (Rocke, 2010, p. 83-92). Així, doncs, va començar a guanyar terreny en la química del segle xix l’anomenada teoria estructural. Aquesta suposava que, en una molècula, les unions entre tots els àtoms estaven determinades per les valències. El terme estructura química va ser introduït el 1861 per Aleksandr Mikhàilovitx Bútlerov (fig. 10) per referir-se a l’ordenació espacial dels àtoms en una molècula. Bútlerov estava convençut que aquesta estructura era la causa de les propietats físiques i químiques de la substància i, a més a més, podia explicar les modificacions dels tipus químics. L’èxit que van tenir les fórmules de Crum Brown s’ha d’entendre en el context de l’acceptació d’aquesta teoria estructural. Aquestes «fórmules estructurals» van mostrar un elevat potencial predictiu. Les possibilitats gràfiques d’aquesta «química de paper i llapis» van permetre la predicció quasi interminable d’hipotètics derivats i isòmers d’un compost abans d’entrar al laboratori per verifi-
car-los. El repte va consistir tant a dur a terme la síntesi de possibles compostos com a intentar explicar la inexistència d’altres.

Per acabar
A principi del segle xx, les teories físiques sobre la constitució dels àtoms i, en particular, sobre la naturalesa i el comportament dels electrons van obrir expectatives que s’havien aparcat quan es va liquidar la teoria electroquímica dualística. Els químics van adonar-se, no sense reticències, que els conceptes afinitat i valència podien formar part d’un territori compartit amb els físics. Aquesta opció no havia estat possible anteriorment perquè les nocions de força gravitatòria i elèctrica no havien reeixit a l’hora d’abastar la complexitat dels canvis químics. La teoria de l’enllaç per parell d’electrons de valència, elaborada per Gilbert Newton Lewis i Irving Langmuir durant els anys vint del segle xx, va reflectir la influència de físics com Joseph John Thomson en l’aplicació de les idees sobre els electrons a les molècules (Nye, 1996, p. 178-180). Les aportacions de Lewis sobre la naturalesa de l’enllaç químic van suposar l’inici d’un llarg itinerari per explorar les fronteres de la
química i la física. El seu model per reinterpretar els conceptes valència i enllaç químic va sobreviure a la transició de la física clàssica a la mecànica quàntica. Això va ser així perquè les mateixes limitacions del model van esdevenir, a la llarga, les seves virtuts per fomentar i incorporar novetats i reajustaments (Gavroglu i Simões, 2012, p. 47-55). No obstant això, va ser durant gairebé vint-i-cinc frenètics anys del segle xix que els debats sobre la naturalesa de les substàncies orgàniques propiciaren la construcció de conceptes com valència, enllaç i estructura química
Referències
couper, A. S. (1858). «On a new chemical theory». The Philosophical Magazine and Journal of Science, núm. 16, p. 104-116. crum Brown, A. (1864). «On the theory of isomeric compounds». Transactions of the Royal Society of Edinburgh, núm. 23, p. 707-719. FranklanD, E. (1852). «On a new series of organic bodies containing metals». Philosophical Transactions of the Royal Society, núm. 142, p. 417-444. — (1866). Lecture notes for chemical students, embracing mineral and organic chemistry. Londres: John van Voorst.
gavroglu, K.; simões, A. (2012). Neither physics nor chemistry: A history of quantum chemistry Cambridge: MIT Press. grapí, P. (2004). «El racó de la història: canvi químic i afinitat. Una relació secular». Revista de la Societat Catalana de Química, núm. 5, p. 48-57.
— (2008). «L’electrificació del canvi químic. Els seus inicis al primer quart del segle xix». Educació Química EduQ, núm. 1, p. 51-57.
hoFmann, A. W. (1865). «On the combining power of atoms».
Proceedings of the Royal Society, núm. 4, p. 401-430.
kekulé, A. (1866). Lehrbuch der organischen Chemie. Erlangen: Ferdinand Enke. (1963). «The constitution and metamorphoses of chemical compounds and the chemical nature of carbon». A: theoDor BenFey, O. (ed.). Classics in the theory of chemical combination. Nova York: Dover, p. 109-131. [L’original és del 1858]
nye, M. J. (1996). Before the big science: The pursuit of modern chemistry and physics, 18001940. Nova York: Simon & Schuster Macmillan.
rocke, A. J. (2010). Image and reality: Kekulé, Kopp, and the scientific imagination. Chicago: The Chicago University Press.
russell, C. A. (1971). The history of valency. Leicester: Leicester University Press.
simpson, M.; gautier, A. (1867). On the formation of succinic acid from chloride of ethylidene: Report of the Thirty-Seventh Meeting of the British Association for the Advancement of Science (Transactions of sections). Londres: John Murray.

Pere Grapí Vilumara És llicenciat en ciències químiques (UB) i doctor en filosofia i lletres (programa Història de la ciència, UAB). Ha estat catedràtic de física i química d’ensenyament secundari. Les seves àrees de recerca principals en història de les ciències són la química de final del segle xviii i principi del segle xix, així com les relacions entre la història de la ciència i l’ensenyament.
A/e: pgrapi@gmail.com
Enlazando didáctica e historia de la ciencia: clasificaciones y modelos de las uniones químicas en los libros de texto de física y química de secundaria (2007-2016)
Enllaçant didàctica i història de la ciència: classificacions i models de les unions químiques en els llibres de text de secundària (2007-2016)
Bonding didactics and history of science: classifications and models of the chemical bonds in secondary education chemistry textbooks (2007-2016)
Luis Moreno Martínez / Universidad de Valencia. Instituto de Historia de la Medicina y de la Ciencia López Piñero / Universidad Autónoma de Madrid. Facultad de Formación de Profesorado y Educación
resumen

Comprender cómo átomos, iones o moléculas se unen para dar lugar a estructuras que permitan explicar las propiedades de las sustancias es uno de los objetivos característicos de la educación química. Con este fin didáctico, los libros de texto suelen hacer uso de clasificaciones y modelos, así como alusiones a algunos protagonistas de la historia de la química que contribuyeron al estudio de las uniones químicas. El presente artículo analiza la forma en que son presentadas dichas clasificaciones y modelos, así como el tratamiento dado a la historia de la química en el estudio de las uniones químicas.
palabras clave
Enlace químico, didáctica de la química, historia de la ciencia, libros de texto.
resum
Comprendre com àtoms, ions o molècules s’uneixen per donar lloc a estructures que permetin explicar les propietats de les substàncies és un dels objectius característics de l’educació química. Amb aquesta finalitat didàctica, els llibres de text solen fer ús de classificacions i models, així com al·lusions a alguns protagonistes de la història de la química que van contribuir a l’estudi de les unions químiques. El present article analitza la forma en què es presenten aquestes classificacions i models, així com el tractament que s’ha donat a la història de la química en l’estudi de les unions químiques.
paraules clau
Enllaç químic, didàctica de la química, història de la ciència, llibres de text.
abstract
Understanding how atoms, ions or molecules bind together and result in structures that explain the properties of the substances is one of the characteristic objectives of chemistry education. With this didactic purpose, textbooks often use classifications and models, as well as references to some scientists in the history of chemistry that contributed to the study of chemical bonds. This essay analyzes how these classifications and models are presented, as well as the treatment of the history of chemistry in the explanation of the chemical bond.
keywords
Chemical bond, didactics of chemistry, history of science, textbooks.
Introducción
Enlace químico, enlace covalente, enlace de hidrógeno, enlaces intermoleculares, fuerzas intermoleculares, etc. Son varios los tipos de uniones entre átomos, moléculas o iones que podemos encontrar en libros de texto y manuales de química. En algunos casos, interacciones como las fuerzas de Van der Waals o los enlaces de hidrógeno son incluidas dentro del enlace químico. En otros, el término enlace químico se reserva únicamente para los enlaces covalente, iónico y metálico. A fin de solventar este primer problema terminológico, emplearemos el término uniones químicas, donde el adjetivo químicas no denota la naturaleza de la interacción, sino el marco en el que dichas interacciones son consideradas: el caso de la química, ciencia en la que el estudio de las uniones entre átomos, moléculas e iones tiene un papel fundamental. En las próximas líneas, haremos un recorrido por la investigación didáctica en torno a clasificaciones, modelos y protagonistas relacionados con las uniones químicas a través de varios libros de texto de ESO y bachillerato. Un recorrido en el que la historia de la química estará presente explícita e implícitamente.
Las uniones químicas en ESO y bachillerato a través de los libros de texto
Muestra
El análisis recogido en el presente artículo ha sido realizado sobre una muestra compuesta de un total de dieciséis libros de texto de ESO y bachillerato, pertenecientes a cuatro editoriales. En todos los casos, se trata de libros de texto de la materia de Física y química, excepto en segundo curso de bachillerato, en que se ha acotado el análisis a la materia de Química. Los libros de
texto analizados se inscriben en el currículo LOE para ESO y bachillerato (2007-2016), lo que ha permitido inscribir las conclusiones alcanzadas en un marco temporal amplio y a la vez próximo a nuestra situación educativa actual.
La elección de estas editoriales se ha realizado con base en los resultados del estudio Scholarly publishers indicators in humanities and social sciences, partiendo del ranking 2014 sobre prestigio editorial en el ámbito de la educación, y seleccionando cuatro editoriales (dos españolas, A y B, y dos extranjeras, C y D) que ocupasen los primeros puestos según dicho estudio, con una línea editorial destinada a la publicación de libros de texto vigentes en el marco temporal señalado y cuya publicación estuviese generalizada al conjunto de comunidades autónomas. La relación de libros de texto analizados se puede consultar al final del presente trabajo1
Los libros de texto analizados se inscriben en el currículo LOE para ESO y bachillerato (2007-2016), lo que ha permitido inscribir las conclusiones alcanzadas en un marco temporal amplio y a la vez próximo a nuestra situación educativa actual
1 Las cuatro editoriales se han designado como A, B, C y D a lo largo del artículo. Para identificar el libro de texto correspondiente, se añadirá un número determinado: 1 (1.º bachillerato), 2 (2.º bachillerato), 3 (3.º ESO) y 4 (4.º ESO). Así, por ejemplo, cuando nos refiramos al texto C3, significará que hacemos alusión al libro de texto de 3.º de ESO de la editorial C.
Instrumento metodológico
El instrumento metodológico creado consta de once ítems para ESO (tabla 1) y nueve para bachillerato (tabla 3). Estas cuestiones se enmarcan en la investigación didáctica relacionada con el enlace químico y la estructura de la materia, permitiendo abordar problemas de interés actual en la enseñanza de la química, como la modelización de las uniones químicas para su enseñanzaaprendizaje y otros tantos interrogantes que abarcan desde cuestiones terminológicas hasta históricas. La historia de la ciencia se ha tenido en cuenta a la hora del diseño del instrumento metodológico, de modo que, además de los correspondientes ítems relacionados con la historia de la química, se ha empleado una ficha de registro de todas aquellas referencias históricas que incluyen los libros de texto analizados (véase el anexo). Como veremos, esta es solo una de las formas de enlazar didáctica e historia de la ciencia.
Resultados y discusión
Los resultados obtenidos tras aplicar el instrumento metodológico diseñado a la muestra de libros de texto de ESO y bachillerato se encuentran recogidos en las tablas 2 y 4, respectivamente.
Los resultados del análisis llevado a cabo han permitido perfilar un marco de reflexión que puede ser de interés para la investigación educativa y la práctica docente, pero también para otras disciplinas, como la historia de la ciencia:
1. Clasificaciones
La mayoría de libros de texto suelen distinguir tres tipos de enlaces químicos (enlace covalente, iónico y metálico) y otro conjunto de interacciones (fuerzas de Van der Waals y enlaces



de hidrógeno), que clasifican 2 como fuerzas intermoleculares
2 Para los ítems relacionados con referencias históricas en texto e imágenes, se consideran las posibles opciones: ninguna (0 referencias), pocas (hasta 5), algunas (hasta 10) o varias (más de 10).
Centrándonos únicamente en los enlaces químicos, uno de los criterios de diferenciación entre los tres tipos suele ser atender a la diferencia de carácter metálico o de electronegatividad de los átomos enlazados. Si bien esta clasificación tiene una gran
utilidad didáctica, especialmente para los primeros cursos, ha de ser revisada y matizada en cursos superiores, como en segundo curso de bachillerato, a fin de no introducir ideas erróneas en el aprendizaje del enlace químico.

Una primera limitación de dicho criterio para identificar los distintos tipos de enlace químico la encontramos cuando se estudia la geometría molecular. Los dihaluros de berilio (frecuentemente, el dicloruro de berilio) suelen ser presentados como ejemplos típicos de moléculas lineales
Una primera limitación de 3 dicho criterio para identificar los distintos tipos de enlace químico la encontramos cuando se estudia la geometría molecular. Los dihaluros de berilio (frecuentemente, el dicloruro de berilio) suelen ser presentados como ejemplos típicos de moléculas lineales. Encontramos aquí un ejemplo de enlace covalente entre un átomo de un elemento metálico y un átomo de otro elemento no metálico, algo que según las clasificaciones imperantes en los libros de texto debería ser consi-
3 Aclaración: MC, modelo mecano-cuántico del átomo.
derado como un enlace iónico. Una segunda limitación la encontramos en el caso de los compuestos de coordinación. Si bien la química de coordinación está poco presente en los libros de texto de segundo curso de bachillerato, por no incluir muchos de ellos la teoría ácidobase de Lewis (no recogida en el currículo), sí es posible encontrar referencias a los compuestos de coordinación al menos en dos ocasiones: cuando se explica el enlace covalente coordinado o dativo y cuando se explica la formación de complejos de un metal como mecanismo para aumentar la solubilidad de un precipitado. De este modo, el alumno de segundo curso de bachillerato encuentra otra nueva situación en la que la definición de enlace covalente como aquel que se da entre átomos de elementos no metálicos se revela insuficiente.
Esto pone de manifiesto que la clasificación de los enlaces químicos recogida en los libros de texto se muestra limitada en segundo curso de bachillerato, siendo conveniente destacar que los distintos tipos de enlace no dejan de ser sino modelizaciones y que podemos encontrar enlaces
que no sean de un único tipo. Aunque este tipo de cuestiones sí se apuntan en algunos de los libros de texto de bachillerato analizados4, se hace necesario destacar su importancia, pues, además de contribuir a una mejor alfabetización química, contribuyen a mostrar la química como una ciencia que trata de describir la realidad (la materia) usando modelos, que tienen limitaciones y que estas han de ser conocidas.
2. Modelos
Tal y como apuntan los resultados, la mayor parte de los libros de texto, tanto de ESO como de bachillerato, presentan los distintos modelos de enlace químico para poder explicar las propiedades de las sustancias. No obstante, junto con la estructura química, el tipo de enlace químico (covalente, iónico, metálico) permite justificar las propiedades de las sustancias con estructura gigante (covalente, iónica, metálica), pero no las de las sustancias
4 Algunos textos presentan el enlace metálico como un caso de enlace covalente colectivo (A2) y el enlace iónico y el covalente apolar, como casos extremos opuestos de un único enlace químico generalizado (C2, D2).
moleculares, que requieren atender a las fuerzas intermoleculares.
En ESO, la mayoría de libros de texto enmarcan la explicación del enlace químico en el contexto del modelo atómico planetario, incluso cuando no se aborda el estudio de las configuraciones electrónicas, lo cual limita el uso de estructuras o diagramas de Lewis. En estos niveles, sobre todo en tercer curso, se hace especialmente necesario analizar cómo ha de ser presentado el enlace químico, si es necesario hacerlo y con qué fin, constituyendo un interesante punto de reflexión en torno a la selección y secuenciación de los contenidos conceptuales de la química en los primeros cursos de la materia de Física y química.
En bachillerato, encontramos otro caso de gran interés para el análisis didáctico en torno a la enseñanza-aprendizaje de las uniones químicas. Si bien en primer curso algunos libros de texto introducen la geometría molecular, es en segundo curso de bachillerato cuando su estudio se amplia y se detalla. El método, teoría o modelo (pues todos estos términos aparecen recogidos en los textos) de repulsión de pares electrónicos de la capa de valencia (RPECV) y la teoría de hibridación de orbitales atómicos son las dos herramientas principales para explicar la geometría de las moléculas. Mientras que el método RPECV permite predecir la geometría de las moléculas, es la teoría de enlace de valencia (TEV) la que permite justificar la misma. El uso generalizado de la hibridación como recurso para justificar la geometría molecular puede inducir en el alumno la idea de que siempre es necesario recurrir a orbitales híbridos para explicar la geometría molecular o el enlace. Por ejemplo, explicar la formación del enlace en molécu-
las como Cl2 o HCl no requiere considerar hibridación alguna para el átomo de cloro.
A fin de que el alumno comprenda por qué ha de emplear orbitales híbridos, es conveniente mostrar que no siempre es necesario recurrir a la hibridación, justificando cuándo ha de ser empleada. De hecho, históricamente, la hibridación actúa como solución para aquellos casos en que la TEV no podía explicar la geometría molecular en términos de orbitales atómicos puros. Todo ello pone de manifiesto la importancia de mostrar que la elección de una u otra hibridación radica en que ha de ser capaz de justificar la geometría molecular y el enlace a partir de los datos experimentales (como los ángulos de enlace), sin olvidar que de lo que se trata es de utilizar aproximaciones y modelos que permitan explicar la estructura de las moléculas. Un ejemplo más de las potencialidades que ofrece el estudio de las uniones químicas para, además de justificar las propiedades de las sustancias, comprender la naturaleza de la química como disciplina científica: una ciencia que usa distintos modelos que «conviven» y se complementan para describir distintas propiedades y fenómenos de la materia.
3. Protagonistas
El análisis realizado ha puesto de manifiesto que la historia de la química en relación con las uniones químicas tiene una presencia minoritaria, cuando no nula, en los libros de texto de ESO y bachillerato. El registro de referencias históricas (que se pueden consultar en el anexo) revela que la historia de la química en torno al enlace químico consiste fundamentalmente en una escueta sucesión de datos cronológicos (donde 1916 tiene un papel destacado),
alusiones puntuales a descubrimientos (como el caso del grafeno y el de los fullerenos) y menciones superficiales a los científicos artífices de distintos modelos y teorías (teoría de Lewis, teoría de enlace de valencia, hibridación, modelo del mar de electrones).
Pese a esta escasa presencia de la historia de la química, el análisis de las referencias históricas recogidas permite obtener algunas conclusiones en torno al tratamiento y los usos didácticos de la historia de la química en la enseñanza.
Las alusiones a los científicos que actuaron como artífices de las distintas teorías, tales como Lewis, Kossel, Langmuir o Pauling, introducen la idea de una evolución lineal de la historia de la química. Así, ante un determinado problema, surge una serie de modelos que se suceden y rara vez interaccionan entre sí. Esta visión lineal, acumulativa y teleológica del desarrollo histórico de la química se aleja de los trabajos de investigación y perspectivas procedentes de los estudios históricos y sociales de la ciencia, así como de la línea de actuación de trabajos recientes sobre las múltiples contribuciones de la filosofía y la historia de la ciencia a la educación química (Quintanilla, Daza y Cabrera, 2014; Izquierdo et al., 2016; Niaz, 2016).
Asimismo, esta visión de la historia de la química difiere de uno de los objetivos que el currículo LOE fija para la materia de Química de segundo curso de bachillerato: «Comprender y valorar el carácter tentativo y evolutivo de las leyes y teorías químicas, evitando posiciones dogmáticas y apreciando sus perspectivas de desarrollo». La investigación histórica ha señalado que la historia de los modelos atómicos y de las uniones químicas en las primeras décadas del siglo xx no puede entenderse
La (escasa) historia de la química presente en los libros de texto suele ignorar la interacción con otras disciplinas científicas, como la física. De este modo, se pierde la oportunidad de mostrar el papel que tuvo la física cuántica en el desarrollo de la química en el siglo xx
como dos historias independientes e inconexas entre sí, sino que se inscriben en un periodo complejo y confuso (Bensaude Vincent y Stengers, 1997)5 Trabajos recientes han apuntado en esta dirección, señalando cómo Lewis se dedicó, en el periodo 1916-1923, a tratar de armonizar su modelo cúbico del átomo (ausente en los libros de texto de ESO y bachillerato) con el modelo atómico de Bohr (Arabatzis, 2006).
La (escasa) historia de la química presente en los libros de texto suele ignorar la interacción con otras disciplinas científicas, como la física. De este modo, se pierde la oportunidad de mostrar el papel que tuvo la física cuántica en el desarrollo de la química en el siglo xx, uno de los criterios de evaluación específicos de la materia de Química de segundo curso de bachillerato del currículo LOE. En esta línea, trabajos recientes en historia de la ciencia
5 En esta línea, Harold Robinson expresaba en el Faraday Society Meeting de 1923: «Hoy parece que vivimos en un periodo de transición del conocimiento comparable a las décadas de los años cuarenta y cincuenta del siglo pasado, y dentro de dos o tres generaciones los químicos contemplarán retrospectivamente la confusión actual con los mismos sentimientos que nosotros experimentamos cuando contemplamos esa época» (Palmer, 1965).
han señalado el interés de Lewis por tratar de conciliar el «átomo físico» y el «átomo químico», que coexistieron en las primeras décadas del siglo xx, y cómo su idea del par de electrones como responsable del enlace covalente fue reinterpretada en el marco de la mecánica cuántica (Gavroglou y Simões, 2012).
Pese a la baja contextualización histórica, es posible encontrar referencias cronológicas, destacando especialmente una fecha: 1916, año en el que ora Lewis ora Lewis junto con otros científicos (Langmuir y Kossel) propone(n) sus (respectivas) explicaciones y modelos sobre los enlaces químicos. Este año corresponde a la publicación del artículo «The atom and the molecules», de Gilbert Newton Lewis, en Journal of American Chemical Society (Lewis, 1916), en el que planteaba la posibilidad de que «un electrón puede formar parte de una misma capa exterior de dos átomos diferentes y no podría afirmarse su pertenencia a ninguno de los dos de forma exclusiva». Si bien este artículo constituye un trabajo de gran importancia en la historia de las uniones químicas, posteriormente tendrá lugar un proceso de difusión, popularización y apropiación de las ideas de Lewis en que varios protagonistas (como Langmuir) tuvieron un papel significativo (Brock, 1998; Gavroglou y Simões, 2012). Frente a una narración que presenta la actividad científica como una empresa individual que avanza gracias a «momentos clave» que suponen puntos de ruptura total con trabajos anteriores, los trabajos de investigación en historia de la ciencia como los referidos anteriormente amplían el número de protagonistas y contextos, revelando de este modo la química como una actividad humana colectiva.
Retos y oportunidades: didáctica e historia de la ciencia. ¿Enlace simple o enlace doble?
Si bien el análisis realizado se enmarca dentro de la investigación en didáctica de las ciencias experimentales, se ha pretendido propiciar una relación doble entre historia de la ciencia y didáctica. En primer lugar, considerando la historia de la ciencia como objeto de estudio por parte de la investigación educativa. Así, algunos de los ítems del instrumento metodológico diseñado han pretendido conocer presencias y ausencias de la historia de la química ligada a las uniones químicas en los libros de texto. De este modo, el análisis de las escasas narrativas históricas presentes en los textos ha permitido confrontar la imagen de la química y su historia que reflejan estos materiales educativos con los resultados de algunos trabajos de investigación en historia de la ciencia.
Como se ha señalado, durante los dos primeros tercios del siglo xx, varios modelos coexistieron a fin de describir la estructura atómica, el enlace y la estructura de las sustancias. En la actualidad, los libros de texto de química constituyen materiales educativos en los que con facilidad conviven ideas clásicas y cuánticas en una misma página. Es por ello que el estudio de la enseñanza de la química en el siglo xx (especialmente, en las décadas señaladas) permite recuperar un escenario fértil para la reflexión en torno a la enseñanza del enlace químico. Una oportunidad para enlazar doblemente didáctica e historia de la ciencia y facilitar así el largo recorrido que en ocasiones existe en la transformación de la investigación histórica en reflexión didáctica y práctica docente.
Libros de texto analizados A1. zuBiaurre, S.; arsuaga, J. M.; moreno, J.; garzón, B. (2014).
Física y química 1.º bachillerato Madrid: Anaya.
A2. zuBiaurre, S.; arsuaga, J. M.; garzón, B. (2012). Química 2.º bachillerato. Madrid: Anaya.
A3. zuBiaurre, S.; morales, A. M.; arsuaga, J. M.; pérez, A. (2011). Física y química 3.º ESO. Madrid: Anaya.
A4. zuBiaurre, S.; morales, A. M.; gálvez, F.; molina, I. (2012). Física y química 4.º ESO. Madrid: Anaya.
B1. martínez, M. J.; Fontanet, Á. (2012). Química 2.º bachillerato Barcelona: Vicens Vives.
B2. Fontanet, Á. (2014). Química 2.º bachillerato. Barcelona: Vicens Vives.
B3. Fontanet, Á.; martínez, M. J. (2012). Física y química 3.º ESO Barcelona: Vicens Vives.
[Proyecto Nuevo Ergio]
B4. Fontanet, Á.; martínez, M. J. (2012). Física y química 4.º ESO Barcelona: Vicens Vives. [Proyecto Nuevo Ergio]
C1. roDríguez, A.; pozas, A.; garcía, J. A.; martín, R.; peña, A. (2012). Física y química 1.º bachillerato. Madrid: McGrawHill.
C2. pozas, A.; martín, R.; roDríguez, A.; ruiz, A. (2009). Química 2.º bachillerato. Madrid: McGraw-Hill.
C3. peña, A.; pozas, A.; garcía, J. A.; vasco, A. J. (2007). Física y química 3.º ESO. Madrid: McGraw-Hill.
C4. carDona, A. R.; antonio, J.; peña, A.; pozas, A.; vasco, A. J. (2013). Física y química 4.º ESO. Madrid: McGrawHill.
D1. Ballestero, M.; Barrio, J. (2008). Física y química 1.º bachillerato Madrid: Oxford. [Proyecto Tesela]
D2. peña, J.; viDal, M. C. (2009). Química 2.º bachillerato. Madrid: Oxford. [Proyecto Tesela]
D3. piñar, I. (2011). Física y química 3.º ESO. Madrid: Oxford. [Proyecto Adarve]
D4. piñar, I. (2012). Física y química 4.º ESO. Madrid: Oxford. [Proyecto Adarve]
Legislación
Real Decreto 1631/2006, de 29 de diciembre, por el que se establecen las enseñanzas mínimas correspondientes a la educación secundaria obligatoria (BOE n.º 5, de 5 de enero de 2007, p. 677-773).
Real Decreto 1467/2007, de 2 de noviembre, por el que se establece la estructura del bachillerato y se fijan sus enseñanzas mínimas (BOE n.º 266, de 5 de noviembre de 2007, p. 45381-45477).
Enlace web
Scholarly Publishers Indicators (SPI): http://ilia.cchs.csic.es/SPI/ index.html
Anexo
Las fichas de registro con las referencias históricas obtenidas del análisis de los libros de texto han sido incluidas como anexo.
Referencias y otras fuentes
araBatzis, T. (2006). «How the electrons spend their leisure time: the chemist’s perspective» En: Representing electrons: A biographical approach to theoretical entities. Chicago: University of Chicago Press, p. 175-199.
BensauDe vincent, B.; stengers, I. (1997). Historia de la química Salamanca: Addison-Wesley; Madrid: Universidad Autónoma de Madrid.
Bertomeu sánchez, J. R.; garcía Belmar, A. (2008). «La historia de la química: pequeña guía para navegantes. Parte I: viejas y nuevas tendencias». Anales de Química, n.º 1, p. 56-63.
Brock, W. H. (1998). Historia de la química. Madrid: Alianza. gavroglou, K.; simões, A. (2012). Neither physics nor chemistry:
A history of quantum chemistry
Massachusetts: MIT Press.
izquierDo, M.; garcía, A.; quintanilla, M.; aDúriz, A. (2016).
Historia, filosofía y didáctica de las ciencias: Aportes para la formación del profesorado de ciencias
Bogotá: Universidad Distrital. lewis, G. N. (1916). «The atom and the molecule». Journal of American Chemical Society, vol. 38, n.º 4, p. 762-785.
niaz, M. (2016). Chemistry education and contributions from history and philosophy of science. Londres: Springer.
palmer, W. G. (1965). A history of the concept of valence to 1930 Cambridge: Cambridge University Press.
quintanilla, M.; Daza, S.; caBrera, H. (2014). Historia y filosofía de la ciencia: Aportes para «una nueva aula de ciencias», promotora de ciudadanía y valores. Santiago de Chile: Bellaterra.

Luis Moreno Martínez
Es licenciado en Ciencias Químicas, experto en divulgación y cultura científica, máster en formación del profesorado de ESO y bachillerato (física y química) y en historia de la ciencia y comunicación científica. Tras haberse dedicado a la enseñanza y a la comunicación científica, actualmente es investigador predoctoral en estudios históricos y sociales sobre ciencia en el Instituto de Historia de la Medicina y de la Ciencia
López Piñero de la Universidad de Valencia y en educación (didáctica de las ciencias experimentales) en la Facultad de Formación de Profesorado y Educación de la Universidad Autónoma de Madrid.
C. e.: luis.morenomartinez@predoc.uam.es.
Anexo
EDUCACIÓN SECUNDARIA OBLIGATORIA (TERCER Y CUARTO CURSO)
REFERENCIAS HISTÓRICAS (TEXTO)
A A3— A4
1. «Los hechos que acabamos de reflejar [la estabilidad de los gases nobles y que estos tengan su capa de valencia completa con ocho electrones, excepto el helio, que tiene dos] llevaron a G. Lewis y otros científicos a relacionar, en el periodo 1916-1918, la reactividad química con la estructura electrónica de la capa de valencia, dando lugar a la teoría electrónica del enlace químico o teoría de Lewis».
2. También se hace referencia al grafeno, «sustancia pura alótropo del carbono, ya descrita en la década de 1930 y que a finales del siglo xx se denominó grafeno […]. Sin embargo, no ha sido hasta principios de este siglo cuando la sociedad ha tenido noticia de qué es el grafeno y por qué es importante».
B B3—
B4
C
D
1. «Las bases de una teoría del enlace químico fueron establecidas en 1916, de forma independiente y complementaria, por W. Kossel y G. Lewis. El punto de partida fue el diferente comportamiento de los gases nobles respecto a los demás elementos. […] Esta primera teoría del enlace fue revisada y reformulada más adelante en profundidad, entre otras razones, porque la regla del octeto no es generalizable a todos los elementos. No obstante, pese a ser una aproximación muy elemental, permite explicar la formación de enlaces químicos en muchas sustancias, ya que la regla del octeto puede aplicarse a los elementos más representativos de la tabla periódica».
2. También se hace referencia al descubrimiento de los fullerenos en 1985.
C3—
C4—
D3
1. «Fue Avogadro quien, en 1811, sugirió que las últimas partículas de los gases elementales no son átomos, sino agregados de átomos a los que dio el nombre de moléculas».
D4—
BACHILLERATO
A1
A2
REFERENCIAS HISTÓRICAS (TEXTO)
1. Se hace referencia a que, entre 1916 y 1919, Lewis, Langmuir y Kossel relacionaron la actividad química con la estructura electrónica, estableciendo que los electrones de la capa más externa o de valencia deben desempeñar el papel principal en el enlace químico.
1. «La naturaleza del enlace químico fue objeto de muchas disputas entre los químicos del siglo xix Se intuía que las fuerzas eléctricas desempeñaban un papel importante, pero nadie sabía cómo aplicarlas a los átomos que son cuerpos eléctricamente neutros. La teoría de Lewis, basada en la naturaleza electrónica del enlace, fue la primera teoría moderna del enlace químico».
2. En el periodo 1916-1918, dos estadounidenses, Lewis y Langmuir, y un alemán, Kossel, propusieron la naturaleza electrónica del enlace químico, relacionando la actividad química y la estructura electrónica de un átomo dado.
3. Se indica que el modelo del gas de electrones se propuso con anterioridad a la teoría de Lewis.
4. Se señala que el método RPECV es el desarrollo natural de la teoría de Lewis, aunque fue propuesto cincuenta años más tarde.
5. A pie de foto, se indica que J. D. van der Waals recibió el Premio Nobel de Física en 1910 por su trabajo en el establecimiento de una ecuación de estado para gases y líquidos.
B1
B2
1. Se señala que la falta de reactividad de los gases nobles se atribuyó a su configuración electrónica y llevó a Lewis y Kossel a plantear la regla del octeto.
1. La unidad didáctica se inicia indicando que ya los antiguos filósofos griegos se preguntaron por la unión de los átomos, pero que no fue sino hasta principios del siglo xx cuando se elaboró una serie de modelos (enlace iónico, covalente y metálico) basados en el modelo mecano-cuántico del átomo.
2. El texto indica que, partiendo del caso de los gases nobles, el químico norteamericano Lewis y el físico Kossel argumentaron que los elementos se enlazaban porque así conseguían una configuración electrónica como la del gas noble que tuvieran más cerca en la tabla periódica.
3. «En 1916, G. N. Lewis propuso un modelo de enlace covalente por compartición de electrones para explicar la formación de moléculas por unión de átomos de elementos no metálicos».
1. Se apunta que las bases para explicar la formación de los enlaces iónico y covalente fueron expuestas en 1916 por Kossel y Lewis, respectivamente. Según el texto, «ambos autores atribuían la falta de reactividad mostrada por los átomos de los gases nobles a la estructura electrónica de la última capa llena que presentaban, lo que les confería gran estabilidad».
2. También se indica que «en 1916, Lewis propuso una notación abreviada aplicable a cada molécula a fin de intentar facilitar la descripción y visualización de las uniones atómicas covalentes. Actualmente, las denominamos diagramas o estructuras de Lewis».
1. La unidad didáctica se inicia con una flecha del tiempo.
2. «En 1916, Kossel explicaba la formación de los enlaces iónicos, mientras Lewis abordaba la de los enlaces de tipo covalente».
3. «En 1921, Perkins formula el enlace covalente coordinado o dativo».
C2
4. «Pauling propone el concepto de resonancia».
5. «En 1927, Walter Heitler y Fritz London desarrollan la teoría del enlace de valencia».
6. «En 1931, Linus Pauling propone la teoría de hibridación de funciones orbitales atómicas».
7. Se apunta que el estudio de las propiedades metálicas llevó en 1902 a Drude y, posteriormente, en 1923 a Lorentz a proponer el modelo del gas electrónico o del mar de electrones.
1. En la introducción del tema se señala que se seguirán las directrices que en 1920 dieron los químicos Kossel y Lewis.
2. En el texto se recoge que «en 1916, Lewis y Langmuir sugirieron que el enlace covalente se forma por compartición de pares electrónicos».
3. Se señala que las fuerzas intermoleculares fueron descubiertas por el holandés J. D. van der Waals.
4. En la explicación del enlace metálico, el texto indica que «en 1900, Drude propuso un modelo basado en la idea de que los átomos metálicos, al unirse, se desprenden de sus electrones de valencia. Entonces estos electrones quedan deslocalizados en la red y sin conexión alguna con los átomos, que, a su vez, quedan ionizados positivamente.
D2
1. «En 1923, el químico norteamericano Lewis ideó la simbología para la representación bidimensional de las fórmulas».
2. «Pauling propone la teoría de enlace de valencia en 1939».
Velocidad de fusión del hielo en distintas disoluciones: un ejemplo de aprendizaje activo de la ciencia
Velocitat de fusió del gel en diferents dissolucions: un exemple d’aprenentatge actiu de la ciència
Rate of ice melting in different solutions: an example of active learning of science
Gabriel Pinto / Universidad Politécnica de Madrid. ETS de Ingenieros Industriales
Pascual Lahuerta / Universidad de Valencia. Facultad de Química
resumen

Con una sencilla experiencia en la que se estudia la velocidad de fusión de bloques de hielo en diferentes disoluciones acuosas, se introduce a alumnos de distintos niveles educativos en los procedimientos propios del método científico. Es un ejemplo práctico para aprender y discutir conceptos fisicoquímicos, así como para fomentar un aprendizaje activo y la formación en competencias. Sirve para motivar a los alumnos y, además, es un punto de partida para que observen cómo propiedades de sustancias sencillas (agua y cloruro de sodio) influyen en fenómenos complejos, como la circulación termohalina de los mares, causada por gradientes de densidades.
palabras clave
Aprendizaje activo, circulación termohalina, convección, densidad, propiedades del agua.
resum
Amb una senzilla experiència en la qual s’estudia la velocitat de fusió de blocs de gel en diferents dissolucions aquoses, s’introdueix alumnes de diferents nivells educatius en els procediments propis del mètode científic. És un exemple pràctic per aprendre i discutir conceptes fisicoquímics, així com per fomentar un aprenentatge actiu i la formació en competències. Serveix per motivar els alumnes i, a més, és un punt de partida perquè observin com propietats de substàncies senzilles (aigua i clorur de sodi) influeixen en fenòmens complexos, com ara la circulació termohalina dels mars, causada per gradients de densitats.
paraules clau
Aprenentatge actiu, circulació termohalina, convecció, densitat, propietats de l’aigua.
abstract
Students from different educational levels are introduced into the procedures of the scientific method using a simple experience in which the rate of melting of ice cubes in different aqueous solutions is studied. It is a practical example to learn and discuss physicochemical concepts, as well as to promote active learning and skills training. It serves to motivate and also is a starting point to observe how properties of simple substances (water and sodium chloride) influence complex phenomena, such as thermohaline circulation of the oceans, caused by density gradients.
keywords
Active learning, thermohaline circulation, convection, density, properties of water.
Introducción
Se muestra un ejemplo de problema, relacionado con la velocidad de fusión de un bloque de hielo en distintos medios (agua y disoluciones acuosas de cloruro de sodio), que los autores emplean para introducir a sus alumnos en metodologías activas de aprendizaje (Science education now…, 2007). Se promueve el aprendizaje por indagación, la formación de competencias básicas en ciencia y genéricas (propuesta y realización de experimentos, trabajo en equipo, observación, interpretación de resultados, elaboración de informes, etc.) y la discusión de conceptos fisicoquímicos (densidad, cambio de fase, flotabilidad, convección, solubilidad, etc.).
Los alumnos deben seguir el método científico para resolver un problema de fácil formulación y aparentemente sencillo, pero cuyo resultado no es baladí. Para ello, deben aplicar los pasos propios del citado método: formulación de hipótesis, realización de un primer experimento para contrastar las hipótesis, observación atenta, comparación de los resultados con las predicciones iniciales, proposición y realización de experimentos que permitan resolver nuevos interrogantes, interpretación de resultados, etc. Y así, hasta llegar a una explicación razonable del fenómeno que sea confirmada con la experiencia.
Los experimentos son sencillos, requieren un utillaje simple, son rápidos de hacer y permiten un fácil control de las variables implicadas, pudiendo ser realizados, sin ninguna peligrosidad, incluso en el propio hogar.
Esta actividad práctica se ha desarrollado con anterioridad por otros profesores, principalmente en el ámbito de las enseñanzas de Ciencias del Mar (Glessmer, 2014; Melting ice, s. a.), pero se considera un ejemplo también idóneo para las asignaturas de Física y de Quí-
mica. Aunque se puede implementar con distintas estrategias educativas, aquí se resume el procedimiento seguido con alumnos de bachillerato y de primer curso de varios grados en ingeniería.
Planteamiento del problema sobre la velocidad de fusión del hielo en distintos medios acuosos
Se sugiere a los alumnos que respondan a la siguiente pregunta: «¿Dónde fundirá antes un cubito de hielo, en agua o en agua saturada de sal?». Se puede detallar que la pregunta se refiere en ausencia de agitación. De forma intencionada, no se especifica el tipo de sal para que, cuando lo discutan, se planteen el hecho de si se refiere a la sal común (NaCl). Se enuncia, de forma expresa, que el agua, en el segundo caso, está saturada de sal, para que aprecien la importancia de conocer conceptos previos (como saturación de una disolución) y para favorecer que el resultado no ofrezca dudas (no se apreciaría de una forma tan perceptible la diferencia si se estudiara el comportamiento en agua con una pequeña cantidad de sal disuelta).
Tras dejarles tres minutos para que razonen de forma individual, se les solicita una respuesta sobre cuál será el resultado del problema, dándoles las opciones de que el cubito funde antes: a) en agua; b) en agua saturada de sal; c) prácticamente igual en ambos casos, y d) no se sabe. Una vez responden y el profesor recopila las respuestas, se les pide que
razonen, en grupos de tres, durante cinco minutos, qué les ha llevado a proponer una respuesta u otra. Después de contabilizar de nuevo el número de respuestas, se reflejan en la pizarra (se muestra un ejemplo en la tabla 1).
A continuación, se plantea a los alumnos que, mediante una «tormenta de ideas», indiquen cómo se podría resolver la cuestión, llegando a la conclusión de que lo mejor sería realizar un experimento para determinar el resultado.
Se les da un tiempo de dos semanas para que, en grupos de tres, realicen el experimento y confirmen de este modo cómo se produce la fusión en los dos medios. Se les pide igualmente que, en ese tiempo, razonen las causas del diferente comportamiento y que realicen un informe, donde deben indicar el resultado obtenido aportando datos, condiciones experimentales, tiempos medidos, fotografías, etc. También se les incide en que incluyan su razonamiento sobre si creen que se debería haber especificado algo más el enunciado de la cuestión, desde el punto de vista físico o químico, así como otros detalles que consideren de interés.
Una vez realizado el primer informe, se les dan otras dos semanas para que realicen un segundo informe sobre nuevas experiencias que ayuden a responder a la pregunta «¿Qué hace que en la disolución salina la fusión del hielo sea más lenta?». Para ello, deberían probar otros solutos, distintas concentraciones
1. Respuestas iniciales planteadas al problema por alumnos de primer curso del grado en Ingeniería Química en 2013
¿Dónde funde antes un cubito de hielo?
a) En agua
N.º de respuestas tras el razonamiento Individual En equipo
8 5
b) En agua saturada de sal 39 48
c) Prácticamente igual en los dos medios 6 3
d) No lo sé
3 0
un ejemplo de aprendizaje activo de la
salinas, empleo de colorantes o de agitación, etc. Este es un momento clave marcado por la iniciativa de los alumnos: tienen que proponer una o más variables determinantes para el fenómeno y alguna experiencia que aporte información experimental sobre su importancia.
Finalmente, una vez corregidos los informes finales, se discute el tema en clase.
Resultados experimentales de los alumnos
Con esta tarea, los alumnos valoran la importancia del trabajo en equipo y se facilita que encuentren que la práctica experimental es fundamental en ciencia. Además, se promueve el aprendizaje y la discusión de conceptos en principio bien conocidos.
Al preguntar a los alumnos, el día de la discusión inicial, las razones por las que creen (erróneamente) que el hielo funde antes en agua con sal, aluden frecuentemente al descenso crioscópico del agua o al hecho conocido (relacionado con el primero) del empleo de sal para evitar la formación de hielo en carreteras y aceras en tiempo de nevadas. Es importante precisar que la respuesta al problema no es elemental (e, incluso, es controvertida cuando se plantea entre profesores).
El agua y el cloruro de sodio, dos sustancias ampliamente conocidas, son objeto aquí de un problema aparentemente sencillo, pero cuya discusión puede llegar a ser apasionante (Glessmer, 2014).
Cuando se discute inicialmente con los alumnos cómo se podría conocer la solución al problema planteado, se suelen dar tres tipos de respuesta:
— Sería necesario y posible realizar un experimento sencillo, en el que se dispusiera un cubito de hielo del frigorífico de casa en un vaso de agua a temperatura ambiente y otro en un vaso igual,
pero sobre el que se añadiría cloruro de sodio hasta observar que no se disuelve más (saturación). Es la respuesta más frecuente y adecuada para los objetivos planteados.
— Se puede «buscar en Internet». Es una respuesta muy recurrente en clase, que puede dar pie al profesor a comentar cómo hay que utilizar la web como fuente de recursos para el aprendizaje.
— Se podría preguntar a un experto en el tema (profesor, investigador, etc.).
misma); temperatura (debe ser igual inicialmente en ambos líquidos); determinación del final de la fusión (esto hace que el resultado no tenga una gran precisión, pero sí se establece claramente la diferencia de tiempos en los dos medios); tipo de recipiente (los dos vasos han de ser iguales, para evitar otras influencias), y necesidad de depositar suavemente los bloques de hielo en el líquido (para evitar la influencia de la agitación). La realización del experimento y su descripción varían mucho de

Hay alumnos que piensan que, de alguna manera, el profesor plantea algo «con trampa» y hacen comentarios del tipo: «depende de lo que consideremos igual velocidad», «depende de las cifras significativas», etc.
La mayoría de los alumnos observa, cuando realizan el experimento en su casa (fig. 1), que el tiempo necesario para la fusión del hielo es significativamente mayor en el vaso con sal, contrariamente a lo que suelen indicar inicialmente (hipótesis general de partida). Algunos resultados de tiempos medidos por alumnos se muestran en la fig. 2.
Algunos factores a tener en cuenta al realizar el experimento son los siguientes: control de la cantidad y forma del hielo (deben ser bloques muy similares); cantidad de los líquidos (debe ser la
unos grupos a otros debido a que el interés y el grado de implicación son desiguales. Hay alumnos que hacen el experimento solo una vez y reflejan de forma escueta o incompleta el resultado, y hay quien recoge detalles como el volumen de líquido (normalmente, entre 100 y 250 mL), las temperaturas iniciales de los líquidos, la cantidad de sal empleada, la masa (o las dimensiones) de los bloques de hielo, etc. También hay quien detalla muchos aspectos con la realización de fotografías. Incluso un alumno (en una ocasión en la que el trabajo se hizo de forma individual) llegó a escribir en su informe que no pudo ver el resultado final porque se descuidó mientras «desaparecían» del todo los bloques de hielo. Otros realizan experimentos adicionales de interés, con lo que
profundizan en la resolución del problema. Ejemplos típicos son probar con otros solutos en vez de cloruro de sodio (el más recurrente es el azúcar, aunque hay quien prueba con disoluciones de sales como NaHCO3, accesible en casa) y ensayar con distintas concentraciones.
medio líquido) observó que el agua con gran cantidad de NaCl disuelto no llegaba a cristalizar completamente en el congelador, y que se depositaba parte de la sal en el fondo.
Un grupo de alumnos comprobó que no había diferencia apre-

Un equipo realizó los dos experimentos con bloques de «hielo» de distinta composición, que denominaron «hielos» de agua, Coca-Cola, leche, tinto de verano y Fanta de naranja. No explicaron bien sus conclusiones (en todos los casos, se fundía antes el bloque de «hielo» en agua frente al agua saturada de sal, excepto en el de tinto de verano, que era similar). Observaron una mayor rapidez en la fusión de los bloques de bebidas carbonatadas heladas que en el hielo puro, lo que puede deberse a que el CO2 ocluido en la congelación hace que los bloques no sean tan compactos. Una cuestión que descubrieron tiene su importancia: indicaron que fueron «incapaces de congelar vodka». Aunque no lo explicaron, descubrieron que, en esta bebida, el etanol actúa como «anticongelante».
Otro equipo que se planteó estudiar la influencia de la composición del propio hielo (no del
considerando distinto número de bloques de hielo. Sorprende, en este caso, que con un solo bloque de hielo las diferencias de tiempo sean tan pequeñas, pero no especificaron ni el volumen de los bloques ni el de los líquidos.
Por comentar otro ejemplo, muestra de la creatividad de los alumnos, un grupo investigó qué ocurre si se pone un cubito de hielo en etanol: el hielo se hunde y, cuando va fundiendo, queda entre dos capas bien visibles (en la superior está el etanol, de menor densidad, y en la inferior está el agua que se va formando) y, entre ambas, se encuentra el hielo, de densidad intermedia. Este ejemplo puede ser inspirador para otras posibles experiencias, como se especifica más adelante, a la par que explica en parte el fenómeno principal que se discute en este trabajo, esto es, la diferencia de densidades entre líquidos.

ciable entre preparar la disolución salina con «sal fina» o con «sal gorda». Otros compararon el experimento efectuado en Madrid y en Alicante, especificando la diferencia de presión atmosférica y de humedad relativa.
En la fig. 3 se muestran los resultados de un grupo de alumnos al determinar los tiempos de fusión en los dos medios líquidos,
Razonamientos de los alumnos sobre los resultados obtenidos
Las interpretaciones que ofrecen los alumnos sobre las causas del diferente comportamiento observado son de muy diversos tipos. Algunas de las más frecuentes, reformuladas para agrupar distintas aportaciones, son las siguientes: — La densidad de la disolución salina es mayor que la del agua.
En la primera, el hielo flota más que en la segunda y, por ello, la fusión es más lenta. Para la confirmación de esta hipótesis, algunos alumnos proponen acertadamente experimentos para evaluar en qué medida dicho efecto influye en el proceso de fusión del hielo. Un experimento adecuado consiste en llenar ambos vasos de agua, con sal y sin sal, casi hasta el borde, poner seguidamente los dos cubitos de hielo que deberán sobrepasar los bordes del vaso y colocar encima del vaso una superficie de cristal (por ejemplo, un vaso de mayor anchura), de manera que los cubos de hielo se encuentren completamente sumergidos en el líquido. El resultado sigue siendo el mismo: en el vaso con sal, la fusión del hielo es más lenta, si bien los tiempos de fusión de los cubos de hielo varían ligeramente.
— Los iones (sodio y cloruro) interaccionan con las moléculas de agua en el cubo de hielo, «retrasando la fusión». Para confirmar esta hipótesis, algunos alumnos proponen sustituir la disolución salina por una disolución de azúcar en agua, como ya se ha indicado. El resultado es análogo (en el vaso con azúcar, la fusión del hielo es más lenta que en el vaso que solo contiene agua) y los tiempos de fusión varían dependiendo de la cantidad de azúcar añadida.
— La disolución salina hace que disminuya la temperatura en contacto con el hielo y por eso el proceso es más lento.
En cuanto al análisis del enunciado, al solicitarles si consideraban necesario haber especificado más, casi todos reparan en aspectos anecdóticos y no tanto en señalar que no se especifica la sal (entendiéndose que es NaCl), ni los volúmenes de líquido en el vaso (no sería lo mismo con muy pequeñas cantidades), ni la tem-
peratura inicial de los líquidos, entre otras cuestiones.
Nuevos experimentos propuestos a los alumnos
Según el nivel de interés, se puede sugerir a los alumnos que profundicen en el tema, realizando, por ejemplo, el experimento de partida con el hielo o el medio líquido con unas gotas de colorante alimentario, tinta o disolución de permanganato de potasio. De este modo, se puede observar fácilmente una de las claves del problema, como se sugerirá más adelante. En la fig. 4 se muestra el aspecto que tienen dos bloques de hielo preparados por congelación de agua sobre la que se añadieron un par de gotas de colorante alimentario. Se observa que el colorante, en un principio distribuido homogéneamente en el agua, se concentra en la parte central al formarse el hielo. Este es un aspecto relevante de la complejidad que concierne al proceso de congelación.
mentos los fueran proponiendo los alumnos como forma de confirmar alguna hipótesis. Parece que nunca se agotan las propuestas de interpretación de las causas del comportamiento observado en la experiencia. Aparte de aportaciones propias de los alumnos, como las resaltadas anteriormente, suele ser conveniente sugerirles que realicen algunas observaciones en el transcurso del experimento. Con objeto de no ser exhaustivos, se proponen aquí solamente tres: — Determinar cómo afecta la concentración de sal en la disolución salina al proceso de fusión del hielo. Para ello, se pueden preparar dos vasos, uno con una disolución saturada de sal y otro con una disolución que tenga una menor concentración salina. En la disolución saturada, la fusión del hielo es más lenta, por lo que se concluye que el aumento de concentración de soluto tiene un efecto «retardador» en la fusión del hielo.

También se les puede sugerir que midan temperaturas frente al tiempo de fusión y/o en distintas posiciones del vaso, que realicen los experimentos con agitación (en este caso, se observa que los dos bloques de hielo funden en un tiempo parecido), etc. Lo ideal, claro está, sería que esos experi-
— Puesto que la fusión conlleva un cambio de temperatura en el líquido, utilizar un termómetro para medirla. Este nuevo experimento puede llevar un tiempo de realización, hasta que los alumnos observen que los valores de temperatura que se obtienen varían según en qué parte del liqui-
do se realiza la medida. Al final, deberían decidir medir temperaturas en la superficie (lejos del hielo, a ser posible) y en el fondo del vaso. Se observa que, en el vaso con agua saturada de sal, la temperatura en la superficie es varios grados más baja que en el fondo del vaso. Por el contrario, en el vaso con agua, la temperatura en el fondo es menor que en la superficie. Por ejemplo, las fig. 5 y 6 recogen gráficas realizadas a partir de los datos aportados por un grupo de alumnos.
laboratorio, bien en el aula).
Se puede medir la temperatura (como se indicó en el párrafo anterior) en diferentes momentos. El resultado es que, en ambas muestras, los hielos funden prácticamente de forma simultánea y que no se observan gradientes de temperatura tan acusados entre la superficie y el fondo del vaso. Se puede concluir así que el efecto de agitación iguala las condiciones de difusión en ambos vasos.

Valores obtenidos por un grupo de alumnos de la temperatura en función del tiempo cuando el hielo se dispone en agua.

Figura 6. Valores obtenidos por un grupo de alumnos de la temperatura en función del tiempo cuando el hielo se dispone en agua saturada de NaCl.
— En todos los ensayos que suelen realizar los alumnos, el líquido está en reposo, pero ¿qué pasa si se agita? En un nuevo experimento, se puede repetir la experiencia agitando ambos vasos de forma simultánea (usando, por ejemplo, un agitador magnético, bien en el
Explicación del fenómeno observado
Las conclusiones de todas las observaciones que se han descrito en los apartados anteriores se pueden resumir en:
— El diferente tiempo de fusión del hielo en agua y en agua salada se observa
solo si los vasos están en reposo.
— Mayores concentraciones de sal producen tiempos de fusión mayores.
— El efecto de los iones no es importante.
— En reposo, se observa un gradiente de temperatura, diferente en los dos casos, que se rompe por agitación.
Las interpretaciones que se pueden inferir de estas observaciones son las siguientes:
— En el vaso sin sal, el agua que se forma al fundir el hielo tiene una temperatura más baja que el resto y también una mayor densidad. La densidad del hielo a 0 ºC es 0,9162 g/cm3, la del agua líquida a 0 ºC es 0,9998 g/cm3 y a 20 ºC es 0,9982 g/cm3 (Density of ice…, 2010). Por eso el agua que se forma en la fusión se difunde al fondo del vaso, donde se observa una temperatura más baja. Una propuesta de trabajo interesante para los alumnos es que indaguen sobre la peculiar variación de la densidad del hielo y del agua líquida con la temperatura.
— En el vaso con sal, el agua que se forma al fundir el hielo tiene una temperatura más baja que el resto, pero ahora la densidad de la disolución es mayor e impide así la difusión del agua recién fundida hacia el fondo. En concreto, la densidad de una disolución acuosa saturada de NaCl es del orden de 1,20 g/cm3 entre 20 ºC y 25 ºC (Thurmond, Potter y Clynne, 1984). Por otra parte, la solubilidad del NaCl a 25 ºC es de 360 g NaCl/1 kg H2O (Burgess, 1978).
— Por todo ello, en el vaso con sal, el hielo funde rodeado de agua más fría que en el otro caso y, como consecuencia, lo hace más lentamente.
— La agitación rompe el gradiente de temperaturas al favorecer la difusión.
Una forma directa de confirmar el diferente fenómeno de difusión en ambos vasos puede ser añadir unas gotas de colorante alimentario, al principio o a los pocos minutos de iniciada la experiencia, como ya se mencionó. En el vaso de disolución salina, el colorante queda en la superficie, resaltando así la capa de agua fría y de menor densidad. Incluso sin colorante, hay alumnos que visualizan una doble capa en el vaso de disolución salina. En el vaso sin sal, el colorante se difunde (de forma bastante espectacular) hacia el fondo, como se muestra en la fig. 7.
do al fundirse el hielo en ambos medios. En concreto, en la experiencia realizada, el bloque de hielo sobre el agua tardó veinte minutos en fundir y el del otro medio tardó ochenta y cinco minutos. Estos datos se han incluido en la gráfica de la fig. 2. La fotografía inicial (a) está tomada cuando se dispusieron los dos bloques de hielo, con suavidad, sobre los líquidos y se empezó a contabilizar el tiempo, justo antes de añadir dos gotas de colorante alimentario rojo sobre cada uno de los bloques de hielo. Entre las imágenes a y d transcurrió media hora. La imagen d está tomada al

En la fig. 7 se recogen distintas fotografías de una experiencia realizada por los autores en el laboratorio. Se partió de bloques de hielo de 80 g cada uno, depositados en 1 L de agua y en 1 L de disolución saturada de NaCl en agua. Ambos líquidos tenían una temperatura inicial de 21 ºC. Aunque las imágenes están tomadas desde distintas perspectivas, a la izquierda siempre se trata del agua y a la derecha, de la disolución acuosa saturada de NaCl. A medida que transcurre el tiempo (entre las fotografías a y d), se visualiza lo ya comentado anteriormente y que demuestra cómo circula el agua que se va forman-
mismo tiempo que la c, pero desde arriba.
En el experimento, aparte de la difusión del agua que se va formando, por diferencia de densidad, se observa una distinta for-
ma de fundirse el bloque de hielo (de forma más homogénea, en agua, y de forma más cónica, en el agua con sal), por efecto de las temperaturas existentes en el agua que rodea cada bloque.
También se observa que el hielo se mueve en el vaso con agua, mientras que en el otro permanece inmóvil, lo que supone la generación de movimiento entre las capas de agua, en el primer caso. Otro detalle curioso que conviene destacar es que, en el segundo caso, apareció la formación de agua condensada en la parte externa del vaso, en la zona próxima al hielo, mientras que en el caso del agua, no (fig. 8). Esto denota una importante diferencia de las temperaturas alcanzadas en la zona superior.
En la fig. 9 se muestra cómo se puede visualizar el fenómeno general con los hielos preparados con colorante (como se mostró en la fig. 4), en este caso azul (también con dos gotas sobre 80 g de agua y homogeneizado antes de introducirlo en el congelador).
Algunos errores conceptuales o ideas alternativas reseñadas por los alumnos para explicar el fenómeno observado implican alusiones a: «descenso o aumento» ebulloscópico, calor de disolución, principio de Le Châtelier sobre el equilibrio químico, el conocido dicho químico de «semejante disuelve a semejante», fuerzas electrostáticas, variación de entropía, calor específico del agua, interacciones


Figura 9. Imágenes del experimento realizado con el colorante incluido al formarse hielo. A la izquierda, el líquido es agua y, a la derecha, disolución acuosa saturada de NaCl.
dipolo-dipolo, enlace de hidrógeno, etc. Por ejemplo, un grupo de alumnos indicó: «Para disolver la sal, hace falta energía para romper los enlaces sodio-cloruro; como la única fuente de calor es el agua líquida, la sal absorbe calor del agua y por eso su temperatura es menor que en el otro vaso».
Es importante tener algo en cuenta para el proceso educativo: a veces, los alumnos, más que buscar la solución a un problema, intentan ver cómo «encaja» con lo que han estudiado en clase.
Hay alumnos que copian directamente soluciones absurdas (muchas veces tomadas de Internet) del tipo «la sal disminuye la solubilidad del agua» o «tienen más energía los enlaces del agua para romper los enlaces del H2O del hielo que los enlaces de NaCl con H2O». Es bueno analizarlo para ayudar a plantear las estrategias educativas.
A pesar de estas especificaciones, recogidas por su interés pedagógico, cabe resaltar también que muchos alumnos hacen unos trabajos y unos razonamientos excelentes.
Conclusiones y propuestas de nuevas cuestiones a investigar
La experiencia de los autores en la introducción de metodolo-
gías activas para alumnos de las materias de Física y de Química de bachillerato y de primer curso universitario, así como en cursos de formación de profesores, ha sido altamente positiva, con temas muy variados (Pinto, 2013; Prolongo y Pinto, 2010). El caso aquí presentado es otro ejemplo ilustrativo de la forma con que se pueden abordar estas metodologías en la práctica docente con sustancias sencillas y bien conocidas.
Esta experiencia es sumamente enriquecedora, tanto para alumnos como para profesores. A modo de ejemplo, basado en una experiencia reflejada por un grupo de alumnos, se puede repetir el experimento principal forzando (por ejemplo, con una varilla de vidrio) al hielo a estar sumergido en el líquido. Se observará que la variación de velocidad de fusión es justo la contraria que en el caso de partida. Otro experimento muy interesante, ya señalado, consiste en probar a fundir el hielo en etanol o en otros medios (como distintos tipos de aceite de cocina).
También se puede proponer realizar otros experimentos para discutir aspectos relacionados con el cambio de fase de hielo a
agua líquida o viceversa, como, por ejemplo:
— El conocido y controvertido «efecto Mpemba»: en algunas condiciones, el agua caliente se congela antes que el agua fría (Jeng, 2006).
— La congelación instantánea del agua preenfriada (pero no congelada) en un congelador al golpear el recipiente, que pone de manifiesto el sobreenfriamiento de un líquido (Schülli, 2010).
— La preparación de mezclas frigoríficas con hielo y sal común, que tiene que ver con el equilibrio entre fases (Martínez Pons, 2003).
— La obtención de bloques de hielo transparentes e incoloros (como algunos comerciales), evitando la turbidez típica de los caseros.
Entre otros aspectos didácticos que también se pueden abordar, se indica que, con las etiquetas de los colorantes alimentarios utilizados, los alumnos pueden indagar en su composición, obtención, propiedades, etc. En concreto, el azul y el rojo usados en este trabajo son el E122 (azorrubina) y el E133 (azul brillante FCP), respectivamente.
La experiencia analizada en este trabajo es una buena ocasión para introducir aspectos más conocidos pero no por ello menos sorprendentes para los alumnos, como es el hecho de que el hielo sea menos denso que el agua o la explicación de por qué los lagos se congelan desde la superficie hacia el fondo (Chang, 1998).
Aparte de descubrir los alumnos, por sí mismos y de forma experimental, la solución al problema, observan cómo se transmite el calor por convección. Para ellos, suele ser más sencillo entender las otras formas de transmisión del calor (conducción y radiación). Además, las corrientes de convección que
aprecian en los vasos de los experimentos pueden ser la base para que indaguen sobre este importante fenómeno en la naturaleza, como son los efectos en el clima del movimiento de las capas de la atmósfera y la influencia en las corrientes oceánicas de la variación de la densidad del agua por distinta temperatura y salinidad (circulación termohalina) (Bryan, 1986; Skliris, 2014).
Confiamos que los resultados recogidos en este trabajo orienten y sirvan de inspiración a otros docentes para la utilización de metodologías activas, con objeto de facilitar la formación en competencias básicas en ciencia.
Agradecimientos
Se agradece el apoyo recibido de la Universidad Politécnica de Madrid con el proyecto de innovación educativa PT14_15-03002, así como la labor desempeñada por los alumnos durante el desarrollo de la actividad.
Referencias
Bryan, F. (1986). «High-latitude salinity effects and interhemispheric thermohaline circulations». Nature, n.º 323, p. 301-304.
Burgess, J. (1978). Metal ions in solution. Nueva York: Ellis Horwood. chang, R. (1998). Química. 6.ª ed. Nueva York: McGraw-Hill, p. 429.
Density of ice and liquid water calculator [en línea] (2010). S. l.: Had2Know. <http://bit. ly/1Nl38Qx> [Consulta: 1 diciembre 2014].
glessmer, M. S. (2014). Ice cubes melting in fresh water and salt water [en línea]. S. l.: s. n. <http://bit.ly/1NkUvpc> [Consulta: 1 diciembre 2014].
Jeng, M. (2006). «The Mpemba effect: when can hot water freeze faster than cold?». Ame-
rican Journal of Physics, n.º 74, p. 514-522.
martínez pons, J. A. (2003). «Fisicoquímica de la heladera tradicional». El Rincón de la Ciencia [en línea], n.º 66, s. p. <http:// bit.ly/1LI9WCc> [Consulta: 1 diciembre 2014].
Melting ice [en línea] (s. a.). Narragansett: Centers for Ocean Sciences Education Excellence. <http://bit.ly/1Xrbs7V> [Consulta: 1 diciembre 2014].
pinto, G. (2013). «Termoquímica de las calderas domésticas de condensación: un caso de aprendizaje contextualizado por indagación dirigida». Educació Química EduQ, n.º 14, p. 29-38.
prolongo, M. L.; pinto, G. (2010). «Las bebidas autocalentables y autoenfriables como recursos para un aprendizaje activo». Educació Química EduQ, n.º 7, p. 4-14.
Science education now: A renewed pedagogy for the future of Europe [en línea] (2007). Bruselas: Comisión Europea. <http://bit. ly/1ixEQz5> [Consulta: 1 diciembre 2014].
schÜlli, T. (2010). «Science is cool… super cool». Science in School, n.º 17, p. 17-22. Trad. al español en línea: <http://bit. ly/1XrciS4> [Consulta: 1 diciembre 2014].
skliris, N. (2014). «Past, present and future patterns of the thermohaline circulation and characteristic water masses of the Mediterranean Sea». En: goFFreDo, S.; DuBinsky, z (ed.). The Mediterranean Sea: Its history and present changes. Dordrecht: Springer, p. 29. thurmonD, M. L.; potter, R. W.; clynne, M. A. (1984). The densities of saturated solutions of NaCl and KCl from 10 ºC to 105 ºC: Open file report 84-253 [en línea]. Washington: United States Department of the Interior Geological Survey. <http://
on.doi.gov/1LPR7TR> [Consulta: 1 diciembre 2014].

Gabriel Pinto
Es doctor en Ciencias Químicas por la Universidad Complutense de Madrid y catedrático en la Universidad Politécnica de Madrid. Ha investigado sobre materiales poliméricos, así como sobre didáctica de la química y la ingeniería. Es autor de más de trescientos trabajos, entre artículos, ponencias en congresos y capítulos de libros. También ha impartido conferencias en varios países sobre didáctica de las ciencias experimentales. Su principal ámbito de interés es la elaboración de recursos educativos para la formación en competencias básicas en ciencia y tecnología.
C. e.: gabriel.pinto@upm.es Web: http://quim.iqi.etsii.upm.es/vidaco tidiana/Inicio.htm

Pascual Lahuerta
Es doctor en Química por la Universidad de Zaragoza y catedrático en la Universidad de Valencia. Ha investigado sobre la síntesis y las propiedades catalíticas de compuestos organometálicos, en particular, de rodio y paladio. Es autor de más de un centenar de publicaciones científicas en este campo. Una línea de interés actual es el desarrollo de materiales interactivos para la enseñanza de la química a todos los niveles.
C. e.: lahuerta@uv.es
NORMES DE PUBLICACIÓ
Preparació dels manuscrits
Els articles han de fer referència a qualsevol dels temes de les seccions de la revista per a qualsevol nivell d’educació, des de primària fins a l’educació universitària. Han de ser inèdits i han d’estar escrits en català, tot i que també es publicaran articles en castellà, francès, portuguès, italià i anglès, si l’autoria és de persones de fora de l’àmbit de la llengua catalana.
Els treballs han de tenir una extensió màxima de 25.000 caràcters sense espais i han de ser escrits amb un espaiat d’1,5 i han de tenir el nombre de caràcters amb espais especificat en cadascuna de les seccions de la revista. El text ha d’estar en format Microsoft Word i lletra Times New Roman de cos 12.
La primera pàgina ha de contenir el títol del treball, el nom o noms dels autors i el centre o centres de treball, un resum de 500 caràcters (incloent-hi espais) i cinc paraules clau. El títol, el resum i les paraules clau han d’anar seguits de la seva versió en anglès. Cal enviar també l’adreça postal dels autors o la del centre de treball per poder enviar-los el número de la revista en què han participat.
Els articles han d’anar acompanyats de fotografies i imatges en color que il·lustrin el contingut del text. L’article haurà de contenir fotografies en color del treball a l’aula, dels muntatges dels experiments o altres fotografies relacionades amb el contingut. També han de contenir gràfics, esquemes, dibuixos i treballs o produccions dels alumnes que il·lustrin i facin més comprensible el contingut del text. Les il·lustracions han de portar títol (peu d’imatge) i cal indicar on cal situar-les dins l’article. Les fotografies i imatges s'han d'enviar en arxius separats en format .tif o .jpeg (resolució mínima: 300 píxels/polzada) i, si es tracta de gràfics, en Excel o Corel Draw.
L’article ha d’estar estructurat en diferents apartats. Els autors han de seguir les normes recomanades per la IUPAC a l’hora d’anomenar els composts químics i utilitzar el sistema internacional d’unitats. És convenient el fet d’assenyalar 3 o 4 frases de l’article que es destacaran amb una lletra més gran i de color en l’article maquetat.
Les referències bibliogràfiques han d’anar al final del text, escrites com els exemples següents:
Per a llibres:
VILCHES, A.; GIL, D.(2003). Construyamos un futuro sostenible: Diálogos de supervivencia. Madrid: Cambridge University Press. Citació en el text: (Viches i Gil, 1994).
Per a articles:
SARDÀ, A.; SANMARTÍ, N.(2000). «Ensenyar a argumentar científicament: un repte de les classes de ciències». Enseñanza de las Ciencias, vol. 18, núm. 3, p. 405-422. Citació en el text: (Sardà i Sanmartí, 2000).
Per a documents digitals (webs): OCDE (2006). PISA 2006: Marco de la evaluación. Conocimientos y habilidades en Ciencias, Matemáticas y Lectura [recurs electrònic]. París: OCDE. <http://www.oecd.org/dataoecd/59/2/39732471.pdf> [Consulta: 11 setembre 2013].
Per a altres exemples, consulteu un número recent de la revista.
Al final de l’article ha de constar una breu ressenya professional i una fotografia de les persones autores de l’article. Cada ressenya ha de contenir el nom i cognoms, càrrec, centre de treball, camp principal en el qual desenvolupa la seva tasca i correu electrònic (màxim de 400 caràcters amb espais). Cal enviar els arxius de les fotografies de carnet dels autors en format .tif o .jpeg (resolució mínima: 300 píxels/polzada).
Enviament d’articles
Els articles han de ser enviats per correu electrònic a l’adreça següent: EduQ@iec.cat Revisió dels articles
Els articles seran revisats per tres experts. Els articles revisats i enviats als autors hauran de ser retornats als editors en el termini màxim de 10 dies. Sempre que sigui possible, les proves de maquetació seran enviades als autors abans de la seva publicació.
SECCIONS
ACTUALITZACIÓ DE CONTINGUTS
Articles que revisen i posen al dia continguts propis de la disciplina o en relació a altres àmbits del coneixement, i que faciliten i promouen un ensenyament actualitzat de la química.
APRENENTATGE DE CONCEPTES I MODELS
Articles que tracten sobre conceptes i models químics, des del punt de vista de les concepcions alternatives dels alumnes i les dificultats d’aprenentatge conceptuals, així com les estratègies didàctiques per a l’elaboració i l’aplicació dels models químics a l’aula.
CURRÍCULUM, PROJECTES I UNITATS
Presentació i anàlisi dels currículums de química de diferents països, de projectes curriculars i unitats i seqüències didàctiques.
DIVULGACIÓ DE LA QUÍMICA
Articles que presenten temes d’actualitat química amb caràcter divulgatiu i que posen de manifest les relacions de la química amb la societat i altres àmbits del coneixement o bé presenten activitats i experiències de caire divulgador de la química adreçades a l’alumnat o al públic en general.
ESTRATÈGIES DIDÀCTIQUES
Presentació i anàlisi d’enfocaments i estratègies didàctiques per a l’ensenyament i l’aprenentatge de la química: modelització, indagació, resolució de problemes, treball cooperatiu, avaluació, etc.
FORMACIÓ DEL PROFESSORAT
Propostes i investigacions sobre la formació inicial i en actiu del professorat de química i ciències en general que contribueixin al seu desenvolupament professional.
HISTÒRIA
I NATURALESA DE LA QUÍMICA
Articles sobre la història i la naturalesa de la química i sobre l’interès didàctic d’aquestes disciplines en l’ensenyament de la química. Activitats per treballar aspectes de la naturalesa de la ciència.
INNOVACIÓ A L’AULA
Articles que descriuen la planificació i l’experimentació a l’aula d’experiències didàctiques de caràcter innovador. La secció pretén ser un espai per compartir experiències d’aula.
LLENGUATGE, TERMINOLOGIA I COMUNICACIÓ
Articles relacionats amb l’aprenentatge de les habilitats comunicatives (llegir, escriure i parlar) en relació amb l’aprenentatge de la química. I també sobre el llenguatge i la terminologia científics.
NOVES TECNOLOGIES
Articles relacionats amb la utilització de les noves tecnologies en l’ensenyament de la química: simulacions, ús d’Internet, mitjans audiovisuals, laboratoris virtuals, experiències amb equips de captació de dades, etc.
QUÍMICA EN CONTEXT
Articles que presenten contextos rellevants –de la vida quotidiana, tecnològics, industrials, socials, mediambientals, de salut o culturals– que puguin ser presos com a punt de partida per a un ensenyament de la química en context i per promoure l’alfabetització científica.
QUÍMICA, EDUCACIÓ AMBIENTAL I SOSTENIBILITAT
Articles que facin palesa l’estreta de relació entre la química i els aspectes del medi ambient, i temàtiques mediambientals d’actualitat des d’una vessant química, així com propostes educatives per a la sostenibilitat
RECERCA EN DIDÀCTICA DE LA QUÍMICA
Articles que difonguin investigacions didàctiques d’utilitat per a la millora de l’ensenyament de la química. Descripció i resultats d’experiències didàctiques que hagin estat avaluades de forma qualitativa o quantitativa.
RECURSOS DIDÀCTICS
Articles que presentin qualsevol tipus de recurs i material didàctic per a l’ensenyament de la química. Poden incloure, entre d’altres, audiovisuals, jocs, visites, textos dels mitjans de comunicació, etc.
TREBALL EXPERIMENTAL
Articles sobre diferents tipus de treballs pràctics experimentals: demostracions, experiències interpretatives, aprenentatge de tècniques, investigacions, etc.
TREBALLS DE RECERCA DELS ALUMNES
Articles descriptius de treballs de recerca dels alumnes dins l’àmbit de la química. En aquesta secció, els alumnes són els autèntics protagonistes.
Properes monografies
Química a la xarxa
Especial ECRICE2016
Productes químics


