Planeación




Progresión 2
Metas, categorías y subcategorías
Metas
• CC. Comprende qué es la materia y concibe sus interacciones. Identifica los flujos y conservación de la materia y energía. Concibe que cuando la energía y la materia circulan, se dan cambios físicos y químicos en los materiales y organismos vivos del planeta.
• CT1. Relacionar la naturaleza de la estructura microscópica con los patrones macroscópicos.
• CT3. Extraer información sobre la magnitud de las propiedades y los procesos a partir de relaciones proporcionales entre distintas cantidades.
• CT4. Reconocer que los sistemas algunas veces interactúan con otros sistemas, pueden contener subsistemas o bien ser parte de sistemas más grandes y complejos. Describir un sistema a partir de sus límites e interacciones: entradas, procesos, salidas y flujos.
• CT5. Comprender que el principio de conservación de la materia se presenta porque el número de átomos se conservan en los procesos físicos y químicos.
• CT6. Analizar las estructuras del sistema de forma independiente para determinar cómo funcionan.
Conceptos transversales
• CT1. Patrones
• CT3. Mediciones
• CT4. Sistemas
• CT5. Flujos y ciclos de la materia y la energía
• CT6. Estructura y función
Al finalizar la progresión 2, los estudiantes habrán adquirido conocimientos sobre cómo se forman las moléculas a partir de los átomos. Aprenderán que los átomos se pueden combinar para formar moléculas, que son las unidades básicas de la mayoría de las sustancias. También aprenderán que las sustancias puras están compuestas por un solo tipo de átomo, molécula o ión, lo que les da propiedades únicas que pueden usarse para identificarlas y distinguirlas de otras sustancias. Mediante el estudio de estas propiedades características, serán capaces de identificar y comprender mejor los elementos y sustancias del entorno.
Recursos necesarios
• Pintarrón y marcadores
• Libro de texto (páginas 20, 21, 22, 23, 24, 25, 26 y 27)
• Lápiz
• Computadora o dispositivo movil con conexión a internet
• Un encendedor o cerillos
• 100 g de ácido bórico
• 100 ml acetona o quitaesmalte de uñas
• 200 ml de alcohol
• Cuatro vidrios de reloj o recipientes de aluminio o de vidrio que resistan el calor
• 1 m de hilo de cobre
Recursos adicionales

Plataforma en línea (keepteaching.app)
Notas de clase
Soluciones
Versión digital del libro
Lecciones interactivas
TMAI-2.1-Atomos, elementos químicos y tabla
https://keepteaching.app/PzWjNkoX/1a75c488-f236-4786-b499-927ad6110590
Videos
Como Hacer Fuego de Colores | Experimentos Caseros
https://www.youtube.com/embed/HOg7UjdtgpQ
Estructura atómica, átomo, electrón, protón, neutrón, número atómico, de masa, ion
https://www.youtube.com/embed/8uvluIhFX9I
Enlaces
Conceptos de número atómico, número de masa, masa atómica e isótopos
https://www.aev.dfie.ipn.mx/Materia_quimica/temas/tema2/subtema3/subtema3.html

Materia, elementos y átomos
https://es.khanacademy.org/science/ap-biology/chemistry-of-life/elements-oflife/a/matter-elements-atoms-article
Elementos y átomos
https://es.khanacademy.org/science/ap-biology/chemistry-of-life/elements-oflife/v/elements-and-atoms
Propiedades y cambios físicos y químicos de la materia
http://uapas2.bunam.unam.mx/ciencias/propiedadesycambios/
Propiedades de la materia
https://www.aev.dfie.ipn.mx/Materia_quimica/temas/tema1/subtema1/subtema1.html
Disparador cognitivo
Esta sección ofrece una introducción al mundo de los átomos y las propiedades de las sustancias, mediante el desarrollo de un experimento para hacer fuego de colores, en el que se manipularán las propiedades químicas de distintas sustancias, como ácido bórico, acetona, alcohol e hilo de cobre.
El desarrollo de este experimento permitirá a los estudiantes aprender de una manera divertida y fácil sobre los distintos tipos de átomos y cómo se pueden distinguir por sus colores, lo que a su vez contribuirá a desarrollar su comprensión de la materia y la energía, mejorar sus habilidades de pensamiento crítico y resolución de problemas, al identificar las diferentes sustancias involucradas en el experimento, así como a desarrollar su alfabetización científica, ya que aprenderán sobre el método científico y cómo realizar experimentos, además de reconocer la importancia de la seguridad en el laboratorio y cómo manejar los productos químicos de manera segura
Realice en plenaria estas preguntas:

• ¿Me pueden dar un ejemplo de una propiedad física que puede cambiar sin que se modifiquen las propiedes químicas de una sustancia? Por ejemplo, la forma de una hoja de papel se puede cambiar doblándola, pero el papel sigue siendo papel.
• ¿Me pueden dar un ejemplo de una propiedad química que puede cambiar la composición de una sustancia? Por ejemplo, cuando la madera se quema, se transforma en cenizas y dióxido de carbono.
Pida a los estudiantes que imaginen por un momento que tienen que preparar un platillo que incluya una proteína, como carne, pollo o pescado, una porción de verduras y un agua de frutas.
Provoque una lluvia de ideas con las siguientes interrogantes:
• ¿Qué pasaría si les dicen que el platillo se lo va a comer una persona sin dientes?
¿Cómo tendrían que presentarlo?
• ¿Qué pasaría si deciden hacer un agua de guayaba con semillas y la persona que la va a tomar quiere usar un vaso de chupón? ¿Qué tendrían que ha cer para que no se tape el chupón?
• ¿Qué pasaría si tienen que hacer una crema de verduras de distintos colores? ¿La mezcla conservaría los colores originales? ¿Por qué?
Ciencias físicas
El átomo: partículas fundamentales y masa atómica
1. Comparta con los estudiantes las características distintivas del átomo que se mencionan en el libro.
2. Explique cuáles son las partículas fundamentales del átomo, qué es la masa atómica, el número atómico y el número de masa
3. Utilice los ejemplos del libro para ilustrar las partículas del átomo y la identidad del átomo.
4. Solicite que respondan la actividad de recuperación sobre las características del átomo.
Ciencias físicas
Los tipos de átomos y moléculas
1. Presente a los estudiantes la información sobre los tipos de átomos que se mencionan en el libro.
2. Explique cuáles son los tipos de moléculas según la composición de átomos.
3. Muestre las representaciones de las diversas moléculas que aparecen en el libro, así como los ejemplos de la composición del agua y de átomos y moléculas.
4. Pida que respondan las preguntas de cierre mediante el análisis y la reflexión.
Las sustancias y mezclas: composición y propiedades
1. Defina qué es una sustancia y explique cómo se clasifica la materia.
2. Explique qué son las sustancias puras y su división, las mezclas y sus tipos, así como las propiedades de una sustancia y su clasificación.
3. Muestre la información gráfica de las propiedades físcias y químicas que aparecen en el libro.
4. Solicite que respondan las actividades para diferenciar los conceptos de sustancia y mezcla.
Cierre
Retome los temas revisados durante la progresión, enfatice sobre cómo se forman las moléculas y las propiedades que permiten identificar y comprender mejor los elementos y sustancias del entorno, y aclare las dudas que puedan surgir.
Solicite a los estudiantes que elijan a un científico destacado en el estudio de los átomos y las moléculas. Algunos ejemplos pueden ser John Dalton, Marie Curie, Albert Einstein, Niels Bohr, Dmitri Mendeléyev, entre otros, y que investiguen la vida y las contribuciones del científico seleccionado. Pueden utilizar fuentes confiables como libros, artículos científicos y sitios web especializados para recopilar información y redactar una biografía resumida que incluya los aspectos clave de su vida, como su formación académica, contribuciones científicas destacadas y premios o reconocimientos recibidos.
• Tabla de resultados del experimento para hacer fuego de colores (página 20)
• Actividades del libro (páginas 21, 23, 25 y 27)

Describe de manera precisa las propiedades observadas de las sustancias después del experimento.
Describe correctamente los componentes principales de un átomo (protones, neutrones y electrones)

Demuestra una comprensión sólida de las propiedades y comportamientos de los átomos y moléculas identificados.
Explica de manera precisa y clara la diferencia entre una sustancia y una mezcla.
Proporciona ejemplos específicos de sustancias y mezclas y sus propiedades correspondientes.
Utiliza un lenguaje claro y coherente en la presentación de sus actividades

En esta progresión se explorará cómo las moléculas se forman a partir de átomos y cómo la composición de estos puede variar. Se aprenderá que las sustancias puras están compuestas por un solo tipo de átomo, molécula o ión, lo que les confiere propiedades únicas. Mediante el estudio de estas propiedades características, podemos identificar y comprender mejor los elementos y sustancias en nuestro entorno.

Desempeño
Evalúa la validez y confiabilidad de múltiples afirmaciones que aparecen en textos científicos y técnicos o informes de los medios, verificando los datos cuando sea posible.
META DE APRENDIZAJE
CT3. Extraer información sobre la magnitud de las propiedades y los procesos a partir de relaciones proporcionales entre distintas cantidades.
Disparador cognitivo
Todo lo que nos rodea es parte de la materia y está compuesta por sustancias. Una sustancia es un tipo específico de materia con propiedades físicas y químicas que la distinguen de otras sustancias. Estas pueden existir en forma de elementos o compuestos.
A continuación vamos a reconocer distintos tipos de sustancias a través de manipular sus propiedades químicas.
En este experimento se te mostrara cómo hacer fuego de colores de manera sencilla; sin embargo, como algunos materiales que se utilizan son altamente inflamables, siempre debes de tomar las precauciones necesarias para manipularlos. Sigue correctamente las instrucciones de tu profesor.
Materiales:
■ Un encendedor o cerillos
■ 100 g de ácido bórico
■ 100 ml acetona o quitaesmalte de uñas
■ 200 ml de alcohol
■ Cuatro vidrios de reloj o recipientes de aluminio pequeños, también pueden ser recipientes de vidrio que resistan el calor
■ 1 m de hilo de cobre
Toma nota
Debes de guardar las medidas de prevención de accidentes para este experimento: utilizar una bata, manipular las sustancias o instrumentos bajo las indicaciones que estén presentes en los instructivos o que te proporcionen tus profesores y manejar con cuidado la fuente de fuego.
Paso 1: En uno vidrio de reloj colocar 75 cm de hilo de cobre y 50 ml de alcohol, en otro vidrio 100 ml de acetona y 50 ml de alcohol, tercer vidrio 75 g ácido bórico y 50 ml de alcohol. Para el cuarto 50 ml de alcohol, 25 g de ácido bórico y 25 cm de hilo de cobre.
Paso 2: Es importante que en esta etapa del experimento limpies muy bien la mesa de trabajo, pues no debe quedar ningún resto de los materiales que usaste y lavarte las manos.
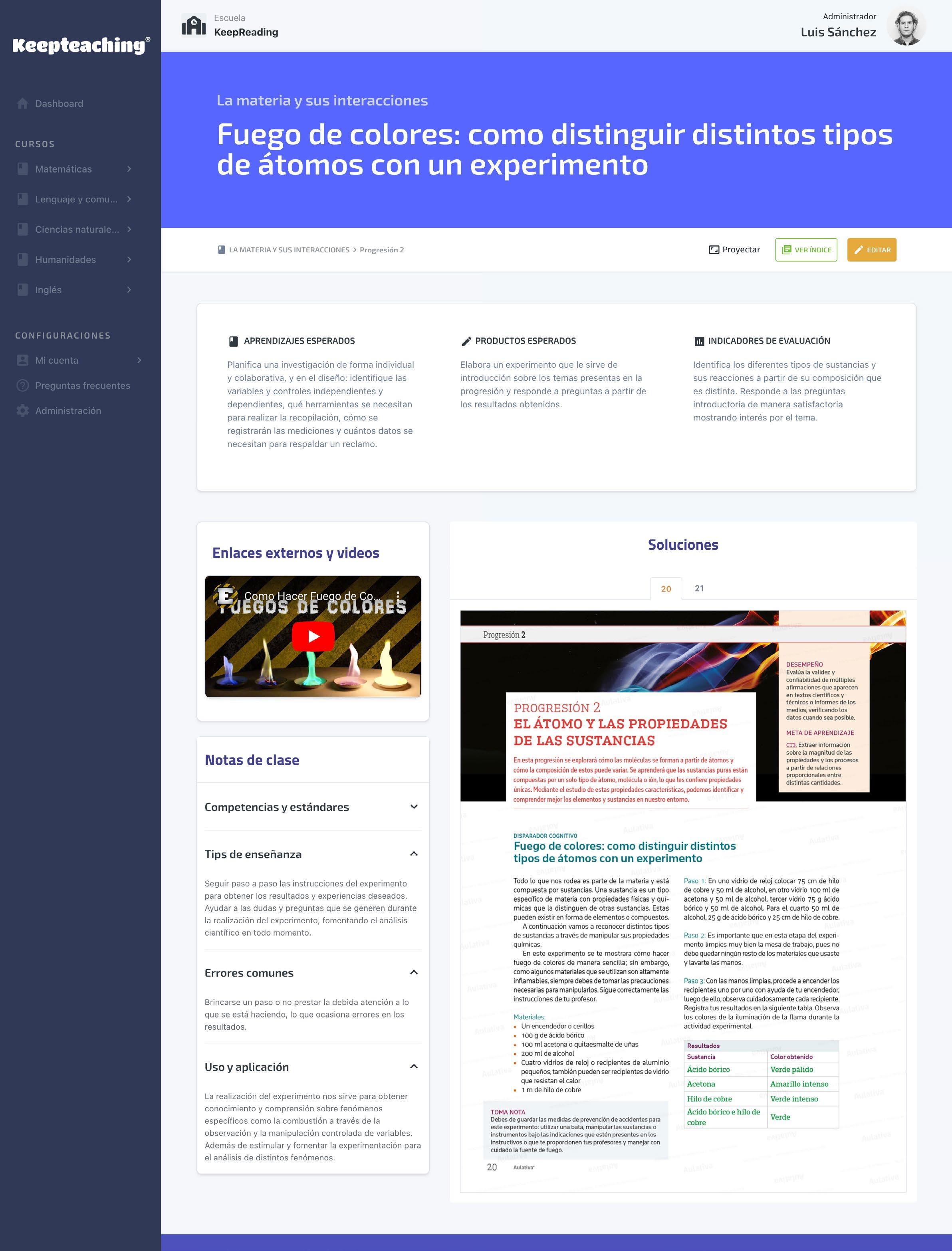
Paso 3: Con las manos limpias, procede a encender los recipientes uno por uno con ayuda de tu encendedor, luego de ello, observa cuidadosamente cada recipiente. Registra tus resultados en la siguiente tabla. Observa los colores de la iluminación de la flama durante la actividad experimental.
Resultados
Sustancia
Color obtenido
Fuego de colores: como distinguir distintos tipos de átomos con un experimento
Describe las propiedades de las sustancias después de un experimento Responde las siguientes preguntas.
1. ¿A qué se deben esos colores?
2. ¿Qué pasa en los fuegos artificiales que tienen un sin fin de colores?
3. Investiga como es que se elaboran los fuegos artificiales.
4. ¿Qué factores están involucrados durante la realización del experimento?
5. ¿Cada elemento químico posee características propias y diferentes?
6. ¿La cantidad de humo emitido por cada sustancia fue igual para todos o hubo variaciones?
7. ¿Fue la misma cantidad de sustancia para cada uno? ¿Qué sucedería si añades o quitas material?
8. ¿Los materiales utilizados están compuestos por varios materiales o sólo uno?
9. Investiga de que está compuesto el ácido bórico, acetona, alcohol, hilo de cobre.
10. ¿Cuál es la manera con la cuál se representa a los protones, neutrones y electrones?

El átomo es la parte de la materia más pequeña que se puede medir sin alterar sus propiedades. Las partículas que ayudan a entender los fenómenos eléctricos son los protones, electrones y neutrones.
Cada una de estas partículas tiene dos características distintivas: la masa, que es la cantidad de materia que contiene, y la carga eléctrica, que es una propiedad intrínseca de la materia, lo cual quiere decir que es parte de la naturaleza de las partículas elementales. No se sabe con precisión qué es ni qué la ocasiona, pero se pueden conocer y estudiar sus efectos.
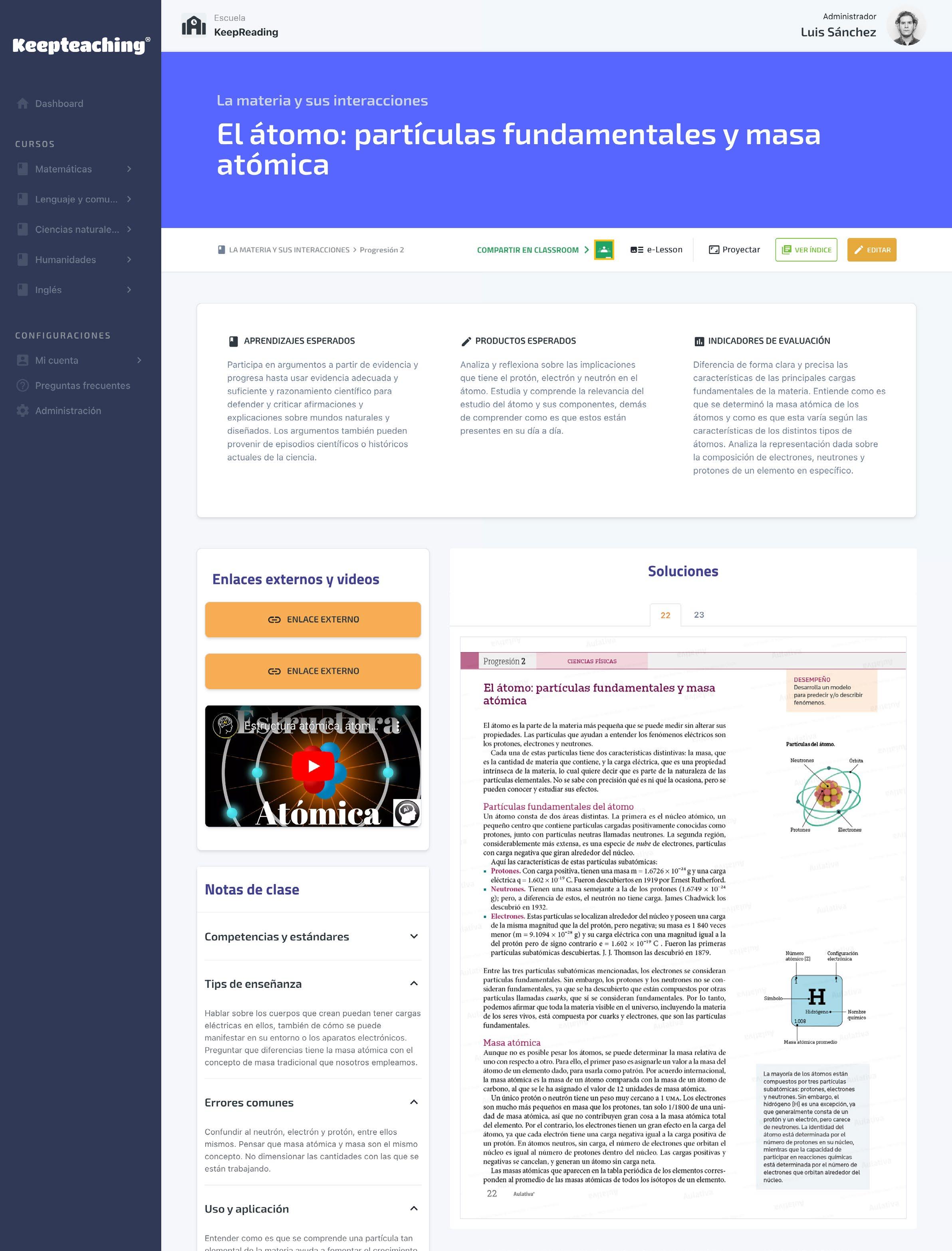
Un átomo consta de dos áreas distintas. La primera es el núcleo atómico, un pequeño centro que contiene partículas cargadas positivamente conocidas como protones, junto con partículas neutras llamadas neutrones. La segunda región, considerablemente más extensa, es una especie de nube de electrones, partículas con carga negativa que giran alrededor del núcleo.
Aquí las características de estas partículas subatómicas:
■ Protones. Con carga positiva, tienen una masa m = 1.6726 × 10 24 g y una carga eléctrica q = 1.602 × 10-19 C. Fueron descubiertos en 1919 por Ernest Rutherford.
■ Neutrones. Tienen una masa semejante a la de los protones (1.6749 × 10 24 g); pero, a diferencia de estos, el neutrón no tiene carga. James Chadwick los descubrió en 1932.
■ Electrones. Estas partículas se localizan alrededor del núcleo y poseen una carga de la misma magnitud que la del protón, pero negativa; su masa es 1 840 veces menor (m = 9.1094 × 10 28 g) y su carga eléctrica con una magnitud igual a la del protón pero de signo contrario e = 1.602 × 10 19 C . Fueron las primeras partículas subatómicas descubiertas. J. J. Thomson las descubrió en 1879.
Entre las tres partículas subatómicas mencionadas, los electrones se consideran partículas fundamentales. Sin embargo, los protones y los neutrones no se consideran fundamentales, ya que se ha descubierto que están compuestos por otras partículas llamadas cuarks, que sí se consideran fundamentales. Por lo tanto, podemos afirmar que toda la materia visible en el universo, incluyendo la materia de los seres vivos, está compuesta por cuarks y electrones, que son las partículas fundamentales.
Aunque no es posible pesar los átomos, se puede determinar la masa relativa de uno con respecto a otro. Para ello, el primer paso es asignarle un valor a la masa del átomo de un elemento dado, para usarla como patrón. Por acuerdo internacional, la masa atómica es la masa de un átomo comparada con la masa de un átomo de carbono, al que se le ha asignado el valor de 12 unidades de masa atómica.
Un único protón o neutrón tiene un peso muy cercano a 1 uma. Los electrones son mucho más pequeños en masa que los protones, tan solo 1/1800 de una unidad de masa atómica, así que no contribuyen gran cosa a la masa atómica total del elemento. Por el contrario, los electrones tienen un gran efecto en la carga del átomo, ya que cada electrón tiene una carga negativa igual a la carga positiva de un protón. En átomos neutros, sin carga, el número de electrones que orbitan el núcleo es igual al número de protones dentro del núcleo. Las cargas positivas y negativas se cancelan, y generan un átomo sin carga neta.
Las masas atómicas que aparecen en la tabla periódica de los elementos corresponden al promedio de las masas atómicas de todos los isótopos de un elemento.
Desempeño Desarrolla un modelo para predecir y/o describir fenómenos.
Neutrones Electrones
Órbita
La mayoría de los átomos están compuestos por tres partículas subatómicas: protones, electrones y neutrones. Sin embargo, el hidrógeno (H) es una excepción, ya que generalmente consta de un protón y un electrón, pero carece de neutrones. La identidad del átomo está determinada por el número de protones en su núcleo, mientras que la capacidad de participar en reacciones químicas está determinada por el número de electrones que orbitan alrededor del núcleo.
 Partículas del átomo. 1 H 1 Hidrógeno 1.008 Nombre químico
Configuración electrónica
Masa atómica promedio
Símbolo
Número atómico (Z)
Protones
Partículas del átomo. 1 H 1 Hidrógeno 1.008 Nombre químico
Configuración electrónica
Masa atómica promedio
Símbolo
Número atómico (Z)
Protones
En los átomos neutros el número de cargas positivas (protones) es igual al número de cargas negativas (electrones).
Para determinar el número de neutrones es necesario restar el número atómico al número de masa. Por lo tanto, A-Z = número de neutrones de un átomo. Generalmente en la tabla periódica aparecen los símbolos de los elementos, su número atómico y su masa atómica; el número de masa se toma como el entero más cercano a su masa atómica. Los electrones de valencia son muy importantes, ya que de ellos depende la estabilidad de los elementos y la forma de asociarse. Cuando un átomo neutro pierde o gana electrones se transforma en un ion. Si el átomo pierde electrones se forma un ion positivo llamado catión, y si gana electrones se convierte en un ion negativo o anión.
Los protones, neutrones y electrones son diminutos, y la mayoría del volumen de un átomo, más del 99 por ciento, consiste en espacio vacío. A pesar de tanto espacio vacío, puede surgir la pregunta de cómo los objetos sólidos no atraviesan unos a otros. La respuesta radica en que las nubes de electrones, cargadas negativamente, de los átomos se repelen mutuamente si se acercan demasiado, lo cual genera nuestra experiencia de solidez.
Número atómico y número de masa
Número atómico
Cada átomo que posee un elemento químico se distingue por tener en su núcleo una determinada cantidad de protones (p+). Este total se conoce como número atómico y se simboliza con la letra Z (por el término zahl, que en alemán significa número). Los átomos de un elemento tienen el mismo número de protones, lo cual significa que las propiedades de todos ellos son iguales.
Número de masa
Corresponde al total de partículas que tiene un átomo en su núcleo, por lo que este número es igual a la suma de los protones más los neutrones de cada átomo. Es representado por la letra A.
explica las características del átomo y sus tipos
Responde a las siguiente preguntas de acuerdo a lo leído en la lección e investigando en fuentes de información confiable.
1. ¿Qué son los cuarks?
2. ¿De qué átomos se conforma la sangre que circula por el cuerpo humano?
La unidad de masa atómica unificada (símbolo u) o dalton (símbolo Da) es una unidad estándar de masa definida como la doceava parte (1/12) de la masa de un átomo, neutro y no enlazado, de carbono-12, en su estado fundamental eléctrico y nuclear,3 y equivale a 1.660 5402(10) × 10−27 kg (valor recomendado por CODATA).4 La masa de un mol de unidades (NA) de masa atómica equivale a un g.
El litio, por ejemplo, se representa como Li 7 3 , lo cual indica que tiene 3 protones, 4 neutrones y 3 electrones. Cuando este elemento se combina con otro cede un electrón y forma un ion positivo (Li1+); esto significa que tiene 3 protones (p+), 4 neutrones (nº) y 2 electrones (e−−).
La representación del flúor es F 19 9 ; esto indica que posee 9 protones, 10 neutrones y 9 electrones. Al combinarse con otro, este elemento gana un electrón, por lo que forma un ion negativo (F1−) y queda con 9 protones, 10 neutrones y 10 electrones.
Fuerza nuclear fuerte La atmósfera: La atmósfera es una capa gaseosa que rodea la Tierra. Es esencial para la vida en el planeta, ya que proporciona el aire que respiramos y protege la superficie terrestre de la radiación solar dañina. La atmósfera se compone de diferentes capas: la troposfera, la estratosfera, la mesosfera, la termosfera y la exosfera. Cada capa tiene características únicas en términos de composición química, temperatura y presión.
3. ¿Qué es lo que sucede cuando unes dos o más átomos distintos?
4. Menciona al menos 3 compuestos químicos que se forman al juntar dos átomos distintos (nomenclatura y nombre común).
El átomo es la unidad básica de la materia. La molécula es el resultado de la unión de dos o más átomos, es decir, las moléculas están formadas por la combinación de dos átomos igual o distintos. Los átomos son entonces, los bloques fundamentales de construcción del Universo.
La definición del átomo es: la menor cantidad de materia que retiene las propiedades químicas del elemento.
Una molécula es el resultado de la unión de dos o más átomos. Los electrones que se encuentran en la capa más externa de un átomo (electrones de valencia) cuando se comparten entre átomos, forman una molécula.
Tipos de átomos
Cada uno de los diferentes elementos químicos está constituido por un único tipo de átomo. El tipo de átomo viene determinado por el número de protones que haya en su núcleo. Así por ejemplo, los átomos con un protón son los átomos de hidrógeno; con dos protones, los átomos de Helio; con tres protones, los átomos de Litio, etc.
Todo está hecho de átomos, pero no todos los átomos son idénticos. De hecho, hay más de 100 tipos de átomos. Cerca de 92 de ellos ocurren naturalmente, y los otros han sido creados por científicos en el laboratorio. Hay átomos de hidrógeno, átomos de helio, átomos de carbono, átomos de oxígeno, etc. Las sustancias que están formadas por un solo tipo de átomo se denominan elementos. Los átomos del mismo elemento son todos esencialmente iguales y son diferentes de los átomos de otros elementos.
Existen diferentes tipos de moléculas según la composición de los átomos que las conforman y la forma en que se unen entre sí. A continuación, se presentan algunos tipos comunes de moléculas:
■ Moléculas orgánicas: Son moléculas que contienen carbono en su estructura. Estas moléculas forman la base de la química de los compuestos orgánicos, que incluyen biomoléculas como carbohidratos, lípidos, proteínas y ácidos nucleicos.
■ Moléculas inorgánicas: Son moléculas que no contienen carbono en su estructura. Ejemplos de moléculas inorgánicas incluyen el agua (H2O), el dióxido de carbono (CO2) (como a excepción a la regla debido a su estructura y comportamiento químico), los óxidos metálicos y los ácidos y bases inorgánicas.
■ Moléculas polares: Son moléculas que tienen una distribución desigual de la carga eléctrica, lo que resulta en un momento dipolar. Esto se debe a la presencia de enlaces polares o a la geometría asimétrica de la molécula. El agua (H2O) es un ejemplo de molécula polar.
■ Moléculas no polares: Son moléculas que tienen una distribución uniforme de la carga eléctrica y no tienen un momento dipolar. Esto ocurre cuando los enlaces dentro de la molécula son no polares o cuando la geometría de la molécula es simétrica. El dióxido de carbono (CO2) es un ejemplo de molécula no polar.
■ Moléculas diatómicas: Son moléculas formadas por dos átomos del mismo elemento químico. Ejemplos comunes incluyen el oxígeno molecular (O2), el nitrógeno molecular (N2) y el hidrógeno molecular (H2).
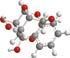
■ Moléculas triatómicas y poliatómicas: Son moléculas formadas por tres o más átomos. Estas moléculas pueden ser tanto orgánicas como inorgánicas. Ejemplos incluyen el dióxido de azufre (SO2), el metano (CH4), el ácido sulfúrico (H2SO4), entre otros.
Desempeño
Obtiene, evalúa y comunica información y avances para evaluar la validez y confiabilidad de las afirmaciones, métodos y diseños.
Electrones de valencia
Son los electrones que se encuentran en el nivel principal de energía más alto del átomo, siendo estos los responsables de la interacción entre átomos de
Diagrama de la molécula inorgánica del ácido clorhídrico Diagrama de la molécula polar del agua Diagrama de la molécula no polar del dióxido de carbono Diagrama de la molécula del oxígeno molecular. Diagrama de la molécula triatómica del dióxido de azufreH20
ÁTOMOS Y MÓLECULAS
Ejemplo de 4 átomos de diferentes elementos
Nitrogeno (N)
Hidrógeno (H)
Carbón (C) Oxígeno (O)
Átomo del elemento hidrógeno
Átomo del elemento oxígeno
Molécula de agua (Hecha de multiples átomos)
Vacío entre particulas
Las moleculas son grupos de átomos que están unidos. pueden estar conformadas de combinaciones de elementos distintos o del mismo elemento.
Mismo elemento Combinación de elementos
Mólecula de hidrógeno (H₂)
Mólecula de oxígeno (O₂)
Mólecula de dióxido de carbono (CO₂)
Mólecula del agua (H₂O)
Analiza los distintos tipos de átomos y moléculas del entorno Analiza, reflexiona y responde las siguientes preguntas
1. ¿Por qué al unir dos o más moléculas se genera una nueva?
2. Investiga la relevancia de las moléculas órganicas e inorgánicas
3. ¿Para que sirve el estudio de los átomos y partículas?

Una sustancia es un elemento químico y sus compuestos en su estado natural u obtenidos por algún proceso de fabricación. En la naturaleza casi no existen sustancias, pues generalmente están formando mezclas. Un ejemplo de una sustancia aislada que se encuentra de forma natural es la sal (cloruro de sodio). Por el contrario es más fácil encontrar sustancias aisladas en productos sintéticos, por ejemplo el nailon.
La clasificación de la materia según la forma en que se encuentra en la naturaleza es: sustancias puras y mezclas.

Las sustancias puras tienen una composición definida, que no se modifica, y propiedades físicas y químicas específicas que las distinguen claramente de otras, tales como su temperatura de fusión o ebullición, su densidad o su solubilidad; sus átomos o moléculas son iguales. Estas sustancias se dividen en elementos y compuestos.
Elementos
También conocidos como sustancias puras simples, los elementos, al estar formados por átomos de un mismo tipo, no pueden descomponerse en sustancias más sencillas. Según el tipo de sustancia, su composición puede constar de un solo átomo —el helio y los otros gases nobles (neón, argón, kriptón, xenón, radón, organesón)—; de dos o más átomos unidos entre sí, formando moléculas —el oxígeno (O2) y el nitrógeno molecular (N2) están formados por dos átomos, y las moléculas de ozono (O3), por tres átomos de oxígeno—; o bien pueden estar enlazados formando redes cristalinas, como en los casos del diamante, el hierro y otros metales.
Compuestos
Están formados por átomos de dos o más elementos unidos entre sí por enlaces químicos, como en el dióxido de carbono (CO2), el agua (H2O) o el ácido sulfhídrico (H2S).

Los elementos que constituyen un compuesto siempre están en una proporción fija y constante, es decir, siempre tienen la misma fórmula. Si la proporción cambia, el compuesto ya no será el mismo: una molécula de H2O siempre tendrá dos átomos de hidrógeno (H) y uno de oxígeno (O), mientras que la de peróxido de hidrógeno (H2O2) siempre tendrá uno más de oxígeno.
Es importante señalar que los compuestos presentan propiedades físicas y químicas diferentes de las de los elementos que los constituyen; por ejemplo, las propiedades del oxígeno y del hidrógeno son diferentes de las del agua. De igual manera, los elementos que forman un compuesto solo se pueden separar por métodos químicos, que permiten la ruptura de las uniones entre los átomos.
Mezclas
Una mezcla se define como la unión física de dos o más sustancias en cualquier proporción, sin que se alteren sus propiedades aunque estén combinadas, pues no existe una reacción química. De esta manera, los componentes de la mezcla se pueden separar por medio de procesos físicos.
Según sus componentes, las mezclas pueden ser de dos tipos: homogéneas y heterogéneas.
Homogéneas
Son aquellas en las que no es posible distinguir sus componentes a simple vista ni con microscopio. Al tratarse de una porción de materia uniforme en todas sus partes, se considera que tienen una sola fase.
Todas las mezclas homogéneas son disoluciones. Una disolución es una mezcla que parece ser una sola sustancia; al componente en menor proporción se le llama soluto y al de mayor proporción disolvente. La sal disuelta en agua, el aire, el etanol mezclado con agua y las aleaciones son ejemplos de mezclas homogéneas.
Desempeño
Construye y revisa una explicación basada en evidencia válida y confiable obtenida de una variedad de fuentes (incluidas las propias investigaciones de los estudiantes, modelos, teorías, simulaciones, revisión por pares) y la suposición de que las teorías y leyes que describen el mundo natural siguen vigentes como lo fueron en el pasado y lo seguirán haciendo en el futuro.
Sustancias puras
Carbono (C) Calcio (Ca) Cobre (Cu)En esta progresión se explorará cómo las moléculas se forman a partir de átomos y cómo la composición de estos puede variar. Se aprenderá que las sustancias puras están compuestas por un solo tipo de átomo, molécula o ión, lo que les confiere propiedades únicas. Mediante el estudio de estas propiedades características, podemos identificar y comprender mejor los elementos y sustancias en nuestro entorno.

Desempeño
Evalúa la validez y confiabilidad de múltiples afirmaciones que aparecen en textos científicos y técnicos o informes de los medios, verificando los datos cuando sea posible.
META DE APRENDIZAJE
CT3. Extraer información sobre la magnitud de las propiedades y los procesos a partir de relaciones proporcionales entre distintas cantidades.
Disparador cognitivo
Todo lo que nos rodea es parte de la materia y está compuesta por sustancias. Una sustancia es un tipo específico de materia con propiedades físicas y químicas que la distinguen de otras sustancias. Estas pueden existir en forma de elementos o compuestos.
A continuación vamos a reconocer distintos tipos de sustancias a través de manipular sus propiedades químicas.
En este experimento se te mostrara cómo hacer fuego de colores de manera sencilla; sin embargo, como algunos materiales que se utilizan son altamente inflamables, siempre debes de tomar las precauciones necesarias para manipularlos. Sigue correctamente las instrucciones de tu profesor.
Materiales:
■ Un encendedor o cerillos
■ 100 g de ácido bórico
■ 100 ml acetona o quitaesmalte de uñas
■ 200 ml de alcohol
■ Cuatro vidrios de reloj o recipientes de aluminio pequeños, también pueden ser recipientes de vidrio que resistan el calor
■ 1 m de hilo de cobre
Toma nota
Debes de guardar las medidas de prevención de accidentes para este experimento: utilizar una bata, manipular las sustancias o instrumentos bajo las indicaciones que estén presentes en los instructivos o que te proporcionen tus profesores y manejar con cuidado la fuente de fuego.
Paso 1: En uno vidrio de reloj colocar 75 cm de hilo de cobre y 50 ml de alcohol, en otro vidrio 100 ml de acetona y 50 ml de alcohol, tercer vidrio 75 g ácido bórico y 50 ml de alcohol. Para el cuarto 50 ml de alcohol, 25 g de ácido bórico y 25 cm de hilo de cobre.
Paso 2: Es importante que en esta etapa del experimento limpies muy bien la mesa de trabajo, pues no debe quedar ningún resto de los materiales que usaste y lavarte las manos.
Paso 3: Con las manos limpias, procede a encender los recipientes uno por uno con ayuda de tu encendedor, luego de ello, observa cuidadosamente cada recipiente. Registra tus resultados en la siguiente tabla. Observa los colores de la iluminación de la flama durante la actividad experimental.
Resultados
Resultados
Sustancia
Sustancia
Ácido bórico
Acetona
Hilo de cobre
Ácido bórico e hilo de cobre
Color obtenido
Color obtenido
Verde pálido
Amarillo intenso
Verde intenso
Verde
Fuego de colores: como distinguir distintos tipos de átomos con un experimento

En esta progresión se explorará cómo las moléculas se forman a partir de átomos y cómo la composición de estos puede variar. Se aprenderá que las sustancias puras están compuestas por un solo tipo de átomo, molécula o ión, lo que les confiere propiedades únicas. Mediante el estudio de estas propiedades características, podemos identificar y comprender mejor los elementos y sustancias en nuestro entorno.

Desempeño
Evalúa la validez y confiabilidad de múltiples afirmaciones que aparecen en textos científicos y técnicos o informes de los medios, verificando los datos cuando sea posible.
META DE APRENDIZAJE
CT3. Extraer información sobre la magnitud de las propiedades y los procesos a partir de relaciones proporcionales entre distintas cantidades.
Disparador cognitivo
Todo lo que nos rodea es parte de la materia y está compuesta por sustancias. Una sustancia es un tipo específico de materia con propiedades físicas y químicas que la distinguen de otras sustancias. Estas pueden existir en forma de elementos o compuestos.
A continuación vamos a reconocer distintos tipos de sustancias a través de manipular sus propiedades químicas.
En este experimento se te mostrara cómo hacer fuego de colores de manera sencilla; sin embargo, como algunos materiales que se utilizan son altamente inflamables, siempre debes de tomar las precauciones necesarias para manipularlos. Sigue correctamente las instrucciones de tu profesor.
Materiales:
■ Un encendedor o cerillos
■ 100 g de ácido bórico
■ 100 ml acetona o quitaesmalte de uñas
■ 200 ml de alcohol
■ Cuatro vidrios de reloj o recipientes de aluminio pequeños, también pueden ser recipientes de vidrio que resistan el calor
■ 1 m de hilo de cobre
Toma nota
Debes de guardar las medidas de prevención de accidentes para este experimento: utilizar una bata, manipular las sustancias o instrumentos bajo las indicaciones que estén presentes en los instructivos o que te proporcionen tus profesores y manejar con cuidado la fuente de fuego.
Paso 1: En uno vidrio de reloj colocar 75 cm de hilo de cobre y 50 ml de alcohol, en otro vidrio 100 ml de acetona y 50 ml de alcohol, tercer vidrio 75 g ácido bórico y 50 ml de alcohol. Para el cuarto 50 ml de alcohol, 25 g de ácido bórico y 25 cm de hilo de cobre.
Paso 2: Es importante que en esta etapa del experimento limpies muy bien la mesa de trabajo, pues no debe quedar ningún resto de los materiales que usaste y lavarte las manos.
Paso 3: Con las manos limpias, procede a encender los recipientes uno por uno con ayuda de tu encendedor, luego de ello, observa cuidadosamente cada recipiente. Registra tus resultados en la siguiente tabla. Observa los colores de la iluminación de la flama durante la actividad experimental.
Resultados
Resultados
Sustancia Color obtenido
Ácido bórico Verde pálido
Acetona Amarillo intenso
Hilo de cobre Verde intenso
Ácido bórico e hilo de cobre Verde
Fuego de colores: como distinguir distintos tipos de átomos con un experimento
Describe las propiedades de las sustancias después de un experimento Responde las siguientes preguntas.
1. ¿A qué se deben esos colores?
A que la composición química de las sustancias empleadas es distinta, por eso es que varían los colores.
2. ¿Qué pasa en los fuegos artificiales que tienen un sin fin de colores?
Cuando se exponen al fuego(combustión), cada metal produce ondas de colores específicos distintas.

3. Investiga como es que se elaboran los fuegos artificiales.
Por ejemplo, el sodio produce amarillo, el estroncio produce rojo, y el bario produce verde. Mezclar los químicos puede producir una gran variedad de matices, incluso el morado hecho de una mezcla de componentes de estroncio y cobre.
4. ¿Qué factores están involucrados durante la realización del experimento?
Las distintas sustancias químicas y la combustión. Diferentes.
5. ¿Cada elemento químico posee características propias y diferentes?
6. ¿La cantidad de humo emitido por cada sustancia fue igual para todos o hubo variaciones?
Fue distinta, ya que la reacción a la combustión variará de elemento en elemento.
7. ¿Fue la misma cantidad de sustancia para cada uno? ¿Qué sucedería si añades o quitas material?
No fue la misma cantidad, ya que en este caso los 100 ml de acetona no son iguales a los 100 g de ácido bórico y de la cantidad del hilo de cobre; por lo que al añadir más de una sustancia influiría en la duración de la flama haciendo que se prolongue, caso contrario si se sustrae.
8. ¿Los materiales utilizados están compuestos por varios materiales o sólo uno?
Se espera que los alumnos puedan brindar un respuesta donde expliquen que si, los materiales empleados están compuestos por la combinación de elementos químicos.
9. Investiga de que está compuesto el ácido bórico, acetona, alcohol, hilo de cobre.
Ácido bórico: 3 moléculas de hidrogeno, una molécula de boro y 3 moléculas de oxígeno.
Acetona: 3 moléculas de carbono, 6 moléculas de hidrógeno y una molécula de oxígeno.
Alcohol: 2 moléculas de carbono, 6 moléculas de hidrógeno y una molécula de oxígeno.
Cobre: El hilo de cobre consiste principalmente en átomos de cobre (Cu) unidos entre sí mediante enlaces metálicos.
10. ¿Cuál es la manera con la cuál se representa a los protones, neutrones y electrones?
Protones (p+), electrones (e-), neutrones (n).
El átomo es la parte de la materia más pequeña que se puede medir sin alterar sus propiedades. Las partículas que ayudan a entender los fenómenos eléctricos son los protones, electrones y neutrones.
Cada una de estas partículas tiene dos características distintivas: la masa, que es la cantidad de materia que contiene, y la carga eléctrica, que es una propiedad intrínseca de la materia, lo cual quiere decir que es parte de la naturaleza de las partículas elementales. No se sabe con precisión qué es ni qué la ocasiona, pero se pueden conocer y estudiar sus efectos.
Un átomo consta de dos áreas distintas. La primera es el núcleo atómico, un pequeño centro que contiene partículas cargadas positivamente conocidas como protones, junto con partículas neutras llamadas neutrones. La segunda región, considerablemente más extensa, es una especie de nube de electrones, partículas con carga negativa que giran alrededor del núcleo.
Aquí las características de estas partículas subatómicas:
■ Protones. Con carga positiva, tienen una masa m = 1.6726 × 10 24 g y una carga eléctrica q = 1.602 × 10-19 C. Fueron descubiertos en 1919 por Ernest Rutherford.
■ Neutrones. Tienen una masa semejante a la de los protones (1.6749 × 10 24 g); pero, a diferencia de estos, el neutrón no tiene carga. James Chadwick los descubrió en 1932.
■ Electrones. Estas partículas se localizan alrededor del núcleo y poseen una carga de la misma magnitud que la del protón, pero negativa; su masa es 1 840 veces menor (m = 9.1094 × 10 28 g) y su carga eléctrica con una magnitud igual a la del protón pero de signo contrario e = 1.602 × 10 19 C . Fueron las primeras partículas subatómicas descubiertas. J. J. Thomson las descubrió en 1879.
Entre las tres partículas subatómicas mencionadas, los electrones se consideran partículas fundamentales. Sin embargo, los protones y los neutrones no se consideran fundamentales, ya que se ha descubierto que están compuestos por otras partículas llamadas cuarks, que sí se consideran fundamentales. Por lo tanto, podemos afirmar que toda la materia visible en el universo, incluyendo la materia de los seres vivos, está compuesta por cuarks y electrones, que son las partículas fundamentales.
Aunque no es posible pesar los átomos, se puede determinar la masa relativa de uno con respecto a otro. Para ello, el primer paso es asignarle un valor a la masa del átomo de un elemento dado, para usarla como patrón. Por acuerdo internacional, la masa atómica es la masa de un átomo comparada con la masa de un átomo de carbono, al que se le ha asignado el valor de 12 unidades de masa atómica.
Un único protón o neutrón tiene un peso muy cercano a 1 uma. Los electrones son mucho más pequeños en masa que los protones, tan solo 1/1800 de una unidad de masa atómica, así que no contribuyen gran cosa a la masa atómica total del elemento. Por el contrario, los electrones tienen un gran efecto en la carga del átomo, ya que cada electrón tiene una carga negativa igual a la carga positiva de un protón. En átomos neutros, sin carga, el número de electrones que orbitan el núcleo es igual al número de protones dentro del núcleo. Las cargas positivas y negativas se cancelan, y generan un átomo sin carga neta.
Las masas atómicas que aparecen en la tabla periódica de los elementos corresponden al promedio de las masas atómicas de todos los isótopos de un elemento.
Desempeño Desarrolla un modelo para predecir y/o describir fenómenos.
Neutrones Electrones
Órbita
La mayoría de los átomos están compuestos por tres partículas subatómicas: protones, electrones y neutrones. Sin embargo, el hidrógeno (H) es una excepción, ya que generalmente consta de un protón y un electrón, pero carece de neutrones. La identidad del átomo está determinada por el número de protones en su núcleo, mientras que la capacidad de participar en reacciones químicas está determinada por el número de electrones que orbitan alrededor del núcleo.
 Partículas del átomo. 1 H 1 Hidrógeno 1.008 Nombre químico
Configuración electrónica
Masa atómica promedio
Símbolo
Número atómico (Z)
Protones
Partículas del átomo. 1 H 1 Hidrógeno 1.008 Nombre químico
Configuración electrónica
Masa atómica promedio
Símbolo
Número atómico (Z)
Protones
En los átomos neutros el número de cargas positivas (protones) es igual al número de cargas negativas (electrones).
Para determinar el número de neutrones es necesario restar el número atómico al número de masa. Por lo tanto, A-Z = número de neutrones de un átomo. Generalmente en la tabla periódica aparecen los símbolos de los elementos, su número atómico y su masa atómica; el número de masa se toma como el entero más cercano a su masa atómica. Los electrones de valencia son muy importantes, ya que de ellos depende la estabilidad de los elementos y la forma de asociarse. Cuando un átomo neutro pierde o gana electrones se transforma en un ion. Si el átomo pierde electrones se forma un ion positivo llamado catión, y si gana electrones se convierte en un ion negativo o anión.
Los protones, neutrones y electrones son diminutos, y la mayoría del volumen de un átomo, más del 99 por ciento, consiste en espacio vacío. A pesar de tanto espacio vacío, puede surgir la pregunta de cómo los objetos sólidos no atraviesan unos a otros. La respuesta radica en que las nubes de electrones, cargadas negativamente, de los átomos se repelen mutuamente si se acercan demasiado, lo cual genera nuestra experiencia de solidez.
Número atómico y número de masa
Número atómico
Cada átomo que posee un elemento químico se distingue por tener en su núcleo una determinada cantidad de protones (p+). Este total se conoce como número atómico y se simboliza con la letra Z (por el término zahl, que en alemán significa número). Los átomos de un elemento tienen el mismo número de protones, lo cual significa que las propiedades de todos ellos son iguales.
Número de masa
Corresponde al total de partículas que tiene un átomo en su núcleo, por lo que este número es igual a la suma de los protones más los neutrones de cada átomo. Es representado por la letra A.
explica las características del átomo y sus tipos
Responde a las siguiente preguntas de acuerdo a lo leído en la lección e investigando en fuentes de información confiable.
1. ¿Qué son los cuarks?
Es una partícula subatómica que constituye la materia
2. ¿De qué átomos se conforma la sangre que circula por el cuerpo humano?
Oxígeno (O), Carbono (C), Hidrógeno (H), Nitrógeno (N), Calcio (Ca), Fósforo (P), Hierro (Fe), potasio (K), sodio (Na), cloro (Cl), magnesio (Mg), zinc (Zn)
3. ¿Qué es lo que sucede cuando unes dos o más átomos distintos?
Forman una molécula.
4. Menciona al menos 3 compuestos químicos que se forman al juntar dos átomos distintos (nomenclatura y nombre común).
Cloruro de sodio (NaCl), peróxido de hidrógeno (H2O2), ácido sulfúrico (H2SO4).
La unidad de masa atómica unificada (símbolo u) o dalton (símbolo Da) es una unidad estándar de masa definida como la doceava parte (1/12) de la masa de un átomo, neutro y no enlazado, de carbono-12, en su estado fundamental eléctrico y nuclear,3 y equivale a 1.660 5402(10) × 10−27 kg (valor recomendado por CODATA).4 La masa de un mol de unidades (NA) de masa atómica equivale a un g.
El litio, por ejemplo, se representa como Li 7 3 , lo cual indica que tiene 3 protones, 4 neutrones y 3 electrones. Cuando este elemento se combina con otro cede un electrón y forma un ion positivo (Li1+); esto significa que tiene 3 protones (p+), 4 neutrones (nº) y 2 electrones (e−−).
La representación del flúor es F 19 9 ; esto indica que posee 9 protones, 10 neutrones y 9 electrones. Al combinarse con otro, este elemento gana un electrón, por lo que forma un ion negativo (F1−) y queda con 9 protones, 10 neutrones y 10 electrones.
Fuerza nuclear fuerte La atmósfera: La atmósfera es una capa gaseosa que rodea la Tierra. Es esencial para la vida en el planeta, ya que proporciona el aire que respiramos y protege la superficie terrestre de la radiación solar dañina. La atmósfera se compone de diferentes capas: la troposfera, la estratosfera, la mesosfera, la termosfera y la exosfera. Cada capa tiene características únicas en términos de composición química, temperatura y presión.
El átomo es la unidad básica de la materia. La molécula es el resultado de la unión de dos o más átomos, es decir, las moléculas están formadas por la combinación de dos átomos igual o distintos. Los átomos son entonces, los bloques fundamentales de construcción del Universo.
La definición del átomo es: la menor cantidad de materia que retiene las propiedades químicas del elemento.
Una molécula es el resultado de la unión de dos o más átomos. Los electrones que se encuentran en la capa más externa de un átomo (electrones de valencia) cuando se comparten entre átomos, forman una molécula.
Tipos de átomos
Cada uno de los diferentes elementos químicos está constituido por un único tipo de átomo. El tipo de átomo viene determinado por el número de protones que haya en su núcleo. Así por ejemplo, los átomos con un protón son los átomos de hidrógeno; con dos protones, los átomos de Helio; con tres protones, los átomos de Litio, etc.
Todo está hecho de átomos, pero no todos los átomos son idénticos. De hecho, hay más de 100 tipos de átomos. Cerca de 92 de ellos ocurren naturalmente, y los otros han sido creados por científicos en el laboratorio. Hay átomos de hidrógeno, átomos de helio, átomos de carbono, átomos de oxígeno, etc. Las sustancias que están formadas por un solo tipo de átomo se denominan elementos. Los átomos del mismo elemento son todos esencialmente iguales y son diferentes de los átomos de otros elementos.
Existen diferentes tipos de moléculas según la composición de los átomos que las conforman y la forma en que se unen entre sí. A continuación, se presentan algunos tipos comunes de moléculas:
■ Moléculas orgánicas: Son moléculas que contienen carbono en su estructura. Estas moléculas forman la base de la química de los compuestos orgánicos, que incluyen biomoléculas como carbohidratos, lípidos, proteínas y ácidos nucleicos.
■ Moléculas inorgánicas: Son moléculas que no contienen carbono en su estructura. Ejemplos de moléculas inorgánicas incluyen el agua (H2O), el dióxido de carbono (CO2) (como a excepción a la regla debido a su estructura y comportamiento químico), los óxidos metálicos y los ácidos y bases inorgánicas.
■ Moléculas polares: Son moléculas que tienen una distribución desigual de la carga eléctrica, lo que resulta en un momento dipolar. Esto se debe a la presencia de enlaces polares o a la geometría asimétrica de la molécula. El agua (H2O) es un ejemplo de molécula polar.
■ Moléculas no polares: Son moléculas que tienen una distribución uniforme de la carga eléctrica y no tienen un momento dipolar. Esto ocurre cuando los enlaces dentro de la molécula son no polares o cuando la geometría de la molécula es simétrica. El dióxido de carbono (CO2) es un ejemplo de molécula no polar.
■ Moléculas diatómicas: Son moléculas formadas por dos átomos del mismo elemento químico. Ejemplos comunes incluyen el oxígeno molecular (O2), el nitrógeno molecular (N2) y el hidrógeno molecular (H2).

■ Moléculas triatómicas y poliatómicas: Son moléculas formadas por tres o más átomos. Estas moléculas pueden ser tanto orgánicas como inorgánicas. Ejemplos incluyen el dióxido de azufre (SO2), el metano (CH4), el ácido sulfúrico (H2SO4), entre otros.
Obtiene, evalúa y comunica información y avances para evaluar la validez y confiabilidad de las afirmaciones, métodos y diseños.
Electrones de valencia
Son los electrones que se encuentran en el nivel principal de energía más alto del átomo, siendo estos los responsables de la interacción entre átomos de distintas
Diagrama de la molécula inorgánica del ácido clorhídrico Diagrama de la molécula polar del agua Diagrama de la molécula no polar del dióxido de carbono Diagrama de la molécula del oxígeno molecular. Diagrama de la molécula triatómica del dióxido de azufreH20
Ejemplo de 4 átomos de diferentes elementos
Nitrogeno (N)
Hidrógeno (H)
Carbón (C) Oxígeno (O)
Átomo del elemento hidrógeno
Átomo del elemento oxígeno
Molécula de agua (Hecha de multiples átomos)
Vacío entre particulas
Las moleculas son grupos de átomos que están unidos. pueden estar conformadas de combinaciones de elementos distintos o del mismo elemento.
Mismo elemento Combinación de elementos
Mólecula de hidrógeno (H₂)
Mólecula de oxígeno (O₂)
Mólecula de dióxido de carbono (CO₂)
Mólecula del agua (H₂O)
Analiza los distintos tipos de átomos y moléculas del entorno Analiza, reflexiona y responde las siguientes preguntas
1. ¿Por qué al unir dos o más moléculas se genera una nueva?
1 Al unir dos o más moléculas, se producen reorganizaciones y formaciones de enlaces químicos que dan lugar a una nueva molécula con propiedades distintas a las moléculas originales.
2. Investiga la relevancia de las moléculas órganicas e inorgánicas
☟
3. ¿Para que sirve el estudio de los átomos y partículas?
El estudio de los átomos y partículas es esencial para comprender la estructura de la materia, las interacciones fundamentales, la física del universo y el desarrollo de tecnologías avanzadas. Contribuye a ampliar nuestros conocimientos científicos, mejorar nuestra calidad de vida y abrir nuevas posibilidades en diversos campos científicos y tecnológicos.

Una sustancia es un elemento químico y sus compuestos en su estado natural u obtenidos por algún proceso de fabricación. En la naturaleza casi no existen sustancias, pues generalmente están formando mezclas. Un ejemplo de una sustancia aislada que se encuentra de forma natural es la sal (cloruro de sodio). Por el contrario es más fácil encontrar sustancias aisladas en productos sintéticos, por ejemplo el nailon.
La clasificación de la materia según la forma en que se encuentra en la naturaleza es: sustancias puras y mezclas

Sustancias puras
Las sustancias puras tienen una composición definida, que no se modifica, y propiedades físicas y químicas específicas que las distinguen claramente de otras, tales como su temperatura de fusión o ebullición, su densidad o su solubilidad; sus átomos o moléculas son iguales. Estas sustancias se dividen en elementos y compuestos
Elementos
También conocidos como sustancias puras simples, los elementos, al estar formados por átomos de un mismo tipo, no pueden descomponerse en sustancias más sencillas. Según el tipo de sustancia, su composición puede constar de un solo átomo —el helio y los otros gases nobles (neón, argón, kriptón, xenón, radón, organesón)—; de dos o más átomos unidos entre sí, formando moléculas —el oxígeno (O2) y el nitrógeno molecular (N2) están formados por dos átomos, y las moléculas de ozono (O3), por tres átomos de oxígeno—; o bien pueden estar enlazados formando redes cristalinas, como en los casos del diamante, el hierro y otros metales.
Compuestos
Están formados por átomos de dos o más elementos unidos entre sí por enlaces químicos, como en el dióxido de carbono (CO2), el agua (H2O) o el ácido sulfhídrico (H2S).

Los elementos que constituyen un compuesto siempre están en una proporción fija y constante, es decir, siempre tienen la misma fórmula. Si la proporción cambia, el compuesto ya no será el mismo: una molécula de H2O siempre tendrá dos átomos de hidrógeno (H) y uno de oxígeno (O), mientras que la de peróxido de hidrógeno (H2O2) siempre tendrá uno más de oxígeno.
Es importante señalar que los compuestos presentan propiedades físicas y químicas diferentes de las de los elementos que los constituyen; por ejemplo, las propiedades del oxígeno y del hidrógeno son diferentes de las del agua. De igual manera, los elementos que forman un compuesto solo se pueden separar por métodos químicos, que permiten la ruptura de las uniones entre los átomos.
Mezclas
Una mezcla se define como la unión física de dos o más sustancias en cualquier proporción, sin que se alteren sus propiedades aunque estén combinadas, pues no existe una reacción química. De esta manera, los componentes de la mezcla se pueden separar por medio de procesos físicos.
Según sus componentes, las mezclas pueden ser de dos tipos: homogéneas y heterogéneas.
Homogéneas
Son aquellas en las que no es posible distinguir sus componentes a simple vista ni con microscopio. Al tratarse de una porción de materia uniforme en todas sus partes, se considera que tienen una sola fase.
Todas las mezclas homogéneas son disoluciones. Una disolución es una mezcla que parece ser una sola sustancia; al componente en menor proporción se le llama soluto y al de mayor proporción disolvente. La sal disuelta en agua, el aire, el etanol mezclado con agua y las aleaciones son ejemplos de mezclas homogéneas.
Desempeño
Construye y revisa una explicación basada en evidencia válida y confiable obtenida de una variedad de fuentes (incluidas las propias investigaciones de los estudiantes, modelos, teorías, simulaciones, revisión por pares) y la suposición de que las teorías y leyes que describen el mundo natural siguen vigentes como lo fueron en el pasado y lo seguirán haciendo en el futuro.
Sustancias puras
Carbono (C) Calcio (Ca) Cobre (Cu)Sus componentes sí se pueden distinguir a simple vista o mediante el microscopio. Es por ello que presentan por lo menos dos fases, entendidas como cada uno de los componentes que integran la mezcla de este tipo.
Las mezclas heterogéneas se dividen, a su vez, en suspensiones y coloides Cuando las partículas están dispersas en líquidos o gases forman suspensiones y, eventualmente, las partículas se sedimentan. El lodo, la arena en una cubeta de agua o los medicamentos con la leyenda «agítese antes de usarse», son ejemplos de suspensiones. También existen dispersiones de sólido en sólido, como el granito y la arena.
Por otro lado, los coloides son mezclas aparentemente homogéneas, aunque se pueden observar diferentes fases al microscopio, por lo que se les clasifica como mezclas heterogéneas, como la mayonesa y la leche.
Una propiedad de una sustancia es una característica específica de dicha sustancia. Puede ser percibida a través de los sentidos, como el olor, o solo puede ser registrada mediante dispositivos de medición, como la densidad.
En química, se hace una distinción entre sustancias puras y mezclas de sustancias, ya que las sustancias puras siempre tienen las mismas propiedades, mientras que las propiedades de las mezclas de sustancias dependen de las proporciones en las que se mezclan los componentes.
Las propiedades de los materiales pueden clasificarse en varios grupos:
■ Propiedades físicas, como su dureza, temperatura de fusión, solubilidad en agua, tensión superficial, conductividad eléctrica o actividad óptica.
■ Propiedades químicas, son por ejemplo la acidez, basicidad, poder oxidante, poder reductor, combustibilidad y reactividad química.
■ Las propiedades fisiológicas se refieren a los efectos de los materiales sobre los seres vivos y el medio ambiente, considerando tanto sus propiedades químicas como físicas.
Cada sustancia posee una combinación única de propiedades que se pueden utilizar para identificarla. Dos sustancias no pueden ser idénticas en todas sus propiedades.
Sustancia Estaño Oxígeno Agua Color
Incoloro Incoloro
Propiedades químicas Sustancia Estaño Oxígeno Reacciona con Ácidos y bases fuertes
Metales y no metales por reacciones de oxidación Es
Resistente a la corrosión y tóxico cuando está en los compuestos organoestanosos
Oxidante, favorece la corrosión y la combustión.
Diferencia entre los conceptos de sustancia y mezcla y Reconoce algunas de sus propiedades Escribe "F" físicas o "Q"químicas, según corresponda, al tipo de propiedades al que responden los enunciados.
1. El hidrógeno es el gas de menor densidad. ( )
2. Los metales son dúctiles y maleables. ( )
3. El cloro es un gas tóxico. ( )
Explica una diferencia entre mezcla y sustancia.
4. El carbón es un sólido negro. ( )
5. El cobre se funde a 1 284 °C. ( )
6. El vinagre produce dióxido de carbono gaseoso cuando se mezcla con bicarbonato. ( )
Una sustancia es una forma de materia con una composición química definida y propiedades características, mientras que una mezcla es una combinación física de dos o más sustancias en proporciones variables, donde los componentes mantienen sus propiedades individuales.
Distingue entre una mezcla homogénea y una mezcla heterogénea, y proporciona un ejemplo de cada una.